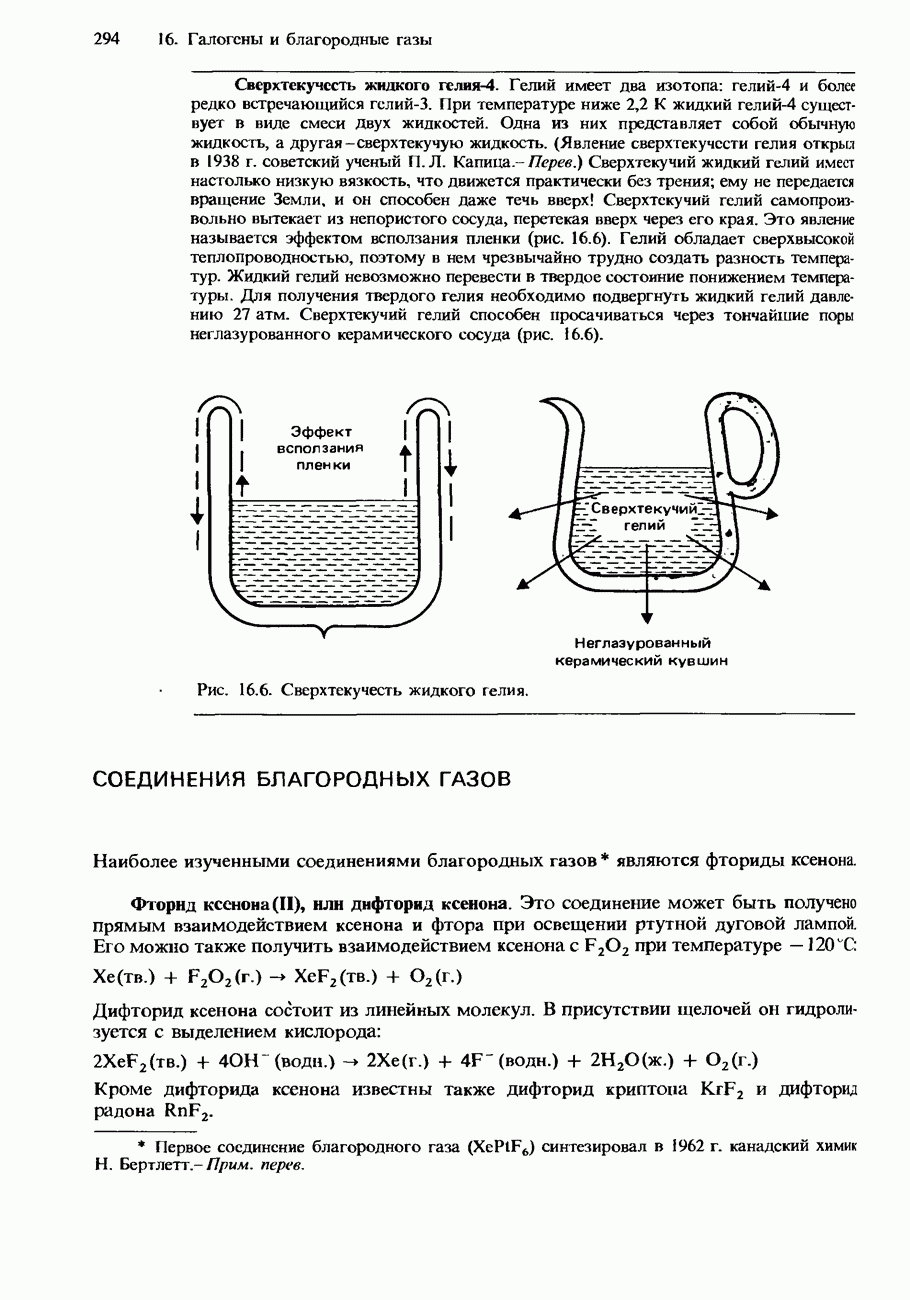
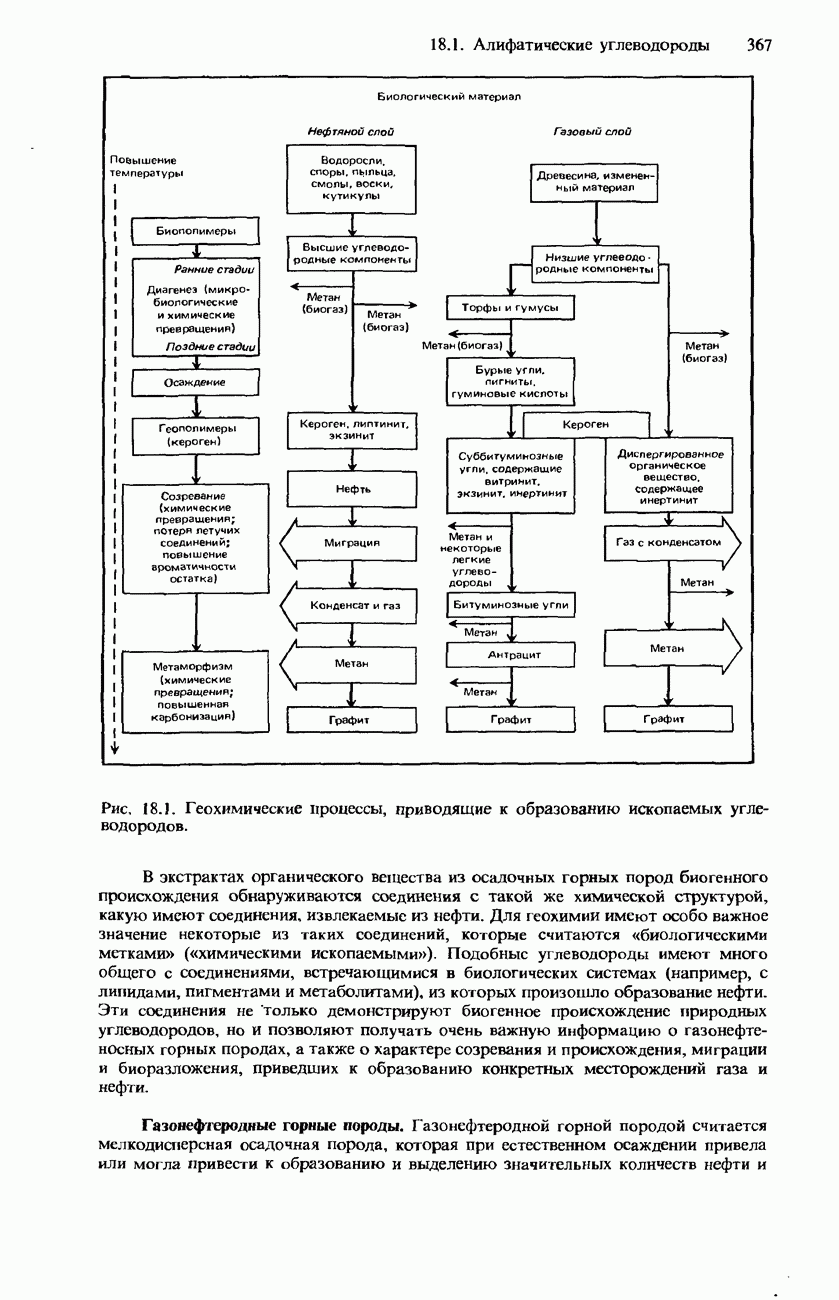
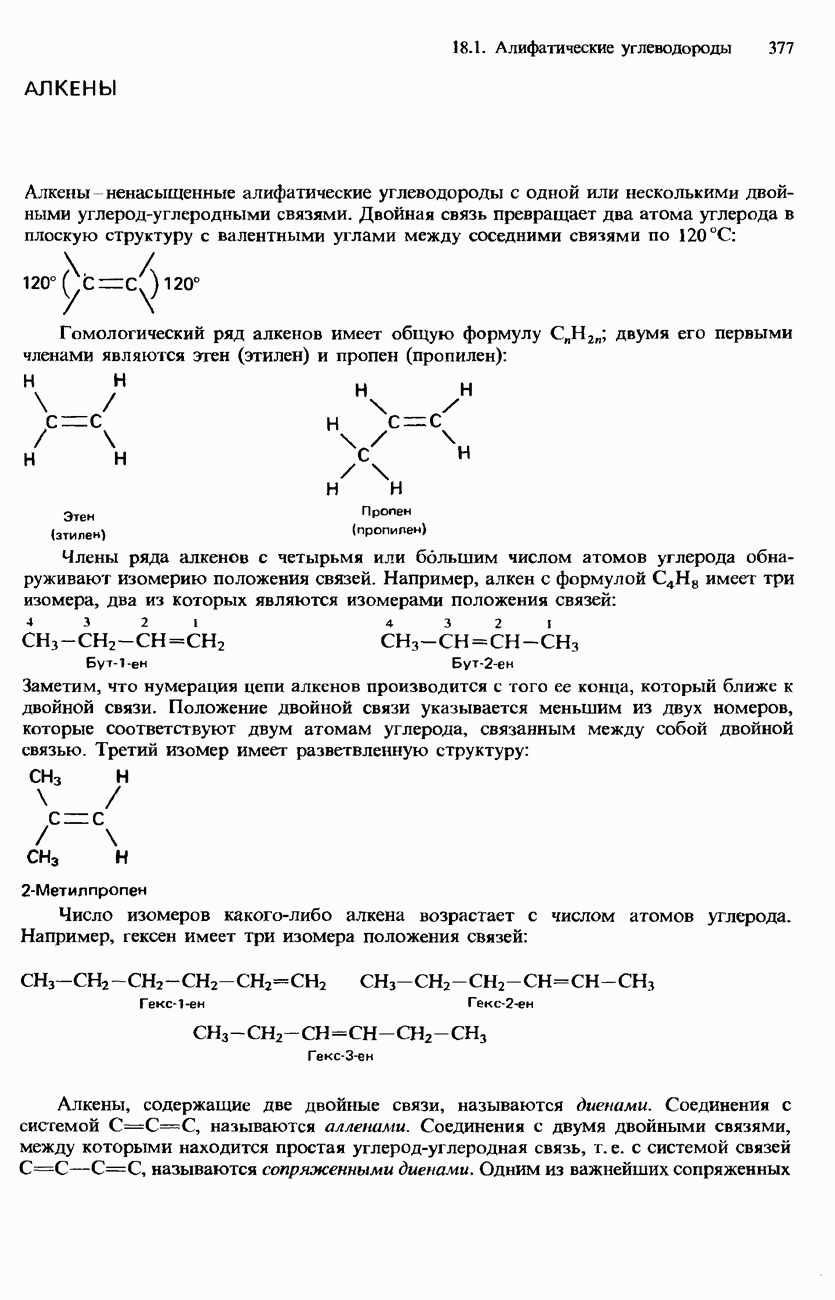
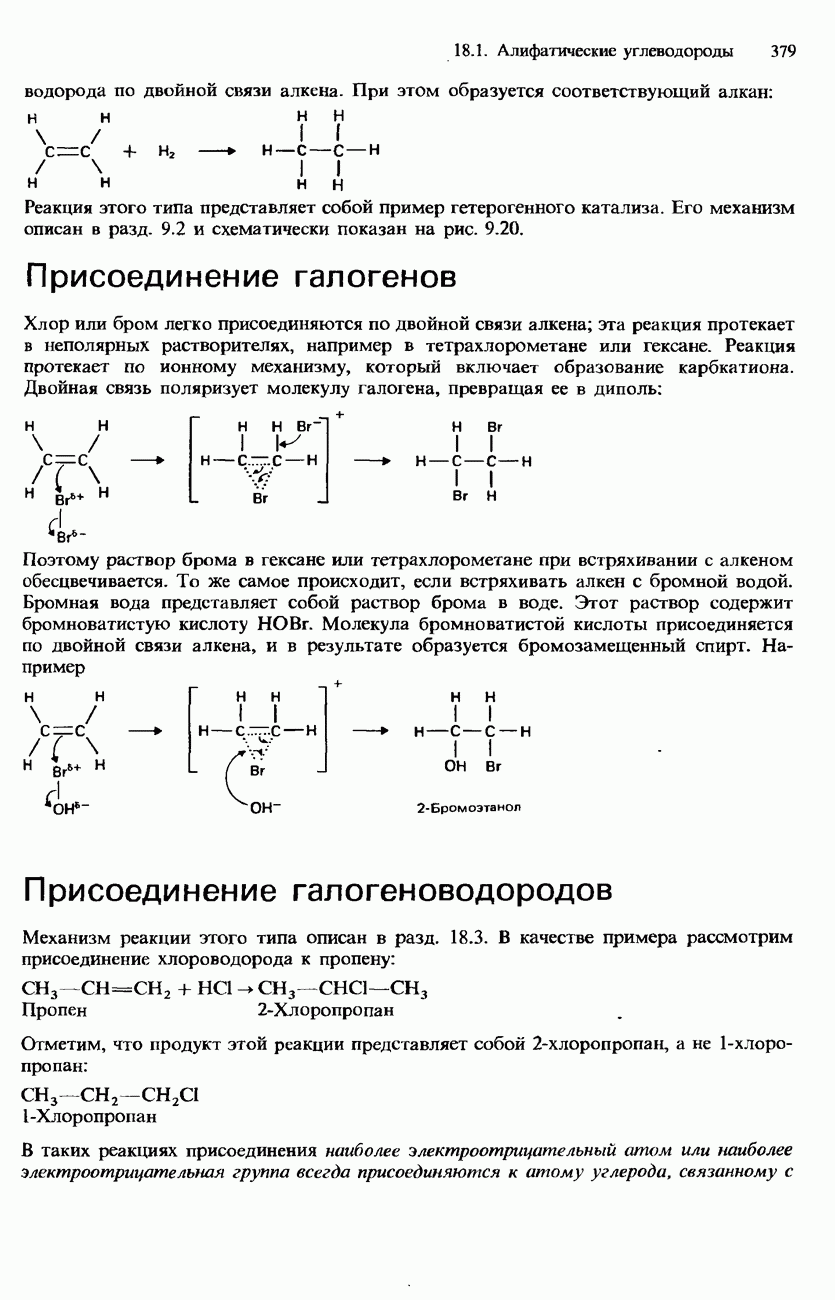
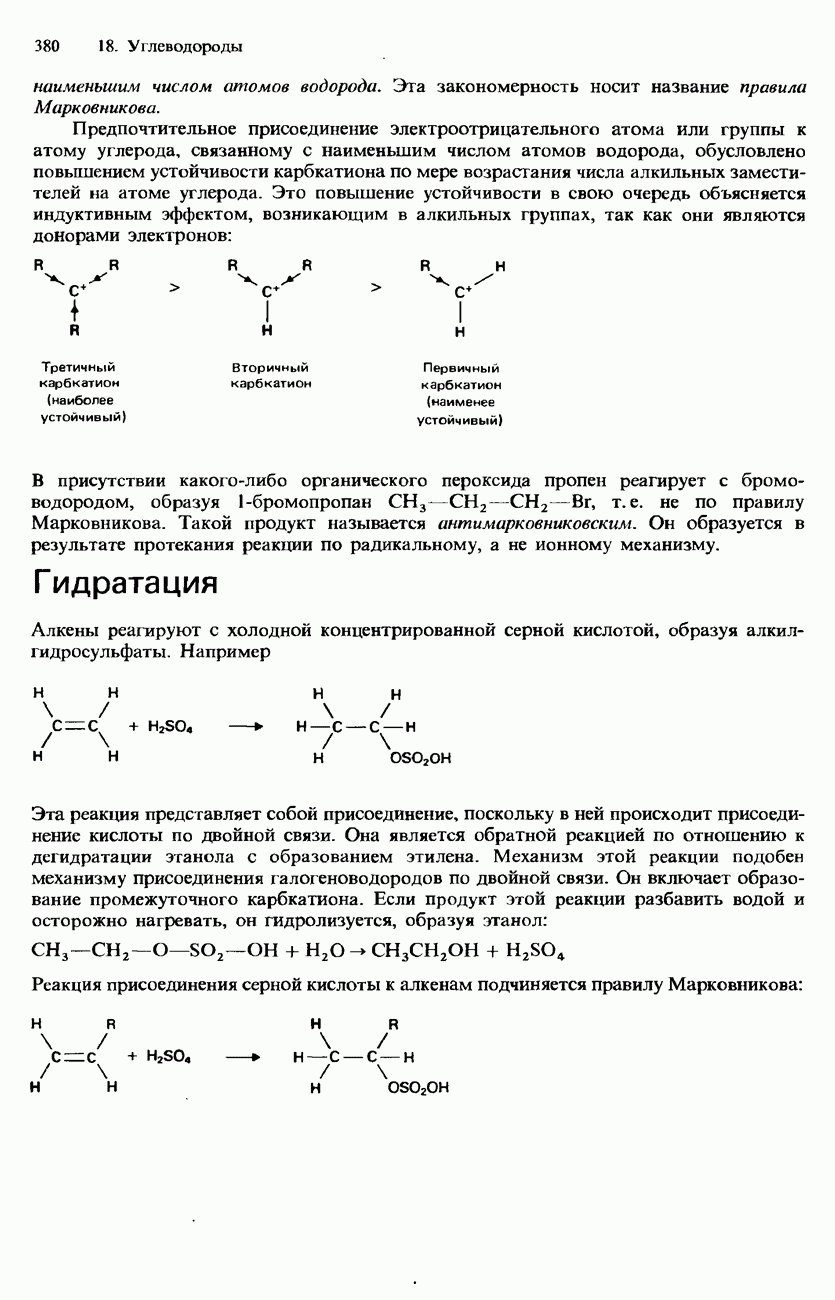
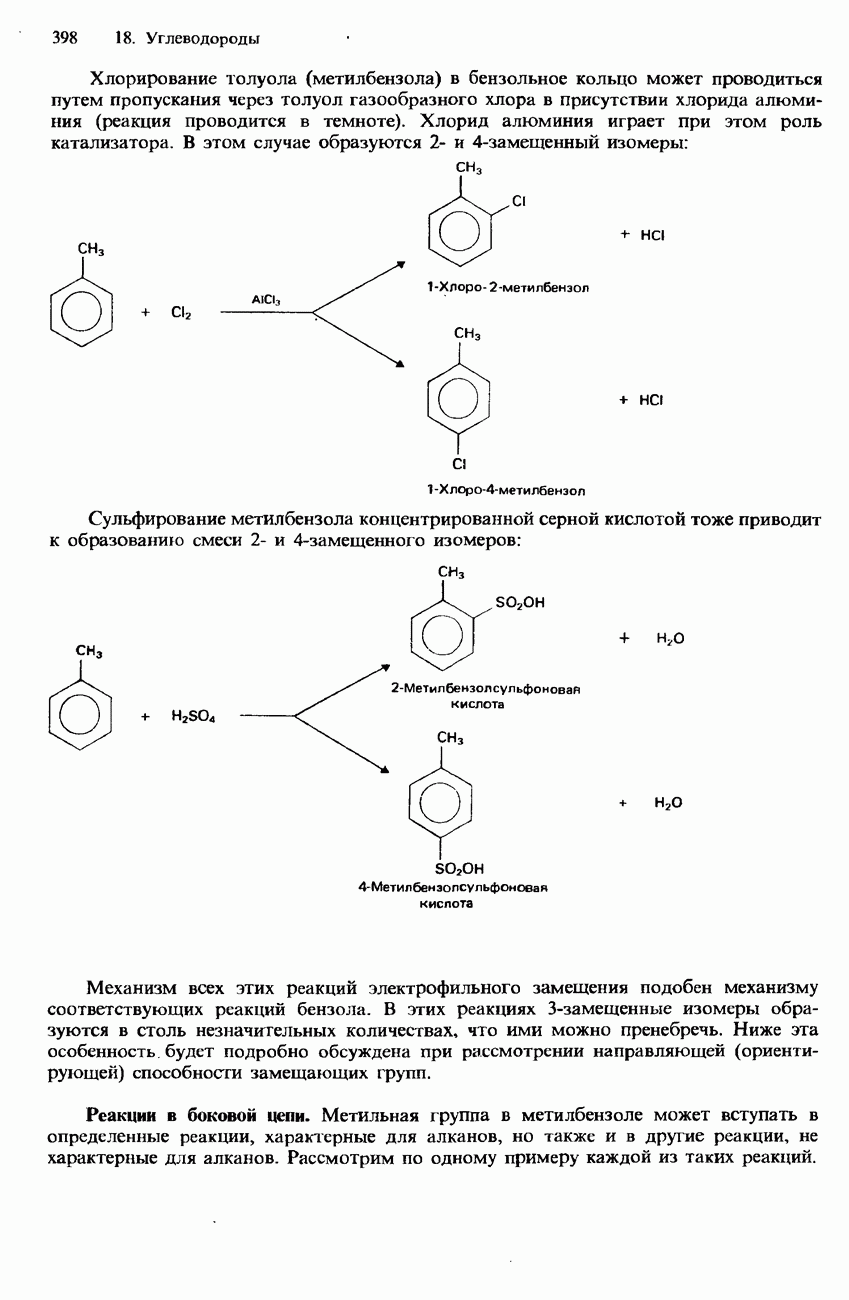
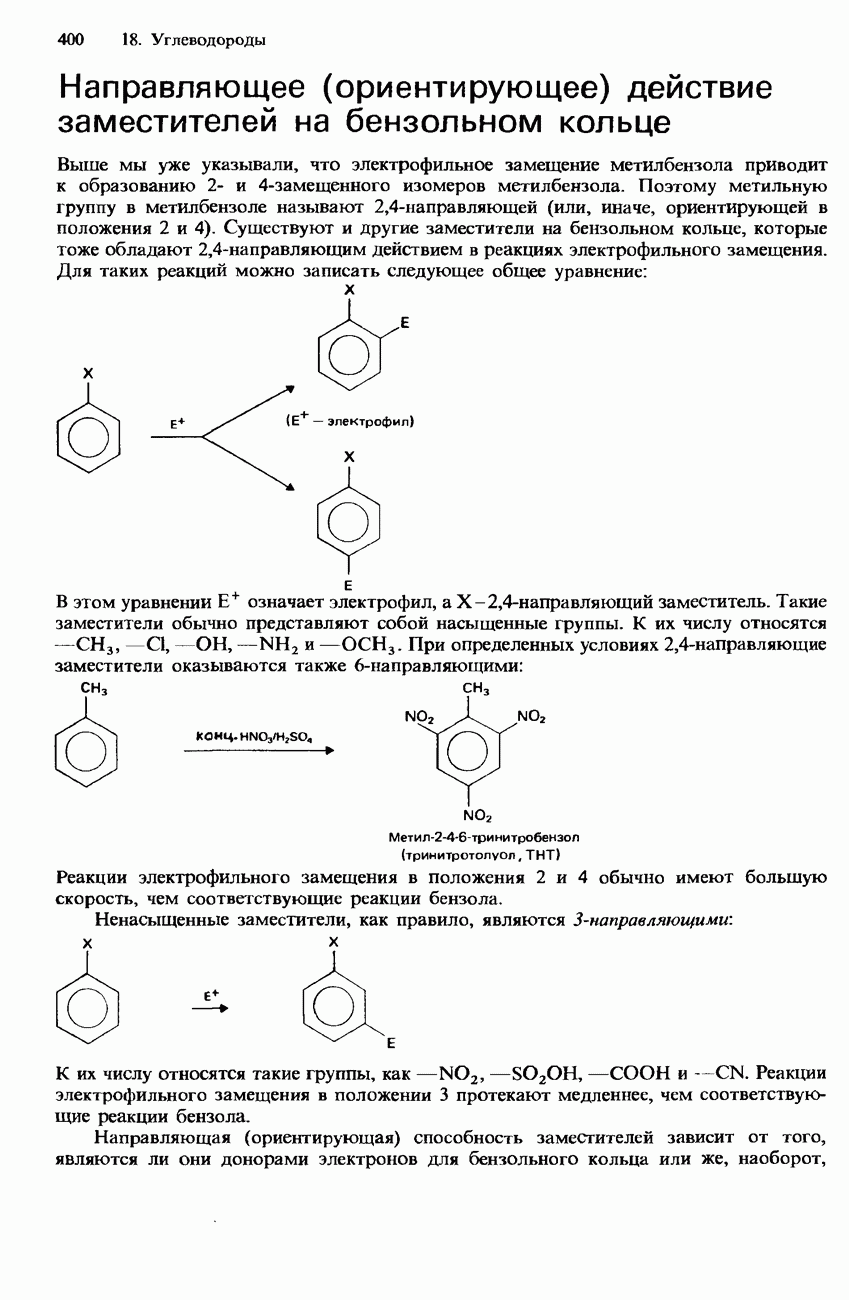
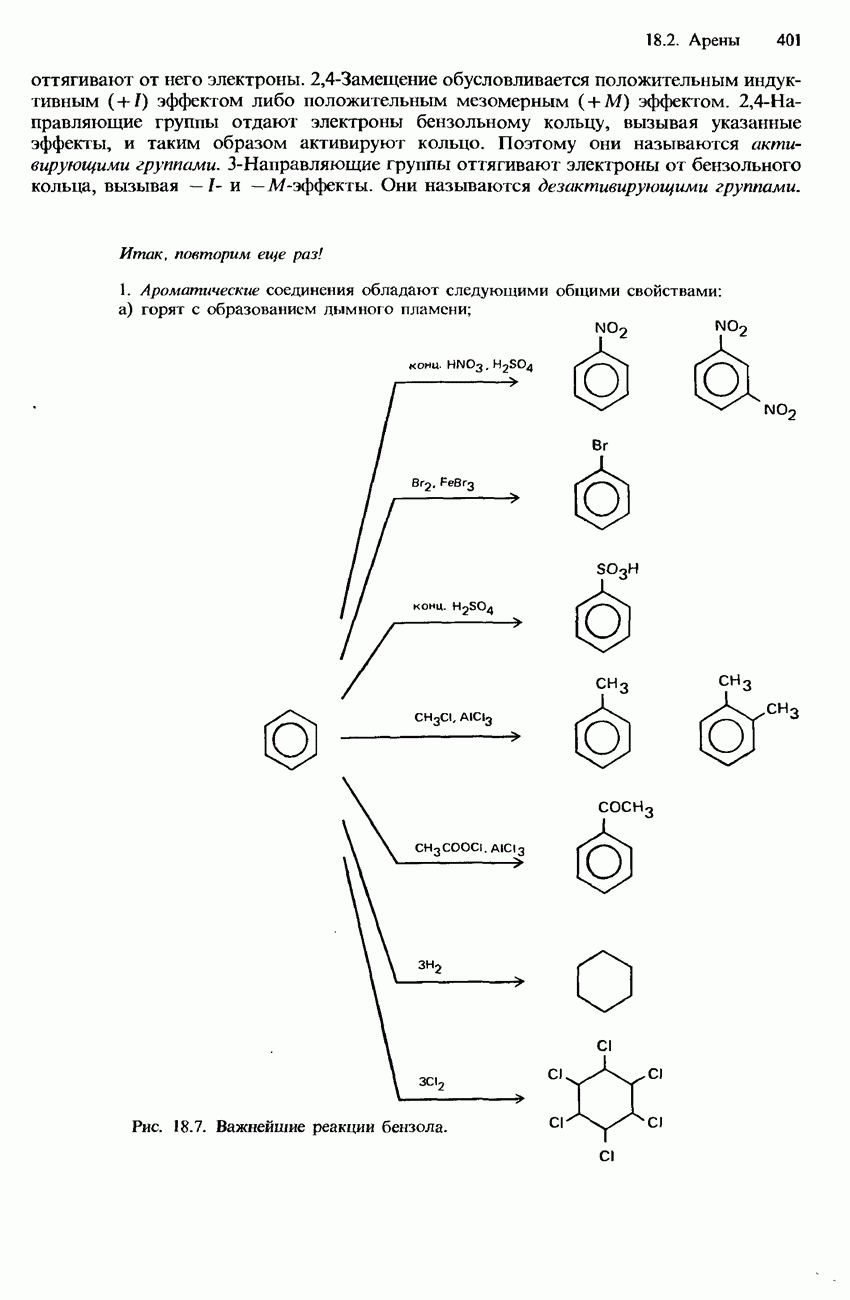
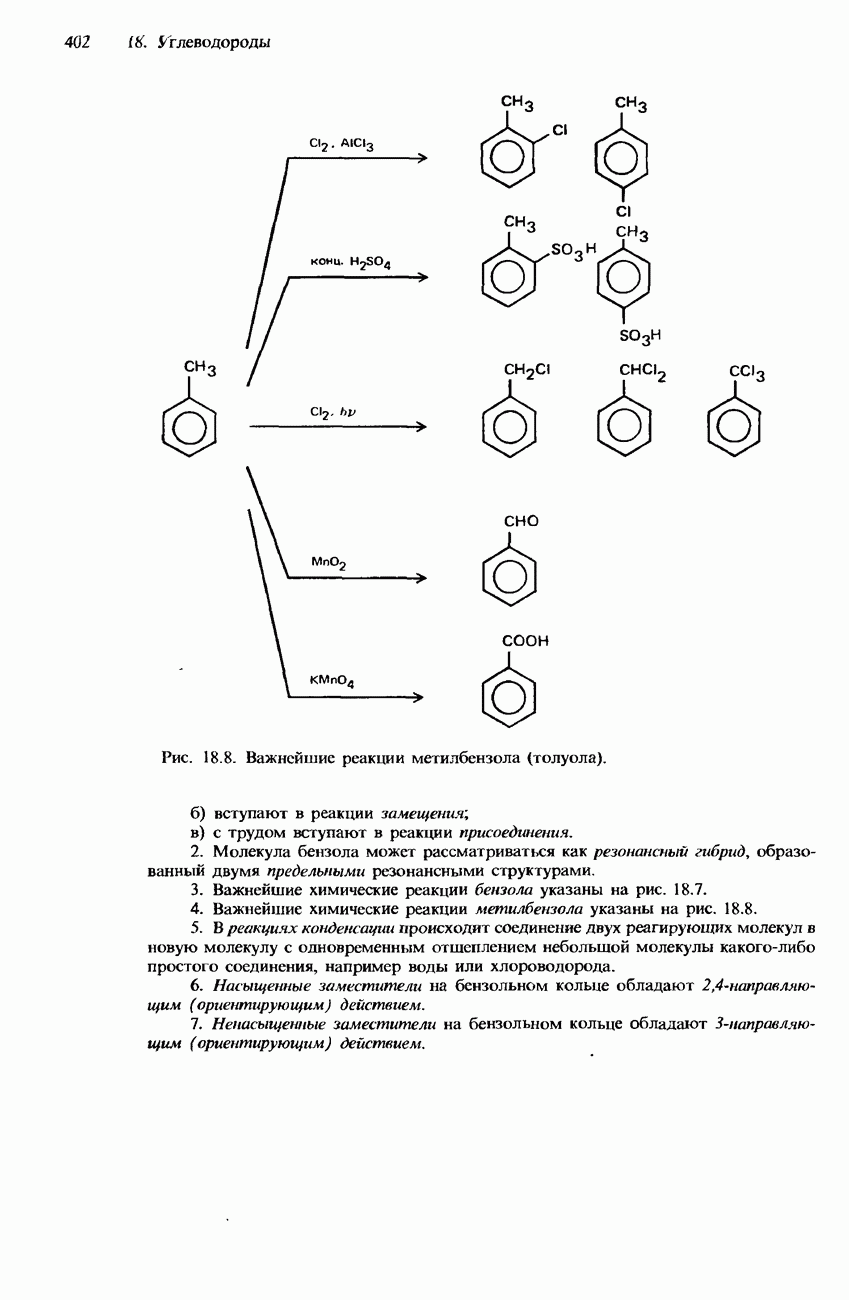
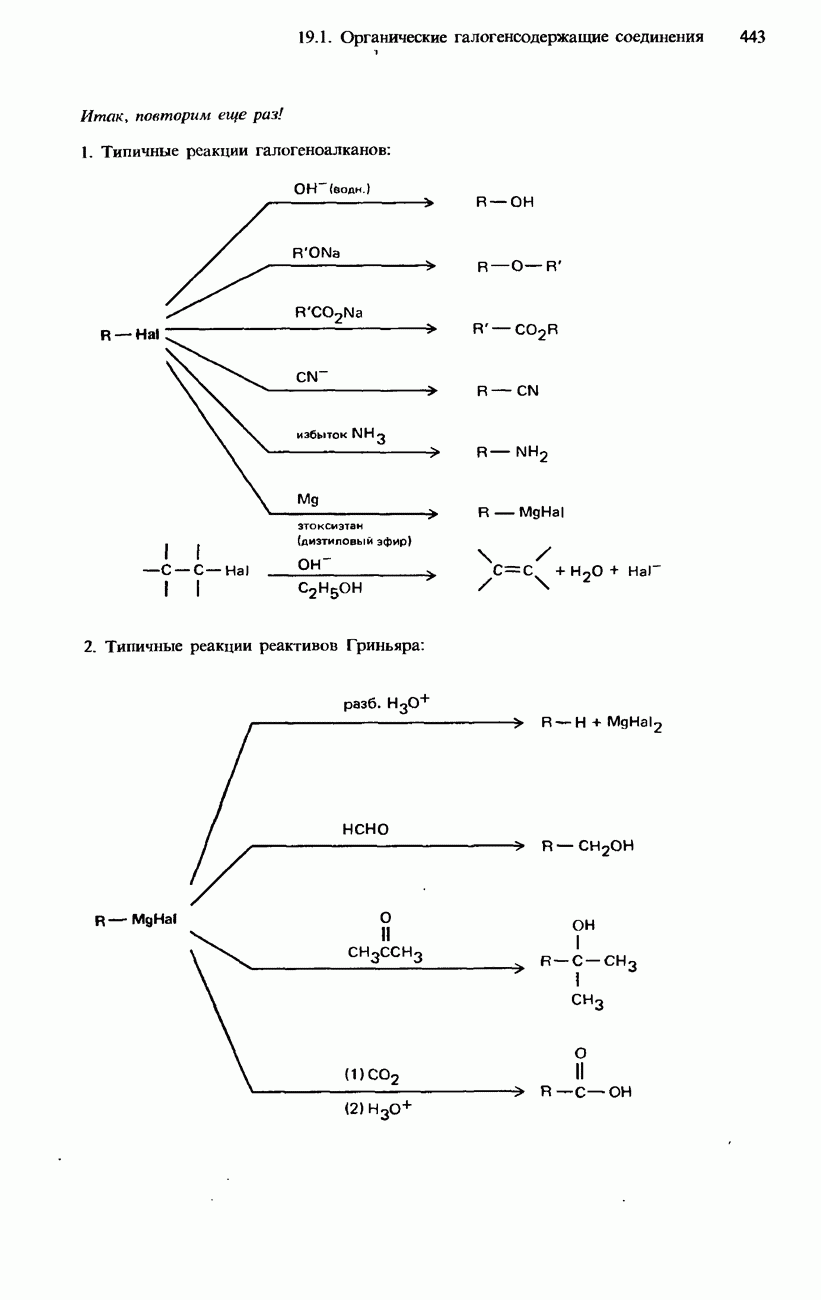
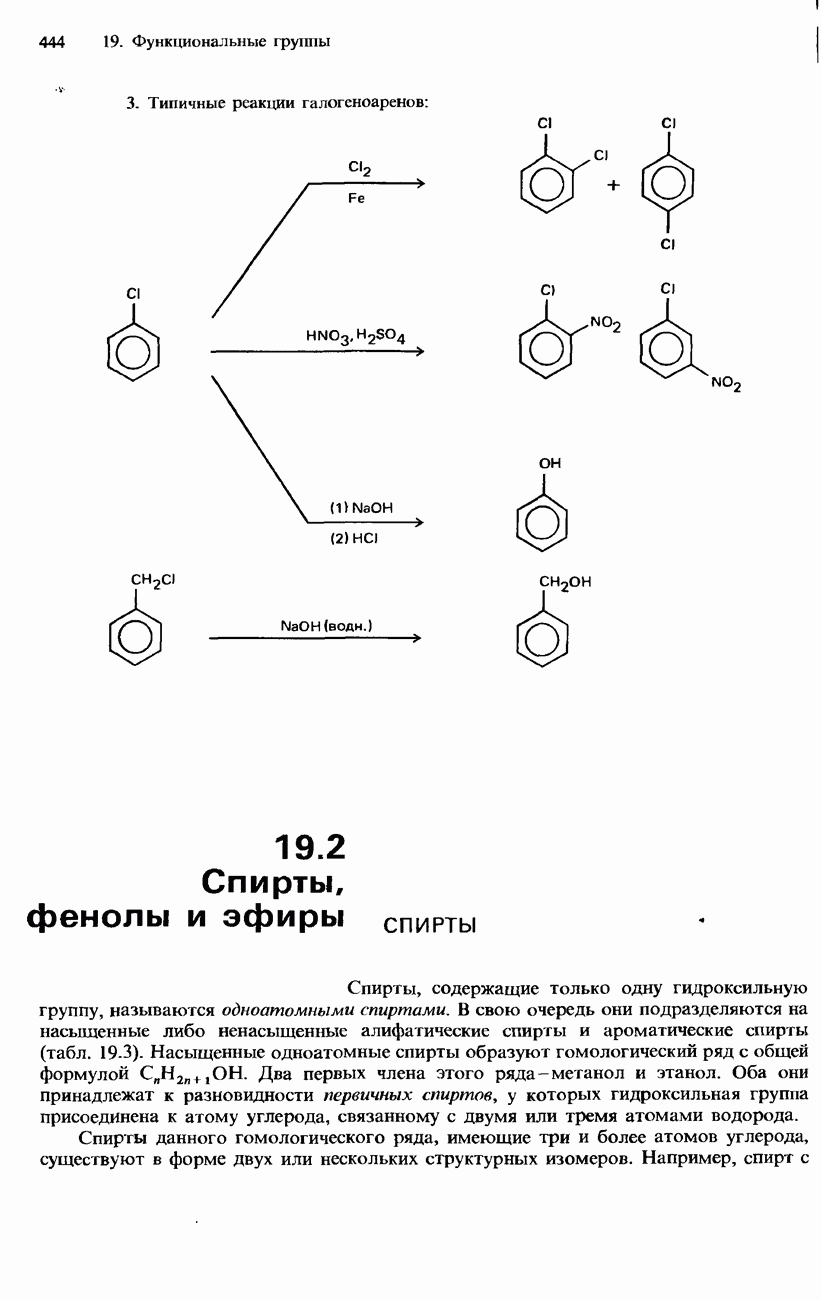
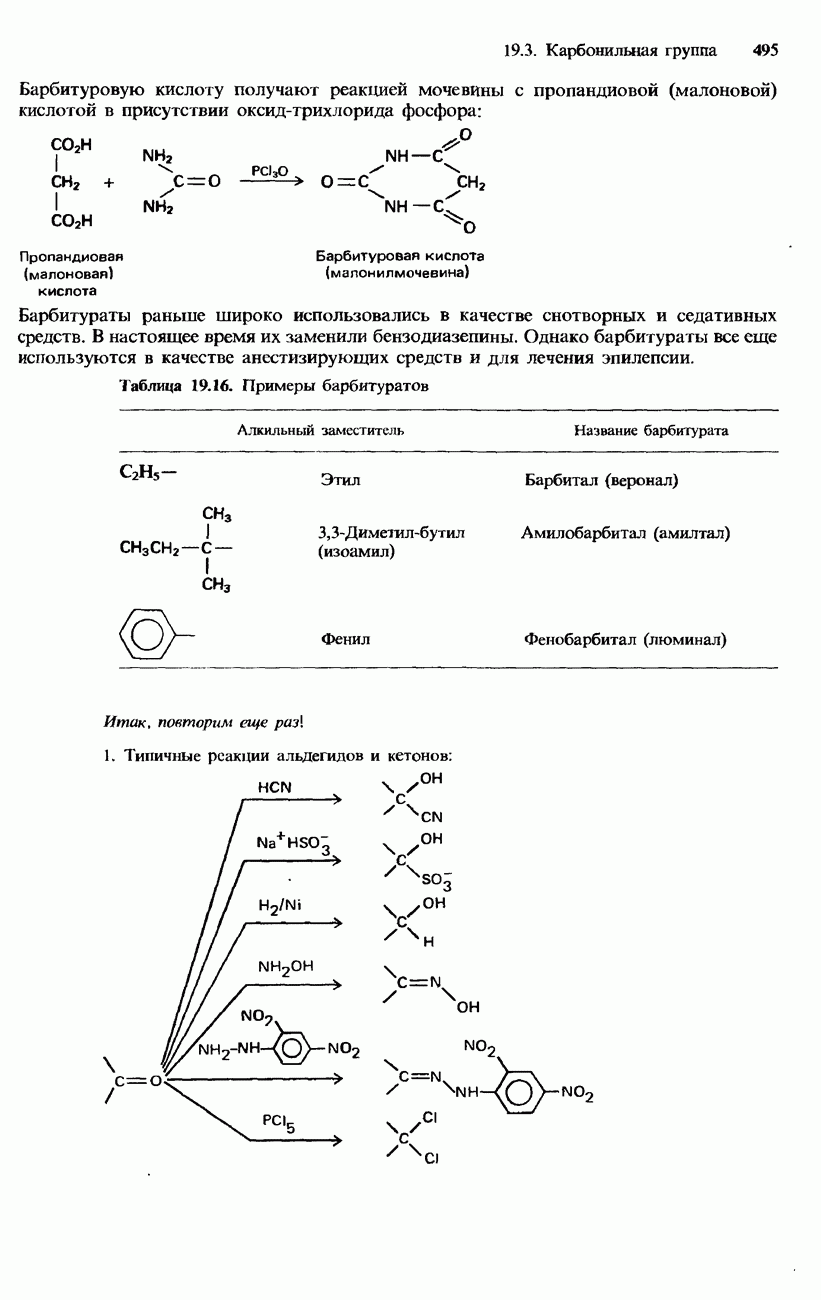
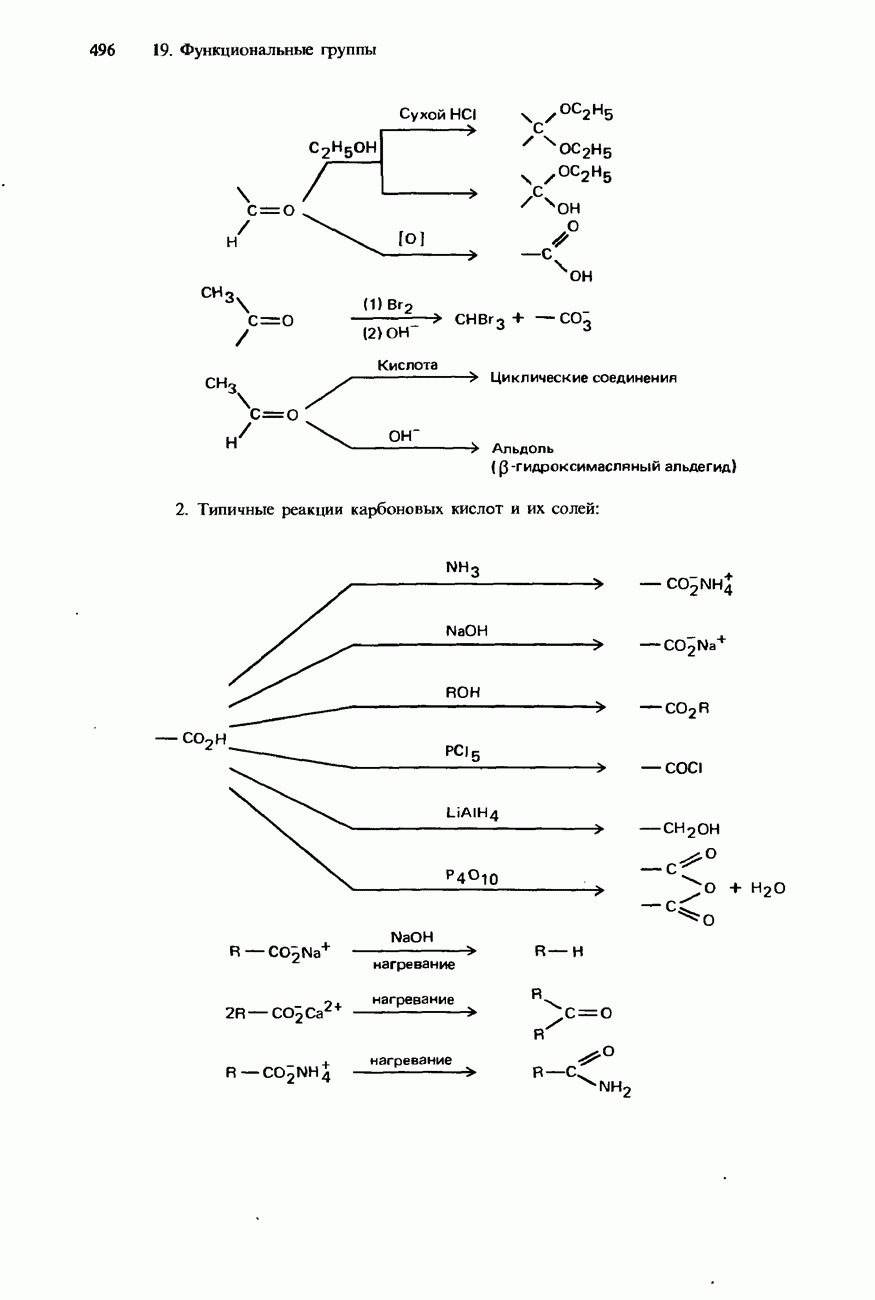
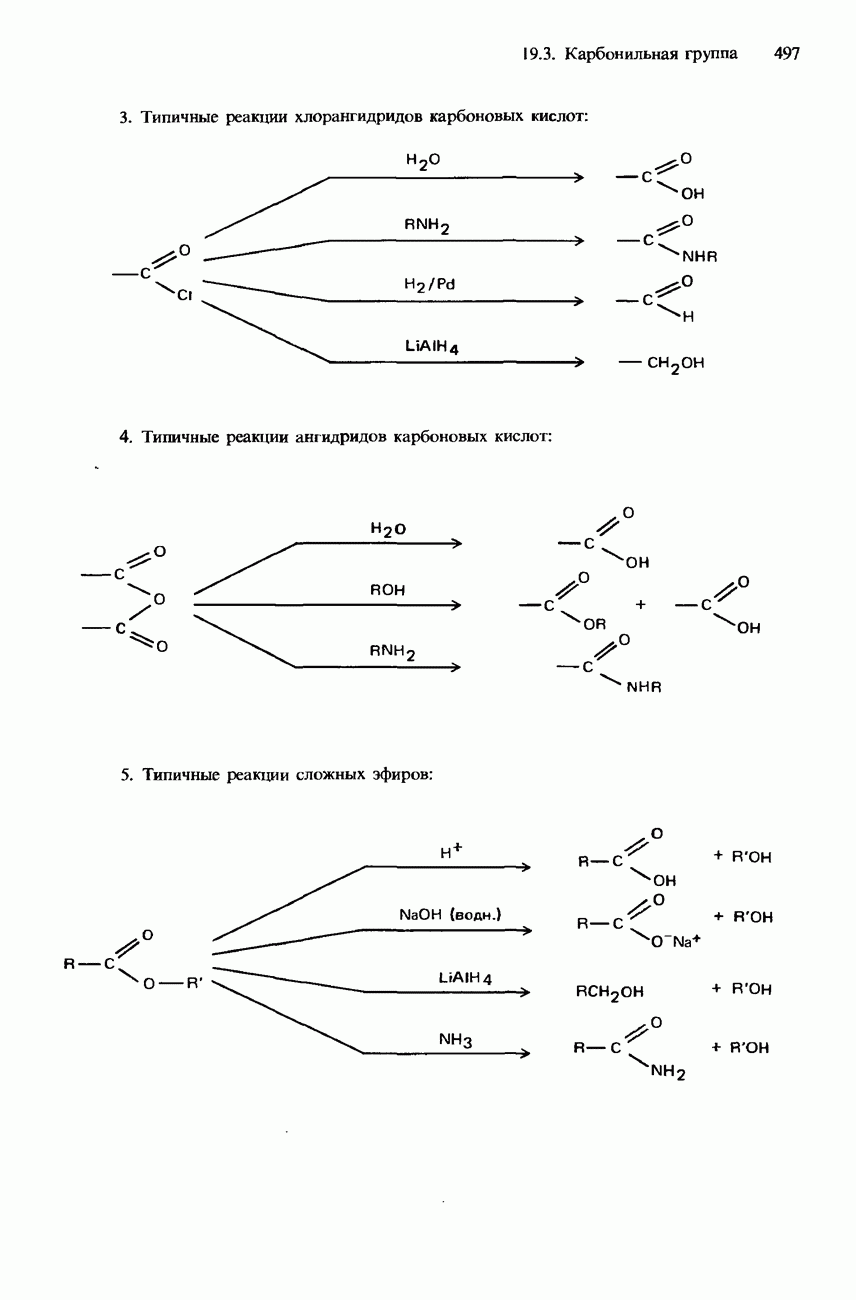
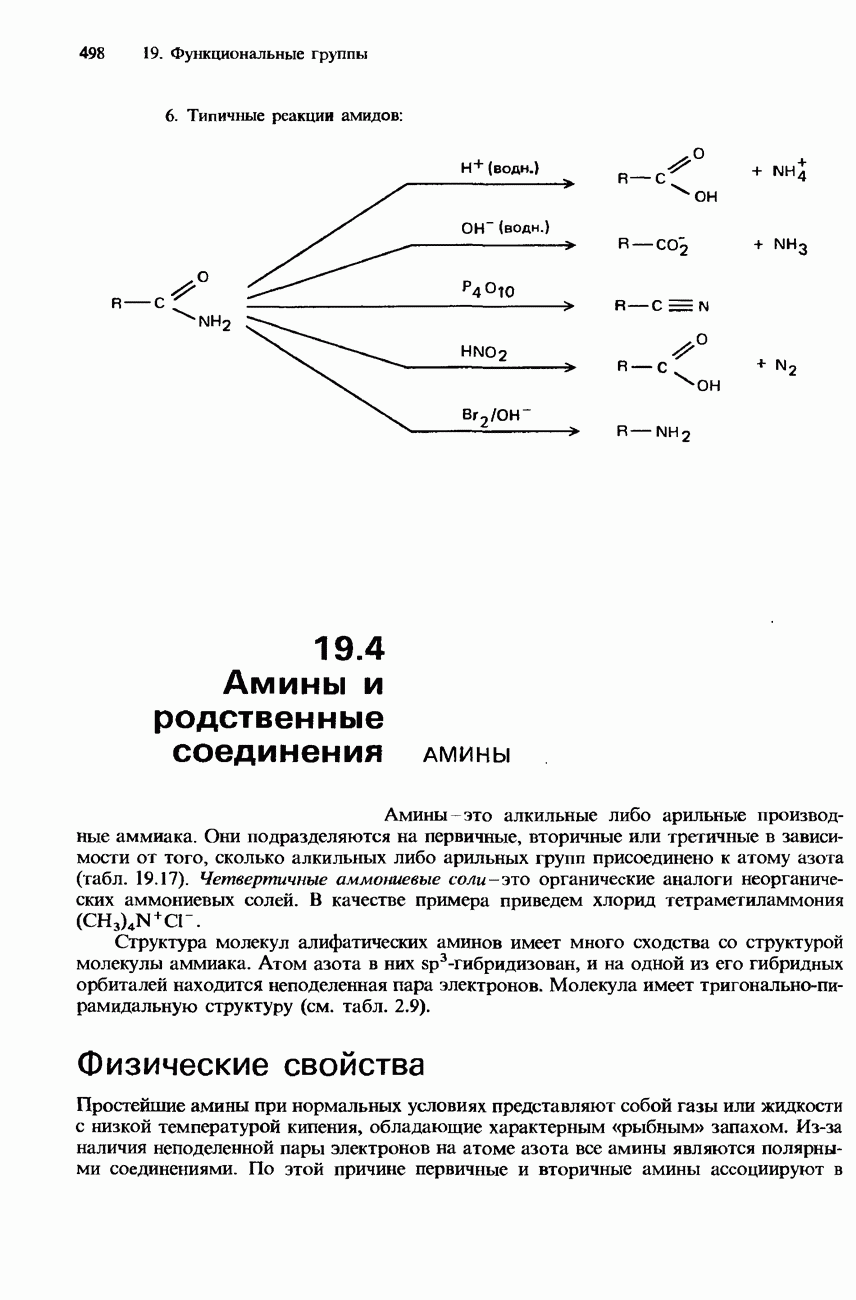
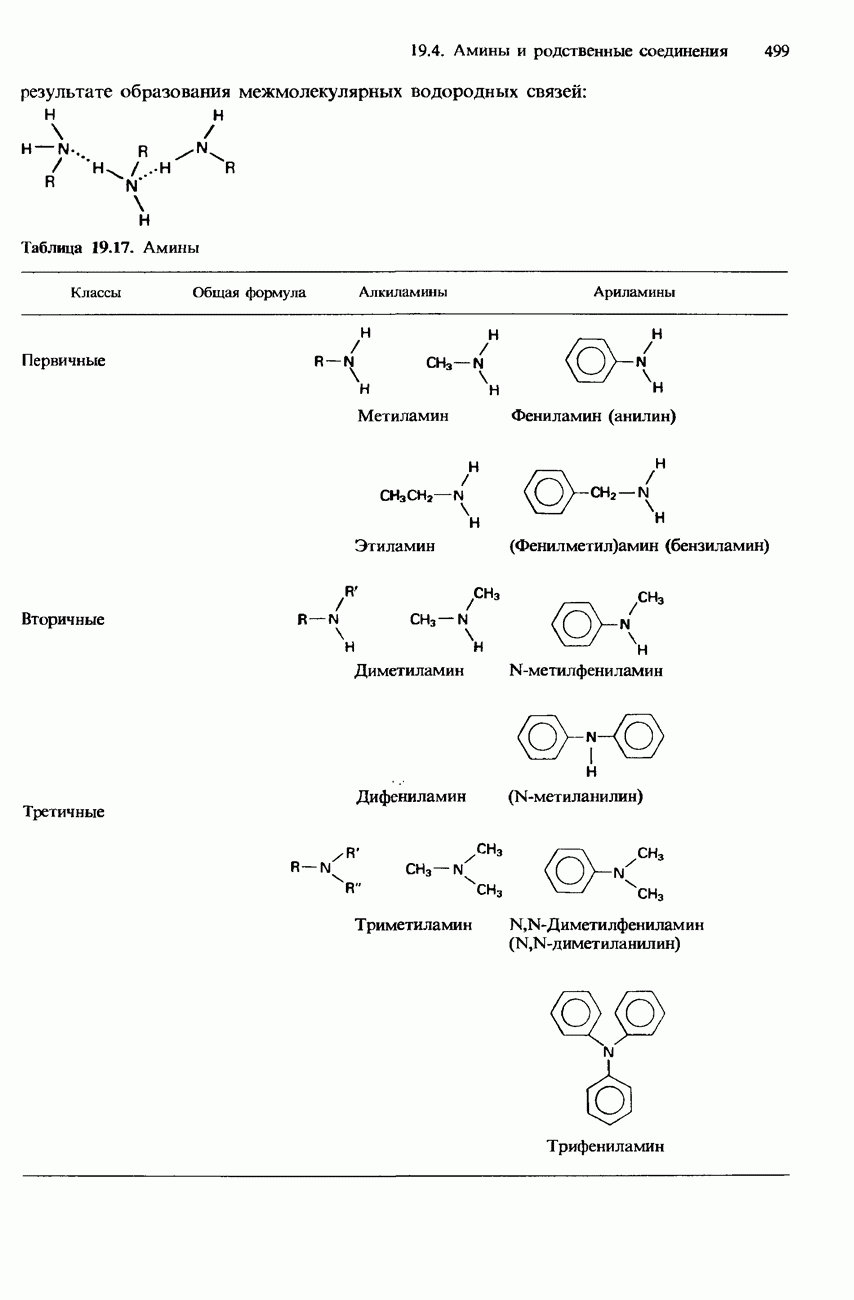
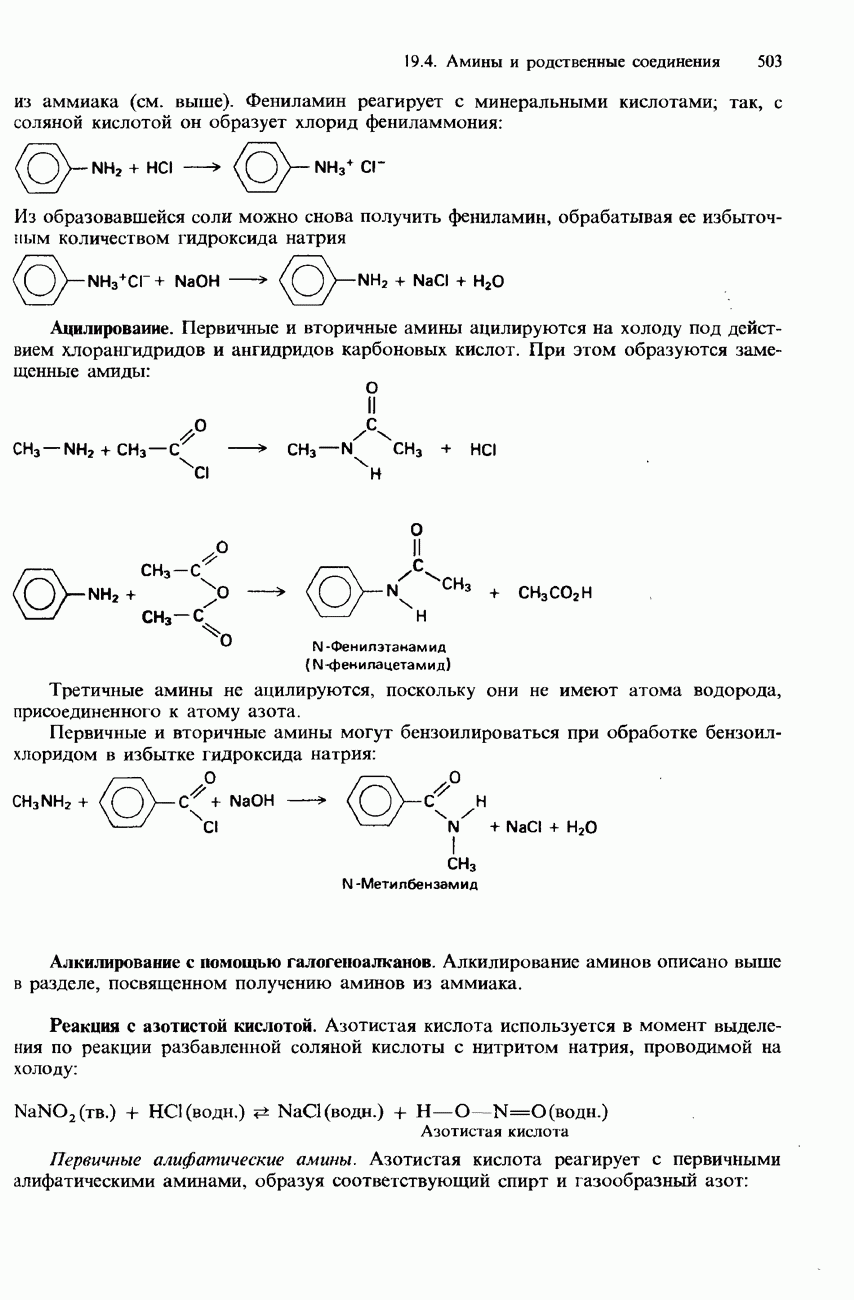
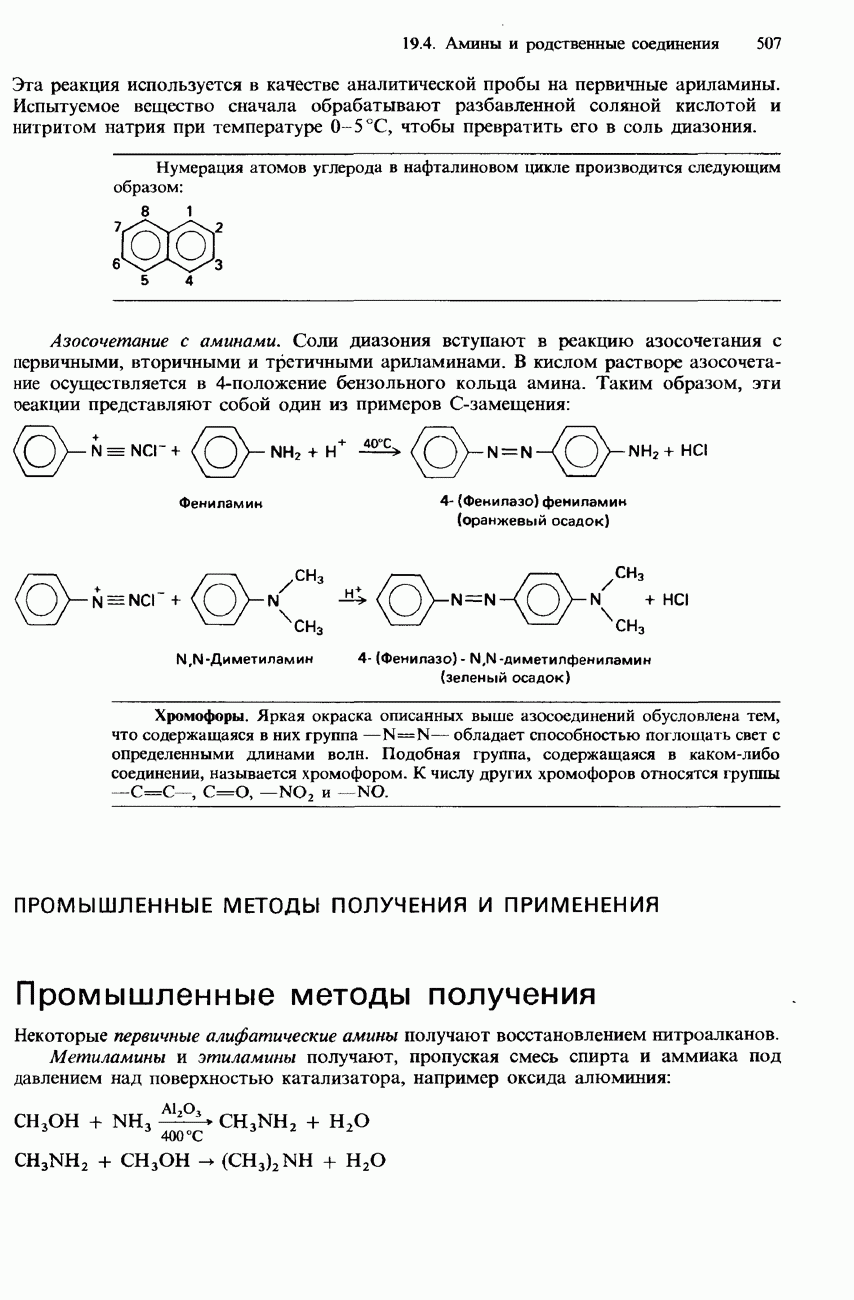
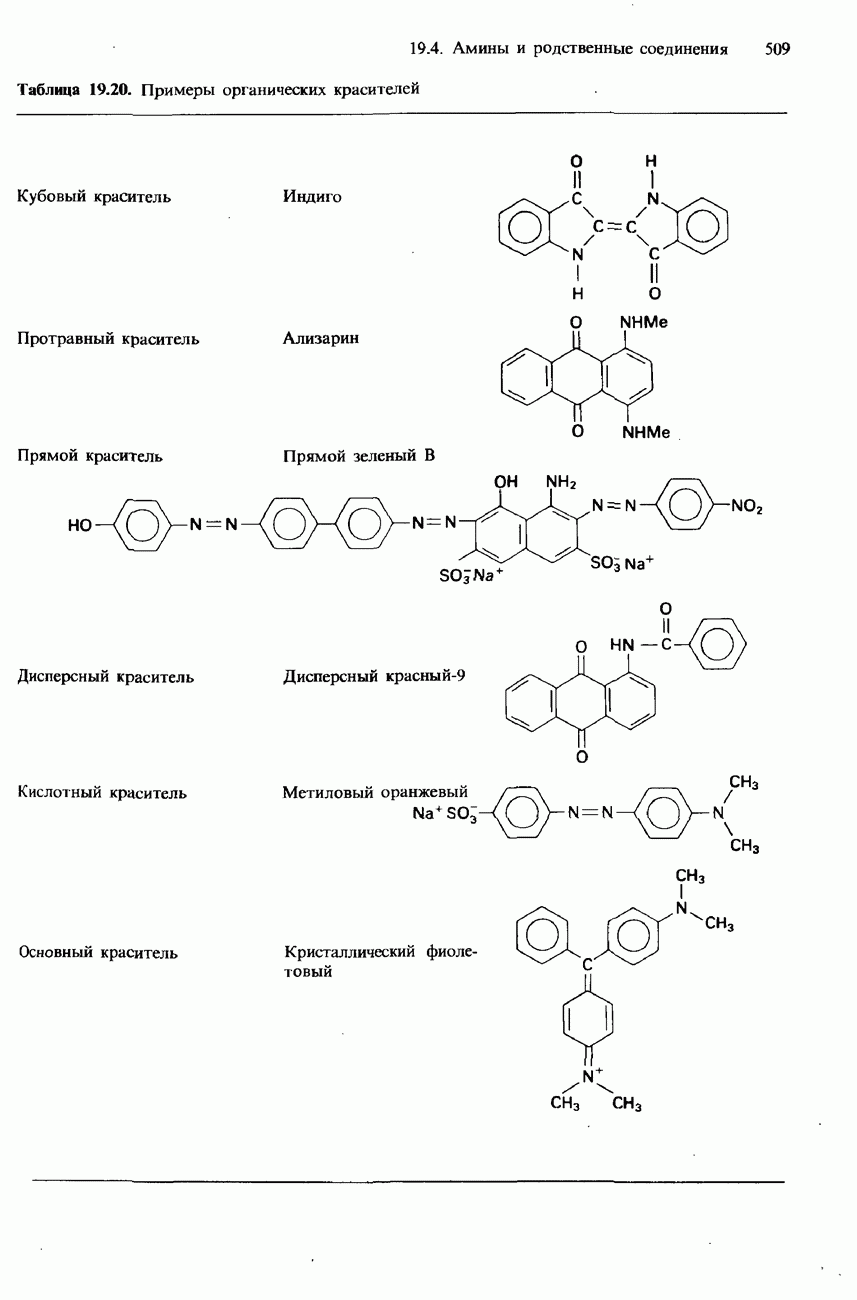
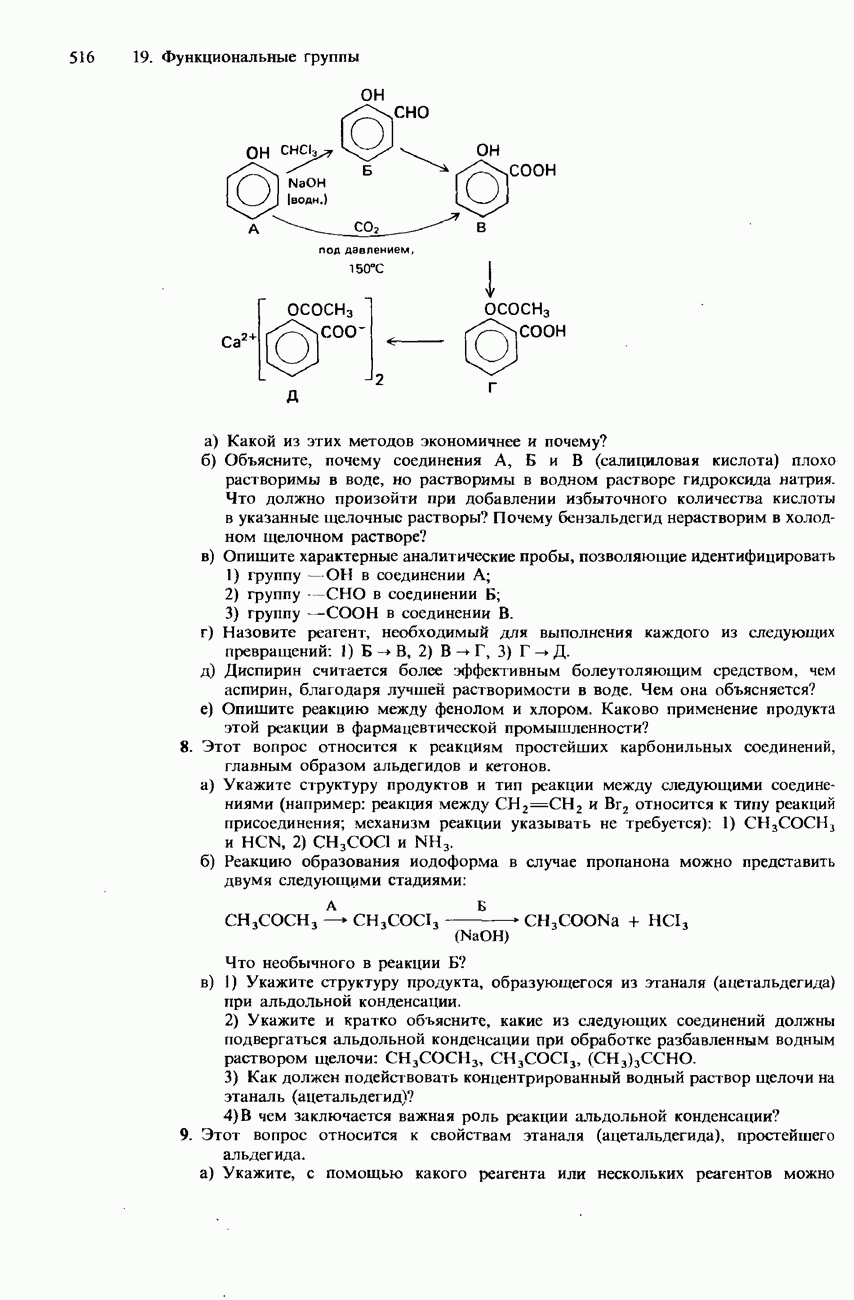
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
СОЕДИНЕНИЯ ФОСФОРА
Фосфин
Фосфин-бесцветный газ с характерным рыбным запахом. Он очень ядовит. Для получения фосфина в лабораторных условиях кипятят белый фосфор в концентрированном водном растворе гидроксида натрия:

Фосфин, получаемый таким способом, может самопроизвольно возгораться из-за присутствия в нем неустойчивого дифосфина 
Молекула фосфина имеет пирамидальную форму подобно молекуле аммиака, хотя с другими углами между связями.
Основность фосфина меньше, чем у аммиака, и в отличие от аммиака фосфин очень плохо растворяется в воде. Это объясняется меньшей электроотрицательностью фосфора по сравнению с азотом, в связи с чем фосфор не образует водородных связей с водой. Отсутствие в жидком фосфине водродных связей приводит к тому, что фосфин имеет более низкую температуру кипения, чем аммиак, несмотря на то что его относительная молекулярная масса выше.
Хлориды фосфора
Фосфор образует два хлорида: трихлорид фосфора  и пентахлорид фосфора
и пентахлорид фосфора 
Трихлорид фосфора получают, пропуская хлор над поверхностью белого фосфора. При этом фосфор горит бледно-зеленым пламенем, а образующийся хлорид фосфора конденсируется в виде бесцветной жидкости.
Трихлорид фосфора гидролизуется водой с образованием фосфористой кислоты и хлороводорода:

Трихлорид фосфора используется в органической химии в качестве хлорирующего реагента.
Пентахлорид фосфора можно получить в лабораторных условиях с помощью реакции хлора и трихлорида фосфора, проводимой при температуре около  Эта реакция обратима:
Эта реакция обратима:

Пентахлорид фосфора представляет собой бледно-желтое кристаллическое вещество, состоящее из тетраэдрических ионов  и октаэдрических ионов
и октаэдрических ионов  . В газообразном состоянии
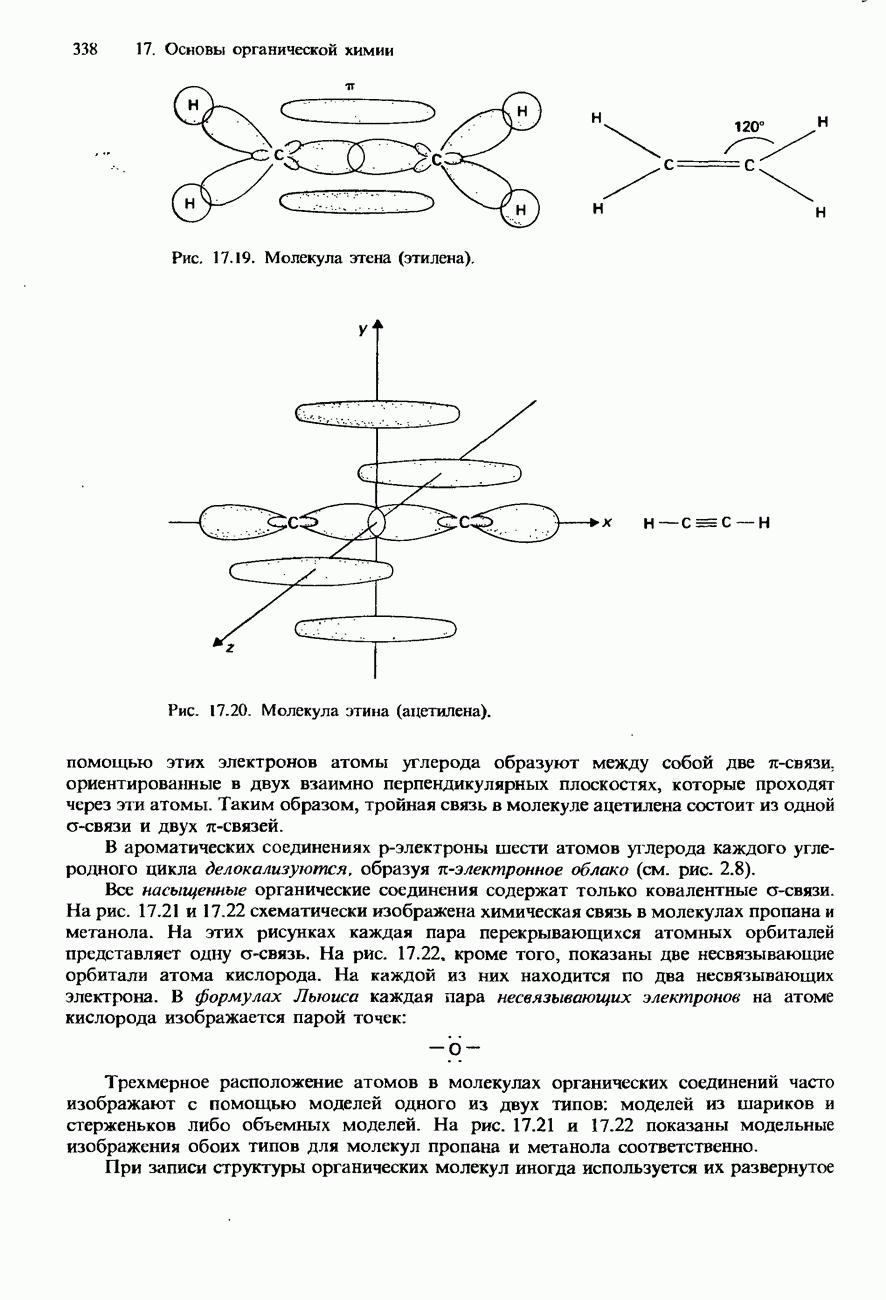
. В газообразном состоянии  состоит из ковалентных молекул
состоит из ковалентных молекул  имеющих бипирамидальную форму.
имеющих бипирамидальную форму.
При нагревании пентахлорид фосфора диссоциирует на трихлорид фосфора и хлор.
Пентахлорид фосфора бурно реагирует с водой, образуя  кислоту. Эта реакция описывается следующим суммарным уравнением:
кислоту. Эта реакция описывается следующим суммарным уравнением:

Пентахлорид фосфора тоже используется как хлорирующий реагент.
Оксиды фосфора
Оксид  представляет собой белое твердое вещество; он образуется при сгорании белого фосфора в условиях ограниченного доступа воздуха. Если же белый фосфор сгорает в избыточном количестве воздуха, образуется другое белое вещество оксид
представляет собой белое твердое вещество; он образуется при сгорании белого фосфора в условиях ограниченного доступа воздуха. Если же белый фосфор сгорает в избыточном количестве воздуха, образуется другое белое вещество оксид 

Чтобы предотвратить самопроизвольное протекание этих реакций, белый фосфор хранят под слоем воды. Оксид  при нагревании реагирует с кислородом, образуя оксид
при нагревании реагирует с кислородом, образуя оксид 

Оксиды  обладают кислотными свойствами и лег» реагируют с водой, образуя фосфористую либо
обладают кислотными свойствами и лег» реагируют с водой, образуя фосфористую либо  кислоты соответствен но:
кислоты соответствен но:

Поэтому оба этих оксида необходимо хранить в герметичных сосудах.  высокого сродства к воде оксид
высокого сродства к воде оксид  иногда используют в качестве осушающей средства.
иногда используют в качестве осушающей средства.
Кислоты фосфора и их соли
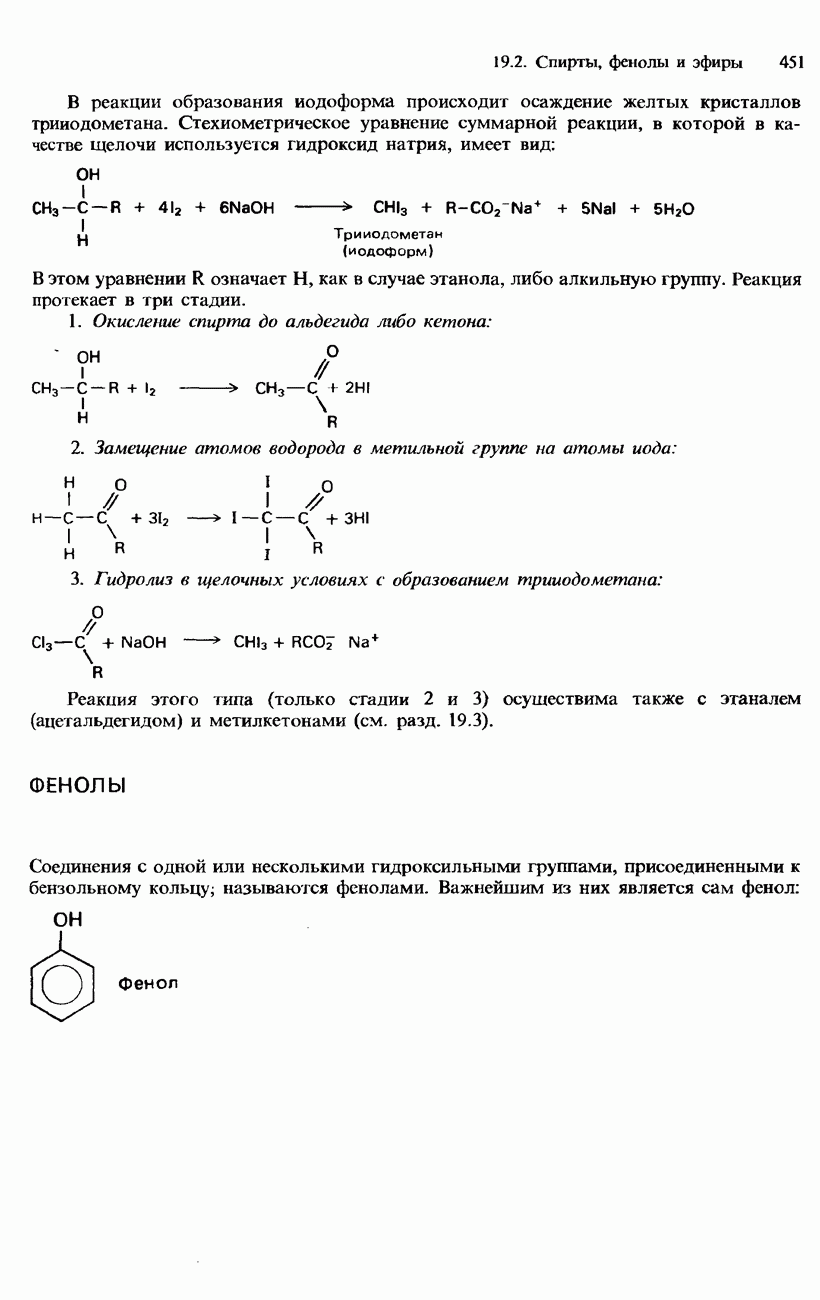
Фосфор образует целый ряд кислородсодержащих кислот (оксокислот). Некоторые и: них мономерны, например фосфиновая, фосфористая и  кислоты. Кислоты фосфора могут быть одноосновными (однопротонными) либс многоосновными (многопротонными). Кроме того, фосфор образует еще полимерньк оксокислоты. Такие кислоты могут иметь ациклическое либо циклическое строение, Например,
кислоты. Кислоты фосфора могут быть одноосновными (однопротонными) либс многоосновными (многопротонными). Кроме того, фосфор образует еще полимерньк оксокислоты. Такие кислоты могут иметь ациклическое либо циклическое строение, Например,  кислота представляет собой димернук оксокислоту фосфора.
кислота представляет собой димернук оксокислоту фосфора.
Наиболее важной из всех этих кислот является  кислота (другое ее название - ортофосфорная кислота). При нормальных условиях она представляет собой белое кристаллическое вещество, расплывающееся при поглощении влаги из воздуха. Ее
кислота (другое ее название - ортофосфорная кислота). При нормальных условиях она представляет собой белое кристаллическое вещество, расплывающееся при поглощении влаги из воздуха. Ее  -ный водный раствор называют «сиропообразной фосфорной кислотой».
-ный водный раствор называют «сиропообразной фосфорной кислотой».  кислота является слабой трехосновной кислотой:
кислота является слабой трехосновной кислотой:

Трех- и двузамещенные соли  кислоты, как правило, нерастворимы в воде, исключение составляют лишь соли щелочных металлов и аммония. Соли, содержащие
кислоты, как правило, нерастворимы в воде, исключение составляют лишь соли щелочных металлов и аммония. Соли, содержащие  -ион, обладают большей растворимостью. Например, фосфат кальция
-ион, обладают большей растворимостью. Например, фосфат кальция  содержащийся в фосфорной руде, нерастворим, а дигидрофосфат кальция растворим. Последний используется как составная часть фосфатного удобрения суперфосфата (см. гл. 13).
содержащийся в фосфорной руде, нерастворим, а дигидрофосфат кальция растворим. Последний используется как составная часть фосфатного удобрения суперфосфата (см. гл. 13).
Кислородсодержащие кислоты  и их соли
и их соли
Фосфиновая кислота 

Фосфоновая кислота 

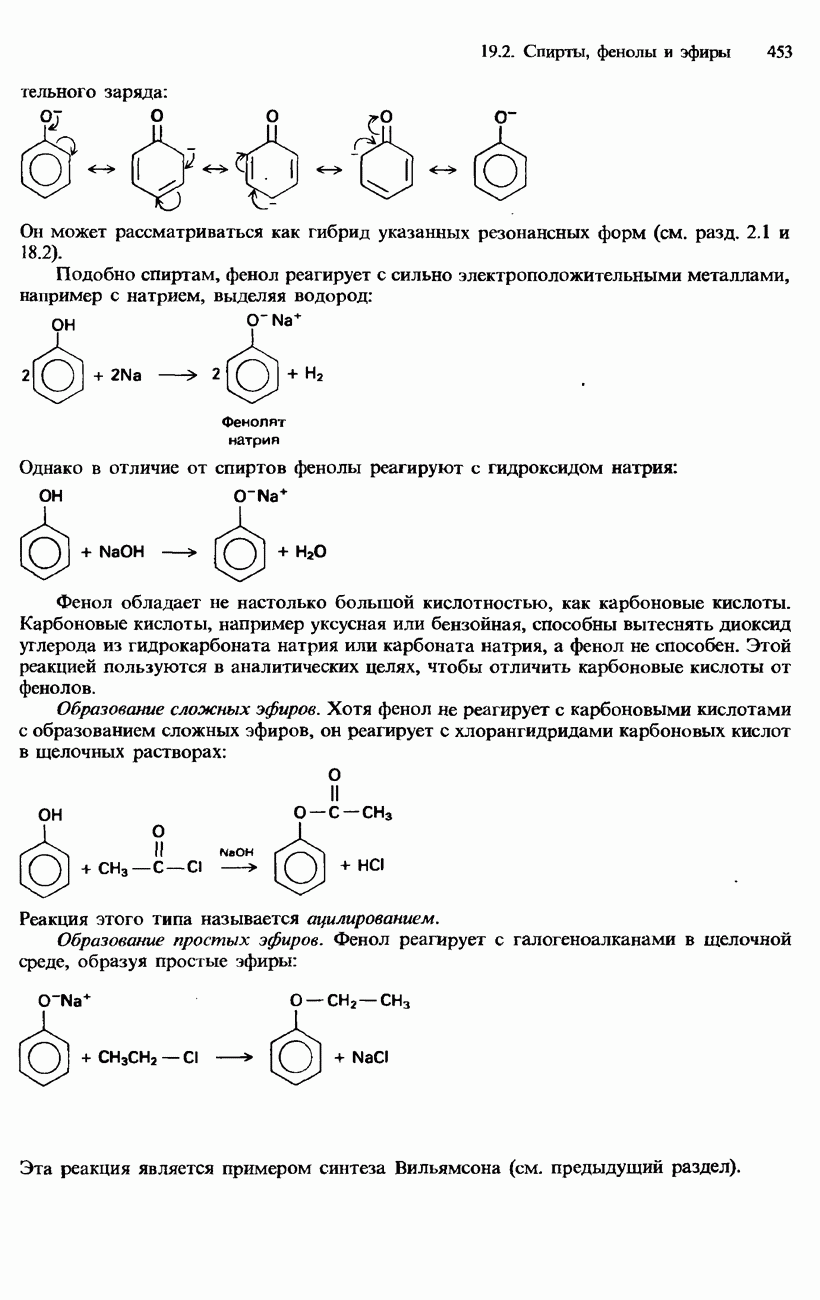
Фосфорная{ V) (ортофосфорная) кислота 

Дифосфорная(V) (пирофосфорная) кислота 

Фосфорную(V) кислоту в промышленных условиях получают нагреванием смеси фосфорной руды с концентрированной серной кислотой либо растворением оксида фосфора(V) в воде (см. выше).
Итак, повторим еще раз!
1. При перемещении к нижней части V группы неметаллические свойства элементов сменяются металлическими.
2. Фосфор существует в трех аллотропных формах.
3. Азот и фосфор существуют в своих соединениях в состояниях окисления от —3 до +5.
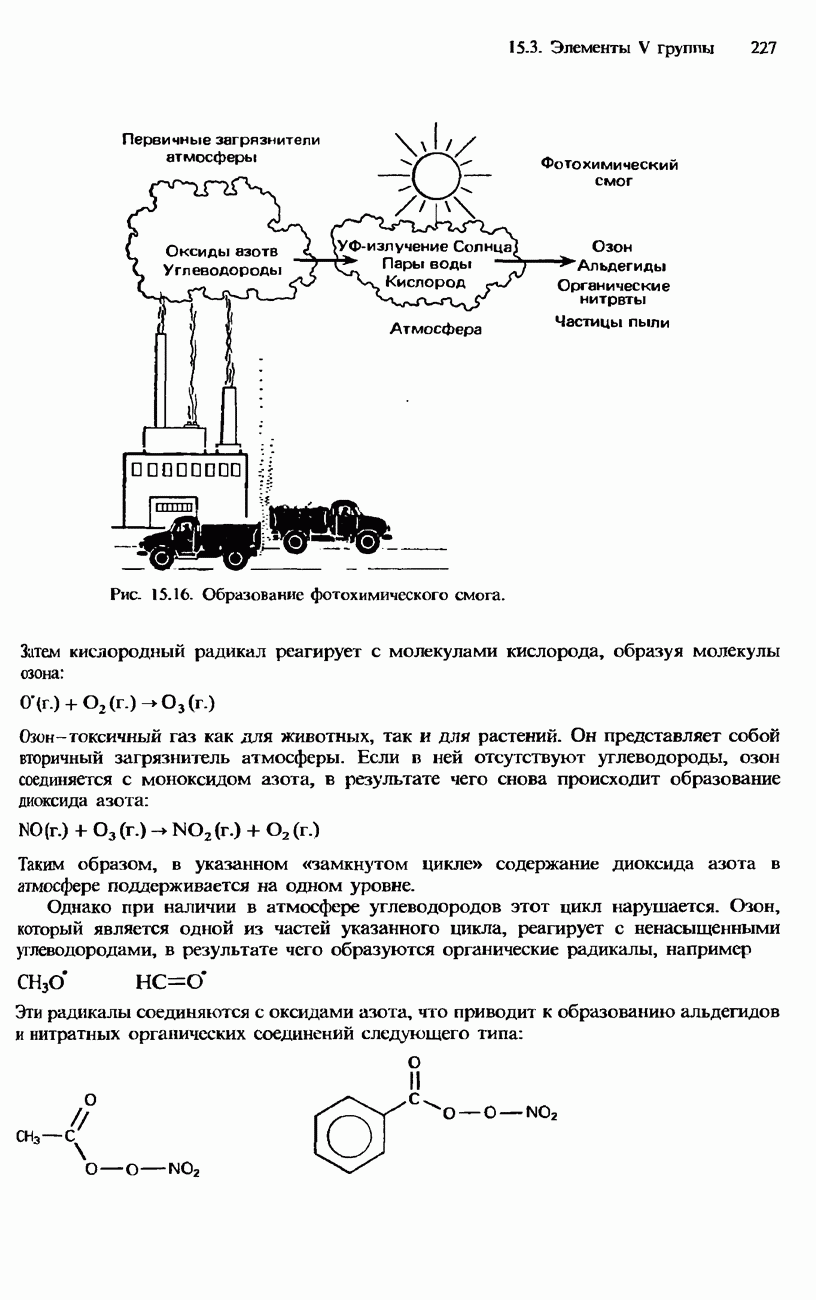
4. Процесс превращения атмосферного азота в форму, усвояемую растениями и животными, называется связыванием (фиксацией) азота. Этот процесс является составной частью круговорота азота в природе.
5. Промышленное получение азота основано на сжижении воздуха и его последующей фракционной перегонке.
6. Фосфор необходим животным для построения костных тканей и для обеспечения организма энергией в процессе дыхания (см. также ниже).
7. Фосфор входит в состав некоторых минералов, важнейшим из которых является апатит.
8. Апатит используется для получения фосфатных удобрений.
9. Аммиак представляет собой ковалентное соединение, молекулы которого имеют пирамидальную форму.
10. Аммиак обладает свойствами льюисова основания.
11. Растворы аммиака осаждают нерастворимые гидроксиды металлов из растворов солей этих металлов.
12. Аммиак обладает свойствами восстановителя.
13. Соли аммония при нагревании разлагаются.
14. Все шесть оксидов азота являются эндотермическими соединениями.
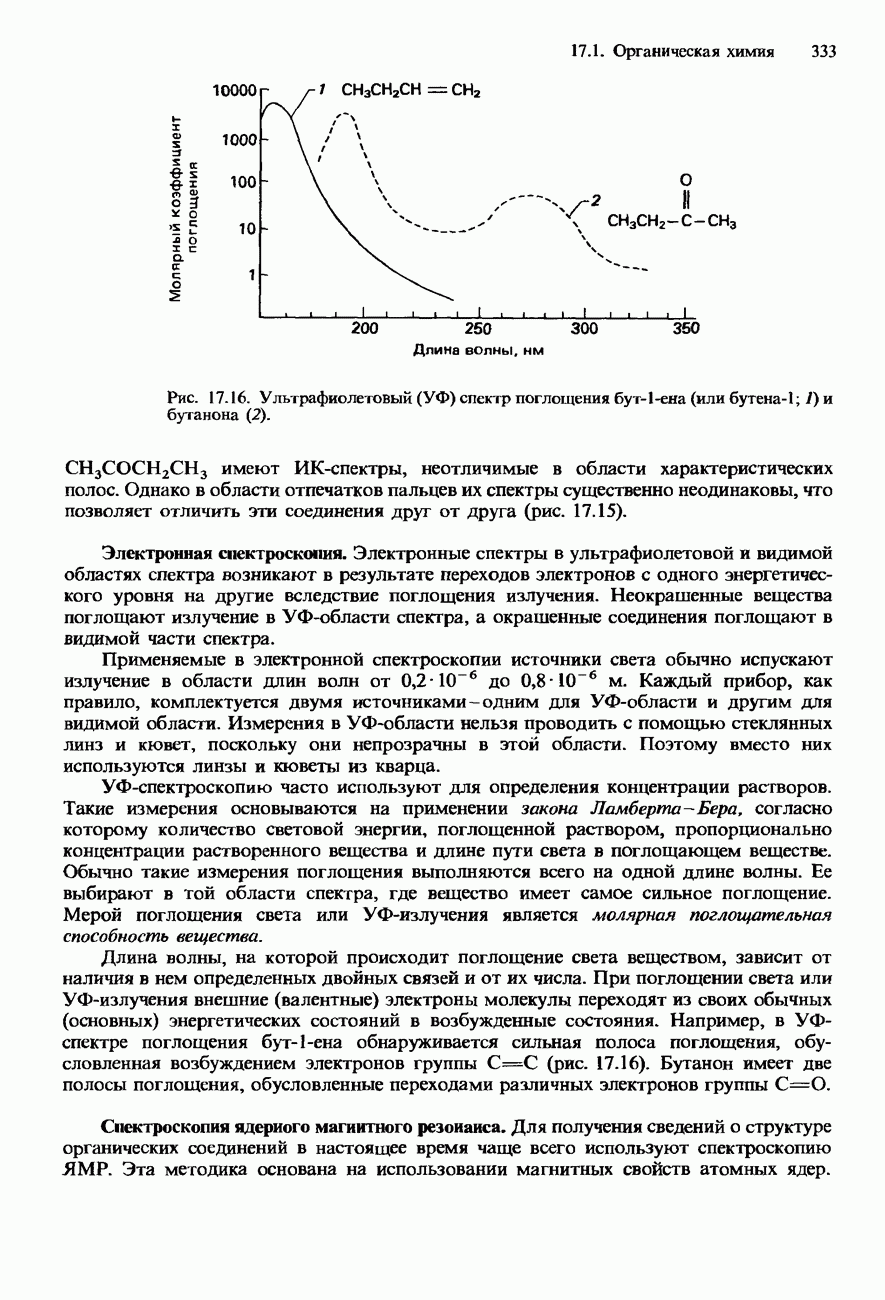
15. Тремя важнейшими оксидами азота являются: а) оксид диазота  , б) моноксид азота NO, в) диоксид азота
, б) моноксид азота NO, в) диоксид азота  . Все они представляют собой простые молекулярные соединения, которые по их электронному строению можно рассматривать как резонансные гибриды. Например
. Все они представляют собой простые молекулярные соединения, которые по их электронному строению можно рассматривать как резонансные гибриды. Например

16. Оксиды азота считаются первичными загрязнителями окружающей среды. В атмосфере они вступают в различные реакции, образуя вторичные загрязнители. Последние могут приводить к образованию фотохимического смога.
17. Азотная кислота является типичной сильной кислотой.
18. Азотная кислота используется в качестве нитрующего реагента в органической химии.
19. Неорганические нитраты при нагревании разлагаются.
20. Для промышленного получения азотной кислоты используется процесс Оствальда. Он состоит из трех стадий: 1) каталитическое окисление аммиака, 2) получение диоксида азота, 3) превращение диоксида азота в азотную кислоту.
21. Оба хлорида фосфора гидролизуются водой.
22. Оба оксида фосфора обладают кислотными свойствами.
23. Фосфор образует целый ряд кислородсодержащих кислот (оксокислот). Важнейшей из них является  или ортофосфорная, кислота
или ортофосфорная, кислота  .
.
| << Предыдущий параграф | Следующий параграф >> |
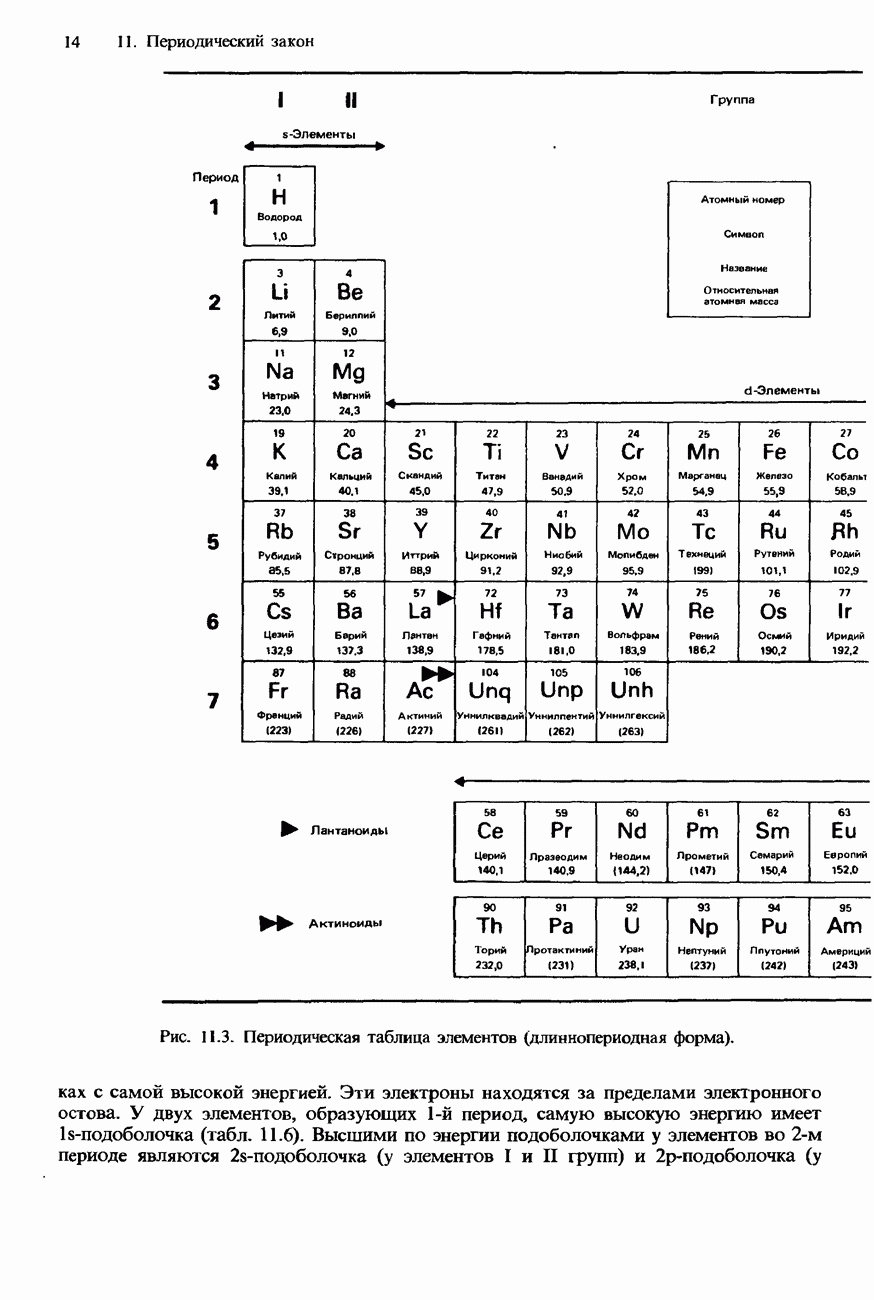
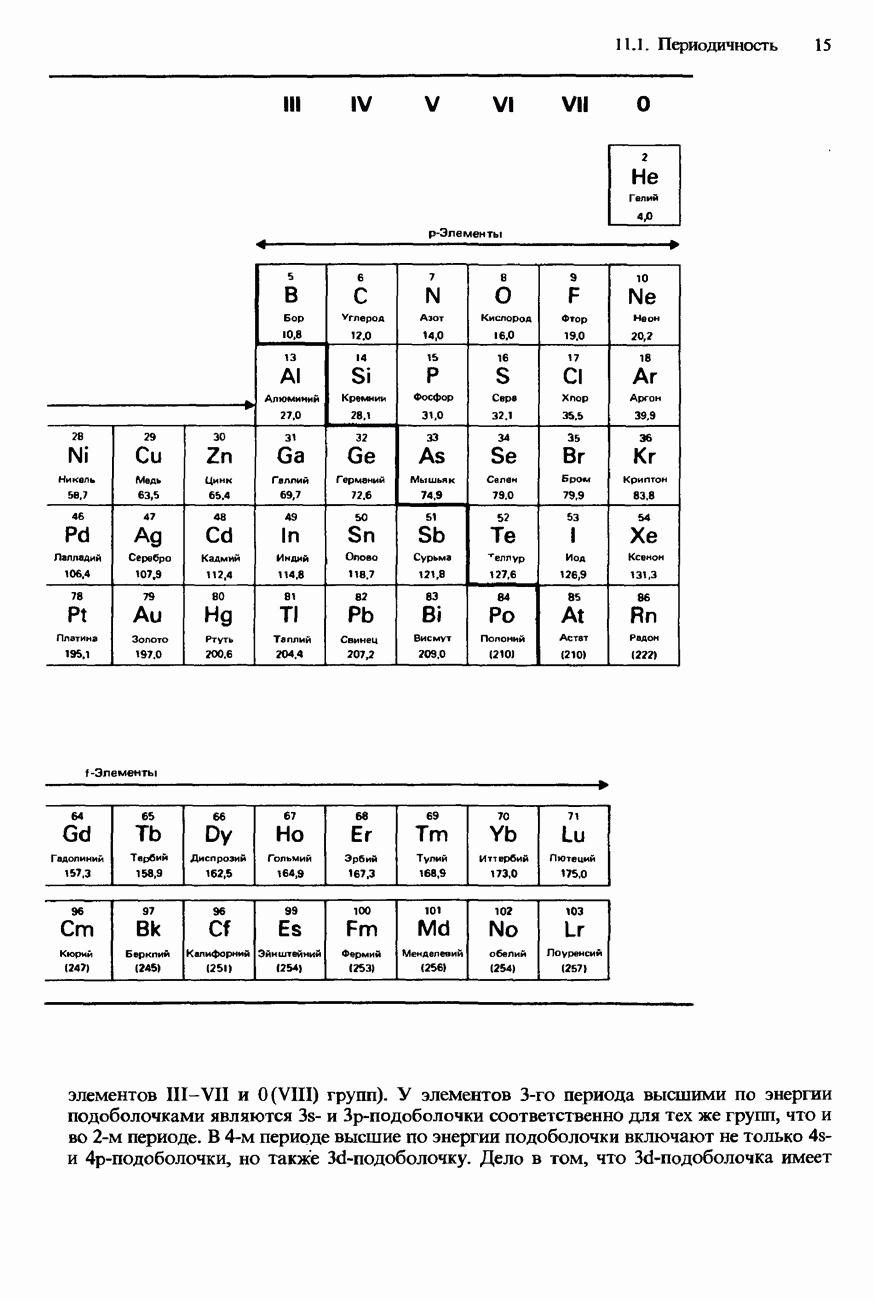
- 11. ПЕРИОДИЧЕСКИЙ ЗАКОН
- 11.1 Периодичность
- СОВРЕМЕННАЯ ФОРМА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
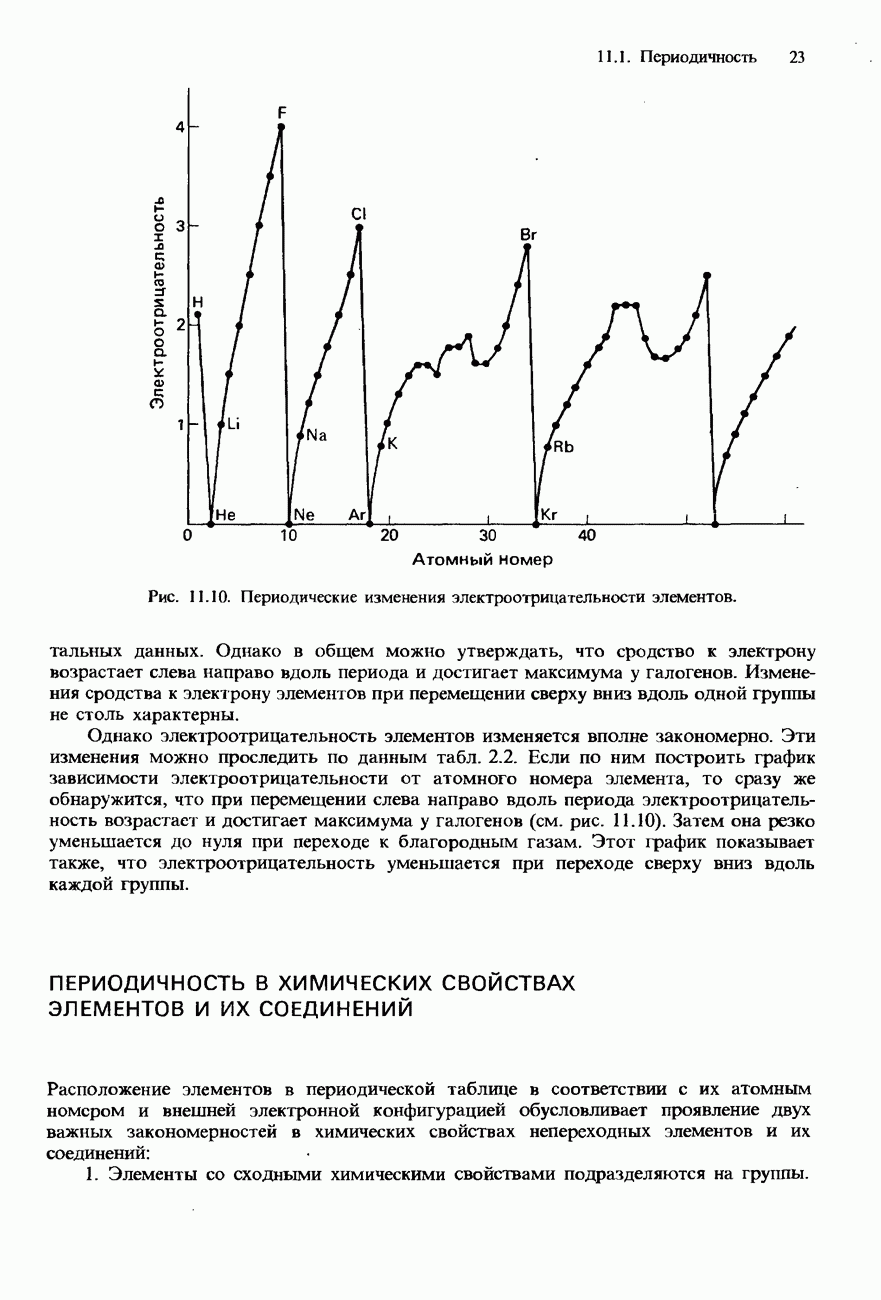
- ПЕРИОДИЧНОСТЬ
- ПЕРИОДИЧНОСТЬ В ХИМИЧЕСКИХ СВОЙСТВАХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 12. ВОДОРОД И ВОДА
- 12.1. ВОДОРОД
- ПОЛУЧЕНИЕ ВОДОРОДА В ЛАБОРАТОРНЫХ УСЛОВИЯХ
- РАЗЛИЧНЫЕ ФОРМЫ ВОДОРОДА
- ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
- ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
- ТИПЫ СОЕДИНЕНИЙ ВОДОРОДА
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПОЛУЧЕНИЕ И ИСПОЛЬЗОВАНИЕ ВОДОРОДА
- 12.2 Вода
- ХИМИЧЕСКИЕ РЕАКЦИИ С УЧАСТИЕМ ВОДЫ
- ИСТОЧНИКИ ПРЕСНОЙ ВОДЫ И ЕЕ ИСПОЛЬЗОВАНИЕ
- КАЧЕСТВО ВОДЫ
- ЗАГРЯЗНЕНИЕ ВОДЫ
- ОЧИСТКА И ПОДГОТОВКА ВОДЫ
- ОКЕАНЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 13. s-Металлы
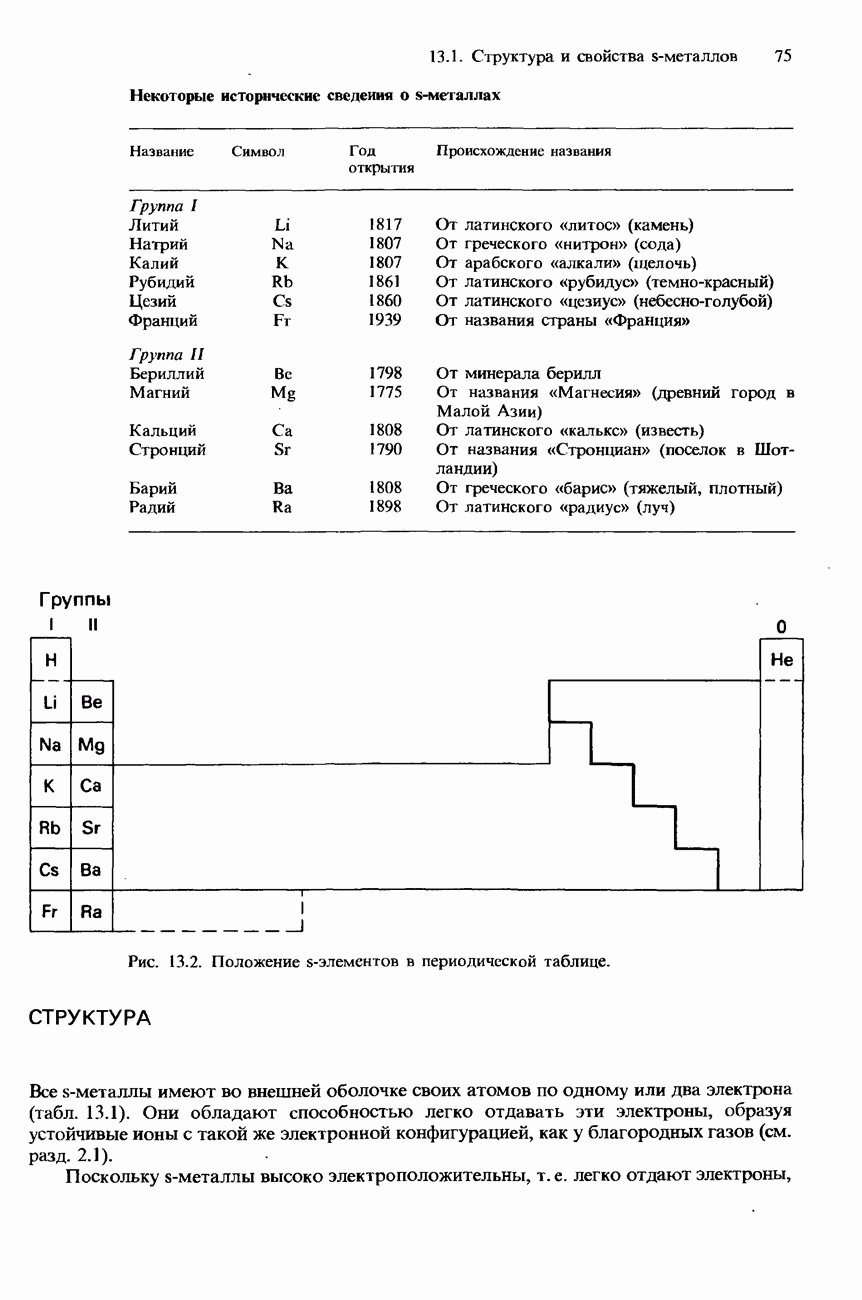
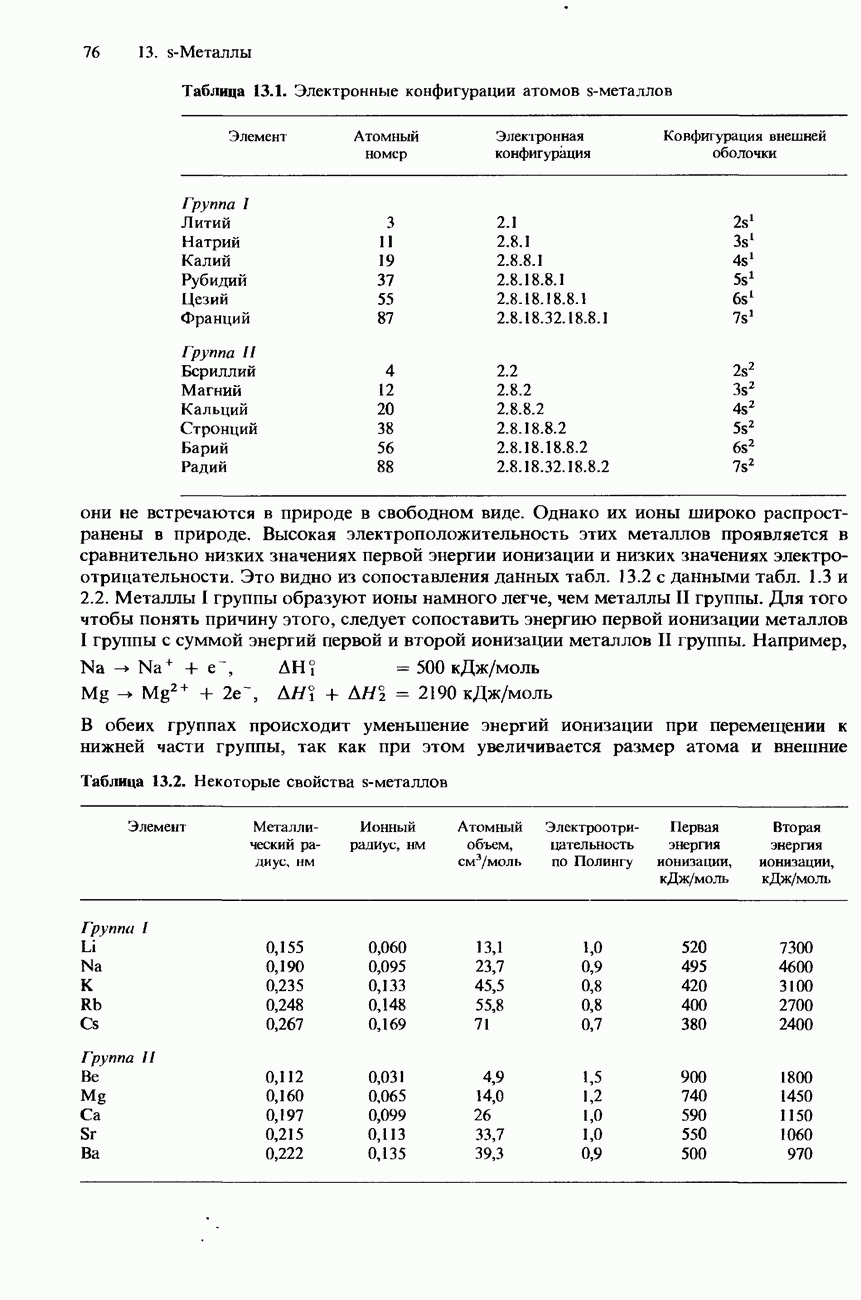
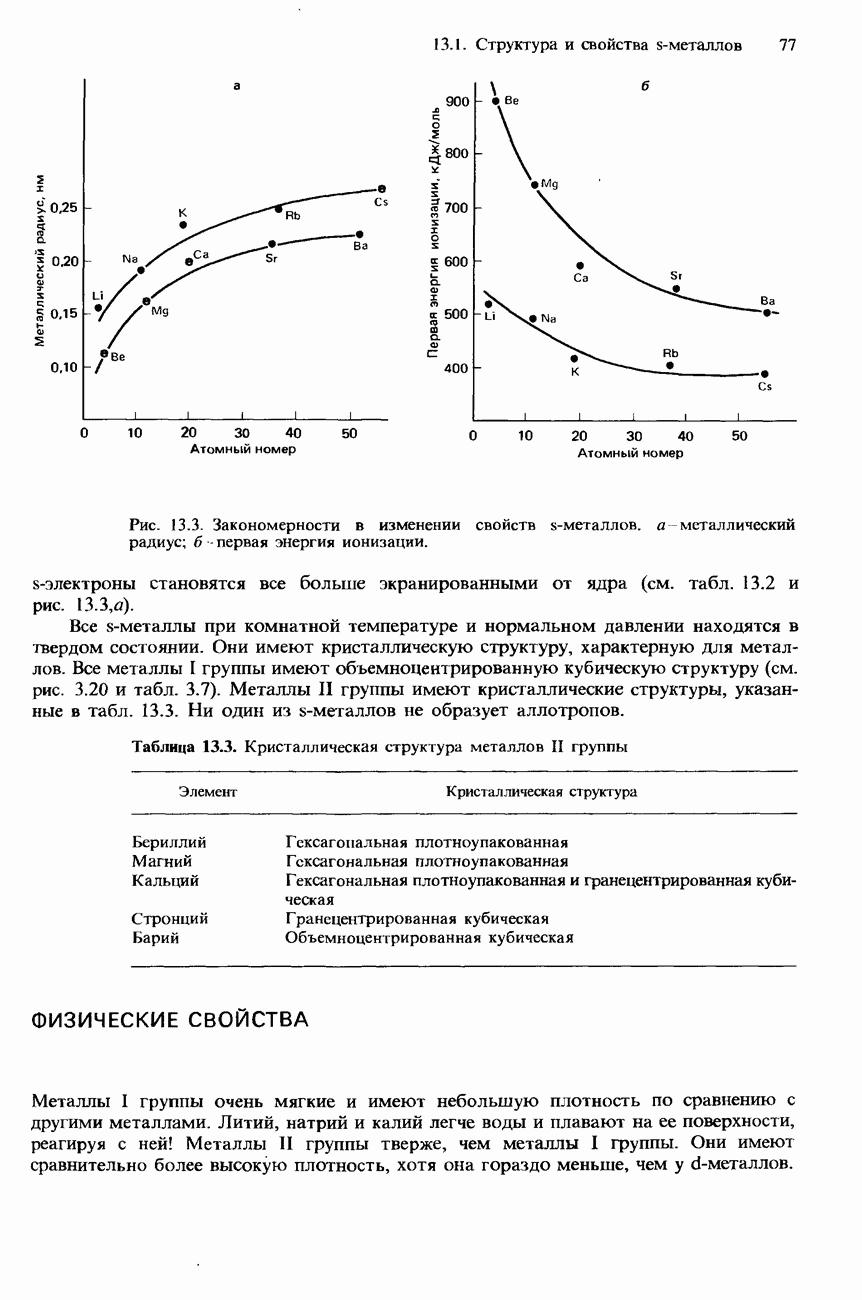
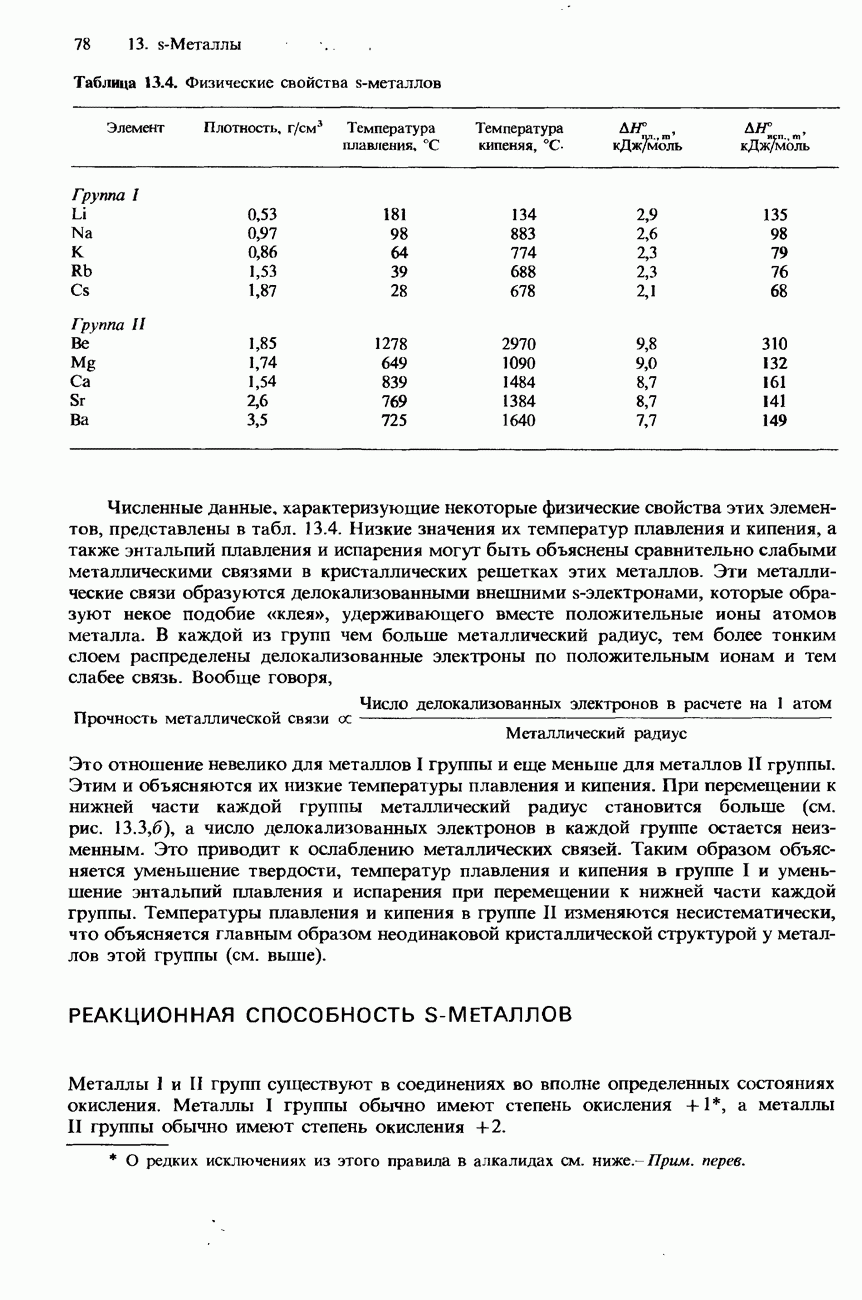
- 13.1 Структура и свойства s-металлов
- СТРУКТУРА
- ФИЗИЧЕСКИЕ СВОЙСТВА
- РЕАКЦИОННАЯ СПОСОБНОСТЬ S-МЕТАЛЛОВ
- 13.2 Соединения, образуемые s-металлами
- ДРУГИЕ БИНАРНЫЕ СОЕДИНЕНИЯ
- ГИДРОКСИДЫ
- КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ ОКСОСОЕДИНЕНИЙ S-МЕТАЛЛОВ
- РАСТВОРИМОСТЬ СОЛЕЙ И ГИДРОКСИДОВ МЕТАЛЛОВ I И II ГРУПП В ВОДЕ
- АНОМАЛЬНЫЕ СВОЙСТВА ЛИТИЯ И БЕРИЛЛИЯ, А ТАКЖЕ ИХ СОЕДИНЕНИЙ
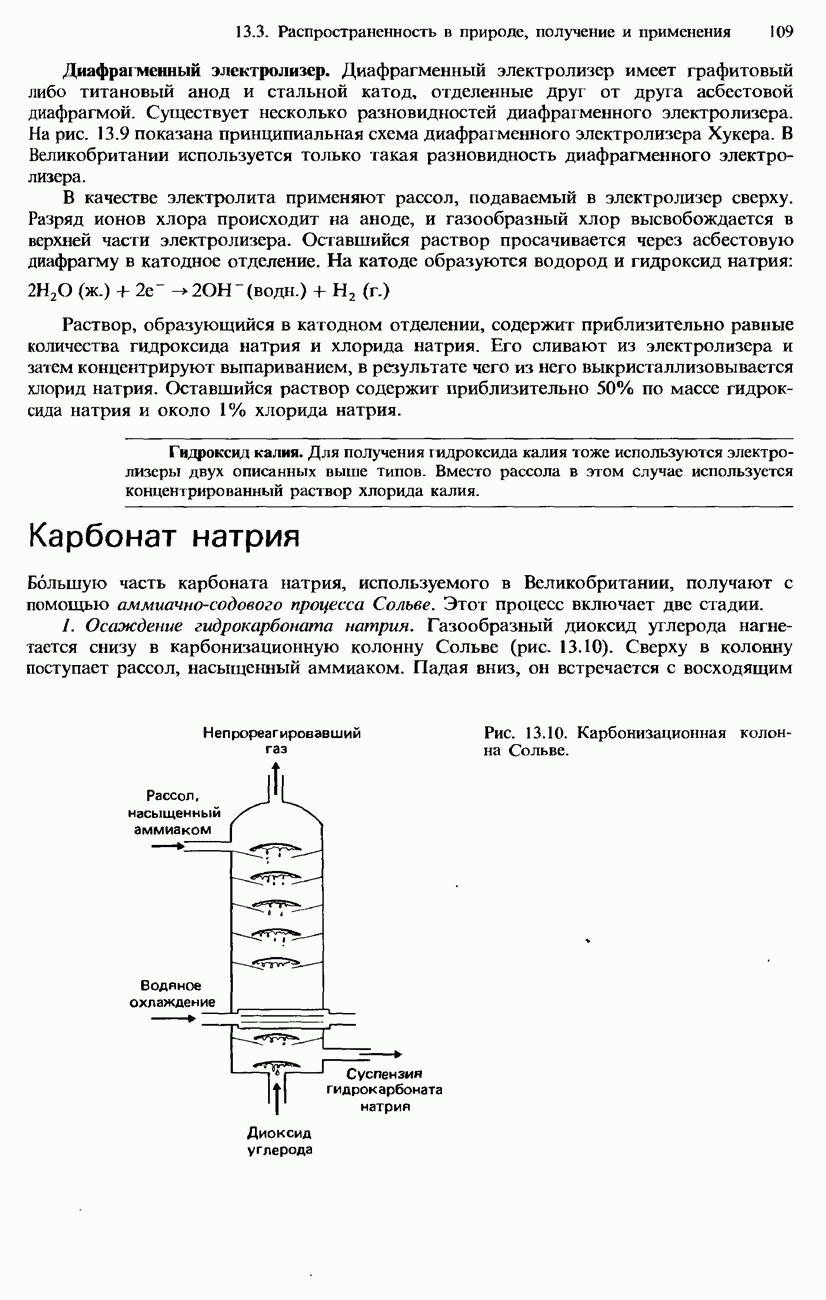
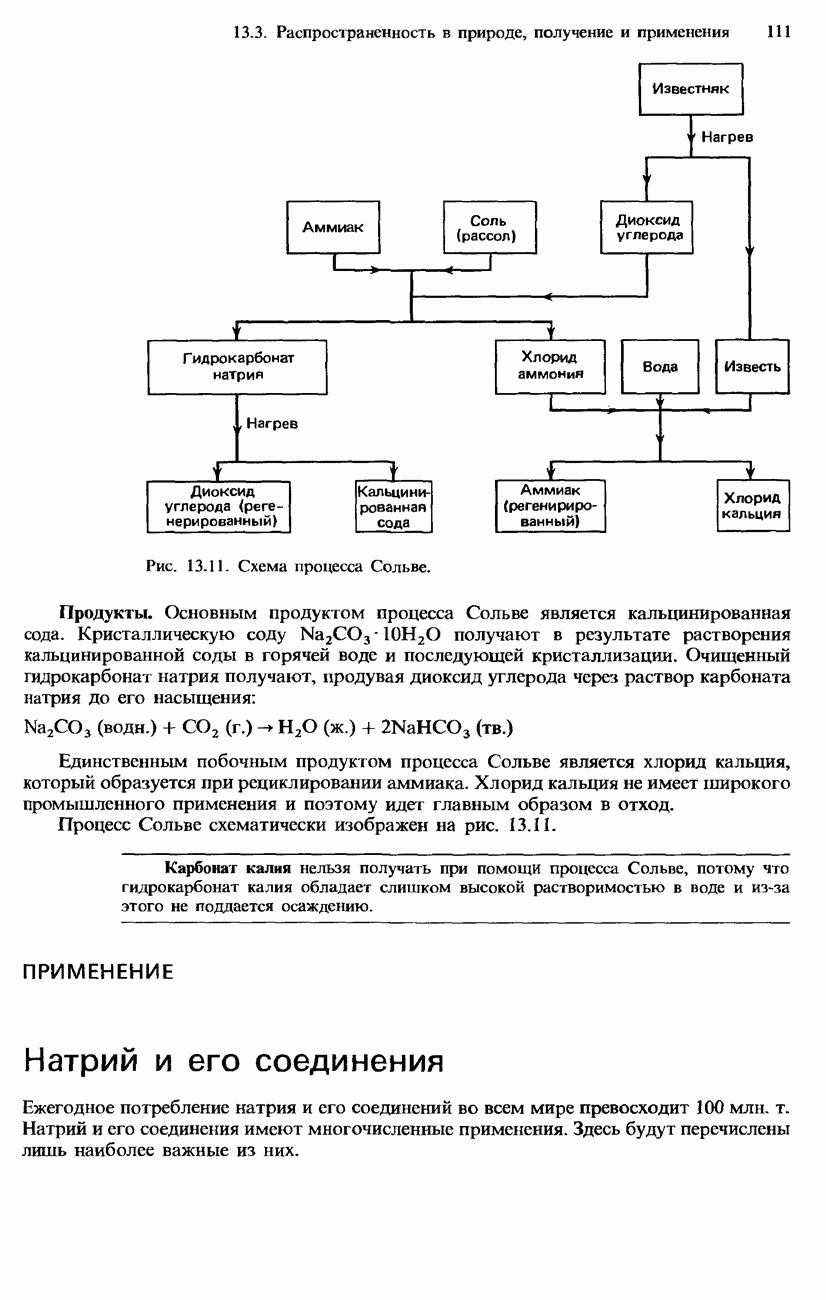
- 13.3. Распространенность в природе, получение и применение
- ПОЛУЧЕНИЕ S-МЕТАЛЛОВ
- ПОЛУЧЕНИЕ СОЕДИНЕНИЙ S-МЕТАЛЛОВ
- ПРИМЕНЕНИЕ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
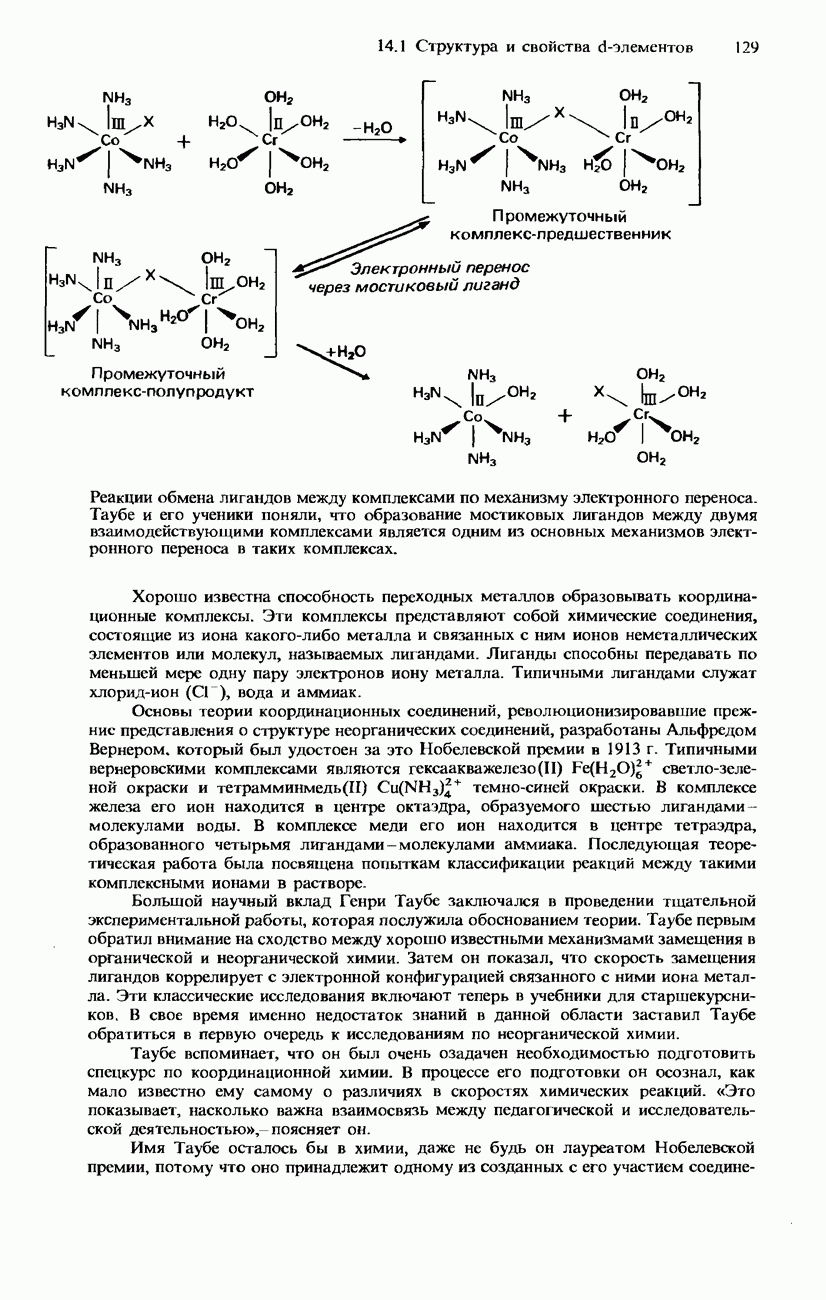
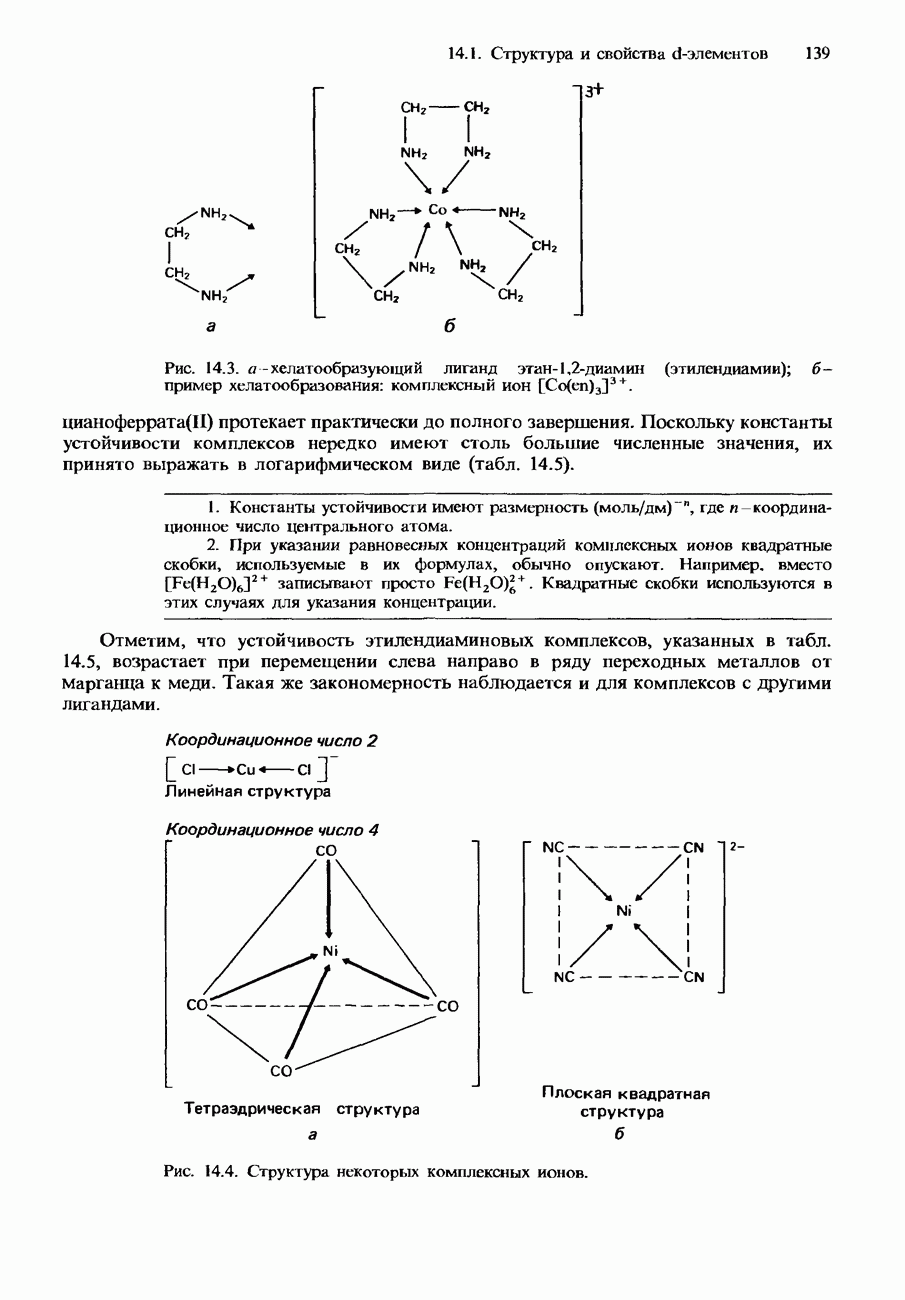
- 14. d-ЭЛЕМЕНТЫ
- 14.1. Структура и свойства d-элементов
- d-ЭЛЕМЕНТЫ
- ФИЗИЧЕСКИЕ СВОЙСТВА
- ХИМИЧЕСКИЕ СВОЙСТВА
- 14.2 Химия семи d-элементов
- МАРГАНЕЦ
- ЖЕЛЕЗО
- КОБАЛЬТ
- НИКЕЛЬ
- МЕДЬ
- ЦИНК
- 14.3. Распространенность в природе, получение и применения
- ПРОИЗВОДСТВО ЖЕЛЕЗА И СТАЛИ
- ПОЛУЧЕНИЕ ДРУГИХ МЕТАЛЛОВ ПЕРВОГО ПЕРЕХОДНОГО РЯДА
- ПРИМЕНЕНИЯ d-ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 15. ЭЛЕМЕНТЫ III-VI ГРУПП
- 15.1. Алюминий и другие элементы III группы
- БОР
- ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ
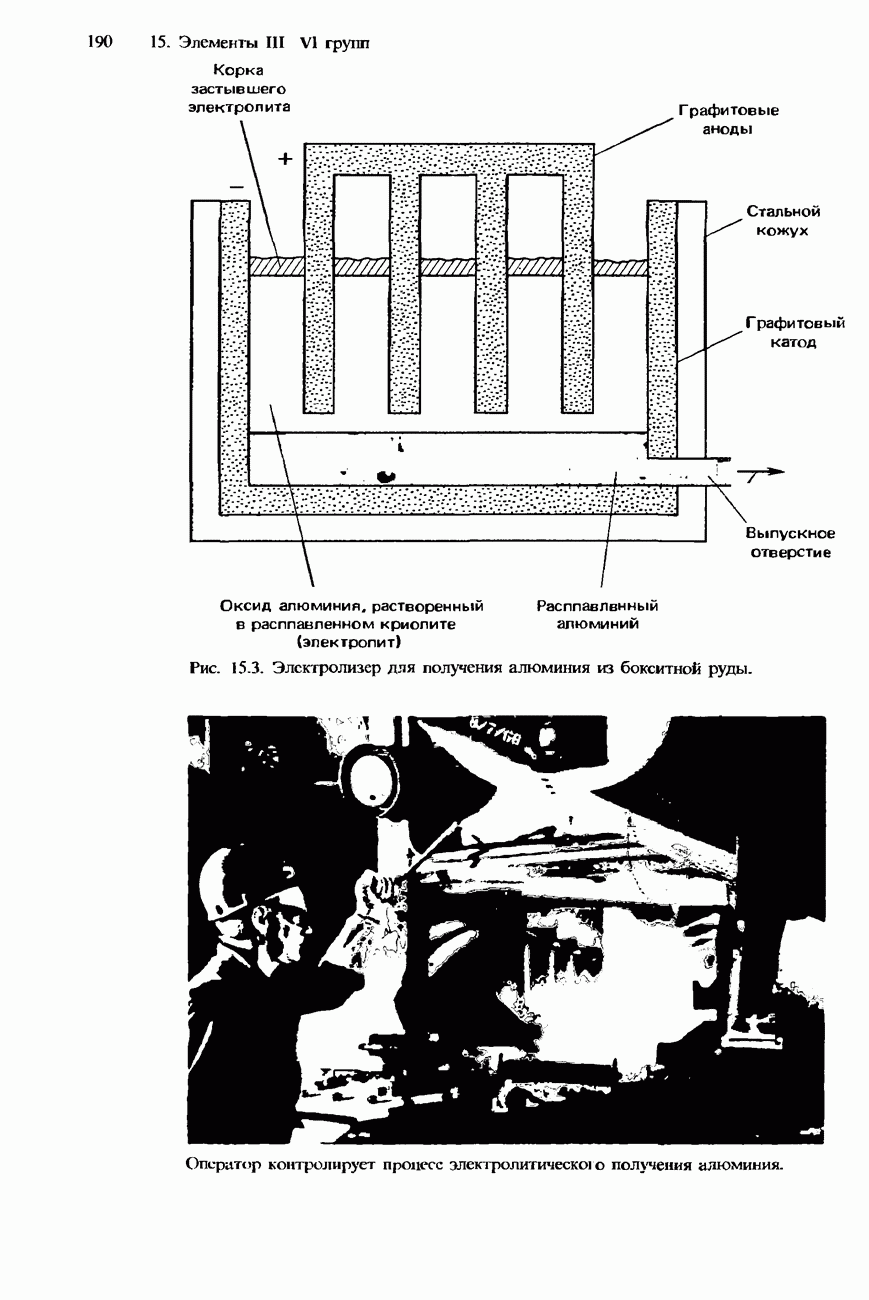
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ
- ПРИМЕНЕНИЯ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ
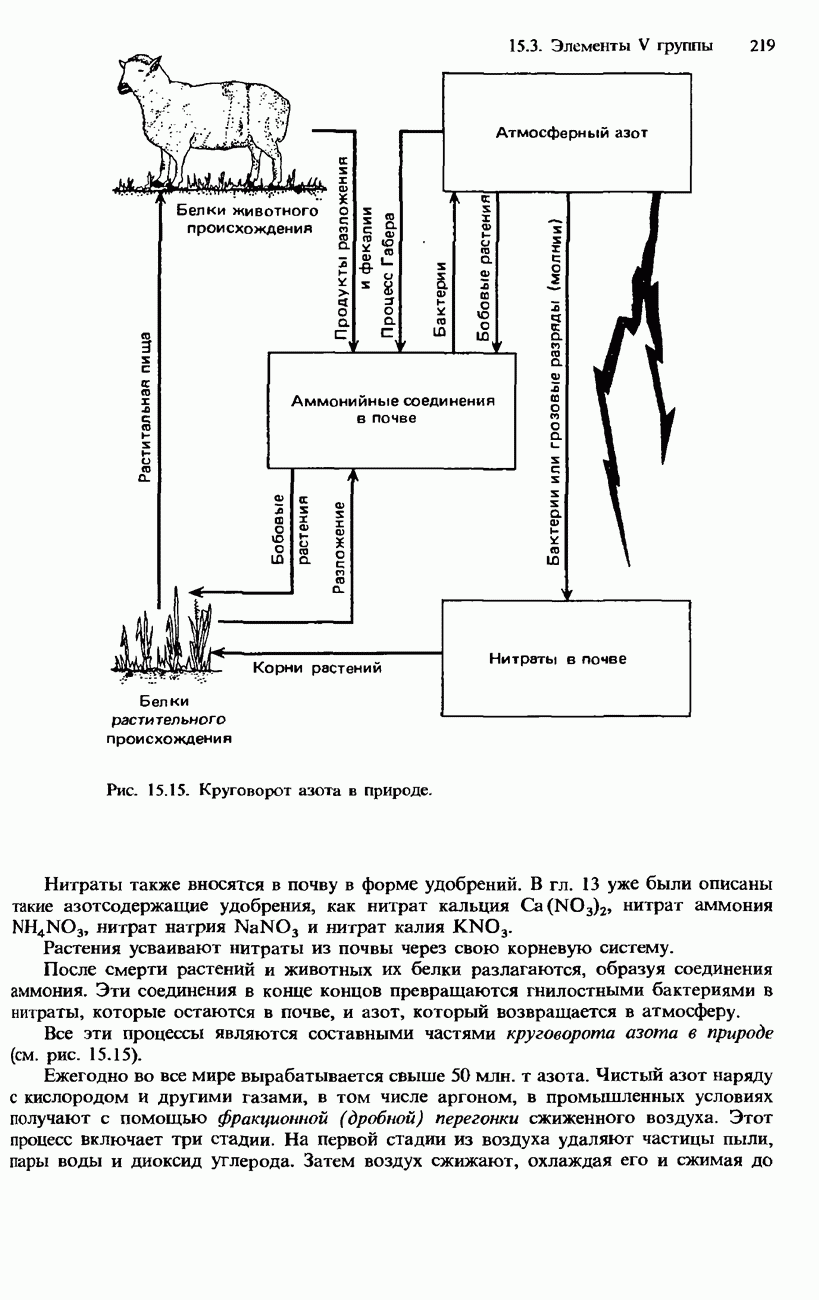
- 15.2. IV группа периодической системы
- СОЕДИНЕНИЯ
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ ИЗ РУД
- ПРИМЕНЕНИЯ УГЛЕРОДА
- ПРИМЕНЕНИЯ КРЕМНИЯ
- ПРИМЕНЕНИЯ ГЕРМАНИЯ, ОЛОВА И СВИНЦА
- 15.3. Элементы V группы
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЯ АЗОТА И ФОСФОРА
- СОЕДИНЕНИЯ АЗОТА
- СОЕДИНЕНИЯ ФОСФОРА
- 15.4. Элементы VI группы. Кислород и сера
- КИСЛОРОД
- СОЕДИНЕНИЯ КИСЛОРОДА
- СЕРА
- СОЕДИНЕНИЯ СЕРЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 16. ГАЛОГЕНЫ И БЛАГОРОДНЫЕ ГАЗЫ
- 16.1. Галогены
- ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ ГАЛОГЕНОВ
- ЛАБОРАТОРНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ ГАЛОГЕНОВ
- ФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА
- РЕАКЦИОННАЯ СПОСОБНОСТЬ ГАЛОГЕНОВ
- 16.2. Соединения галогенов
- ГАЛОГЕНОВОДОРОДЫ
- КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ГАЛОГЕНОВ
- 16.3. Распространенность, получение и применение галогенов и их соединений
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ХЛОРА
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ДРУГИХ ГАЛОГЕНОВ
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ СОЕДИНЕНИЙ ХЛОРА
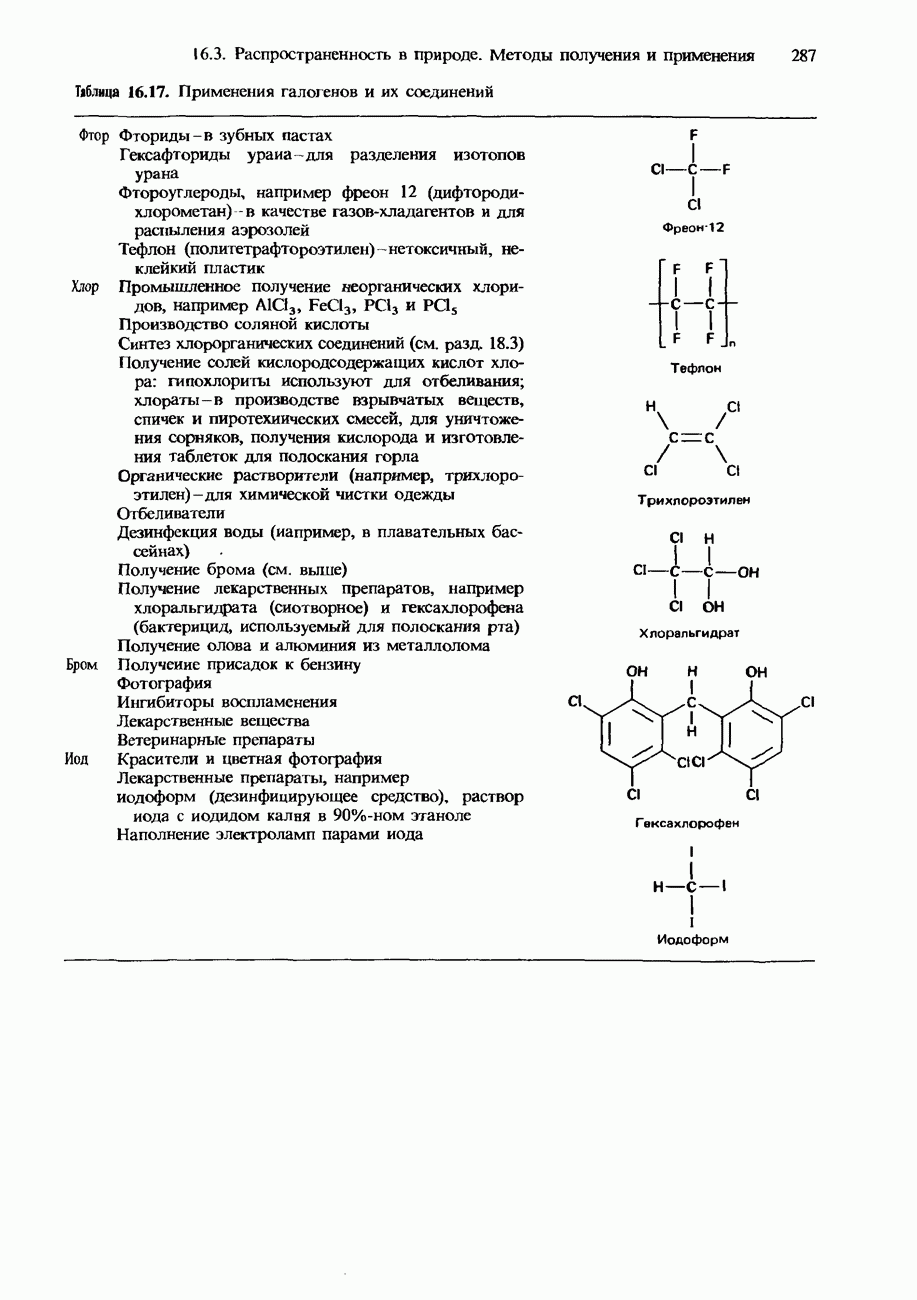
- ПРИМЕНЕНИЯ ГАЛОГЕНОВ И ИХ СОЕДИНЕНИЙ
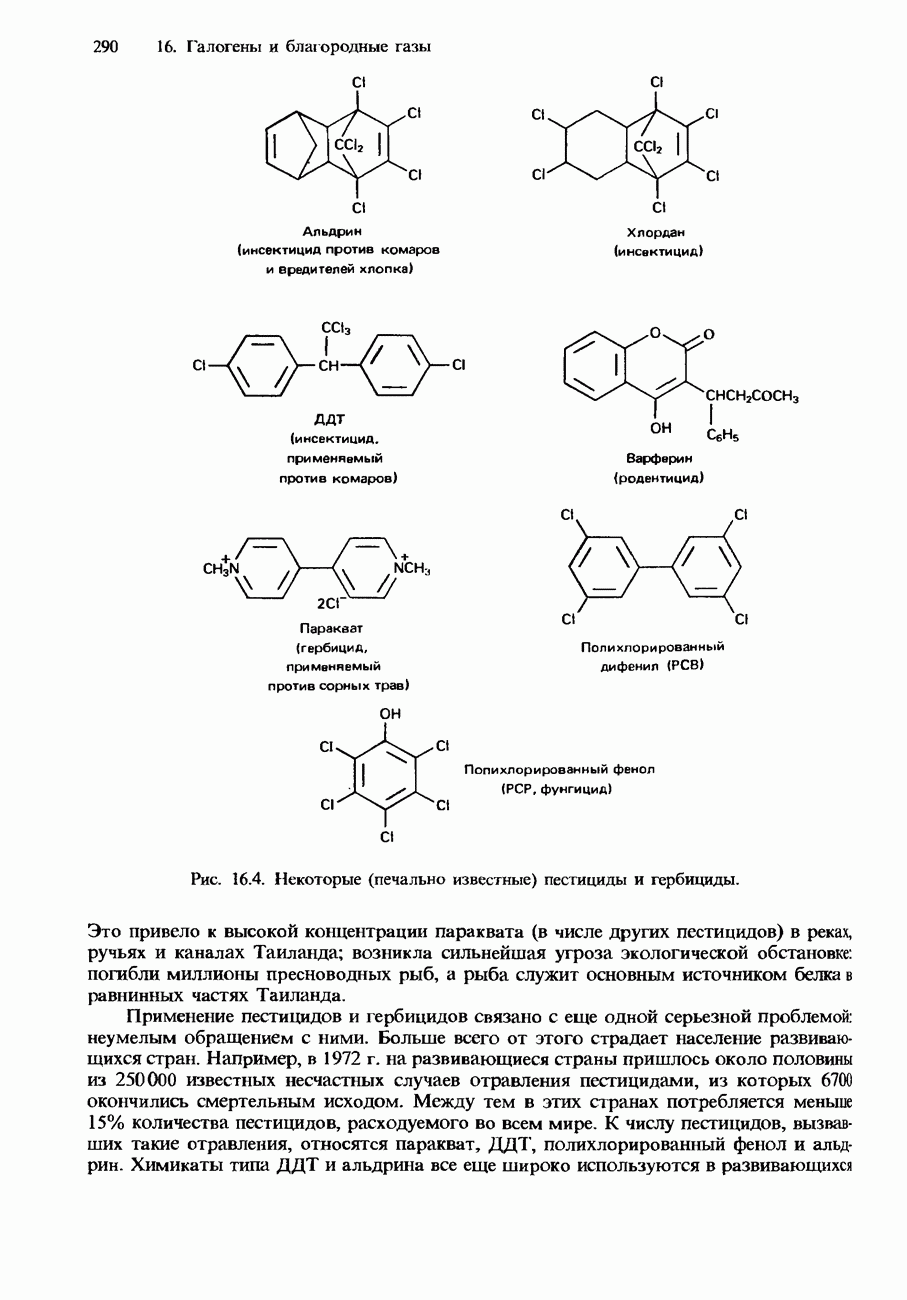
- ТОКСИЧНОСТЬ ХЛОРСОДЕРЖАЩИХ ПРОДУКТОВ
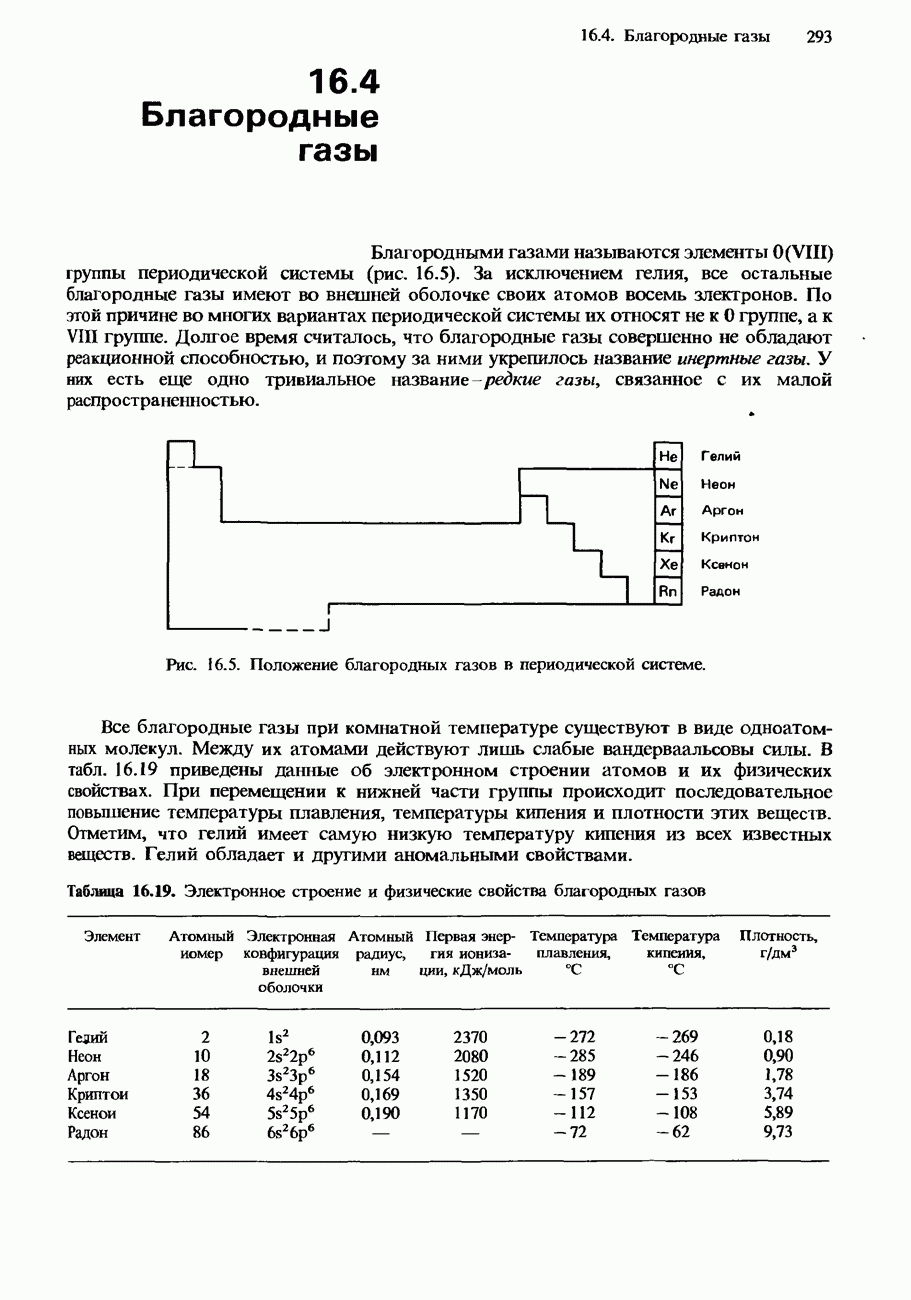
- 16.4. Благородные газы
- СОЕДИНЕНИЯ БЛАГОРОДНЫХ ГАЗОВ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 17. ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
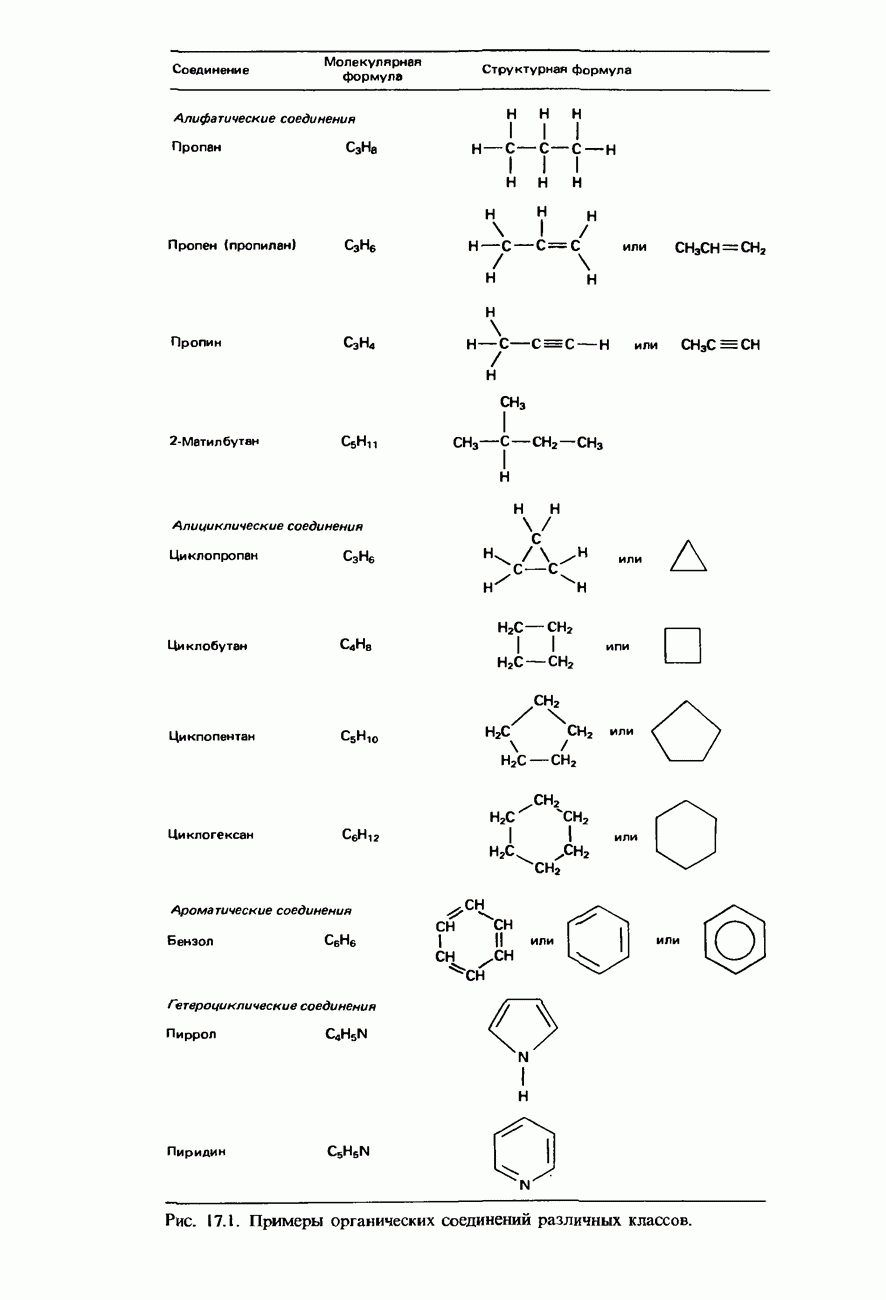
- 7.1. Органическая химия
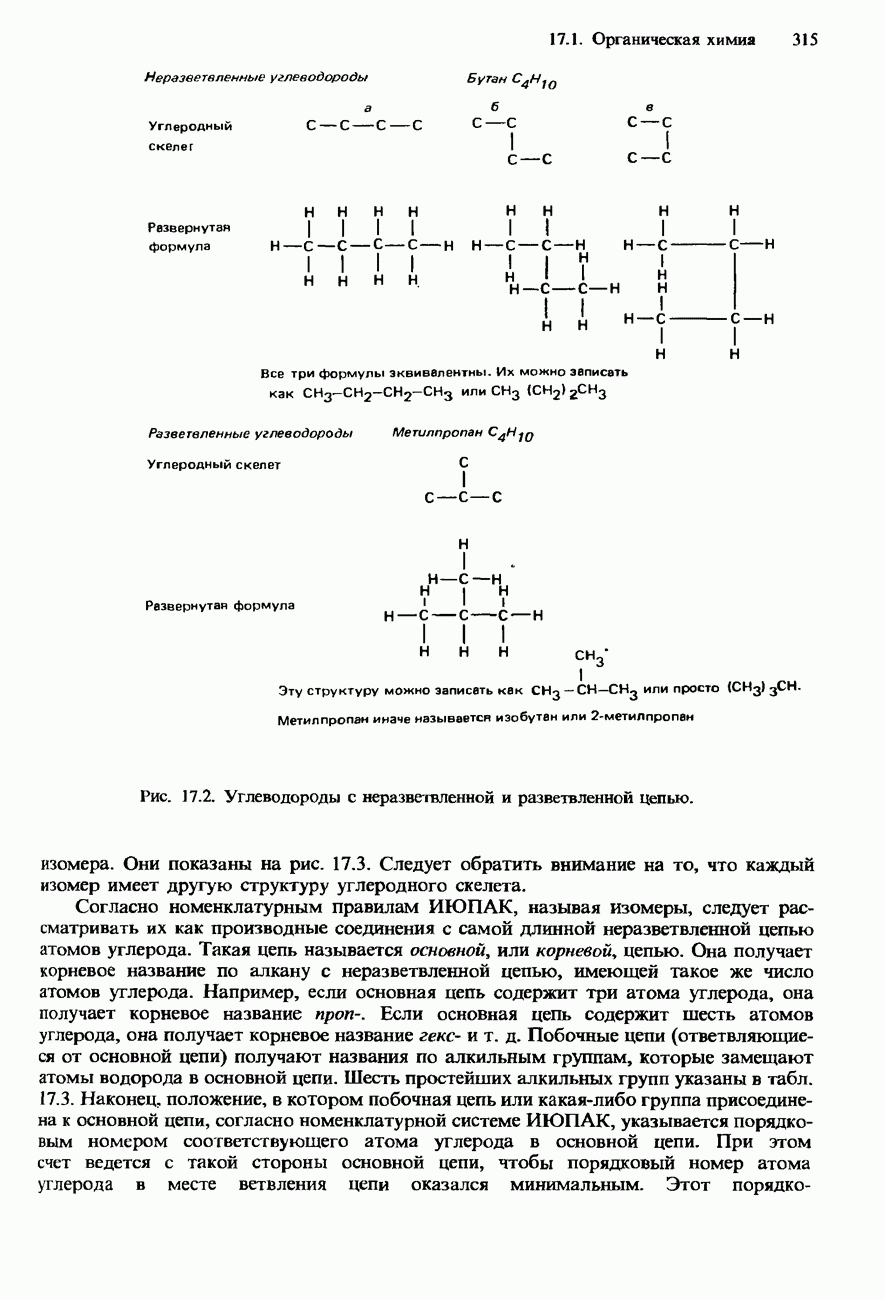
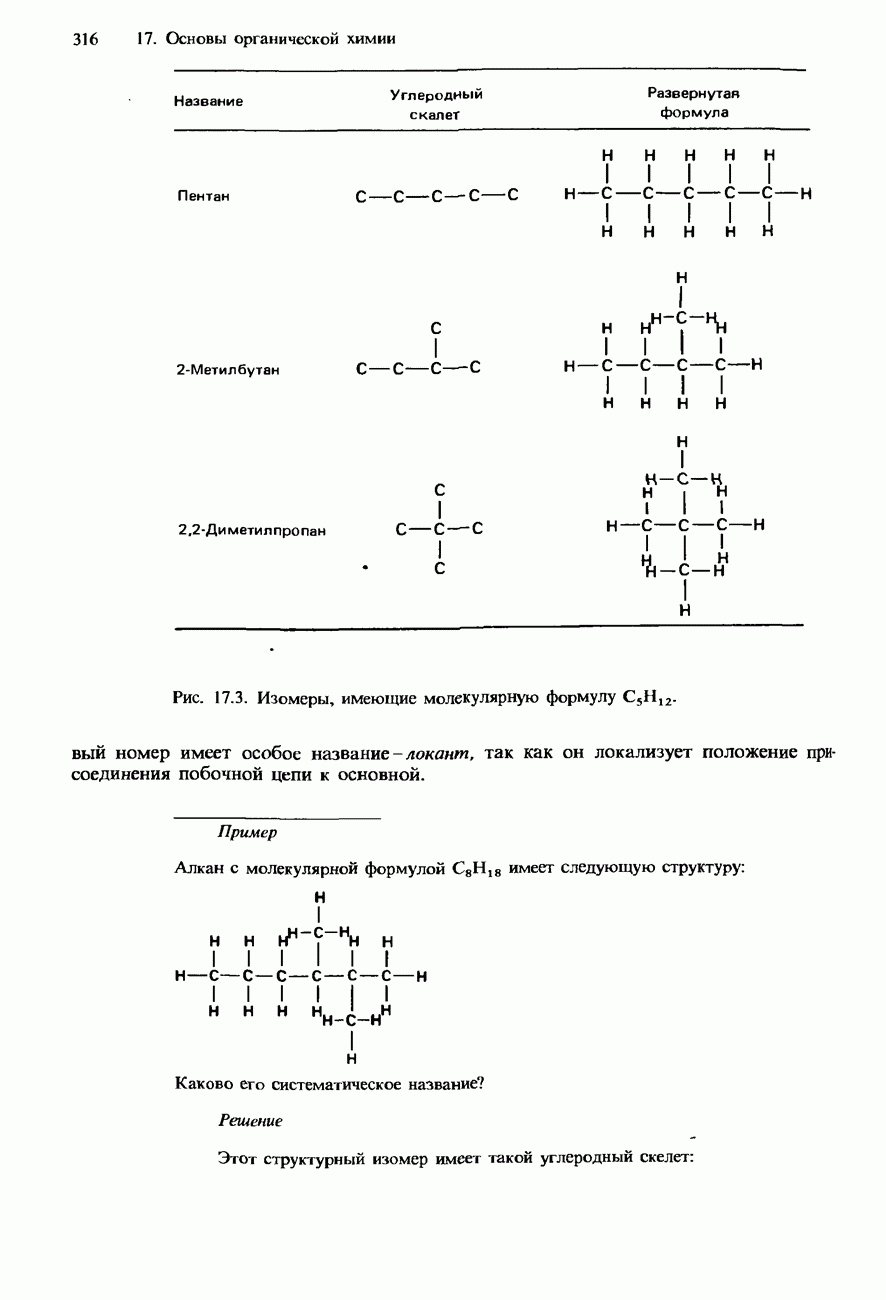
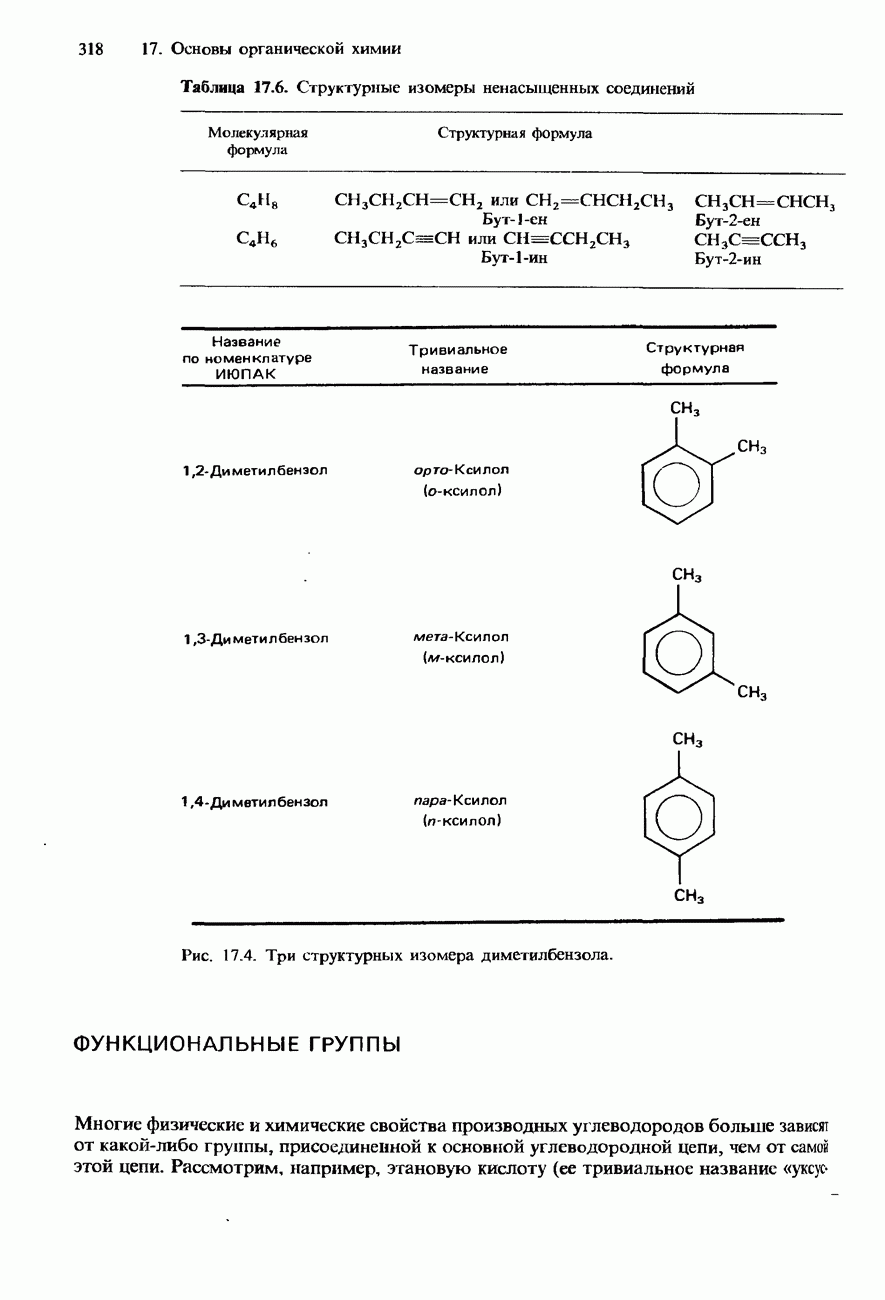
- НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- УГЛЕВОДОРОДЫ
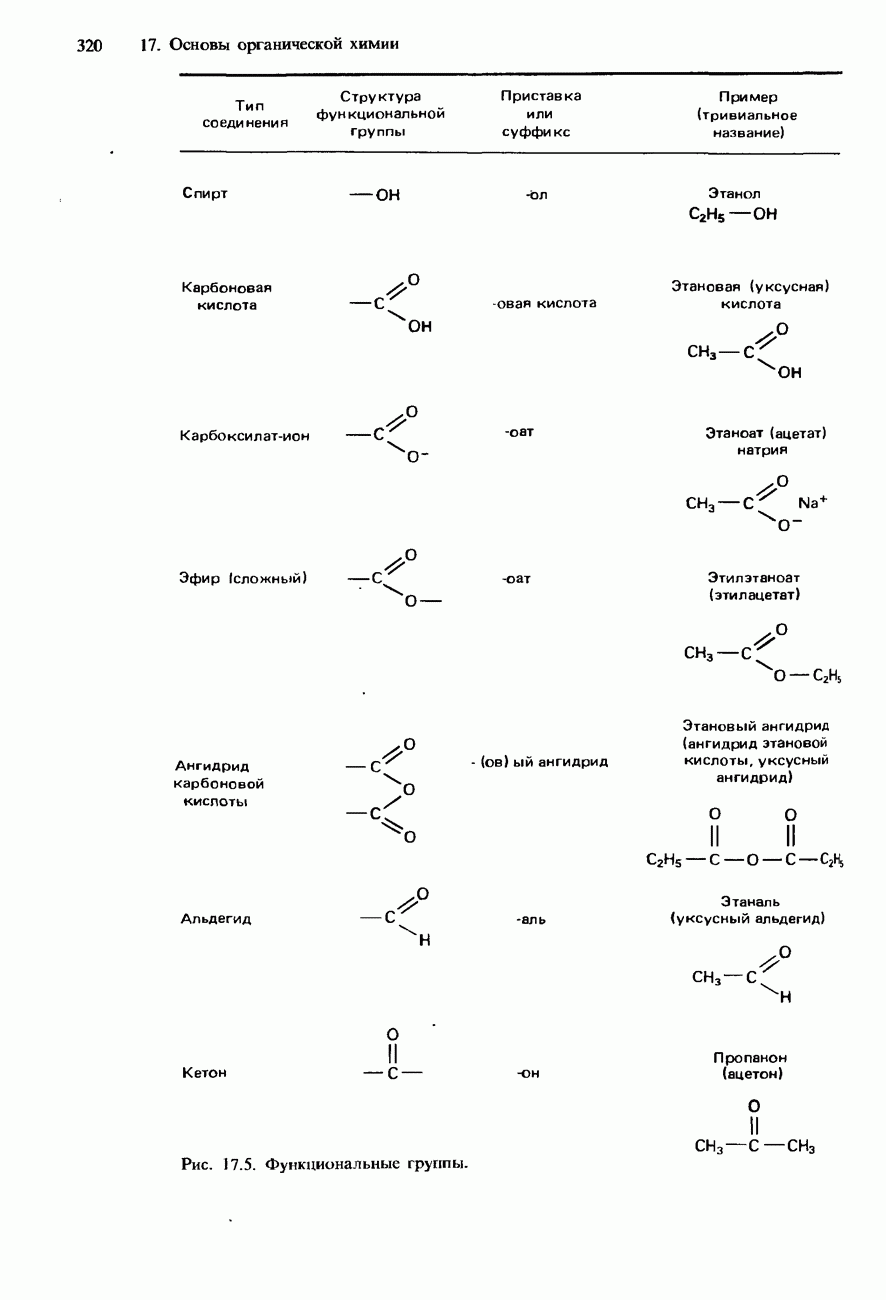
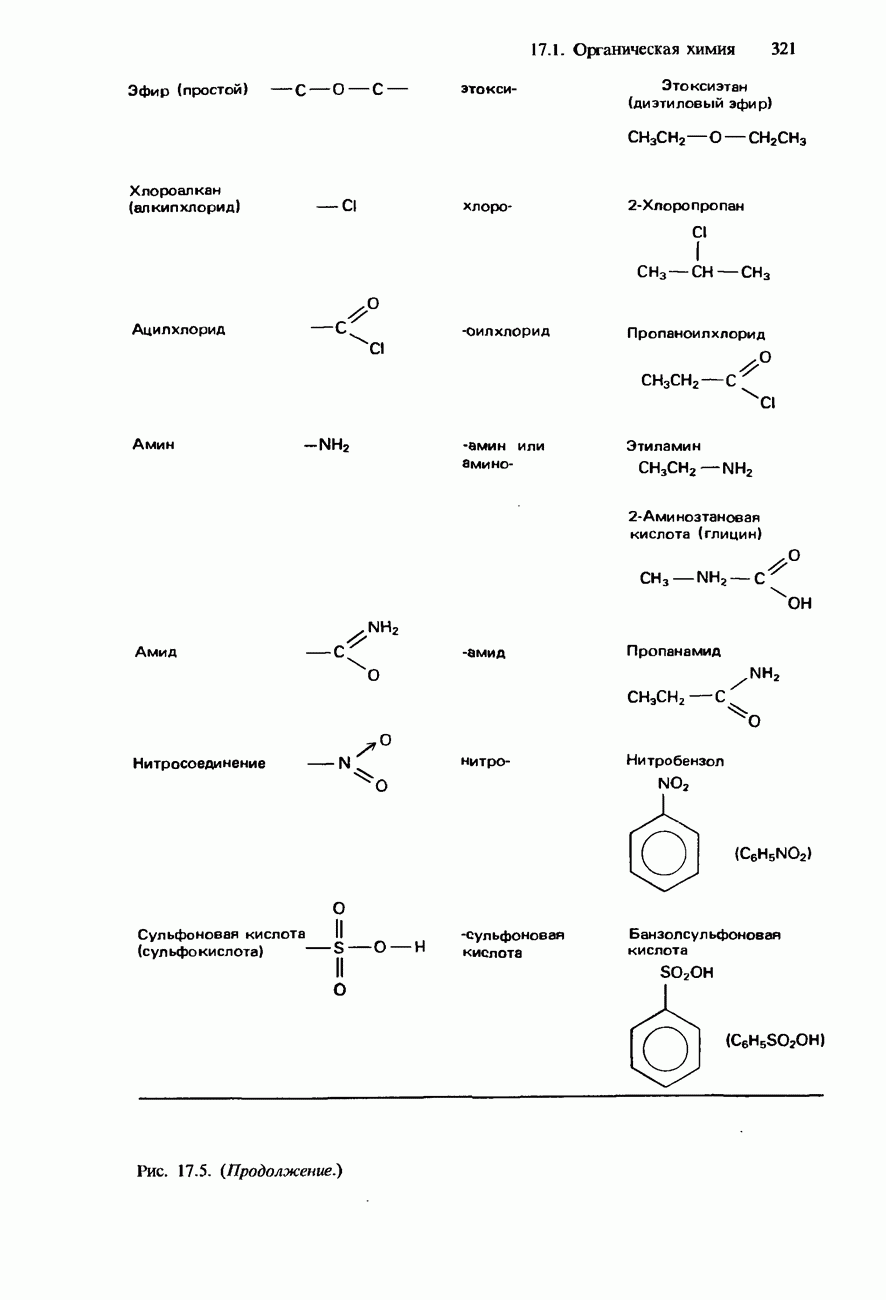
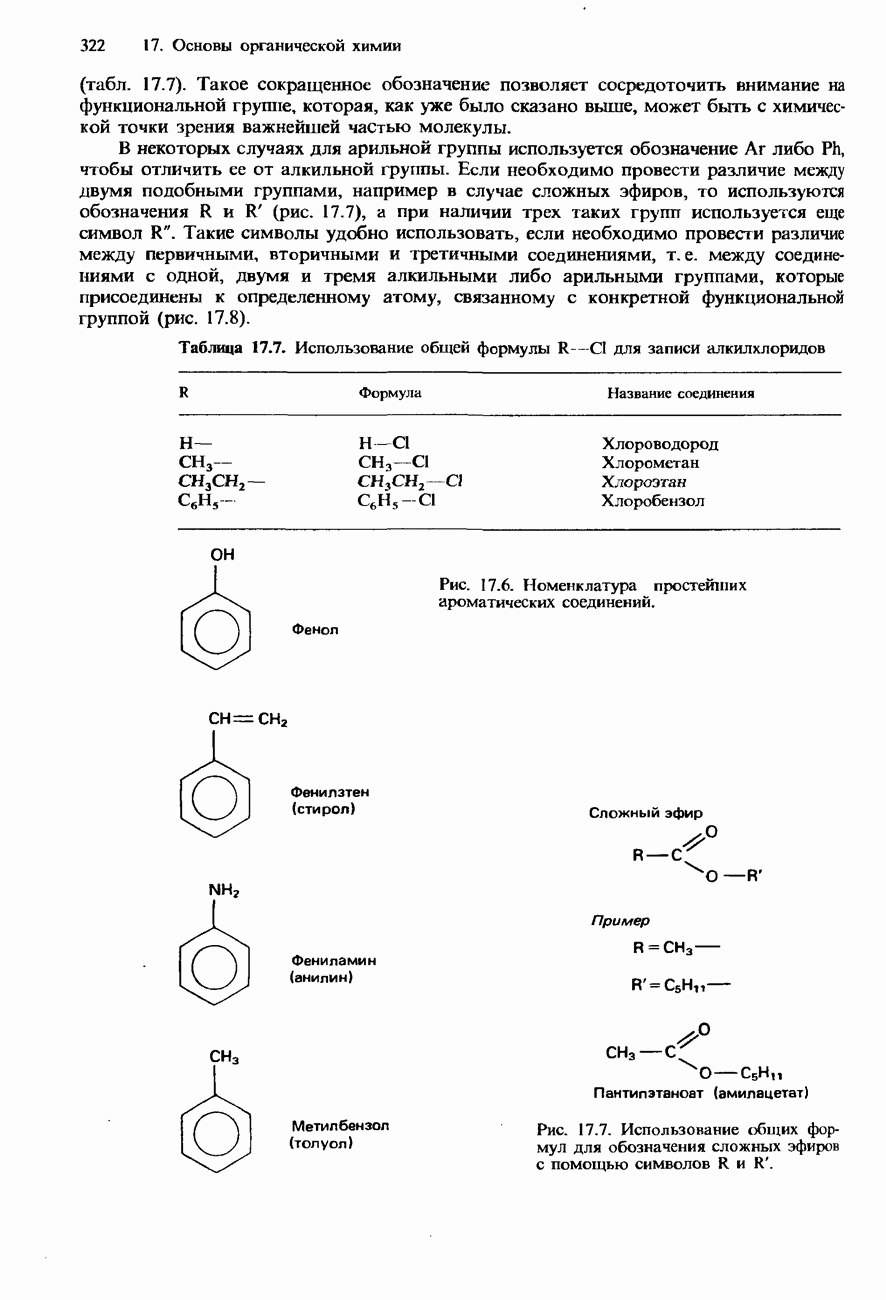
- ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
- ФИЗИЧЕСКИЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- ПОЛУЧЕНИЕ И ИДЕНТИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
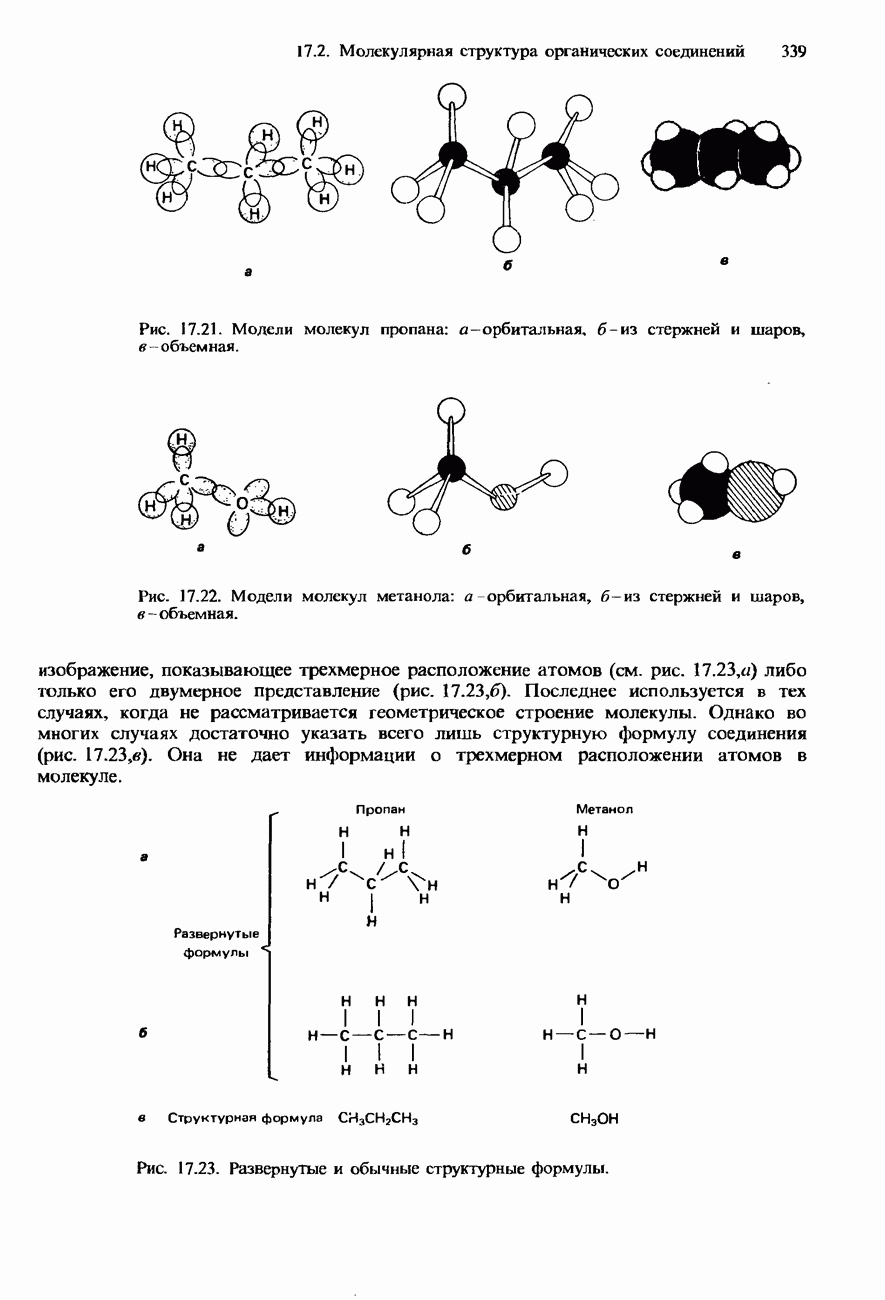
- 17.2. Молекулярная структура органических соединений
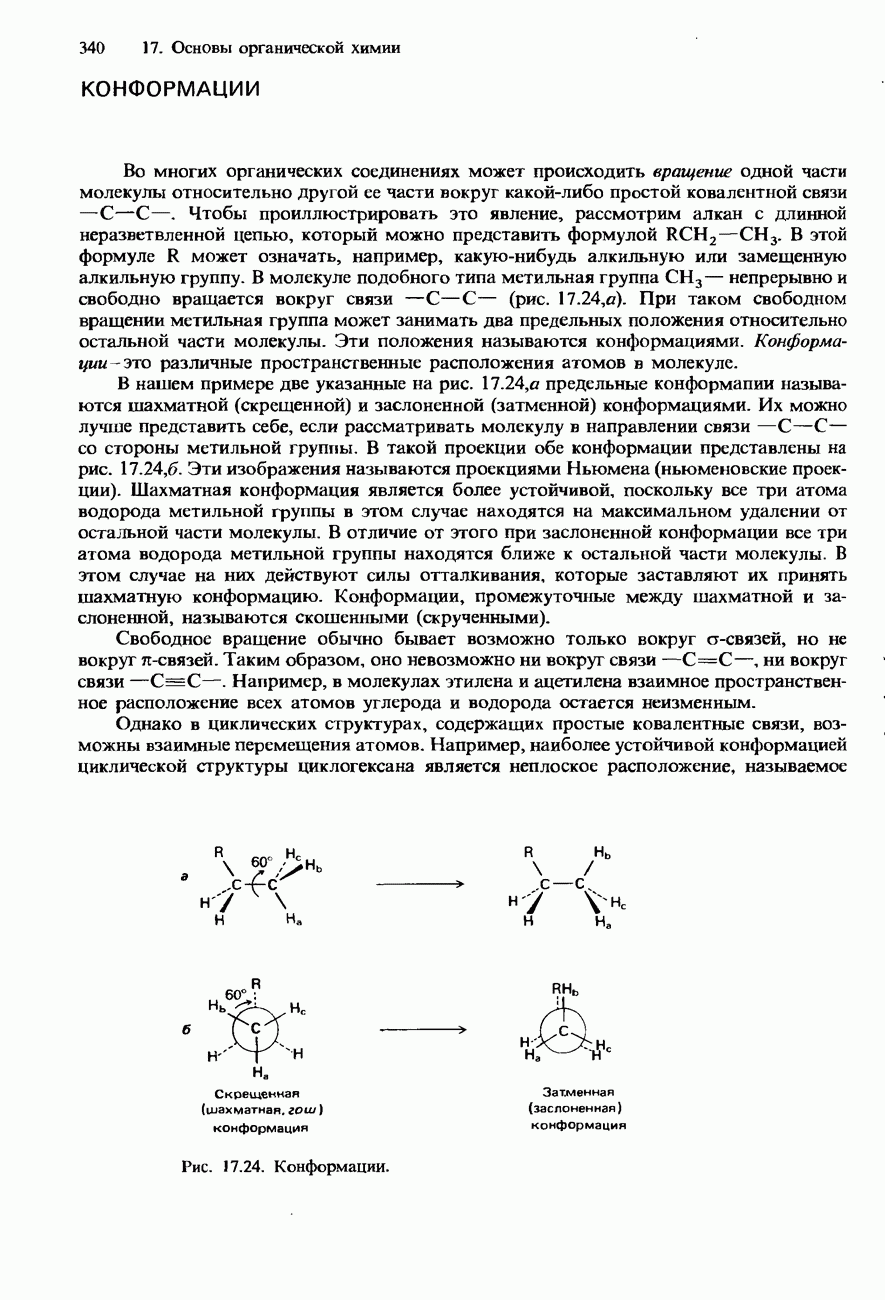
- КОНФОРМАЦИИ
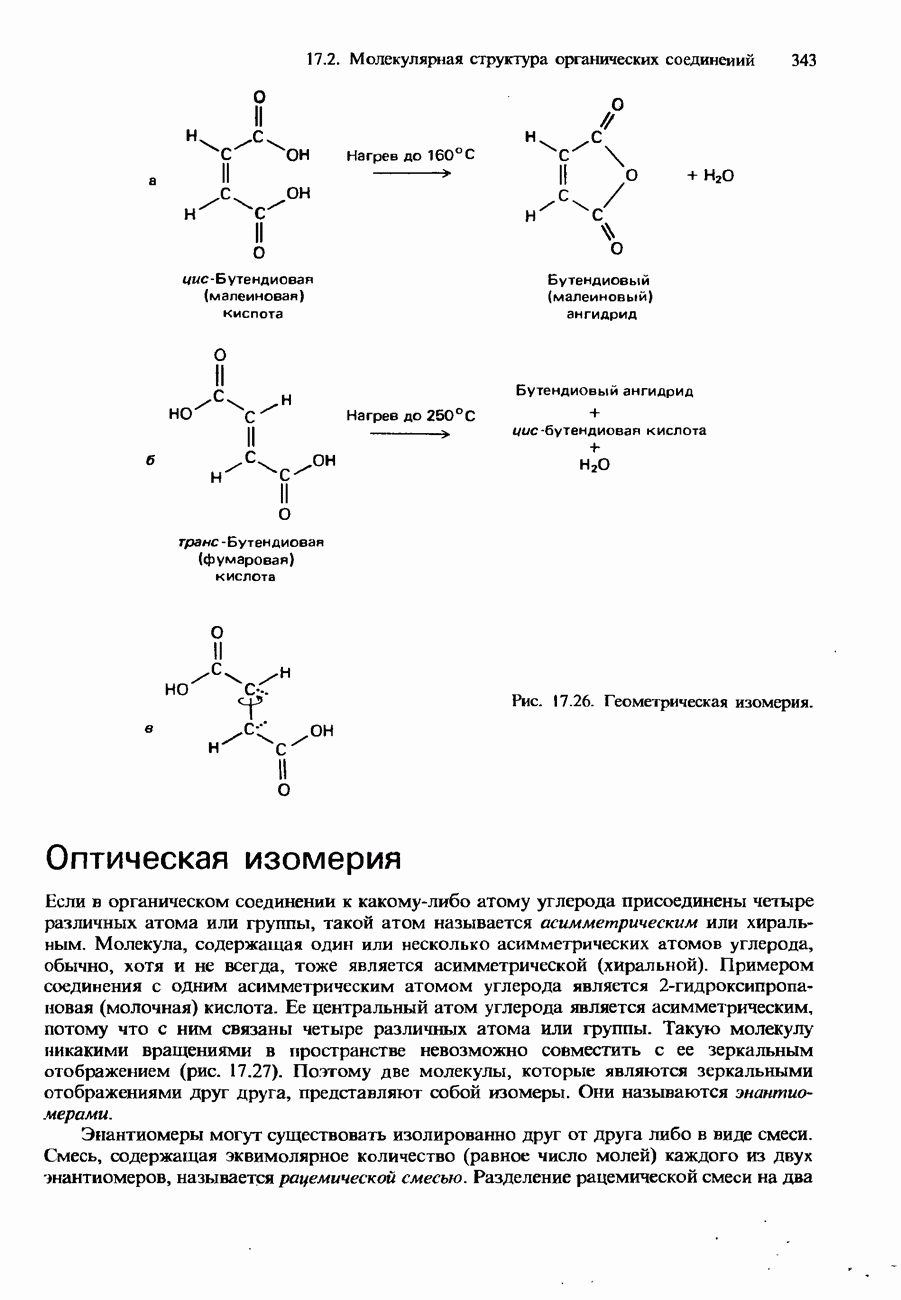
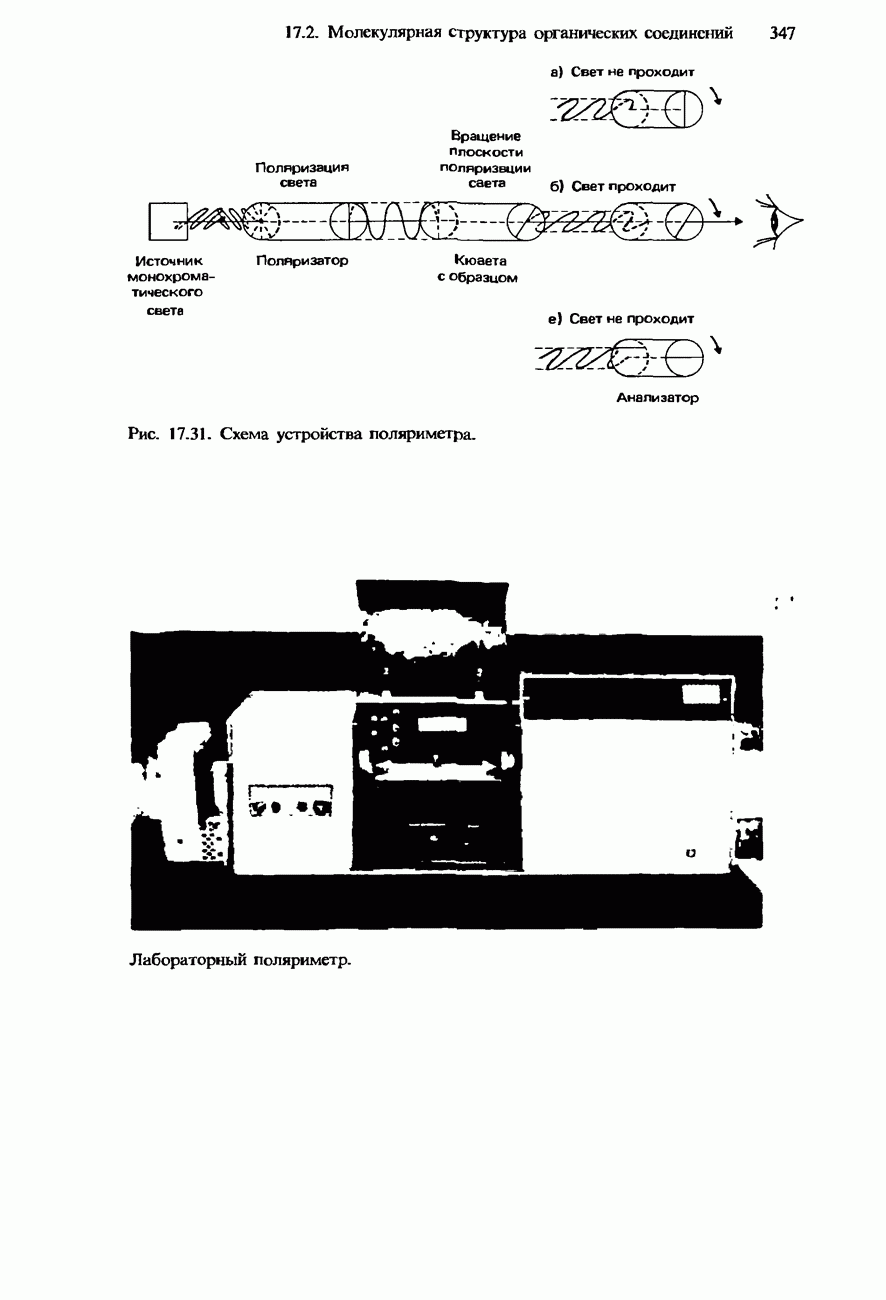
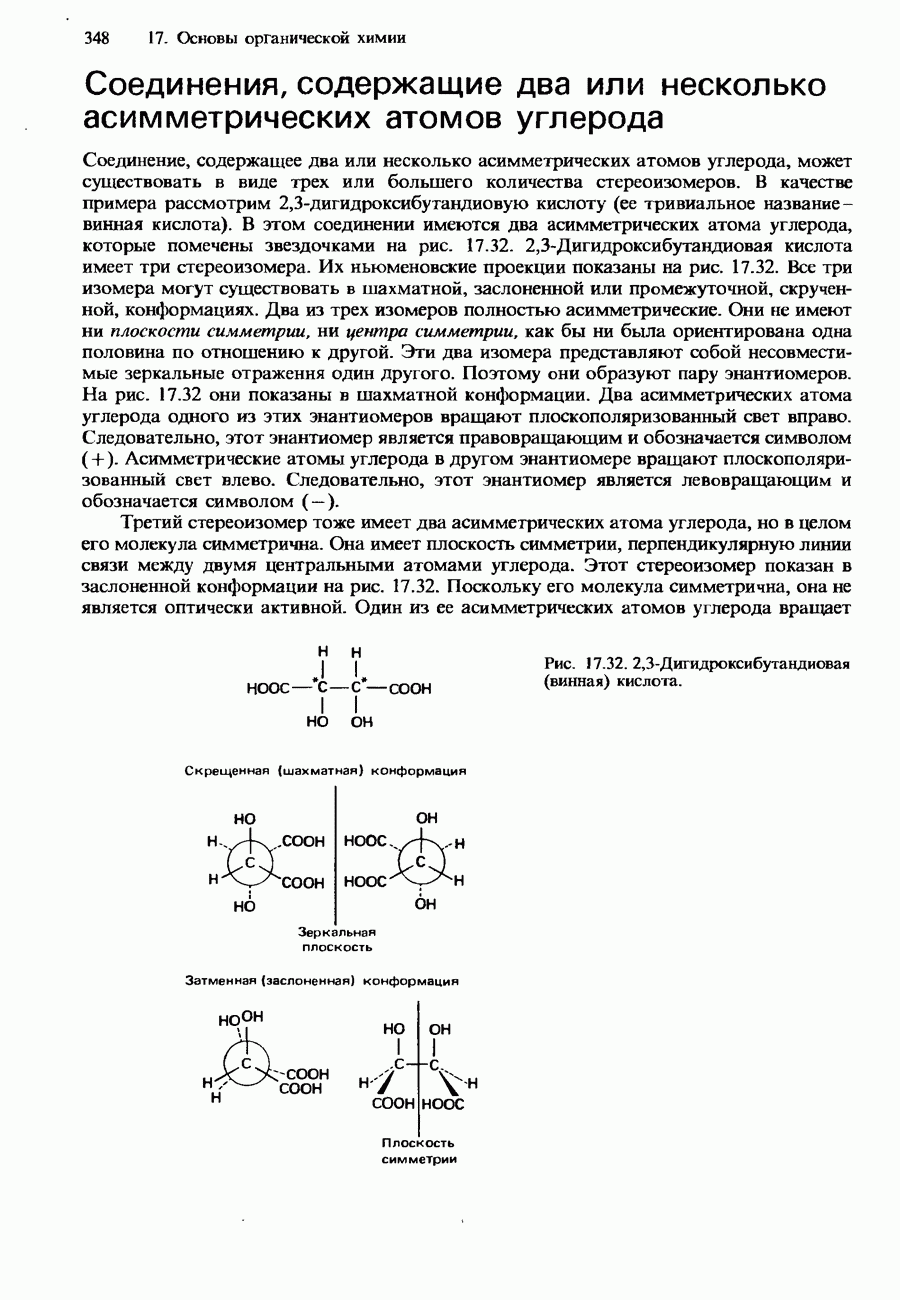
- СТЕРЕОИЗОМЕРИЯ
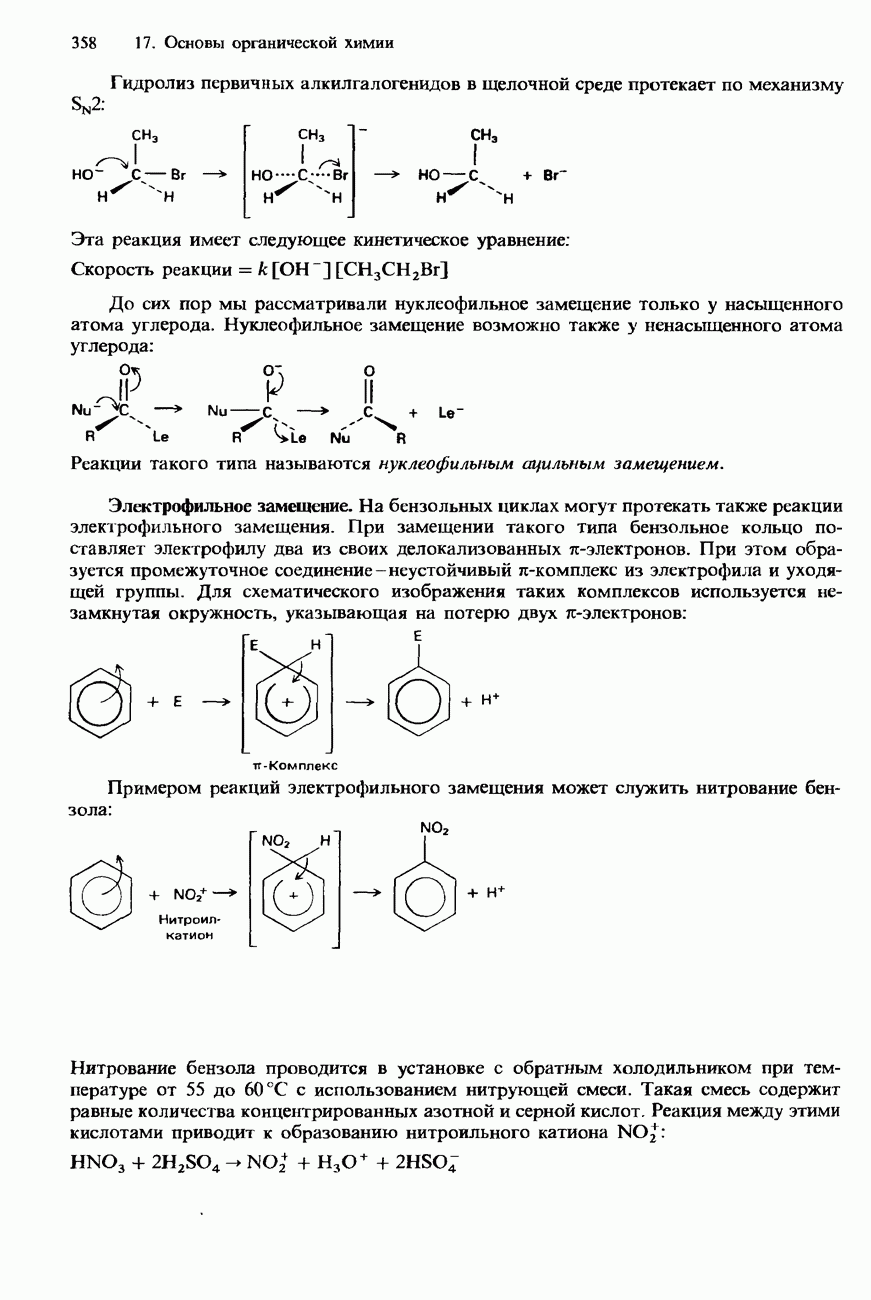
- 17.3. Механизмы органических реакций
- ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- НУКЛЕОФИЛЫ И ЭЛЕКТРОФИЛЫ
- ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 18. УГЛЕВОДОРОДЫ
- 18.1. Алифатические углеводороды
- АЛКАНЫ
- АЛКЕНЫ
- АЛКИНЫ
- 18.2. Арены
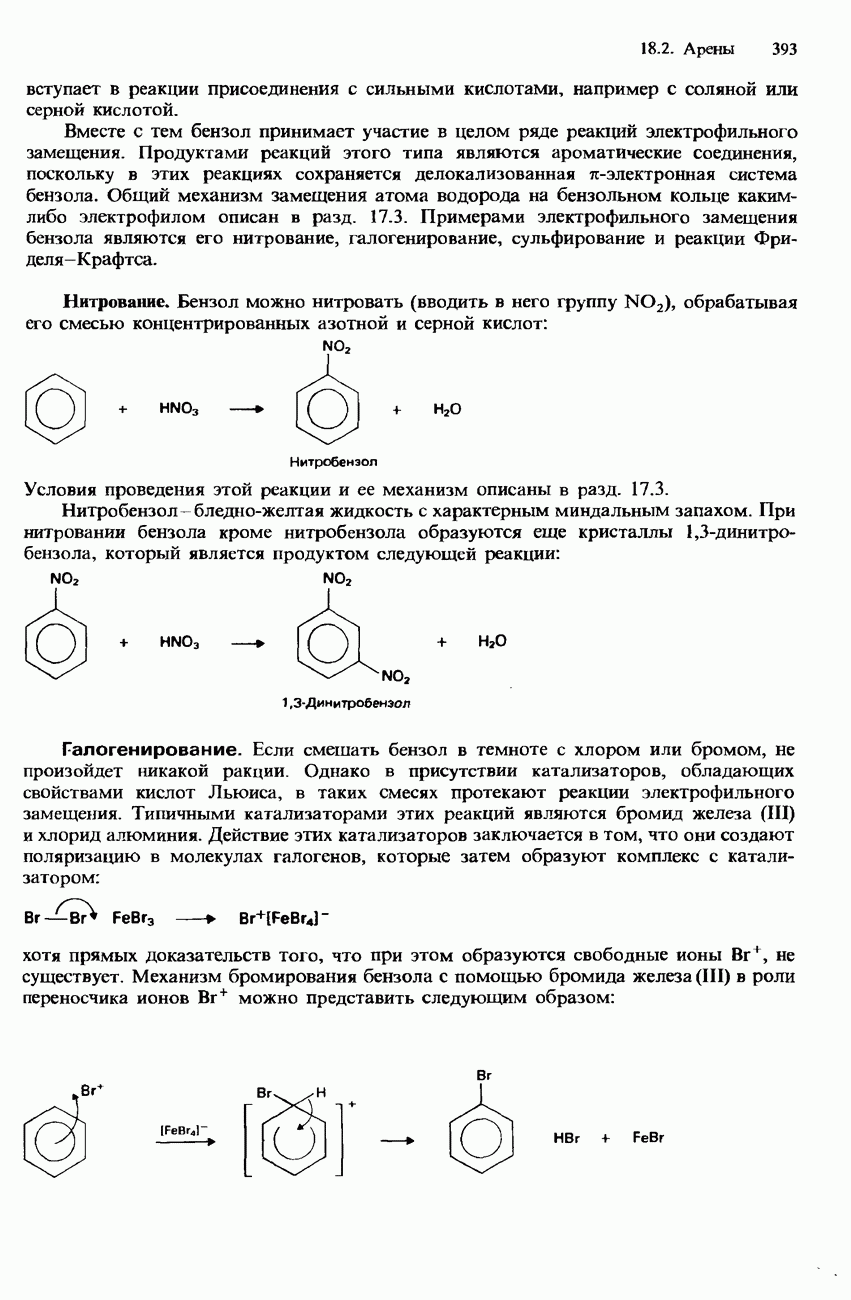
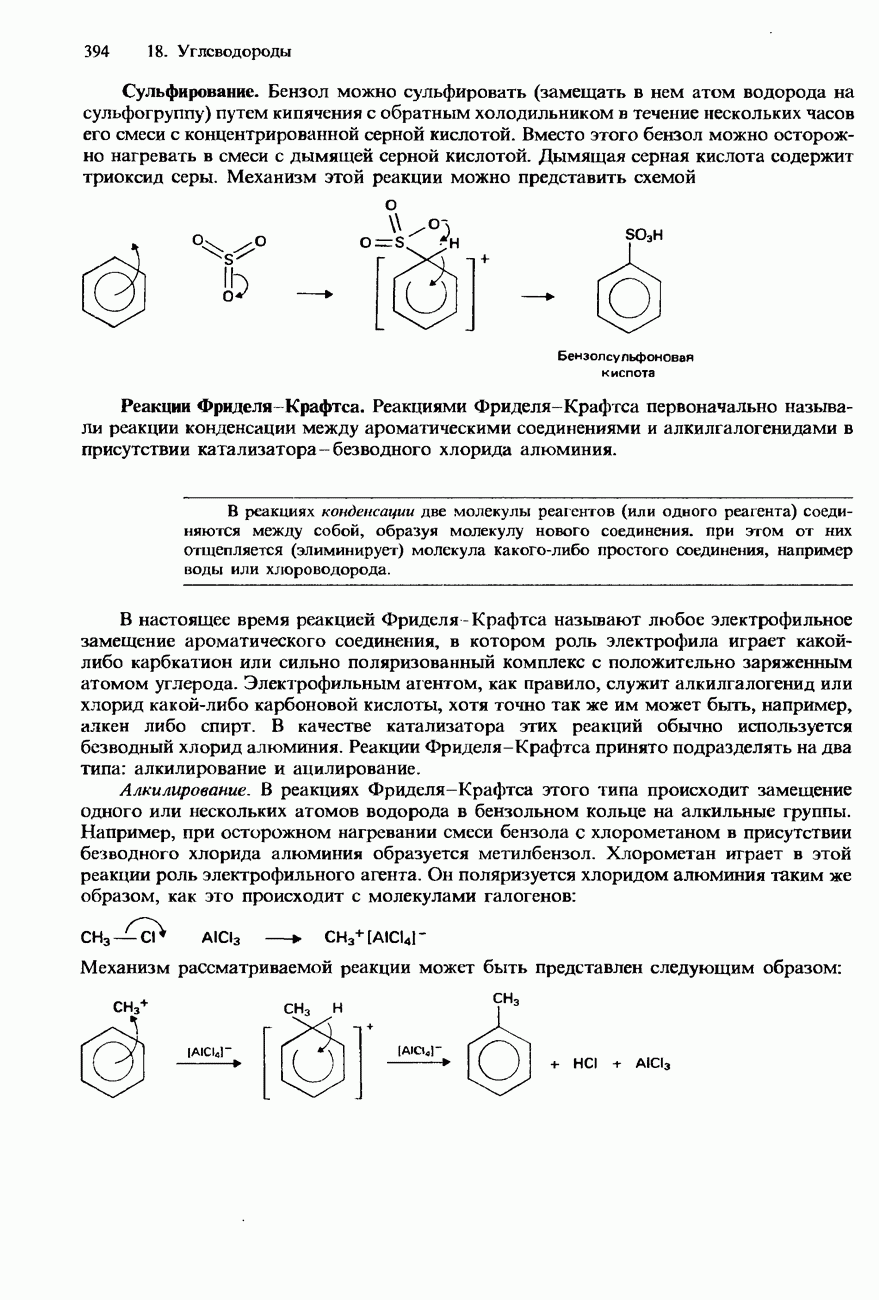
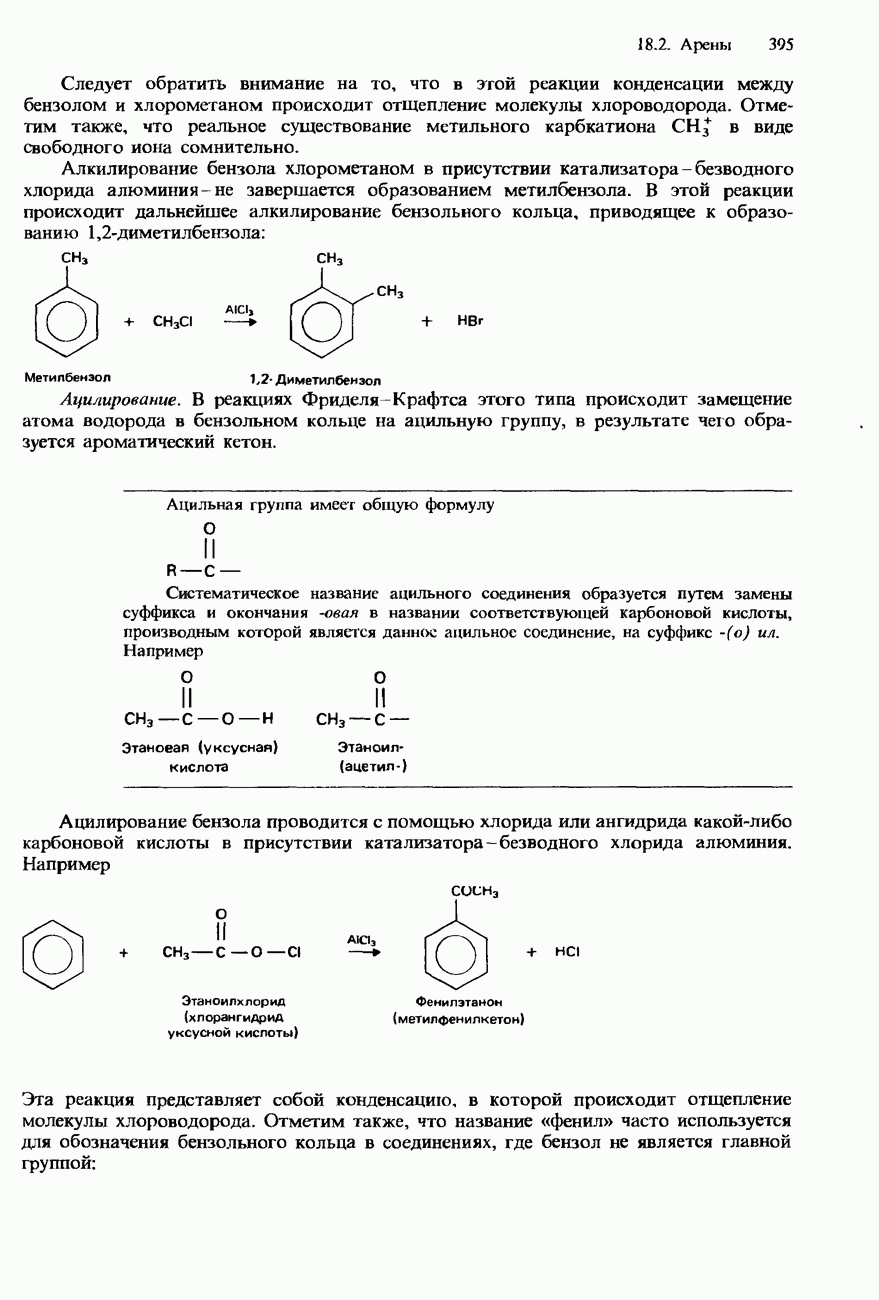
- БЕНЗОЛ
- МЕТИЛБЕНЗОЛ
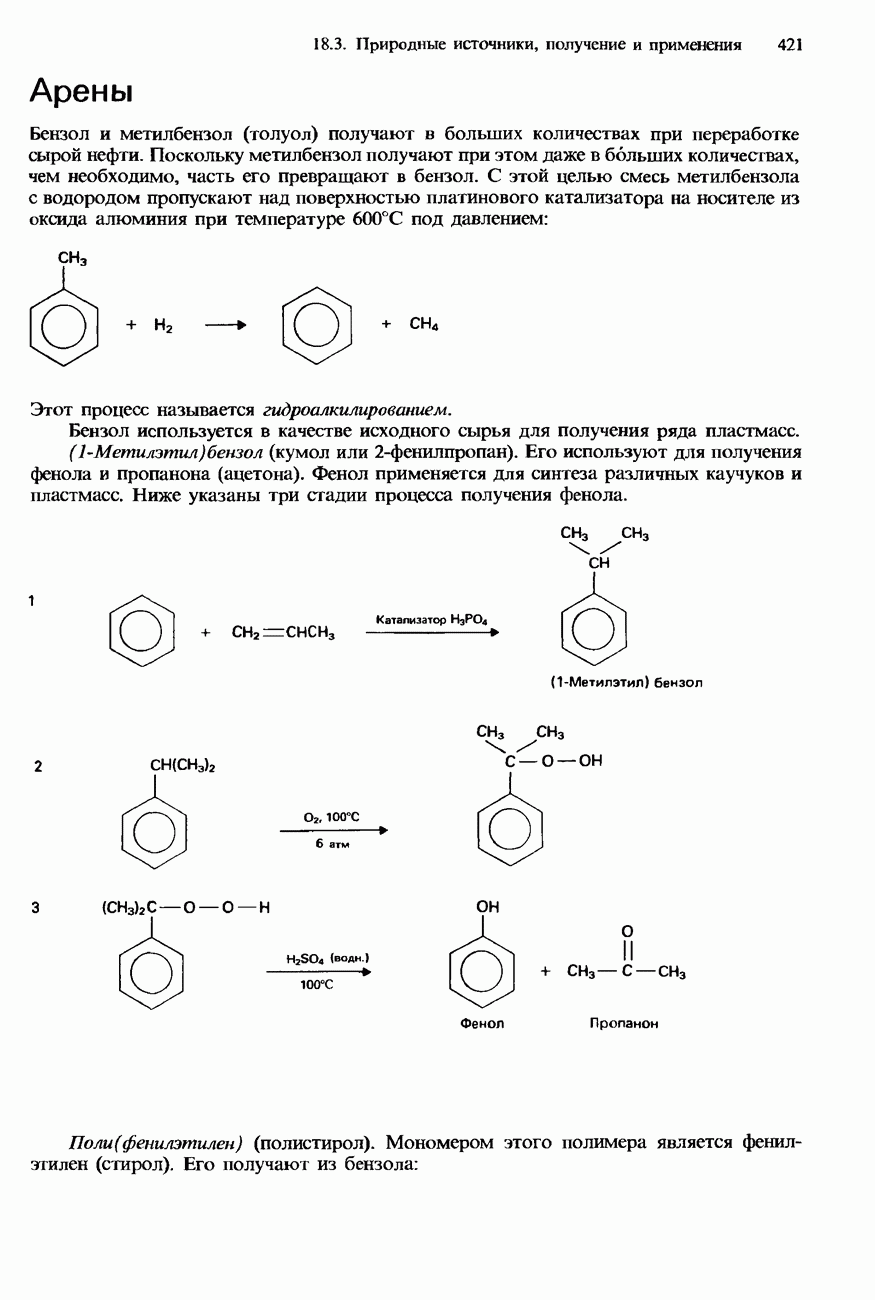
- 18.3. Природные источники, получение и применения
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ УГЛЕВОДОРОДОВ
- ПЕРЕРАБОТКА НЕФТИ
- ПРИМЕНЕНИЯ УГЛЕВОДОРОДОВ
- ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ НЕФТЬЮ И ПРОДУКТАМИ ЕЕ СГОРАНИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 19. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
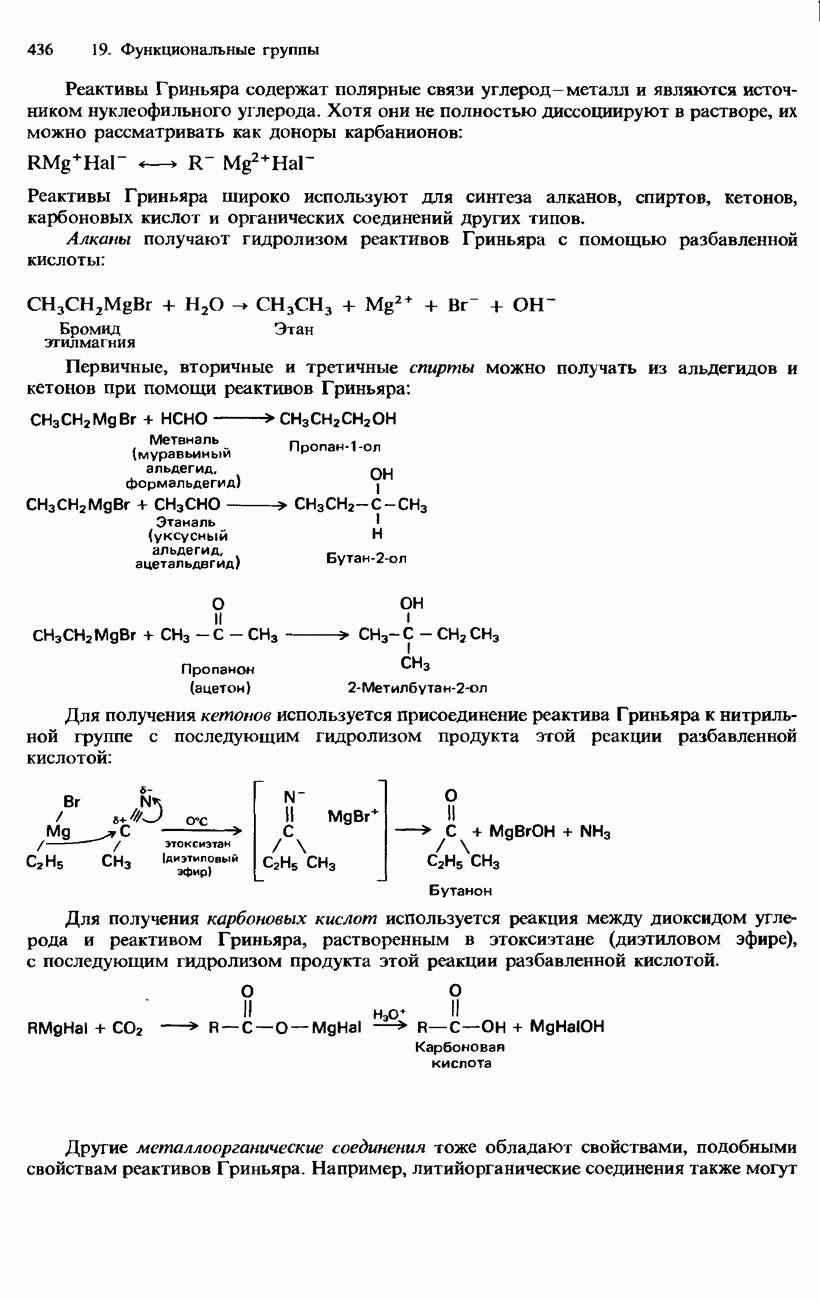
- 19.1. Органические галогенсодержащие соединения
- ГАЛОГЕНОАЛКЕНЫ
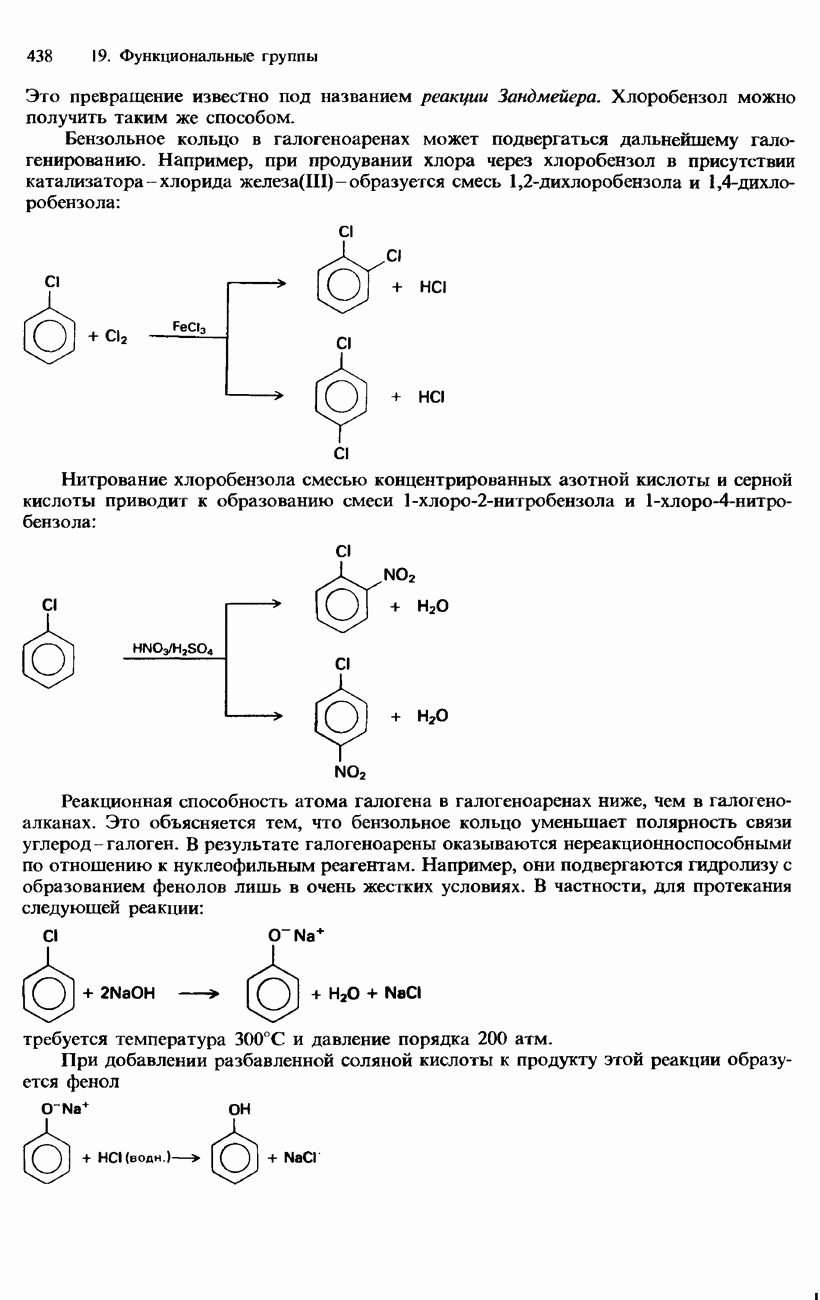
- ГАЛОГЕНОАРЕНЫ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ОРГАНИЧЕСКИХ ГАЛОГЕНСОДЕРЖАЩИХ СОЕДИНЕНИЙ
- 19.2. Спирты, фенолы и эфиры
- ФЕНОЛЫ
- ПРОСТЫЕ ЭФИРЫ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ СПИРТОВ, ФЕНОЛОВ И ПРОСТЫХ ЭФИРОВ
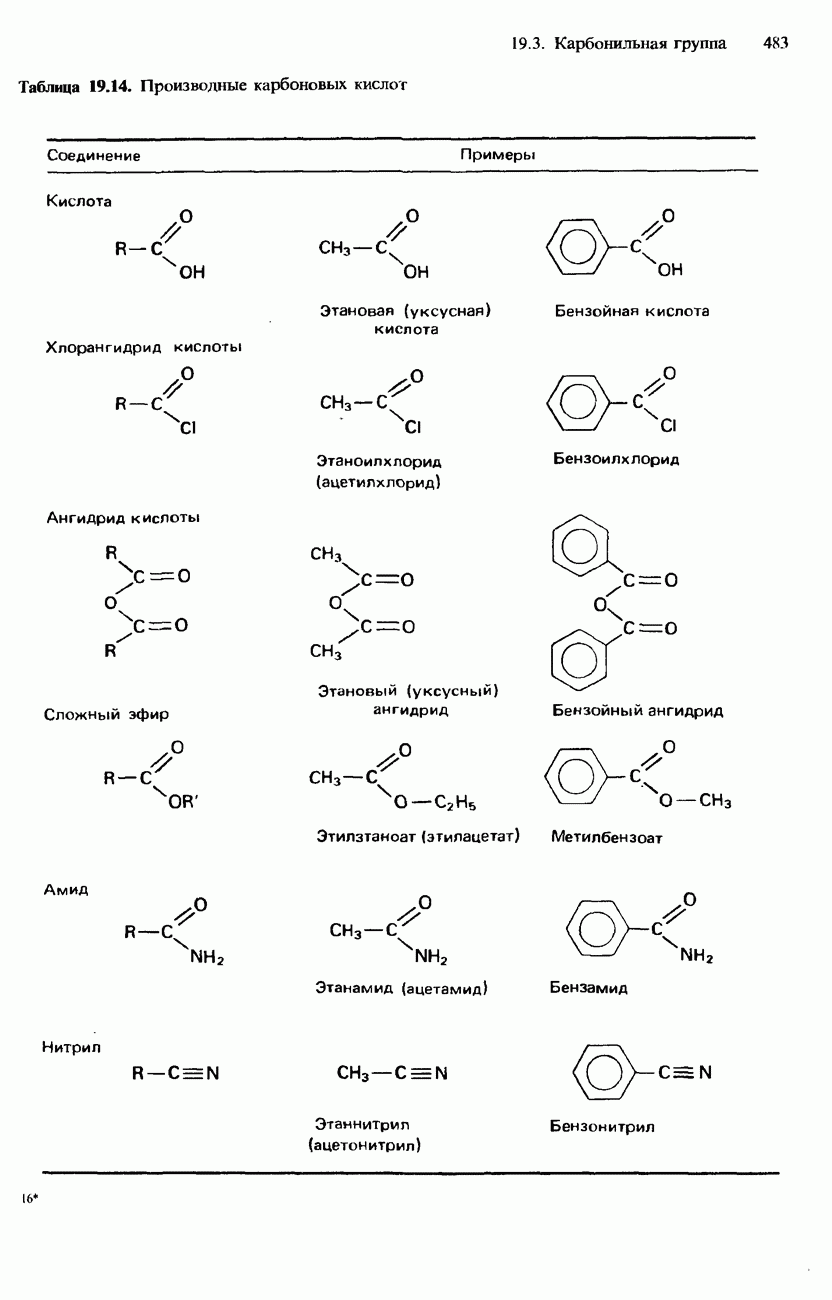
- 19.3. Карбонильная группа
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
- КАРБОНОВЫЕ КИСЛОТЫ
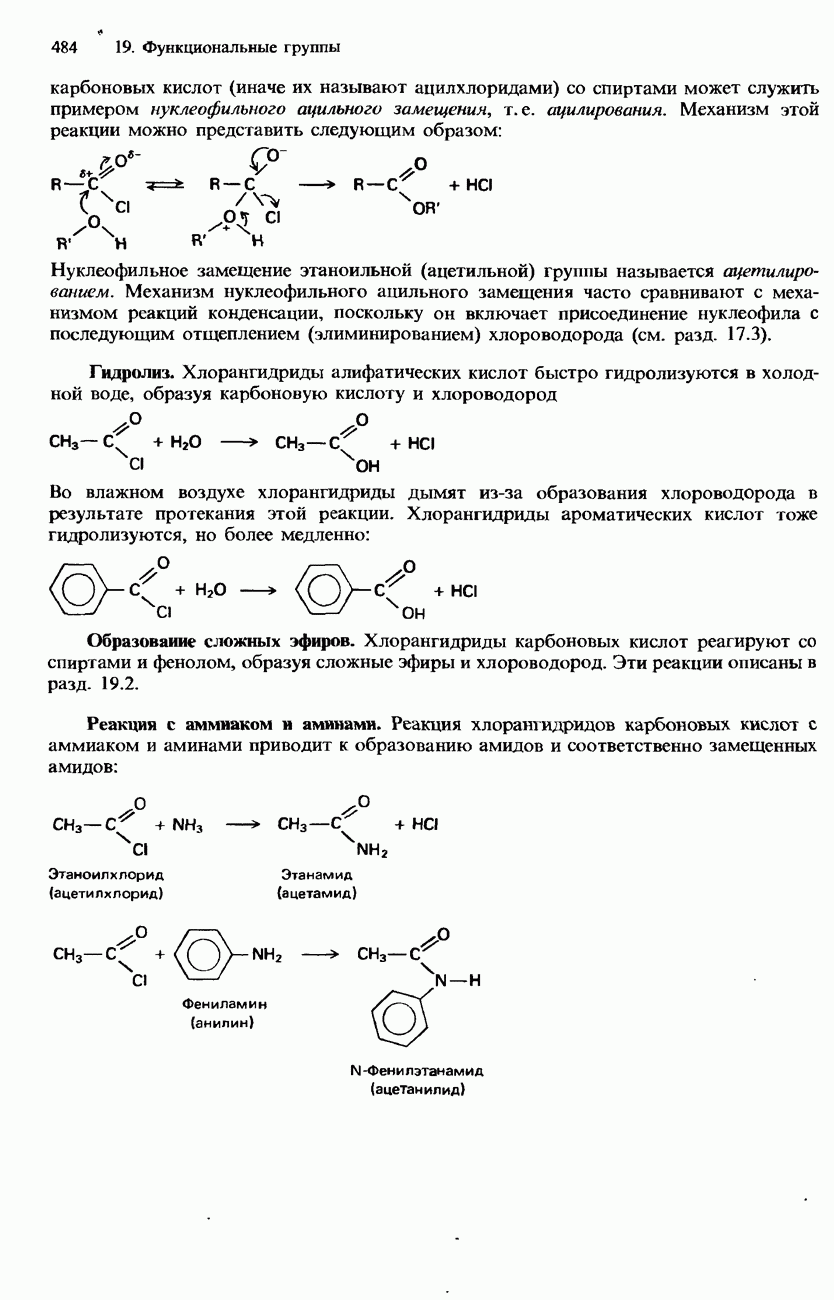
- ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ
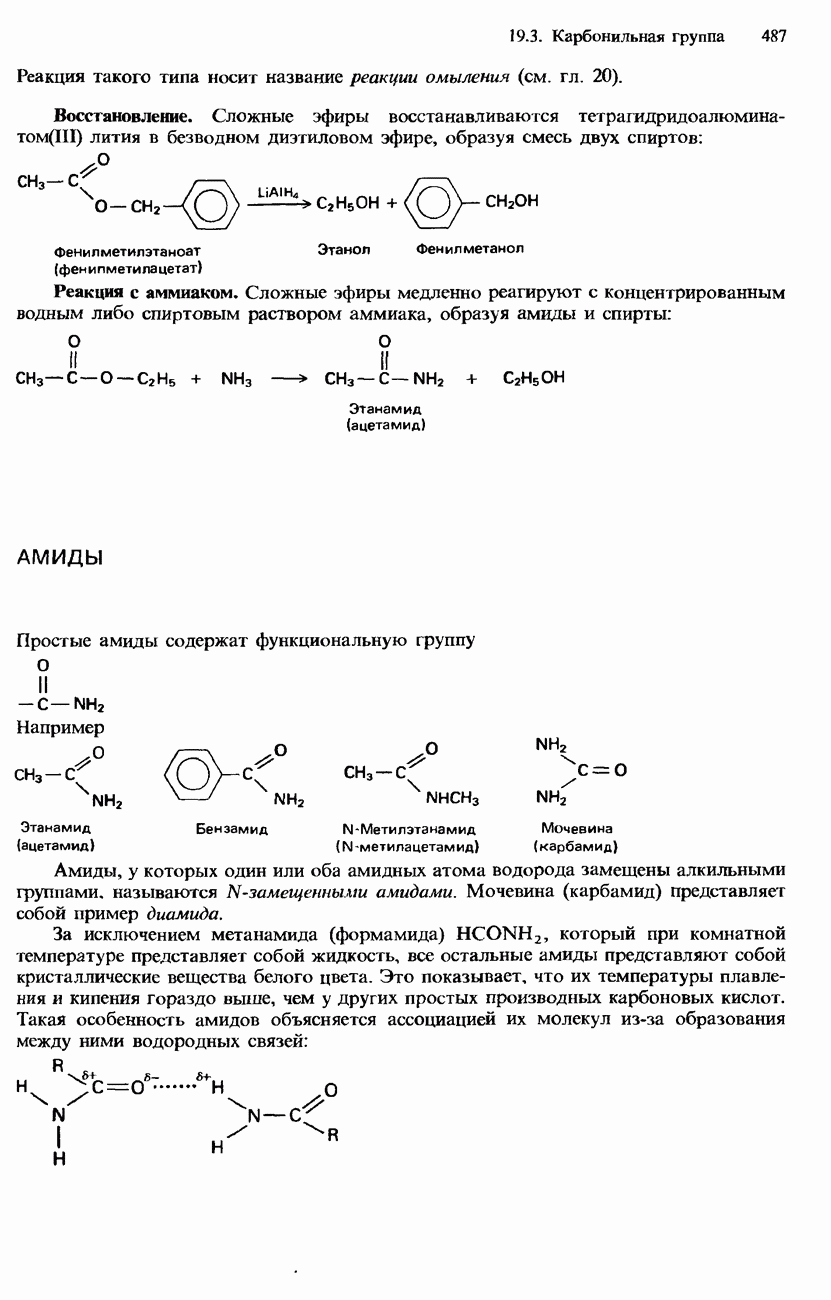
- АМИДЫ
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ
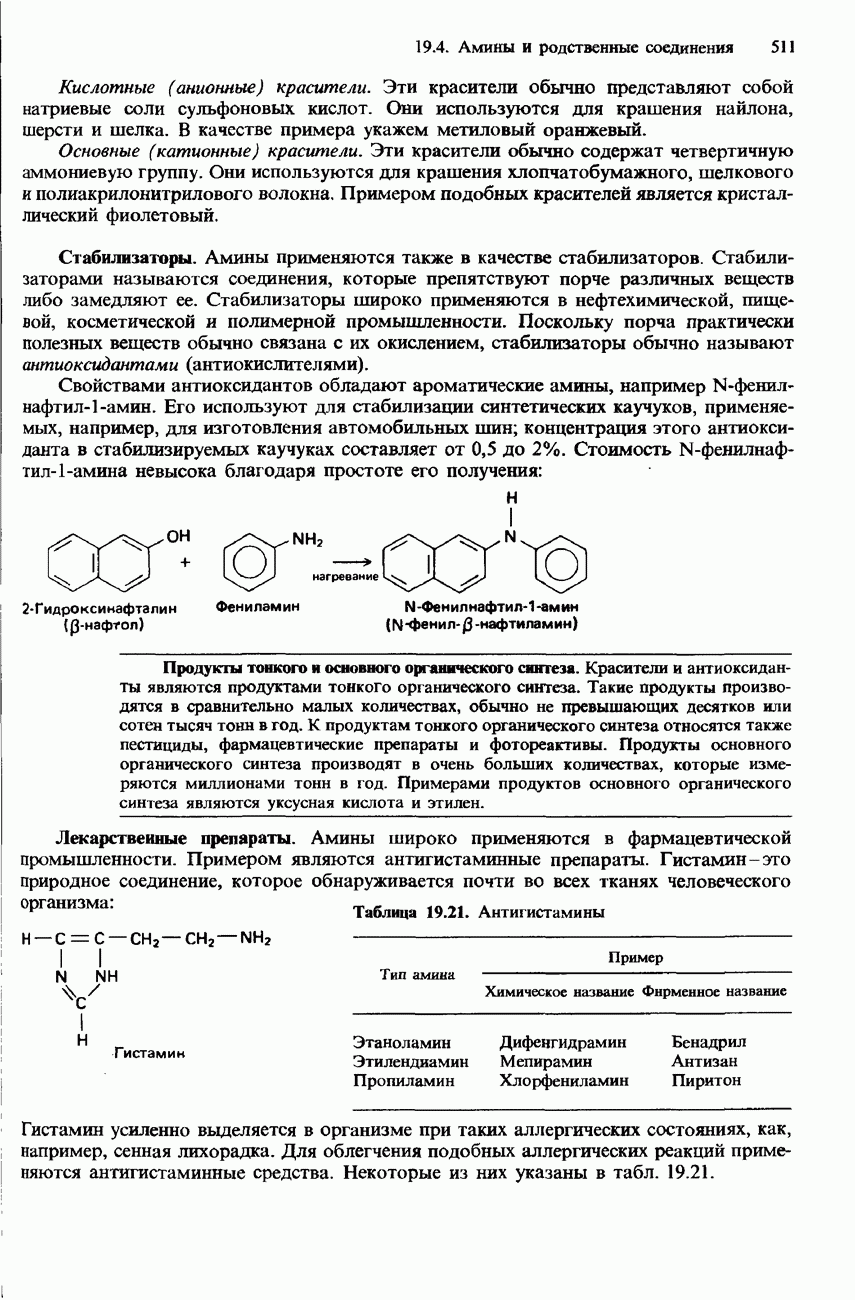
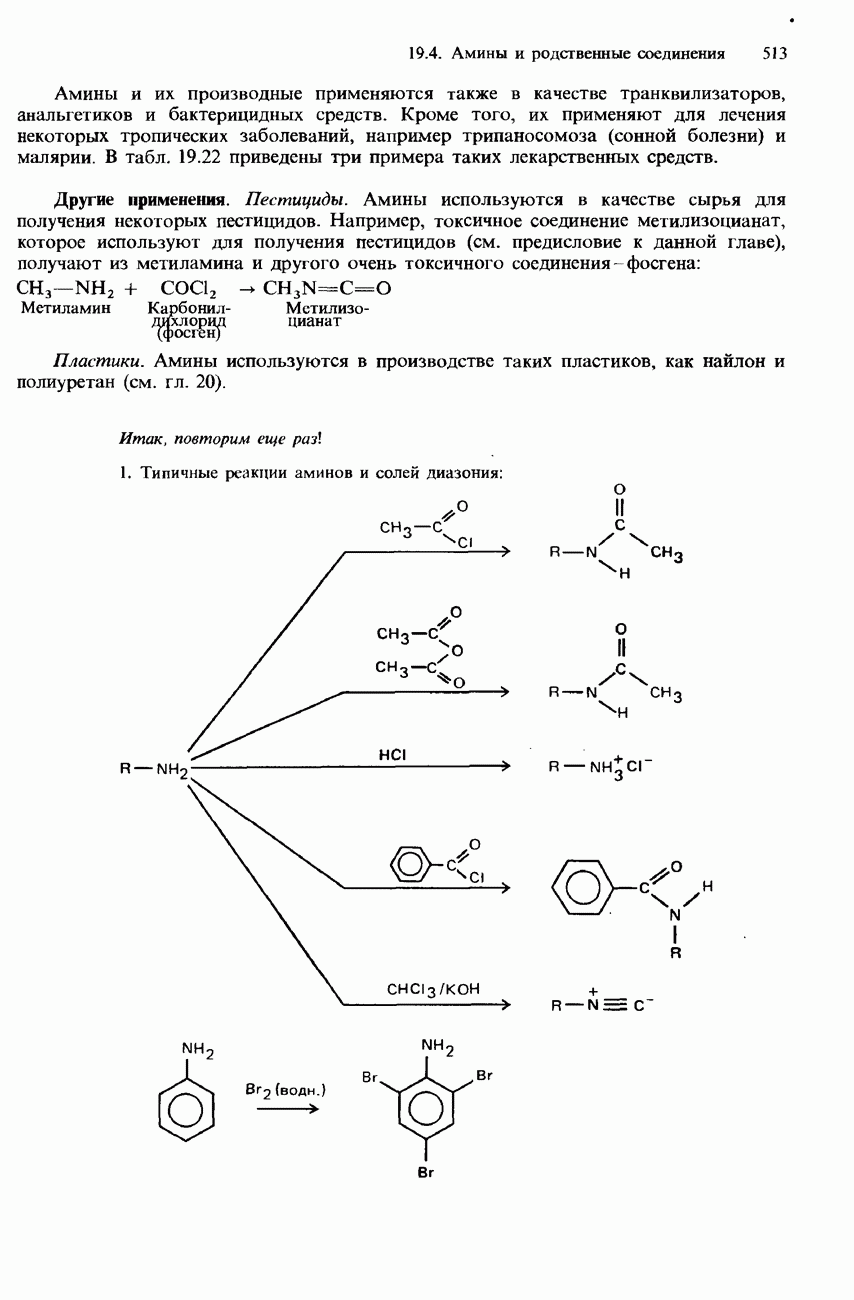
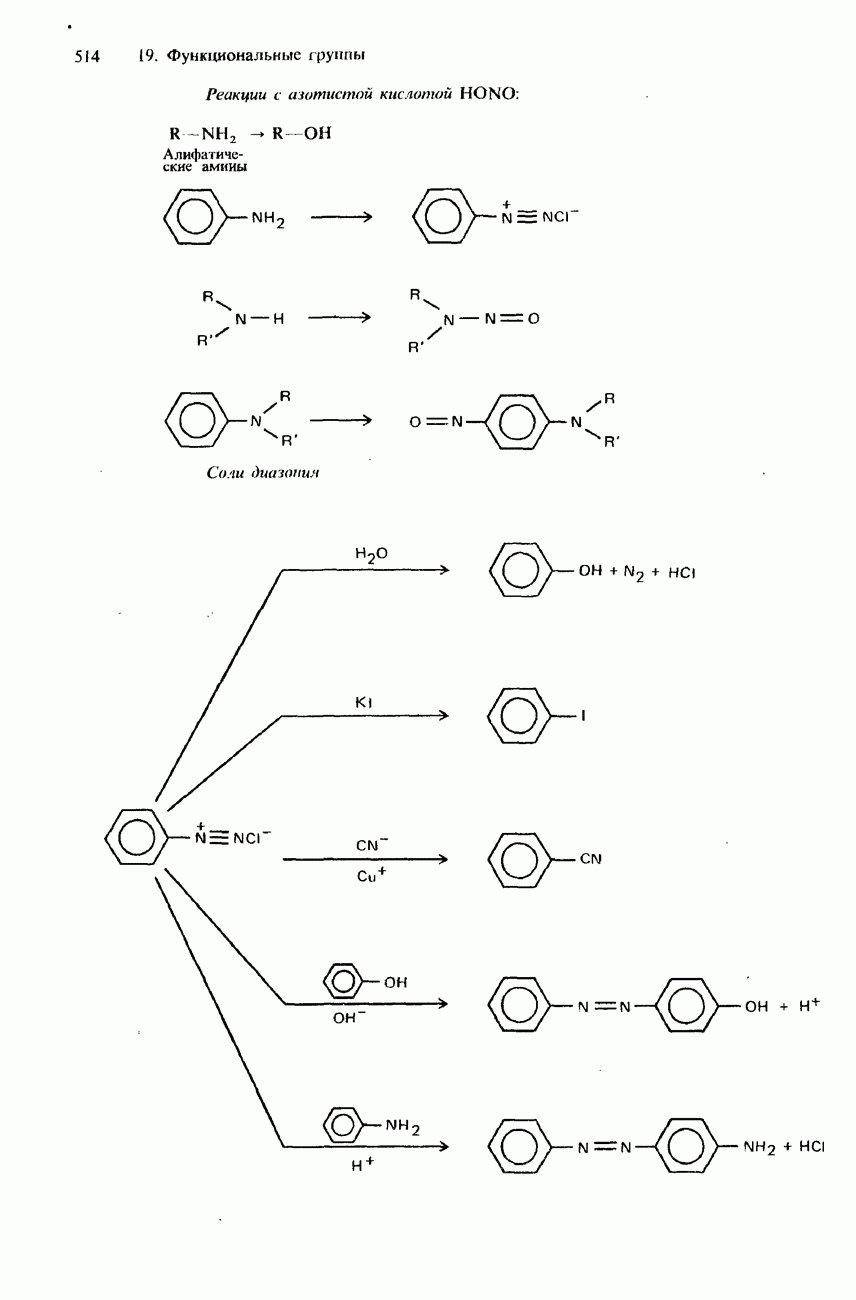
- 19.4 Амины и родственные соединения
- СОЛИ ДИАЗОНИЯ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 20. ПРИРОДНЫЕ СОЕДИНЕНИЯ И ПОЛИМЕРЫ
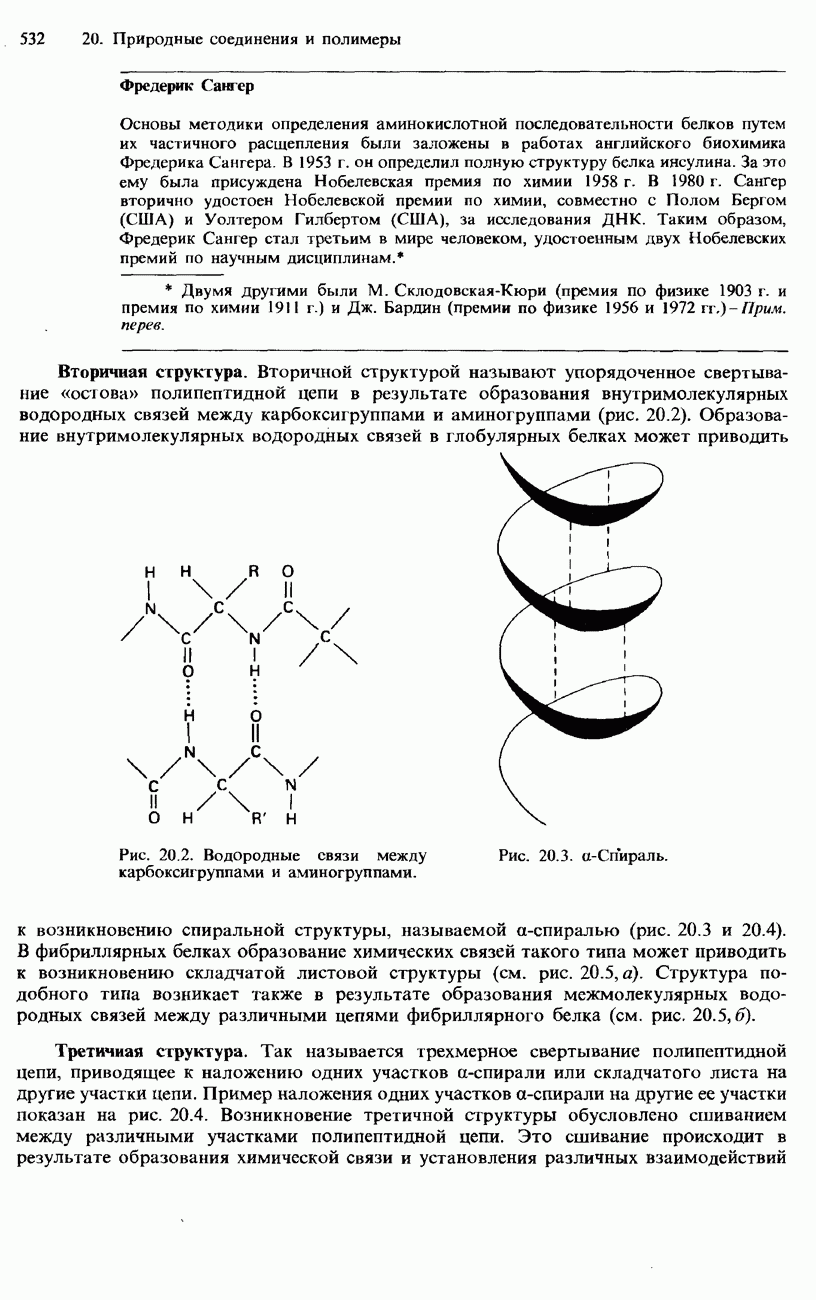
- 20.1. Аминокислоты, пептиды и белки
- АМИНОКИСЛОТЫ
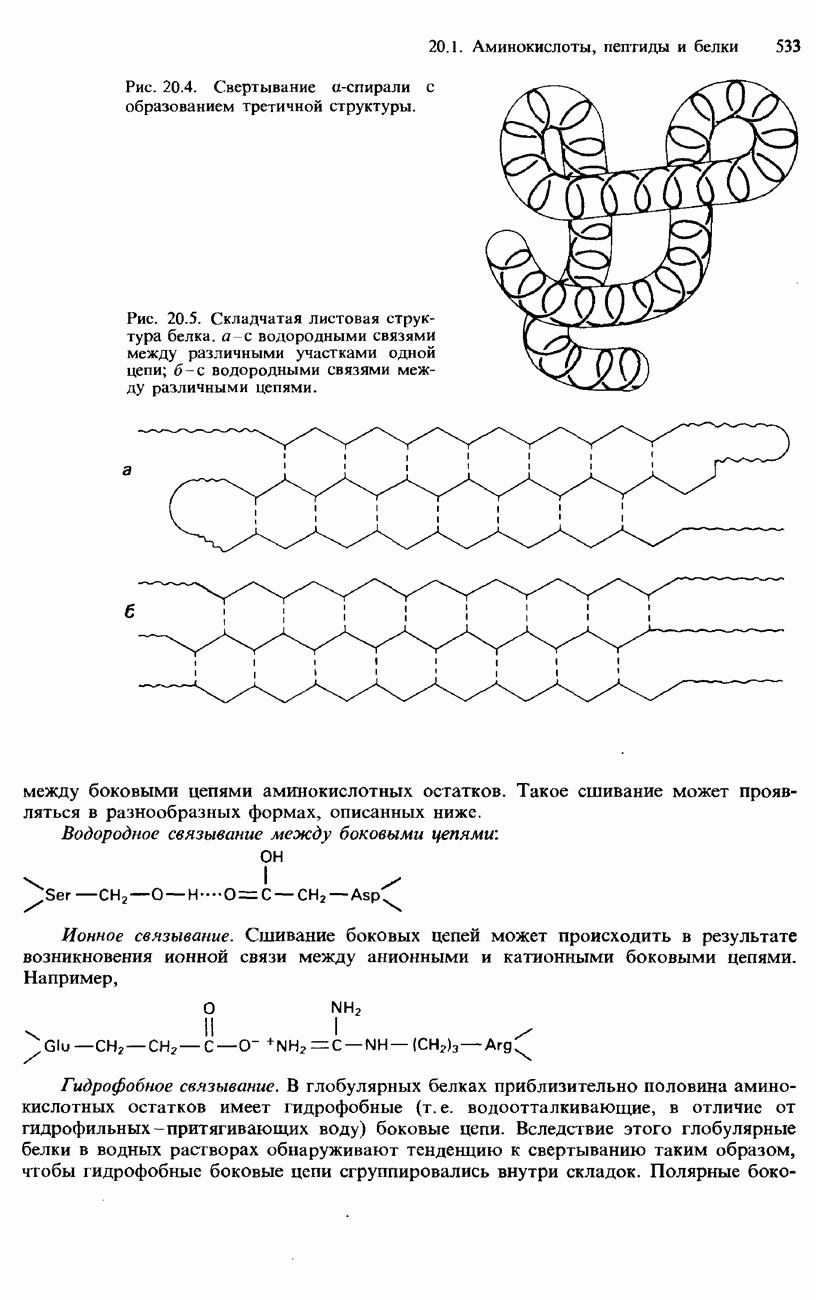
- ПЕПТИДЫ
- БЕЛКИ
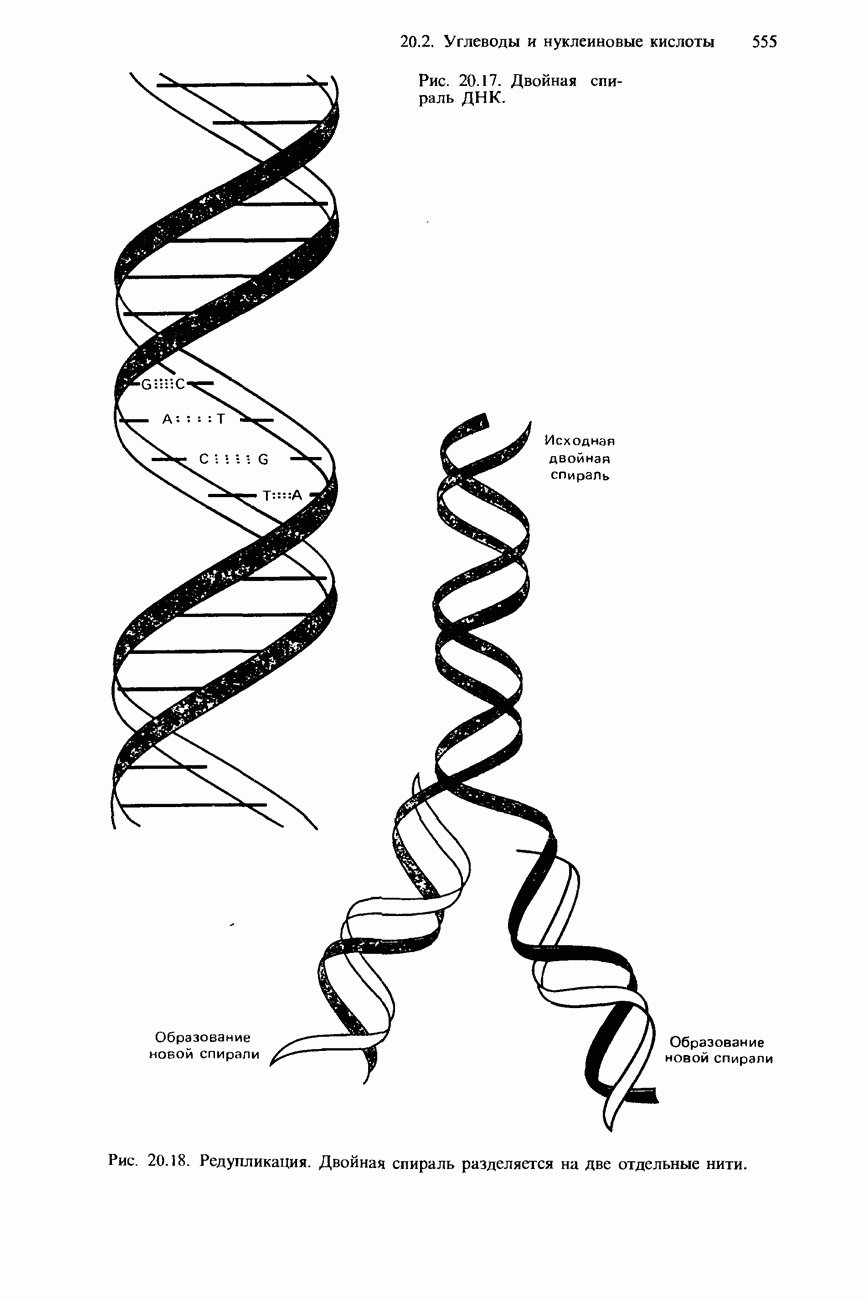
- 20.2. Углеводы и нуклеиновые кислоты
- НУКЛЕИНОВЫЕ КИСЛОТЫ
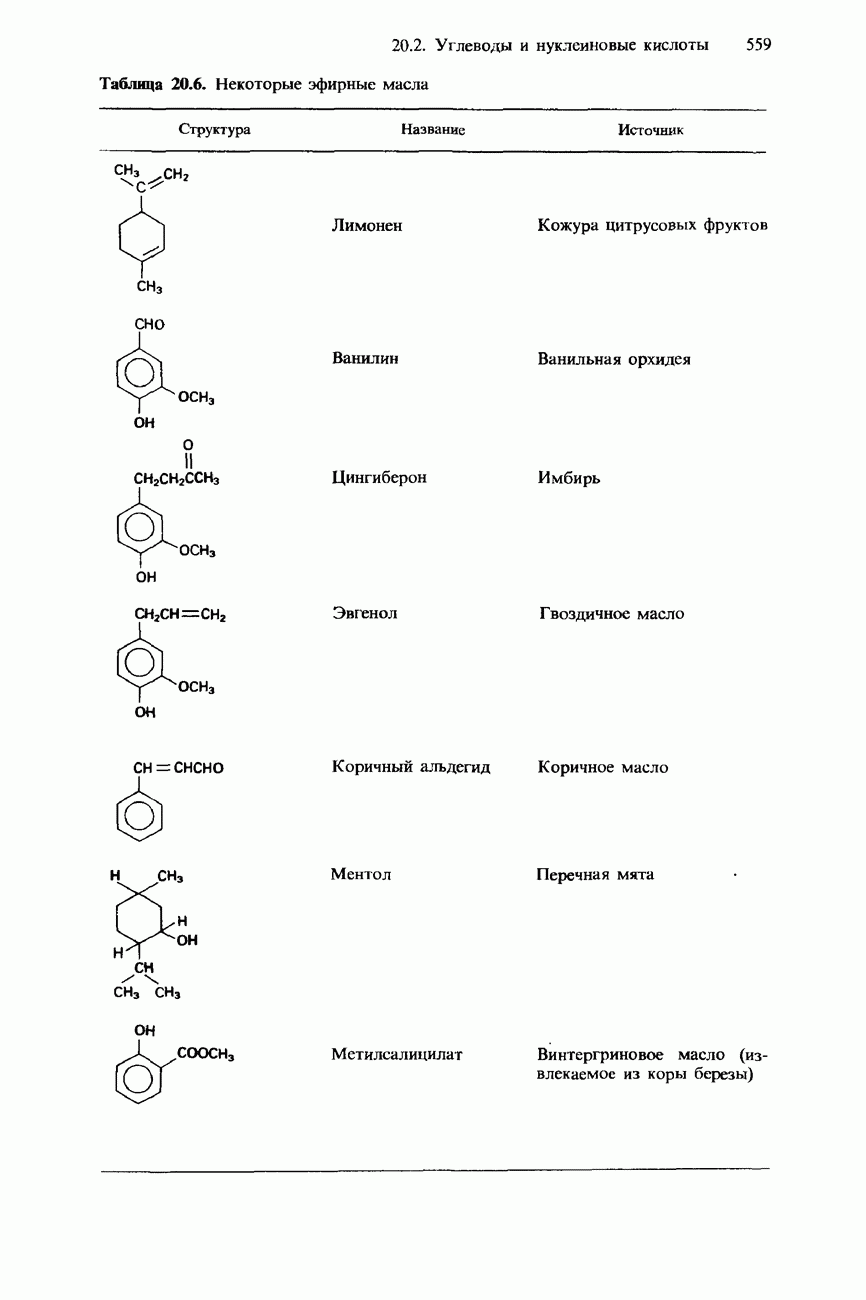
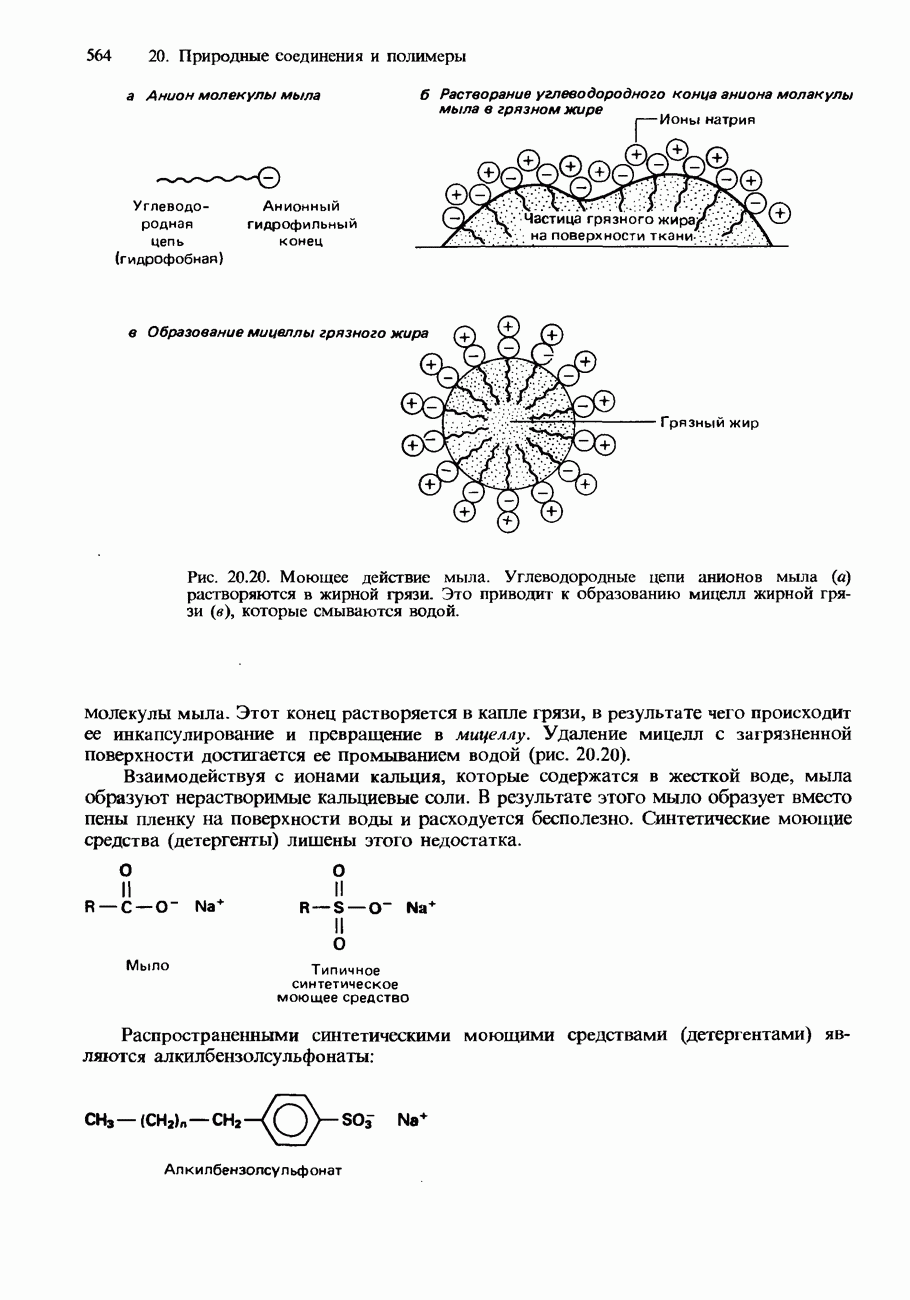
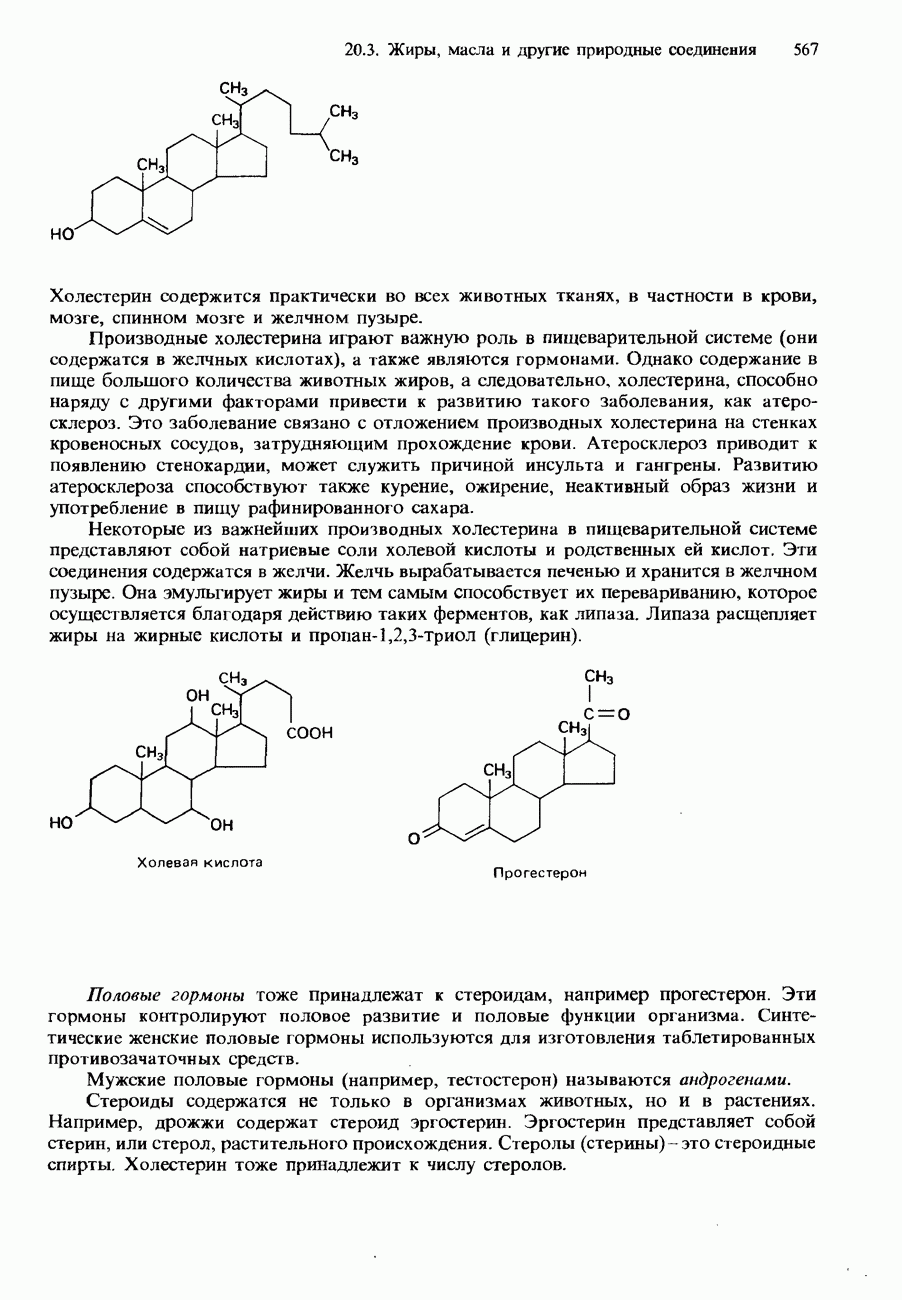
- 20.3. Жиры, масла и другие природные соединения
- ЖИРНЫЕ КИСЛОТЫ И ТРИГЛИЦЕРИДЫ
- ВОСКИ
- ФОСФОЛИПИДЫ И ГЛИКОЛИПИДЫ
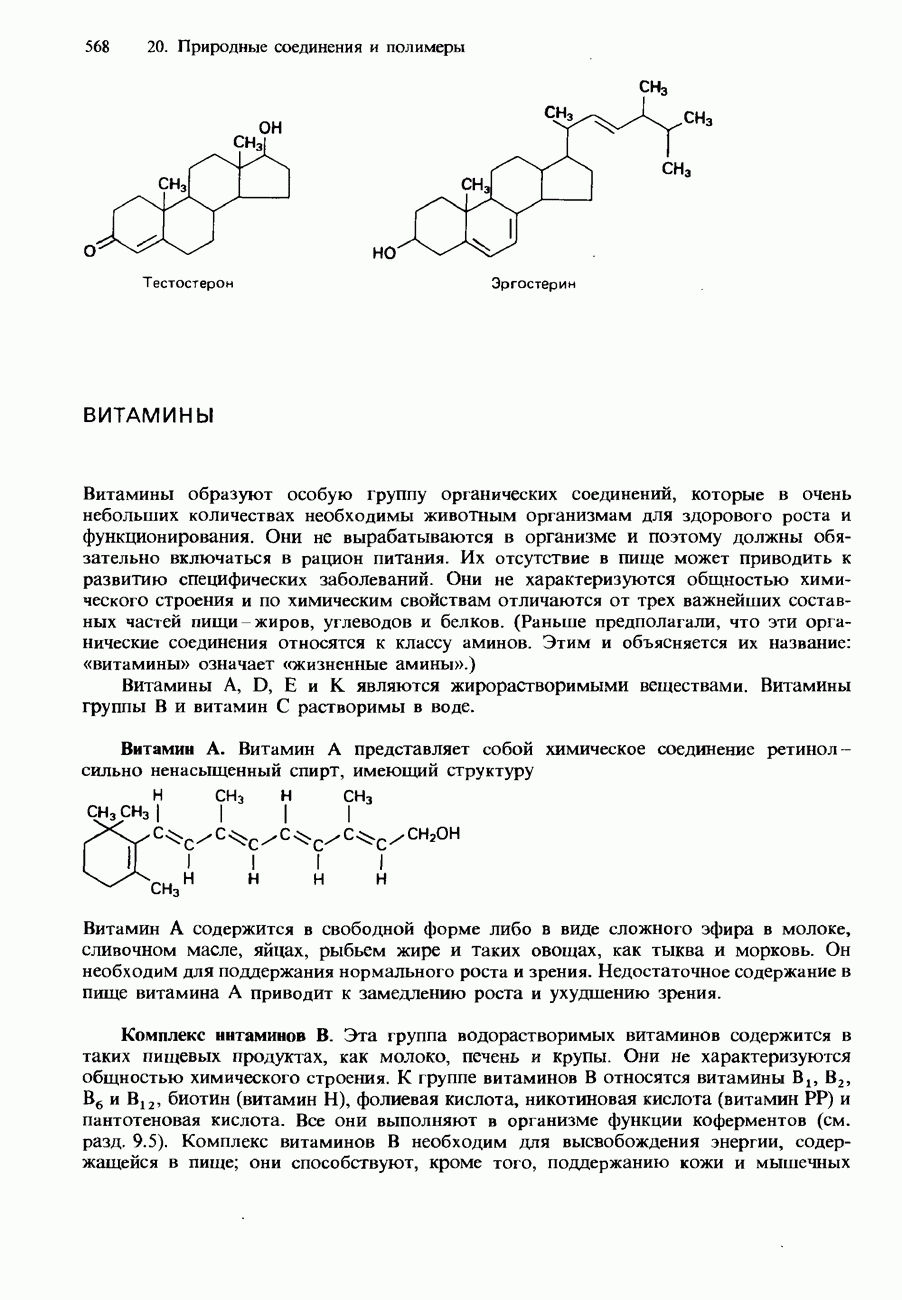
- ВИТАМИНЫ
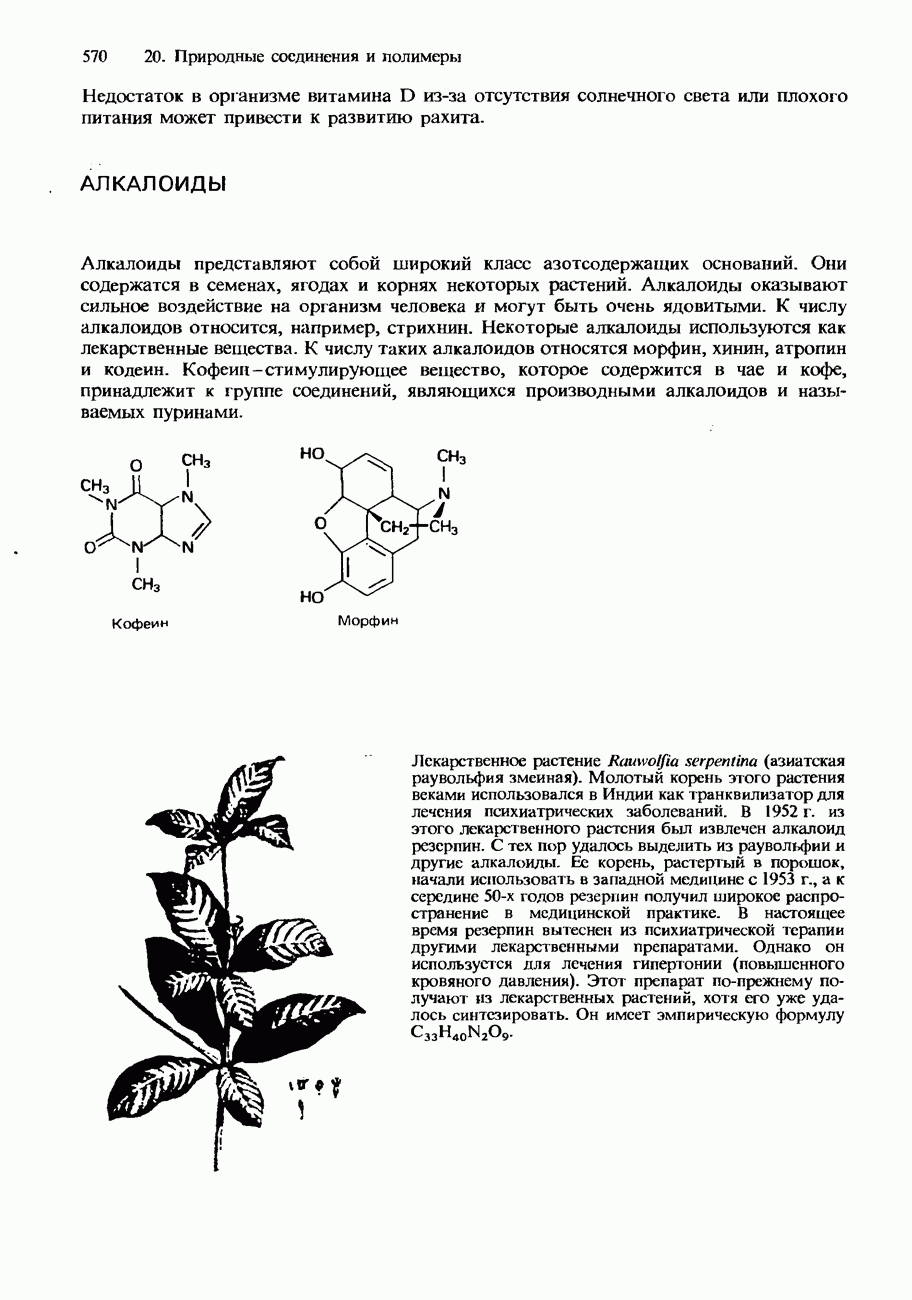
- АЛКАЛОИДЫ
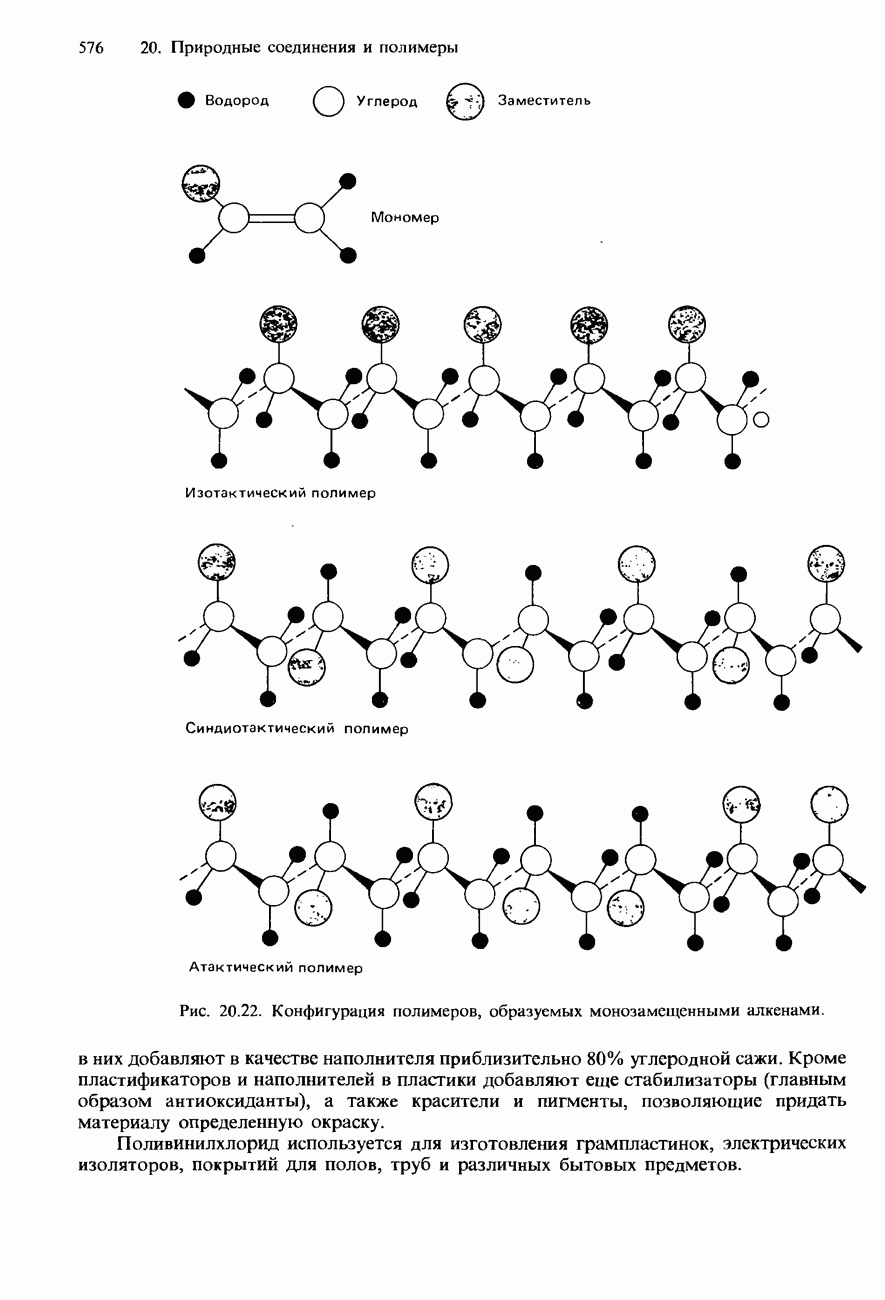
- 20.4. Полимеры
- ПОЛИМЕРИЗАЦИЯ
- НАТУРАЛЬНЫЕ И СИНТЕТИЧЕСКИЕ КАУЧУКИ
- ЦЕЛЛЮЛОЗНОЕ ВОЛОКНО
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- ПРИЛОЖЕНИЯ