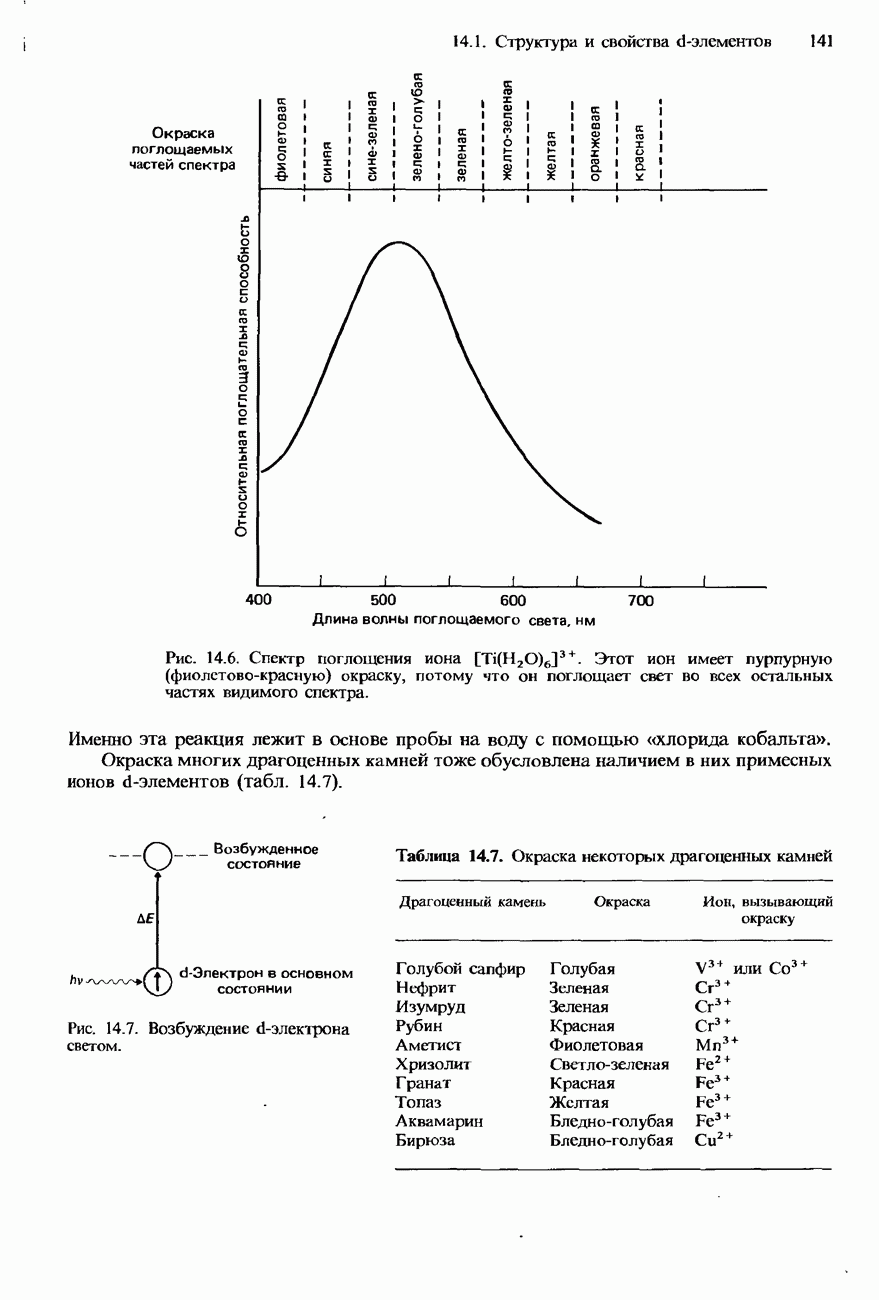
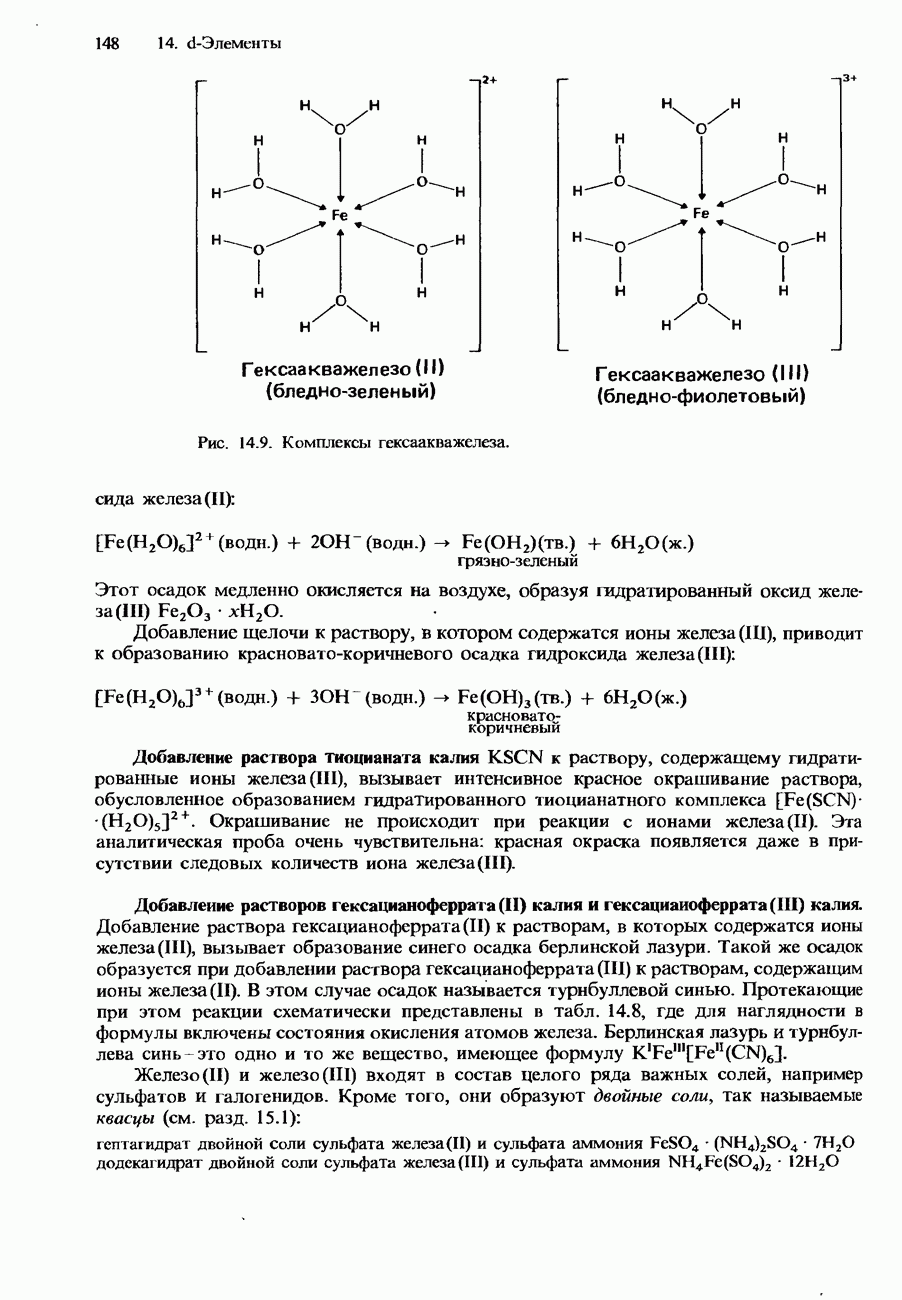
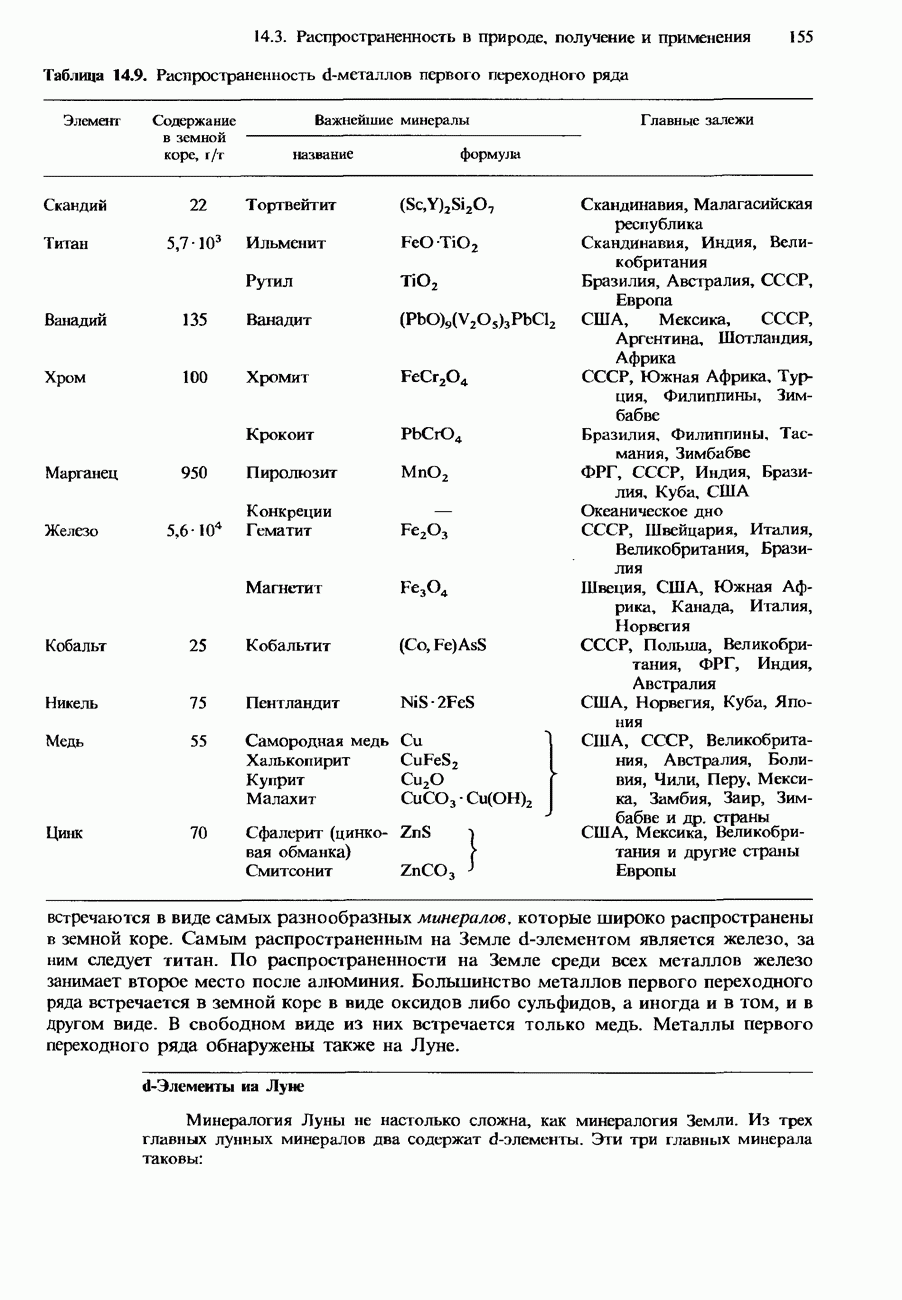
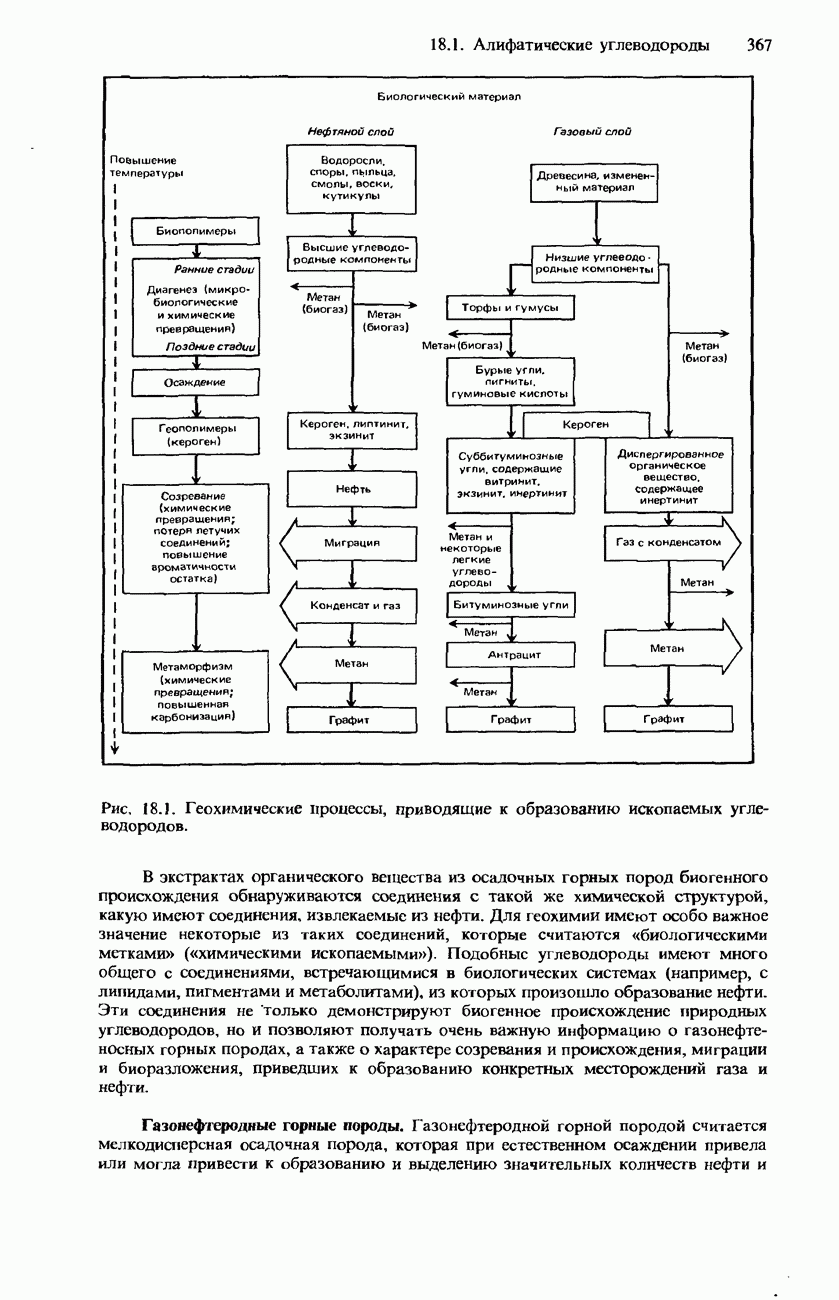
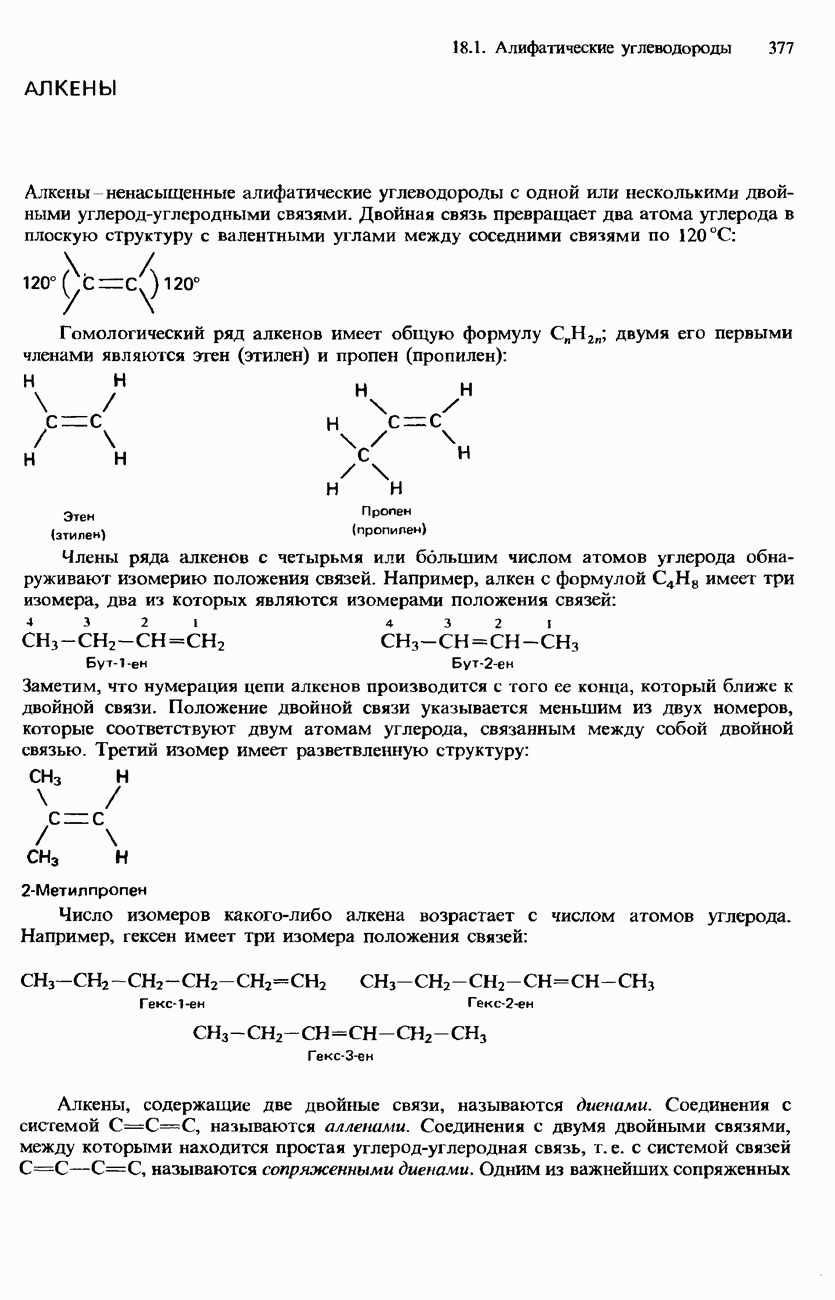
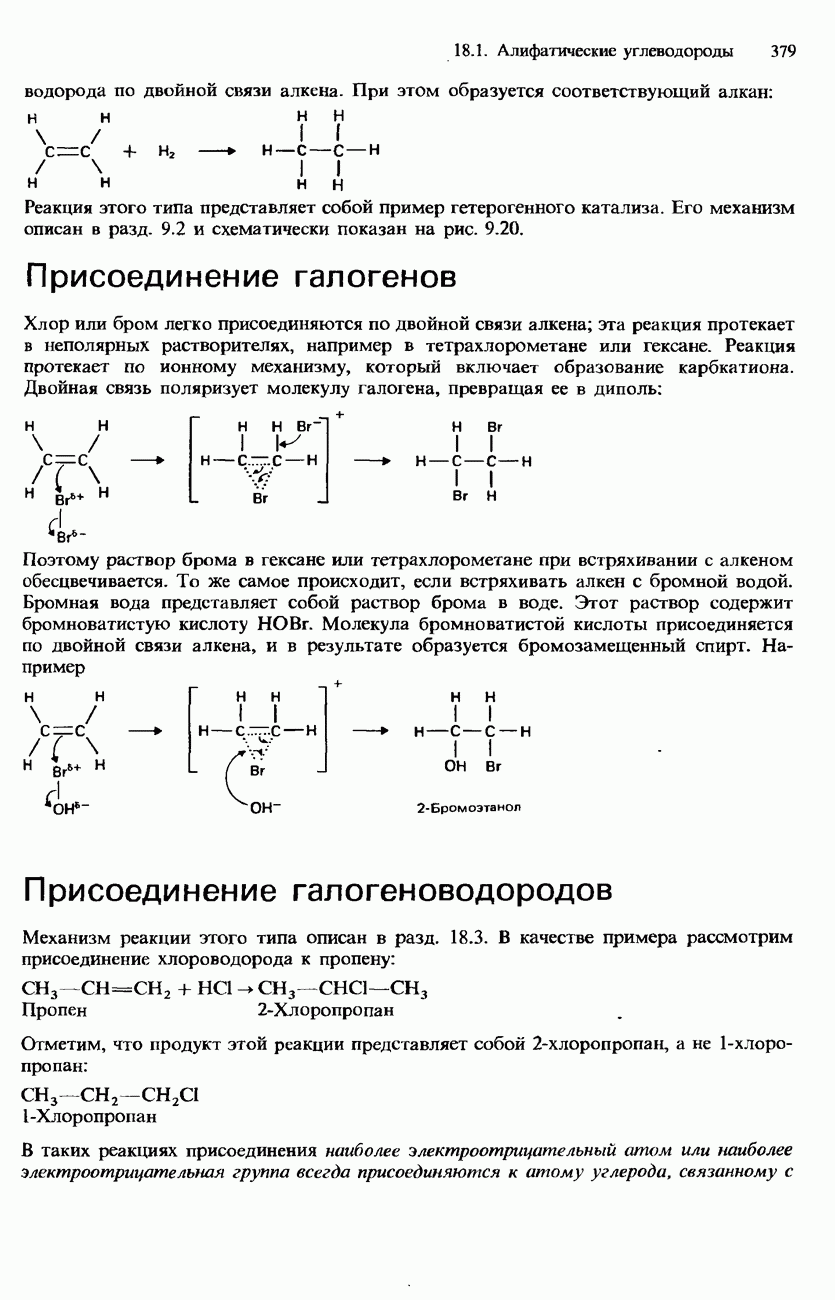
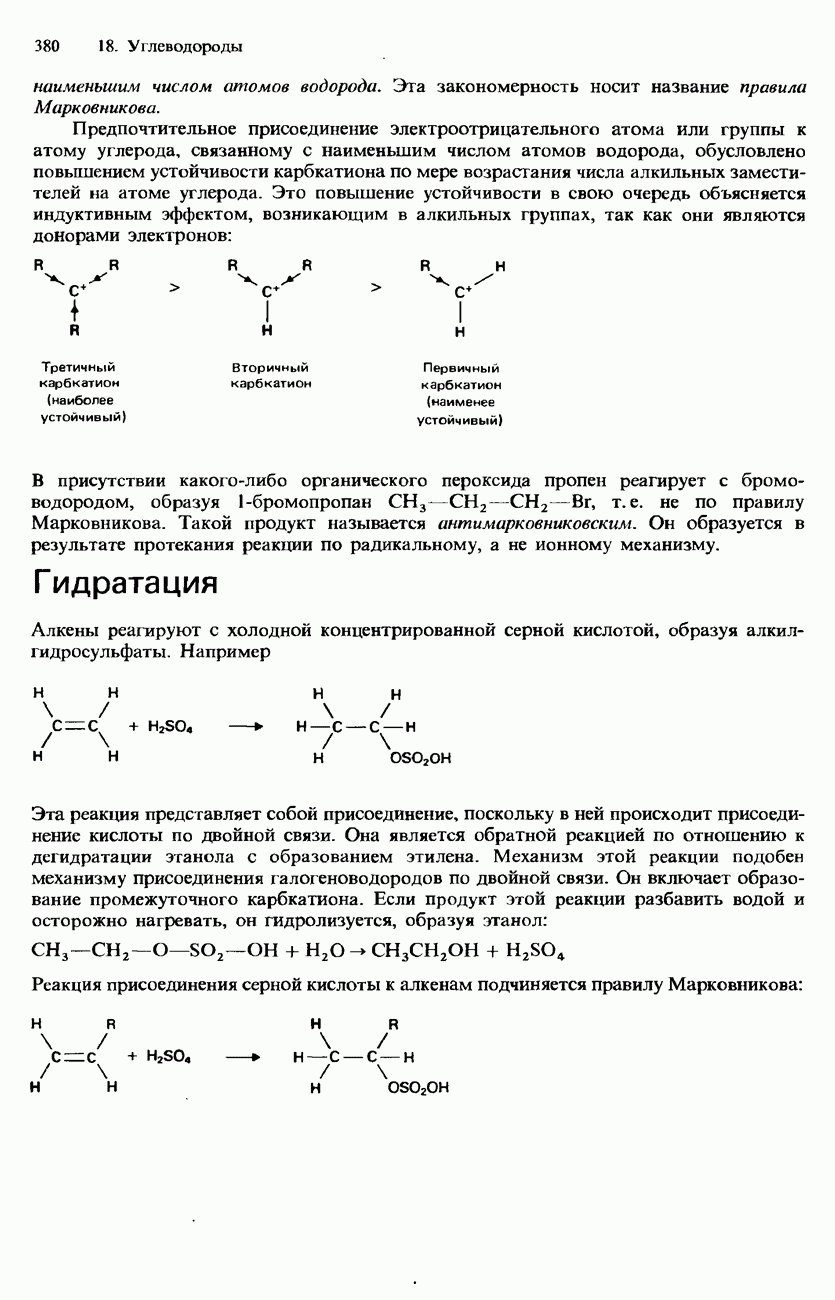
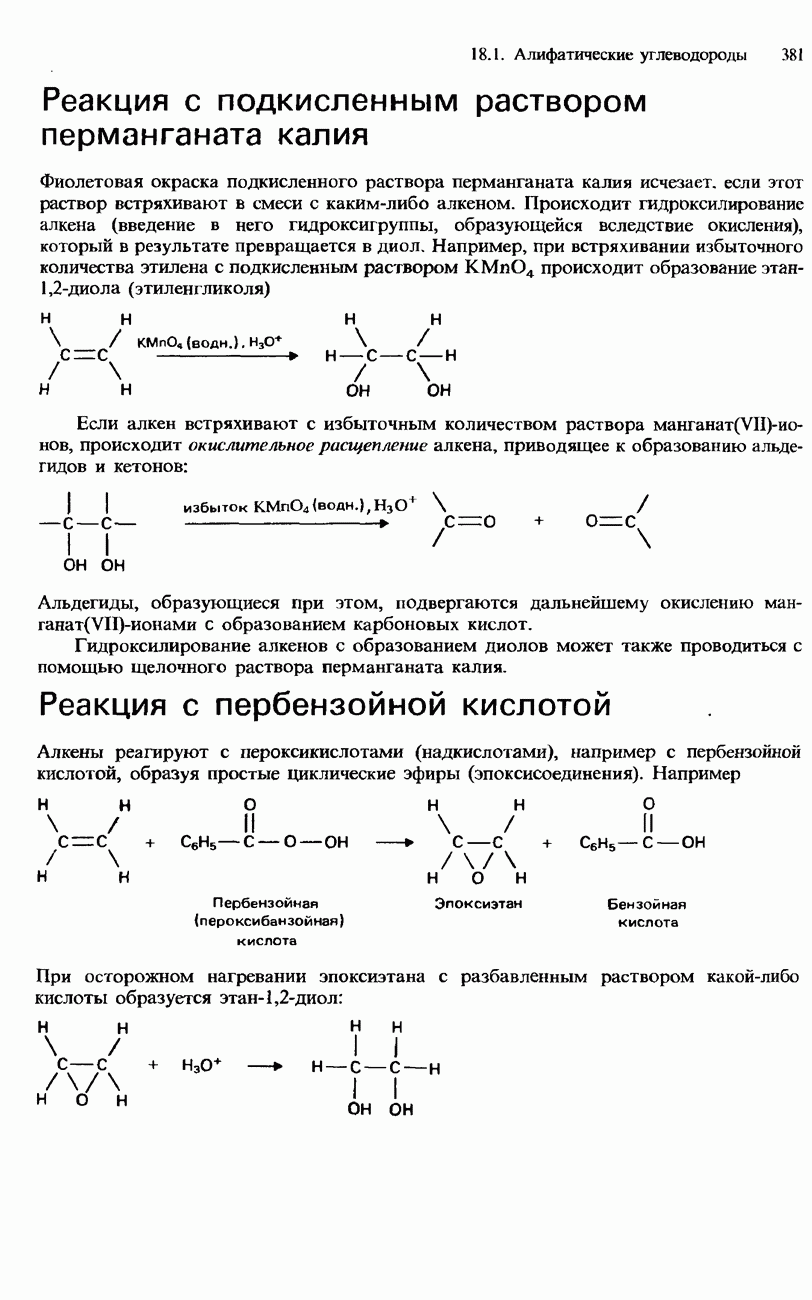
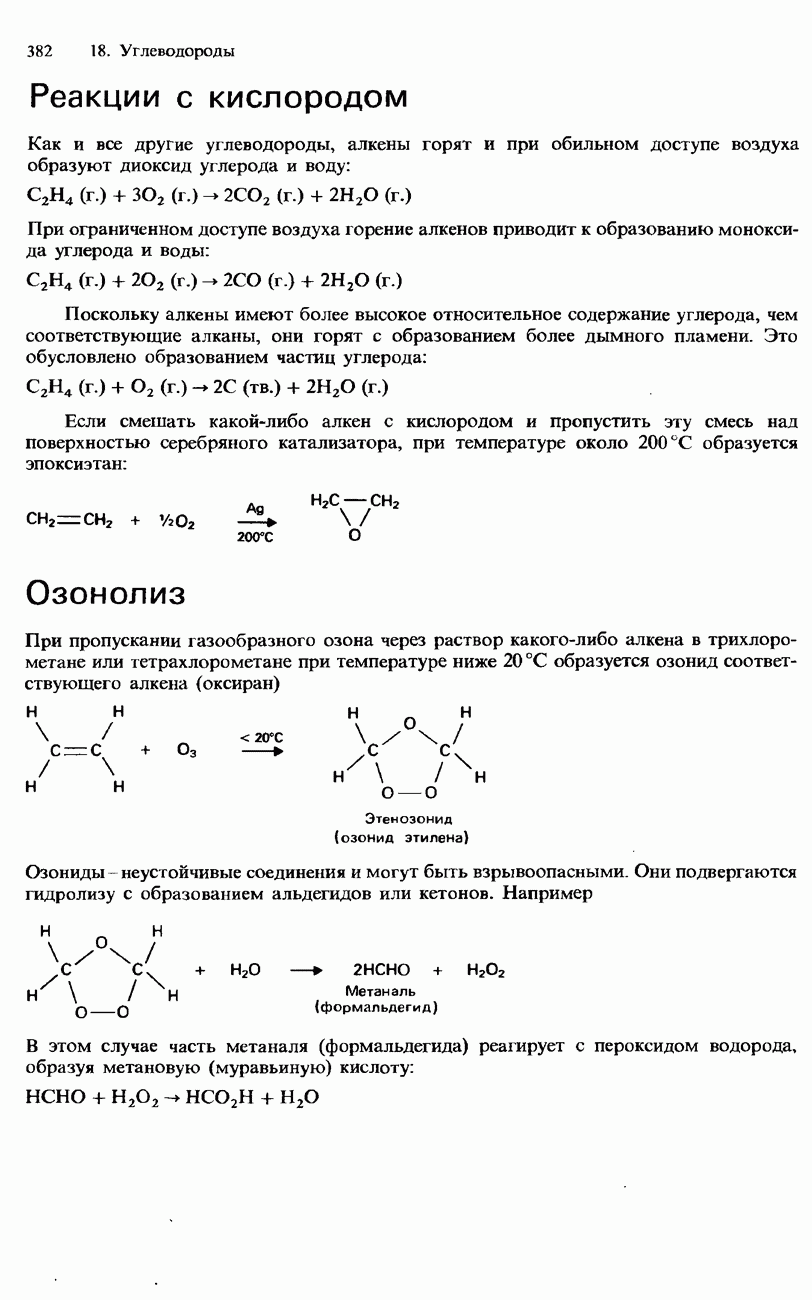
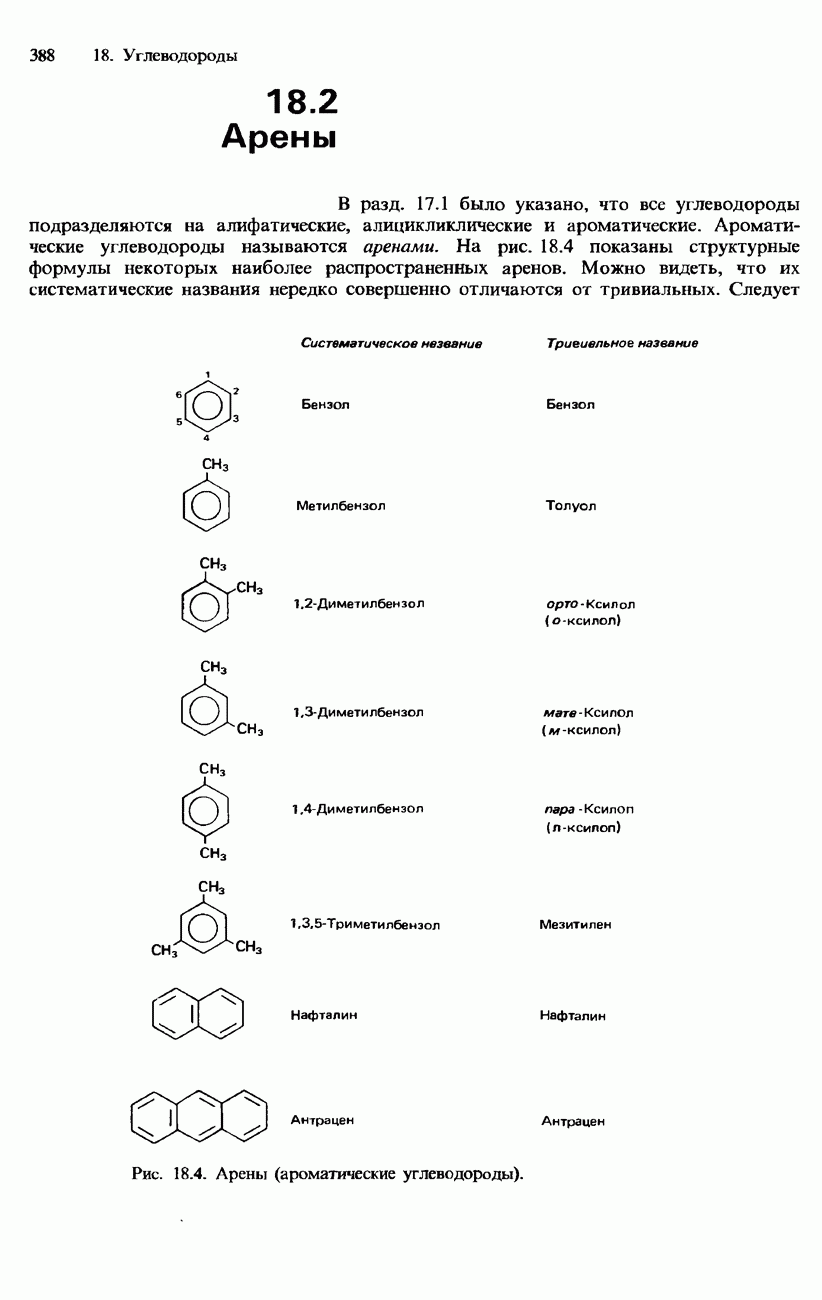
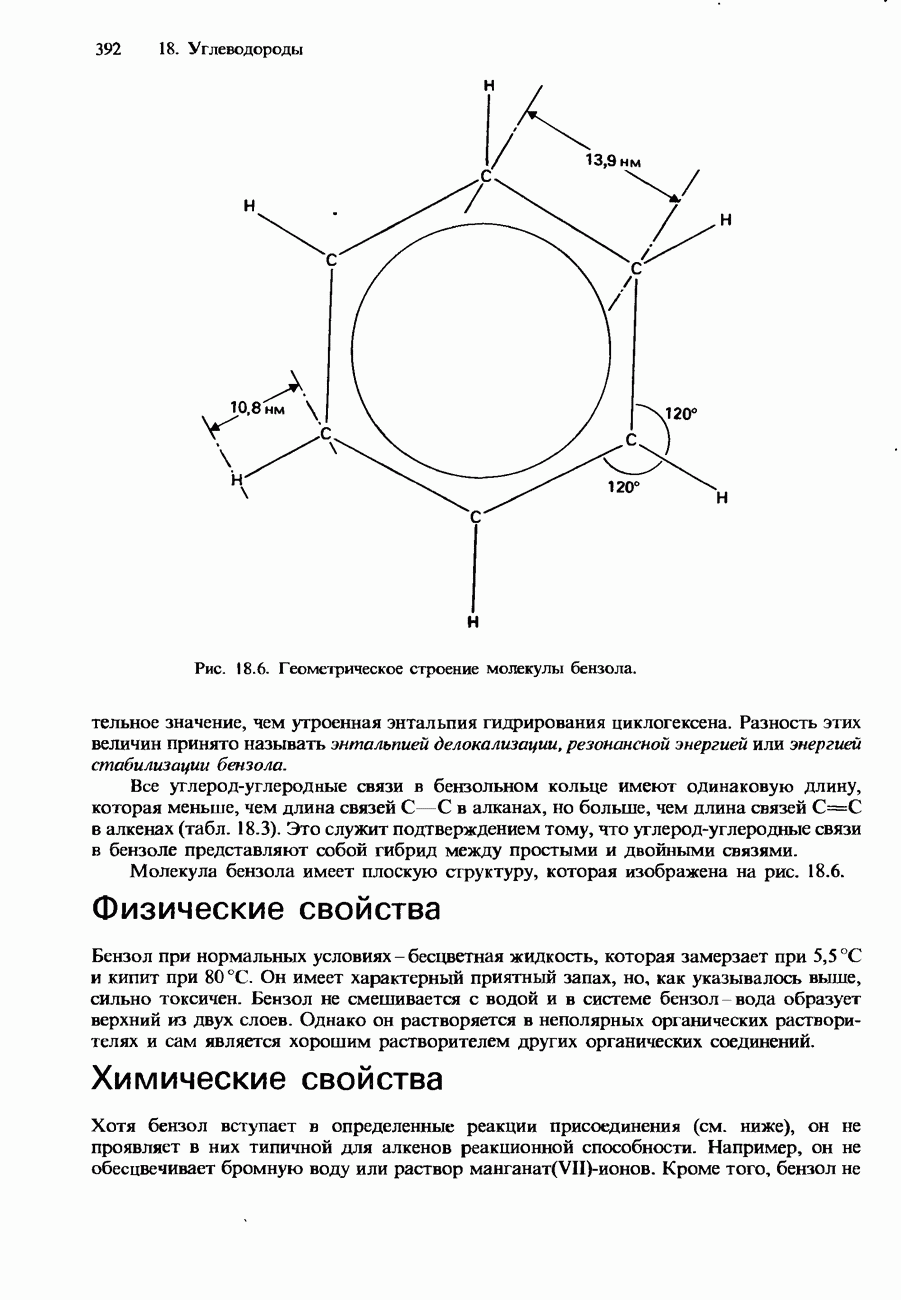
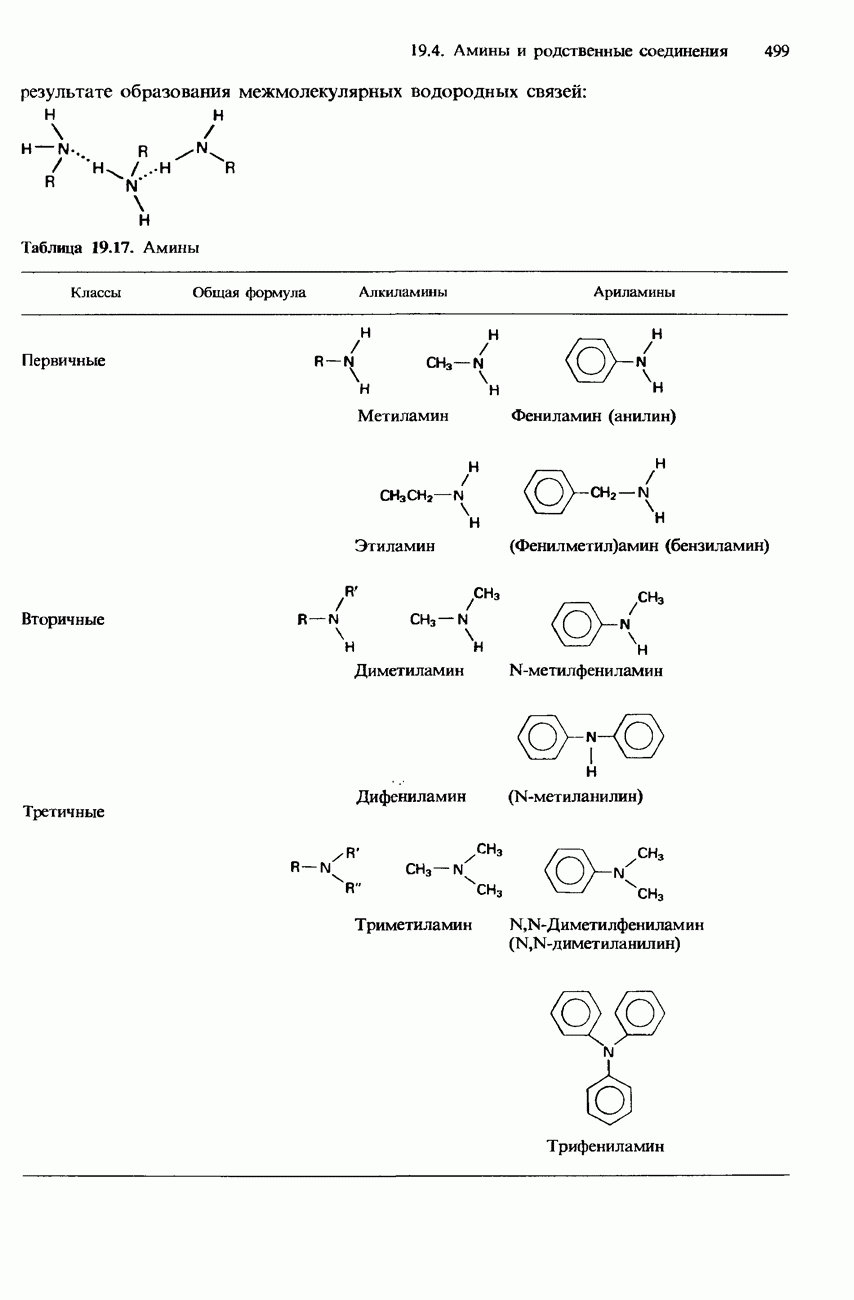
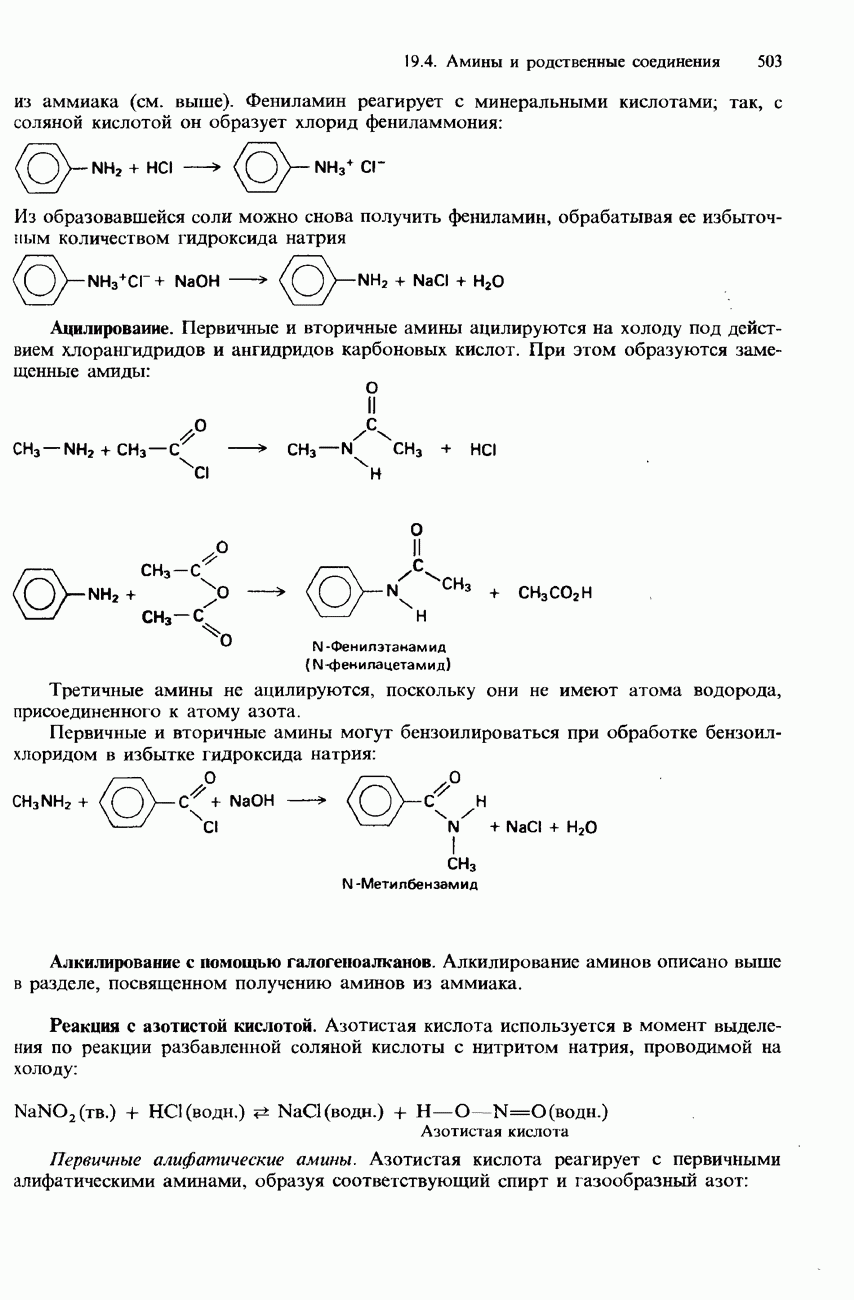
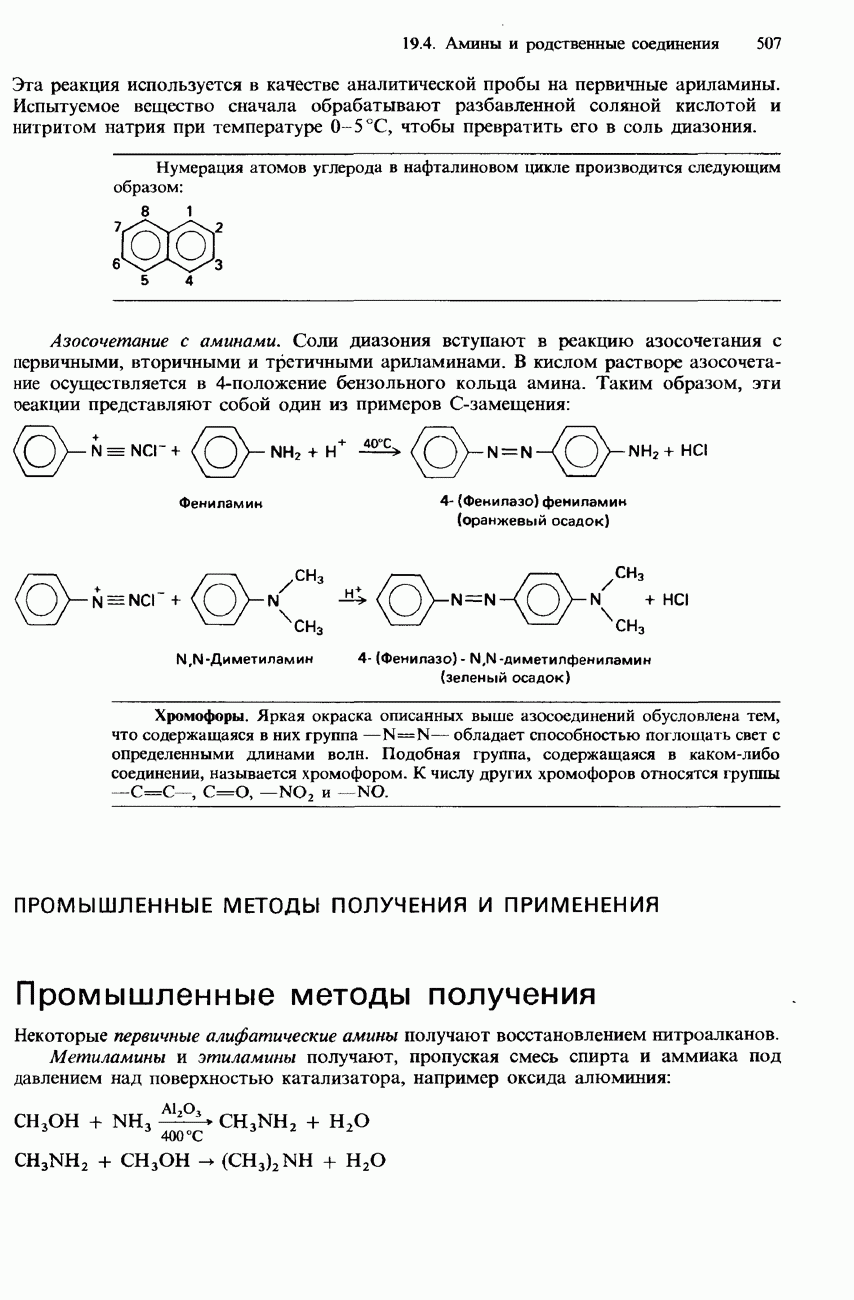
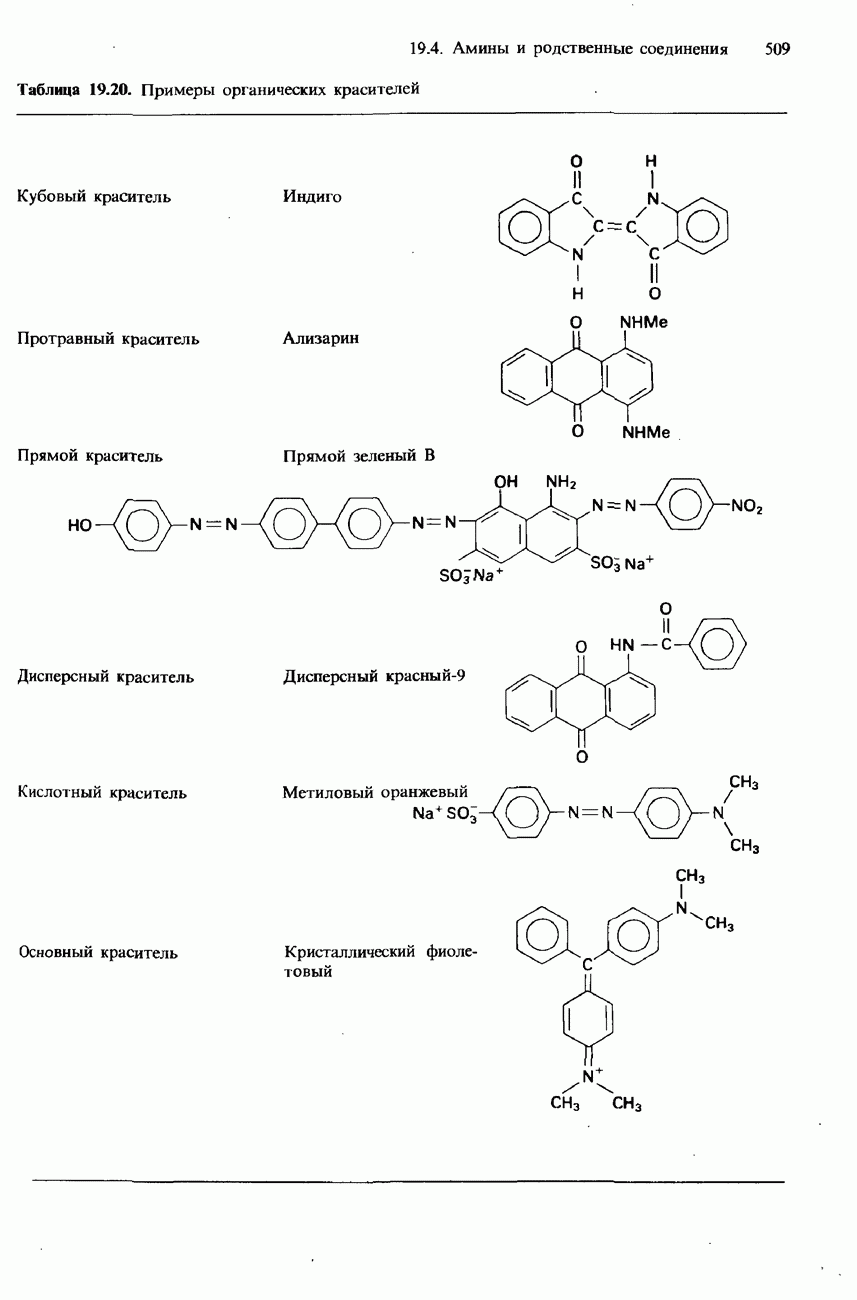
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
19.1. Органические галогенсодержащие соединения
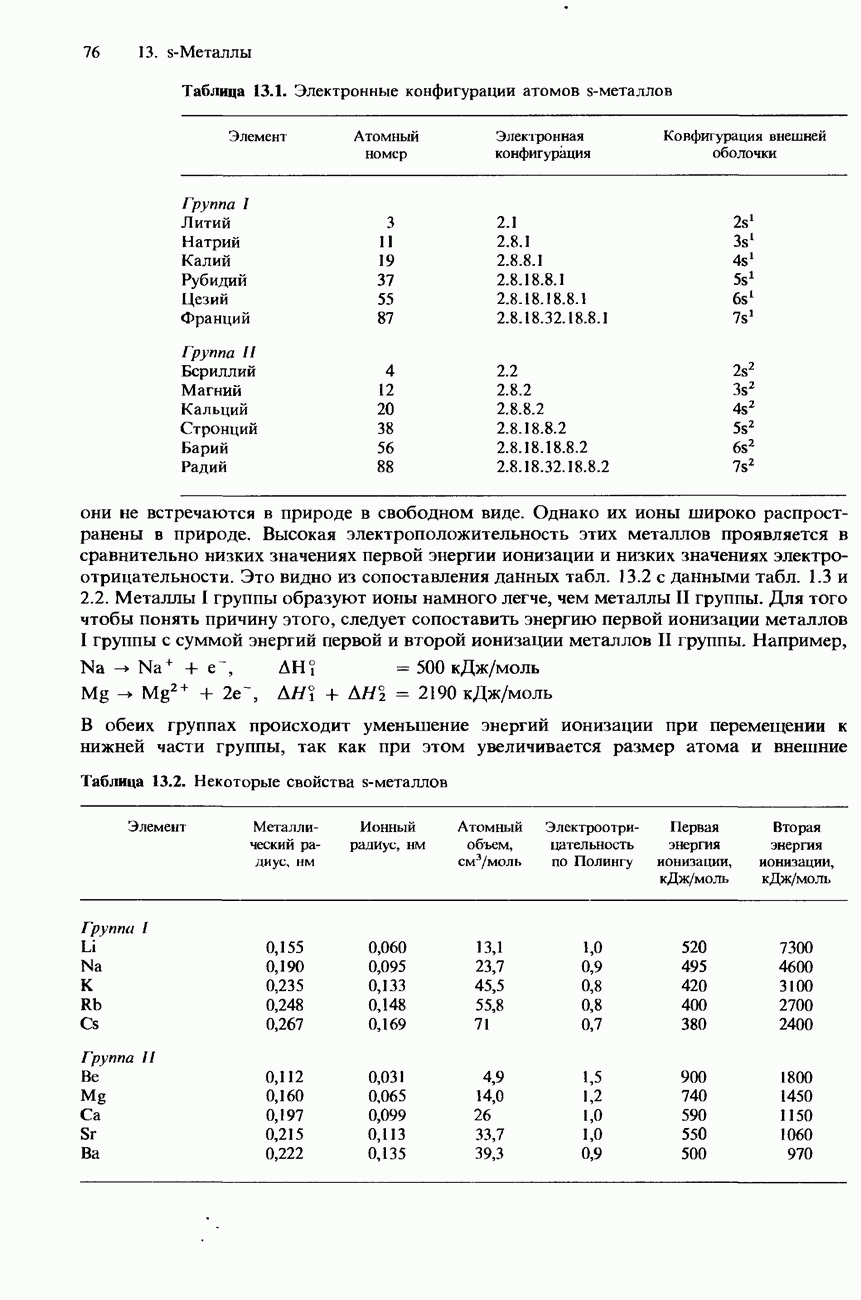
В разд. 17.1 было указано, что органические соединения часто классифицируют не по их углеродному скелету, а по функциональным группам. Функциональная группа представляет собой реакционноспособный центр молекулы. Она обусловливает многие химические и физические свойства, характерные для соединений с такой функциональной группой.
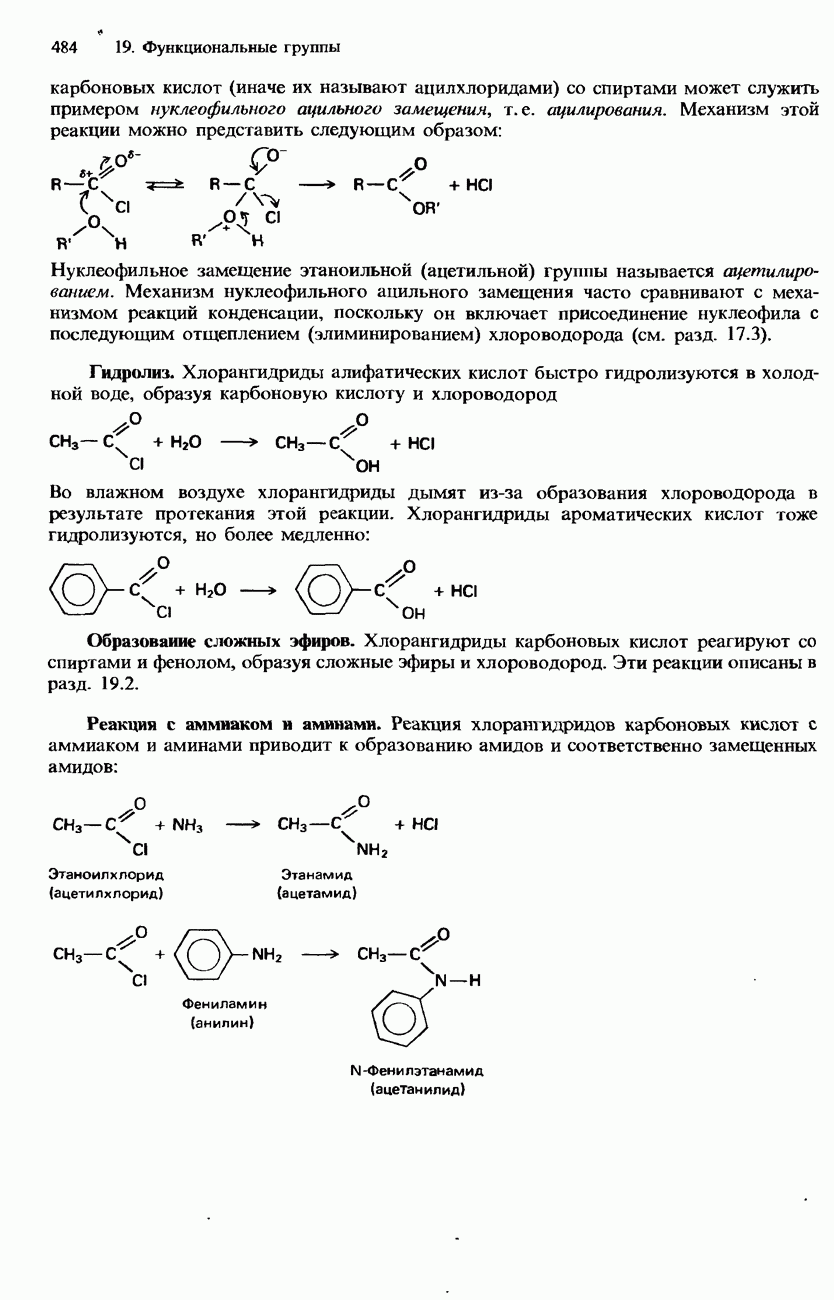
В табл. 19.2 приведены формулы и названия некоторых наиболее важных органических галогенсодержащих соединений. Для интересующих нас целей органические галогенсодержащие соединения удобно подразделить на три типа: галогеноалканы (алкилгалот ениды), галогеноалкены (алкенилгалогениды) и галогеноарены (арилгало-гениды). Однако следует отметить, что существуют и другие типы органических соединений, которые тоже содержат галогены. В качестве примера приведем хлорангидриды карбоновых кислот (они будут рассматриваться в разд. 19.3).
Таблица 19.2. Галогенсодержащие органические соединения

ГАЛОГЕНОАЛКАНЫ
Согласно номенклатурным правилам ИЮПАК, галогеноалканами называются моногалогенопроизводные алканов. Другое их название - «алкилгалогениды». Например, согласно номенклатурным правилам ИЮПАК, соединение, имеющее формулу  называется «хлороэтан». Другое его название - «этилхлорид».
называется «хлороэтан». Другое его название - «этилхлорид».
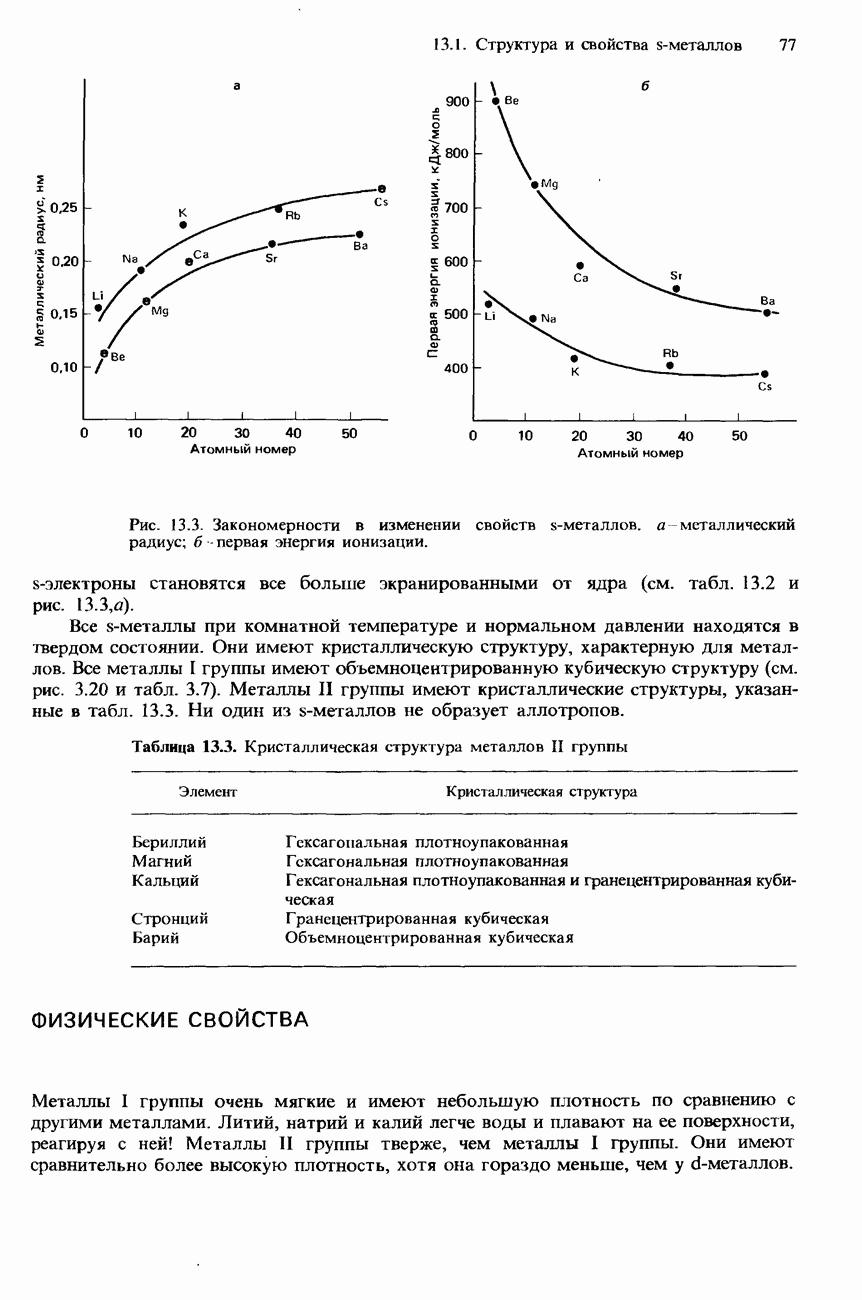
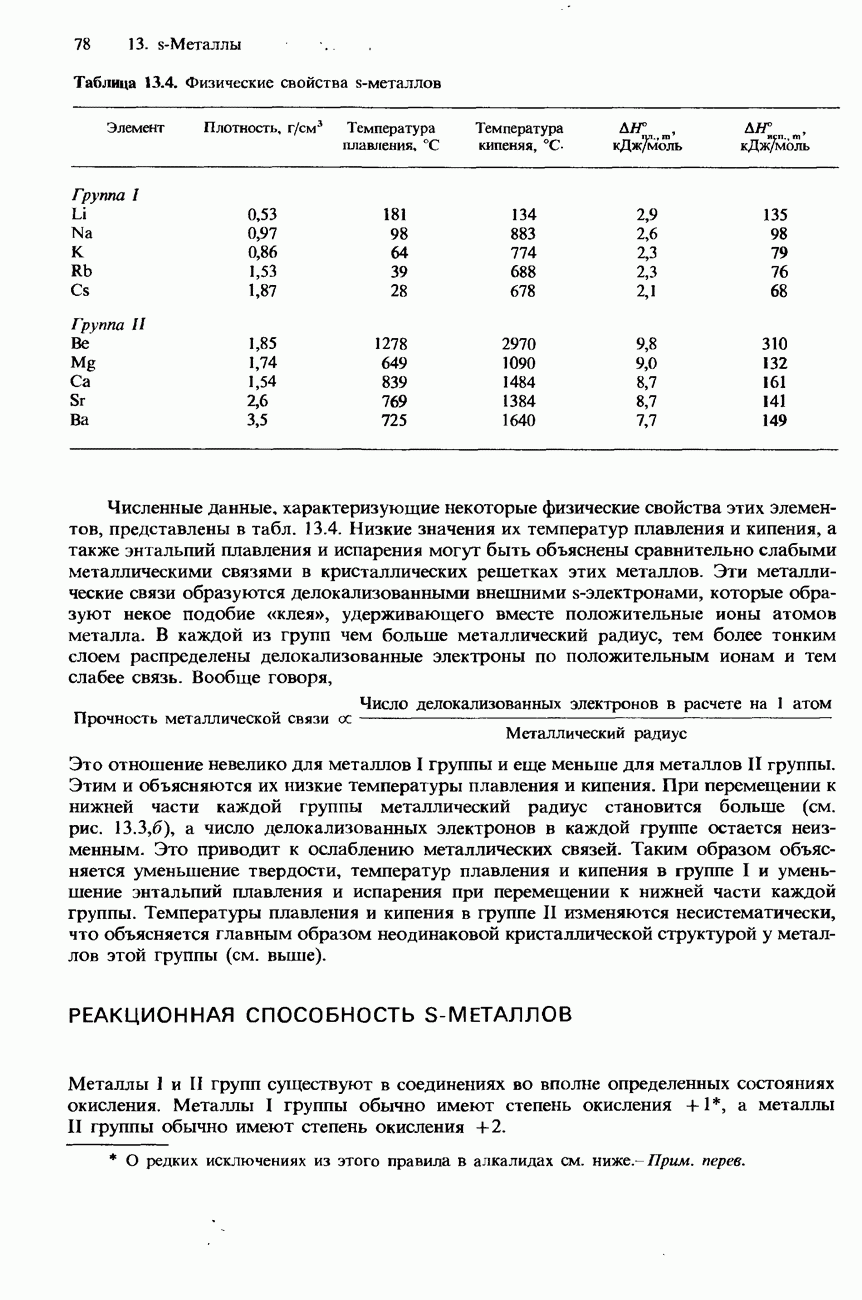
Галогеноалкаыы образуются в результате реакции между соответствующим алканом и галогеном в присутствии солнечного света. Эти реакции имеют радикальную природу и, как было указано в разд. 18.1, приводят к образованию не только моногалогенопроизводных, но также дигалогено- и тригалогенопроизводных.
В лабораторных условиях для получения галогеноалканов могут использоваться различные методы. Например, их можно получать из спиртов либо из алкенов, которые обрабатывают соответствующими галогеноводородами (см. разд. 17.3 и 18.1).
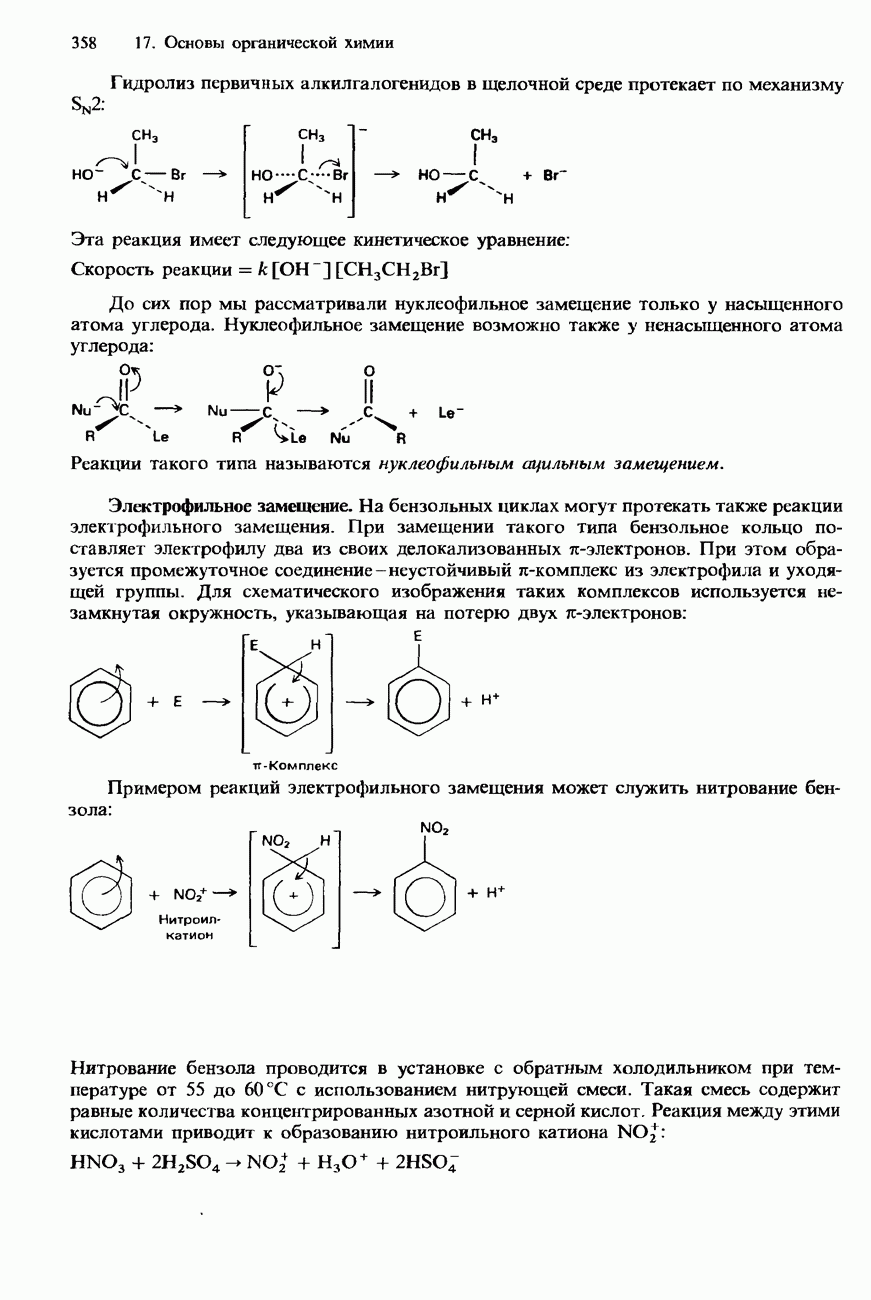
Нуклеофильное замещение
Химические свойства галогеноалканов во многом обусловлены полярностью связи углерод - галоген:

Эта полярность обусловлена индуктивным эффектом (см. разд. 17.3). В присутствии какого-либо нуклеофила связь углерод галоген при соответствующих условиях может подвергаться гетеролитическому расщеплению:

Реакция этого типа представляет собой нуклеофильное замещение. Механизмы подобных реакций обсуждались в разд. 17.3.
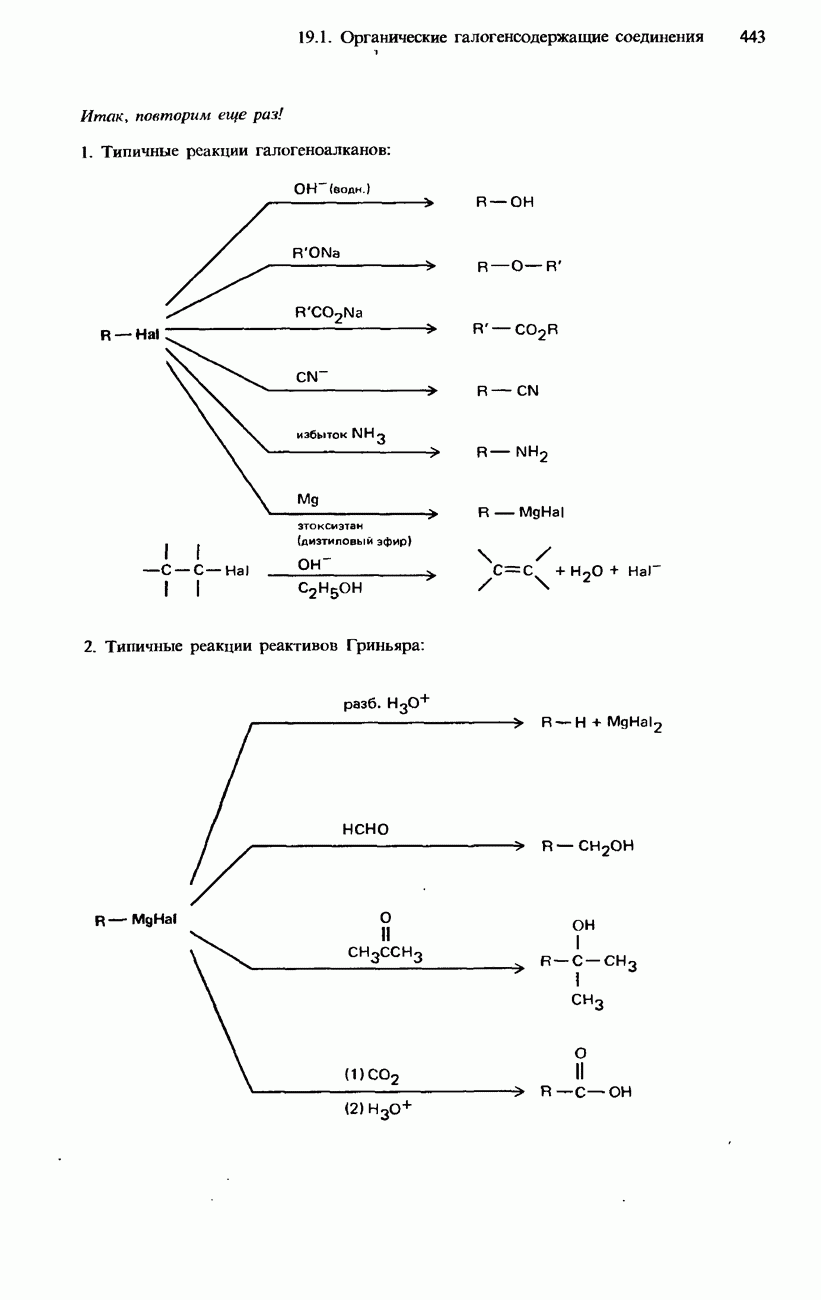
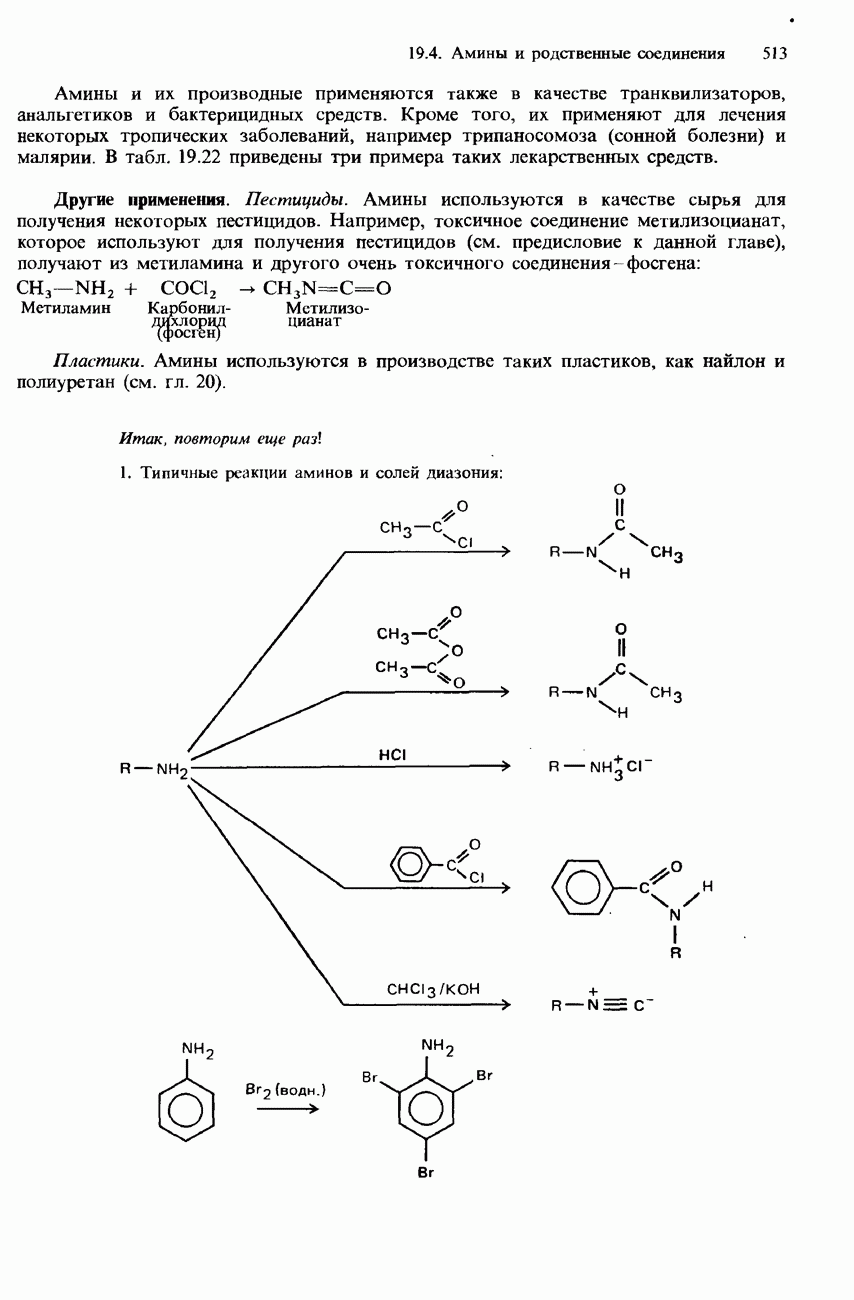
Примерами реакций нуклеофильного замещения являются гидролиз галогеноалканов, синтез Вильямсона, образование сложных эфиров и нитрилов, а также реакции галогеноалканов с аммиаком.
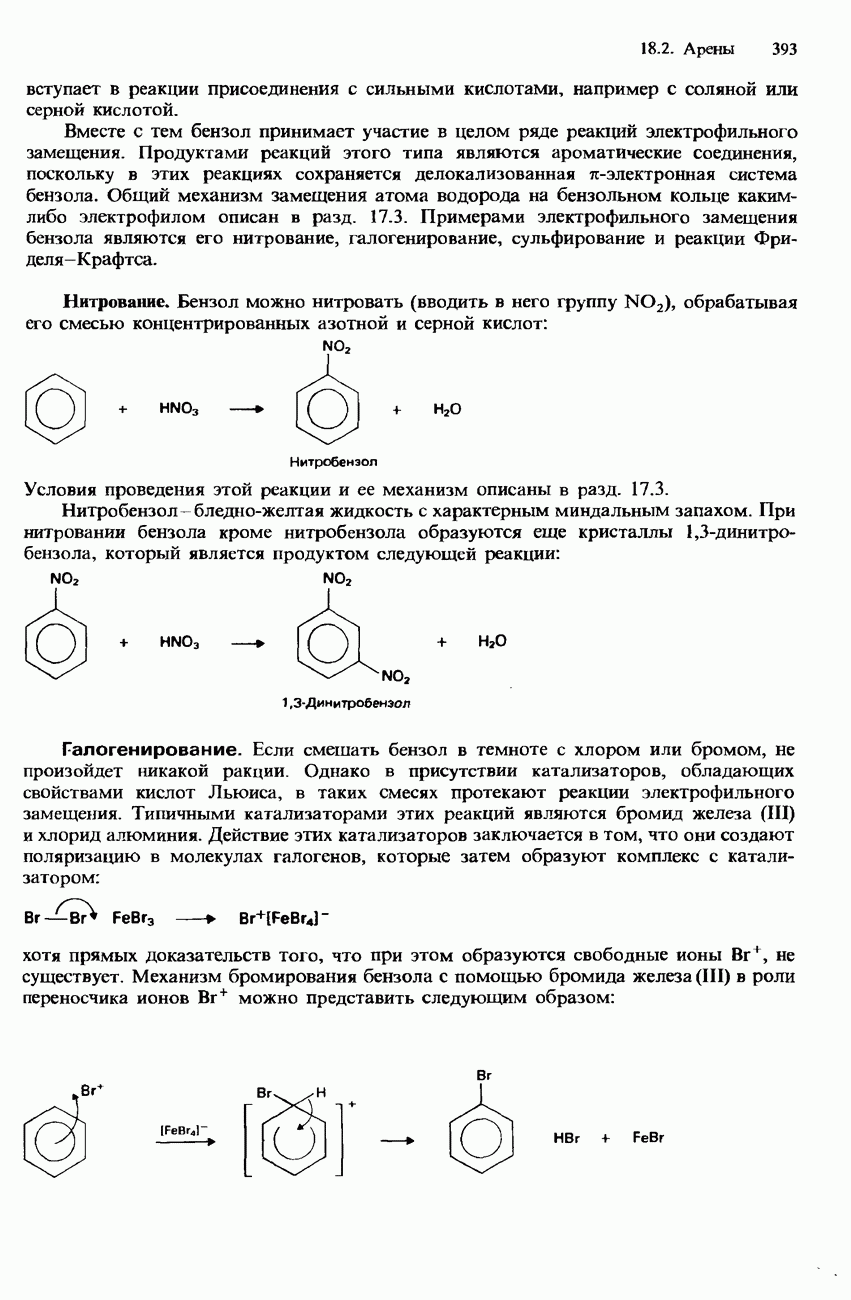
Гидролиз. При нагревании с обратным холодильником смеси галогеноалканов с водными растворами щелочей происходит гидролиз галогеноалканов с образованием спиртов. Например

В этой реакции обычно используется водный раствор гидроксида калия. Отметим, что при использовании этанольного раствора гидроксида калия происходит образование алкенов с отщеплением бромоводорода (см. ниже).
Гидролиз галогеноалканов происходит также при их кипячении со взвесью оксида серебра в воде. (Эта взвесь называется влажным оксидом серебра.)

Превращение соединений
Гидролиз является типичной реакцией для галогеноалканов. Общее уравнение гидролиза галогеноалканов можно записать следующим образом:

нагревание с обратным холодильником
Типичные реакции для соединений с различными функциональными группами указаны в заключительных частях каждого из разделов данной главы.
Превращение одного соединения в другое не всегда осуществимо в одну стадию. Например, чтобы превратить какой-либо галогеноалкан в карбоновую кислоту, необходимы по меньшей мере две стадии:

В избытке при уксусная подкислении кислота 
Вторая стадия представляет собой типичную реакцию для спиртов. Таким образом, превращения одного соединения в другое нередко могут осуществляться по нескольким путям (маршрутам). Эти маршруты превращения могут требовать проведения одной, двух, трех или нескольких стадий.
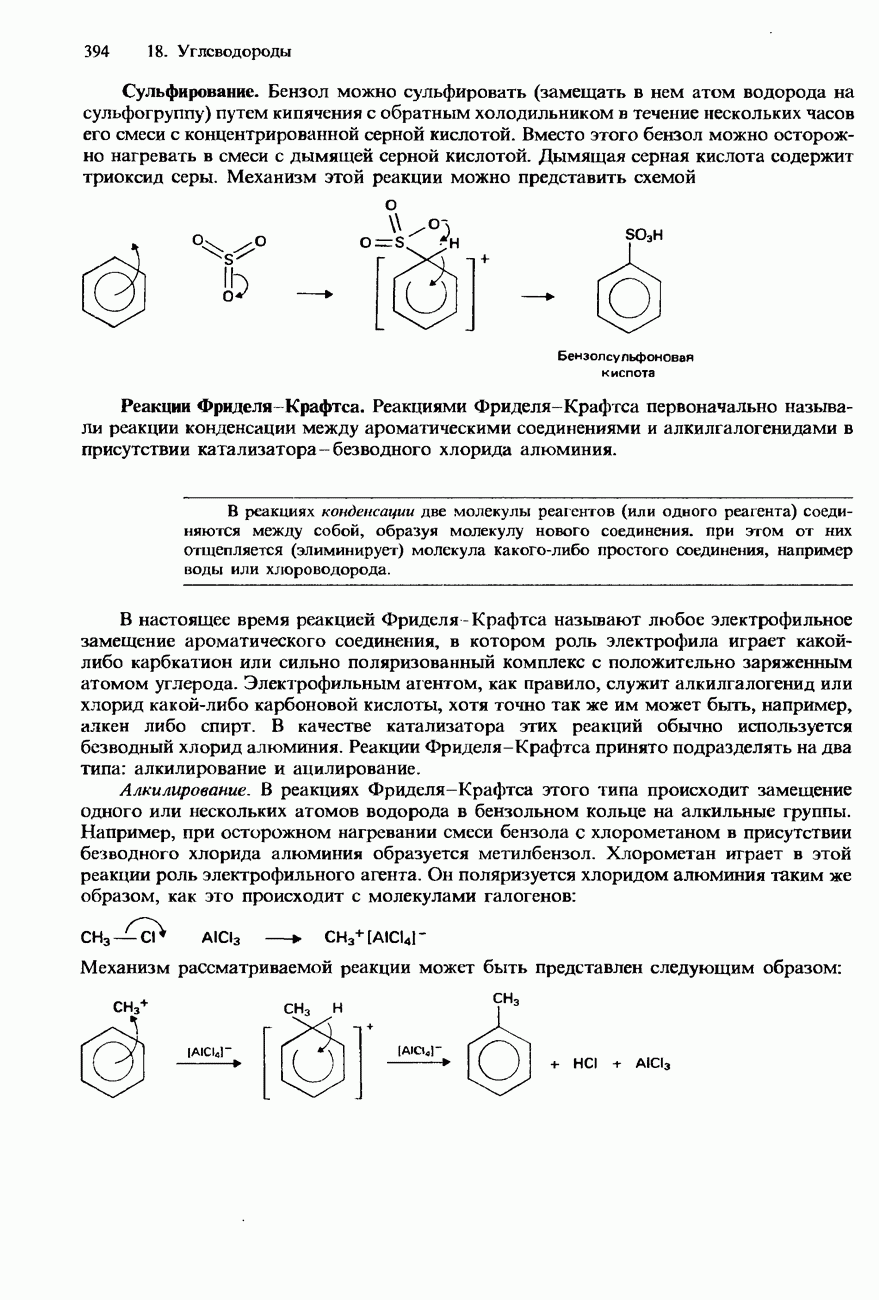
Синтез Вильямсона. При нагревании с обратным холодильником смеси какого-либо галогеноалкана со спиртовым раствором алкоксида (алкоголята) натрия происходит образование соответствующего эфира. Например

Эта реакция носит название синтез Вильямсона. Роль нуклеофила в ней играет анион  Алкоксид натрия получают по реакции натрия с соответствующим спиртом:
Алкоксид натрия получают по реакции натрия с соответствующим спиртом:

Образование сложных эфиров. При нагревании с обратным холодильником смеси какого-либо галогеноалкана с Натриевой или серебряной солью карбоновой кислоты образуется сложный эфир этой кислоты:

В этой реакции нуклеофилом является этаноатанион 
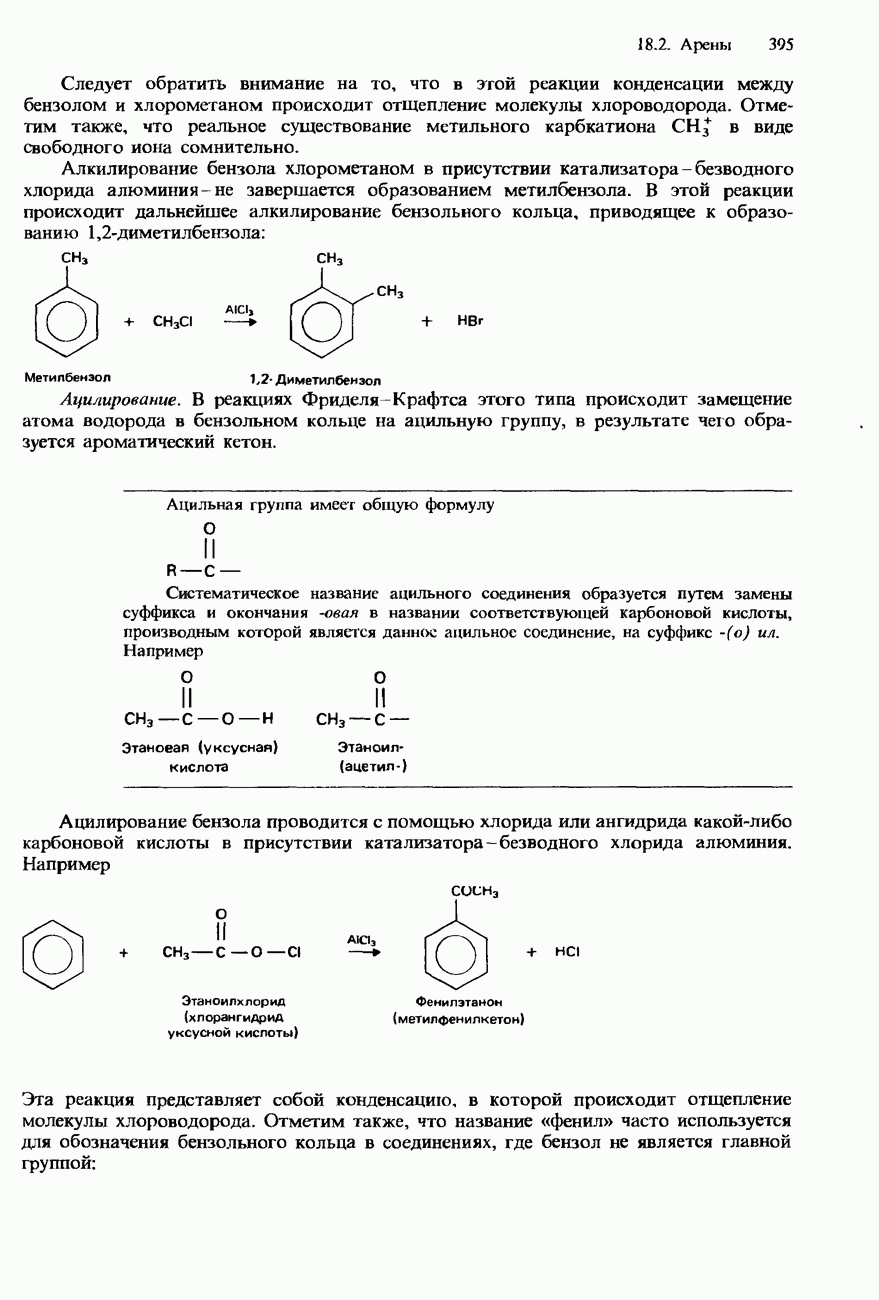
Образование нитрилов. При нагревании с обратным холодильником смеси какого-либо галогеноалкана с этанольным раствором натрия или цианида натрия происходит
образование соответствующего нитрила:

Поскольку в этой реакции происходит удлинение углеродного скелета на один атом углерода, такую реакцию можно рассматривать как средство восхождения в гомологическом ряду (см. ниже).
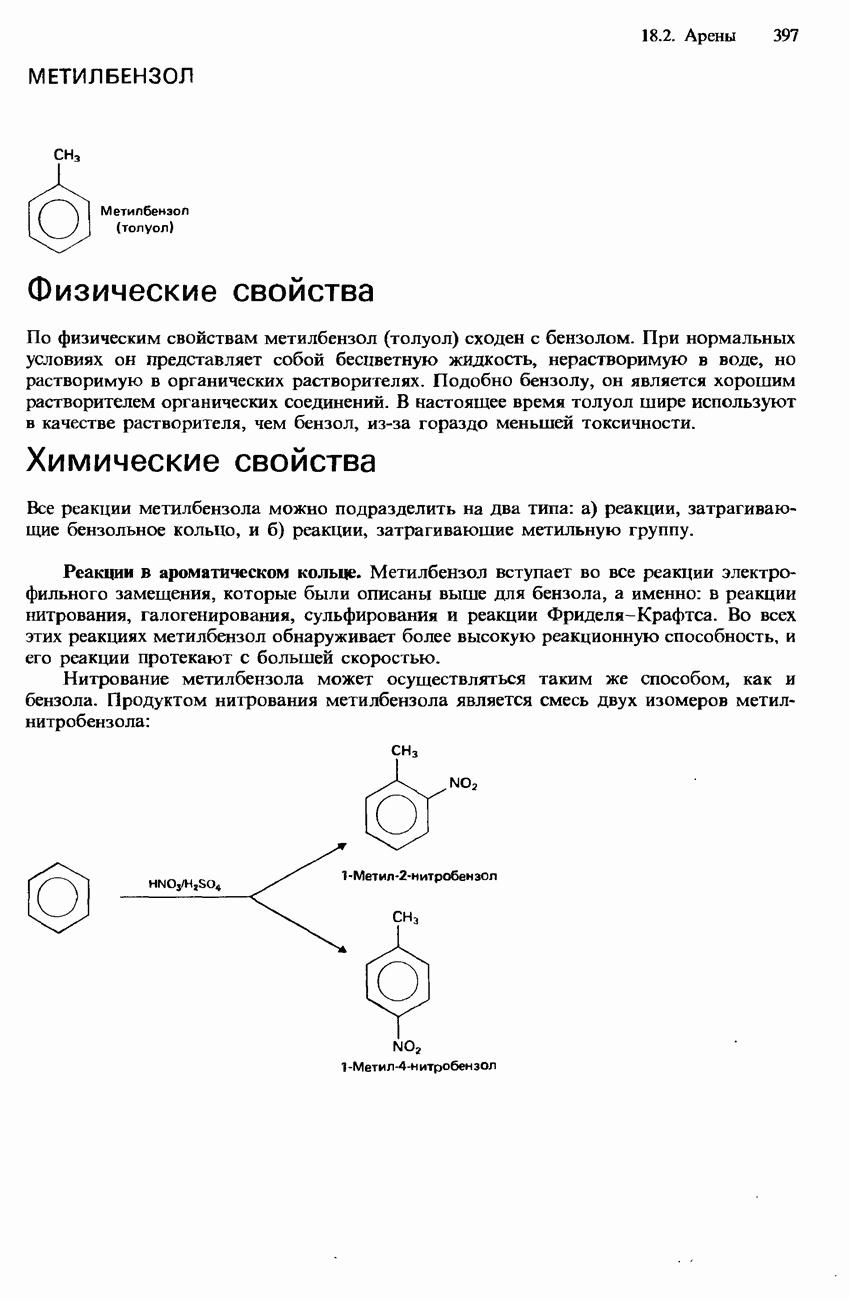
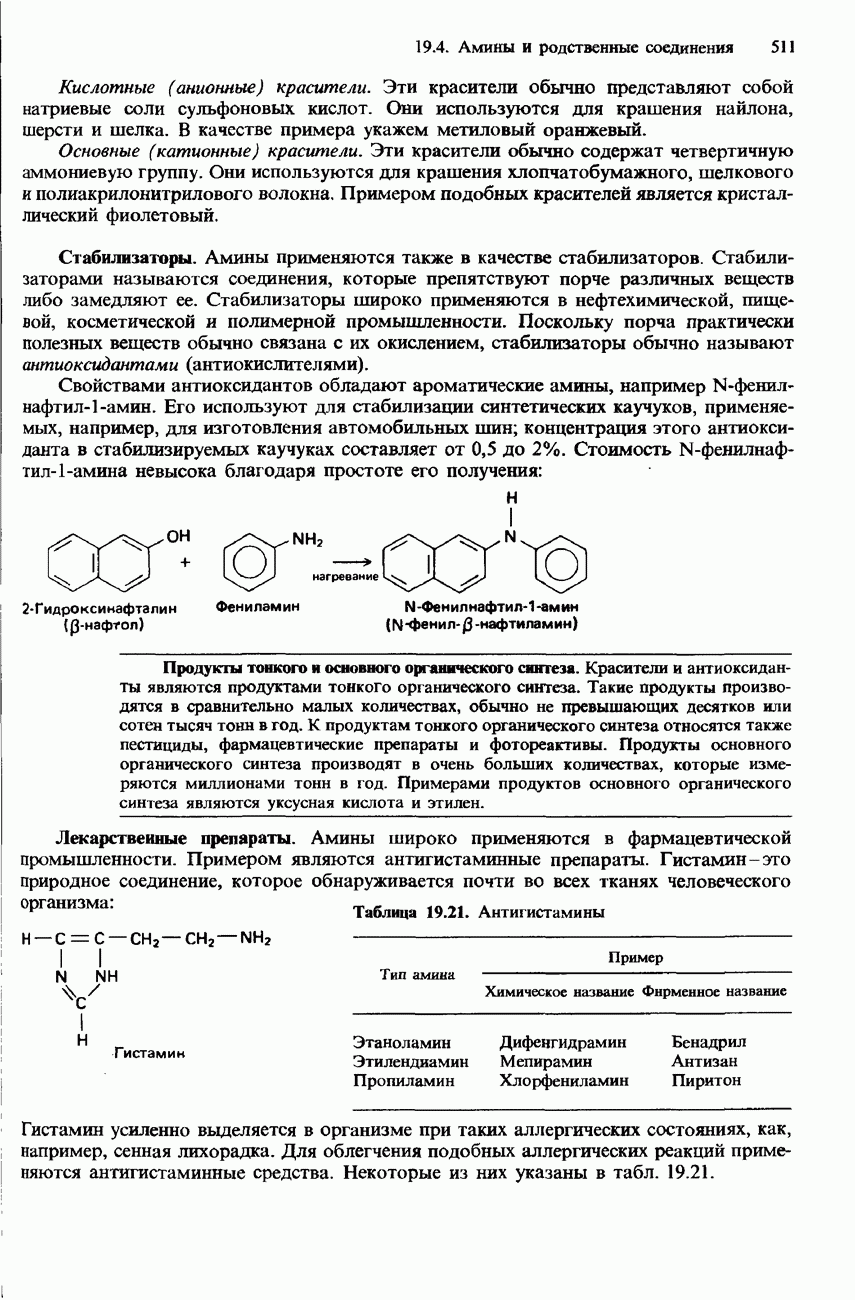
Реакция с аммиаком. При нагревании смеси какого-либо галогеноалкана с этанольным раствором аммиака образуется смесь первичного, вторичного и третичного аминов, а также четвертичной аммониевой соли. Например, при нагревании бромоэтана с этанольным раствором аммиака происходит образование следующих аминов:

Использование аммиака в избыточном количестве улучшает выход первичного амина:

Примеры восхождения в гомологическом ряду
Как превратить этановую (уксусную) кислоту в пропановую (пропионовую) кислоту? Решение
Один из возможных маршрутов такого превращения включает четыре стадии.
1. Этановую (уксусную) кислоту сначала превращают в этанол, обрабатывая ее тетрагидридоалюминатом(Ш) лития в сухом этоксиэтане (диэтиловом эфире):

2. Этанол превращают в иодоэтан при помощи реакции с концентрированной иодоводородной кислотой. Иодоводородную кислоту используют в момент выделения (in situ) по реакции между концентрированной серной кислотой и иодидом калия:

3. Иодоэтан нагревают с обратным холодильником в смеси с цианидом калия, в результате чего образуется пропаннитрил:

4. Наконец, натрил гидролизуют кипячением с разбавленной кислотой либо щелочью, в результате чего образуется пропионовая кислота:

Реакции элиминирования (отщепления)
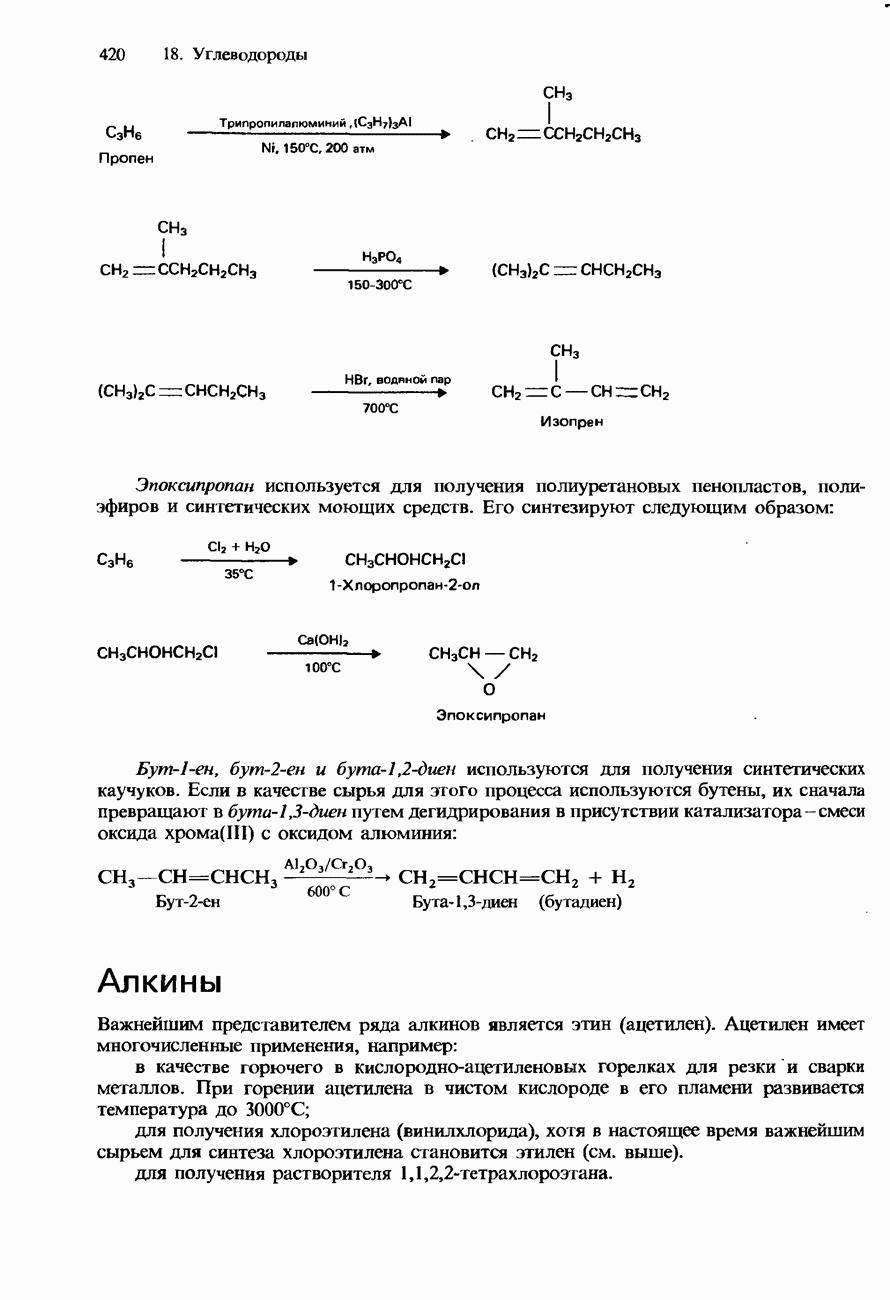
Если при нагревании (кипячении) с обратным холодильником какого-либо галогеноалкана используется его смесь не с водным, а с этанольным раствором гидроксида калия, то происходит отщепление водорода и галогена, приводящее к образованию соответствующего алкена:

Механизм реакций этого типа описан в разд. 17.3. Как было указано в этом разделе, реакции отщепления и нуклеофильного замещения способны протекать одновременно. Преобладание одной из них определяется конкретными условиями.
При нагревании с обратным холодильником смеси какого-либо дигалогеноалкана с этанольным раствором гидроксида калия происходит образование соответствующего алкина:

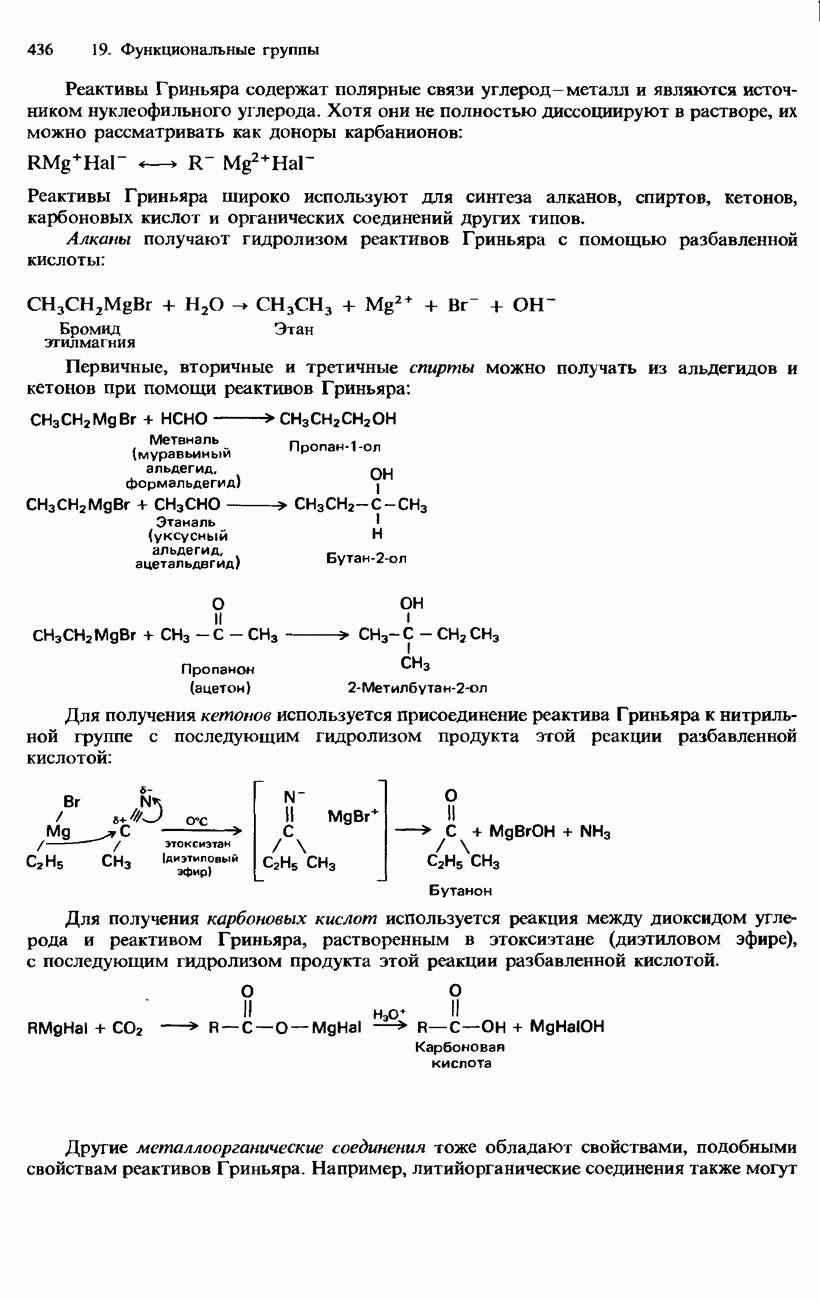
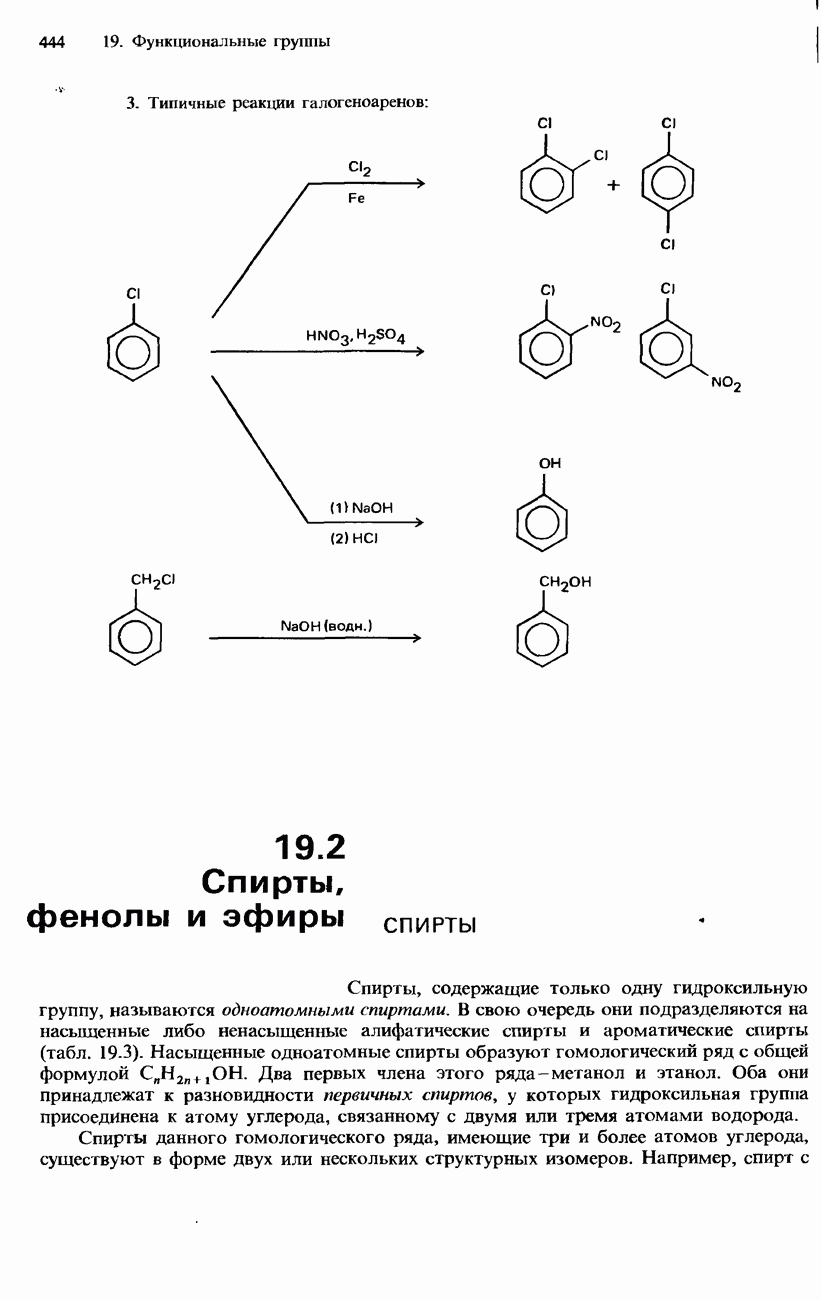
Реактивы Гриньяра
Так называют органические соединения магния, имеющие общую формулу  . Они образуются в результате реакции магния с галогеноалканами в сухом этоксиэтане (диэтиловом эфире):
. Они образуются в результате реакции магния с галогеноалканами в сухом этоксиэтане (диэтиловом эфире):

В качестве растворителя для проведения этой реакции используется также тетрагидрофуран:


Франсуа Виктор Гриньяр (1871—1935), французский химик. Гриньяр опубликовал свою первую работу по реакциям магний органических соединений в обезвоженном эфире в 1901 г. В 1912 г. ему была присуждена Нобелевская премия по химии за открытие реактивов, которые получили впоследствии его имя. В 1919 г. Гриньяр стал профессором химии в Лионе.
Реактивы Гриньяра содержат полярные связи углерод—металл и являются источником нуклеофильного углерода. Хотя они не полностью диссоциируют в растворе, их можно рассматривать как доноры карбанионов:

Реактивы Гриньяра широко используют для синтеза алканов, спиртов, кетонов, карбоновых кислот и органических соединений других типов.
Алканы получают гидролизом реактивов Гриньяра с помощью разбавленной кислоты:

Первичные, вторичные и третичные спирты можно получать из альдегидов и кетонов при помощи реактивов Гриньяра:

Для получения кетонов используется присоединение реактива Гриньяра к нитрильной группе с последующим гидролизом продукта этой реакции разбавленной кислотой:

Для получения карбоновых кислот используется реакция между диоксидом углерода и реактивом Гриньяра, растворенным в этоксиэтане (диэтиловом эфире), с последующим гидролизом продукта этой реакции разбавленной кислотой.

Другие металлоорганические соединения тоже обладают свойствами, подобными свойствам реактивов Гриньяра. Например, литийорганические соединения также могут
служить источником нуклеофильного углерода:

Подобно реактивам Гриньяра, алкиллитиевые соединения тоже можно получать из соответствующих галогеноалканов. Например,

| << Предыдущий параграф | Следующий параграф >> |
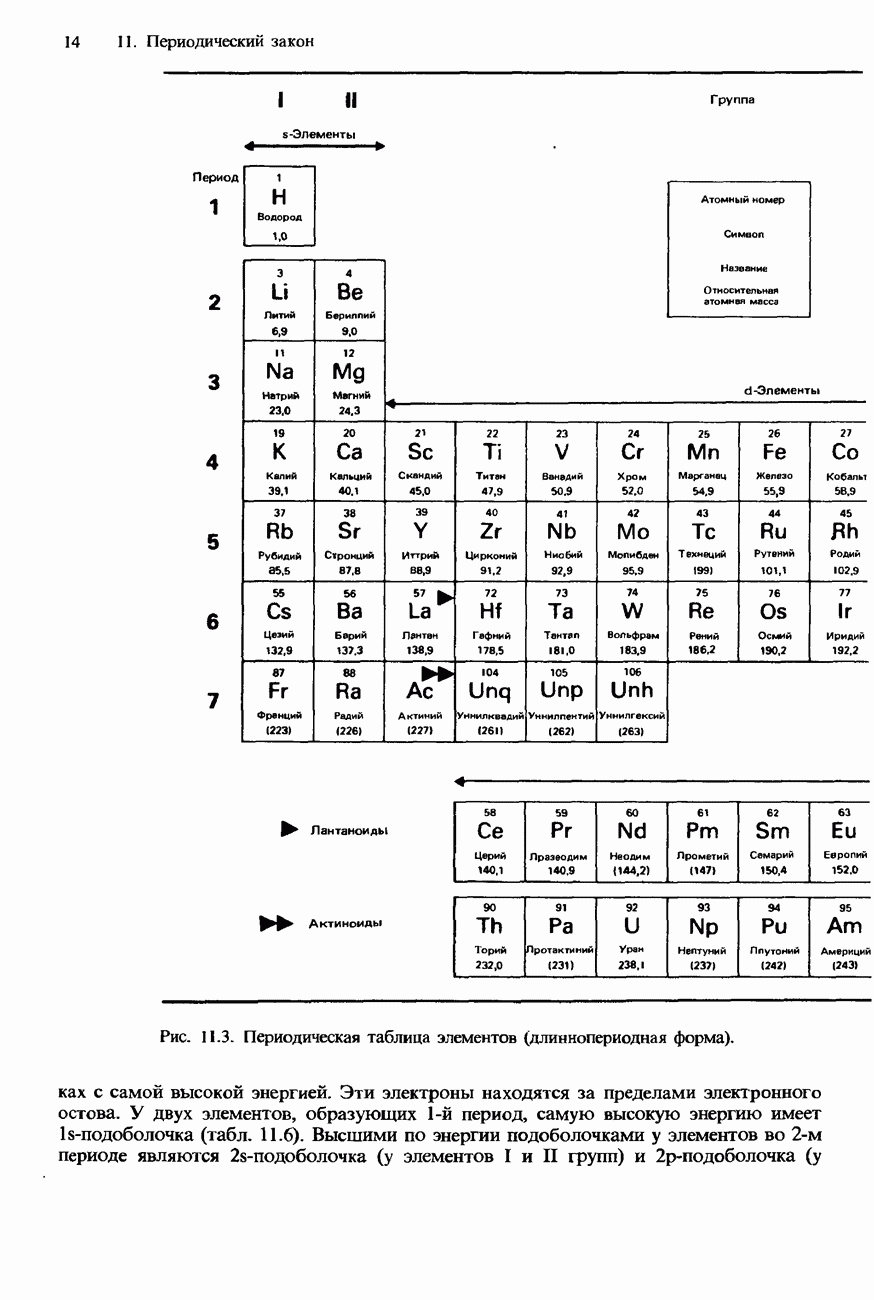
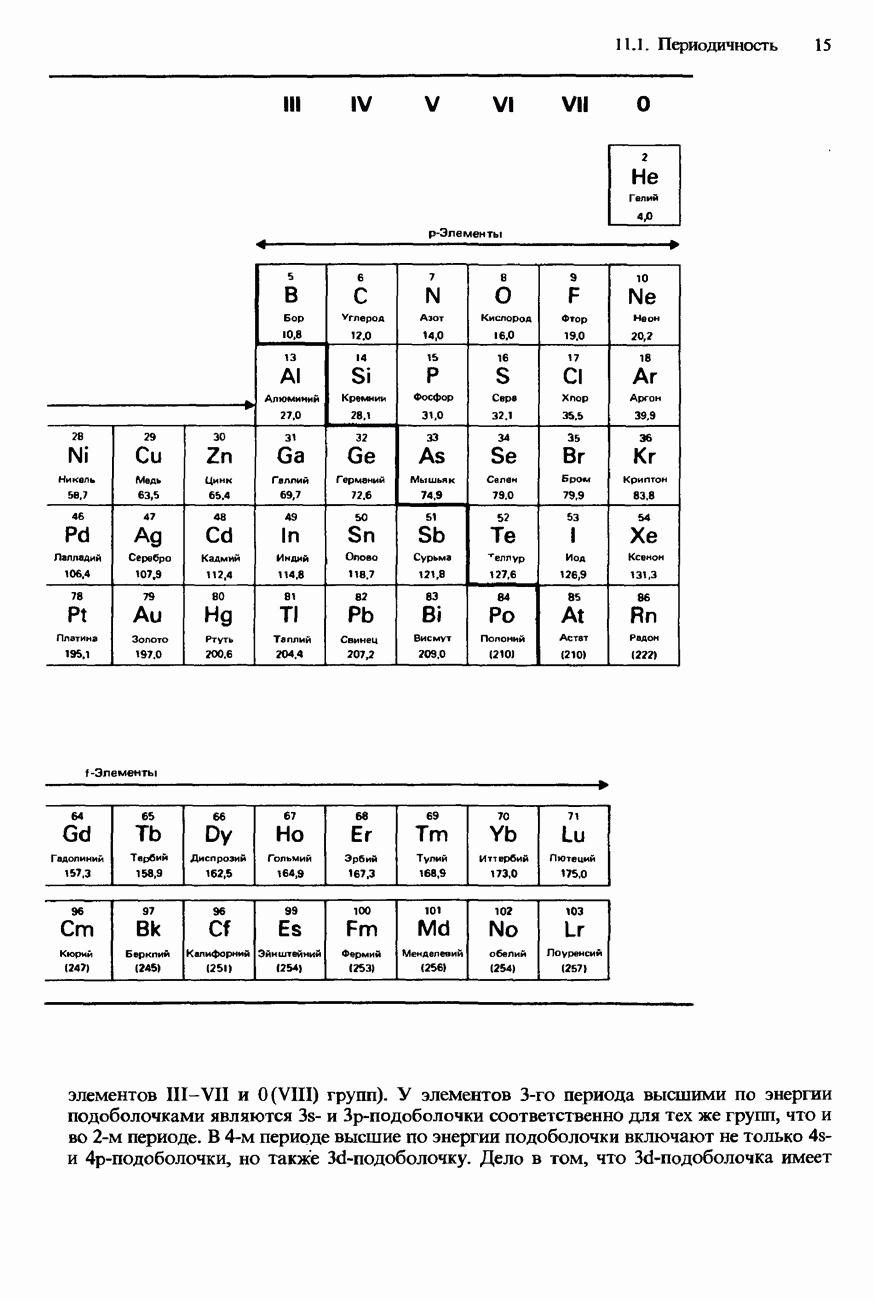
- 11. ПЕРИОДИЧЕСКИЙ ЗАКОН
- 11.1 Периодичность
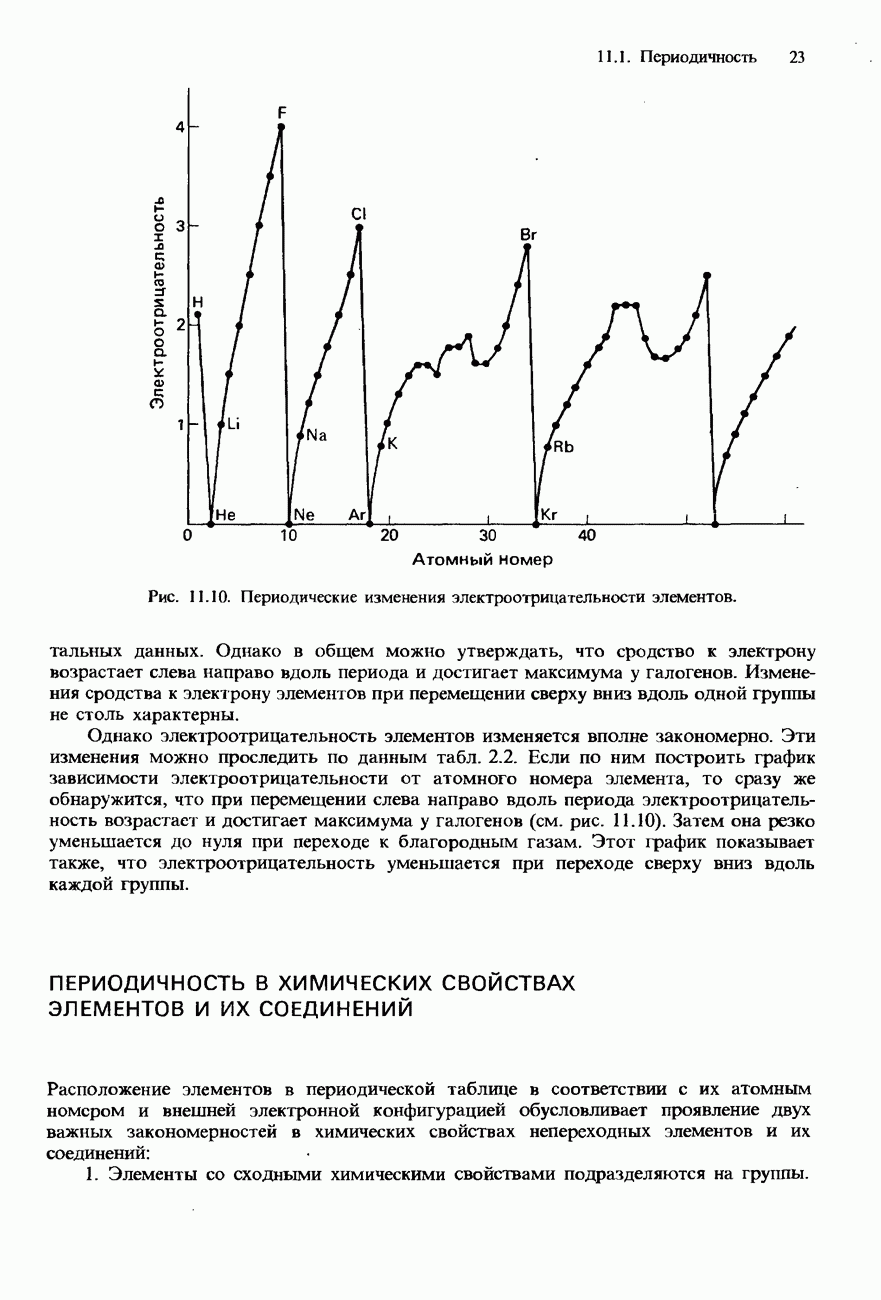
- СОВРЕМЕННАЯ ФОРМА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
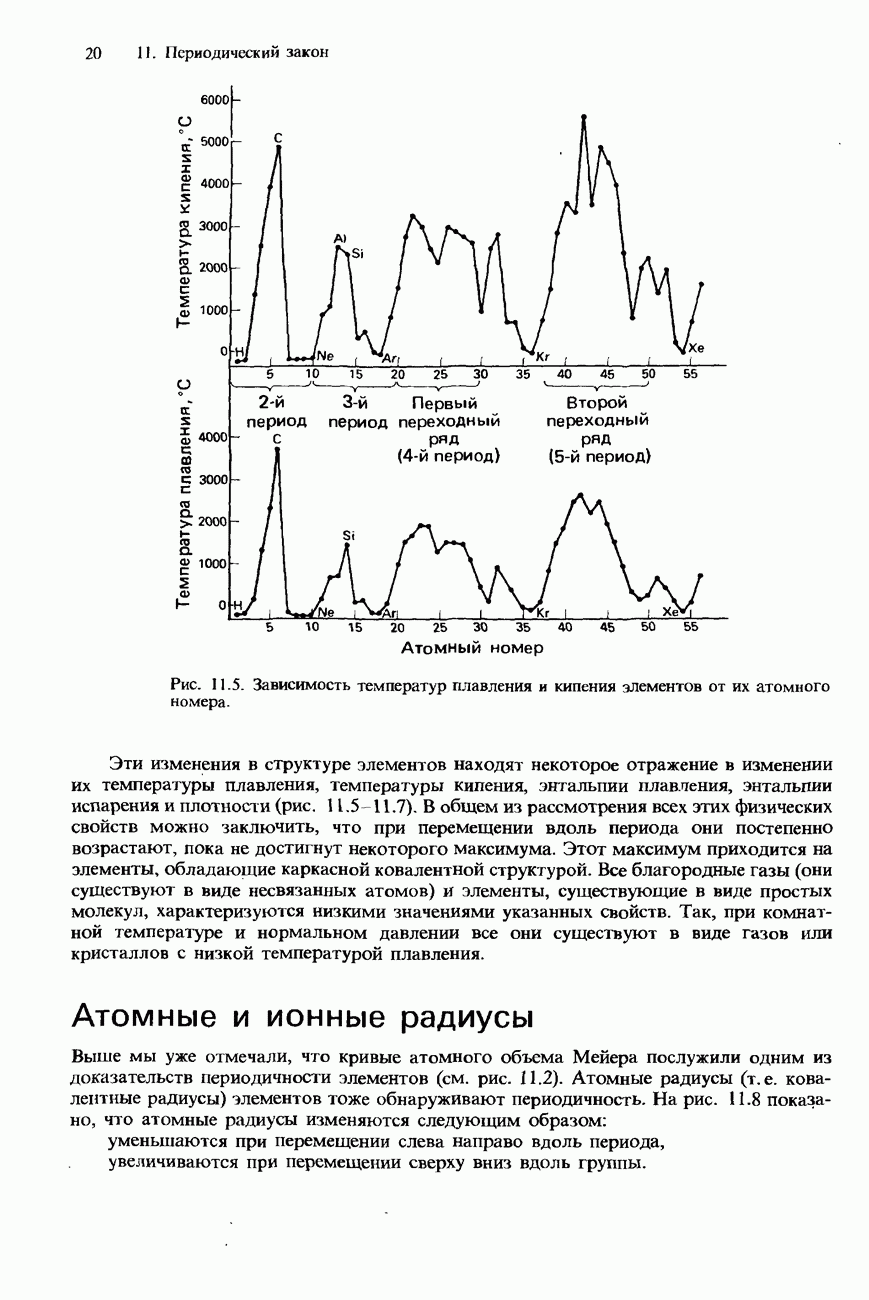
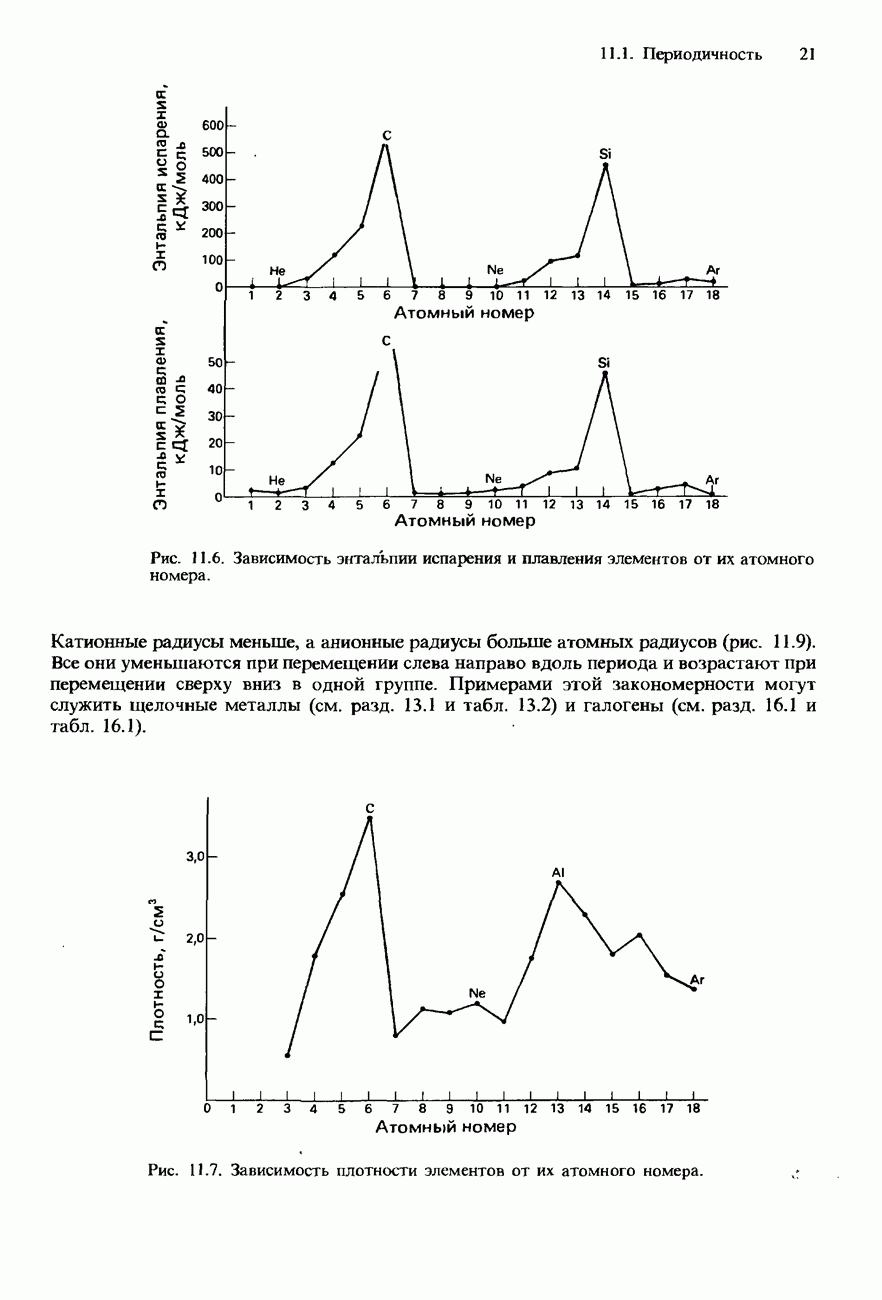
- ПЕРИОДИЧНОСТЬ
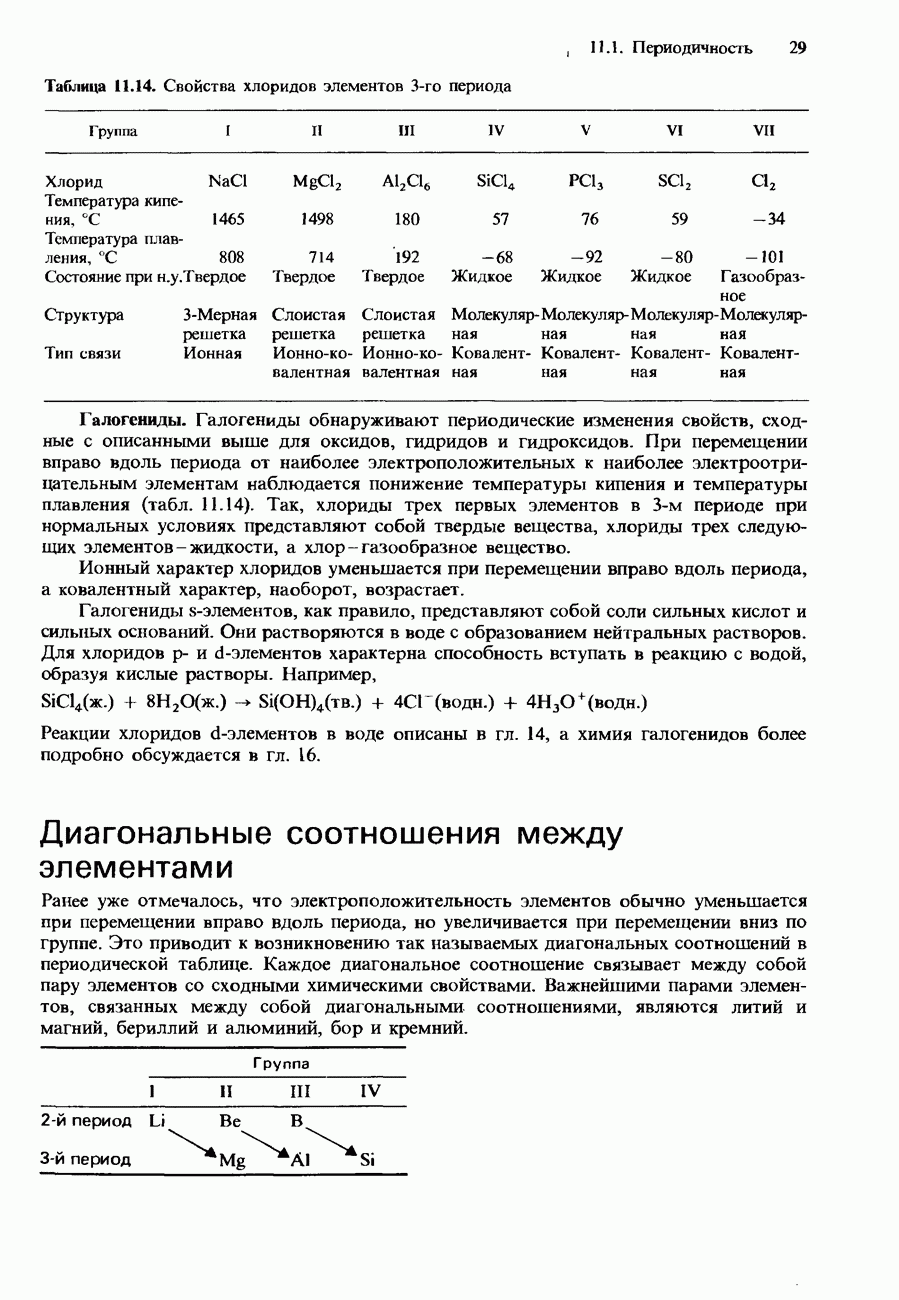
- ПЕРИОДИЧНОСТЬ В ХИМИЧЕСКИХ СВОЙСТВАХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 12. ВОДОРОД И ВОДА
- 12.1. ВОДОРОД
- ПОЛУЧЕНИЕ ВОДОРОДА В ЛАБОРАТОРНЫХ УСЛОВИЯХ
- РАЗЛИЧНЫЕ ФОРМЫ ВОДОРОДА
- ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
- ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
- ТИПЫ СОЕДИНЕНИЙ ВОДОРОДА
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПОЛУЧЕНИЕ И ИСПОЛЬЗОВАНИЕ ВОДОРОДА
- 12.2 Вода
- ХИМИЧЕСКИЕ РЕАКЦИИ С УЧАСТИЕМ ВОДЫ
- ИСТОЧНИКИ ПРЕСНОЙ ВОДЫ И ЕЕ ИСПОЛЬЗОВАНИЕ
- КАЧЕСТВО ВОДЫ
- ЗАГРЯЗНЕНИЕ ВОДЫ
- ОЧИСТКА И ПОДГОТОВКА ВОДЫ
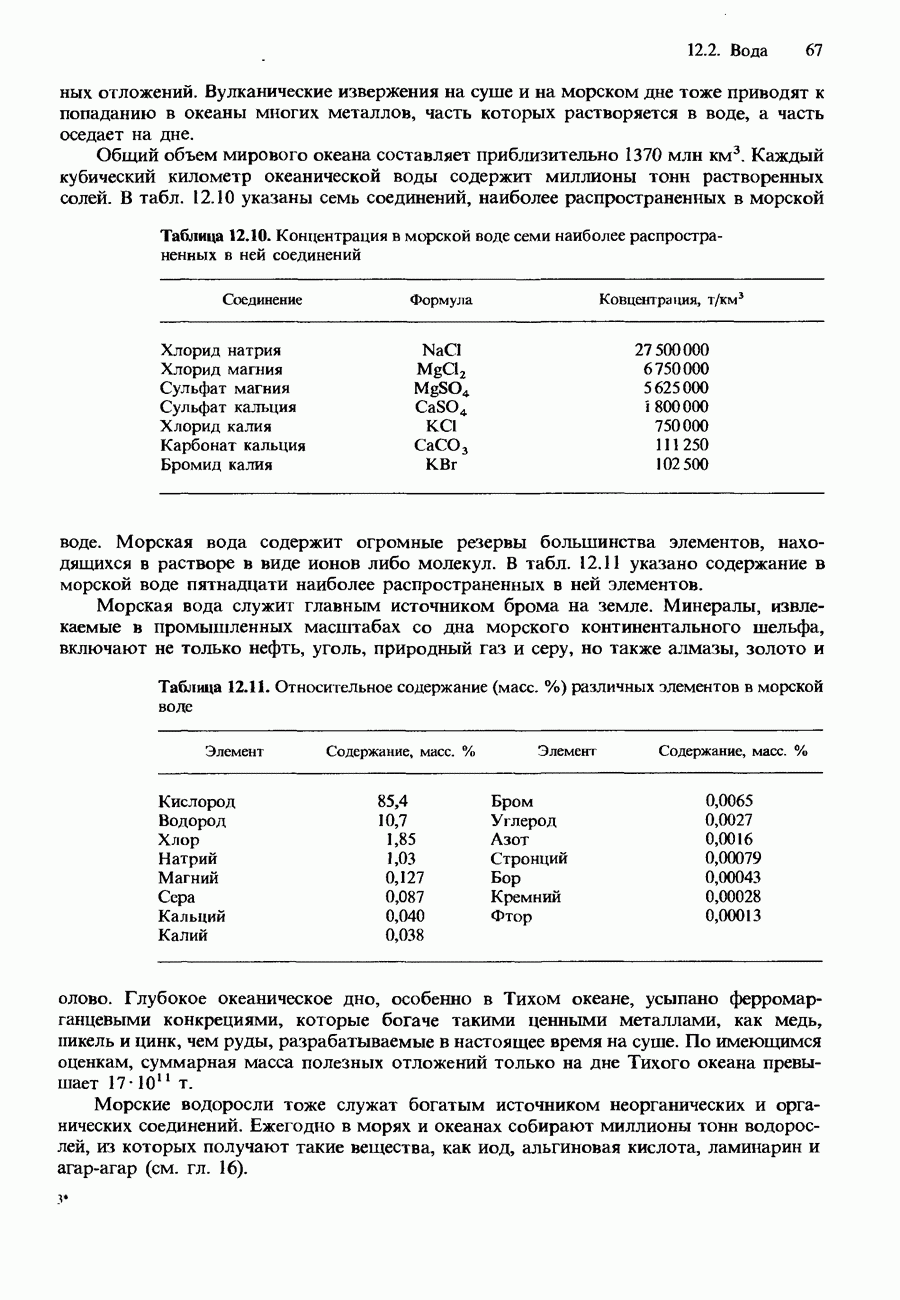
- ОКЕАНЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 13. s-Металлы
- 13.1 Структура и свойства s-металлов
- СТРУКТУРА
- ФИЗИЧЕСКИЕ СВОЙСТВА
- РЕАКЦИОННАЯ СПОСОБНОСТЬ S-МЕТАЛЛОВ
- 13.2 Соединения, образуемые s-металлами
- ДРУГИЕ БИНАРНЫЕ СОЕДИНЕНИЯ
- ГИДРОКСИДЫ
- КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
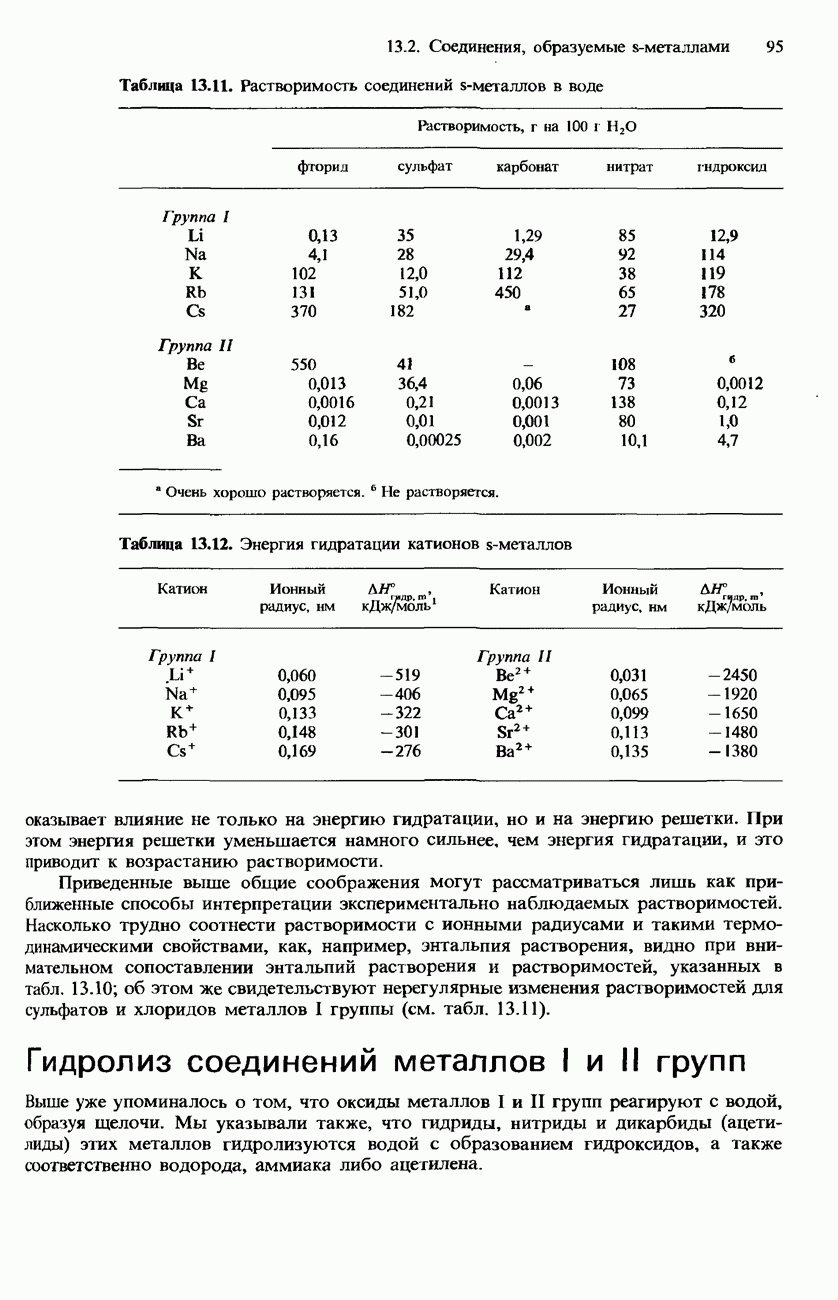
- ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ ОКСОСОЕДИНЕНИЙ S-МЕТАЛЛОВ
- РАСТВОРИМОСТЬ СОЛЕЙ И ГИДРОКСИДОВ МЕТАЛЛОВ I И II ГРУПП В ВОДЕ
- АНОМАЛЬНЫЕ СВОЙСТВА ЛИТИЯ И БЕРИЛЛИЯ, А ТАКЖЕ ИХ СОЕДИНЕНИЙ
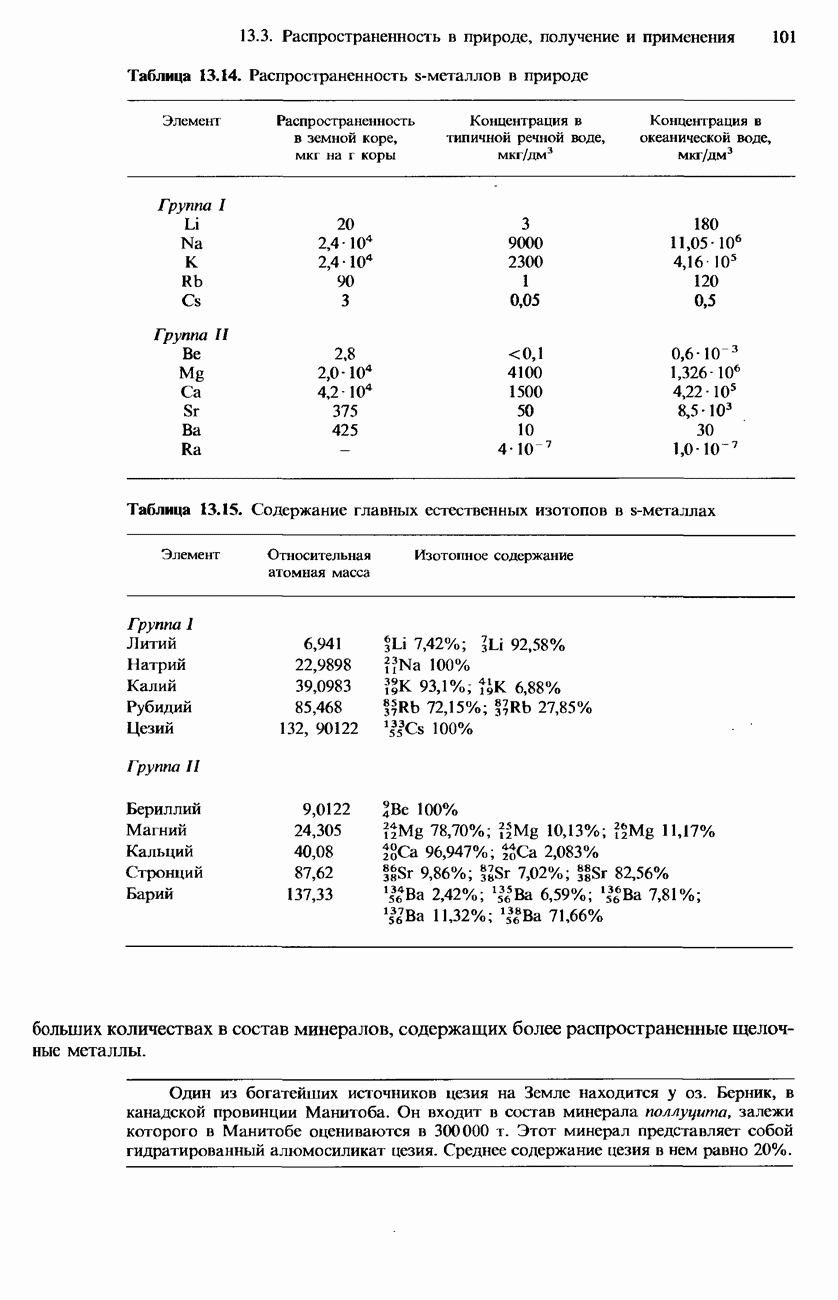
- 13.3. Распространенность в природе, получение и применение
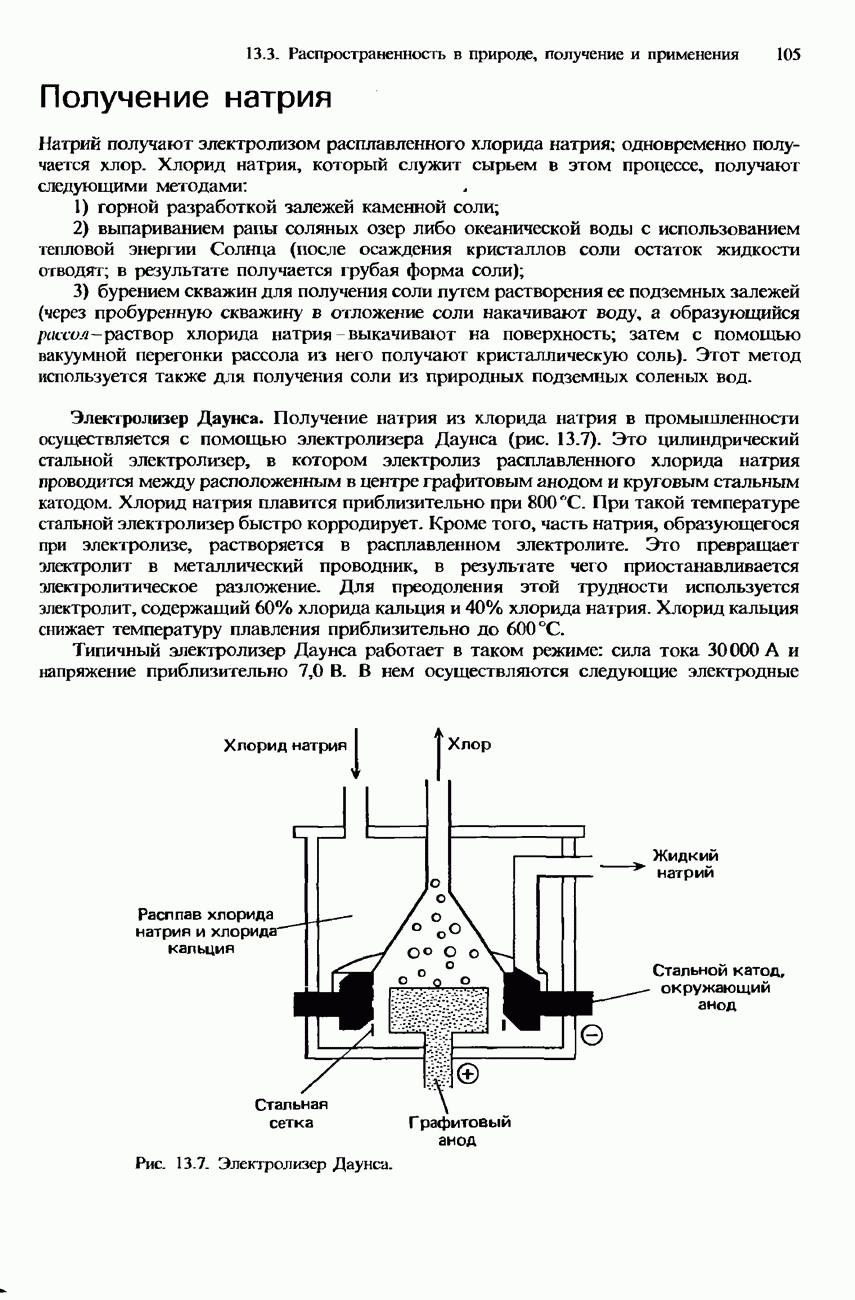
- ПОЛУЧЕНИЕ S-МЕТАЛЛОВ
- ПОЛУЧЕНИЕ СОЕДИНЕНИЙ S-МЕТАЛЛОВ
- ПРИМЕНЕНИЕ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 14. d-ЭЛЕМЕНТЫ
- 14.1. Структура и свойства d-элементов
- d-ЭЛЕМЕНТЫ
- ФИЗИЧЕСКИЕ СВОЙСТВА
- ХИМИЧЕСКИЕ СВОЙСТВА
- 14.2 Химия семи d-элементов
- МАРГАНЕЦ
- ЖЕЛЕЗО
- КОБАЛЬТ
- НИКЕЛЬ
- МЕДЬ
- ЦИНК
- 14.3. Распространенность в природе, получение и применения
- ПРОИЗВОДСТВО ЖЕЛЕЗА И СТАЛИ
- ПОЛУЧЕНИЕ ДРУГИХ МЕТАЛЛОВ ПЕРВОГО ПЕРЕХОДНОГО РЯДА
- ПРИМЕНЕНИЯ d-ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 15. ЭЛЕМЕНТЫ III-VI ГРУПП
- 15.1. Алюминий и другие элементы III группы
- БОР
- ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ
- ПРИМЕНЕНИЯ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ
- 15.2. IV группа периодической системы
- СОЕДИНЕНИЯ
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ ИЗ РУД
- ПРИМЕНЕНИЯ УГЛЕРОДА
- ПРИМЕНЕНИЯ КРЕМНИЯ
- ПРИМЕНЕНИЯ ГЕРМАНИЯ, ОЛОВА И СВИНЦА
- 15.3. Элементы V группы
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЯ АЗОТА И ФОСФОРА
- СОЕДИНЕНИЯ АЗОТА
- СОЕДИНЕНИЯ ФОСФОРА
- 15.4. Элементы VI группы. Кислород и сера
- КИСЛОРОД
- СОЕДИНЕНИЯ КИСЛОРОДА
- СЕРА
- СОЕДИНЕНИЯ СЕРЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 16. ГАЛОГЕНЫ И БЛАГОРОДНЫЕ ГАЗЫ
- 16.1. Галогены
- ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ ГАЛОГЕНОВ
- ЛАБОРАТОРНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ ГАЛОГЕНОВ
- ФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА
- РЕАКЦИОННАЯ СПОСОБНОСТЬ ГАЛОГЕНОВ
- 16.2. Соединения галогенов
- ГАЛОГЕНОВОДОРОДЫ
- КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ГАЛОГЕНОВ
- 16.3. Распространенность, получение и применение галогенов и их соединений
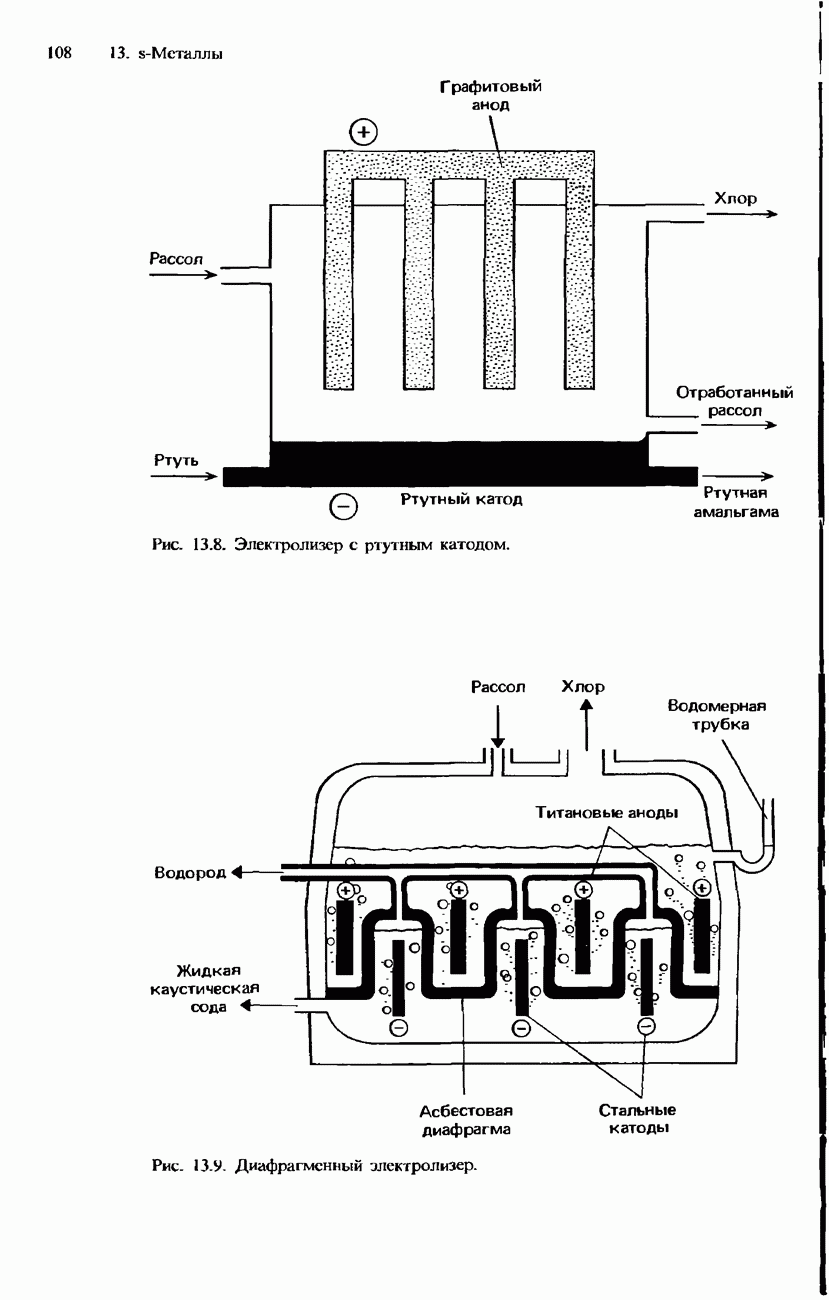
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ХЛОРА
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ДРУГИХ ГАЛОГЕНОВ
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ СОЕДИНЕНИЙ ХЛОРА
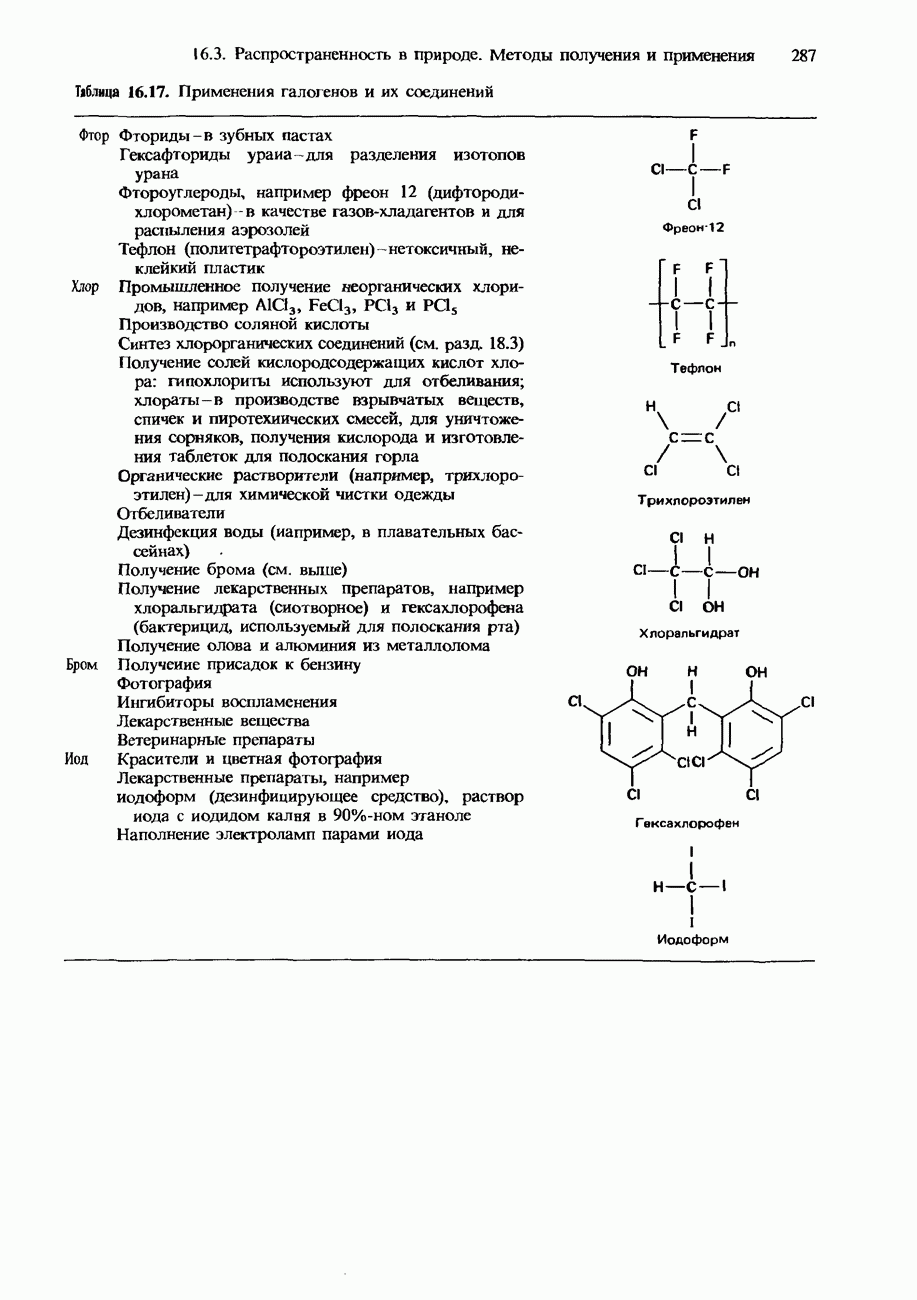
- ПРИМЕНЕНИЯ ГАЛОГЕНОВ И ИХ СОЕДИНЕНИЙ
- ТОКСИЧНОСТЬ ХЛОРСОДЕРЖАЩИХ ПРОДУКТОВ
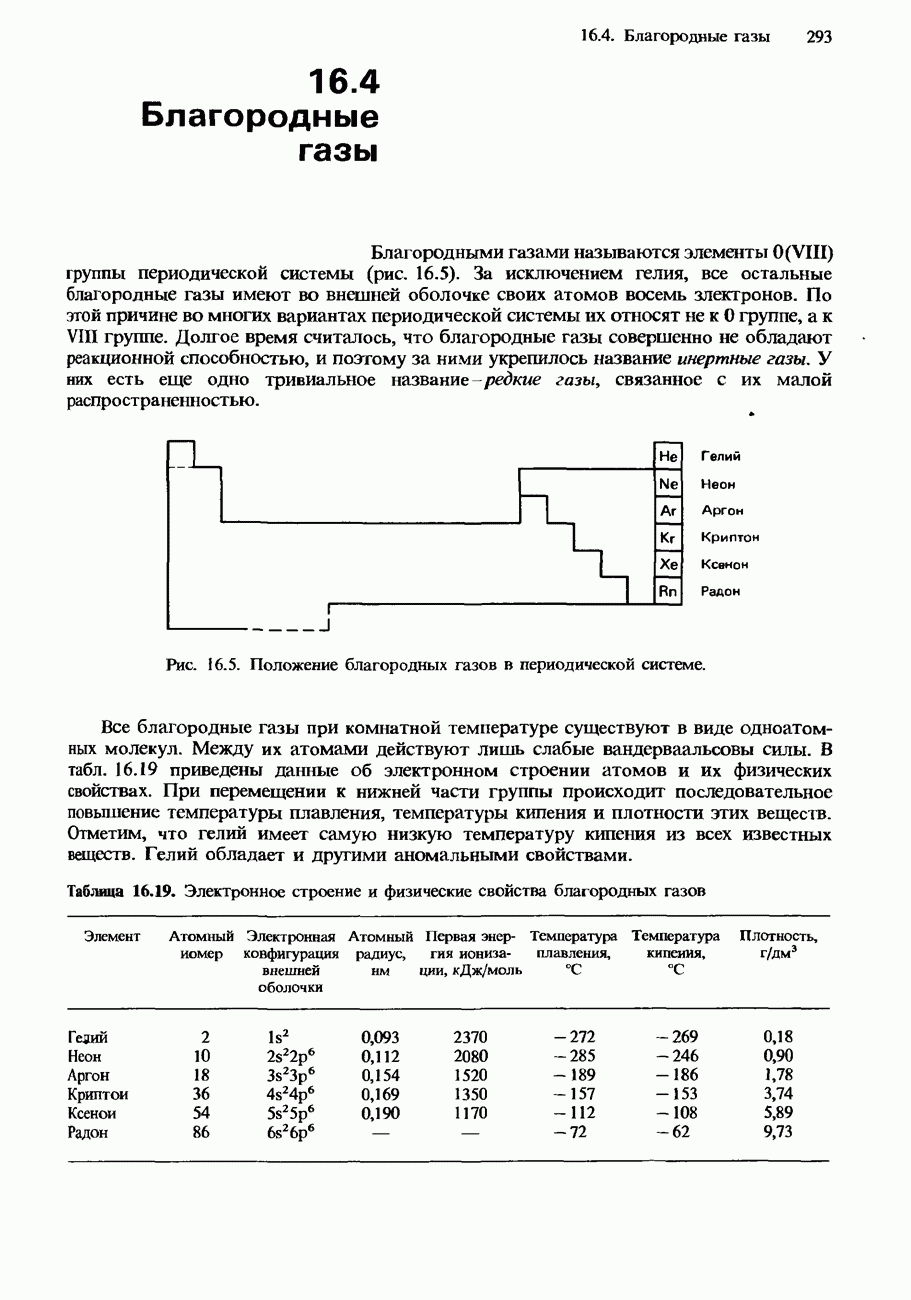
- 16.4. Благородные газы
- СОЕДИНЕНИЯ БЛАГОРОДНЫХ ГАЗОВ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 17. ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
- 7.1. Органическая химия
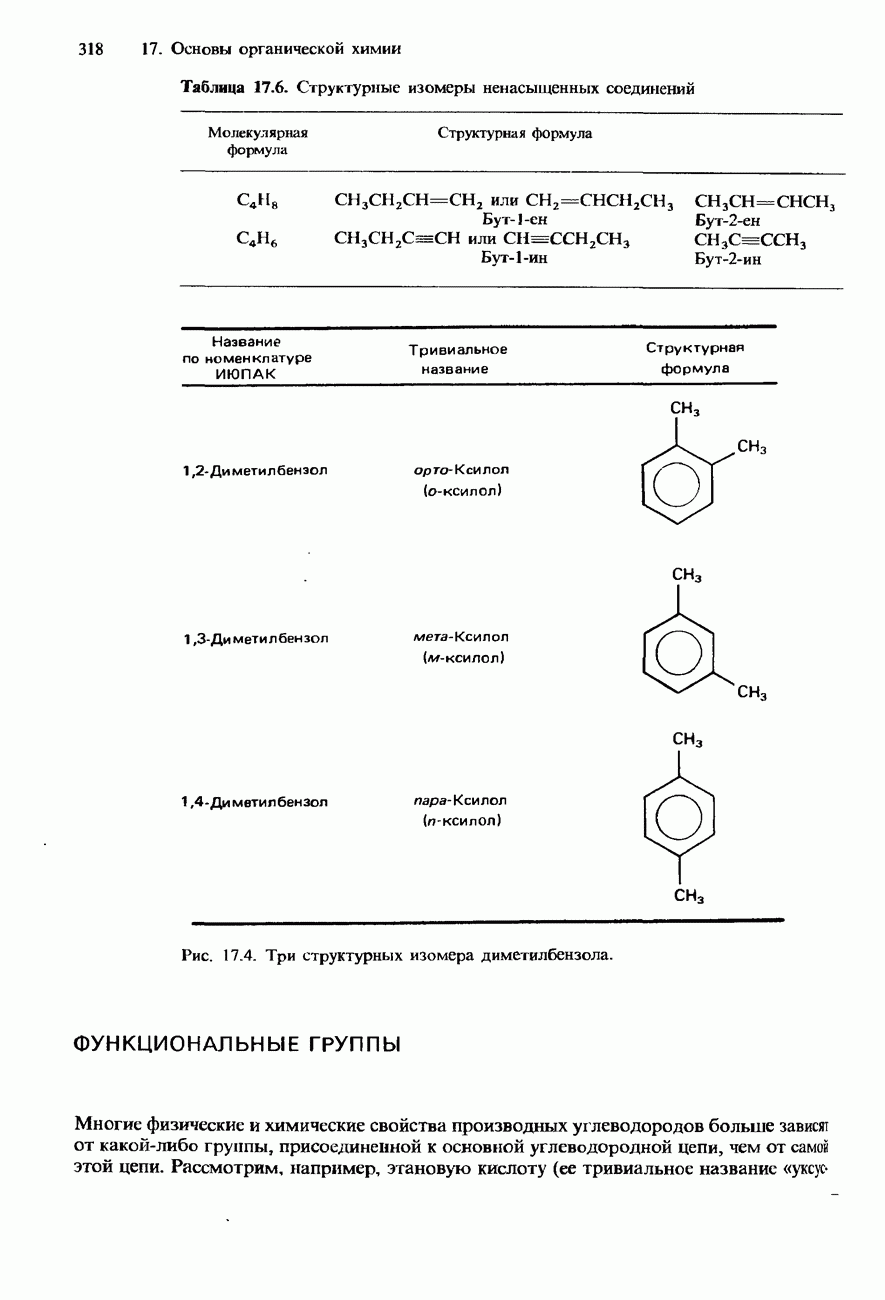
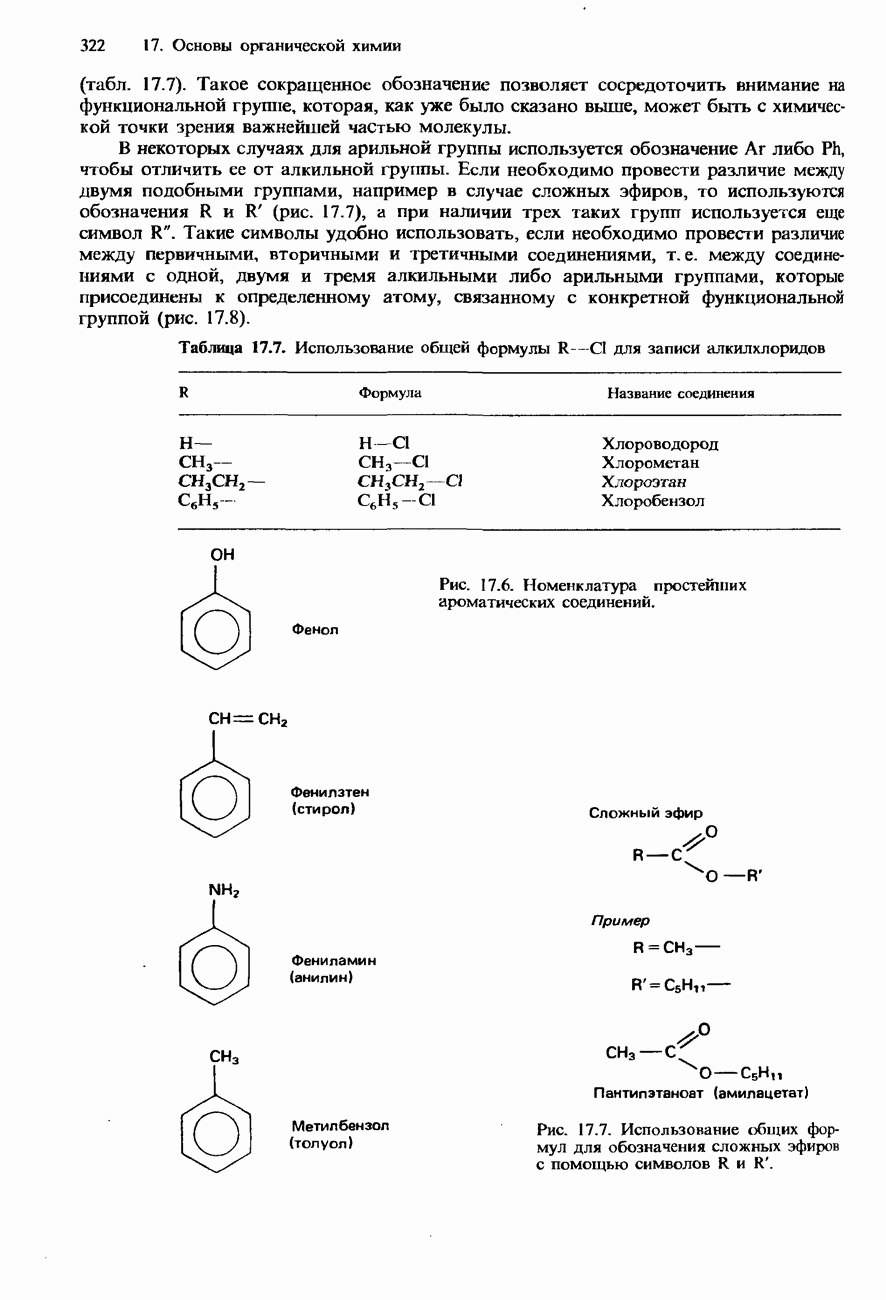
- НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- УГЛЕВОДОРОДЫ
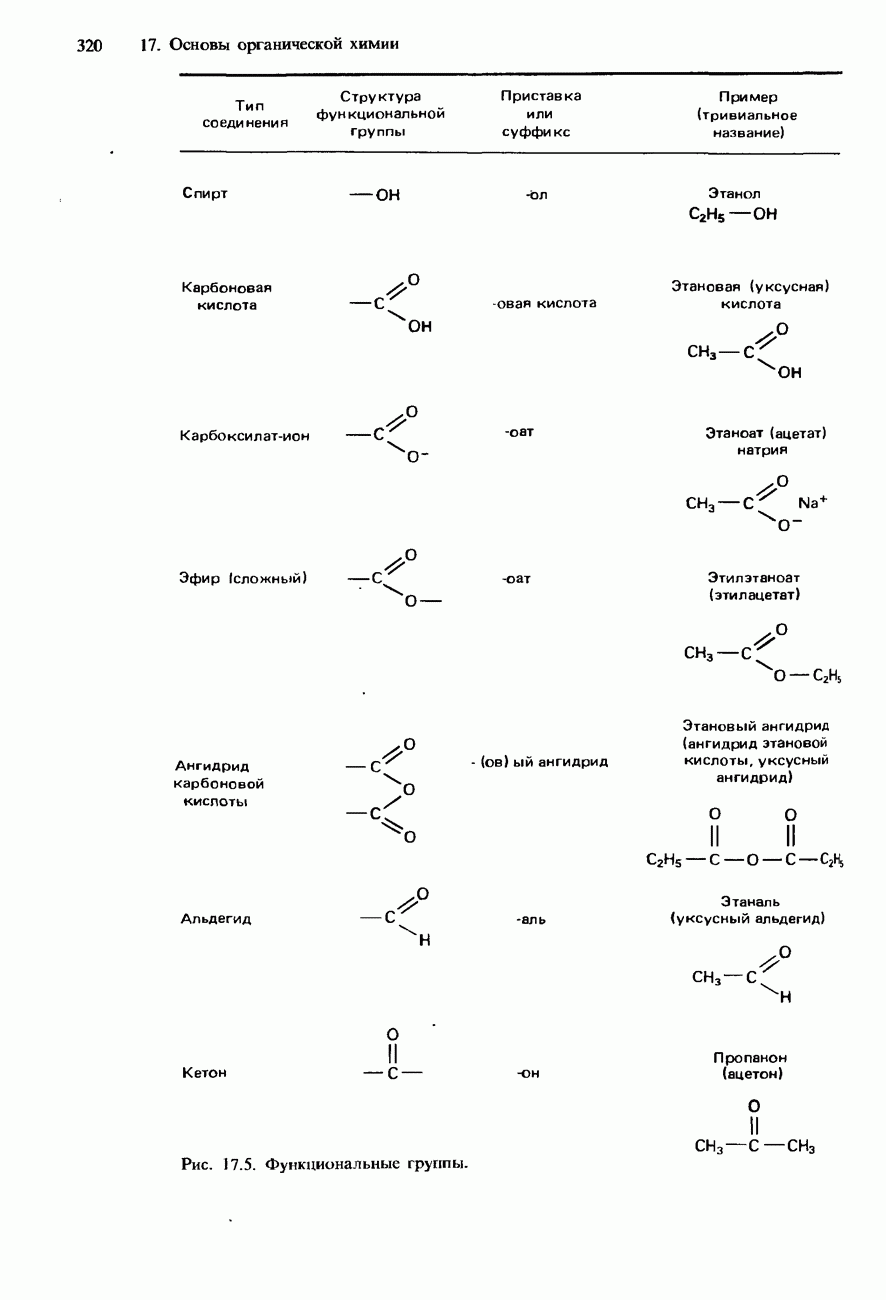
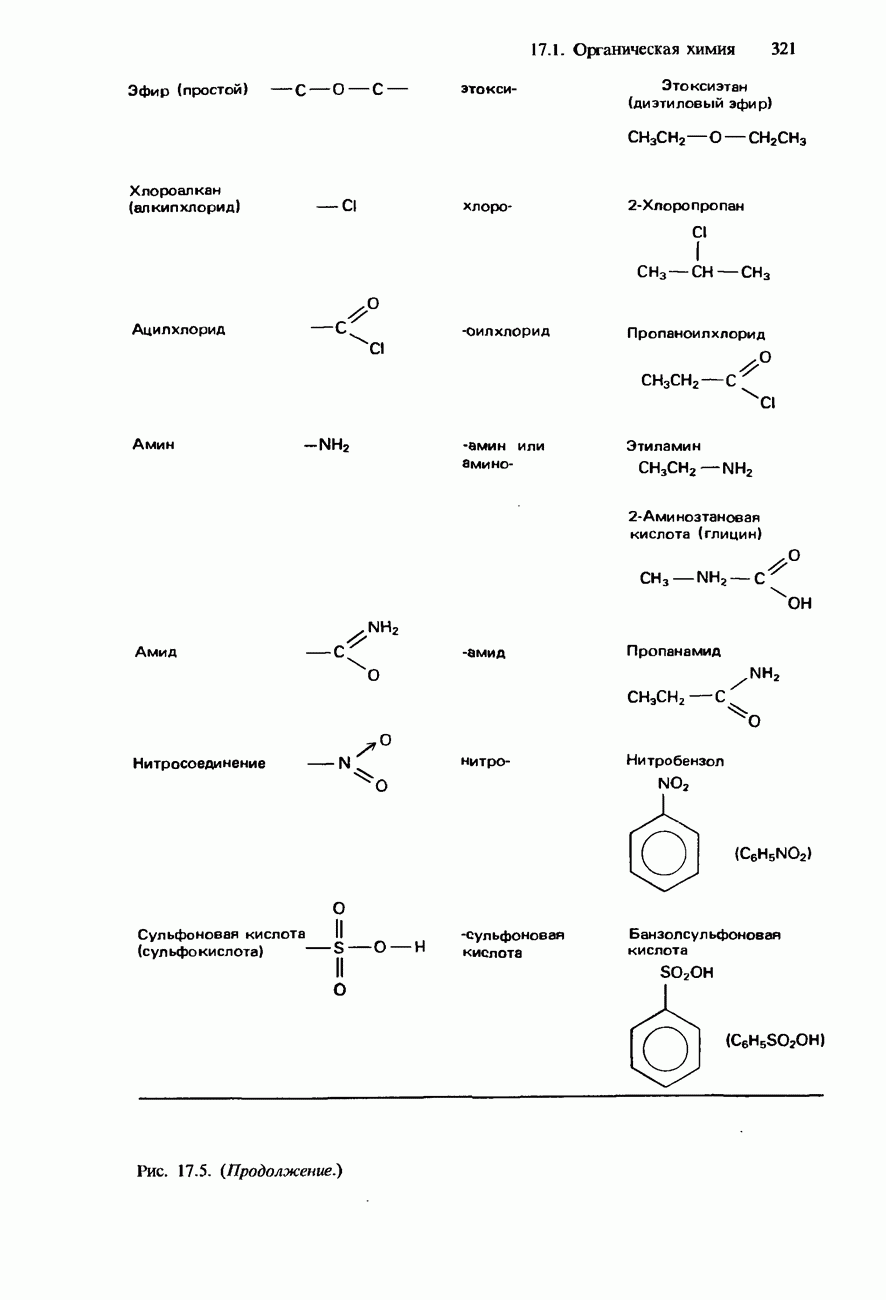
- ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
- ФИЗИЧЕСКИЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- ПОЛУЧЕНИЕ И ИДЕНТИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
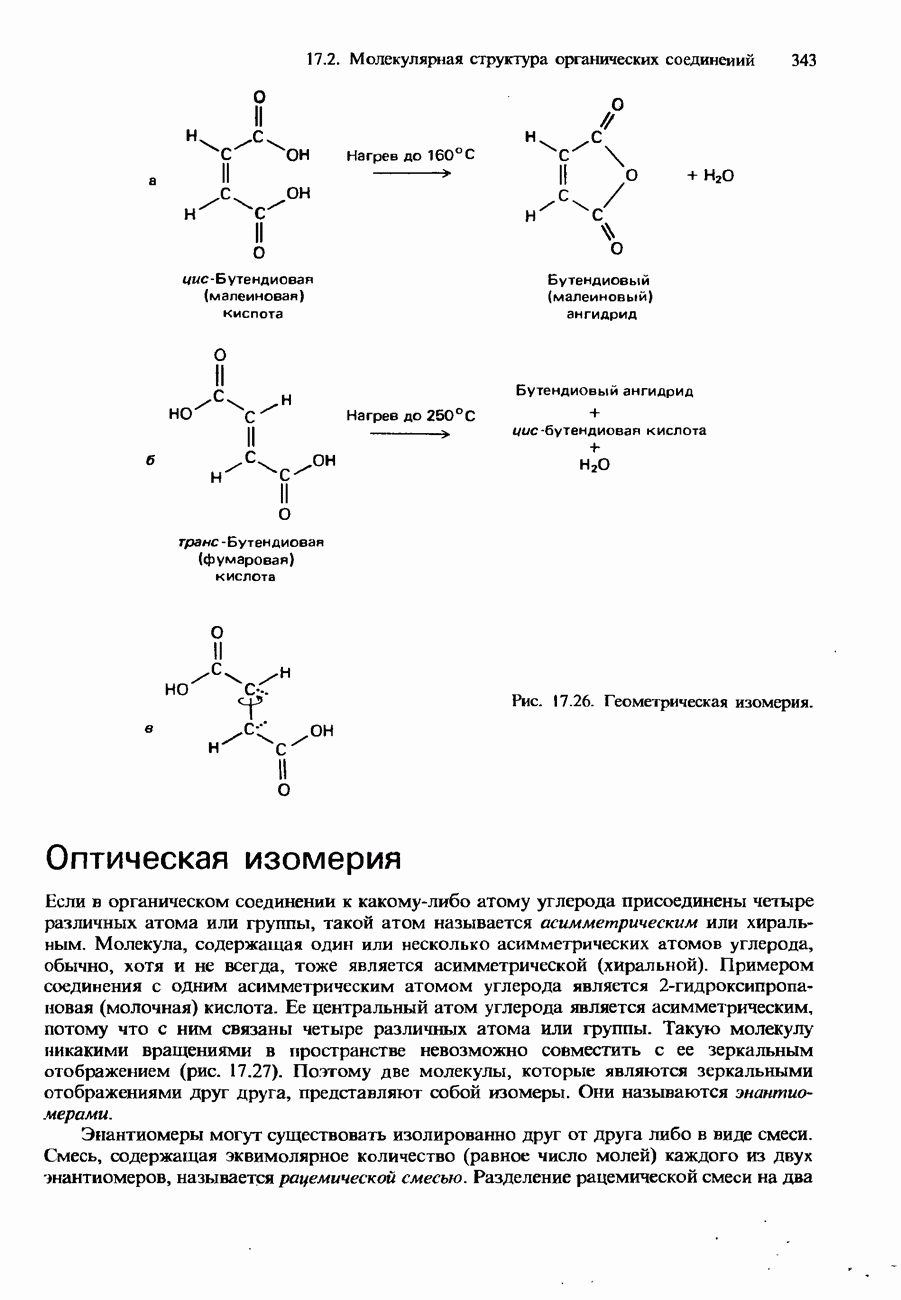
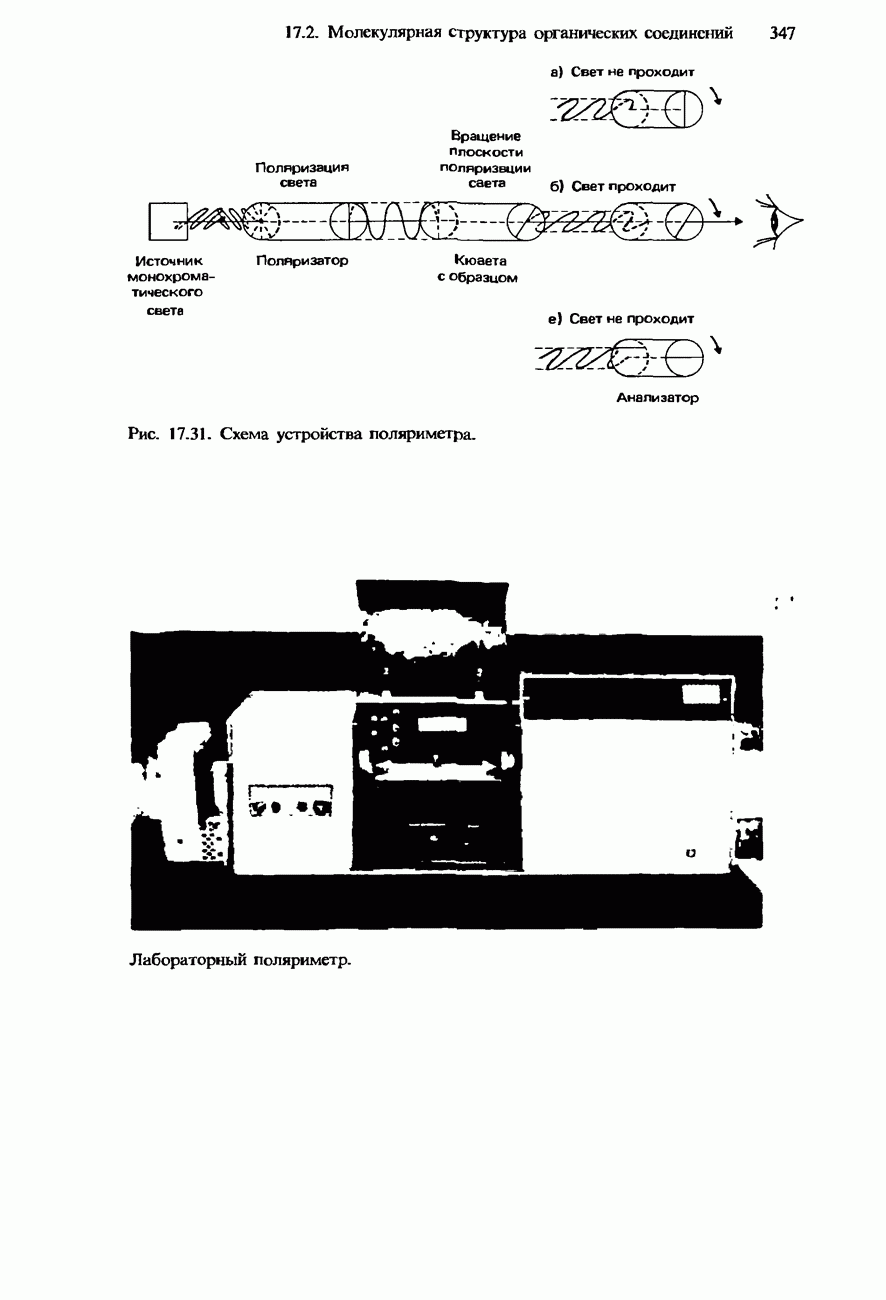
- 17.2. Молекулярная структура органических соединений
- КОНФОРМАЦИИ
- СТЕРЕОИЗОМЕРИЯ
- 17.3. Механизмы органических реакций
- ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- НУКЛЕОФИЛЫ И ЭЛЕКТРОФИЛЫ
- ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 18. УГЛЕВОДОРОДЫ
- 18.1. Алифатические углеводороды
- АЛКАНЫ
- АЛКЕНЫ
- АЛКИНЫ
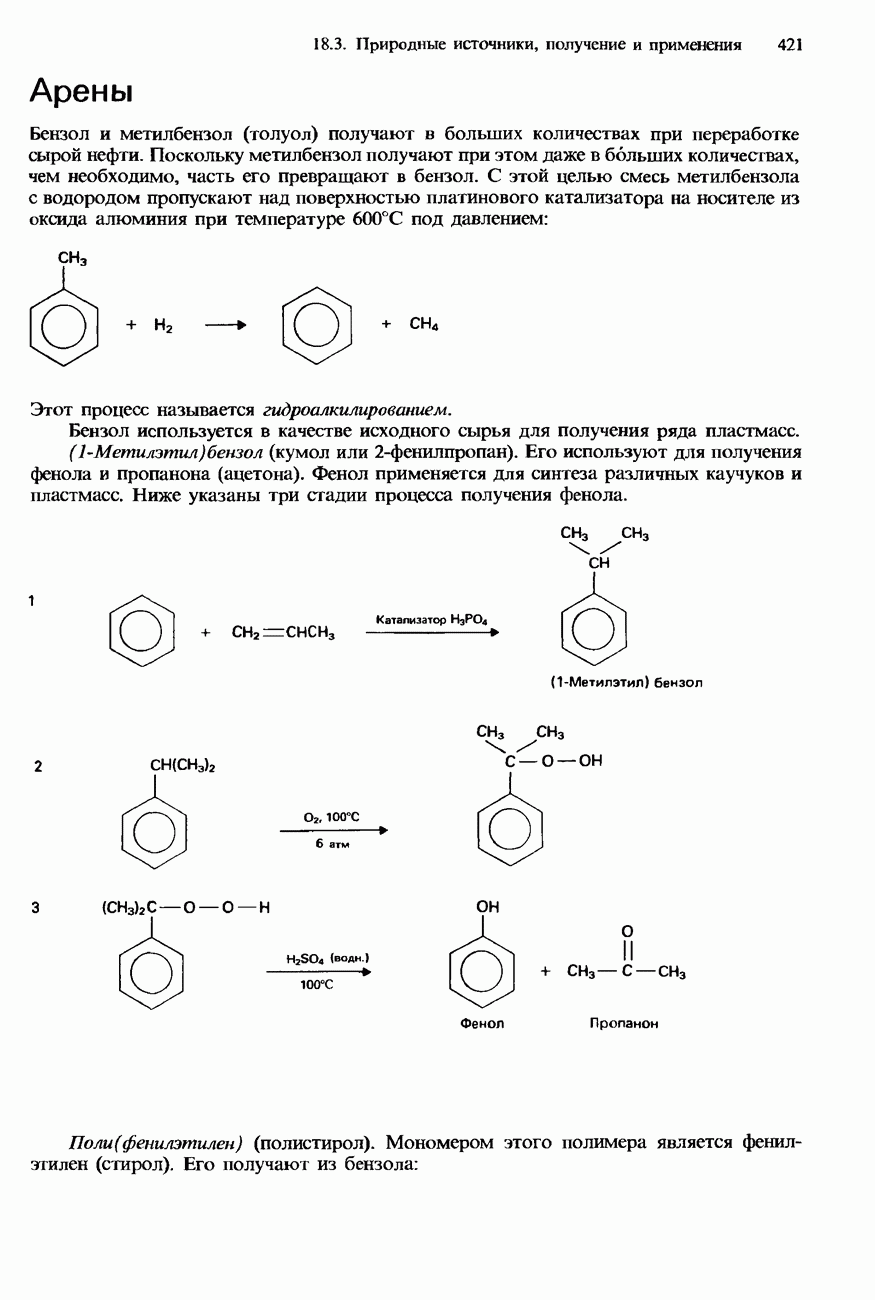
- 18.2. Арены
- БЕНЗОЛ
- МЕТИЛБЕНЗОЛ
- 18.3. Природные источники, получение и применения
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ УГЛЕВОДОРОДОВ
- ПЕРЕРАБОТКА НЕФТИ
- ПРИМЕНЕНИЯ УГЛЕВОДОРОДОВ
- ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ НЕФТЬЮ И ПРОДУКТАМИ ЕЕ СГОРАНИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 19. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
- 19.1. Органические галогенсодержащие соединения
- ГАЛОГЕНОАЛКЕНЫ
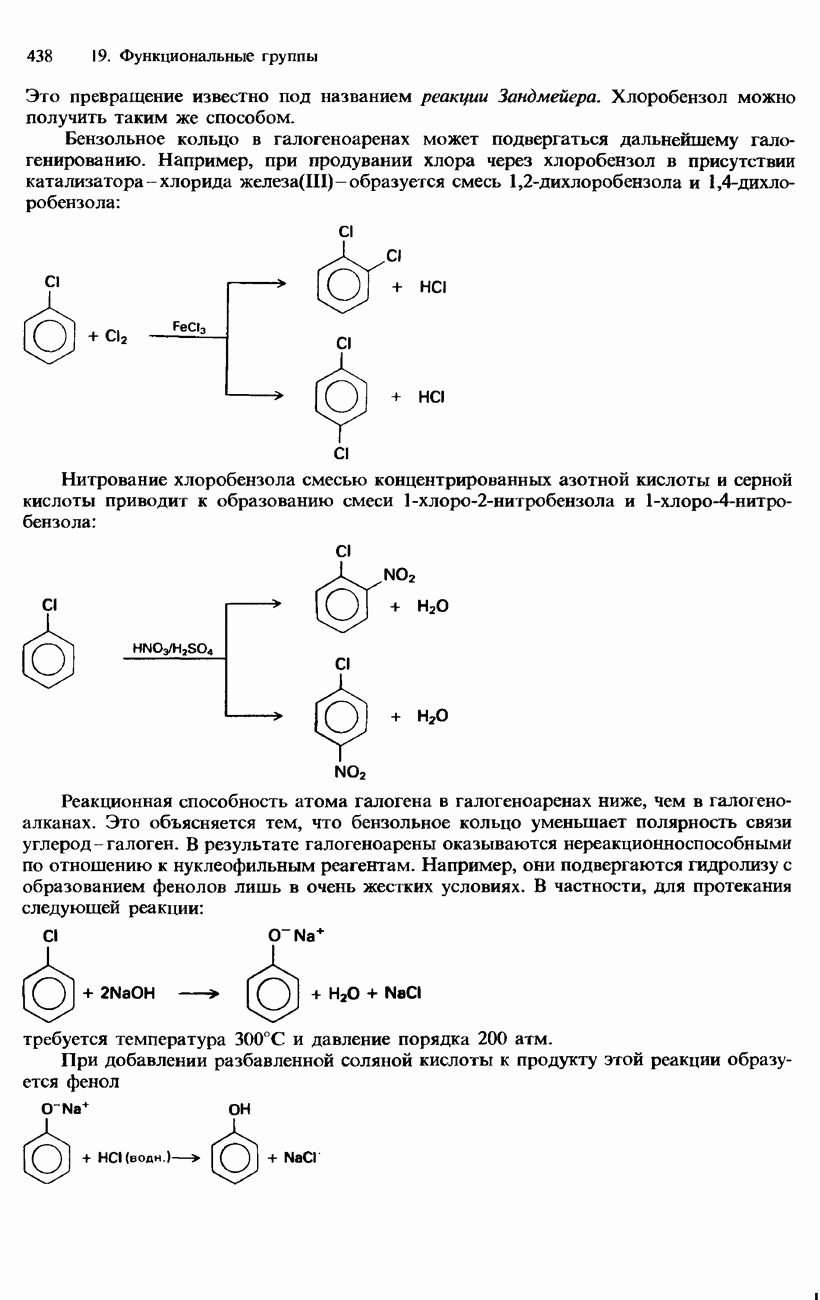
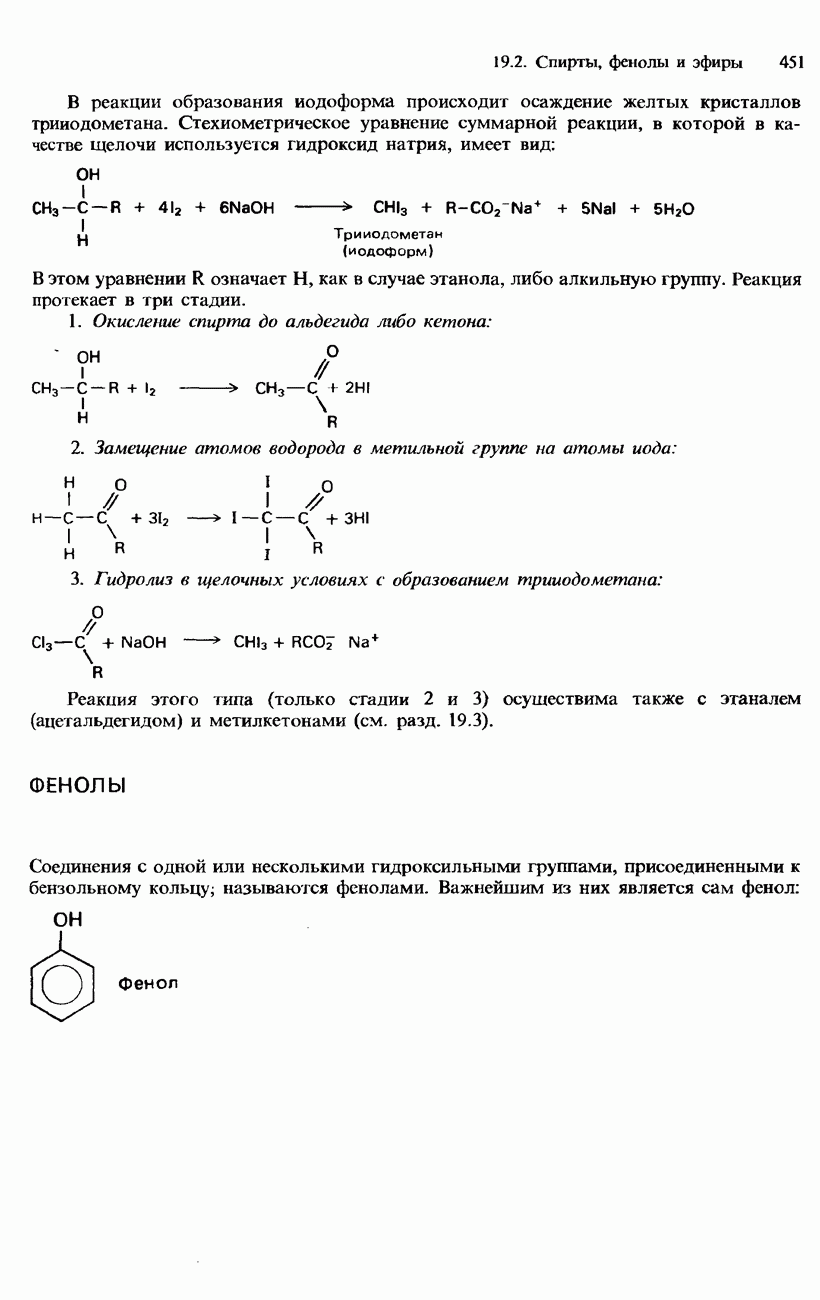
- ГАЛОГЕНОАРЕНЫ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ОРГАНИЧЕСКИХ ГАЛОГЕНСОДЕРЖАЩИХ СОЕДИНЕНИЙ
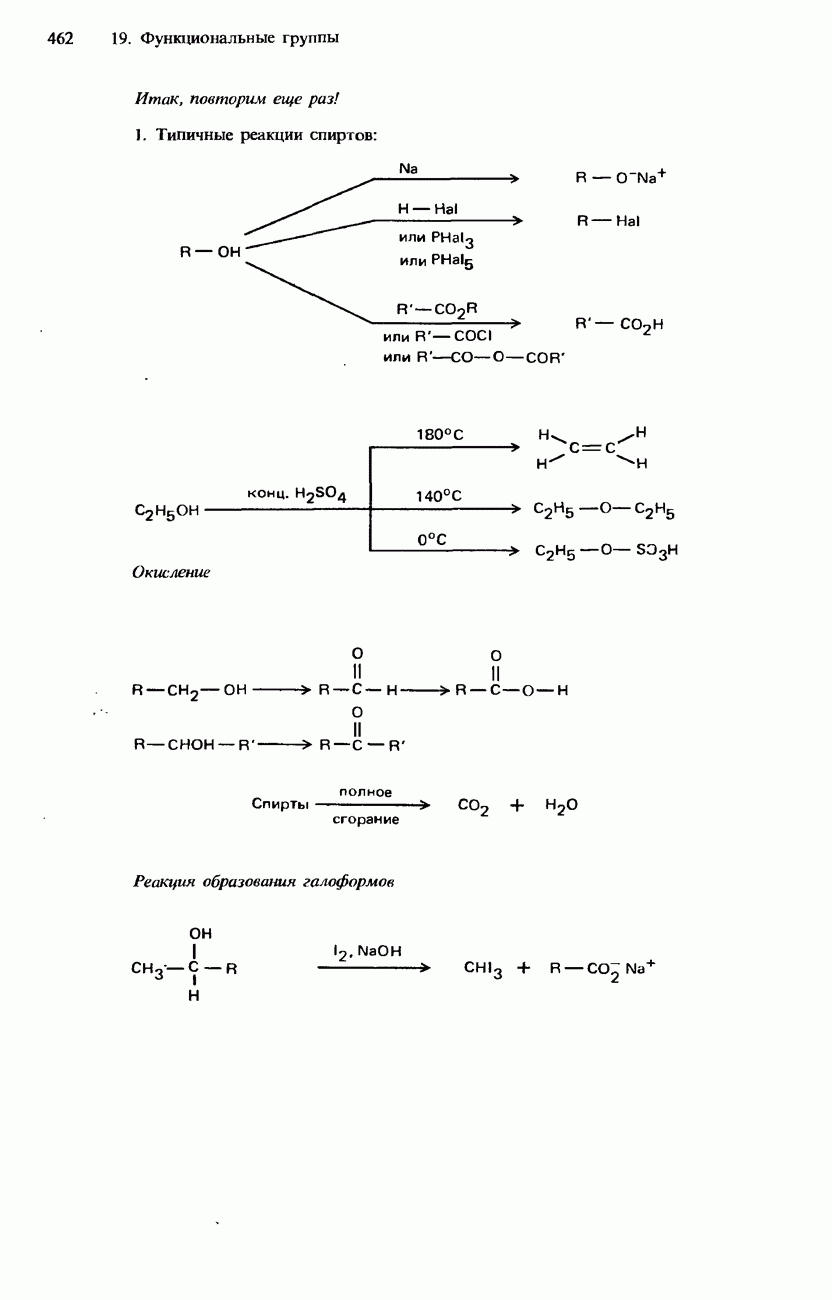
- 19.2. Спирты, фенолы и эфиры
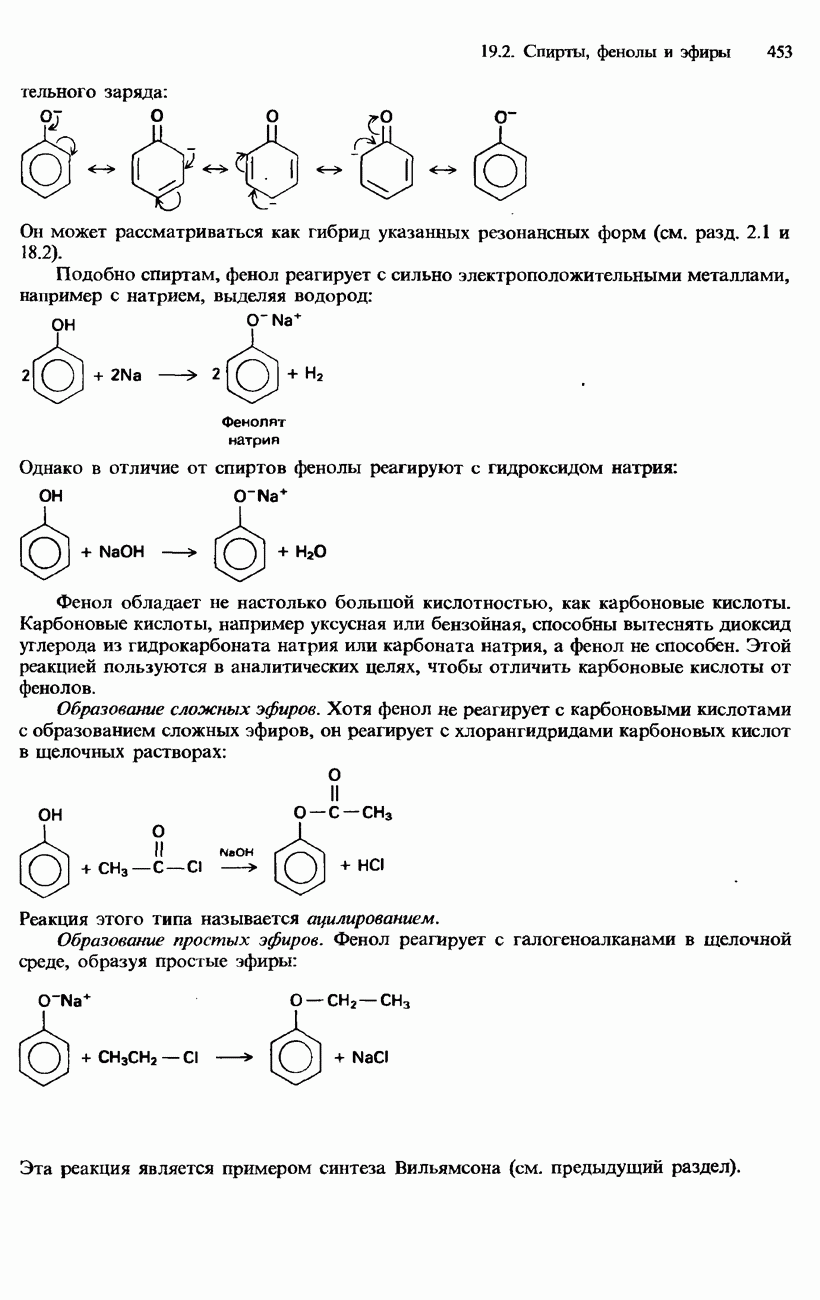
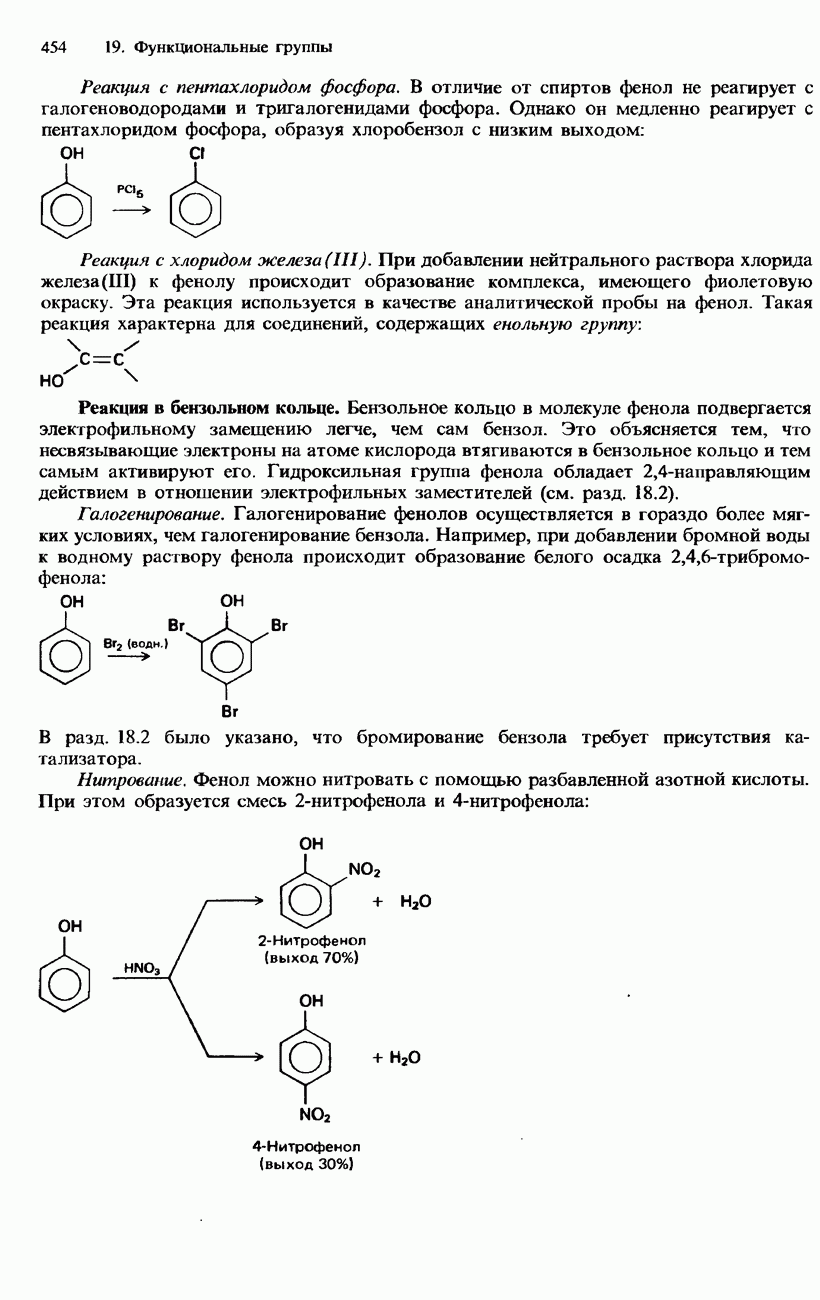
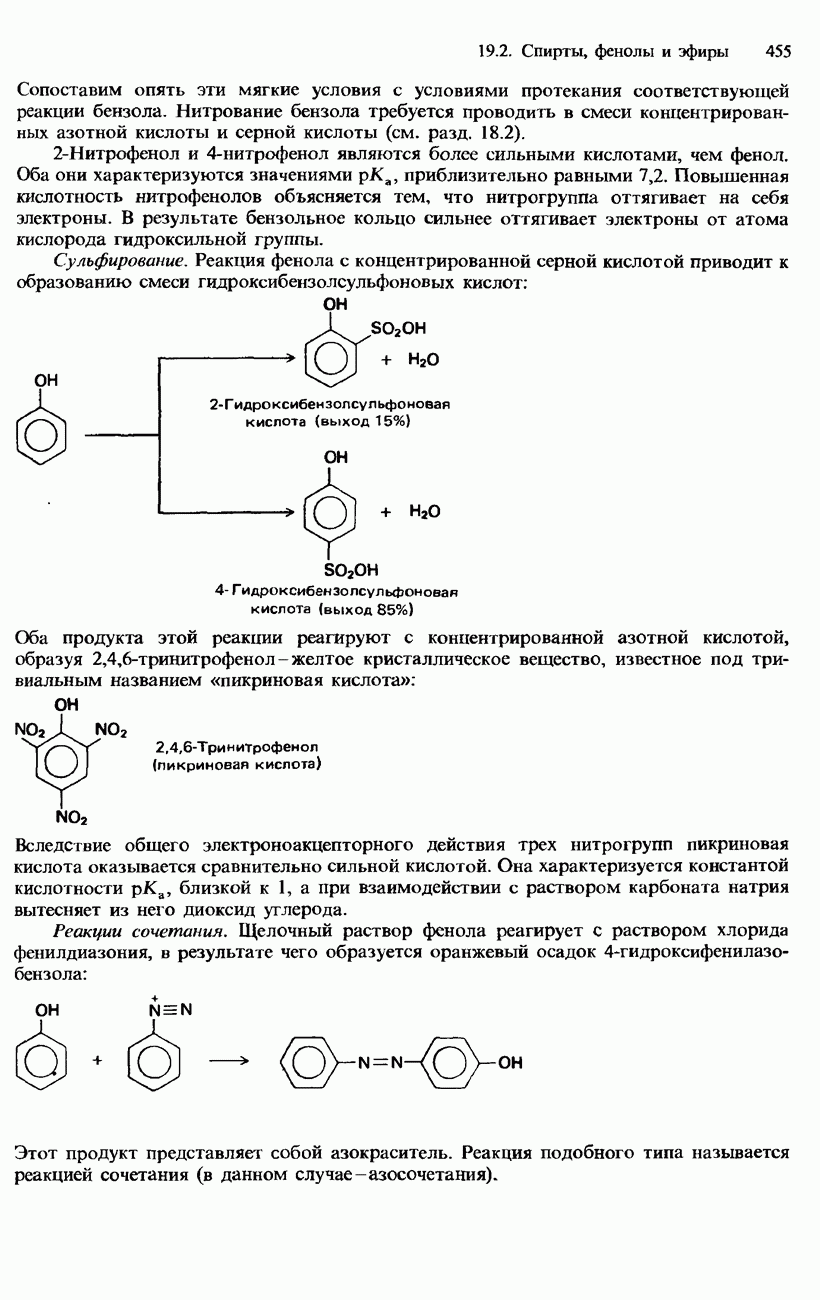
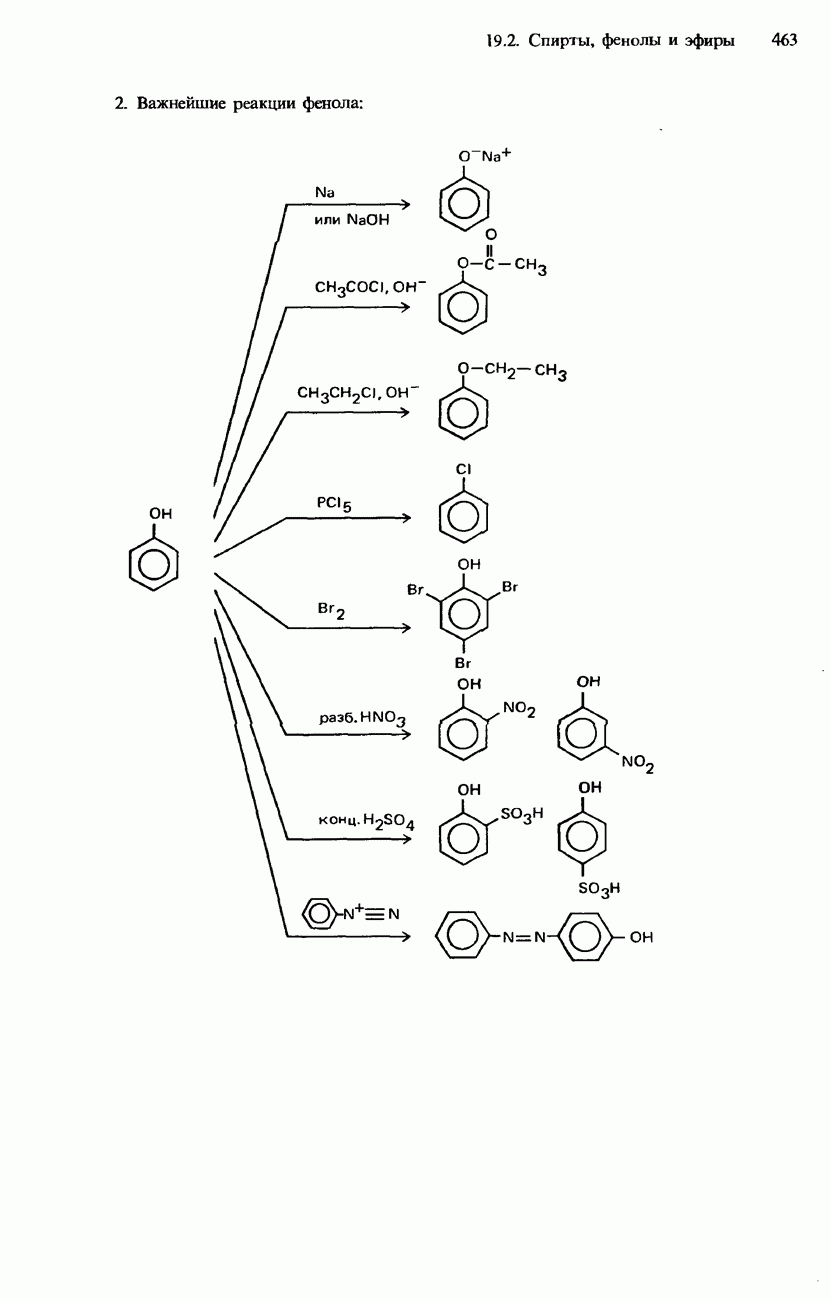
- ФЕНОЛЫ
- ПРОСТЫЕ ЭФИРЫ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ СПИРТОВ, ФЕНОЛОВ И ПРОСТЫХ ЭФИРОВ
- 19.3. Карбонильная группа
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
- КАРБОНОВЫЕ КИСЛОТЫ
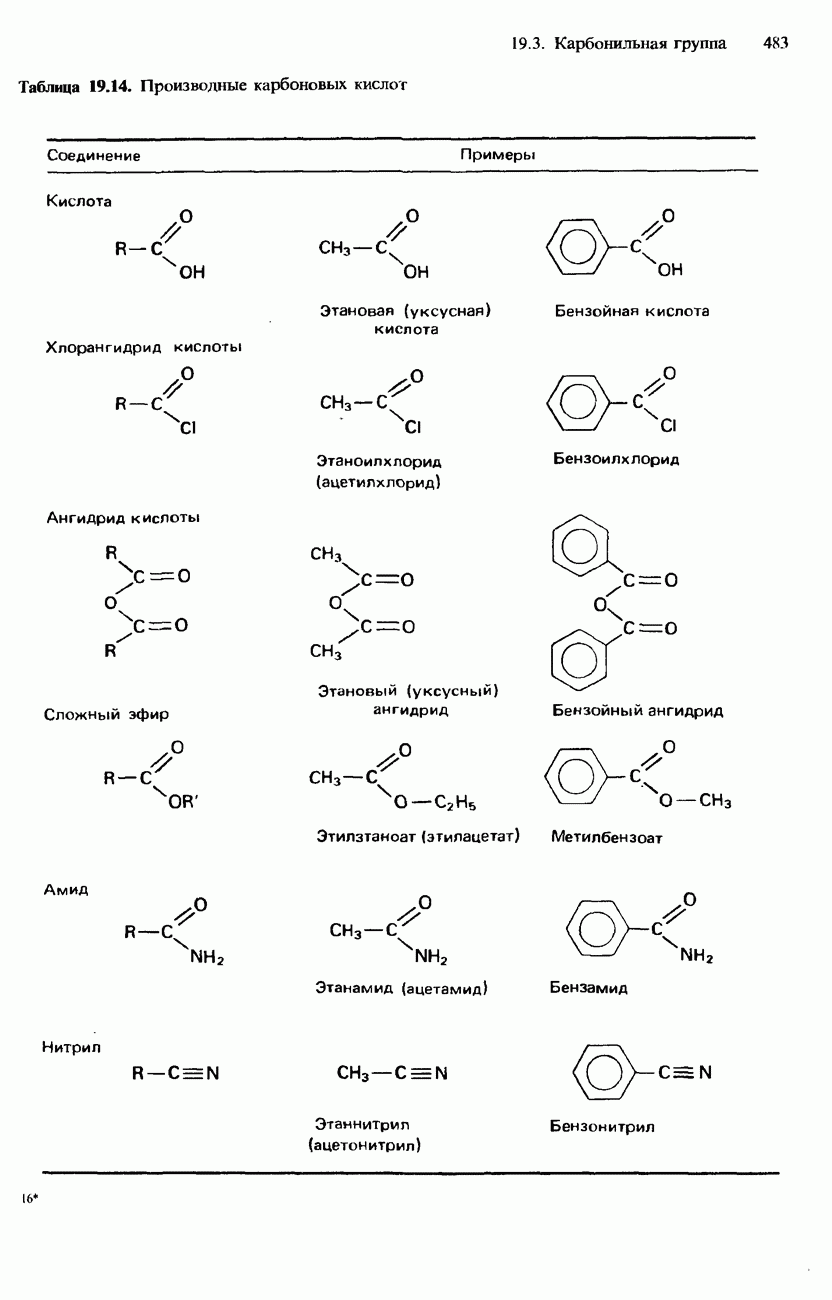
- ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ
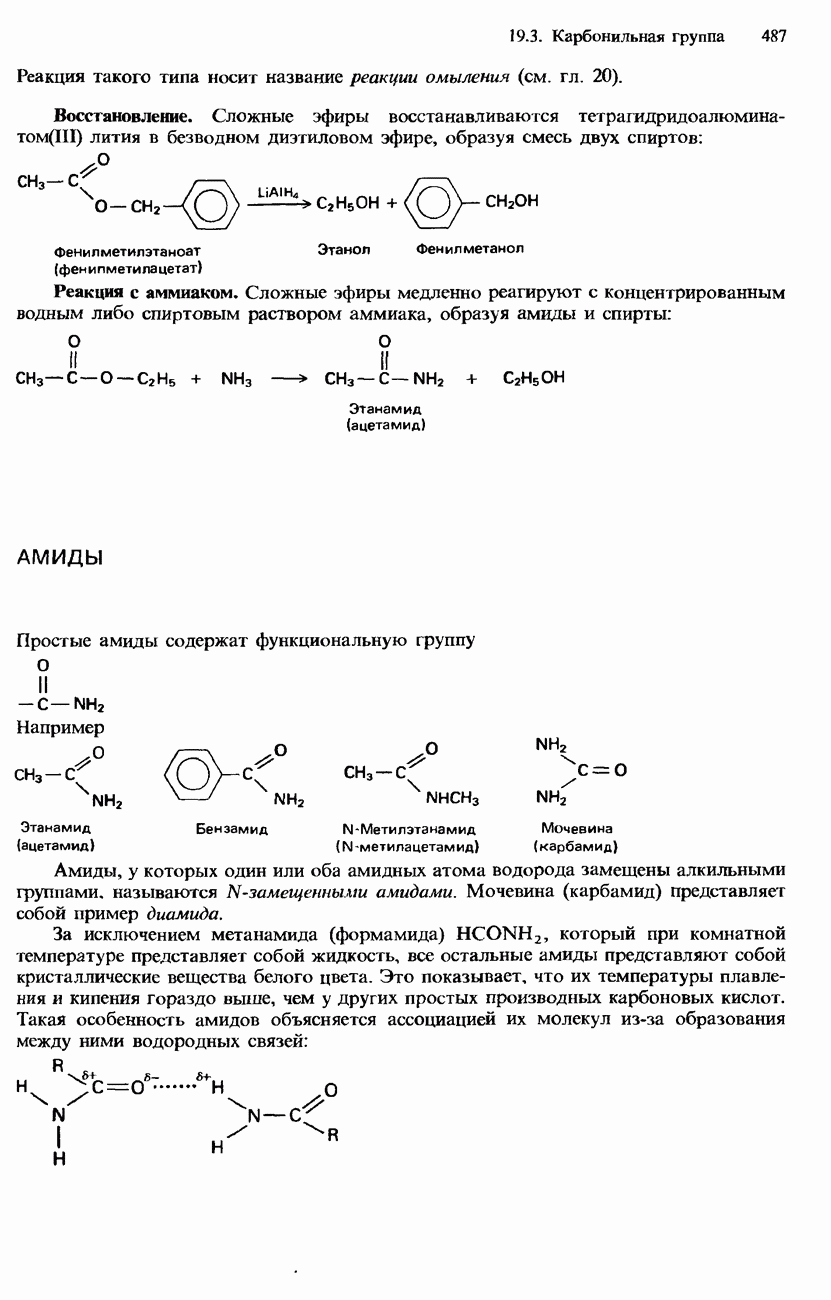
- АМИДЫ
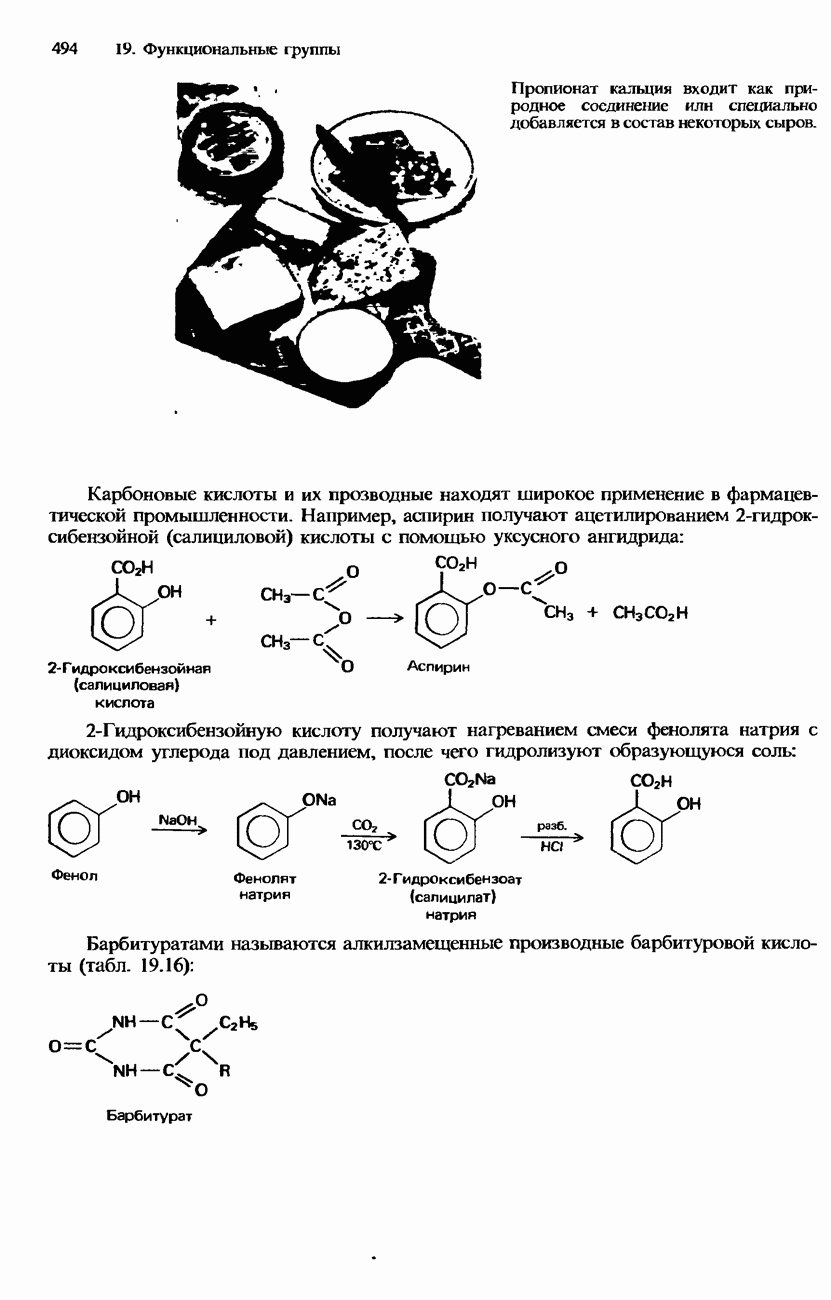
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ
- 19.4 Амины и родственные соединения
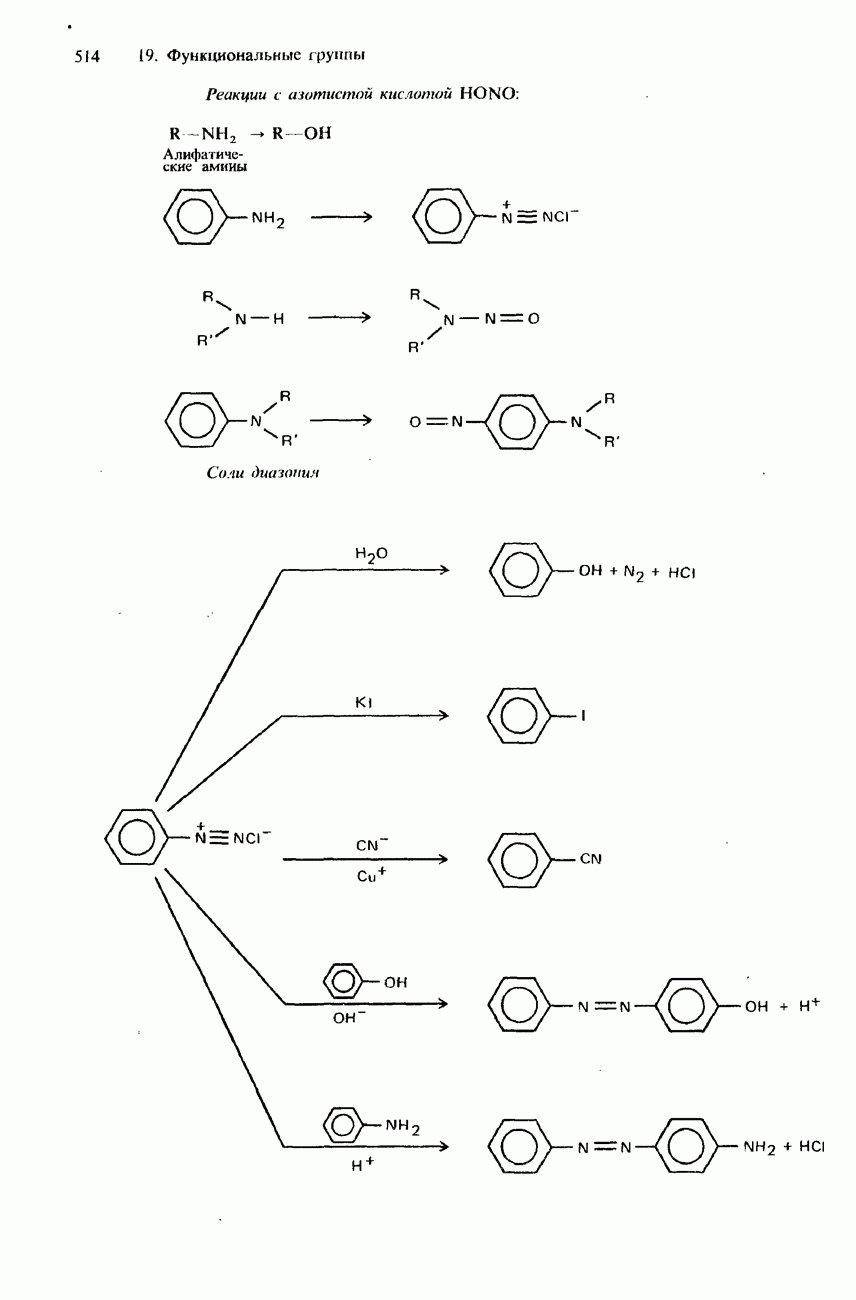
- СОЛИ ДИАЗОНИЯ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 20. ПРИРОДНЫЕ СОЕДИНЕНИЯ И ПОЛИМЕРЫ
- 20.1. Аминокислоты, пептиды и белки
- АМИНОКИСЛОТЫ
- ПЕПТИДЫ
- БЕЛКИ
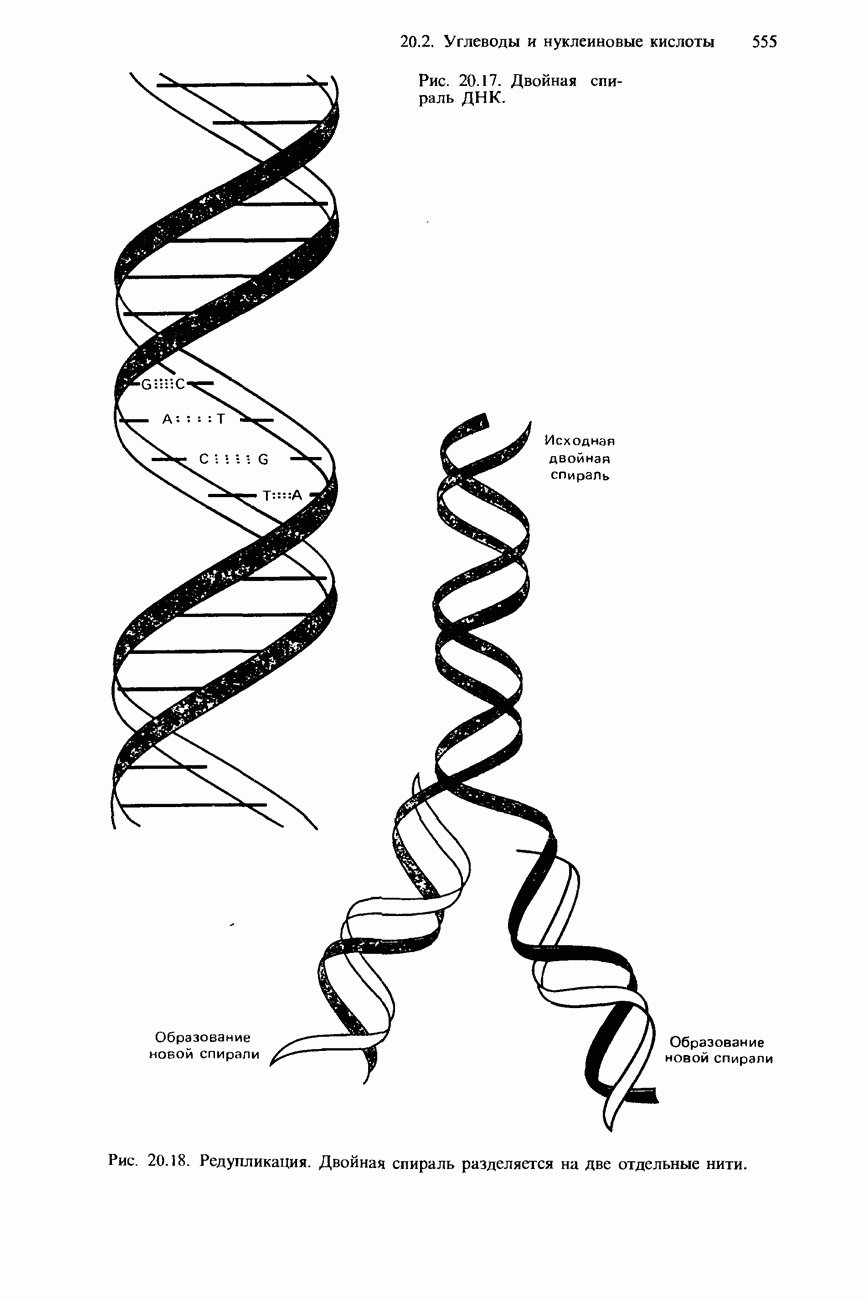
- 20.2. Углеводы и нуклеиновые кислоты
- НУКЛЕИНОВЫЕ КИСЛОТЫ
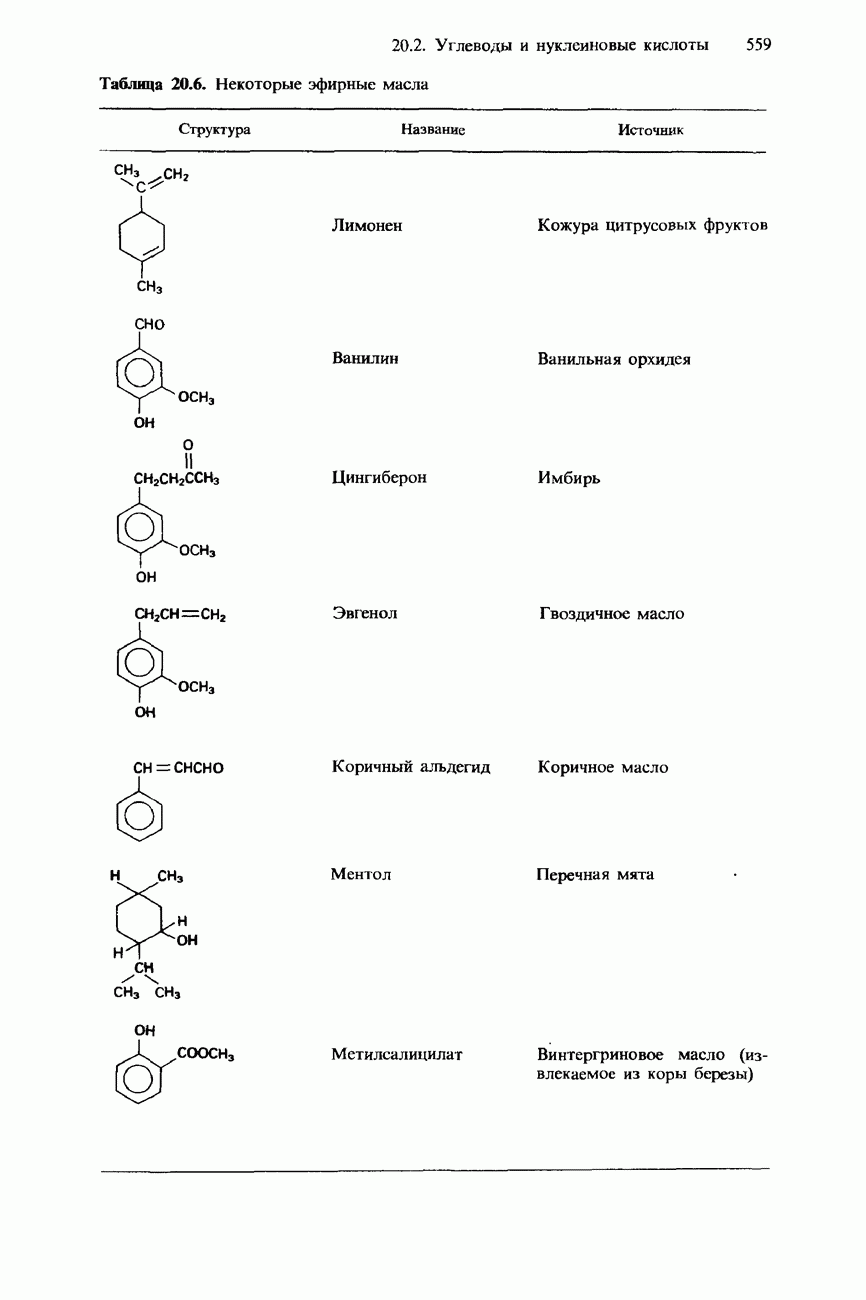
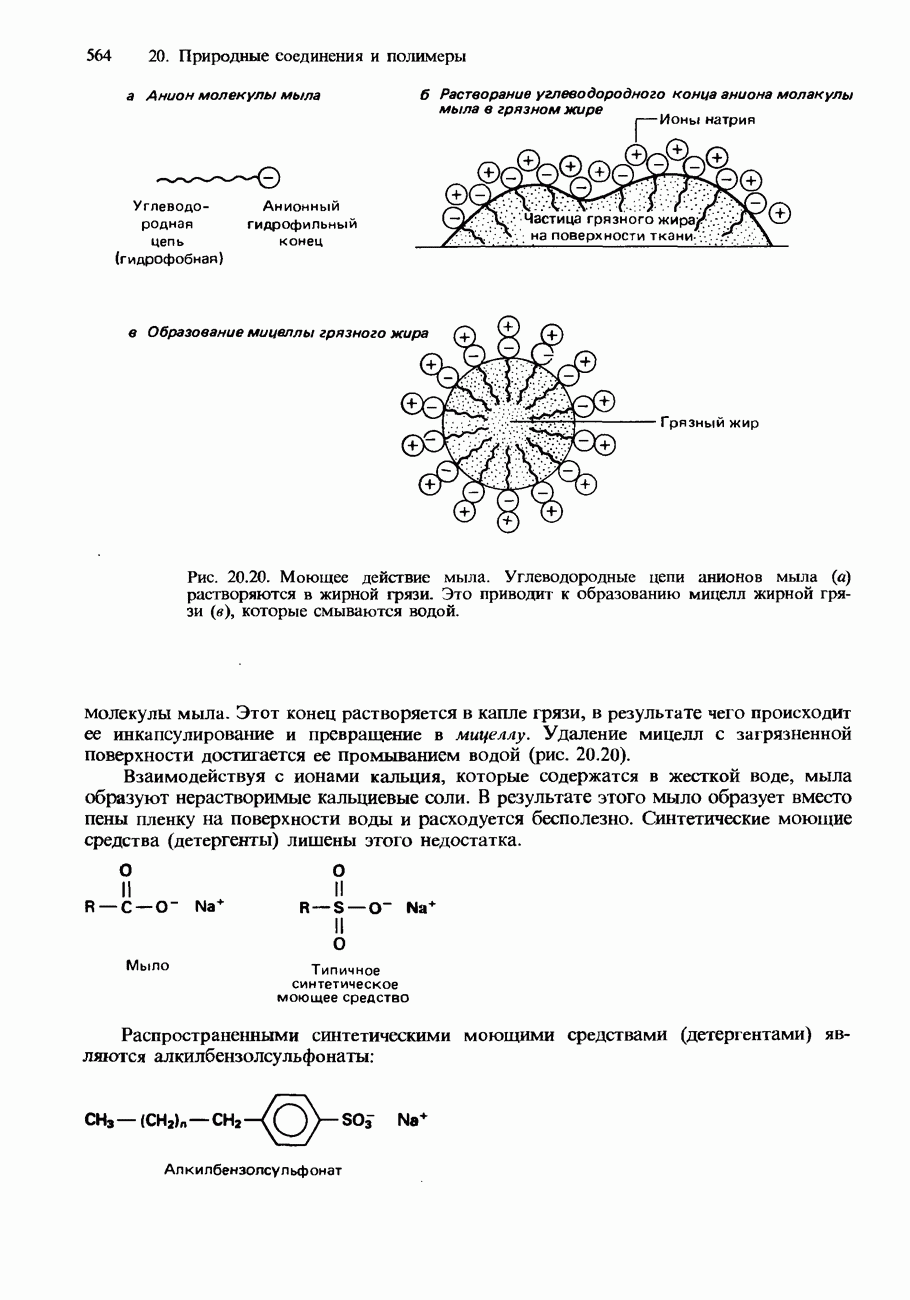
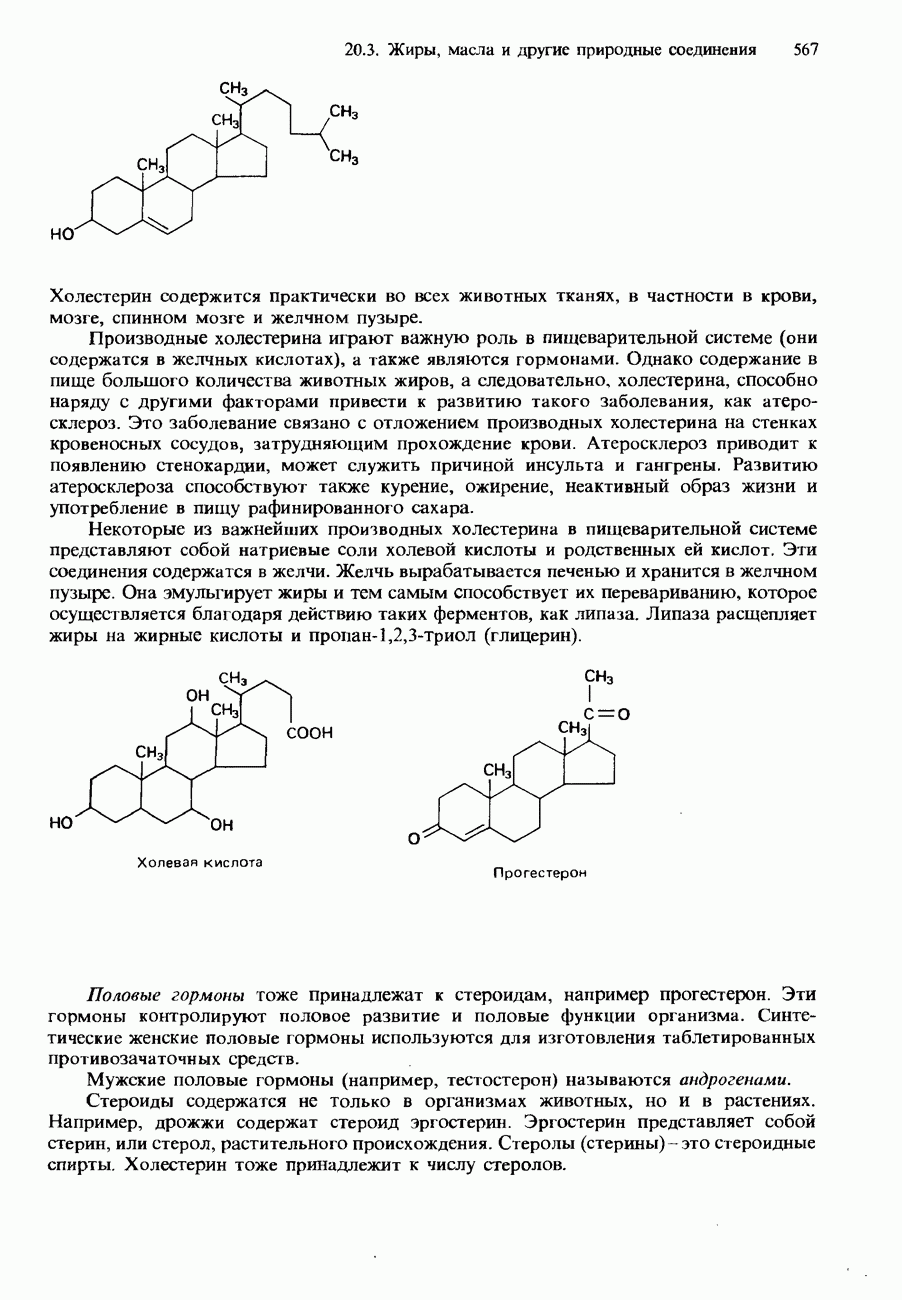
- 20.3. Жиры, масла и другие природные соединения
- ЖИРНЫЕ КИСЛОТЫ И ТРИГЛИЦЕРИДЫ
- ВОСКИ
- ФОСФОЛИПИДЫ И ГЛИКОЛИПИДЫ
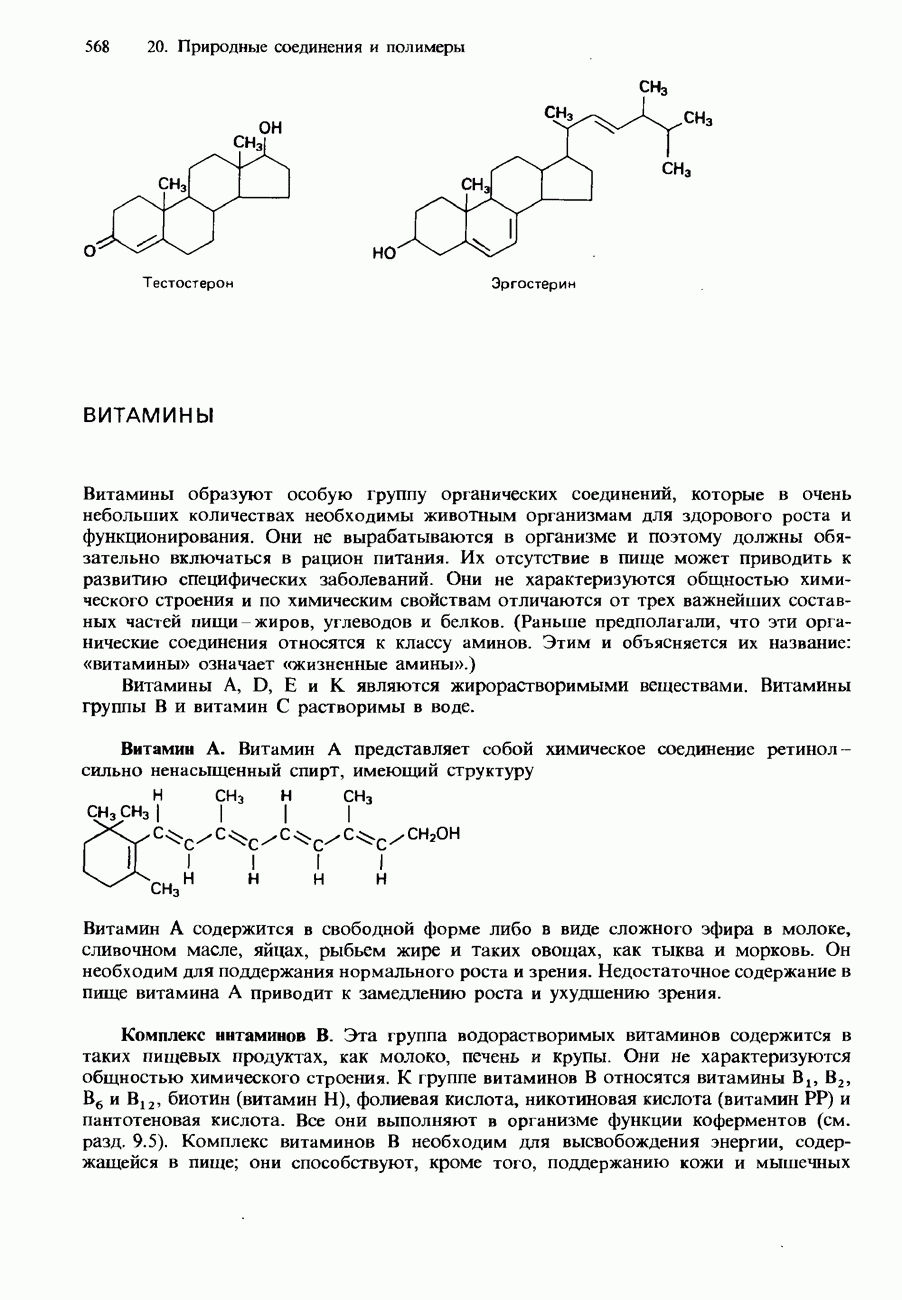
- ВИТАМИНЫ
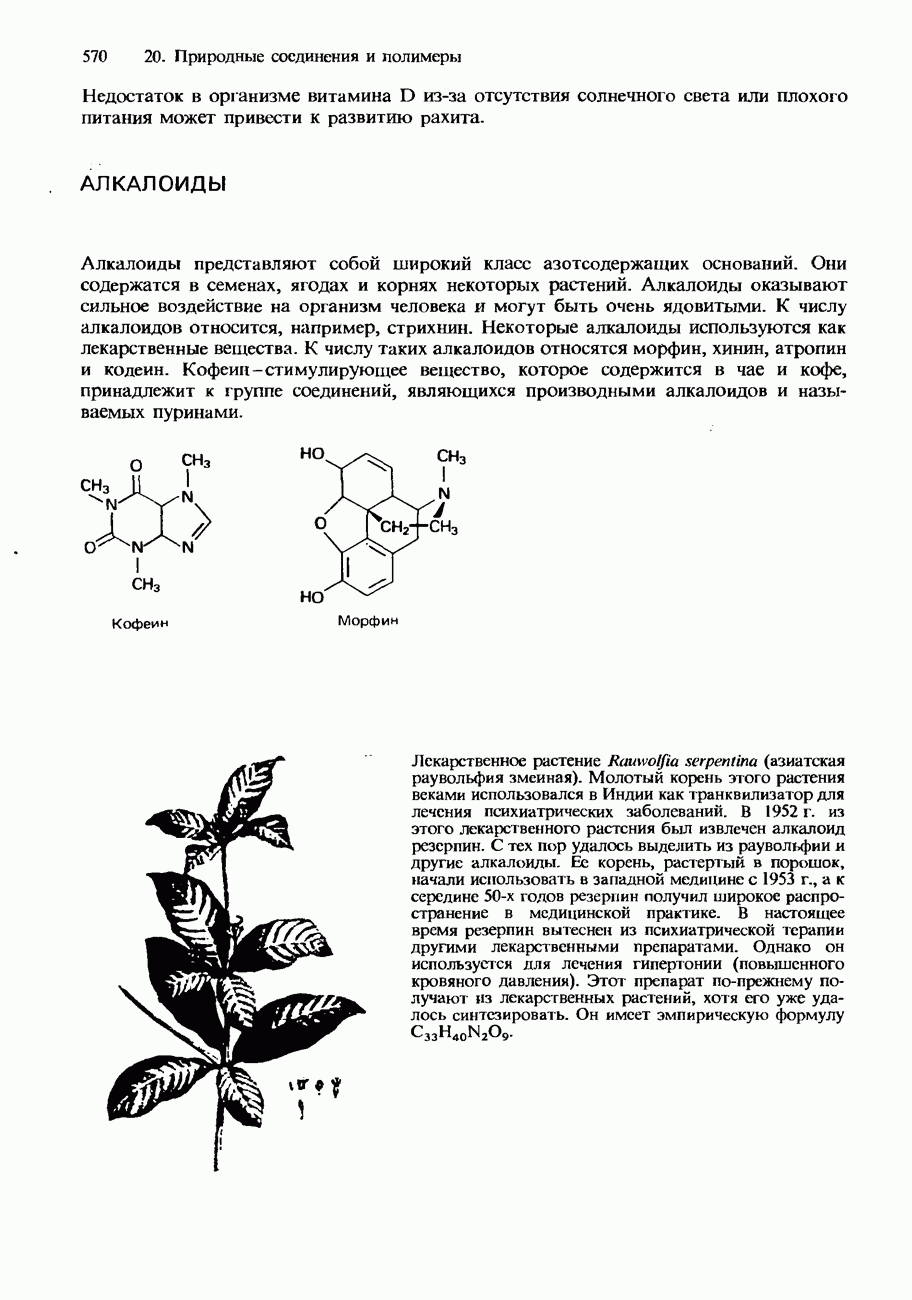
- АЛКАЛОИДЫ
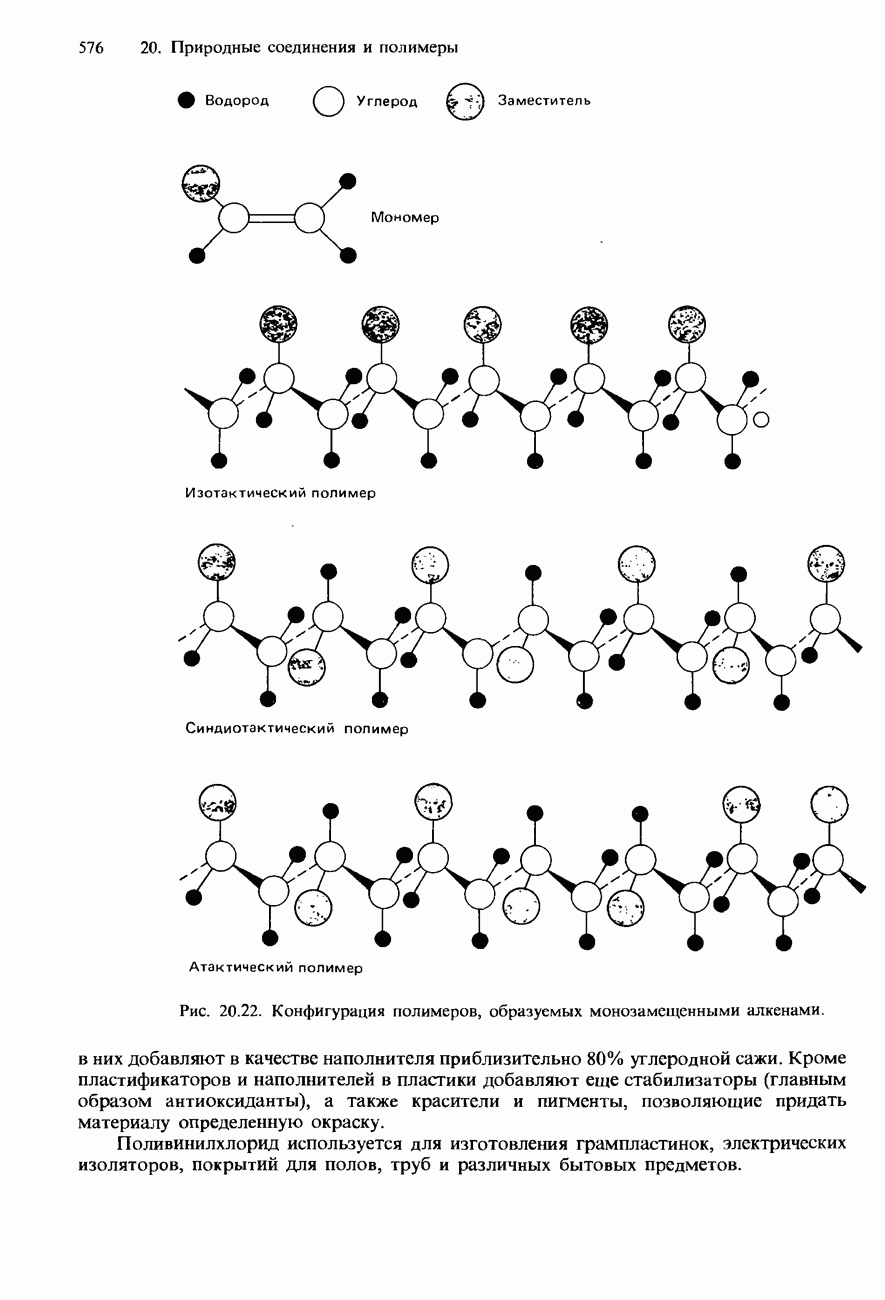
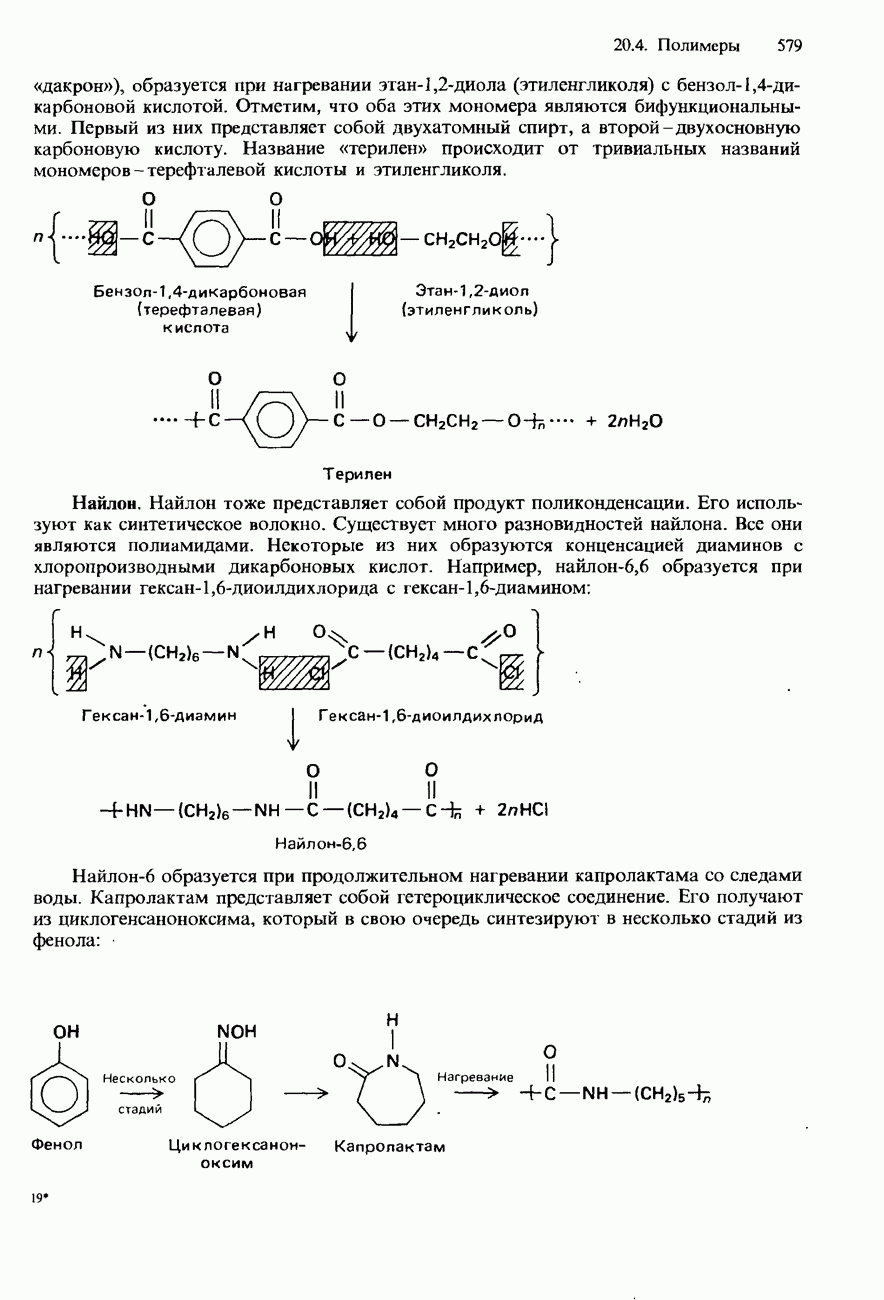
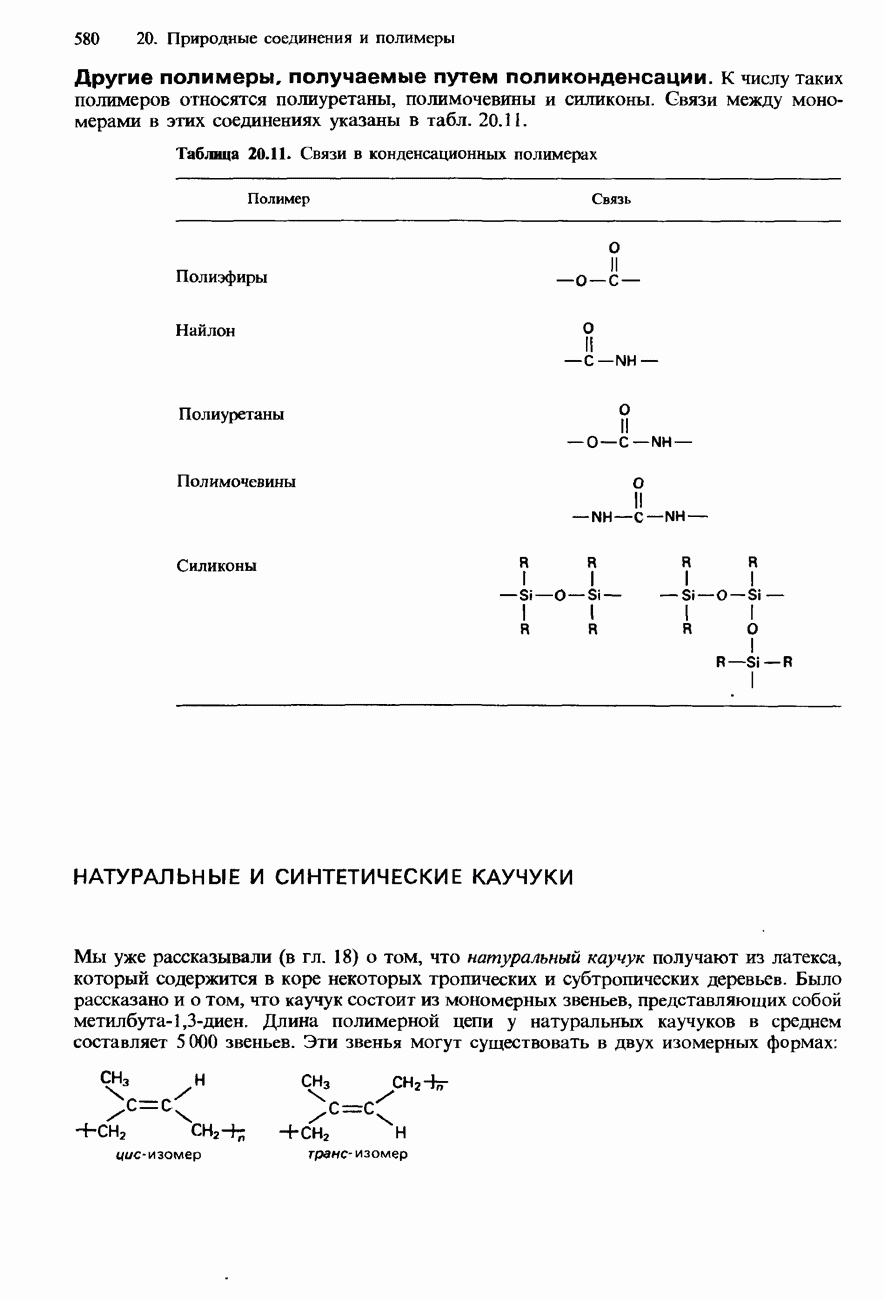
- 20.4. Полимеры
- ПОЛИМЕРИЗАЦИЯ
- НАТУРАЛЬНЫЕ И СИНТЕТИЧЕСКИЕ КАУЧУКИ
- ЦЕЛЛЮЛОЗНОЕ ВОЛОКНО
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- ПРИЛОЖЕНИЯ