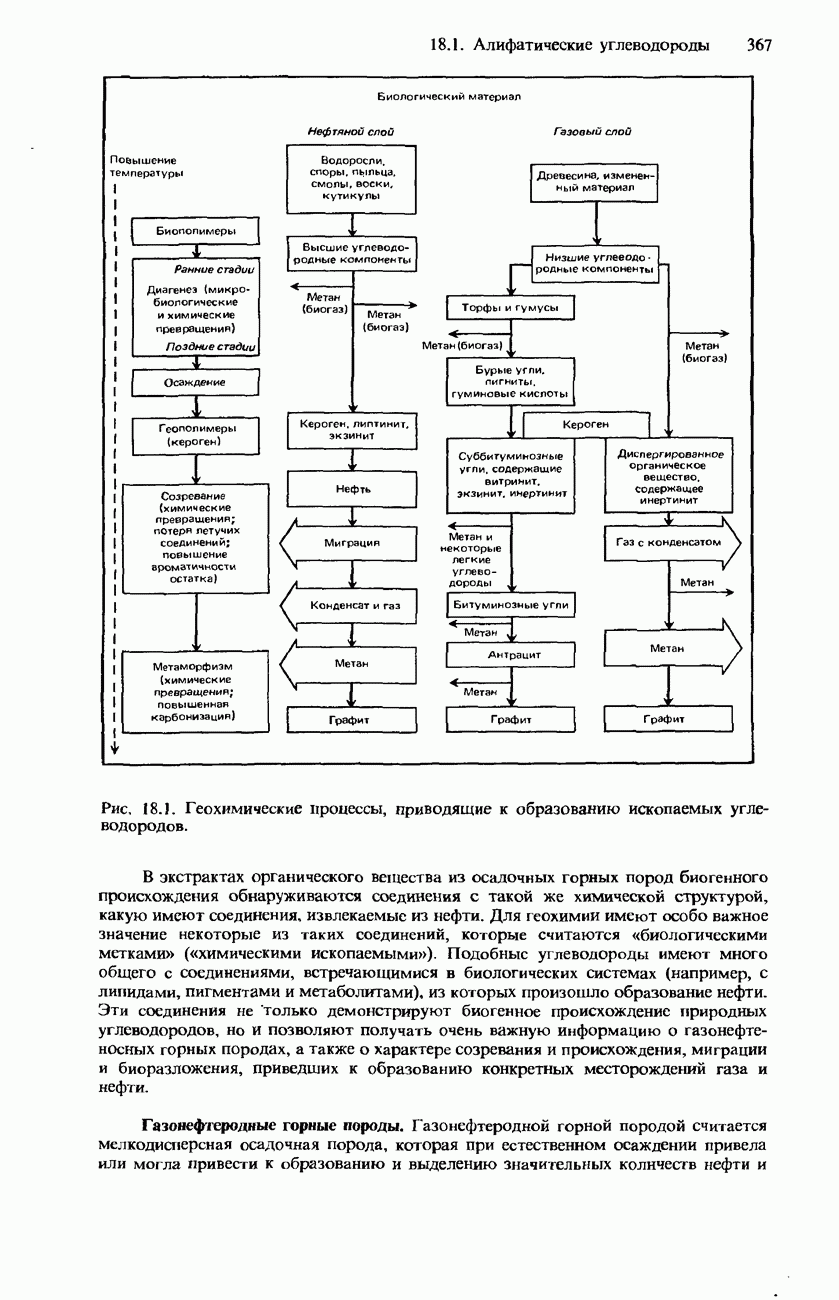
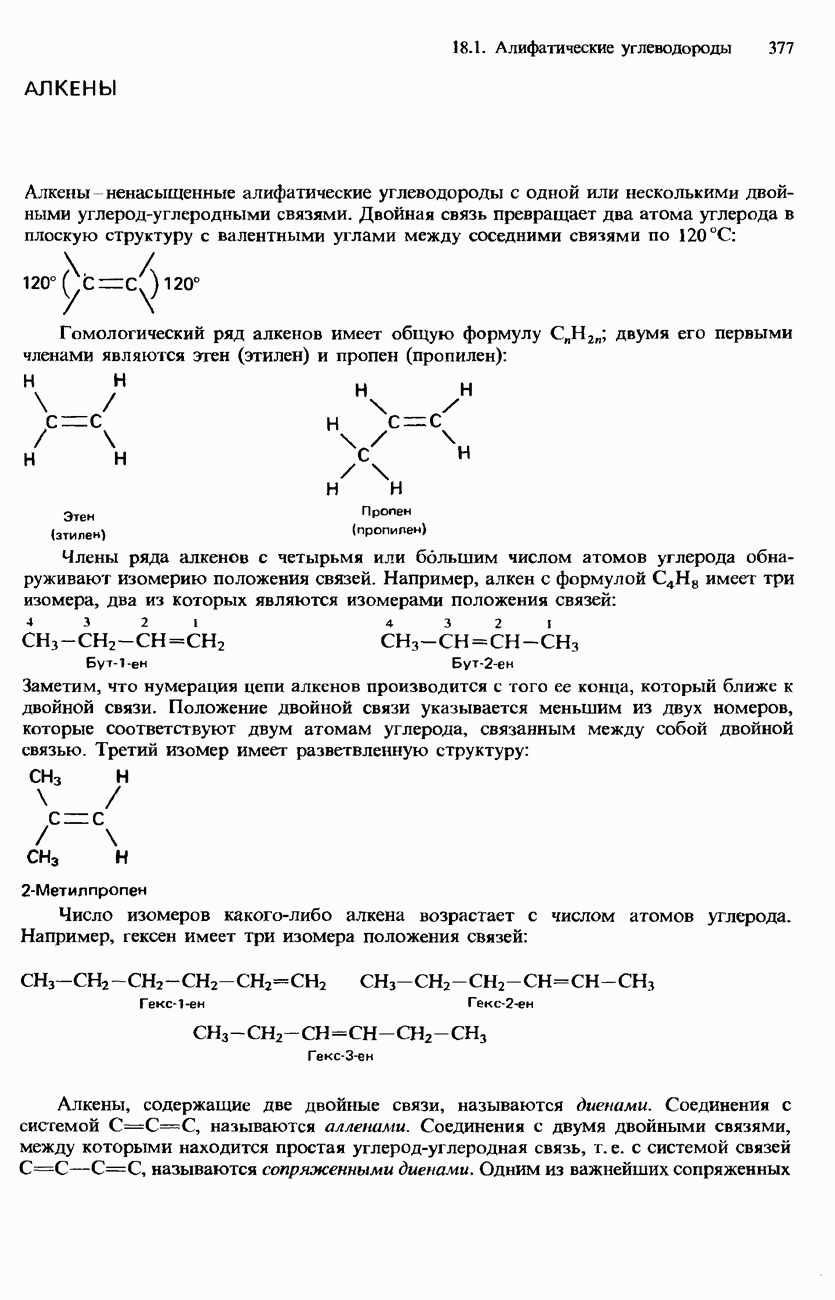
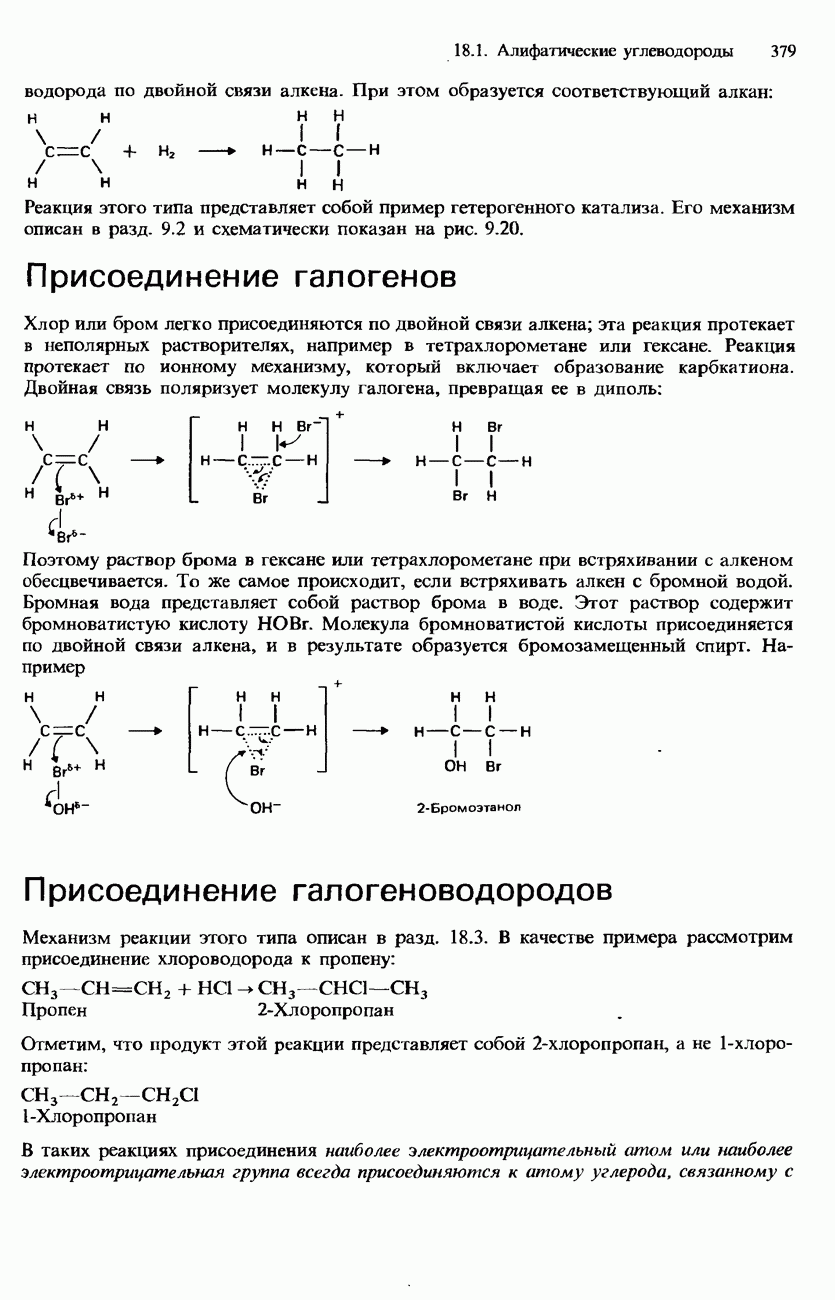
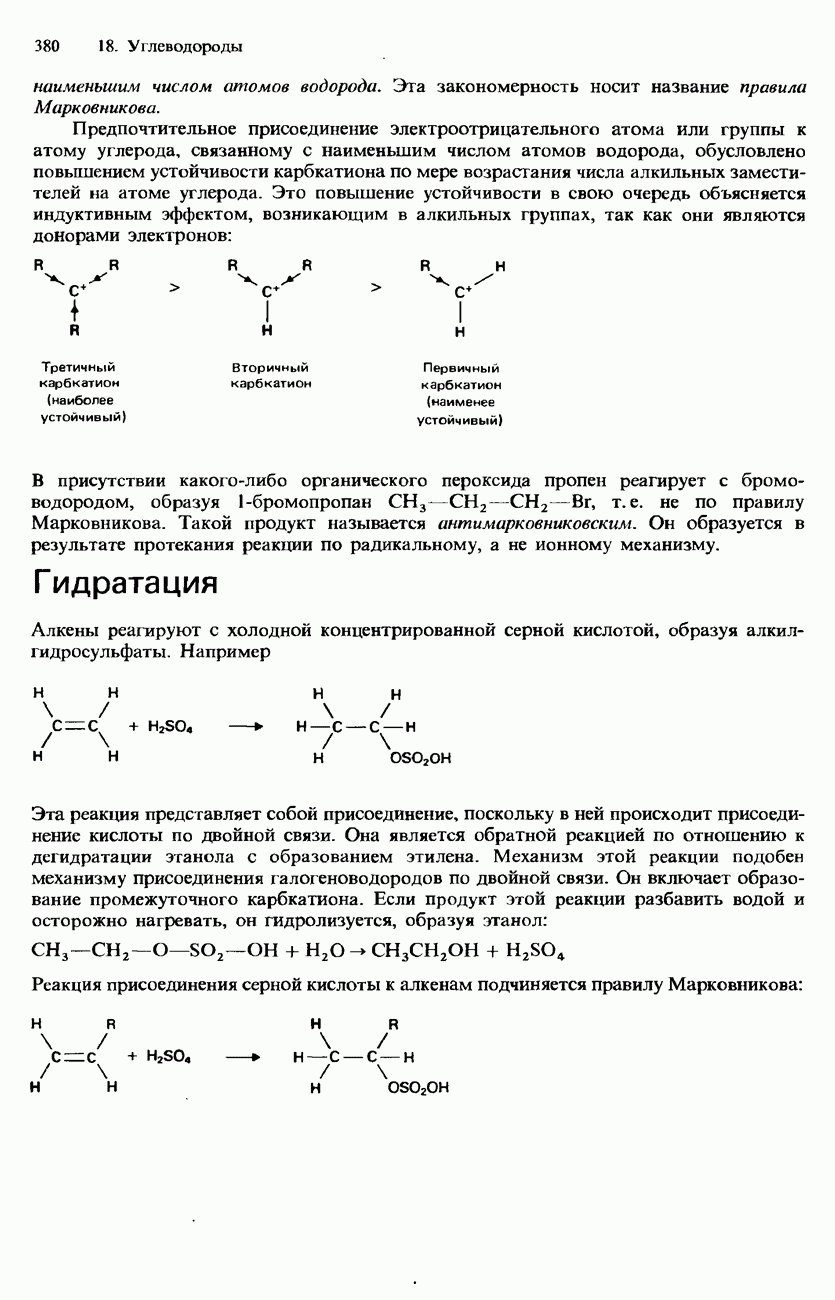
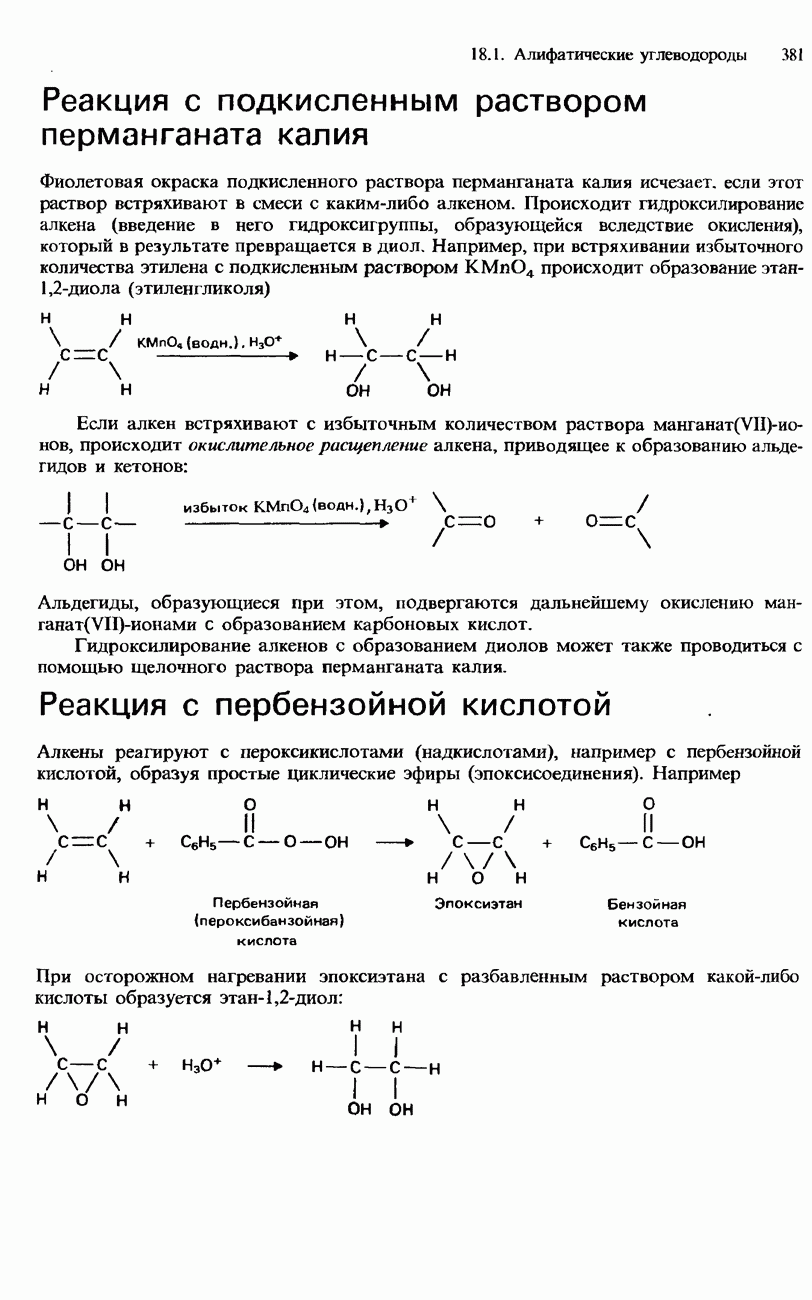
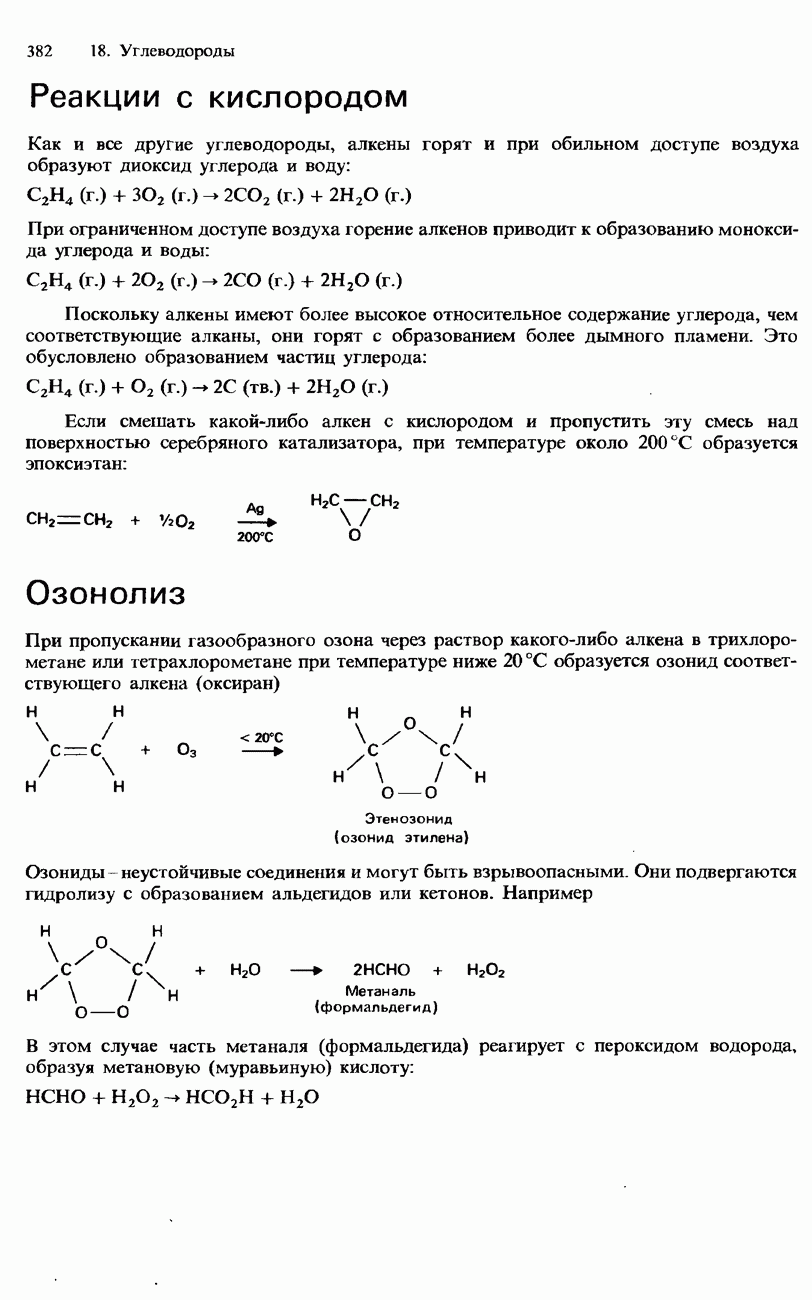
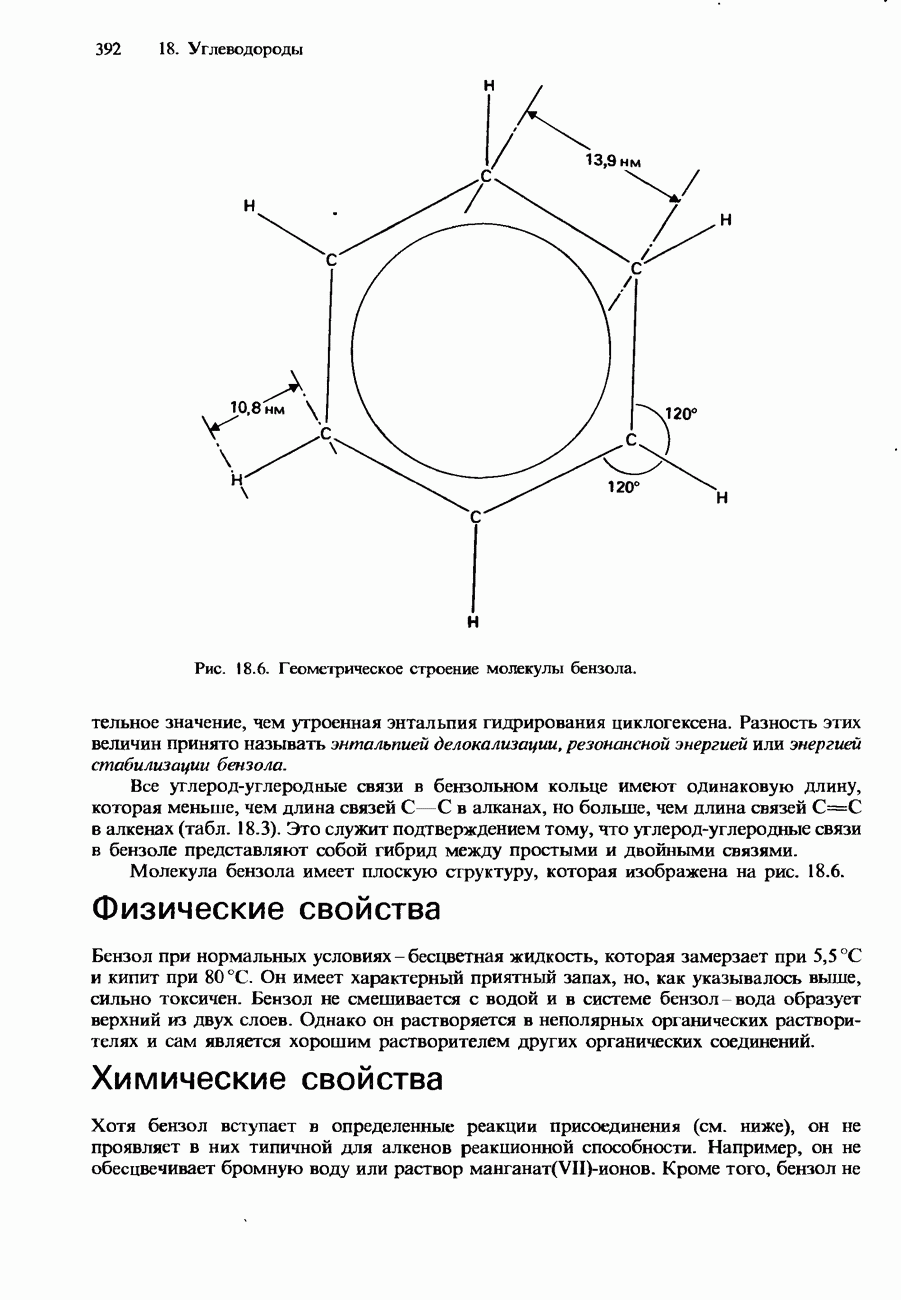
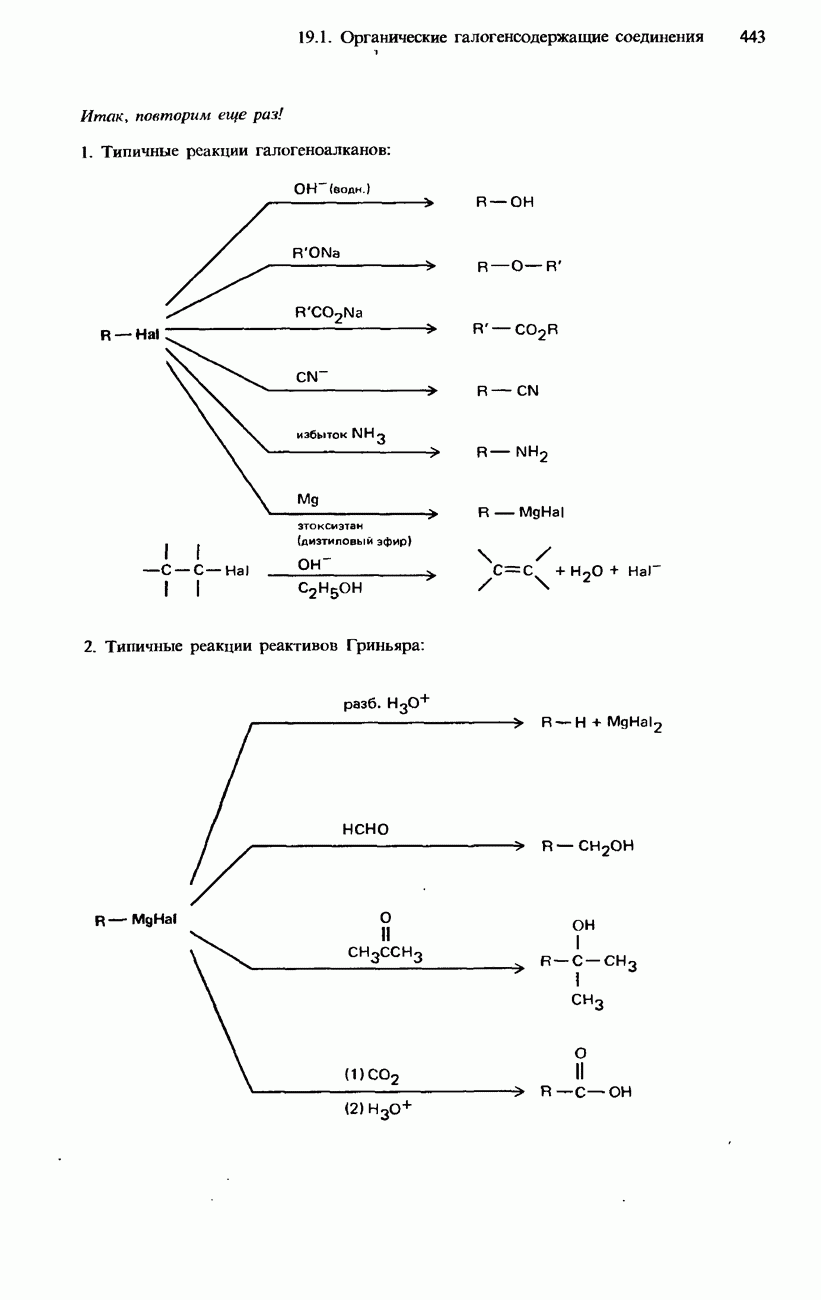
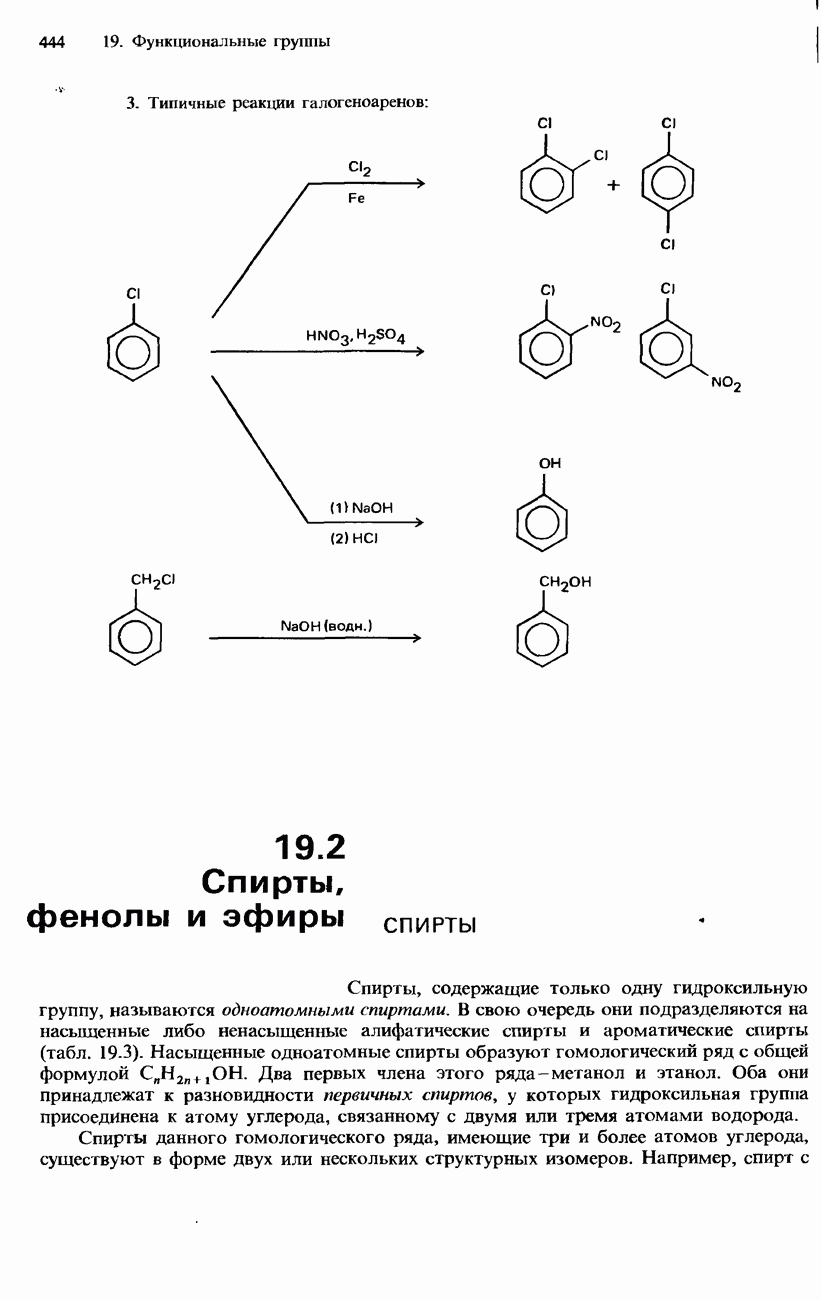
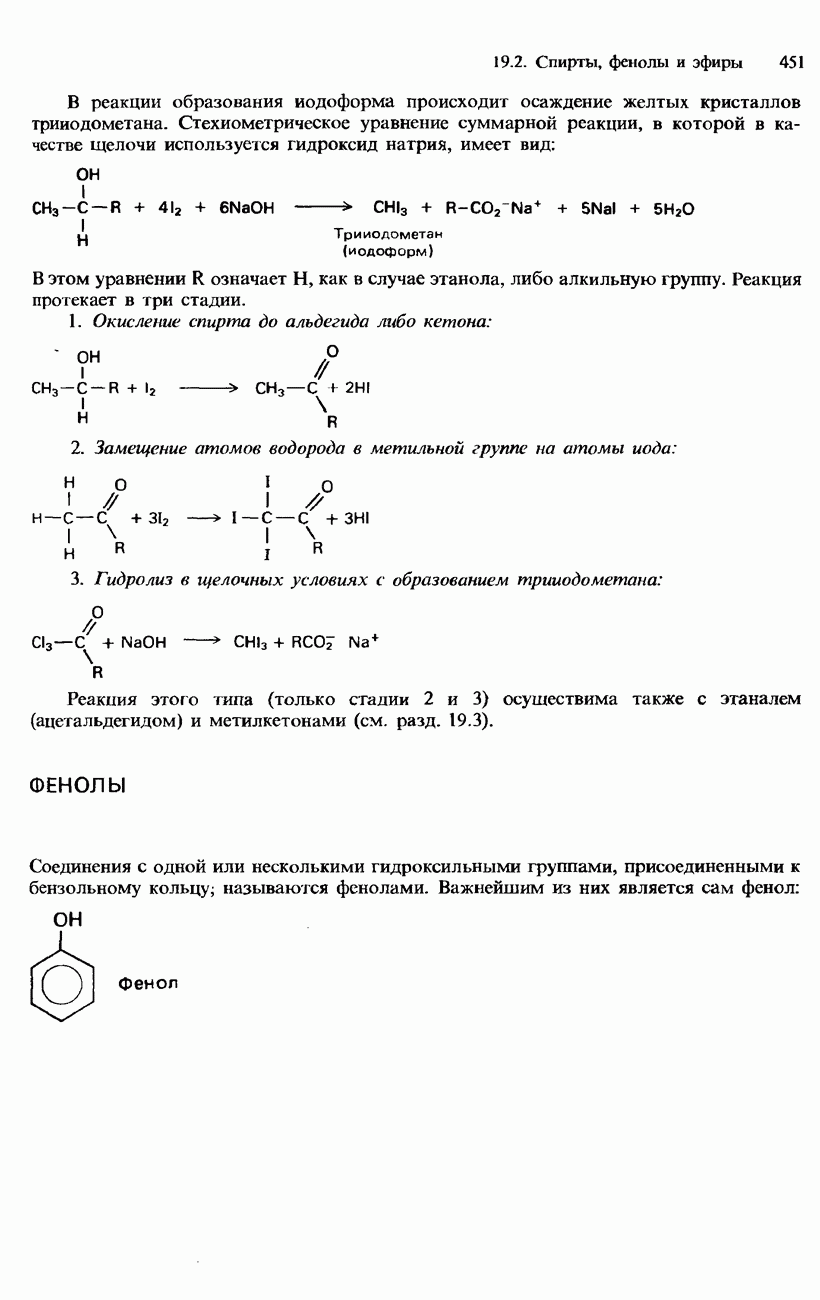
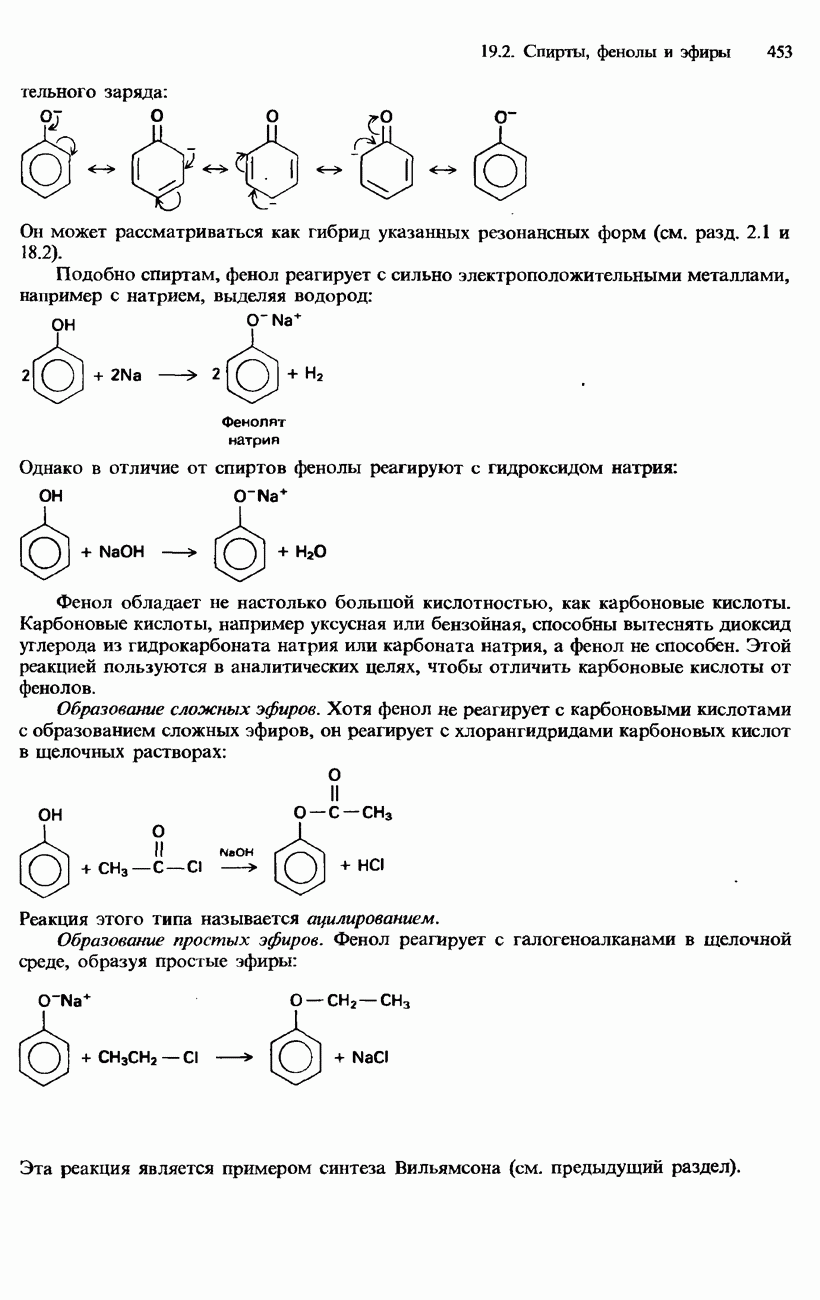
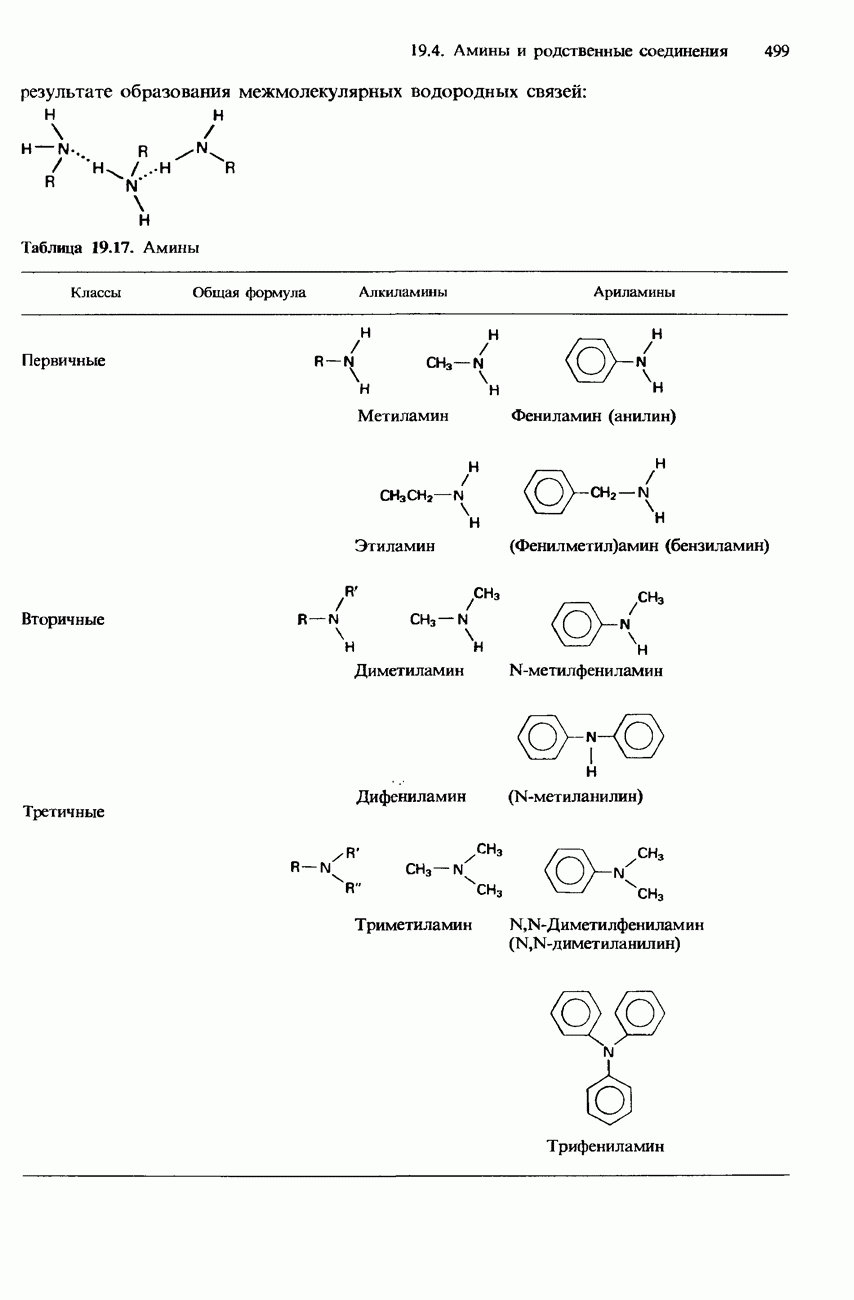
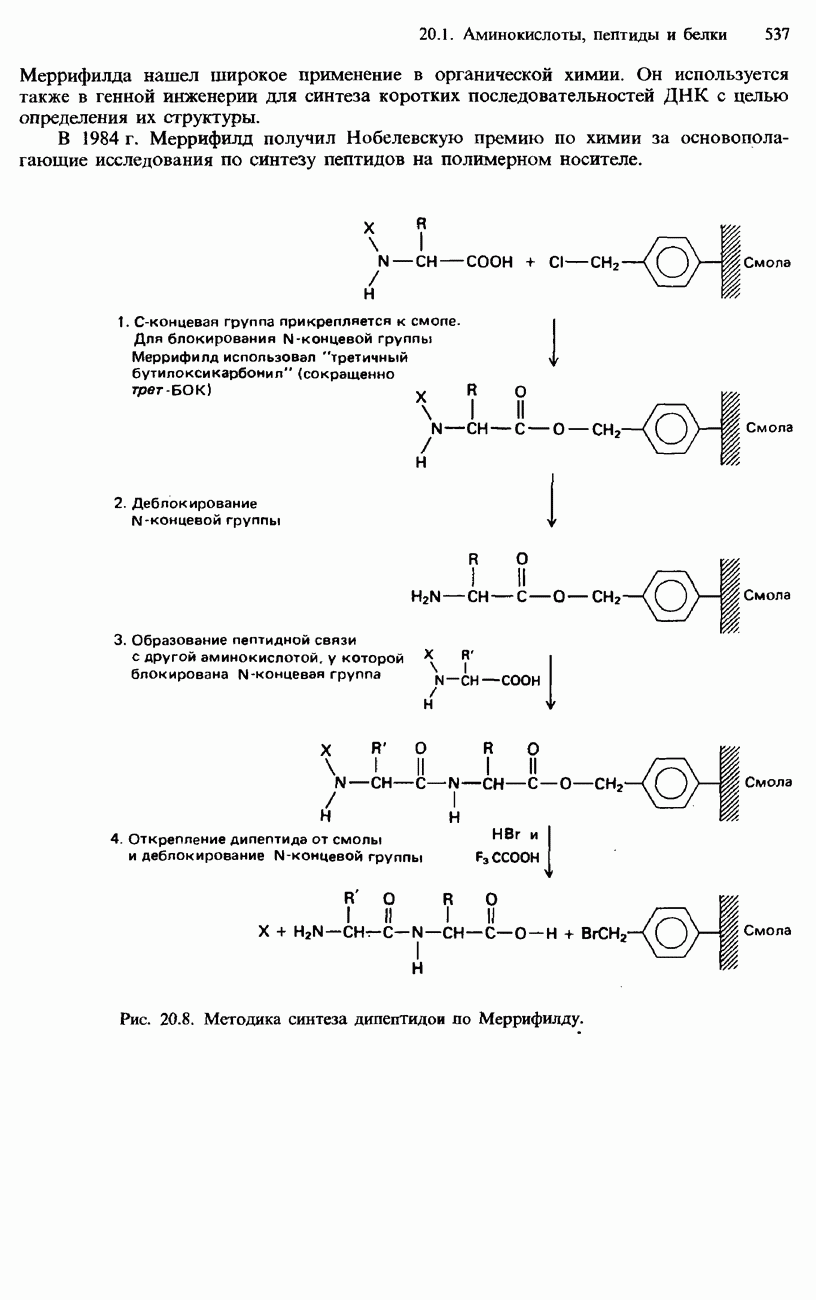
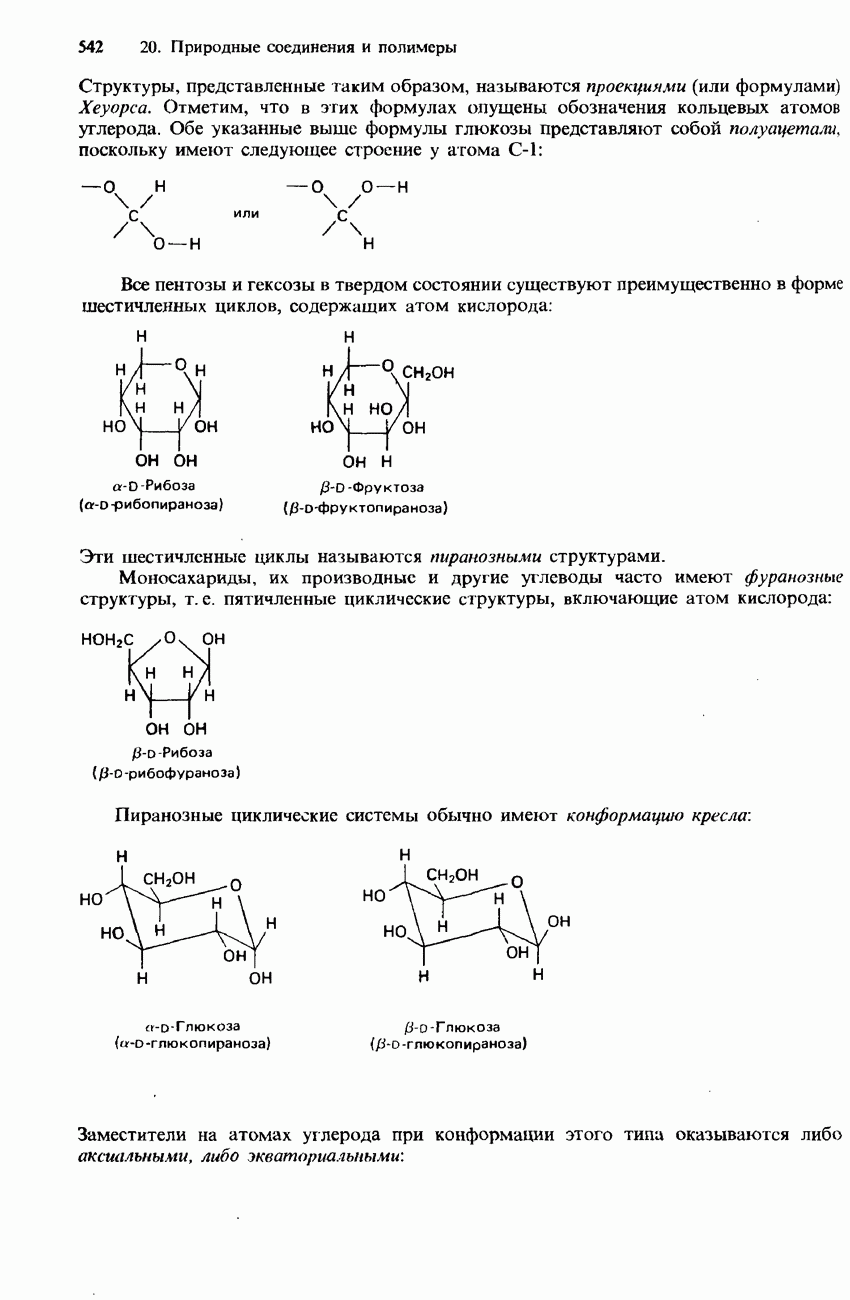
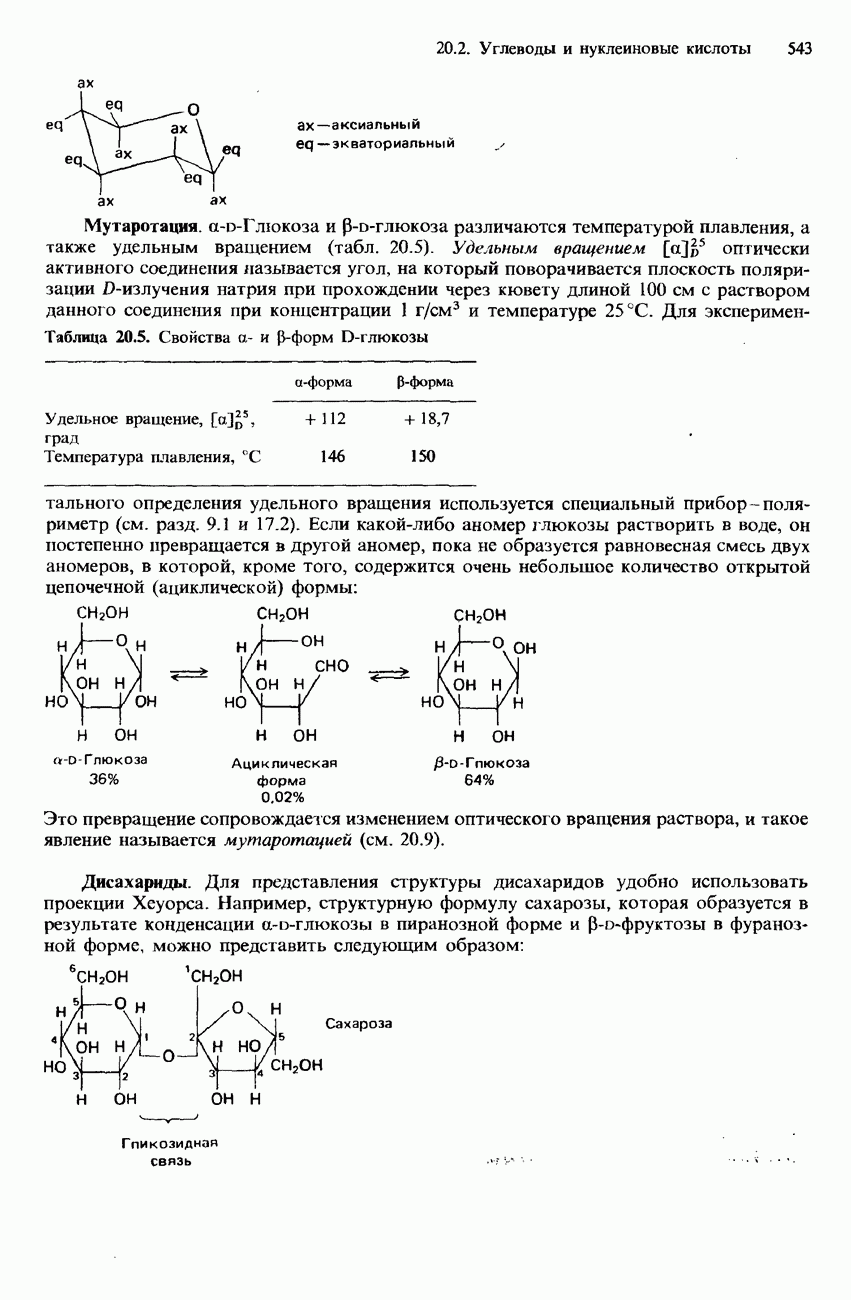
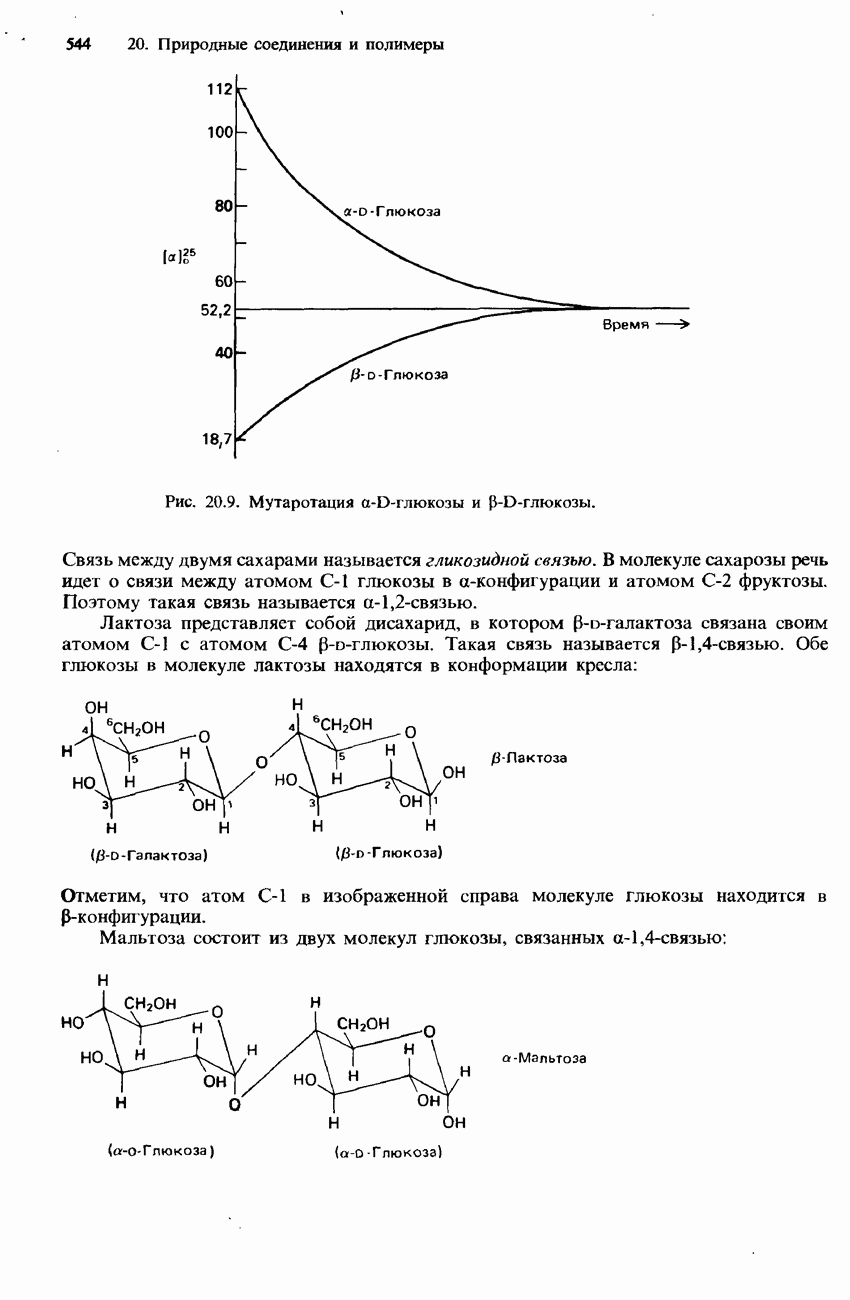
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
АЛКАНЫ
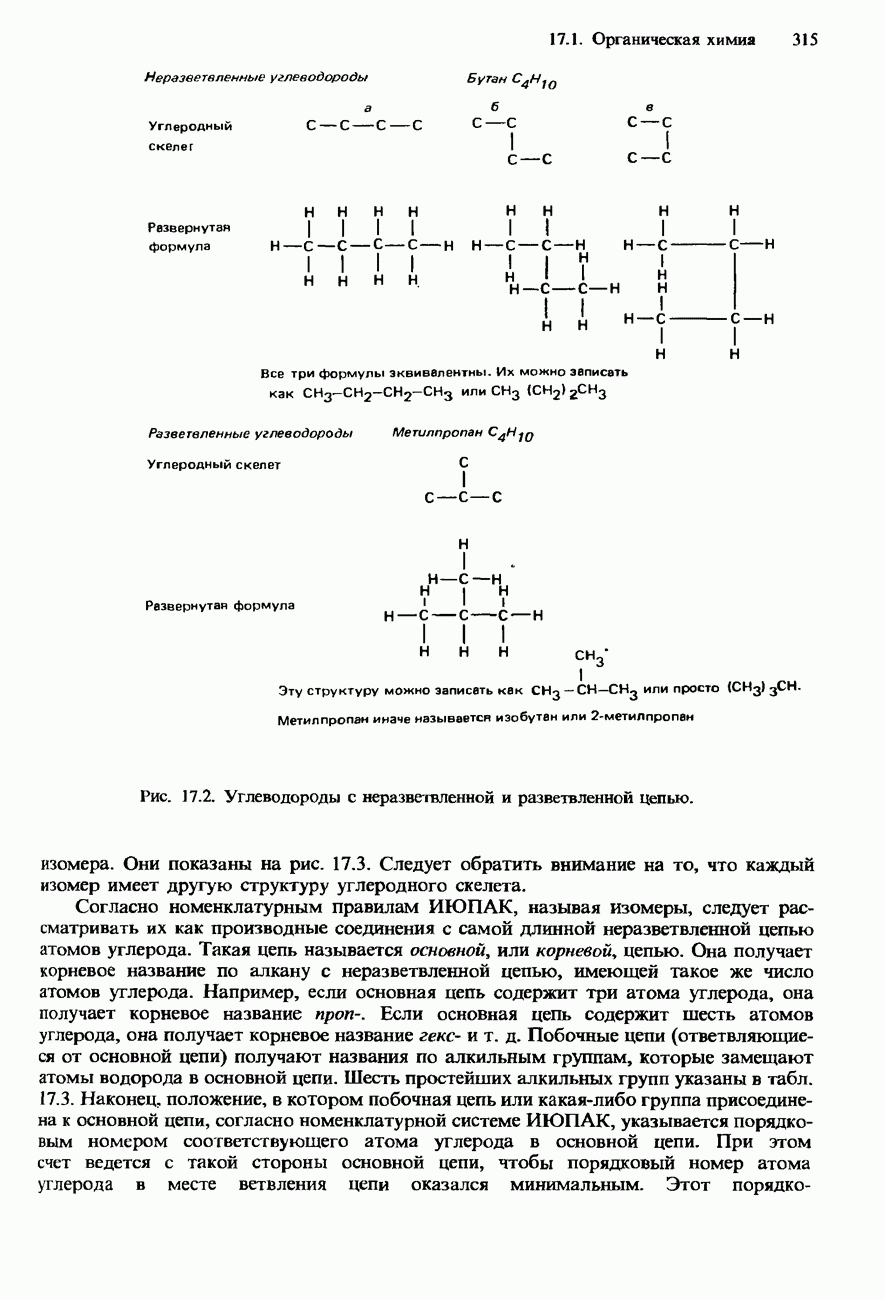
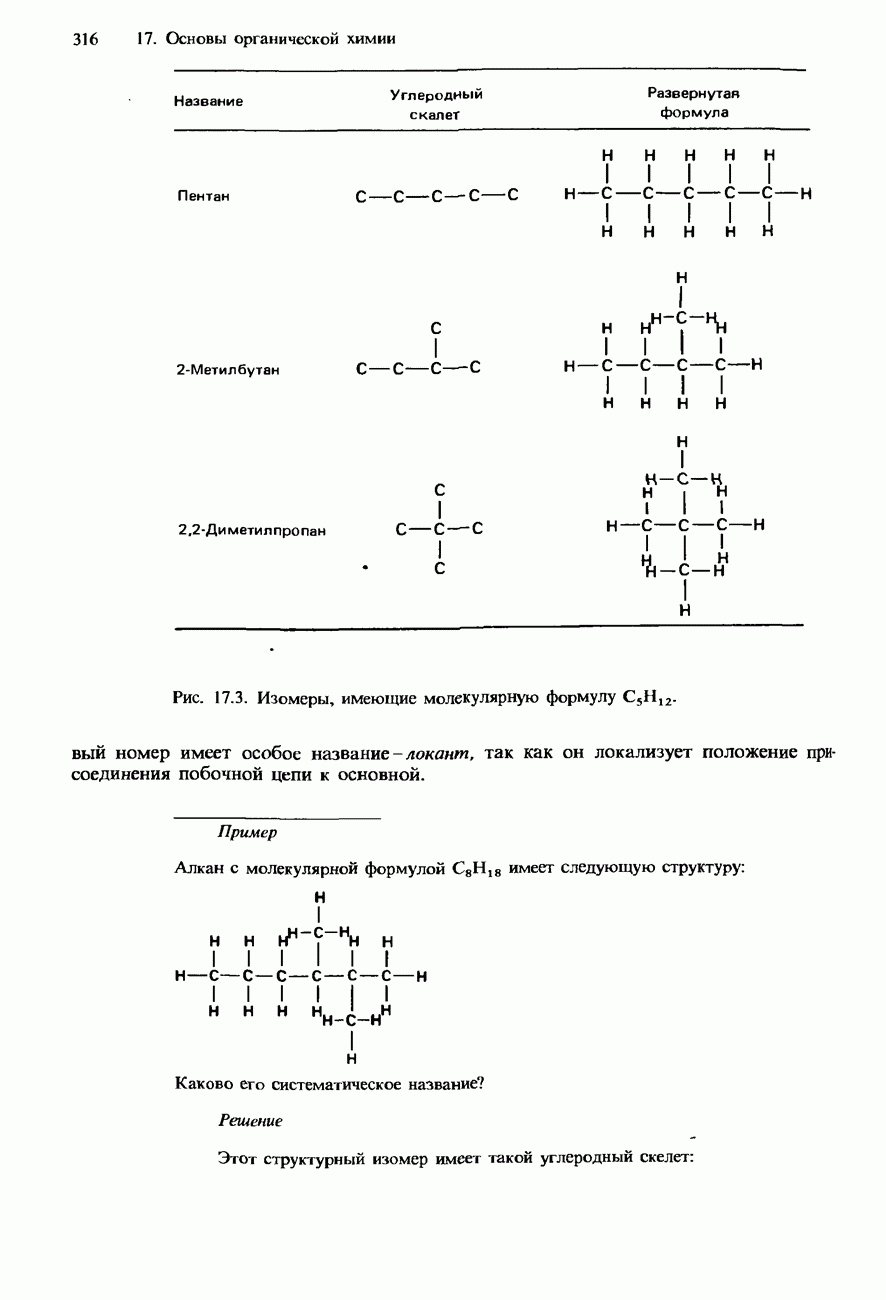
В табл. 17.3 указаны названия и формулы шести первых членов гомологического ряда алканов. В разд. 17.1 указаны номенклатурные правила ИЮПАК, которыми определяются систематические названия алканов.
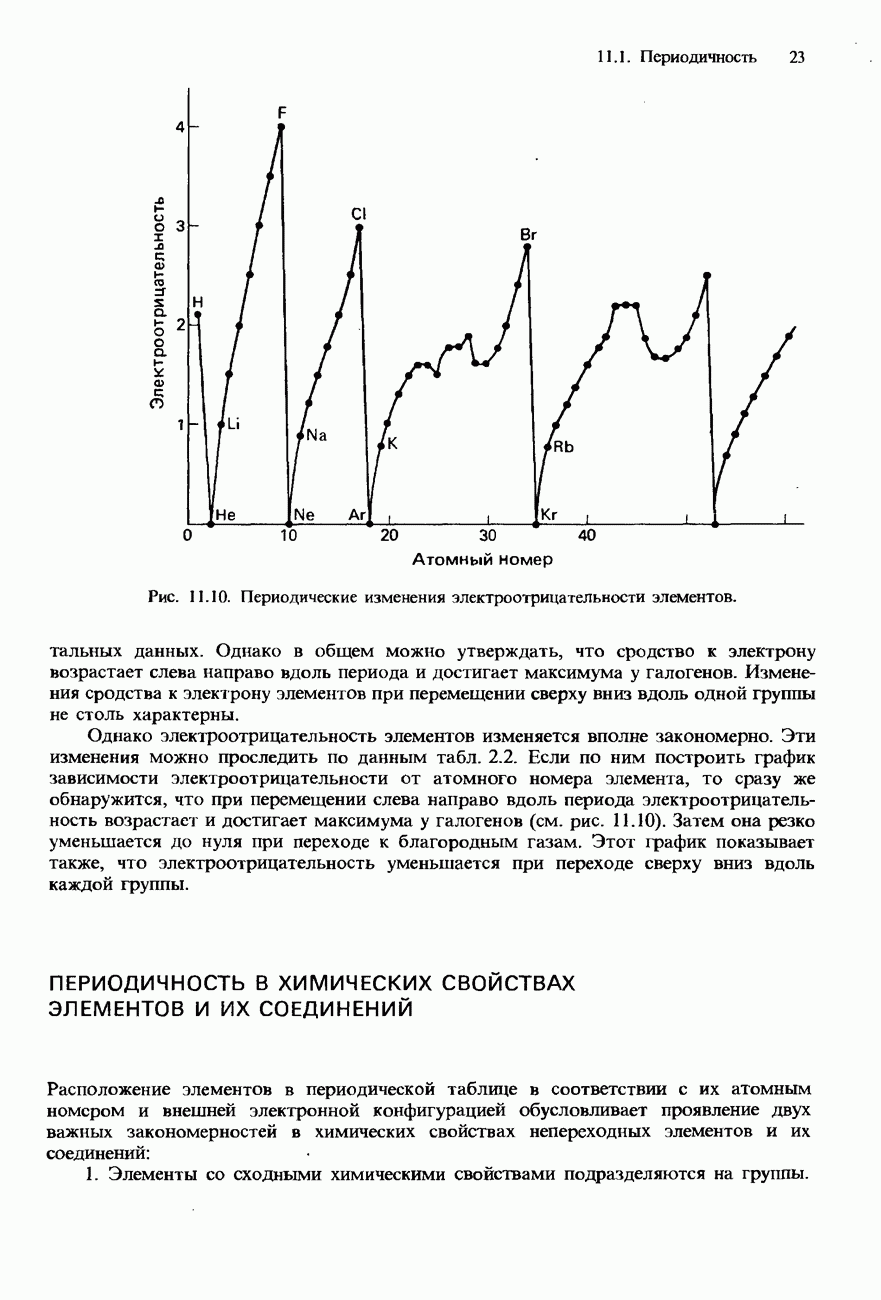
Физические свойства
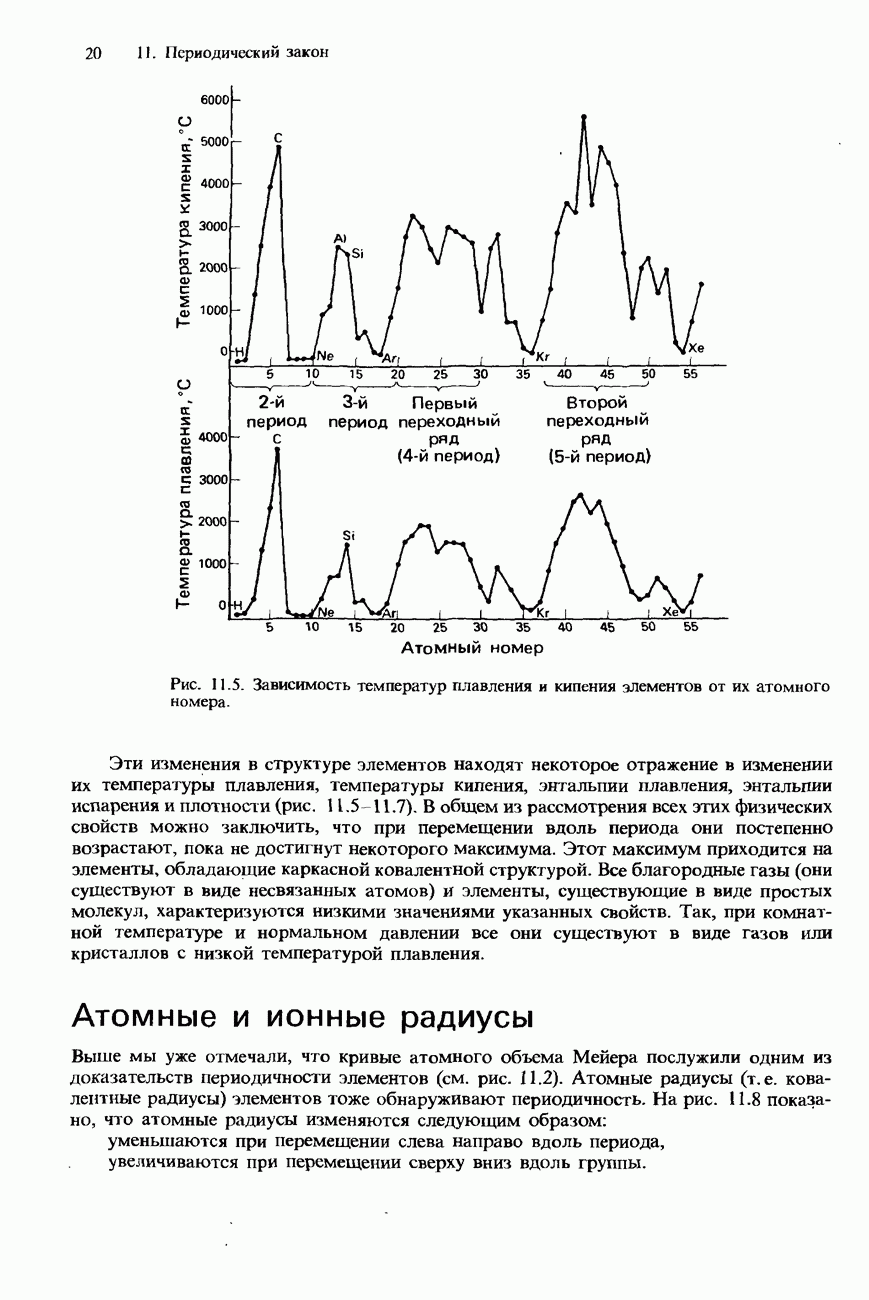
Температуры плавления и кипения алканов систематически возрастают по мере увеличения в их молекулах числа атомов углерода. На рис. 18.2 показано, как происходит повышение температуры кипения у первых восьми членов ряда алканов по мере увеличения в их молекулах числа атомов углерода. Алканы с числом атомов углерода от одного до четырех (от метана до бутана включительно) при комнатной температуре и нормальном давлении представляют собой бесцветные газы. Алканы с числом атомов углерода от 5 до 16 при нормальных условиях представляют собой жидкости, а алканы с еще большим числом атомов углерода - твердые вешества.
Все алканы нерастворимы в воде, но растворимы в органических растворителях, например этаноле (этиловом спирте) и этоксиэтане (диэтиловом эфире).
Лабораторные методы получения
Алканы легко получают из природного сырья (см. разд. 18.3), и поэтому обычно не возникает необходимости синтезировать их лабораторными или промышленными методами. В практических применениях алканы обычно используются в виде смесей и поэтому редко возникает необходимость выделить и подвергнуть очистке какой-либо

Рис. 18.2. Температуры кипения первых восьми членов гомологического ряда неразветвленных алканов.
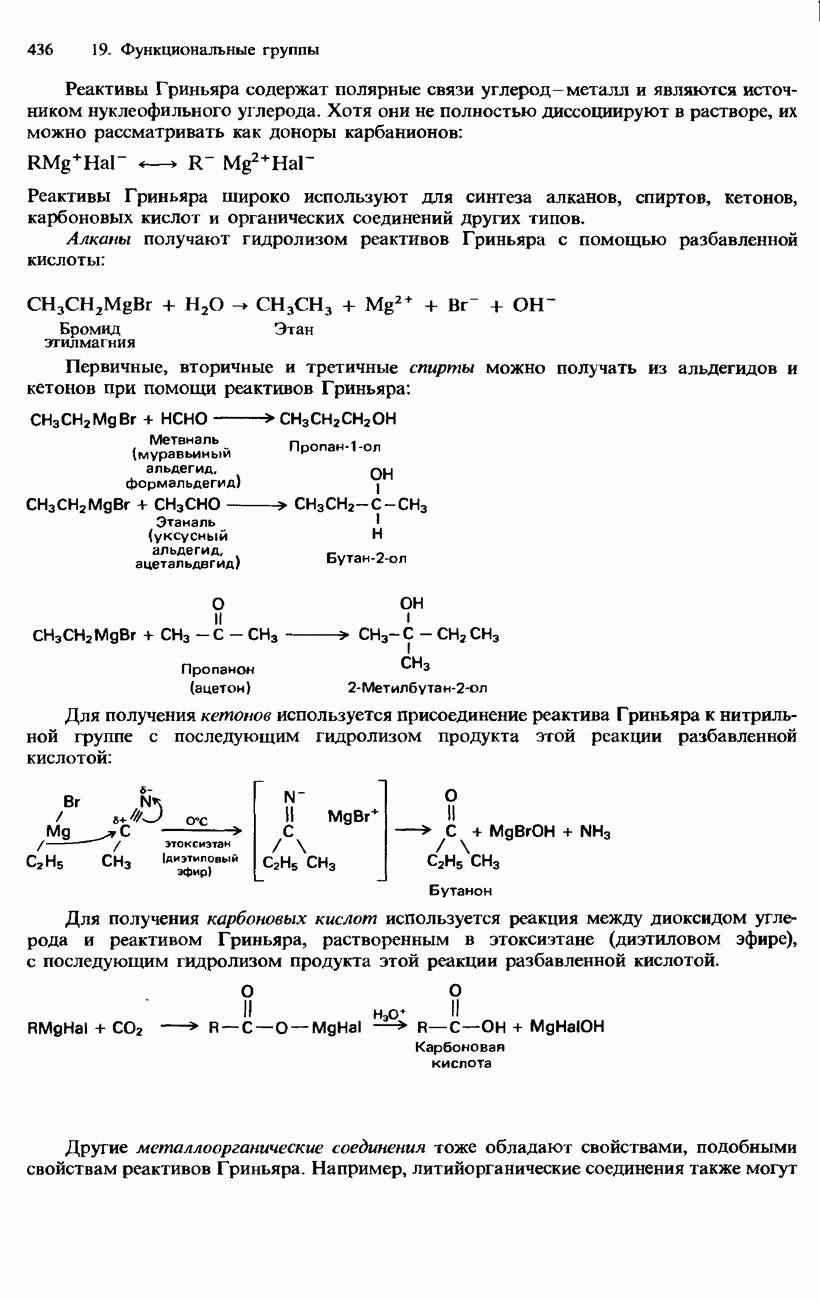
конкретный алкан. Для получения чистых алканов в лабораторных условиях может использоваться много способов. Например, алканы можно получать восстановлением соответствующих алкенов с помощью тонкоизмельченного палладиевого или платинового катализаторов (см. ниже). Другой лабораторный способ получения алканов заключается в проведении гидролиза алкилмагнийгалогенидов (реактивов Гриньяра, см. гл. 19).
Химические свойства
Алканы обладают сравнительно низкой химической активностью. Например, они не вступают в реакции с соединениями следующих классов: с сильными кислотами, например с соляной кислотой; с сильными основаниями, например с гидроксидом натрия; с сильными окислителями, например с перманганатом калия; с сильными восстановителями, например с натрием.
Низкая реакционная способность алканов обусловлена отсутствием электронодефицитных центров в их молекулах. Это в свою очередь объясняется тем, что углерод и водород обладают приблизительно одинаковой электроотрицательностью (см. табл. 2.2).
Однако алканы вступают в реакции замещения, например с хлором, и, кроме того, разумеется, в реакции горения. В реакциях обоих этих типов происходит гомолитическое расщепление (или гомолиз) ковалентных связей в молекулах алканов. Это означает, что указанные реакции осуществляются по радикальному механизму.
Горение
При наличии достаточного количества воздуха или кислорода алканы сгорают с образованием диоксида углерода и воды. В условиях ограниченного доступа кислорода алканы сгорают с образованием моноксида углерода и воды.
Моноксид углерода образуется при работе автомобильных двигателей в условиях замкнутого пространства. Высокий уровень содержания моноксида углерода обнаруживается в местах усиленного транспортного движения на городских улицах, застроенных высокими зданиями. В центральных частях больших городов был обнаружен уровень содержания моноксида углерода, превышающий 60 м. д. (м. д.-миллионные доли), тогда как по нормам Всемирной организации здравоохранения (ВОЗ) предельное содержание этого загрязнителя воздуха не должно превышать 9 м. д. в течение 8 ч или 36 м. д. в течение 1 ч. Эти нормы установлены в связи с сильной токсичностью моноксида углерода, который блокирует связывание гемоглобина крови с кислородом и тем самым препятствует нормальному дыханию. Вдыхание значительных количеств моноксида углерода вызывает повышенную утомляемость и головные боли. Моноксид углерода содержится также в сравнительно высоких концентрациях в сигаретном дыме.
В условиях очень ограниченного доступа воздуха алканы сгорают с образованием углерода в числе прочих продуктов. Свечение углеводородного пламени как раз и обусловлено наличием в нем тлеющих частичек углерода. Например, метан горит в бунзеновской горелке при полностью открытом отверстии для воздуха горячим бесцветным пламенем. Если закрыть это отверстие и тем самым резко ограничить доступ воздуха, образуется светящееся пламя.
Газовая сажа, которая используется в качестве пигмента для изготовления копировальной бумаги и типографских красок, а также наполнителя резины ттри изготовлении автомобильных шин, образуется при неполном сгорании алканов.
Механизм процессов горения очень сложен и полностью еще не установлен. Он включает сложную последовательность радикальных реакций. Однако суммарные реакции можно представить простыми стехиометрическими уравнениями. Например, горение метана должно включать одну или несколько следующих реакций в зависимости от условий доступа воздуха или кислорода:
1) при обильном доступе кислорода

2) при ограниченном доступе кислорода

3) при очень ограниченном доступе кислорода

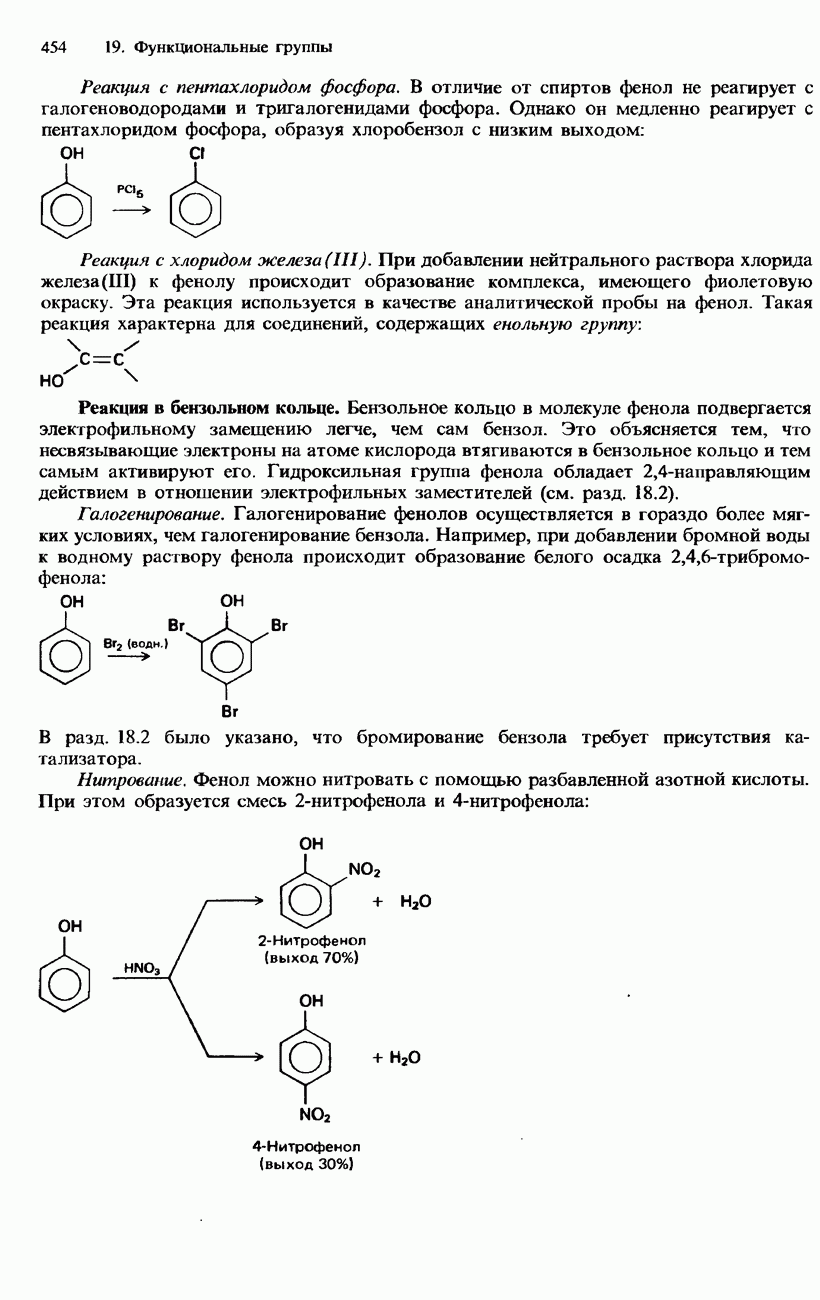
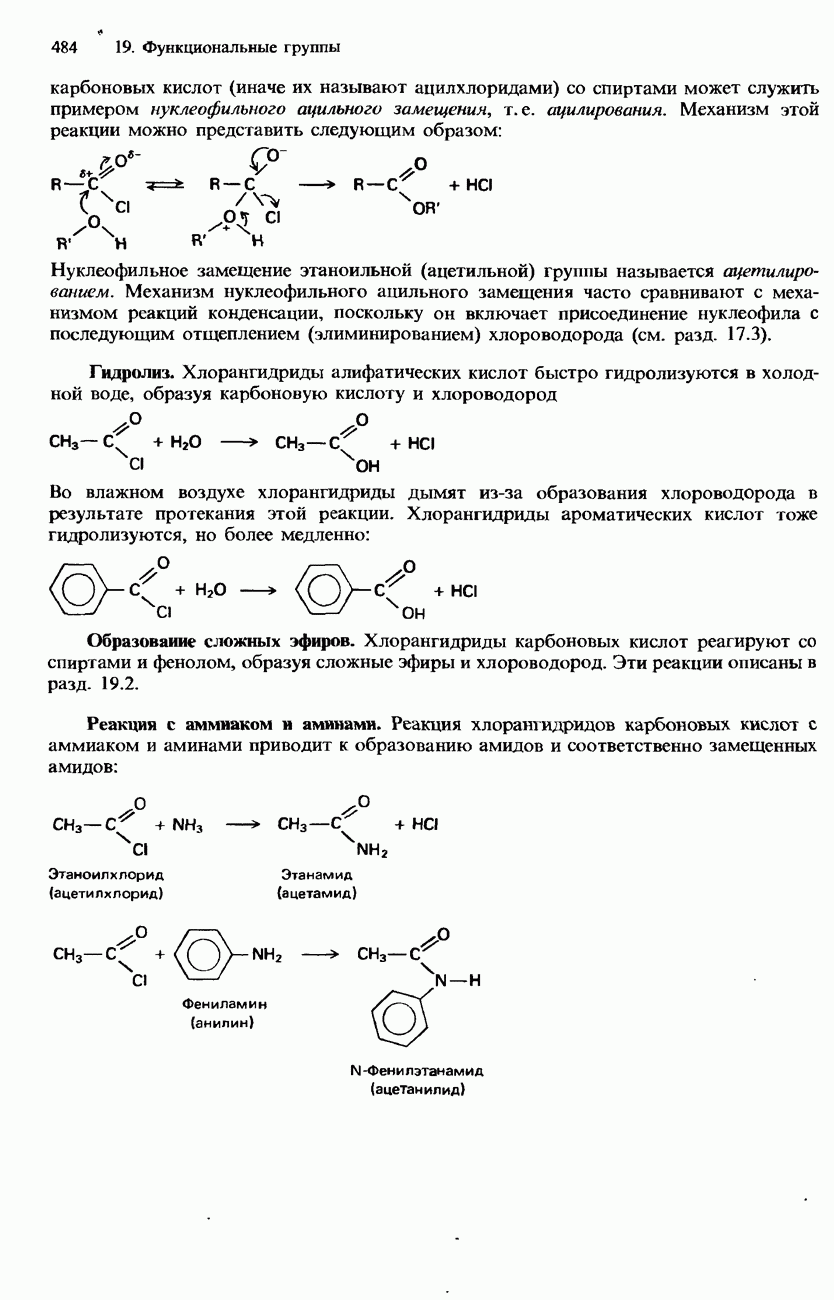
Реакции с хлором
Алканы не реагируют с хлором в темноте. Однако на солнечном свету они подвергаются ряду реакций замещения. Например, смесь метана с хлором на солнечном свету взрывается, в результате чего образуются смесь хлорометана  дихлорометана
дихлорометана  трихлорометана
трихлорометана  и тетрахлорометана
и тетрахлорометана 
Эта реакция является примером фотохимической цепной реакции (см. разд. 9.2). Она осуществляется в три стадии: инициирование, развитие и обрыв цепи.
Инициирование (зарождение цепи). Эта стадия представляет собой гомолитическое расщепление молекулы хлора с образованием радикалов хлора

Развитие цепи. Эта стадия включает множество реакций, приводящих к образованию таких продуктов, как  и
и  Например,
Например,


Алканы бурно реагируют с фтором. Их реакции с бромом протекают намного медленнее, чем с хлором. Как правило, они не реагируют с иодом.
Реакции алканов с бромом протекают гораздо селективнее, чем их реакции с хлором. Например, в присутствии солнечного света хлор реагирует с пропаном, образуя почти эквимолярную смесь  и
и  . Однако соответствующая реакция пропана с бромом приводит к образованию смеси из
. Однако соответствующая реакция пропана с бромом приводит к образованию смеси из  и лишь
и лишь 
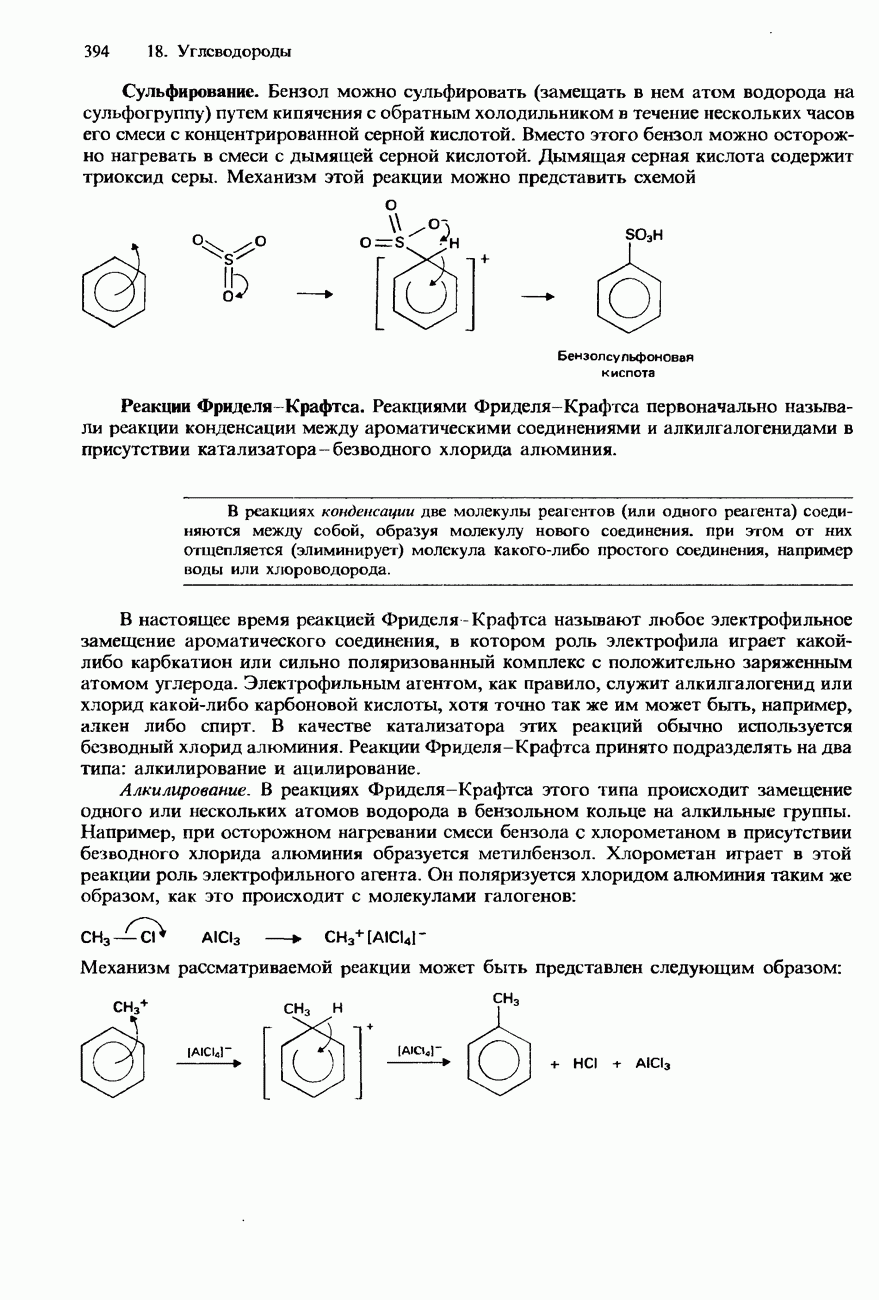
Крекинг
Так называется процесс, в котором происходит разрыв связей  в молекулах алканов с длинными цепями и образуются менее крупные молекулы алканов и алкенов (см. также разд. 18.3). Состав продуктов крекинга зависит от условий, в которых он проводится.
в молекулах алканов с длинными цепями и образуются менее крупные молекулы алканов и алкенов (см. также разд. 18.3). Состав продуктов крекинга зависит от условий, в которых он проводится.
Термический крекинг. Крекинг такого типа называется также пиролизом. В этом процессе алканы нагревают до температур  . При таких температурах происходит гомолитический разрыв углерод-углеродных связей в молекулах алканов. Эти реакции протекают по цепным механизмам с участием разнообразных радикалов. Рассмотрим их на сравнительно простом примере - термическом крекинге бутана.
. При таких температурах происходит гомолитический разрыв углерод-углеродных связей в молекулах алканов. Эти реакции протекают по цепным механизмам с участием разнообразных радикалов. Рассмотрим их на сравнительно простом примере - термическом крекинге бутана.
Инициирование. На этой стадии происходит образование метального, этильного и пропильного радикалов:

ИЛИ

Развитие цепи. Эти алкильные радикалы реагируют с молекулами бутана, образуя бутильные радикалы. Например,

Затем связи  в бутильных радикалах подвергаются гомолитическому расщеплению с образованием молекул алкенов и новых радикалов
в бутильных радикалах подвергаются гомолитическому расщеплению с образованием молекул алкенов и новых радикалов

Помимо этого возможны также самые разнообразные другие стадии развития цепи.
Обрыв цепи. Как обычно, эта стадия наступает, когда два радикала соединяются друг с другом, образуя какую-либо молекулу. Например,


Рис. 18.3. Каталитический крекинг алканов.
На практике термический крекинг бутана приводит к образованию смеси метана, этана, этилена, пропена, 1-бутена, 2-бутена и водорода.
Каталитический крекинг. Этот метод крекинга заключается в том, что алкан пропускают над поверхностью катализатора при температурах 400-500 °С. Обычно в качестве катализаторов крекинга используют смесь оксида алюминия с кремнеземом либо оксидом  . Подобно термическому крекингу, каталитический крекинг тоже приводит к образованию смеси алканов и алкенов, обладающих более короткими углеродными цепями. Однако в отличие от термического крекинга каталитический крекинг имеет ионный механизм. Использование в качестве катализаторов ионных оксидов приводит к образованию карбанионов и карбкатионов.
. Подобно термическому крекингу, каталитический крекинг тоже приводит к образованию смеси алканов и алкенов, обладающих более короткими углеродными цепями. Однако в отличие от термического крекинга каталитический крекинг имеет ионный механизм. Использование в качестве катализаторов ионных оксидов приводит к образованию карбанионов и карбкатионов.
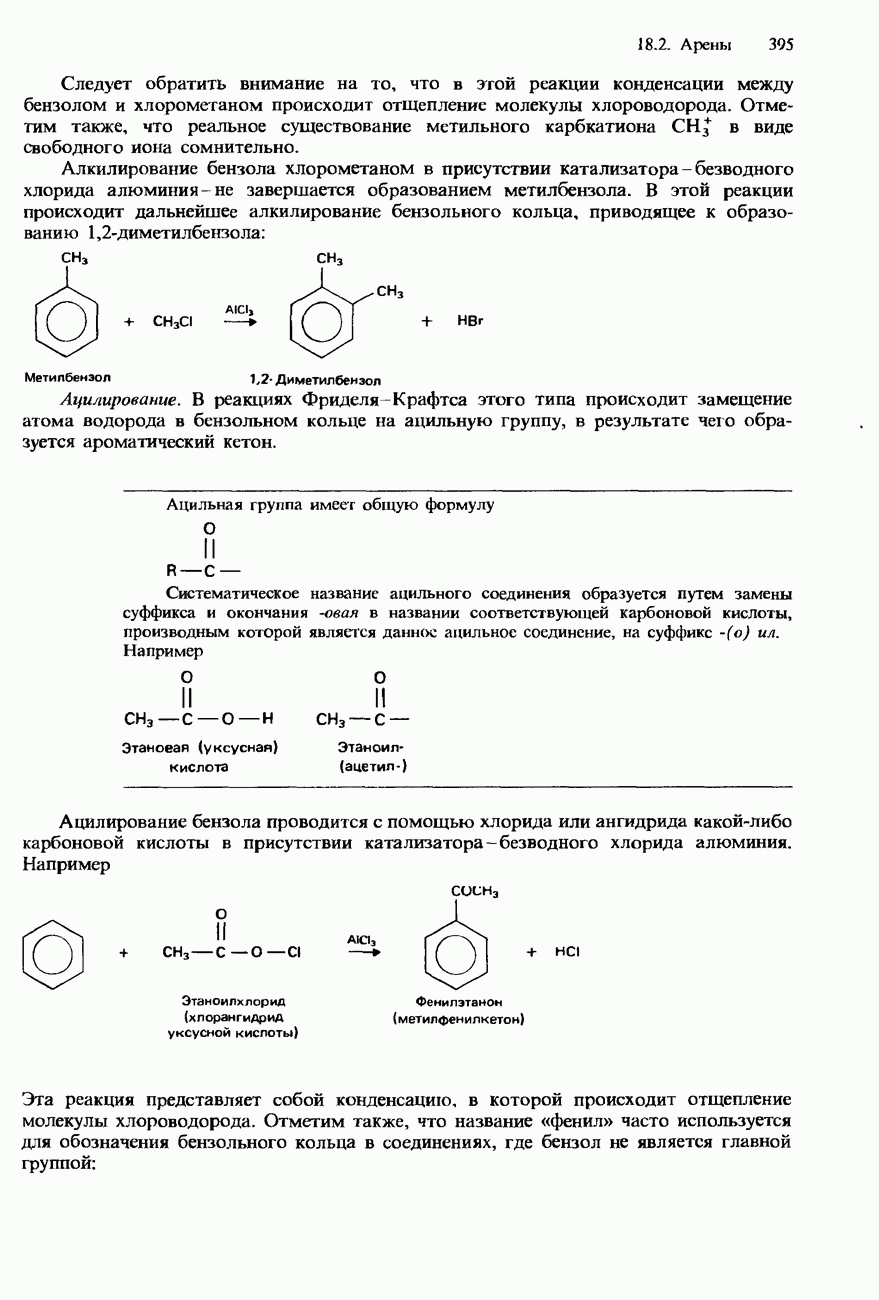
Каталитический крекинг можно продемонстрировать в лабораторных условиях с помощью установки, схематически изображенной на рис. 18.3. Присутствие алкенов в смеси образовавшихся продуктов можно обнаружить, встряхивая ее с бромной водой. Ненасыщенные соединения обесцвечивают бромную воду (см. ниже).
При проведении этого эксперимента следует позаботиться о том, чтобы после прекращения нагрева или при уменьшении скорости образования пузырьков газа отводная трубка была вынута из воды, иначе через трубку в горячую пробирку будет втягиваться вода.
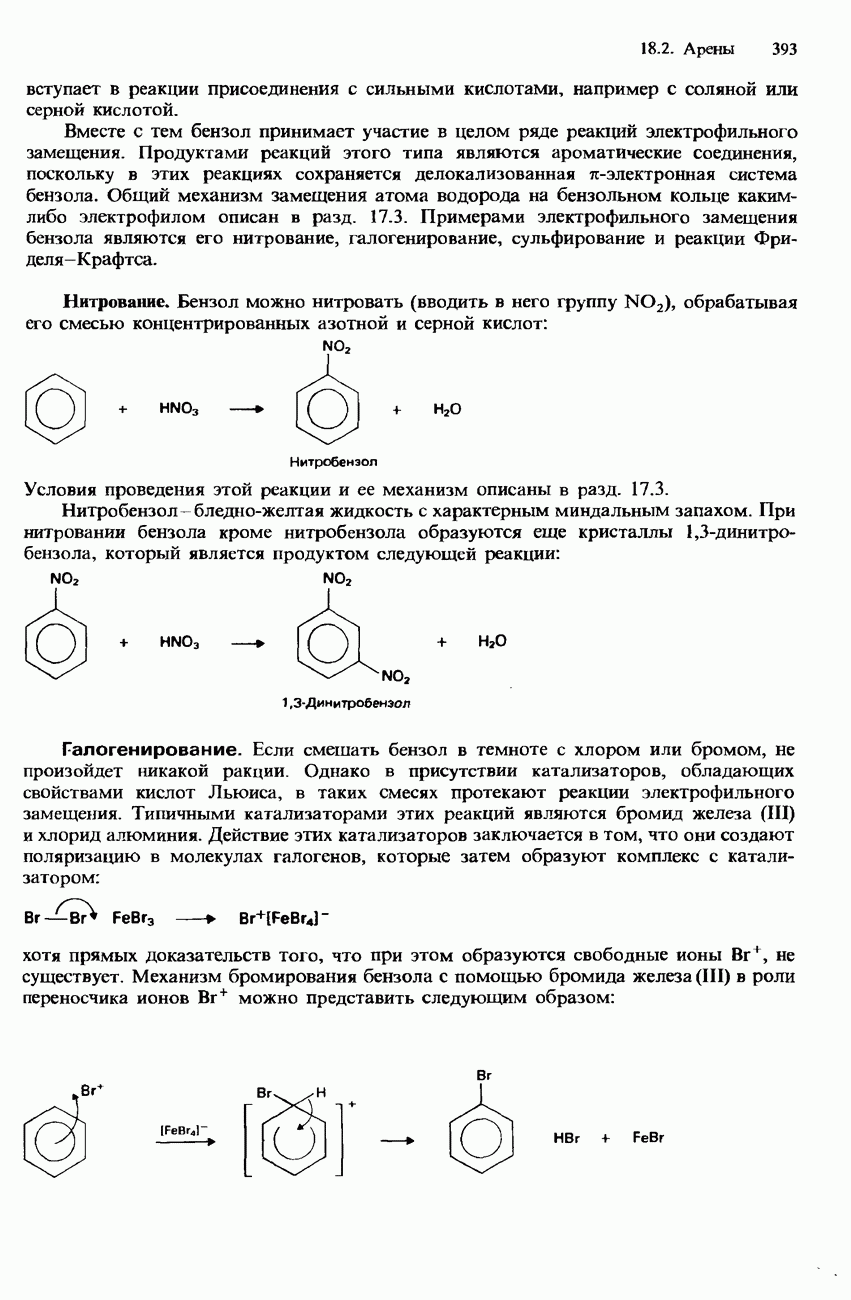
Нитрование
Нитрование алканов (замещение атома водорода на нитрогруппу) может осуществляться с помощью азотной кислоты. Эта реакция протекает в паровой фазе при температурах порядка 

Высшие алканы при нитровании образуют смеси продуктов. Для их разделения используется фракционная перегонка. Нитроалканы используются в качестве растворителей.
| << Предыдущий параграф | Следующий параграф >> |
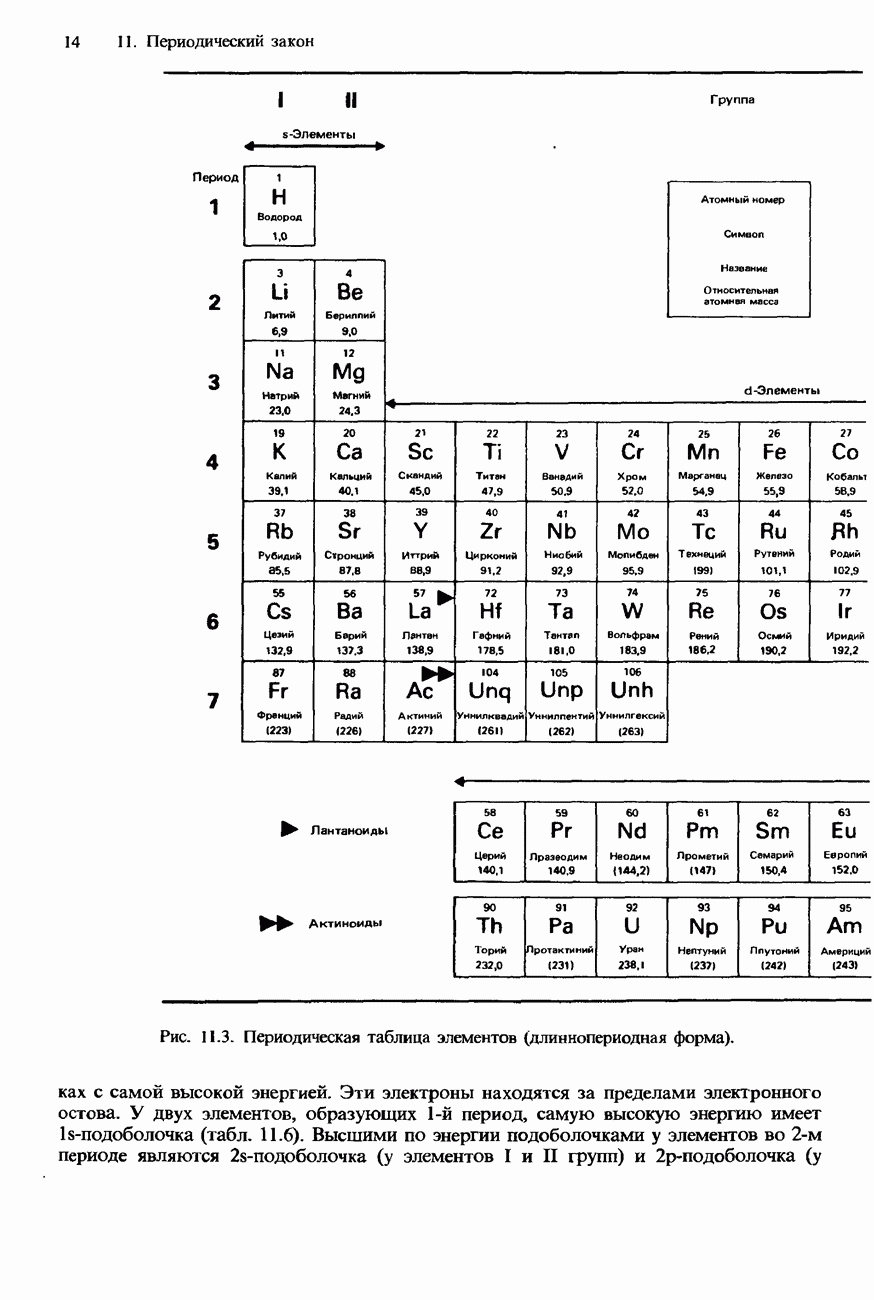
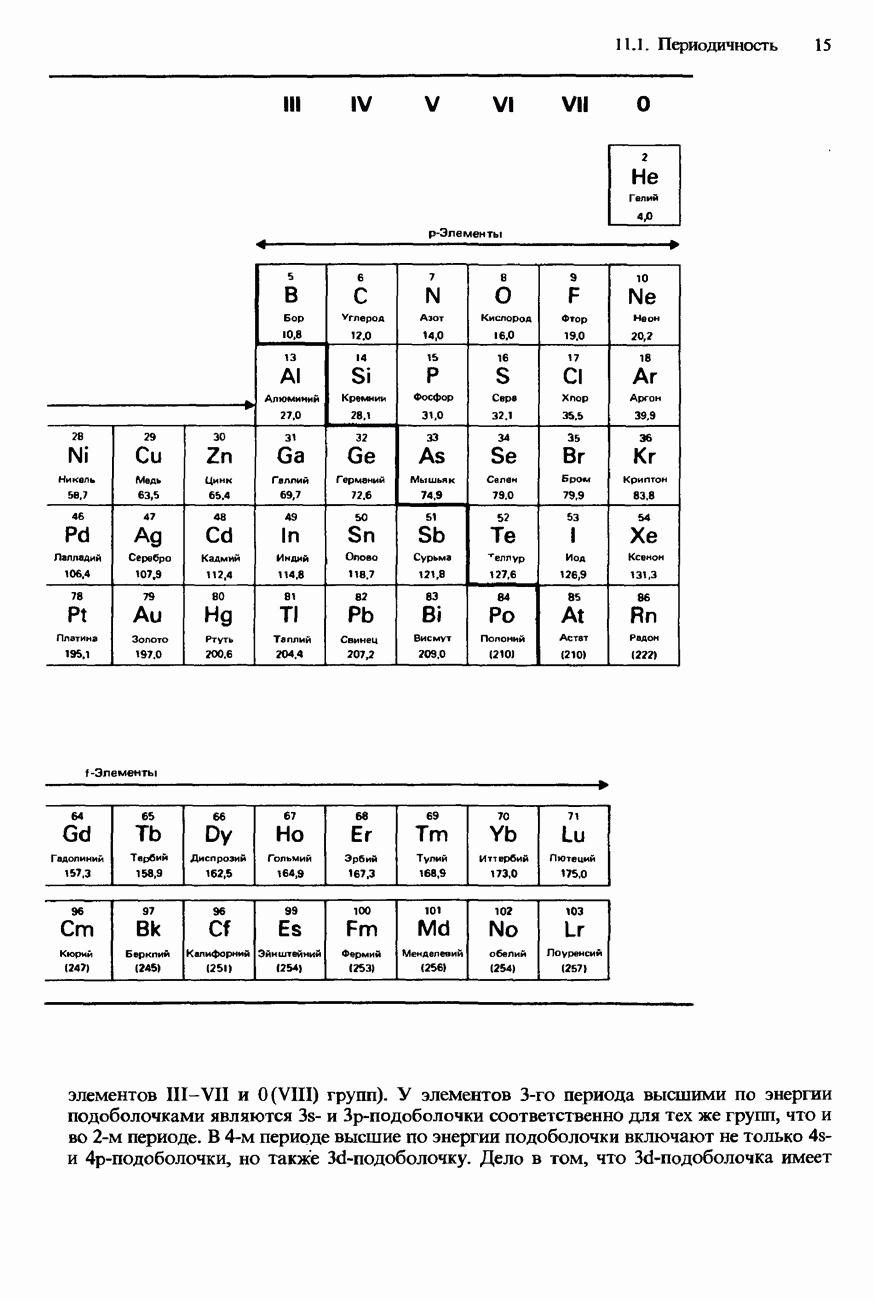
- 11. ПЕРИОДИЧЕСКИЙ ЗАКОН
- 11.1 Периодичность
- СОВРЕМЕННАЯ ФОРМА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
- ПЕРИОДИЧНОСТЬ
- ПЕРИОДИЧНОСТЬ В ХИМИЧЕСКИХ СВОЙСТВАХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 12. ВОДОРОД И ВОДА
- 12.1. ВОДОРОД
- ПОЛУЧЕНИЕ ВОДОРОДА В ЛАБОРАТОРНЫХ УСЛОВИЯХ
- РАЗЛИЧНЫЕ ФОРМЫ ВОДОРОДА
- ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
- ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
- ТИПЫ СОЕДИНЕНИЙ ВОДОРОДА
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПОЛУЧЕНИЕ И ИСПОЛЬЗОВАНИЕ ВОДОРОДА
- 12.2 Вода
- ХИМИЧЕСКИЕ РЕАКЦИИ С УЧАСТИЕМ ВОДЫ
- ИСТОЧНИКИ ПРЕСНОЙ ВОДЫ И ЕЕ ИСПОЛЬЗОВАНИЕ
- КАЧЕСТВО ВОДЫ
- ЗАГРЯЗНЕНИЕ ВОДЫ
- ОЧИСТКА И ПОДГОТОВКА ВОДЫ
- ОКЕАНЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 13. s-Металлы
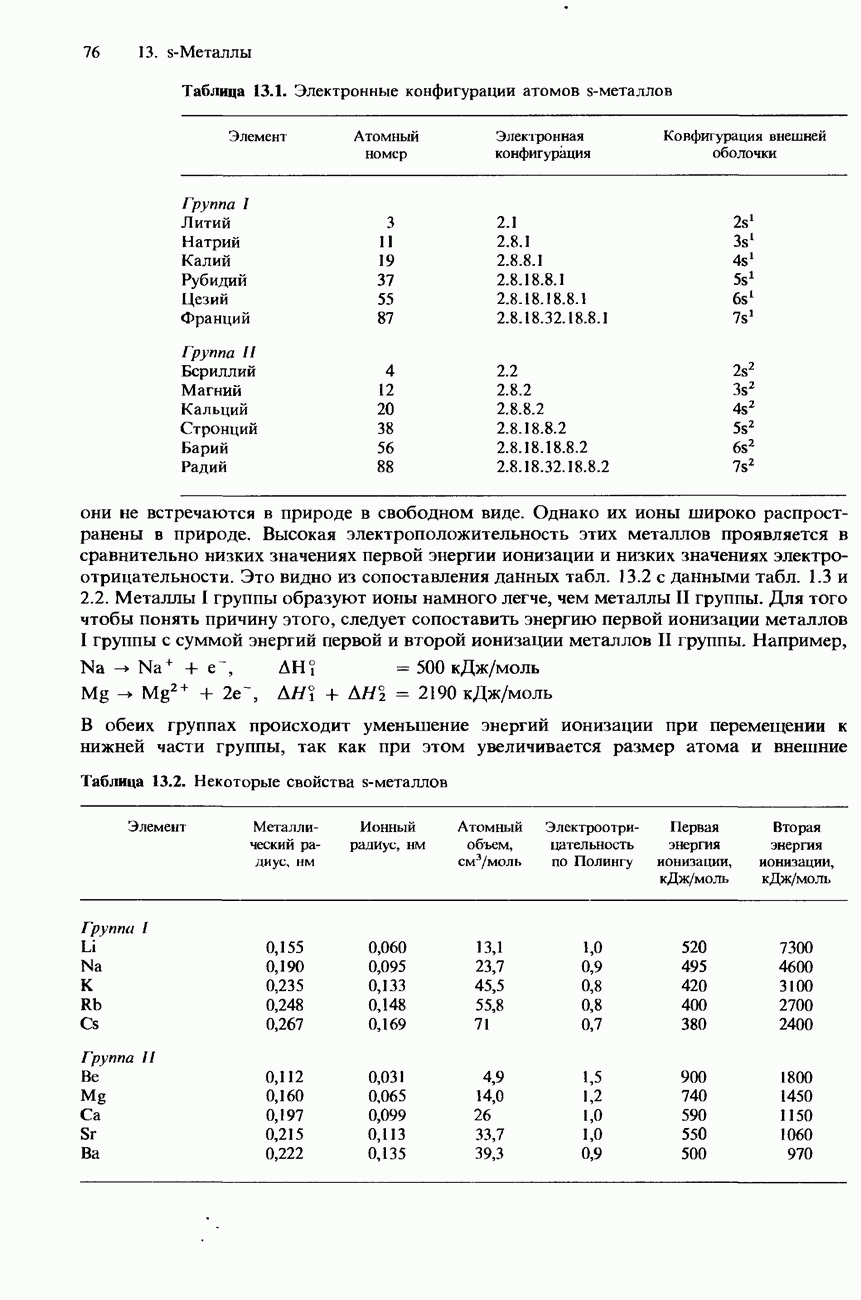
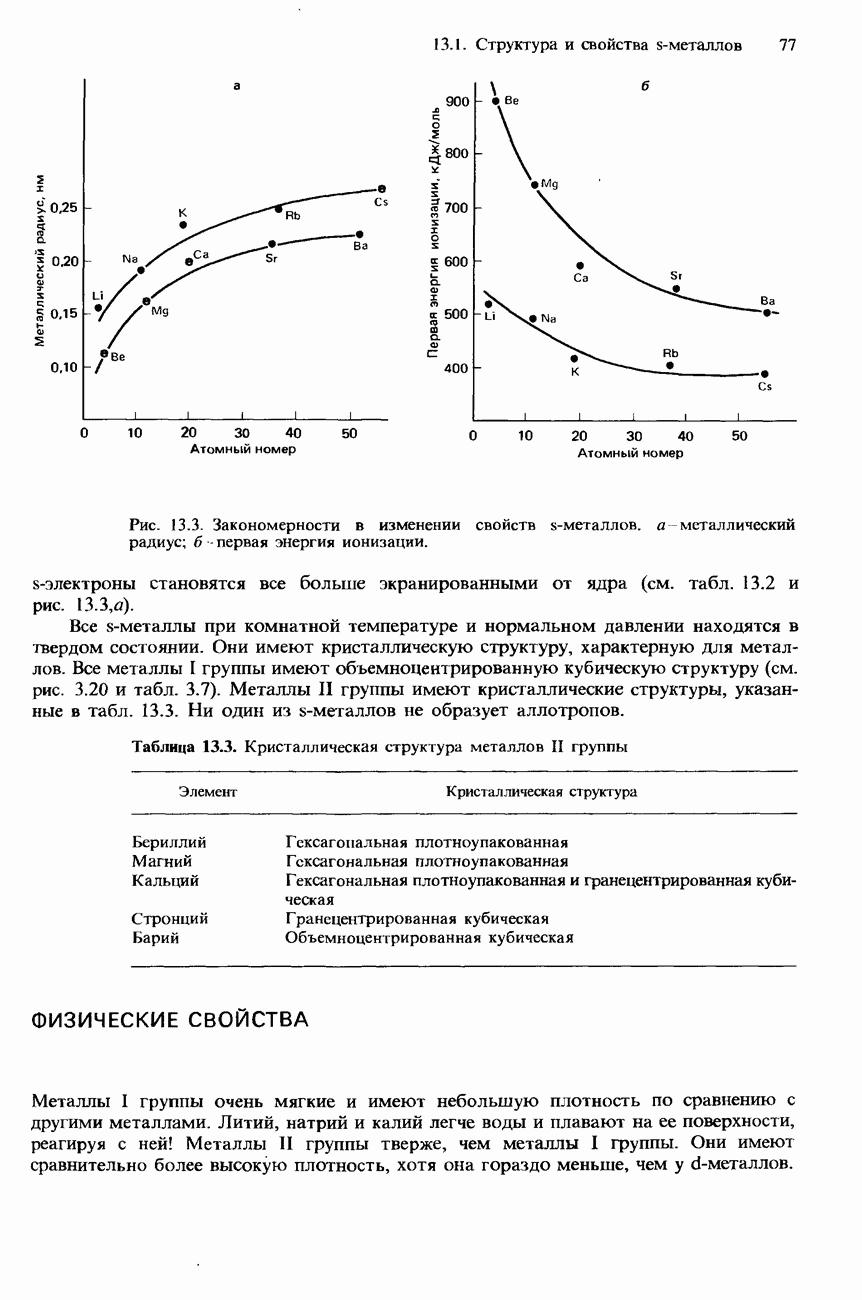
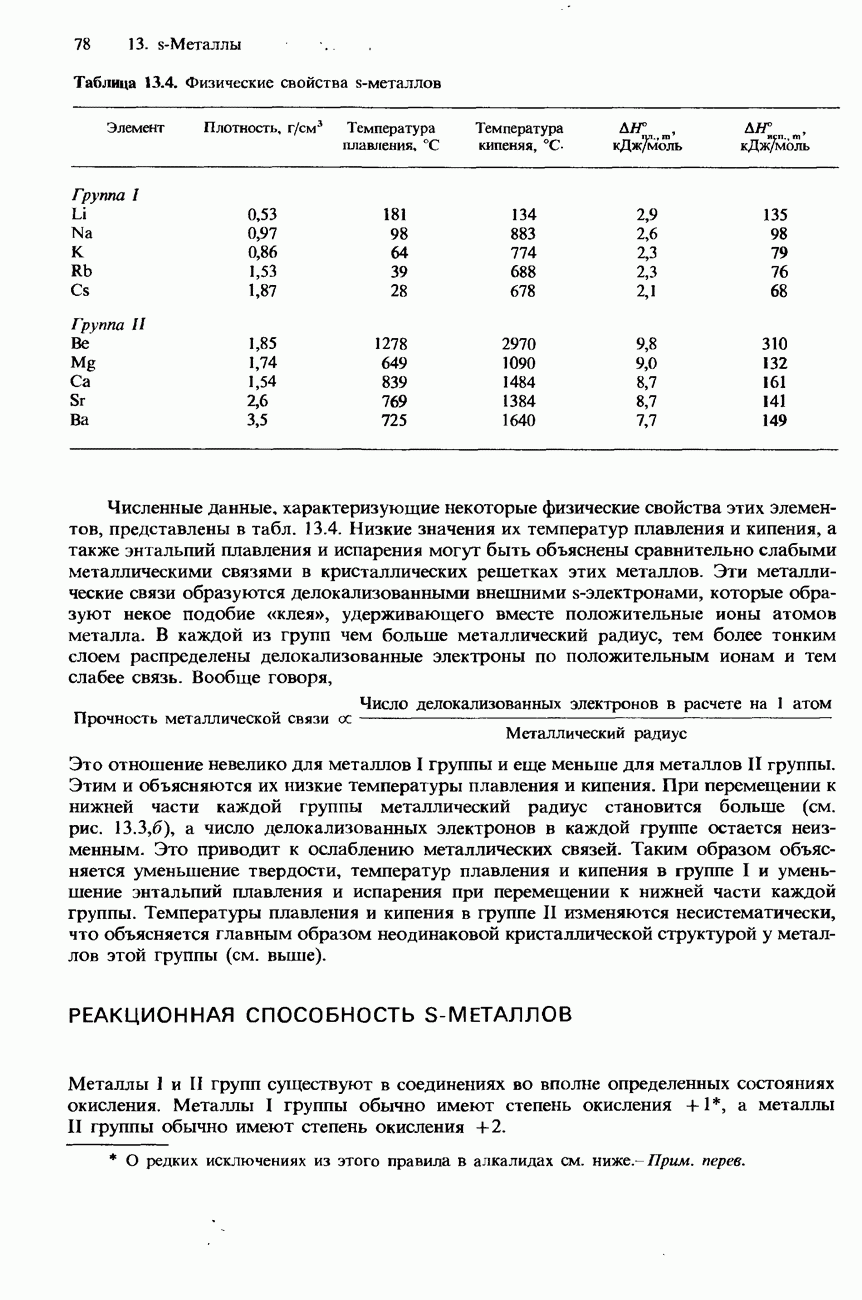
- 13.1 Структура и свойства s-металлов
- СТРУКТУРА
- ФИЗИЧЕСКИЕ СВОЙСТВА
- РЕАКЦИОННАЯ СПОСОБНОСТЬ S-МЕТАЛЛОВ
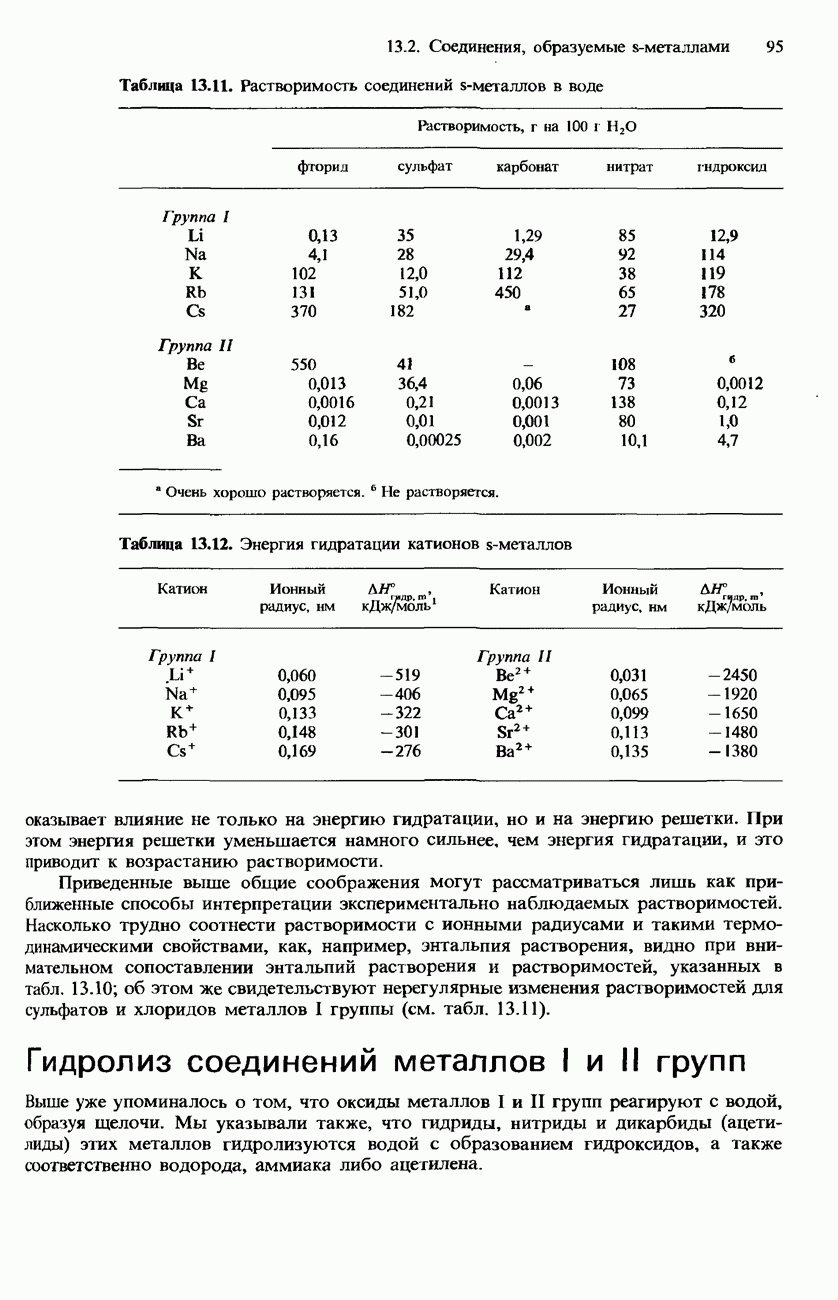
- 13.2 Соединения, образуемые s-металлами
- ДРУГИЕ БИНАРНЫЕ СОЕДИНЕНИЯ
- ГИДРОКСИДЫ
- КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ ОКСОСОЕДИНЕНИЙ S-МЕТАЛЛОВ
- РАСТВОРИМОСТЬ СОЛЕЙ И ГИДРОКСИДОВ МЕТАЛЛОВ I И II ГРУПП В ВОДЕ
- АНОМАЛЬНЫЕ СВОЙСТВА ЛИТИЯ И БЕРИЛЛИЯ, А ТАКЖЕ ИХ СОЕДИНЕНИЙ
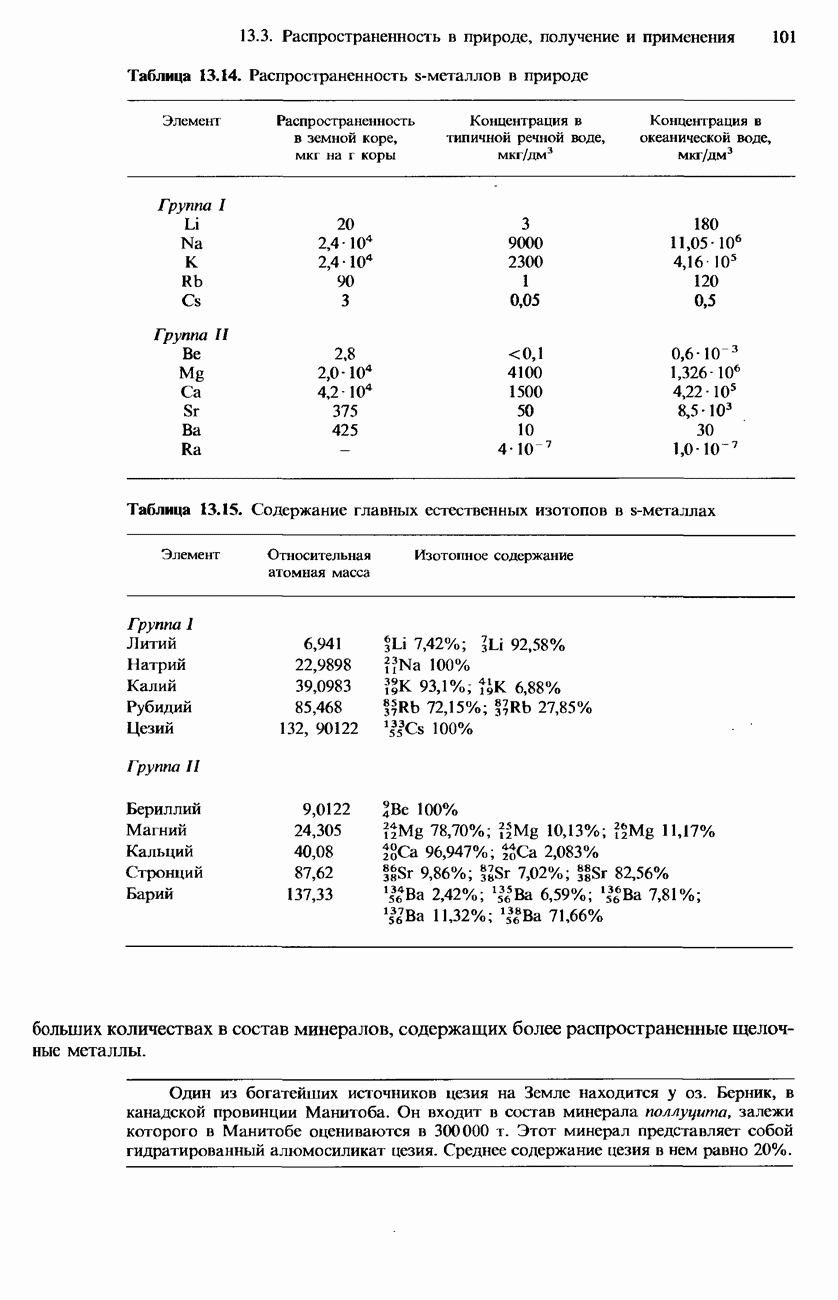
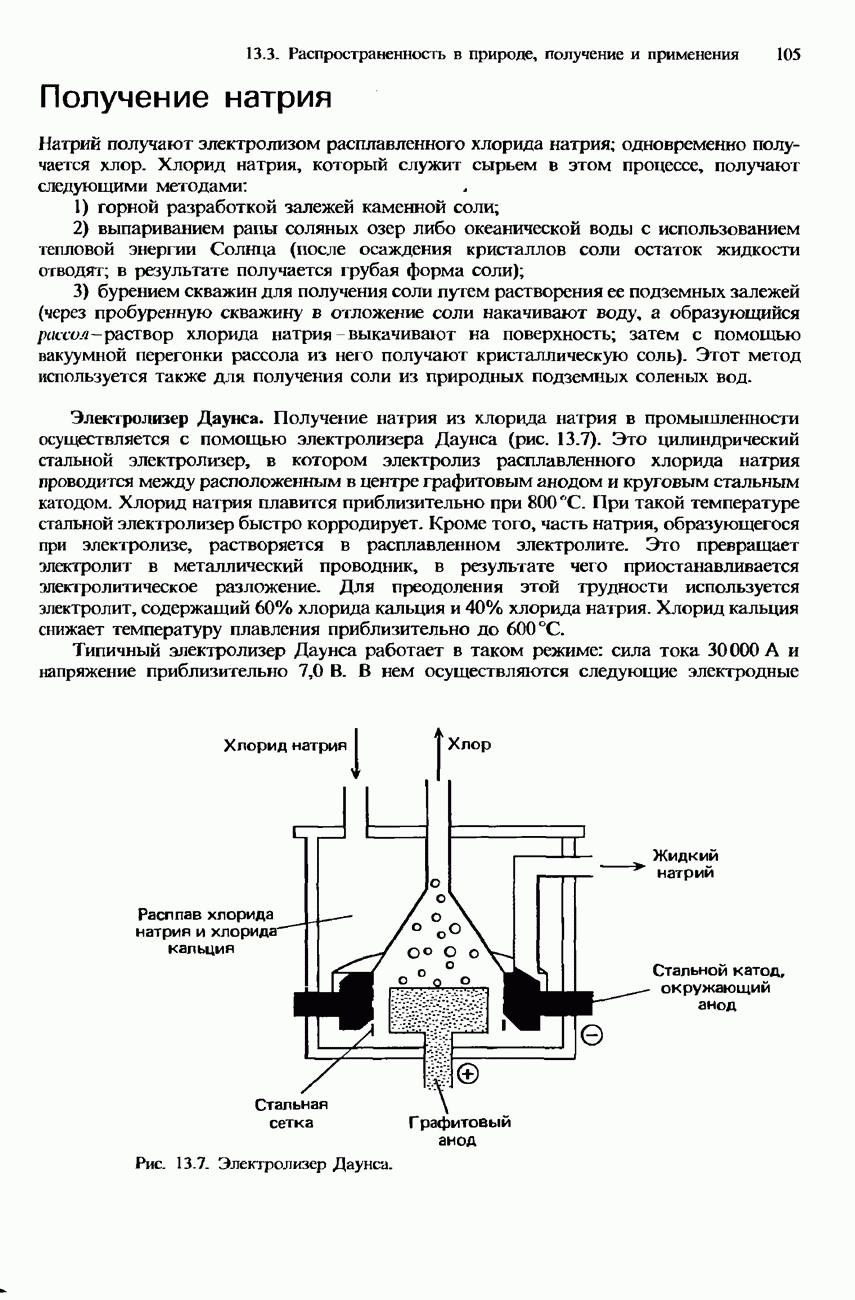
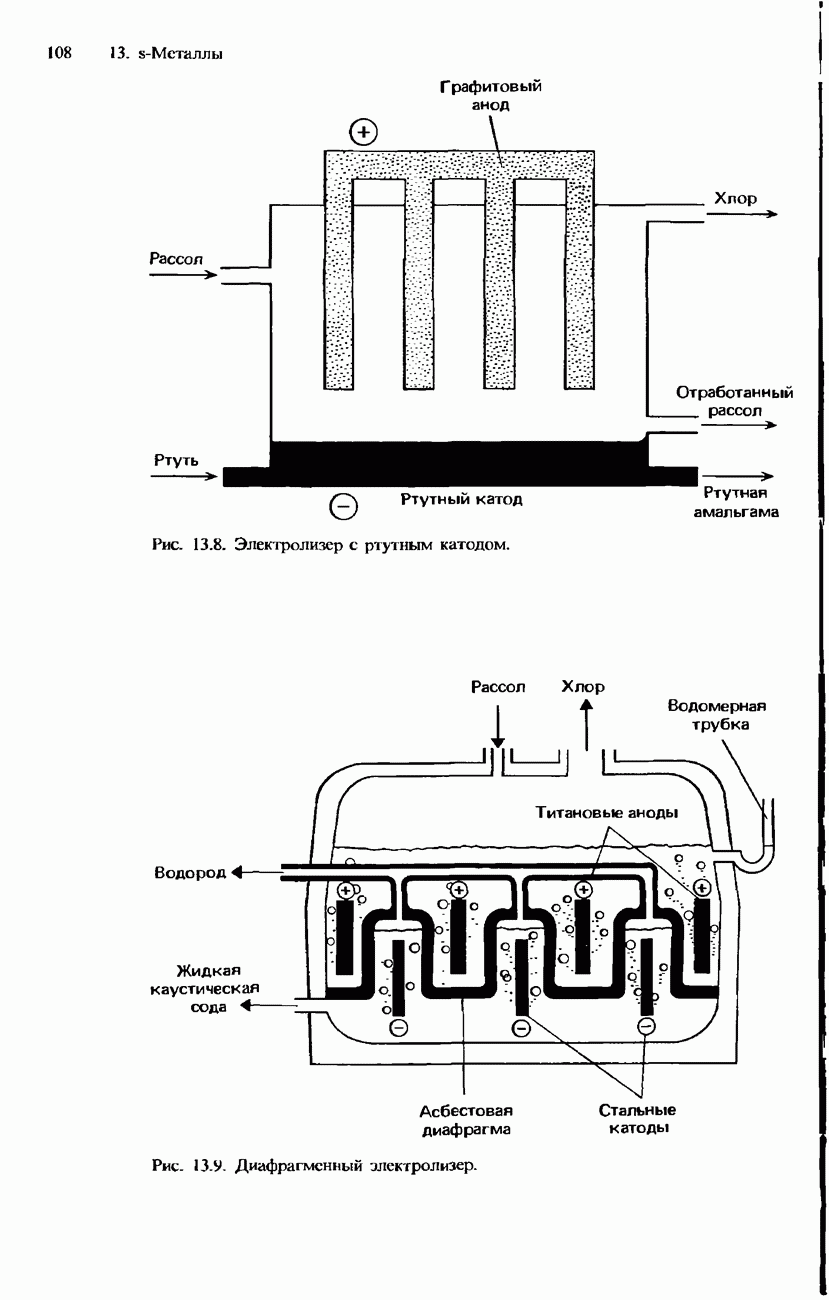
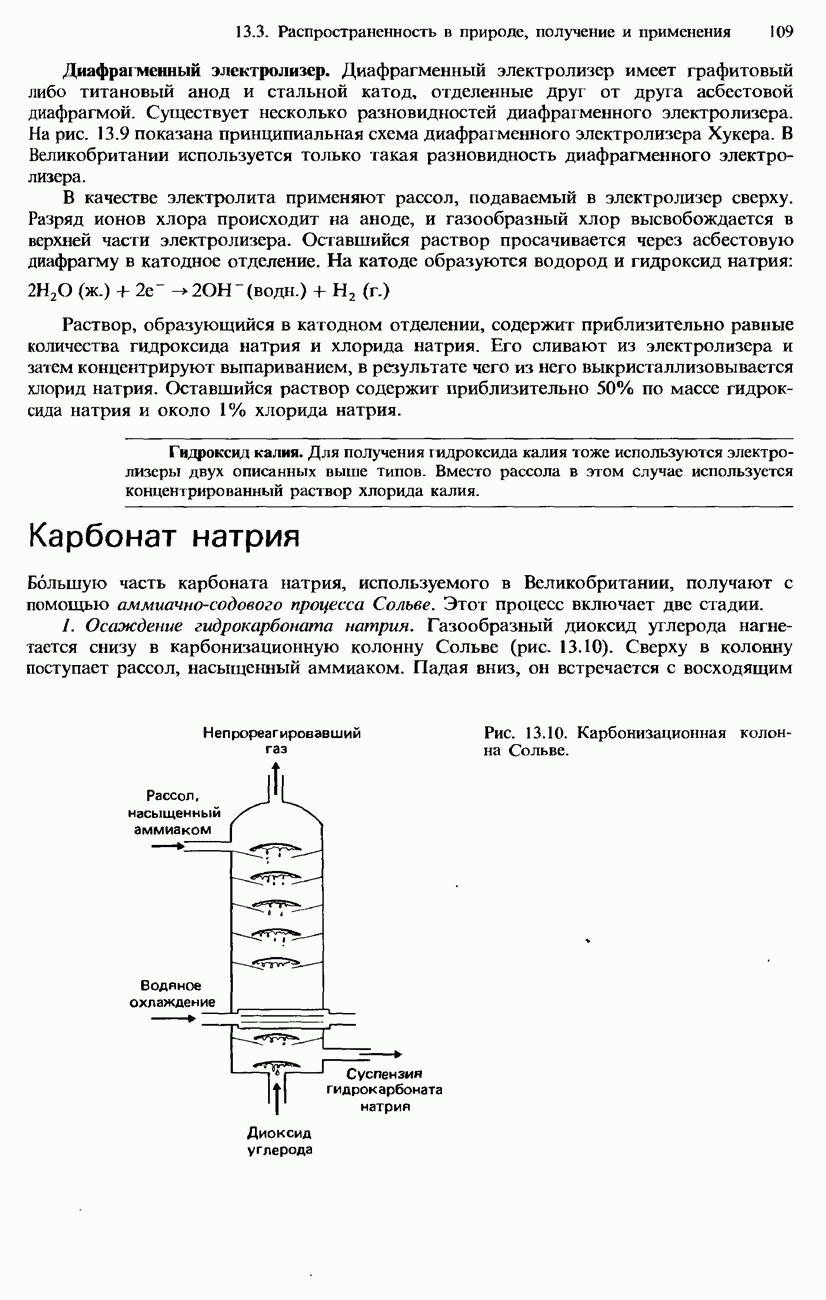
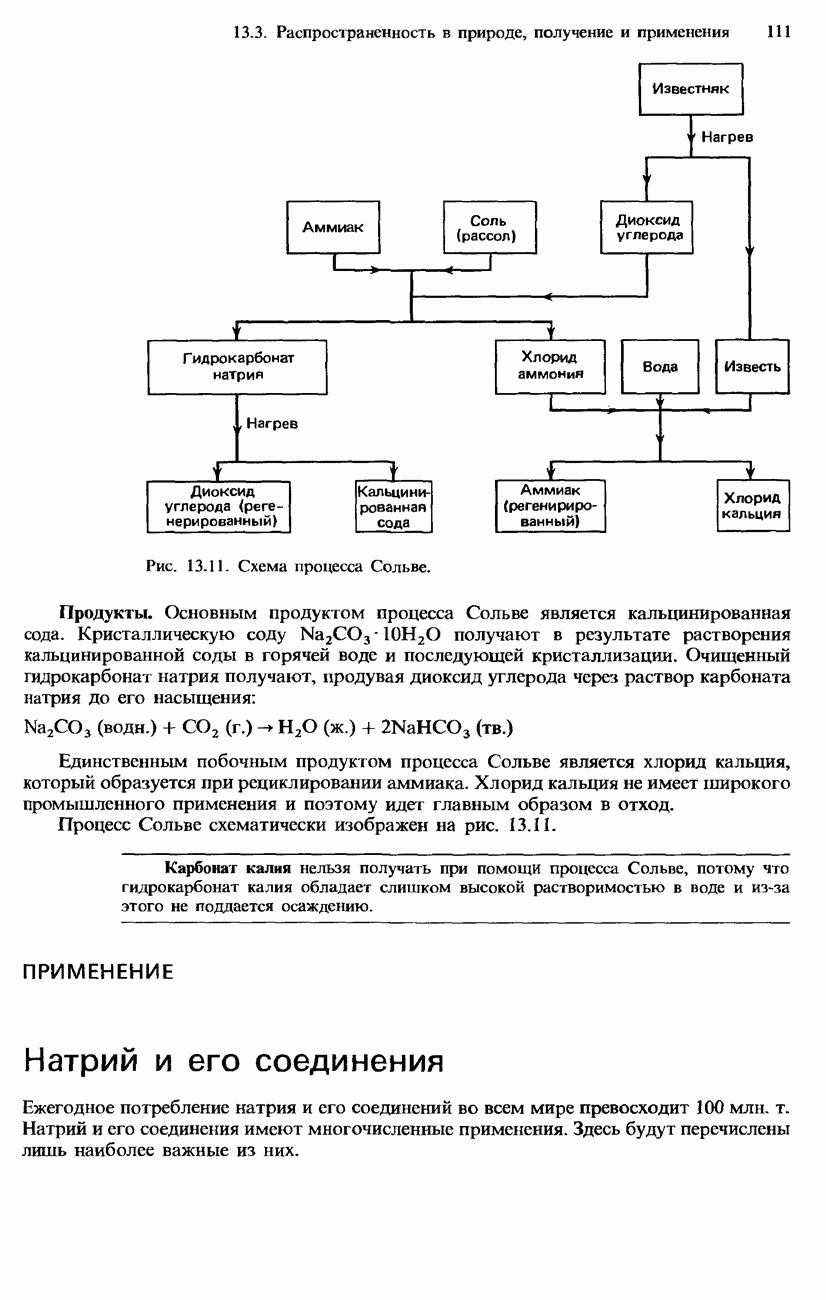
- 13.3. Распространенность в природе, получение и применение
- ПОЛУЧЕНИЕ S-МЕТАЛЛОВ
- ПОЛУЧЕНИЕ СОЕДИНЕНИЙ S-МЕТАЛЛОВ
- ПРИМЕНЕНИЕ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 14. d-ЭЛЕМЕНТЫ
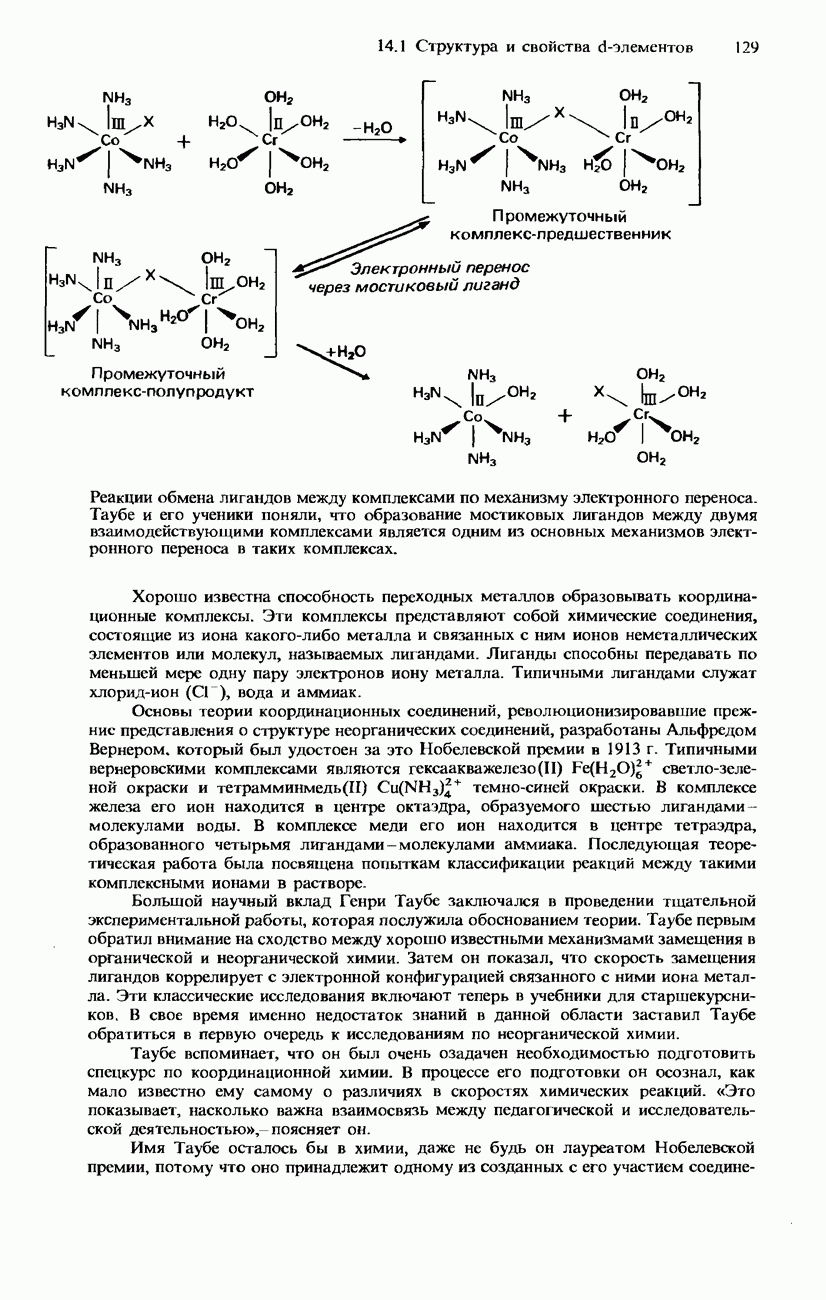
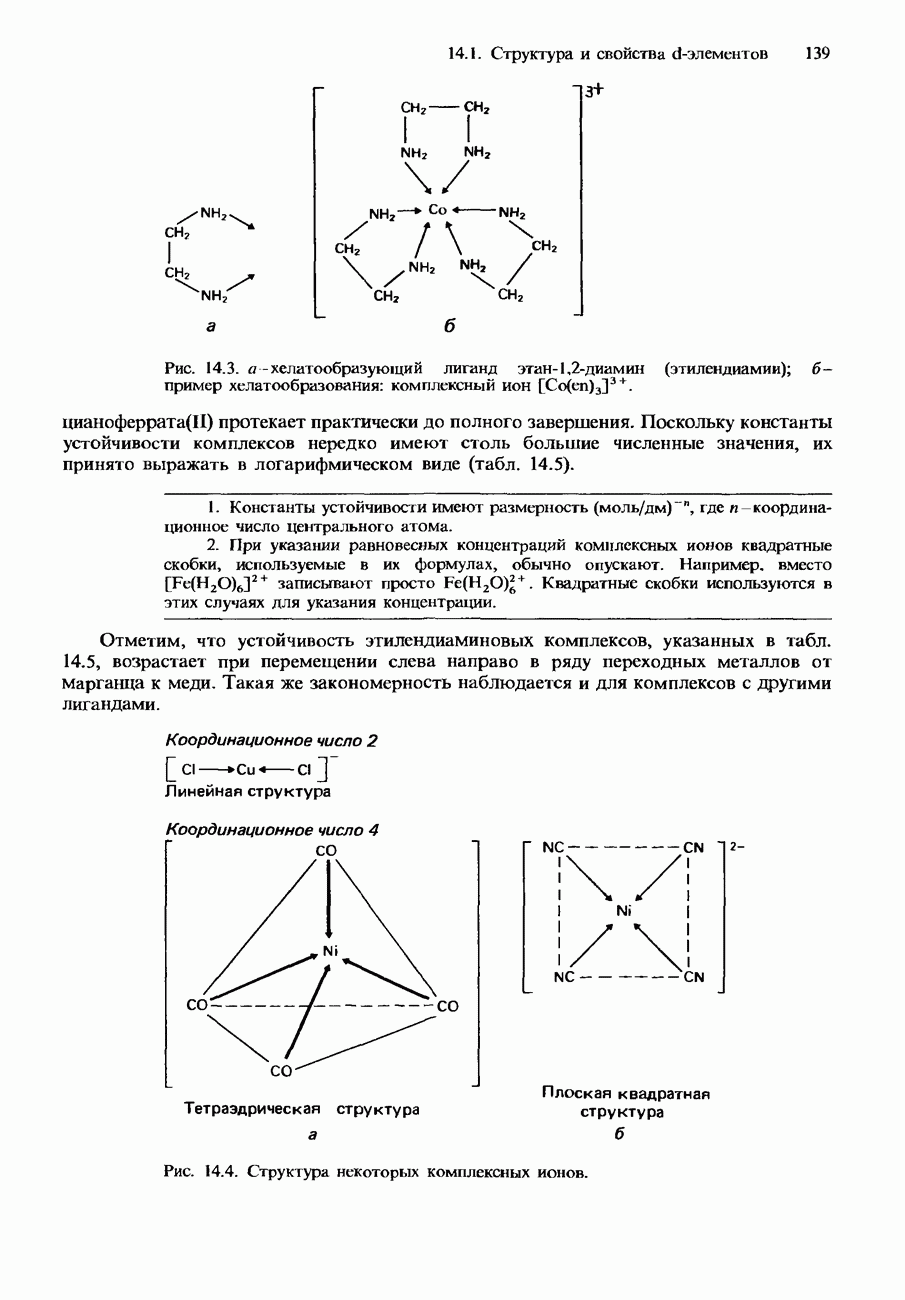
- 14.1. Структура и свойства d-элементов
- d-ЭЛЕМЕНТЫ
- ФИЗИЧЕСКИЕ СВОЙСТВА
- ХИМИЧЕСКИЕ СВОЙСТВА
- 14.2 Химия семи d-элементов
- МАРГАНЕЦ
- ЖЕЛЕЗО
- КОБАЛЬТ
- НИКЕЛЬ
- МЕДЬ
- ЦИНК
- 14.3. Распространенность в природе, получение и применения
- ПРОИЗВОДСТВО ЖЕЛЕЗА И СТАЛИ
- ПОЛУЧЕНИЕ ДРУГИХ МЕТАЛЛОВ ПЕРВОГО ПЕРЕХОДНОГО РЯДА
- ПРИМЕНЕНИЯ d-ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 15. ЭЛЕМЕНТЫ III-VI ГРУПП
- 15.1. Алюминий и другие элементы III группы
- БОР
- ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ
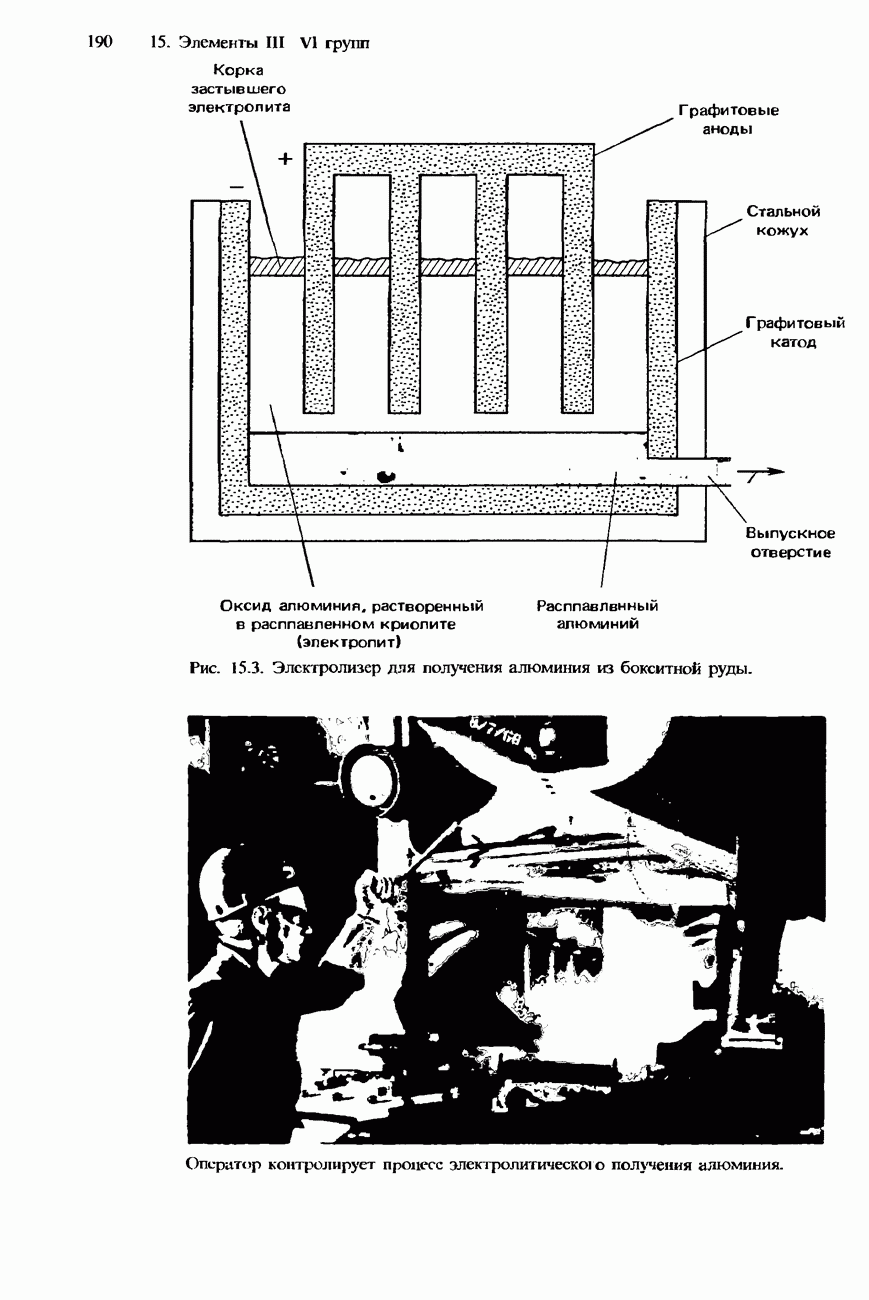
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ
- ПРИМЕНЕНИЯ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ
- 15.2. IV группа периодической системы
- СОЕДИНЕНИЯ
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ ИЗ РУД
- ПРИМЕНЕНИЯ УГЛЕРОДА
- ПРИМЕНЕНИЯ КРЕМНИЯ
- ПРИМЕНЕНИЯ ГЕРМАНИЯ, ОЛОВА И СВИНЦА
- 15.3. Элементы V группы
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЯ АЗОТА И ФОСФОРА
- СОЕДИНЕНИЯ АЗОТА
- СОЕДИНЕНИЯ ФОСФОРА
- 15.4. Элементы VI группы. Кислород и сера
- КИСЛОРОД
- СОЕДИНЕНИЯ КИСЛОРОДА
- СЕРА
- СОЕДИНЕНИЯ СЕРЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 16. ГАЛОГЕНЫ И БЛАГОРОДНЫЕ ГАЗЫ
- 16.1. Галогены
- ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ ГАЛОГЕНОВ
- ЛАБОРАТОРНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ ГАЛОГЕНОВ
- ФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА
- РЕАКЦИОННАЯ СПОСОБНОСТЬ ГАЛОГЕНОВ
- 16.2. Соединения галогенов
- ГАЛОГЕНОВОДОРОДЫ
- КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ГАЛОГЕНОВ
- 16.3. Распространенность, получение и применение галогенов и их соединений
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ХЛОРА
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ДРУГИХ ГАЛОГЕНОВ
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ СОЕДИНЕНИЙ ХЛОРА
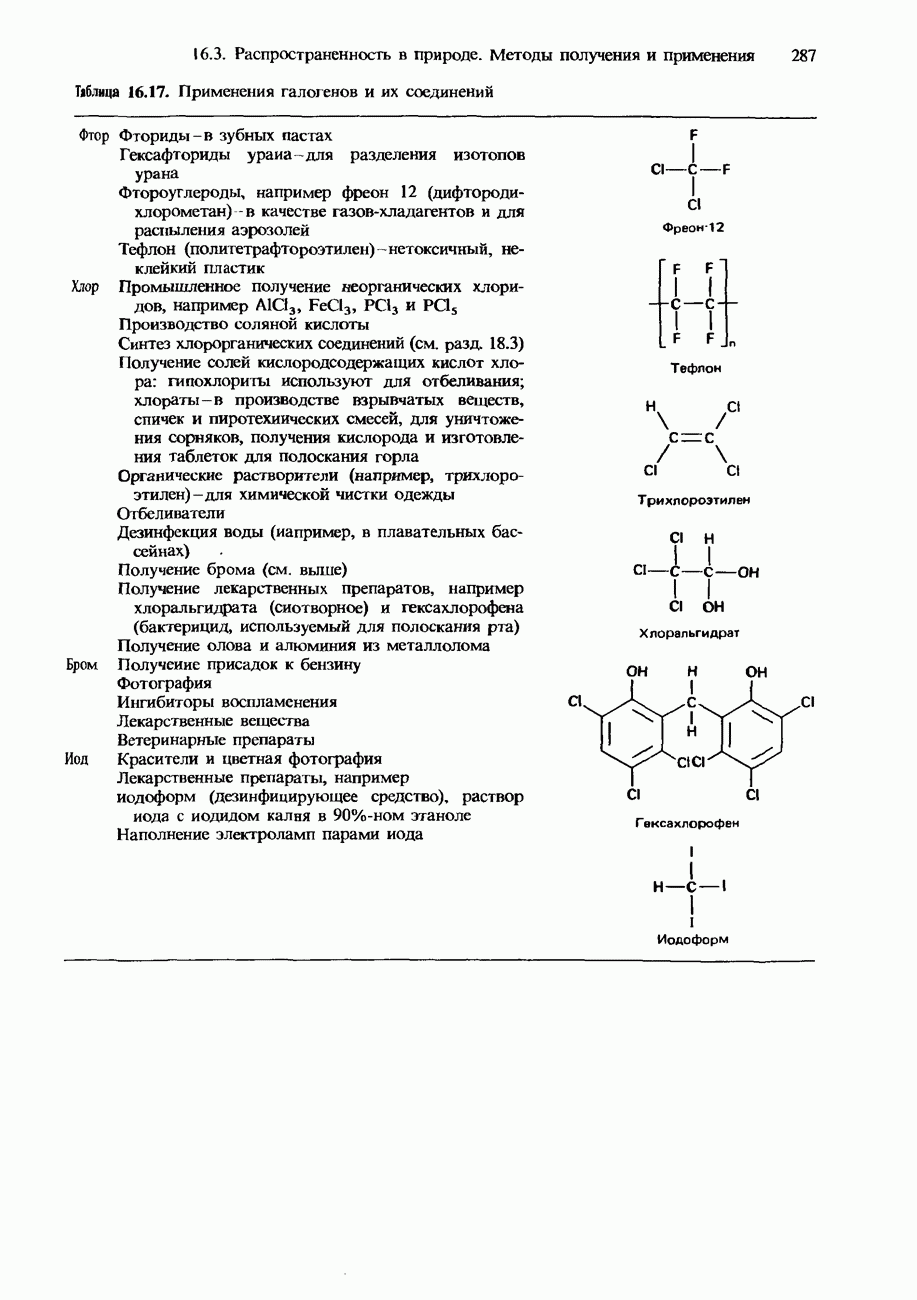
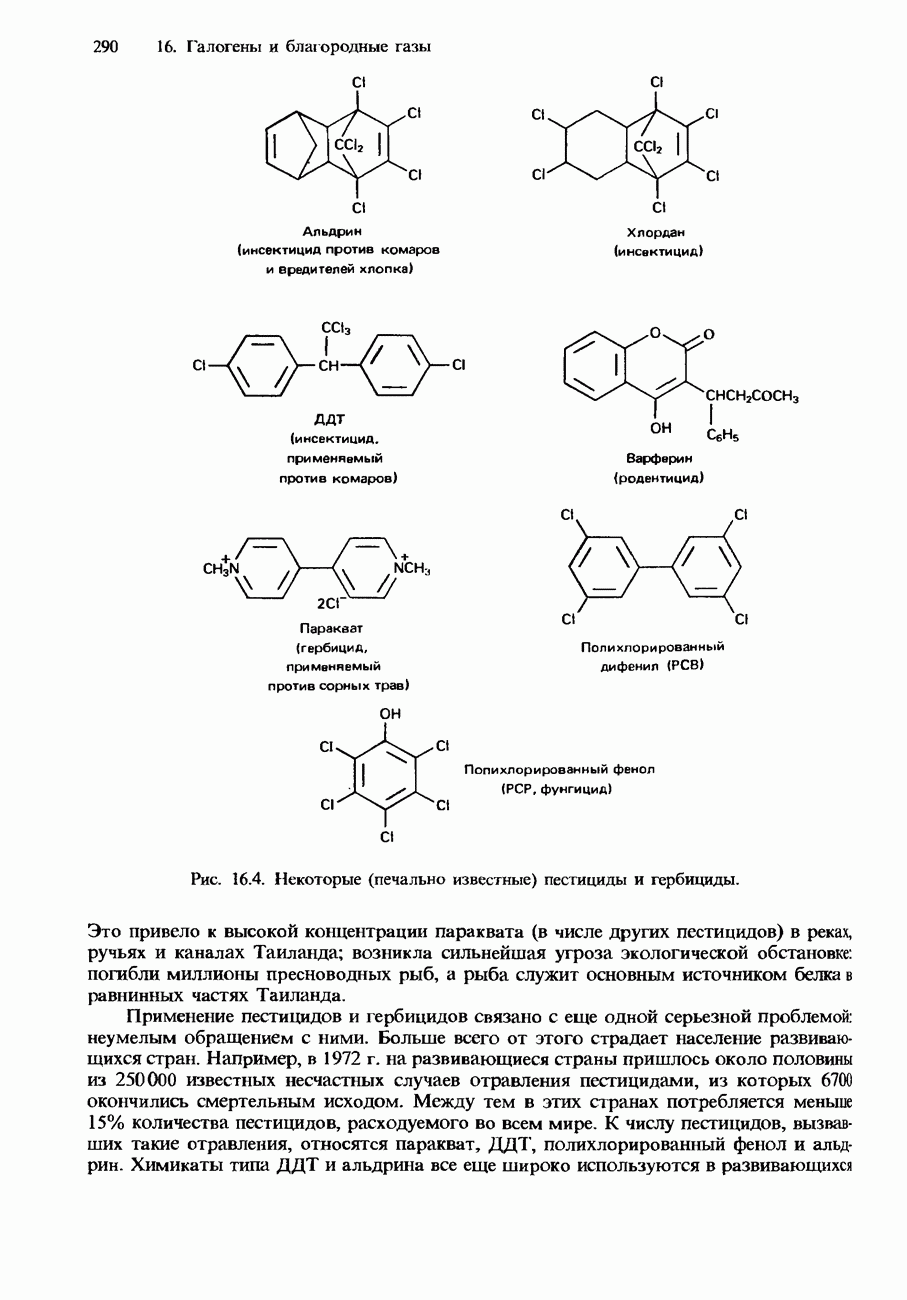
- ПРИМЕНЕНИЯ ГАЛОГЕНОВ И ИХ СОЕДИНЕНИЙ
- ТОКСИЧНОСТЬ ХЛОРСОДЕРЖАЩИХ ПРОДУКТОВ
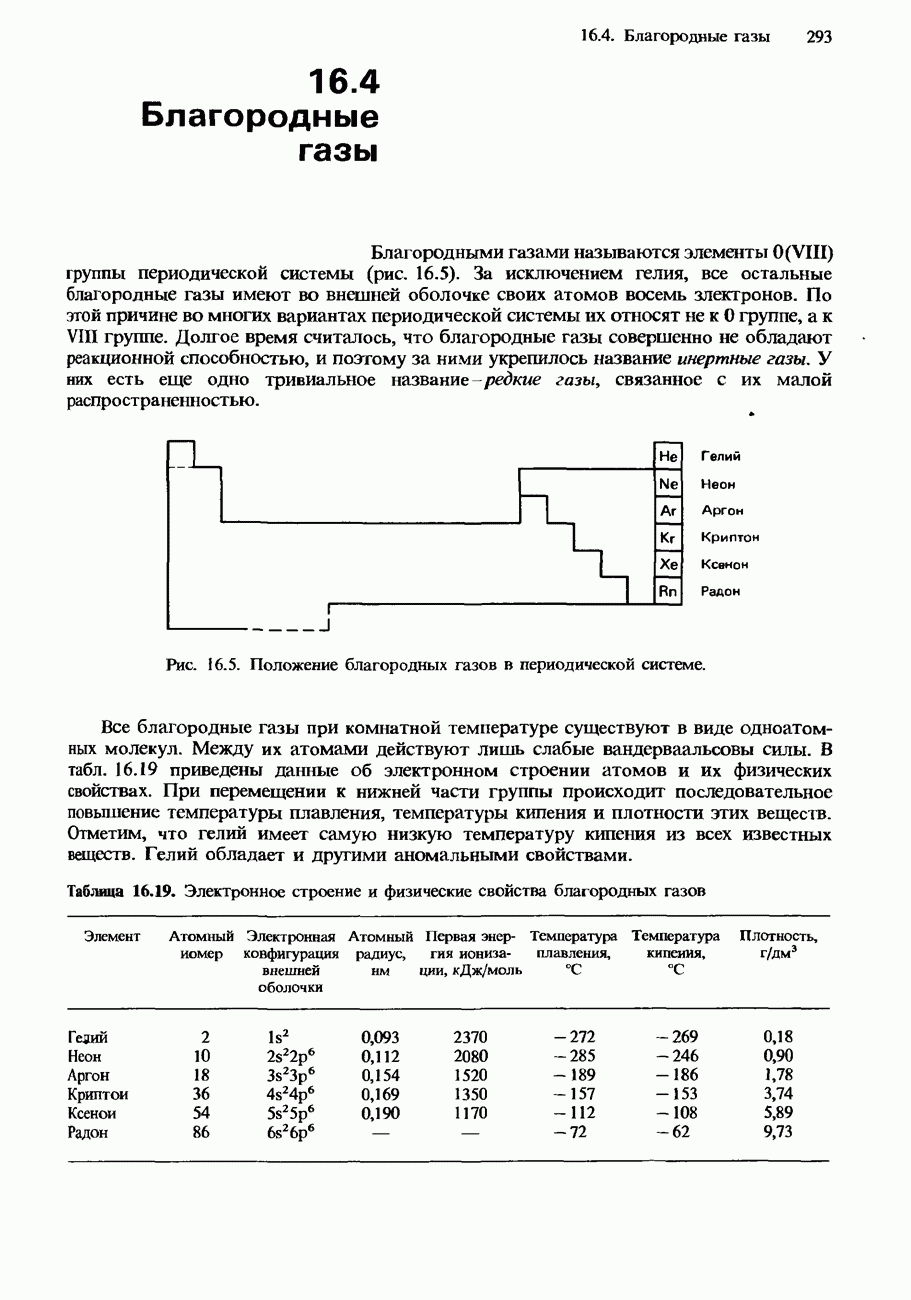
- 16.4. Благородные газы
- СОЕДИНЕНИЯ БЛАГОРОДНЫХ ГАЗОВ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 17. ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
- 7.1. Органическая химия
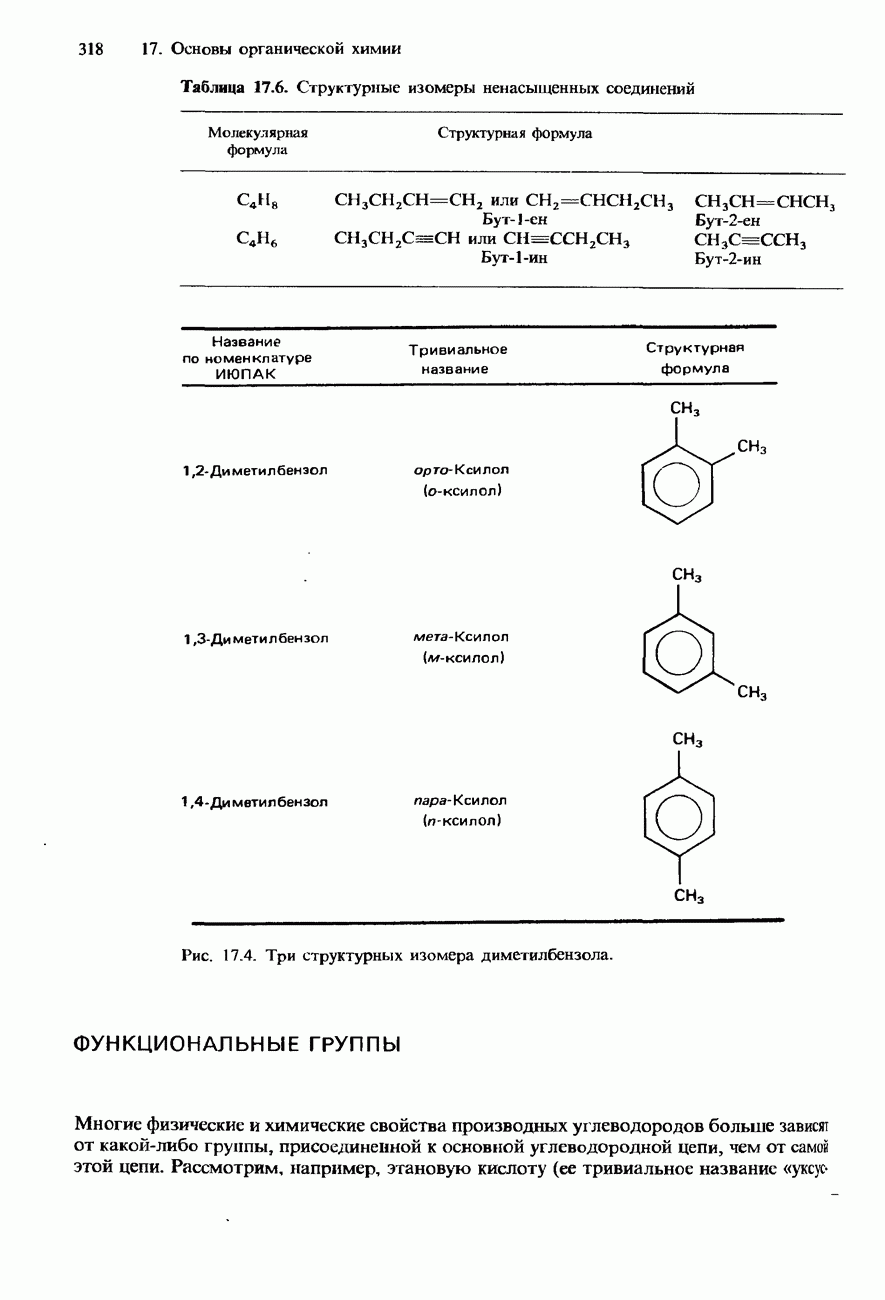
- НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- УГЛЕВОДОРОДЫ
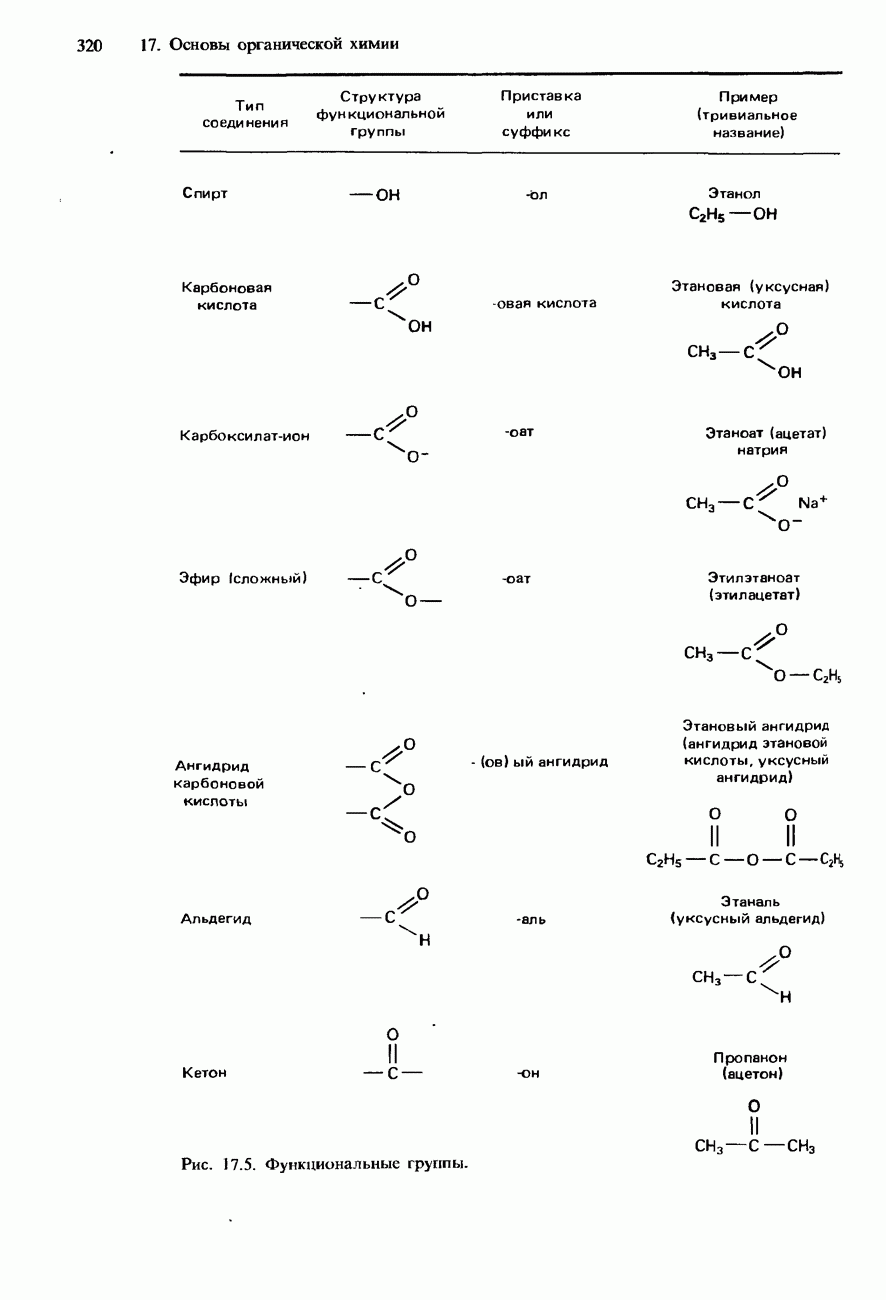
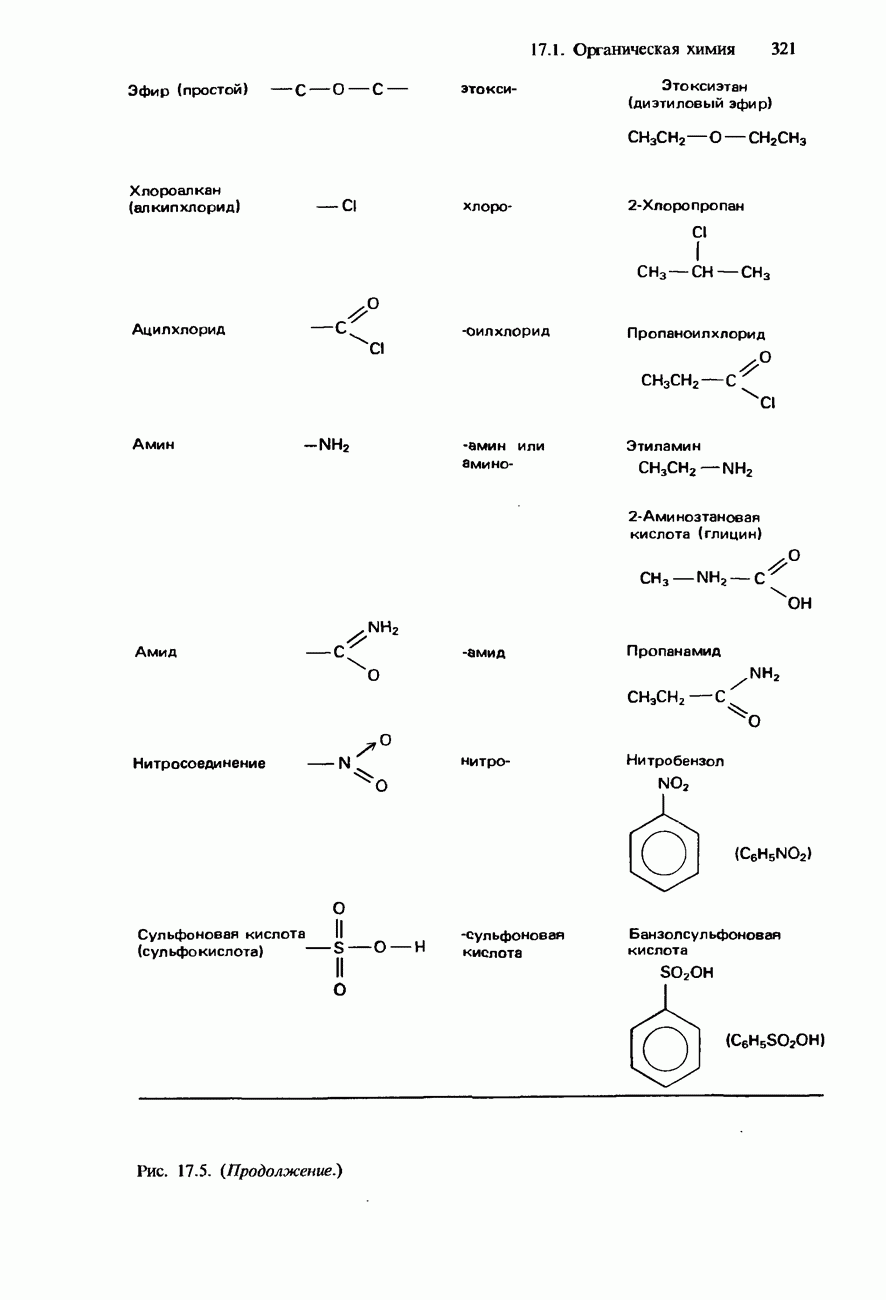
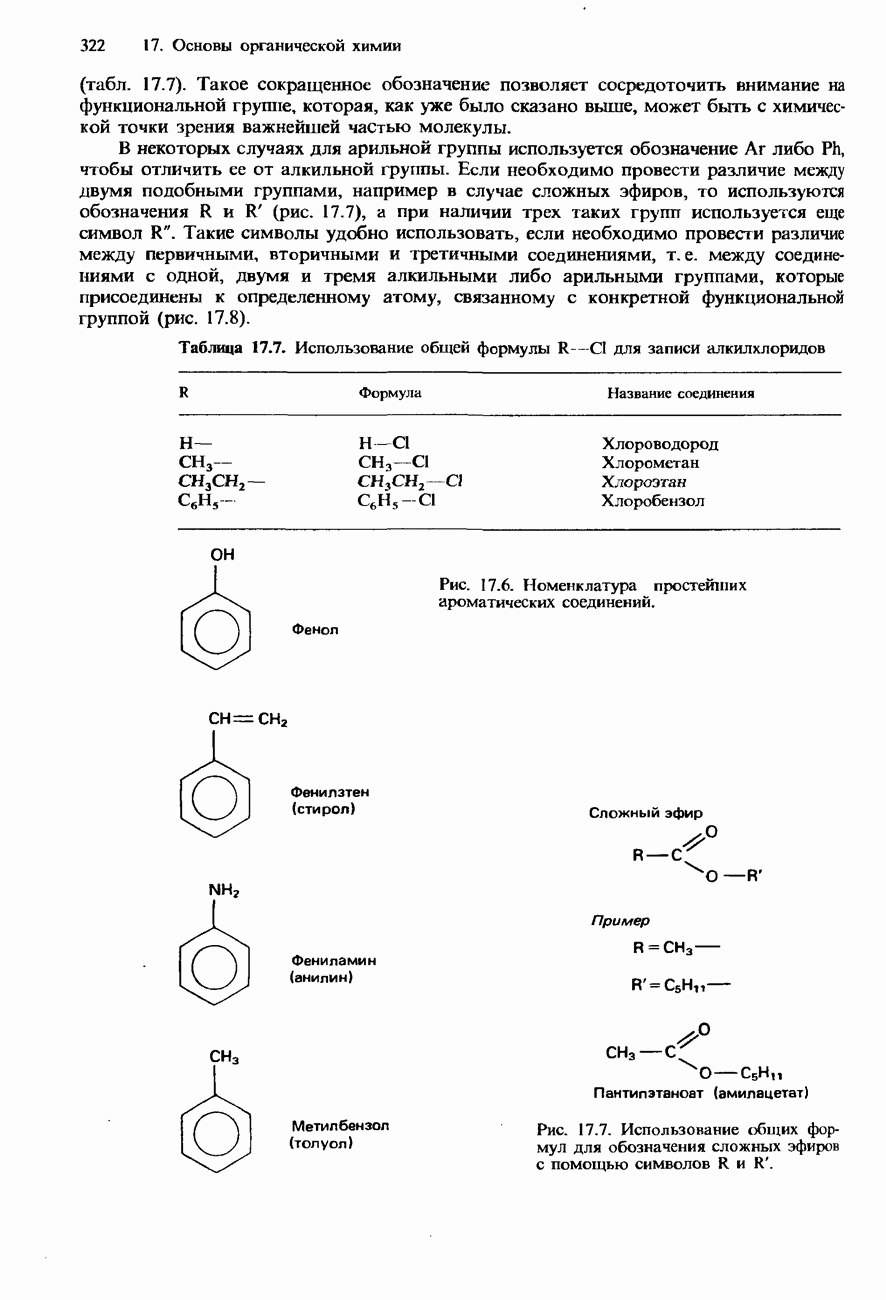
- ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
- ФИЗИЧЕСКИЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- ПОЛУЧЕНИЕ И ИДЕНТИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- 17.2. Молекулярная структура органических соединений
- КОНФОРМАЦИИ
- СТЕРЕОИЗОМЕРИЯ
- 17.3. Механизмы органических реакций
- ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- НУКЛЕОФИЛЫ И ЭЛЕКТРОФИЛЫ
- ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 18. УГЛЕВОДОРОДЫ
- 18.1. Алифатические углеводороды
- АЛКАНЫ
- АЛКЕНЫ
- АЛКИНЫ
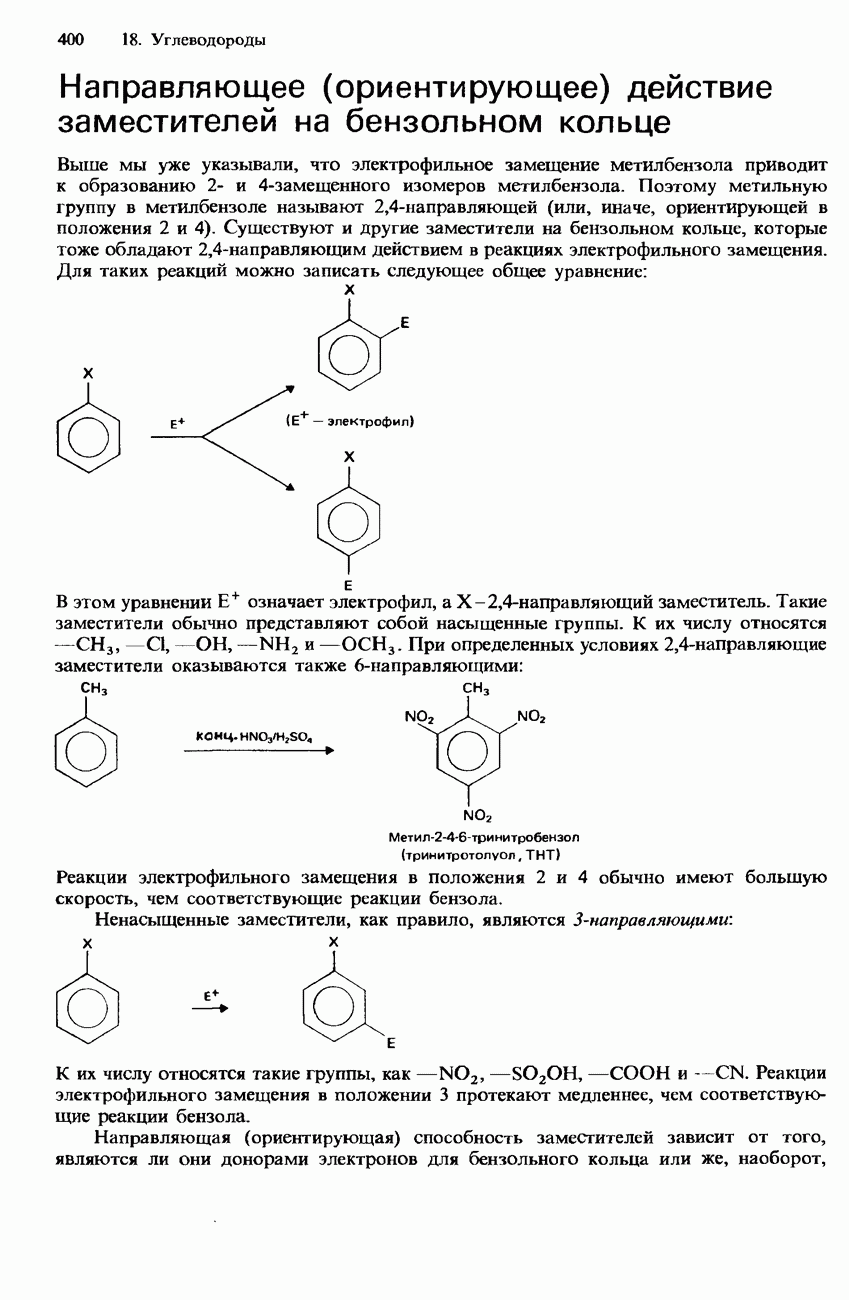
- 18.2. Арены
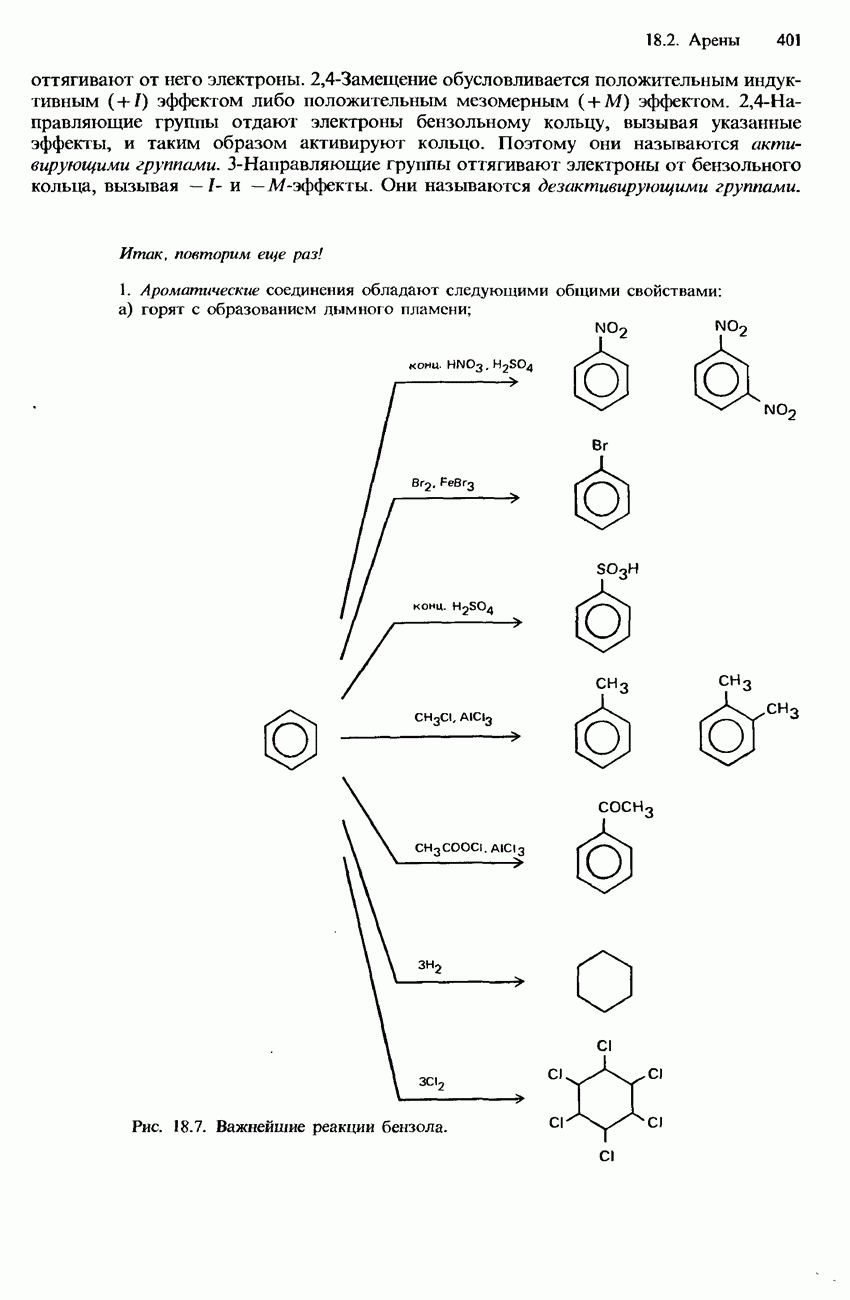
- БЕНЗОЛ
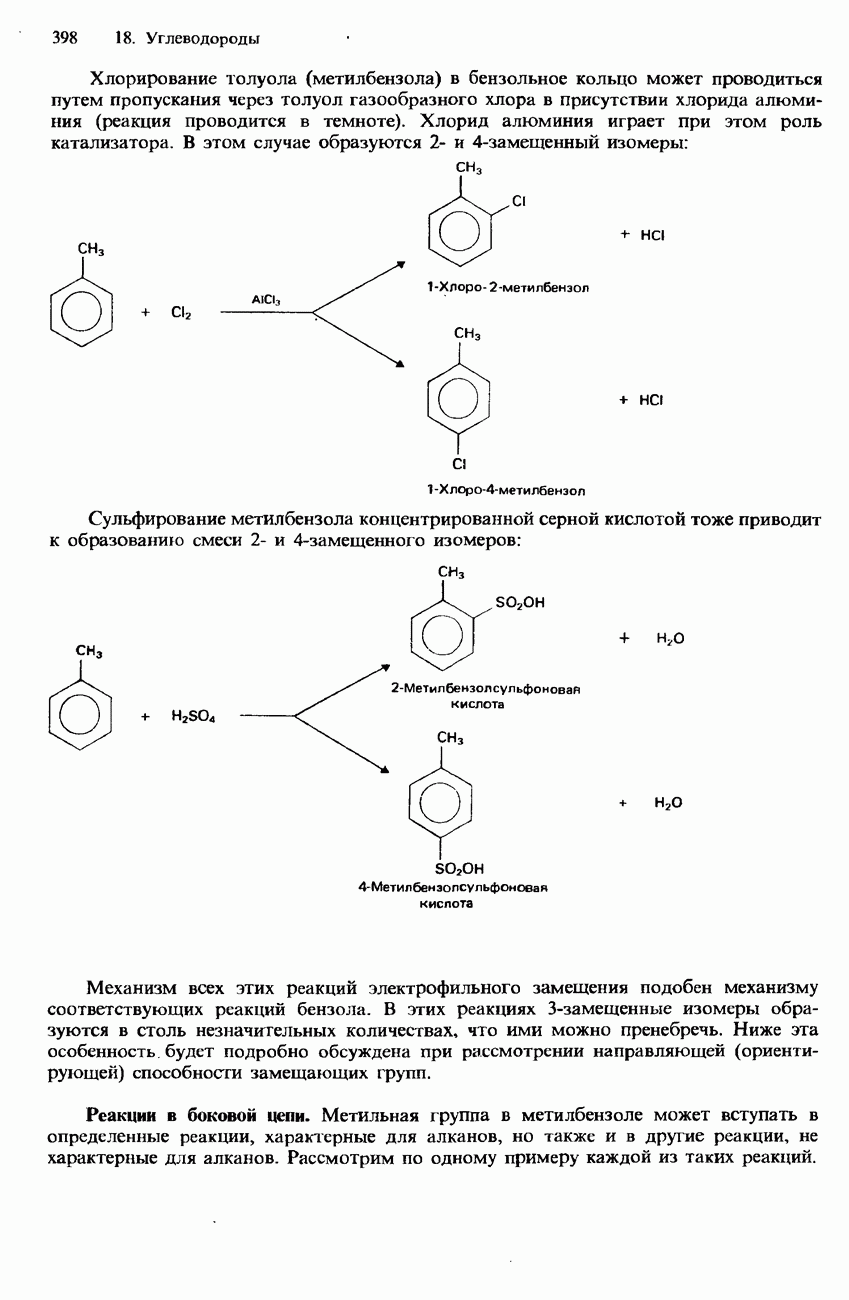
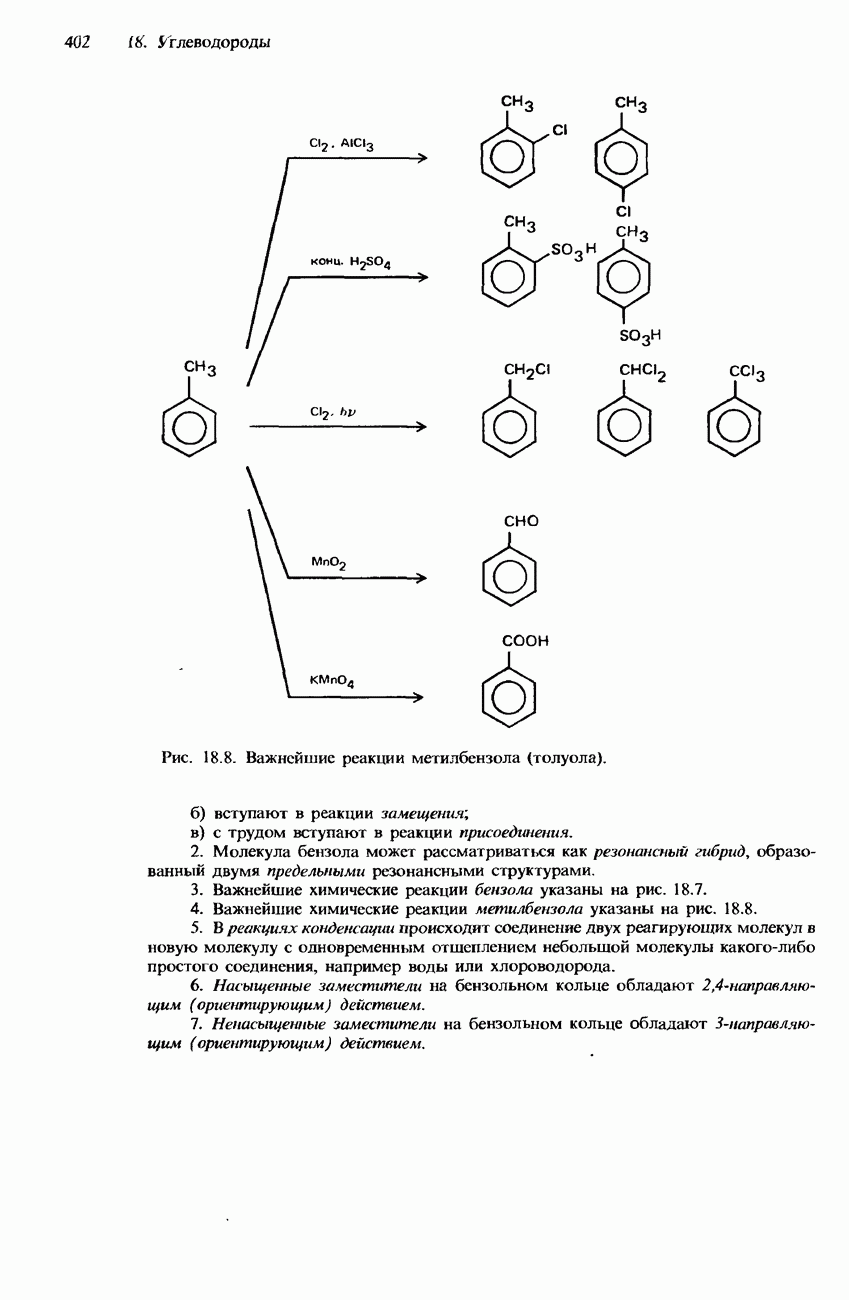
- МЕТИЛБЕНЗОЛ
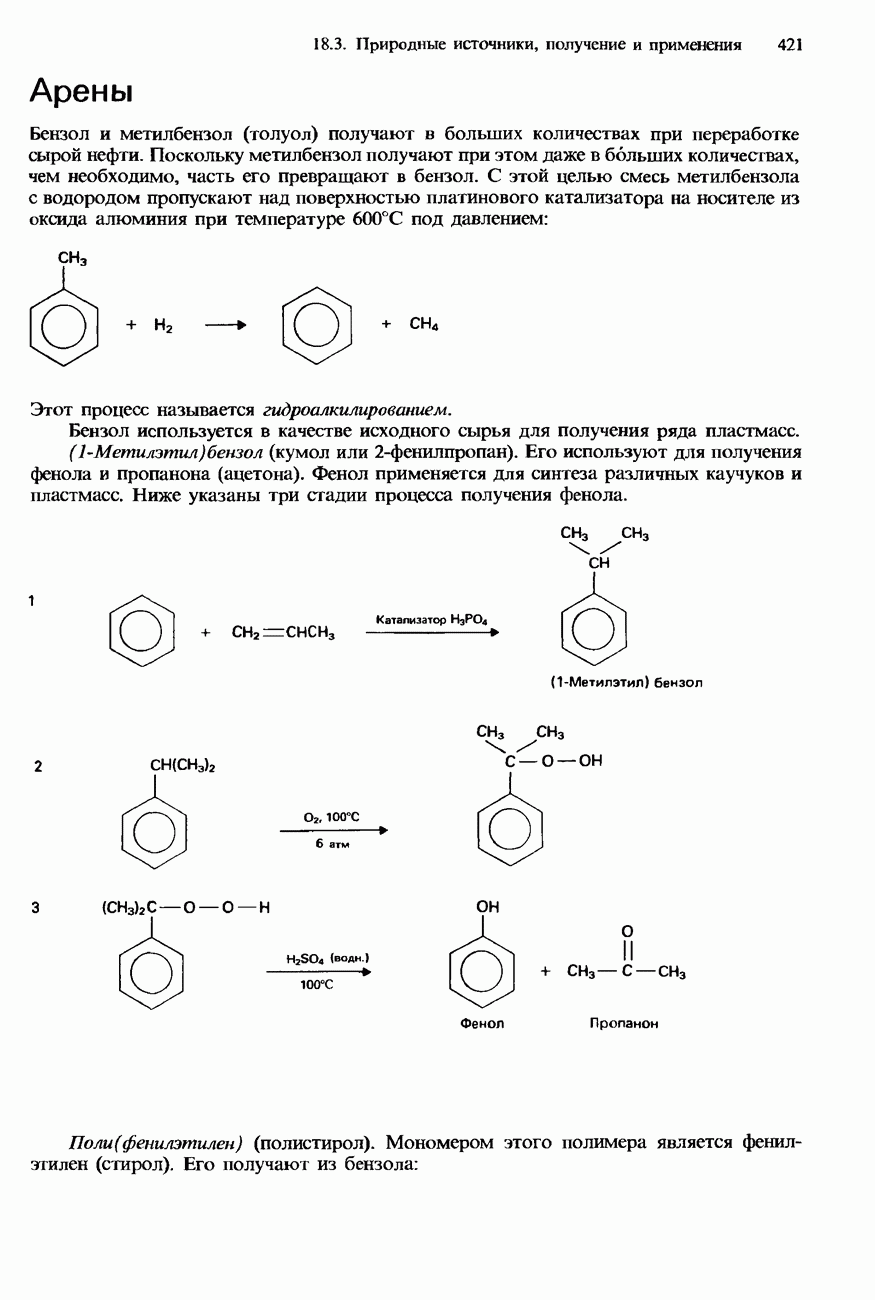
- 18.3. Природные источники, получение и применения
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ УГЛЕВОДОРОДОВ
- ПЕРЕРАБОТКА НЕФТИ
- ПРИМЕНЕНИЯ УГЛЕВОДОРОДОВ
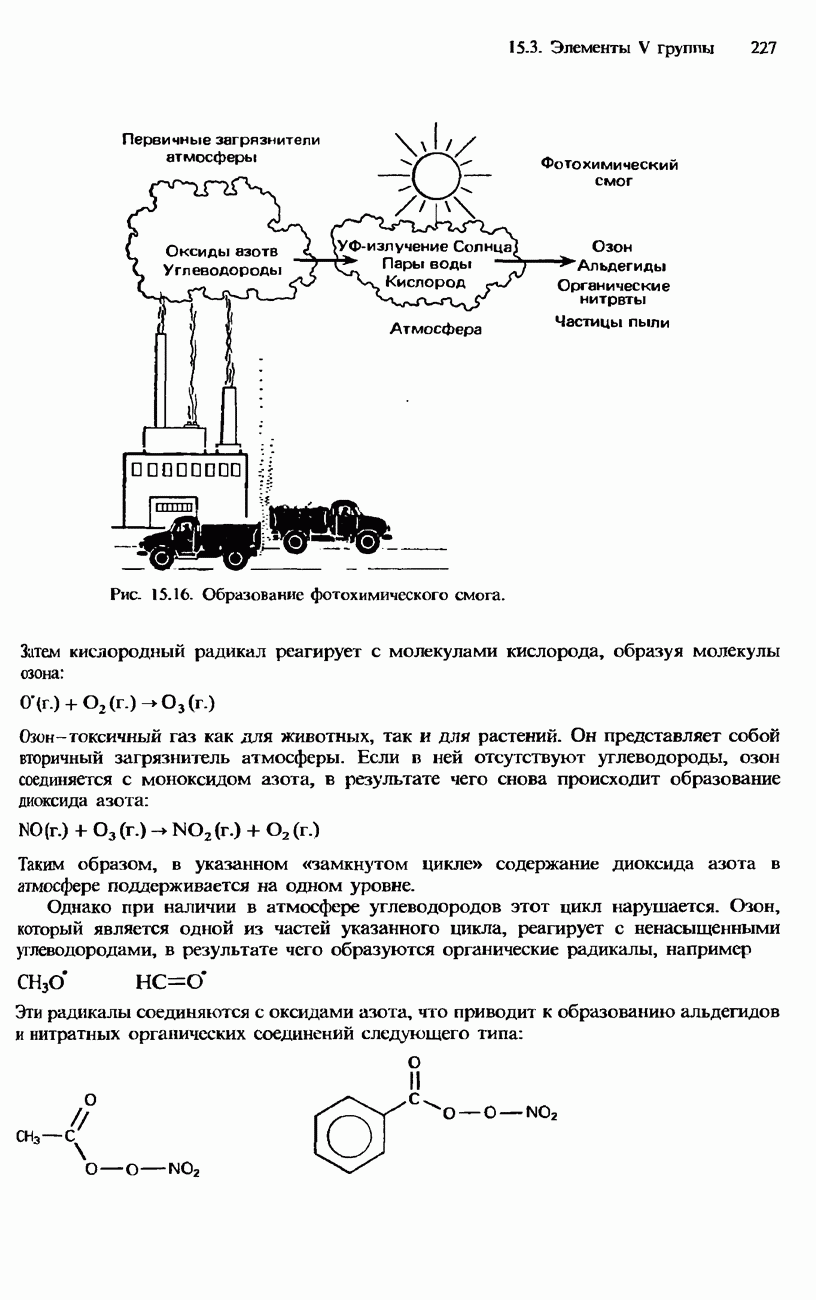
- ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ НЕФТЬЮ И ПРОДУКТАМИ ЕЕ СГОРАНИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 19. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
- 19.1. Органические галогенсодержащие соединения
- ГАЛОГЕНОАЛКЕНЫ
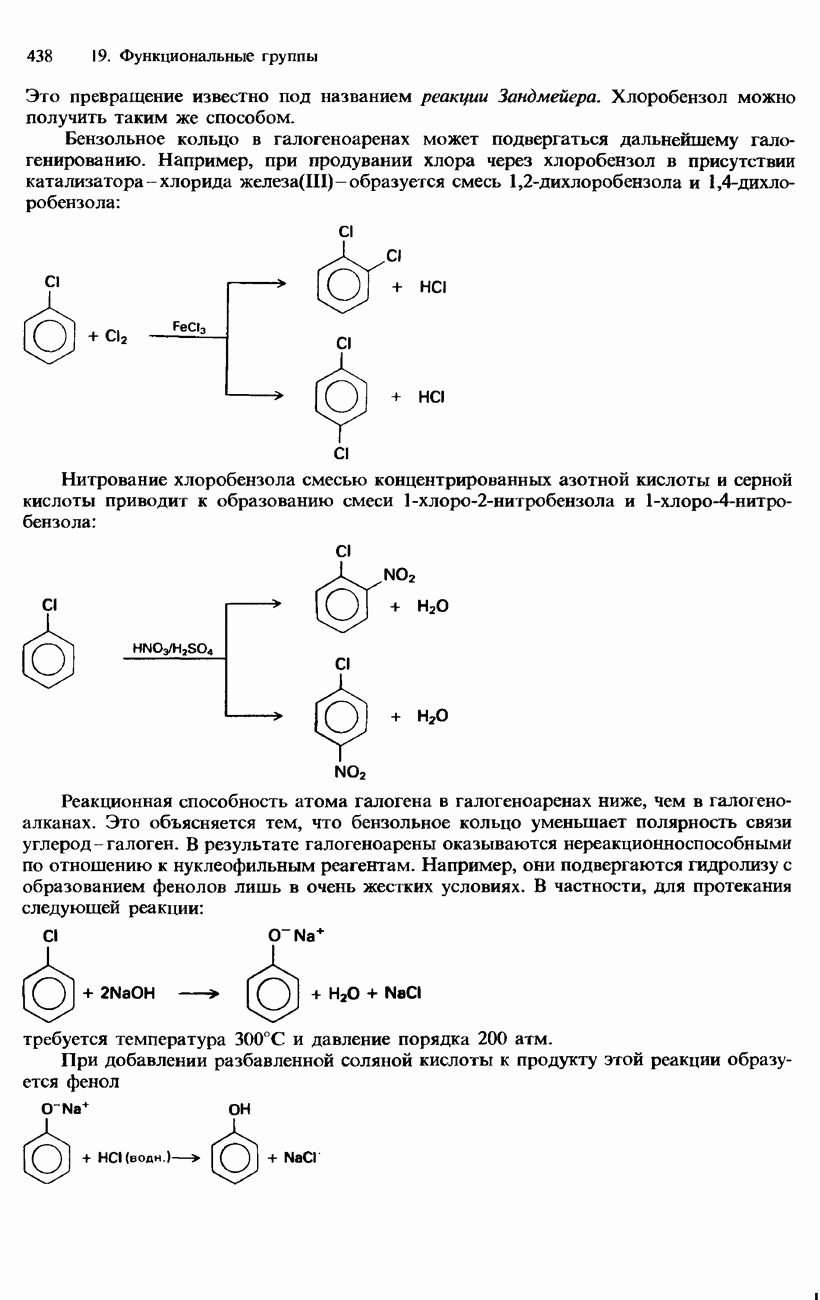
- ГАЛОГЕНОАРЕНЫ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ОРГАНИЧЕСКИХ ГАЛОГЕНСОДЕРЖАЩИХ СОЕДИНЕНИЙ
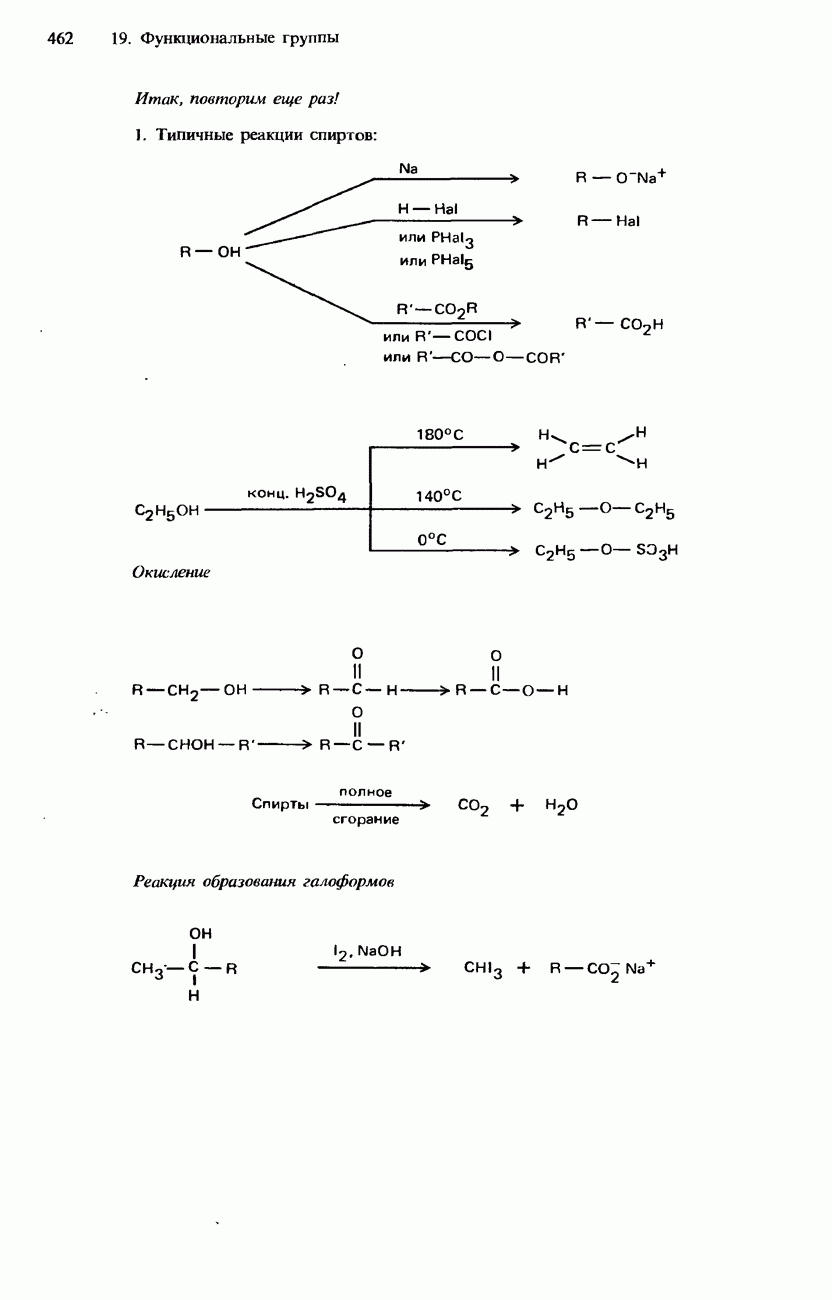
- 19.2. Спирты, фенолы и эфиры
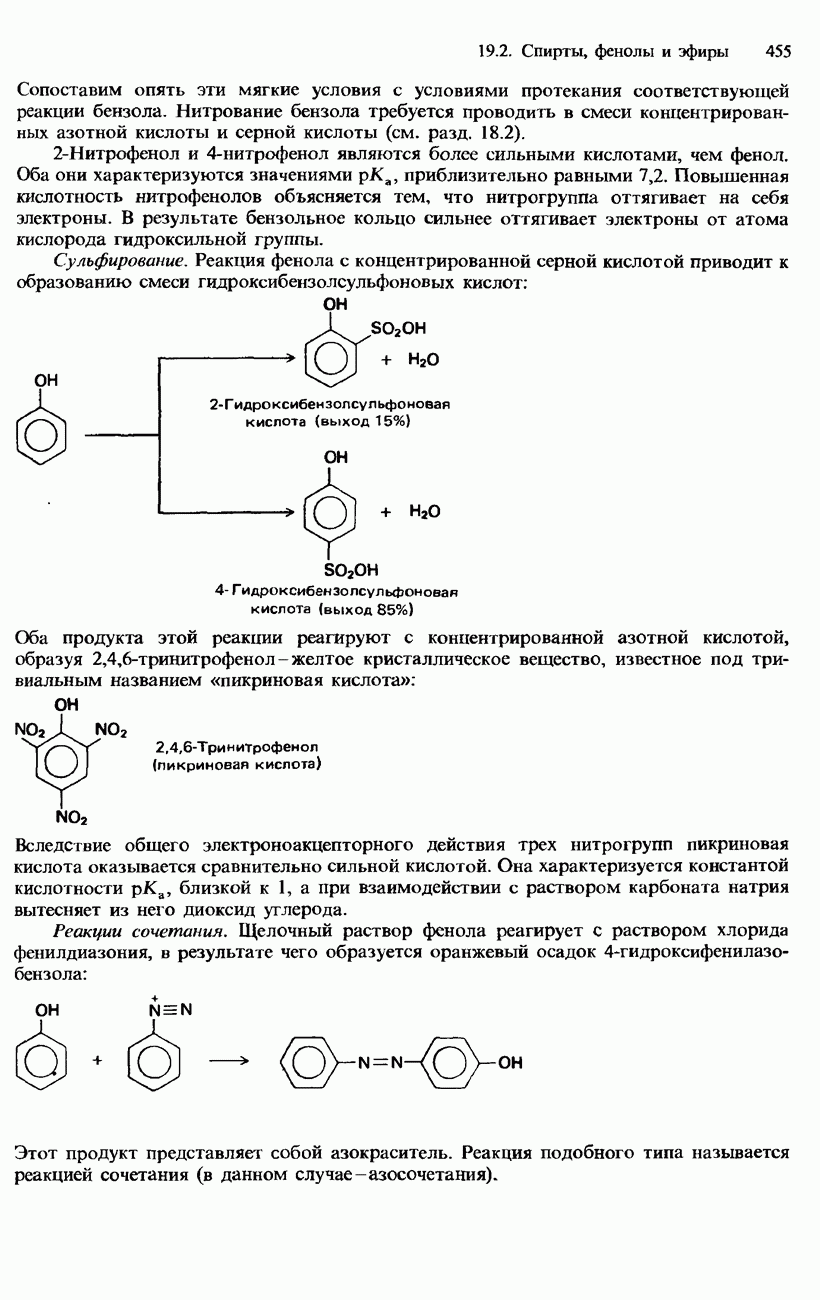
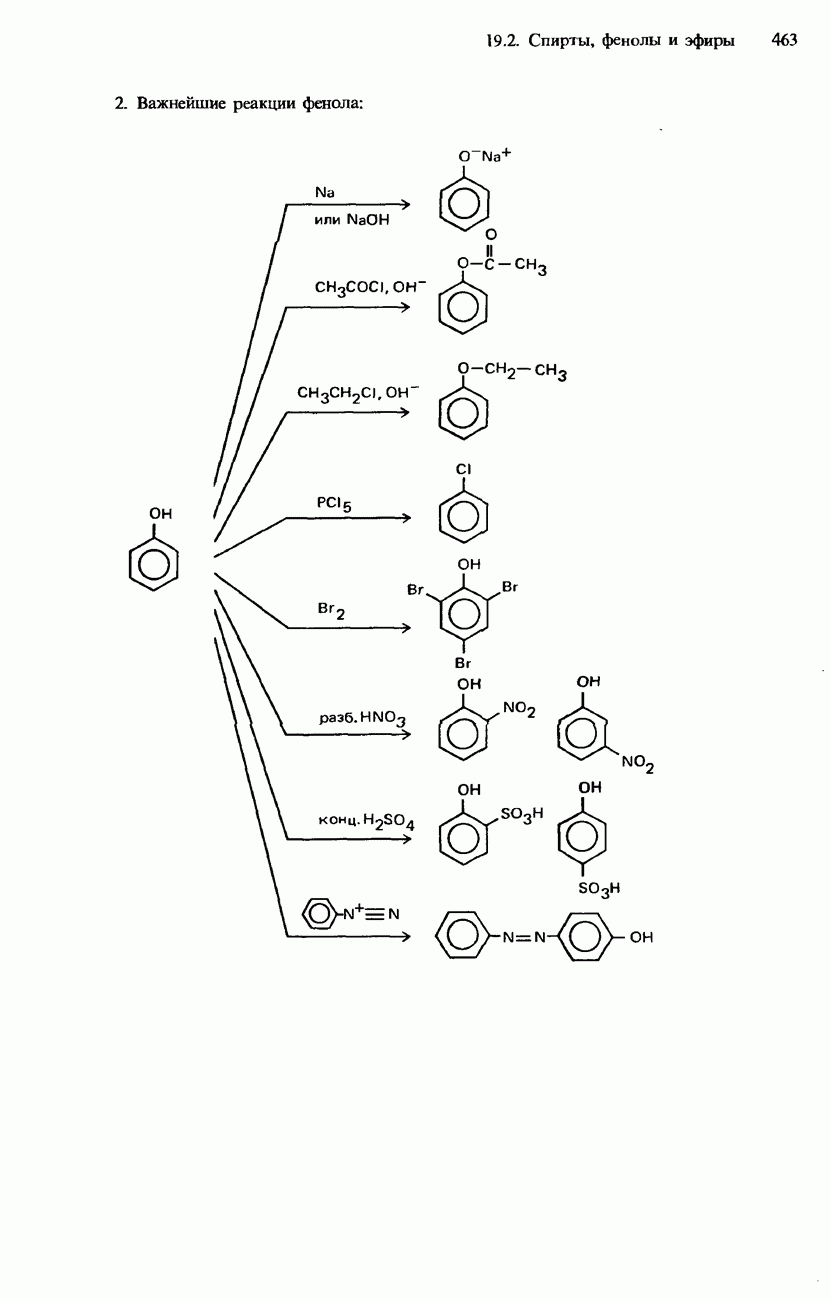
- ФЕНОЛЫ
- ПРОСТЫЕ ЭФИРЫ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ СПИРТОВ, ФЕНОЛОВ И ПРОСТЫХ ЭФИРОВ
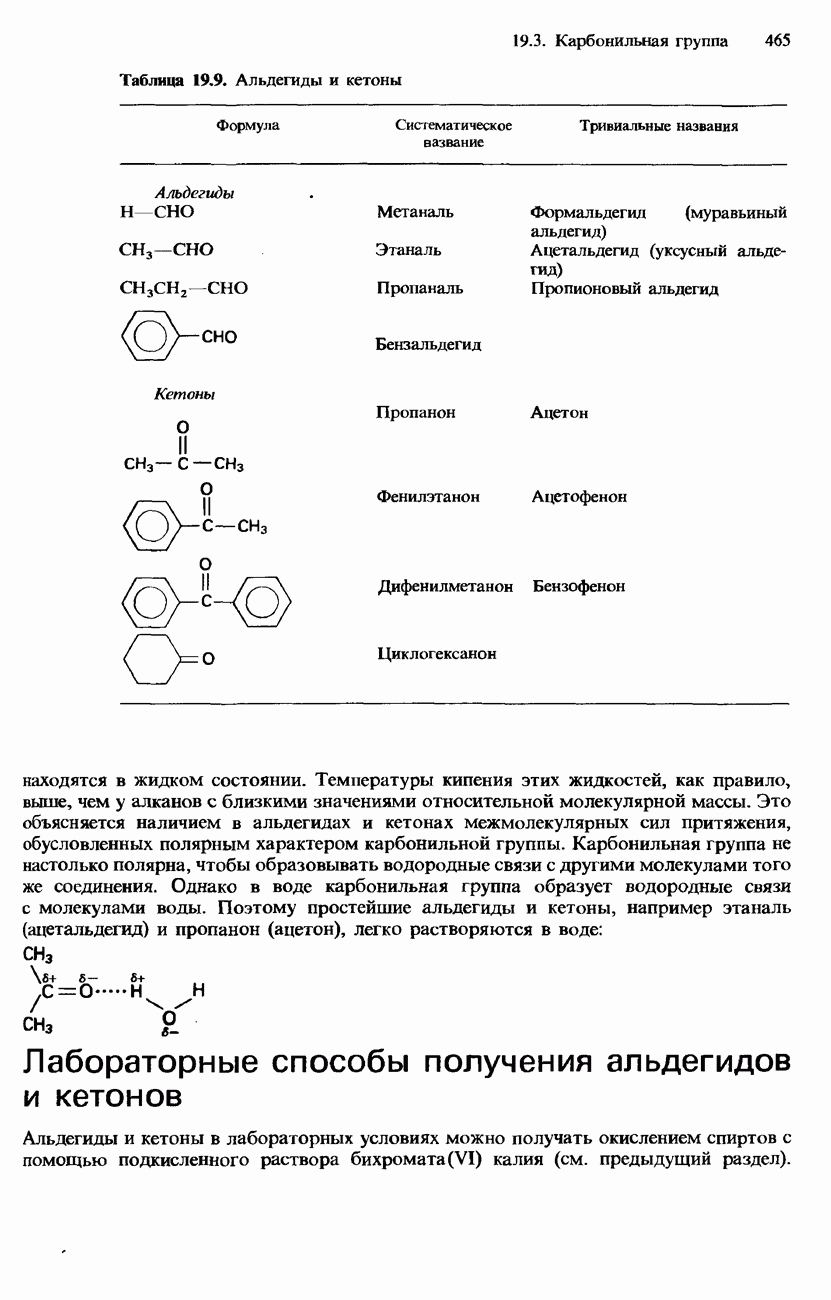
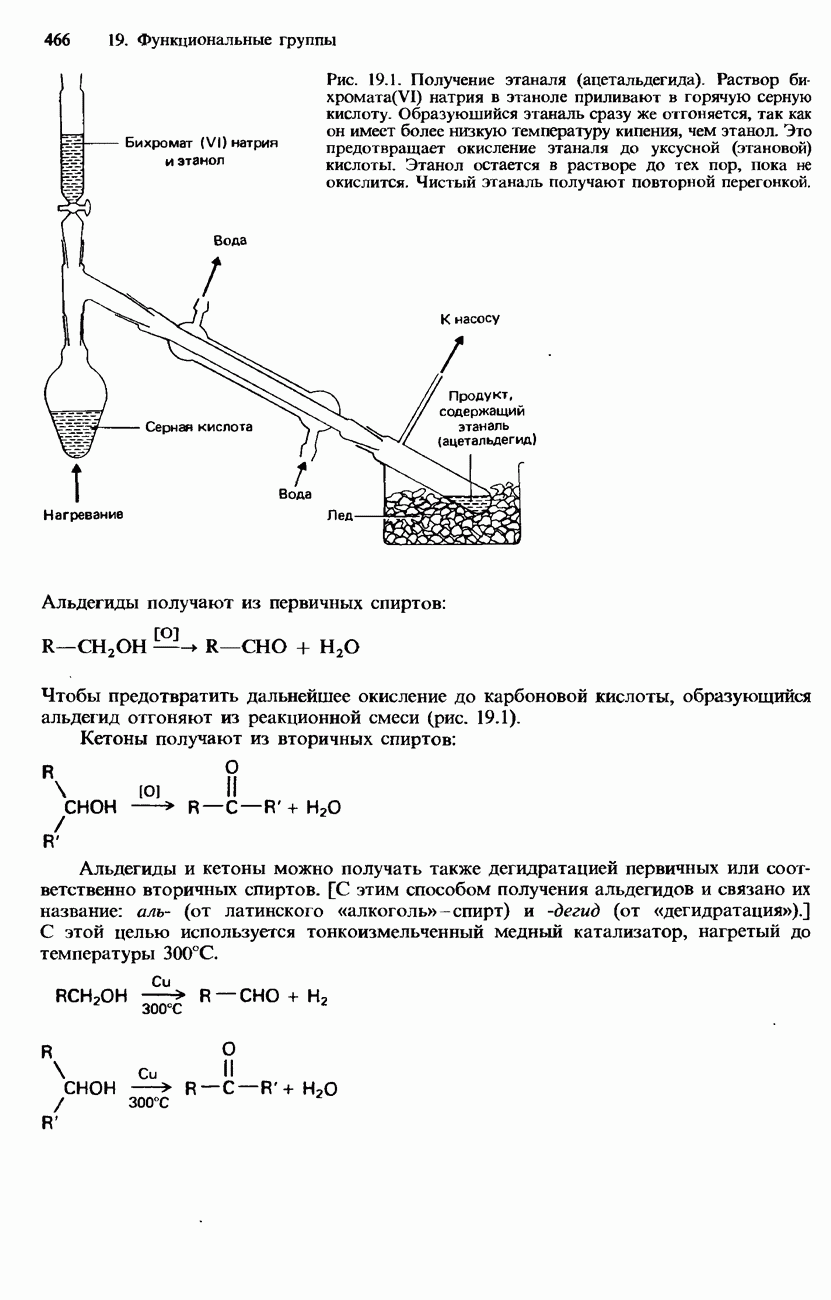
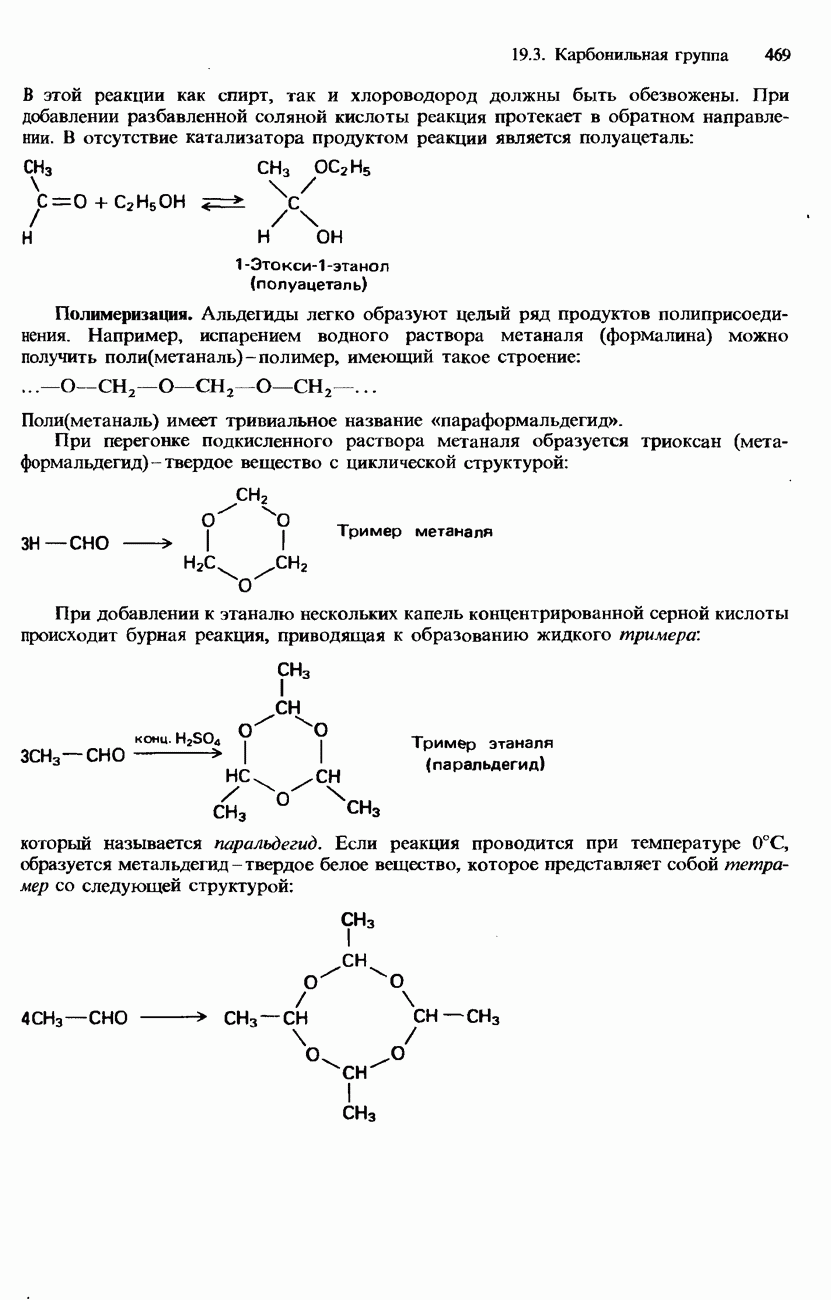
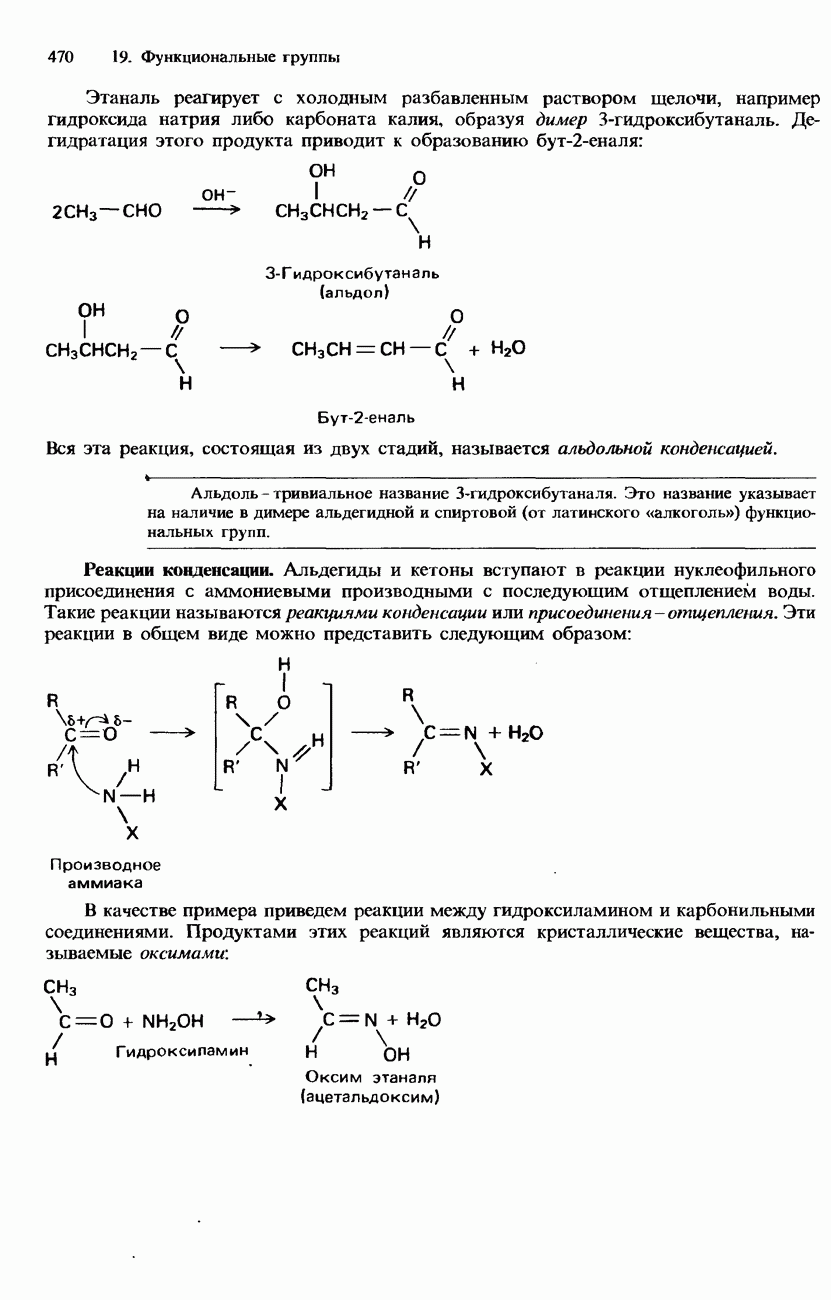
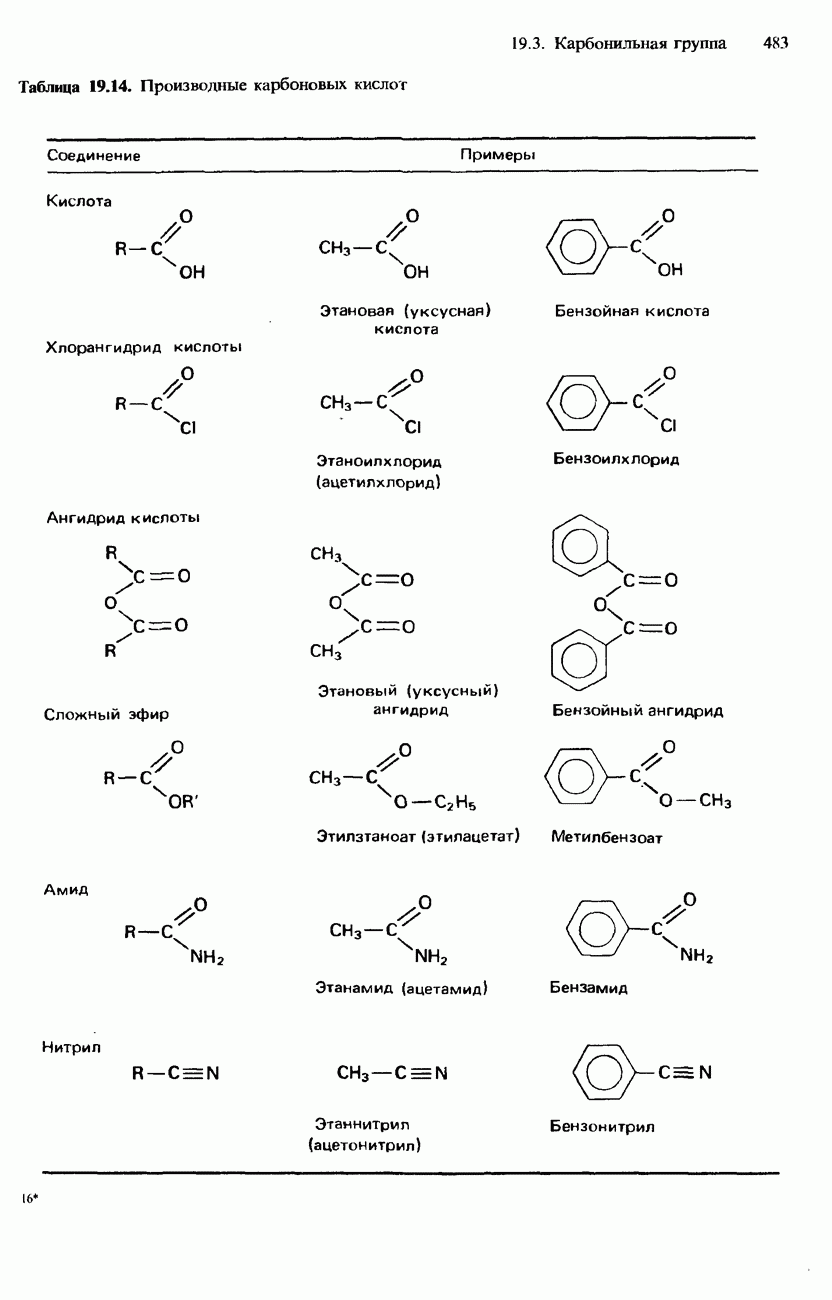
- 19.3. Карбонильная группа
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
- КАРБОНОВЫЕ КИСЛОТЫ
- ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ
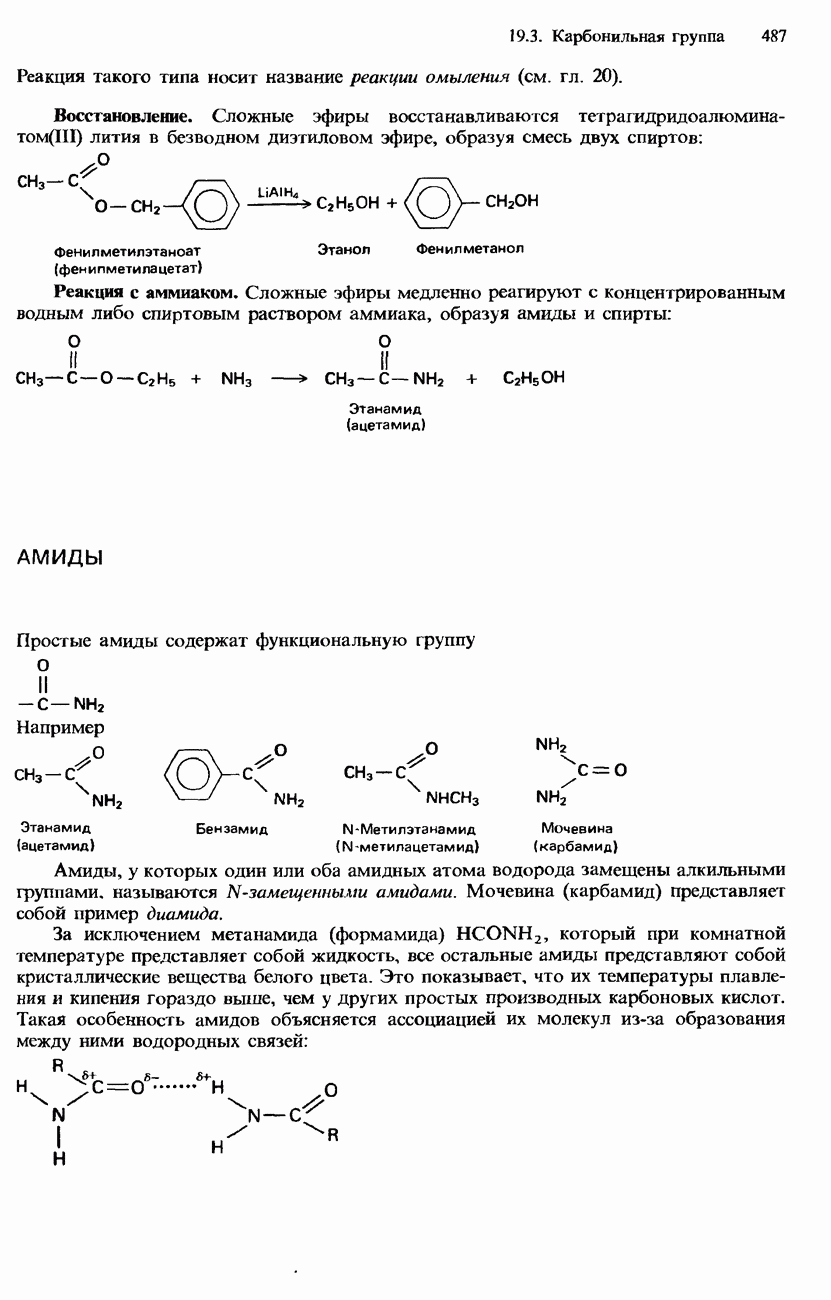
- АМИДЫ
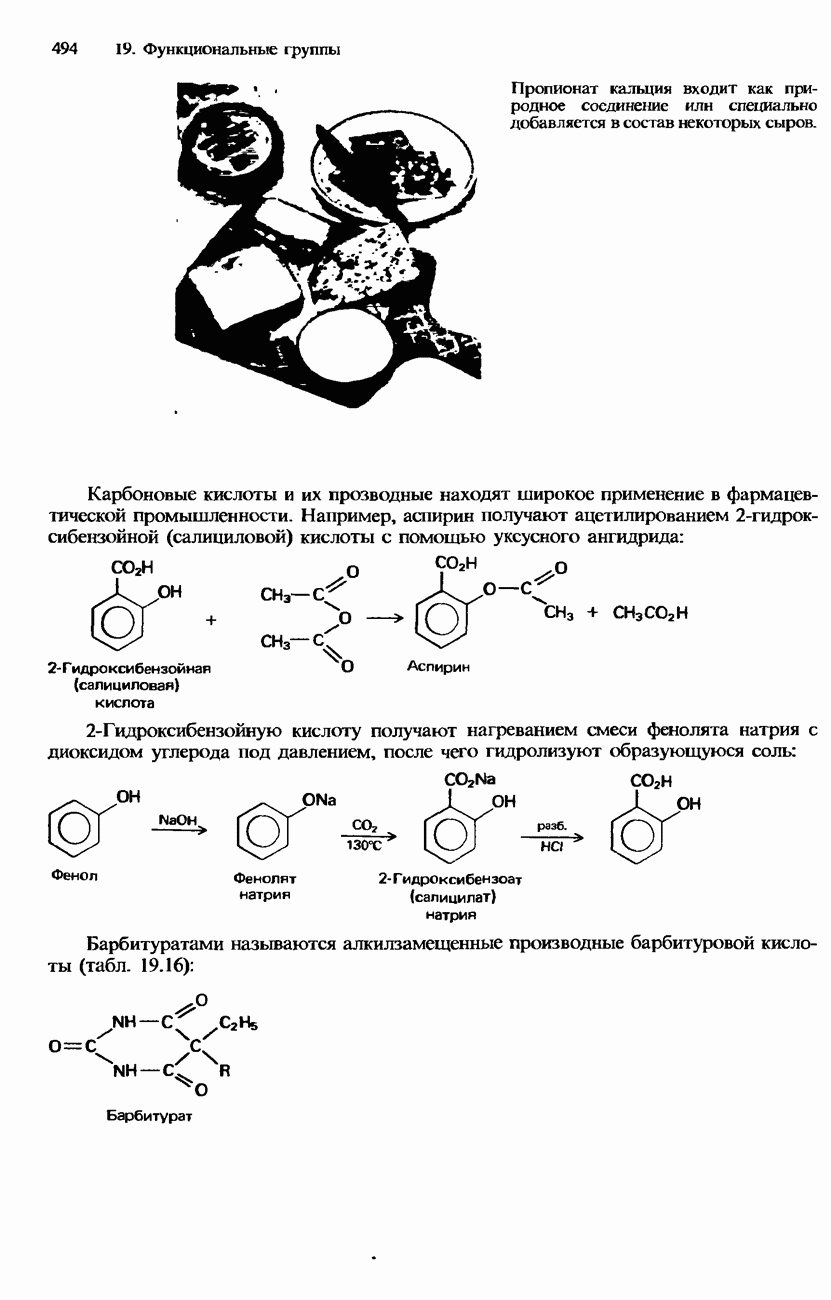
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ
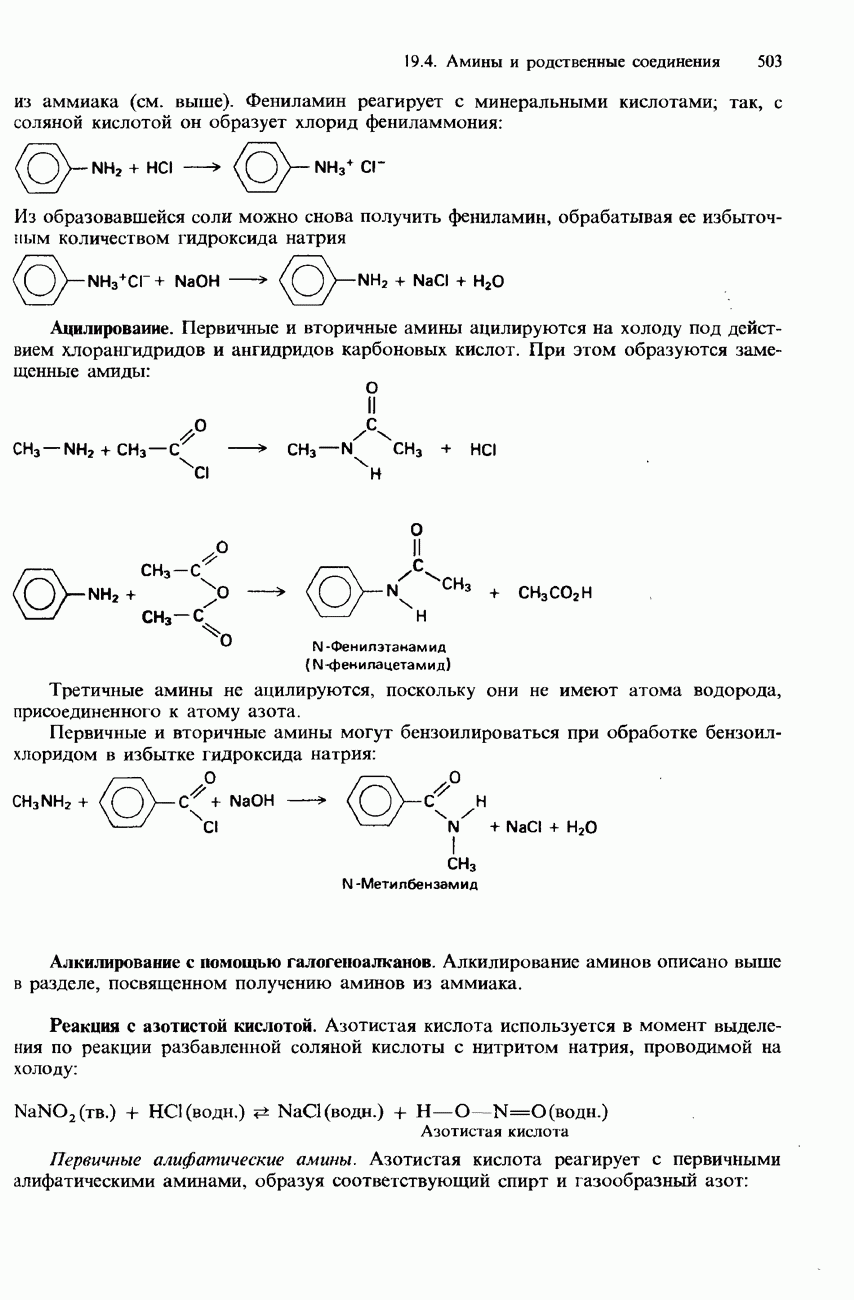
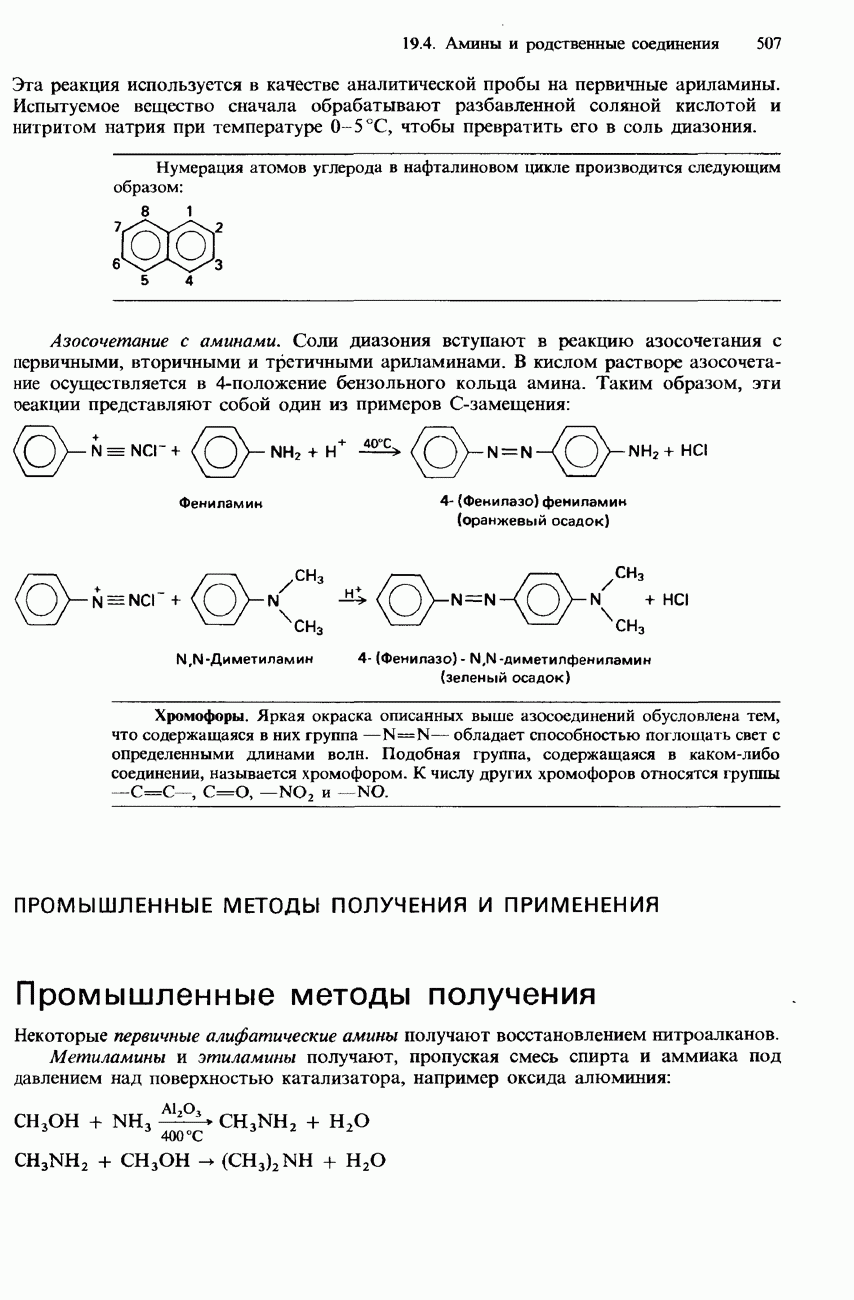
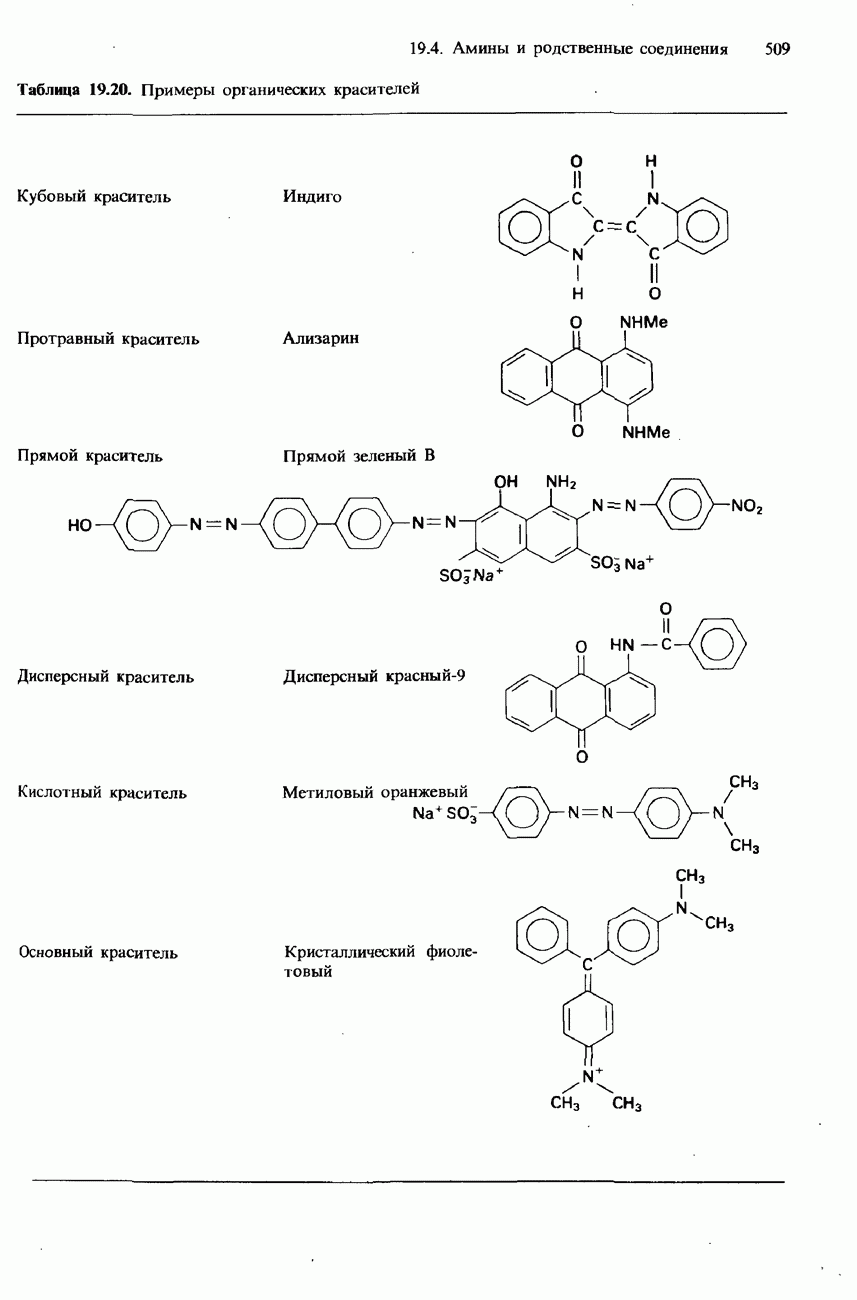
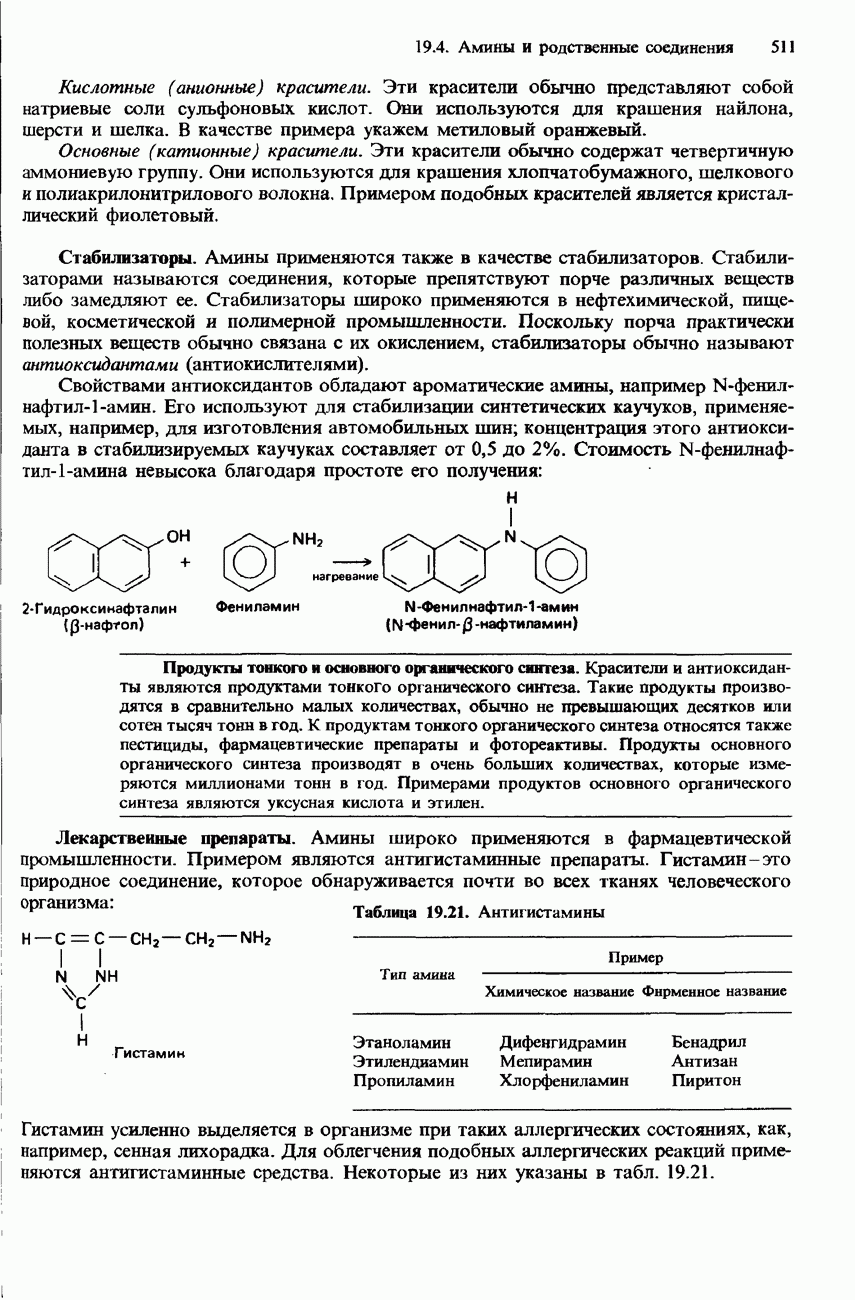
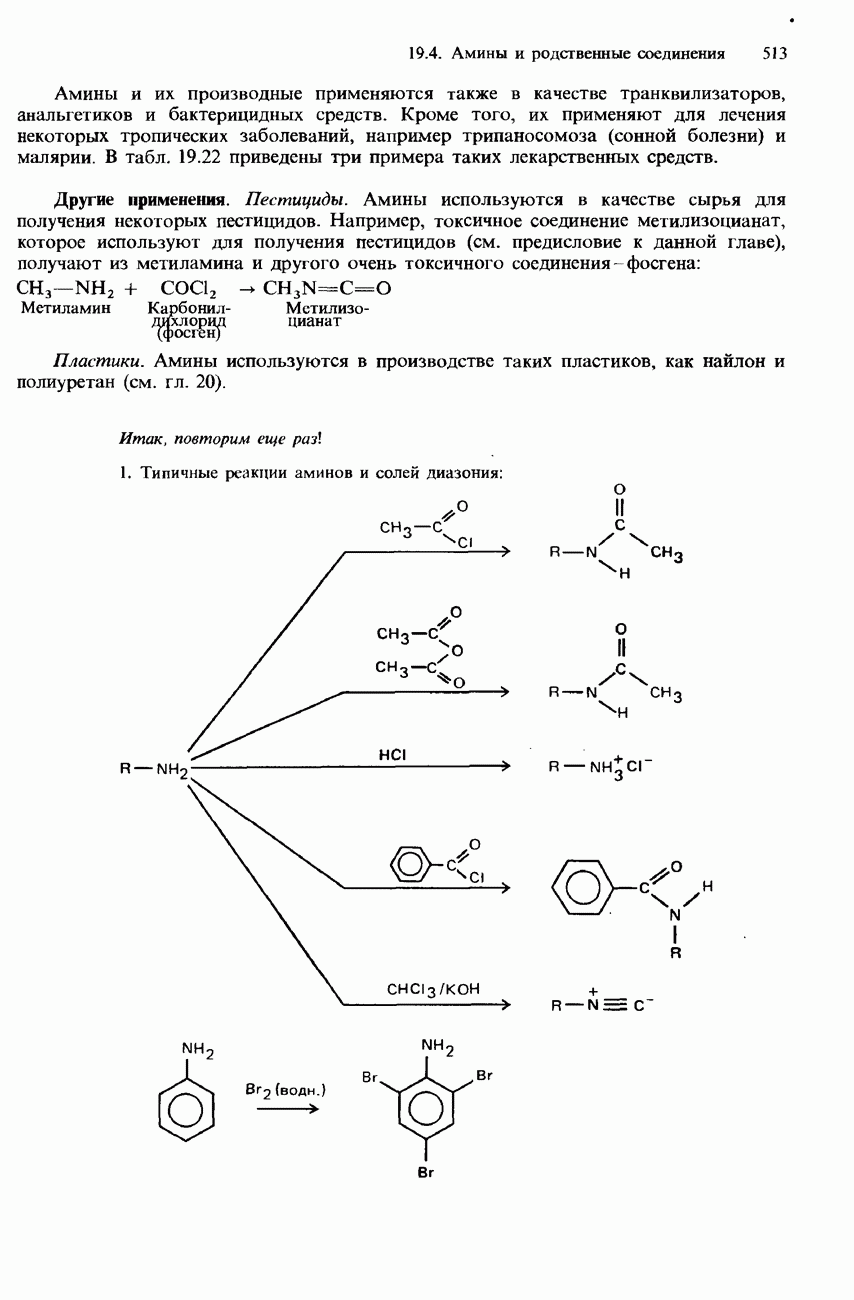
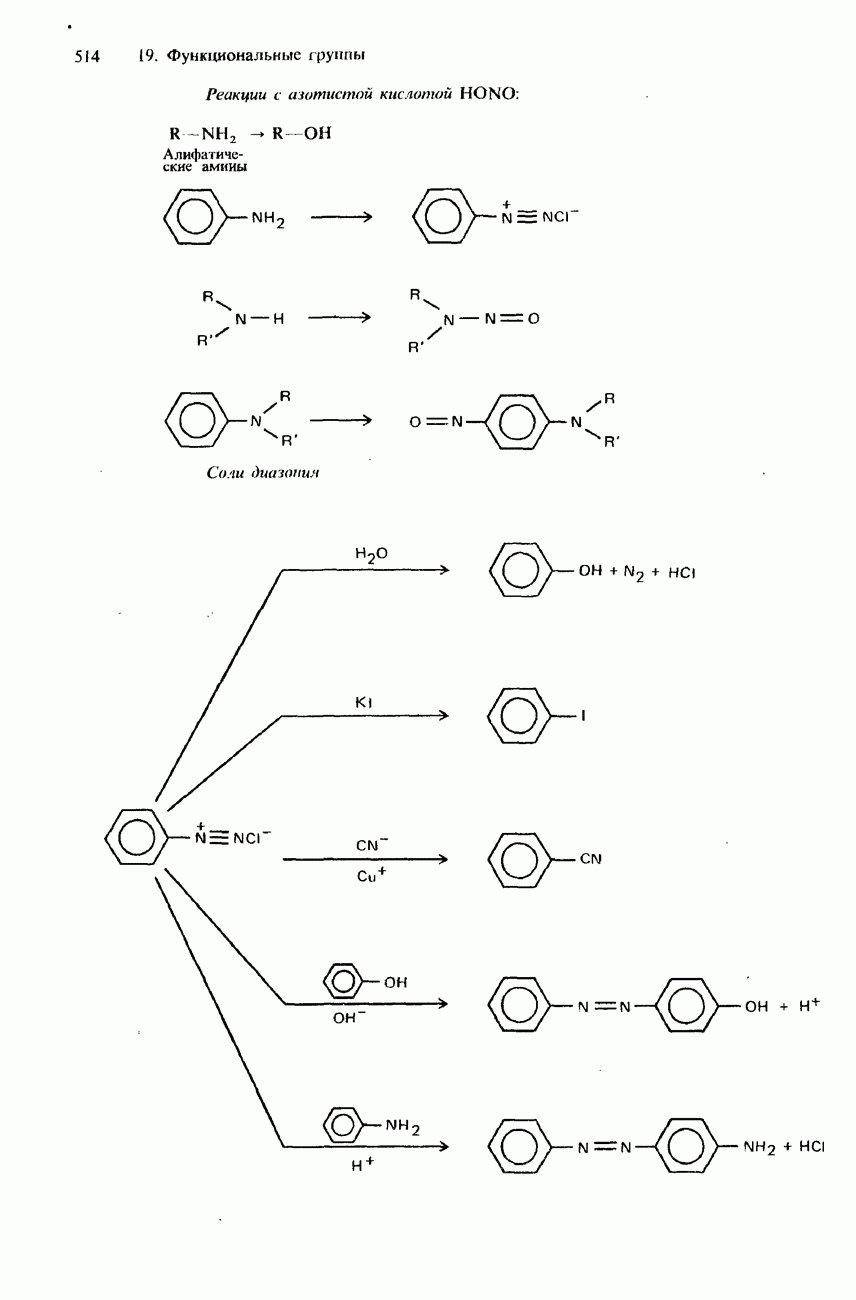
- 19.4 Амины и родственные соединения
- СОЛИ ДИАЗОНИЯ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 20. ПРИРОДНЫЕ СОЕДИНЕНИЯ И ПОЛИМЕРЫ
- 20.1. Аминокислоты, пептиды и белки
- АМИНОКИСЛОТЫ
- ПЕПТИДЫ
- БЕЛКИ
- 20.2. Углеводы и нуклеиновые кислоты
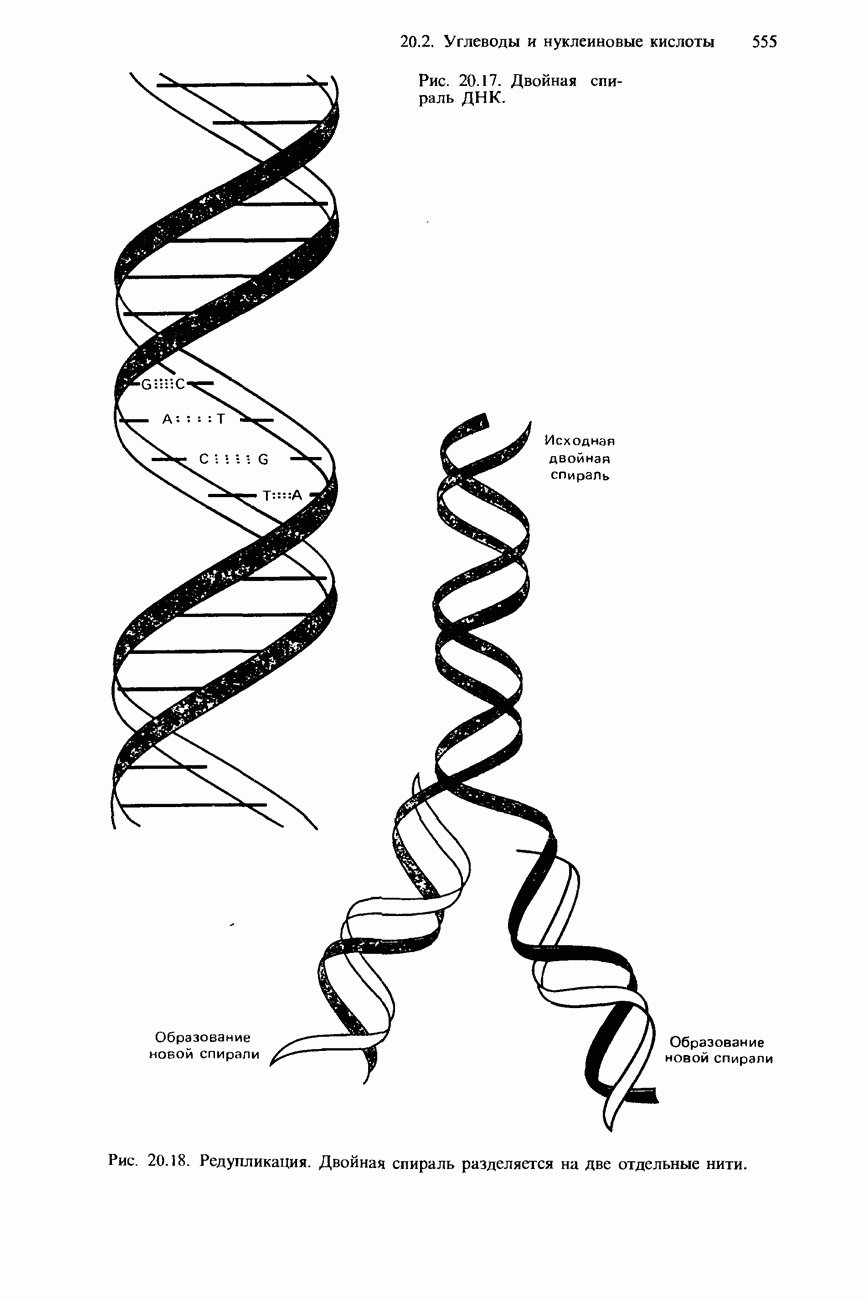
- НУКЛЕИНОВЫЕ КИСЛОТЫ
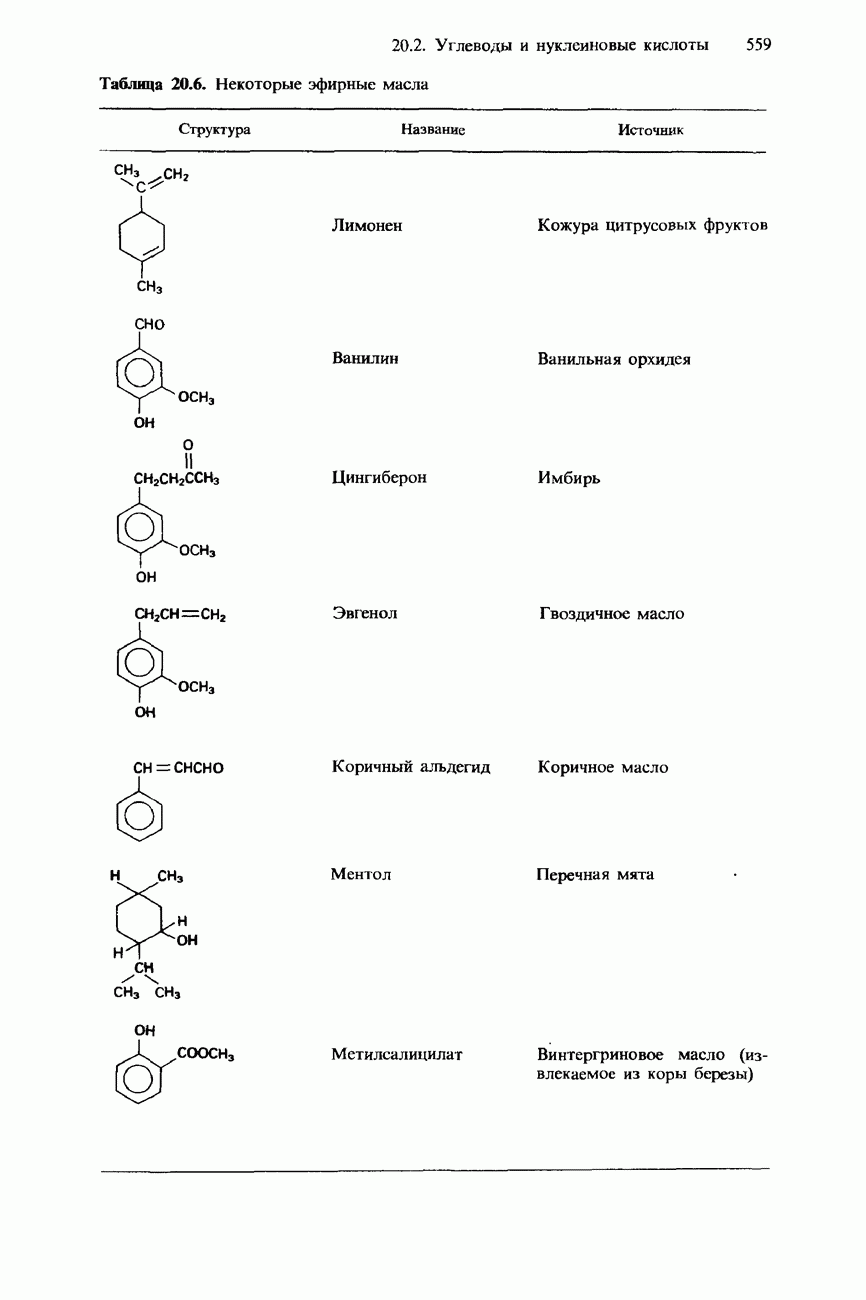
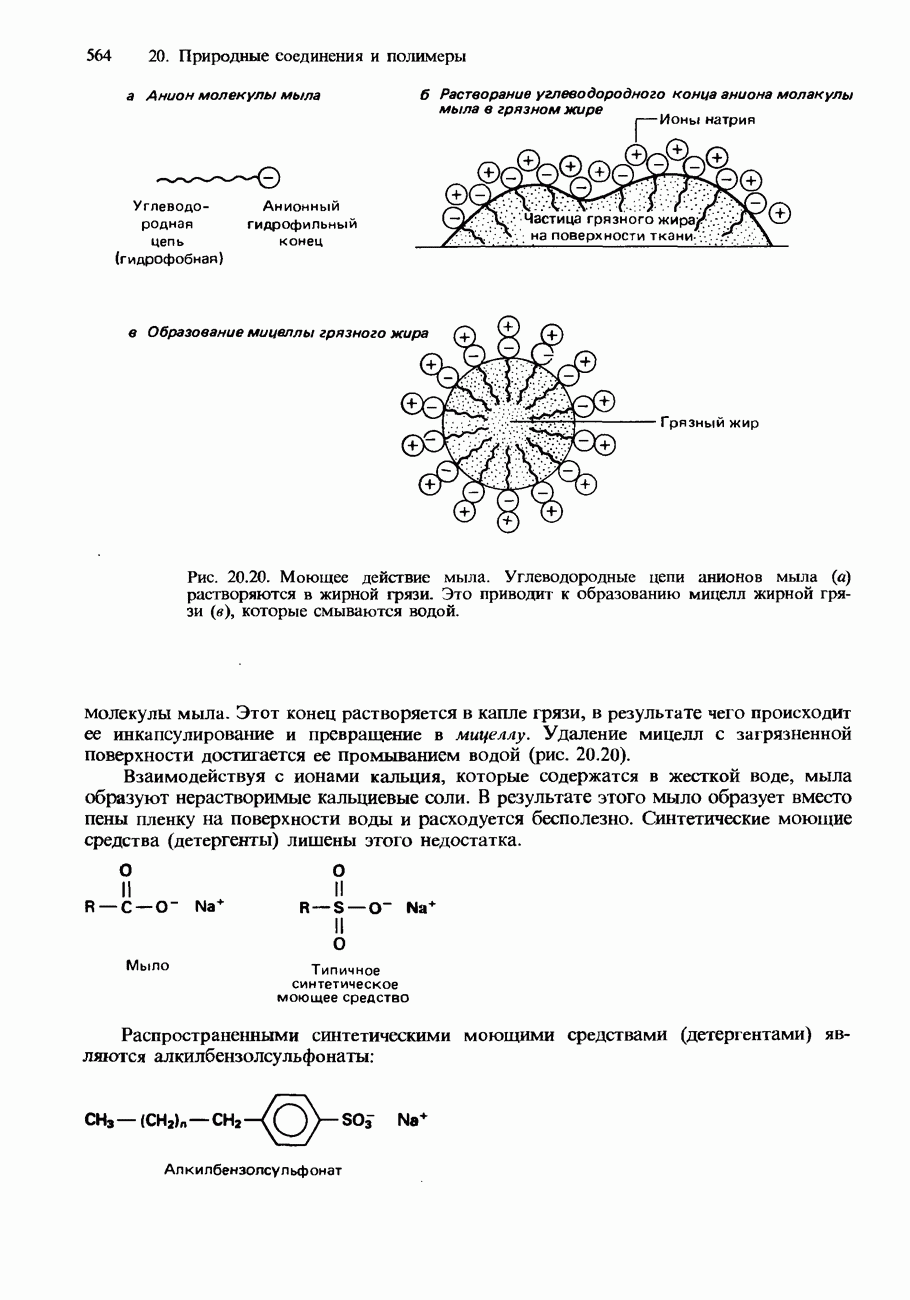
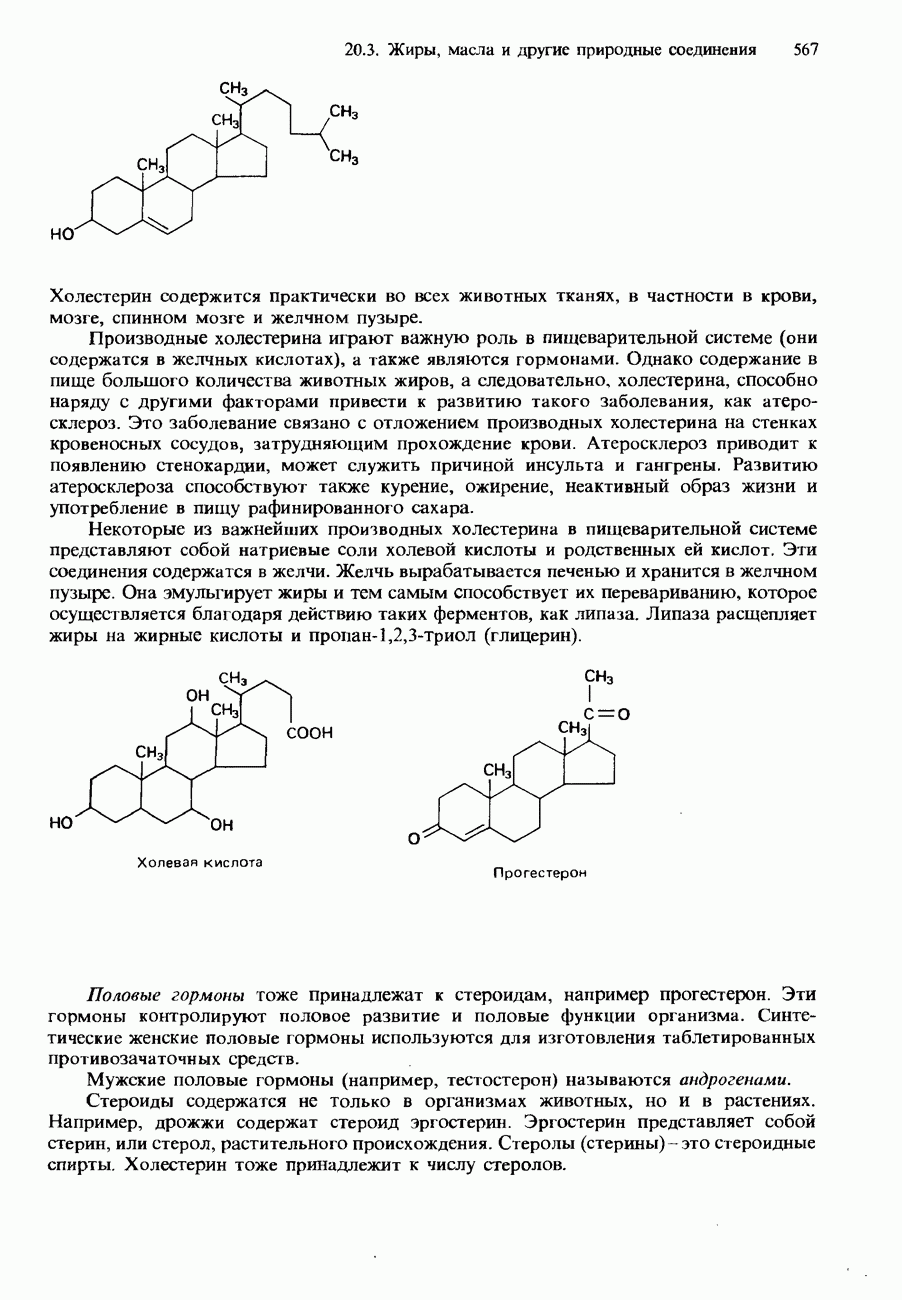
- 20.3. Жиры, масла и другие природные соединения
- ЖИРНЫЕ КИСЛОТЫ И ТРИГЛИЦЕРИДЫ
- ВОСКИ
- ФОСФОЛИПИДЫ И ГЛИКОЛИПИДЫ
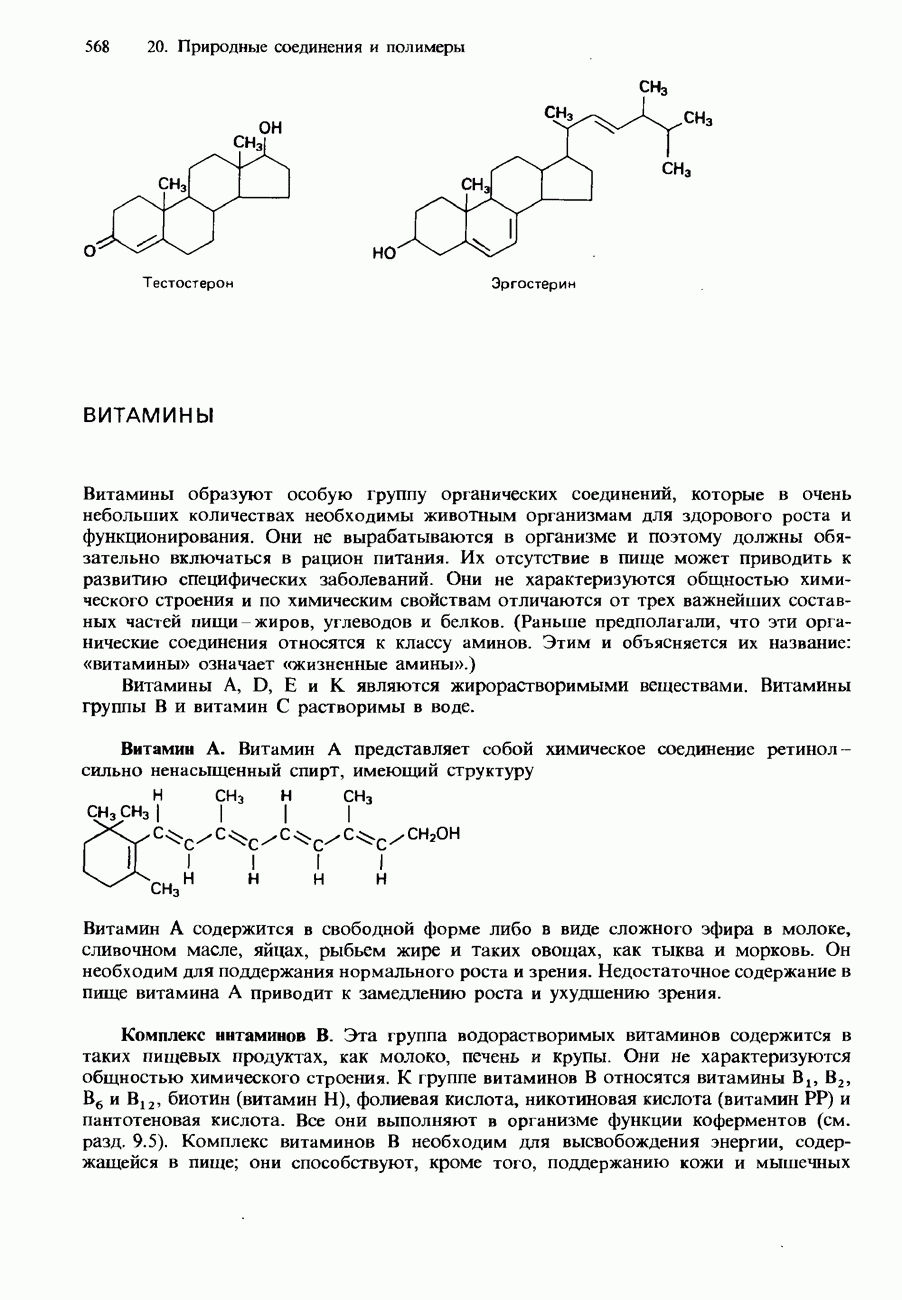
- ВИТАМИНЫ
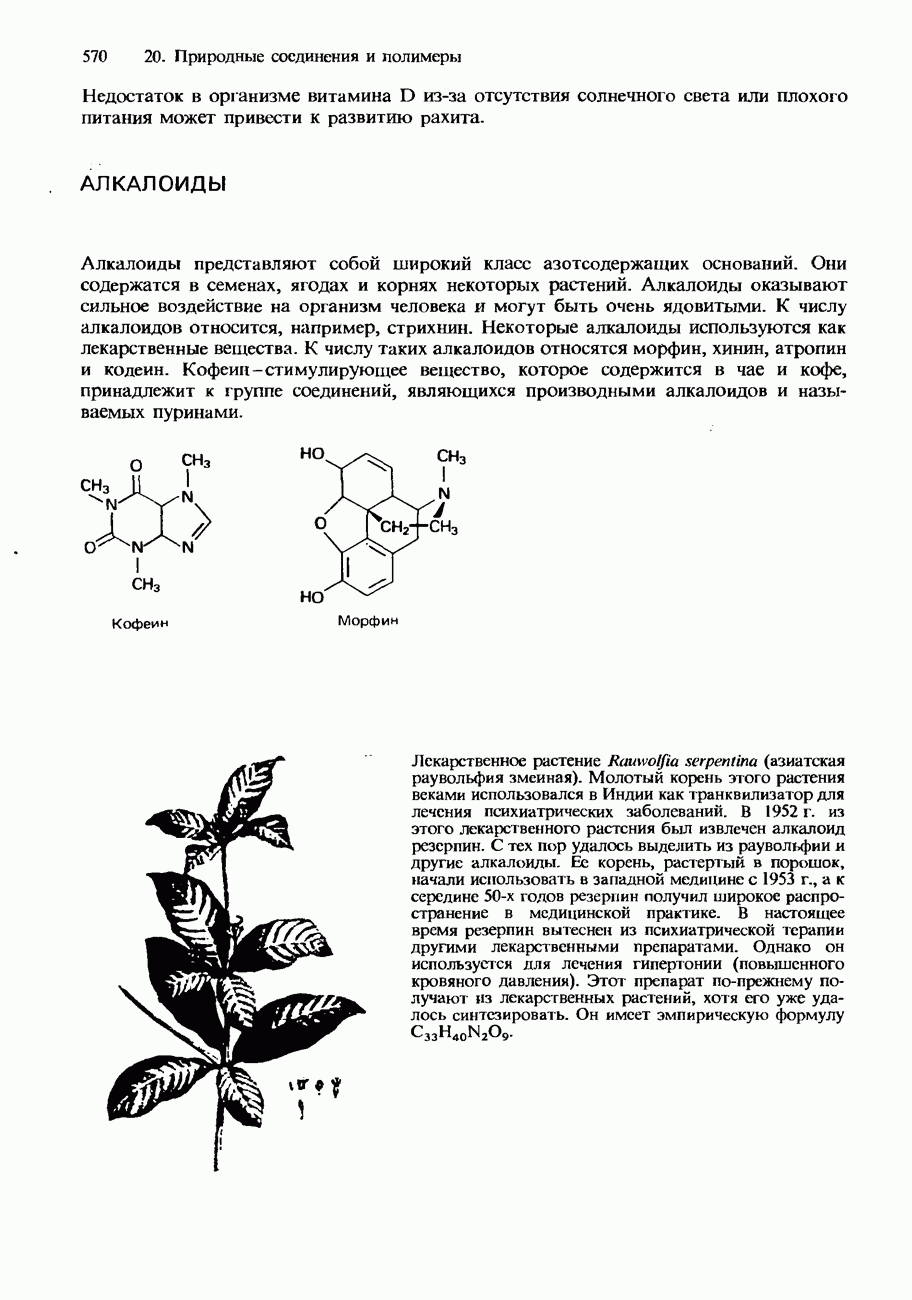
- АЛКАЛОИДЫ
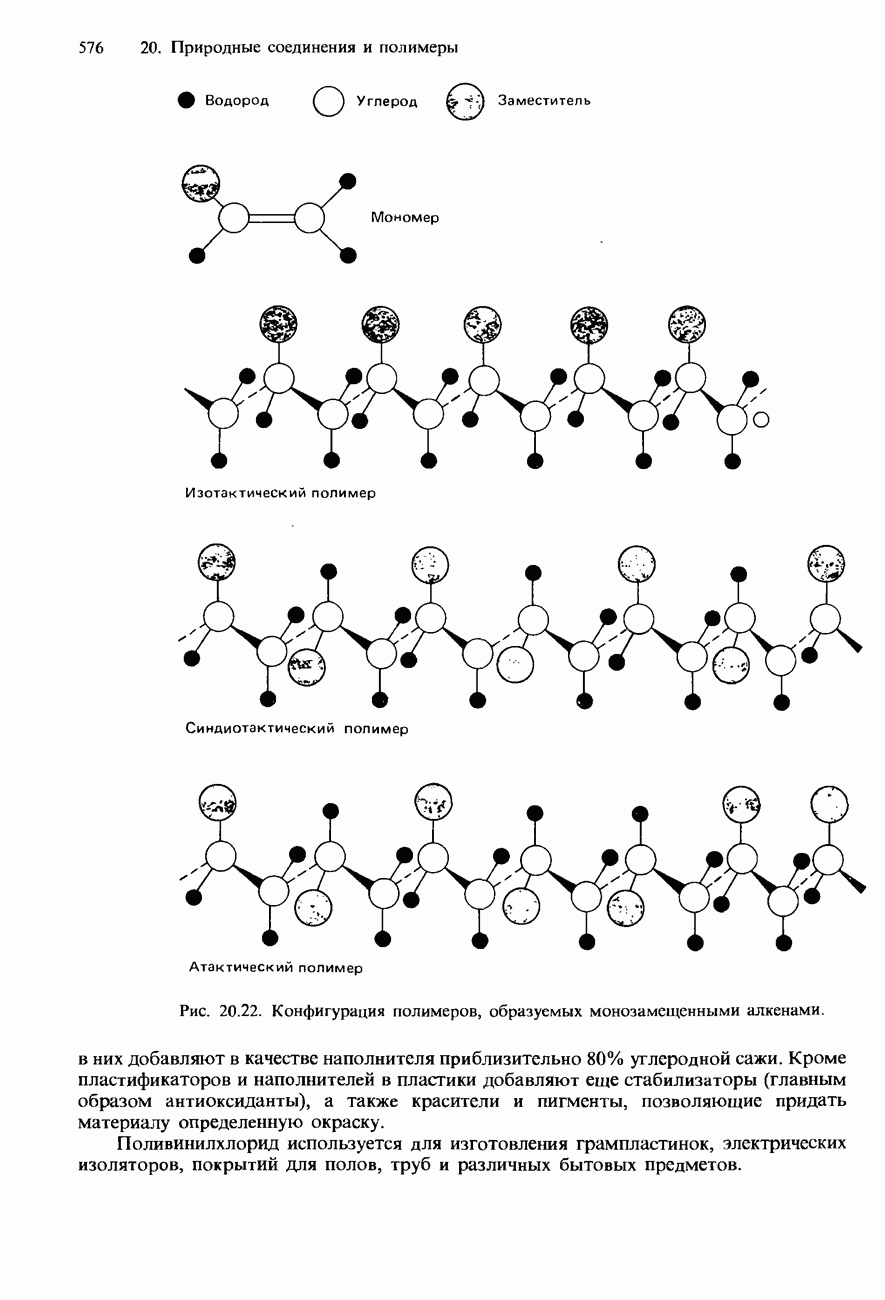
- 20.4. Полимеры
- ПОЛИМЕРИЗАЦИЯ
- НАТУРАЛЬНЫЕ И СИНТЕТИЧЕСКИЕ КАУЧУКИ
- ЦЕЛЛЮЛОЗНОЕ ВОЛОКНО
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- ПРИЛОЖЕНИЯ