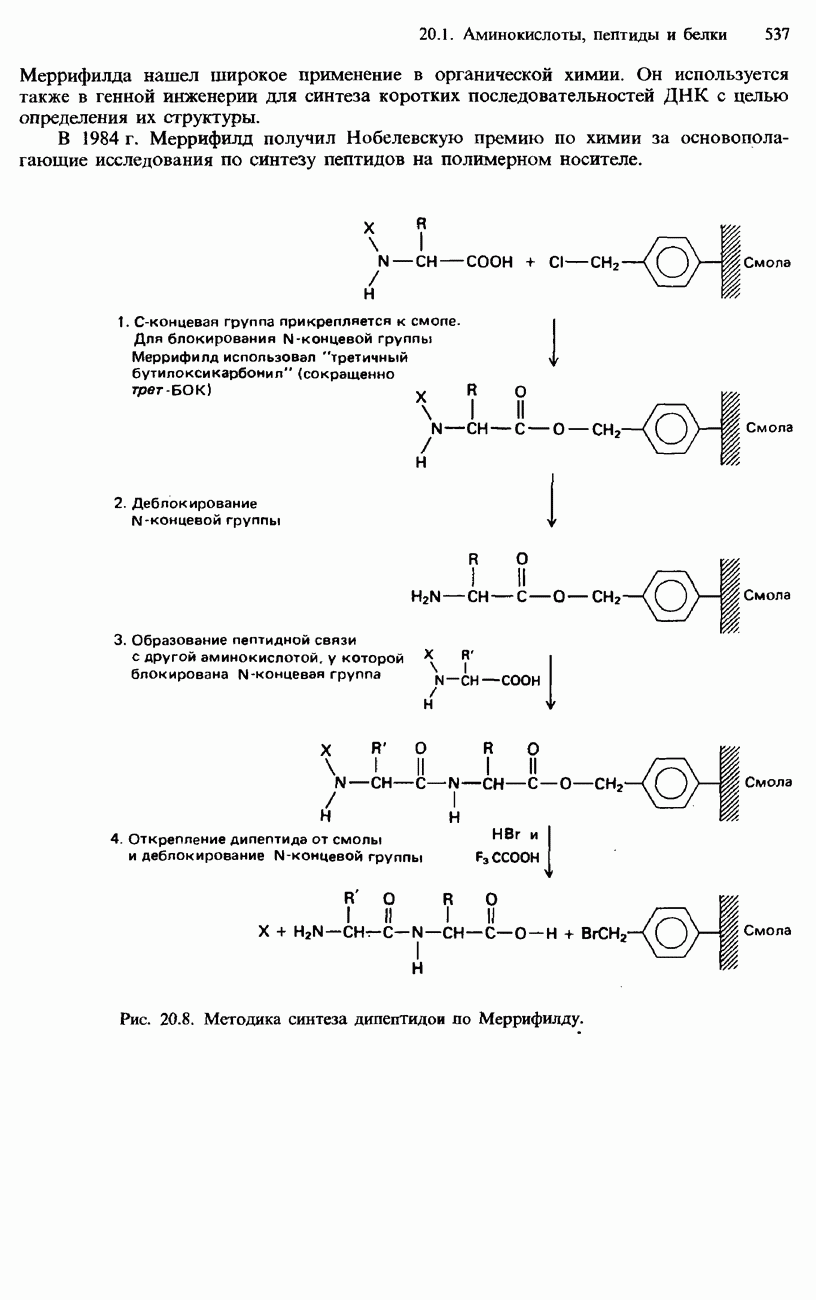
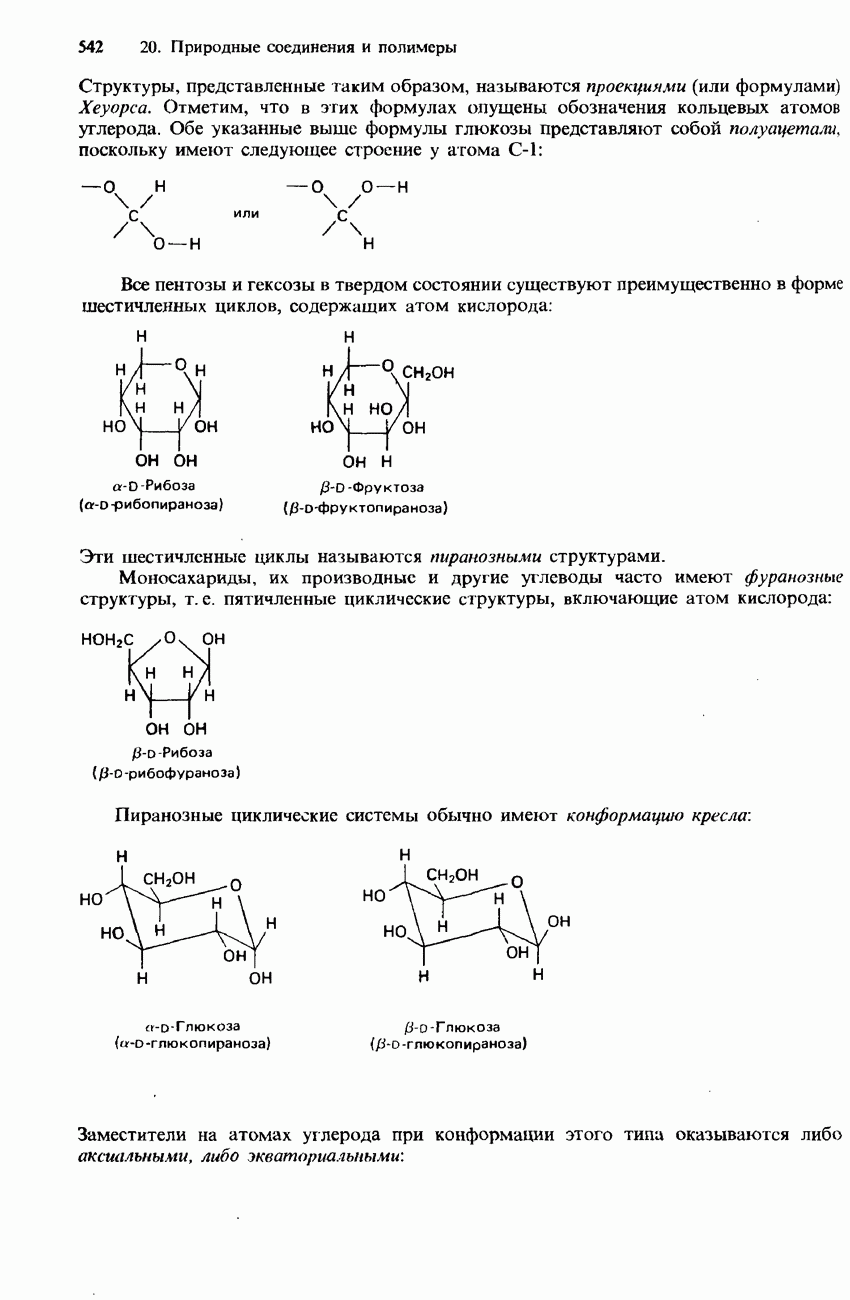
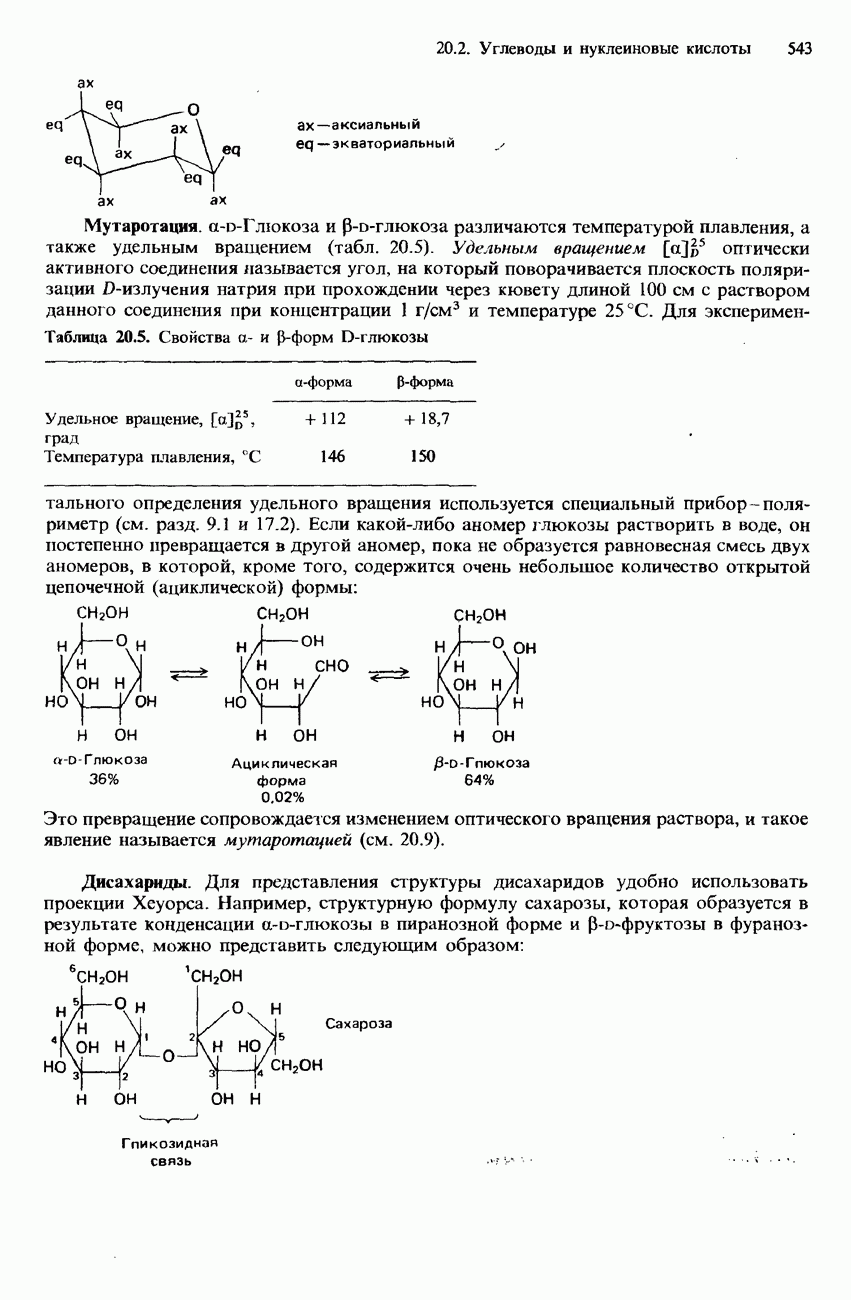
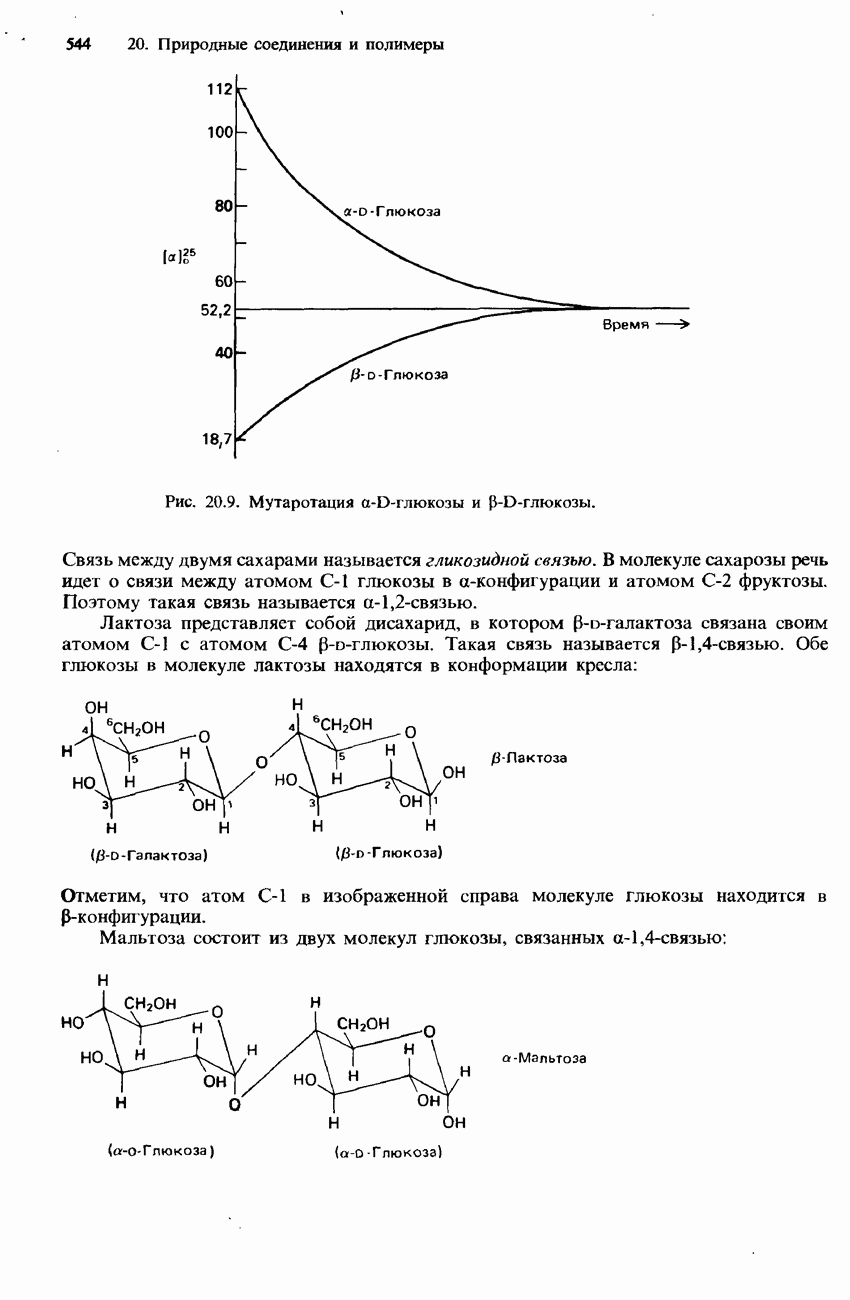
| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ ОКСОСОЕДИНЕНИЙ S-МЕТАЛЛОВ
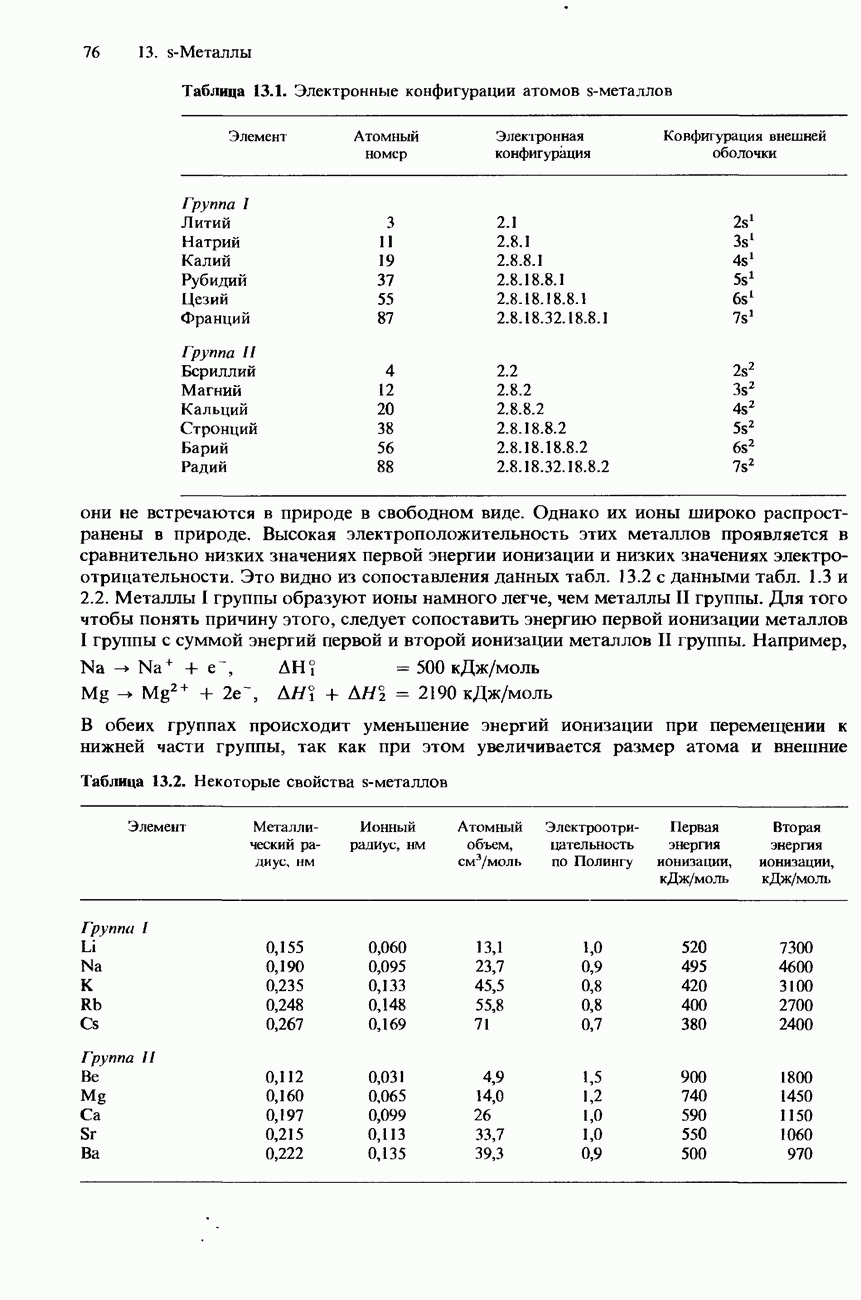
Термическая устойчивость соединений металлов зависит от поляризующей способности ионов металлов. Катионы с небольшой поляризующей способностью, как правило, образуют соединения, которые сравнительно устойчивы к нагреванию. При возрастании поляризующей способности катиона соединения приобретают более ковалентный характер и, следовательно, становятся менее устойчивыми к нагреванию. Поскольку ионы металлов I группы имеют небольшие заряды, но сравнительно большие размеры, они обладают небольшой поляризующей способностью. Поэтому они сравнительно устойчивы к нагреванию. Соли металлов II группы обладают меньшей термической устойчивостью (табл. 13.9).
Оксиды любого конкретного металла, как правило, более устойчивы, чем его карбонаты или нитраты. Дело в том, что ион кислорода  имеет меньшие размеры, чем карбонат-ион или нитрат-ион. Поэтому его поляризуемость меньше, чем у этих ионов. Вот почему некоторые карбонаты и нитраты металлов I и II групп при нагревании разлагаются с образованием более устойчивых оксидов.
имеет меньшие размеры, чем карбонат-ион или нитрат-ион. Поэтому его поляризуемость меньше, чем у этих ионов. Вот почему некоторые карбонаты и нитраты металлов I и II групп при нагревании разлагаются с образованием более устойчивых оксидов.
Карбонаты и гидрокарбонаты
Карбонаты натрия, калия, рубидия и стронция устойчивы к нагреванию. Карбонаты остальных  -металлов разлагаются при нагревании, образуя оксид соответствующего металла и диоксид углерода, например
-металлов разлагаются при нагревании, образуя оксид соответствующего металла и диоксид углерода, например

Таблица 13.9. Температуры плавления или разложения соединений s-металлов

Данные табл. 13.9 показывают, что при перемещении к нижней части II группы карбонаты соответствующих металлов становятся более устойчивыми к нагреванию. Это объясняется тем, что в указанном направлении происходит увеличение размеров катионов и, следовательно, уменьшение их поляризующей способности.
Литий и металлы II группы не образуют твердых гидрокарбонатов, хотя они существуют в растворах. При нагревании таких растворов гидрокарбонаты указанных металлов разлагаются с образованием карбонатов. Все твердые гидрокарбонаты разлагаются при температурах от 100 до 300°С, образуя карбонаты, например

Нитраты
За исключением нитрата лития, нитраты всех остальных металлов I группы разлагаются при сильном нагревании, образуя нитриты и кислород. Например

Нитрат лития и нитраты металлов II группы разлагаются при нагревании с образованием диоксида азота, кислорода и термически устойчивых оксидов. Например

Гидроксиды и оксиды
Термическая устойчивость гидроксидов металлов I и II группы подчиняется тем же закономерностям, что и термическая устойчивость их карбонатов и нитратов. Гидроксид лития и гидроксиды всех металлов II группы разлагаются при нагревании с образованием устойчивых оксидов и воды:

За исключением гидроксида лития, гидроксиды всех остальных металлов I группы термически устойчивы.
Нормальные оксиды лития, натрия и металлов II группы особенно устойчивы и плавятся только при высоких температурах (см. табл. 13.9). Это объясняется сравнительно малым размером иона кислорода  Пероксиды обладают более низкими температурами плавления.
Пероксиды обладают более низкими температурами плавления.
Сульфаты и галогениды
Сульфаты и галогениды металлов I и II групп термически устойчивы.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- 11. ПЕРИОДИЧЕСКИЙ ЗАКОН
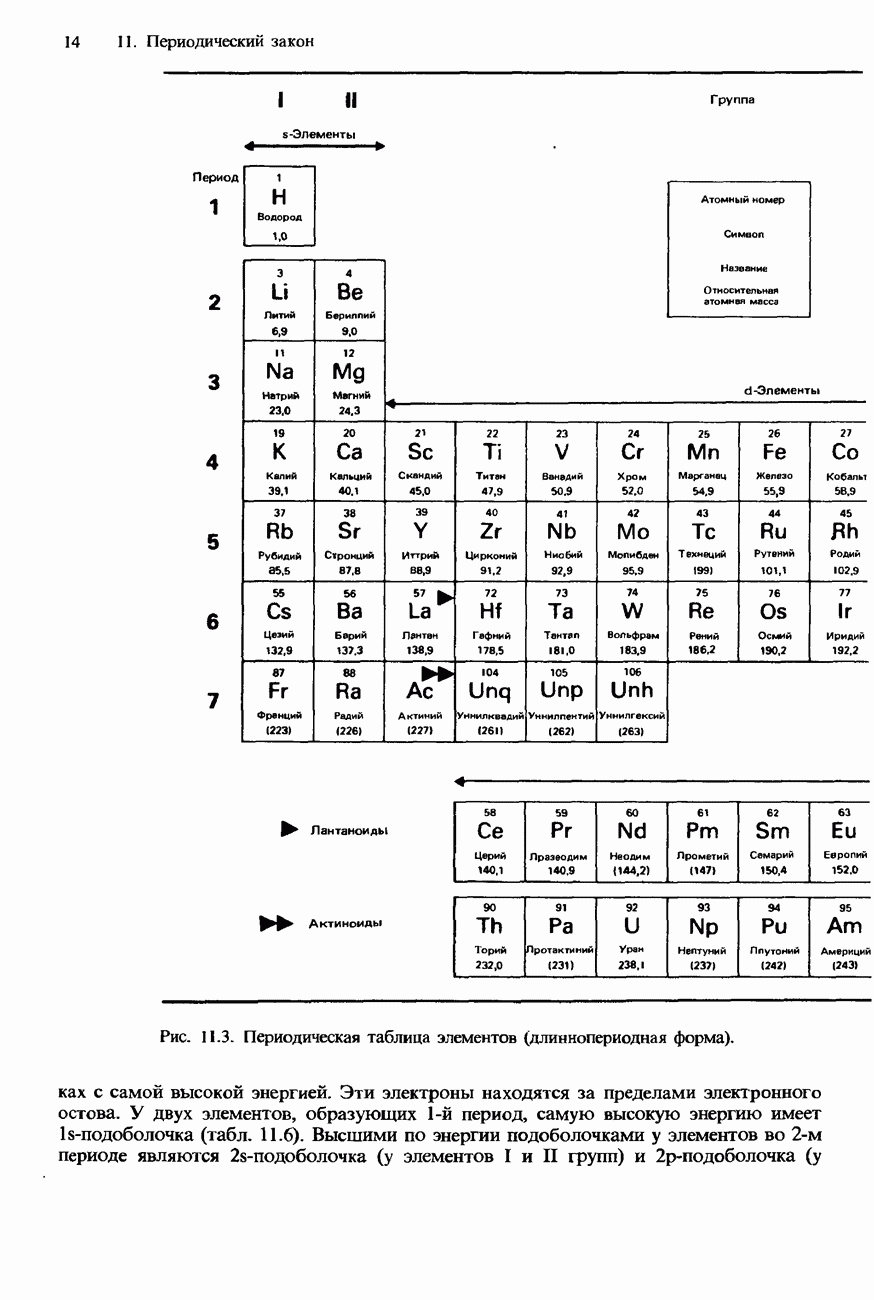
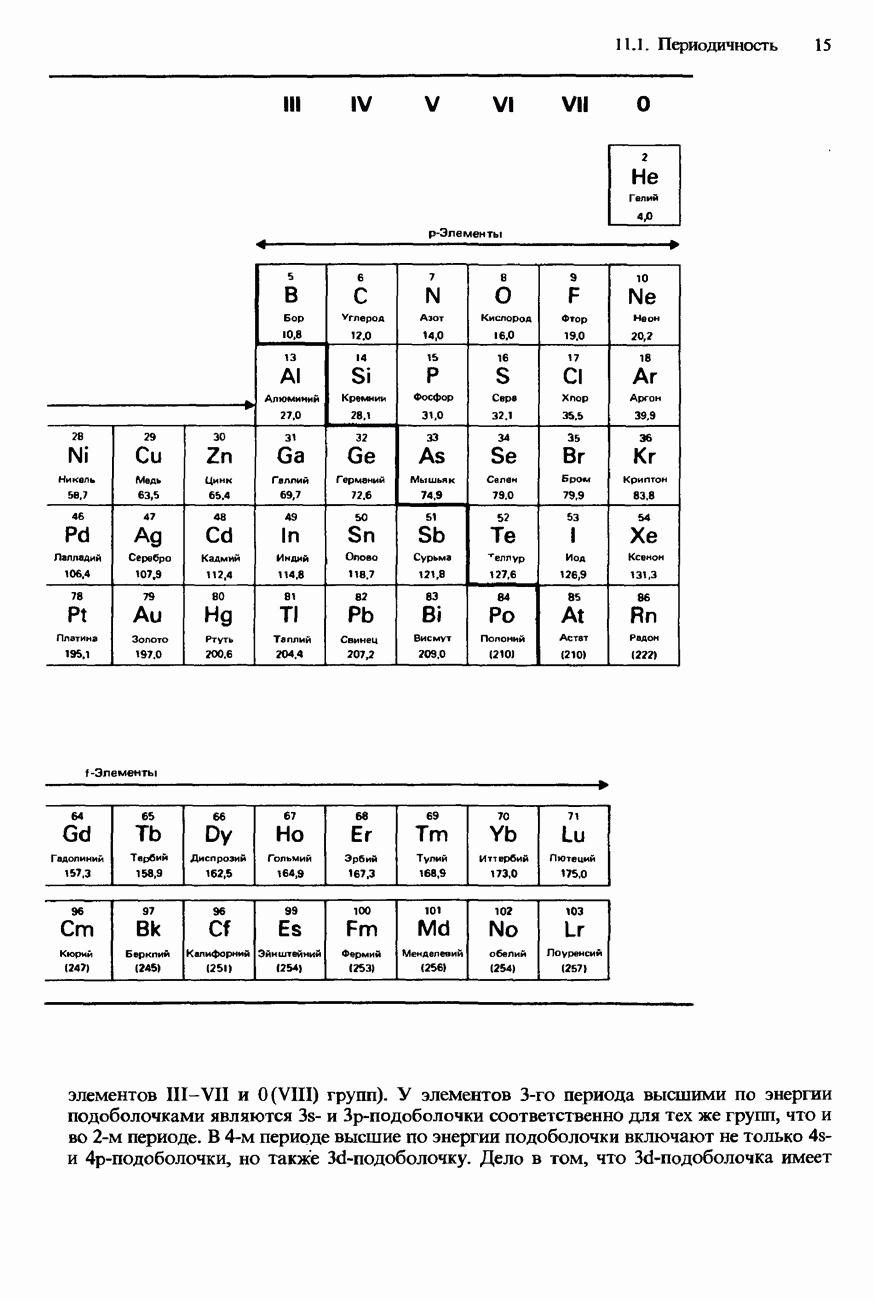
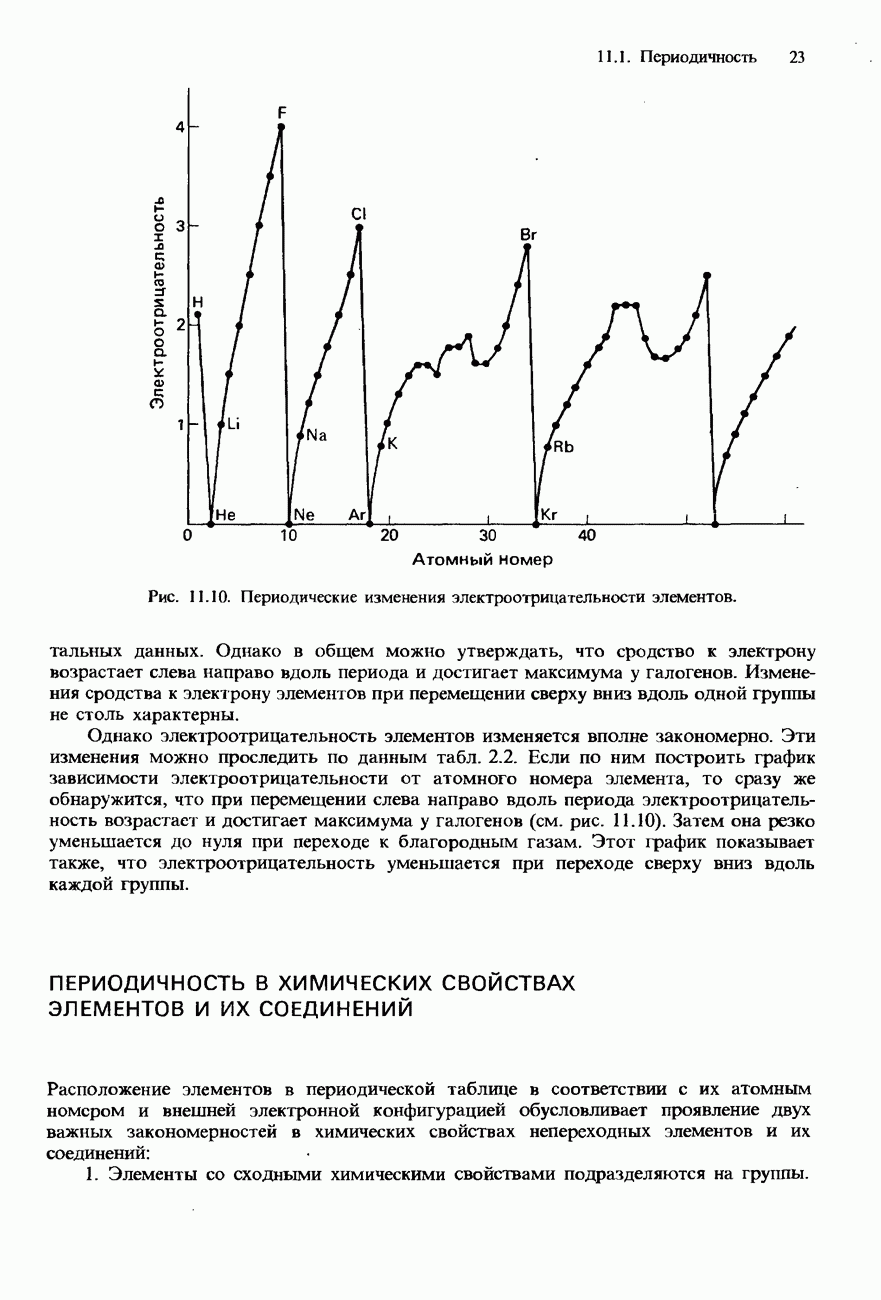
- 11.1 Периодичность
- СОВРЕМЕННАЯ ФОРМА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
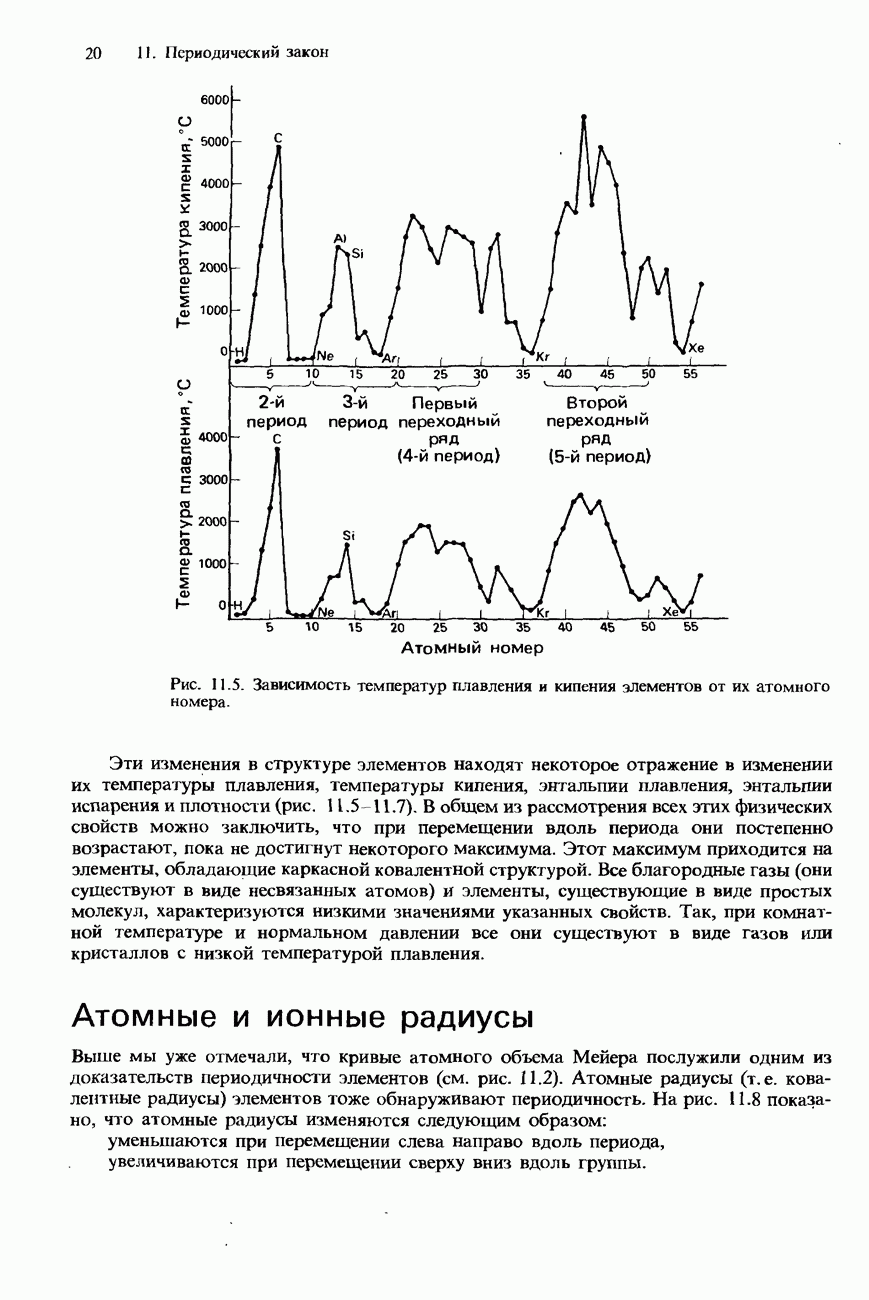
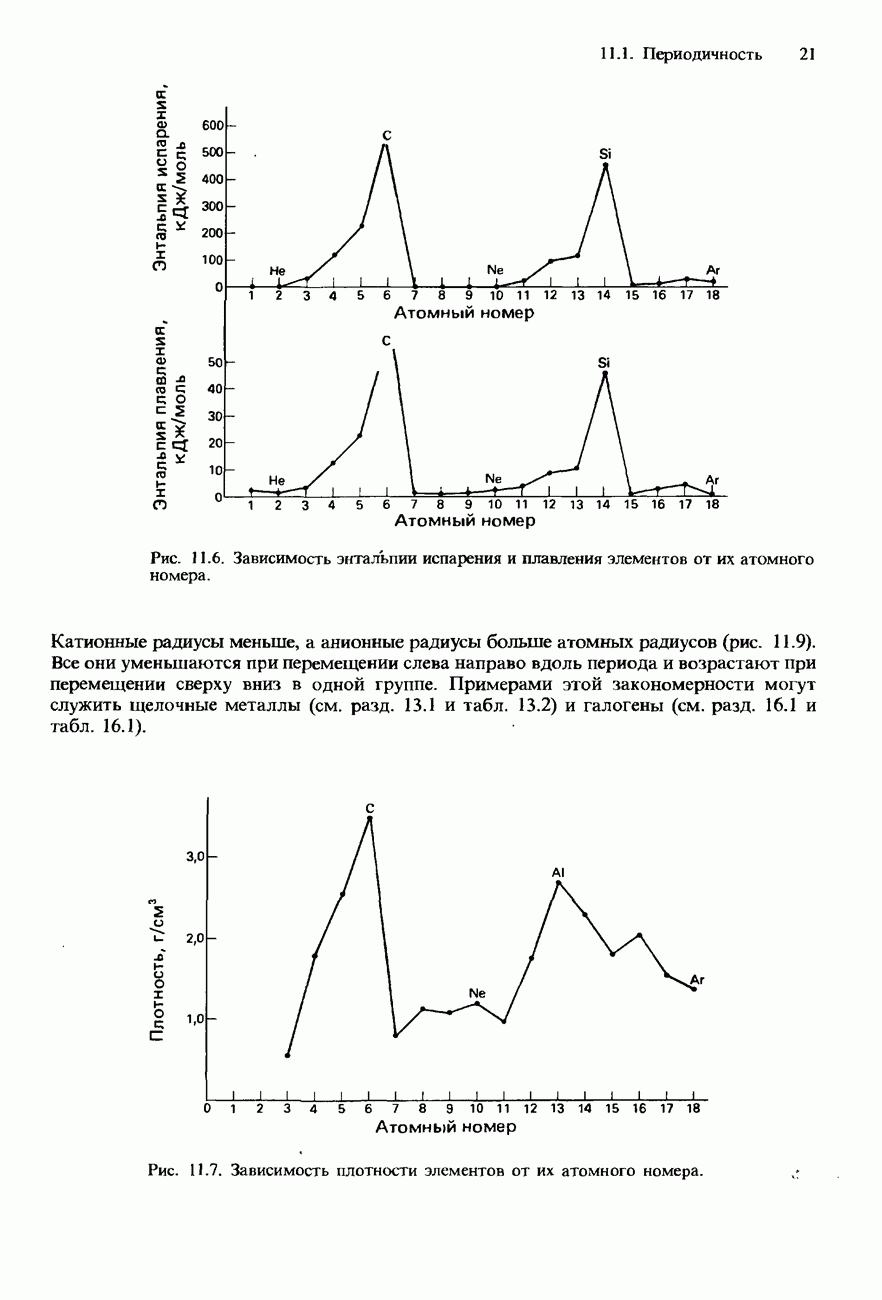
- ПЕРИОДИЧНОСТЬ
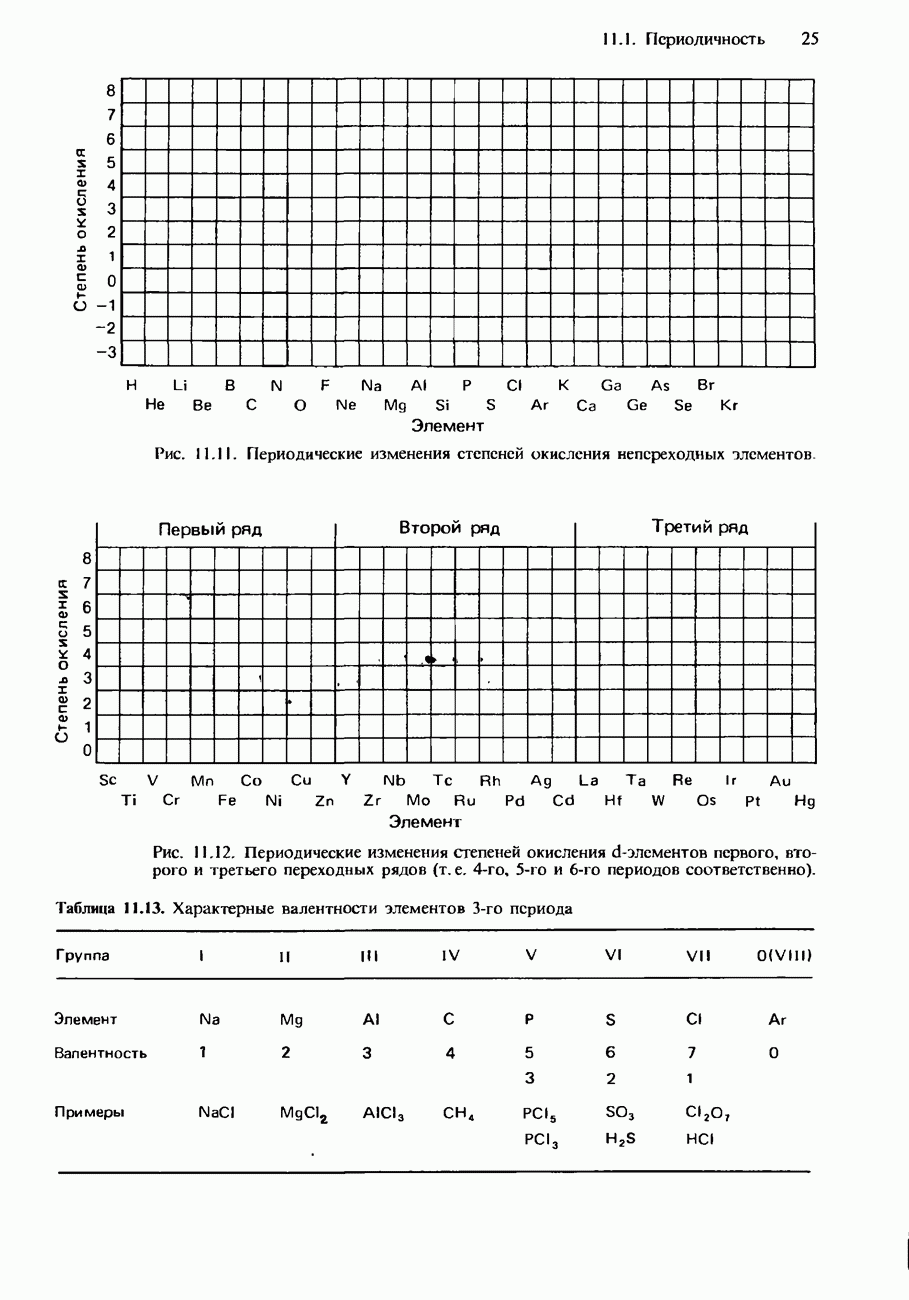
- ПЕРИОДИЧНОСТЬ В ХИМИЧЕСКИХ СВОЙСТВАХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 12. ВОДОРОД И ВОДА
- 12.1. ВОДОРОД
- ПОЛУЧЕНИЕ ВОДОРОДА В ЛАБОРАТОРНЫХ УСЛОВИЯХ
- РАЗЛИЧНЫЕ ФОРМЫ ВОДОРОДА
- ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
- ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
- ТИПЫ СОЕДИНЕНИЙ ВОДОРОДА
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПОЛУЧЕНИЕ И ИСПОЛЬЗОВАНИЕ ВОДОРОДА
- 12.2 Вода
- ХИМИЧЕСКИЕ РЕАКЦИИ С УЧАСТИЕМ ВОДЫ
- ИСТОЧНИКИ ПРЕСНОЙ ВОДЫ И ЕЕ ИСПОЛЬЗОВАНИЕ
- КАЧЕСТВО ВОДЫ
- ЗАГРЯЗНЕНИЕ ВОДЫ
- ОЧИСТКА И ПОДГОТОВКА ВОДЫ
- ОКЕАНЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 13. s-Металлы
- 13.1 Структура и свойства s-металлов
- СТРУКТУРА
- ФИЗИЧЕСКИЕ СВОЙСТВА
- РЕАКЦИОННАЯ СПОСОБНОСТЬ S-МЕТАЛЛОВ
- 13.2 Соединения, образуемые s-металлами
- ДРУГИЕ БИНАРНЫЕ СОЕДИНЕНИЯ
- ГИДРОКСИДЫ
- КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ ОКСОСОЕДИНЕНИЙ S-МЕТАЛЛОВ
- РАСТВОРИМОСТЬ СОЛЕЙ И ГИДРОКСИДОВ МЕТАЛЛОВ I И II ГРУПП В ВОДЕ
- АНОМАЛЬНЫЕ СВОЙСТВА ЛИТИЯ И БЕРИЛЛИЯ, А ТАКЖЕ ИХ СОЕДИНЕНИЙ
- 13.3. Распространенность в природе, получение и применение
- ПОЛУЧЕНИЕ S-МЕТАЛЛОВ
- ПОЛУЧЕНИЕ СОЕДИНЕНИЙ S-МЕТАЛЛОВ
- ПРИМЕНЕНИЕ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 14. d-ЭЛЕМЕНТЫ
- 14.1. Структура и свойства d-элементов
- d-ЭЛЕМЕНТЫ
- ФИЗИЧЕСКИЕ СВОЙСТВА
- ХИМИЧЕСКИЕ СВОЙСТВА
- 14.2 Химия семи d-элементов
- МАРГАНЕЦ
- ЖЕЛЕЗО
- КОБАЛЬТ
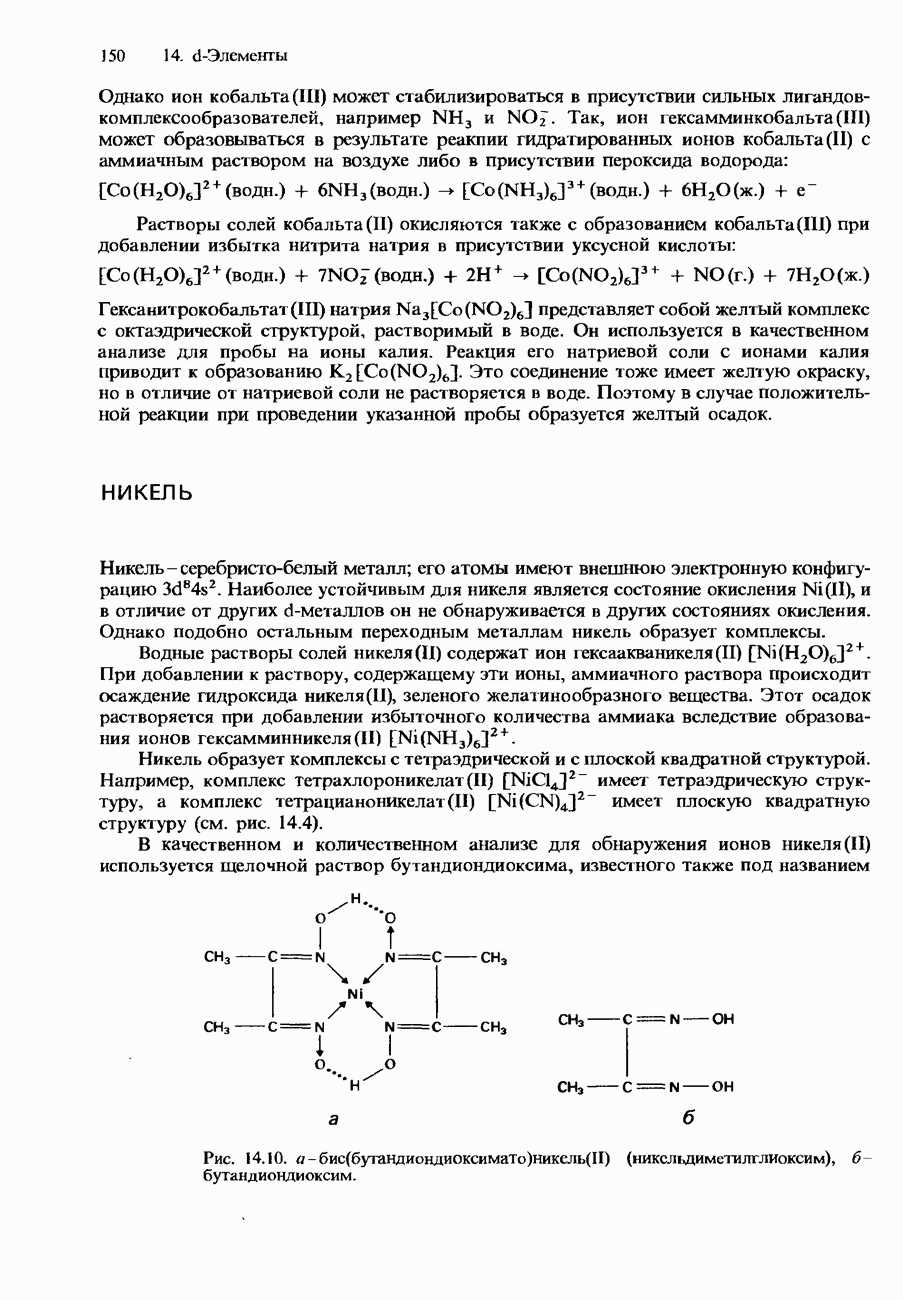
- НИКЕЛЬ
- МЕДЬ
- ЦИНК
- 14.3. Распространенность в природе, получение и применения
- ПРОИЗВОДСТВО ЖЕЛЕЗА И СТАЛИ
- ПОЛУЧЕНИЕ ДРУГИХ МЕТАЛЛОВ ПЕРВОГО ПЕРЕХОДНОГО РЯДА
- ПРИМЕНЕНИЯ d-ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 15. ЭЛЕМЕНТЫ III-VI ГРУПП
- 15.1. Алюминий и другие элементы III группы
- БОР
- ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ
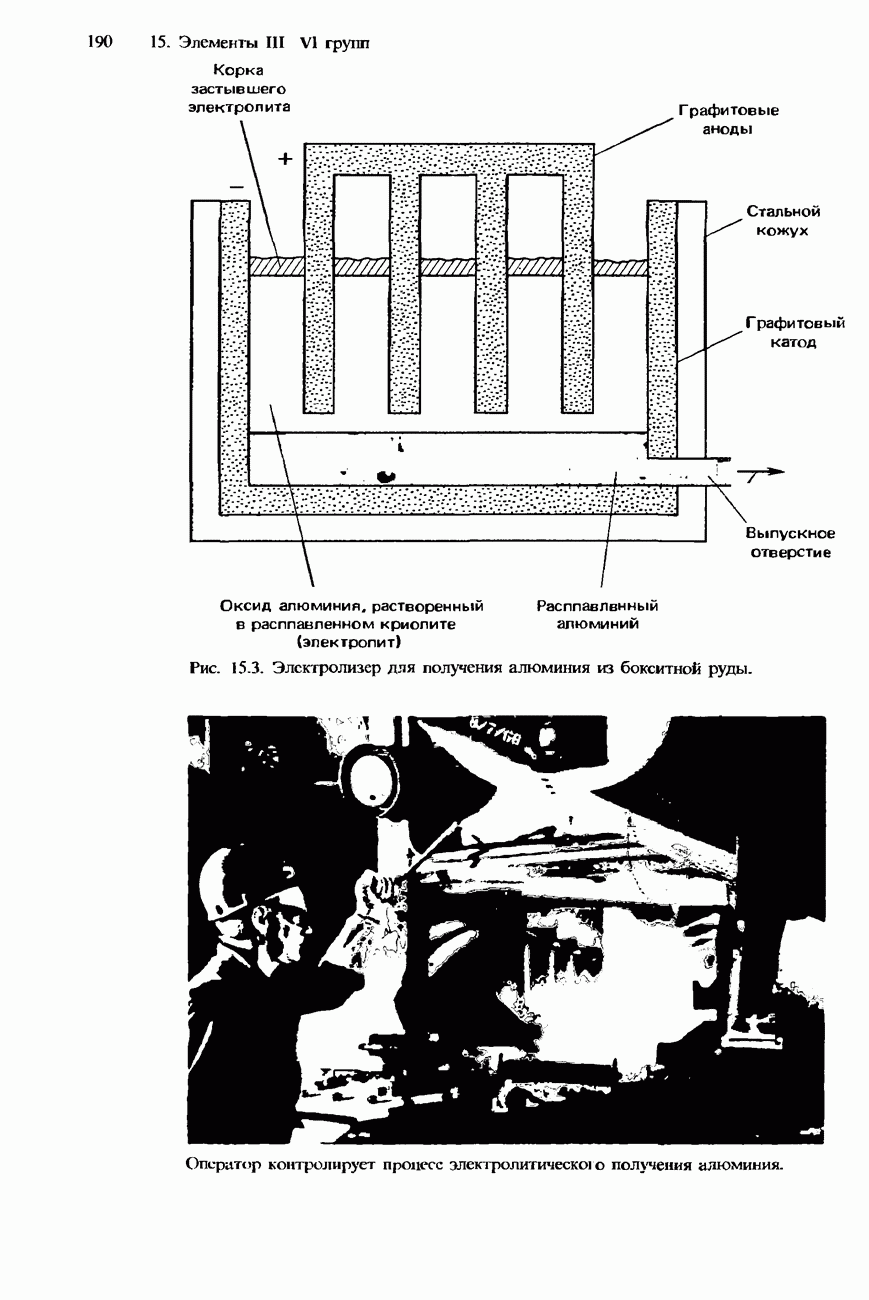
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ
- ПРИМЕНЕНИЯ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ
- 15.2. IV группа периодической системы
- СОЕДИНЕНИЯ
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ ИЗ РУД
- ПРИМЕНЕНИЯ УГЛЕРОДА
- ПРИМЕНЕНИЯ КРЕМНИЯ
- ПРИМЕНЕНИЯ ГЕРМАНИЯ, ОЛОВА И СВИНЦА
- 15.3. Элементы V группы
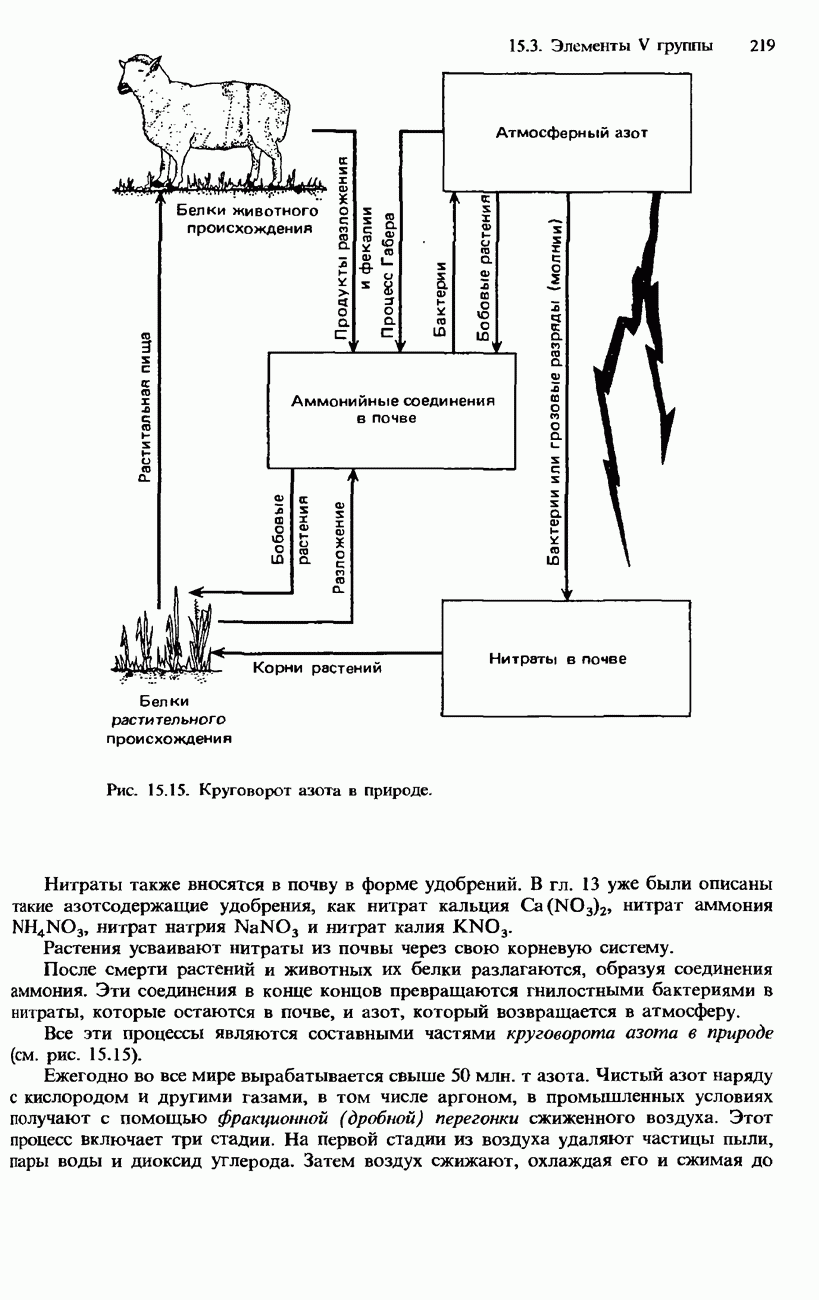
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЯ АЗОТА И ФОСФОРА
- СОЕДИНЕНИЯ АЗОТА
- СОЕДИНЕНИЯ ФОСФОРА
- 15.4. Элементы VI группы. Кислород и сера
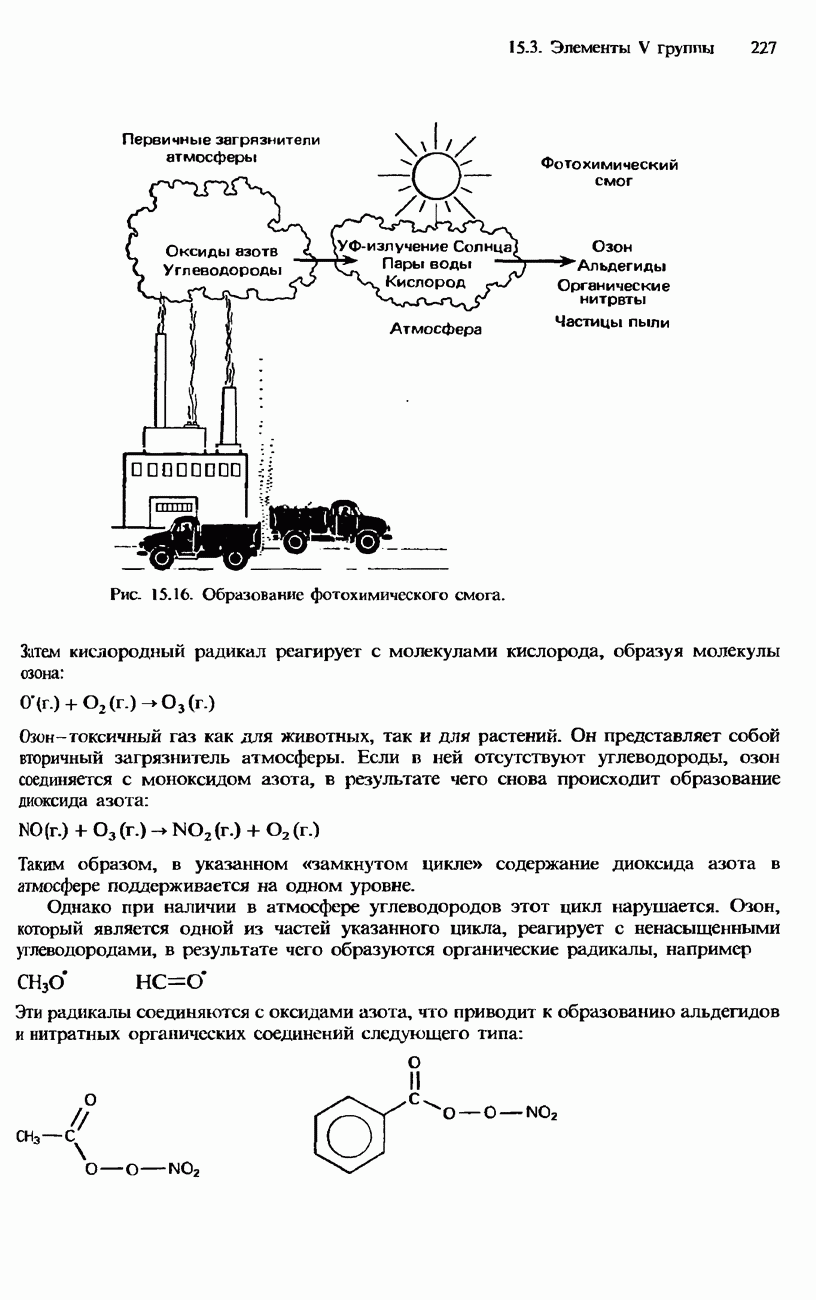
- КИСЛОРОД
- СОЕДИНЕНИЯ КИСЛОРОДА
- СЕРА
- СОЕДИНЕНИЯ СЕРЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 16. ГАЛОГЕНЫ И БЛАГОРОДНЫЕ ГАЗЫ
- 16.1. Галогены
- ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ ГАЛОГЕНОВ
- ЛАБОРАТОРНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ ГАЛОГЕНОВ
- ФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА
- РЕАКЦИОННАЯ СПОСОБНОСТЬ ГАЛОГЕНОВ
- 16.2. Соединения галогенов
- ГАЛОГЕНОВОДОРОДЫ
- КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ГАЛОГЕНОВ
- 16.3. Распространенность, получение и применение галогенов и их соединений
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ХЛОРА
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ДРУГИХ ГАЛОГЕНОВ
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ СОЕДИНЕНИЙ ХЛОРА
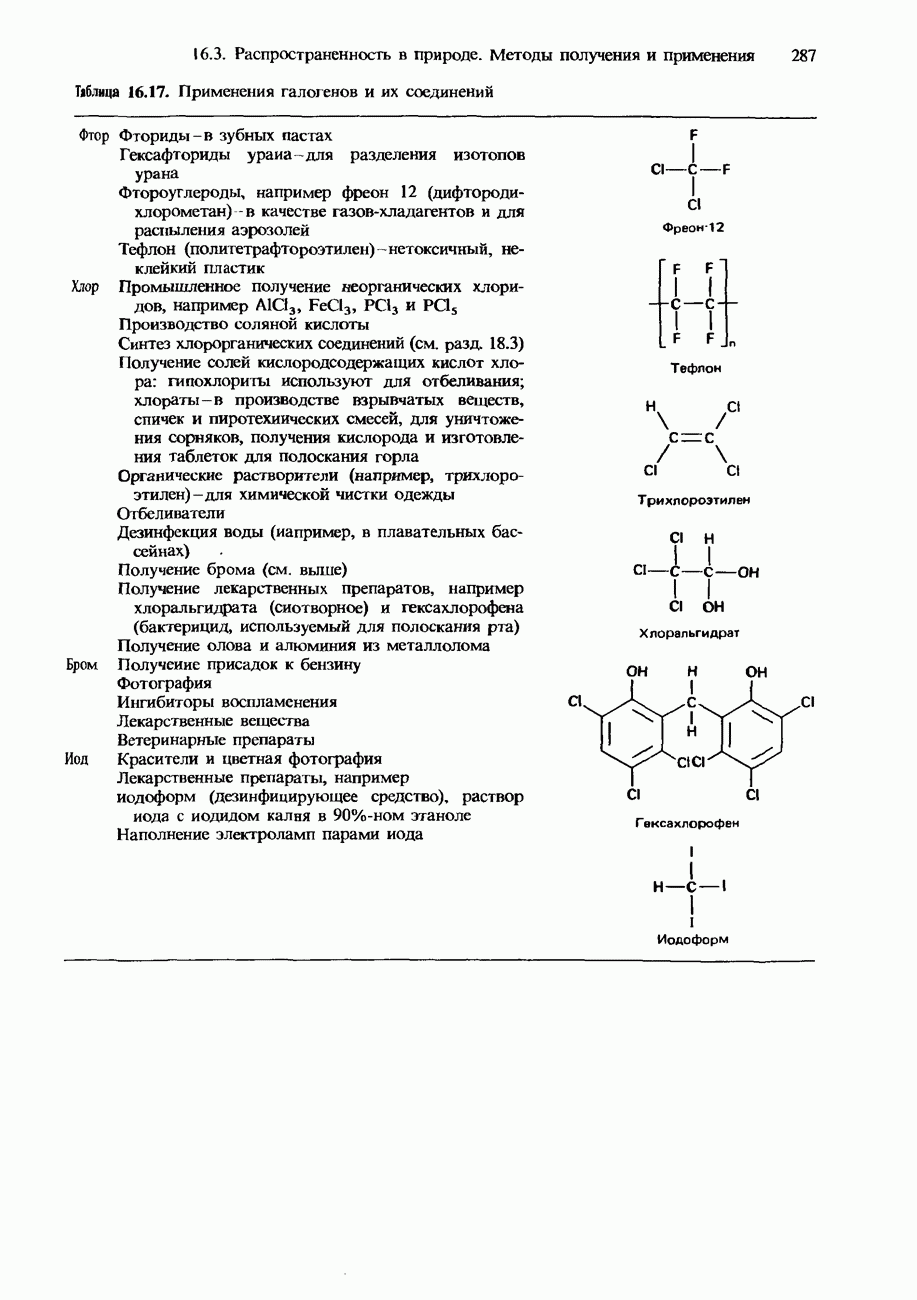
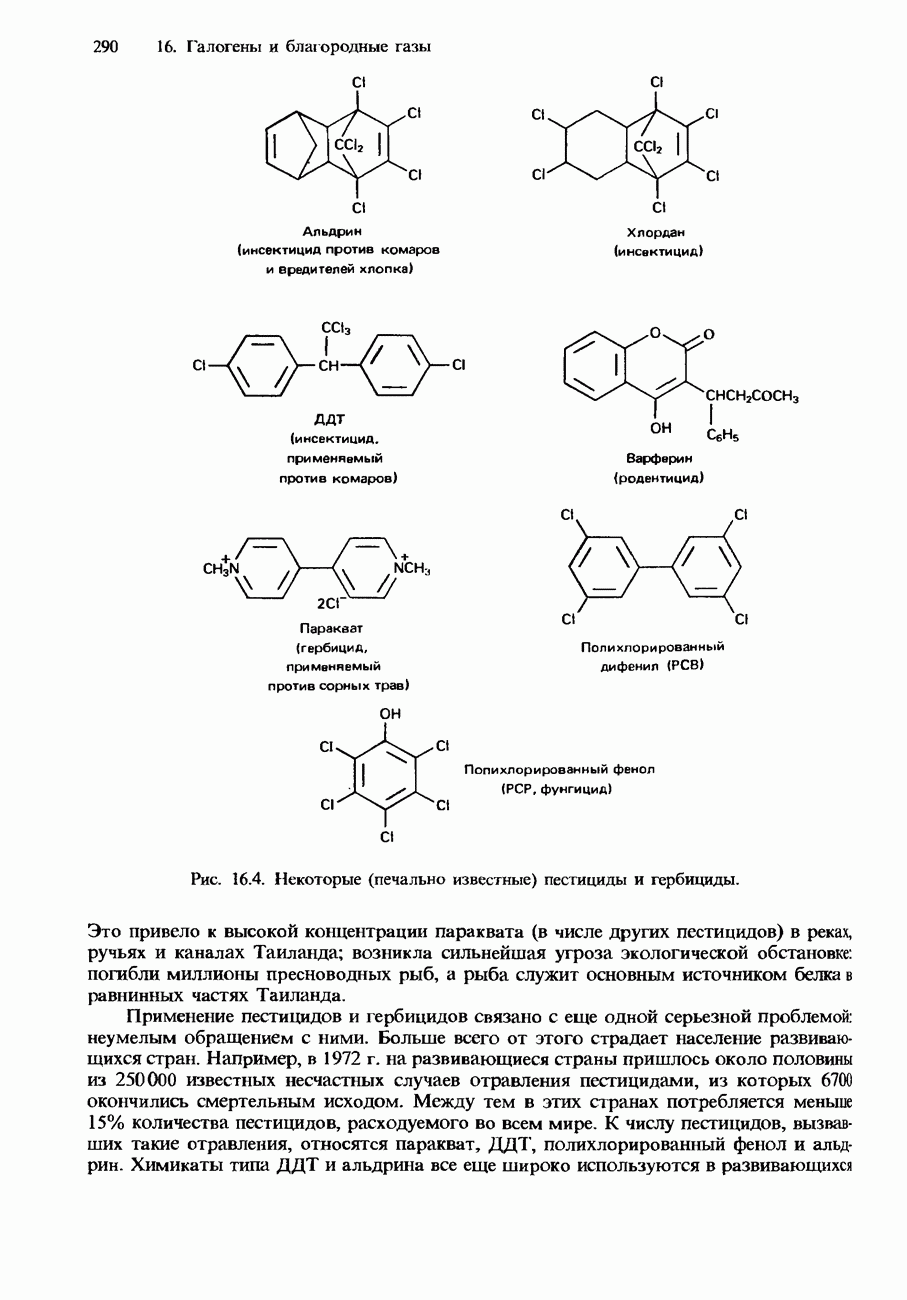
- ПРИМЕНЕНИЯ ГАЛОГЕНОВ И ИХ СОЕДИНЕНИЙ
- ТОКСИЧНОСТЬ ХЛОРСОДЕРЖАЩИХ ПРОДУКТОВ
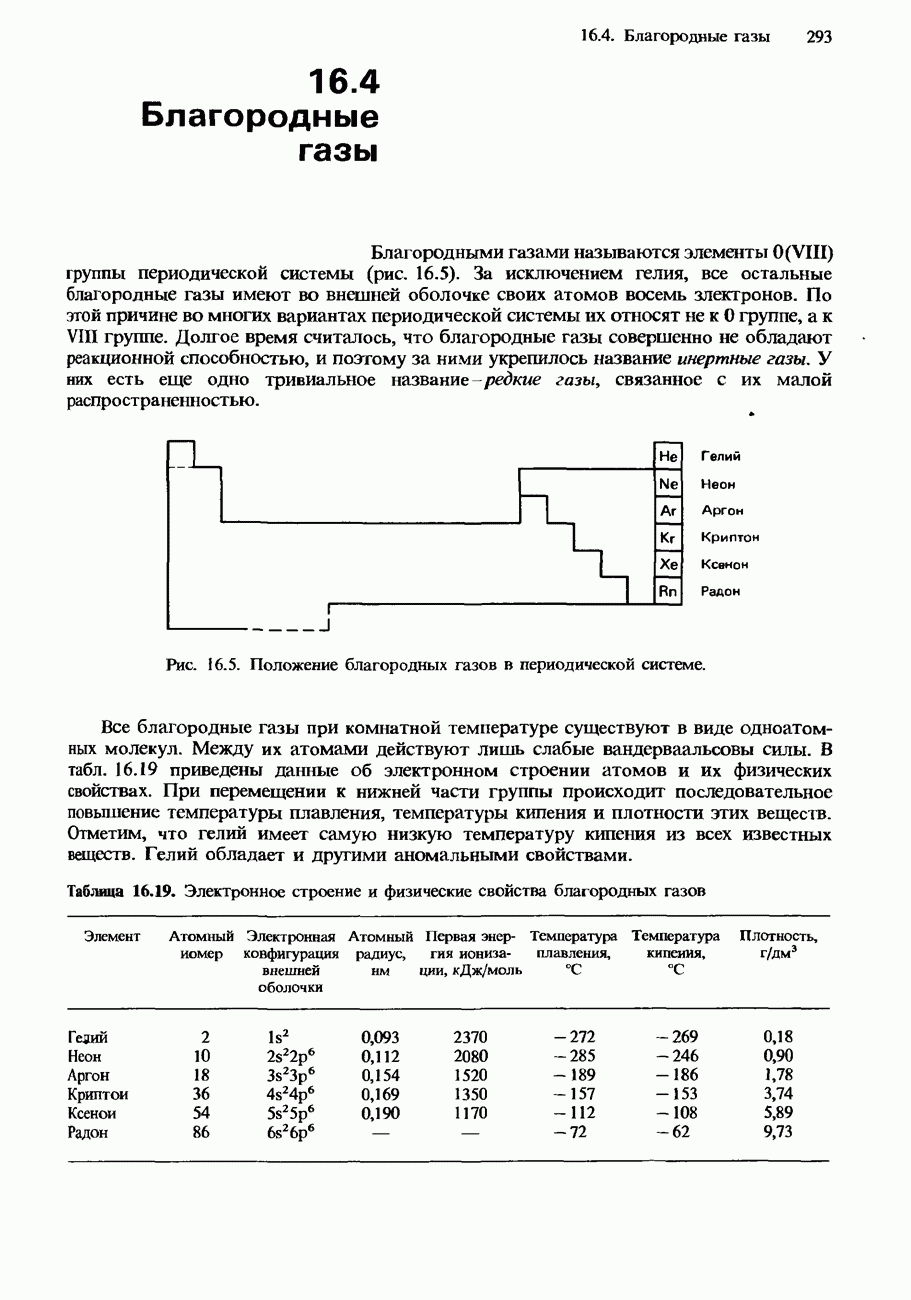
- 16.4. Благородные газы
- СОЕДИНЕНИЯ БЛАГОРОДНЫХ ГАЗОВ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 17. ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
- 7.1. Органическая химия
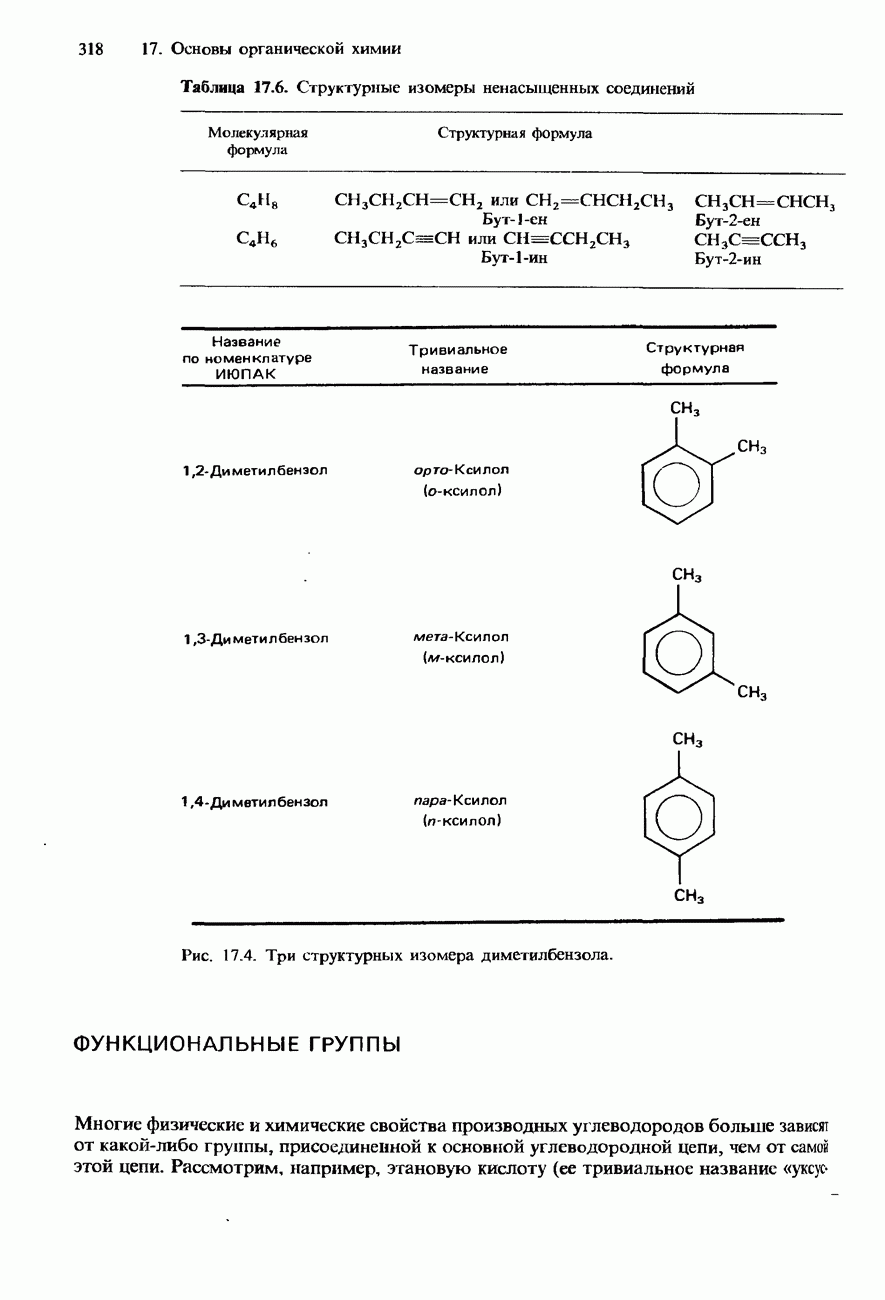
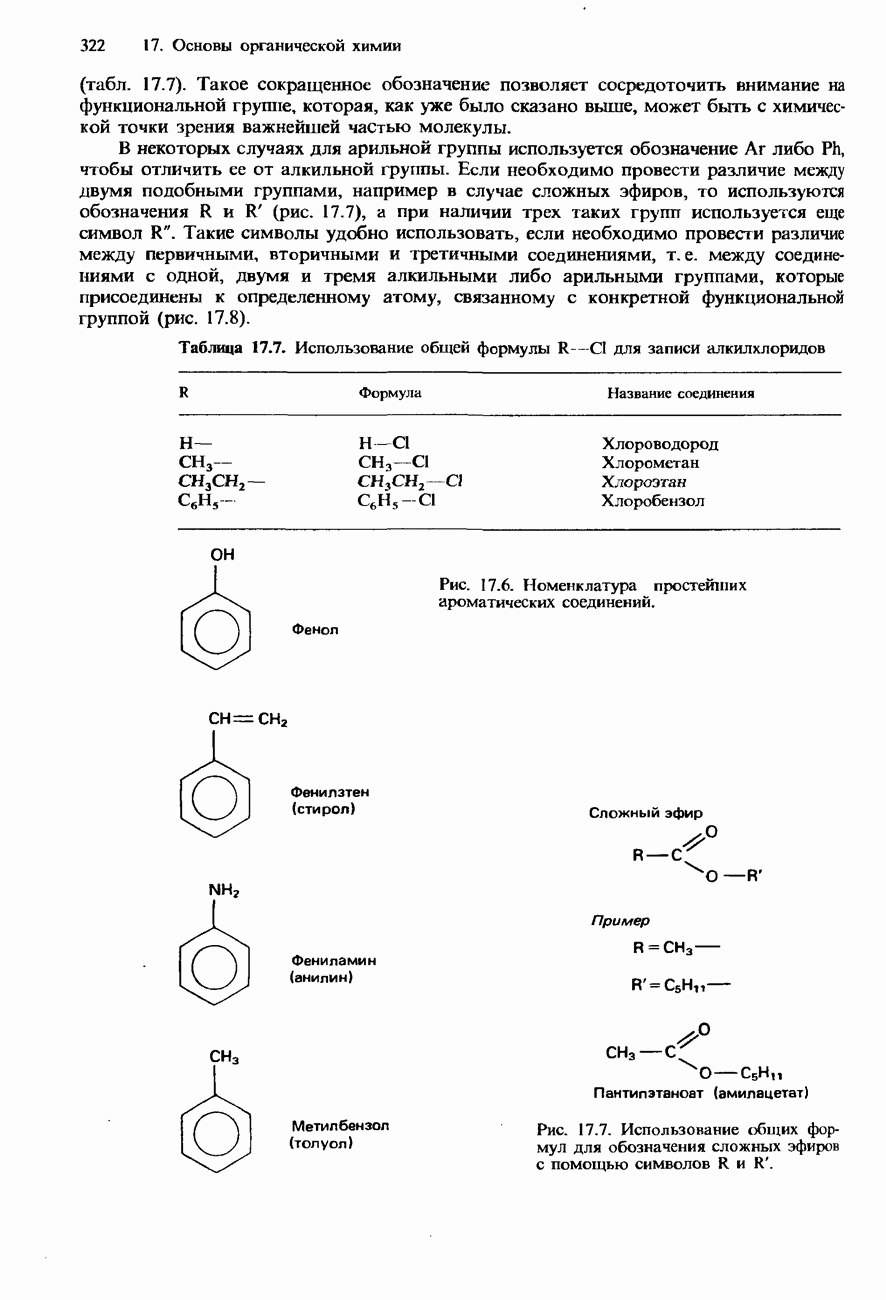
- НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
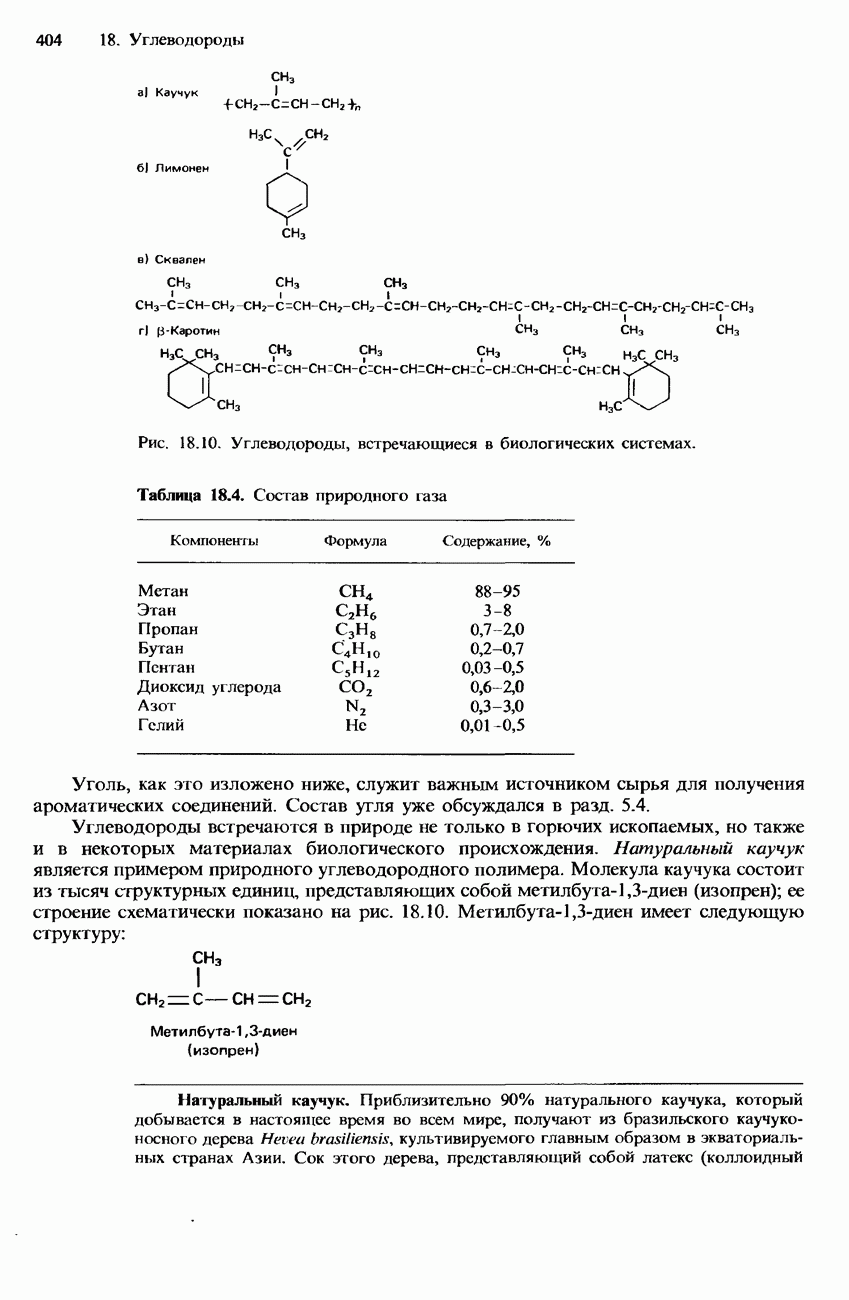
- УГЛЕВОДОРОДЫ
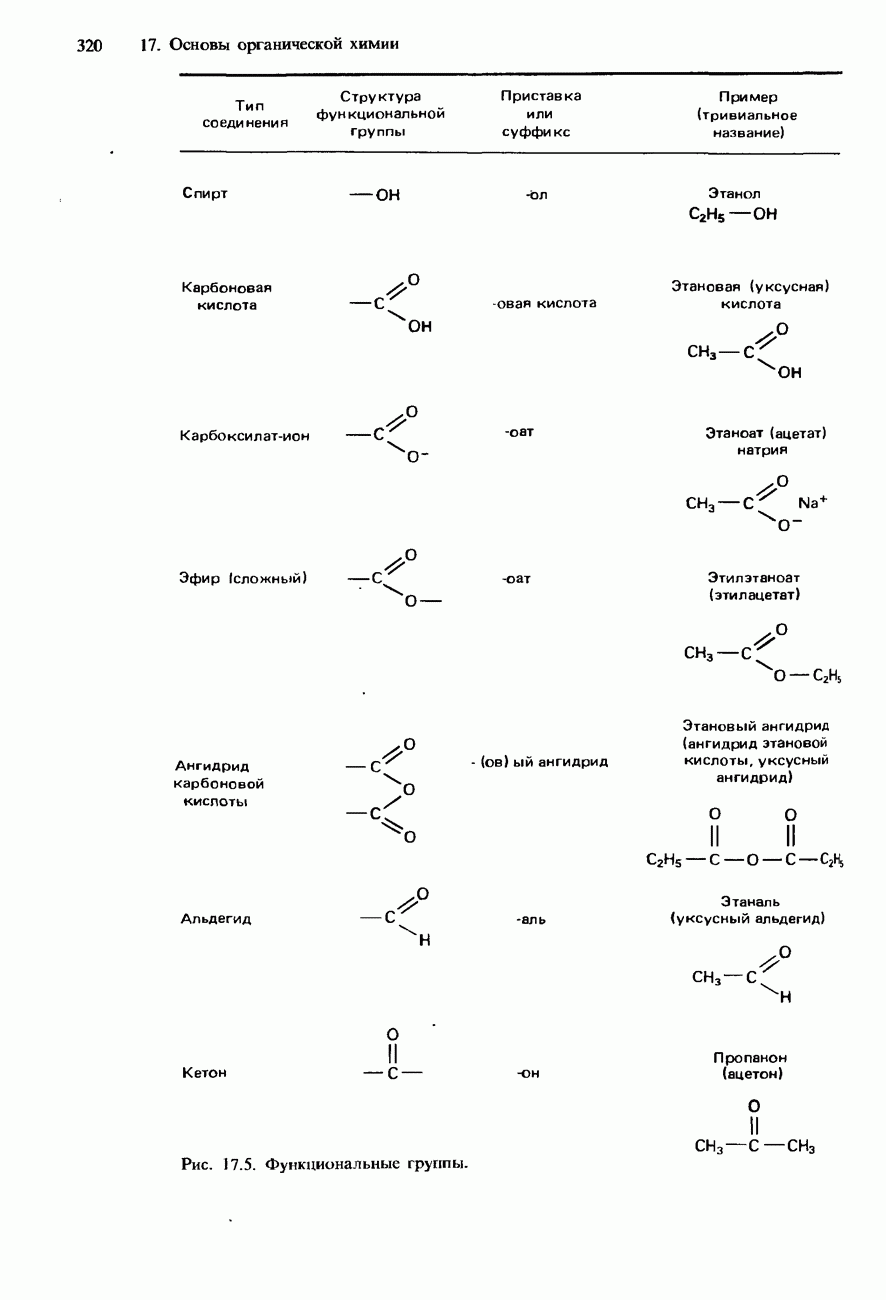
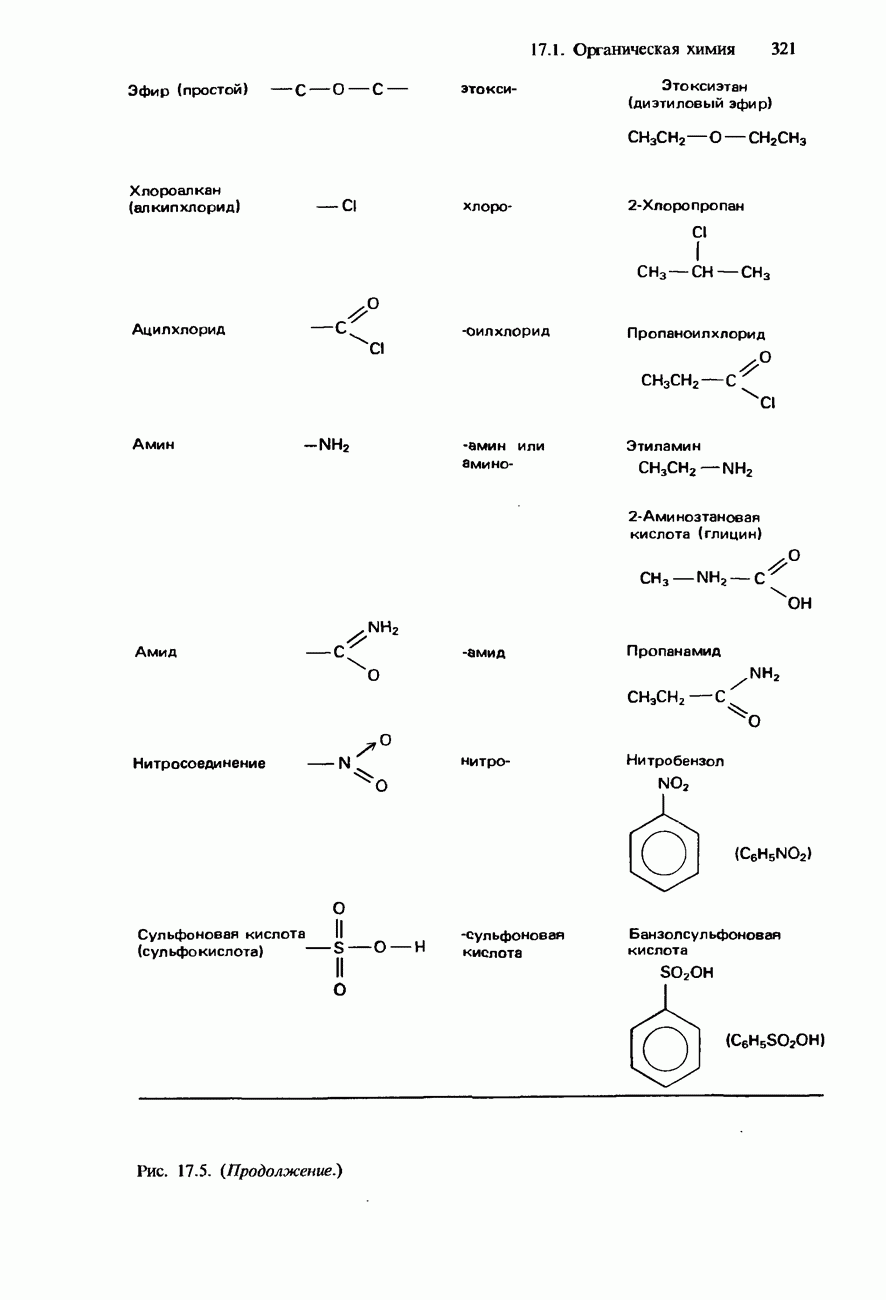
- ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
- ФИЗИЧЕСКИЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- ПОЛУЧЕНИЕ И ИДЕНТИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- 17.2. Молекулярная структура органических соединений
- КОНФОРМАЦИИ
- СТЕРЕОИЗОМЕРИЯ
- 17.3. Механизмы органических реакций
- ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- НУКЛЕОФИЛЫ И ЭЛЕКТРОФИЛЫ
- ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 18. УГЛЕВОДОРОДЫ
- 18.1. Алифатические углеводороды
- АЛКАНЫ
- АЛКЕНЫ
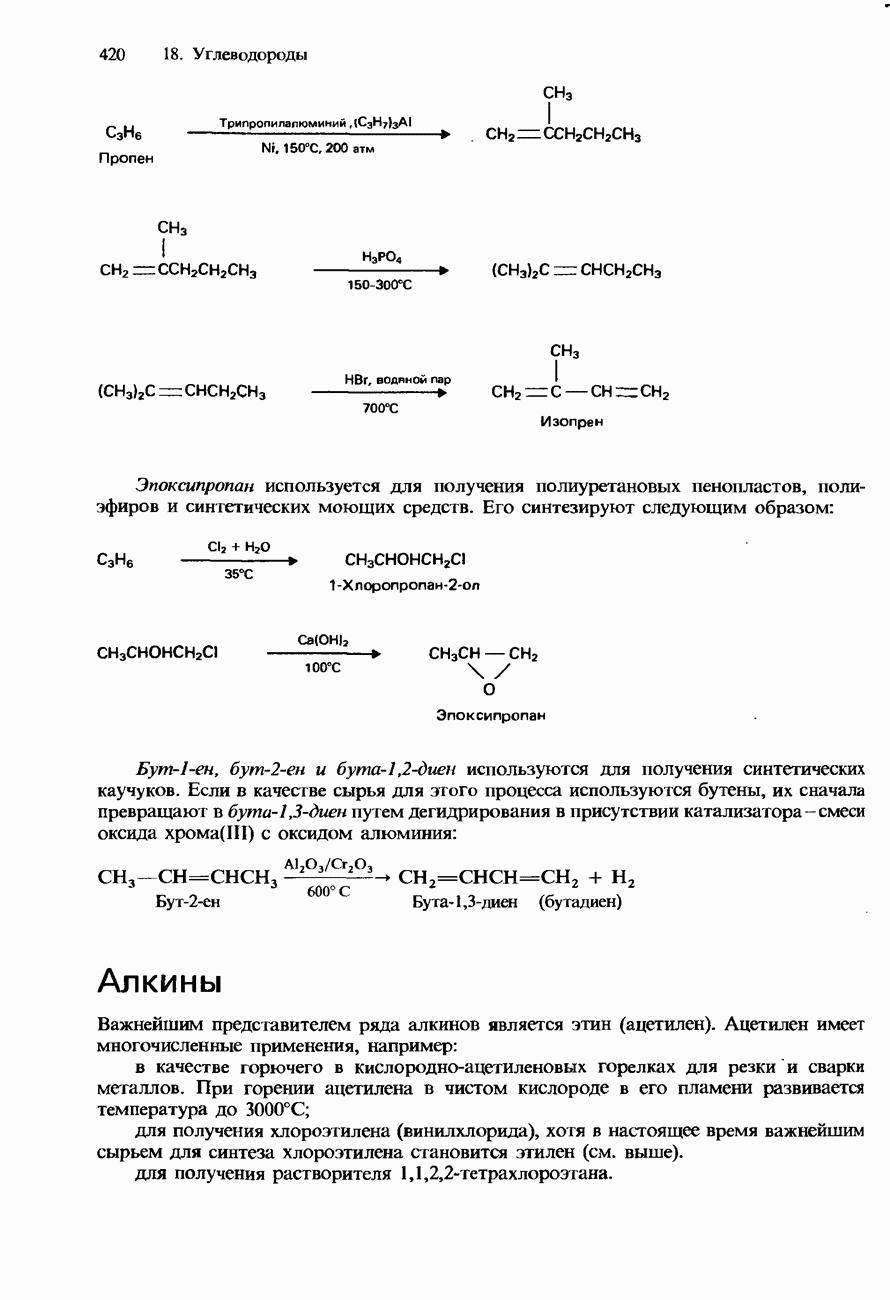
- АЛКИНЫ
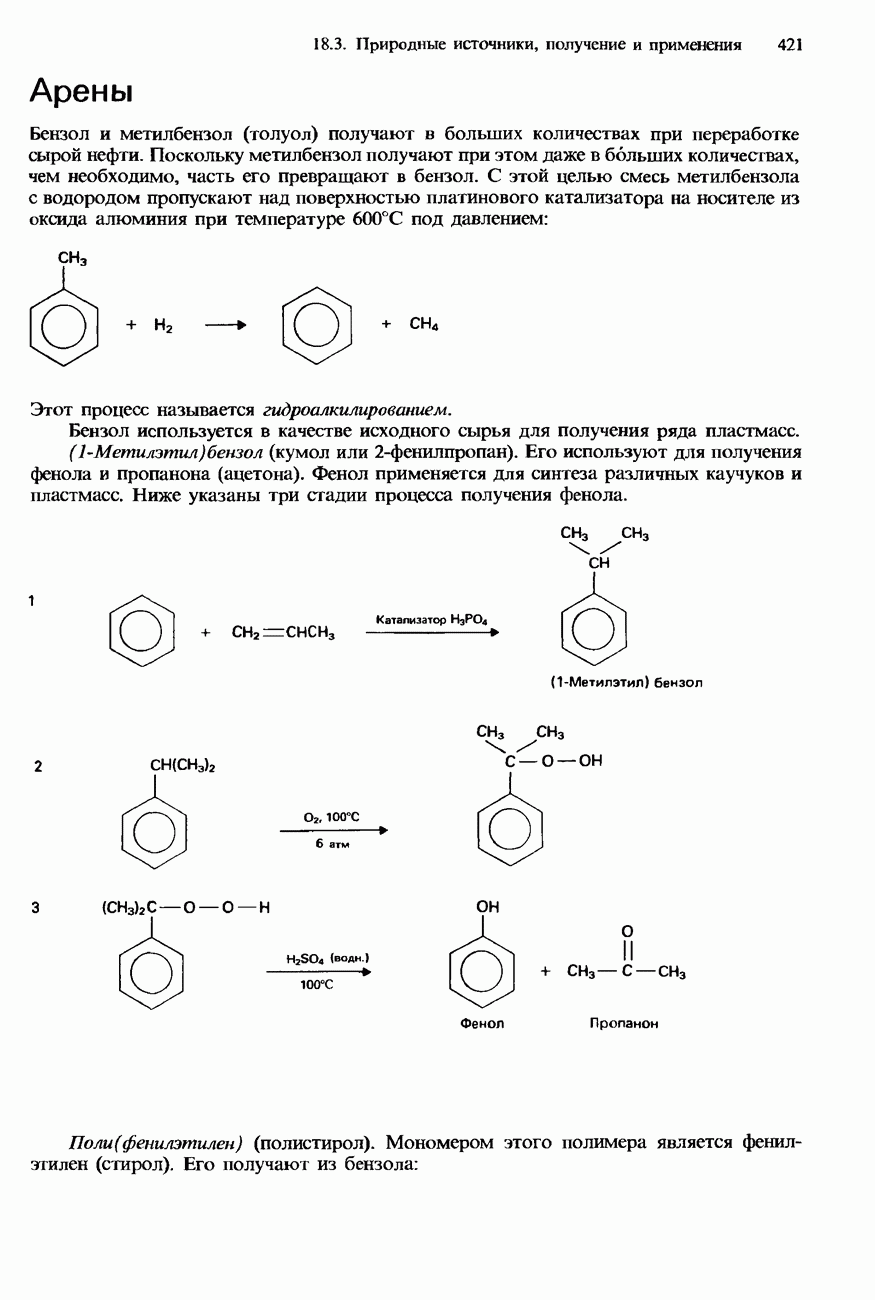
- 18.2. Арены
- БЕНЗОЛ
- МЕТИЛБЕНЗОЛ
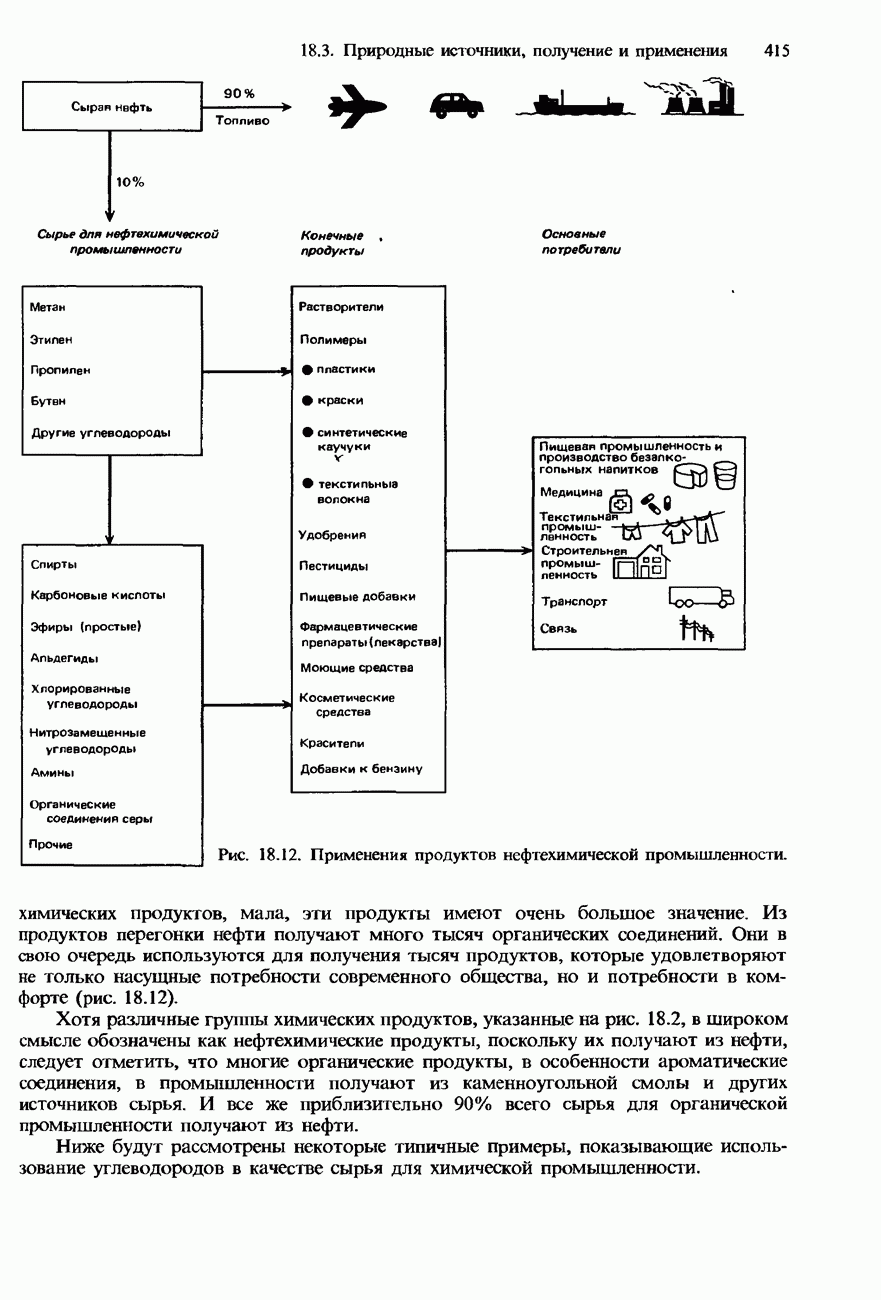
- 18.3. Природные источники, получение и применения
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ УГЛЕВОДОРОДОВ
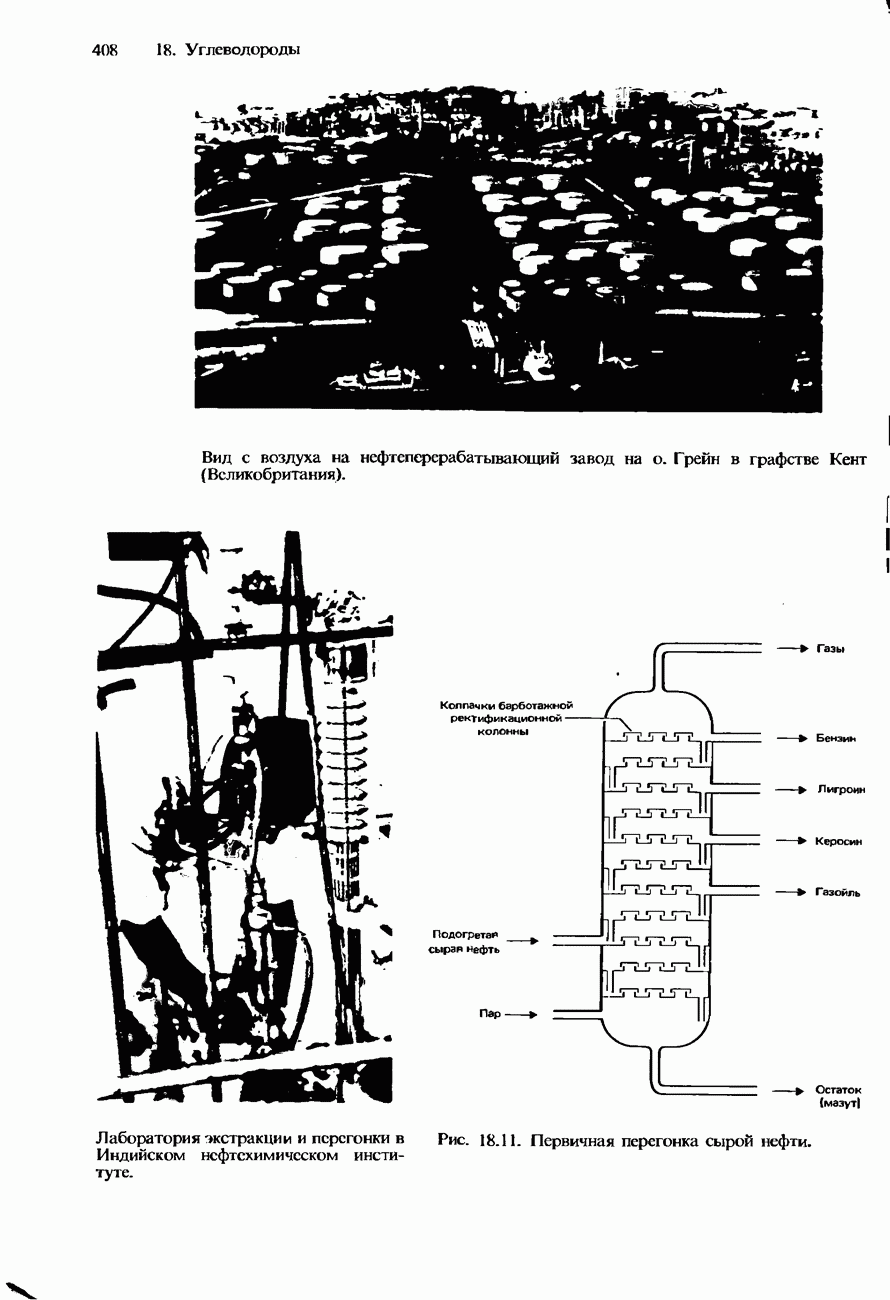
- ПЕРЕРАБОТКА НЕФТИ
- ПРИМЕНЕНИЯ УГЛЕВОДОРОДОВ
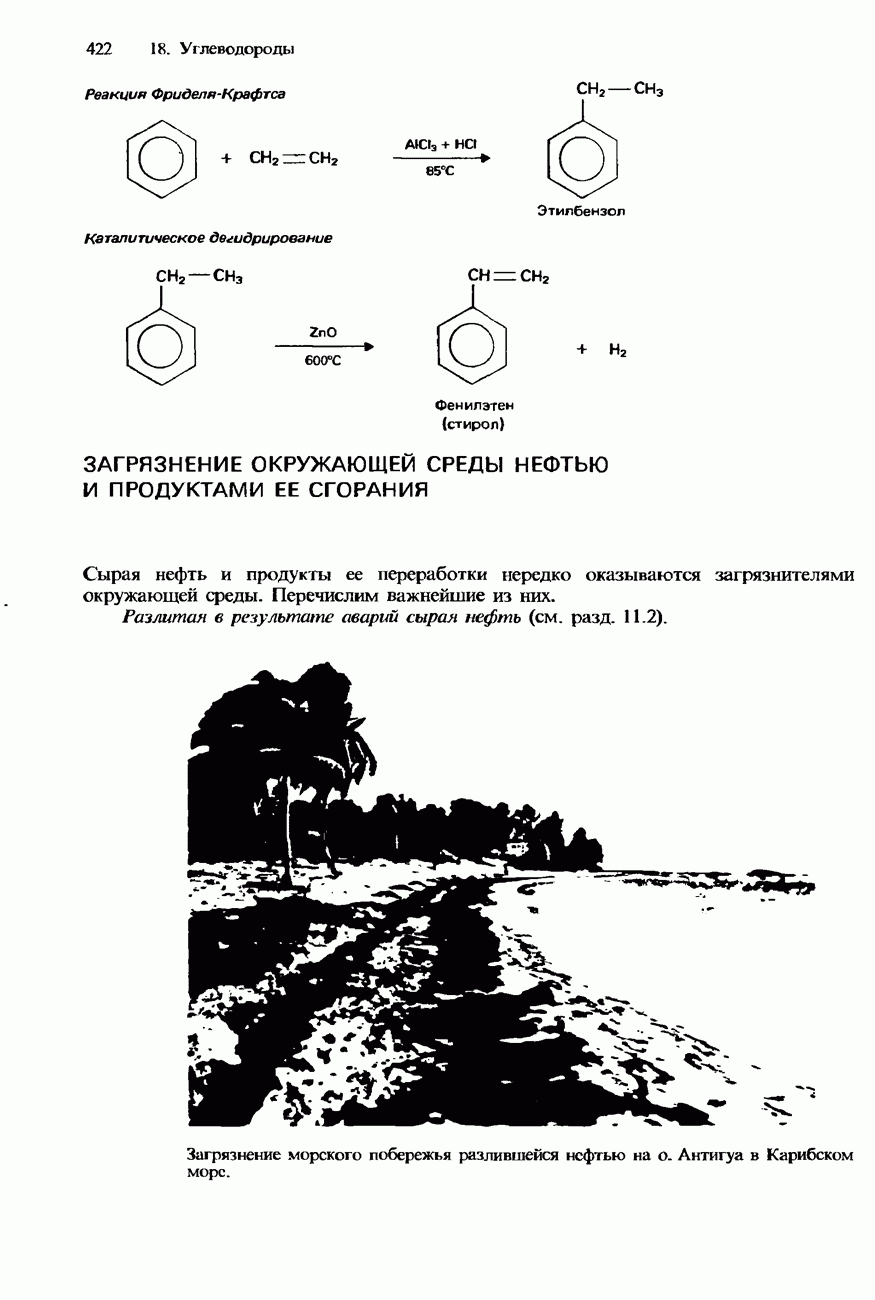
- ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ НЕФТЬЮ И ПРОДУКТАМИ ЕЕ СГОРАНИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 19. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
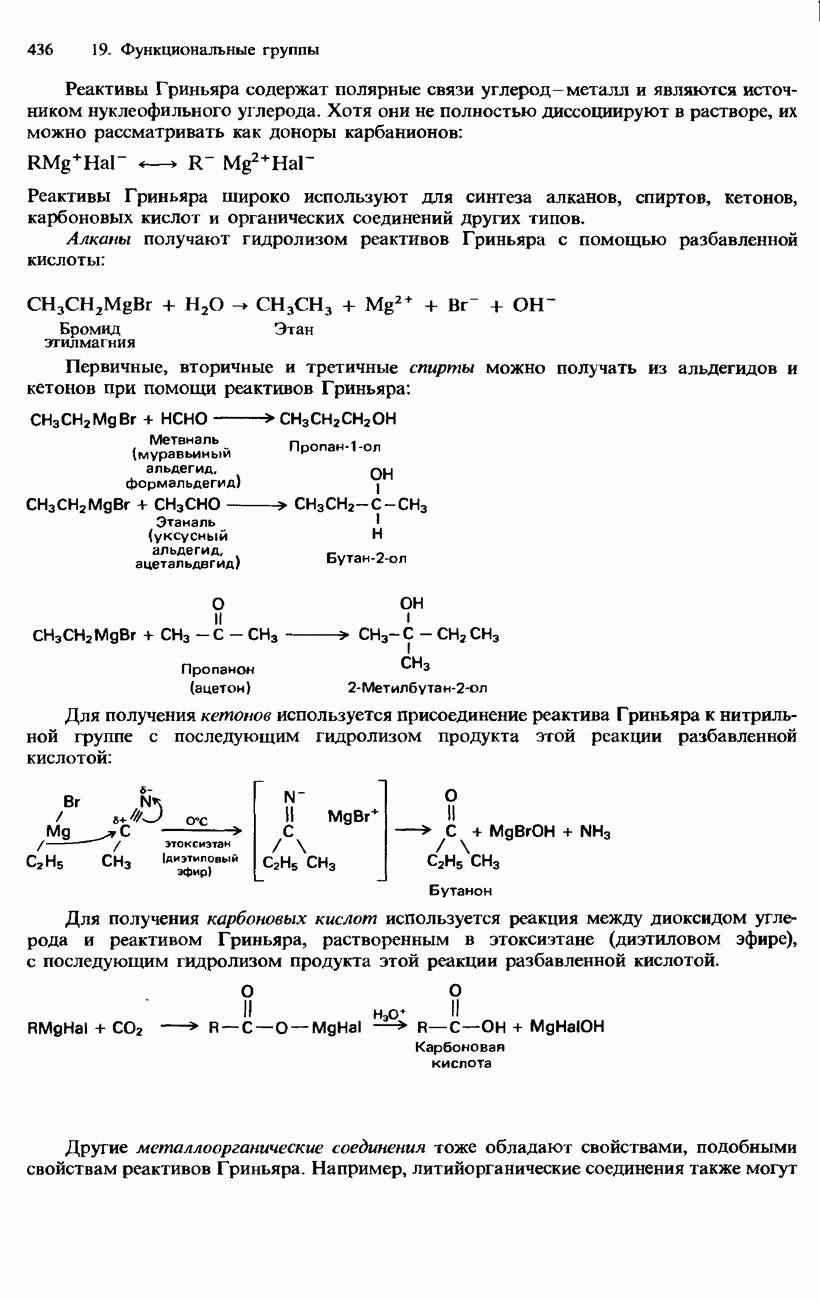
- 19.1. Органические галогенсодержащие соединения
- ГАЛОГЕНОАЛКЕНЫ
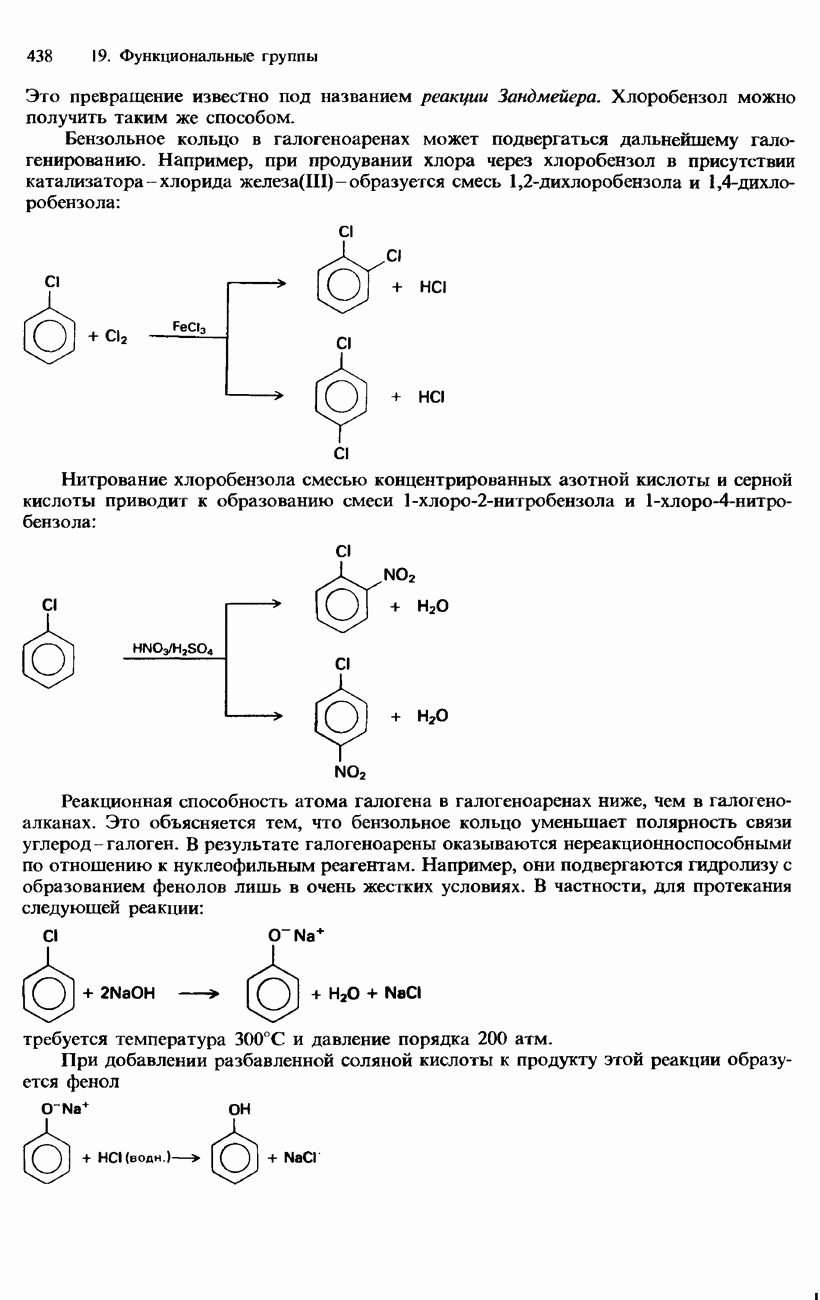
- ГАЛОГЕНОАРЕНЫ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ОРГАНИЧЕСКИХ ГАЛОГЕНСОДЕРЖАЩИХ СОЕДИНЕНИЙ
- 19.2. Спирты, фенолы и эфиры
- ФЕНОЛЫ
- ПРОСТЫЕ ЭФИРЫ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ СПИРТОВ, ФЕНОЛОВ И ПРОСТЫХ ЭФИРОВ
- 19.3. Карбонильная группа
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
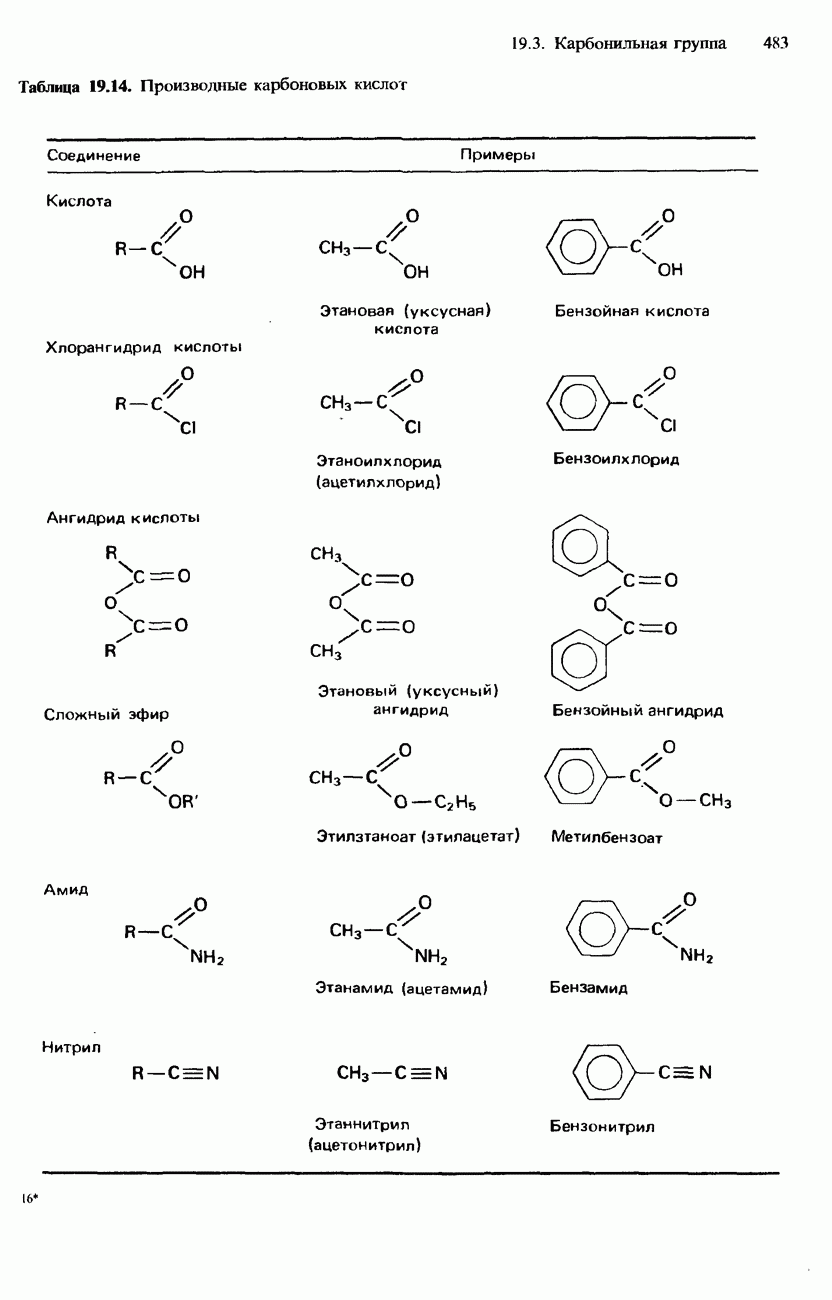
- КАРБОНОВЫЕ КИСЛОТЫ
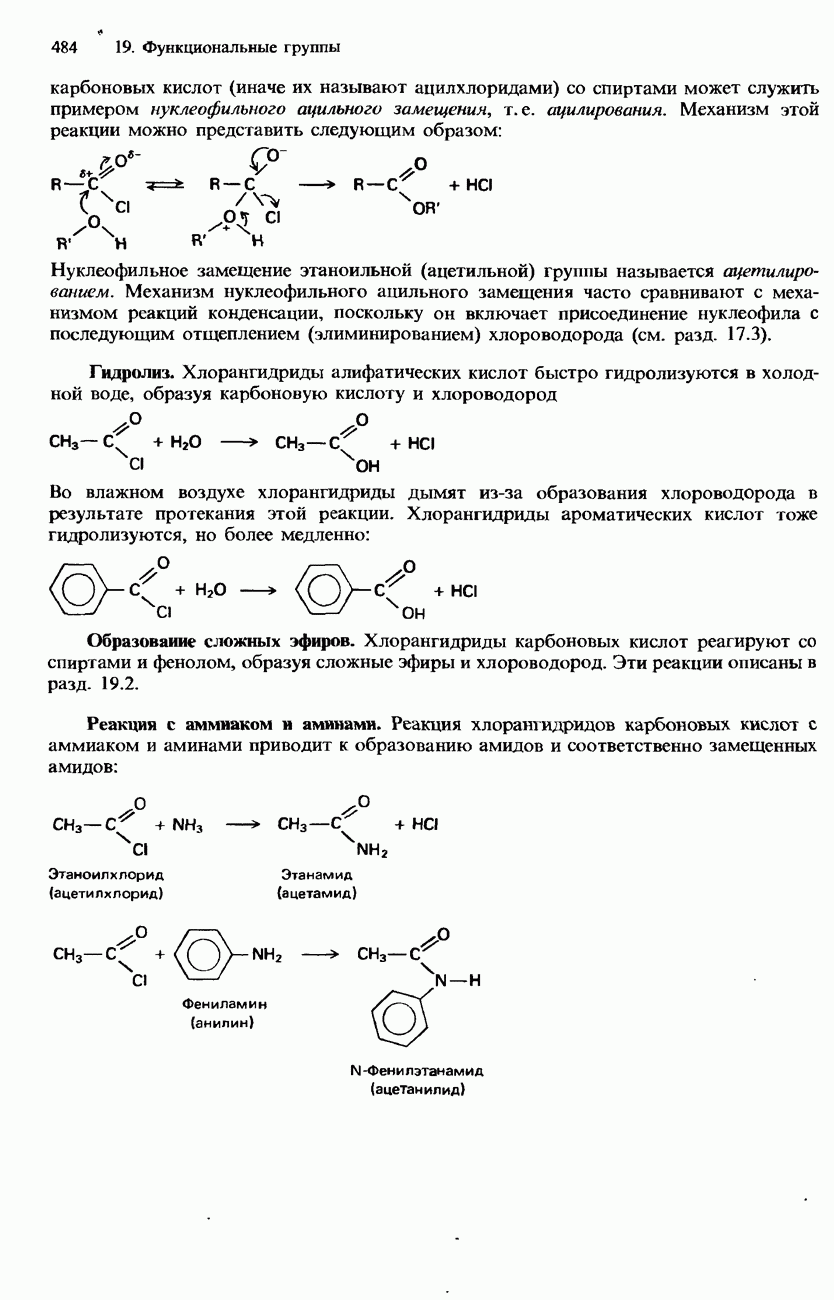
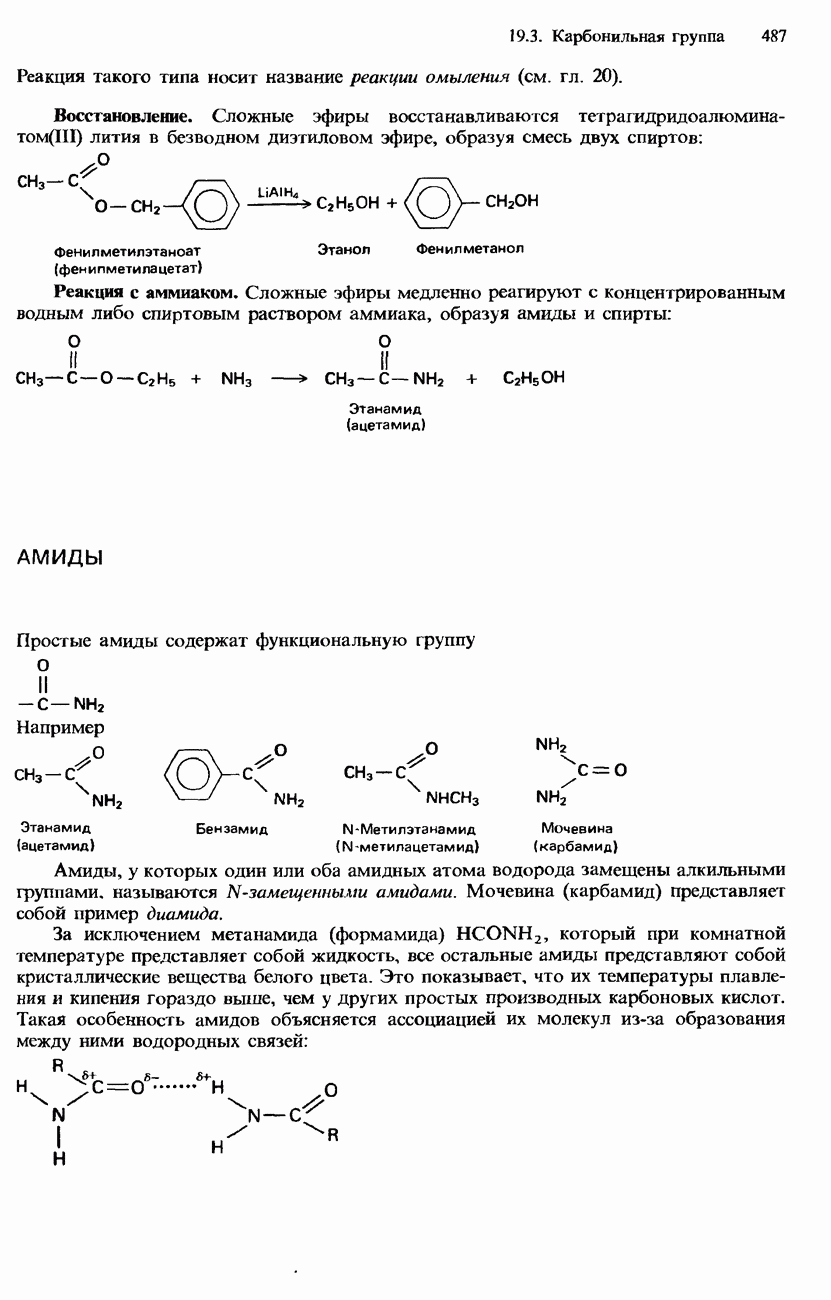
- ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ
- АМИДЫ
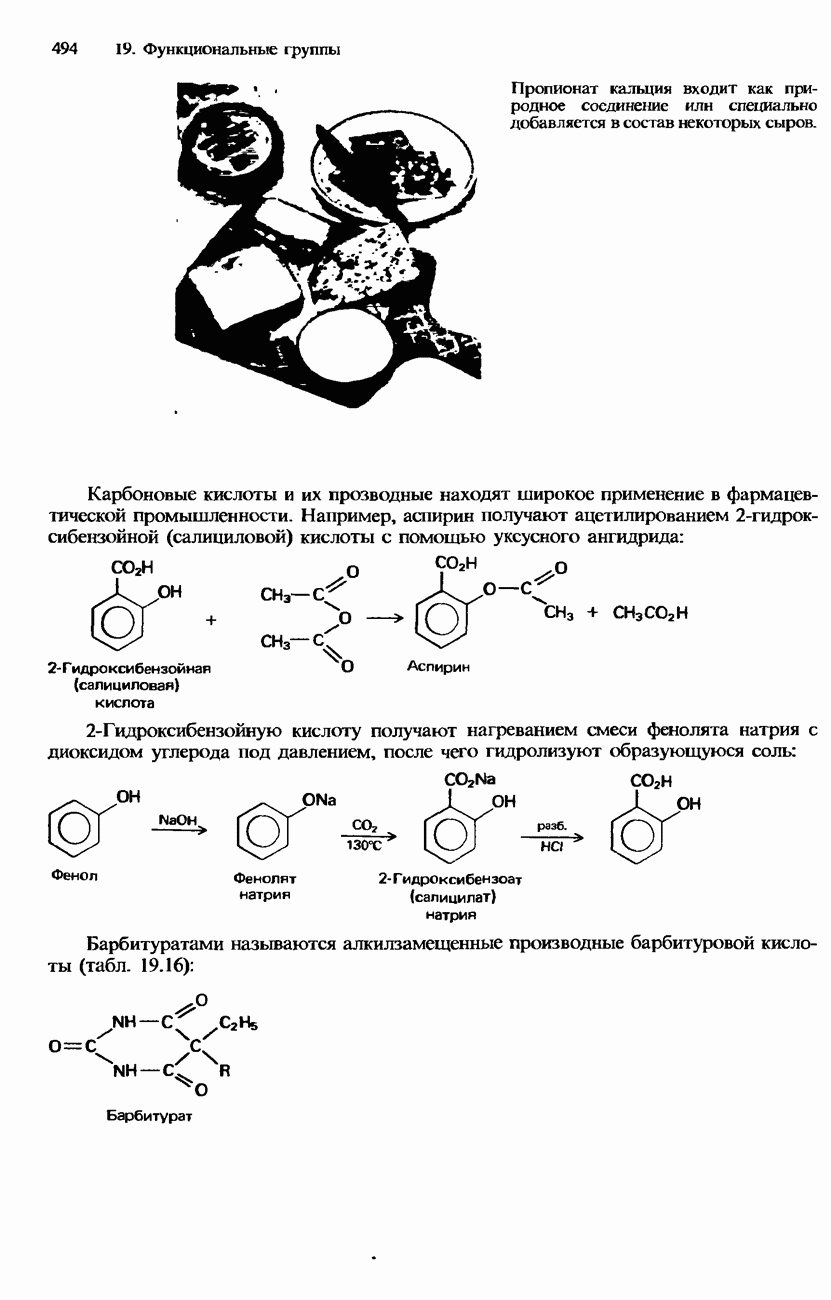
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ
- 19.4 Амины и родственные соединения
- СОЛИ ДИАЗОНИЯ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 20. ПРИРОДНЫЕ СОЕДИНЕНИЯ И ПОЛИМЕРЫ
- 20.1. Аминокислоты, пептиды и белки
- АМИНОКИСЛОТЫ
- ПЕПТИДЫ
- БЕЛКИ
- 20.2. Углеводы и нуклеиновые кислоты
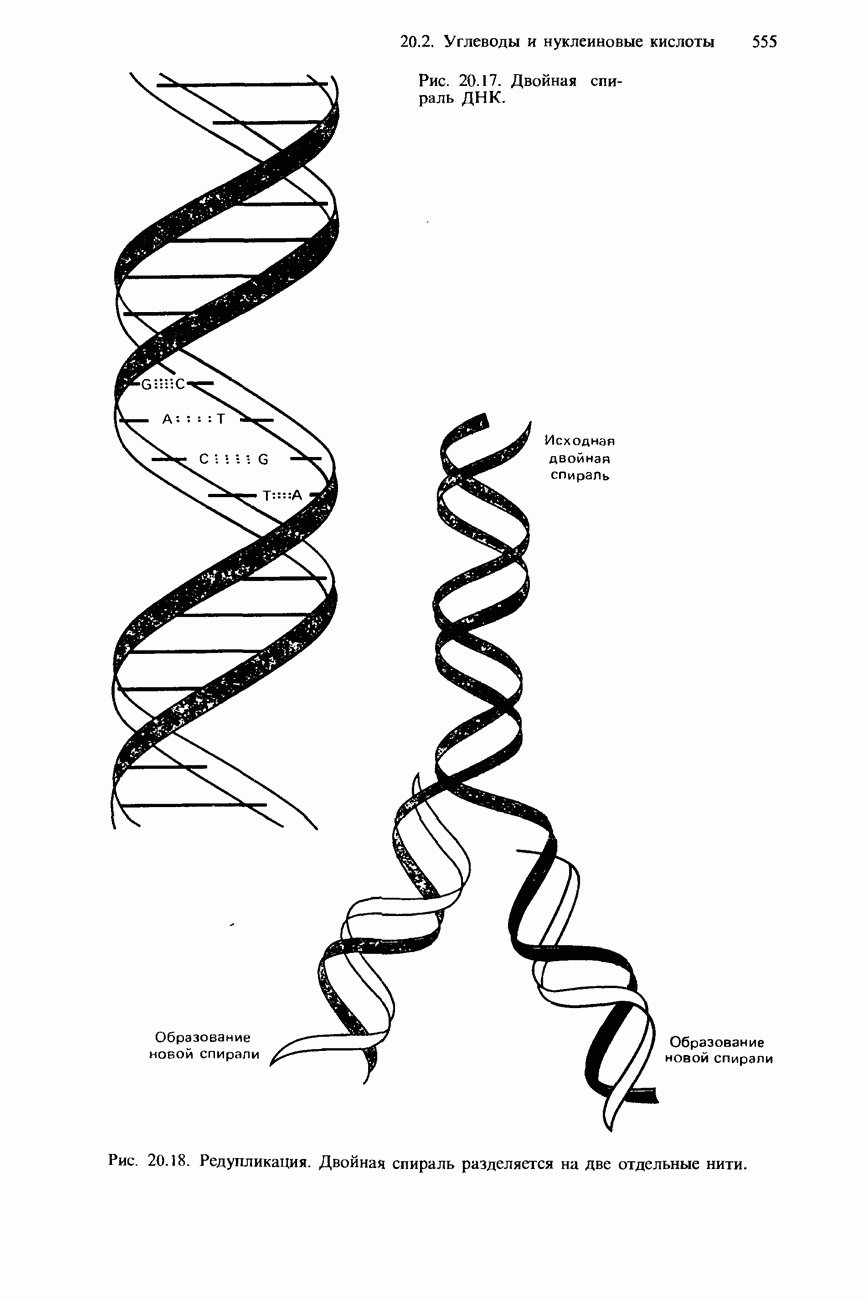
- НУКЛЕИНОВЫЕ КИСЛОТЫ
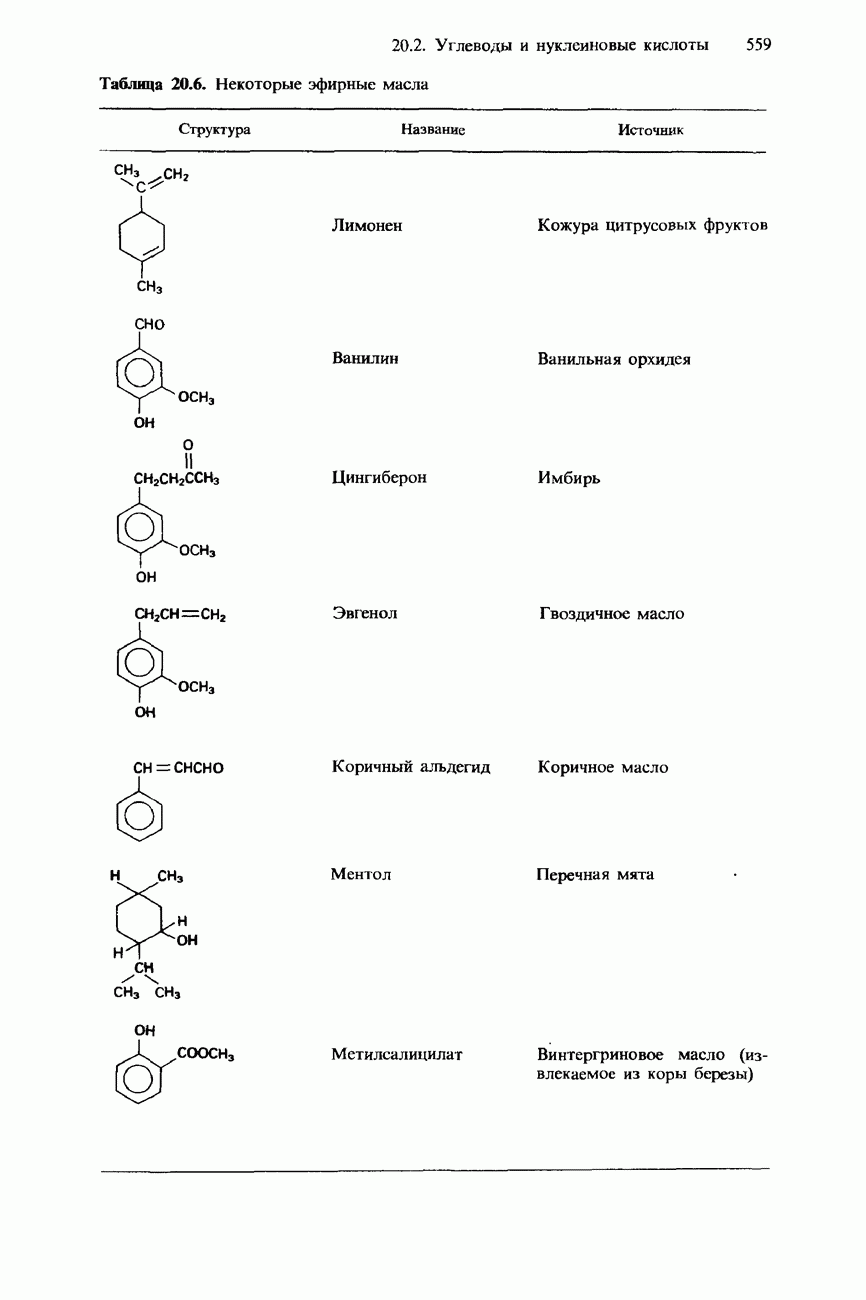
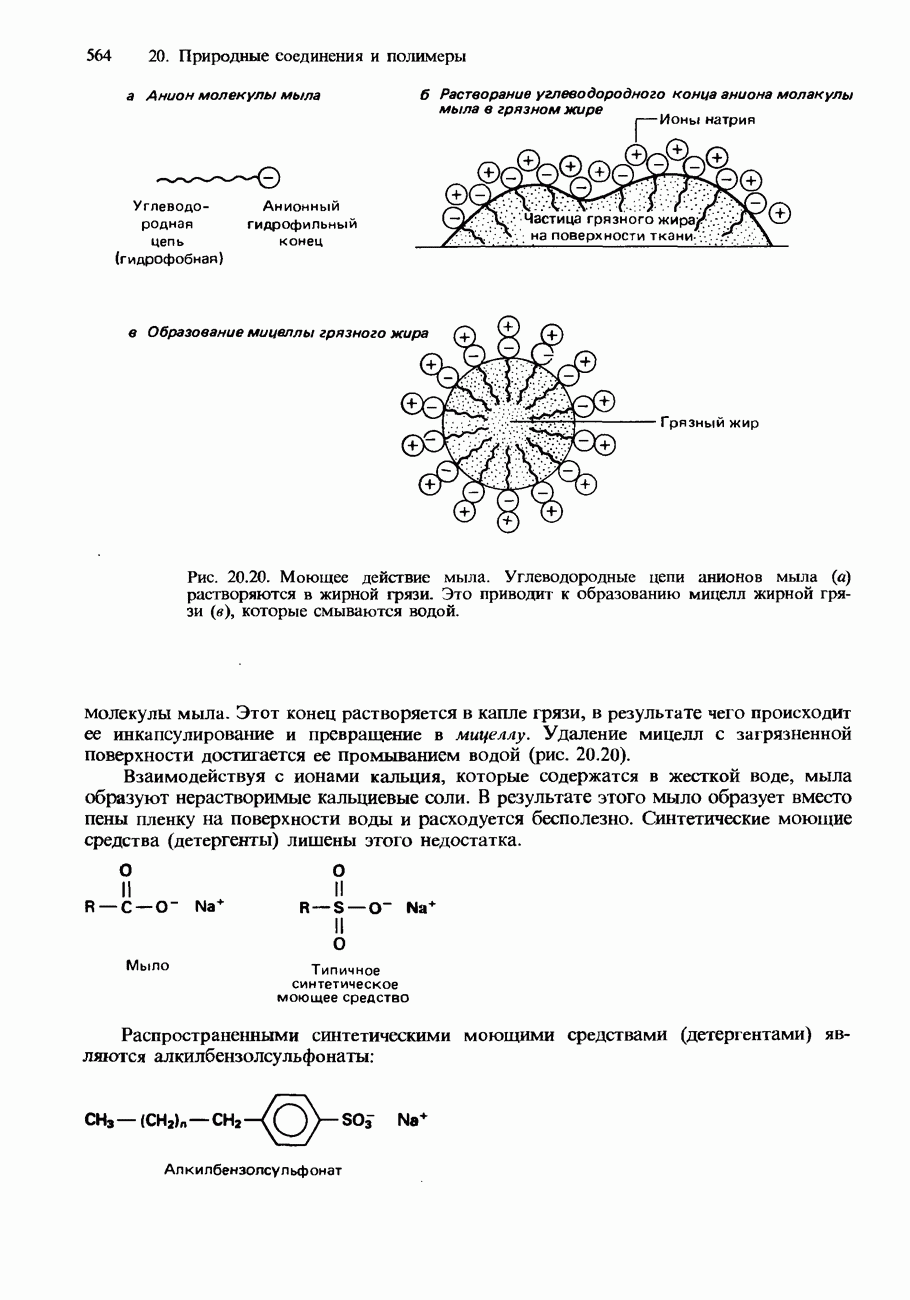
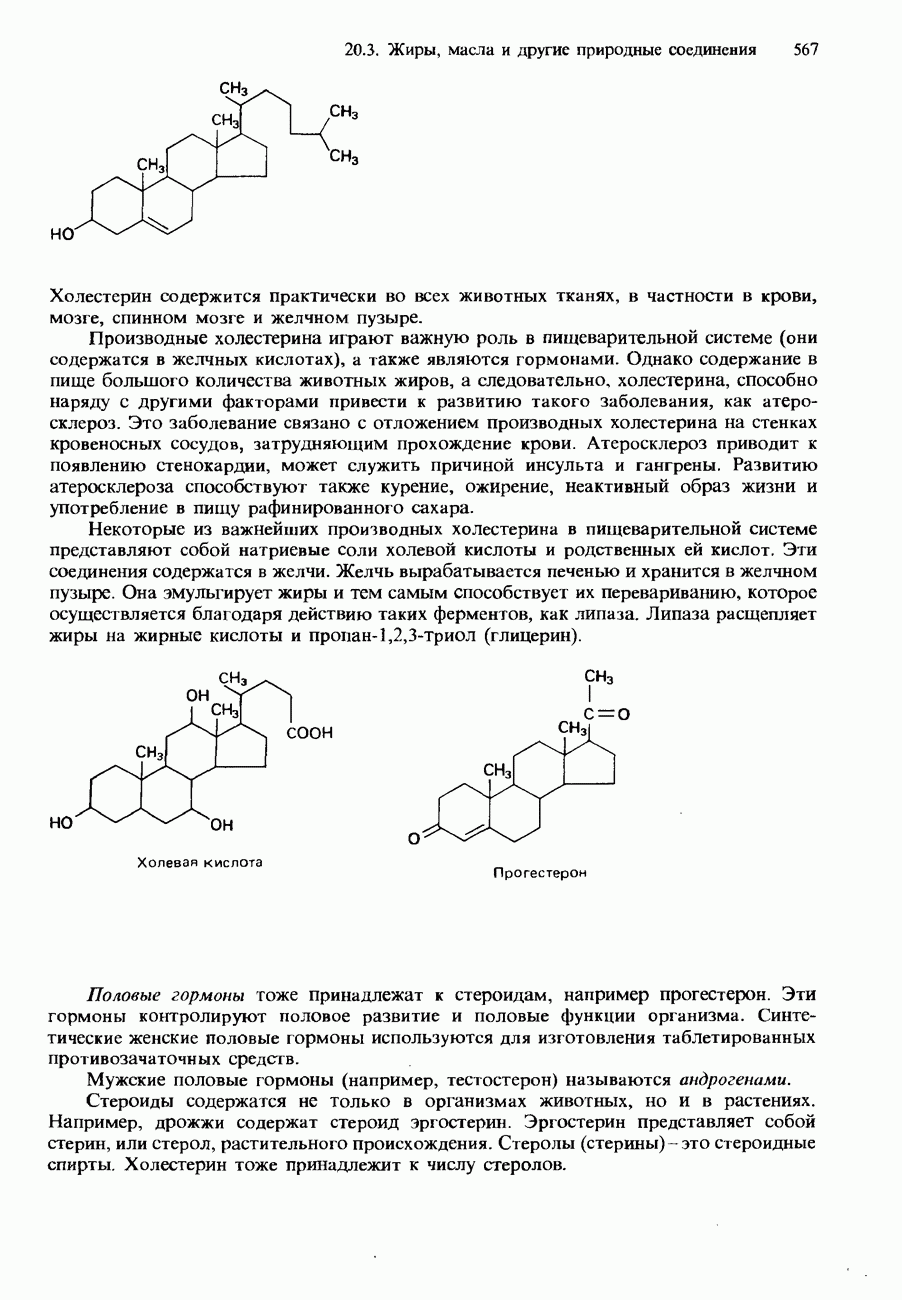
- 20.3. Жиры, масла и другие природные соединения
- ЖИРНЫЕ КИСЛОТЫ И ТРИГЛИЦЕРИДЫ
- ВОСКИ
- ФОСФОЛИПИДЫ И ГЛИКОЛИПИДЫ
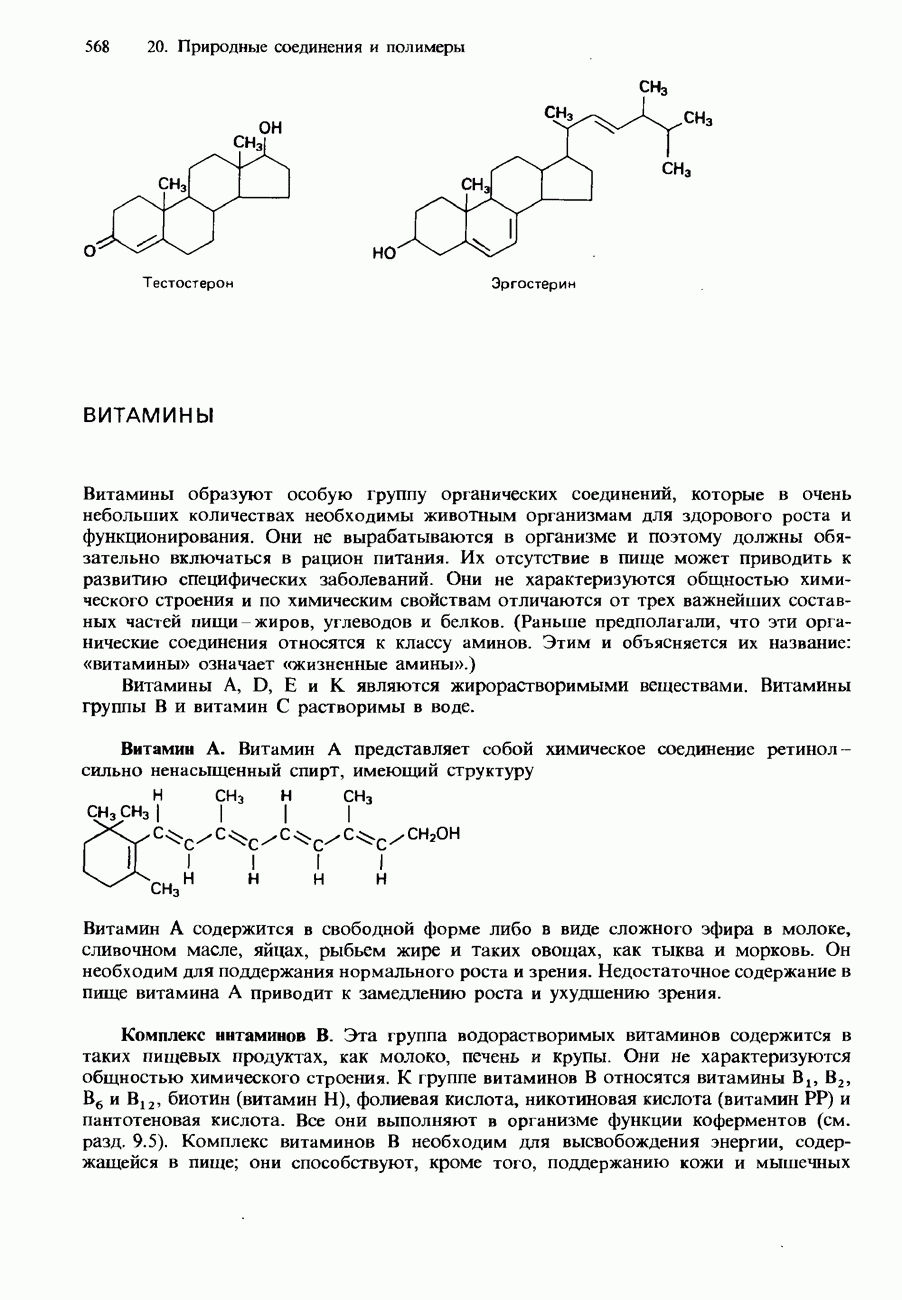
- ВИТАМИНЫ
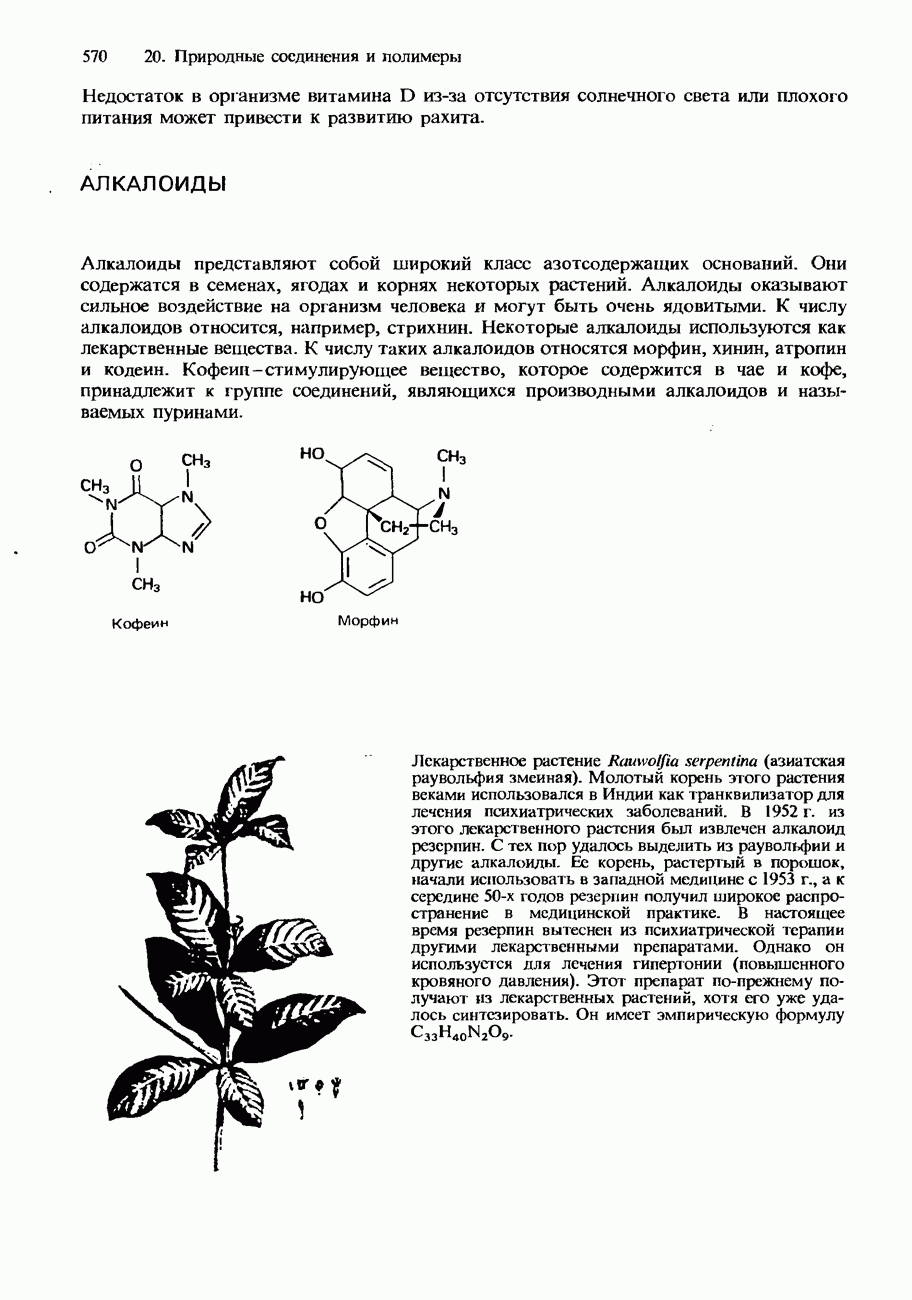
- АЛКАЛОИДЫ
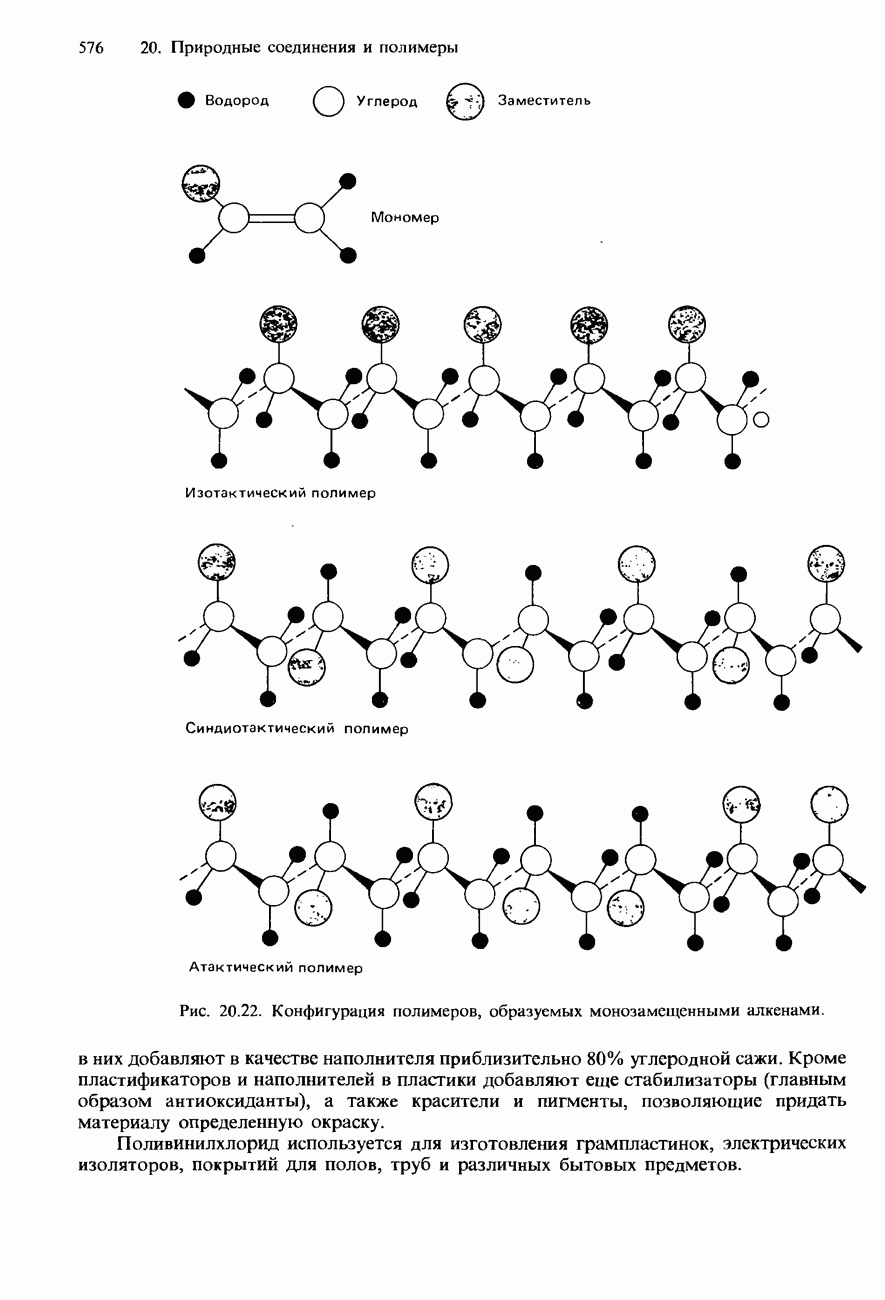
- 20.4. Полимеры
- ПОЛИМЕРИЗАЦИЯ
- НАТУРАЛЬНЫЕ И СИНТЕТИЧЕСКИЕ КАУЧУКИ
- ЦЕЛЛЮЛОЗНОЕ ВОЛОКНО
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- ПРИЛОЖЕНИЯ