| Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
Раздел I. ХИМИЯ АМИНОКИСЛОТ, ПЕПТИДОВ И БЕЛКОВ
АМИНОКИСЛОТЫ, ПЕПТИДЫ И ПРОСТЫЕ БЕЛКИ (ПРОТЕИНЫ)
Белки — высокомолекулярные органические соединения. Они играют огромную роль в жизнедеятельности клеток и тканей, являются важнейшей составной частью всего живого. «Повсюду, где мы встречаем жизнь, мы находим, что она связана с каким-либо белковым телом, и повсюду, где мы встречаем какое-либо белковое тело, не находящееся в процессе разложения, мы без исключения встречаем и явления жизни» (Маркс К., Энгельс Ф. Соч., т. 20, с. 83). С белками в живом организме связаны важнейшие функции: рост и развитие клеток, пищеварение, размножение, передача наследственных признаков, раздражимость, мышечные сокращения, образование антигенов и антител, обратимое связывание и перенос жизненно важных веществ и др. Биологические катализаторы — ферменты являются белковыми веществами.
Белки — основной материал, из которого строится структура живой, клетки.
В состав белков входят (в процентах): углерод (50,6- 54,5), кислород (21,5-23,5), азот (15,0-17,6, в среднем 16), водород (6,5-7,3), сера (0,3-2,5), фосфор (0,5-0,6).
Суммарное количество белков в тканях определяют, умножая общее содержание в них азота на коэффициент 6,25.
Все белковые вещества разделяют на две группы: простые (протеины) и сложные белки (протеиды). Простые белки при гидролизе распадаются только на аминокислоты. В состав сложных белков, кроме аминокислот, входят также вещества небелковой природы — нуклеиновые
кислоты, углеводы, липиды, пигменты, фосфорная кислота, металлы и т. д.
В построении молекул различных белков участвуют более 20 аминокислот, которые могут быть разделены на две большие группы: ациклические и циклические. В зависимости от числа аминогрупп и карбоксильных групп в молекуле ациклические аминокислоты делят на: а) моноамшюмонокарбоновые, содержащие по одной амино- и карбоксильной группе; б) моноаминодикарбоновыс, в состав молекулы которых входят одна амино- и две карбоксильные группы; в) диаминомонокарбоновые, для которых характерно наличие в молекуле двух аминогрупп и одной карбоксильной. Циклические аминокислоты разделяют на карбоциклические и гетероциклические. В группу циклических включают также и иминокислоты.
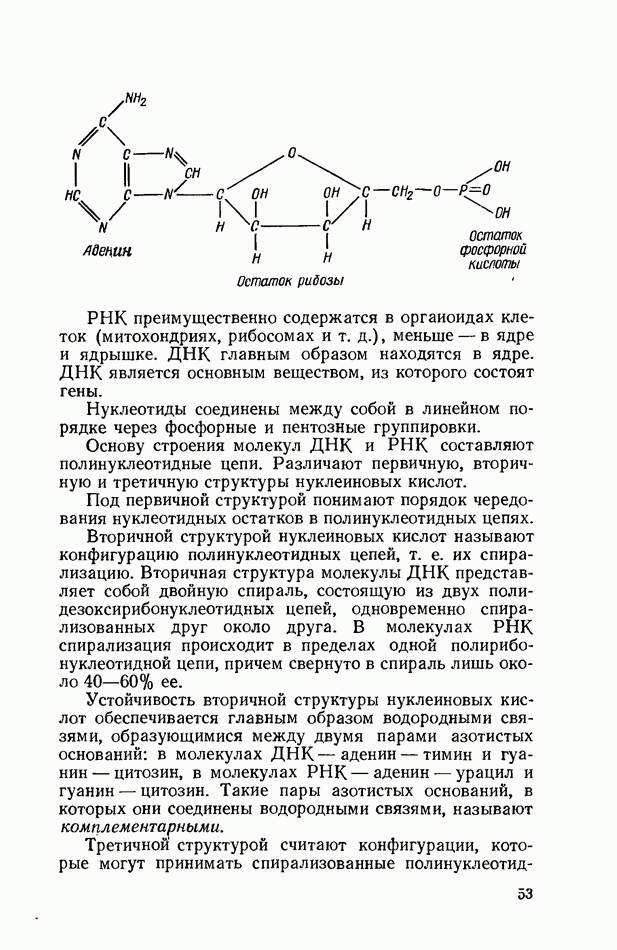
В белковой молекуле аминокислоты соединены между собой пептидными связями. При образовании пептидной связи карбоксильная группа одной аминокислоты взаимодействует с аминной группой другой, при этом выделяется молекула воды:

Изучение распределения электронов в пептидной связи показало, что здесь имеет место явление мезомерии, или резонанса. Поэтому пептидная связь не является строго ни двойной, ни простой, занимая промежуточное положение, и схематически может быть представлена так:

Это подтверждают также данные, характеризующие расстояние между атомами углерода и азота для разных типов связи. Для двойной связи оно составляет 1,28А, простой — 1,48А, тогда как для пептидной -1,32А.
Резонанс является фактором, повышающим устойчивость химических соединений, и его наличием объясняется прочность пептидной связи.
Соединение из двух аминокислот носит название дипептид (например, глицил-аланин), из трех — трипептид, из четырех — тетрапептид и т. п., а из многих аминокислот — полипептид.
В образовании пептидной связи у моноаминодикар-боновых и диаминомонокарбоновых кислот принимают участие только аминогруппы и карбоксильные группы, связанные с а-углеродным атомом.
В пространственной конфигурации белковой молекулы имеют место различные типы связей. Чаще всего это водородные связи, но большую роль играют также дисульфидные, эфирные (ортофосфатные, пирофосфатные), фосфоамидные, ионные и др.
Аминокислоты и белки обладают амфотерным характером. При диссоциации как свободных аминогрупп, так и свободных карбоксильных групп они приобретают заряды: в кислой среде — положительный, в щелочной — отрицательный.
Регулируя pH среды, можно достигнуть такого состояния, когда диссоциация аминогрупп и карбоксильных групп будет одинаковой, т. е. уравняется количество положительных и отрицательных зарядов, следовательно, общий заряд частицы окажется равным нулю. Значение pH, при котором сумма положительных зарядов равна сумме отрицательных зарядов белковой частицы, называется изоэлектрической точкой. В изоэлектрической точке растворы белка весьма неустойчивы, белок из них легко выпадает в осадок. Значение изоэлектрической точки характерно для каждого белка и зависит от аминокислотного состава. Таким образом, меняя концентрацию водородных ионов, можно изменить заряд белковых частиц.
Белки отличаются различной растворимостью.
При растворении белков в воде происходит гидратация их молекул. Вокруг каждой из них образуется водная оболочка (гидросфера). Наличие оболочек, состоящих из ориентированных в пространстве молекул воды, является наряду с зарядом белковых частиц фактором устойчивости белковых растворов. Под действием факторов, уменьшающих гидратацию белковых частиц (например, водоотнимающих средств) и нейтрализующих их заряд, растворимость
белков понижается и они могут выпасть в осадок.
Качественные реакции на аминокислоты, пептиды и белки можно разделить на две группы: а) цветные реакции, обусловленные аминокислотами и пептидами; б) реакции осаждения, в основе которых лежат изменения физико-химических свойств белковых молекул.
| Следующий параграф >> |
- Раздел I. ХИМИЯ АМИНОКИСЛОТ, ПЕПТИДОВ И БЕЛКОВ
- Приготовление растворов белка
- Цветные реакции
- Исследование физико-химических свойств белковых веществ
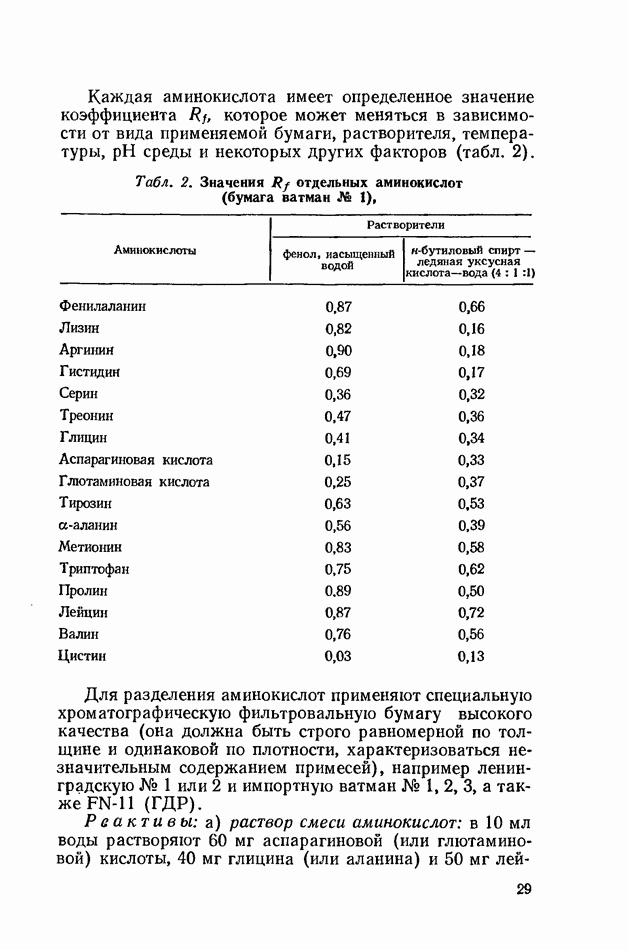
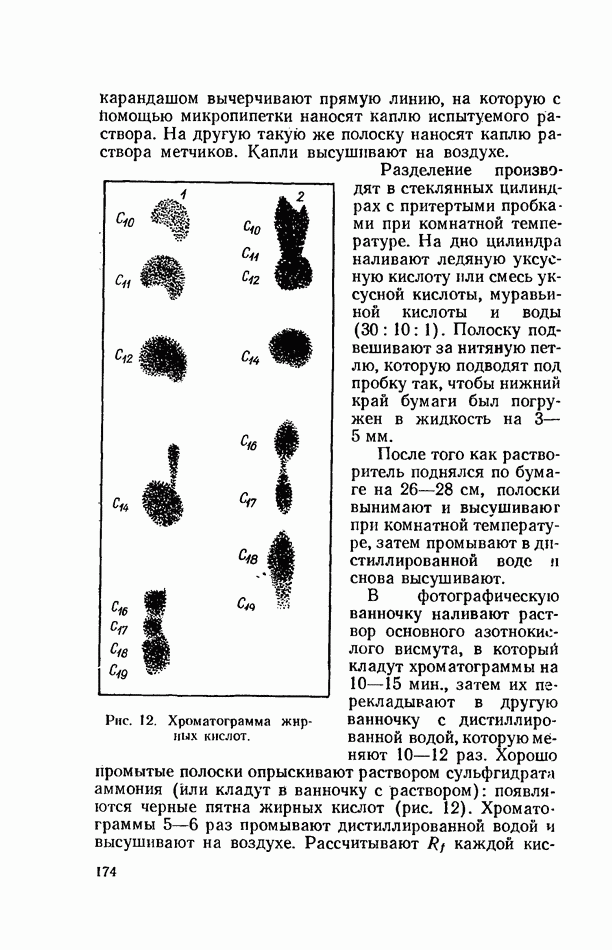
- Распределительная хроматография аминокислот на бумаге
- Разделение белка и низкомолекулярных примесей методом гельфильтрации на сефадексе G 25 (по Р. Мардашеву, А. А. Покровскому, Н. А. Павловой, с дополнениями)
- Электрофорез белков и аминокислот на бумаге
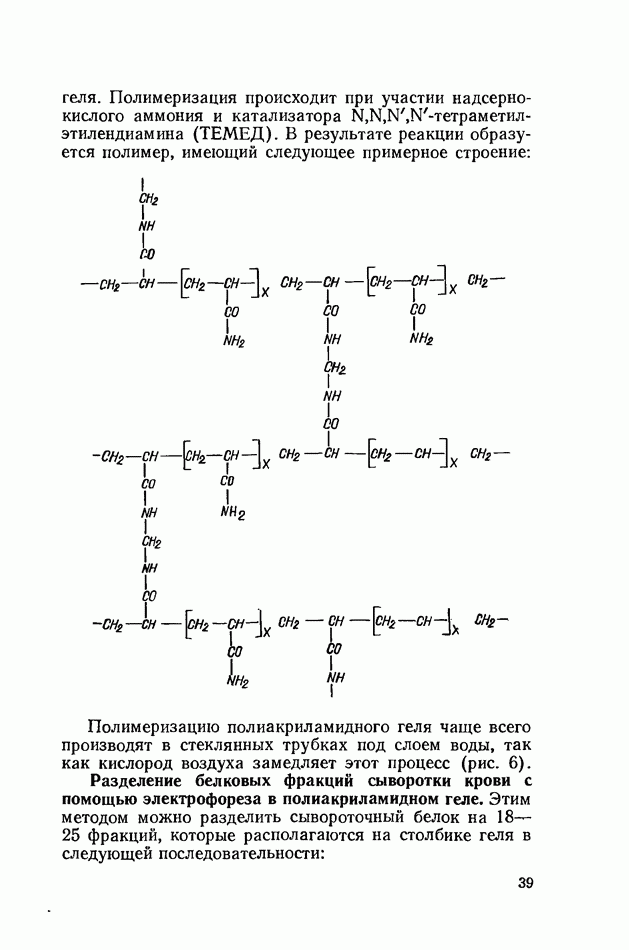
- Электрофорез белков в полиакриламидном геле (по В. Бжескому и 3. Канюга, с дополнениями)
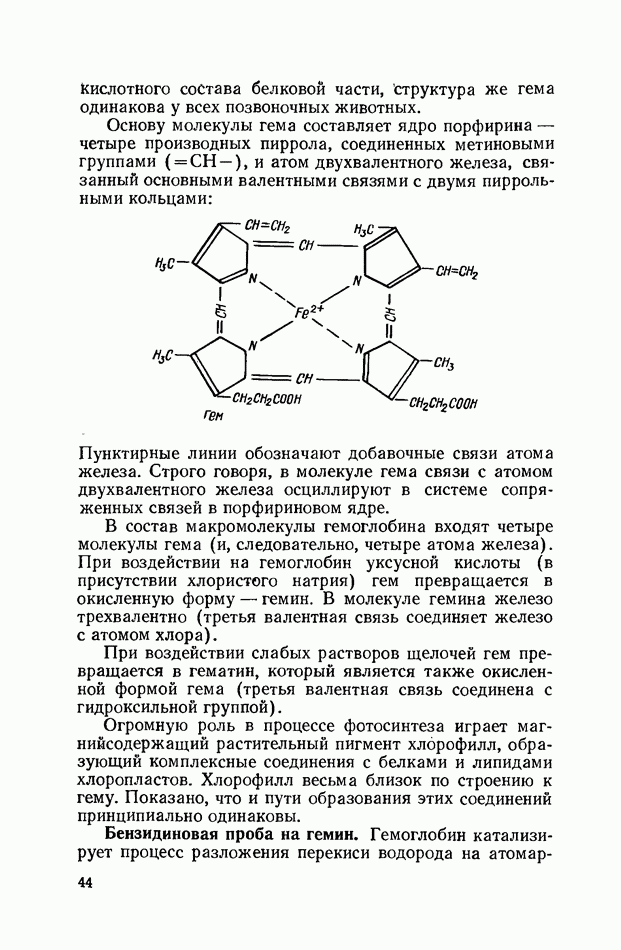
- СЛОЖНЫЕ БЕЛКИ (ПРОТЕИДЫ)
- Гликопротеиды
- Фосфопротеиды
- Раздел II. НУКЛЕОПРОТЕИДЫ. НУКЛЕИНОВЫЕ КИСЛОТЫ
- ВЫДЕЛЕНИЕ ДЕЗОКСИРИБОНУКЛЕОПРОТЕИДОВ ИЗ ПЕЧЕНИ ИЛИ СЕЛЕЗЕНКИ
- КАЧЕСТВЕННАЯ РЕАКЦИЯ НА ДНК
- ВЫДЕЛЕНИЕ НУКЛЕОПРОТЕИДОВ ИЗ ДРОЖЖЕЙ
- ГИДРОЛИЗ НУКЛЕОПРОТЕИДОВ
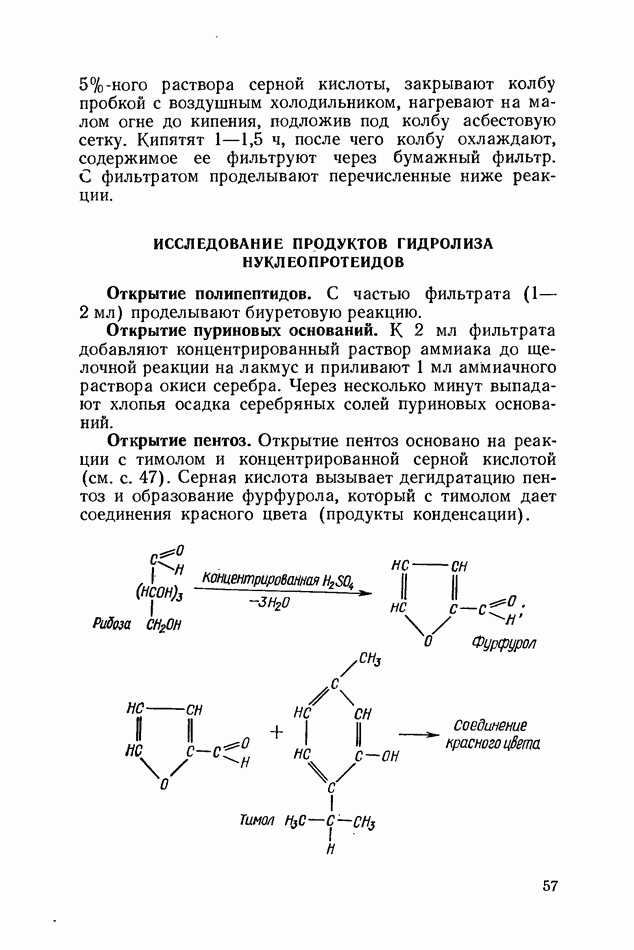
- ИССЛЕДОВАНИЕ ПРОДУКТОВ ГИДРОЛИЗА НУКЛЕОПРОТЕИДОВ
- ОЧИСТКА И РАЗДЕЛЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ (по Шмидту и Таннгаузеру, в прописи Г. П. Георгиева)
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ДНК (по Дише)
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ РНК (по Мейбаум)
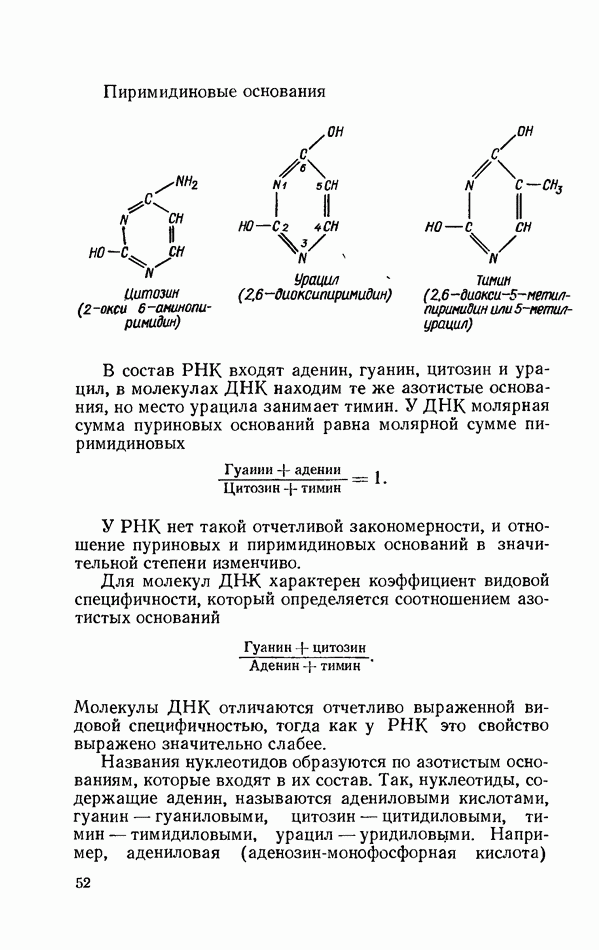
- ХРОМАТОГРАФИЯ НА БУМАГЕ ПУРИНОВЫХ И ПИРИМИДИНОВЫХ ОСНОВАНИЙ, НУКЛЕОЗИДОВ И НУКЛЕОТИДОВ
- Раздел III. ВИТАМИНЫ
- ВИТАМИНЫ ГРУППЫ А
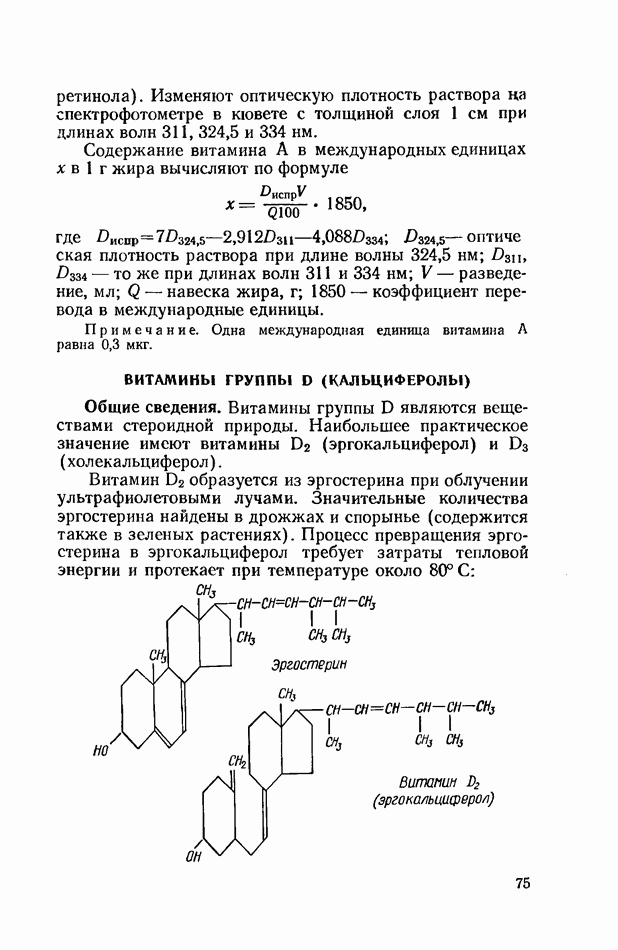
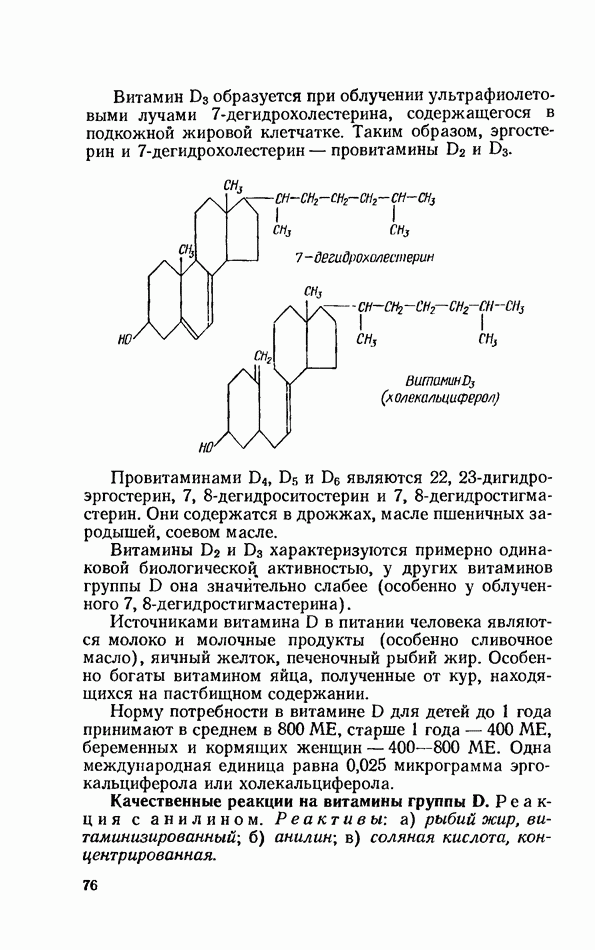
- ВИТАМИНЫ ГРУППЫ D (КАЛЬЦИФЕРОЛЫ)
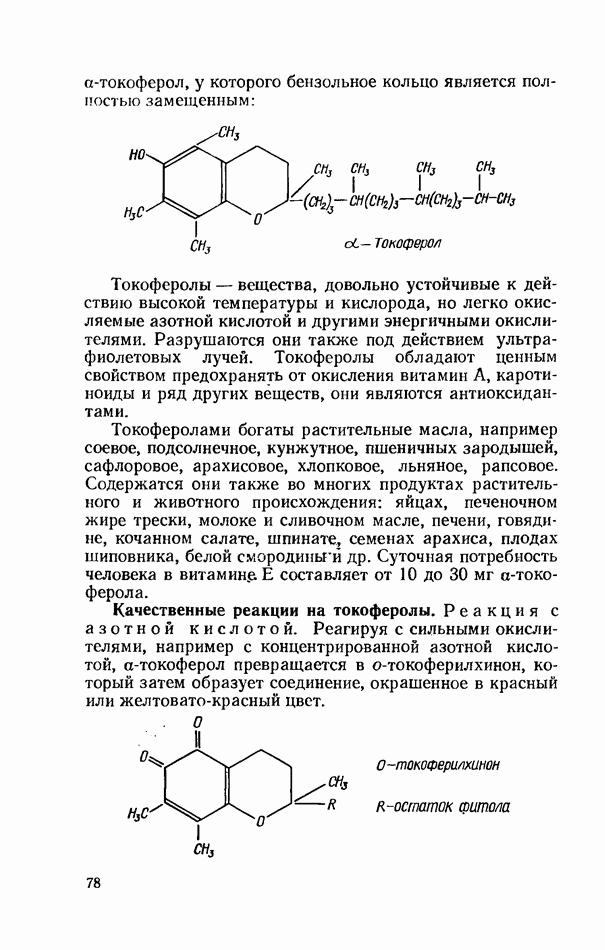
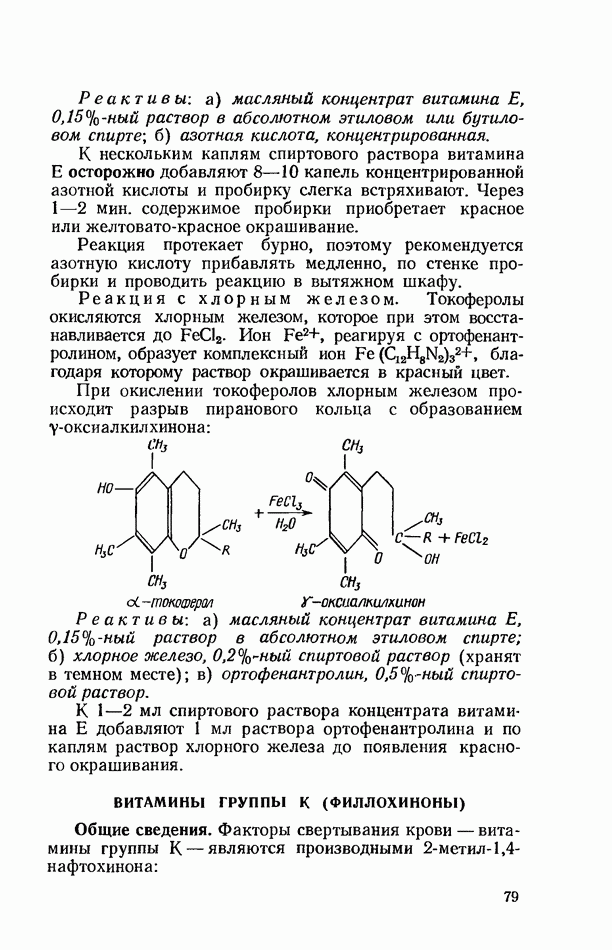
- ВИТАМИНЫ ГРУППЫ Е (ТОКОФЕРОЛЫ)
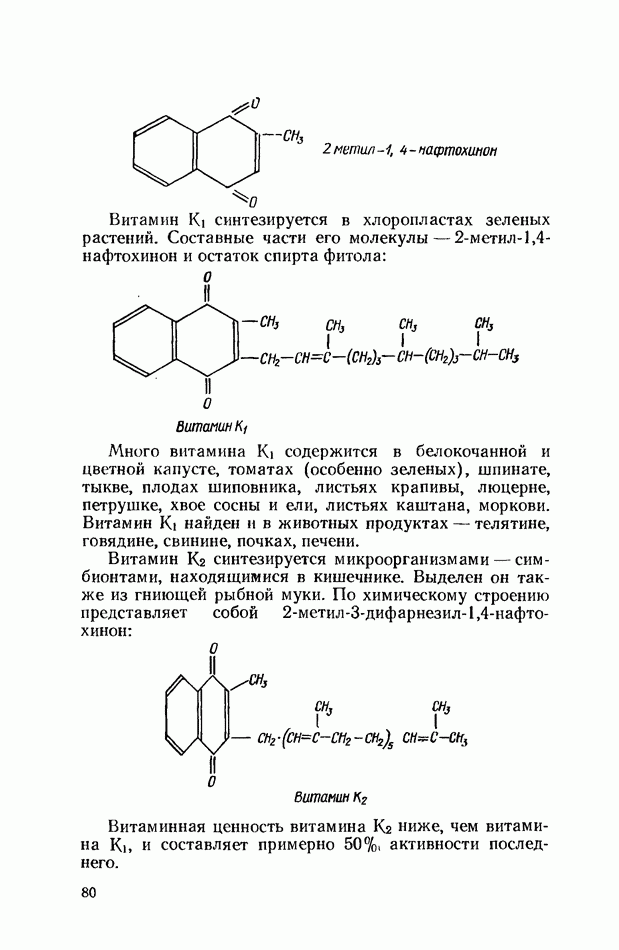
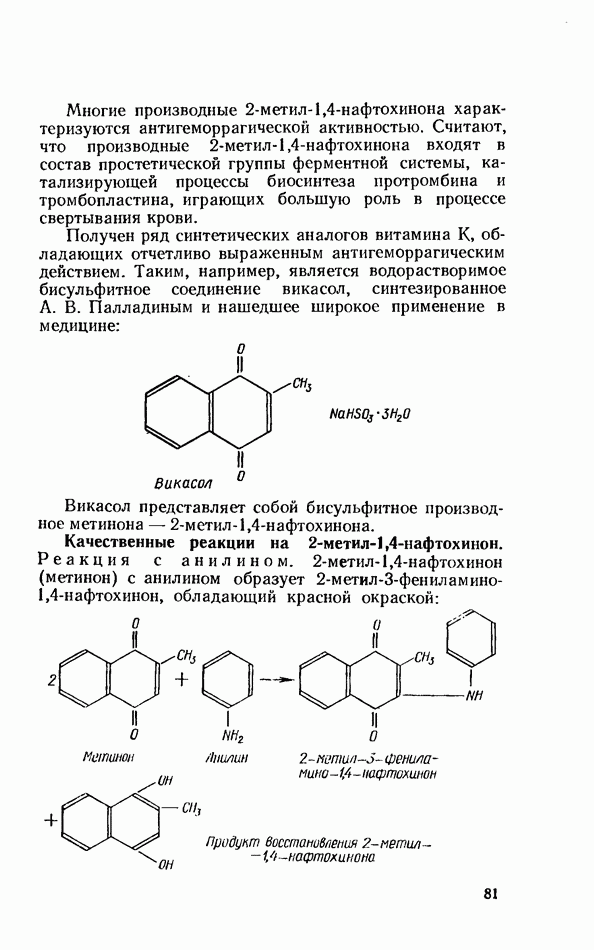
- ВИТАМИНЫ ГРУППЫ К (ФИЛЛОХИНОНЫ)
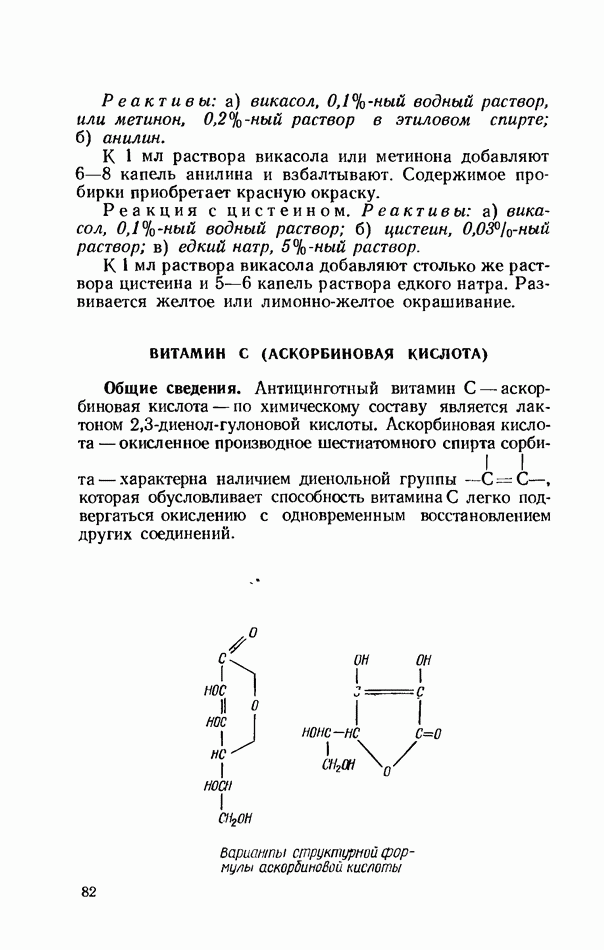
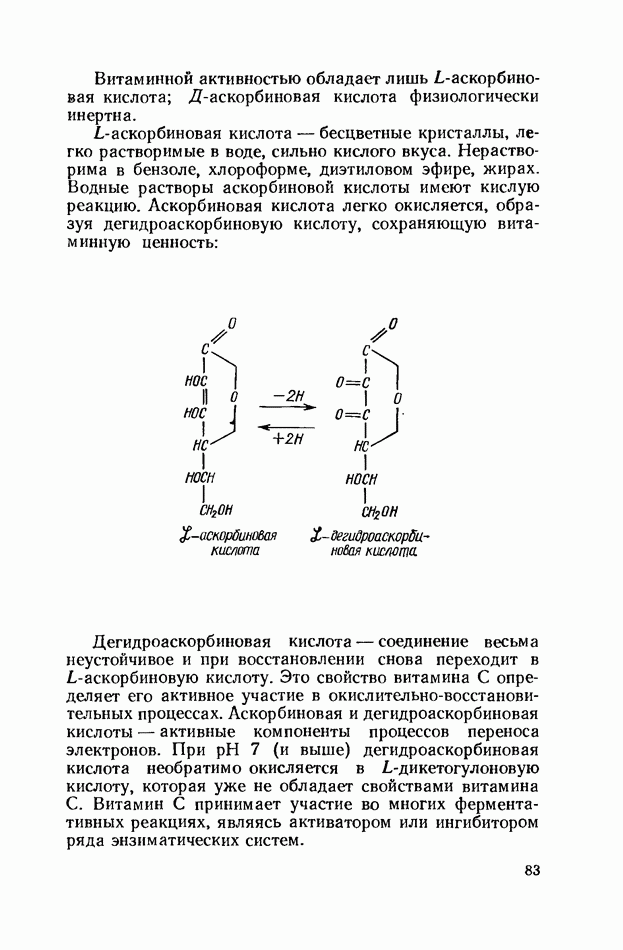
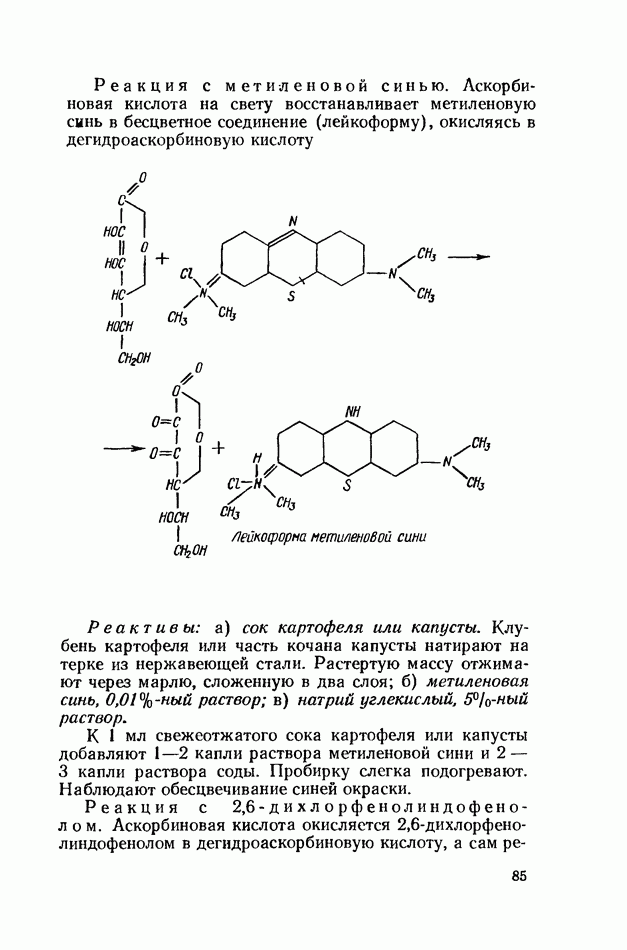
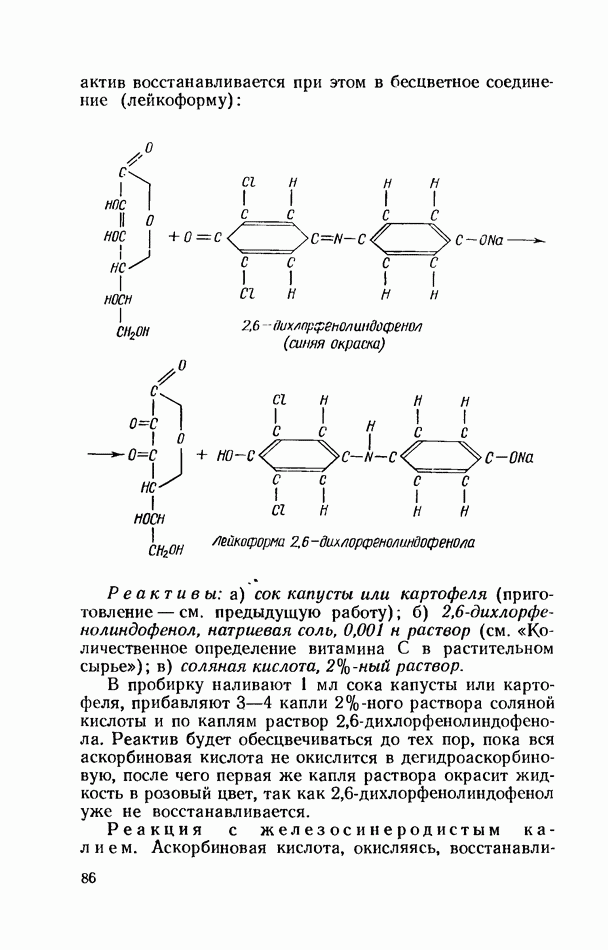
- ВИТАМИН С (АСКОРБИНОВАЯ КИСЛОТА)
- БИОФЛАВОНОИДЫ (ВЕЩЕСТВА Р-ВИТАМИННОГО ДЕЙСТВИЯ)
- ВИТАМИН В: (ТИАМИН)
- ВИТАМИН В2 (РИБОФЛАВИН)
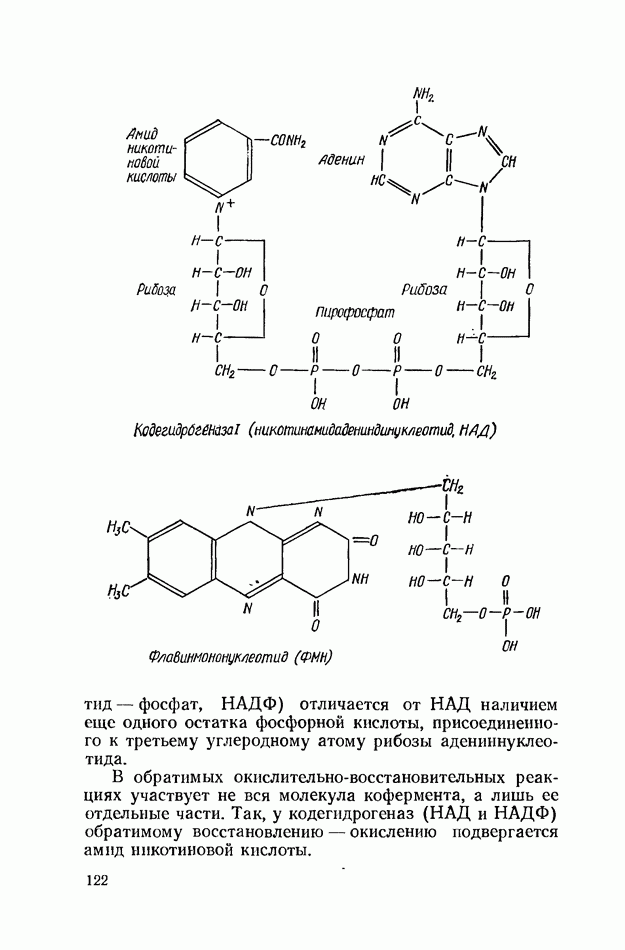
- ВИТАМИН РР (В5, НИКОТИНОВАЯ КИСЛОТА, НИКОТИНАМИД)
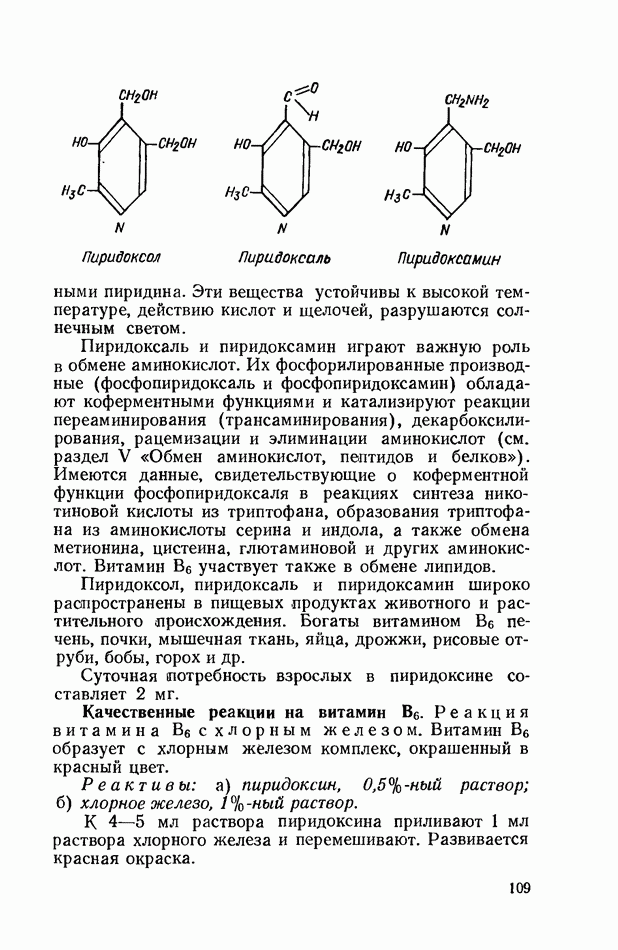
- ВИТАМИН В6 (ПИРИДОКСИН)
- Раздел IV. ФЕРМЕНТЫ (ЭНЗИМЫ)
- ИССЛЕДОВАНИЕ ОБЩИХ СВОЙСТВ ФЕРМЕНТОВ
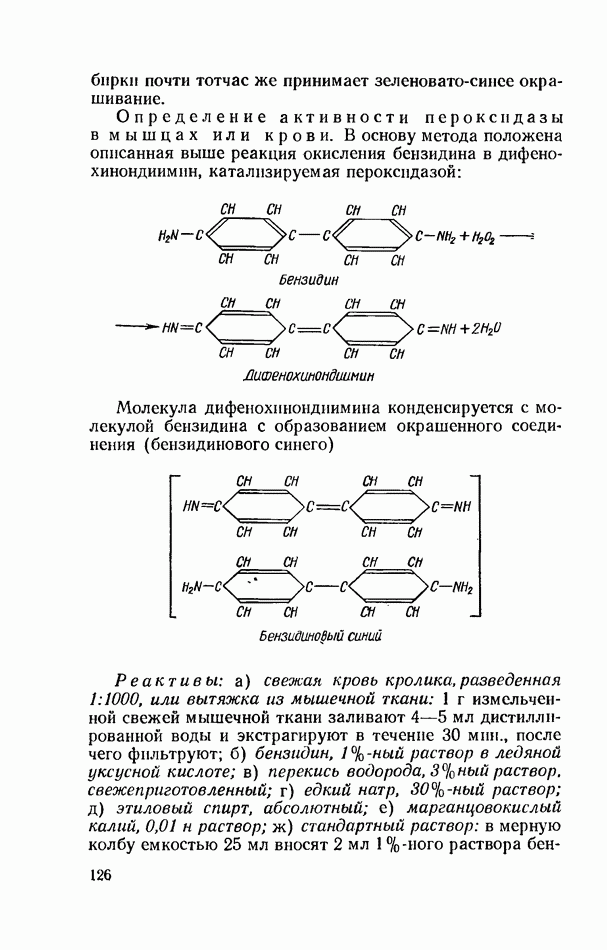
- ОПРЕДЕЛЕНИЕ АКТИВНОСТИ ГИДРОЛИТИЧЕСКИХ ФЕРМЕНТОВ (ГИДРОЛАЗ)
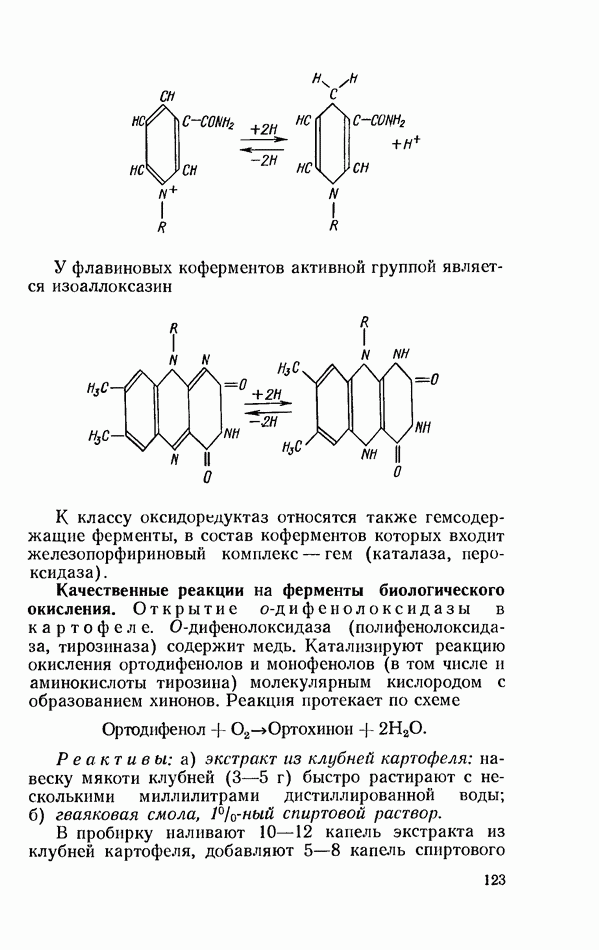
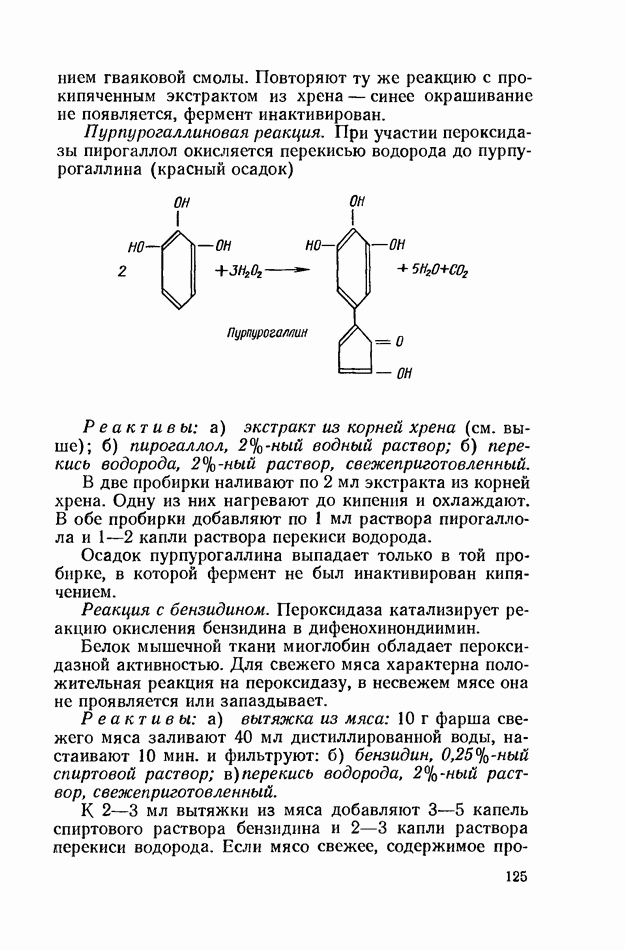
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ФЕРМЕНТЫ (ОКСИДОРЕДУКТАЗЫ)
- Раздел V. ОБМЕН АМИНОКИСЛОТ, ПЕПТИДОВ И БЕЛКОВ
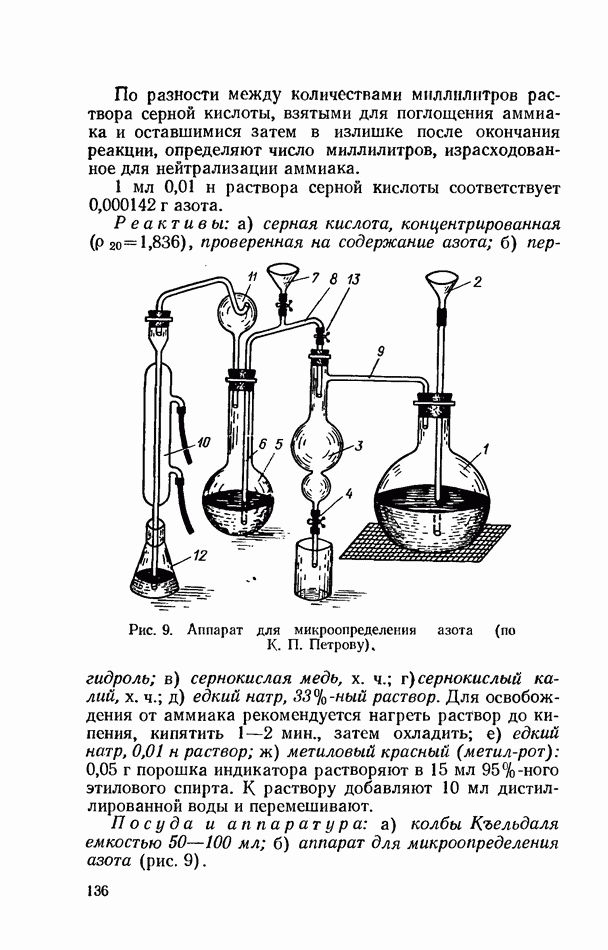
- ОПРЕДЕЛЕНИЕ ОБЩЕГО АЗОТА ПО КЪЕЛЬДАЛЮ (МИКРОМЕТОД)
- ОПРЕДЕЛЕНИЕ БЕЛКОВОГО И НЕБЕЛКОВОГО АЗОТА
- БЫСТРЫЙ МЕТОД КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ БЕЛКОВ
- ОПРЕДЕЛЕНИЕ АЗОТА АМИНОКИСЛОТ
- ОПРЕДЕЛЕНИЕ СВОБОДНЫХ АМИНОКИСЛОТ В МЫШЕЧНОЙ ТКАНИ МЕТОДОМ ТОНКОСЛОЙНОЙ ХРОМАТОГРАФИИ (по Г. В. Колоболотскому)
- ГИДРОЛИТИЧЕСКОЕ РАСЩЕПЛЕНИЕ БЕЛКА ФЕРМЕНТАМИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
- ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
- ПЕРЕАМИНИРОВАНИЕ (ТРАНСАМИНИРОВАНИЕ) АМИНОКИСЛОТ
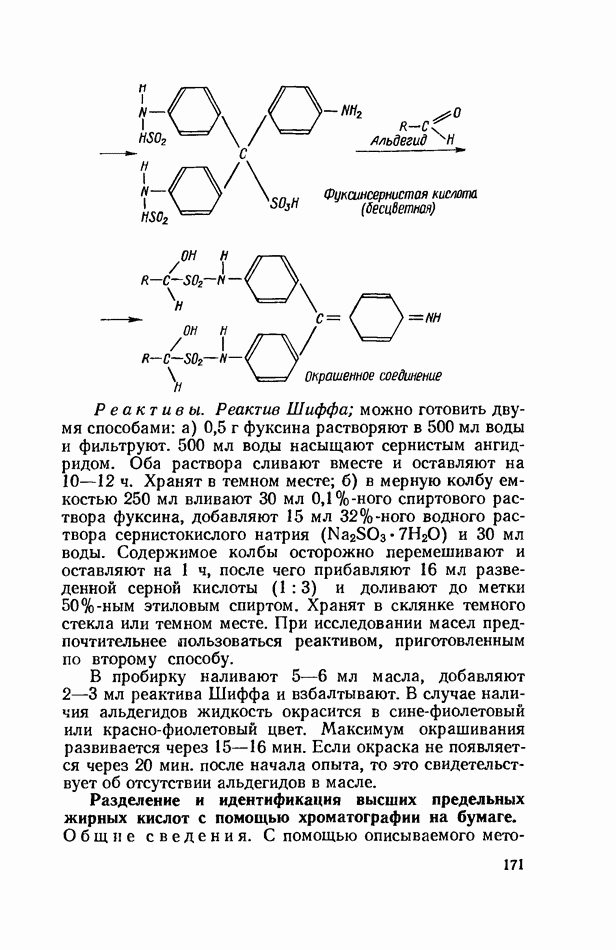
- Раздел VI. ХИМИЯ И ОБМЕН ЛИПИДОВ
- ЖИРЫ (НЕЙТРАЛЬНЫЕ ЖИРЫ)
- ФОСФАТИДЫ, ИЛИ ФОСФОЛИПИДЫ
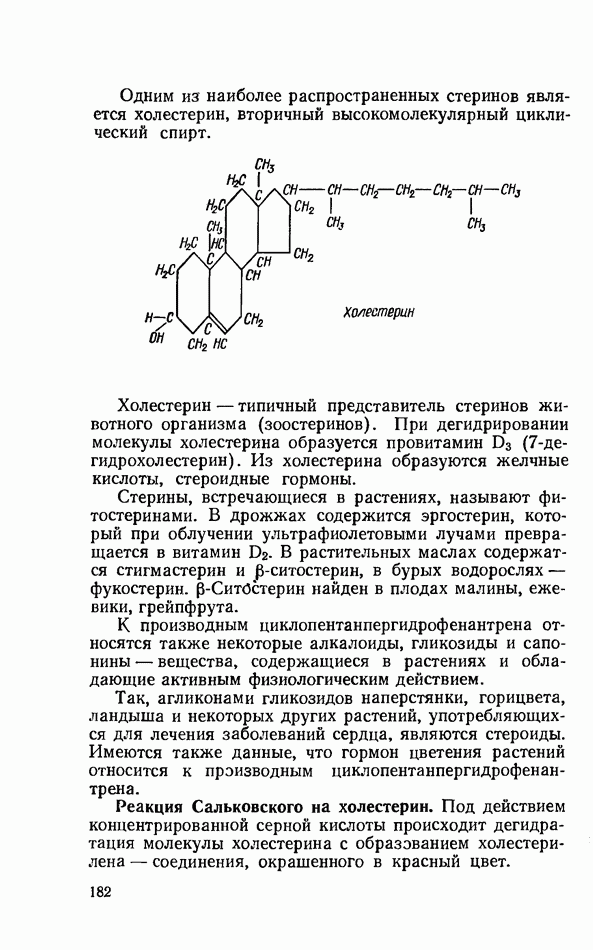
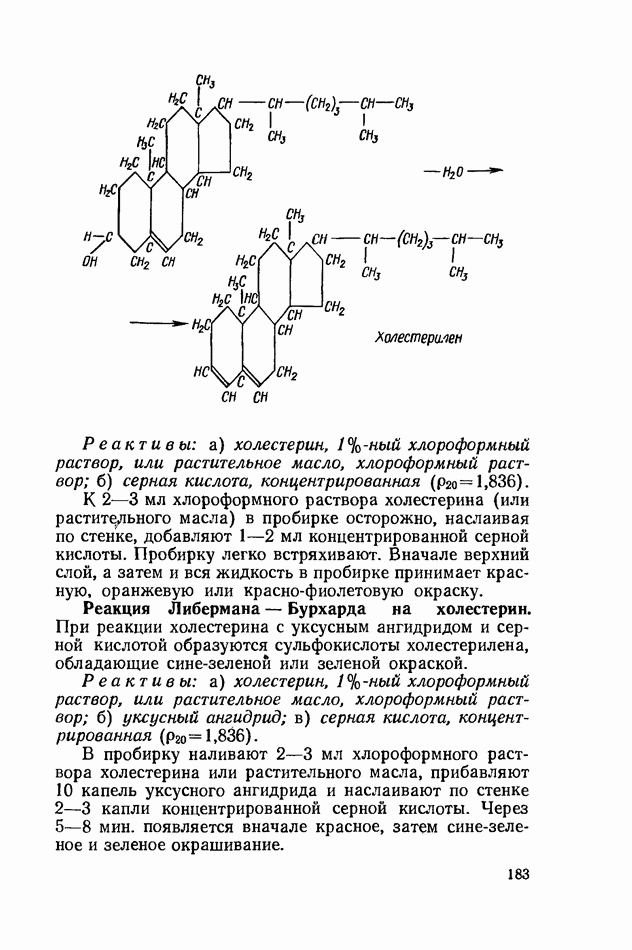
- СТЕРИНЫ
- ФЕРМЕНТАТИВНЫЙ ГИДРОЛИЗ ЛИПИДОВ
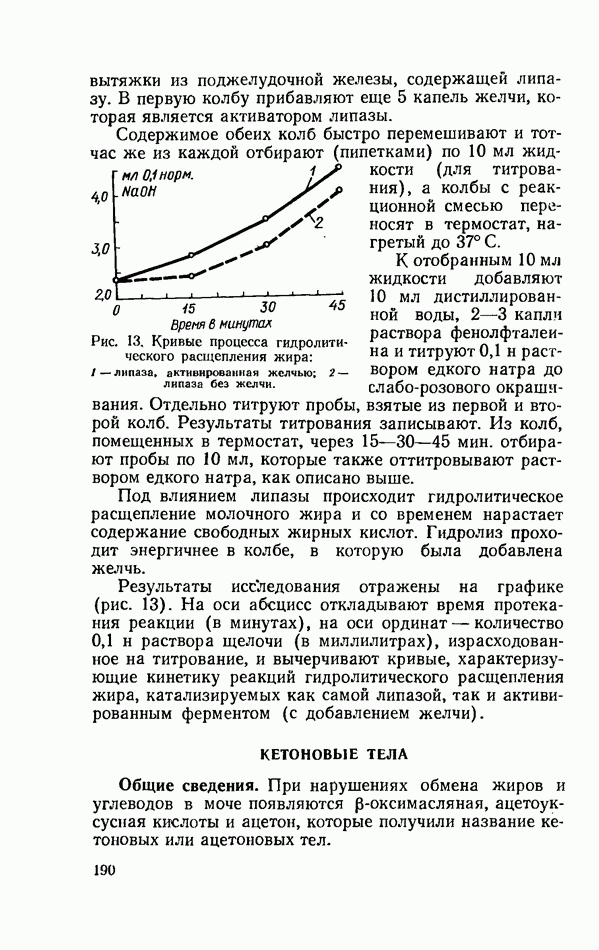
- КЕТОНОВЫЕ ТЕЛА
- Раздел VII. ХИМИЯ И ОБМЕН УГЛЕВОДОВ
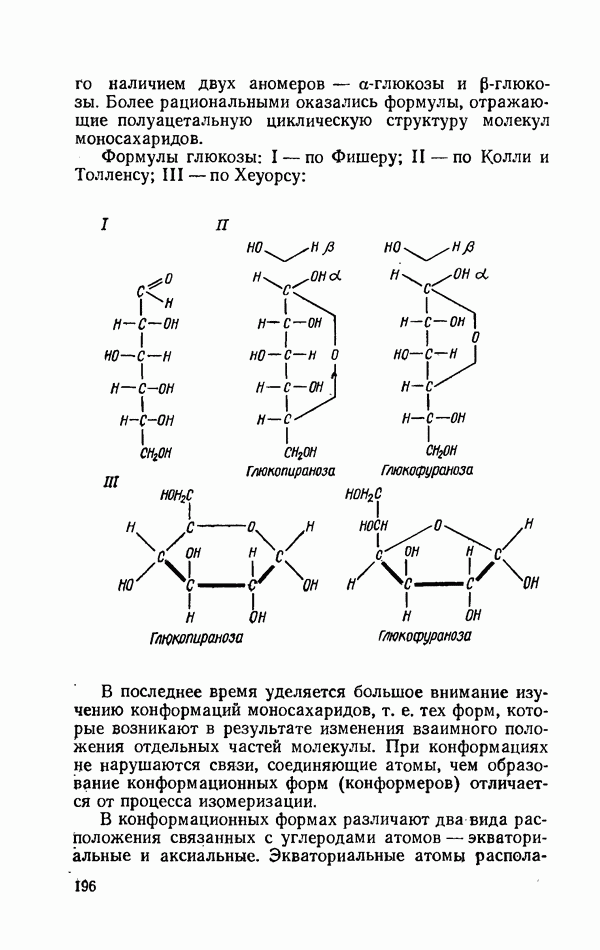
- КАЧЕСТВЕННЫЕ РЕАКЦИИ НА МОНОСАХАРИДЫ
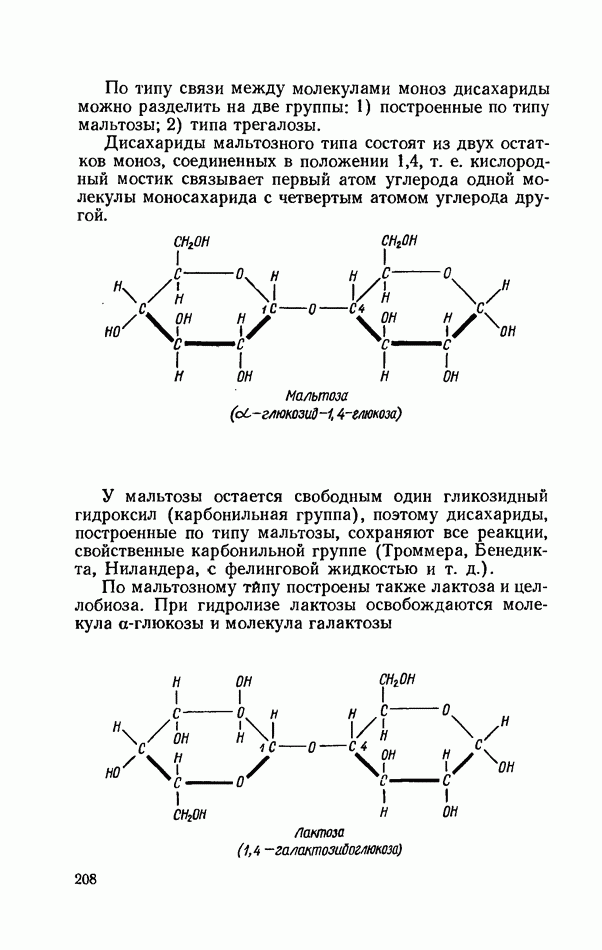
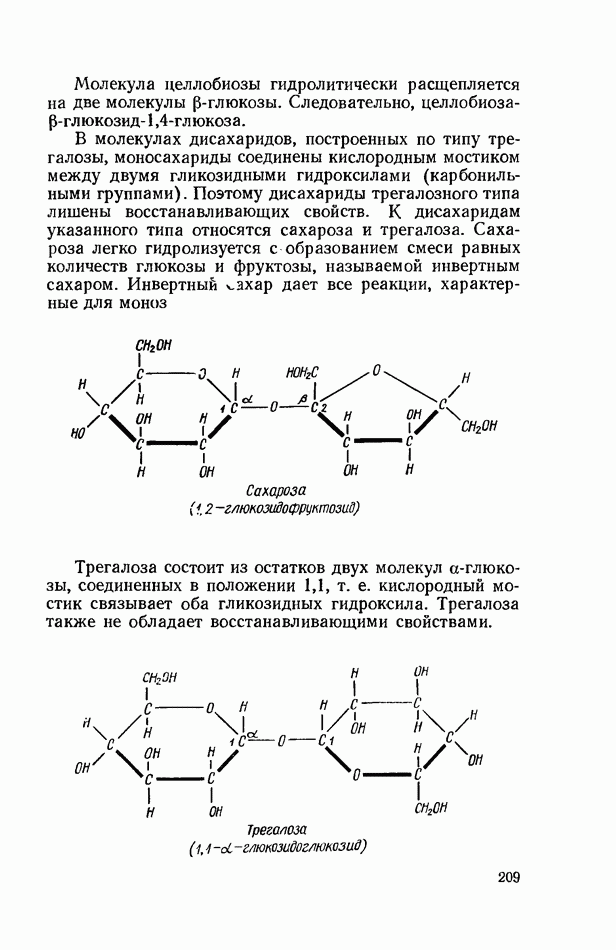
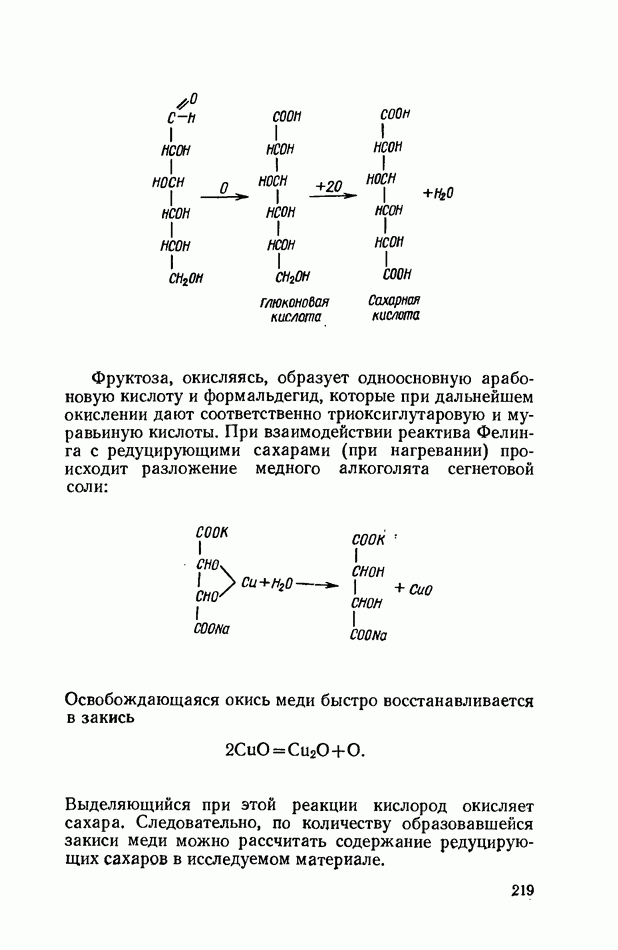
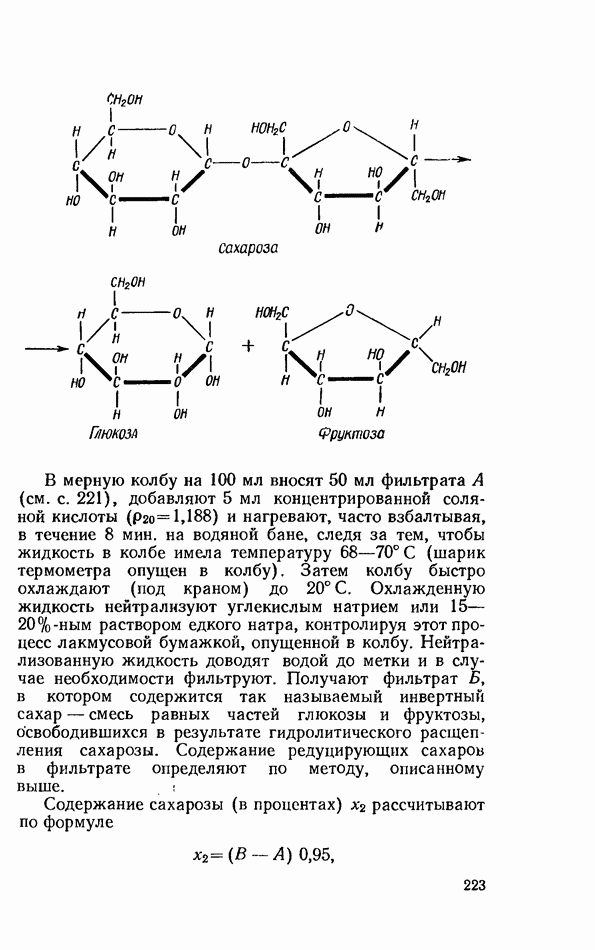
- ОБЩИЕ РЕАКЦИИ ДИСАХАРИДОВ
- ВЫСШИЕ ПОЛИСАХАРИДЫ
- ОПРЕДЕЛЕНИЕ РЕДУЦИРУЮЩИХ (ВОССТАНАВЛИВАЮЩИХ) САХАРОВ В РАСТИТЕЛЬНОМ МАТЕРИАЛЕ
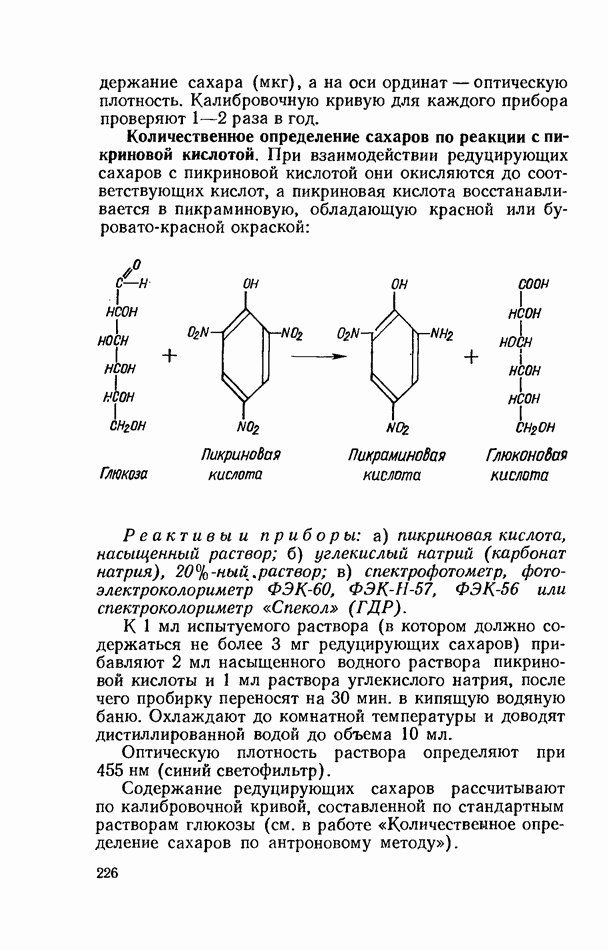
- ФОТОМЕТРИЧЕСКИЕ МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ РЕДУЦИРУЮЩИХ САХАРОВ
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ САХАРОВ В РАСТИТЕЛЬНОМ МАТЕРИАЛЕ С ПОМОЩЬЮ ХРОМАТОГРАФИИ НА БУМАГЕ (по О. А. Павлиновой)
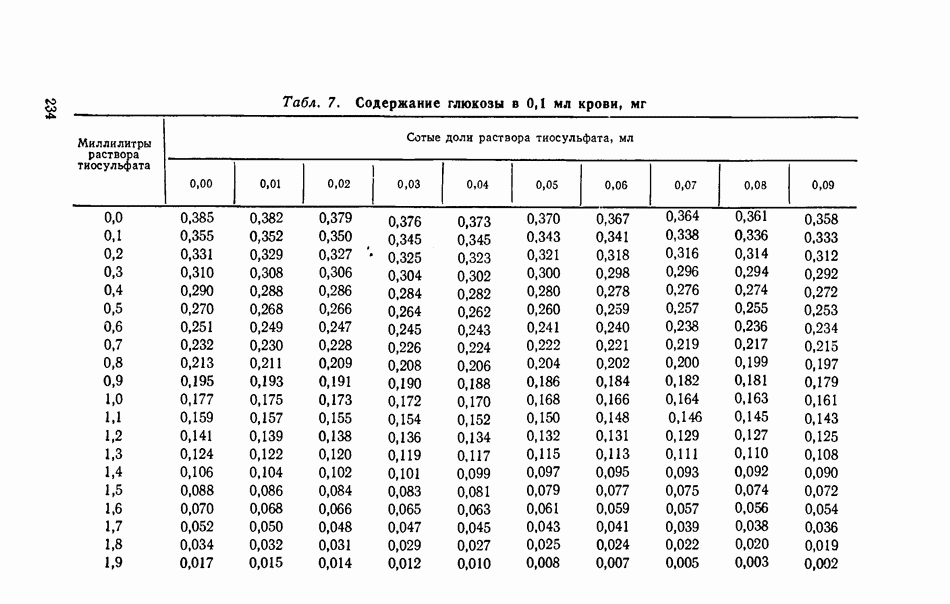
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ГЛЮКОЗЫ В КРОВИ (по Хагедорну — Иеисену)
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ КРАХМАЛА
- ИССЛЕДОВАНИЕ АНАЭРОБНОГО РАСПАДА ГЛИКОГЕНА ИЛИ КРАХМАЛА
- ОПРЕДЕЛЕНИЕ ПИРОВИНОГРАДНОЙ КИСЛОТЫ В МОЧЕ
- Раздел VIII. ГОРМОНЫ
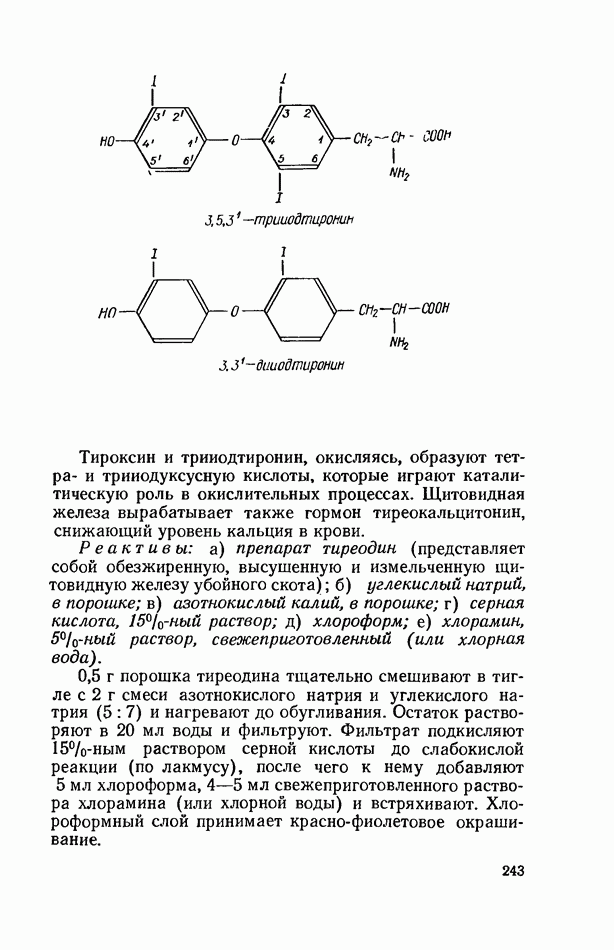
- ОТКРЫТИЕ ИОДА В ЩИТОВИДНОЙ ЖЕЛЕЗЕ
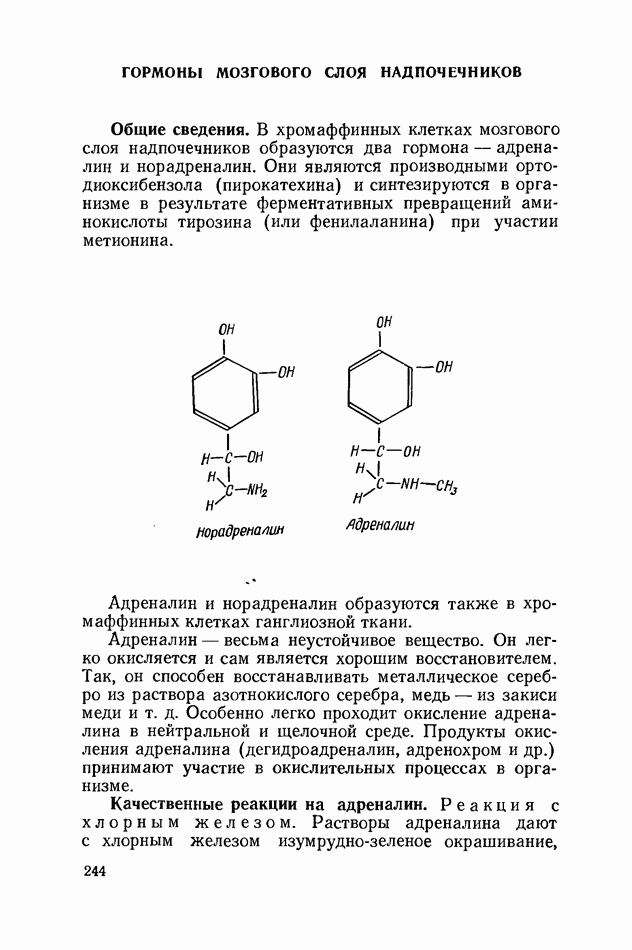
- ГОРМОНЫ МОЗГОВОГО СЛОЯ НАДПОЧЕЧНИКОВ
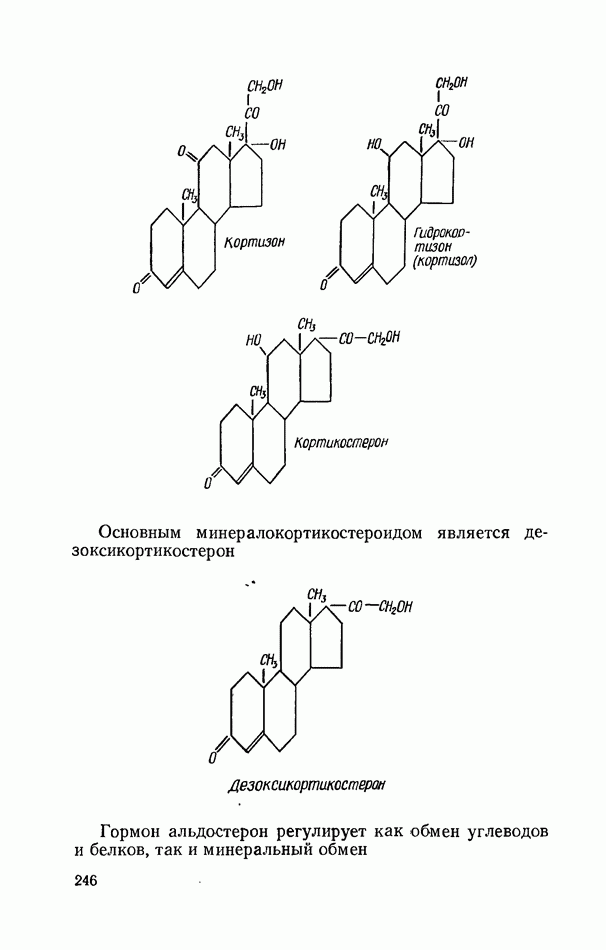
- ГОРМОНЫ КОРКОВОГО СЛОЯ НАДПОЧЕЧНИКОВ (КОРТИКОСТЕРОИДЫ)
- ГОРМОНЫ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
- Раздел IX. ОБМЕН МИНЕРАЛЬНЫХ ВЕЩЕСТВ
- ОПРЕДЕЛЕНИЕ КАЛЬЦИЯ В СЫВОРОТКЕ КРОВИ
- ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ КАЛЬЦИЯ В МОЛОКЕ
- ОПРЕДЕЛЕНИЕ ОБЩЕГО СОДЕРЖАНИЯ ФОСФОРА В МОЛОКЕ
- ОПРЕДЕЛЕНИЕ ЖЕЛЕЗА В ПЛАЗМЕ ИЛИ СЫВОРОТКЕ КРОВИ (по прописи П. А. Розенберг и Н. К. Бялко)
- ОПРЕДЕЛЕНИЕ ХЛОРИДОВ В ПИЩЕВЫХ ПРОДУКТАХ (по А. С. Вечеру и В. В. Малоян)
- ЛИТЕРАТУРА
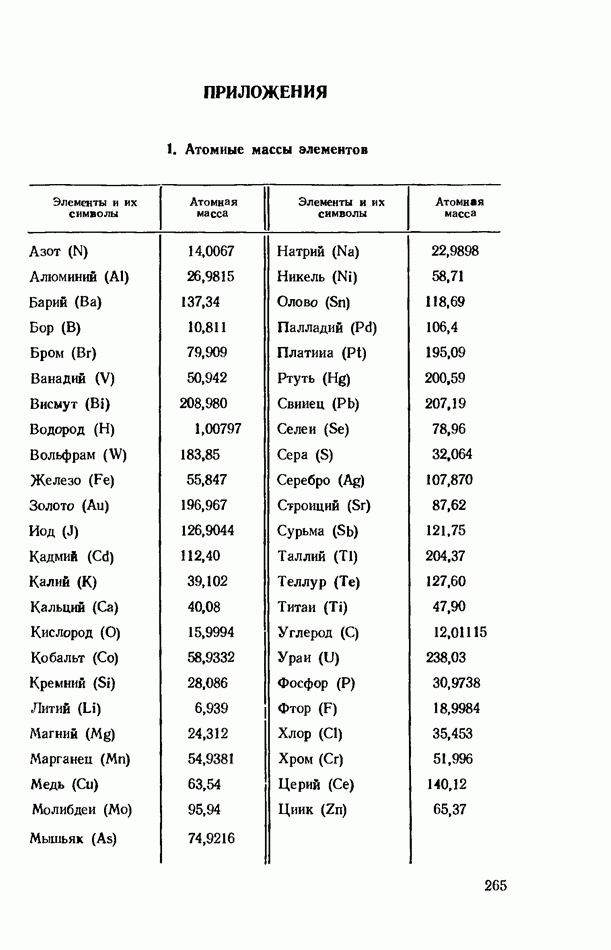
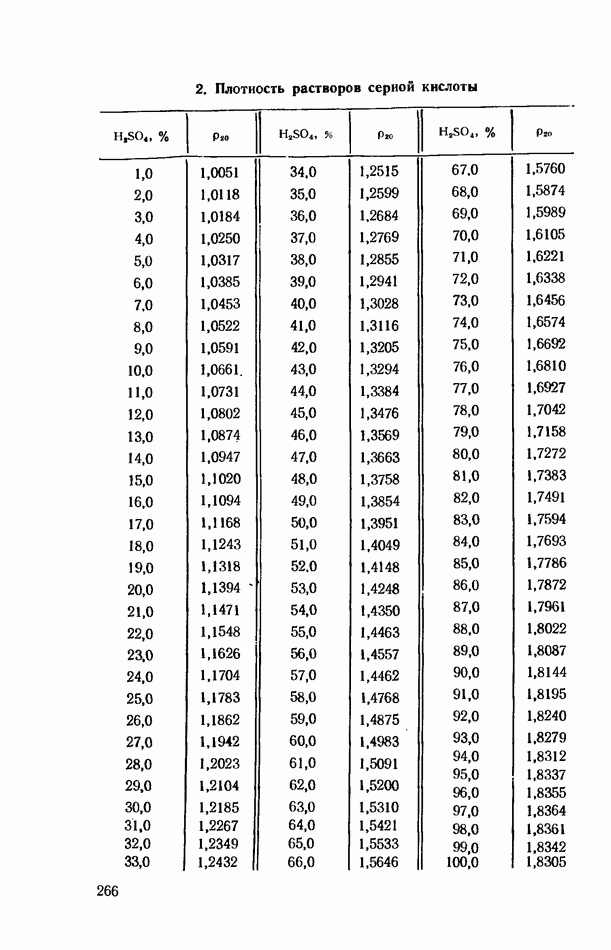
- ПРИЛОЖЕНИЯ