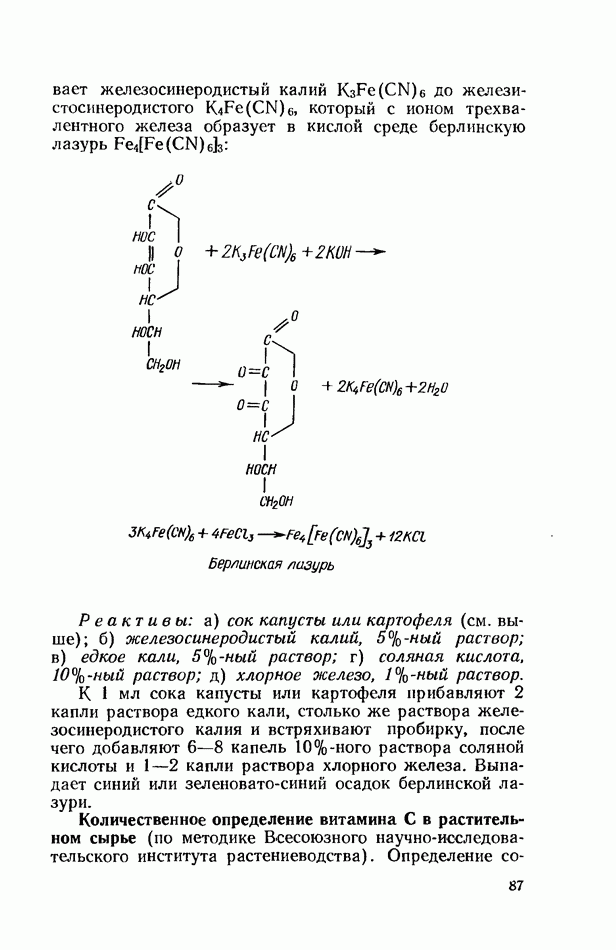
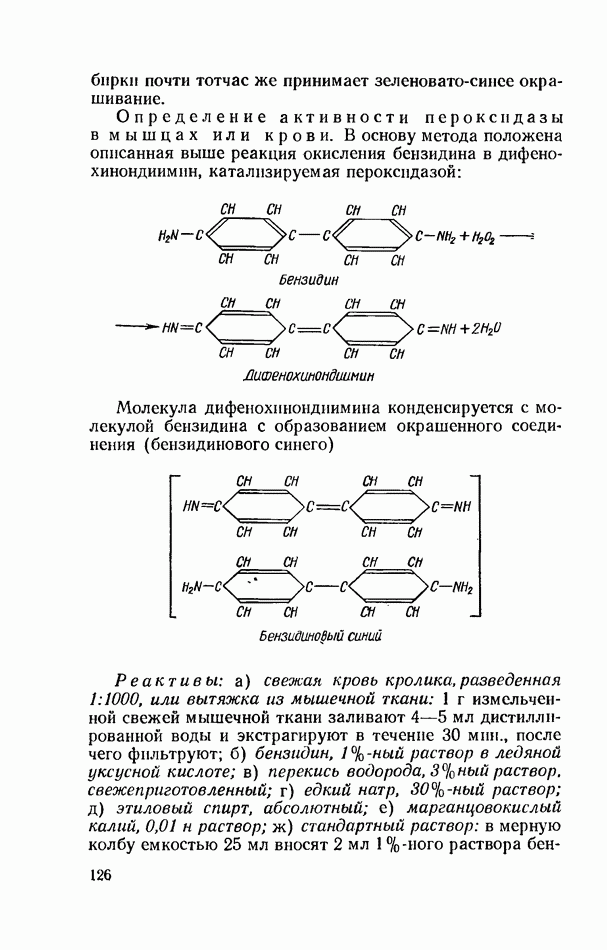
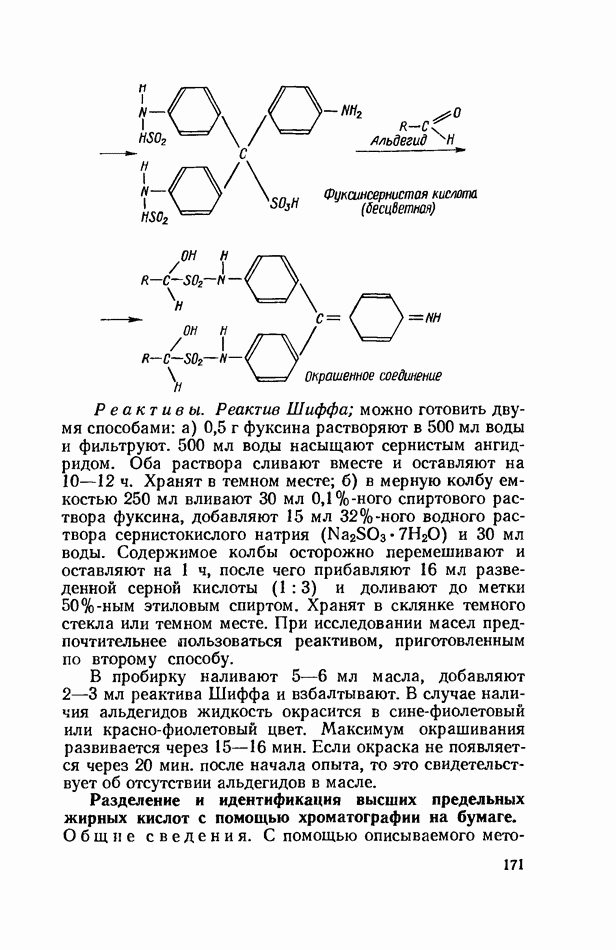
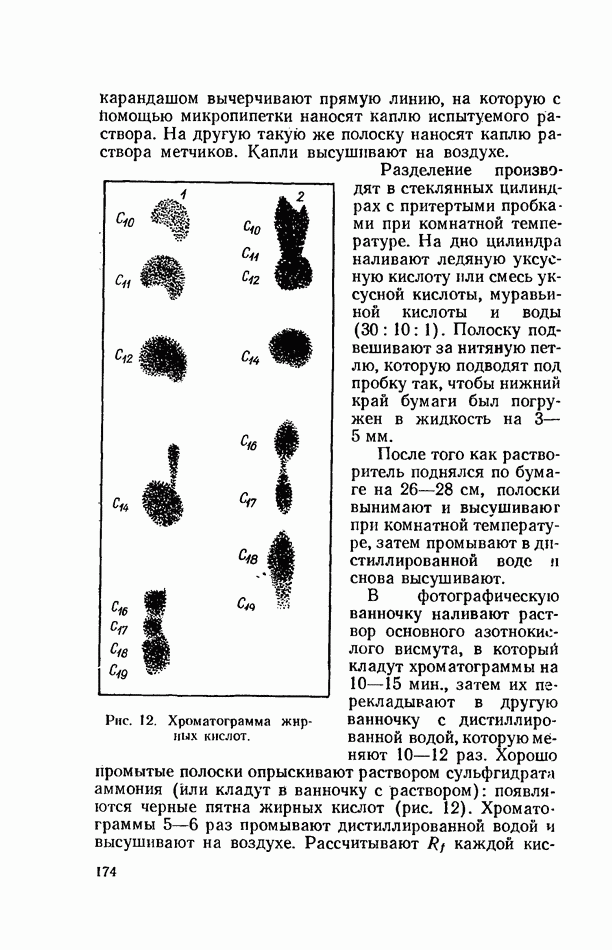
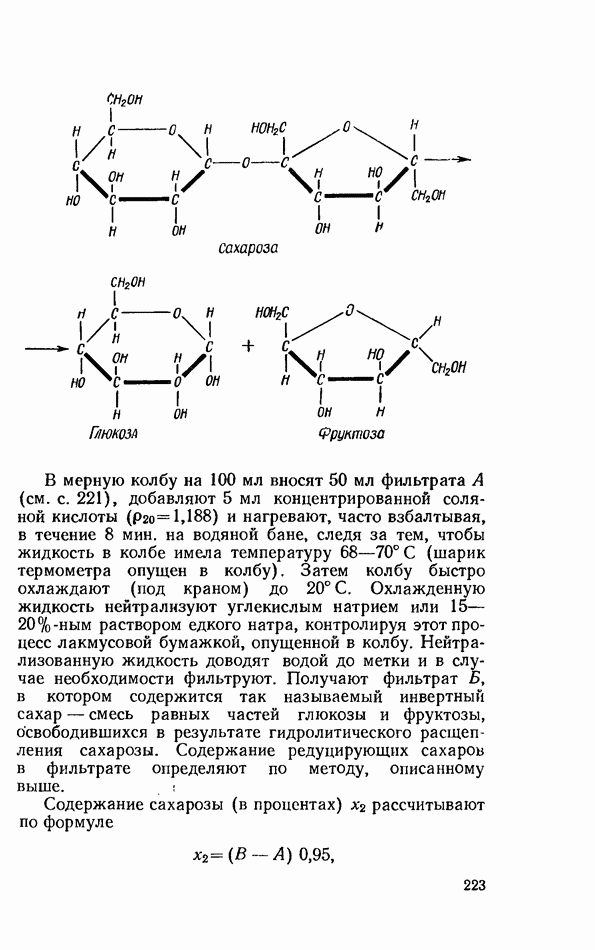
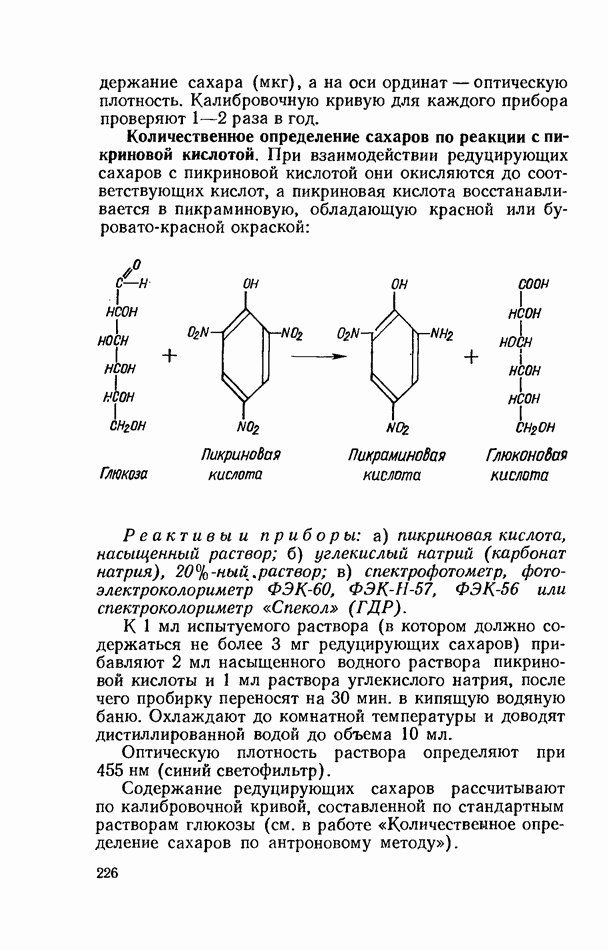
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
Электрофорез белков в полиакриламидном геле (по В. Бжескому и 3. Канюга, с дополнениями)
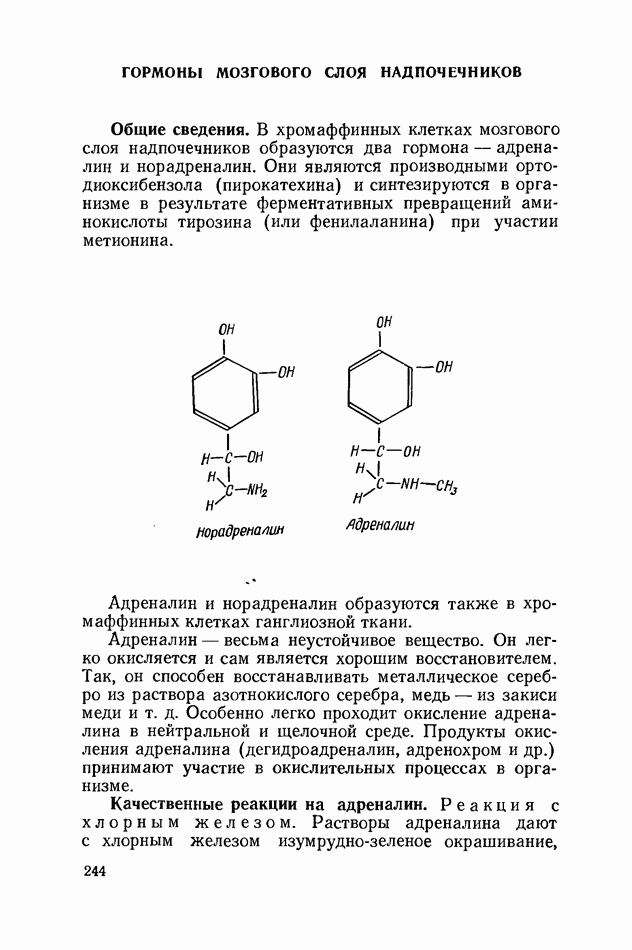
Общие сведения.
Электрофорез в полиакриламидном геле, как и другие виды аналогичных исследований, основан на использовании неодинаковой электрофоретической подвижности различных белковых фракций. Кроме того, гель играет роль молекулярного сита: вещества, имеющие размеры молекул большие, чем диаметр пор геля, проходят через гель, не проникая внутрь его частиц; соединения же, характеризующиеся размерами молекул меньшими диаметра пор геля, будут проходить гель по порам, и поэтому их движение окажется замедленным. Благодаря способности избирательно адсорбировать более мелкие молекулы молекулярное сито позволяет разделить фракции с различным молекулярным весом.
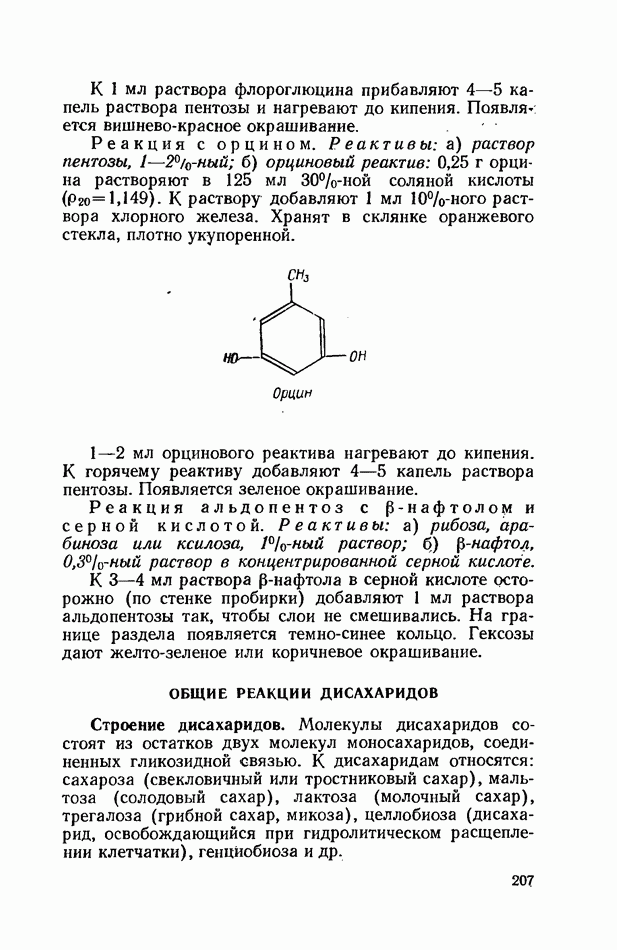
Акриламид, употребляемый для электрофореза, представляет собой смесь двух веществ — собственно акриламида  и
и  -метилен-бис-акрила-мида
-метилен-бис-акрила-мида  . В зависимости от сочетания этих соединений получают полимеры с различной частотой и размерами пор. Размеры пор определяются количеством
. В зависимости от сочетания этих соединений получают полимеры с различной частотой и размерами пор. Размеры пор определяются количеством  -метилен-бис-акри-ламида в реакционной смеси, поскольку он содержит так называемые поперечные метиленовые мостики, от количества которых зависит в конечном счете и диаметр пор
-метилен-бис-акри-ламида в реакционной смеси, поскольку он содержит так называемые поперечные метиленовые мостики, от количества которых зависит в конечном счете и диаметр пор
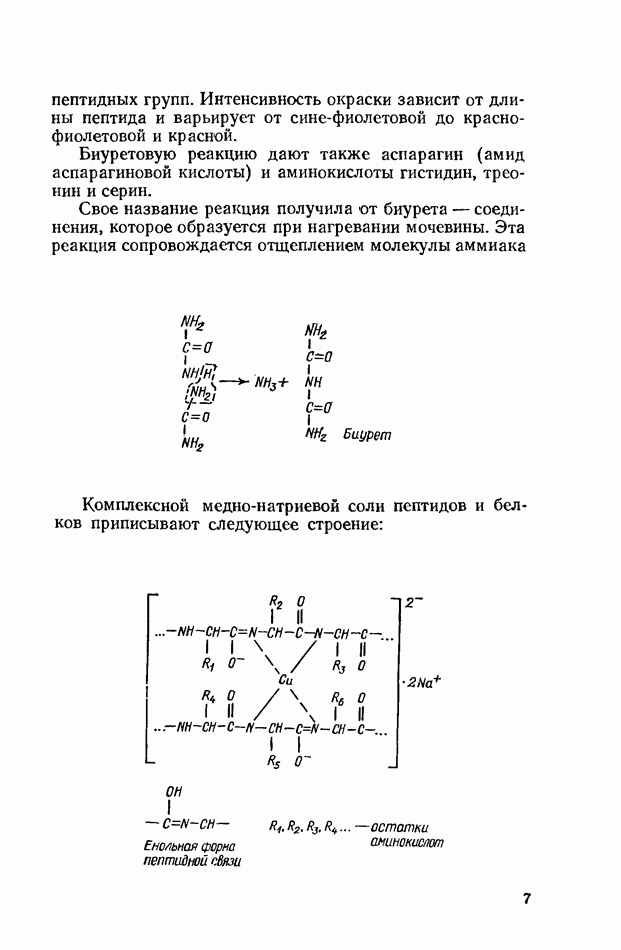
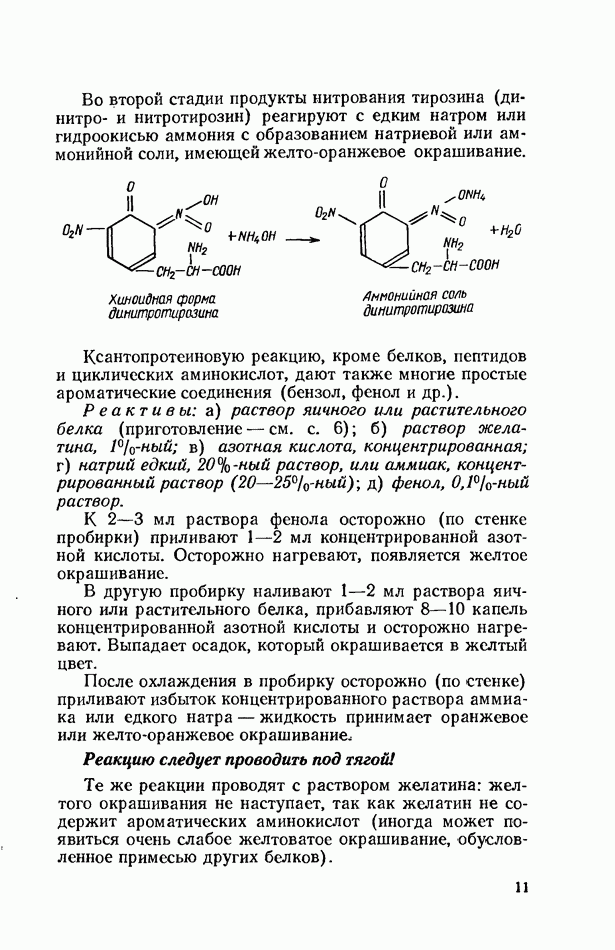
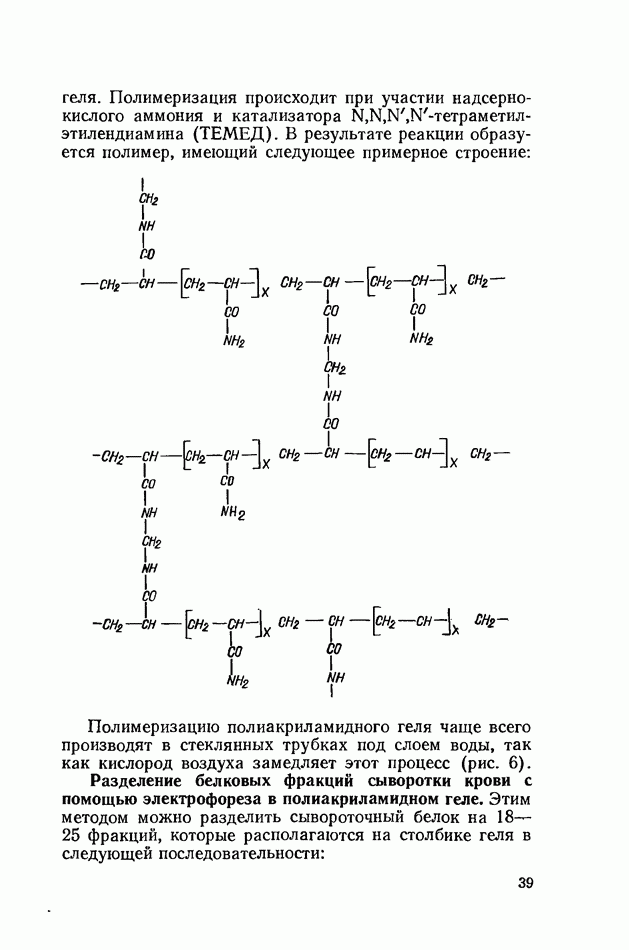
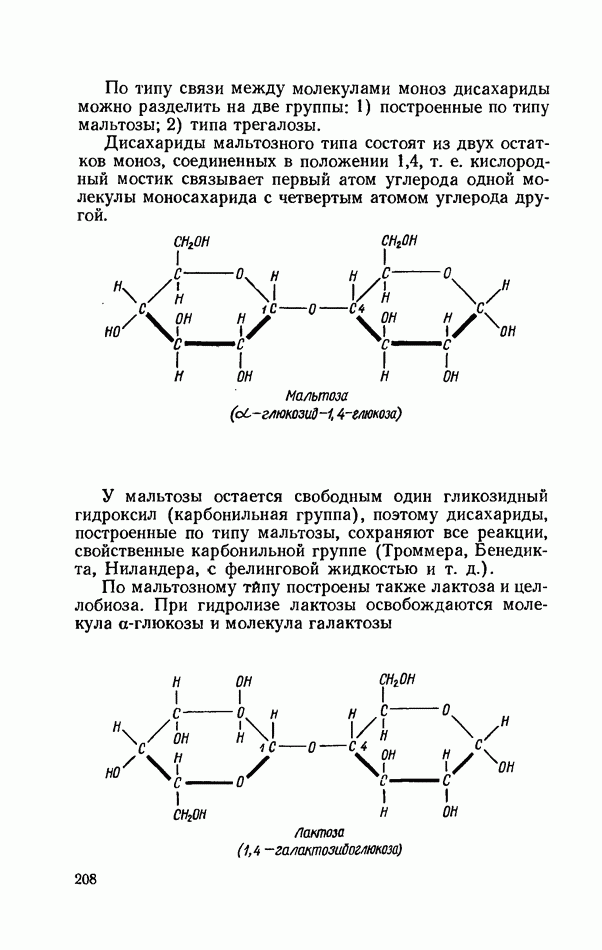
геля. Полимеризация происходит при участии надсерно-кислого аммония и катализатора  -тетраметил-этилендиамина (ТЕМЕД). В результате реакции образуется полимер, имеющий следующее примерное строение:
-тетраметил-этилендиамина (ТЕМЕД). В результате реакции образуется полимер, имеющий следующее примерное строение:

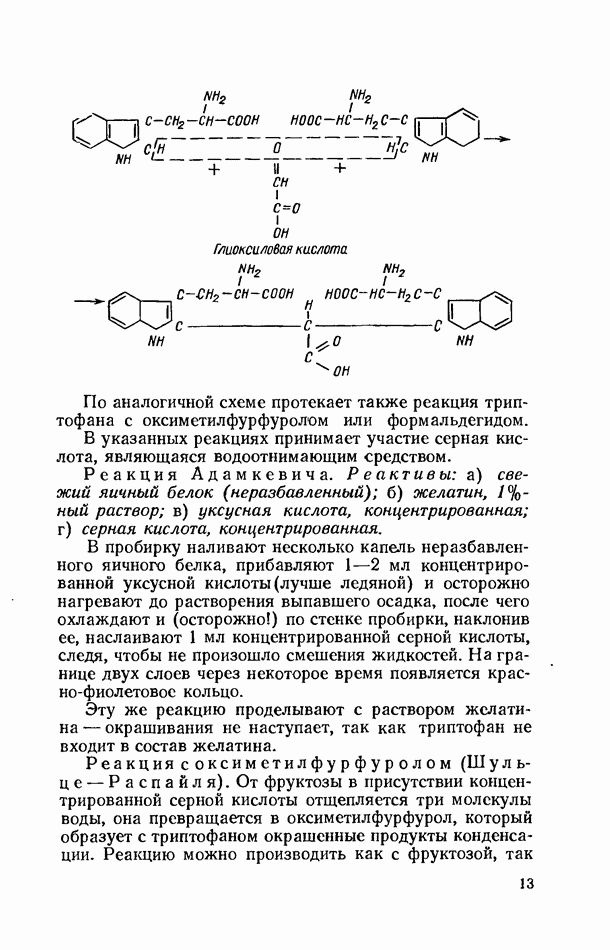
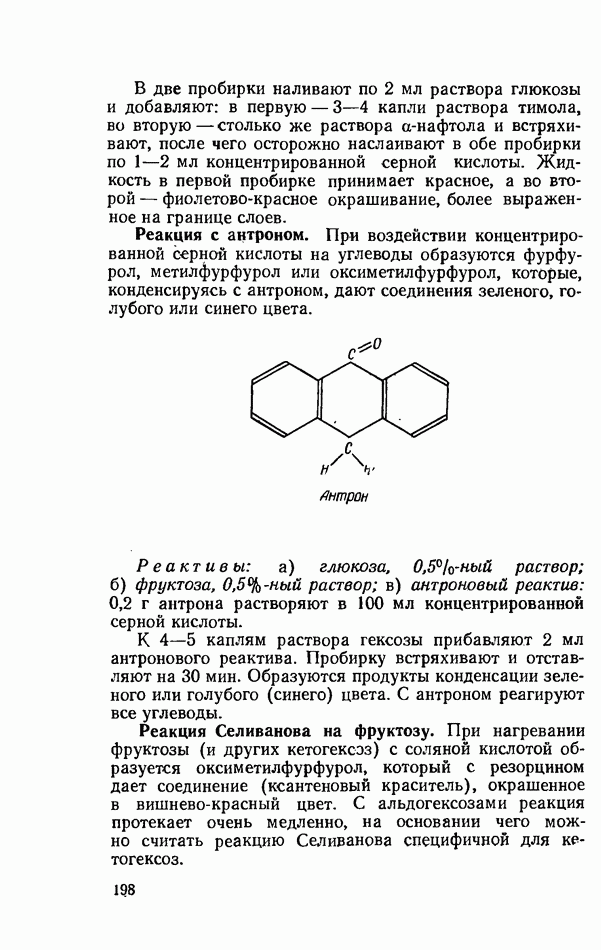
Полимеризацию полиакриламидного геля чаще всего производят в стеклянных трубках под слоем воды, так как кислород воздуха замедляет этот процесс (рис. 6).
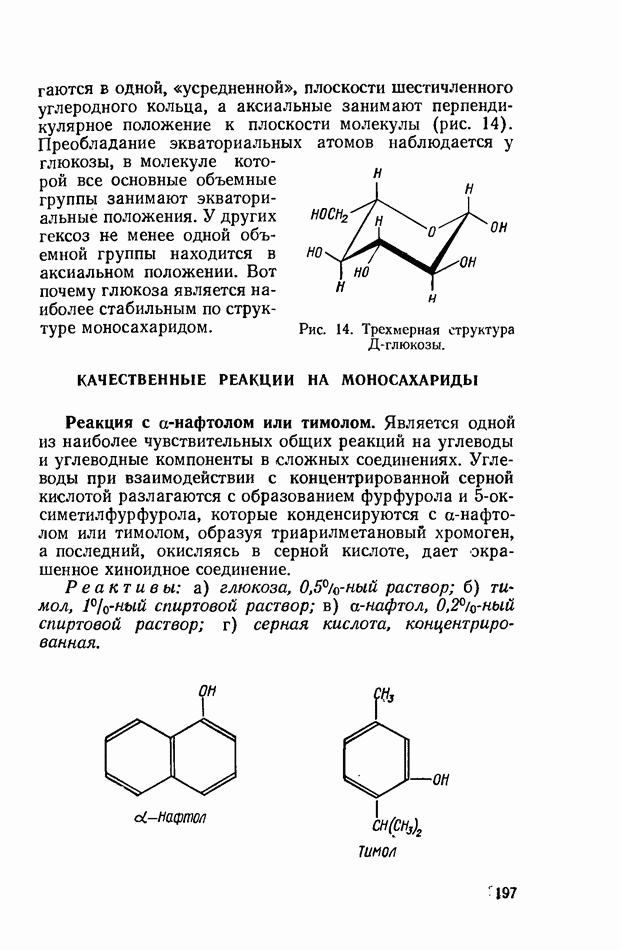
Разделение белковых фракций сыворотки крови с помощью электрофореза в полиакриламидном геле.
Этим методом можно разделить сывороточный белок на 18— 25 фракций, которые располагаются на столбике геля в следующей последовательности:
1) находящаяся в авангарде фракция преальбуминов;
2) альбумины (очень широкие полосы);
3)  полосы);
полосы);
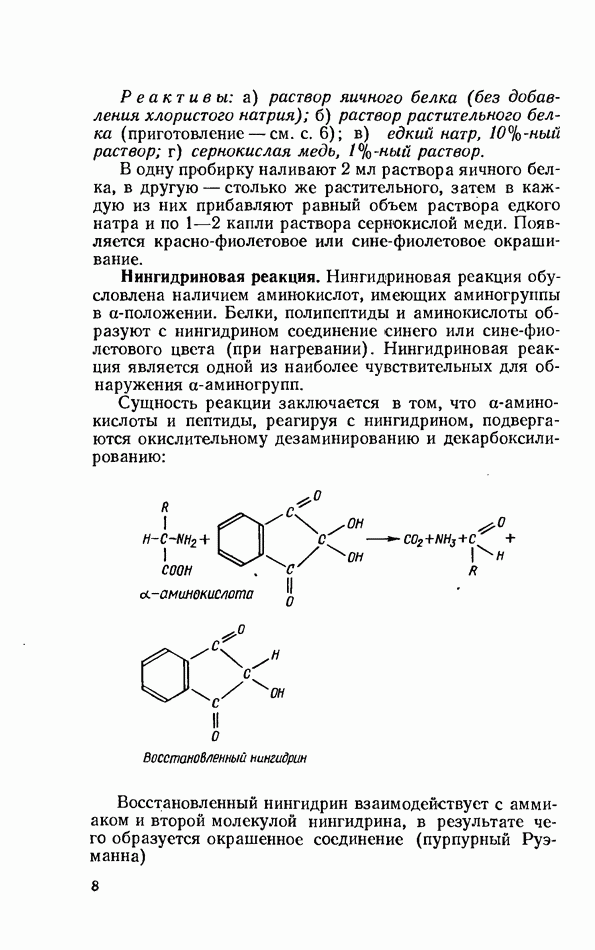
4) 
5)  -глобулины (фракции 4 и 5 образуют широкие, интенсивно окрашенные полосы)
-глобулины (фракции 4 и 5 образуют широкие, интенсивно окрашенные полосы) 
6)  -глобулины (16 тонких полос, расположенных близко друг к Другу);
-глобулины (16 тонких полос, расположенных близко друг к Другу);
7) угглобулины (остаются на старте).

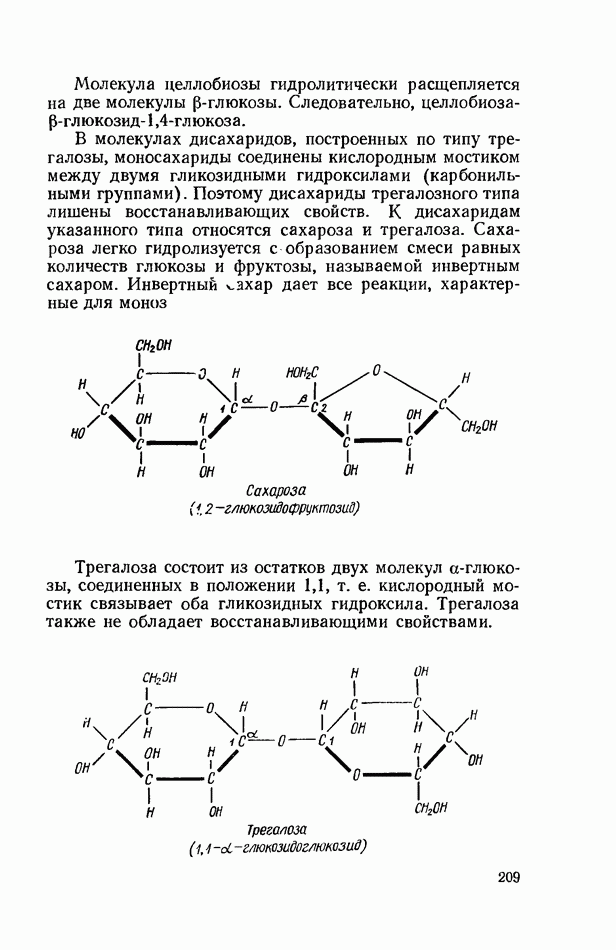
Рис. 6. Прибор для электрофореза в полиакриламидном геле (схема): 1 — крышка аппарата; 2— верхняя часть; 3 — нижняя часть; 4 - трубка с гелем; 5 — электрод; 6 - уровень буферной смеси; 7 — уплотняющая резиновая муфта.
Реактивы, материалы, аппаратура: а) сыворотка крови. Свежую кровь крупного рогатого скота взбалтывают со стеклянными бусами в течение 10—12 мин., после чего сыворотку сливают и центрифугируют 15 мин. со скоростью 3000 об/мин. Осветленную сыворотку снимают с осадка пипеткой и хранят при температуре — 20° (в морозильной камере холодильника, установив регулятор термостата на «холод»). Для электрофореза смешивают 0,04 мл сыворотки с  -ного раствора сахарозы; б) сахароза, 40%-ный раствор; в) раствор акриламида и
-ного раствора сахарозы; б) сахароза, 40%-ный раствор; в) раствор акриламида и  г акриламида и 0,1 г метилен-бис-акриламида растворяют в 12,3 мл дистиллированной воды (соблюдать меры предосторожности— акриламид ядовит!); г) N, N, N,
г акриламида и 0,1 г метилен-бис-акриламида растворяют в 12,3 мл дистиллированной воды (соблюдать меры предосторожности— акриламид ядовит!); г) N, N, N,  -тет-раметилэтилендиамин, 0,28%-ный раствор (по объему). Сохраняют в холодильнике; д) над сернокислый аммоний, 0,14%-ный раствор (весо-объемный). Перед употреблением готовят 5 мл раствора; е) трис-глициновая буферная смесь для приготовления геля: 0,29 г глицина (гликокол-ла) и 0,06 г
-тет-раметилэтилендиамин, 0,28%-ный раствор (по объему). Сохраняют в холодильнике; д) над сернокислый аммоний, 0,14%-ный раствор (весо-объемный). Перед употреблением готовят 5 мл раствора; е) трис-глициновая буферная смесь для приготовления геля: 0,29 г глицина (гликокол-ла) и 0,06 г  растворяют в 9,8 мл воды. Хранят в холодильнике; ж) трис-глициновая буферная смесь
растворяют в 9,8 мл воды. Хранят в холодильнике; ж) трис-глициновая буферная смесь  г глицина, 0,6 г
г глицина, 0,6 г  соляной
соляной
кислоты растворяют в 97,5 мл воды. pH раствора проверяют с помощью рН-метра. Перед употреблением разбавляют дистиллированной водой в 10 раз. К каждым 100 мл разведенного буфера, которые вливают в верхнюю часть аппарата, прибавляют  водного раствора красителя бромфенолового синего; з) амидочерный 10 В: 0,1%-ный раствор на 7%-ной уксусной кислоте; и) уксусная кислота, 7%-ный раствор; к) капиллярная пипетка. Ее готовят из стеклянной трубки, которую вытягивают в капилляр длиной 8 см и диаметром 2 мм; л) пипетка с соской и ниткой, протянутой через ее канал (рис. 7); м) аппарат для электрофореза (см. рис. 6); н) микропипетка с делениями на 0,005 мл; о) плоская кювета (из фаянса или пластмассы); п) препаровальная игла-, р) стеклянные трубки длиной 75 мм и диаметром 5 мм, имеющие «воротнички» на одном из концов (см. рис. 6); с) резиновые пробки от пенициллиновых склянок.
водного раствора красителя бромфенолового синего; з) амидочерный 10 В: 0,1%-ный раствор на 7%-ной уксусной кислоте; и) уксусная кислота, 7%-ный раствор; к) капиллярная пипетка. Ее готовят из стеклянной трубки, которую вытягивают в капилляр длиной 8 см и диаметром 2 мм; л) пипетка с соской и ниткой, протянутой через ее канал (рис. 7); м) аппарат для электрофореза (см. рис. 6); н) микропипетка с делениями на 0,005 мл; о) плоская кювета (из фаянса или пластмассы); п) препаровальная игла-, р) стеклянные трубки длиной 75 мм и диаметром 5 мм, имеющие «воротнички» на одном из концов (см. рис. 6); с) резиновые пробки от пенициллиновых склянок.

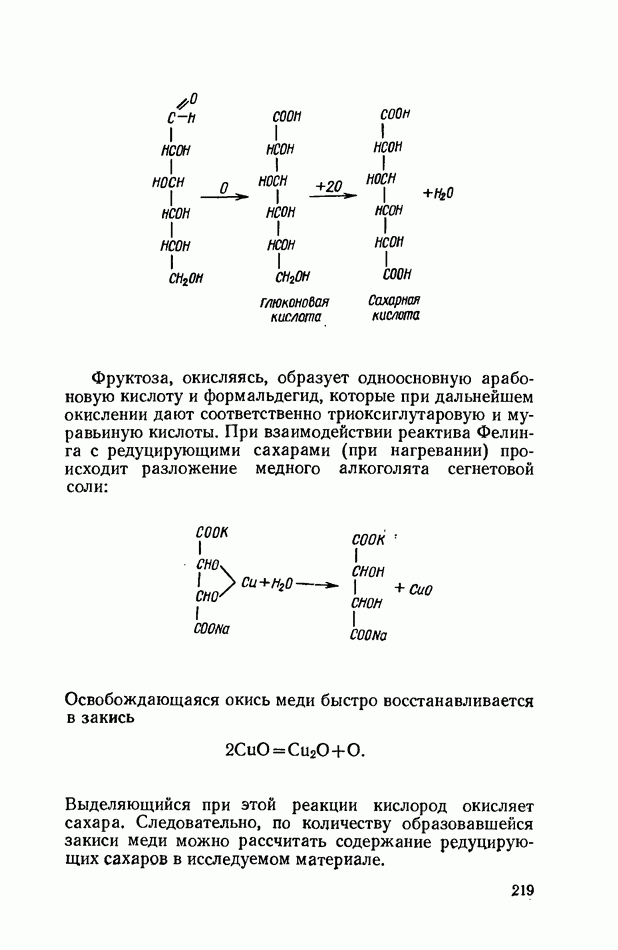
Рис. 7. Пипетка с соской и ниткой, протянутой через ее канал.
Подготовка трубок. Четыре стеклянные трубки закрепляют «воротничками» в пробках от пенициллиновых склянок. На расстоянии 18 мм от верхнего конца трубок карандашом «стеклограф» наносят риски. Трубки ставят в штатив. С помощью капиллярной пипетки наливают раствор сахарозы на 2 мм выше верхнего края пробок, не касаясь пробки кончиком пипетки.
Приготовление геля. 2 мл раствора акрила-мида и метилен-бис-акриламида смешивают с 1 мл раствора тетраметилэтилендиамина, 4 мл раствора надсернокислого аммония и 1 мл трис-глицинового буфера. Полученной смесью (с помощью капиллярной пипетки) осторожно наполняют трубки до рисок, нанесенных ранее. Кончик пипетки при этом упирают в стенку трубки над самой поверхностью раствора сахарозы. Поверх слоя смеси вносят (пипеткой с ниткой) слой воды в 0,5-1 см, касаясь ниткой стенки трубки у самой поверхности смеси. При этом следят, чтобы сохранялась четкая граница между водой и полимеризующейся смесью. По мере полимеризации эта граница смазывается, и лишь через 1 ч после
завершения процесса она снова становится четко различимой.
Чтобы поверхность геля была идеально гладкой, трубки во время, полимеризации нельзя сдвигать с места. После окончания реакции воду осторожно отсасывают с помощью тонкой пипетки, трубки вынимают из пробок и устанавливают в верхней части аппарата для электрофореза (см. рис. 6).
Электрофорез. Нижнюю часть аппарата наполняют буфером, pH которого равен 8,1. Верхнюю часть переворачивают дном кверху и в трубки с гелем осторожно вводят буфер так, чтобы, не было пузырьков воздуха. После этого ее снова устанавливают на нижней, следя, чтобы в нижние концы трубок не проник воздух. Затем наливают буфер в верхнюю часть прибора. Слой жидкости должен быть на 1 см выше верхнего края трубок. Пользуясь тонкой пипеткой, удаляют пузырьки воздуха из верхней части трубок. Микропипеткой вносят в каждую трубку по 15 мкл разведенной сыворотки, касаясь кончиком пипетки стенки трубки над самой поверхностью геля. Сыворотку вводят в трубку очень медленно и осторожно, следя за тем, чтобы не произошло ее смешения с буфером.
В верхнюю часть аппарата осторожно доливают еще немного буферной смеси и закрывают крышкой. Аппарат присоединяют к источнику питания (положительный электрод — в нижней части аппарата, отрицательный — в верхней) и устанавливают такое напряжение, чтобы на каждую трубку с гелем приходилось 1—2 мА. Когда буфер проникнет в гель на 1—2 мм (о чем будет свидетельствовать окрашенное кольцо), увеличивают напряжение так, чтобы сила тока составляла 4 мА на трубку. Ток пропускают до тех пор, пока окрашенное кольцо буфера не достигнет уровня, отстоящего на 5 мм от нижнего конца геля.
Окрашивание белковых фракций. В пластмассовую или фаянсовую кювету наливают воду. Держа трубки под водой, вынимают столбики геля, осторожно продвигая препаровальную иглу между гелем и стенкой трубки, и сразу же переносят их на 30—60 мин. в пробирки с раствором амидочерного. Окрашенные столбики ополаскивают водопроводной водой, избыток красителя удаляют с помощью раствора уксусной кислоты,
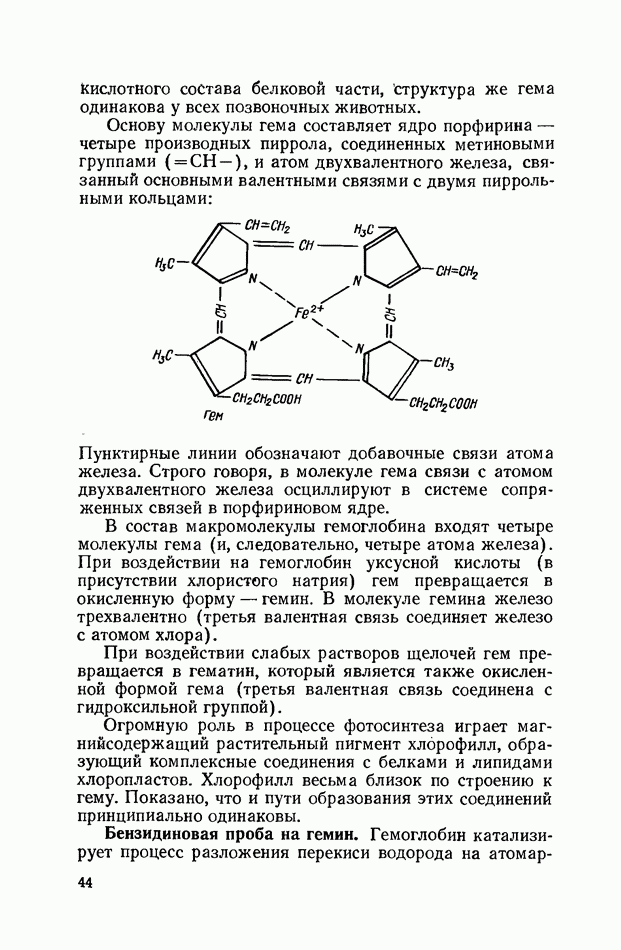
свежие порции которого все время подливают в пробирки. Окрашенные столбики хранят в 7%-ном растворе уксусной кислоты. Положение отдельных фракций белков устанавливают, руководствуясь данными, приведенными на с. 40.
| << Предыдущий параграф | Следующий параграф >> |
- Раздел I. ХИМИЯ АМИНОКИСЛОТ, ПЕПТИДОВ И БЕЛКОВ
- Приготовление растворов белка
- Цветные реакции
- Исследование физико-химических свойств белковых веществ
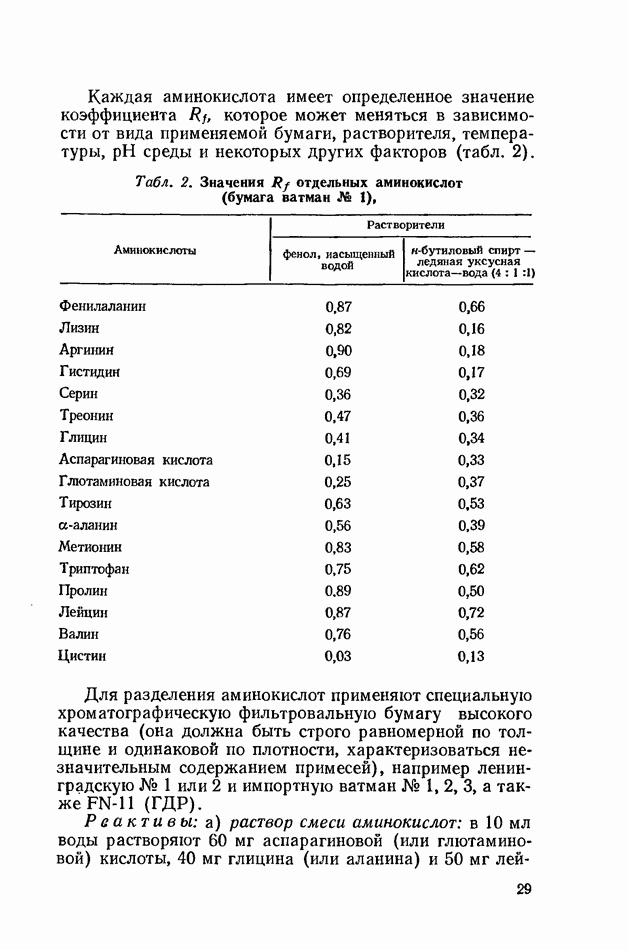
- Распределительная хроматография аминокислот на бумаге
- Разделение белка и низкомолекулярных примесей методом гельфильтрации на сефадексе G 25 (по Р. Мардашеву, А. А. Покровскому, Н. А. Павловой, с дополнениями)
- Электрофорез белков и аминокислот на бумаге
- Электрофорез белков в полиакриламидном геле (по В. Бжескому и 3. Канюга, с дополнениями)
- СЛОЖНЫЕ БЕЛКИ (ПРОТЕИДЫ)
- Гликопротеиды
- Фосфопротеиды
- Раздел II. НУКЛЕОПРОТЕИДЫ. НУКЛЕИНОВЫЕ КИСЛОТЫ
- ВЫДЕЛЕНИЕ ДЕЗОКСИРИБОНУКЛЕОПРОТЕИДОВ ИЗ ПЕЧЕНИ ИЛИ СЕЛЕЗЕНКИ
- КАЧЕСТВЕННАЯ РЕАКЦИЯ НА ДНК
- ВЫДЕЛЕНИЕ НУКЛЕОПРОТЕИДОВ ИЗ ДРОЖЖЕЙ
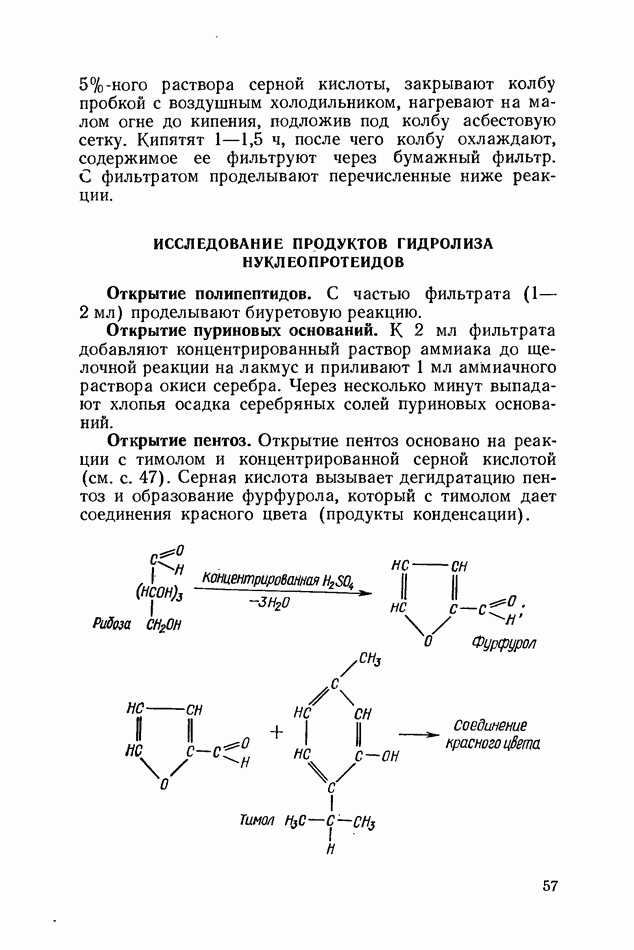
- ГИДРОЛИЗ НУКЛЕОПРОТЕИДОВ
- ИССЛЕДОВАНИЕ ПРОДУКТОВ ГИДРОЛИЗА НУКЛЕОПРОТЕИДОВ
- ОЧИСТКА И РАЗДЕЛЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ (по Шмидту и Таннгаузеру, в прописи Г. П. Георгиева)
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ДНК (по Дише)
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ РНК (по Мейбаум)
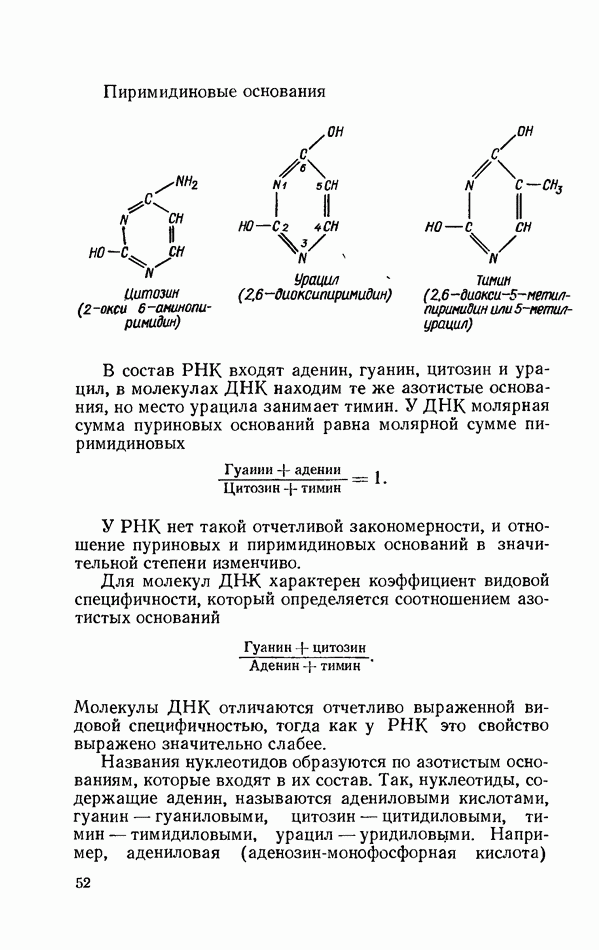
- ХРОМАТОГРАФИЯ НА БУМАГЕ ПУРИНОВЫХ И ПИРИМИДИНОВЫХ ОСНОВАНИЙ, НУКЛЕОЗИДОВ И НУКЛЕОТИДОВ
- Раздел III. ВИТАМИНЫ
- ВИТАМИНЫ ГРУППЫ А
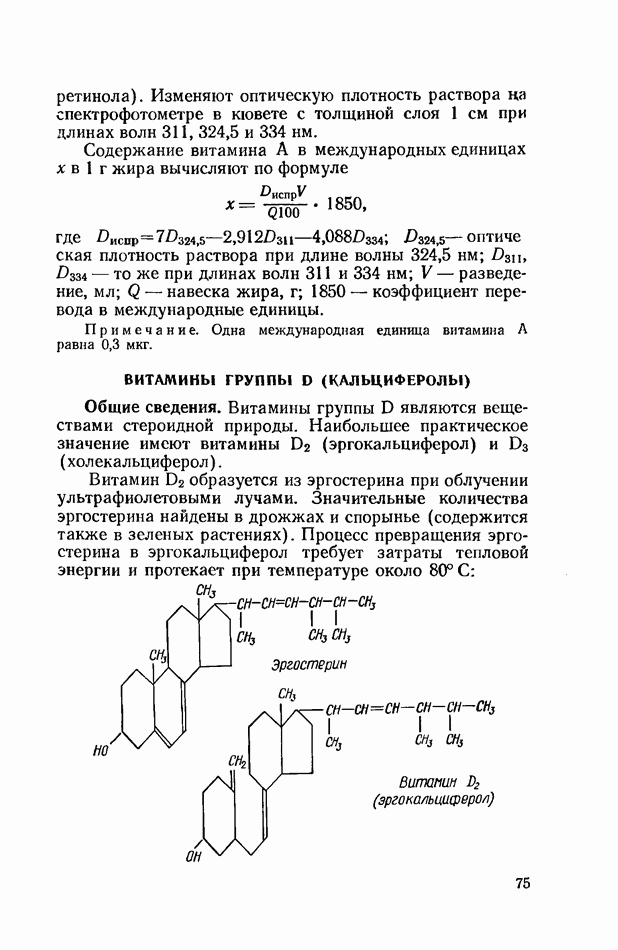
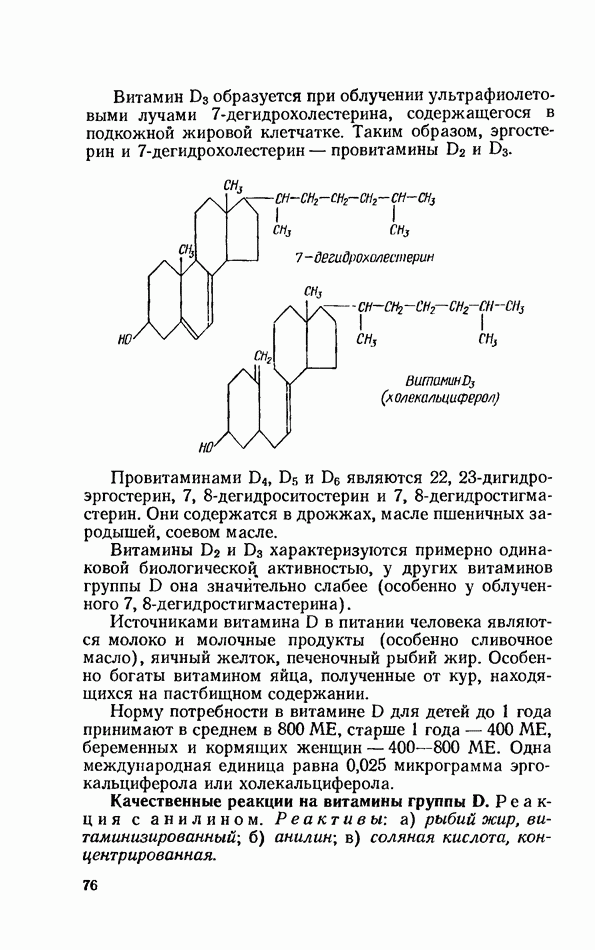
- ВИТАМИНЫ ГРУППЫ D (КАЛЬЦИФЕРОЛЫ)
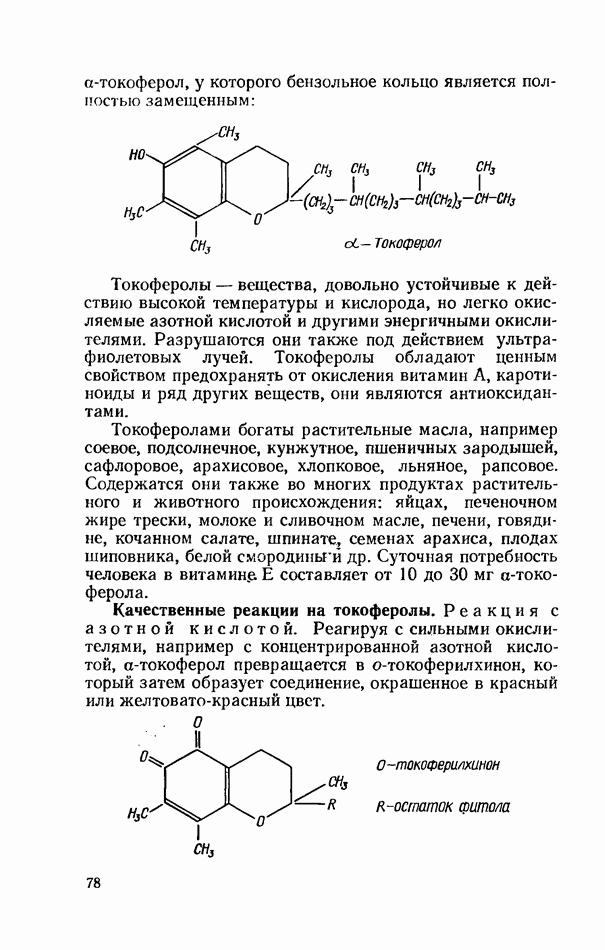
- ВИТАМИНЫ ГРУППЫ Е (ТОКОФЕРОЛЫ)
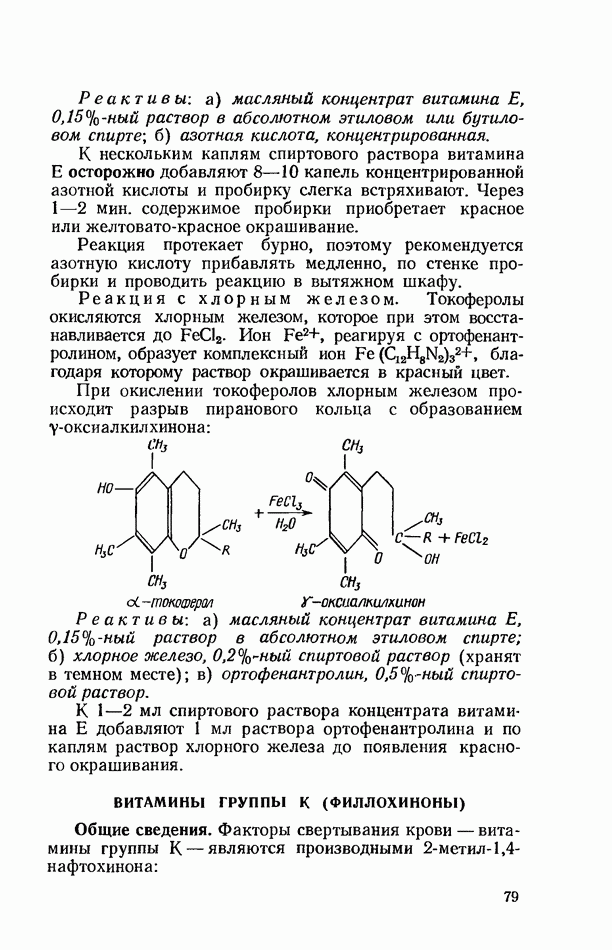
- ВИТАМИНЫ ГРУППЫ К (ФИЛЛОХИНОНЫ)
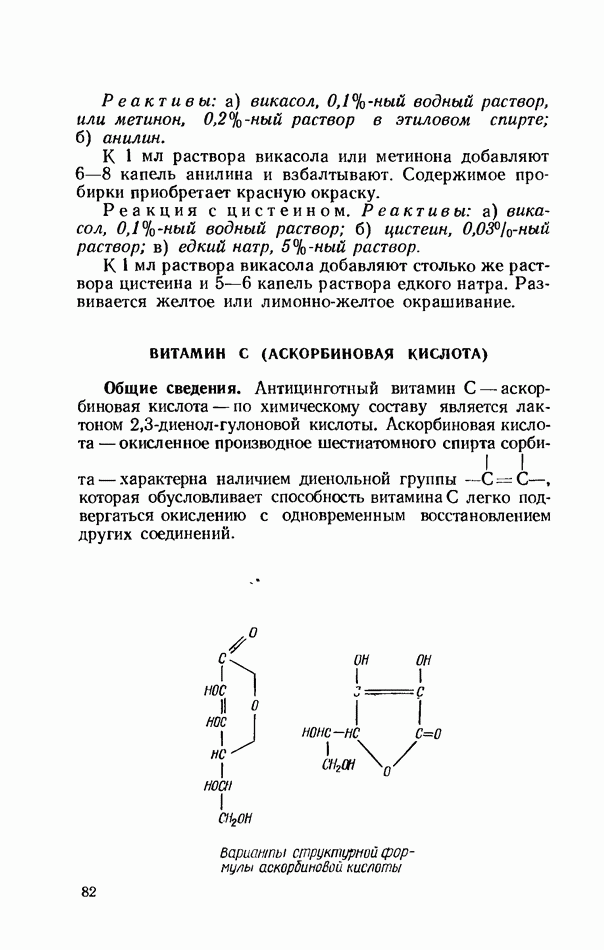
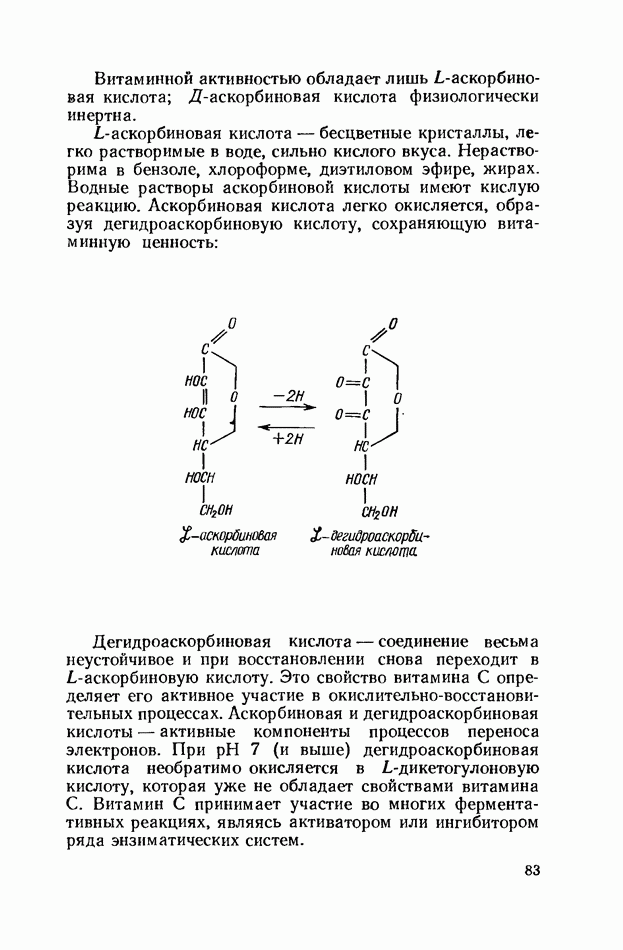
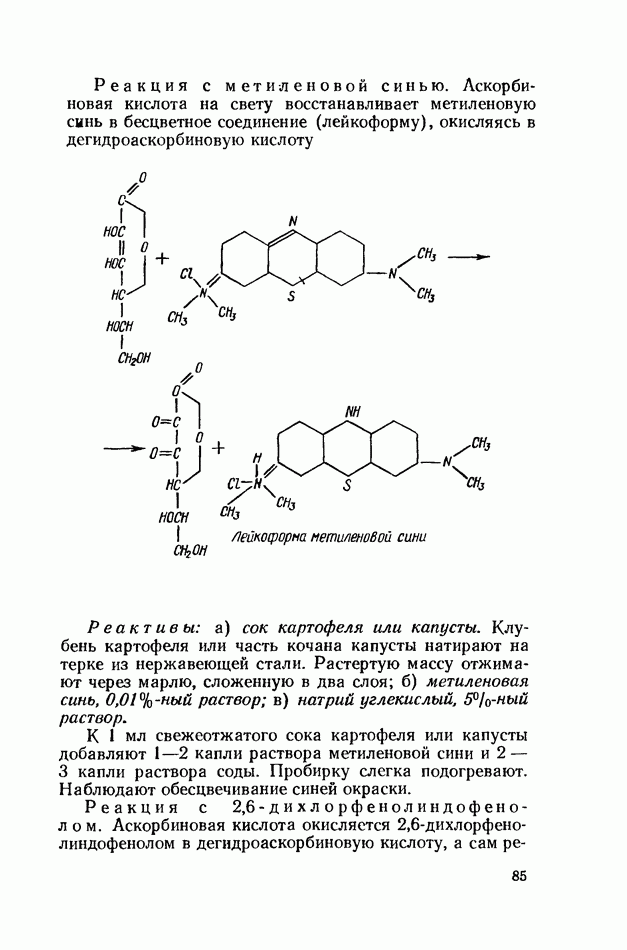
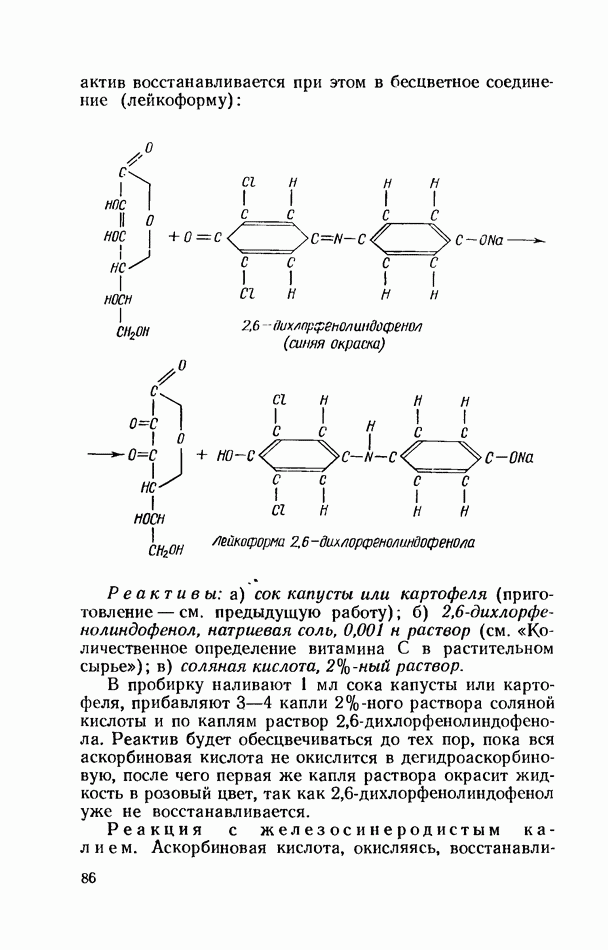
- ВИТАМИН С (АСКОРБИНОВАЯ КИСЛОТА)
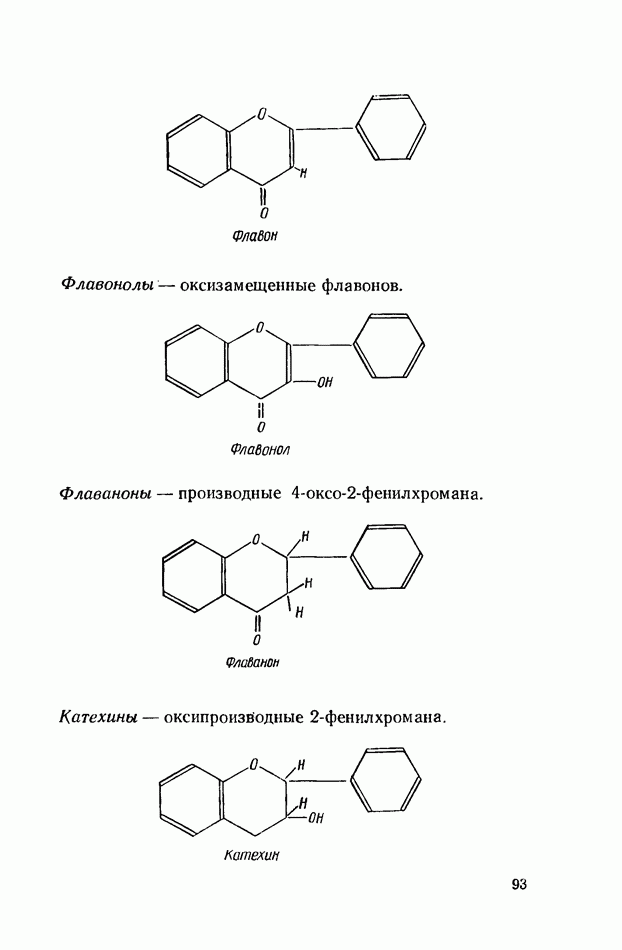
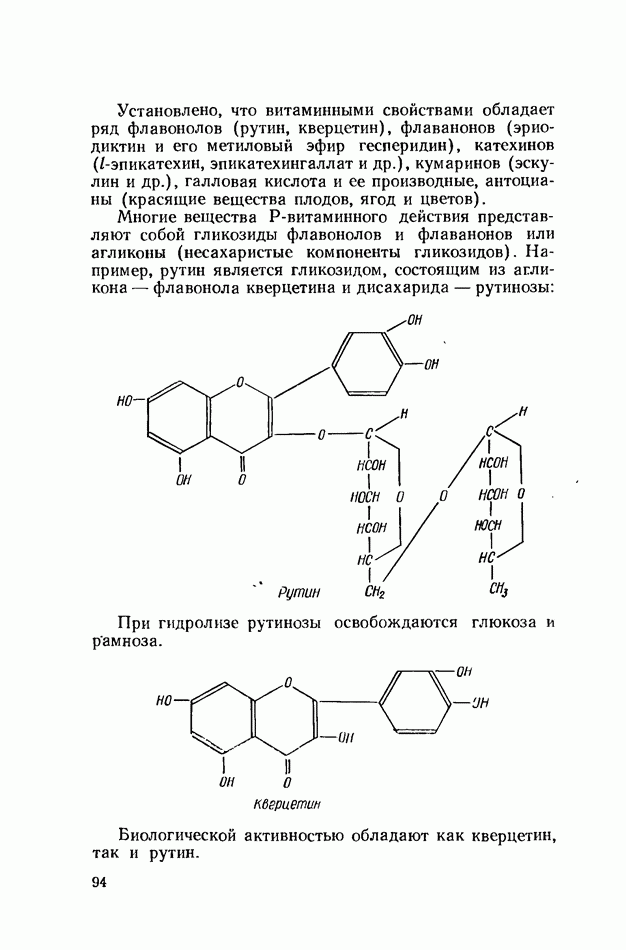
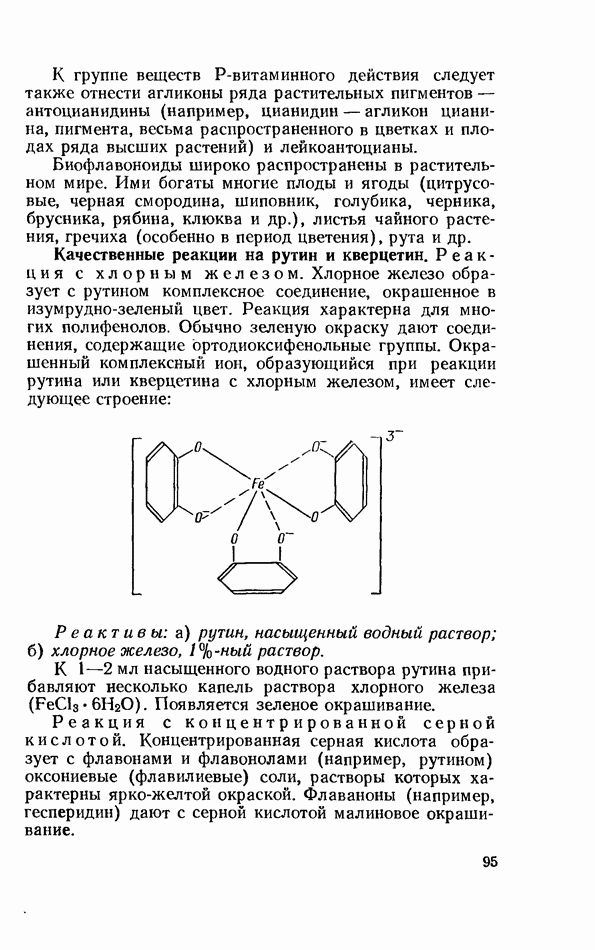
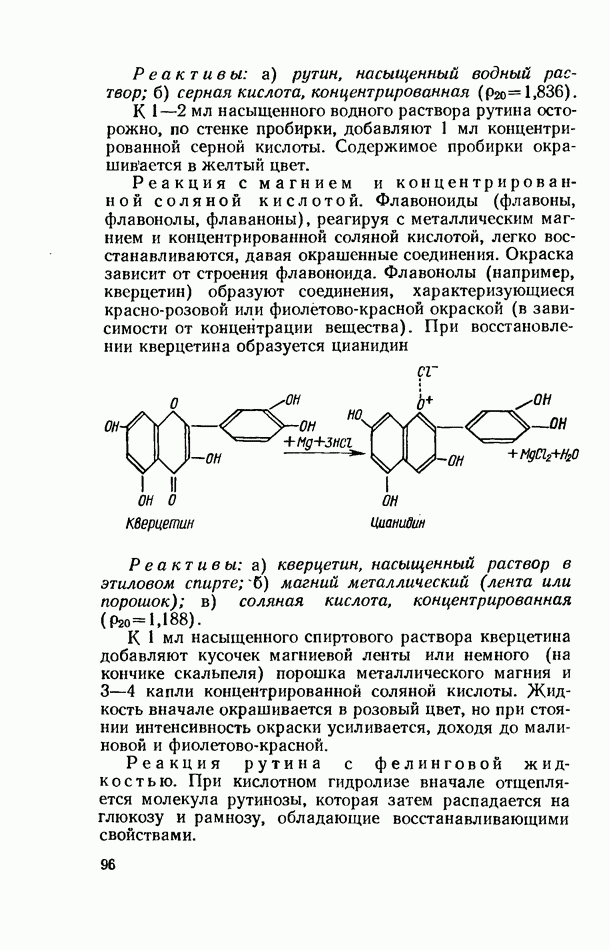
- БИОФЛАВОНОИДЫ (ВЕЩЕСТВА Р-ВИТАМИННОГО ДЕЙСТВИЯ)
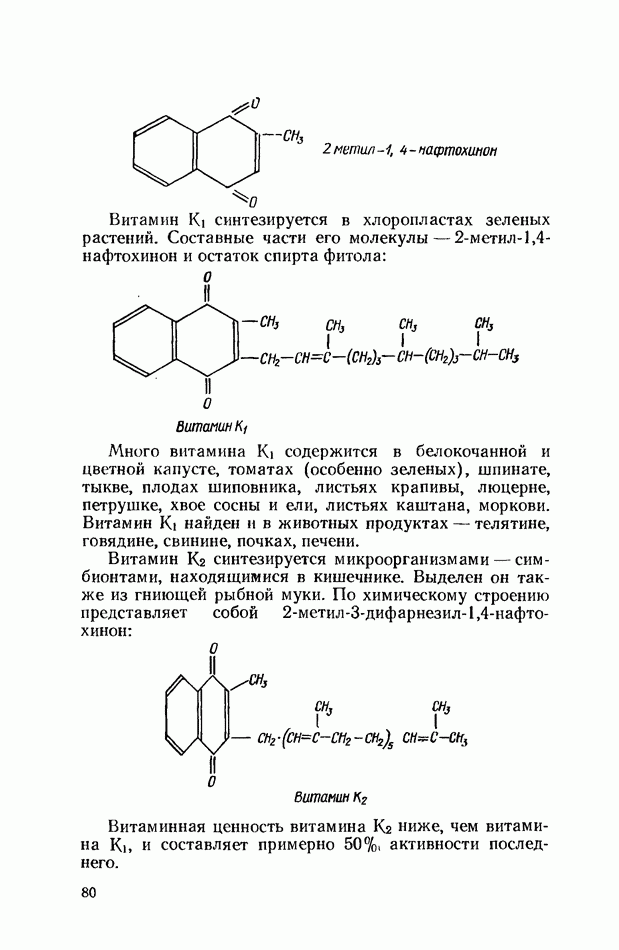
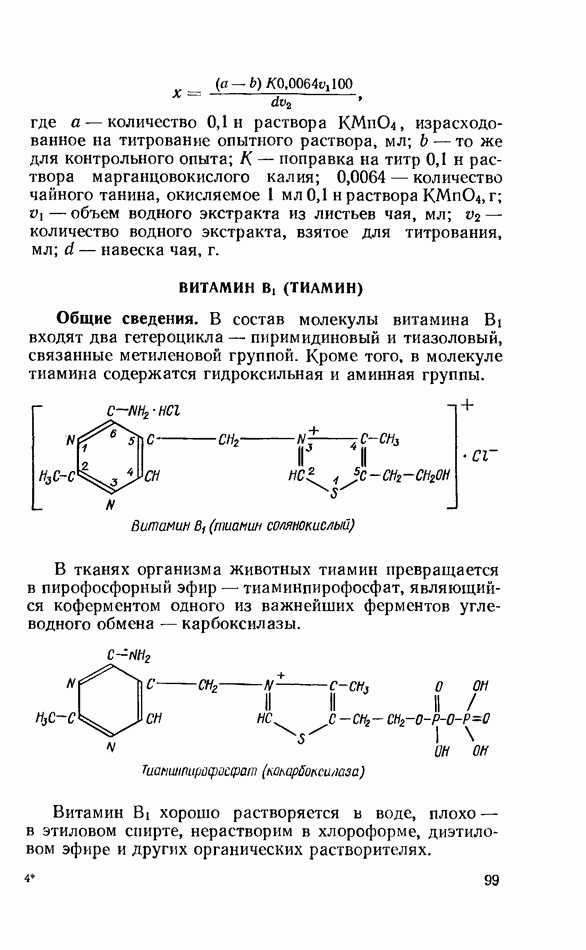
- ВИТАМИН В: (ТИАМИН)
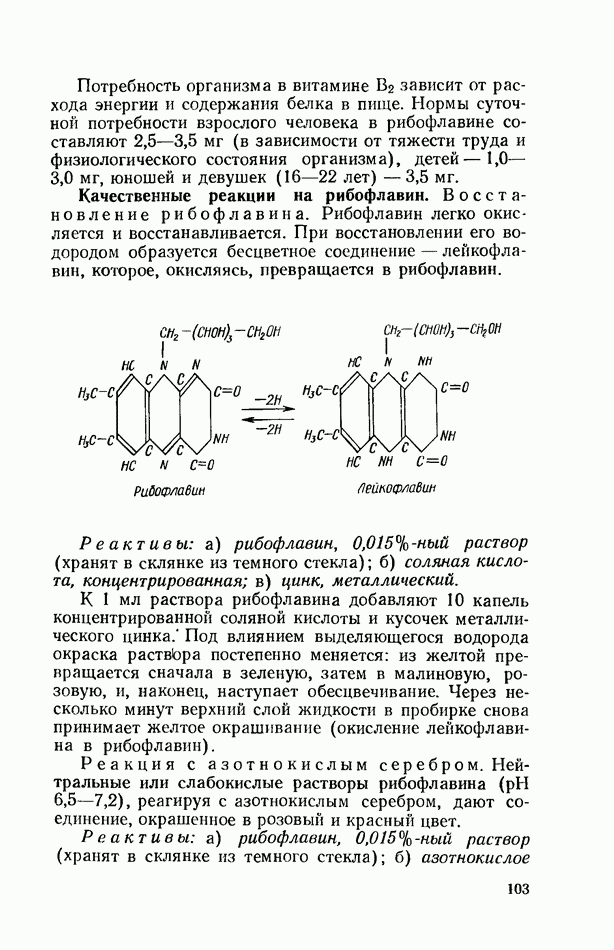
- ВИТАМИН В2 (РИБОФЛАВИН)
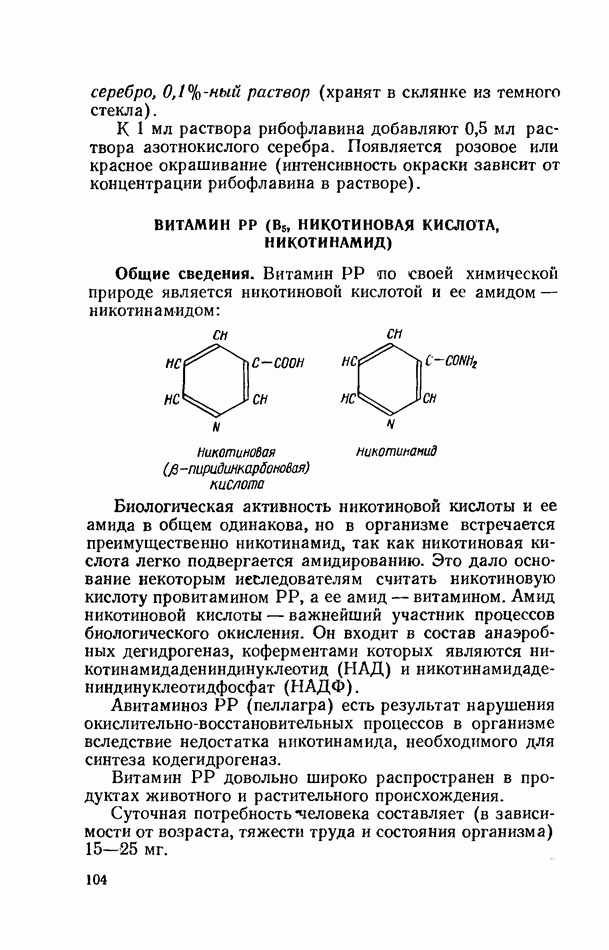
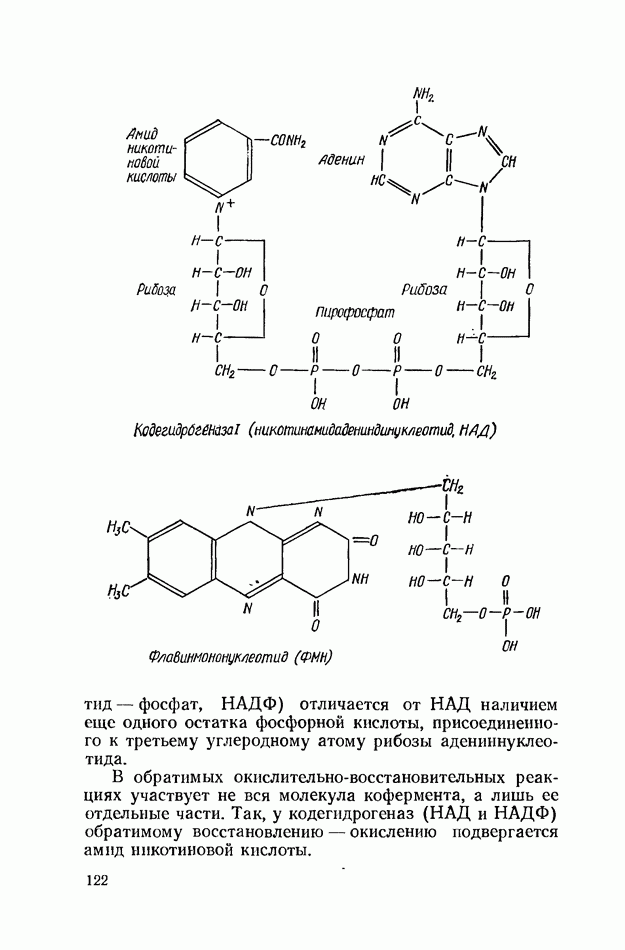
- ВИТАМИН РР (В5, НИКОТИНОВАЯ КИСЛОТА, НИКОТИНАМИД)
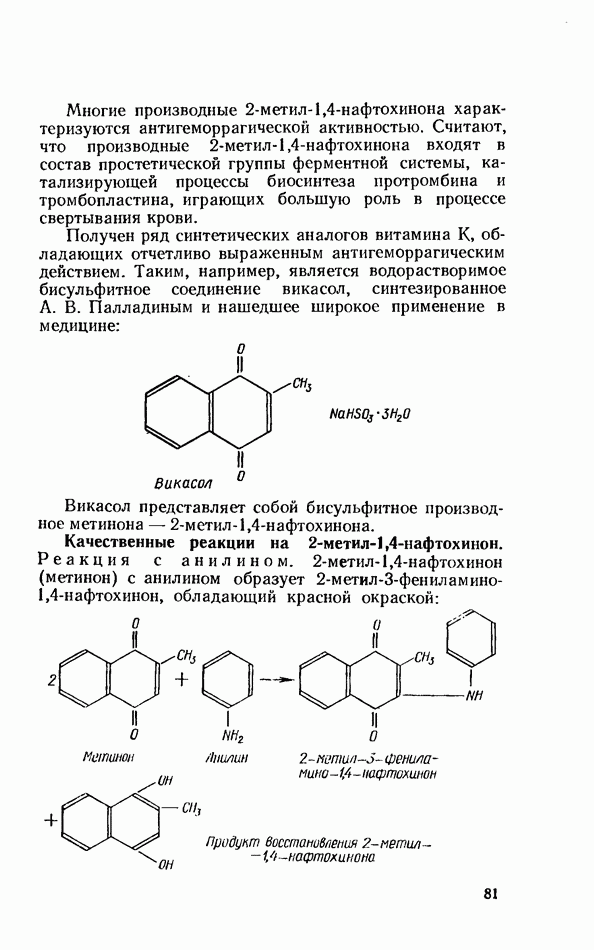
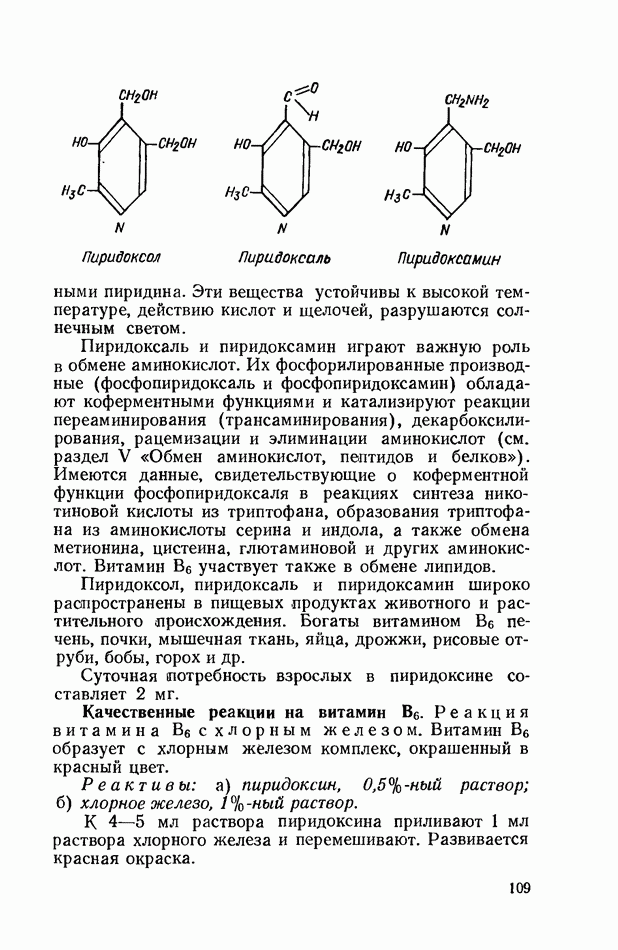
- ВИТАМИН В6 (ПИРИДОКСИН)
- Раздел IV. ФЕРМЕНТЫ (ЭНЗИМЫ)
- ИССЛЕДОВАНИЕ ОБЩИХ СВОЙСТВ ФЕРМЕНТОВ
- ОПРЕДЕЛЕНИЕ АКТИВНОСТИ ГИДРОЛИТИЧЕСКИХ ФЕРМЕНТОВ (ГИДРОЛАЗ)
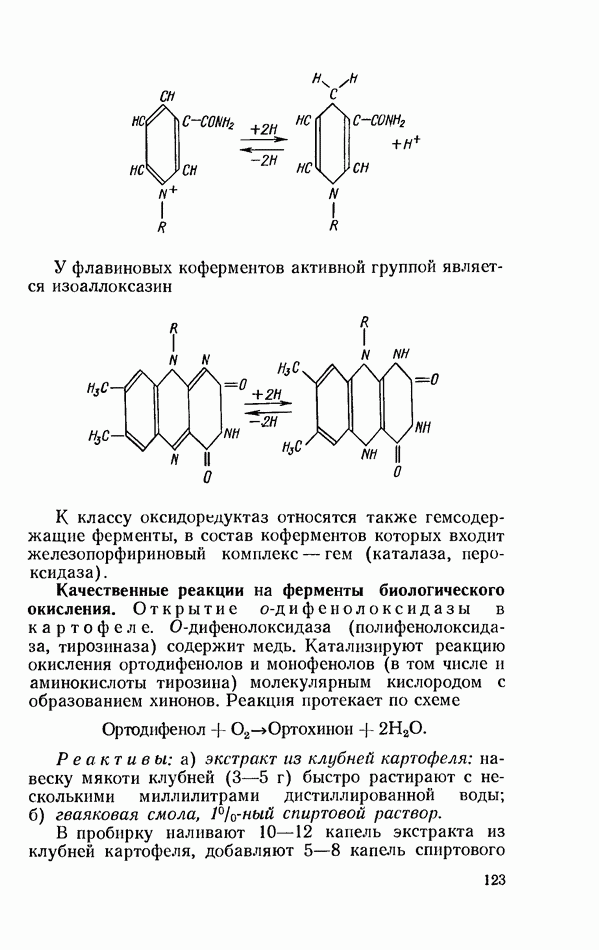
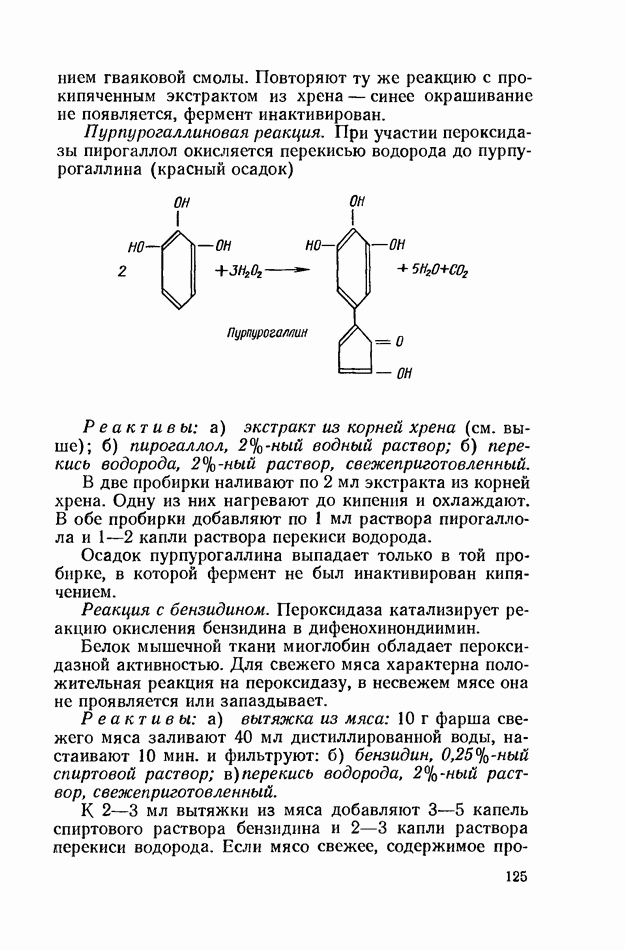
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ФЕРМЕНТЫ (ОКСИДОРЕДУКТАЗЫ)
- Раздел V. ОБМЕН АМИНОКИСЛОТ, ПЕПТИДОВ И БЕЛКОВ
- ОПРЕДЕЛЕНИЕ ОБЩЕГО АЗОТА ПО КЪЕЛЬДАЛЮ (МИКРОМЕТОД)
- ОПРЕДЕЛЕНИЕ БЕЛКОВОГО И НЕБЕЛКОВОГО АЗОТА
- БЫСТРЫЙ МЕТОД КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ БЕЛКОВ
- ОПРЕДЕЛЕНИЕ АЗОТА АМИНОКИСЛОТ
- ОПРЕДЕЛЕНИЕ СВОБОДНЫХ АМИНОКИСЛОТ В МЫШЕЧНОЙ ТКАНИ МЕТОДОМ ТОНКОСЛОЙНОЙ ХРОМАТОГРАФИИ (по Г. В. Колоболотскому)
- ГИДРОЛИТИЧЕСКОЕ РАСЩЕПЛЕНИЕ БЕЛКА ФЕРМЕНТАМИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
- ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
- ПЕРЕАМИНИРОВАНИЕ (ТРАНСАМИНИРОВАНИЕ) АМИНОКИСЛОТ
- Раздел VI. ХИМИЯ И ОБМЕН ЛИПИДОВ
- ЖИРЫ (НЕЙТРАЛЬНЫЕ ЖИРЫ)
- ФОСФАТИДЫ, ИЛИ ФОСФОЛИПИДЫ
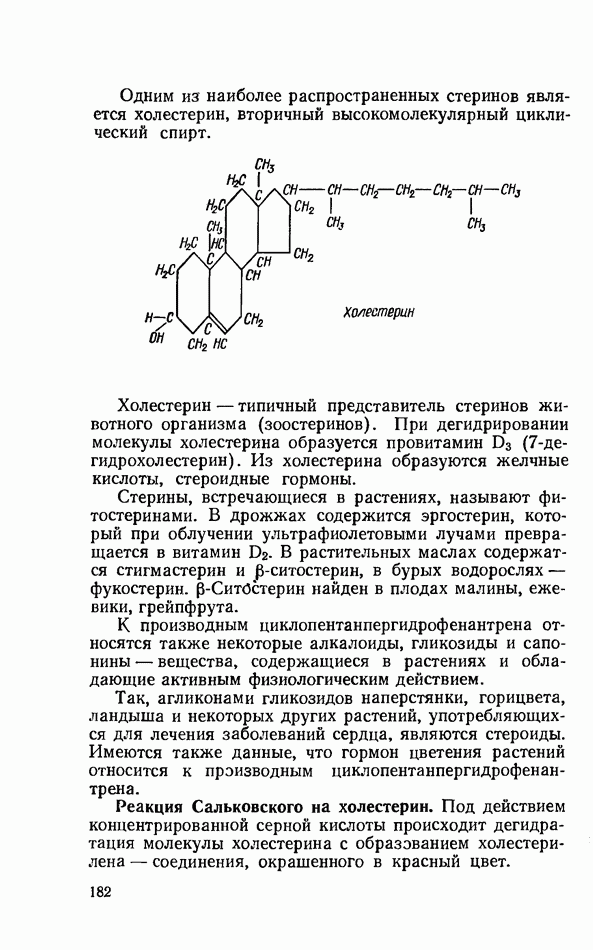
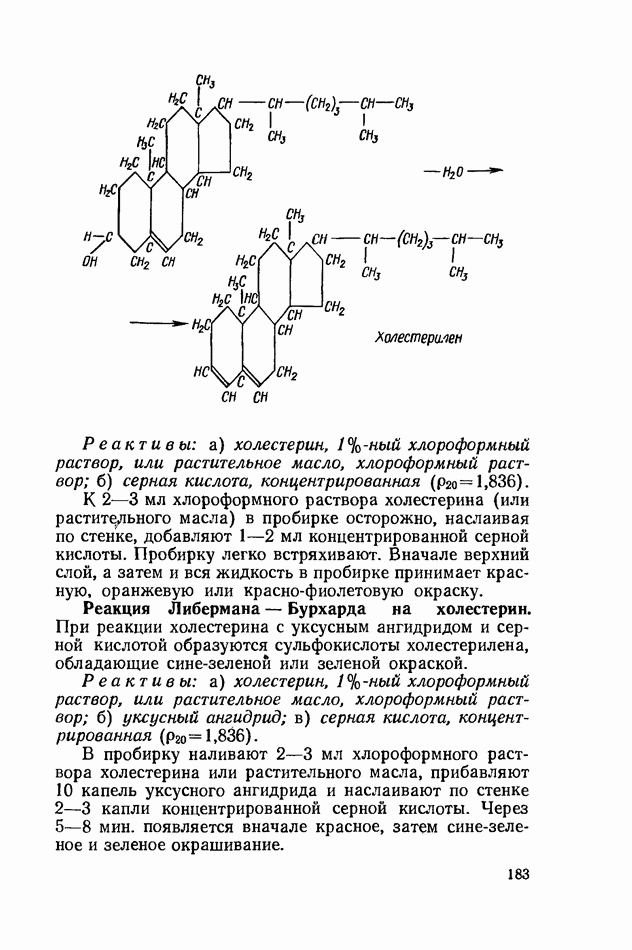
- СТЕРИНЫ
- ФЕРМЕНТАТИВНЫЙ ГИДРОЛИЗ ЛИПИДОВ
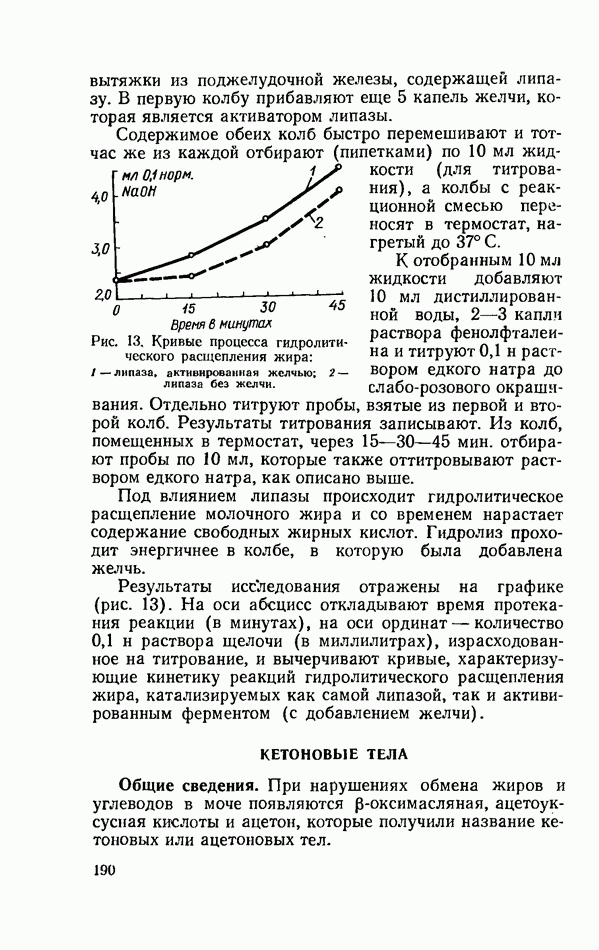
- КЕТОНОВЫЕ ТЕЛА
- Раздел VII. ХИМИЯ И ОБМЕН УГЛЕВОДОВ
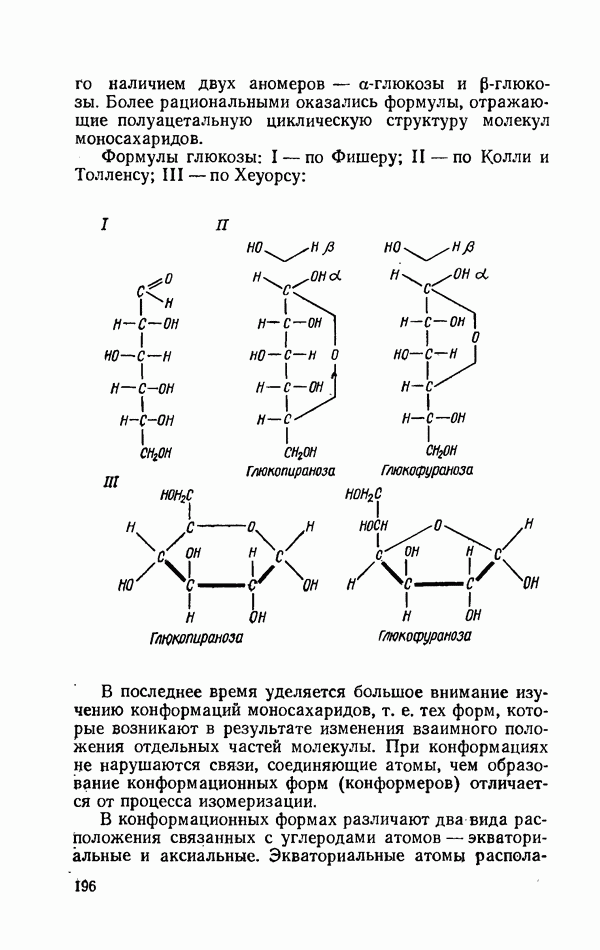
- КАЧЕСТВЕННЫЕ РЕАКЦИИ НА МОНОСАХАРИДЫ
- ОБЩИЕ РЕАКЦИИ ДИСАХАРИДОВ
- ВЫСШИЕ ПОЛИСАХАРИДЫ
- ОПРЕДЕЛЕНИЕ РЕДУЦИРУЮЩИХ (ВОССТАНАВЛИВАЮЩИХ) САХАРОВ В РАСТИТЕЛЬНОМ МАТЕРИАЛЕ
- ФОТОМЕТРИЧЕСКИЕ МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ РЕДУЦИРУЮЩИХ САХАРОВ
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ САХАРОВ В РАСТИТЕЛЬНОМ МАТЕРИАЛЕ С ПОМОЩЬЮ ХРОМАТОГРАФИИ НА БУМАГЕ (по О. А. Павлиновой)
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ГЛЮКОЗЫ В КРОВИ (по Хагедорну — Иеисену)
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ КРАХМАЛА
- ИССЛЕДОВАНИЕ АНАЭРОБНОГО РАСПАДА ГЛИКОГЕНА ИЛИ КРАХМАЛА
- ОПРЕДЕЛЕНИЕ ПИРОВИНОГРАДНОЙ КИСЛОТЫ В МОЧЕ
- Раздел VIII. ГОРМОНЫ
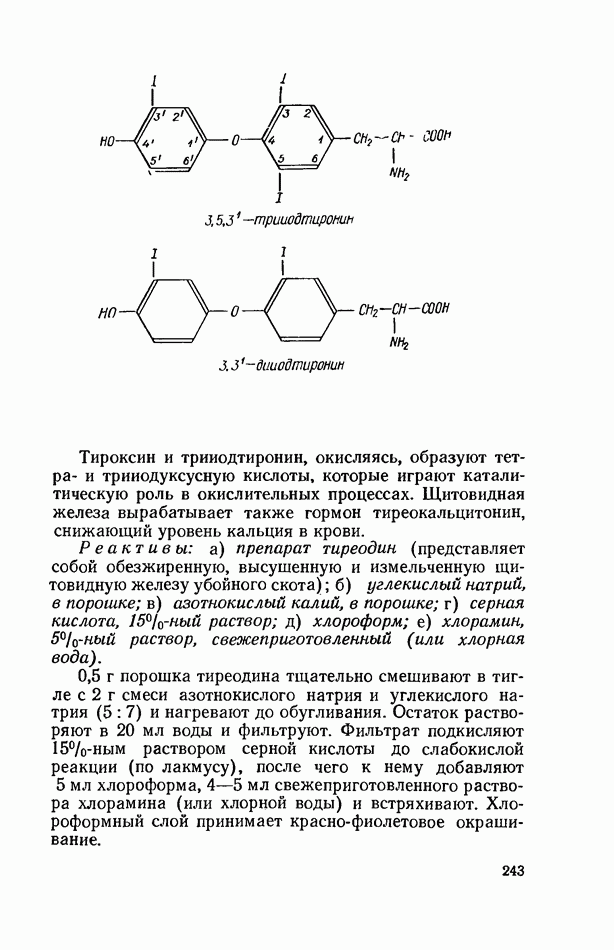
- ОТКРЫТИЕ ИОДА В ЩИТОВИДНОЙ ЖЕЛЕЗЕ
- ГОРМОНЫ МОЗГОВОГО СЛОЯ НАДПОЧЕЧНИКОВ
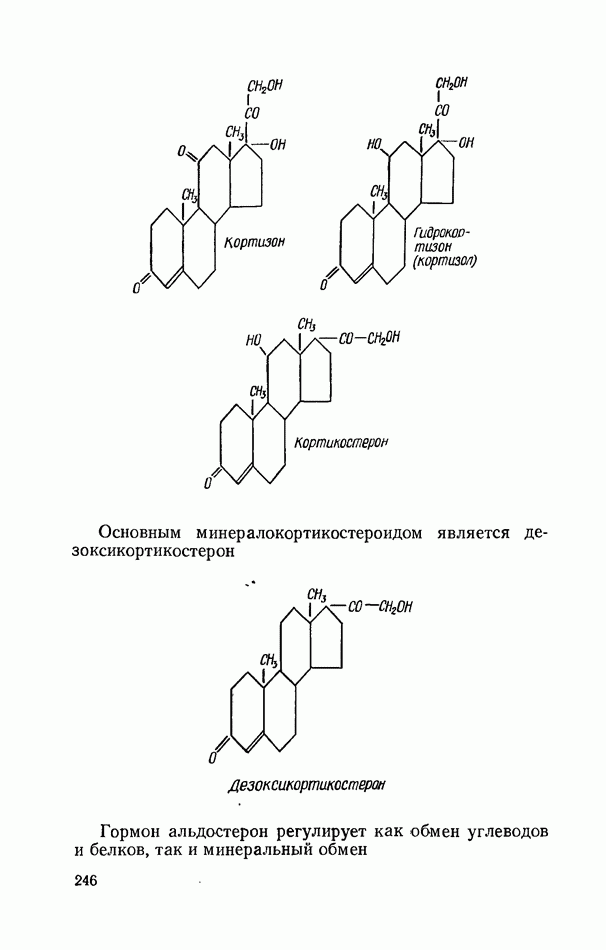
- ГОРМОНЫ КОРКОВОГО СЛОЯ НАДПОЧЕЧНИКОВ (КОРТИКОСТЕРОИДЫ)
- ГОРМОНЫ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
- Раздел IX. ОБМЕН МИНЕРАЛЬНЫХ ВЕЩЕСТВ
- ОПРЕДЕЛЕНИЕ КАЛЬЦИЯ В СЫВОРОТКЕ КРОВИ
- ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ КАЛЬЦИЯ В МОЛОКЕ
- ОПРЕДЕЛЕНИЕ ОБЩЕГО СОДЕРЖАНИЯ ФОСФОРА В МОЛОКЕ
- ОПРЕДЕЛЕНИЕ ЖЕЛЕЗА В ПЛАЗМЕ ИЛИ СЫВОРОТКЕ КРОВИ (по прописи П. А. Розенберг и Н. К. Бялко)
- ОПРЕДЕЛЕНИЕ ХЛОРИДОВ В ПИЩЕВЫХ ПРОДУКТАХ (по А. С. Вечеру и В. В. Малоян)
- ЛИТЕРАТУРА
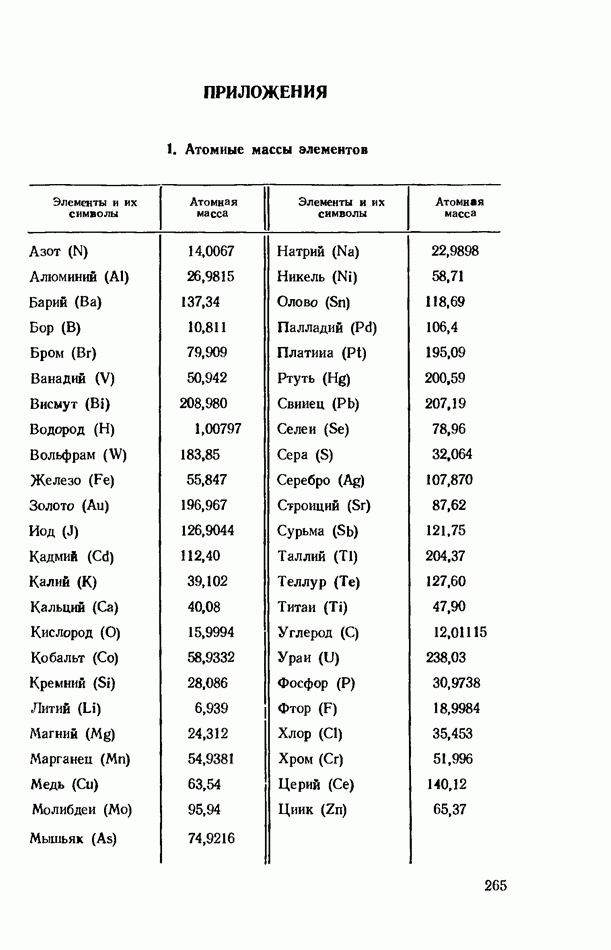
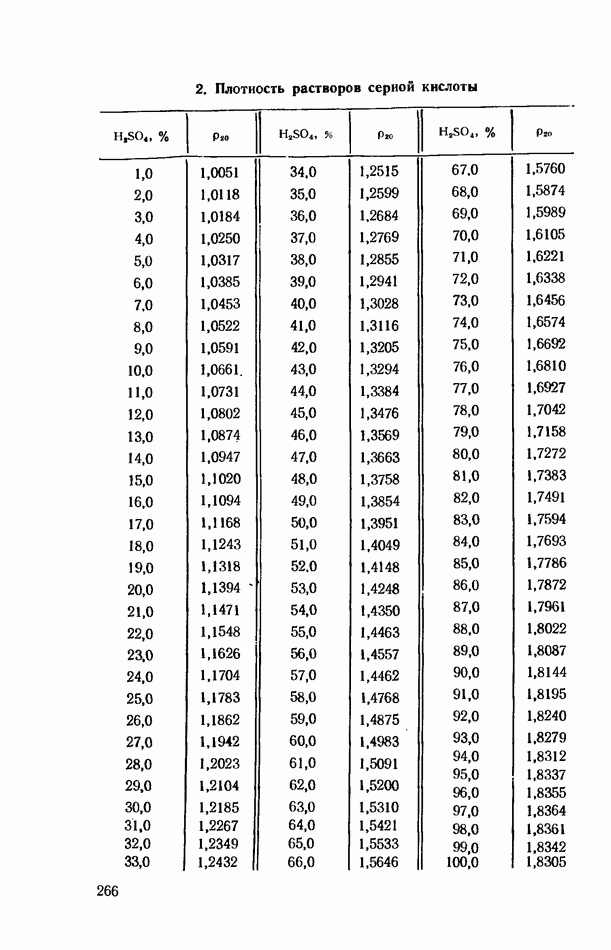
- ПРИЛОЖЕНИЯ