| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
5. Силы притяжения Ван-дер-Ваальса
Гайтлер и Лондон сводят силы, действующие между двумя атомами, к обменной энергии пар электронов, принадлежащих одновременно обоим атомам. Так как собственные функции, а следовательно, и плотность зарядов электронных "облаков" экспоненциально падают по мере удаления от ядра, то и величина обменного интеграла обоих атомов, по крайней мере для больших расстояний, уменьшается по тому же закону. Поэтому соответствующие силы притяжения и отталкивания имеют сравнительно маленький радиус действия и практически исчезают при расстоянии от ядра, равном нескольким А.
Но, кроме них, между атомами действуют и другие силы, величина которых при увеличении расстояния падает более медленно, благодаря чему на больших расстояниях  действие преобладает по сравнению с действием обменных сил. Силы эти — результат электрической поляризации обоих атомов. Такие же силы притяжения входят в уравнение состояния газа Ван-дер-Ваальса. Мы будем называть их поэтому силами Ван-дер-Ваальса.
действие преобладает по сравнению с действием обменных сил. Силы эти — результат электрической поляризации обоих атомов. Такие же силы притяжения входят в уравнение состояния газа Ван-дер-Ваальса. Мы будем называть их поэтому силами Ван-дер-Ваальса.
Квантовомеханическая теория этих сил была создана Лондоном и Эйзеншитцем. Ниже мы изложим коротко основное содержание этой теории.
Оба атома  настолько удалены друг от друга, что их собственные функции не перекрываются. Тогда можно пренебречь обменными силами между атомами и
настолько удалены друг от друга, что их собственные функции не перекрываются. Тогда можно пренебречь обменными силами между атомами и
невозмущенную собственную функцию нашей системы записать в виде  произведения собственных функций первого атома
произведения собственных функций первого атома  и второго Невозмущенное собственное значение будет следующим:
и второго Невозмущенное собственное значение будет следующим:

где через  обозначены энергии
обозначены энергии  состояния
состояния  состояния В. Предположим теперь, что расстояние
состояния В. Предположим теперь, что расстояние  между обоими атомами остается неизменным. Построим прямоугольную систему координат
между обоими атомами остается неизменным. Построим прямоугольную систему координат  ось
ось  которой совпадает с прямой, соединяющей оба атома. Пусть
которой совпадает с прямой, соединяющей оба атома. Пусть  и С означают компоненты электрических дипольных моментов атомов. Тогда, как известно, потенциал взаимодействия будет равен:
и С означают компоненты электрических дипольных моментов атомов. Тогда, как известно, потенциал взаимодействия будет равен:

Эта энергия связи между обоими атомами, которую мы рассматриваем теперь как энергию возмущения, является причиной сил Ван-дер-Ваальса.
Рассмотрим сначала возмущение основного состояния системы под действием энергии связи. В первом приближении возмущение определяется средним значением энергии возмущения  вычисляемым с помощью невозмущенной собственной функции
вычисляемым с помощью невозмущенной собственной функции 

где для сокращения обозначено:

Все эти величины равны нулю, так как невозмущенный атом в основном состоянии не имеет электрического момента. Вследствие этого в первом приближении возмущение собственного значения энергии отсутствует.
Второр приближение для энергии возмущения будет, согласно теории возмущений, выражаться формулой:

причем матричные элементы энергии возмущения  определяются следующими выражениями:
определяются следующими выражениями:

Здесь  и соответствующие величины являются матричными элементами электрических моментов обоих атомов. Они определяют также и вероятности оптического перехода. Подставляя их в уравнение для
и соответствующие величины являются матричными элементами электрических моментов обоих атомов. Они определяют также и вероятности оптического перехода. Подставляя их в уравнение для  и одновременно учитывая значения
и одновременно учитывая значения  , получим
, получим

где

Так как и числитель и знаменатель правой части этого выражения положительны  энергии атомов в основном состоянии всегда меньше
энергии атомов в основном состоянии всегда меньше  то постоянная К положительна.
то постоянная К положительна.
Следовательно, силы Ван-дер-Ваальса, действующие между атомами в основном состоянии, являются силами притяжения. Определяющий их потенциал обратно пропорционален шестой степени расстояния между ядрами.
Можно легко оценить порядок величины К. Например, для двух щелочных металлов, в предположении, что
 спин можно не учитывать;
спин можно не учитывать;
 следует принимать во внимание только переход,соответствующий резонансному излучению;
следует принимать во внимание только переход,соответствующий резонансному излучению;
с) так же, как в классической теории, этому переходу соответствует один дисперсионный электрон (сила осциллятора  получим
получим

где  длина волны резонансной линии. Отсюда для натрия
длина волны резонансной линии. Отсюда для натрия 
Для других атомов, поляризующихся менее сильно, чем атомы щелочных металлов, получаются значительно меньшие значения. Например, для водорода (по Эйзеншитцу и Лондону) 
| << Предыдущий параграф | Следующий параграф >> |
- ЧАСТЬ I. МОЛЕКУЛЫ
- 2. Полярная связь
- 3. Гомеополярное соединение. Молекула водорода
- 4. Распространение на другие молекулы
- 5. Силы притяжения Ван-дер-Ваальса
- ГЛАВА II. СПЕКТРЫ ДВУХАТОМНЫХ МОЛЕКУЛ
- 6. Общая схема термов молекулы
- 7. Правила отбора для J и v
- 8. Вращательно-колебательные полосы
- 9. Электронные полосы
- 10. Ангармоничность колебаний и диссоциация
- 11. Предиссоциация
- 12. Отклонения от свойств жесткого ротатора
- 13. Электронные термы
- 14. Квантовомеханическое исследование электронных термов
- 15. Влияние спина
- 16. Молекулы с несколькими валентными электронами
- 17. Случаи связи по Гунду
- 18. A-удвоение
- 19. Сопоставление молекулярных термов с атомными термами
- 20. Четные и нечетные термы
- 21. Симметричные и антисимметричные термы
- 22. Спин ядра
- 23. Чередование интенсивности
- 24. Пара- и орто-водород
- 25. Изотопические эффекты в полосатых спектрах
- 26. Эффекты Зеемана и Штарка в полосатых спектрах
- 27. Флуоресценция двухатомных молекул
- 28. Эффект Рамака у двухатомных молекул
- ГЛАВА III. ТЕПЛОВЫЕ СВОЙСТВА ДВУХАТОМНЫХ МОЛЕКУЛ
- 30. Распределение интенсивностей в полосах
- 31. Постоянная энтропии
- ГЛАВА IV. МНОГОАТОМНЫЕ МОЛЕКУЛЫ
- 32. Структура многоатомных молекул
- 33. Рассеяние молекулами рентгеновских лучей
- 34. Электрическая поляризуемость молекул
- 35. Электрический момент молекул
- 36. Вращательные термы многоатомных молекул
- 37. Колебания многоатомных молекул
- 38. Инфракрасные спектры многоатомных молекул
- 39. Раман-эффект многоатомных молекул
- 40. Правила отбора в колебательном эффекте Рамана
- 41. Особенности колебательных термов многоатомных молекул
- ЧАСТЬ II. КРИСТАЛЛЫ
- ГЛАВА I. ГЕОМЕТРИЯ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
- 2. Симметрия решеток
- 3. Определение структуры кристаллической решетки
- 4. Определение структуры для сложных решеток
- 5. Примеры кристаллической структуры
- ГЛАВА II. ФИЗИЧЕСКИЕ СВОЙСТВ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
- 6. Теплоемкость кристалла
- 7. Теория теплоемкости Дебая
- 8. Упругие свойства одномерной решетки
- 9. Колебания простых и сложных решеток
- 10. Инфракрасные частоты и остаточные лучи
- 11. Раман-эффект в кристаллах
- 12. Тепловое расширение и теплопроводность кристаллов
- 13. Ионная решетка
- 14. Электростатическая энергия ионной решетки
- 15. Силы отталкивания. Сравнение с экспериментом
- 16. Распространение электромагнитных волн в кристаллах
- 17. Поглощение света в кристаллах
- ЧАСТЬ III. СТАТИСТИКА И КВАНТОВАЯ ТЕОРИЯ
- 1. Обобщение принципа Больцмана
- 2. Тепловое равновесие и вероятность заполнения квантовых состояний атома или молекулы
- 3. Антистоксовы линии флуоресценции и рамановскяе линии
- 4. Средняя энергия осциллятора
- 5. Спектр черного тела
- 6. Формула Планка
- 7. Статистическое равновесие между атомами и излучением полости
- 8. Квантовал теория парамагнитного газа
- 9. Статистическое толкование термодинамических величин
- 10. Принцип Нернста
- ГЛАВА II. КВАНТОВАЯ СТАТИСТИКА ГАЗА
- 11. Фазовое пространство идеального газа
- 12. Постоянная энтропии
- 13. Тепловое ионизационное равновесие и тепловая электронная эмиссия
- 14. Новая статистика
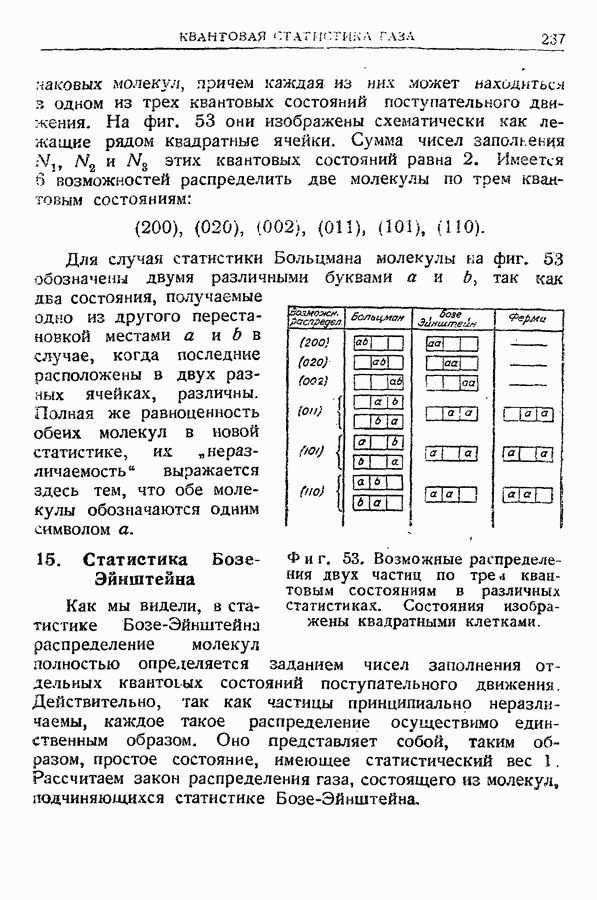
- 15. Статистика Бозе-Эйнштейна
- 16. Эйнштейновское вырождение газа
- 17. Бозевский газ световых квантов
- 18. Статистика Ферми
- 19. Статистические свойства газа Ферми
- 20. Свойства сильно вырожденного газа
- 21. Статистическое распределение электронов в атоме