| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
§ 10. Ионное произведение воды
Вода является важнейшим растворителем, широко применяемым в практике аналитической химии.
Химически чистая жидкая вода является простейшей гомогенной системой, с которой обычно начинается изучение этих систем. Угол связи в молекуле воды НОН равен  межъядерное расстояние
межъядерное расстояние  составляет 0,97 А;
составляет 0,97 А;  — 1,63 А; дипольный момент равен
— 1,63 А; дипольный момент равен  . Сильный дипольный характер молекул
. Сильный дипольный характер молекул  обусловливает особую склонность воды образовывать продукты присоединения. Диэлектрическая проницаемость воды
обусловливает особую склонность воды образовывать продукты присоединения. Диэлектрическая проницаемость воды  80,4. Для сравнения приводим значения
80,4. Для сравнения приводим значения  для некоторых других жидкостей: формамид 109,5; синильная кислота 106,8; безводная серная кислота 101; жидкий фтористый водород 83,6; муравьиная кислота 58,5; этиловый спирт 24,30; уксусная кислота 6,15; диоксан 2,2. Это указывает на то, что
для некоторых других жидкостей: формамид 109,5; синильная кислота 106,8; безводная серная кислота 101; жидкий фтористый водород 83,6; муравьиная кислота 58,5; этиловый спирт 24,30; уксусная кислота 6,15; диоксан 2,2. Это указывает на то, что  воды довольно высока по сравнению со многими жидкостями.
воды довольно высока по сравнению со многими жидкостями.
При комнатной температуре и даже при  вода обладает заметным давлением пара, которое нужно учитывать при вычислении объемов собранных над водой газов. Б жидком состоянии молекулы воды ассоциированы
вода обладает заметным давлением пара, которое нужно учитывать при вычислении объемов собранных над водой газов. Б жидком состоянии молекулы воды ассоциированы  . Ассоциация возрастает с увеличением давления и понижением температуры. В органических растворителях вода находится полностью в виде димерных молекул
. Ассоциация возрастает с увеличением давления и понижением температуры. В органических растворителях вода находится полностью в виде димерных молекул  . Обычно степень ассоциации воды
. Обычно степень ассоциации воды  достигает 2—4; при температурах, близких к 0° С,
достигает 2—4; при температурах, близких к 0° С,  равна 8.
равна 8.
Наиболее устойчивыми являются молекулы  , имеюшие следующее строение:
, имеюшие следующее строение:

Молекулы  подвергаются электролитической диссоциации:
подвергаются электролитической диссоциации:

Как видно из уравнения электролитической диссоциации, вода может проявлять и кислотные, и основные свойства.
Применив закон действия масс, получим

где  — константа электролитической диссоциации воды.
— константа электролитической диссоциации воды.
Равновесная концентрация недиссоциированных молекул воды равна:

где  — суммарная концентрация диссоциированных и недиссоциированных молекул воды.
— суммарная концентрация диссоциированных и недиссоциированных молекул воды.
Ввиду очень малой степени электролитической диссоциации воды величинами  можно пренебречь. Тогда выражение примет вид:
можно пренебречь. Тогда выражение примет вид:

Здесь  — величина постоянная.
— величина постоянная.
Вычислив, сколько молей воды в  ее:
ее:

выразим общую концентрацию воды  в молях на 1 л:
в молях на 1 л:

Подставив это значение в выражение закона действия масс, получим:

Величину произведения  называют ионным произведением воды и обозначают
называют ионным произведением воды и обозначают  . Эта величина больше константы электролитической диссоциации воды в 55,5 раза.
. Эта величина больше константы электролитической диссоциации воды в 55,5 раза.

Ионное произведение воды остается постоянным в водных растворах кислот, щелочей, солей или других соединений. При повышении температуры эта величина сильно возрастает.
При температуре кипения воды (100° С) ионное произведение увеличивается приблизительно в 100 раз по сравнению с его значением при 18° С и становится равным  .
.
Вода является слабым электролитом (удельная электропроводность равняется  ). Например, при комнатной температуре в
). Например, при комнатной температуре в  воды в диссоциированном состоянии находится только 1 моль воды, т. е.
воды в диссоциированном состоянии находится только 1 моль воды, т. е.  молекул (число Авогадро). Так как 1 л воды содержит 55,5 моль
молекул (число Авогадро). Так как 1 л воды содержит 55,5 моль  , то в
, то в  воды содержится всего
воды содержится всего  молекул ее. Следовательно, на каждые
молекул ее. Следовательно, на каждые

молекул  электролитически диссоциирует только одна молекула.
электролитически диссоциирует только одна молекула.
Изменение величины константы электролитической диссоциации и ионного произведения воды в зависимости от температуры имеет очень важное значение в теории и практике аналитической химии.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ
- ВВЕДЕНИЕ
- § 1. Анализ и синтез
- § 2. Предмет аналитической химии
- § 3. Развитие аналитической химии
- § 4. Качественный и количественный анализ
- ГЛАВА I. ПРИМЕНЕНИЕ ЗАКОНА ДЕЙСТВИЯ МАСС В АНАЛИТИЧЕСКОЙ ХИМИИ
- § 1. Влияние среды на состояние ионов в растворах
- § 2. Обратимые и необратимые аналитические реакции
- § 3. Направление аналитических реакций; правила обменного разложения
- § 4. Закон действия масс и следствие из него
- § 5. Границы применимости закона действия масс
- § 6. Сильные и слабые электролиты
- § 7. Активность
- § 8. Коэффициент активности и ионная сила
- Б. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ (В ГОМОГЕННЫХ СИСТЕМАХ)
- § 9. Гомогенные и гетерогенные системы
- § 10. Ионное произведение воды
- § 11. Ионы гидроксония
- § 12. Равновесие ионов в водных растворах; понятие о pH
- § 13. Равновесие в водных растворах слабых электролитов
- § 14. Влияние сильных кислот или сильных оснований на степень электролитической диссоциации слабых электролитов
- § 15. Приближенные формулы для расчета [H+] и [OH-] в водных растворах кислот и оснований
- В. РАВНОВЕСИЯ В БУФЕРНЫХ РАСТВОРАХ
- § 16. Буферные растворы
- § 17. Применение буферных растворов в химическом анализе
- Г. РАВНОВЕСИЯ В РАСТВОРАХ ГИДРОЛИЗУЮЩИХСЯ СОЛЕЙ
- § 18. Теоретические основы гидролиза
- § 19. Механизм гидролитического расщепления
- § 20. Подавление и усиление гидролиза солей
- Д. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ТИПИЧНО АМФОТЕРНЫХ ЭЛЕКТРОЛИТОВ
- § 21. Поведение амфотерных гидроокисей в водных растворах
- § 22. Константы электролитической диссоциации амфотерных гидроокисей
- Е. РАВНОВЕСИЯ В СИСТЕМАХ: ОСАДОК-НАСЫЩЕННЫЙ РАСТВОР
- § 23. Осаждение как один из основных методов химического анализа
- § 24. Произведение растворимости
- § 25. Произведение активностей
- § 26. Вычисление растворимости электролитов в воде по величине произведения растворимости
- § 27. Влияние различных факторов на растворимость малорастворимых электролитов
- Ж. ОСНОВЫ ТЕОРИИ ОБРАЗОВАНИЯ И РАЗЛОЖЕНИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИИ, ПРИМЕНЯЕМЫХ В АНАЛИТИЧЕСКОЙ ХИМИИ
- § 28. Характеристика комплексных соединений, имеющих значение в химическом анализе
- § 29. Квантовомеханические представления о строении комплексов
- § 30. Равновесия в растворах комплексных соединений
- § 31. Константы нестойкости комплексов
- § 32. Внутрикомплексные соединения
- § 33. Методы разложения и образования комплексов, применяемых в аналитической химии
- § 34. Применение метода комплексообразования в химическом анализе
- ГЛАВА II. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ, ПРИМЕНЯЕМЫХ В АНАЛИТИЧЕСКОЙ ХИМИИ
- § 1. Окисление—восстановление как один из основных методов химического анализа
- § 2. Направление реакций окисления—восстановления
- § 3. Окислительно-восстановительные потенциалы
- § 4. Зависимость между величинами окислительно-восстановительных потенциалов и условиями, в которых протекают реакции окисления—восстановления
- § 5. Вычисление окислительно-восстановительных потенциалов
- § 6. Вычисление окислительно-восстановительных потенциалов с учетом коэффициентов активности
- ГЛАВА III. ВВЕДЕНИЕ В КАЧЕСТВЕННЫЙ АНАЛИЗ
- § 1. Обнаружение отдельных элементов
- § 2. Анализ мокрым и сухим путем
- § 3. Химические и физические методы качественного анализа
- § 4. Макро-, полумикро- и микрометоды
- § 5. Капельный анализ
- § 6. Микрокристаллоскопический анализ
- § 7. Метод растирания порошков
- § 8. Методы анализа, основанные на нагревании и сплавлении веществ
- § 9. Спектральный качественный анализ
- § 10. Хроматографический метод анализа
- § 11. Кинетические методы анализа
- Б. УСЛОВИЯ ВЫПОЛНЕНИЯ КАЧЕСТВЕННЫХ РЕАКЦИЙ
- § 12. Специфичность и чувствительность реакций
- § 13. Максимальная чувствительность аналитических реактивов
- § 14. Способы повышения чувствительности реакций
- § 15. Маскировка мешающих ионов
- § 16. Определение pH среды
- § 17. Регулирование pH среды в процессе аналитических определений
- В. РЕАКТИВЫ
- § 18. Понятие о химических реактивах
- § 19. Концентрация применяемых реактивов
- § 20. Техника пользования реактивами
- Г. ПОСУДА И ПРИБОРЫ, ПРИМЕНЯЕМЫЕ В КАЧЕСТВЕННОМ АНАЛИЗЕ
- § 21. Химическая посуда
- § 22. Приборы
- Д. АНАЛИТИЧЕСКИЕ ГРУППЫ
- § 23. Дробный и систематический анализ
- § 24. Аналитическая классификация катионов
- § 25. Сводные таблицы действия реактивов на катионы и анионы
- Е. ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА И АНАЛИТИЧЕСКАЯ КЛАССИФИКАЦИЯ ИОНОВ
- § 26. Значение периодического закона в аналитической химии
- § 27. Периодическая система элементов Д. И. Менделеева как классификация атомов по их строению
- § 28. Зависимость некоторых химических свойств элементов от положения их в периодической системе Д. И. Менделеева
- § 29. Растворимость химических соединений в связи с положением элементов в периодической системе Д. И. Менделеева
- § 30. Открытие новых аналитических реакций
- § 31. Аналитические группы и периодическая система элементов Д. И. Менделеева
- ОБНАРУЖЕНИЕ ИНДИВИДУАЛЬНЫХ КАТИОНОВ И АНАЛИЗ СМЕСЕЙ КАТИОНОВ
- § 1. Характеристика первой аналитической группы катионов
- § 2. Общие реакции катионов первой аналитической группы
- РЕАКЦИИ КАТИОНОВ 1-й ПОДГРУППЫ
- § 3. Обнаружение NН-ионов
- § 4. Методы разложения и удаления солей аммония
- § 5. Обнаружение K-ионов
- § 6. Обнаружение Rb-ионов
- § 7. Обнаружение Cs-ионов
- § 8. Анализ смеси катионов первой подгруппы
- РЕАКЦИИ КАТИОНОВ 2-й ПОДГРУППЫ
- § 9. Обнаружение Li-ионов
- § 10. Обнаружение Na-ионов
- § 11. Обнаружение Mg-ионов
- § 12. Обзор действия реактивов на катионы первой аналитической группы
- § 13. Анализ смеси катионов второй подгруппы
- § 14. Анализ смеси ионов
- § 15. Анализ смеси ионов
- ГЛАВА V. ВТОРАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ
- § 1. Характеристика второй аналитической группы катионов
- § 2. Общие реакции катионов второй аналитической группы
- § 3. Обнаружение Ca-ионов
- § 4. Обнаружение Sr-ионов
- § 5. Обнаружение Ba-ионов
- § 6. Обзор действия реактивов на катионы второй аналитической группы
- § 7. Основы теории осаждения катионов второй аналитической группы групповым реактивом—карбонатом аммония
- § 8. Систематический ход анализа смеси катионов первой и второй аналитических групп
- § 9. Систематический ход анализа смеси катионов первой и второй аналитических групп в присутствии ионов
- § 10. Теоретические основы перевода сульфатов катионов второй аналитической группы в карбонаты
- ГЛАВА VI. ТРЕТЬЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ
- § 1. Характеристика третьей аналитической группы катионов
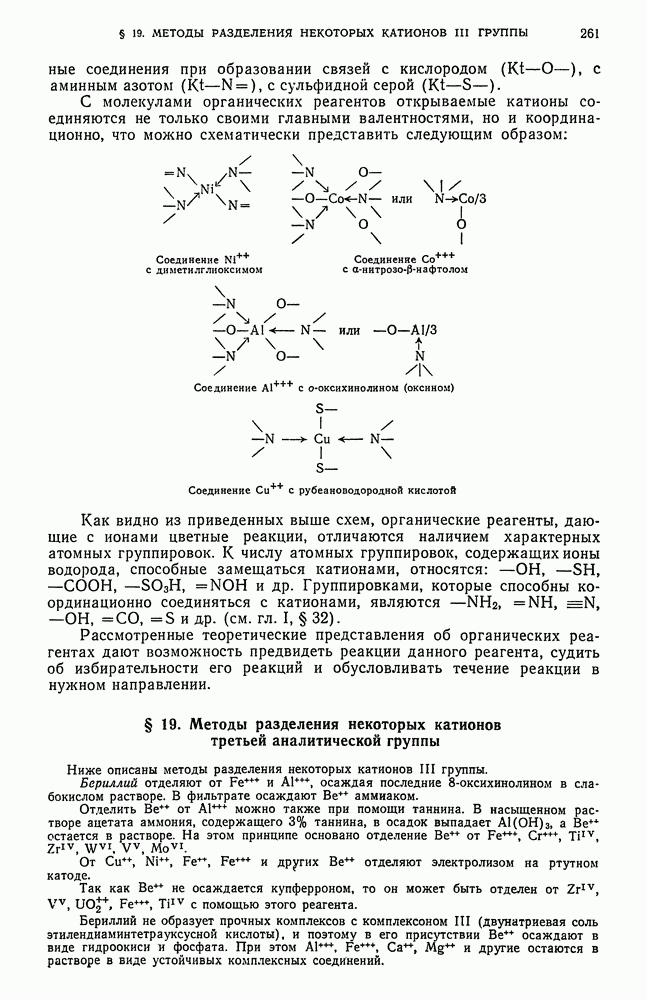
- § 2. Общие реакции катионов третьей аналитической группы
- § 3. Обнаружение Be-ионов
- § 4. Обнаружение Al-ионов
- § 5. Обнаружение ионов титана (IV)
- § 6. Обнаружение Cr-ионов
- § 7. Обнаружение Mn-ионов
- § 8. Обнаружение Fe-ионов
- § 9. Обнаружение Fe-ионов
- § 10. Обнаружение Co-ионов
- § 13. Обнаружение ионов циркония (IV)
- § 14. Обнаружение UO-ионов
- § 15. Обзор действия реактивов на катионы третьей аналитической группы
- § 16. Использование коллоидных систем в химическом анализе
- § 17. Основы теории осаждения катионов третьей аналитической группы групповым реактивом — сульфидом аммония
- § 18. Теоретические основы применения органических реактивов в качественном анализе неорганических веществ
- § 19. Методы разделения некоторых катионов третьей аналитической группы
- § 20. Систематический ход анализа смеси катионов третьей аналитической группы
- § 21. Систематический ход анализа смеси катионов первой, второй и третьей аналитических групп
- § 22. Систематический ход анализа смеси катионов первой, второй и третьей аналитических групп в присутствии PO-ионов
- ГЛАВА VII. ЧЕТВЕРТАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ
- § 1. Характеристика четвертой аналитической группы катионов
- § 2. Общие реакции катионов четвертой аналитической группы
- РЕАКЦИИ КАТИОНОВ ПЕРВОЙ ПОДГРУППЫ (ПОДГРУППЫ МЕДИ)
- § 3. Обнаружение Hg-ионов
- § 4. Обнаружение Cu-ионов
- § 5. Обнаружение Cd-ионов
- § 6. Обнаружение Bi-ионов
- РЕАКЦИИ КАТИОНОВ ВТОРОЙ ПОДГРУППЫ (ПОДГРУППЫ МЫШЬЯКА)
- § 7. Обнаружение ионов мышьяка (III)
- § 8. Обнаружение ионов мышьяка (V)
- § 9. Общие реакции обнаружения
- § 10. Обнаружение ионов сурьмы (III)
- § 11. Обнаружение ионов сурьмы (V)
- § 12. Общие реакции обнаружения Sb
- § 13. Обнаружение ионов олова (II)
- § 14. Обнаружение ионов олова (IV)
- § 15. Общие реакции обнаружения ионов олова (II) и олова (IV)
- § 16. Отделение ионов олова от других ирнов четвертой аналитической группы
- § 17. Обнаружение ионов германия (IV)
- § 18. Отделение ионов германия от других ионов четвертой аналитической группы
- § 19. Обзор действия реактивов на катионы четвертой аналитической группы
- § 20. Основы теории осаждения сульфидов катионов четвертой аналитической группы групповым реактивом — сероводородом
- § 21. Систематический ход анализа смеси катионов четвертой аналитической группы
- ГЛАВА VIII. ПЯТАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ (ГРУППА СЕРЕБРА)
- § 1. Характеристика пятой аналитической группы катионов
- § 2. Общие реакции катионов пятой аналитической группы
- § 3. Обнаружение Ag-ионов
- § 4. Обнаружение [Hg]-ионов
- § 5. Обнаружение Pb-ионов
- § 6. Обзор действия реактивов на катионы пятой аналитической группы
- § 7. Систематический ход анализа смеси катионов пятой аналитической группы
- ГЛАВА IX. АНАЛИЗ СМЕСИ ИОНОВ ВСЕХ ПЯТИ АНАЛИТИЧЕСКИХ ГРУПП
- § 1. Сероводородный метод анализа
- § 2. Недостатки сероводородного метода анализа
- § 3. Ошибки, возникающие при анализе смеси ионов пяти аналитических групп
- § 4. Бессероводородные методы анализа
- ОБНАРУЖЕНИЕ ИНДИВИДУАЛЬНЫХ АНИОНОВ И АНАЛИЗ СМЕСЕЙ АНИОНОВ
- § 1. Аналитическая классификация анионов
- § 2. Групповые реактивы на анионы
- § 3. Классификация методов анализа анионов
- ГЛАВА XI. ПЕРВАЯ АНАЛИТИЧЕСКАЯ ГРУППА АНИОНОВ
- § 1. Характеристика первой группы анионов
- § 2. Реакции анионов первой группы
- § 3. Обнаружение CI-ионов
- § 4. Обнаружение Br-ионов
- § 5. Обнаружение I-ионов
- § 6. Обнаружение CN-ионов
- § 7. Обнаружение SCN-ионов
- § 8. Обнаружение [Fe(CN)]-ионов
- § 9. Обнаружение Fe(CN)-ионов
- § 10. Обнаружение NO-ионов
- § 11. Обнаружение NO2-ионов
- § 12. Обнаружение S-ионов
- § 13. Обнаружение CH3COOO-ионов
- § 14. Обнаружение BrO3-ионов
- § 15. Обнаружение ClO3-ионов
- § 16. Обнаружение ClO4-ионов
- § 17. Обзор действия реактивов на анионы первой группы
- МЕТОДЫ АНАЛИЗА НЕКОТОРЫХ СМЕСЕЙ АНИОНОВ
- § 18. Анализ смеси Cl, Br и I-ионов
- § 19. Анализ смеси Cl, Br, I и SCN-ионов
- § 20. Анализ смеси Cl, ClO3 и ClO4-ионов
- § 21. Анализ смеси NO2 и NO3-ионов
- § 22. Анализ смеси анионов первой группы
- ГЛАВА XII. ВТОРАЯ АНАЛИТИЧЕСКАЯ ГРУППА АНИОНОВ
- § 1. Характеристика второй группы анионов
- § 2. Общие реакции анионов второй группы
- § 3. Обнаружение SO3-ионов
- § 4. Обнаружение S2O3-ионов
- § 5. Обнаружение S2O3 в присутствии SO3-ионов
- § 6. Обнаружение SO4-ионов
- § 7. Обнаружение CO3-ионов
- § 8. Обнаружение CO3-ионов в присутствии SO3 и S2O3-ионов
- § 9. Обнаружение PO4-ионов
- § 10. Обнаружение CrO4-ионов
- § 11. Обнаружение AsO3-ионов
- § 12. Обнаружение AsO4-ионов
- § 13. Обнаружение BO2 и BO3-ионов
- § 14. Обнаружение SiO3-ионов
- § 15. Обнаружение F-ионов
- § 16. Обнаружение C2O4-ионов
- § 17. Обнаружение VO3-ионов
- § 18. Обнаружение MoO4-ионов
- § 19. Обнаружение WO4-ионов
- § 20. Обзор действия реактивов на анионы второй группы
- МЕТОДЫ АНАЛИЗА НЕКОТОРЫХ СМЕСЕЙ АНИОНОВ
- § 21. Анализ смеси ионов
- § 22. Анализ смеси SO3, SO4, S2O3 и CO3-ионов
- § 23. Анализ смеси VO2, MoO4 и WO4-ионов
- § 24. Анализ смеси анионов второй группы
- § 25. Анализ смеси анионов первой и второй групп
- ГЛАВА XIII. ОБНАРУЖЕНИЕ СВОБОДНЫХ МЕТАЛЛОВ И НЕМЕТАЛЛОВ, ИДЕНТИФИЦИРОВАНИЕ СОЛЕЙ И ДРУГИХ ИНДИВИДУАЛЬНЫХ СОЕДИНЕНИЙ И АНАЛИЗ ИХ СМЕСЕЙ
- § 1. Подготовка вещества к анализу
- § 2. Предварительные испытания
- § 3. Растворение анализируемого вещества в воде, кислотах и щелочах
- § 4. Переведение в растворимое состояние веществ, нерастворимых в воде, кислотах и щелочах
- § 5. Анализ неизвестного вещества
- § 6. Обнаружение свободных элементов
- § 7. Идентифицирование солей и других индивидуальных соединений
- § 8. Обнаружение микропримесей
- § 9. Анализ сплавов
- § 10. Анализ силикатов и алюмосиликатов
- § 11. Анализ смеси неорганических веществ
- § 12. Экспрессный метод анализа смесей катионов и анионов
- § 13. Идентифицирование нерастворимых веществ
- ЛИТЕРАТУРА