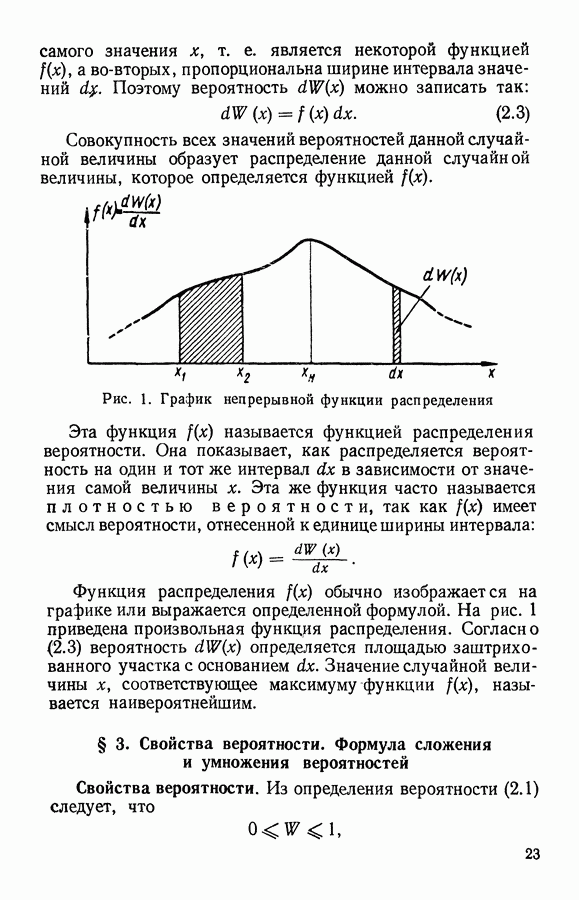
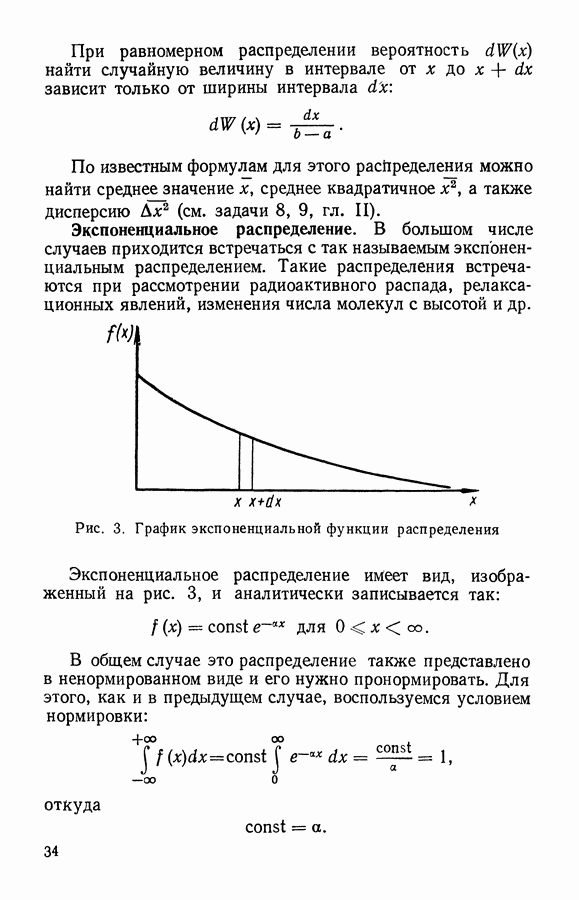
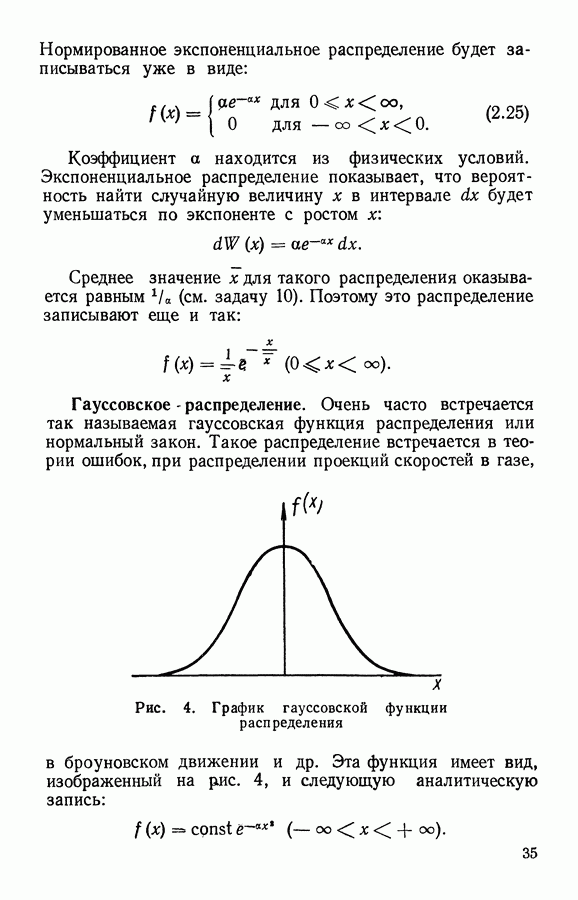
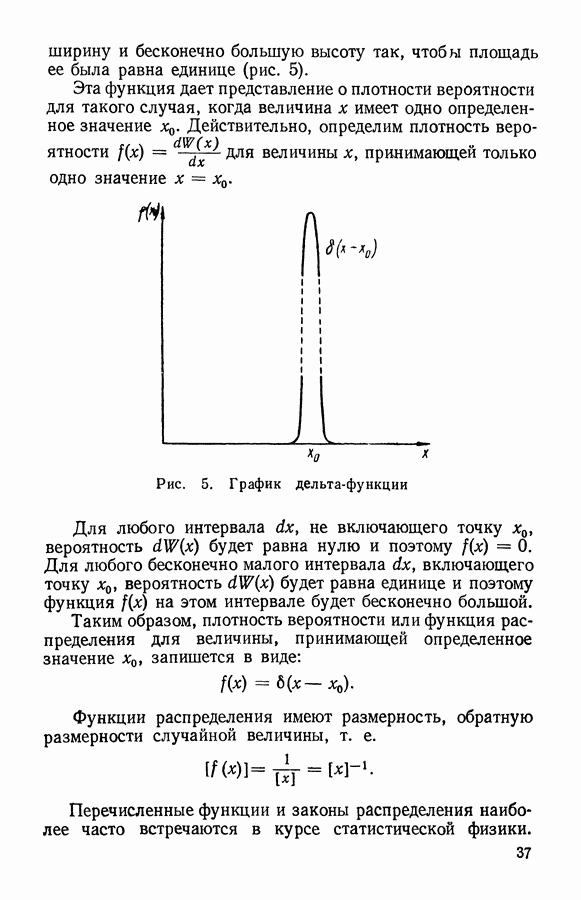
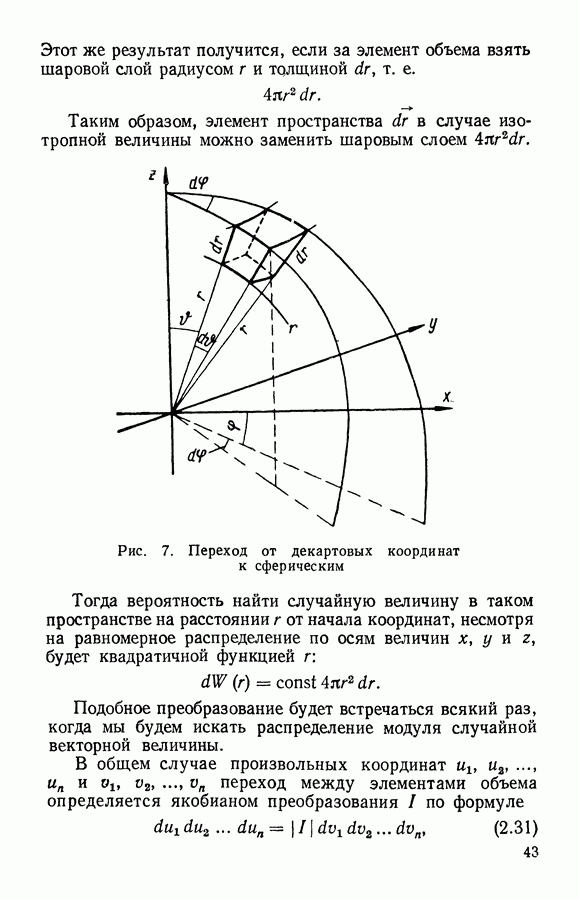
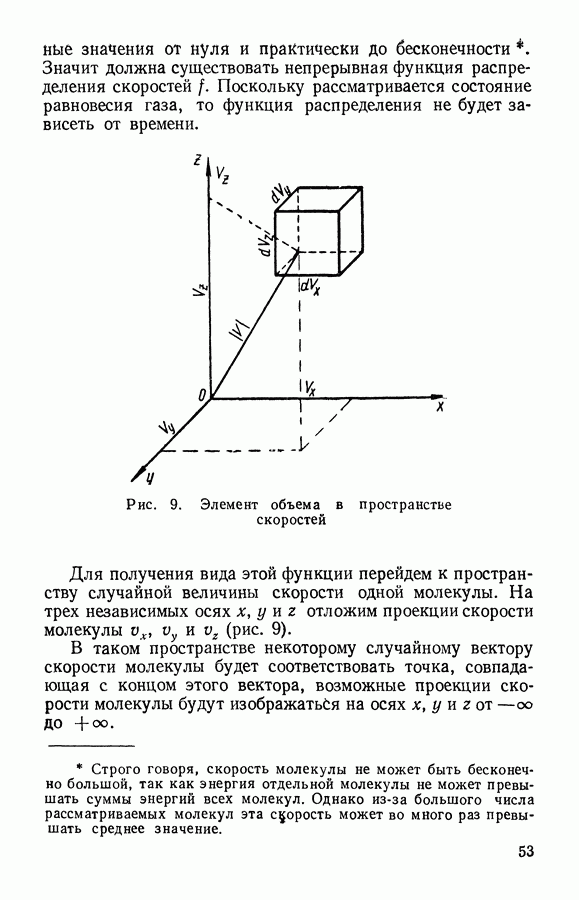
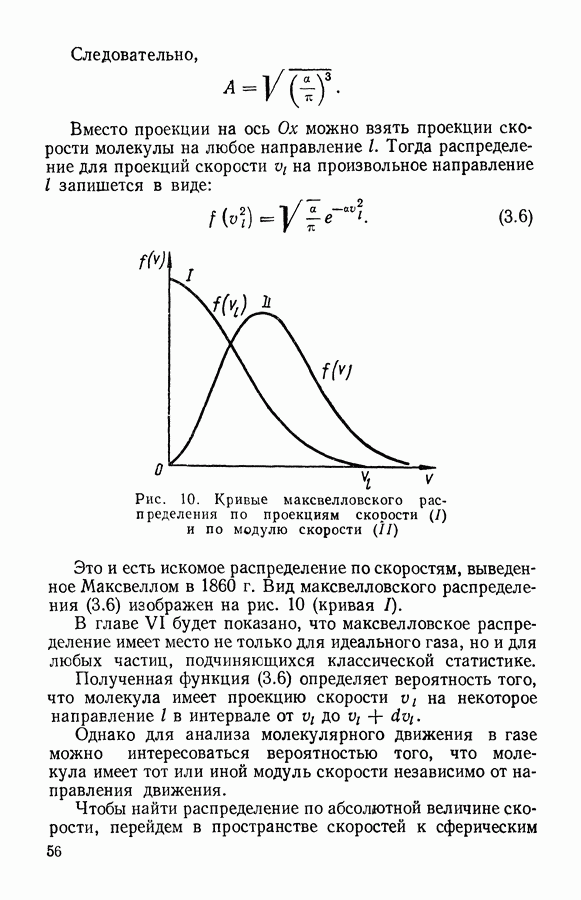
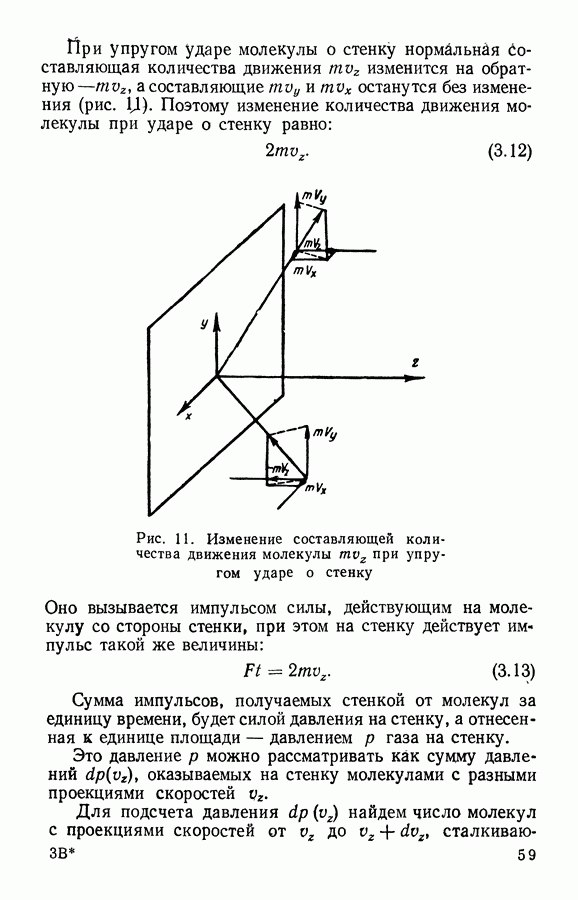
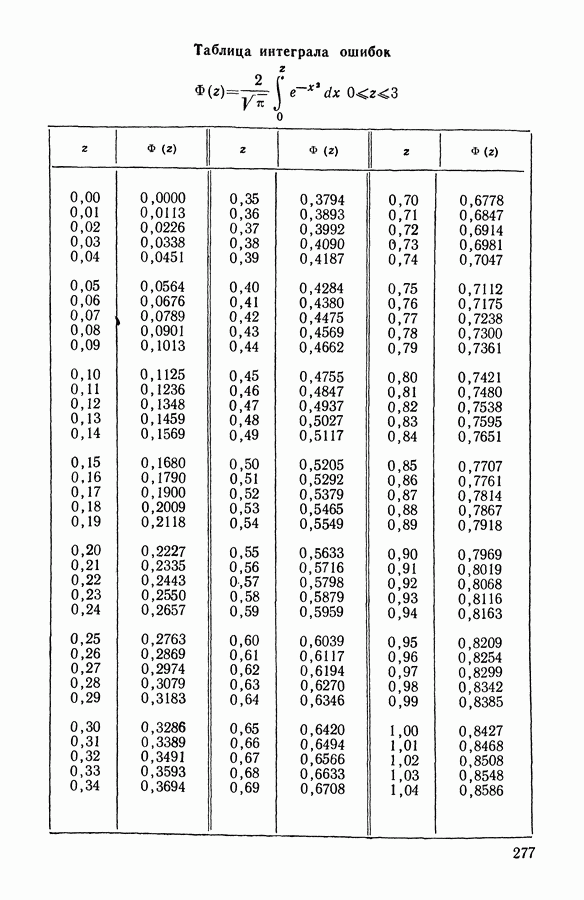
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ЧАСТЬ I. ЭЛЕМЕНТАРНАЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ
Глава III. КЛАССИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНОГО ГАЗА
§ 1. Модель идеального газа
Часто встречающийся в физике идеальный газ является определенной моделью вещества, которая вводится для объяснения простейших свойств некоторых реальных физических систем (реального газа, электронов в металле и др.).
Идеальный газ представляют как систему свободных невзаимодействующих частиц, находящихся в непрерывном хаотическом движении. Взаимодействие частиц идеального газа проявляется только в их упругих столкновениях.
Частицы идеального газа принимают за твердые шарики, размер которых намного меньше среднего расстояния между ними. Промежуток времени между столкновениями при этом оказывается много больше, чем время самих столкновений. Следовательно, большую часть времени частицы движутся в газе равномерно и прямолинейно.
Благодаря беспорядочному движению частицы идеального газа очень часто сталкиваются друг с другом. Эти столкновения частиц между собой приводят к ряду интересных следствий.
Во-первых, разлетаясь после столкновений в разные стороны, частицы из выделенной группы будут постепенно рассеиваться в пространстве, занимая в конце концов бесконечно большой объем. Поэтому в большинстве" случаев идеальный газ рассматривают внутри некоторого объема, т. е. ограниченный стенками сосуда. Частицы, встречая
на своем пути стенки сосуда будут по законам упругого удара отражаться от них, передавая стенке определенное количество движения (импульс силы). Следствием этого является давление, оказываемое газом на стенку.
Во-вторых, столкновения частиц газа между собой приводят к тому, что они непрерывно обмениваются энергией, изменяют свои скорости и координаты внутри объема. Благодаря Этому в газе при постоянных внешних параметрах устанавливается равновесное состояние, которому соответствует определенное распределение частиц в пространстве, по направлениям движения и по скоростям. Любые отклонения от такого равновесного состояния сглаживаются благодаря непрерывному хаотическому движению и столкновениям частиц. За сравнительно короткое время (время релаксации) газ снова приходит в равновесное состояние. Рассматривая газ, при постоянных внешних параметрах, за промежутки времени, большие времени релаксации, мы можем считать его состояние равновесным. Некоторые же вопросы, связанные с неравновесными процессами, будут рассмотрены в IV главе.
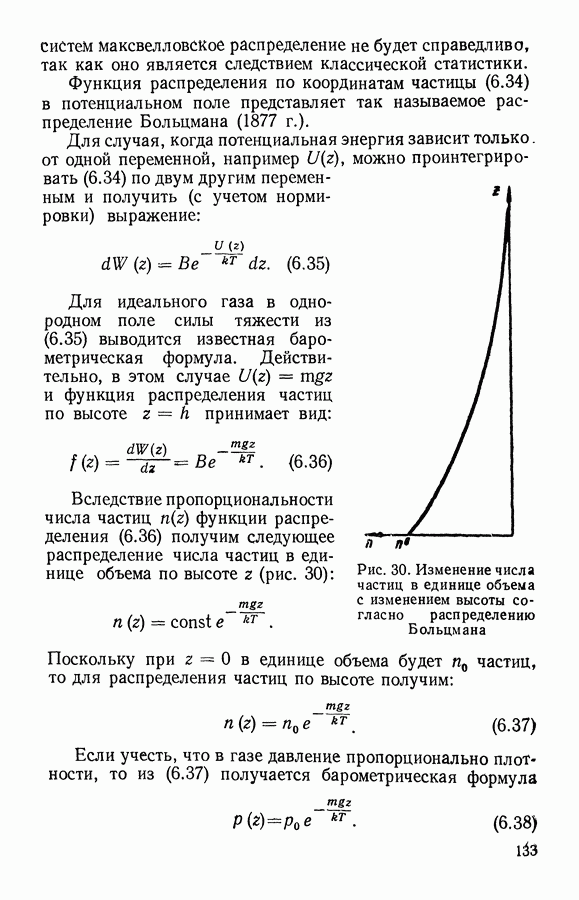
Если идеальный газ находится в равновесном состоянии при отсутствии внешних сил, то его частицы заполняют весь объем с постоянной плотностью. Число частиц, заключенных в некотором интересующем нас объеме V, буяет определяться по формуле

где  — число частиц в единице объема, равное отношению всего числа частиц ко всему занятому газом объему:
— число частиц в единице объема, равное отношению всего числа частиц ко всему занятому газом объему:

Столкновения частиц приводят не только к установлению в газе одинаковой плотности, но и к равномерному распределению в пространстве направлений движения частиц. Сколько частиц движется в одном направлении, столько же в среднем движется и в любом Другом, в том числе и противоположном направлении. В результате такой равноправности направлений движения давление в идеальном газе оказывается изотропным.
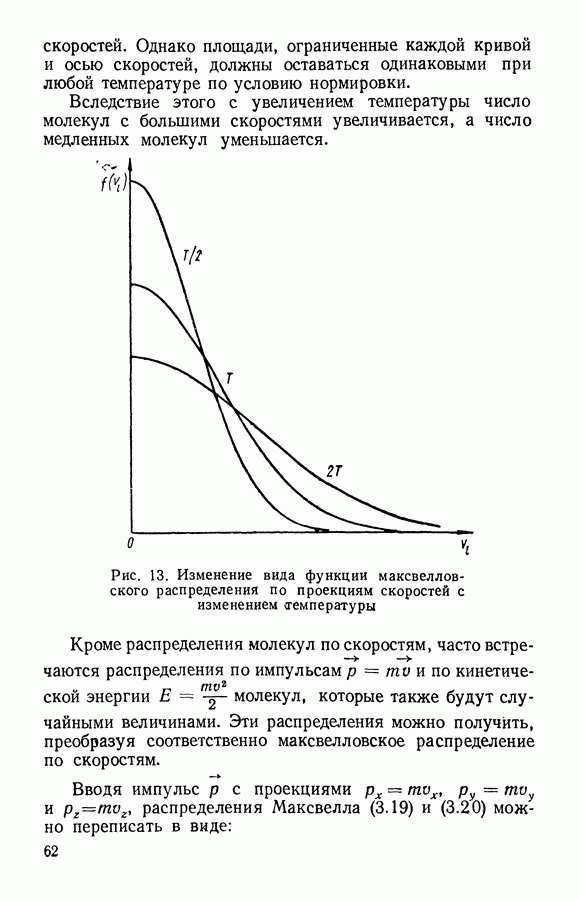
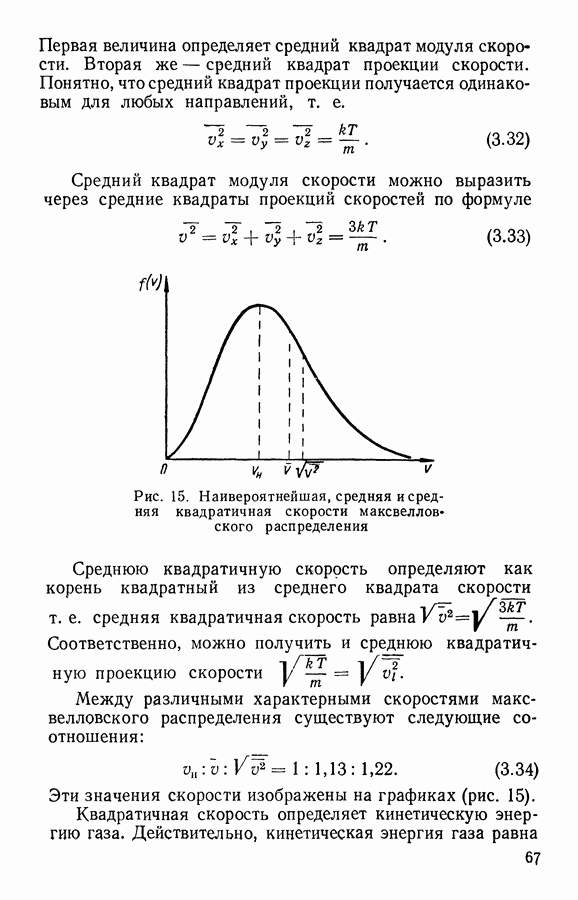
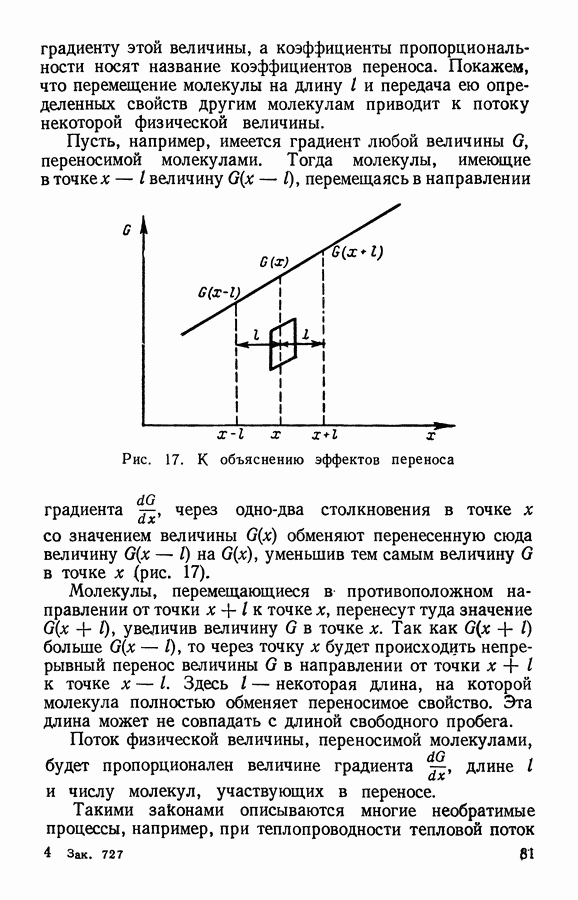
При равновесии в газе устанавливается также и определенное распределение частиц по скоростям. При этом средние скорости и число частиц, движущихся в разных направлениях, оказываются одинаковыми, о чем свидетельствует отсутствие направленного потока газа при равновесии.
Для рассматриваемой модели идеального газа легко найти зависимость между давлением и объемом.
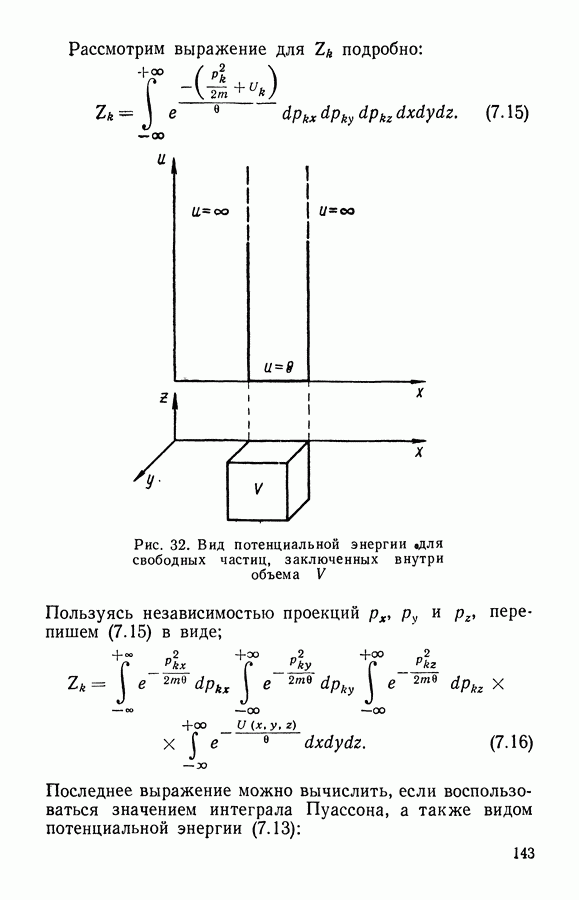
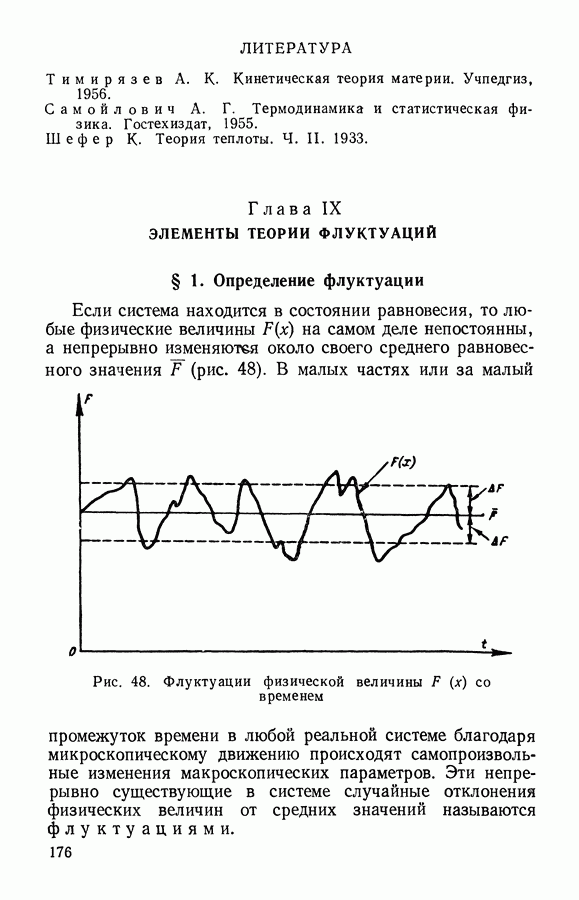
Пусть идеальный газ находится в сосуде, имеющем форму шара с радиусом  . В этом случае
. В этом случае  частиц, находящихся в объеме
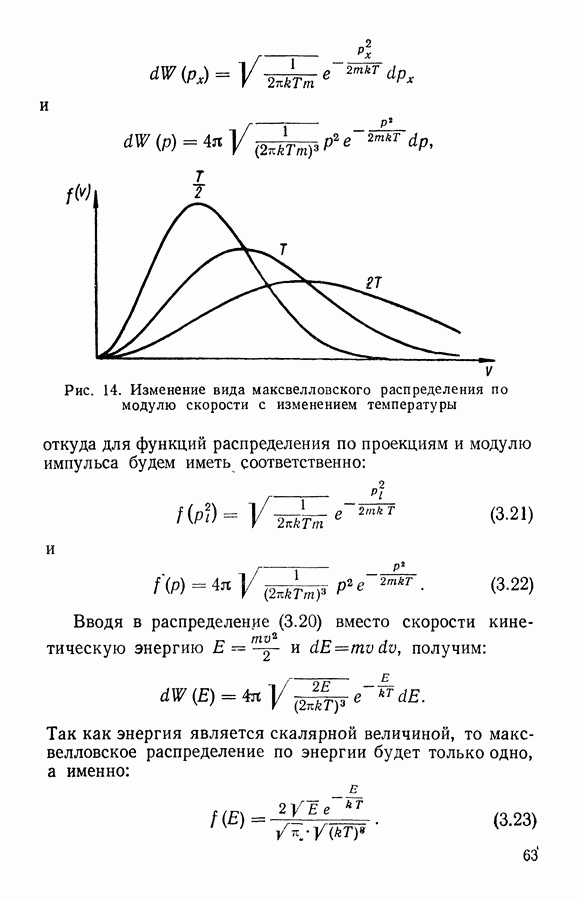
частиц, находящихся в объеме  оказывают давление
оказывают давление  на поверхность
на поверхность 

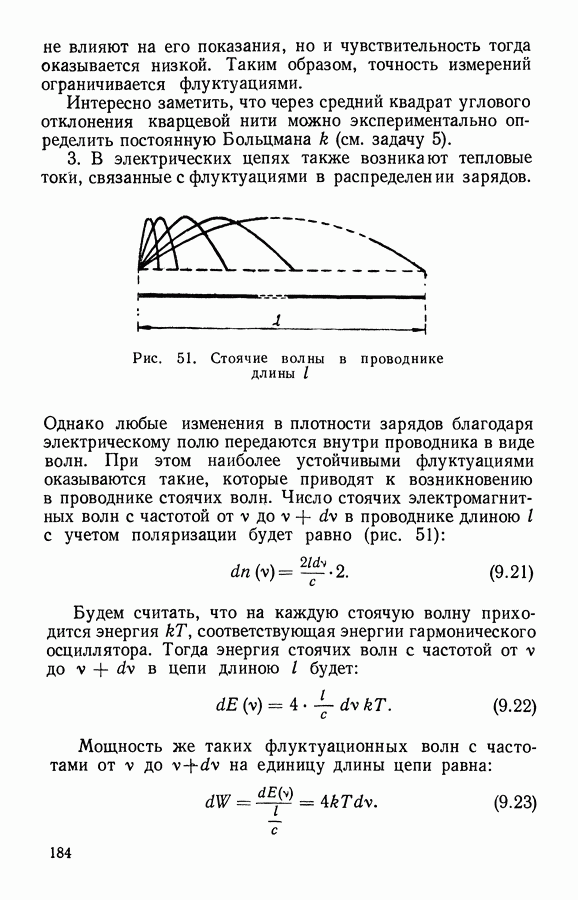
Рис. 8. К выводу закона Бойля — Мариотта по М. В. Ломоносову
Затем сожмем это количество газа так, чтобы он занимал объем шара с вдвое меньшим радиусом  т. е.
т. е.  . Если скорости движения частиц останутся прежними, то те же удары
. Если скорости движения частиц останутся прежними, то те же удары  частиц будут теперь приходиться на вчетверо меньшую поверхность
частиц будут теперь приходиться на вчетверо меньшую поверхность  вследствие чего давление должно возрасти в 4 раза. С другой стороны, из-за уменьшения объема средний путь частицы между столкновениями будет вдвое меньше, что приведет при той же скорости движения молекул к увеличению вдвое числа столкновений в единицу времени, т. е. и со стенкой частицы будут сталкиваться вдвое чаще. Таким образом, при уменьшении объема идеального газа в 8 раз давление должно возрасти также в 8 раз. Это и есть закон Бойля — Мариотта:
вследствие чего давление должно возрасти в 4 раза. С другой стороны, из-за уменьшения объема средний путь частицы между столкновениями будет вдвое меньше, что приведет при той же скорости движения молекул к увеличению вдвое числа столкновений в единицу времени, т. е. и со стенкой частицы будут сталкиваться вдвое чаще. Таким образом, при уменьшении объема идеального газа в 8 раз давление должно возрасти также в 8 раз. Это и есть закон Бойля — Мариотта:

Приведенный здесь вывод этого закона был еще в 1745 г. предложен  Ломоносовым.
Ломоносовым.
Рассмотренная модель идеального газа при определенных условиях объясняет многие свойства реального газа, т. е. простейшего газообразного состояния вещества.
Существует следующий критерий применимости модели идеального газа к реальному газу. Если поведение реального газа удовлетворяет закону Бойля — Мариотта, то газ можно рассматривать как идеальный. Например, воздух при нормальных условиях можно рассматривать как идеальный газ. Поэтому дальнейшие выводы, которые будут получены на основании свойств модели идеального газа, можно распространять и на реальные газы. Вместо частиц идеального газа далее будем рассматривать молекулы реального газа.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- § 1. Предмет и метод статистической физики
- § 2. К вопросу возникновения и развития молекулярно-кинетической теории материи
- § 3. Место статистической физики в раскрытии материалистической картины мира
- § 4. Феноменологические и молекулярно-кинетические теории
- § 5. Модельность в статистической физике. Классическая и квантовая модели вещества
- Глава II. НЕОБХОДИМЫЕ СВЕДЕНИЯ ИЗ ТЕОРИИ ВЕРОЯТНОСТЕЙ
- § 1. Случайные события и случайные величины
- § 2. Понятие вероятности
- § 3. Свойства вероятности. Формула сложения и умножения вероятностей
- § 4. Средние значения случайных величин
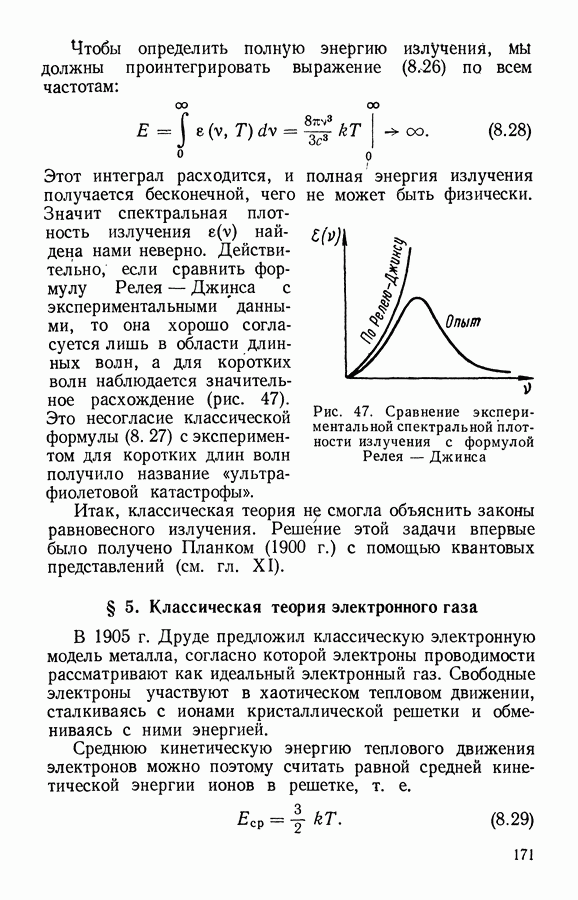
- § 5. Примеры законов распределения случайных величин
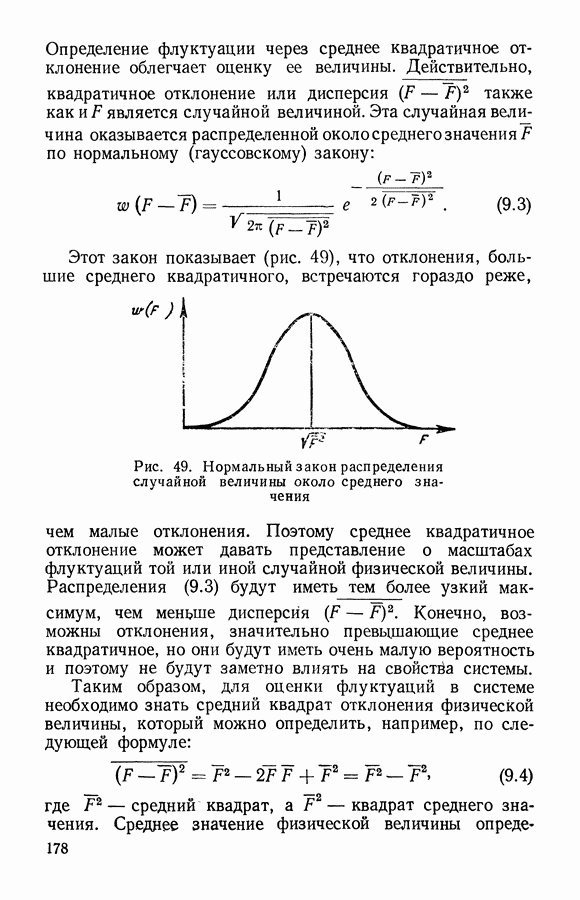
- § 6. Функция распределения для нескольких случайных величин
- ЧАСТЬ I. ЭЛЕМЕНТАРНАЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ
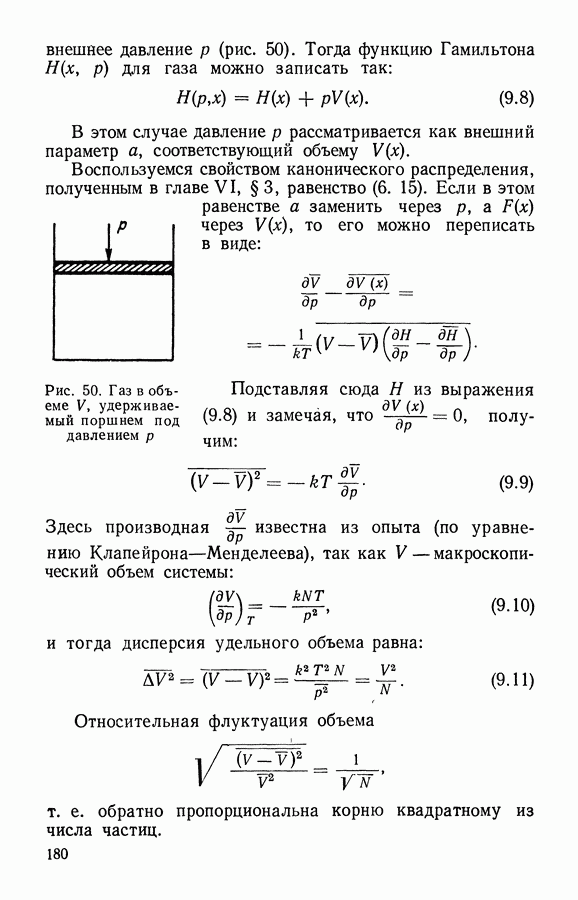
- § 1. Модель идеального газа
- § 2. Распределение молекул газа по скоростям
- § 3. Связь распределения Максвелла по скоростям с абсолютной температурой
- § 4. Характерные скорости максвелловского распределения
- § 5. Средние относительные скорости
- § 6. Соответствие модели идеального газа реальному газу
- Глава IV. ЭЛЕМЕНТЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ НЕРАВНОВЕСНЫХ ПРОЦЕССОВ
- § 1. Неравновесные состояния. Явления релаксации и переноса
- § 2. Поперечные сечения. Длина свободного пробега
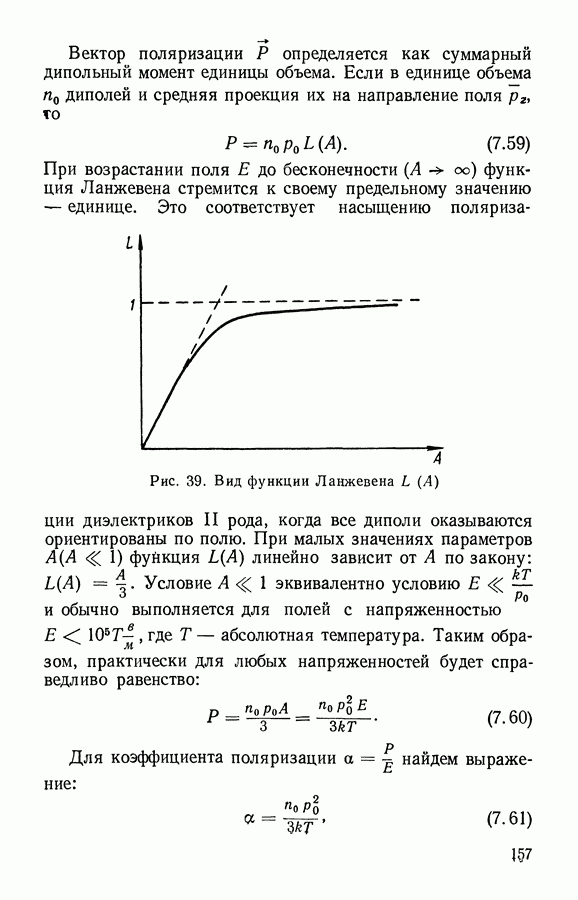
- § 3. Распределение свободных пробегов частиц
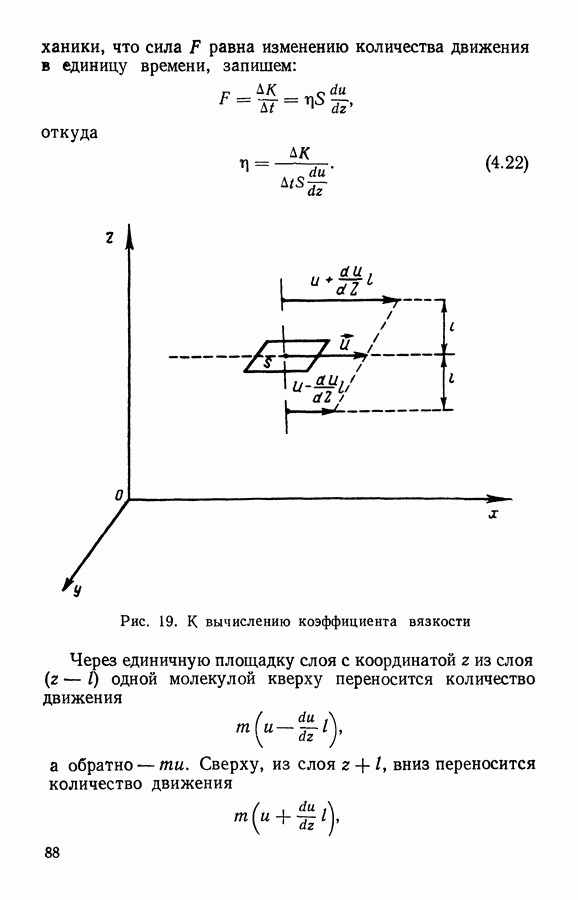
- § 4. Вязкость газов
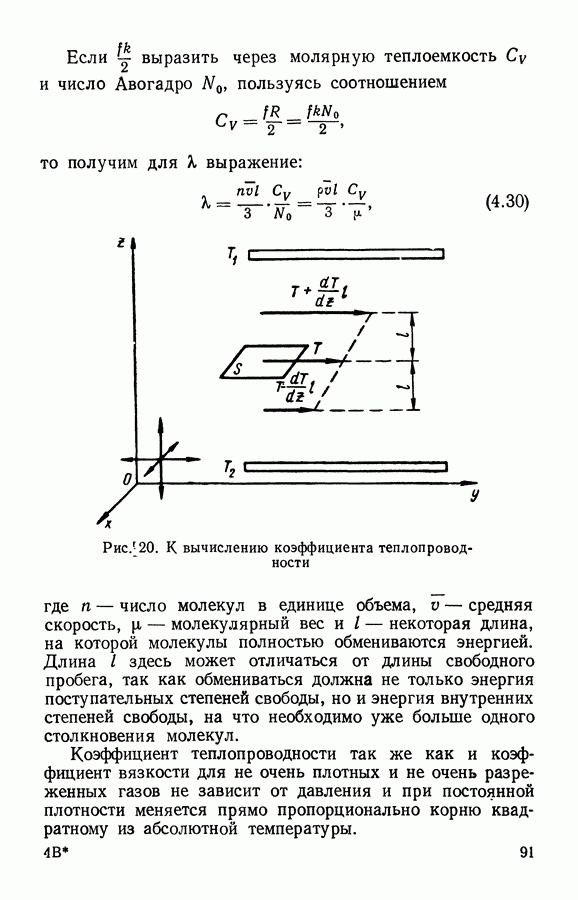
- § 5. Теплопроводность газов
- § 6. Диффузия газов
- ЧАСТЬ II. КЛАССИЧЕСКАЯ СТАТИСТИЧЕСКАЯ ФИЗИКА
- § 1. Невозможность последовательного механического описания физических систем многих частиц
- § 2. Макроскопическое и микроскопическое описание системы в термодинамическом равновесии
- § 3. Изображение системы в фазовом пространстве
- § 4. Элемент фазового объема. Вероятность нахождения системы в фазовом пространстве
- § 5. Теорема о сохранении фазового объема (Теорема Лиувилля)
- § 6. Макроскопические величины как фазовые средние
- Глава VI. СТАЦИОНАРНЫЕ ФУНКЦИИ РАСПРЕДЕЛЕНИЯ
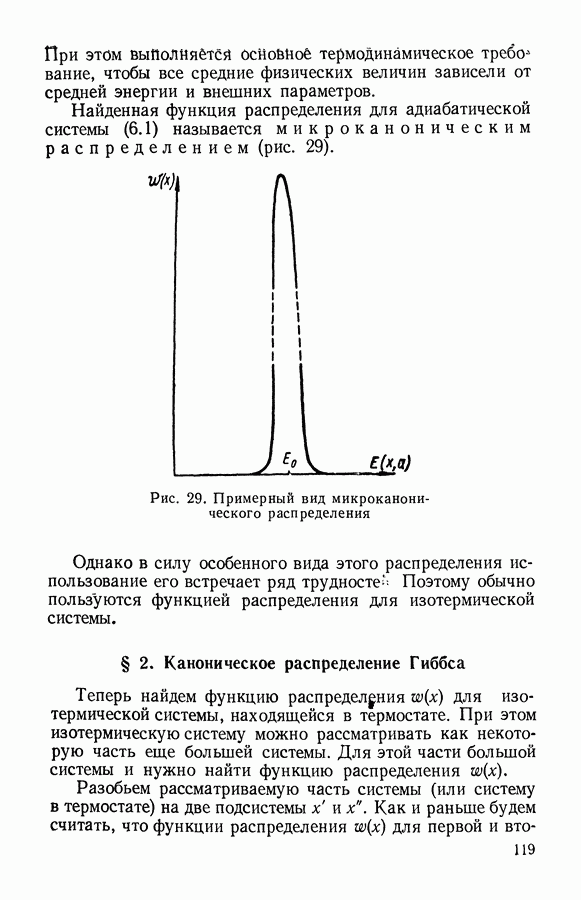
- § 1. Микроканоническое распределение
- § 2. Каноническое распределение Гиббса
- § 3. Свойства канонического распределения
- § 4. Физический смысл параметров канонического распределения
- § 5. Энтропия и ее связь с вероятностью состояния
- § 6. Распределение Максвелла-Больцмана
- § 7. Большое каноническое распределение Гиббса
- Глава VII. ПРИМЕНЕНИЕ РАСПРЕДЕЛЕНИЯ ГИББСА К РЕАЛЬНЫМ СИСТЕМАМ
- § 1. Выражение термодинамических функций через интеграл состояний
- § 2. Интеграл состояний и термодинамические функции идеального газа
- § 3. Статистическое рассмотрение системы взаимодействующих частиц
- § 4. Вывод уравнения состояния реального газа
- § 5. Статистика диэлектриков
- Глава VIII. РАВНОМЕРНОЕ РАСПРЕДЕЛЕНИЕ КИНЕТИЧЕСКОЙ ЭНЕРГИИ ПО СТЕПЕНЯМ СВОБОДЫ
- § 1. Теорема о равномерном распределении энергии по степеням свободы
- § 2. Теплоемкость разреженных газов
- § 3. Теплоемкость твердых тел
- § 4. Применение методов статистической физики к равновесному излучению
- § 5. Классическая теория электронного газа
- Глава IX. ЭЛЕМЕНТЫ ТЕОРИИ ФЛУКТУАЦИЙ
- § 2. Связь флуктуаций со свободной энергией. Корреляция
- § 3. Чувствительность различных измерительных приборов
- § 4. Рассеяние света на флуктуациях плотности
- § 5. Броуновское движение
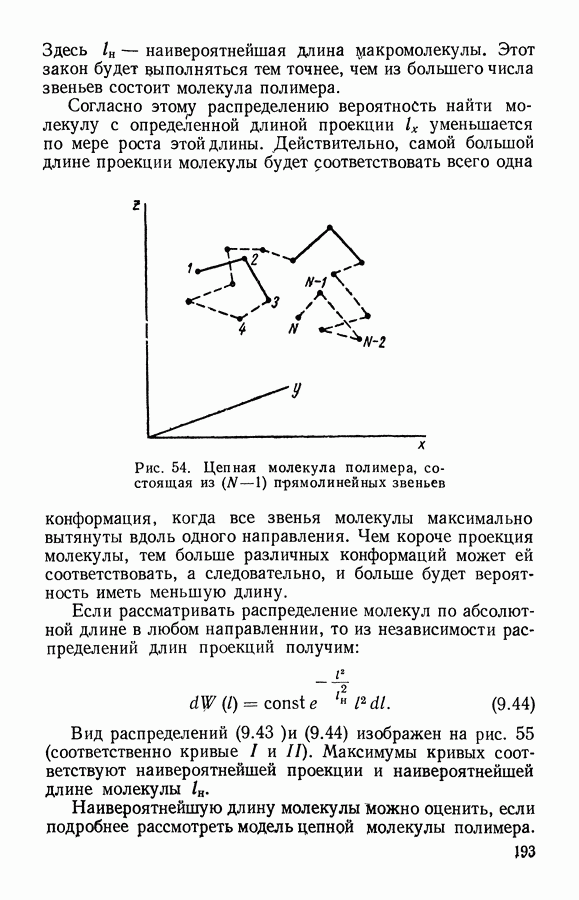
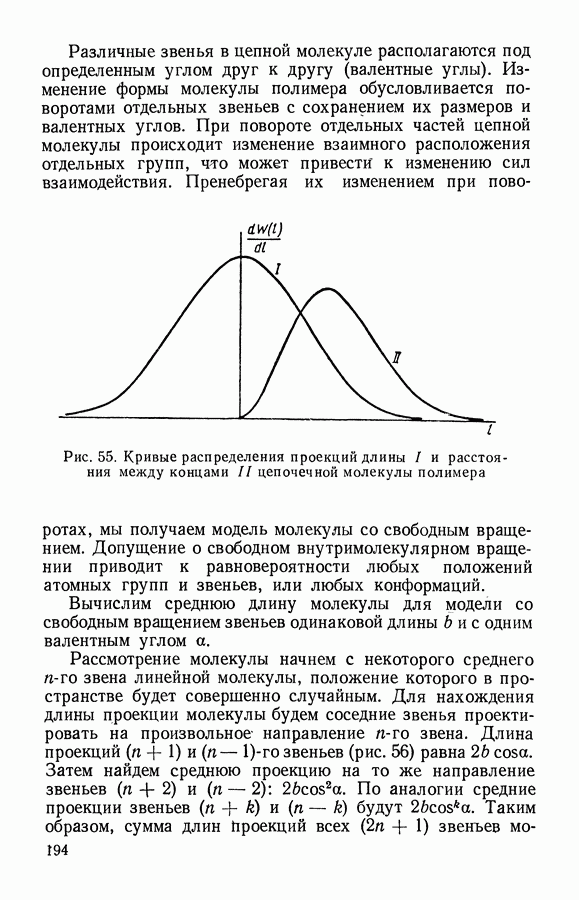
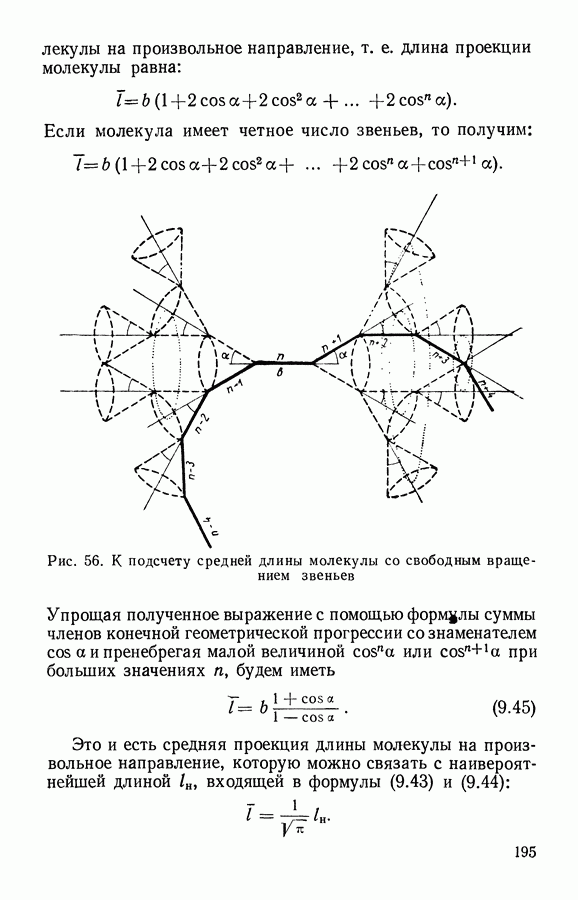
- § 6. Статистика полимеров
- ЧАСТЬ III. КВАНТОВАЯ СТАТИСТИЧЕСКАЯ ФИЗИКА
- § 1. Квантовые системы и их свойства
- § 2. Описание квантовых систем
- § 3. Применение статистического метода к квантовым системам
- § 4. Метод ячеек Больцмана
- § 5. Статистики квантовых систем
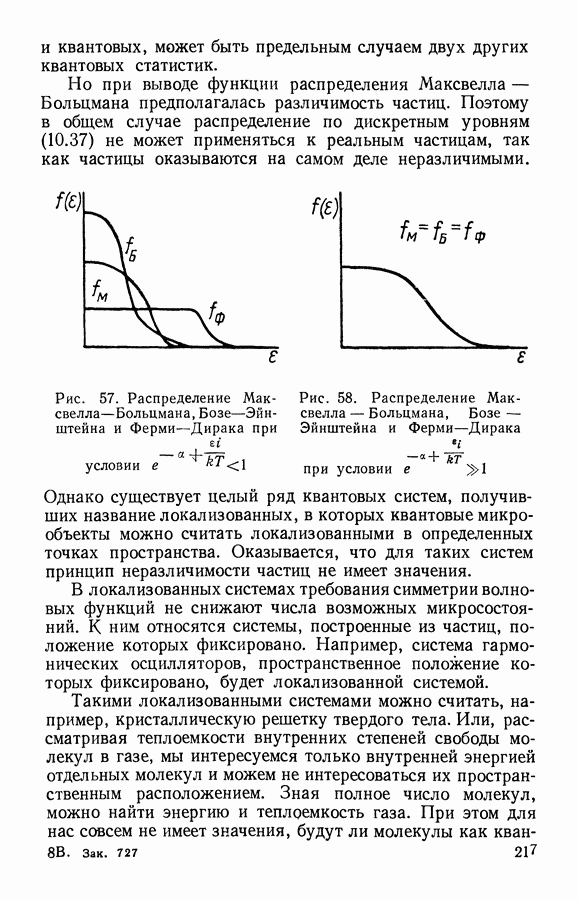
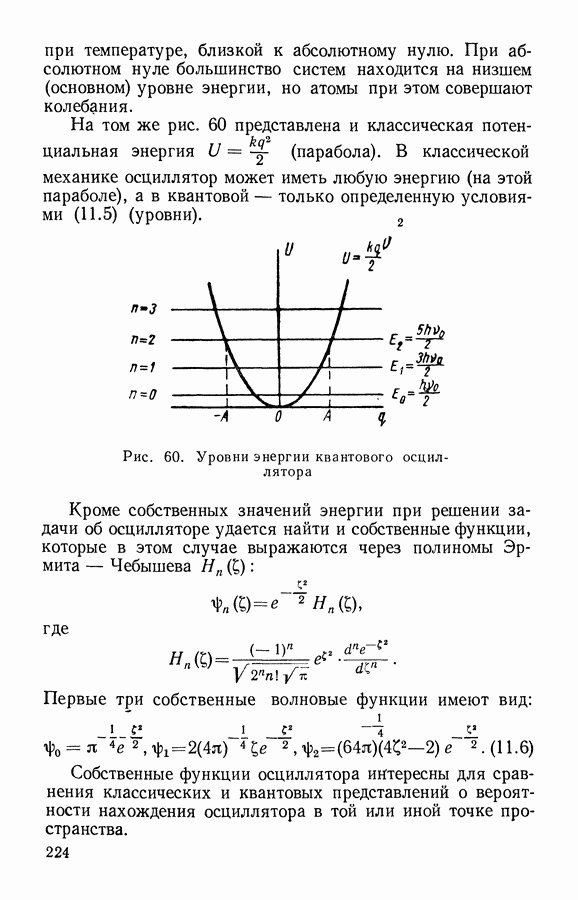
- § 6. Сопоставление статистик Максвелла-Больцмана, Бозе-Эйнштейна и Ферми-Дирака
- Глава XI. ЛОКАЛИЗОВАННЫЕ КВАНТОВЫЕ СИСТЕМЫ
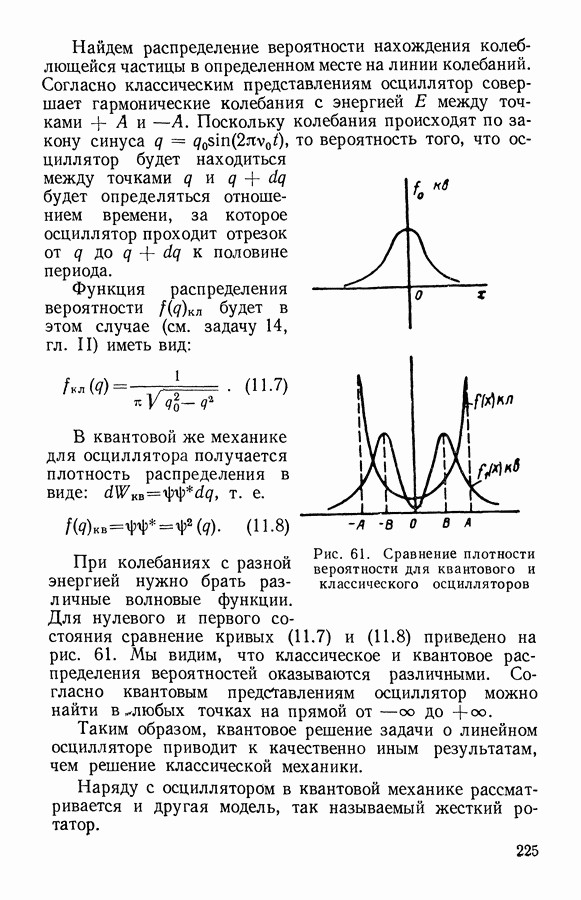
- § 1. Квантовый осциллятор и квантовый ротатор
- § 2. Сумма по состояниям и внутренняя энергия систем осцилляторов и ротаторов
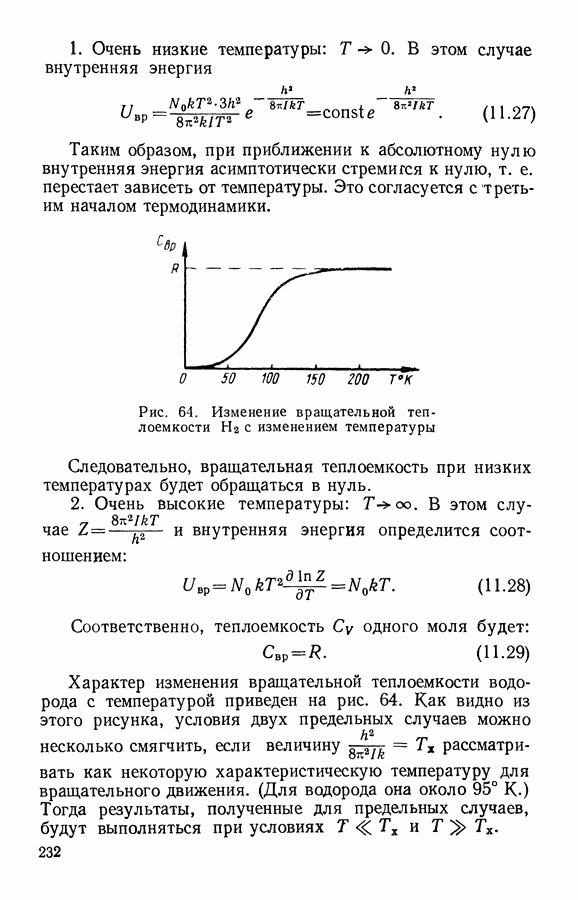
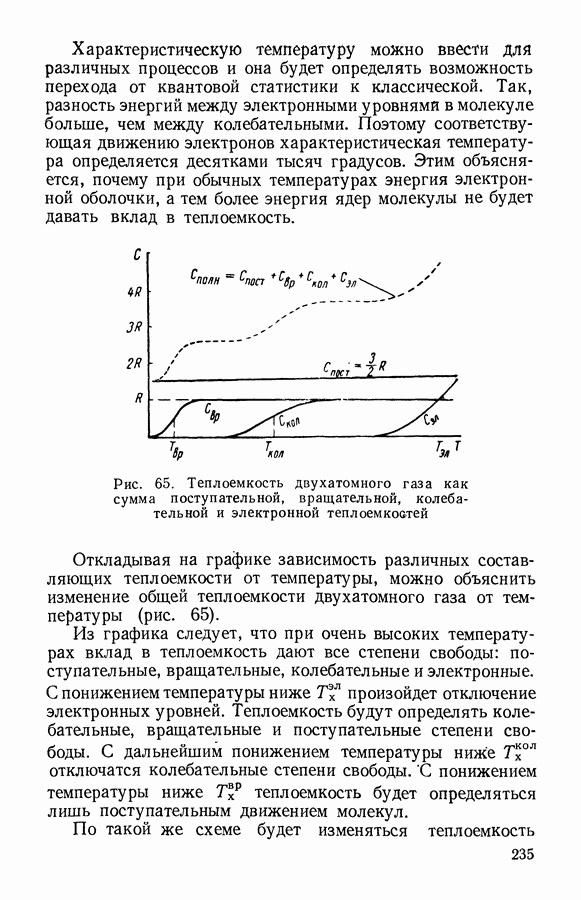
- § 3. Теплоемкость газов. Характеристические температуры
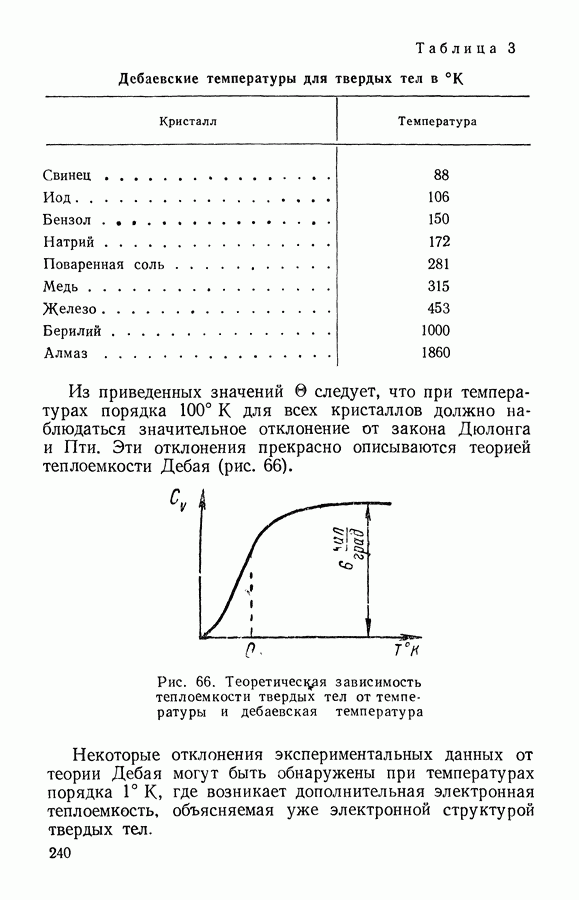
- § 4. Теплоемкость твердых тел. Закон Дебая
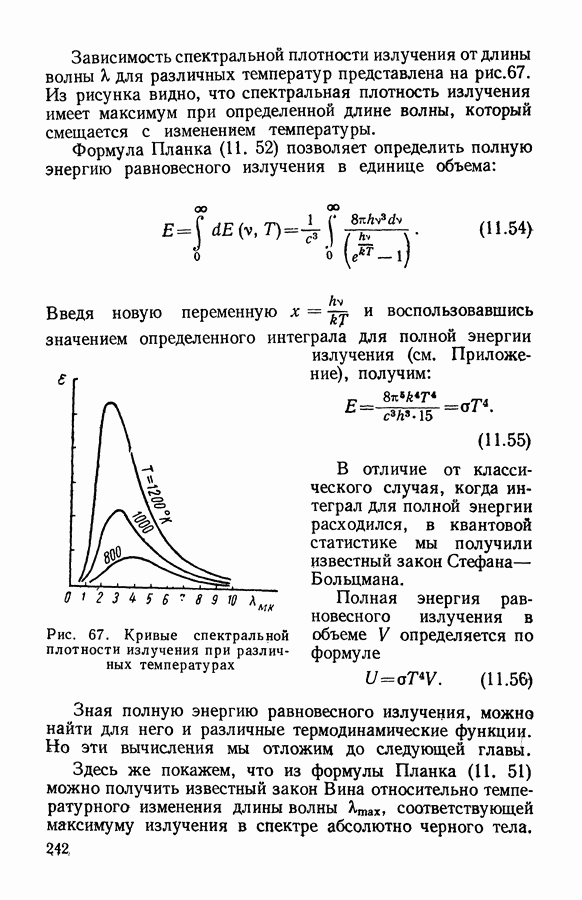
- § 5. Законы равновесного излучения
- § 6. Статистика парамагнетиков
- Глава XII. ПРИМЕНЕНИЕ СТАТИСТИК БОЗЕ — ЭЙНШТЕЙНА И ФЕРМИ — ДИРАКА
- § 1. Применение статистики Бозе — Эйнштейна к описанию системы частиц
- § 2. Равновесное излучение как фотонный газ
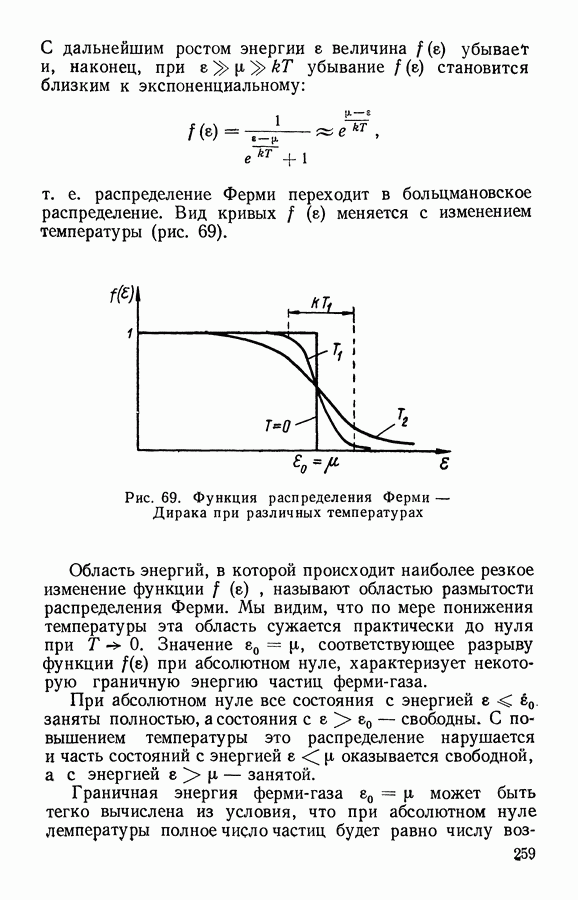
- § 3. Применение статистики Ферми — Дирака к описанию поведения системы частиц
- § 4. Электронный газ в металлах
- § 5. Магнитные свойства электронного газа
- § 6. Состояния систем с отрицательной абсолютной температурой
- ПРИЛОЖЕНИЯ.