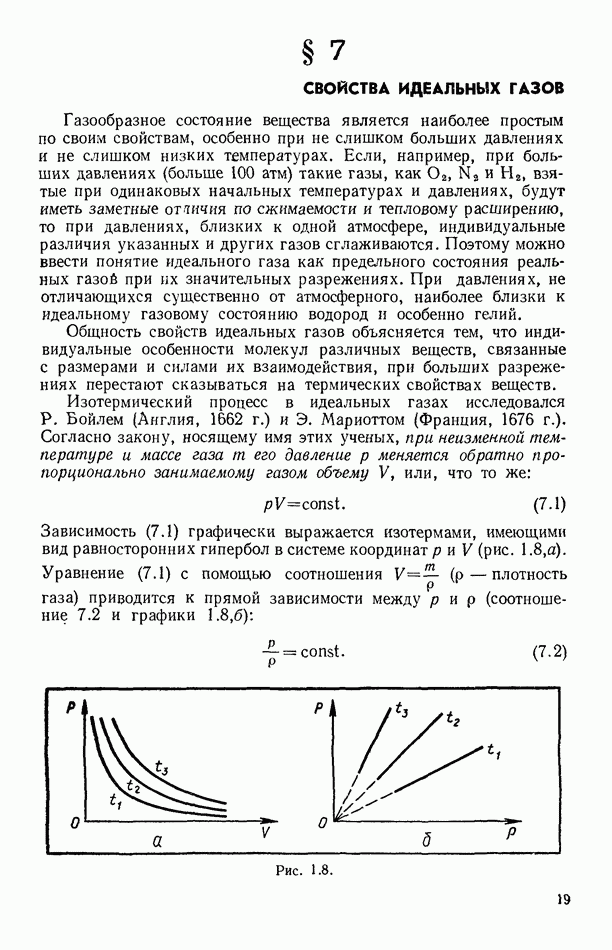
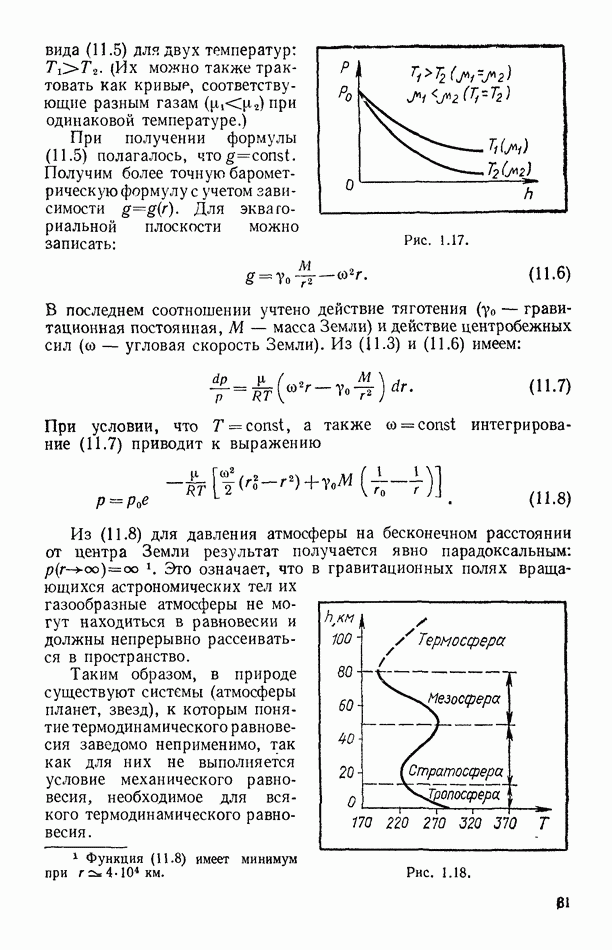
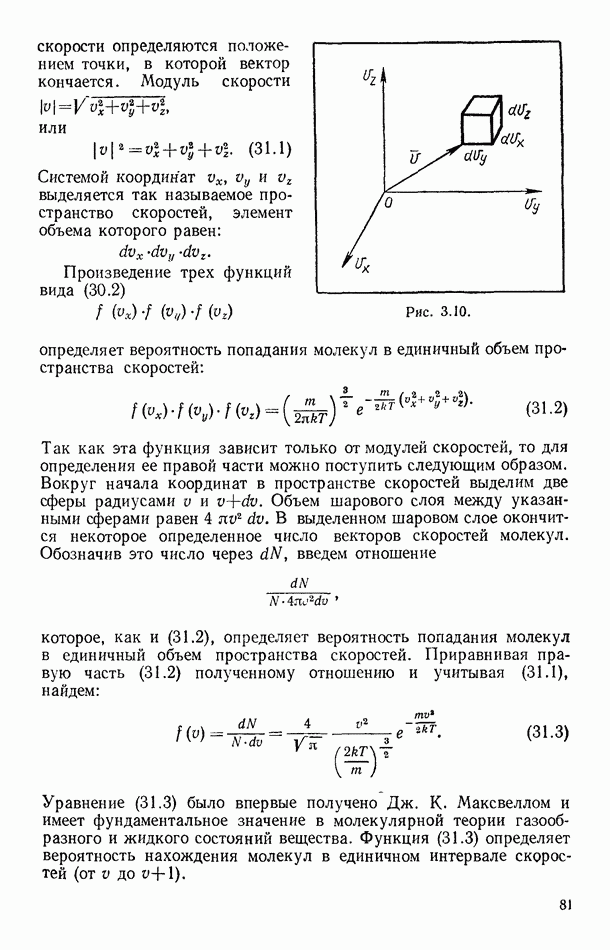
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 21. АДИАБАТИЧЕСКИЙ ПРОЦЕСС В ИДЕАЛЬНОМ ГАЗЕ
Адиабатическим называется процесс, при котором система не получает теплоты извне и не отдает ее. В адиабатическом процессе работа совершается за счет убыли внутренней энергии. Для идеальных газов при  (условие адиабатичности) из
(условие адиабатичности) из  следует, что
следует, что  При адиабатическом расширении газа знаки приращений
При адиабатическом расширении газа знаки приращений  противоположны. Так, при адиабатическом расширении
противоположны. Так, при адиабатическом расширении  изменение же температуры
изменение же температуры  (с расширением происходит охлаждение газа). При сжатии имеет место обратный температурный эффект (адиабатический нагрев).
(с расширением происходит охлаждение газа). При сжатии имеет место обратный температурный эффект (адиабатический нагрев).
Адиабатическое охлаждение воздуха легко демонстрируется с помощью устройства, изображенного на рисунке 2.10. В стеклянную бутыль, содержащую на дне небольшое количество смеси воды и спирта, нагнетается воздух через трубку, вставленную в резиновую пробку. Если затем пробку вынуть из отверстия бутыли, то в

Рис. 2.10.
ней появится туман как результат конденсации паров при их охлаждении.
Равновесный адиабатический процесс можно осуществить с помощью идеализированного устройства, подобного изображенному на рисунке 2.8. Для адиабатичности в этом устройстве цилиндр с газом должен быть изолирован от термостата. (Дно цилиндра должно быть адиабатным.) Если в таком устройстве убрать нагрузку на поршень (убрать несколько песчинок), то удары молекул о поршень вызовут его перемещение, при этом молекулы при ударе об удаляющийся от них поршень теряют часть своей кинетической энергии. (При упругом отражении от удаляющегося поршня, имеющего большую массу, нормальная составляющая скорости молекул уменьшается на удвоенную величину скорости поршня.) При сжатии газа (при увеличении нагрузки на поршень), наоборот, молекулы газа, ударяясь о приближающийся к ним поршень, приобретают дополнительную энергию.
Адиабатический процесс, как и любой процесс в идеальном газе, описывается уравнением Клапейрона — Менделеева, он характеризуется изменением температуры, объема и давления газа. Использование же первого начала термодинамики в случае адиабатического процесса позволяет найти функции, связывающие только два термических параметра:

Все три разновидности функциональной связи называются уравнениями Пуассона. Линии, изображающие указанные функции в координатах  называют адиабатами. Приведем вывод уравнений Пуассона.
называют адиабатами. Приведем вывод уравнений Пуассона.
Первое начало для идеальных газов при  имеет вид
имеет вид

В уравнение состояния

и уравнение (21.1) входят три переменные величины. Исключая из этих соотношений одну переменную, можно получить уравнение, связывающее две переменные. Так, дифференцируя (21.2):

и исключая температуру путем подстановки из  найдем:
найдем:

В полученное уравнение входит отношение теплоемкостей

которое играет чрезвычайно большую роль при описании термодинамических свойств как газов, так и жидкостей и твердых тел. Деля (21.4) на произведение  легко прийти к выражению
легко прийти к выражению

Из последнего выражения следует, что

Это и есть уравнение адиабаты идеального газа (уравнение Пуассона) в переменных 
Сравним уравнение адиабаты (21.6) с уравнением изотермы  Дифференцирование последнего дает:
Дифференцирование последнего дает:

или

Продифференцировав (21,6), получим:

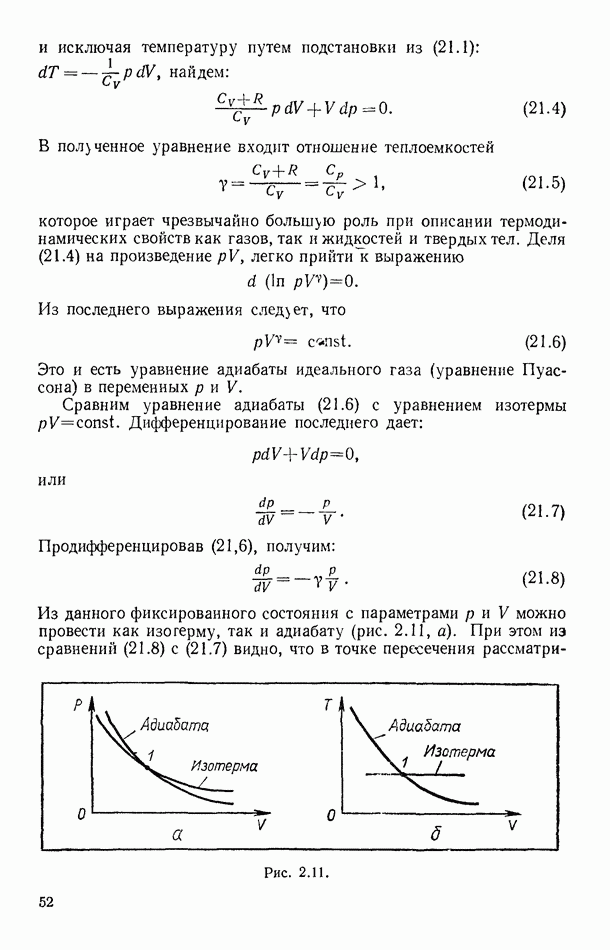
Из данного фиксированного состояния с параметрами  и
и  можно провести как изотерму, так и адиабату (рис. 2.11, а). При этом из сравнений (21.8) с (21.7) видно, что в точке пересечения
можно провести как изотерму, так и адиабату (рис. 2.11, а). При этом из сравнений (21.8) с (21.7) видно, что в точке пересечения

Рис. 1.11.
рассматриваемых кривых тангенс угла наклона адиабаты в у раз больше, чем изотермы (по абсолютному значению).
При увеличениях объема более значительный спад давления по адиабате по сравнению с изотермическим спадом объясняется тем, что при адиабатических изменениях на давление влияет как увеличение объема, так и снижение температуры При изотермических же изменениях давление зависит только от объема.
Два других уравнения Пуассона можно получить несколькими способами. Так, исключая из (21.2) и (21.6) параметр  получим:
получим:

(сравнение адиабаты (21.9) с изотермой дано на рис. 2.11, б). Подобным же образом, исключив из названных уравнений параметр V (предварительно возведя (21.2) в степень  найдем:
найдем:

Рассмотрим работу адиабатического расширения газа. Для этого перепишем (21.1) в форме

где  Для конечных адиабатических изменений следует взять интеграл
Для конечных адиабатических изменений следует взять интеграл  в результате будем иметь:
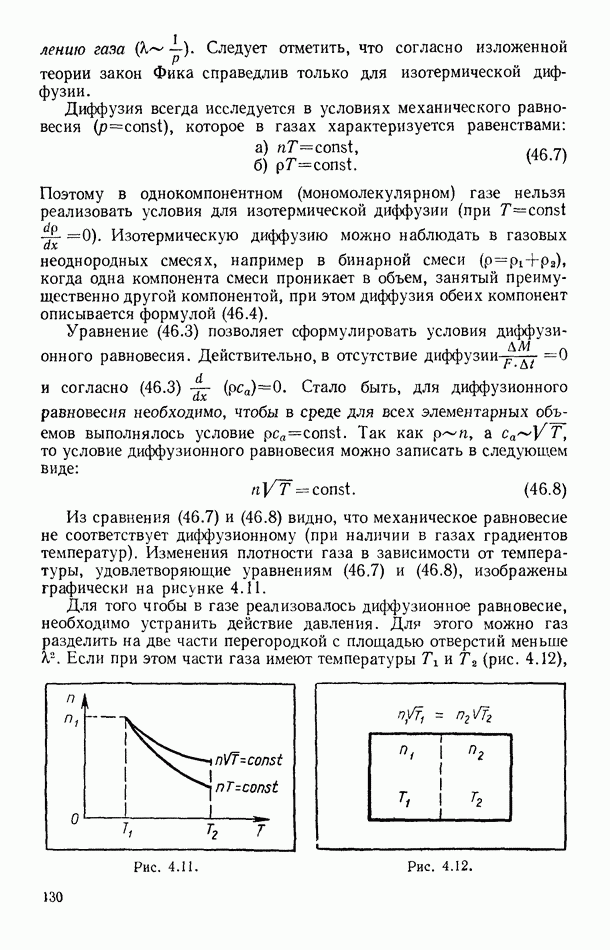
в результате будем иметь:

Полагая, что (21.12) относится к произвольной массе газа, и вводя мольную теплоемкость, перепишем предыдущее уравнение в виде

Формула (21.13) является основной при расчетах работы в адиабатическом процессе. С использованием же (21.9) и (21.10) и вынесением  за скобки можно получить две другие формулы для работы адиабатического расширения газа, полезные при рассмотрении частных случаев:
за скобки можно получить две другие формулы для работы адиабатического расширения газа, полезные при рассмотрении частных случаев:

Теплоемкость, как неоднократно указывалось ранее, зависит от вида процесса. Так, при анализе свойств идеальных газов были введены теплоемкости при постоянном объеме  и при постоянном
и при постоянном
давлении  Теплоемкость же в изотермическом процессе может принимать значения
Теплоемкость же в изотермическом процессе может принимать значения  Детальный анализ этого вопроса показывает, что теплоемкость любой системы в зависимости от процесса может принимать значения от до
Детальный анализ этого вопроса показывает, что теплоемкость любой системы в зависимости от процесса может принимать значения от до  с прохождением через нуль. Нулевая теплоемкость присуща всем телам, испытывающим адиабатические изменения. Действительно, при
с прохождением через нуль. Нулевая теплоемкость присуща всем телам, испытывающим адиабатические изменения. Действительно, при  (условие адиабатичности) имеем:
(условие адиабатичности) имеем:

В заключение заметим, что реализовать равновесный адиабатический процесс в условиях лабораторной практик» чрезвычайно затруднительно из-за отсутствия материалов, которые бы совсем не проводили теплоту. Легче осуществить неравновесное (нестатическое) адиабатное сжатие или расширение газа. При этом стараются процесс провести как можно быстрее, чтобы за время его течения теплообменом через стенки сосуда можно было пренебречь (см. рис. 2.10). На этом основании, например, процесс сжатия горючей смеси в двигателе внутреннего сгорания можно считать близким к адиабатическому, что упрощает многие технические расчеты.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- Глава I. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПОНЯТИЯ И СВОЙСТВА ИДЕАЛЬНЫХ ГАЗОВ
- § 1 О ДВУХ МЕТОДАХ ИССЛЕДОВАНИЯ ФИЗИЧЕСКИХ ЯВЛЕНИЙ
- § 2. ОСНОВНЫЕ ПОНЯТИЯ И ПРЕДСТАВЛЕНИЯ ТЕРМОДИНАМИЧЕСКОГО ОПИСАНИЯ СИСТЕМ
- § 3 ТЕРМИЧЕСКОЕ УРАВНЕНИЕ СОСТОЯНИЯ. РАВНОВЕСНЫЕ ПРОЦЕССЫ
- § 4. ИЗОПРОЦЕССЫ
- § 5. МЕЖДУНАРОДНАЯ ПРАКТИЧЕСКАЯ ТЕМПЕРАТУРНАЯ ШКАЛА
- § 6. МЕТОДЫ ИЗМЕРЕНИЯ ТЕМПЕРАТУРЫ
- § 7. СВОЙСТВА ИДЕАЛЬНЫХ ГАЗОВ
- § 8. РАБОТА РАСШИРЕНИЯ СИСТЕМЫ И ФИЗИЧЕСКИЙ СМЫСЛ УНИВЕРСАЛЬНОЙ ГАЗОВОЙ ПОСТОЯННОЙ
- § 9. УРАВНЕНИЕ СОСТОЯНИЯ СМЕСИ ИДЕАЛЬНЫХ ГАЗОВ
- § 10. ИЗМЕРЕНИЕ ДАВЛЕНИЙ
- § 11. БАРОМЕТРИЧЕСКАЯ ФОРМУЛА
- Глава II. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- § 12. О ЗАКОНЕ СОХРАНЕНИЯ И ПРЕВРАЩЕНИЯ ЭНЕРГИИ
- § 13. РАБОТА КАК МАКРОСКОПИЧЕСКИЙ СПОСОБ ПЕРЕДАЧИ ЭНЕРГИИ
- § 14. ТЕПЛОТА КАК МИКРОФИЗИЧЕСКИЙ СПОСОБ ПЕРЕДАЧИ ЭНЕРГИИ. ТЕПЛОЕМКОСТЬ
- § 15. ИЗМЕРЕНИЕ ТЕПЛОЕМКОСТИ
- § 16. ВНУТРЕННЯЯ ЭНЕРГИЯ КАК ФУНКЦИЯ СОСТОЯНИЯ СИСТЕМЫ
- § 17. ФОРМУЛИРОВКА ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ
- § 18. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ ДЛЯ ИДЕАЛЬНЫХ ГАЗОВ
- § 19. ИЗОБАРИЧЕСКИЙ ПРОЦЕСС В ИДЕАЛЬНОМ ГАЗЕ
- § 20. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС В ИДЕАЛЬНОМ ГАЗЕ
- § 21. АДИАБАТИЧЕСКИЙ ПРОЦЕСС В ИДЕАЛЬНОМ ГАЗЕ
- § 22. ПОЛИТРОПИЧЕСКИЕ ПРОЦЕССЫ В ИДЕАЛЬНОМ ГАЗЕ
- § 23. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ Cp/Cv
- § 24. ТЕПЛОЕМКОСТЬ СМЕСИ ГАЗОВ
- § 18. ЭНТАЛЬПИЯ КАК ФУНКЦИЯ СОСТОЯНИЯ СИСТЕМЫ
- Глава III. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ И ЕЕ ПРИМЕНЕНИЕ К ИДЕАЛЬНЫМ ГАЗАМ
- § 26. ИСХОДНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНОЙ ТЕОРИИ
- § 27. СРЕДНИЕ ВЕЛИЧИНЫ В ОПИСАНИИ МОЛЕКУЛЯРНЫХ СИСТЕМ
- § 28. ОСНОВНЫЕ ПОНЯТИЯ ТЕОРИИ ВЕРОЯТНОСТЕЙ
- § 29. РАСПРЕДЕЛЕНИЕ ЧАСТИЦ ПО ЭНЕРГИЯМ (РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА)
- § 30. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО КОМПОНЕНТАМ СКОРОСТЕЙ ИХ ТЕПЛОВОГО ДВИЖЕНИЯ (РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА)
- § 31. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО СКОРОСТЯМ ИХ ТЕПЛОВОГО ДВИЖЕНИЯ (РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА)
- § 32. ОПЫТНАЯ ПРОВЕРКА РАСПРЕДЕЛЕНИЯ МАКСВЕЛЛА
- § 33. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА ПО КИНЕТИЧЕСКОЙ ТЕОРИИ
- § 34. ПЛОТНОСТЬ ПОТОКА МОЛЕКУЛ В ИДЕАЛЬНОМ ГАЗЕ
- § 35. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ИДЕАЛЬНОГО ГАЗА В ПОЛВ СИЛЫ ТЯЖЕСТИ
- § 36. БРОУНОВСКОЕ ДВИЖЕНИЕ. ОПРЕДЕЛЕНИЕ ПЕРРЕНОМ ЧИСЛА АВОГАДРО
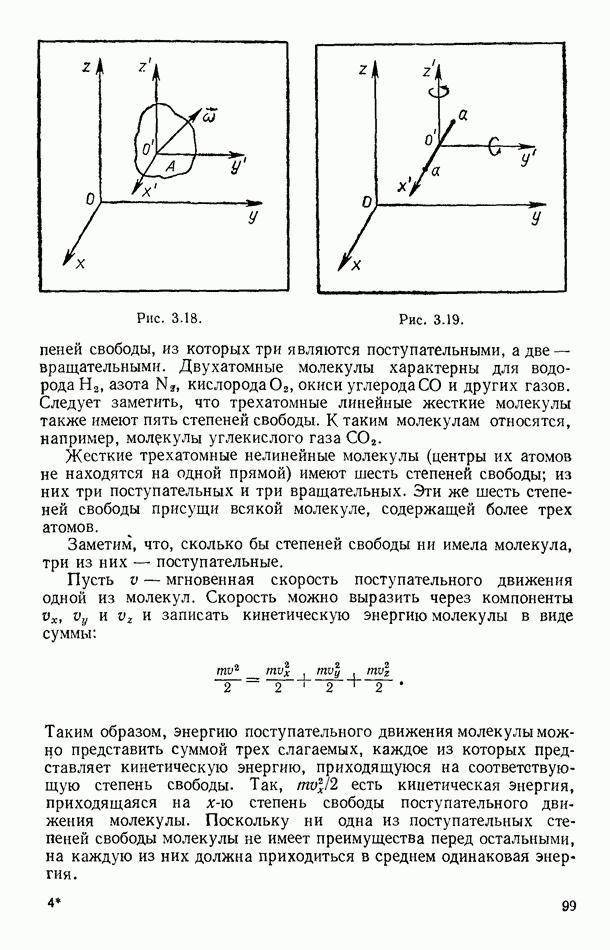
- § 37. ТЕОРЕМА О РАВНОРАСПРЕДЕЛЕНИИ И ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНЫХ ГАЗОВ
- § 38. КВАНТОВАЯ ТЕОРИЯ ТЕПЛОЕМКОСТИ ГАЗОВ
- § 39. ТЕРМОДИНАМИЧЕСКАЯ ВЕРОЯТНОСТЬ И РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ИДЕАЛЬНОГО ГАЗА В ПРОСТРАНСТВЕ
- Глава IV. ЯВЛЕНИЯ ПЕРЕНОСА И ИХ ТЕОРИЯ ДЛЯ ИДЕАЛЬНЫХ ГАЗОВ
- § 40. ТЕПЛОПРОВОДНОСТЬ
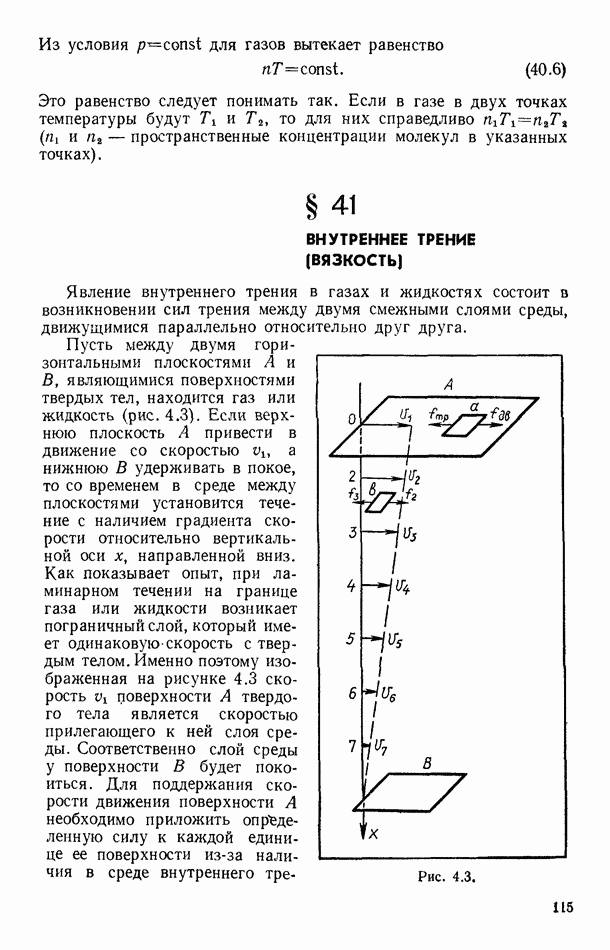
- § 41. ВНУТРЕННЕЕ ТРЕНИЕ (ВЯЗКОСТЬ)
- § 42. ДИФФУЗИЯ
- § 43. СРЕДНЯЯ ДЛИНА СВОБОДНОГО ПРОБЕГА МОЛЕКУЛ
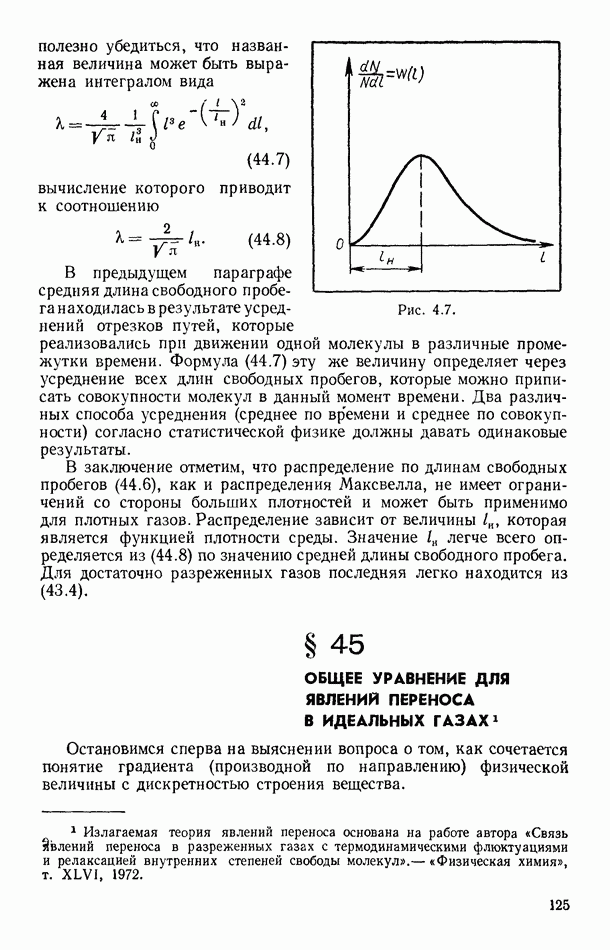
- § 44. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО ДЛИНАМ ИХ СВОБОДНЫХ ПРОБЕГОВ
- § 45. ОБЩЕЕ УРАВНЕНИЕ ДЛЯ ЯВЛЕНИИ ПЕРЕНОСА В ИДЕАЛЬНЫХ ГАЗАХ
- § 46. ДИФФУЗИЯ В ИДЕАЛЬНЫХ ГАЗАХ
- § 47. ВНУТРЕННЕЕ ТРЕНИЕ В ИДЕАЛЬНЫХ ГАЗАХ
- § 48. ТЕПЛОПРОВОДНОСТЬ ИДЕАЛЬНЫХ ГАЗОВ
- § 49. СВЯЗЬ МЕЖДУ КОЭФФИЦИЕНТАМИ ПЕРЕНОСА
- Глава V. СИЛЬНО РАЗРЕЖЕННЫЕ ГАЗЫ
- § 50. ПОЛУЧЕНИЕ И ИЗМЕРЕНИЕ ВАКУУМА
- § 51. СИЛЫ ТРЕНИЯ в ВАКУУМЕ
- § 52. ТЕПЛОПЕРЕДАЧА В ВАКУУМЕ
- § 53. ДИФФУЗИЯ В ВАКУУМЕ
- Глава VI. РЕАЛЬНЫЕ ГАЗЫ
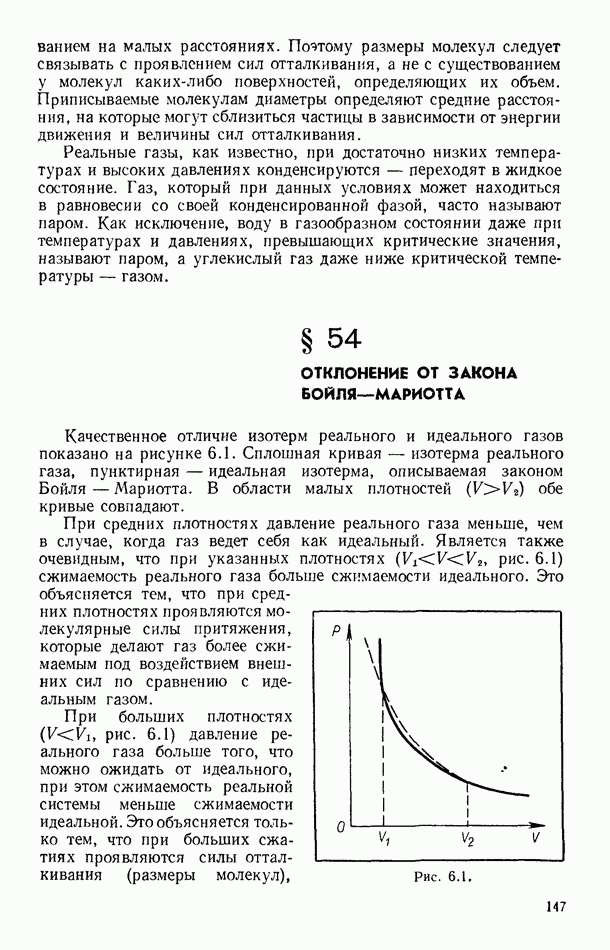
- § 54. ОТКЛОНЕНИЕ ОТ ЗАКОНА БОЙЛЯ—МАРИОТТА
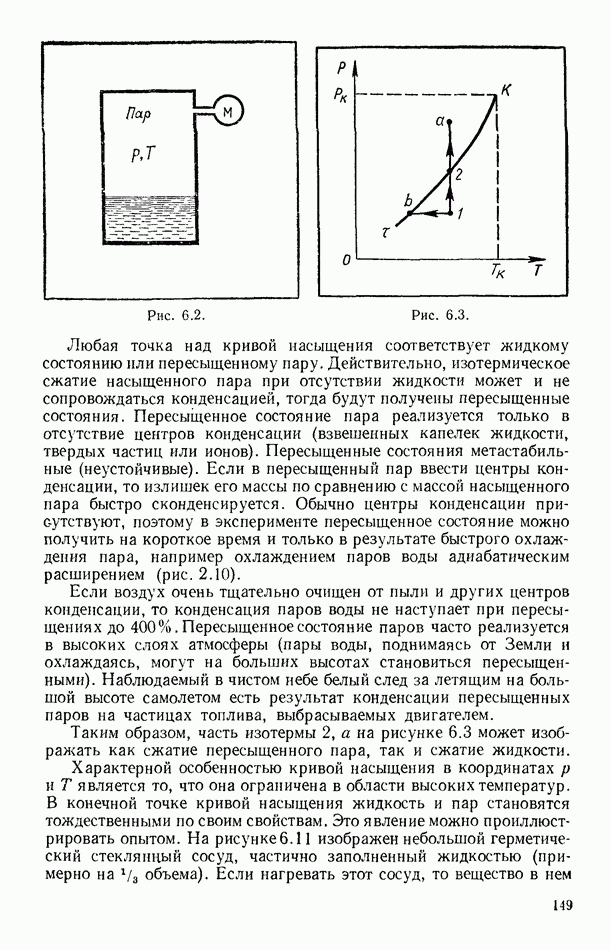
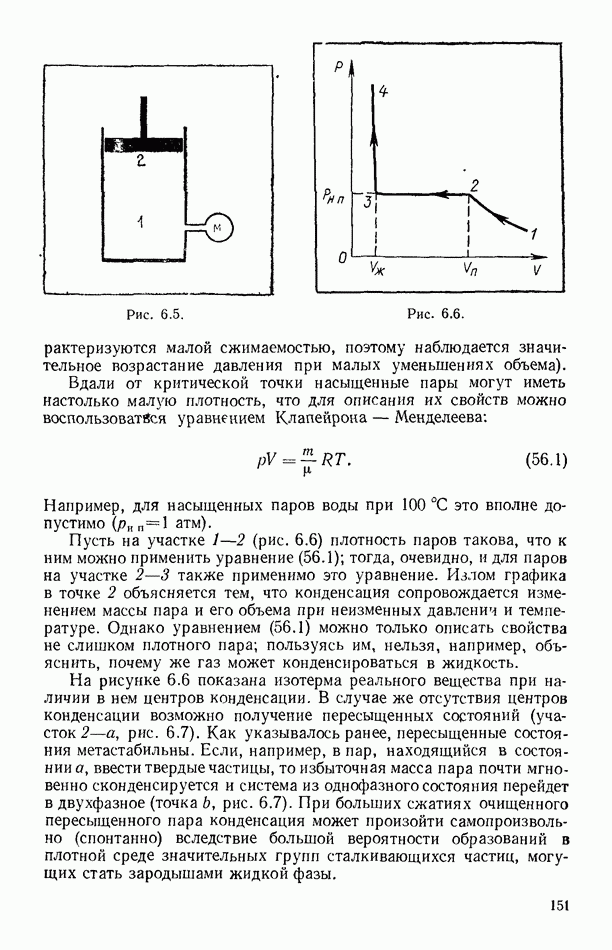
- § 55. РАВНОВЕСИЕ СИСТЕМЫ ЖИДКОСТЬ — ПАР
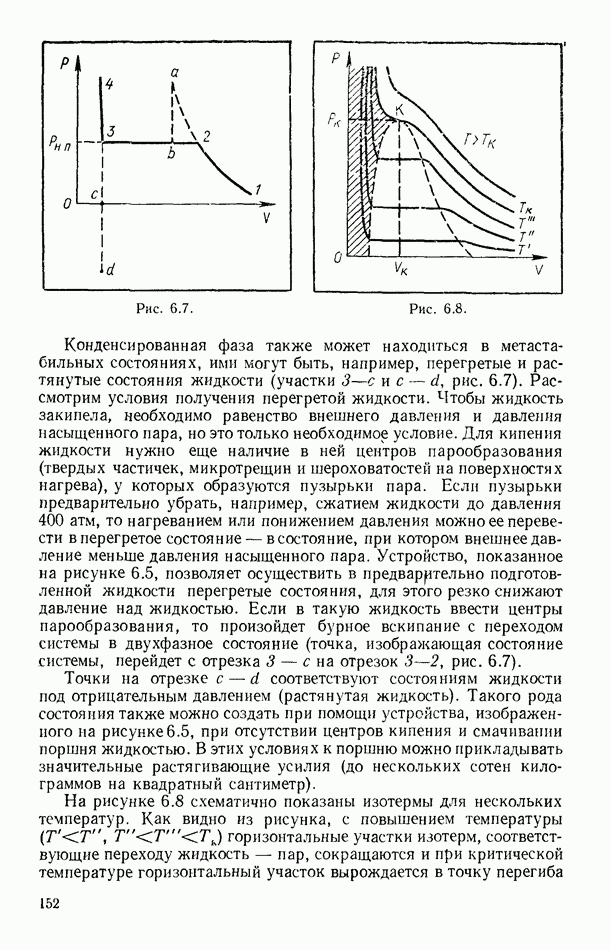
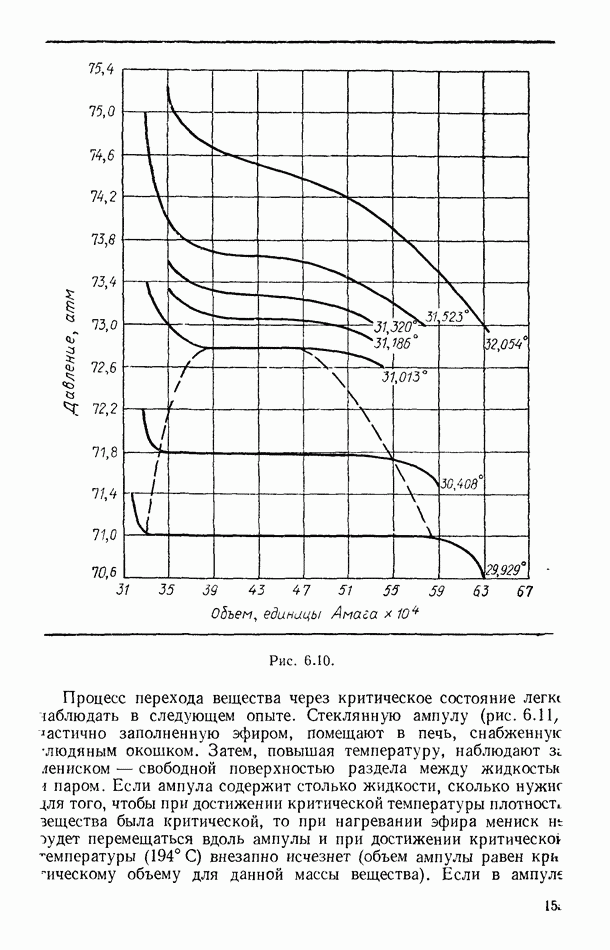
- § 56. ЭКСПЕРИМЕНТАЛЬНЫЕ ИЗОТЕРМЫ. КРИТИЧЕСКОЕ СОСТОЯНИЕ ВЕЩЕСТВА
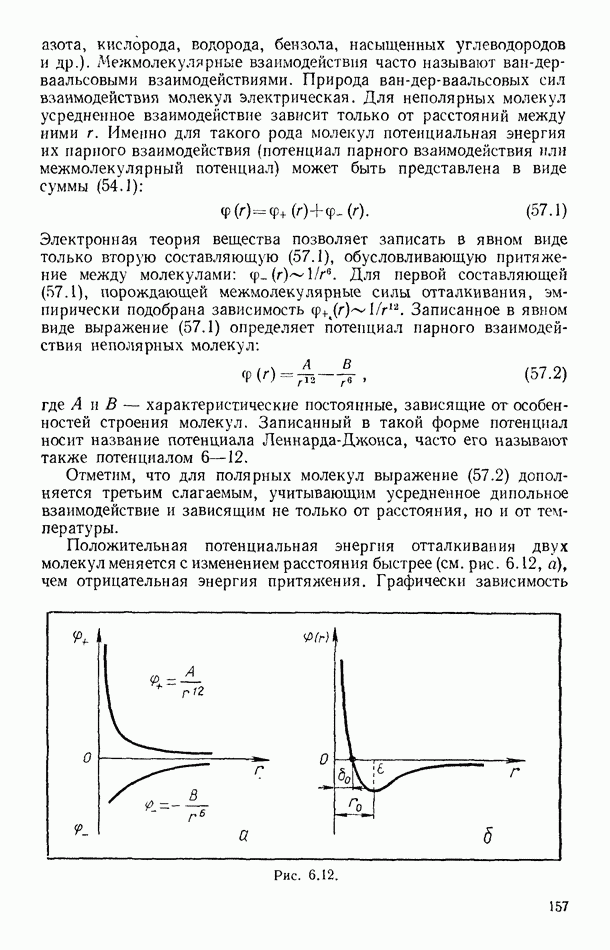
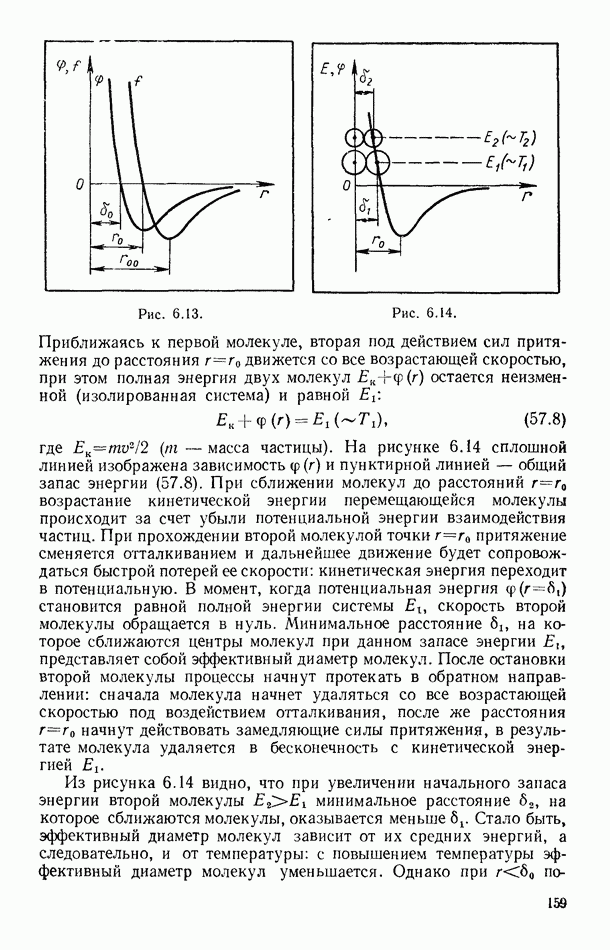
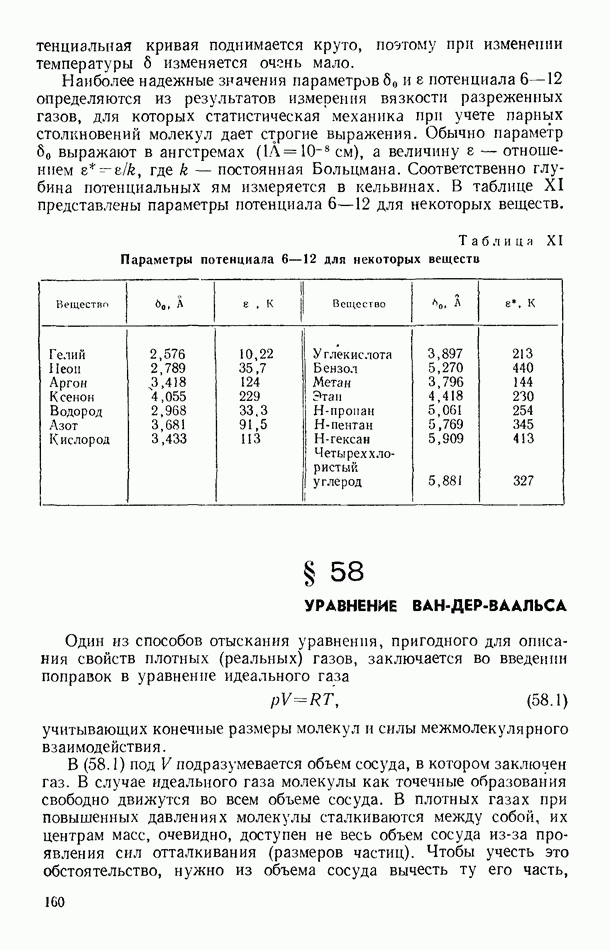
- § 57. ПОТЕНЦИАЛ ПАРНОГО ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ
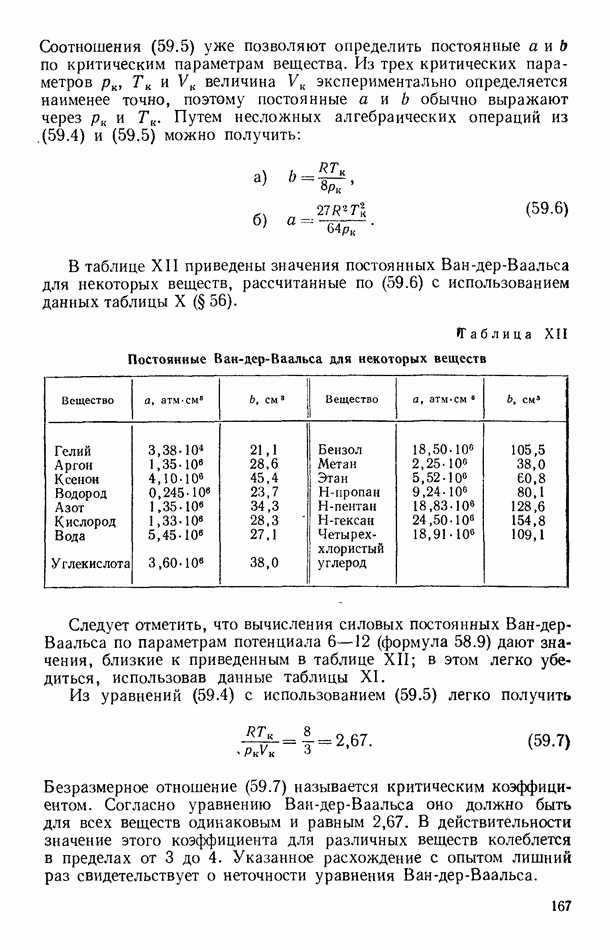
- § 58. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА
- § 59. ИЗОТЕРМЫ ВАН-ДЕР-ВААЛЬСА. КРИТИЧЕСКИЕ ПАРАМЕТРЫ И ПОСТОЯННЫЕ ВАН-ДЕР-ВААЛЬСА
- § 60. ВНУТРЕННЯЯ ЭНЕРГИЯ РЕАЛЬНОГО ГАЗА. ЭФФЕКТ ДЖОУЛЯ — ТОМСОНА
- § 61. СЖИЖЕНИЕ ГАЗОВ
- § 62. УРАВНЕНИЕ СОСТОЯНИЯ РЕАЛЬНЫХ ГАЗОВ В ВИРИАЛЬНОЙ ФОРМЕ
- Глава VII. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
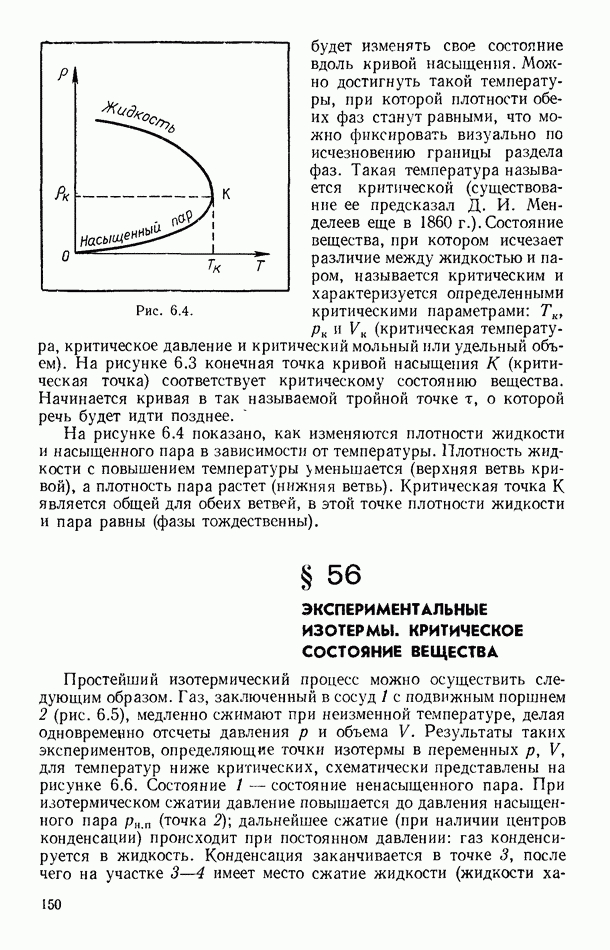
- § 63. РАВНОВЕСНЫЕ И НЕРАВНОВЕСНЫЕ ПРОЦЕССЫ
- § 64. ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ
- § 65. ЦИКЛИЧЕСКИЕ (КРУГОВЫЕ) ПРОЦЕССЫ
- § 66. ЦИКЛ КАРНО
- § 67. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ ДЛЯ ОБРАТИМЫХ ПРОЦЕССОВ
- § 68. ЭНТРОПИЯ КАК ФУНКЦИЯ СОСТОЯНИЯ СИСТЕМЫ
- § 69. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ ДЛЯ НЕОБРАТИМЫХ ПРОЦЕССОВ
- § 70. НЕРАВЕНСТВО КЛАУЗИУСА. ПРИНЦИП ВОЗРАСТАНИЯ ЭНТРОПИИ
- § 71. ЭНТРОПИЯ И ВЕРОЯТНОСТЬ СОСТОЯНИЯ СИСТЕМЫ
- § 72. О ТАК НАЗЫВАЕМОЙ «ТЕПЛОВОЙ СМЕРТИ ВСЕЛЕННОЙ»
- § 73. ИЗОЭНТРОПИЧЕСКОЕ СОСТОЯНИЕ ТРОПОСФЕРЫ ЗЕМЛИ
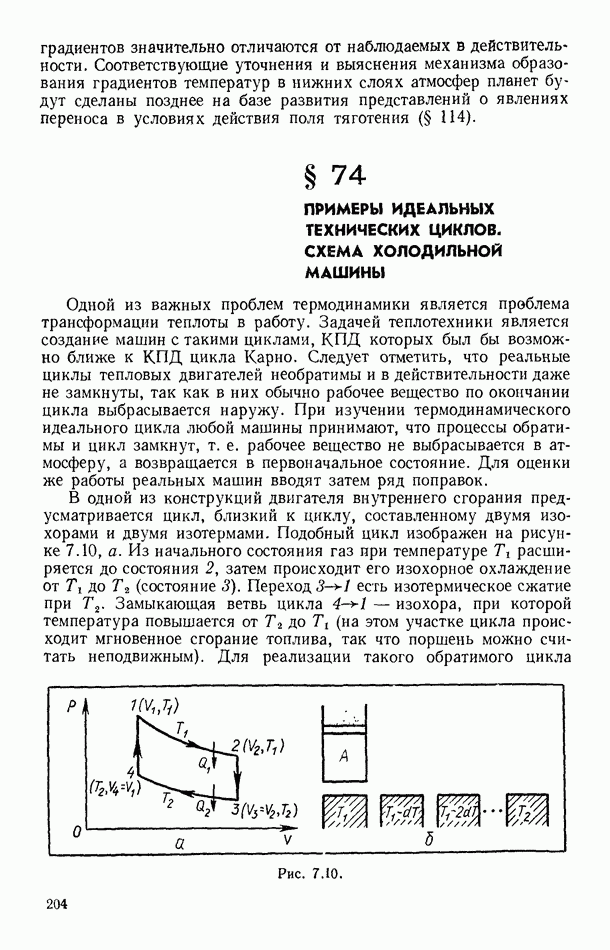
- § 74. ПРИМЕРЫ ИДЕАЛЬНЫХ ТЕХНИЧЕСКИХ ЦИКЛОВ. СХЕМА ХОЛОДИЛЬНОЙ МАШИНЫ
- Глава VIII. ЖИДКОСТИ
- § 75. ТЕПЛОВОЕ ДВИЖЕНИЕ И СТРУКТУРА ЖИДКОСТЕЙ
- § 76. ОСНОВНЫЕ СВОЙСТВА ЖИДКОСТЕЙ
- § 77. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ ЖИДКОСТЕЙ
- § 78. МОЛЕКУЛЯРНОЕ ДАВЛЕНИЕ ПОВЕРХНОСТНОГО СЛОЯ ЖИДКОСТИ
- § 79. СИЛЫ, ВОЗНИКАЮЩИЕ НА КРИВОЙ ПОВЕРХНОСТИ ЖИДКОСТЕЙ
- § 80. КРАЕВОЙ УГОЛ. КАПИЛЛЯРНЫЕ ЯВЛЕНИЯ
- § 81. КИПЕНИЕ ЖИДКОСТЕЙ
- § 82. ТЕПЛОТА ПАРООБРАЗОВАНИЯ ЖИДКОСТЕЙ
- § 83. УРАВНЕНИЕ КЛАПЕЙРОНА — КЛАУЗИУСА
- § 84. ВЯЗКОСТЬ ЖИДКОСТЕЙ
- § 85. ЖИДКИЕ РАСТВОРЫ. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ. ЗАКОН РАУЛЯ
- § 86. ЖИДКИЙ ГЕЛИЙ. СВЕРХТЕКУЧЕСТЬ
- Глава IX. ТВЕРДЫЕ ТЕЛА
- § 87. ОСНОВНЫЕ ОСОБЕННОСТИ ТВЕРДЫХ ТЕЛ
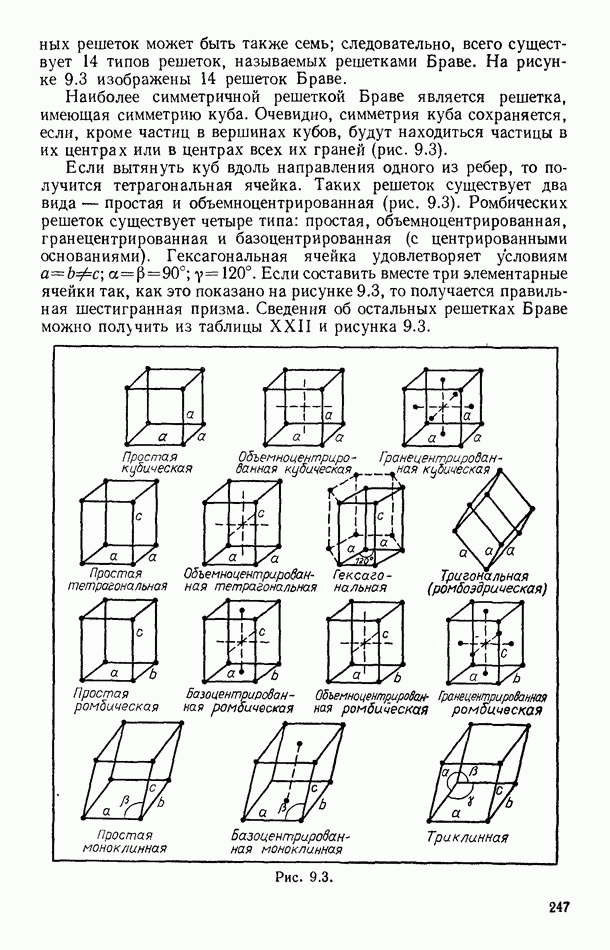
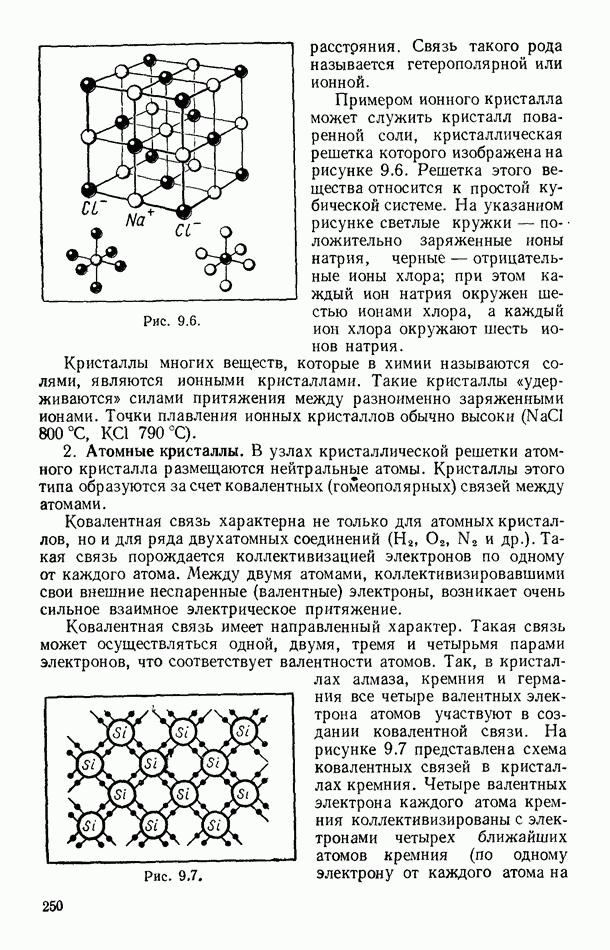
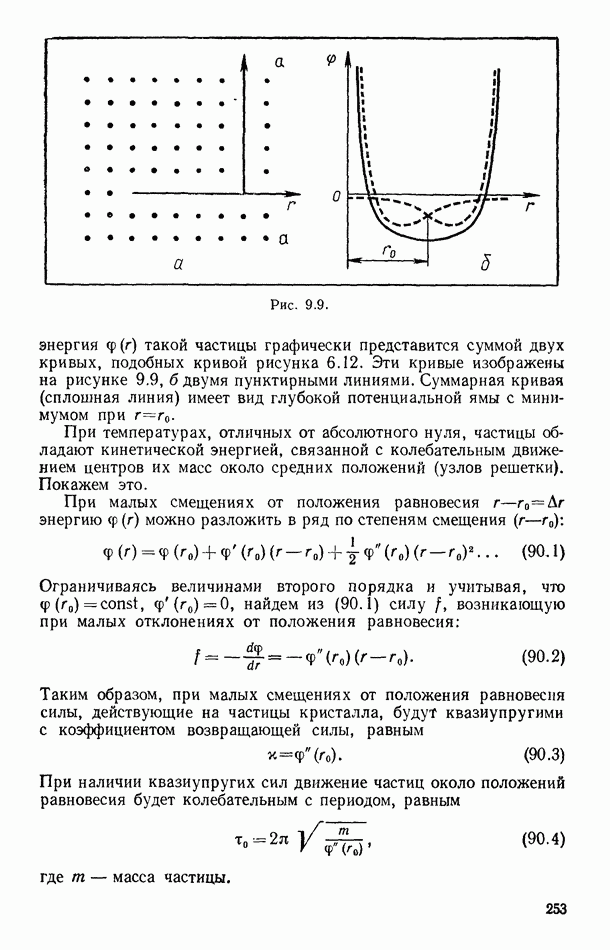
- § 88. СТРУКТУРА КРИСТАЛЛОВ
- § 89. ФИЗИЧЕСКИЕ ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК
- § 90. ТЕПЛОВОЕ ДВИЖЕНИЕ В КРИСТАЛЛАХ
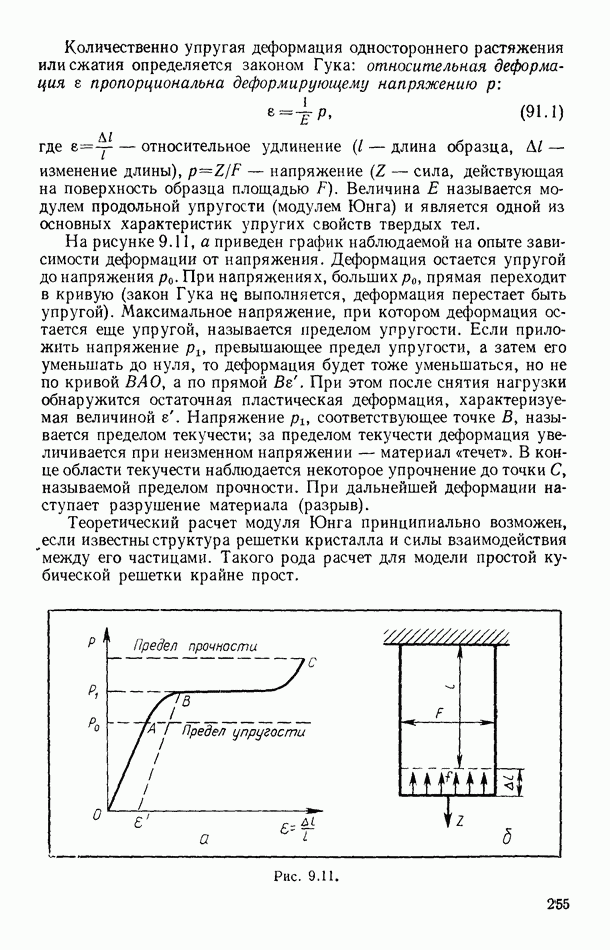
- § 91. МЕХАНИЧЕСКИЕ СВОЙСТВА КРИСТАЛЛОВ
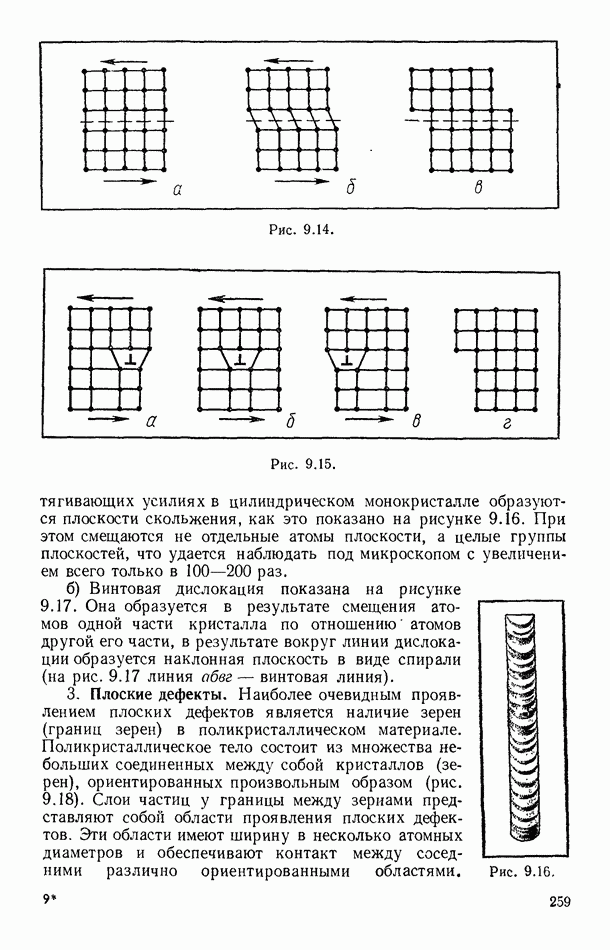
- § 92. ДЕФЕКТЫ В ТВЕРДЫХ ТЕЛАХ
- § 93. ТЕПЛОВОЕ РАСШИРЕНИЕ ТВЕРДЫХ ТЕЛ
- § 94. ТЕПЛОЕМКОСТЬ ТВЕРДЫХ ТЕЛ
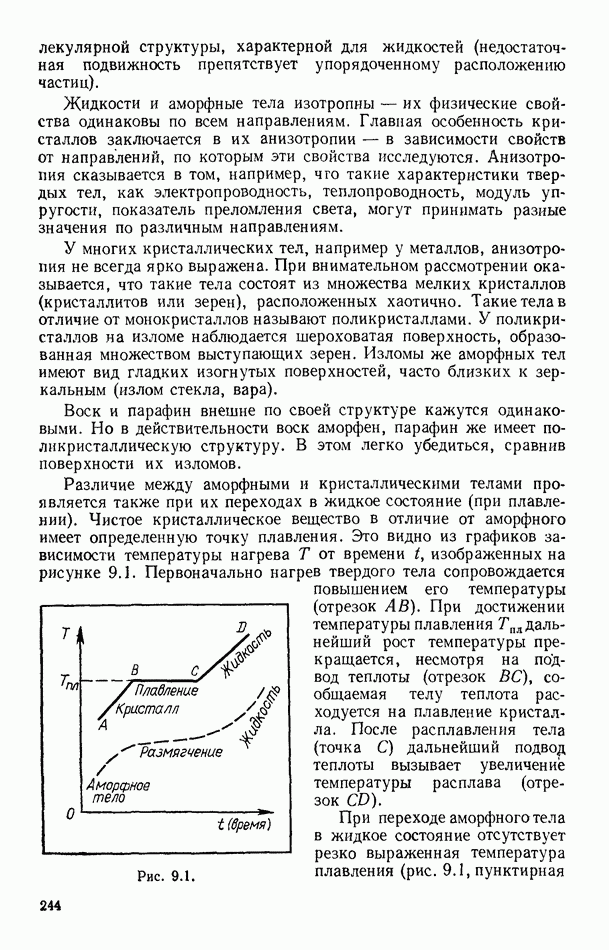
- § 95. ПЛАВЛЕНИЕ И КРИСТАЛЛИЗАЦИЯ
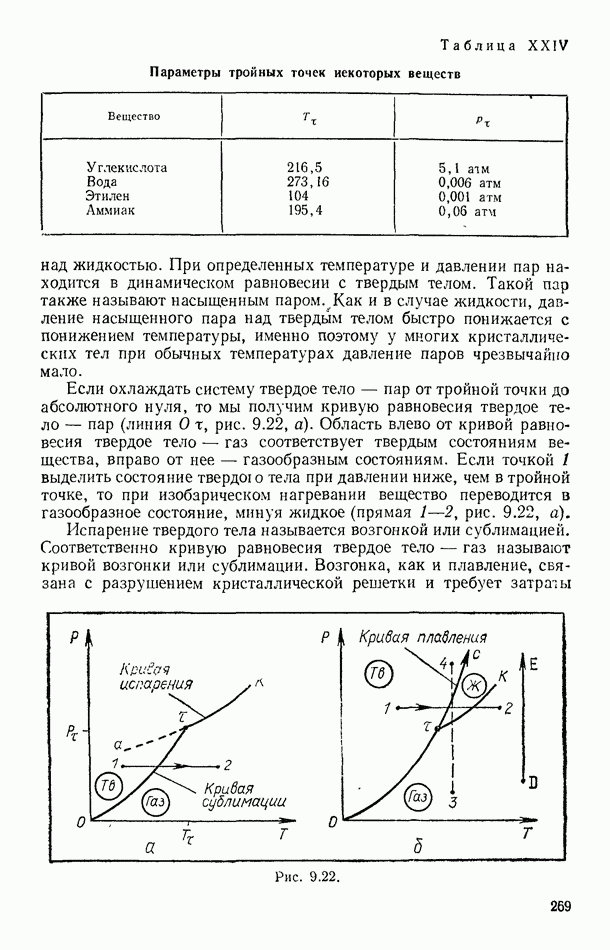
- § 96. ДИАГРАММЫ СОСТОЯНИЙ. ТРОЙНАЯ ТОЧКА
- § 97. ТЕПЛОТА ПЛАВЛЕНИЯ ПРОСТЫХ КРИСТАЛЛИЧЕСКИХ СТРУКТУР
- Глава X. ПОЛИМЕРЫ
- § 98. ОБЩИЕ ПРЕДСТАВЛЕНИЯ
- § 99. ПОЛУЧЕНИЕ ПОЛИМЕРОВ
- § 100. НЕКОТОРЫЕ ТИПЫ ПОЛИМЕРОВ. РОЛЬ МЕЖМОЛЕКУЛЯРНЫХ ВЗАИМОДЕЙСТВИЙ
- § 101. ТРИ СОСТОЯНИЯ АМОРФНЫХ ПОЛИМЕРОВ И ТЕПЛОВОЕ ДВИЖЕНИЕ В НИХ
- § 102. ЭЛАСТИЧНОСТЬ ПОЛИМЕРОВ
- § 103. КРИСТАЛЛИЧЕСКИЕ ПОЛИМЕРЫ
- § 104. ПРИМЕНЕНИЕ ПОЛИМЕРНЫХ МАТЕРИАЛОВ
- Глава XI. ЭЛЕМЕНТЫ ТЕРМОДИНАМИКИ ТЕКУЧИХ СРЕД И РАКЕТНОЙ ТЕХНИКИ
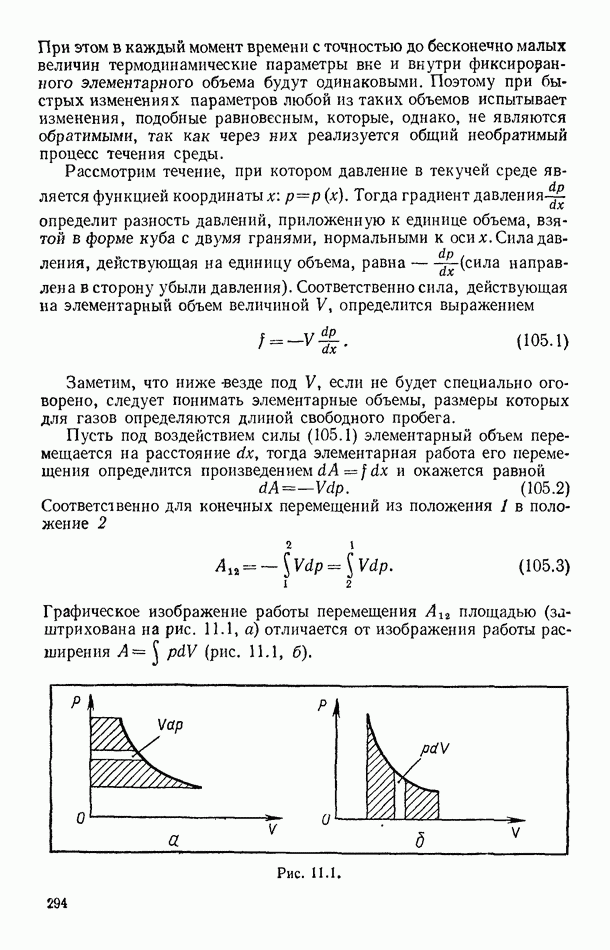
- § 105. РАБОТА ПЕРЕМЕЩЕНИЯ В ТЕКУЧИХ СРЕДАХ
- § 106. ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ ДЛЯ ПОТОКОВ ГАЗОВ И ЖИДКОСТЕЙ
- § 107. ЧАСТНЫЕ СЛУЧАИ ТЕЧЕНИЯ СРЕД
- § 108. ИСТЕЧЕНИЕ ГАЗОВ ИЗ СОПЕЛ. КРИТИЧЕСКАЯ СКОРОСТЬ
- § 109. ПРИНЦИП ДВИЖЕНИЯ РАКЕТ
- § 110. ЭЛЕМЕНТАРНАЯ ТЕРМОДИНАМИКА РАКЕТНОГО ДВИГАТЕЛЯ
- § 111. СХЕМЫ РАКЕТНЫХ ДВИГАТЕЛЕЙ
- § 112. МНОГОСТУПЕНЧАТЫЕ РАКЕТЫ
- § 113. ДВИЖЕНИЕ СО СВЕРХЗВУКОВОЙ СКОРОСТЬЮ. УДАРНЫЕ ВОЛНЫ
- § 114. О ГРАДИЕНТЕ ТЕМПЕРАТУРЫ В ТРОПОСФЕРЕ ЗЕМЛИ