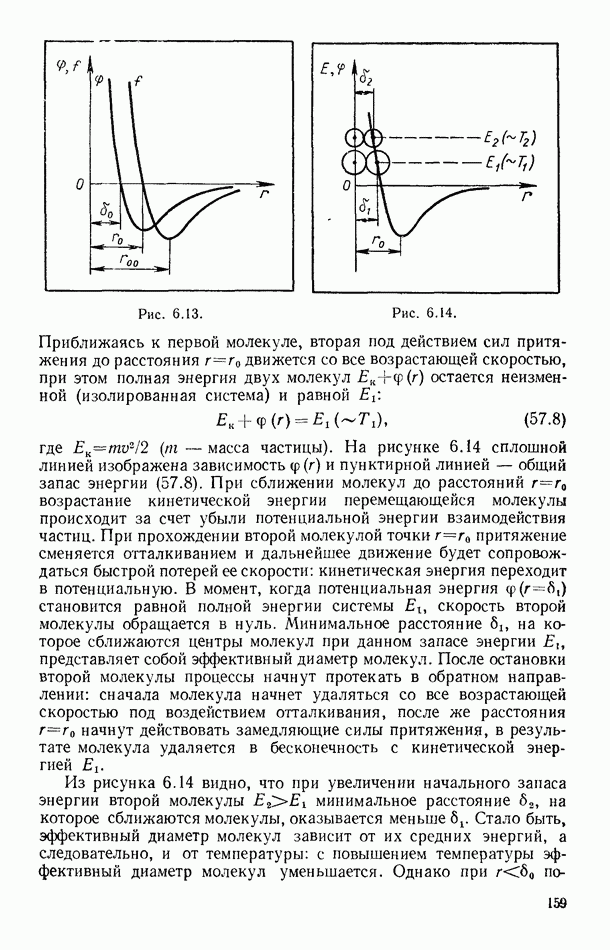
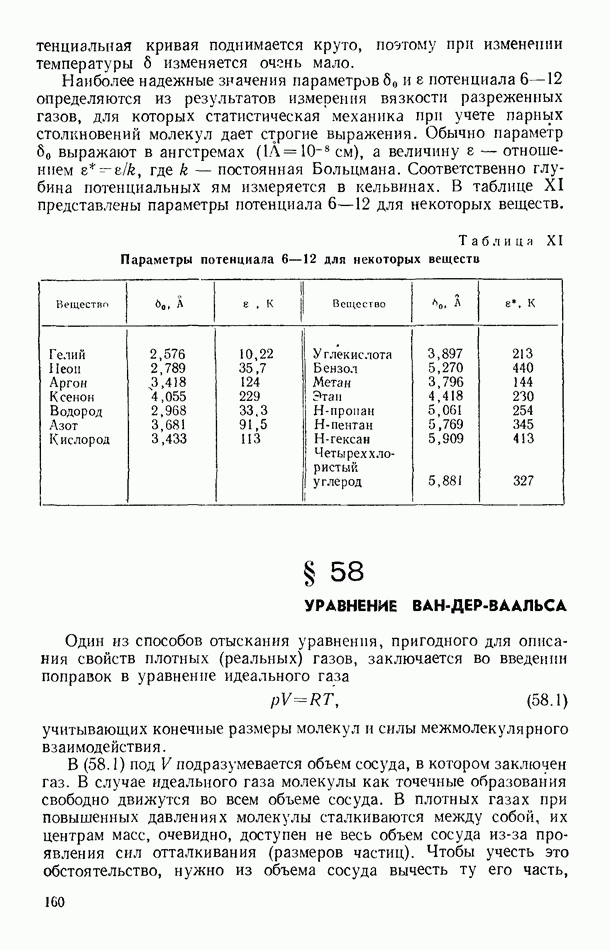
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 59. ИЗОТЕРМЫ ВАН-ДЕР-ВААЛЬСА. КРИТИЧЕСКИЕ ПАРАМЕТРЫ И ПОСТОЯННЫЕ ВАН-ДЕР-ВААЛЬСА
Уравнение Ван-дер-Ваальса после преобразований приводится к виду

Это уравнение третьей степени относительно объема и имеет три корня (фиксированным значениям температуры и давления соответствуют три значения объема). Эти три корня могут быть либо все действительные, либо два из них мнимые и один действительный; мнимые корни для рассматриваемого уравнения не имеют физического смысла, и мы на них останавливаться не будем.
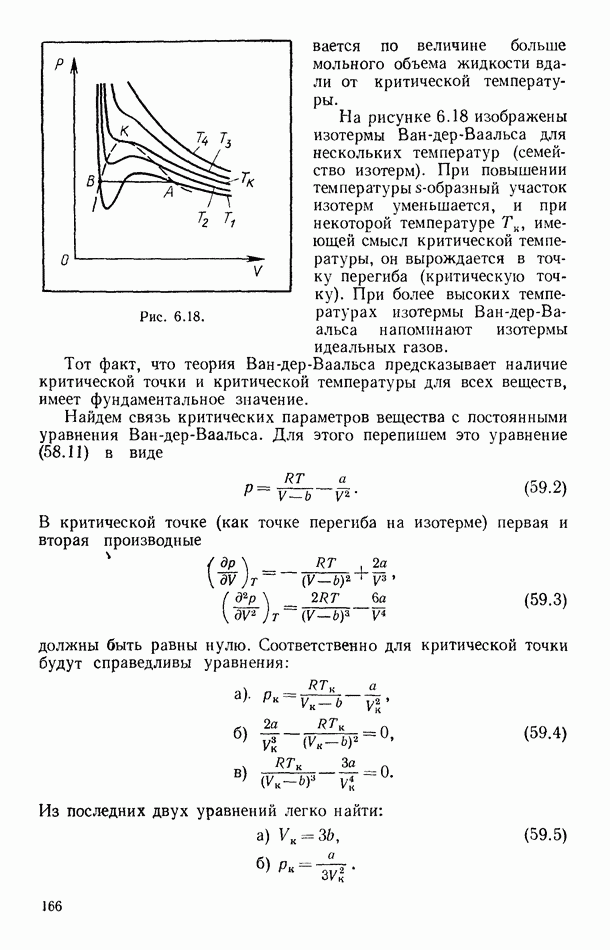
Одна из изотерм уравнения (59.1) (изотерма Ван-дер-Ваальса) для температуры ниже критической представлена на рисунке 6.17. Эта изотерма имеет  -образный участок с наличием максимума и минимума, так что на этом участке одному значению давления, например
-образный участок с наличием максимума и минимума, так что на этом участке одному значению давления, например  соответствуют три значения объема:
соответствуют три значения объема:  Сопоставление полученных результатов с действительными свойствами газов и паров позволяет заключить, что максимальному из трех объемов соответствует газообразное состояние, минимальному — жидкое. Очевидно, при давлениях
Сопоставление полученных результатов с действительными свойствами газов и паров позволяет заключить, что максимальному из трех объемов соответствует газообразное состояние, минимальному — жидкое. Очевидно, при давлениях  вещество будет только в газообразном состоянии, а при
вещество будет только в газообразном состоянии, а при  в жидком. Таким образом, согласно уравнению Ван-дер-Ваальса переход вещества от газообразного состояния (большие объемы) к жидкому (малые объемы) осуществляется через последовательность
в жидком. Таким образом, согласно уравнению Ван-дер-Ваальса переход вещества от газообразного состояния (большие объемы) к жидкому (малые объемы) осуществляется через последовательность

Рис. 6.17.
промежуточных состояний, которые отображаются  -образным участком графика изотермических изменений (рис. 6.17). При этих переходах вещество все время остается однородным (имеет место непрерывный переход от газообразного состояния к жидкому).
-образным участком графика изотермических изменений (рис. 6.17). При этих переходах вещество все время остается однородным (имеет место непрерывный переход от газообразного состояния к жидкому).
Для качественного сравнения экспериментальных изотерм с изотермой Ван-дер-Ваальса свойства реальных веществ схематически (качественно) можно изобразить кривой  (рис. 6.17), которую ниже мы будем называть опытной изотермой. Из сравнения указанных кривых видно, что вместо получаемого на опыте линейного участка 2, 3 изотерма Ван-дер-Ваальса имеет характерный завиток 2, а, с, 3.
(рис. 6.17), которую ниже мы будем называть опытной изотермой. Из сравнения указанных кривых видно, что вместо получаемого на опыте линейного участка 2, 3 изотерма Ван-дер-Ваальса имеет характерный завиток 2, а, с, 3.
Следует отметить, что идея о непрерывности перехода от газообразного состояния к жидкому, вытекающая из уравнения Ван-дер-Ваальса, не является абсурдной. Как это отмечалось в § 56, такого рода переходы возможны в обход критического состояния вещества. Ниже критической температуры, как показывает опыт, такие переходы не реализуются.
Давление (рис. 6.17) соответствует давлению насыщенного пара. Соответственно участки изотермы Ван-дер-Ваальса 2, а и с, 3 можно интерпретировать как состояния пересыщенного пара и перегретой жидкости (метастабильные состояния). Участок завитка изотермы а, с не может быть получен в опыте с реальными веществами. Действительно, при изотермическом сжатии от состояния а к состоянию с давление должно падать, в то время как в эксперименте изотермическое сжатие однородной системы можно получить только увеличением давления.
Сравнение экспериментальных изотерм с изотермой Ван-дер-Ваальса приводит к следующим результатам. Участок 1, 2 изотермы Ван-дер-Ваальса (рис. 6.17) интерпретируется как сжатие пара до насыщения, 2, а — пересыщенные состояния пара; с, 3 — перегретые состояния жидкости, 3,4 — изотермическое сжатие жидкости. Большая крутизна участка 3, 4 свидетельствует о том, что производная  а значит, и сжимаемость
а значит, и сжимаемость  жидкостей очень мала: для незначительных изменений объема требуются очень большие изменения давления.
жидкостей очень мала: для незначительных изменений объема требуются очень большие изменения давления.
Возможность объяснить на основе уравнения Ван-дер-Ваальса переход из газообразного состояния в жидкое явилась в свое время большим достижением молекулярной теории. Описание же самого перехода — расслоения системы на две фазы — относится к еще не решенным до конца проблемам теоретической физики.
Значения постоянных Ван-дер-Ваальса, полученных из критических параметров, могут быть использованы для приближенной количественной оценки сжатия паров вплоть до состояния насыщения. В то же время такого рода постоянные нельзя применять для количественной оценки каких-либо изменений в жидкостях. Дело в том, что постоянная  определенная указанным способом,
определенная указанным способом,

Рис. 6.18.
оказывается по величине больше мольного объема жидкости вдали от критической температуры.
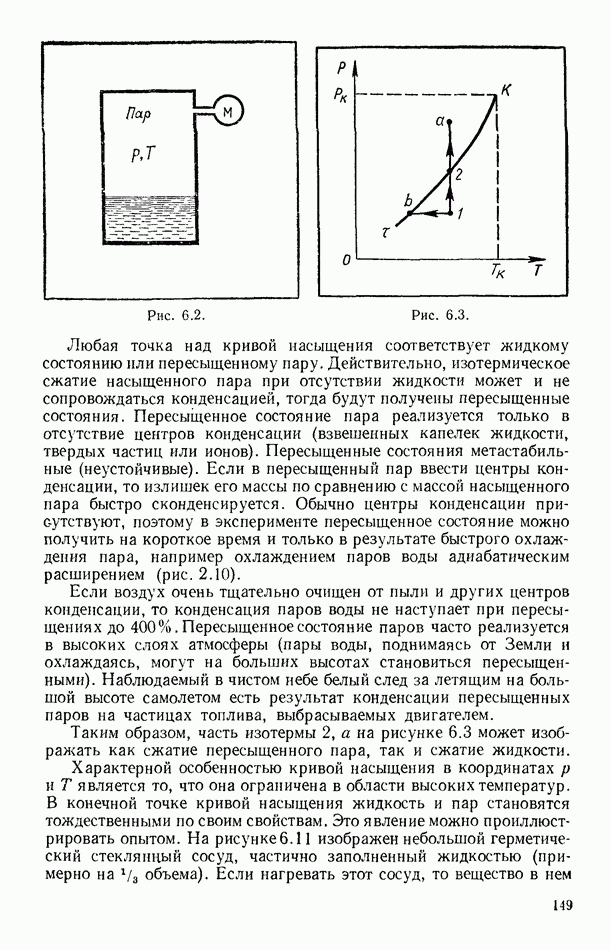
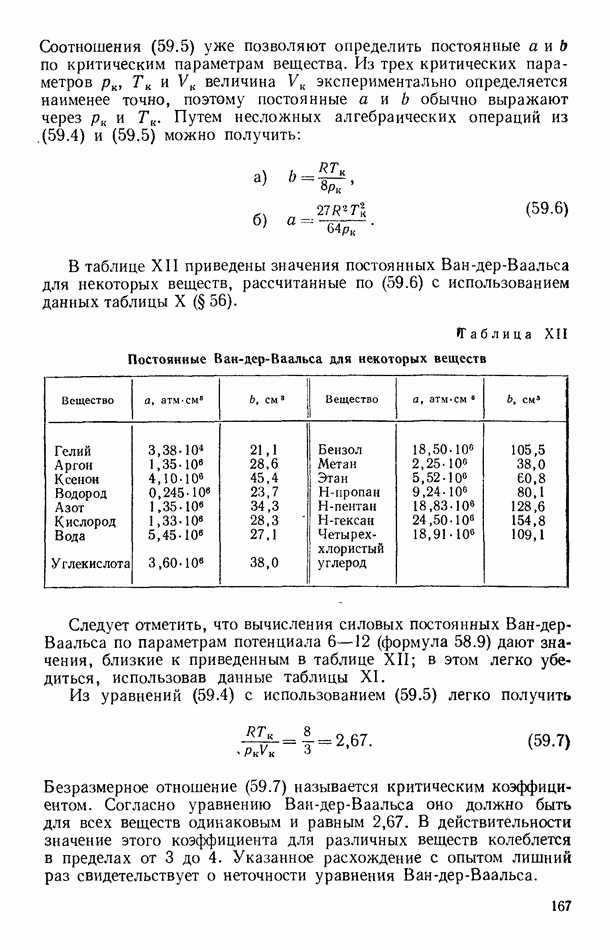
На рисунке 6.18 изображены изотермы Ван-дер-Ваальса для нескольких температур (семейство изотерм). При повышении температуры  -образный участок изотерм уменьшается, и при некоторой температуре
-образный участок изотерм уменьшается, и при некоторой температуре  , имеющей смысл критической температуры, он вырождается в точку перегиба (критическую точку). При более высоких температурах изотермы Ван-дер-Ваальса напоминают изотермы идеальных газов. Тот факт, что теория Ван-дер-Ваальса предсказывает наличие критической точки и критической температуры для всех веществ, имеет фундаментальное значение.
, имеющей смысл критической температуры, он вырождается в точку перегиба (критическую точку). При более высоких температурах изотермы Ван-дер-Ваальса напоминают изотермы идеальных газов. Тот факт, что теория Ван-дер-Ваальса предсказывает наличие критической точки и критической температуры для всех веществ, имеет фундаментальное значение.
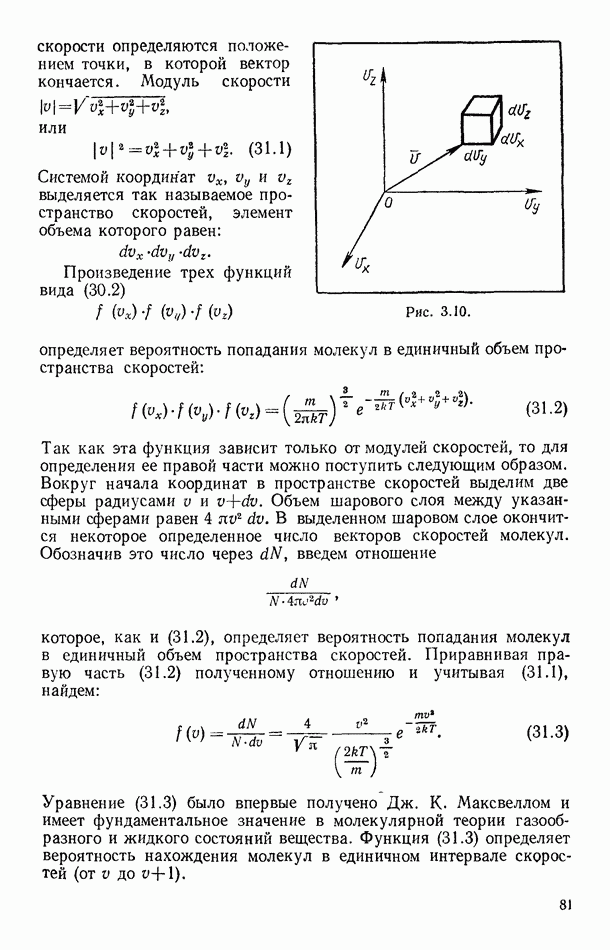
Найдем связь критических параметров вещества с постоянными уравнения Ван-дер-Ваальса. Для этого перепишем это уравнение (58.11) в виде

В критической точке (как точке перегиба на изотерме) первая и вторая производные

должны быть равны нулю. Соответственно для критической точки будут справедливы уравнения:

Из последних двух уравнений легко найти:

Соотношения (59.5) уже позволяют определить постоянные  по критическим параметрам вещества. Из трех критических параметров
по критическим параметрам вещества. Из трех критических параметров  и
и  величина
величина  экспериментально определяется наименее точно, поэтому постоянные
экспериментально определяется наименее точно, поэтому постоянные  обычно выражают через
обычно выражают через  и Тк. Путем несложных алгебраических операций из (59.4) и (59.5) можно получить:
и Тк. Путем несложных алгебраических операций из (59.4) и (59.5) можно получить:

В таблице XII приведены значения постоянных Ван-дер-Ваальса для некоторых веществ, рассчитанные по (59.6) с использованием данных таблицы X (§ 56).
Таблица ХII (см. скан) Постоянные Ван-дер-Ваальса для некоторых веществ
Следует отметить, что вычисления силовых постоянных Ван-дер-Ваальса по параметрам потенциала 6—12 (формула 58.9) дают значения, близкие к приведенным в таблице XII; в этом легко убедиться, использовав данные таблицы XI.
Из уравнений (59.4) с использованием (59.5) легко получить

Безразмерное отношение (59.7) называется критическим коэффициентом. Согласно уравнению Ван-дер-Ваальса оно должно быть для всех веществ одинаковым и равным 2,67. В действительности значение этого коэффициента для различных веществ колеблется в пределах от 3 до 4. Указанное расхождение с опытом лишний раз свидетельствует о неточности уравнения Ван-дер-Ваальса.
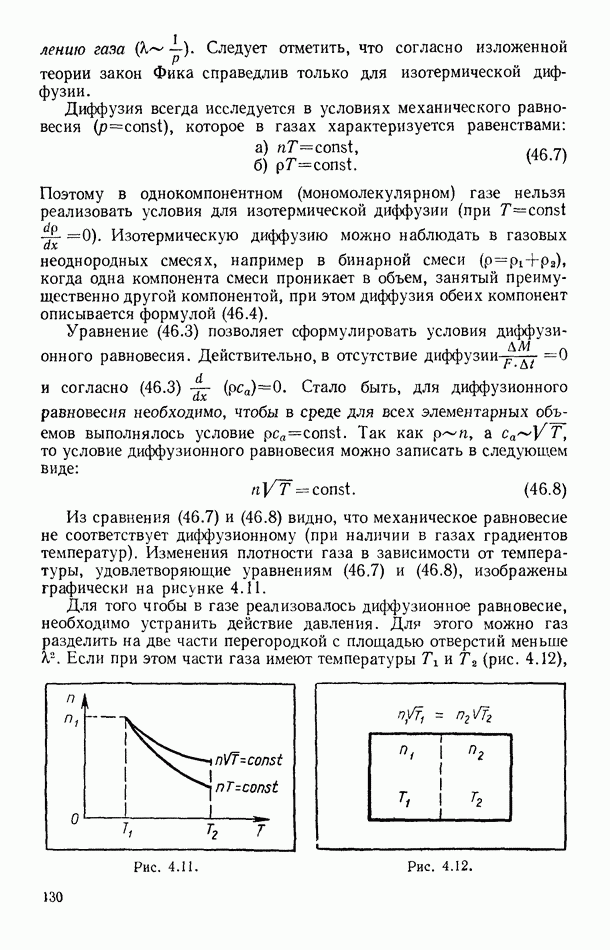
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- Глава I. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПОНЯТИЯ И СВОЙСТВА ИДЕАЛЬНЫХ ГАЗОВ
- § 1 О ДВУХ МЕТОДАХ ИССЛЕДОВАНИЯ ФИЗИЧЕСКИХ ЯВЛЕНИЙ
- § 2. ОСНОВНЫЕ ПОНЯТИЯ И ПРЕДСТАВЛЕНИЯ ТЕРМОДИНАМИЧЕСКОГО ОПИСАНИЯ СИСТЕМ
- § 3 ТЕРМИЧЕСКОЕ УРАВНЕНИЕ СОСТОЯНИЯ. РАВНОВЕСНЫЕ ПРОЦЕССЫ
- § 4. ИЗОПРОЦЕССЫ
- § 5. МЕЖДУНАРОДНАЯ ПРАКТИЧЕСКАЯ ТЕМПЕРАТУРНАЯ ШКАЛА
- § 6. МЕТОДЫ ИЗМЕРЕНИЯ ТЕМПЕРАТУРЫ
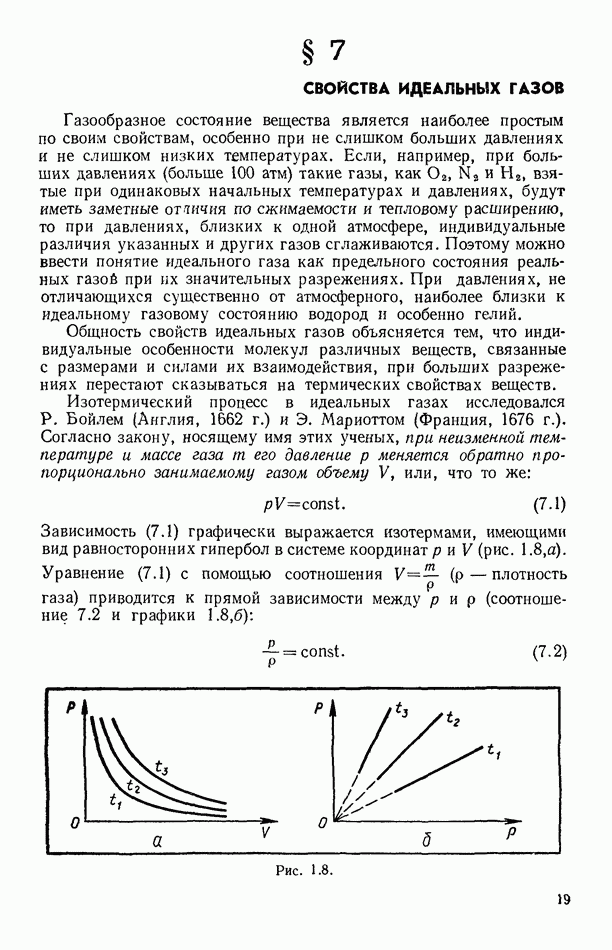
- § 7. СВОЙСТВА ИДЕАЛЬНЫХ ГАЗОВ
- § 8. РАБОТА РАСШИРЕНИЯ СИСТЕМЫ И ФИЗИЧЕСКИЙ СМЫСЛ УНИВЕРСАЛЬНОЙ ГАЗОВОЙ ПОСТОЯННОЙ
- § 9. УРАВНЕНИЕ СОСТОЯНИЯ СМЕСИ ИДЕАЛЬНЫХ ГАЗОВ
- § 10. ИЗМЕРЕНИЕ ДАВЛЕНИЙ
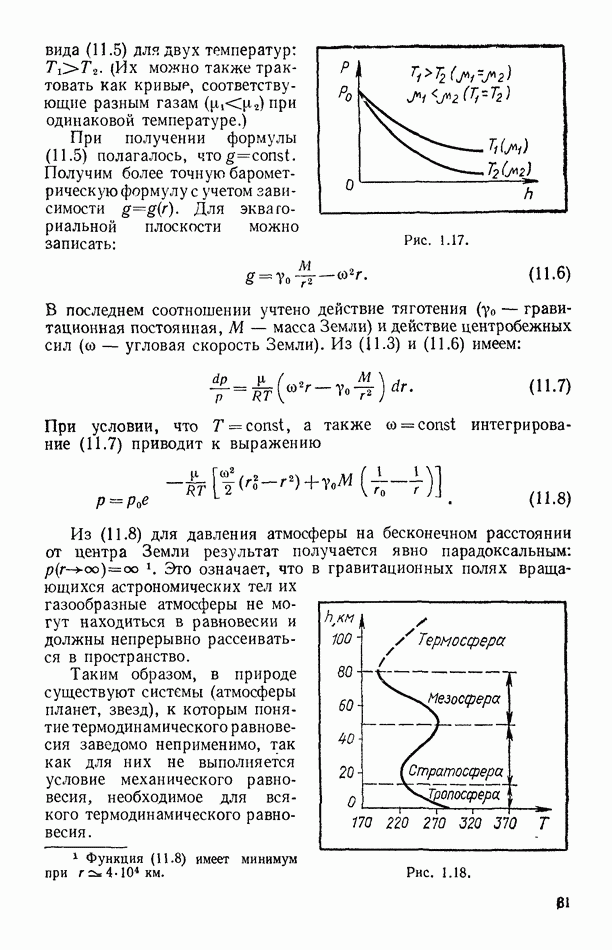
- § 11. БАРОМЕТРИЧЕСКАЯ ФОРМУЛА
- Глава II. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- § 12. О ЗАКОНЕ СОХРАНЕНИЯ И ПРЕВРАЩЕНИЯ ЭНЕРГИИ
- § 13. РАБОТА КАК МАКРОСКОПИЧЕСКИЙ СПОСОБ ПЕРЕДАЧИ ЭНЕРГИИ
- § 14. ТЕПЛОТА КАК МИКРОФИЗИЧЕСКИЙ СПОСОБ ПЕРЕДАЧИ ЭНЕРГИИ. ТЕПЛОЕМКОСТЬ
- § 15. ИЗМЕРЕНИЕ ТЕПЛОЕМКОСТИ
- § 16. ВНУТРЕННЯЯ ЭНЕРГИЯ КАК ФУНКЦИЯ СОСТОЯНИЯ СИСТЕМЫ
- § 17. ФОРМУЛИРОВКА ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ
- § 18. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ ДЛЯ ИДЕАЛЬНЫХ ГАЗОВ
- § 19. ИЗОБАРИЧЕСКИЙ ПРОЦЕСС В ИДЕАЛЬНОМ ГАЗЕ
- § 20. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС В ИДЕАЛЬНОМ ГАЗЕ
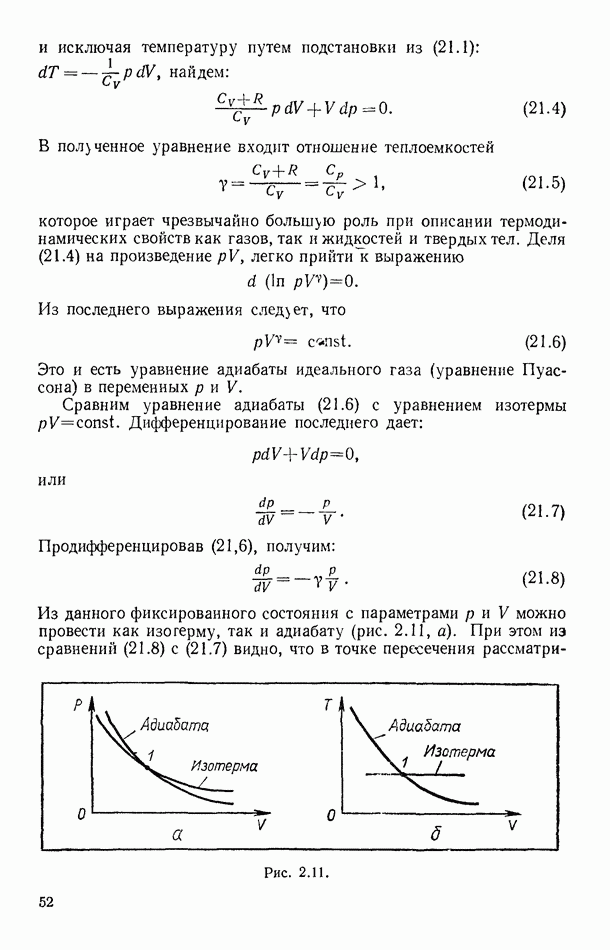
- § 21. АДИАБАТИЧЕСКИЙ ПРОЦЕСС В ИДЕАЛЬНОМ ГАЗЕ
- § 22. ПОЛИТРОПИЧЕСКИЕ ПРОЦЕССЫ В ИДЕАЛЬНОМ ГАЗЕ
- § 23. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ Cp/Cv
- § 24. ТЕПЛОЕМКОСТЬ СМЕСИ ГАЗОВ
- § 18. ЭНТАЛЬПИЯ КАК ФУНКЦИЯ СОСТОЯНИЯ СИСТЕМЫ
- Глава III. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ И ЕЕ ПРИМЕНЕНИЕ К ИДЕАЛЬНЫМ ГАЗАМ
- § 26. ИСХОДНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНОЙ ТЕОРИИ
- § 27. СРЕДНИЕ ВЕЛИЧИНЫ В ОПИСАНИИ МОЛЕКУЛЯРНЫХ СИСТЕМ
- § 28. ОСНОВНЫЕ ПОНЯТИЯ ТЕОРИИ ВЕРОЯТНОСТЕЙ
- § 29. РАСПРЕДЕЛЕНИЕ ЧАСТИЦ ПО ЭНЕРГИЯМ (РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА)
- § 30. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО КОМПОНЕНТАМ СКОРОСТЕЙ ИХ ТЕПЛОВОГО ДВИЖЕНИЯ (РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА)
- § 31. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО СКОРОСТЯМ ИХ ТЕПЛОВОГО ДВИЖЕНИЯ (РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА)
- § 32. ОПЫТНАЯ ПРОВЕРКА РАСПРЕДЕЛЕНИЯ МАКСВЕЛЛА
- § 33. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА ПО КИНЕТИЧЕСКОЙ ТЕОРИИ
- § 34. ПЛОТНОСТЬ ПОТОКА МОЛЕКУЛ В ИДЕАЛЬНОМ ГАЗЕ
- § 35. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ИДЕАЛЬНОГО ГАЗА В ПОЛВ СИЛЫ ТЯЖЕСТИ
- § 36. БРОУНОВСКОЕ ДВИЖЕНИЕ. ОПРЕДЕЛЕНИЕ ПЕРРЕНОМ ЧИСЛА АВОГАДРО
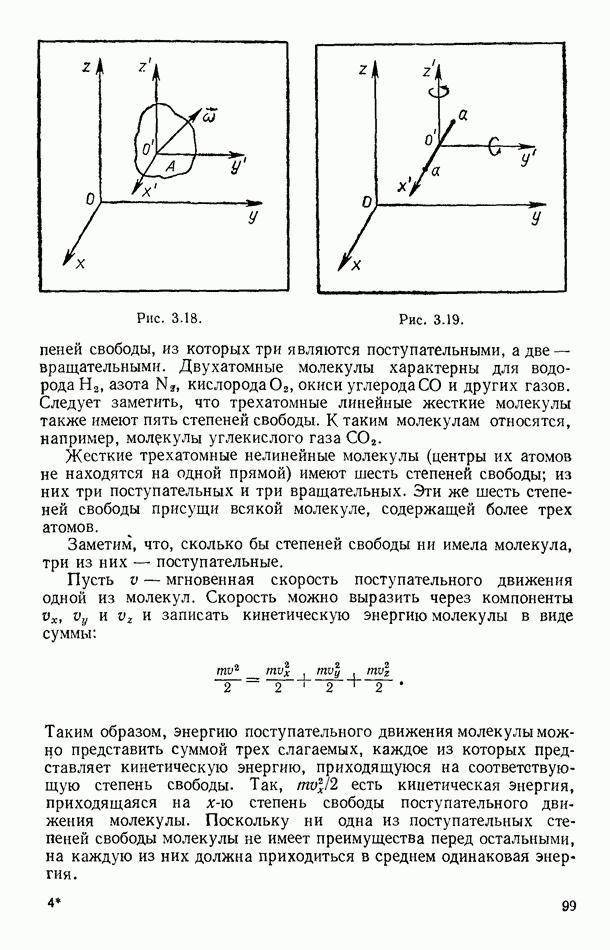
- § 37. ТЕОРЕМА О РАВНОРАСПРЕДЕЛЕНИИ И ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНЫХ ГАЗОВ
- § 38. КВАНТОВАЯ ТЕОРИЯ ТЕПЛОЕМКОСТИ ГАЗОВ
- § 39. ТЕРМОДИНАМИЧЕСКАЯ ВЕРОЯТНОСТЬ И РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ИДЕАЛЬНОГО ГАЗА В ПРОСТРАНСТВЕ
- Глава IV. ЯВЛЕНИЯ ПЕРЕНОСА И ИХ ТЕОРИЯ ДЛЯ ИДЕАЛЬНЫХ ГАЗОВ
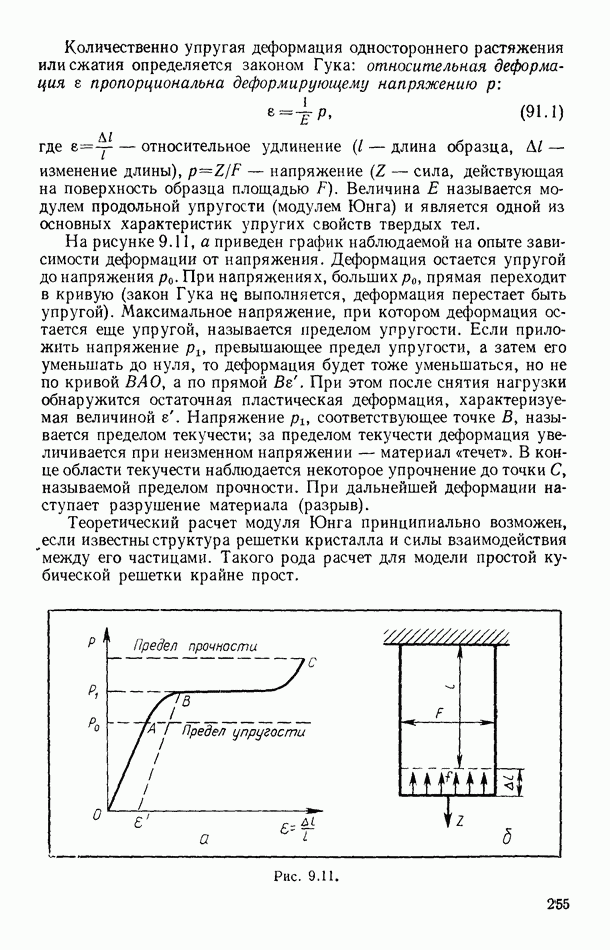
- § 40. ТЕПЛОПРОВОДНОСТЬ
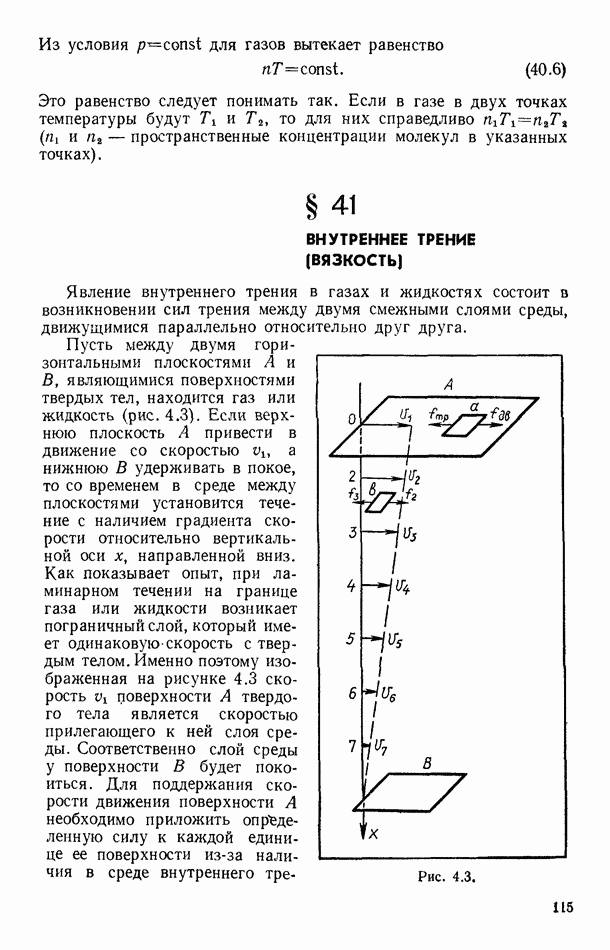
- § 41. ВНУТРЕННЕЕ ТРЕНИЕ (ВЯЗКОСТЬ)
- § 42. ДИФФУЗИЯ
- § 43. СРЕДНЯЯ ДЛИНА СВОБОДНОГО ПРОБЕГА МОЛЕКУЛ
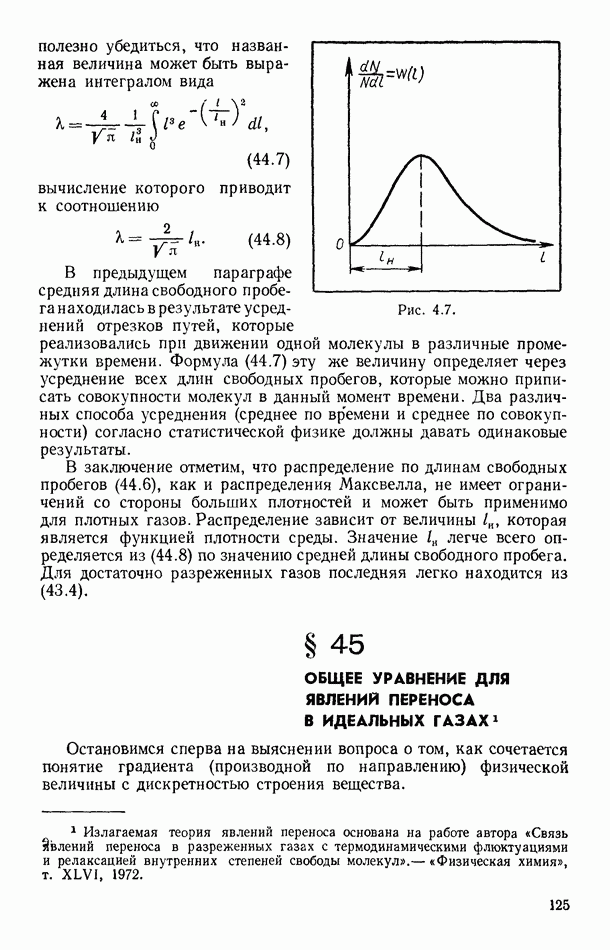
- § 44. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО ДЛИНАМ ИХ СВОБОДНЫХ ПРОБЕГОВ
- § 45. ОБЩЕЕ УРАВНЕНИЕ ДЛЯ ЯВЛЕНИИ ПЕРЕНОСА В ИДЕАЛЬНЫХ ГАЗАХ
- § 46. ДИФФУЗИЯ В ИДЕАЛЬНЫХ ГАЗАХ
- § 47. ВНУТРЕННЕЕ ТРЕНИЕ В ИДЕАЛЬНЫХ ГАЗАХ
- § 48. ТЕПЛОПРОВОДНОСТЬ ИДЕАЛЬНЫХ ГАЗОВ
- § 49. СВЯЗЬ МЕЖДУ КОЭФФИЦИЕНТАМИ ПЕРЕНОСА
- Глава V. СИЛЬНО РАЗРЕЖЕННЫЕ ГАЗЫ
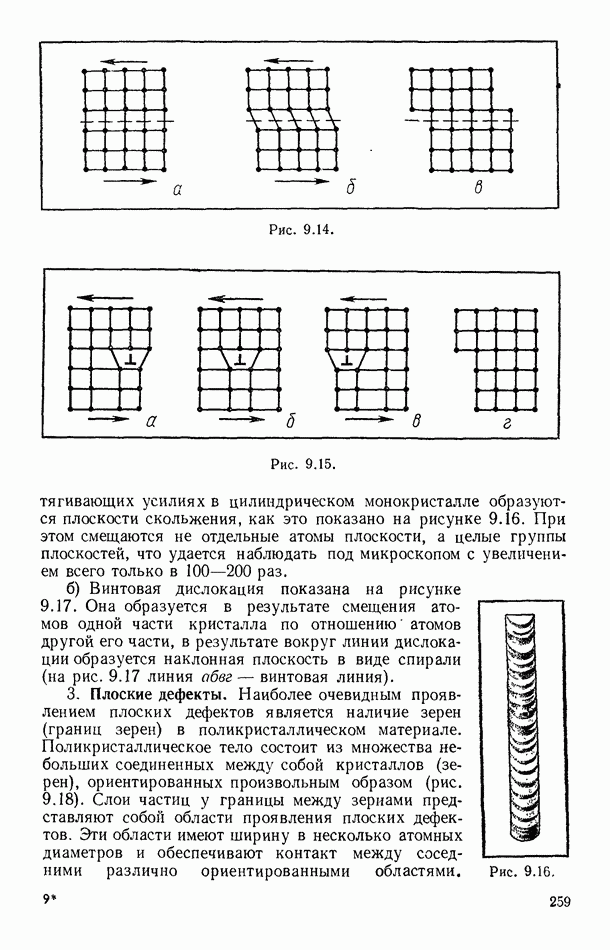
- § 50. ПОЛУЧЕНИЕ И ИЗМЕРЕНИЕ ВАКУУМА
- § 51. СИЛЫ ТРЕНИЯ в ВАКУУМЕ
- § 52. ТЕПЛОПЕРЕДАЧА В ВАКУУМЕ
- § 53. ДИФФУЗИЯ В ВАКУУМЕ
- Глава VI. РЕАЛЬНЫЕ ГАЗЫ
- § 54. ОТКЛОНЕНИЕ ОТ ЗАКОНА БОЙЛЯ—МАРИОТТА
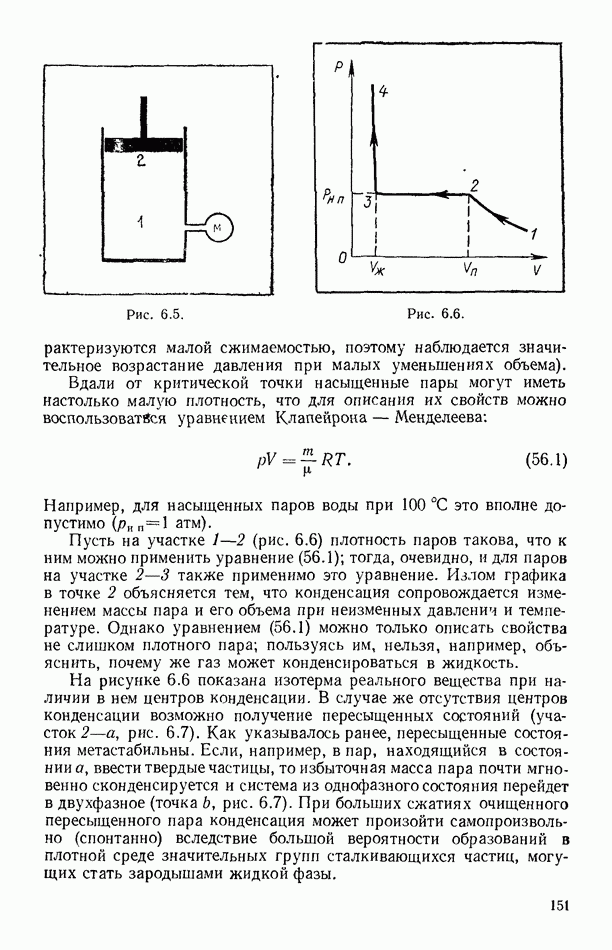
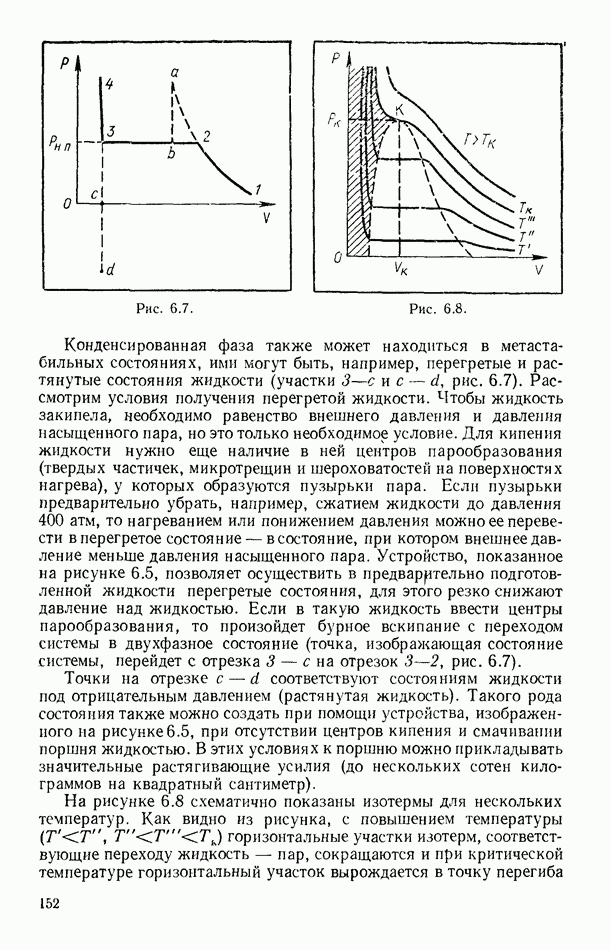
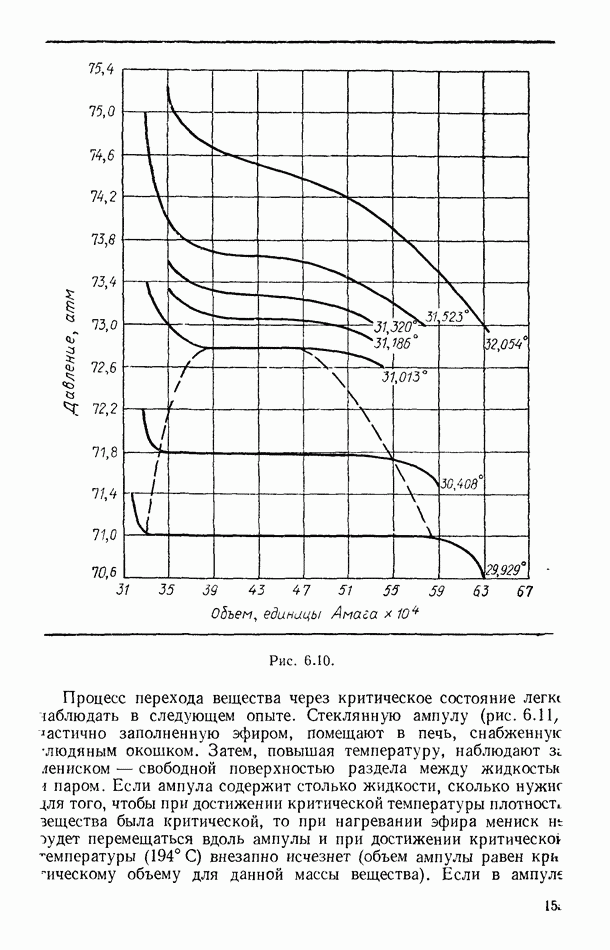
- § 55. РАВНОВЕСИЕ СИСТЕМЫ ЖИДКОСТЬ — ПАР
- § 56. ЭКСПЕРИМЕНТАЛЬНЫЕ ИЗОТЕРМЫ. КРИТИЧЕСКОЕ СОСТОЯНИЕ ВЕЩЕСТВА
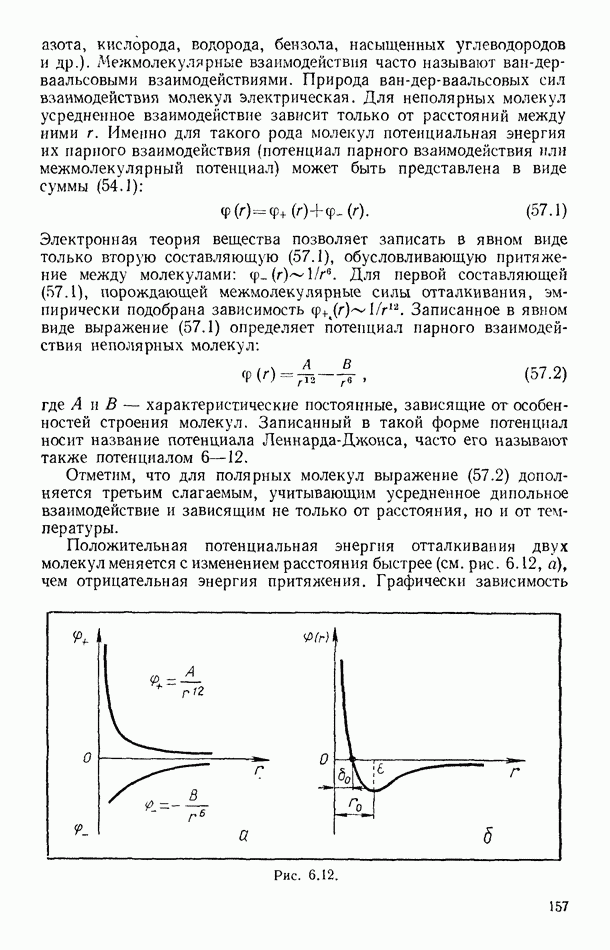
- § 57. ПОТЕНЦИАЛ ПАРНОГО ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ
- § 58. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА
- § 59. ИЗОТЕРМЫ ВАН-ДЕР-ВААЛЬСА. КРИТИЧЕСКИЕ ПАРАМЕТРЫ И ПОСТОЯННЫЕ ВАН-ДЕР-ВААЛЬСА
- § 60. ВНУТРЕННЯЯ ЭНЕРГИЯ РЕАЛЬНОГО ГАЗА. ЭФФЕКТ ДЖОУЛЯ — ТОМСОНА
- § 61. СЖИЖЕНИЕ ГАЗОВ
- § 62. УРАВНЕНИЕ СОСТОЯНИЯ РЕАЛЬНЫХ ГАЗОВ В ВИРИАЛЬНОЙ ФОРМЕ
- Глава VII. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- § 63. РАВНОВЕСНЫЕ И НЕРАВНОВЕСНЫЕ ПРОЦЕССЫ
- § 64. ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ
- § 65. ЦИКЛИЧЕСКИЕ (КРУГОВЫЕ) ПРОЦЕССЫ
- § 66. ЦИКЛ КАРНО
- § 67. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ ДЛЯ ОБРАТИМЫХ ПРОЦЕССОВ
- § 68. ЭНТРОПИЯ КАК ФУНКЦИЯ СОСТОЯНИЯ СИСТЕМЫ
- § 69. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ ДЛЯ НЕОБРАТИМЫХ ПРОЦЕССОВ
- § 70. НЕРАВЕНСТВО КЛАУЗИУСА. ПРИНЦИП ВОЗРАСТАНИЯ ЭНТРОПИИ
- § 71. ЭНТРОПИЯ И ВЕРОЯТНОСТЬ СОСТОЯНИЯ СИСТЕМЫ
- § 72. О ТАК НАЗЫВАЕМОЙ «ТЕПЛОВОЙ СМЕРТИ ВСЕЛЕННОЙ»
- § 73. ИЗОЭНТРОПИЧЕСКОЕ СОСТОЯНИЕ ТРОПОСФЕРЫ ЗЕМЛИ
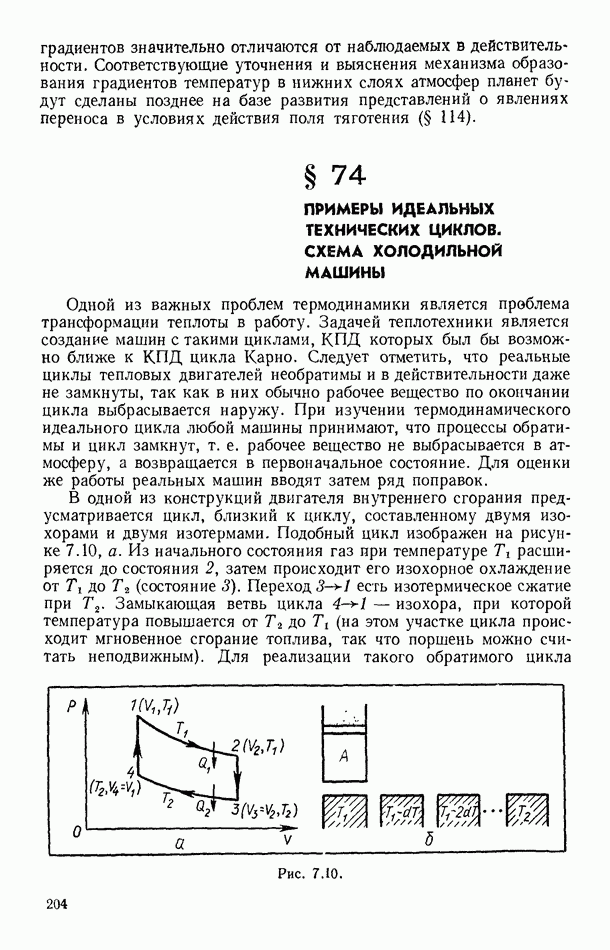
- § 74. ПРИМЕРЫ ИДЕАЛЬНЫХ ТЕХНИЧЕСКИХ ЦИКЛОВ. СХЕМА ХОЛОДИЛЬНОЙ МАШИНЫ
- Глава VIII. ЖИДКОСТИ
- § 75. ТЕПЛОВОЕ ДВИЖЕНИЕ И СТРУКТУРА ЖИДКОСТЕЙ
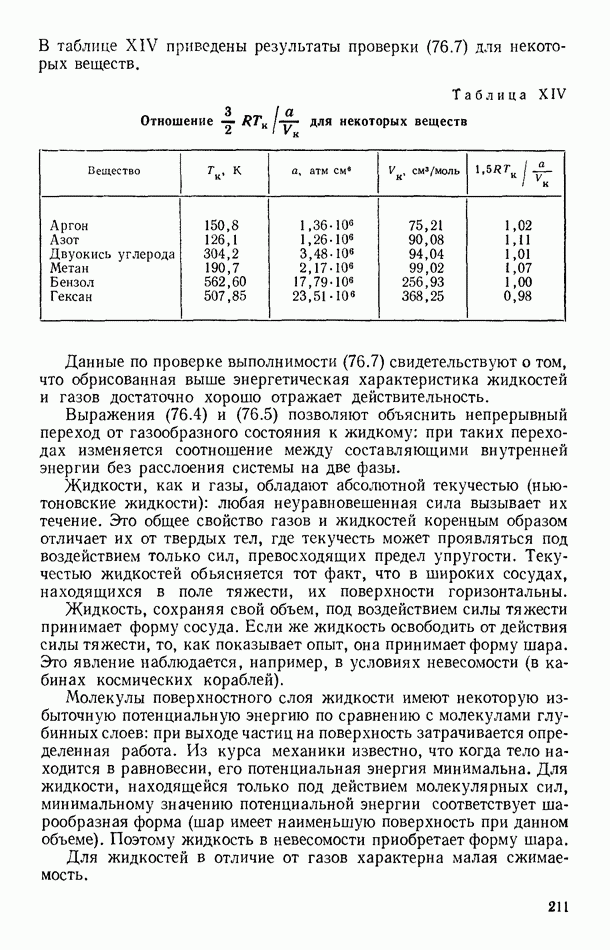
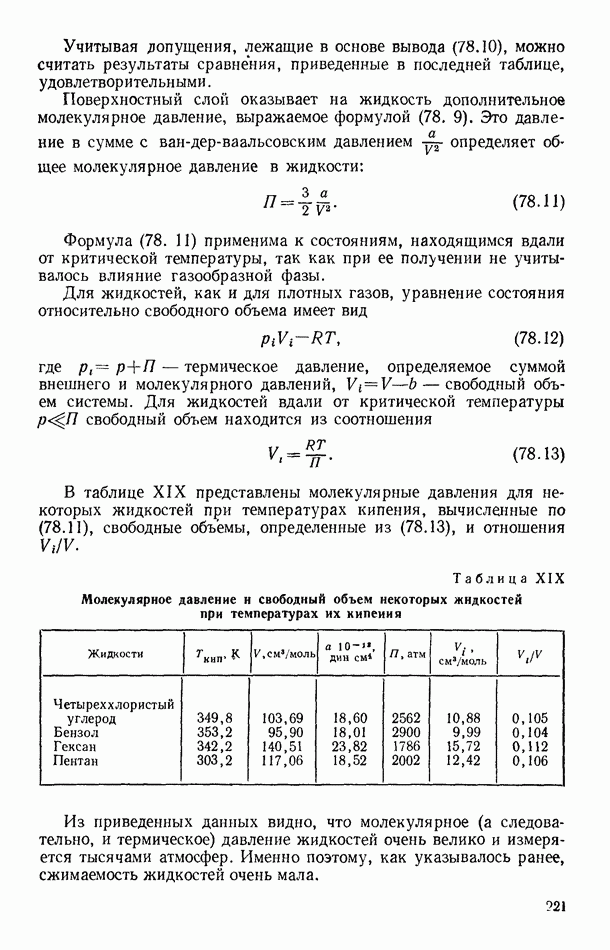
- § 76. ОСНОВНЫЕ СВОЙСТВА ЖИДКОСТЕЙ
- § 77. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ ЖИДКОСТЕЙ
- § 78. МОЛЕКУЛЯРНОЕ ДАВЛЕНИЕ ПОВЕРХНОСТНОГО СЛОЯ ЖИДКОСТИ
- § 79. СИЛЫ, ВОЗНИКАЮЩИЕ НА КРИВОЙ ПОВЕРХНОСТИ ЖИДКОСТЕЙ
- § 80. КРАЕВОЙ УГОЛ. КАПИЛЛЯРНЫЕ ЯВЛЕНИЯ
- § 81. КИПЕНИЕ ЖИДКОСТЕЙ
- § 82. ТЕПЛОТА ПАРООБРАЗОВАНИЯ ЖИДКОСТЕЙ
- § 83. УРАВНЕНИЕ КЛАПЕЙРОНА — КЛАУЗИУСА
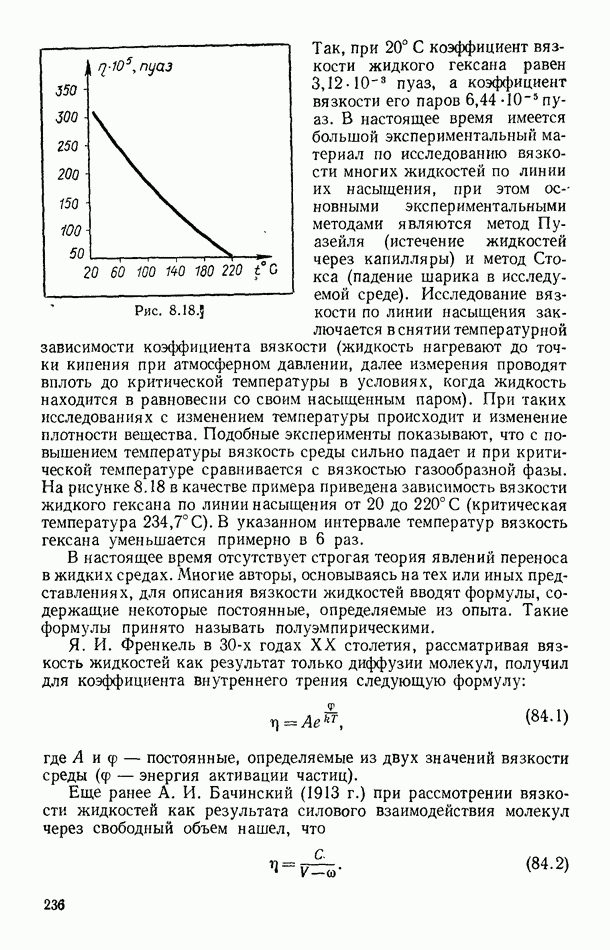
- § 84. ВЯЗКОСТЬ ЖИДКОСТЕЙ
- § 85. ЖИДКИЕ РАСТВОРЫ. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ. ЗАКОН РАУЛЯ
- § 86. ЖИДКИЙ ГЕЛИЙ. СВЕРХТЕКУЧЕСТЬ
- Глава IX. ТВЕРДЫЕ ТЕЛА
- § 87. ОСНОВНЫЕ ОСОБЕННОСТИ ТВЕРДЫХ ТЕЛ
- § 88. СТРУКТУРА КРИСТАЛЛОВ
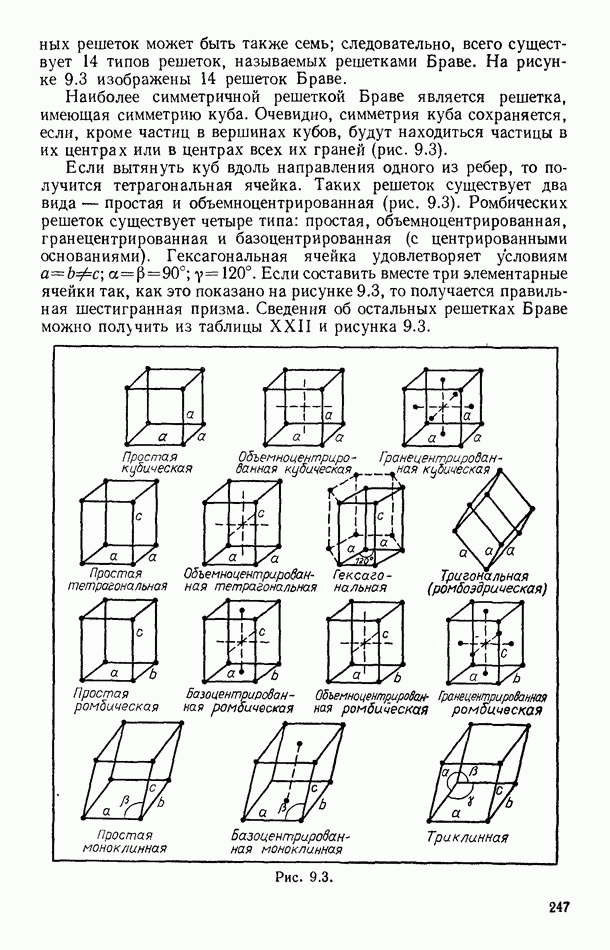
- § 89. ФИЗИЧЕСКИЕ ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК
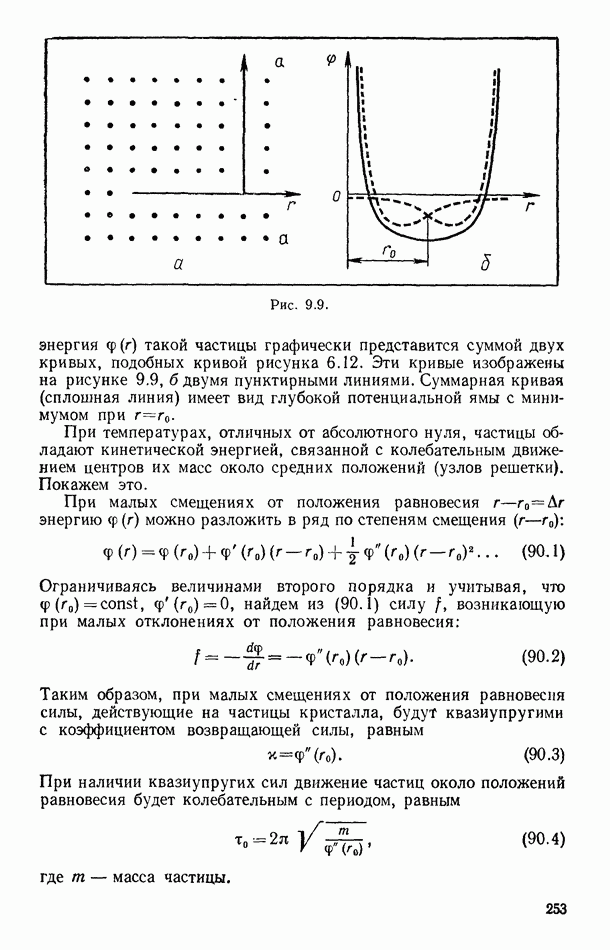
- § 90. ТЕПЛОВОЕ ДВИЖЕНИЕ В КРИСТАЛЛАХ
- § 91. МЕХАНИЧЕСКИЕ СВОЙСТВА КРИСТАЛЛОВ
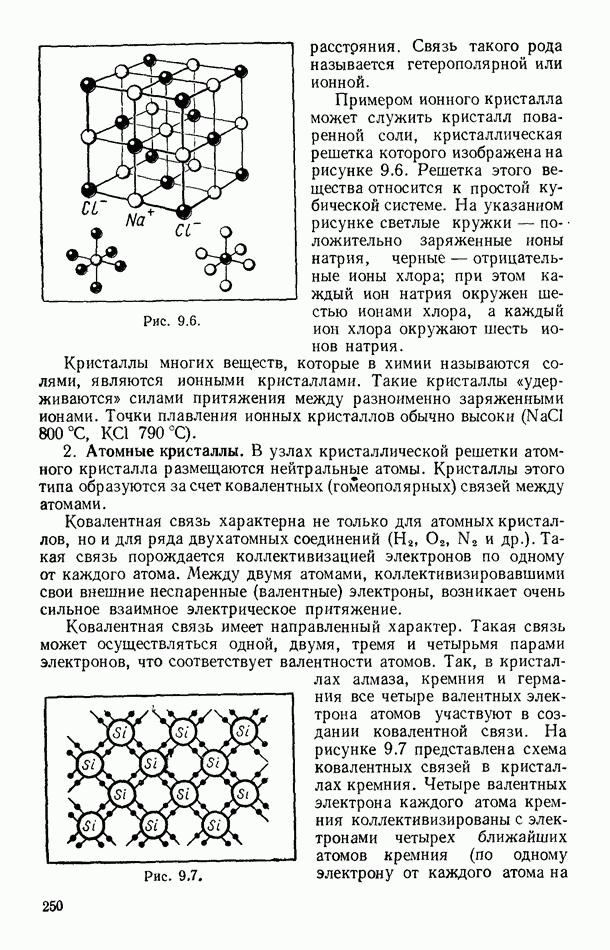
- § 92. ДЕФЕКТЫ В ТВЕРДЫХ ТЕЛАХ
- § 93. ТЕПЛОВОЕ РАСШИРЕНИЕ ТВЕРДЫХ ТЕЛ
- § 94. ТЕПЛОЕМКОСТЬ ТВЕРДЫХ ТЕЛ
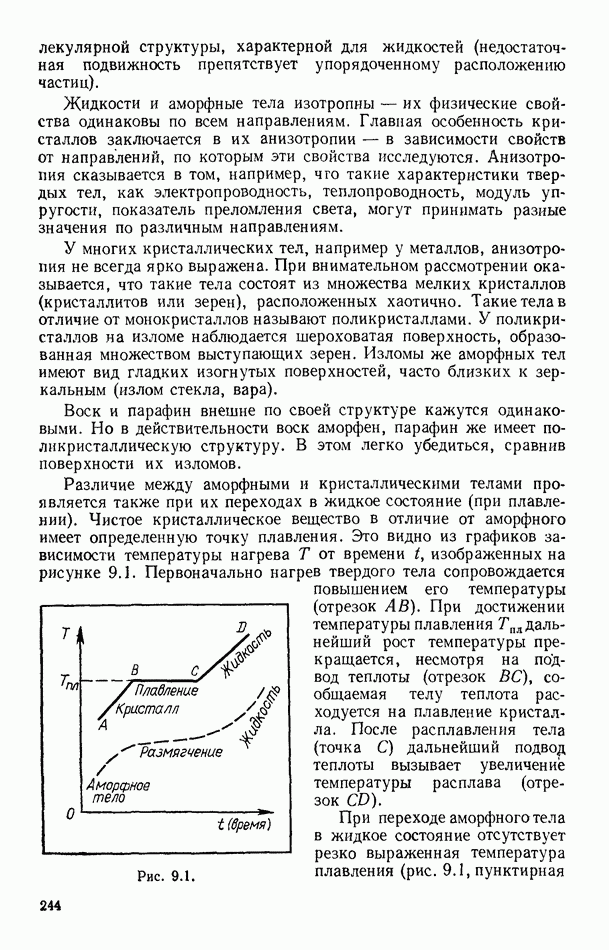
- § 95. ПЛАВЛЕНИЕ И КРИСТАЛЛИЗАЦИЯ
- § 96. ДИАГРАММЫ СОСТОЯНИЙ. ТРОЙНАЯ ТОЧКА
- § 97. ТЕПЛОТА ПЛАВЛЕНИЯ ПРОСТЫХ КРИСТАЛЛИЧЕСКИХ СТРУКТУР
- Глава X. ПОЛИМЕРЫ
- § 98. ОБЩИЕ ПРЕДСТАВЛЕНИЯ
- § 99. ПОЛУЧЕНИЕ ПОЛИМЕРОВ
- § 100. НЕКОТОРЫЕ ТИПЫ ПОЛИМЕРОВ. РОЛЬ МЕЖМОЛЕКУЛЯРНЫХ ВЗАИМОДЕЙСТВИЙ
- § 101. ТРИ СОСТОЯНИЯ АМОРФНЫХ ПОЛИМЕРОВ И ТЕПЛОВОЕ ДВИЖЕНИЕ В НИХ
- § 102. ЭЛАСТИЧНОСТЬ ПОЛИМЕРОВ
- § 103. КРИСТАЛЛИЧЕСКИЕ ПОЛИМЕРЫ
- § 104. ПРИМЕНЕНИЕ ПОЛИМЕРНЫХ МАТЕРИАЛОВ
- Глава XI. ЭЛЕМЕНТЫ ТЕРМОДИНАМИКИ ТЕКУЧИХ СРЕД И РАКЕТНОЙ ТЕХНИКИ
- § 105. РАБОТА ПЕРЕМЕЩЕНИЯ В ТЕКУЧИХ СРЕДАХ
- § 106. ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ ДЛЯ ПОТОКОВ ГАЗОВ И ЖИДКОСТЕЙ
- § 107. ЧАСТНЫЕ СЛУЧАИ ТЕЧЕНИЯ СРЕД
- § 108. ИСТЕЧЕНИЕ ГАЗОВ ИЗ СОПЕЛ. КРИТИЧЕСКАЯ СКОРОСТЬ
- § 109. ПРИНЦИП ДВИЖЕНИЯ РАКЕТ
- § 110. ЭЛЕМЕНТАРНАЯ ТЕРМОДИНАМИКА РАКЕТНОГО ДВИГАТЕЛЯ
- § 111. СХЕМЫ РАКЕТНЫХ ДВИГАТЕЛЕЙ
- § 112. МНОГОСТУПЕНЧАТЫЕ РАКЕТЫ
- § 113. ДВИЖЕНИЕ СО СВЕРХЗВУКОВОЙ СКОРОСТЬЮ. УДАРНЫЕ ВОЛНЫ
- § 114. О ГРАДИЕНТЕ ТЕМПЕРАТУРЫ В ТРОПОСФЕРЕ ЗЕМЛИ