| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 64. ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ
Обратимым термодинамическим процессом называется процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения. Обратимым может быть лишь равновесный процесс, так как при равновесном процессе система проходит непрерывную последовательность состояний, бесконечно мало отличающихся друг от друга. Эту последовательность состояний можно пройти (бесконечно
медленно) как в прямом, так и в обратном направлениях, причем возникающие в окружающих телах на любом промежуточном этапе процесса изменения будут отличаться для прямого и обратного процессов лишь знаком. В этих условиях при возвращении системы в исходное состояние все произошедшие в окружающей среде изменения окажутся скомпенсированными.
Примером обратимого механического процесса может служить свободное падение тела без трения (в пустоте). Если такое тело испытывает упругий удар о горизонтальную плоскость, то оно возвратится в исходную точку траектории, причем форма тела и плоскости после удара восстановятся — каких-либо изменений в окружающих телах не произойдет.
Следует отметить, что всякий чисто механический процесс, в котором отсутствует трение, является принципиально обратимым. Запишем первое начало для процесса, переводящего тело из состояния 1 в состояние 2:

Изменяя внешние воздействия, можно тело вернуть из состояния 2 в первоначальное состояние 1. Тогда

В разобранном примере объект наблюдения, претерпев ряд изменений, возвращается в первоначальное состояние. Такого рода процессы называются циклическими или круговыми. Внутренняя энергия есть функция состояния тела  поэтому, складывая (64.1) и (64.2), получим:
поэтому, складывая (64.1) и (64.2), получим:

Пусть переход  является равновесным, протекающим при бесконечно малой разности между температурой исследуемой системы и температурами источников теплоты и бесконечно малом различии внутреннего и внешнего давлений. Тогда изменением внешних воздействий (изменением знака малых разностей указанных величин) можно систему вернуть из состояния 2 в начальное состояние
является равновесным, протекающим при бесконечно малой разности между температурой исследуемой системы и температурами источников теплоты и бесконечно малом различии внутреннего и внешнего давлений. Тогда изменением внешних воздействий (изменением знака малых разностей указанных величин) можно систему вернуть из состояния 2 в начальное состояние  равновесно через те же промежуточные состояния, которые имели место в первой стадии процесса (рис. 7.3). В этом случае, очевидно,
равновесно через те же промежуточные состояния, которые имели место в первой стадии процесса (рис. 7.3). В этом случае, очевидно,  и согласно
и согласно  Изменение состояний внешних тел связано с совершением над ними (или ими) работы и передачей теплоты, и так как сумма этих эффектов в рассматриваемом случае равна нулю, то указанные тела после ряда изменений возвращаются в первоначальное состояние.
Изменение состояний внешних тел связано с совершением над ними (или ими) работы и передачей теплоты, и так как сумма этих эффектов в рассматриваемом случае равна нулю, то указанные тела после ряда изменений возвращаются в первоначальное состояние.
Как известно из опытов, процесс теплопередачи, вызываемый конечной разностью температур и происходящий в сторону убыли температуры, необратим, хотя тела, участвующие в таком процессе, могут претерпевать квазиравновесные изменения. Стало быть, нельзя утверждать, что всякое равновесное изменение тела обратимо.

Рис. 7.3.

Рис. 7.4.
Поясним это на следующем примере. Пусть имеются два тела  с конечной разностью температур
с конечной разностью температур  (рис. 7.4). Если эти тела соединить плохим проводником тепла А, то их изменения вследствие замедленной теплопередачи будут квазиравновесными. Если после выравнивания температур убрать теплопровод, то тело
(рис. 7.4). Если эти тела соединить плохим проводником тепла А, то их изменения вследствие замедленной теплопередачи будут квазиравновесными. Если после выравнивания температур убрать теплопровод, то тело  можно равновесно вернуть в первоначальное состояние через тепловой контакт с термостатом температуры
можно равновесно вернуть в первоначальное состояние через тепловой контакт с термостатом температуры  (рис. 7.4). Такая же операция может быть проделана с телом II при использовании другого термостата. В данном примере оба тела возвращаются в первоначальное состояние равновесно, но в целом процесс этот оказывается необратимым из-за того, что в конечном итоге термостат, имеющий температуру
(рис. 7.4). Такая же операция может быть проделана с телом II при использовании другого термостата. В данном примере оба тела возвращаются в первоначальное состояние равновесно, но в целом процесс этот оказывается необратимым из-за того, что в конечном итоге термостат, имеющий температуру  отдает некоторое количество теплоты, такое же количество теплоты получит термостат
отдает некоторое количество теплоты, такое же количество теплоты получит термостат  Таким образом, после возвращения тел
Таким образом, после возвращения тел  и II квазиравновесно через тождественные сбстояния в начальные состояния в окружающих телах (термостатах) останутся определенные изменения.
и II квазиравновесно через тождественные сбстояния в начальные состояния в окружающих телах (термостатах) останутся определенные изменения.
Вернемся к рассмотрению прямых и обратных изменений тела, характеризуемых уравнением (64.3). Пусть прямой процесс 1-2 неравновесен вследствие конечной разности сил внутренних и внешних. Тогда согласно изложенному в § 63 при использовании одних и тех же внешних тел нельзя провести процесс в обратном направлении так, чтобы работы прямого и обратного переходов системы компенсировали бы друг друга:  Таким образом, всякий неравновесный процесс необратим: тело, испытывающее неравновесные изменения, можно внешним воздействием вернуть в первоначальное состояние, но при этом в окружающих телах останутся определенные изменения
Таким образом, всякий неравновесный процесс необратим: тело, испытывающее неравновесные изменения, можно внешним воздействием вернуть в первоначальное состояние, но при этом в окружающих телах останутся определенные изменения 
Ярким примером необратимого процесса является расширение газа в пустоту (в вакуум). При таком расширении газ не совершает работу (внешние тела отсутствуют). Этот пример показывает, что всякий необратимый процесс в одном направлении протекает самопроизвольно, но для возвращения газа в первоначальное состояние (для обращения процесса) следует затратить определенную работу (работу сжатия газа), что будет связано с определенными изменениями в окружающих телах. Физическую природу необратимости легче всего пояснить на примере взаимной диффузии двух газов. В
цилиндре с перегородкой, по одну сторону которой находится гелий (малые молекулы), по другую — аргон (большие молекулы), уберем перегородку и проследим (хотя бы мысленно) за необратимым процессом взаимной диффузии газов. Молекулы гелия, сталкиваясь с большими частицами аргона, постепенно будут проникать в объем, занятый аргоном, молекулы же аргона проникнут в объем, где был чистый гелий. Каждый раз, когда происходит столкновение двух разных молекул, они строго по законам механики разлетаются в определенных направлениях, при этом акты взаимодействия молекул обратимы. В результате же множества столкновений частиц возникают необратимые изменения в системе. Если мы могли бы заснять на кинопленку все акты столкновений, то, запустив фильм в обратном направлении, мы ничего парадоксального не увидели бы в картине столкновения любой пары молекул. В конечном же результате обратимое протекание всех столкновений приведет к самопроизвольному разделению компонент газовой смеси, что в природе не наблюдается. В разобранном примере в начале опыта в системе был известный порядок — два различных газа находились в разных частях объема цилиндра. В хаосе молекулярных столкновений первоначальный порядок нарушился. Переход от более упорядоченных состояний к менее упорядоченным — вот в чем физическая сущность необратимости. Необратимость есть результат проявления статистических закономерностей, свойственных системам с большим числом частиц.
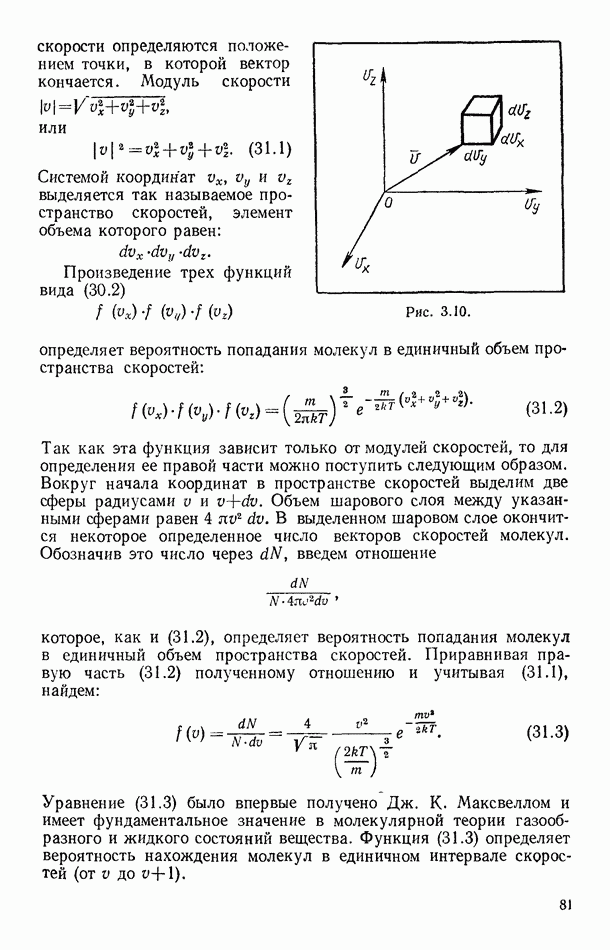
Все возможные процессы делятся на обратимые и необратимые. Соответственно второе начало термодинамики формулируется для обратимых и необратимых процессов. Исторически второе начало термодинамики было сформулировано на основе анализа циклических процессов, хотя в настоящее время в теоретических курсах пользуются и другим, чисто аналитическим методом выведения этого закона. Мы будем пользоваться методом ихлов как более наглядным и легче воспринимаемым на первой стадии ознакомления с термодинамикой. Предварительно же нам придется более подробно остановиться на некоторых особенностях циклов.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- Глава I. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПОНЯТИЯ И СВОЙСТВА ИДЕАЛЬНЫХ ГАЗОВ
- § 1 О ДВУХ МЕТОДАХ ИССЛЕДОВАНИЯ ФИЗИЧЕСКИХ ЯВЛЕНИЙ
- § 2. ОСНОВНЫЕ ПОНЯТИЯ И ПРЕДСТАВЛЕНИЯ ТЕРМОДИНАМИЧЕСКОГО ОПИСАНИЯ СИСТЕМ
- § 3 ТЕРМИЧЕСКОЕ УРАВНЕНИЕ СОСТОЯНИЯ. РАВНОВЕСНЫЕ ПРОЦЕССЫ
- § 4. ИЗОПРОЦЕССЫ
- § 5. МЕЖДУНАРОДНАЯ ПРАКТИЧЕСКАЯ ТЕМПЕРАТУРНАЯ ШКАЛА
- § 6. МЕТОДЫ ИЗМЕРЕНИЯ ТЕМПЕРАТУРЫ
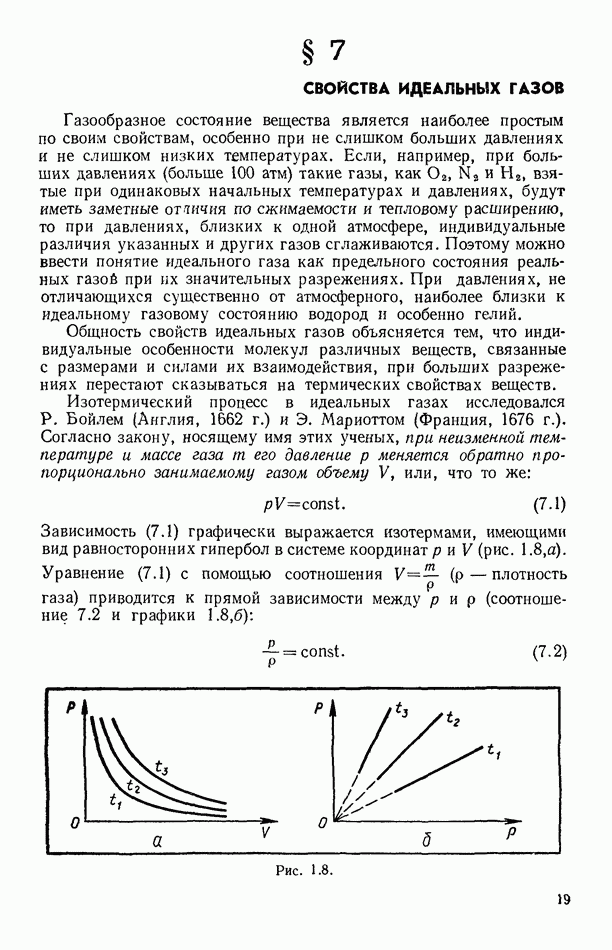
- § 7. СВОЙСТВА ИДЕАЛЬНЫХ ГАЗОВ
- § 8. РАБОТА РАСШИРЕНИЯ СИСТЕМЫ И ФИЗИЧЕСКИЙ СМЫСЛ УНИВЕРСАЛЬНОЙ ГАЗОВОЙ ПОСТОЯННОЙ
- § 9. УРАВНЕНИЕ СОСТОЯНИЯ СМЕСИ ИДЕАЛЬНЫХ ГАЗОВ
- § 10. ИЗМЕРЕНИЕ ДАВЛЕНИЙ
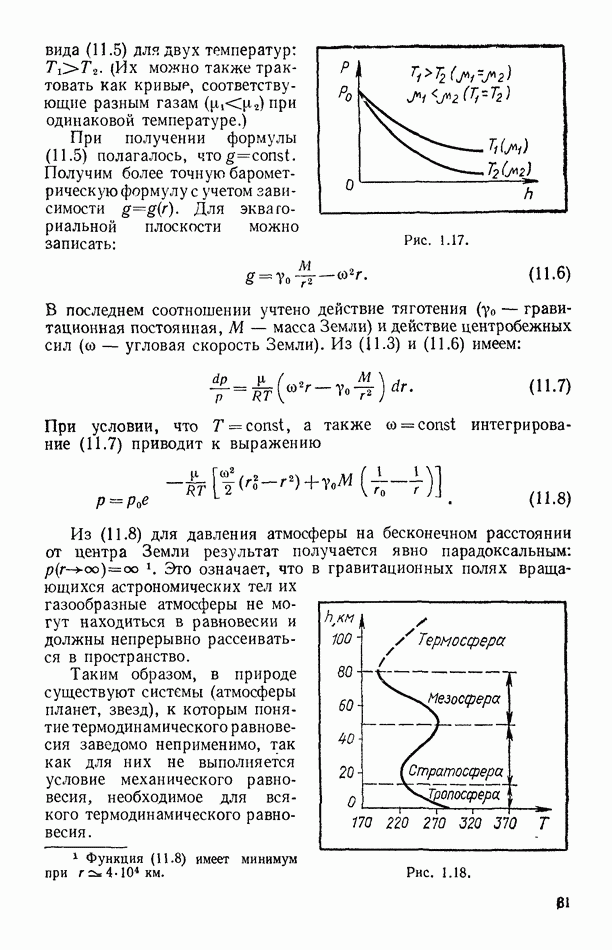
- § 11. БАРОМЕТРИЧЕСКАЯ ФОРМУЛА
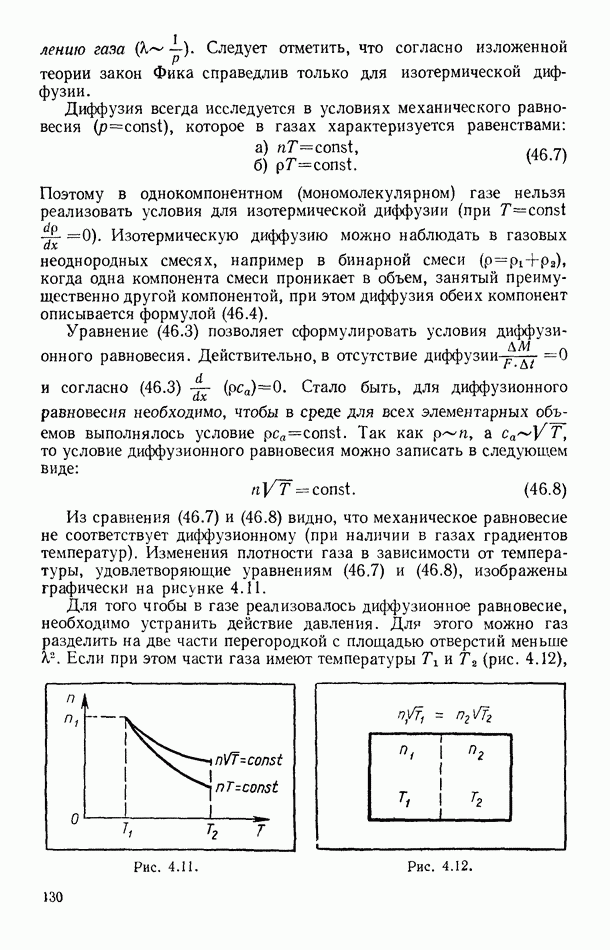
- Глава II. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- § 12. О ЗАКОНЕ СОХРАНЕНИЯ И ПРЕВРАЩЕНИЯ ЭНЕРГИИ
- § 13. РАБОТА КАК МАКРОСКОПИЧЕСКИЙ СПОСОБ ПЕРЕДАЧИ ЭНЕРГИИ
- § 14. ТЕПЛОТА КАК МИКРОФИЗИЧЕСКИЙ СПОСОБ ПЕРЕДАЧИ ЭНЕРГИИ. ТЕПЛОЕМКОСТЬ
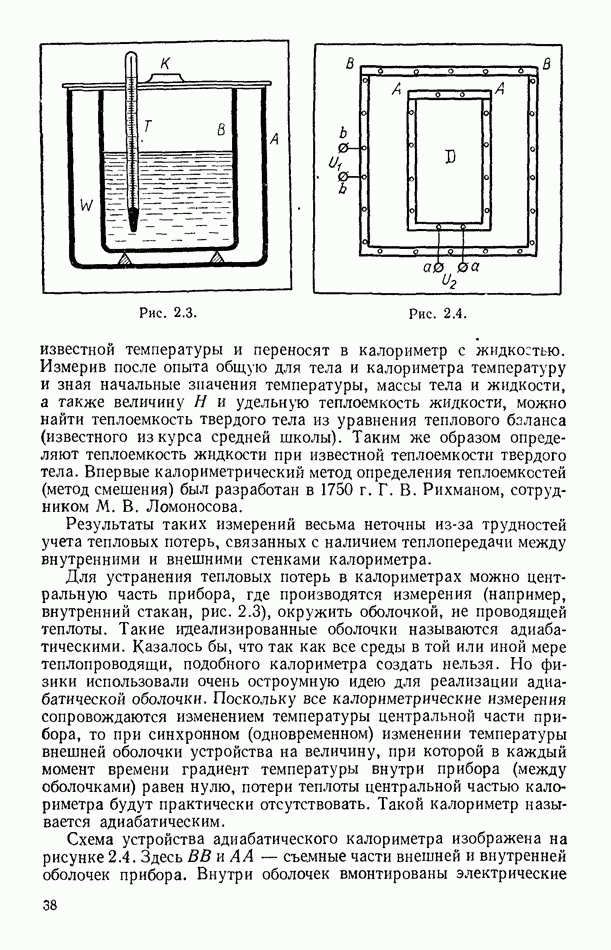
- § 15. ИЗМЕРЕНИЕ ТЕПЛОЕМКОСТИ
- § 16. ВНУТРЕННЯЯ ЭНЕРГИЯ КАК ФУНКЦИЯ СОСТОЯНИЯ СИСТЕМЫ
- § 17. ФОРМУЛИРОВКА ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ
- § 18. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ ДЛЯ ИДЕАЛЬНЫХ ГАЗОВ
- § 19. ИЗОБАРИЧЕСКИЙ ПРОЦЕСС В ИДЕАЛЬНОМ ГАЗЕ
- § 20. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС В ИДЕАЛЬНОМ ГАЗЕ
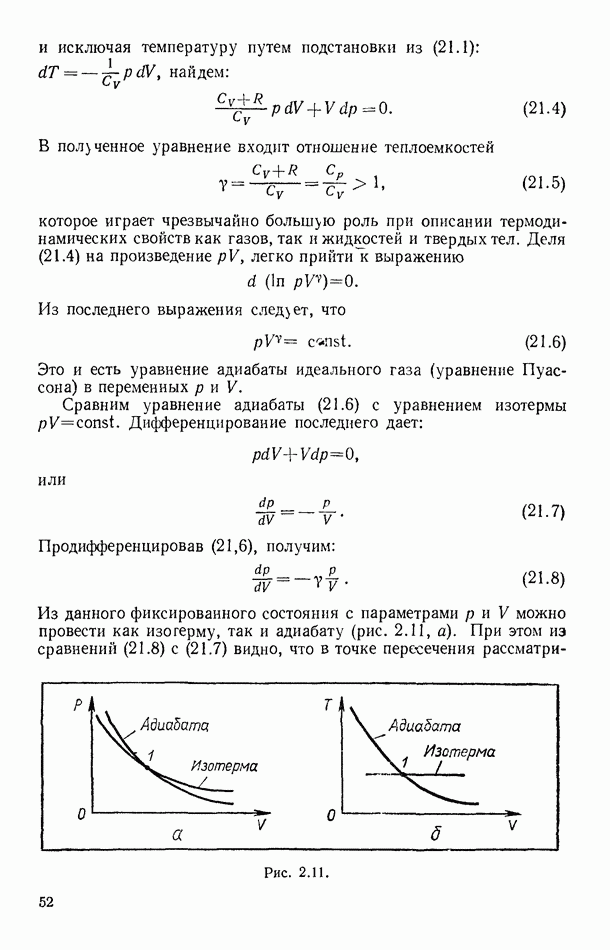
- § 21. АДИАБАТИЧЕСКИЙ ПРОЦЕСС В ИДЕАЛЬНОМ ГАЗЕ
- § 22. ПОЛИТРОПИЧЕСКИЕ ПРОЦЕССЫ В ИДЕАЛЬНОМ ГАЗЕ
- § 23. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ Cp/Cv
- § 24. ТЕПЛОЕМКОСТЬ СМЕСИ ГАЗОВ
- § 18. ЭНТАЛЬПИЯ КАК ФУНКЦИЯ СОСТОЯНИЯ СИСТЕМЫ
- Глава III. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ И ЕЕ ПРИМЕНЕНИЕ К ИДЕАЛЬНЫМ ГАЗАМ
- § 26. ИСХОДНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНОЙ ТЕОРИИ
- § 27. СРЕДНИЕ ВЕЛИЧИНЫ В ОПИСАНИИ МОЛЕКУЛЯРНЫХ СИСТЕМ
- § 28. ОСНОВНЫЕ ПОНЯТИЯ ТЕОРИИ ВЕРОЯТНОСТЕЙ
- § 29. РАСПРЕДЕЛЕНИЕ ЧАСТИЦ ПО ЭНЕРГИЯМ (РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА)
- § 30. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО КОМПОНЕНТАМ СКОРОСТЕЙ ИХ ТЕПЛОВОГО ДВИЖЕНИЯ (РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА)
- § 31. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО СКОРОСТЯМ ИХ ТЕПЛОВОГО ДВИЖЕНИЯ (РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА)
- § 32. ОПЫТНАЯ ПРОВЕРКА РАСПРЕДЕЛЕНИЯ МАКСВЕЛЛА
- § 33. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА ПО КИНЕТИЧЕСКОЙ ТЕОРИИ
- § 34. ПЛОТНОСТЬ ПОТОКА МОЛЕКУЛ В ИДЕАЛЬНОМ ГАЗЕ
- § 35. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ИДЕАЛЬНОГО ГАЗА В ПОЛВ СИЛЫ ТЯЖЕСТИ
- § 36. БРОУНОВСКОЕ ДВИЖЕНИЕ. ОПРЕДЕЛЕНИЕ ПЕРРЕНОМ ЧИСЛА АВОГАДРО
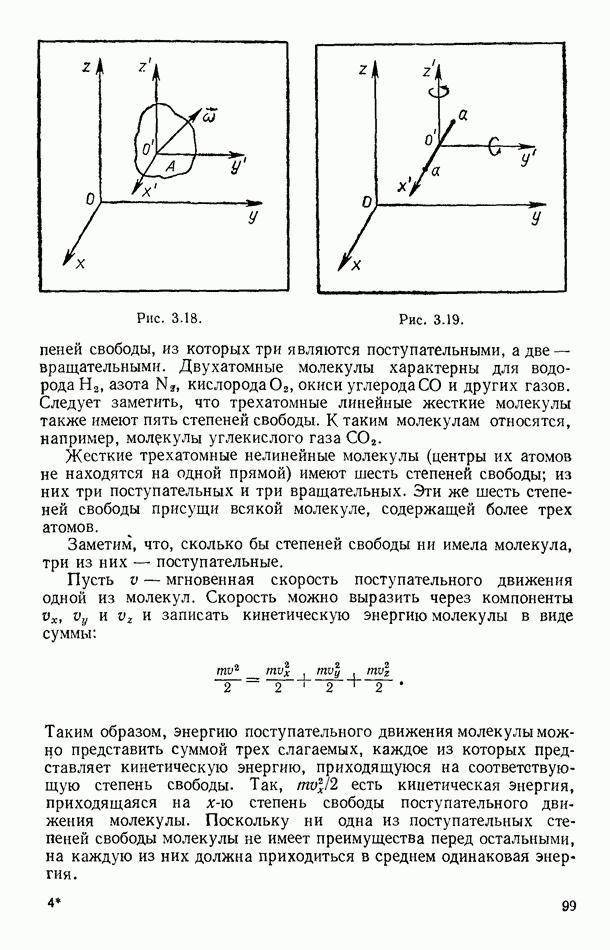
- § 37. ТЕОРЕМА О РАВНОРАСПРЕДЕЛЕНИИ И ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНЫХ ГАЗОВ
- § 38. КВАНТОВАЯ ТЕОРИЯ ТЕПЛОЕМКОСТИ ГАЗОВ
- § 39. ТЕРМОДИНАМИЧЕСКАЯ ВЕРОЯТНОСТЬ И РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ИДЕАЛЬНОГО ГАЗА В ПРОСТРАНСТВЕ
- Глава IV. ЯВЛЕНИЯ ПЕРЕНОСА И ИХ ТЕОРИЯ ДЛЯ ИДЕАЛЬНЫХ ГАЗОВ
- § 40. ТЕПЛОПРОВОДНОСТЬ
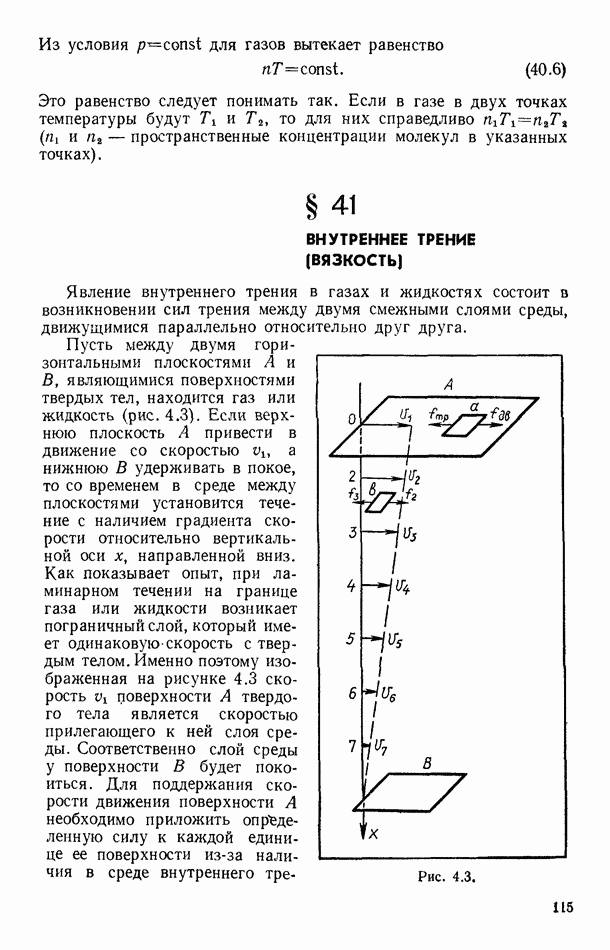
- § 41. ВНУТРЕННЕЕ ТРЕНИЕ (ВЯЗКОСТЬ)
- § 42. ДИФФУЗИЯ
- § 43. СРЕДНЯЯ ДЛИНА СВОБОДНОГО ПРОБЕГА МОЛЕКУЛ
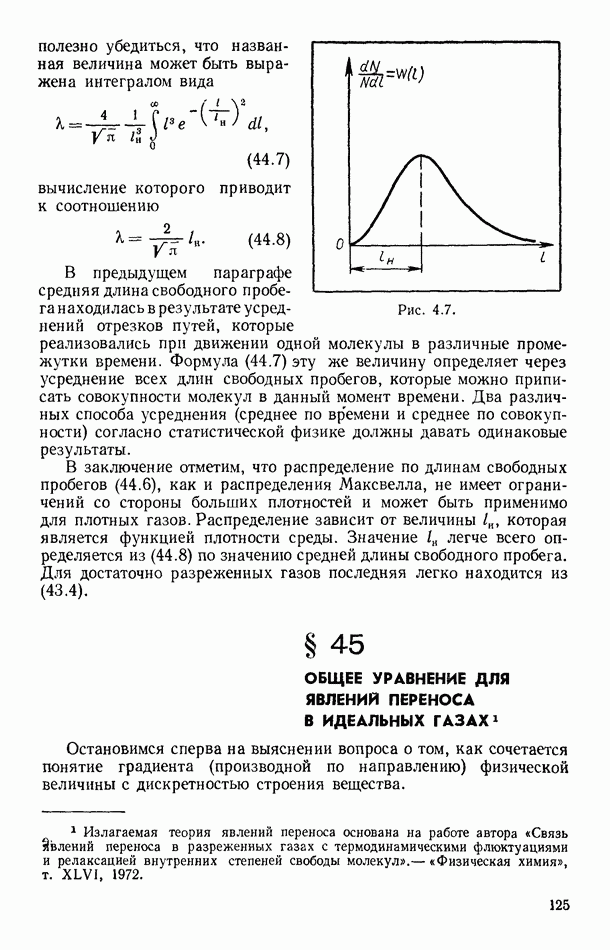
- § 44. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО ДЛИНАМ ИХ СВОБОДНЫХ ПРОБЕГОВ
- § 45. ОБЩЕЕ УРАВНЕНИЕ ДЛЯ ЯВЛЕНИИ ПЕРЕНОСА В ИДЕАЛЬНЫХ ГАЗАХ
- § 46. ДИФФУЗИЯ В ИДЕАЛЬНЫХ ГАЗАХ
- § 47. ВНУТРЕННЕЕ ТРЕНИЕ В ИДЕАЛЬНЫХ ГАЗАХ
- § 48. ТЕПЛОПРОВОДНОСТЬ ИДЕАЛЬНЫХ ГАЗОВ
- § 49. СВЯЗЬ МЕЖДУ КОЭФФИЦИЕНТАМИ ПЕРЕНОСА
- Глава V. СИЛЬНО РАЗРЕЖЕННЫЕ ГАЗЫ
- § 50. ПОЛУЧЕНИЕ И ИЗМЕРЕНИЕ ВАКУУМА
- § 51. СИЛЫ ТРЕНИЯ в ВАКУУМЕ
- § 52. ТЕПЛОПЕРЕДАЧА В ВАКУУМЕ
- § 53. ДИФФУЗИЯ В ВАКУУМЕ
- Глава VI. РЕАЛЬНЫЕ ГАЗЫ
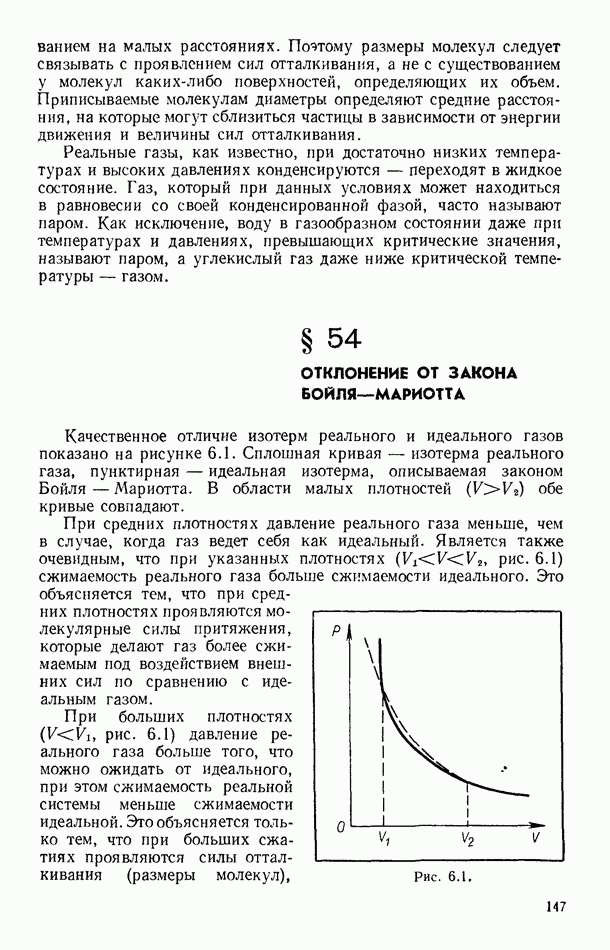
- § 54. ОТКЛОНЕНИЕ ОТ ЗАКОНА БОЙЛЯ—МАРИОТТА
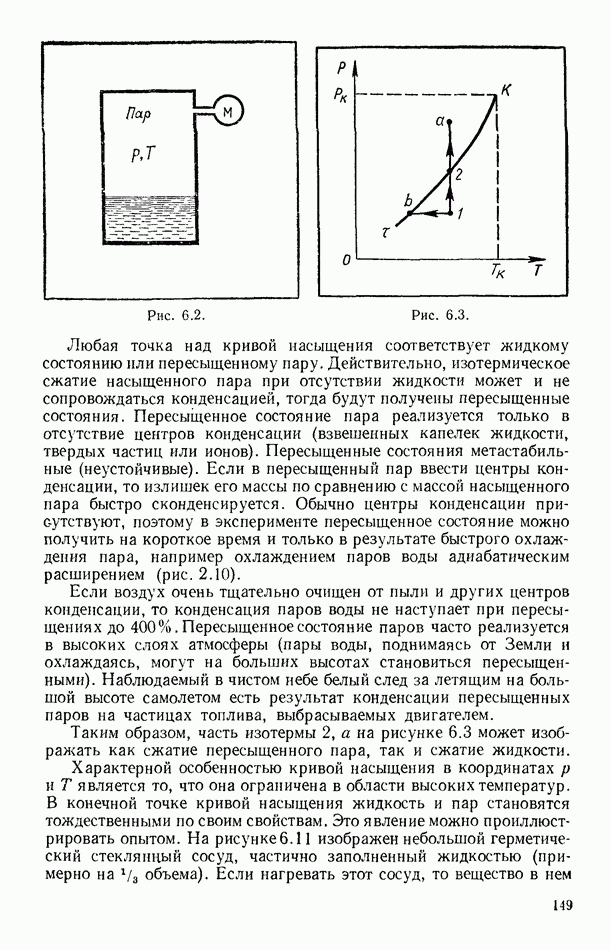
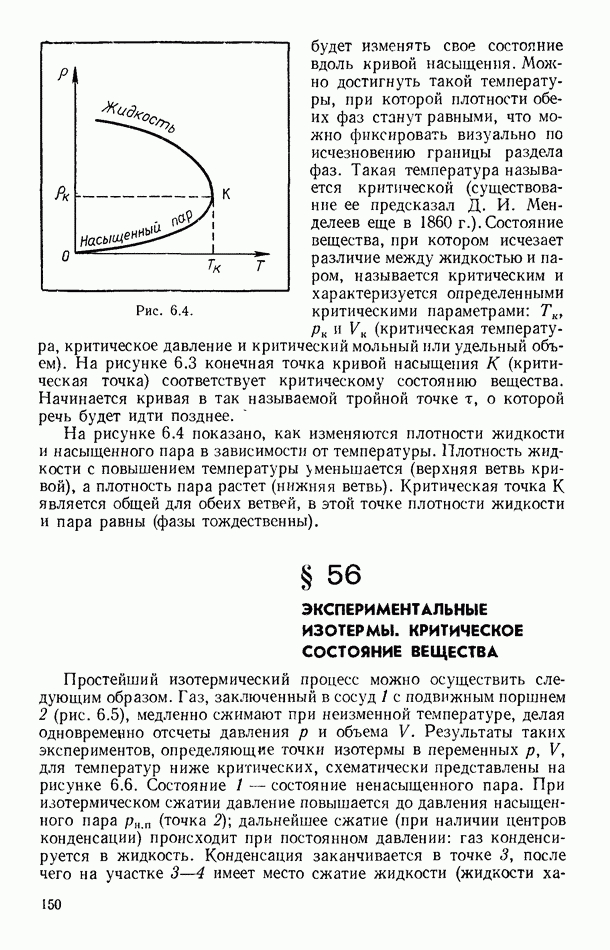
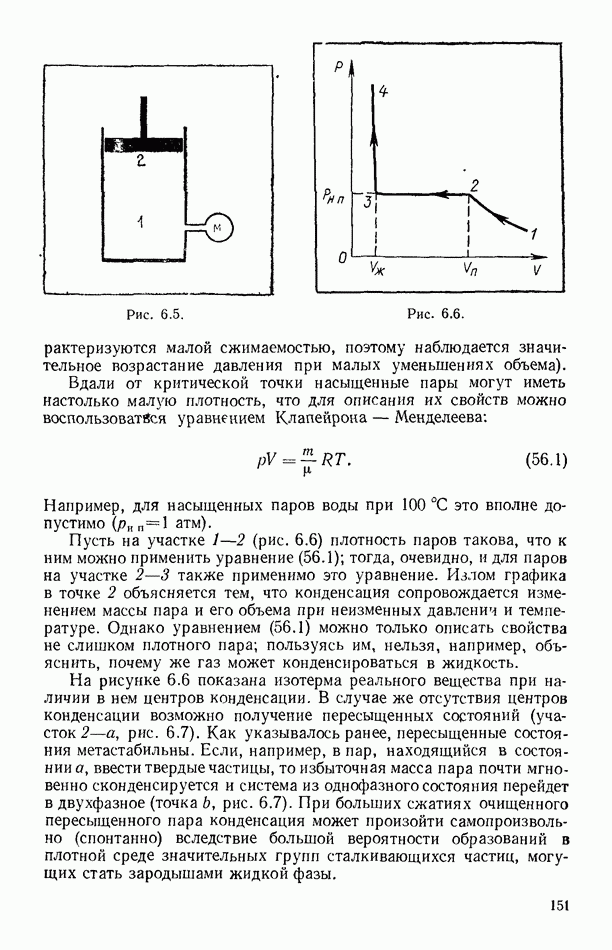
- § 55. РАВНОВЕСИЕ СИСТЕМЫ ЖИДКОСТЬ — ПАР
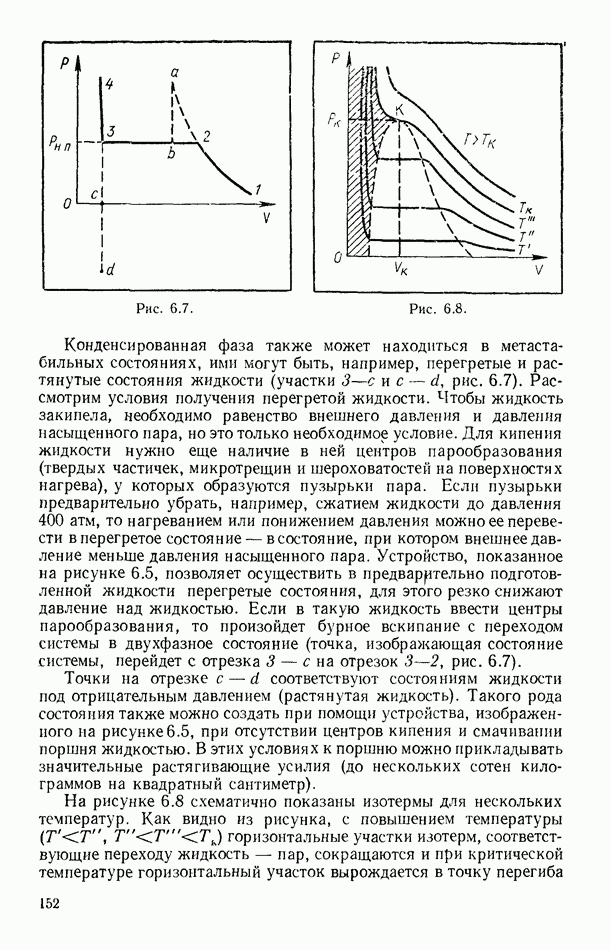
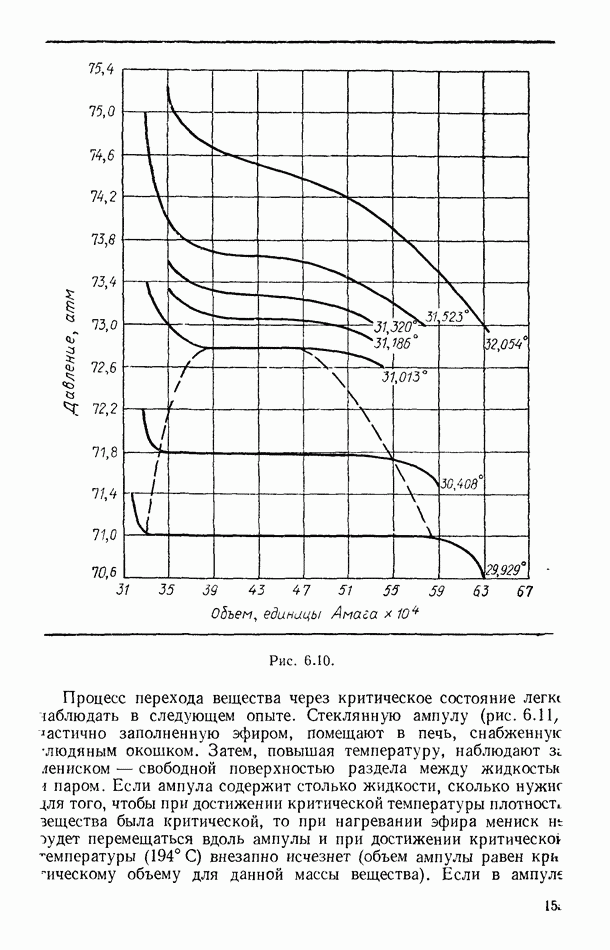
- § 56. ЭКСПЕРИМЕНТАЛЬНЫЕ ИЗОТЕРМЫ. КРИТИЧЕСКОЕ СОСТОЯНИЕ ВЕЩЕСТВА
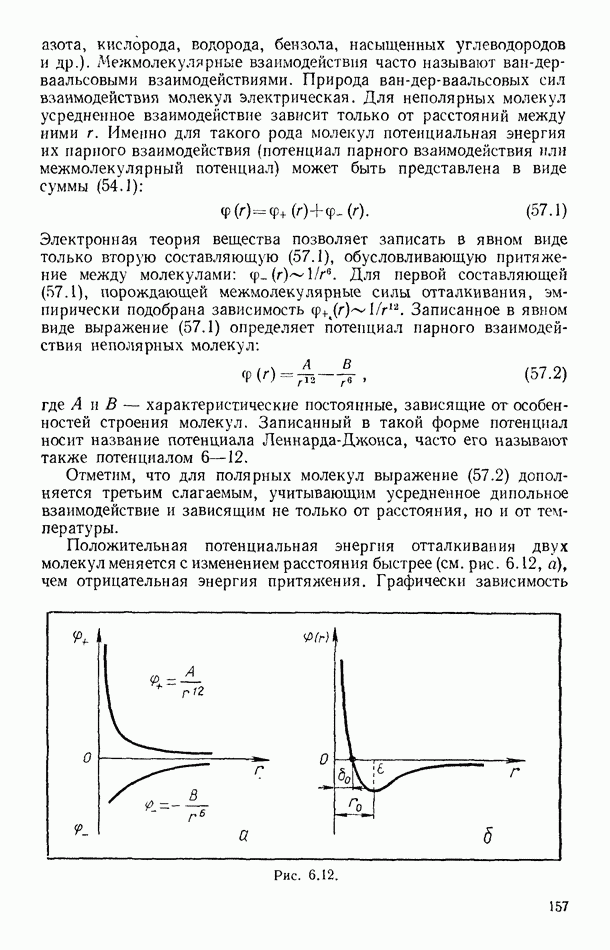
- § 57. ПОТЕНЦИАЛ ПАРНОГО ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ
- § 58. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА
- § 59. ИЗОТЕРМЫ ВАН-ДЕР-ВААЛЬСА. КРИТИЧЕСКИЕ ПАРАМЕТРЫ И ПОСТОЯННЫЕ ВАН-ДЕР-ВААЛЬСА
- § 60. ВНУТРЕННЯЯ ЭНЕРГИЯ РЕАЛЬНОГО ГАЗА. ЭФФЕКТ ДЖОУЛЯ — ТОМСОНА
- § 61. СЖИЖЕНИЕ ГАЗОВ
- § 62. УРАВНЕНИЕ СОСТОЯНИЯ РЕАЛЬНЫХ ГАЗОВ В ВИРИАЛЬНОЙ ФОРМЕ
- Глава VII. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- § 63. РАВНОВЕСНЫЕ И НЕРАВНОВЕСНЫЕ ПРОЦЕССЫ
- § 64. ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ
- § 65. ЦИКЛИЧЕСКИЕ (КРУГОВЫЕ) ПРОЦЕССЫ
- § 66. ЦИКЛ КАРНО
- § 67. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ ДЛЯ ОБРАТИМЫХ ПРОЦЕССОВ
- § 68. ЭНТРОПИЯ КАК ФУНКЦИЯ СОСТОЯНИЯ СИСТЕМЫ
- § 69. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ ДЛЯ НЕОБРАТИМЫХ ПРОЦЕССОВ
- § 70. НЕРАВЕНСТВО КЛАУЗИУСА. ПРИНЦИП ВОЗРАСТАНИЯ ЭНТРОПИИ
- § 71. ЭНТРОПИЯ И ВЕРОЯТНОСТЬ СОСТОЯНИЯ СИСТЕМЫ
- § 72. О ТАК НАЗЫВАЕМОЙ «ТЕПЛОВОЙ СМЕРТИ ВСЕЛЕННОЙ»
- § 73. ИЗОЭНТРОПИЧЕСКОЕ СОСТОЯНИЕ ТРОПОСФЕРЫ ЗЕМЛИ
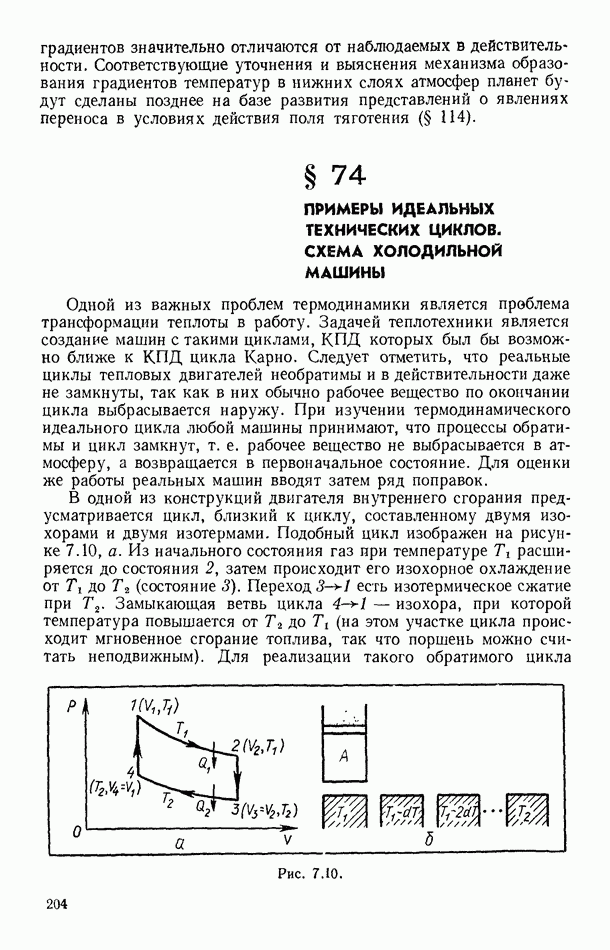
- § 74. ПРИМЕРЫ ИДЕАЛЬНЫХ ТЕХНИЧЕСКИХ ЦИКЛОВ. СХЕМА ХОЛОДИЛЬНОЙ МАШИНЫ
- Глава VIII. ЖИДКОСТИ
- § 75. ТЕПЛОВОЕ ДВИЖЕНИЕ И СТРУКТУРА ЖИДКОСТЕЙ
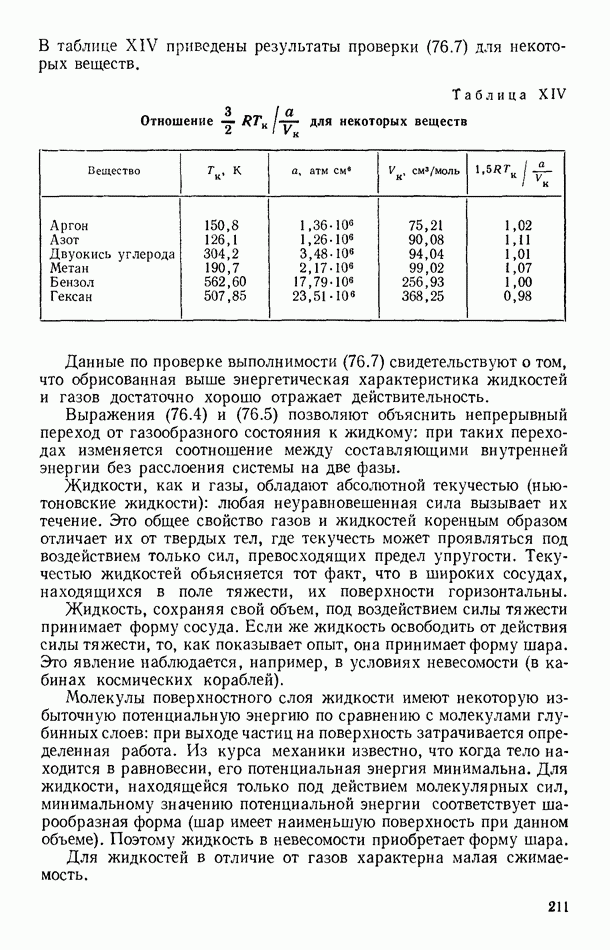
- § 76. ОСНОВНЫЕ СВОЙСТВА ЖИДКОСТЕЙ
- § 77. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ ЖИДКОСТЕЙ
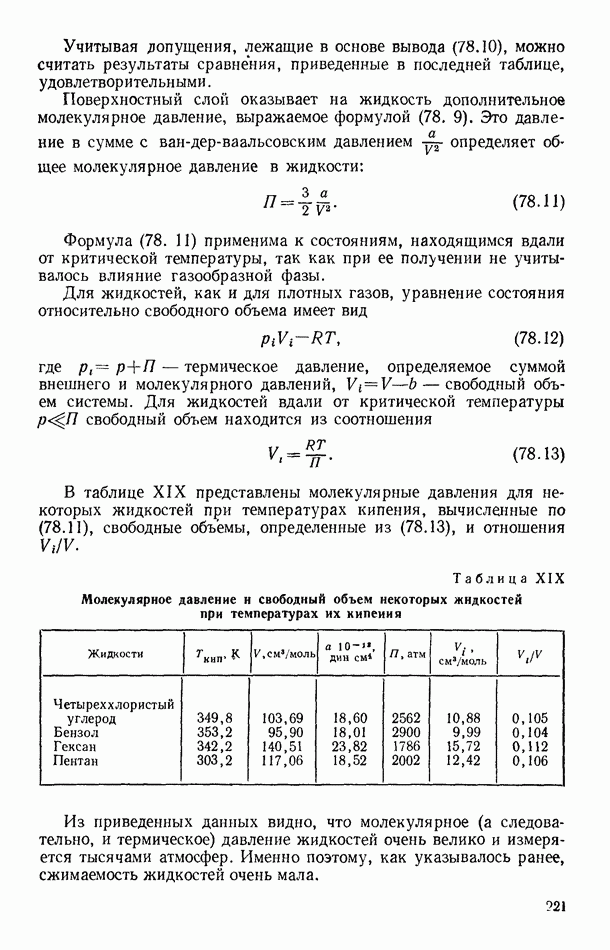
- § 78. МОЛЕКУЛЯРНОЕ ДАВЛЕНИЕ ПОВЕРХНОСТНОГО СЛОЯ ЖИДКОСТИ
- § 79. СИЛЫ, ВОЗНИКАЮЩИЕ НА КРИВОЙ ПОВЕРХНОСТИ ЖИДКОСТЕЙ
- § 80. КРАЕВОЙ УГОЛ. КАПИЛЛЯРНЫЕ ЯВЛЕНИЯ
- § 81. КИПЕНИЕ ЖИДКОСТЕЙ
- § 82. ТЕПЛОТА ПАРООБРАЗОВАНИЯ ЖИДКОСТЕЙ
- § 83. УРАВНЕНИЕ КЛАПЕЙРОНА — КЛАУЗИУСА
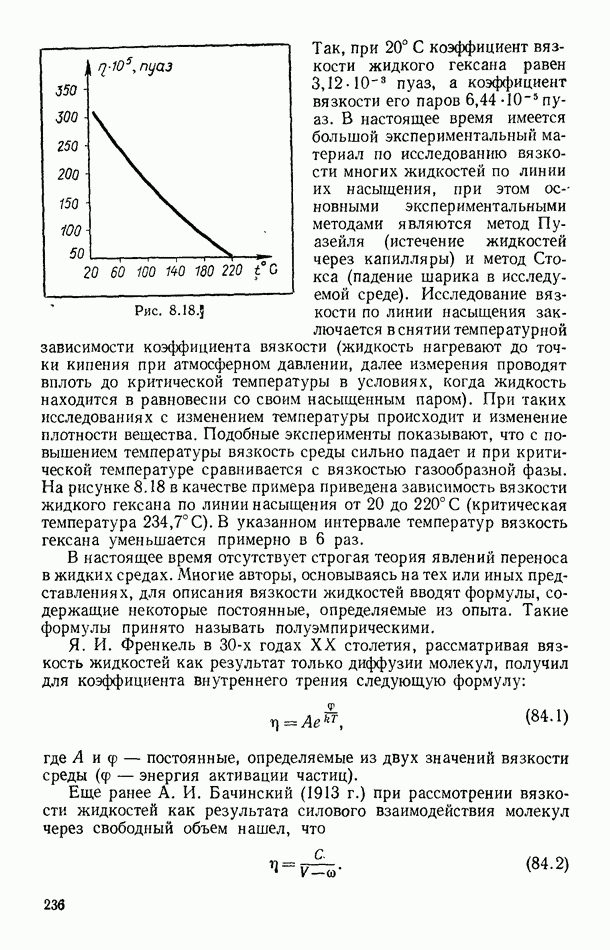
- § 84. ВЯЗКОСТЬ ЖИДКОСТЕЙ
- § 85. ЖИДКИЕ РАСТВОРЫ. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ. ЗАКОН РАУЛЯ
- § 86. ЖИДКИЙ ГЕЛИЙ. СВЕРХТЕКУЧЕСТЬ
- Глава IX. ТВЕРДЫЕ ТЕЛА
- § 87. ОСНОВНЫЕ ОСОБЕННОСТИ ТВЕРДЫХ ТЕЛ
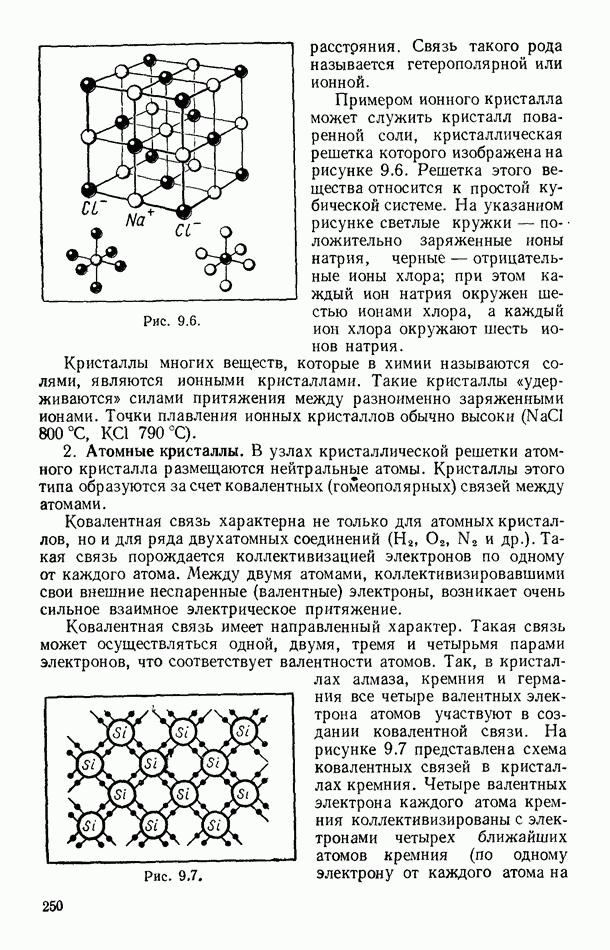
- § 88. СТРУКТУРА КРИСТАЛЛОВ
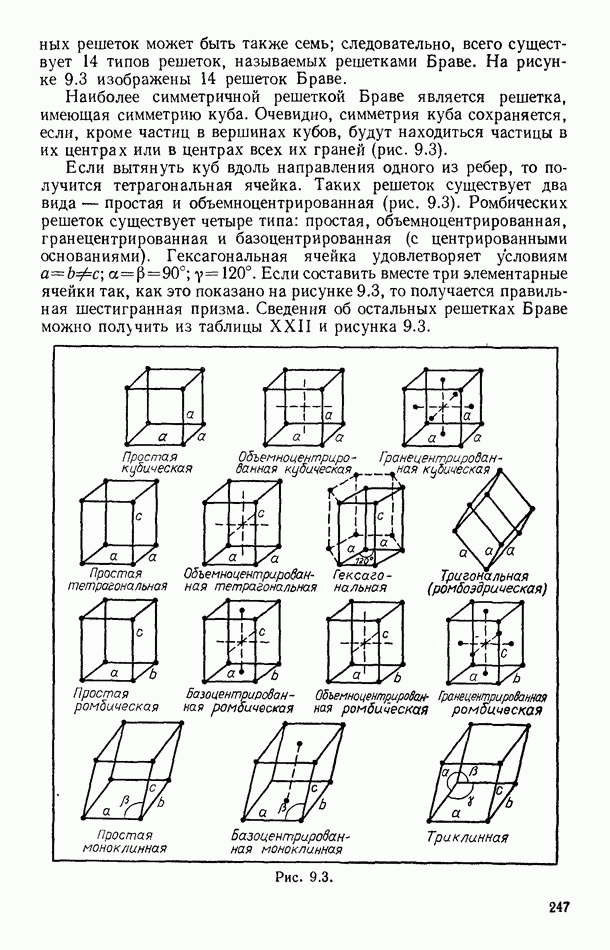
- § 89. ФИЗИЧЕСКИЕ ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК
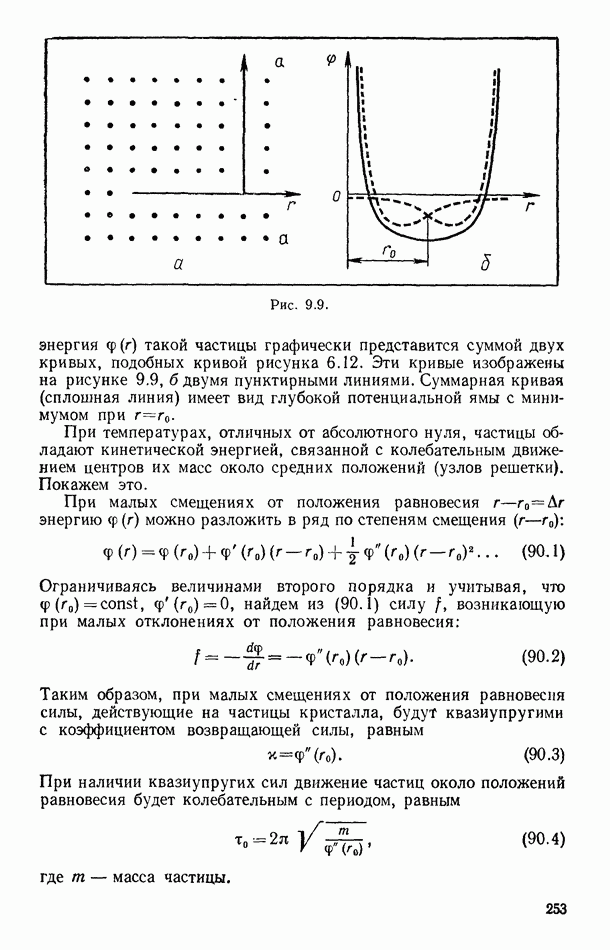
- § 90. ТЕПЛОВОЕ ДВИЖЕНИЕ В КРИСТАЛЛАХ
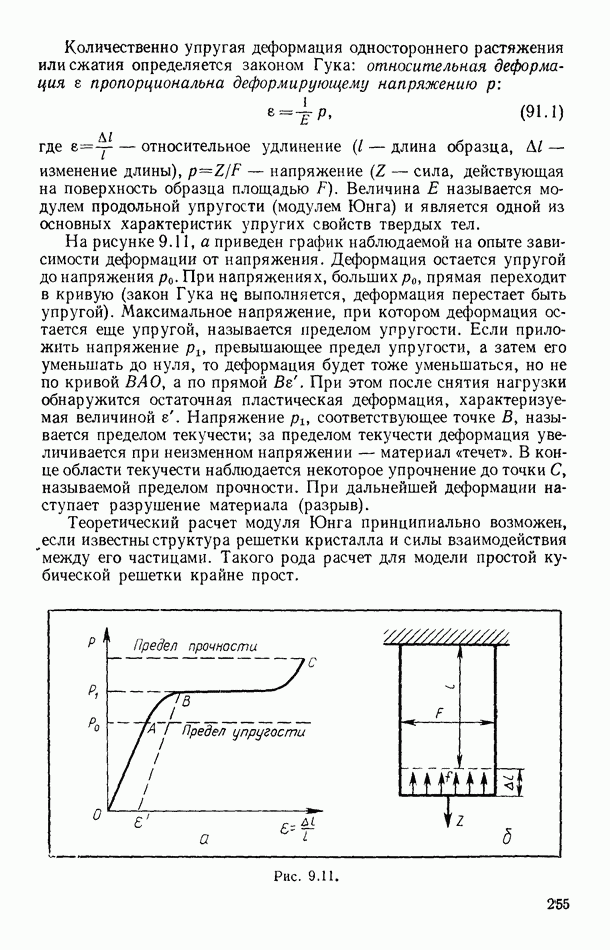
- § 91. МЕХАНИЧЕСКИЕ СВОЙСТВА КРИСТАЛЛОВ
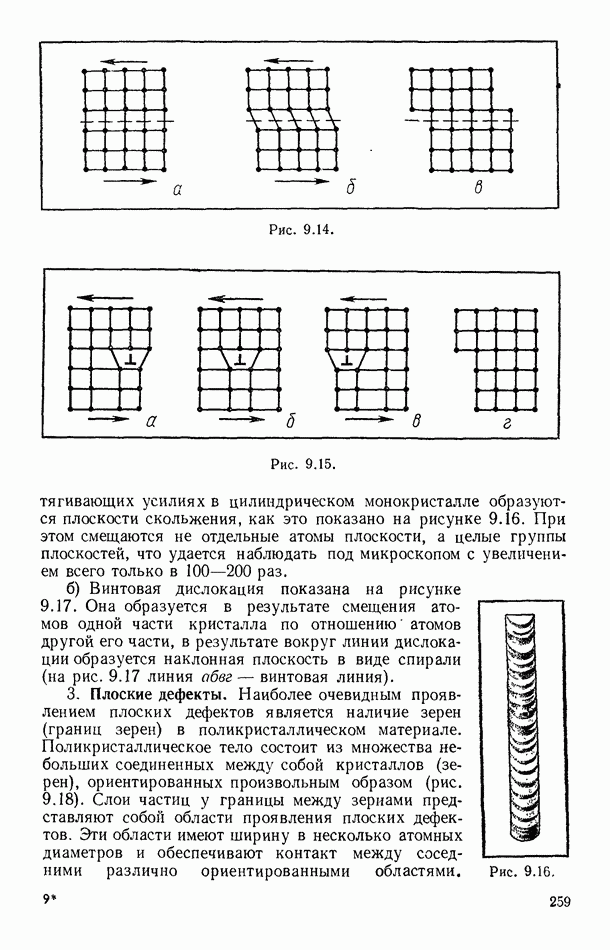
- § 92. ДЕФЕКТЫ В ТВЕРДЫХ ТЕЛАХ
- § 93. ТЕПЛОВОЕ РАСШИРЕНИЕ ТВЕРДЫХ ТЕЛ
- § 94. ТЕПЛОЕМКОСТЬ ТВЕРДЫХ ТЕЛ
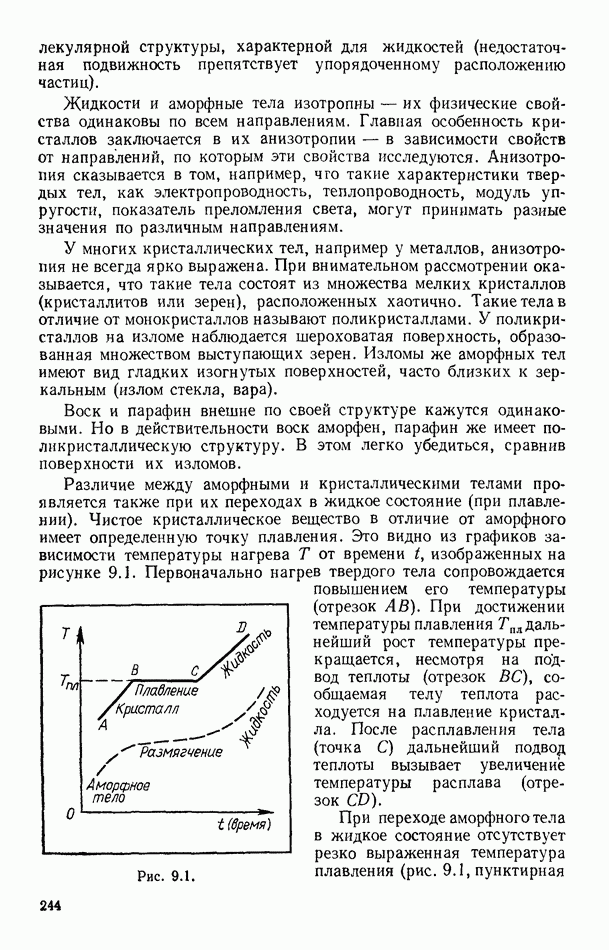
- § 95. ПЛАВЛЕНИЕ И КРИСТАЛЛИЗАЦИЯ
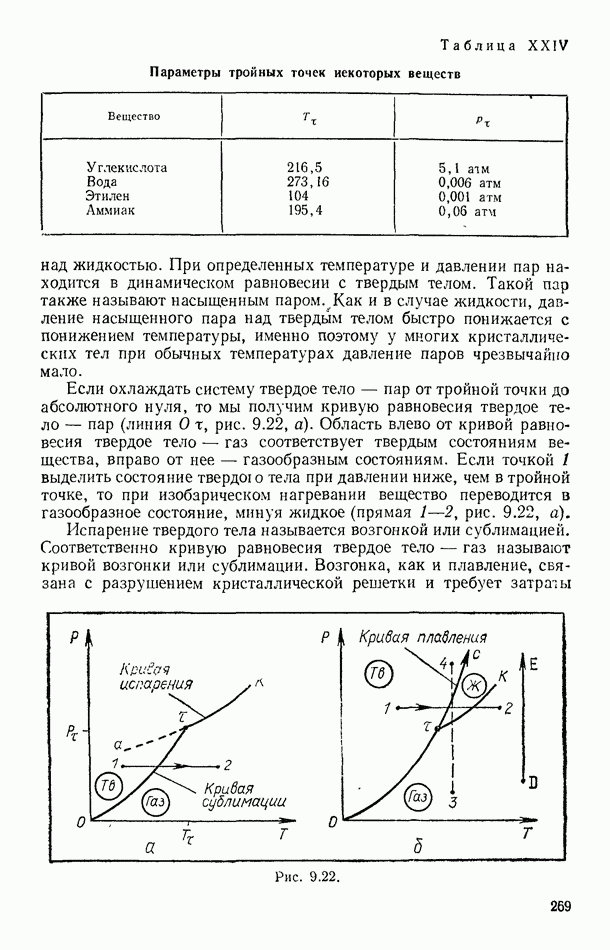
- § 96. ДИАГРАММЫ СОСТОЯНИЙ. ТРОЙНАЯ ТОЧКА
- § 97. ТЕПЛОТА ПЛАВЛЕНИЯ ПРОСТЫХ КРИСТАЛЛИЧЕСКИХ СТРУКТУР
- Глава X. ПОЛИМЕРЫ
- § 98. ОБЩИЕ ПРЕДСТАВЛЕНИЯ
- § 99. ПОЛУЧЕНИЕ ПОЛИМЕРОВ
- § 100. НЕКОТОРЫЕ ТИПЫ ПОЛИМЕРОВ. РОЛЬ МЕЖМОЛЕКУЛЯРНЫХ ВЗАИМОДЕЙСТВИЙ
- § 101. ТРИ СОСТОЯНИЯ АМОРФНЫХ ПОЛИМЕРОВ И ТЕПЛОВОЕ ДВИЖЕНИЕ В НИХ
- § 102. ЭЛАСТИЧНОСТЬ ПОЛИМЕРОВ
- § 103. КРИСТАЛЛИЧЕСКИЕ ПОЛИМЕРЫ
- § 104. ПРИМЕНЕНИЕ ПОЛИМЕРНЫХ МАТЕРИАЛОВ
- Глава XI. ЭЛЕМЕНТЫ ТЕРМОДИНАМИКИ ТЕКУЧИХ СРЕД И РАКЕТНОЙ ТЕХНИКИ
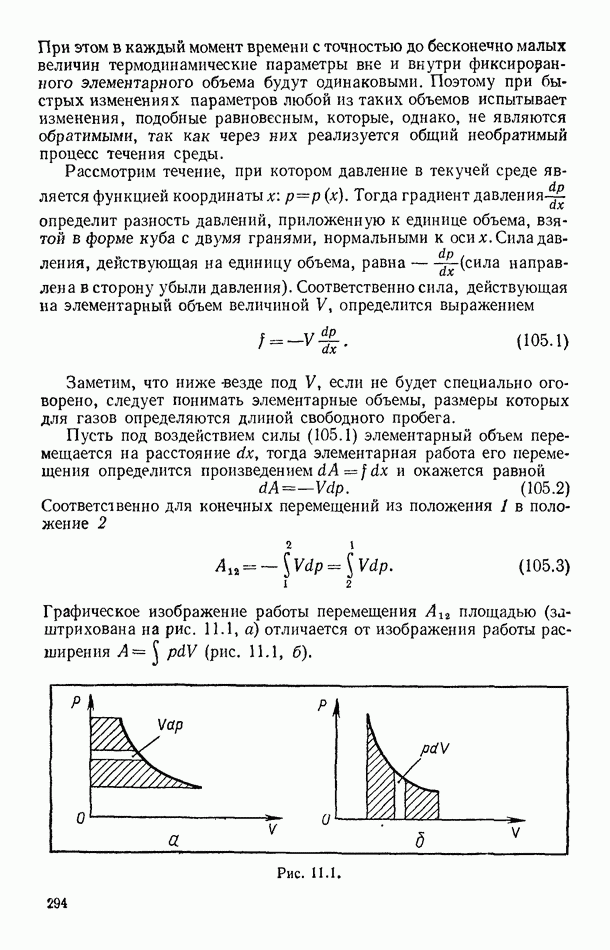
- § 105. РАБОТА ПЕРЕМЕЩЕНИЯ В ТЕКУЧИХ СРЕДАХ
- § 106. ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ ДЛЯ ПОТОКОВ ГАЗОВ И ЖИДКОСТЕЙ
- § 107. ЧАСТНЫЕ СЛУЧАИ ТЕЧЕНИЯ СРЕД
- § 108. ИСТЕЧЕНИЕ ГАЗОВ ИЗ СОПЕЛ. КРИТИЧЕСКАЯ СКОРОСТЬ
- § 109. ПРИНЦИП ДВИЖЕНИЯ РАКЕТ
- § 110. ЭЛЕМЕНТАРНАЯ ТЕРМОДИНАМИКА РАКЕТНОГО ДВИГАТЕЛЯ
- § 111. СХЕМЫ РАКЕТНЫХ ДВИГАТЕЛЕЙ
- § 112. МНОГОСТУПЕНЧАТЫЕ РАКЕТЫ
- § 113. ДВИЖЕНИЕ СО СВЕРХЗВУКОВОЙ СКОРОСТЬЮ. УДАРНЫЕ ВОЛНЫ
- § 114. О ГРАДИЕНТЕ ТЕМПЕРАТУРЫ В ТРОПОСФЕРЕ ЗЕМЛИ