| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ III.3. СТРОЕНИЕ КРИСТАЛЛОВ. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ТЕЛАХ
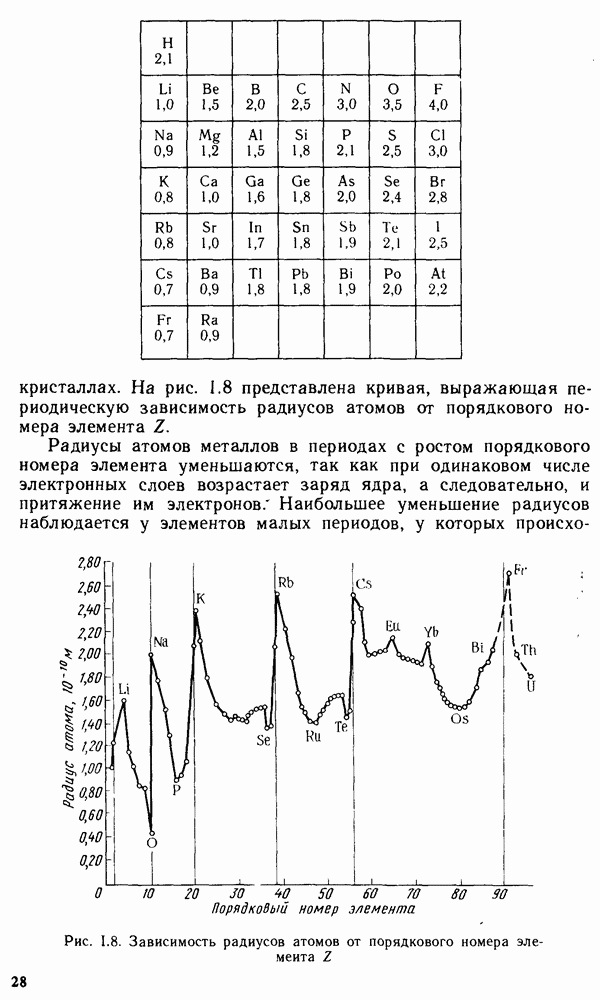
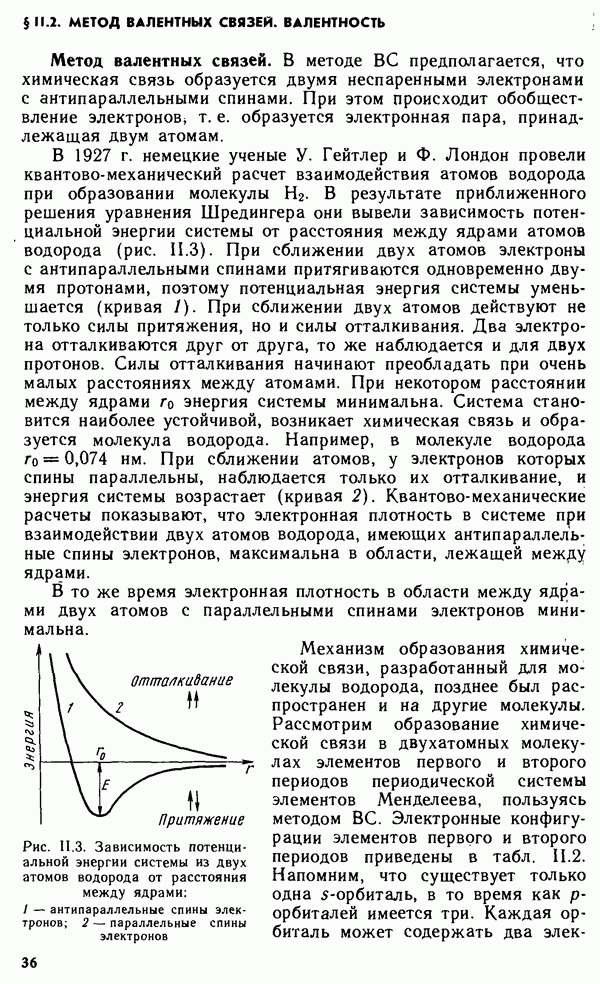
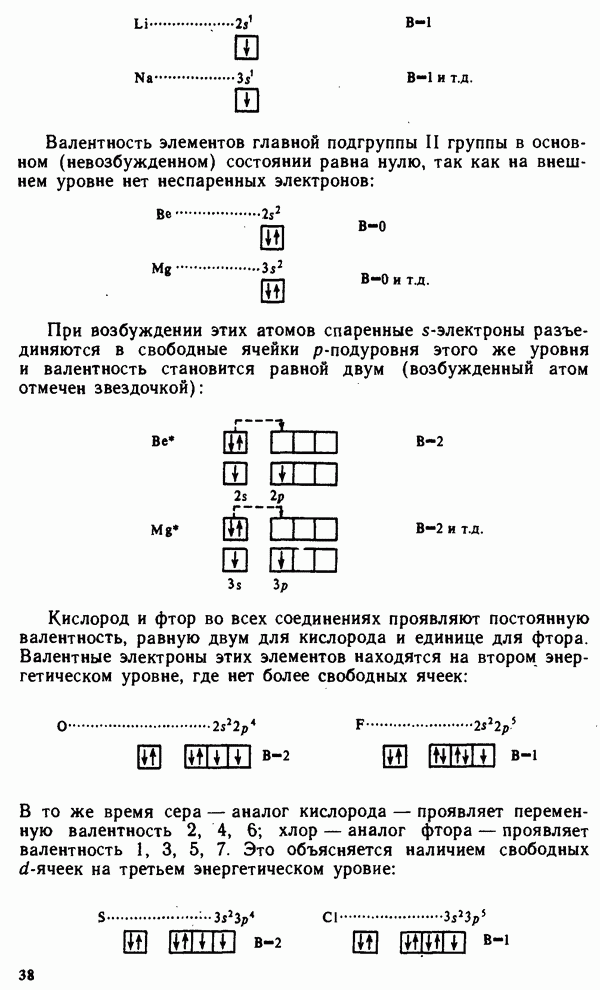
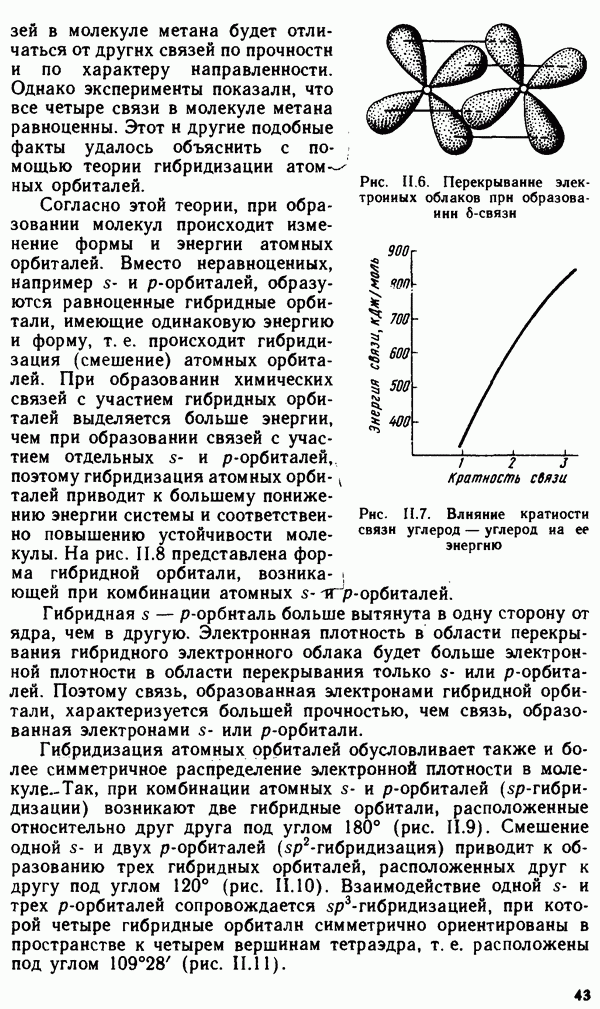
Кристаллические тела классифицируются или по симметрии кристаллов, например кубические, тетрагональные, ромбические, гексагональные, или по осуществляемому в них типу химической связи. Оба этих вида классификации взаимно дополняют друг друга. Классификация по симметрии более удобна при оценке оптических свойств кристаллов, а также каталитической активности кристаллических веществ. С другой стороны, оценку теплот плавления, твердости, электрической проводимости, теплопроводности, растворимости удобнее проводить на основании типа связи в кристалле.
Представления об элементах симметрии и классификации кристаллических форм.
Отображением пространственной структуры монокристалла служит его кристаллическая решетка. Таким образом, различие геометрических форм кристаллов тех или иных веществ связано с особенностями симметрии их кристаллических решеток. Обычно оценивают следующие элементы симметрии в монокристалле: оси симметрии, плоскости симметрии и центры симметрии. Если при повороте на определенный угол вокруг воображаемой оси кристаллическая решетка совмещается сама с собой, то это свидетельствует о наличии в кристалле оси симметрии. Если в кристалле можно провести одну или несколько плоскостей таким образом, что одна часть кристаллической решетки будет зеркальным отображением другой, значит в кристалле имеются плоскости симметрии. Наконец, когда отражение всех узлов решетки в какой-либо точке кристалла приводит к их совмещению, говорят о существовании центра симметрии. В 1890 г. Е. С. Федоров провел расчет всех возможных сочетаний элементов симметрии и установил, что число устойчивых сочетаний равно 230. По-видимому, этой цифрой исчерпывается все многообразие возможных кристаллических структур в природе.
Естественный рост кристалла часто скрывает его истинную симметрию. Поэтому при выяснении его пространственной структуры мысленно выделяют простейшую структурную единицу, последовательным перемещением которой в направлениях характеристических осей можно воссоздать кристаллическую решетку в целом. Подобные структурные единицы называют элементарными ячейками.
Важнейшими параметрами кристалла являются размеры элементарной ячейки; их определяют как равновесные расстояния в направлении характеристических осей между центрами частиц, занимающих соседние узлы решетки, и называют постоянными решетки. Более ста лет тому назад А. Бравэ показал, что существует всего 14 типов элементарных ячеек. Таким образом, кристаллы многих веществ имеют сходную пространственную структуру.

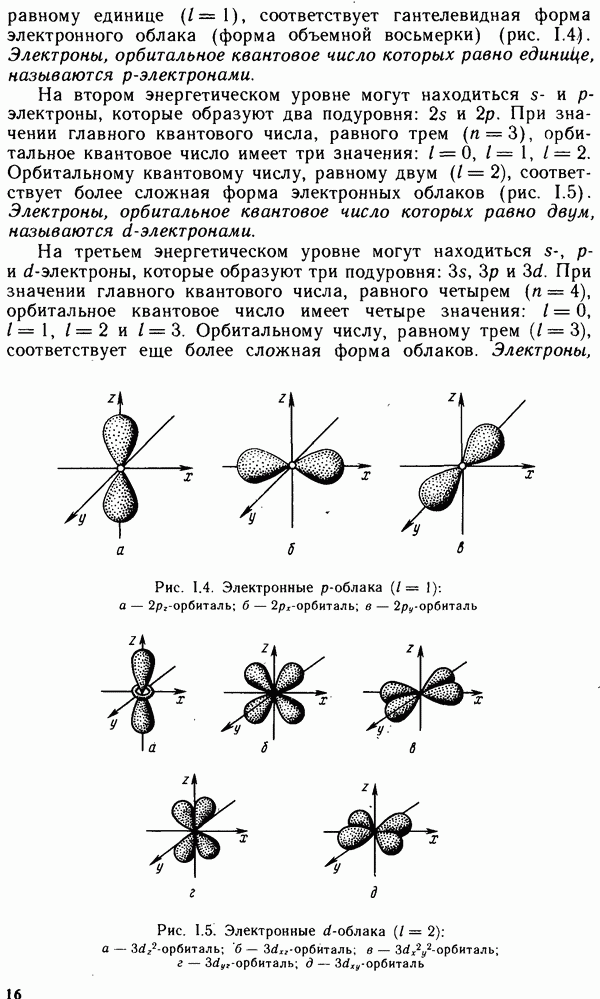
Рис. III.1. Плотнейшие упаковки шаров: а — гексагональная; б — кубическая
Если при этом их химическая природа также подобна, то такие вещества называют изоморфными. Если же эти вещества различной химической природы, их называют изоструктурными. Размещение частиц в пространственной решетке осуществляется таким образом, чтобы обеспечить максимально возможную для данного типа кристалла энергию их связи, а также энергетическую однородность в целом. Для частиц сферической формы наиболее благоприятным часто оказывается такое их размещение, при котором каждая сфера находится в соприкосновении с наибольшим числом ближайших соседей. Подобные пространственные образования называются структурами плотнейшей упаковки.
Количество же частиц, непосредственно примыкающих к данной, определяют как координационное число. В кристаллах, образованных сферическими частицами одинакового размера, их плотнейшая упаковка может осуществляться в виде двух энергетически равноценных структур; кубической и гексагональной (рис. III.1). Координационное число для каждой из этих структур равно 12, а сами сферы занимают 74 % полного объема кристалла. В подобных структурах кристаллизуются большинство металлов и сплавов, благородные газы, ряд соединений, молекулы которых обладают близкой к сферической симметрией, например  . Если частицы, образующие кристалл, не являются сферическими или имеют разные размеры, то их плотнейшая упаковка будет искажаться. При этом значение координационного числа будет меньше 12, а доля незанятого объема в кристалле будет расти.
. Если частицы, образующие кристалл, не являются сферическими или имеют разные размеры, то их плотнейшая упаковка будет искажаться. При этом значение координационного числа будет меньше 12, а доля незанятого объема в кристалле будет расти.
Наименьшие значения координационных чисел свойственны тем кристаллам, у которых между частицами осуществляются направленные ковалентные связи. Так, в кристаллах алмаза, нитрида бора, кристобалита  координационное число равно четырем, а объем, занимаемый частицами, составляет лишь
координационное число равно четырем, а объем, занимаемый частицами, составляет лишь 
Типы кристаллов.
Многие физико-химические свойства кристаллических веществ определяются типом химической связи между образующими их частицами. В соответствии с этой классификацией кристаллы подразделяют на молекулярные, ковалентные, ионные, металлические и смешанные.
При этом наряду с такими параметрами, как постоянные решетки и координационные числа, важной характеристикой кристалла становится энергия кристаллической решетки. Последнюю
определяют как энергию, которую необходимо затратить на разрушение данного монокристалла и удаление образующих его частиц за пределы их взаимодействия. Энергию кристаллической решетки обычно измеряют в килоджоулях и относят к одному молю кристаллического вещества.
Молекулярные кристаллы. Структурными единицами в кристаллах этого типа служат молекулы, связанные друг с другом силами Ван-дер-Ваальса или силами водородной связи. Малая энергия межмолекулярных связей определяет своеобразие свойств кристаллов этого типа. Их характеризует низкая энергия кристаллической решетки и связанные с этим малая механическая прочность, низкие температуры плавления и высокая летучесть. Молекулярные кристаллы не проводят электрический ток (диэлектрики) и обладают низкой теплопроводностью.
Наиболее низкой энергией кристаллической решетки обладают вещества с неполярными молекулами, такие, как благородные газы, галогены,  и т. п. Связь в их кристаллах осуществляется слабыми дисперсионными силами.
и т. п. Связь в их кристаллах осуществляется слабыми дисперсионными силами.
С ростом электрического момента диполя молекул, образующих кристалл, возрастает и энергия кристаллической решетки. Наибольшей энергией кристаллической решетки обладают молекулярные кристаллы с водородными связями, например 
Одна из специфических особенностей молекулярных кристаллов заключается в том, что в силу малой энергии межмолекулярного взаимодействия образующие их молекулы сохраняют свою химическую индивидуальность.
Силы Ван-дер-Ваальса можно считать ненаправленными. Поэтому для молекулярных кристаллов со сферическими или близкими к сферическим молекулами характерна структура кубической  или гексагональной
или гексагональной  плотнейшей упаковки.
плотнейшей упаковки.
Для молекул несферической формы обычно наблюдается искажение плотнейшей упаковки, иногда снимаемое при повышенных температурах. Наибольшие отличия от плотнейшей упаковки имеют молекулярные кристаллы с водородными связями, например  так как водородные связи обладают направленностью. Это в свою очередь снижает координационные числа частиц в кристалле. Так, координационное число молекул воды в структуре льда равно четырем.
так как водородные связи обладают направленностью. Это в свою очередь снижает координационные числа частиц в кристалле. Так, координационное число молекул воды в структуре льда равно четырем.
Ковалентные кристаллы. Структурными единицами в кристаллических решетках этого типа являются атомы одного или различных элементов, связь между которыми носит ковалентный характер и осуществляется по всем трем характеристическим осям. Ковалентные кристаллы сравнительно немногочисленны.
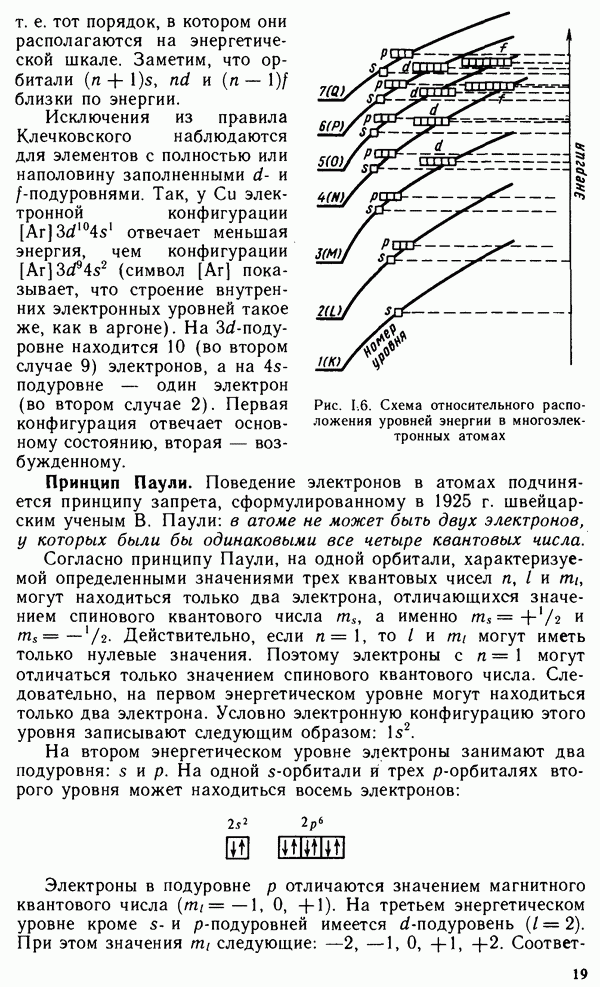
Примерами кристаллов этого типа могут служить алмаз, кремний, германий, серое олово, а также кристаллы сложных

Рис. III.2. Кристаллическая решетка алмаза
веществ, таких, как кварц, карбид кремния, сульфид цинка, нитрид алюминия.
Энергия кристаллической решетки в кристаллах этого типа фактически совпадает с энергией химической связи и лежит в пределах  . Так, энергия кристаллической решетки алмаза составляет
. Так, энергия кристаллической решетки алмаза составляет  Вследствие столь высокой энергии связи ковалентные кристаллы обладают высокими твердостью, температурами кипения и плавления. Диапазон их электропроводящих свойств велик: от типичных диэлектриков (алмаз, нитрид бора, кварц) до полупроводников (кремний, германий) и даже электронных проводников (олово).
Вследствие столь высокой энергии связи ковалентные кристаллы обладают высокими твердостью, температурами кипения и плавления. Диапазон их электропроводящих свойств велик: от типичных диэлектриков (алмаз, нитрид бора, кварц) до полупроводников (кремний, германий) и даже электронных проводников (олово).
В ковалентном кристалле невозможно выделить отдельную структурную единицу. Весь монокристалл по сути дела представляет собой одну гигантскую молекулу. Кристаллическая структура ковалентных твердых тел полностью определяется природой связей. Координационное число многих известных ковалентных кристаллов равно четырем. Это значит, что каждый атом в кристалле образует четыре направленные ковалентные связи. Направленность связи исключает плотнейшую упаковку кристалла. Примером кристаллической решетки с ковалентными связями служит решетка алмаза (рис. III.2).
Ионные кристаллы. Кристаллические решетки этого типа состоят из чередующихся положительно и отрицательно заряженных ионов, между которыми действуют электрические силы притяжения. Ионные кристаллы образуются при взаимодействии атомов, имеющих большую разность электроотрицательности. Примерами кристаллов, в которых преобладает ионный тип связи, могут быть  . В состав ионных соединений могут входить также сложные ионы, например
. В состав ионных соединений могут входить также сложные ионы, например 
Однако было бы неправильным считать ионный кристалл простым набором индивидуальных молекул, например  или
или  Правильнее рассматривать весь кристалл как одну гигантскую молекулу, в которой каждый ион испытывает значительное воздействие со стороны всех остальных ионов.
Правильнее рассматривать весь кристалл как одну гигантскую молекулу, в которой каждый ион испытывает значительное воздействие со стороны всех остальных ионов.
Энергия ионной кристаллической решетки может достигать весьма больших значений. Так, для кристаллов  и
и  она составляет соответственно
она составляет соответственно  Ионные кристаллы имеют высокую прочность, хрупкость, высокие температуры и теплоты плавления, причем перечисленные свойства обусловлены не только значительной энергией кристаллической решетки, но и структурой каркаса ионного монокристалла.
Ионные кристаллы имеют высокую прочность, хрупкость, высокие температуры и теплоты плавления, причем перечисленные свойства обусловлены не только значительной энергией кристаллической решетки, но и структурой каркаса ионного монокристалла.
Многие ионные кристаллы относятся к классу диэлектриков. При комнатных температурах их электрическая проводимость по
крайней мере на двадцать порядков ниже, чем у металлов. С ростом температуры наблюдается увеличение электрической проводимости. Во многих ионных кристаллах наряду с электростатическими силами связи действуют еще ковалентные силы и силы Ван-дер-Ваальса. В то время как вкладом последних можно пренебречь, наличие ковалентности в ионном кристалле вызывает определенные отклонения в его физико-химических свойствах, не объясняемые электростатической моделью. Наименьшее влияние ковалентности отмечено у галогенидов щелочных металлов.
Так как ионная связь не имеет направленного характера, а многим простым ионам можно приписать сферическую симметрию, следует ожидать, что структура большинства ионных кристаллов будет тождественна структуре плотнейшей упаковки. Однако тип упаковки ионного кристалла существенно зависит от соотношения размеров образующих его катионов и анионов.
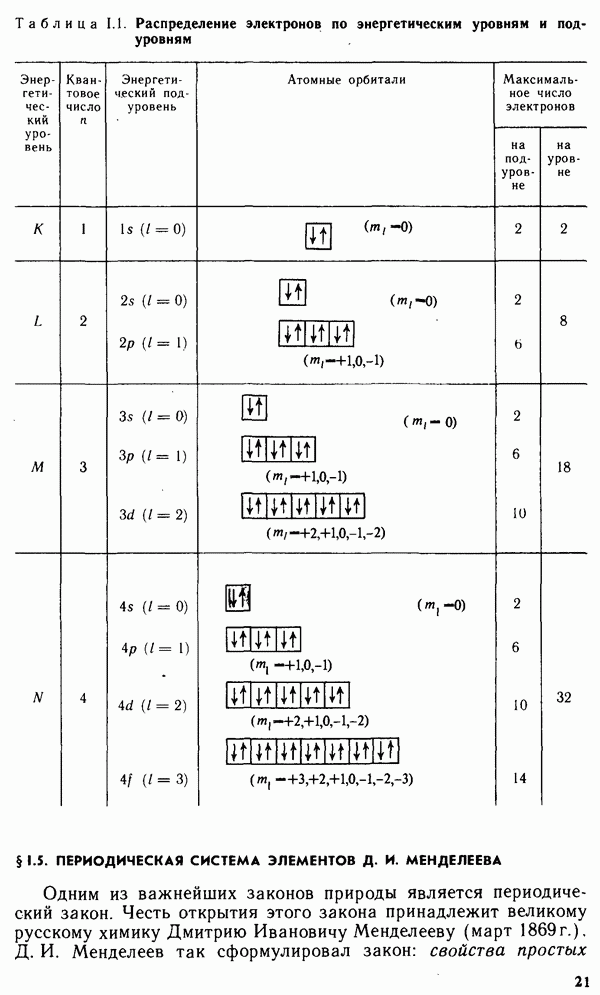
Вещества ионной природы с многоатомными ионами обычно также образуют ионные кристаллы с простыми решетками. Однако геометрическая форма ионов вызывает искажение пространственной структуры кристалла. На рис. III.3 приведены структуры ионных кристаллов  сопоставление которых позволяет оценить степень искажения структуры кристалла, вызванную тригональной симметрией карбонат-иона.
сопоставление которых позволяет оценить степень искажения структуры кристалла, вызванную тригональной симметрией карбонат-иона.
Металлические кристаллы. Металлическая связь. Более восьмидесяти элементов периодической системы в твердом состоянии проявляют так называемые металлические свойства. К ним относятся все  -элементы, кроме водорода и гелия, все
-элементы, кроме водорода и гелия, все  и
и  -элементы и часть
-элементы и часть  -элементов. Металлическими свойствами обладают и многочисленные сплавы указанных элементов. К металлическим свойствам обычно относят большую электрическую проводимость, высокую тягучесть и ковкость, металлический блеск и высокую отражательную способность в видимой области спектра. В табл. II 1.2 приведены некоторые свойства металлов. Там же для сопоставления даны аналогичные
-элементов. Металлическими свойствами обладают и многочисленные сплавы указанных элементов. К металлическим свойствам обычно относят большую электрическую проводимость, высокую тягучесть и ковкость, металлический блеск и высокую отражательную способность в видимой области спектра. В табл. II 1.2 приведены некоторые свойства металлов. Там же для сопоставления даны аналогичные

Рис. III.3. Кристаллические решетки 
Таблица III.2. Некоторые характеристики веществ при 298,16 К (см. скан)
свойства кристаллов других типов; алмаза (ковалентный), хлорида натрия (ионный) и серы (молекулярный).
По энергии кристаллической решетки металлы занимают промежуточное положение между молекулярными и ковалентными кристаллами. В то же время плотность большинства металлов значительна, что свидетельствует об очень плотной структуре металлических кристаллов. С другой стороны, такие свойства металлов, как высокие ковкость и тягучесть, указывают на отсутствие жесткости в металлических решетках: их плоскости довольно легко сдвигаются одна относительно другой.
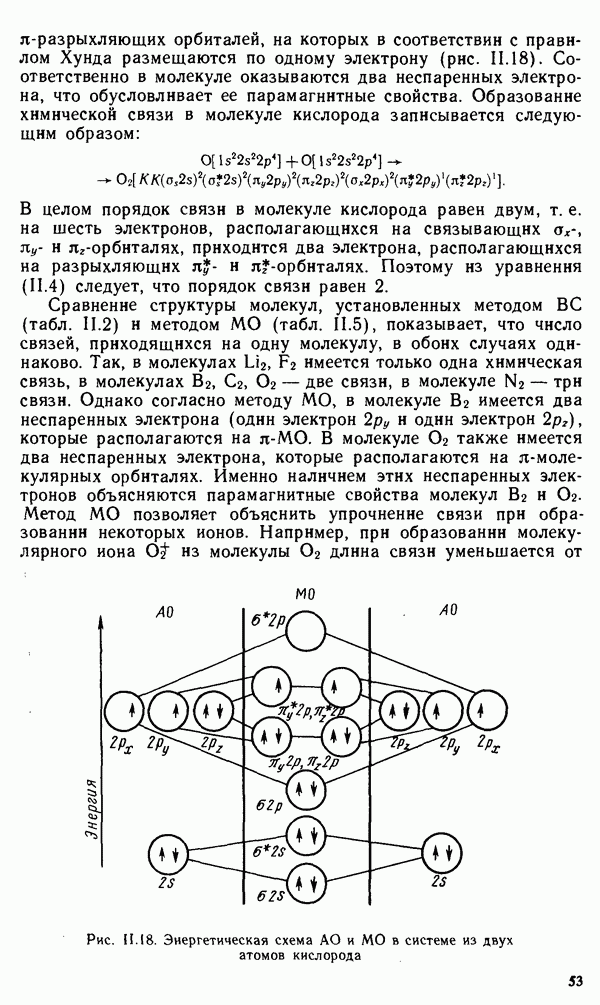
Чрезвычайно высокие по сравнению с другими типами кристаллов значения электрической проводимости и теплопроводности металлов указывают на высокую подвижность и большую «свободу» электронов в их пространственной структуре. С точки зрения строения атомов типичные металлические свойства проявляют элементы, обладающие небольшим числом валентных электронов, и, напротив, большим количеством незаполненных орбиталей на внешнем квантовом слое. За счет перечисленных особенностей при кристаллизации атомы вещества будут упаковываться с максимально возможной плотностью так, чтобы их незаполненные орбитали оказались как можно более полно заселены небольшим числом имеющихся валентных электронов соседних атомов.
Таким образом, валентные электроны участвуют в образовании связи сразу с восемью или двенадцатью атомами, каждый из которых в свою очередь входит в соседнюю группировку, насчитывающую такое же число атомов. В этих условиях валентный электрон с небольшой энергией ионизации свободно перемещается по доступным орбиталям всех соседних атомов, обеспечивая связь между ними, т. е. является нелокализованным.
Такая нелокализованная химическая связь в металлических кристаллах называется металлической связью. Для описания металлической связи часто используют модель «свободного электрона». Согласно этой модели, в узлах кристаллической решетки металла находятся положительные ионы металла, «погруженные» в электронный газ из нелокализованных валентных электронов атомов, участвующих в образовании кристалла. Устойчивость кристалла обеспечивается силами притяжения между положительными ионами и электронным газом.
Согласно этой теории, движение электронного газа подчиняется классическим законам перемещения газообразных молекул. С ростом температуры диапазон тепловых колебаний катионов возрастает, за счет чего увеличивается длина пробега электронов в кристалле и, как следствие, снижается его электрическая проводимость.
Несмотря на явную сомнительность пренебрежения электронно-ионным взаимодействием, теория свободного электрона в состоянии объяснить многие свойства металлов. Так, ненаправленный характер связей ионов с электронным газом в металлических кристаллах объясняет их высокую ковкость и тягучесть. По этой же причине чистые металлы должны кристаллизоваться преимущественно в структурах плотнейших упаковок. И действительно, большая часть металлов имеет или гексагональную, или гранецентрированную кубическую плотнейшую упаковку, аналогичную приведенным на рис. III. 1.
Кристаллы со смешанными связями. Существует большая группа твердых веществ, в кристаллах которых одновременно реализуются разные по типу связи. При оценке свойств такого кристаллического тела необходимо вводить поправку на дополнительное специфическое взаимодействие. Так, в молекулярных кристаллах типа  наряду с силами Ван-дер-Ваальса действуют и силы водородной связи, следствием чего служит относительное повышение прочности таких твердых веществ, а также температур их плавления.
наряду с силами Ван-дер-Ваальса действуют и силы водородной связи, следствием чего служит относительное повышение прочности таких твердых веществ, а также температур их плавления.
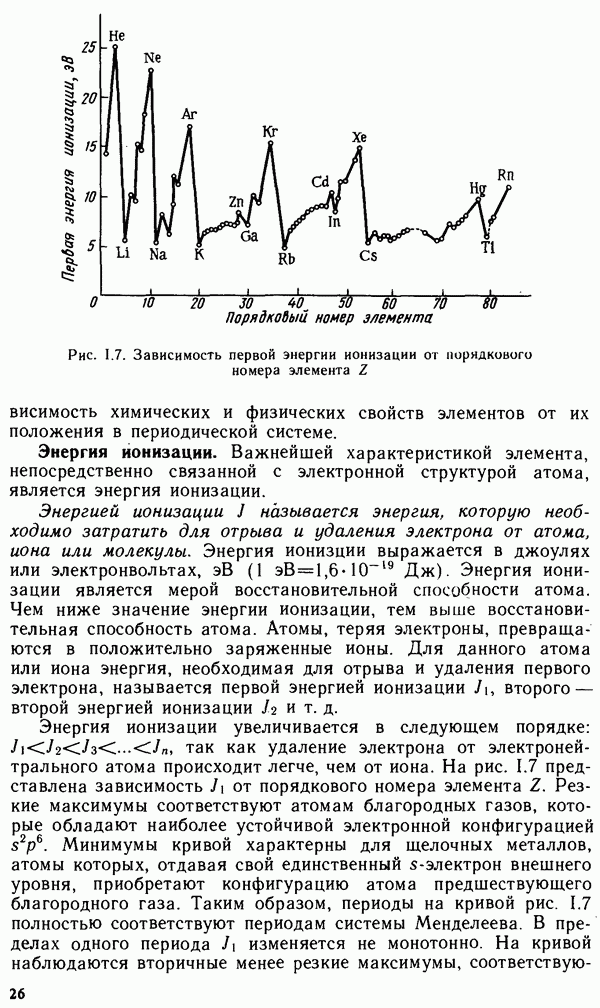
Появление дополнительных видов связи в ковалентных кристаллах может привести к резкому изменению их основных характеристик. Ярким примером кристаллов со смешанными связями служит одна из форм углерода — графит, структура которого приведена на рис. III.4. В графите атомы углерода связаны друг с другом так, что они образуют плоские двухмерные слои, в пределах которых атомы углерода связаны друг с другом за счет  -гибридных орбиталей (длина связи 0,142 нм). При этом в каждом таком слое, состоящем из N атомов углерода, имеются N нелокализованных электронов, участвующих в образовании
-гибридных орбиталей (длина связи 0,142 нм). При этом в каждом таком слое, состоящем из N атомов углерода, имеются N нелокализованных электронов, участвующих в образовании  -связей и способных переносить ток. Связь между рассмотренными двухмерными слоями графита осуществляется лишь за счет слабых сил Ван-дер-Ваальса (расстояние между слоями составляет 0,35 нм). Поэтому в направлении этой оси кристалл графита имеет низкую твердость и относится к типичным изоляторам
-связей и способных переносить ток. Связь между рассмотренными двухмерными слоями графита осуществляется лишь за счет слабых сил Ван-дер-Ваальса (расстояние между слоями составляет 0,35 нм). Поэтому в направлении этой оси кристалл графита имеет низкую твердость и относится к типичным изоляторам

Рис. III. 4. Кристаллическая структура графита
Таким образом, графит является молекулярным кристаллом в одном направлении и ковалентным — в другом направлении.
Так как расстояние между слоями графита достаточно велико, то между ними могут внедряться другие атомы или молекулы, при этом образуются соединения, назы ваемые соединениями внедрения, слоистыми соединениями или клатратами. Примерами таких соединений являются фториды графита CF, в которых атомы фтора внедрень между слоями решетки графита. Они используются как смазка, материалы электрощеток, а также как электроды в химически? источниках тока.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- § 1. ПРЕДМЕТ ХИМИИ
- § 2. ЗНАЧЕНИЕ ХИМИИ В ИЗУЧЕНИИ ПРИРОДЫ И РАЗВИТИИ ТЕХНИКИ
- 1. СТРОЕНИЕ ВЕЩЕСТВА
- Глава I. СТРОЕНИЕ АТОМА И СИСТЕМАТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- § 1.2. КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА
- § 1.3. КВАНТОВЫЕ ЧИСЛА И АТОМНЫЕ ОРБИТАЛИ
- § 1.4. МНОГОЭЛЕКТРОННЫЕ АТОМЫ
- § 1.5. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
- § 1.6. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- Глава II. ХИМИЧЕСКАЯ СВЯЗЬ
- § II.1. ОСНОВНЫЕ ВИДЫ И ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ
- § II.2. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ. ВАЛЕНТНОСТЬ
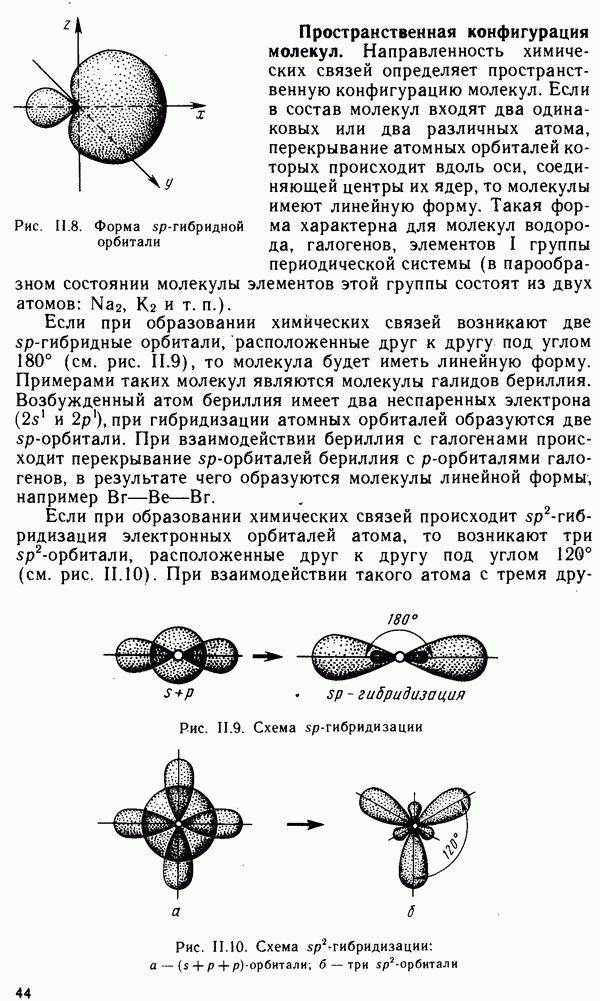
- § II.3. НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. ПРОСТРАНСТВЕННАЯ СТРУКТУРА МОЛЕКУЛ
- § 11.4. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
- § 11.5. ЭЛЕКТРОННАЯ СТРУКТУРА НЕКОТОРЫХ МОЛЕКУЛ
- Глава III. ТИПЫ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ. КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- § III.1. ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ
- § III.2. СВОЙСТВА ВЕЩЕСТВ В РАЗЛИЧНЫХ СОСТОЯНИЯХ
- § III.3. СТРОЕНИЕ КРИСТАЛЛОВ. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ТЕЛАХ
- § III.4. МЕТАЛЛЫ, ПОЛУПРОВОДНИКИ И ДИЭЛЕКТРИКИ
- § III.5. РЕАЛЬНЫЕ КРИСТАЛЛЫ
- 2. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
- Глава IV. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ СРОДСТВО
- § IV.2. ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ И ФАЗОВЫХ ПРЕВРАЩЕНИЙ. ТЕРМОХИМИЧЕСКИЕ ЗАКОНЫ
- § IV.3. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
- § IV.4. ЭНТРОПИЯ. НАПРАВЛЕНИЕ И ПРЕДЕЛ ПРОТЕКАНИЯ ПРОЦЕССОВ В ИЗОЛИРОВАННЫХ СИСТЕМАХ
- § IV.5. ЭНЕРГИЯ ГИББСА И ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА ХИМИЧЕСКОЙ РЕАКЦИИ
- Глава V. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- § V.2. СКОРОСТЬ ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ
- § V.3. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
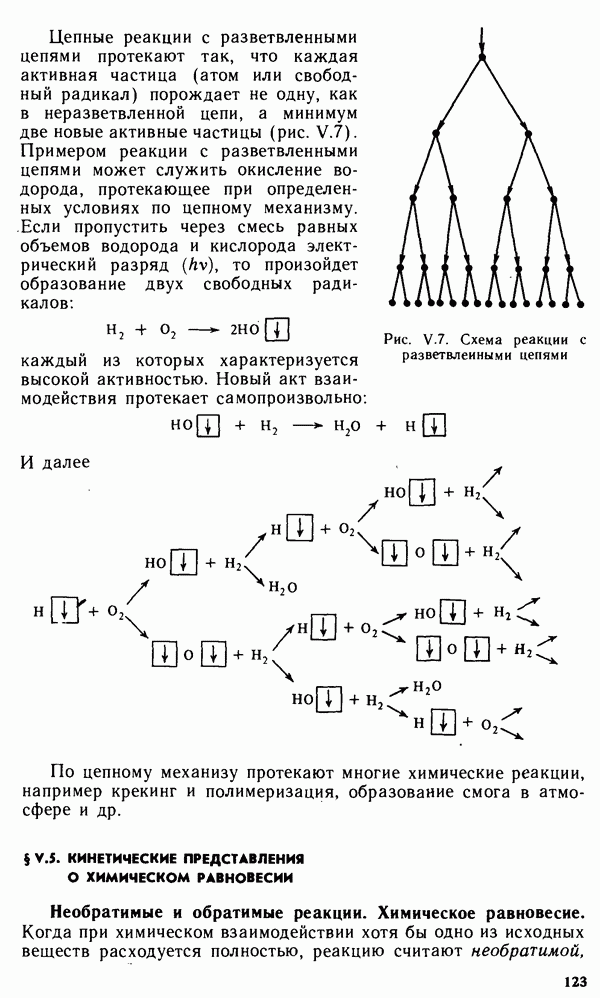
- § V.4. ФИЗИЧЕСКИЕ ВОЗДЕЙСТВИЯ НА ХИМИЧЕСКИЕ РЕАКЦИИ. ЦЕПНЫЕ РЕАКЦИИ
- § V.5. КИНЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ О ХИМИЧЕСКОМ РАВНОВЕСИИ
- § V.6. ФАЗОВЫЕ РАВНОВЕСИЯ ПРАВИЛО ФАЗ
- § V.7. АДСОРБЦИОННОЕ РАВНОВЕСИЕ
- § V.8. КАТАЛИЗ
- 3. РАСТВОРЫ ДИСПЕРСНЫЕ СИСТЕМЫ ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- VI.1. ОБЩИЕ ПОНЯТИЯ О РАСТВОРАХ
- § VI.2. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЖИДКИХ РАСТВОРОВ
- § VI.3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ
- § VI.4. ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- § VI.5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
- § VI.6. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- § VI.7. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ
- § VI.8. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ
- Глава VII. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.1. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- § VII.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.3. ПОТЕНЦИАЛЫ МЕТАЛЛИЧЕСКИХ И ГАЗОВЫХ ЭЛЕКТРОДОВ
- § VII.4. ПОТЕНЦИАЛЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ (РЕДОКСИ-) ЭЛЕКТРОДОВ
- § VII.5. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ. ПОЛЯРИЗАЦИЯ
- § VII.6. ЭЛЕКТРОЛИЗ
- Глава VIII. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- § VIII.1. ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ
- § VIII.2. ХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.4. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
- 4. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- Глава IX. ПРОСТЫЕ ВЕЩЕСТВА И ДВОЙНЫЕ СОЕДИНЕНИЯ. КРАТКИЙ ОБЗОР ХИМИЧЕСКИХ СВОЙСТВ s- И р-ЭЛЕМЕНТОВ
- § IX.2. МЕТАЛЛЫ И СПЛАВЫ. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА
- § IX.3. ДВОЙНЫЕ СОЕДИНЕНИЯ
- § IX.4. СВОЙСТВА МЕТАЛЛОВ ГЛАВНЫХ ПОДГРУПП I И II ГРУПП
- § IX.5. СВОЙСТВА р-ЭЛЕМЕНТОВ III ГРУППЫ
- § IX.6. СВОЙСТВА р-ЭЛЕМЕНТОВ IV ГРУППЫ
- § IX.7. СВОЙСТВА р-ЭЛЕМЕНТОВ V, VI И VII ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ
- Глава Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
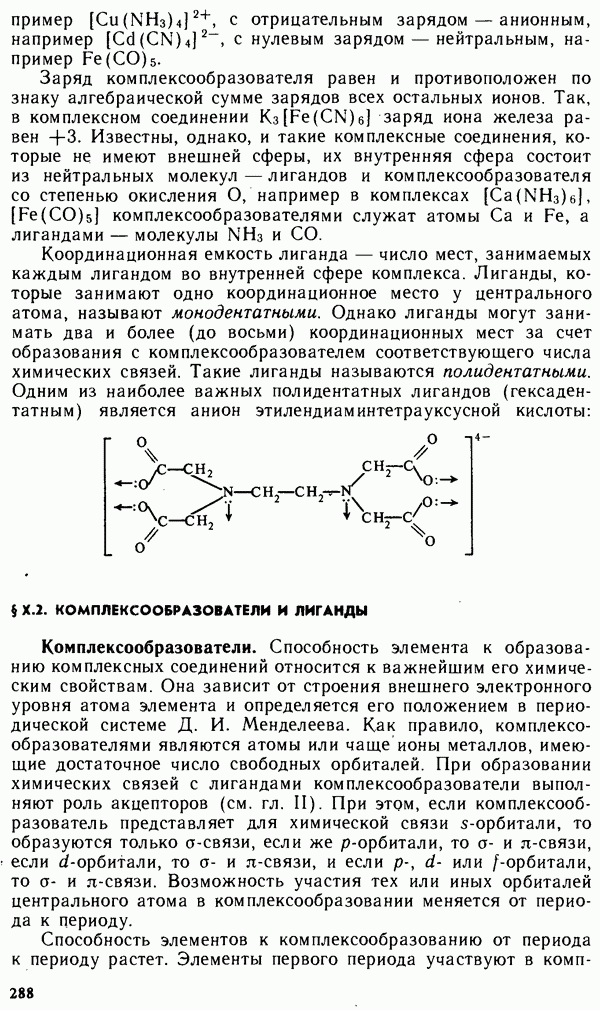
- § Х.1. СТРУКТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИИ
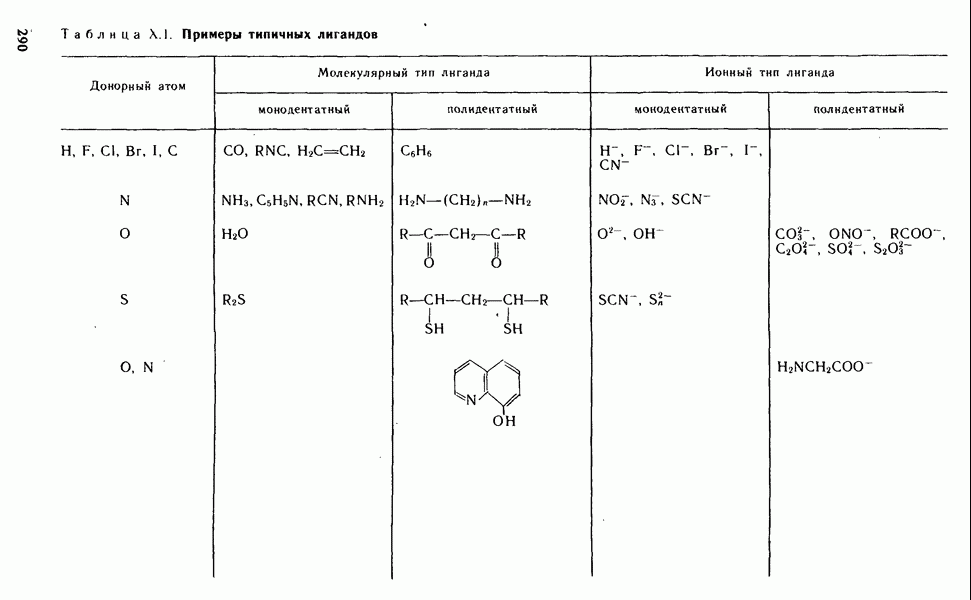
- § Х.2. КОМПЛЕКСООБРАЗОВАТЕЛИ И ЛИГАНДЫ
- § Х.3. НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- § Х.4. МЕТОДЫ РАСЧЕТА ХИМИЧЕСКИХ СВЯЗЕЙ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
- § Х.5. УСТОЙЧИВОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- Глава XI. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- § XI.1. ОСОБЕННОСТИ. ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ И КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- § XI.2. УГЛЕВОДОРОДЫ
- § ХI.3. ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
- 5. СПЕЦИАЛЬНЫЕ ВОПРОСЫ ХИМИИ
- Глава XII. ХИМИЯ КОНСТРУКЦИОННЫХ И ЭЛЕКТРОТЕХНИЧЕСКИХ МАТЕРИАЛОВ
- § XII.2. СВОЙСТВА ПЕРЕХОДНЫХ МЕТАЛЛОВ VIII ГРУППЫ
- § ХII.3. СВОЙСТВА ЭЛЕМЕНТОВ I И II ГРУПП
- § XII.4. ХИМИЯ ПОЛУПРОВОДНИКОВЫХ МАТЕРИАЛОВ
- § XII.5. МЕТОДЫ ПОЛУЧЕНИЯ МАТЕРИАЛОВ ВЫСОКОЙ ЧИСТОТЫ
- Глава XIII. ПОЛИМЕРНЫЕ МАТЕРИАЛЫ И ИХ ПРИМЕНЕНИЕ В ЭНЕРГЕТИКЕ
- § XIII.1. МЕТОДЫ ПОЛУЧЕНИЯ ПОЛИМЕРОВ
- § XIII.2. СТРОЕНИЕ ПОЛИМЕРОВ
- § XIII.3. СВОЙСТВА ПОЛИМЕРОВ
- § XIII.4. ПРИМЕНЕНИЕ ПОЛИМЕРОВ
- Глава XIV. ХИМИЯ ВОДЫ И ТОПЛИВА. ХИМИЯ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ
- § XIV.1. СТРОЕНИЕ И СВОЙСТВА ВОДЫ
- § XIV.2. ПРИРОДНЫЕ ВОДЫ
- § ХIV.3. ОСНОВНЫЕ МЕТОДЫ ОЧИСТКИ ВОДЫ
- § XIV.4. СОСТАВ И СВОЙСТВА ОРГАНИЧЕСКОГО ТОПЛИВА
- § XIV.5. ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ОБЩЕСТВА
- § XIV.6. ОХРАНА ВОЗДУШНОГО БАССЕЙНА
- § XIV.7. ОХРАНА ВОДНОГО БАССЕЙНА
- Глава XV. ЯДЕРНАЯ ХИМИЯ И РАДИОХИМИЯ
- § XV.1. АТОМНОЕ ЯДРО. РАДИОАКТИВНОСТЬ
- § XV.2. ЯДЕРНЫЕ РЕАКЦИИ
- § XV.3. ЯДЕРНАЯ ЭНЕРГЕТИКА
- § XV.4. ХИМИЧЕСКИЕ СВОЙСТВА РАДИОАКТИВНЫХ ЭЛЕМЕНТОВ
- Глава XVI. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ В ЭНЕРГЕТИКЕ, ЭЛЕКТРОНИКЕ И АВТОМАТИКЕ
- § ХVI.1. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА. ЭЛЕКТРОХИМИЧЕСКИЕ ЭНЕРГОУСТАНОВКИ
- § XVI.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ (ХЕМОТРОНЫ)
- § ХVI.3. ЭЛЕКТРОХИМИЧЕСКАЯ АНОДНАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ
- § XVI.4. ПОЛУЧЕНИЕ И СВОЙСТВА ГАЛЬВАНОПОКРЫТИИ
- ЗАКЛЮЧЕНИЕ