| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
Глава XIV. ХИМИЯ ВОДЫ И ТОПЛИВА. ХИМИЯ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ
§ XIV.1. СТРОЕНИЕ И СВОЙСТВА ВОДЫ
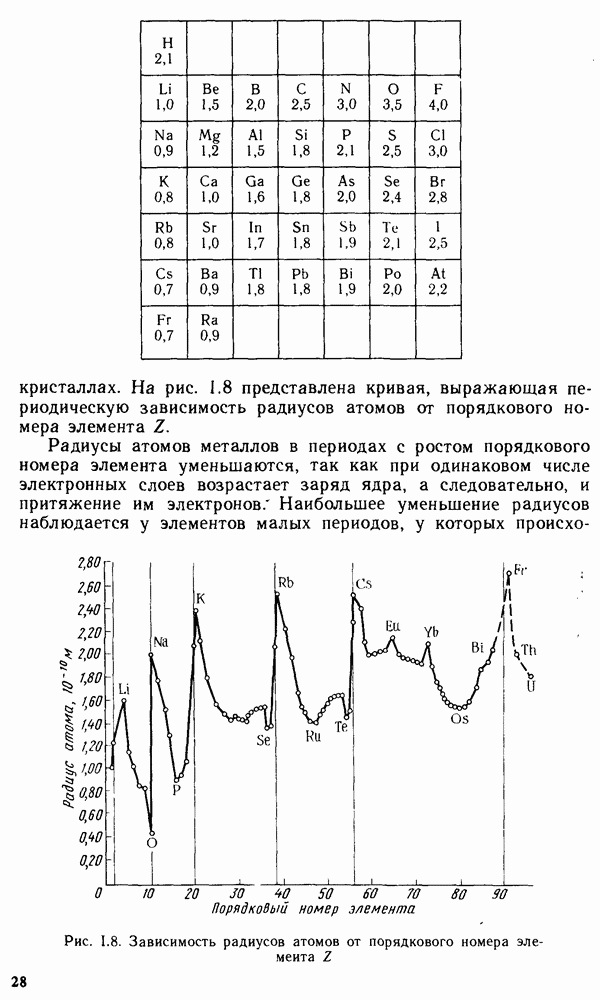
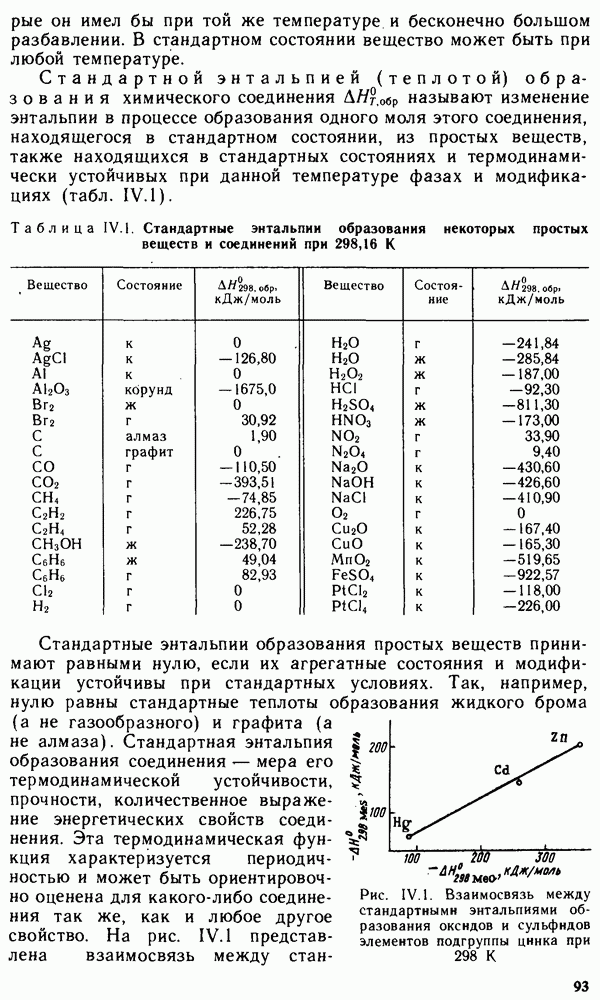
Вода относится к числу наиболее распространенных в природе веществ. Она играет исключительно важную роль в природе, в жизнедеятельности растений, животных и человека, а также в технологических процессах в различных отраслях народного хозяйства. На тепловых и атомных электростанциях, например, вода является основным рабочим веществом — теплоносителем, а на гидроэлектростанциях — носителем механической энергии. Исключительная роль воды в природе и технике обусловлена ее свойствами. Вода — термодинамически устойчивое соединение. Стандартная энергия Гиббса образования жидкой воды при температуре 298 К равна -237,57 кДж/моль, водяного пара -228,94 кДж/моль. Соответственно константа диссоциации водяного пара на водород и кислород очень мала:

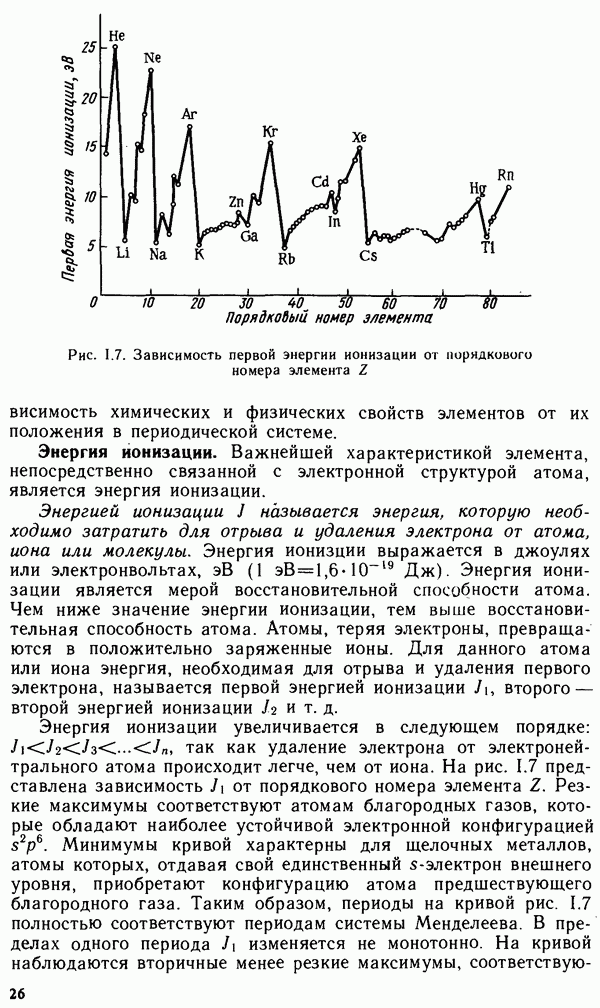
Константа диссоциации приближается к единице лишь при температуре выше 4000 К. Агрегатное состояние воды определяется температурой и давлением (рис. XIV.1). Кривая  соответствует равновесию в системе лед — пар, кривая
соответствует равновесию в системе лед — пар, кривая  — равновесию в системе переохлажденная вода — пар, кривая
— равновесию в системе переохлажденная вода — пар, кривая  — равновесию в системе вода — пар, кривая
— равновесию в системе вода — пар, кривая  — равновесию в системе лед — вода. Температура кристаллизации воды с повышением давления понижается (кривая ОВ). В точке О все кривые пересекаются. Эта точка называется тройной точкой и отвечает равновесию в системе лед — вода — пар. Согласно правилу фаз (см. уравнение V.8), для этой точки степень свободы С равна нулю:
— равновесию в системе лед — вода. Температура кристаллизации воды с повышением давления понижается (кривая ОВ). В точке О все кривые пересекаются. Эта точка называется тройной точкой и отвечает равновесию в системе лед — вода — пар. Согласно правилу фаз (см. уравнение V.8), для этой точки степень свободы С равна нулю:  . Условия равновесия в тройной системе строго фиксированы, и равновесие возможно лишь при температуре
. Условия равновесия в тройной системе строго фиксированы, и равновесие возможно лишь при температуре  и давлении водяного пара 610 Па.
и давлении водяного пара 610 Па.
Свойства воды существенно отличаются от свойств водородных соединений элементов VI группы  Вода
Вода

Рис. XIV. 1. Диаграмма состояния воды
при обычных условиях находится В жидком состоянии, в то время как указанные соединения — газы. Температуры кристаллизации и испарения воды значительно выше температур кристаллизации и испарения водородных соединений элементов VI группы. Максимальную плотность вода имеет при 4 °С, что также необычно. В отличие от других соединений плотность воды при кристаллизации не растет, а уменьшается. Вода имеет очень высокую диэлектрическую проницаемость.
Так, при температуре 298 К диэлектрическая проницаемость ее равна 78,5, в то время как для  она меньше 10. Вода — хороший растворитель полярных жидкостей и соединений с ионными связями.
она меньше 10. Вода — хороший растворитель полярных жидкостей и соединений с ионными связями.
Вода образует кристаллогидраты со многими соединениями, например  (клатраты или соединения включения).
(клатраты или соединения включения).
Вода вступает в химические взаимодействия со многими веществами. При соединении воды с оксидами образуются основания или кислоты. Активные металлы взаимодействуют с водой с выделением водорода. Вода катализирует протекание многих химических реакций. Химические сврйства воды в значительной степени обусловлены ее способностью к электролитической диссоциации на ионы водорода и гидроксида.
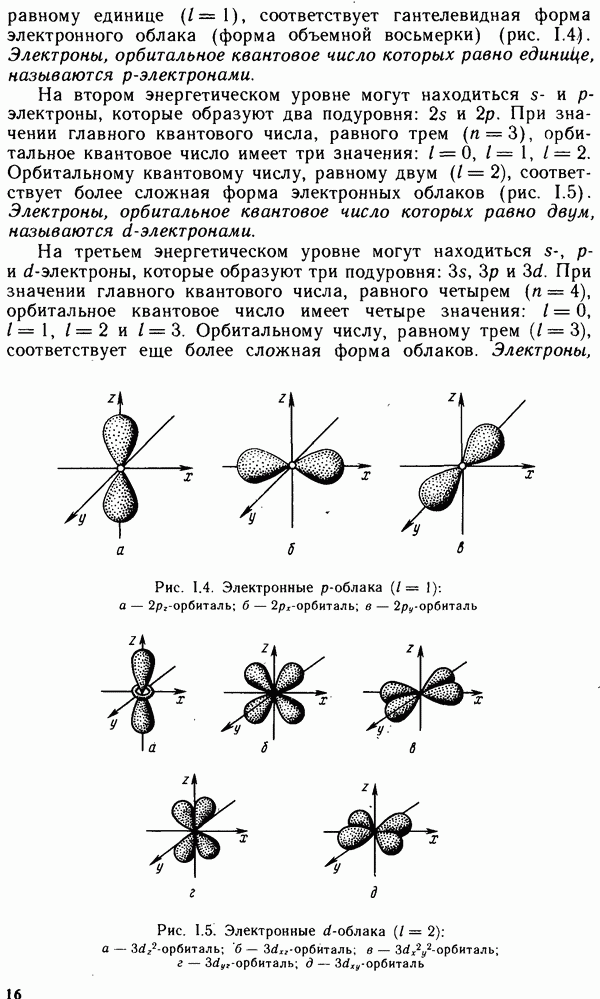
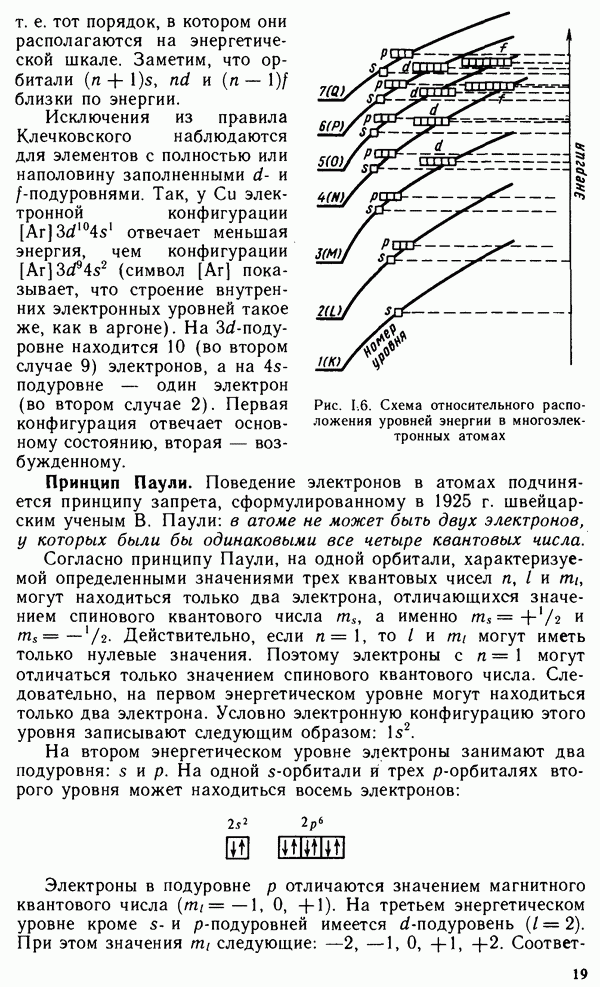
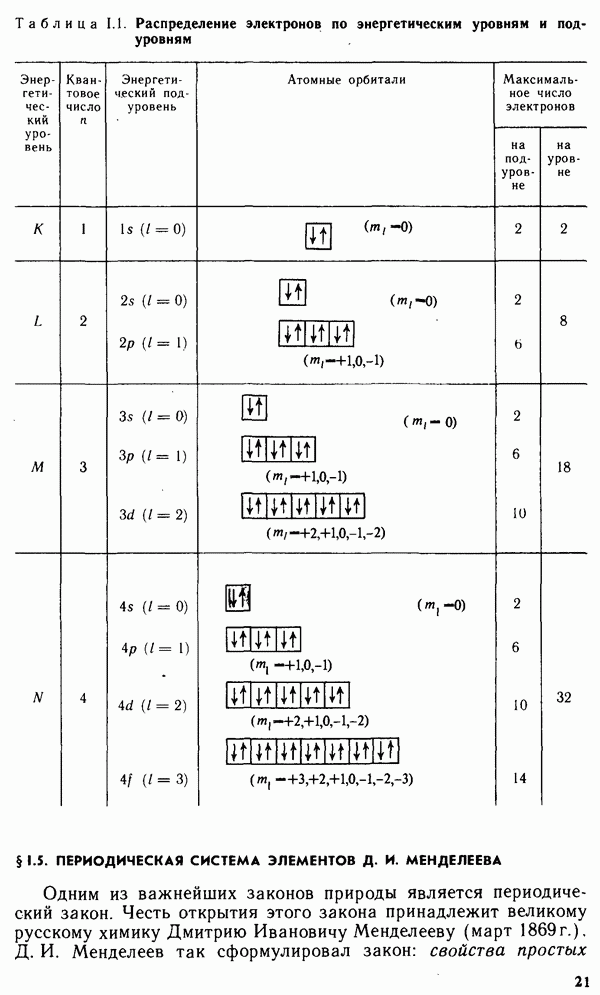
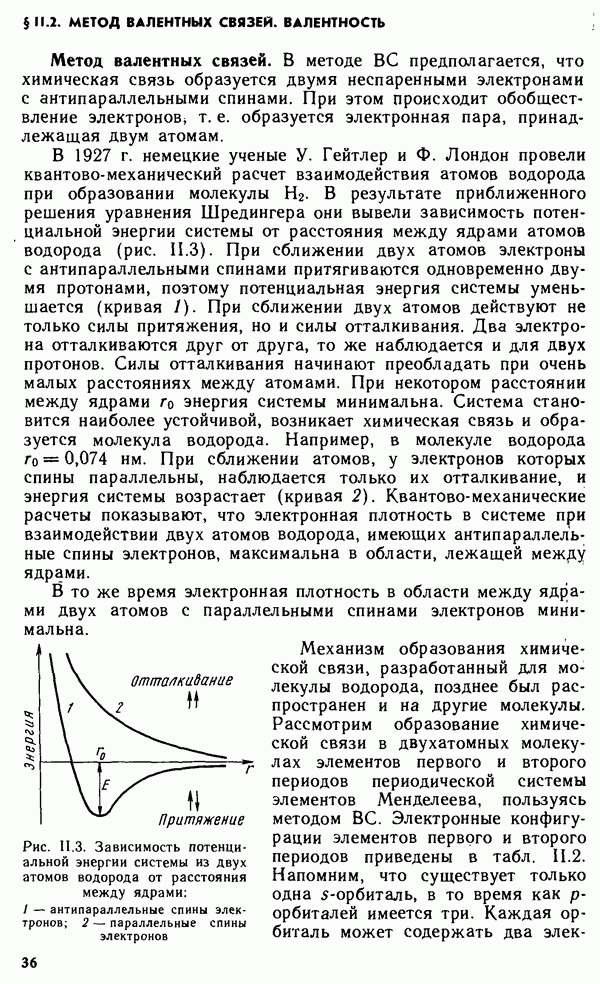
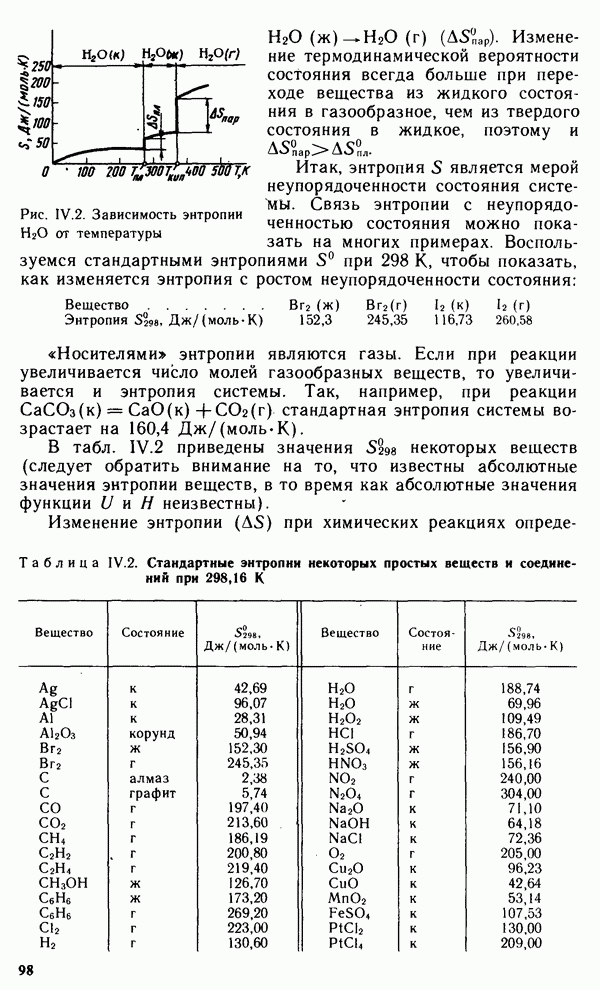
Долгое время необычные свойства воды были загадкой для ученых. Выяснилось, что они в основном обусловлены тремя причинами: полярным характером молекул, наличием неподеленных пар электронов у атомов кислорода и образованием водородных связей. Молекула воды (рис. XIV.2, а) может быть представлена в виде равнобедренного треугольника, в вершине которого расположен атом кислорода, а в основании — два протона (рис. XIV.2, б). Две пары электронов обобществлены между протонами и атомом кислорода, а две пары неподеленных электронов ориентированы по другую сторону кислорода. Длина связи  составляет 96 нм, а угол между связями 105°. Связь
составляет 96 нм, а угол между связями 105°. Связь  имеет полярный характер, молекула воды также полярна. Благодаря полярности вода хорошо растворяет полярные жидкости и соединения с ионными связями. Наличие неподеленных пар электронов у кислорода и смещение обобществленных электронных пар от атомов водорода к атому кислорода обусловливают образование водородных
имеет полярный характер, молекула воды также полярна. Благодаря полярности вода хорошо растворяет полярные жидкости и соединения с ионными связями. Наличие неподеленных пар электронов у кислорода и смещение обобществленных электронных пар от атомов водорода к атому кислорода обусловливают образование водородных

Рис. XIV.2. Схема строения молекулы воды
связей между кислородом и водородом (см. § III.1).
Хотя водородные связи слабее ковалентных и ионных, они значительно прочнее вандерваальсовых связей и обусловливают ассоциацию молекул воды в жидком состоянии и некоторые аномальные свойства воды, в частности высокие температуры плавления и парообразования, высокую диэлектрическую проницаемость, максимальную плотность при 4 °С, а также особую структуру льда. В кристаллах льда молекула воды образует четыре водородные связи с соседними молекулами воды (за счет двух неподеленных электронных пар у кислорода и двух протонов), что обусловливает возникновение тетраэдрической кристаллической структуры льда. Расположение молекул в таком крис-. талле отличается от плотной упаковки молекул, в решетке много свободных мест, поэтому лед имеет относительно невысокую плотность. При высоких давлениях (выше 200 МПа) обеспечивается более плотная укладка молекул воды и возникает еще несколько кристаллических модификаций льда. При плавлении происходит частичное разрушение структуры льда и сближение молекул, поэтому плотность воды возрастает. В то же время повышение температуры усиливает движение молекул, которое снижает плотность вещества. При температуре выше 4 °С последний эффект начинает превалировать и плотность воды понижается.
В жидкой воде молекулы ассоциированы, т. е. объединены в более крупные частицы, причем устанавливается равновесий между молекулами воды, связанными в ассоциаты, и свободными молекулами воды. Наличие ассоциатов повышает температуру кристаллизации и испарения воды и диэлектрическую проницаемость. При увеличении температуры растет доля свободных молекул. При испарении воды ассоциаты разрушаются и водяной пар при невысоких давлениях состоит из свободных молекул  Однако при повышении давления молекулы воды сближаются и образуют водородные связи, происходит ассоциация молекул. По мере повышения давления пар приближается по своему строению к жидкому состоянию. Это вызывает увеличение растворимости в паре соединений с ионными связями.
Однако при повышении давления молекулы воды сближаются и образуют водородные связи, происходит ассоциация молекул. По мере повышения давления пар приближается по своему строению к жидкому состоянию. Это вызывает увеличение растворимости в паре соединений с ионными связями.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- § 1. ПРЕДМЕТ ХИМИИ
- § 2. ЗНАЧЕНИЕ ХИМИИ В ИЗУЧЕНИИ ПРИРОДЫ И РАЗВИТИИ ТЕХНИКИ
- 1. СТРОЕНИЕ ВЕЩЕСТВА
- Глава I. СТРОЕНИЕ АТОМА И СИСТЕМАТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- § 1.2. КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА
- § 1.3. КВАНТОВЫЕ ЧИСЛА И АТОМНЫЕ ОРБИТАЛИ
- § 1.4. МНОГОЭЛЕКТРОННЫЕ АТОМЫ
- § 1.5. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
- § 1.6. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- Глава II. ХИМИЧЕСКАЯ СВЯЗЬ
- § II.1. ОСНОВНЫЕ ВИДЫ И ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ
- § II.2. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ. ВАЛЕНТНОСТЬ
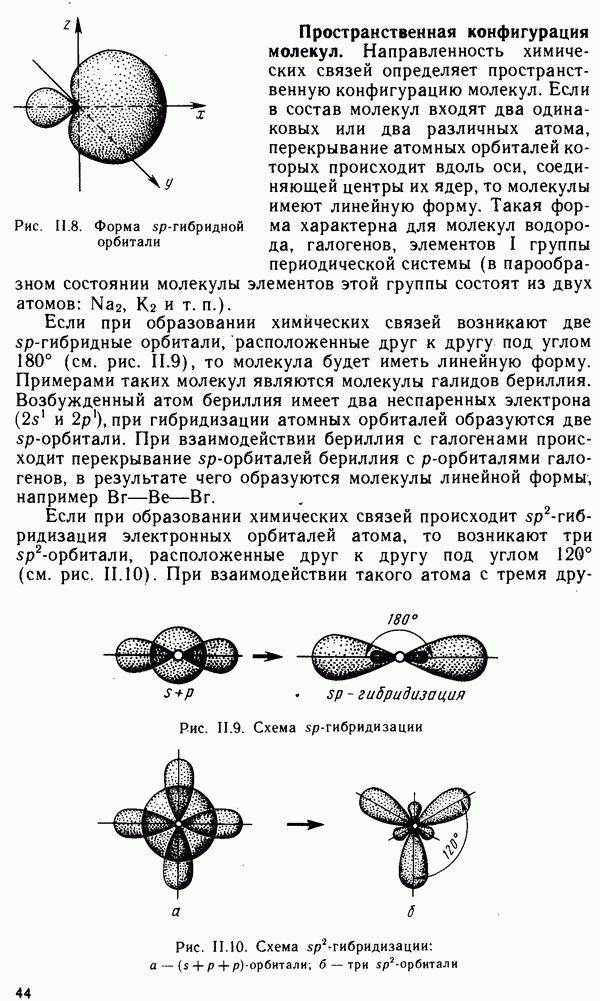
- § II.3. НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. ПРОСТРАНСТВЕННАЯ СТРУКТУРА МОЛЕКУЛ
- § 11.4. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
- § 11.5. ЭЛЕКТРОННАЯ СТРУКТУРА НЕКОТОРЫХ МОЛЕКУЛ
- Глава III. ТИПЫ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ. КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- § III.1. ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ
- § III.2. СВОЙСТВА ВЕЩЕСТВ В РАЗЛИЧНЫХ СОСТОЯНИЯХ
- § III.3. СТРОЕНИЕ КРИСТАЛЛОВ. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ТЕЛАХ
- § III.4. МЕТАЛЛЫ, ПОЛУПРОВОДНИКИ И ДИЭЛЕКТРИКИ
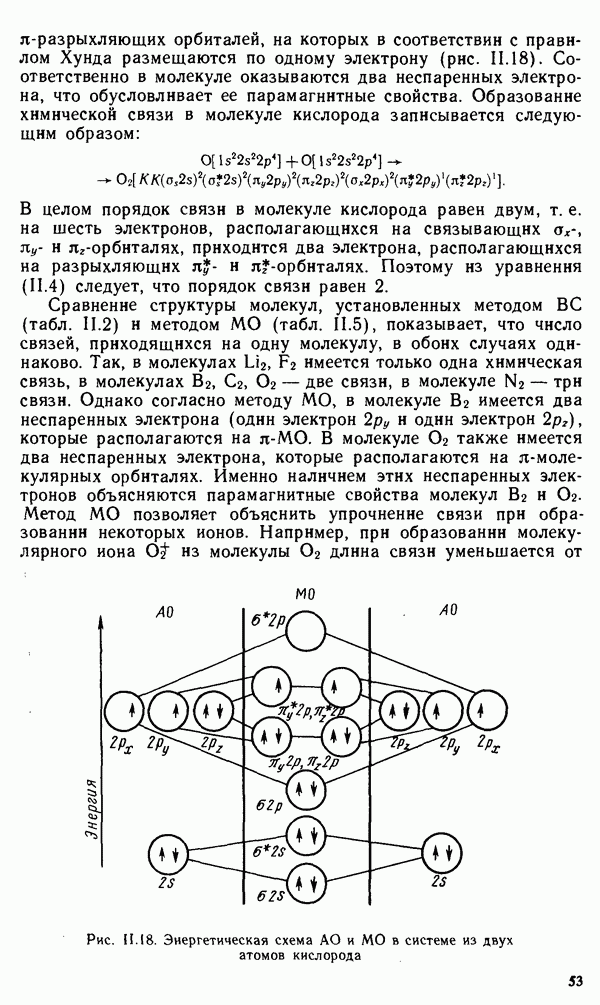
- § III.5. РЕАЛЬНЫЕ КРИСТАЛЛЫ
- 2. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
- Глава IV. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ СРОДСТВО
- § IV.2. ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ И ФАЗОВЫХ ПРЕВРАЩЕНИЙ. ТЕРМОХИМИЧЕСКИЕ ЗАКОНЫ
- § IV.3. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
- § IV.4. ЭНТРОПИЯ. НАПРАВЛЕНИЕ И ПРЕДЕЛ ПРОТЕКАНИЯ ПРОЦЕССОВ В ИЗОЛИРОВАННЫХ СИСТЕМАХ
- § IV.5. ЭНЕРГИЯ ГИББСА И ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА ХИМИЧЕСКОЙ РЕАКЦИИ
- Глава V. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- § V.2. СКОРОСТЬ ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ
- § V.3. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- § V.4. ФИЗИЧЕСКИЕ ВОЗДЕЙСТВИЯ НА ХИМИЧЕСКИЕ РЕАКЦИИ. ЦЕПНЫЕ РЕАКЦИИ
- § V.5. КИНЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ О ХИМИЧЕСКОМ РАВНОВЕСИИ
- § V.6. ФАЗОВЫЕ РАВНОВЕСИЯ ПРАВИЛО ФАЗ
- § V.7. АДСОРБЦИОННОЕ РАВНОВЕСИЕ
- § V.8. КАТАЛИЗ
- 3. РАСТВОРЫ ДИСПЕРСНЫЕ СИСТЕМЫ ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- VI.1. ОБЩИЕ ПОНЯТИЯ О РАСТВОРАХ
- § VI.2. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЖИДКИХ РАСТВОРОВ
- § VI.3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ
- § VI.4. ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- § VI.5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
- § VI.6. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- § VI.7. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ
- § VI.8. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ
- Глава VII. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.1. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- § VII.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.3. ПОТЕНЦИАЛЫ МЕТАЛЛИЧЕСКИХ И ГАЗОВЫХ ЭЛЕКТРОДОВ
- § VII.4. ПОТЕНЦИАЛЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ (РЕДОКСИ-) ЭЛЕКТРОДОВ
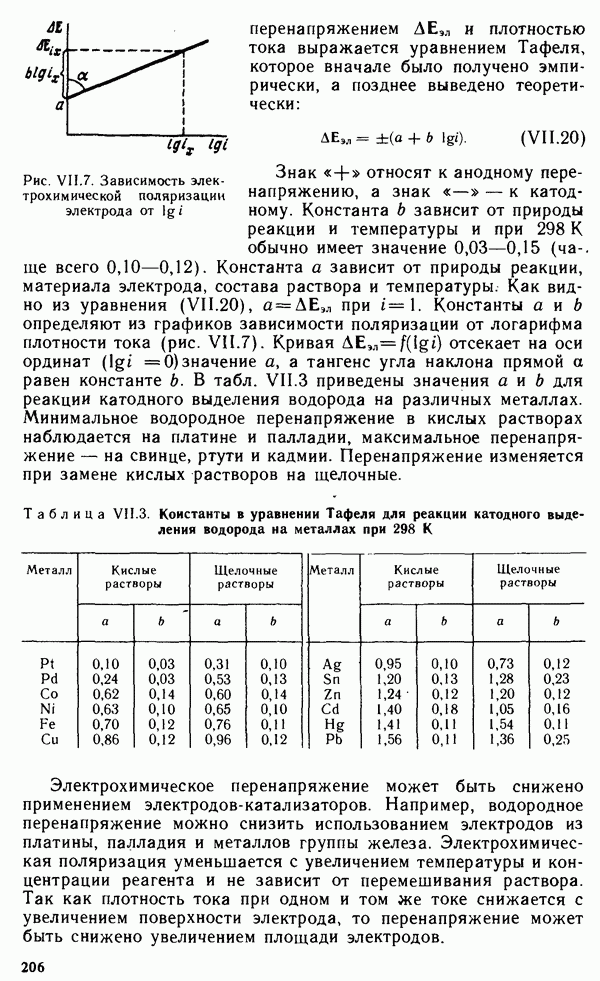
- § VII.5. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ. ПОЛЯРИЗАЦИЯ
- § VII.6. ЭЛЕКТРОЛИЗ
- Глава VIII. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- § VIII.1. ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ
- § VIII.2. ХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.4. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
- 4. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- Глава IX. ПРОСТЫЕ ВЕЩЕСТВА И ДВОЙНЫЕ СОЕДИНЕНИЯ. КРАТКИЙ ОБЗОР ХИМИЧЕСКИХ СВОЙСТВ s- И р-ЭЛЕМЕНТОВ
- § IX.2. МЕТАЛЛЫ И СПЛАВЫ. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА
- § IX.3. ДВОЙНЫЕ СОЕДИНЕНИЯ
- § IX.4. СВОЙСТВА МЕТАЛЛОВ ГЛАВНЫХ ПОДГРУПП I И II ГРУПП
- § IX.5. СВОЙСТВА р-ЭЛЕМЕНТОВ III ГРУППЫ
- § IX.6. СВОЙСТВА р-ЭЛЕМЕНТОВ IV ГРУППЫ
- § IX.7. СВОЙСТВА р-ЭЛЕМЕНТОВ V, VI И VII ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ
- Глава Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
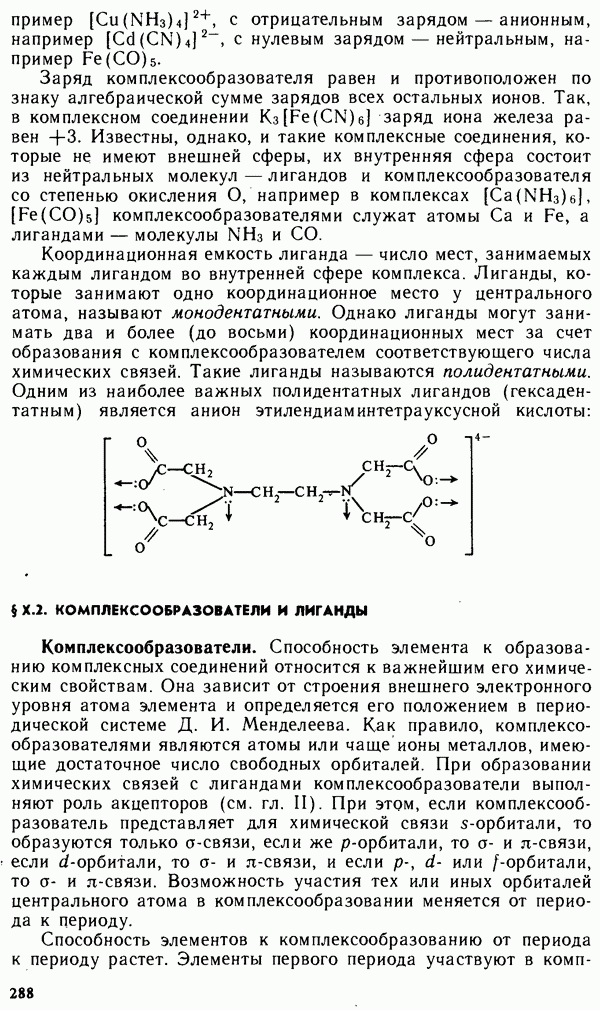
- § Х.1. СТРУКТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИИ
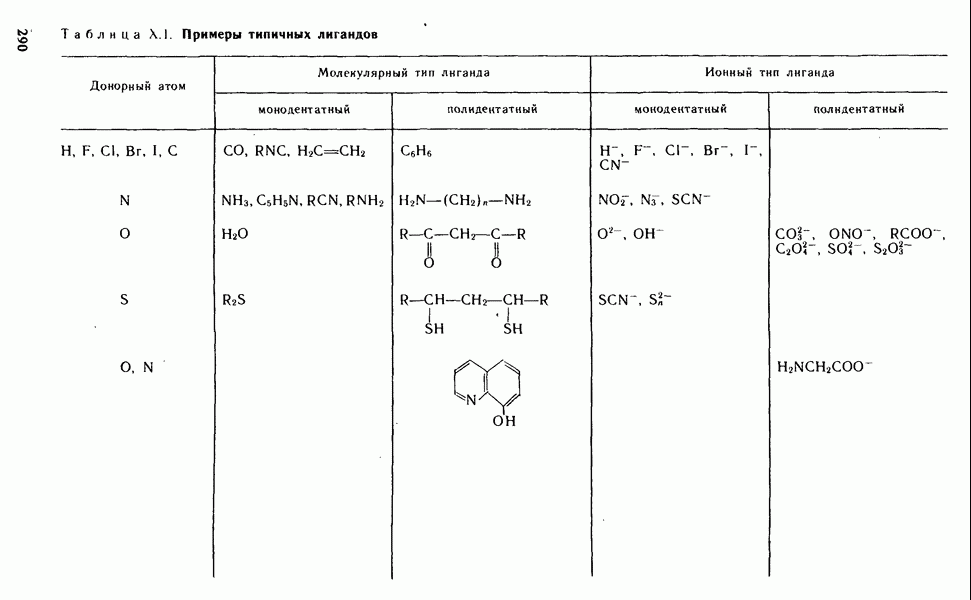
- § Х.2. КОМПЛЕКСООБРАЗОВАТЕЛИ И ЛИГАНДЫ
- § Х.3. НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- § Х.4. МЕТОДЫ РАСЧЕТА ХИМИЧЕСКИХ СВЯЗЕЙ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
- § Х.5. УСТОЙЧИВОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- Глава XI. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- § XI.1. ОСОБЕННОСТИ. ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ И КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- § XI.2. УГЛЕВОДОРОДЫ
- § ХI.3. ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
- 5. СПЕЦИАЛЬНЫЕ ВОПРОСЫ ХИМИИ
- Глава XII. ХИМИЯ КОНСТРУКЦИОННЫХ И ЭЛЕКТРОТЕХНИЧЕСКИХ МАТЕРИАЛОВ
- § XII.2. СВОЙСТВА ПЕРЕХОДНЫХ МЕТАЛЛОВ VIII ГРУППЫ
- § ХII.3. СВОЙСТВА ЭЛЕМЕНТОВ I И II ГРУПП
- § XII.4. ХИМИЯ ПОЛУПРОВОДНИКОВЫХ МАТЕРИАЛОВ
- § XII.5. МЕТОДЫ ПОЛУЧЕНИЯ МАТЕРИАЛОВ ВЫСОКОЙ ЧИСТОТЫ
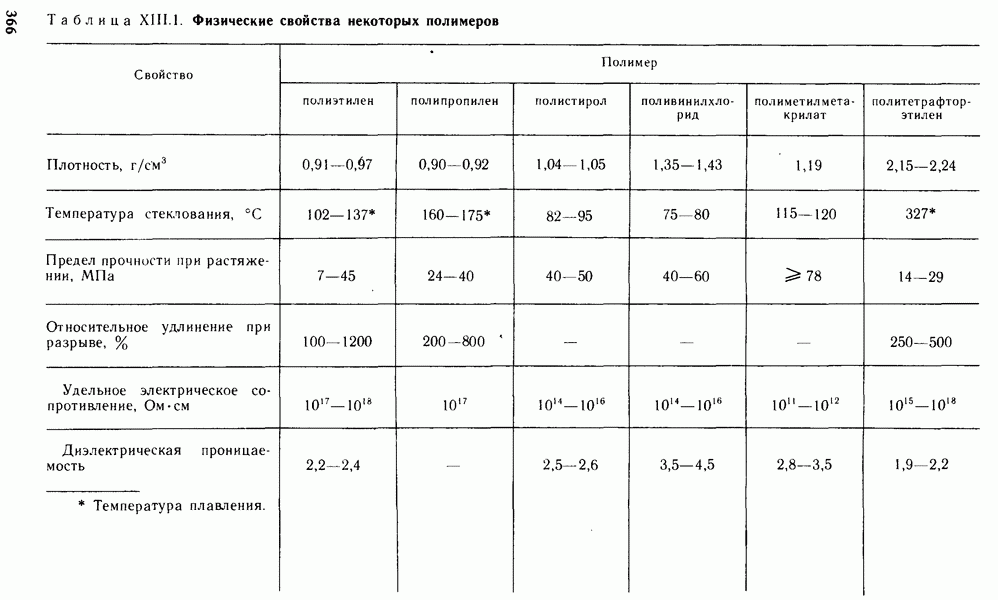
- Глава XIII. ПОЛИМЕРНЫЕ МАТЕРИАЛЫ И ИХ ПРИМЕНЕНИЕ В ЭНЕРГЕТИКЕ
- § XIII.1. МЕТОДЫ ПОЛУЧЕНИЯ ПОЛИМЕРОВ
- § XIII.2. СТРОЕНИЕ ПОЛИМЕРОВ
- § XIII.3. СВОЙСТВА ПОЛИМЕРОВ
- § XIII.4. ПРИМЕНЕНИЕ ПОЛИМЕРОВ
- Глава XIV. ХИМИЯ ВОДЫ И ТОПЛИВА. ХИМИЯ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ
- § XIV.1. СТРОЕНИЕ И СВОЙСТВА ВОДЫ
- § XIV.2. ПРИРОДНЫЕ ВОДЫ
- § ХIV.3. ОСНОВНЫЕ МЕТОДЫ ОЧИСТКИ ВОДЫ
- § XIV.4. СОСТАВ И СВОЙСТВА ОРГАНИЧЕСКОГО ТОПЛИВА
- § XIV.5. ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ОБЩЕСТВА
- § XIV.6. ОХРАНА ВОЗДУШНОГО БАССЕЙНА
- § XIV.7. ОХРАНА ВОДНОГО БАССЕЙНА
- Глава XV. ЯДЕРНАЯ ХИМИЯ И РАДИОХИМИЯ
- § XV.1. АТОМНОЕ ЯДРО. РАДИОАКТИВНОСТЬ
- § XV.2. ЯДЕРНЫЕ РЕАКЦИИ
- § XV.3. ЯДЕРНАЯ ЭНЕРГЕТИКА
- § XV.4. ХИМИЧЕСКИЕ СВОЙСТВА РАДИОАКТИВНЫХ ЭЛЕМЕНТОВ
- Глава XVI. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ В ЭНЕРГЕТИКЕ, ЭЛЕКТРОНИКЕ И АВТОМАТИКЕ
- § ХVI.1. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА. ЭЛЕКТРОХИМИЧЕСКИЕ ЭНЕРГОУСТАНОВКИ
- § XVI.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ (ХЕМОТРОНЫ)
- § ХVI.3. ЭЛЕКТРОХИМИЧЕСКАЯ АНОДНАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ
- § XVI.4. ПОЛУЧЕНИЕ И СВОЙСТВА ГАЛЬВАНОПОКРЫТИИ
- ЗАКЛЮЧЕНИЕ