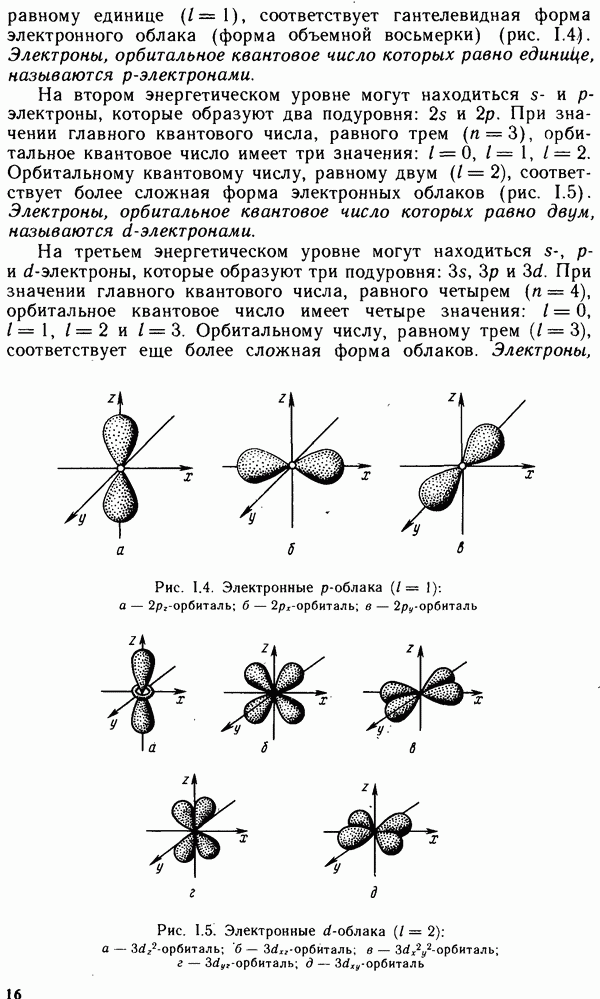
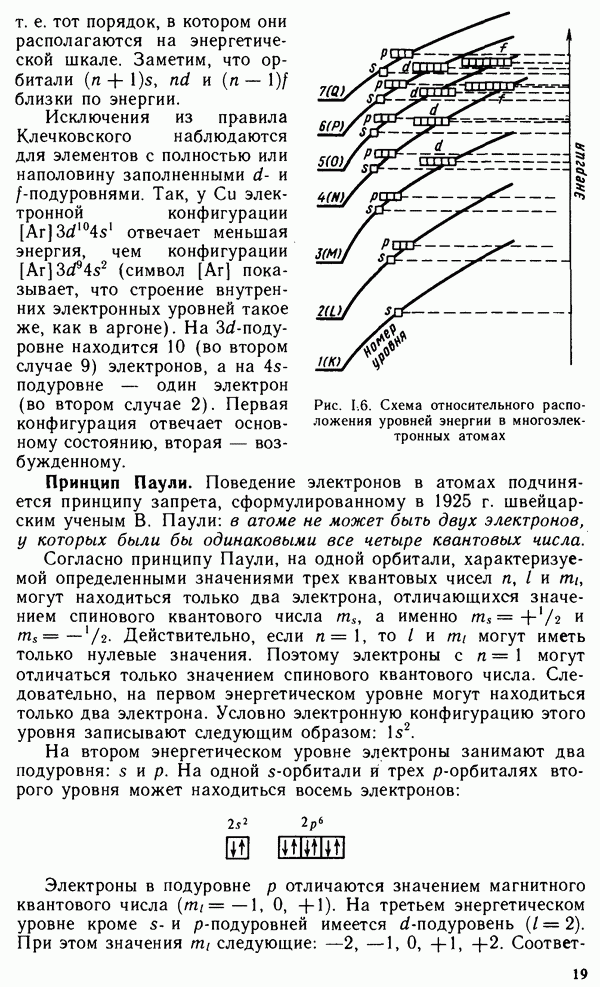
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 1.6. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Химические свойства элементов проявляются при взаимодействии их атомов. Периодическая система элементов отражает закономерное изменение этих свойств.
Типы конфигураций внешних энергетических уровней атомов определяют основные особенности химического поведения элементов. Эти особенности являются специфическими для элементов главных подгрупп (s- и p-элементы), побочных подгрупп ( -элементы) и
-элементы) и  -элементов (лантаноиды и актиноиды).
-элементов (лантаноиды и актиноиды).
Особое место занимают элементы первого периода (Н и Не). Высокая химическая активность атомарного водорода объясняется способностью легко отдавать единственный  -элекрон, тогда как электронная конфигурация атома гелия
-элекрон, тогда как электронная конфигурация атома гелия  весьма устойчива, что обусловливает его химическую инертность.
весьма устойчива, что обусловливает его химическую инертность.
Поскольку у элементов главных подгрупп происходит заполнение внешних энергетических уровней (с  равным номеру периода), свойства элементов заметно меняются по мере роста порядкового номера
равным номеру периода), свойства элементов заметно меняются по мере роста порядкового номера  Так, во втором периоде
Так, во втором периоде  (конфигурация
(конфигурация  — химически активный металл, легко теряющий электрон,
— химически активный металл, легко теряющий электрон,  — также металл, но менее активный. Металлический характер следующего элемента
— также металл, но менее активный. Металлический характер следующего элемента  выражен слабо, все последующие элементы второго периода, у которых происходит заполнение
выражен слабо, все последующие элементы второго периода, у которых происходит заполнение  -подуровня, являются уже неметаллами.
-подуровня, являются уже неметаллами.
Восьмиэлектронная конфигурация внешнего энергетического уровня  чрезвычайно прочна, поэтому неон — благородный газ.
чрезвычайно прочна, поэтому неон — благородный газ.
Аналогичный характер изменения свойств наблюдается у элементов третьего периода, а также  и
и  -элементов всех последующих периодов. Однако ослабление прочности связи внешних электронов с ядром у элементов главных подгрупп по мере роста
-элементов всех последующих периодов. Однако ослабление прочности связи внешних электронов с ядром у элементов главных подгрупп по мере роста  определенным образом сказывается на их свойствах. Так, у р-элементов одной и той же группы отмечается нарастание металлических свойств. В главной подгруппе VIII группы ослабляется устойчивость конфигурации
определенным образом сказывается на их свойствах. Так, у р-элементов одной и той же группы отмечается нарастание металлических свойств. В главной подгруппе VIII группы ослабляется устойчивость конфигурации  (по мере увеличения
(по мере увеличения  ), вследствие чего уже криптон
), вследствие чего уже криптон  (четвертый период) приобретает способность образовывать химические соединения.
(четвертый период) приобретает способность образовывать химические соединения.
Специфика  -элементов четвертого — шестого периодов связана также с тем, что они отделены от
-элементов четвертого — шестого периодов связана также с тем, что они отделены от  -элементов совокупностями элементов, в атомах которых происходит заполнение предшествующих энергетических уровней.
-элементов совокупностями элементов, в атомах которых происходит заполнение предшествующих энергетических уровней.
У d-элементов побочных подгрупп достраиваются незавершенные уровни, главное квантовое число электронов которых  на единицу меньше номера периода. Конфигурация внешних энергетических уровней d-элементов, как правило,
на единицу меньше номера периода. Конфигурация внешних энергетических уровней d-элементов, как правило,  Все d-элементы — металлы.
Все d-элементы — металлы.
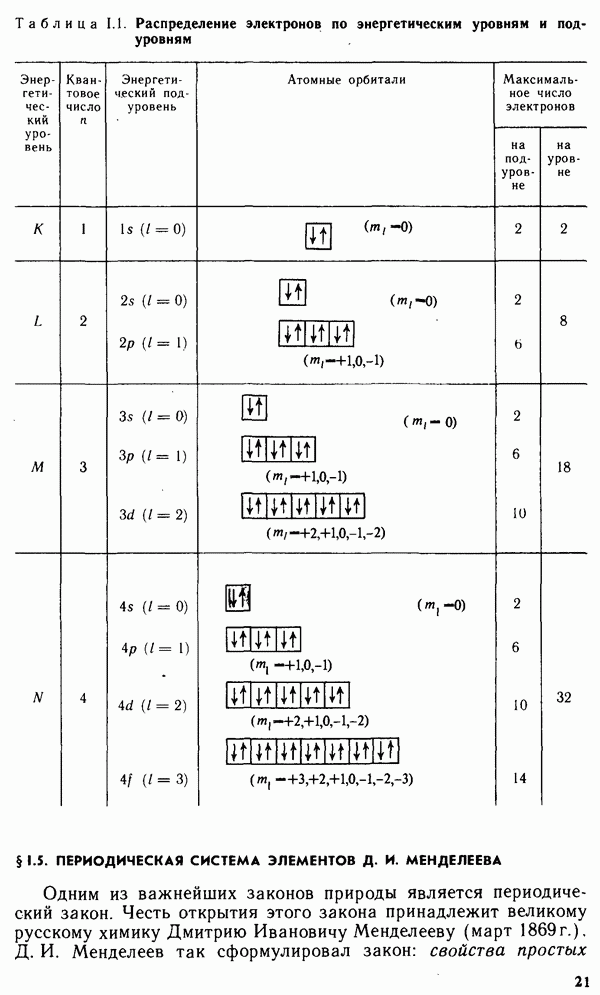
Экспериментальными исследованиями была установлена зависимость

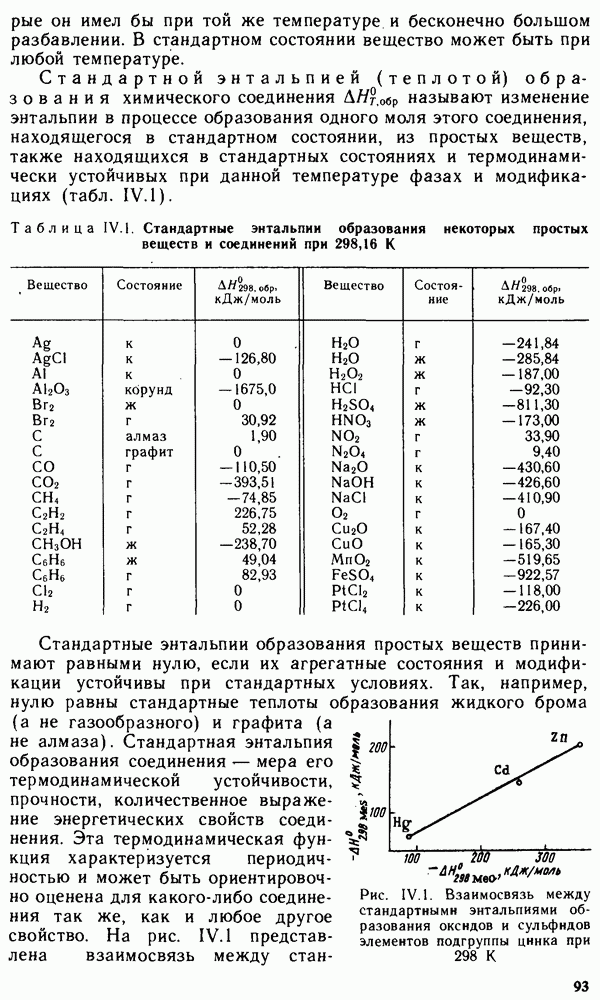
Рис. 1.7. Зависимость первой энергии ионизации от порядкового номера элемента Z
химических и физических свойств элементов от их положения в периодической системе.
Энергия ионизации.
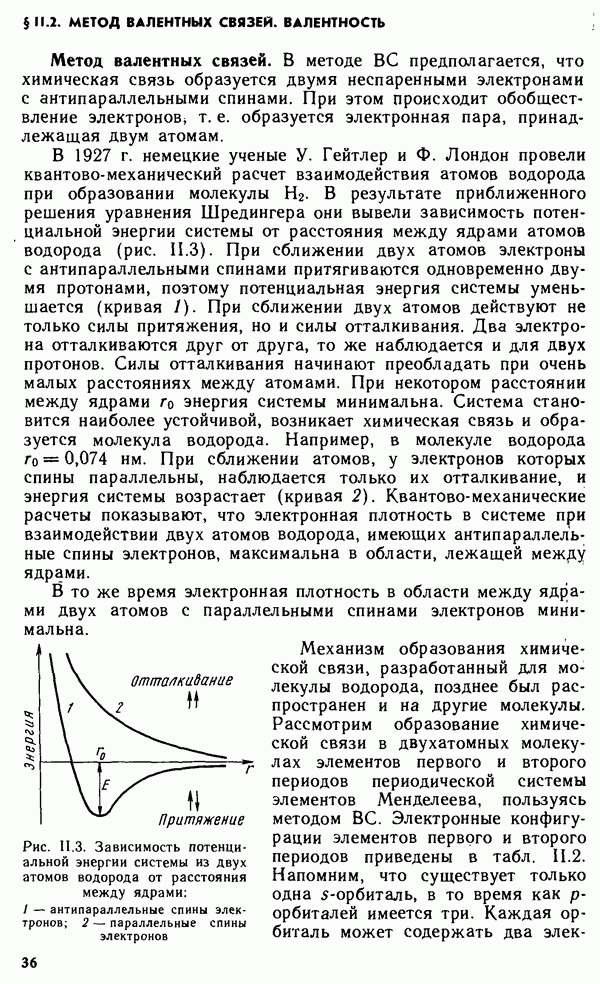
Важнейшей характеристикой элемента, непосредственно связанной с электронной структурой атома, является энергия ионизации.
Энергией ионизации  называется энергия, которую необходимо затратить для отрыва и удаления электрона от атома иона или молекулы. Энергия ионизции выражается в джоулях или электронвольтах, эВ
называется энергия, которую необходимо затратить для отрыва и удаления электрона от атома иона или молекулы. Энергия ионизции выражается в джоулях или электронвольтах, эВ  . Энергия ионизации является мерой восстановительной способности атома. Чем ниже значение энергии ионизации, тем выше восстановительная способность атома. Атомы, теряя электроны, превращаются в положительно заряженные ионы. Для данного атома или иона энергия, необходимая для отрыва и удаления первого электрона, называется первой энергией ионизации
. Энергия ионизации является мерой восстановительной способности атома. Чем ниже значение энергии ионизации, тем выше восстановительная способность атома. Атомы, теряя электроны, превращаются в положительно заряженные ионы. Для данного атома или иона энергия, необходимая для отрыва и удаления первого электрона, называется первой энергией ионизации  второго — второй энергией ионизации
второго — второй энергией ионизации 
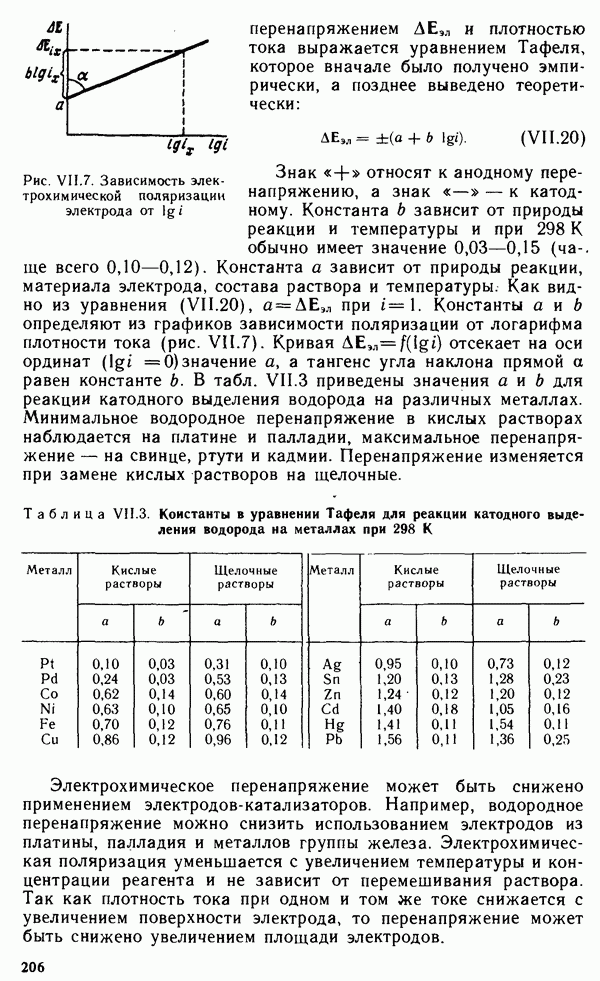
Энергия ионизации увеличивается в следующем порядке:  так как удаление электрона от электронейтрального атома происходит легче, чем от иона. На рис. 1.7 представлена зависимость
так как удаление электрона от электронейтрального атома происходит легче, чем от иона. На рис. 1.7 представлена зависимость  от порядкового номера элемента
от порядкового номера элемента  Резкие максимумы соответствуют атомам благородных газов, которые обладают наиболее устойчивой электронной конфигурацией
Резкие максимумы соответствуют атомам благородных газов, которые обладают наиболее устойчивой электронной конфигурацией  Минимумы кривой характерны для щелочных металлов, атомы которых, отдавая свой единственный
Минимумы кривой характерны для щелочных металлов, атомы которых, отдавая свой единственный  -электрон внешнего уровня, приобретают конфигурацию атома предшествующего благородного газа. Таким образом, периоды на кривой рис. 1.7 полностью соответствуют периодам системы Менделеева. В пределах одного периода
-электрон внешнего уровня, приобретают конфигурацию атома предшествующего благородного газа. Таким образом, периоды на кривой рис. 1.7 полностью соответствуют периодам системы Менделеева. В пределах одного периода  изменяется не монотонно. На кривой наблюдаются вторичные менее резкие максимумы, соответствующие
изменяется не монотонно. На кривой наблюдаются вторичные менее резкие максимумы, соответствующие
заполнению  -подуровня у элементов II группы
-подуровня у элементов II группы  . У следующих за ними элементов III группы
. У следующих за ними элементов III группы  появление первого
появление первого  -электрона снова снижает энергию ионизации. Следующие максимумы на кривой отвечают элементам V группы
-электрона снова снижает энергию ионизации. Следующие максимумы на кривой отвечают элементам V группы  что соответствует энергетически выгодному половинному заполнению
что соответствует энергетически выгодному половинному заполнению  -подуровня. У расположенных за ними элементов VI группы
-подуровня. У расположенных за ними элементов VI группы  энергия ионизации снова снижается.
энергия ионизации снова снижается.
Во II группе периодической системы резкие вторичные максимумы, соответствующие  объясняются влиянием застроенного d-подуровня. В пределах одной группы с увеличением
объясняются влиянием застроенного d-подуровня. В пределах одной группы с увеличением  значения
значения  обычно убывают, что связано с увеличением расстояния внешнего электронного уровня от ядра.
обычно убывают, что связано с увеличением расстояния внешнего электронного уровня от ядра.
Сродство к электрону.
Сродством к электрону называется энергия, которая выделяется при присоединении электрона к атому, молекуле или радикалу. Она выражается в тех же единицах, что и энергия ионизации.
Атомы элементов-окислителей, принимая электроны, превращаются в отрицательно заряженные ионы. Энергия сродства к электрону атомов (как и энергия ионизации) закономерно изменяется в соответствии с характером электронных структур атомов элементов. В периодах слева направо сродство к электрону и окислительные свойства элементов возрастают. В группах сверху вниз сродство к электрону, как правило, уменьшается.
Галогены отличаются самым высоким сродством к электрону, так как при присоединении одного электрона к нейтральному атому они приобретают законченную электронную конфигурацию благородного газа. Щелочные металлы характеризуются низким сродством к электрону. Для решения вопроса о том, какой из атомов легче отдает или присоединяет электрон, учитывают оба показателя: энергию ионизации и сродство к электрону. Согласно Малликену, полусумма энергии ионизации и сродства к электрону называется электроотрицательностью (ЭО)
Учитывая сложность определения величины сродства к электрону, американский ученый Полинг предложил термохимическую систему, согласно которой электроотрицательности атомов А и В определяют исходя из энергий связей  Шкала электроотрицательностей атомов по Полингу приведена на с. 28.
Шкала электроотрицательностей атомов по Полингу приведена на с. 28.
Электроотрицательность возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов одной и той же группы периодической системы Менделеева.
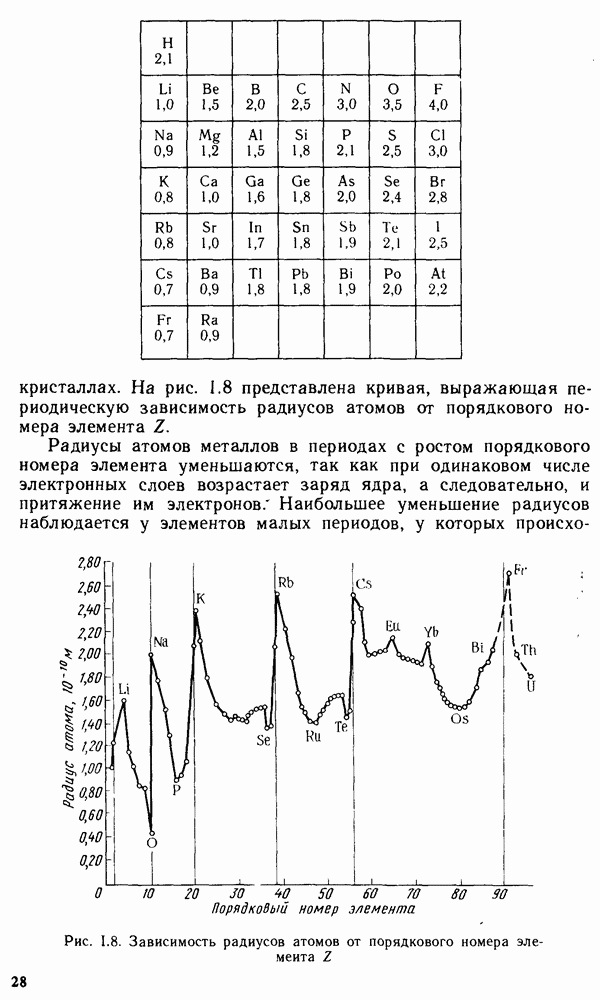
Размеры атомов и ионов (радиусы атомов и ионов).
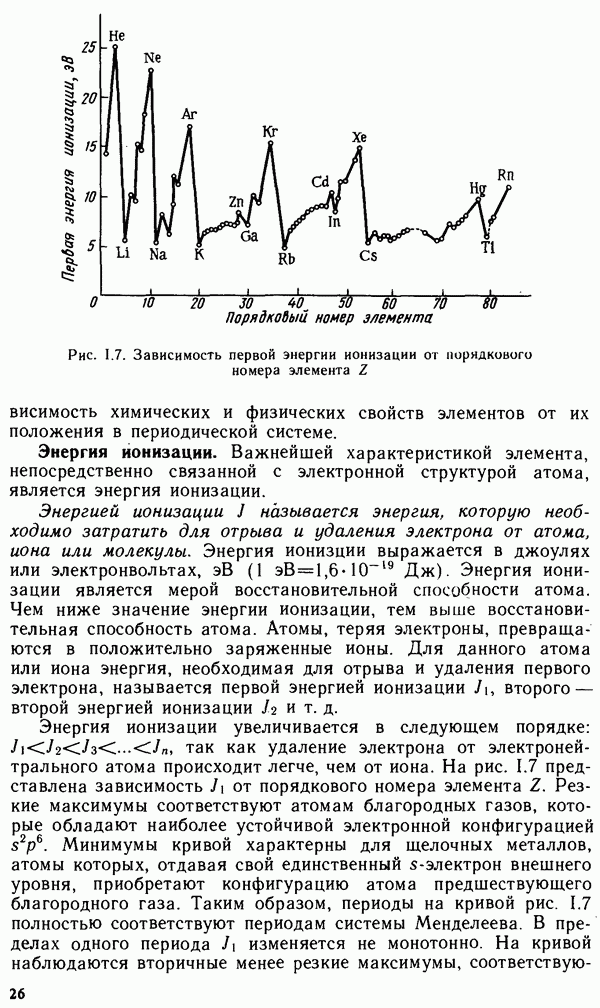
Атомы и ионы не имеют строго определенных границ вследствие волновой природы электронов. Поэтому определяют условные радиусы атомов и ионов, связанных друг с другом химической связью в

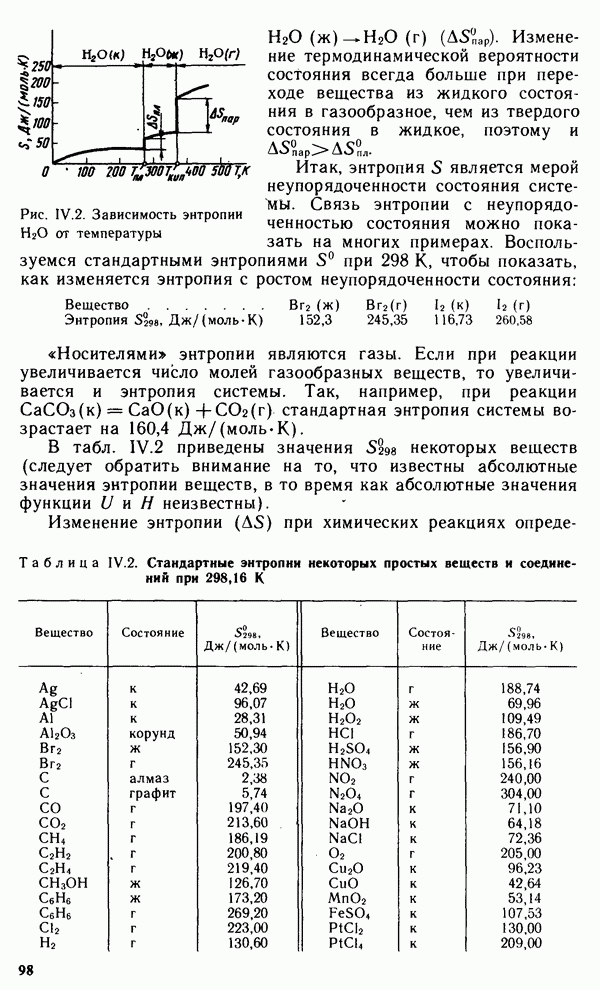
кристаллах. На рис. 1.8 представлена кривая, выражающая периодическую зависимость радиусов атомов от порядкового номера элемента 
Радиусы атомов металлов в периодах с ростом порядкового номера элемента уменьшаются, так как при одинаковом числе электронных слоев возрастает заряд ядра, а следовательно, и притяжение им электронов  Наибольшее уменьшение радиусов наблюдается у элементов малых периодов, у которых происходит
Наибольшее уменьшение радиусов наблюдается у элементов малых периодов, у которых происходит

Рис. 1.8. Зависимость радиусов атомов от порядкового номера элемента 
заполнение электронами внешнего энергетического уровня. В больших периодах  и
и  -элементов наблюдается более плавное уменьшение радиусов при увеличении заряда ядра атома. В пределах каждой подгруппы элементов, как правило, радиусы атомов увеличиваются сверху вниз, так как возрастает число энергетических уровней.
-элементов наблюдается более плавное уменьшение радиусов при увеличении заряда ядра атома. В пределах каждой подгруппы элементов, как правило, радиусы атомов увеличиваются сверху вниз, так как возрастает число энергетических уровней.
Радиусы ионов отличаются от радиусов атомов, так как они или лишились нескольких электронов, или присоединили последние. Поэтому радиусы положительно заряженных ионов меньше, а радиусы отрицательно заряженных ионов больше радиусов соответствующих атомов. Радиусы ионов также находятся в периодической зависимости от порядкового номера элемента. Например, в пределах одной группы радиусы ионов одинакового заряда возрастают с увеличением номера элемента (заряда ядра).
Значение периодического закона.
Открытие Д. И. Менделеевым периодического закона имеет огромное значение для развития химии. Периодический закон обобщил большое число природных закономерностей, он явился научной основой химии. Прежде всего удалось систематизировать богатейший, но разрозненный материал, накопленный к тому времени поколениями химиков, по свойствам элементов и их соединений, уточнить многие понятия, например понятия «химический элемент» и «простое вещество». К моменту открытия периодического закона были известны 63 элемента. Менделеев предсказал существование многих не известных к тому времени элементов; скандия (экабор), галлия (экаалюминий) и германия (экасицилий).
В отличие от своих предшественников, пытавшихся дать ту или иную систематику элементов, Менделеев был убежден, что им открыт закон природы и, основываясь на нем, он подошел к оценке имевшихся экспериментальных данных, далеко не все из которых казались достоверными. В ряде случаев, основываясь на периодическом законе, им были изменены принятые в то время атомные массы элементов  которые ранее были определены на основе ошибочных представлений о валентности элементов и составе соединений. Например, высшему оксиду урана приписывался состав
которые ранее были определены на основе ошибочных представлений о валентности элементов и составе соединений. Например, высшему оксиду урана приписывался состав  вместо
вместо 
В некоторых случаях Д. И. Менделеев расположил элементы в соответствии с закономерным изменением свойств, предполагая возможную неточность значений их атомных масс  ). Этим была поставлена задача уточнения атомных масс указанных элементов, и для некоторых из них атомные массы были исправлены. Первоначально казалось, что открытие благородных газов нарушит периодичность изменения свойств элементов, однако затем были открыты остальные благородные газы, которые хорошо вписались в периодическую систему.
). Этим была поставлена задача уточнения атомных масс указанных элементов, и для некоторых из них атомные массы были исправлены. Первоначально казалось, что открытие благородных газов нарушит периодичность изменения свойств элементов, однако затем были открыты остальные благородные газы, которые хорошо вписались в периодическую систему.
Предсказания ученого блестяще оправдались. С тех пор периодический закон и периодическая система элементов
Д. И. Менделеева служат научной базой прогнозирования в химии. С момента опубликования периодической системы элементов в ней появилось более 40 новых элементов. На основе периодического закона были получены искусственным путем трансурановые элементы, в том числе № 101, названный менделевием. Периодический закон позволил предсказать свойства не открытых еще элементов, например 117, 118, 119 и 120.
Периодический закон сыграл решающую роль в выяснении сложной структуры атома. С помощью периодической системы элементов удается определять физико-химические константы химических соединений на основе сопоставления известных величин. Периодический закон — фундамент химии, в первую очередь неорганической; он помогает решению задач синтеза веществ с заданными свойствами; разработке новых материалов, в частности полупроводниковых; подбору специфических катализаторов для различных химических процессов и т. д.
КОНТРОЛЬНЫЕ ВОПРОСЫ
(см. скан)
(см. скан)
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- § 1. ПРЕДМЕТ ХИМИИ
- § 2. ЗНАЧЕНИЕ ХИМИИ В ИЗУЧЕНИИ ПРИРОДЫ И РАЗВИТИИ ТЕХНИКИ
- 1. СТРОЕНИЕ ВЕЩЕСТВА
- Глава I. СТРОЕНИЕ АТОМА И СИСТЕМАТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- § 1.2. КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА
- § 1.3. КВАНТОВЫЕ ЧИСЛА И АТОМНЫЕ ОРБИТАЛИ
- § 1.4. МНОГОЭЛЕКТРОННЫЕ АТОМЫ
- § 1.5. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
- § 1.6. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- Глава II. ХИМИЧЕСКАЯ СВЯЗЬ
- § II.1. ОСНОВНЫЕ ВИДЫ И ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ
- § II.2. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ. ВАЛЕНТНОСТЬ
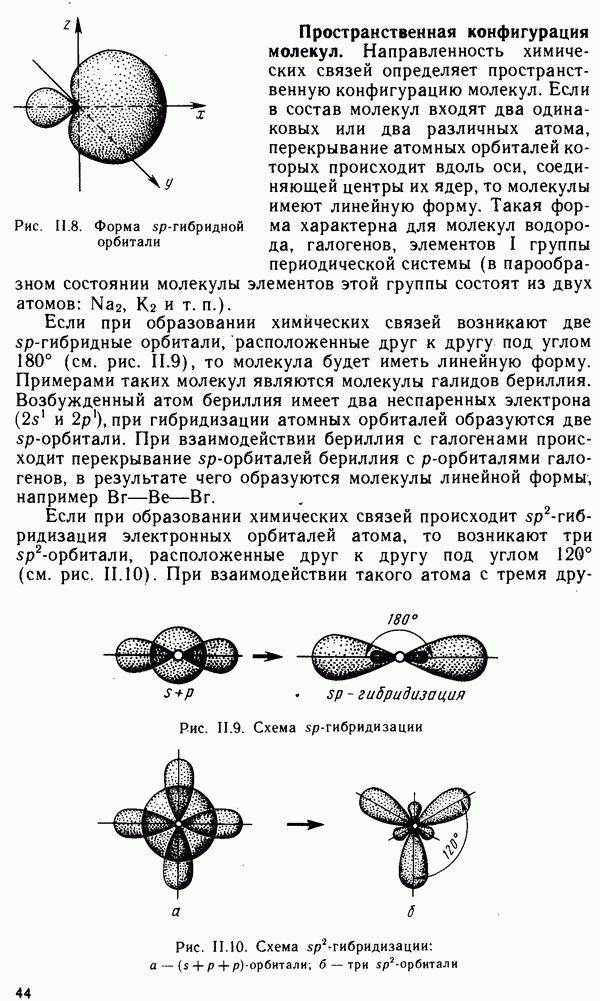
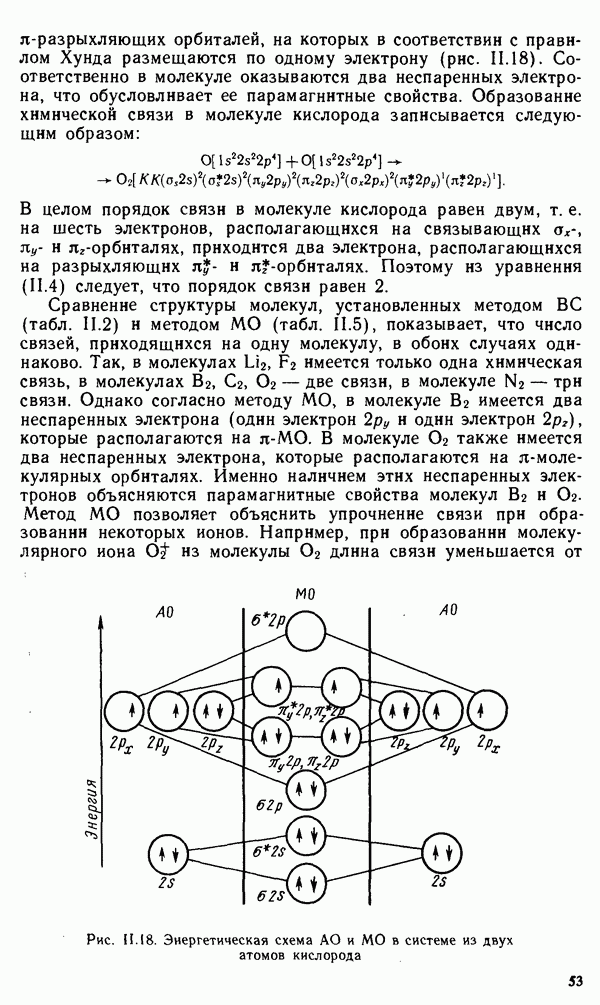
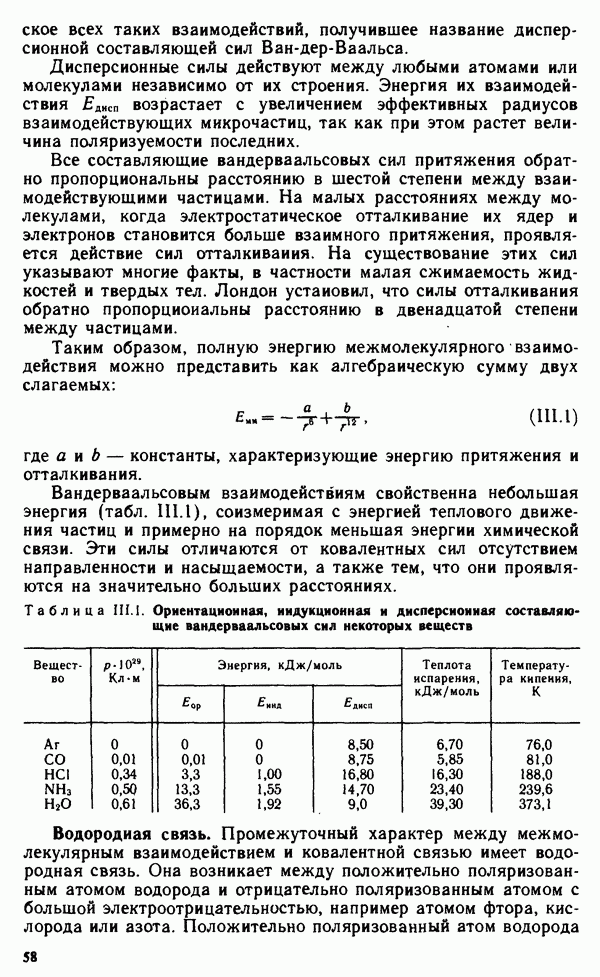
- § II.3. НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. ПРОСТРАНСТВЕННАЯ СТРУКТУРА МОЛЕКУЛ
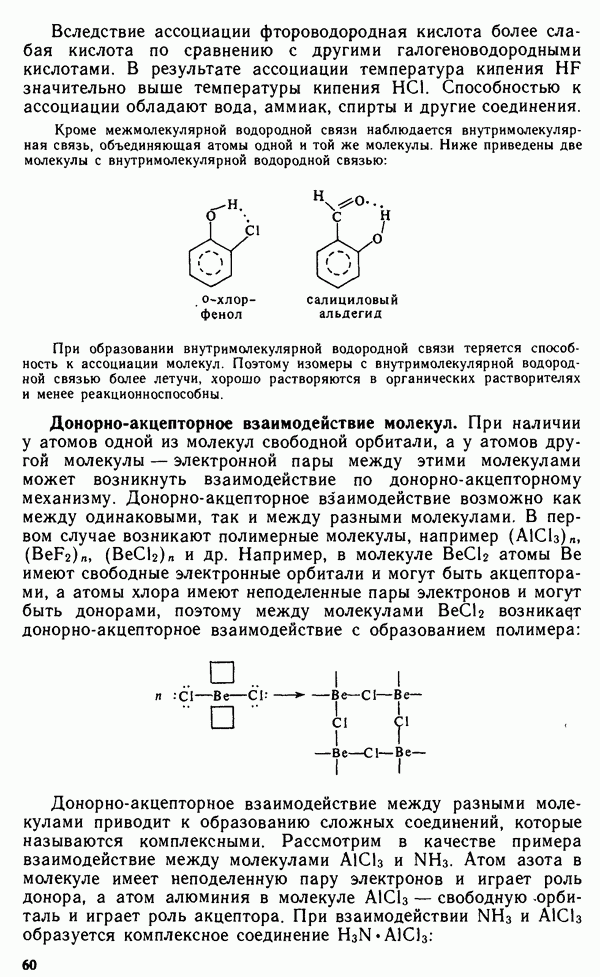
- § 11.4. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
- § 11.5. ЭЛЕКТРОННАЯ СТРУКТУРА НЕКОТОРЫХ МОЛЕКУЛ
- Глава III. ТИПЫ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ. КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- § III.1. ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ
- § III.2. СВОЙСТВА ВЕЩЕСТВ В РАЗЛИЧНЫХ СОСТОЯНИЯХ
- § III.3. СТРОЕНИЕ КРИСТАЛЛОВ. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ТЕЛАХ
- § III.4. МЕТАЛЛЫ, ПОЛУПРОВОДНИКИ И ДИЭЛЕКТРИКИ
- § III.5. РЕАЛЬНЫЕ КРИСТАЛЛЫ
- 2. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
- Глава IV. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ СРОДСТВО
- § IV.2. ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ И ФАЗОВЫХ ПРЕВРАЩЕНИЙ. ТЕРМОХИМИЧЕСКИЕ ЗАКОНЫ
- § IV.3. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
- § IV.4. ЭНТРОПИЯ. НАПРАВЛЕНИЕ И ПРЕДЕЛ ПРОТЕКАНИЯ ПРОЦЕССОВ В ИЗОЛИРОВАННЫХ СИСТЕМАХ
- § IV.5. ЭНЕРГИЯ ГИББСА И ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА ХИМИЧЕСКОЙ РЕАКЦИИ
- Глава V. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- § V.2. СКОРОСТЬ ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ
- § V.3. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- § V.4. ФИЗИЧЕСКИЕ ВОЗДЕЙСТВИЯ НА ХИМИЧЕСКИЕ РЕАКЦИИ. ЦЕПНЫЕ РЕАКЦИИ
- § V.5. КИНЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ О ХИМИЧЕСКОМ РАВНОВЕСИИ
- § V.6. ФАЗОВЫЕ РАВНОВЕСИЯ ПРАВИЛО ФАЗ
- § V.7. АДСОРБЦИОННОЕ РАВНОВЕСИЕ
- § V.8. КАТАЛИЗ
- 3. РАСТВОРЫ ДИСПЕРСНЫЕ СИСТЕМЫ ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- VI.1. ОБЩИЕ ПОНЯТИЯ О РАСТВОРАХ
- § VI.2. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЖИДКИХ РАСТВОРОВ
- § VI.3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ
- § VI.4. ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- § VI.5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
- § VI.6. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- § VI.7. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ
- § VI.8. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ
- Глава VII. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.1. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- § VII.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.3. ПОТЕНЦИАЛЫ МЕТАЛЛИЧЕСКИХ И ГАЗОВЫХ ЭЛЕКТРОДОВ
- § VII.4. ПОТЕНЦИАЛЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ (РЕДОКСИ-) ЭЛЕКТРОДОВ
- § VII.5. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ. ПОЛЯРИЗАЦИЯ
- § VII.6. ЭЛЕКТРОЛИЗ
- Глава VIII. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- § VIII.1. ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ
- § VIII.2. ХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.4. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
- 4. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- Глава IX. ПРОСТЫЕ ВЕЩЕСТВА И ДВОЙНЫЕ СОЕДИНЕНИЯ. КРАТКИЙ ОБЗОР ХИМИЧЕСКИХ СВОЙСТВ s- И р-ЭЛЕМЕНТОВ
- § IX.2. МЕТАЛЛЫ И СПЛАВЫ. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА
- § IX.3. ДВОЙНЫЕ СОЕДИНЕНИЯ
- § IX.4. СВОЙСТВА МЕТАЛЛОВ ГЛАВНЫХ ПОДГРУПП I И II ГРУПП
- § IX.5. СВОЙСТВА р-ЭЛЕМЕНТОВ III ГРУППЫ
- § IX.6. СВОЙСТВА р-ЭЛЕМЕНТОВ IV ГРУППЫ
- § IX.7. СВОЙСТВА р-ЭЛЕМЕНТОВ V, VI И VII ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ
- Глава Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
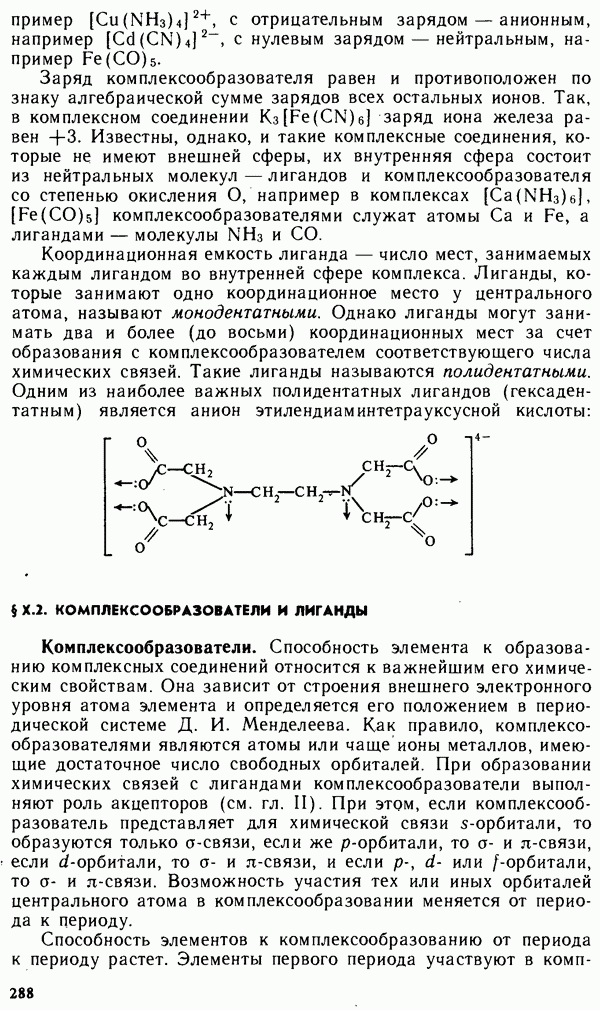
- § Х.1. СТРУКТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИИ
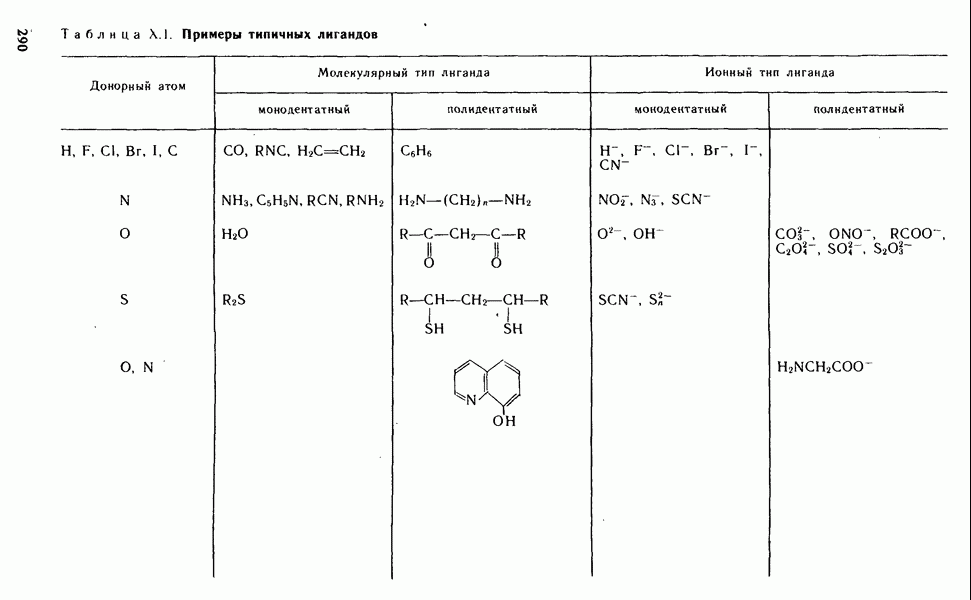
- § Х.2. КОМПЛЕКСООБРАЗОВАТЕЛИ И ЛИГАНДЫ
- § Х.3. НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- § Х.4. МЕТОДЫ РАСЧЕТА ХИМИЧЕСКИХ СВЯЗЕЙ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
- § Х.5. УСТОЙЧИВОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- Глава XI. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- § XI.1. ОСОБЕННОСТИ. ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ И КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- § XI.2. УГЛЕВОДОРОДЫ
- § ХI.3. ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
- 5. СПЕЦИАЛЬНЫЕ ВОПРОСЫ ХИМИИ
- Глава XII. ХИМИЯ КОНСТРУКЦИОННЫХ И ЭЛЕКТРОТЕХНИЧЕСКИХ МАТЕРИАЛОВ
- § XII.2. СВОЙСТВА ПЕРЕХОДНЫХ МЕТАЛЛОВ VIII ГРУППЫ
- § ХII.3. СВОЙСТВА ЭЛЕМЕНТОВ I И II ГРУПП
- § XII.4. ХИМИЯ ПОЛУПРОВОДНИКОВЫХ МАТЕРИАЛОВ
- § XII.5. МЕТОДЫ ПОЛУЧЕНИЯ МАТЕРИАЛОВ ВЫСОКОЙ ЧИСТОТЫ
- Глава XIII. ПОЛИМЕРНЫЕ МАТЕРИАЛЫ И ИХ ПРИМЕНЕНИЕ В ЭНЕРГЕТИКЕ
- § XIII.1. МЕТОДЫ ПОЛУЧЕНИЯ ПОЛИМЕРОВ
- § XIII.2. СТРОЕНИЕ ПОЛИМЕРОВ
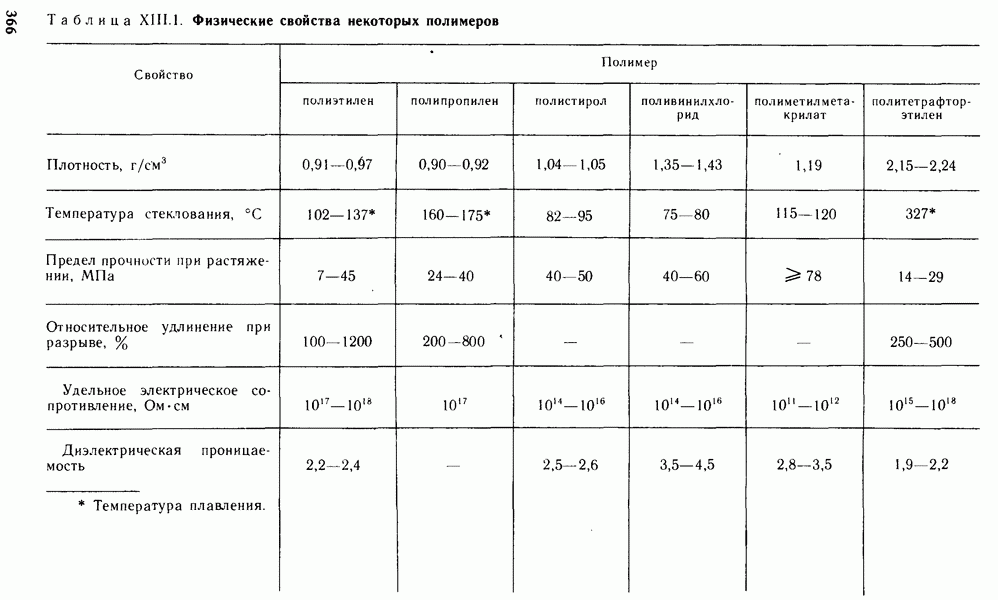
- § XIII.3. СВОЙСТВА ПОЛИМЕРОВ
- § XIII.4. ПРИМЕНЕНИЕ ПОЛИМЕРОВ
- Глава XIV. ХИМИЯ ВОДЫ И ТОПЛИВА. ХИМИЯ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ
- § XIV.1. СТРОЕНИЕ И СВОЙСТВА ВОДЫ
- § XIV.2. ПРИРОДНЫЕ ВОДЫ
- § ХIV.3. ОСНОВНЫЕ МЕТОДЫ ОЧИСТКИ ВОДЫ
- § XIV.4. СОСТАВ И СВОЙСТВА ОРГАНИЧЕСКОГО ТОПЛИВА
- § XIV.5. ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ОБЩЕСТВА
- § XIV.6. ОХРАНА ВОЗДУШНОГО БАССЕЙНА
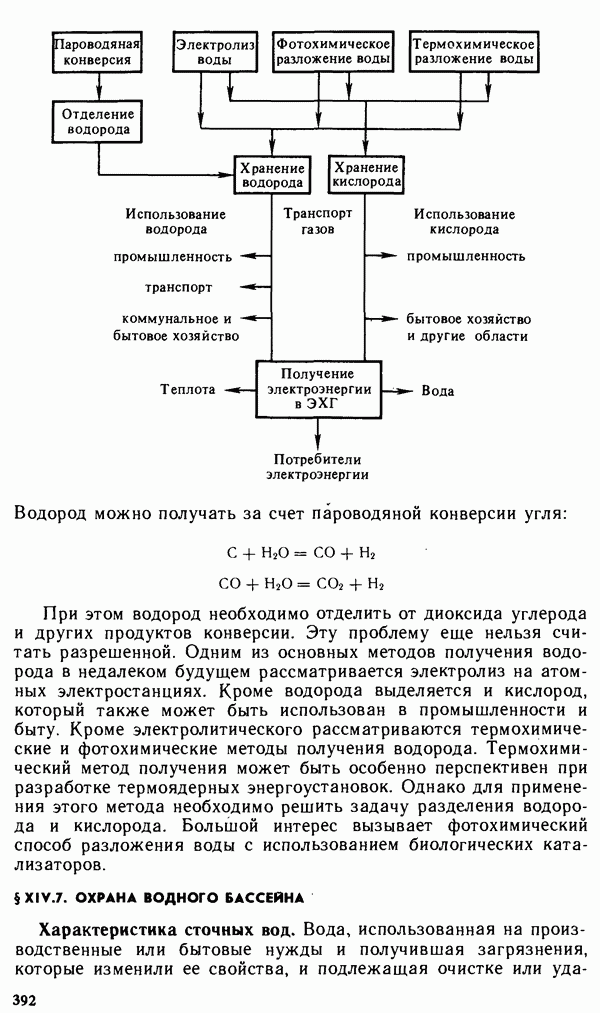
- § XIV.7. ОХРАНА ВОДНОГО БАССЕЙНА
- Глава XV. ЯДЕРНАЯ ХИМИЯ И РАДИОХИМИЯ
- § XV.1. АТОМНОЕ ЯДРО. РАДИОАКТИВНОСТЬ
- § XV.2. ЯДЕРНЫЕ РЕАКЦИИ
- § XV.3. ЯДЕРНАЯ ЭНЕРГЕТИКА
- § XV.4. ХИМИЧЕСКИЕ СВОЙСТВА РАДИОАКТИВНЫХ ЭЛЕМЕНТОВ
- Глава XVI. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ В ЭНЕРГЕТИКЕ, ЭЛЕКТРОНИКЕ И АВТОМАТИКЕ
- § ХVI.1. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА. ЭЛЕКТРОХИМИЧЕСКИЕ ЭНЕРГОУСТАНОВКИ
- § XVI.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ (ХЕМОТРОНЫ)
- § ХVI.3. ЭЛЕКТРОХИМИЧЕСКАЯ АНОДНАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ
- § XVI.4. ПОЛУЧЕНИЕ И СВОЙСТВА ГАЛЬВАНОПОКРЫТИИ
- ЗАКЛЮЧЕНИЕ