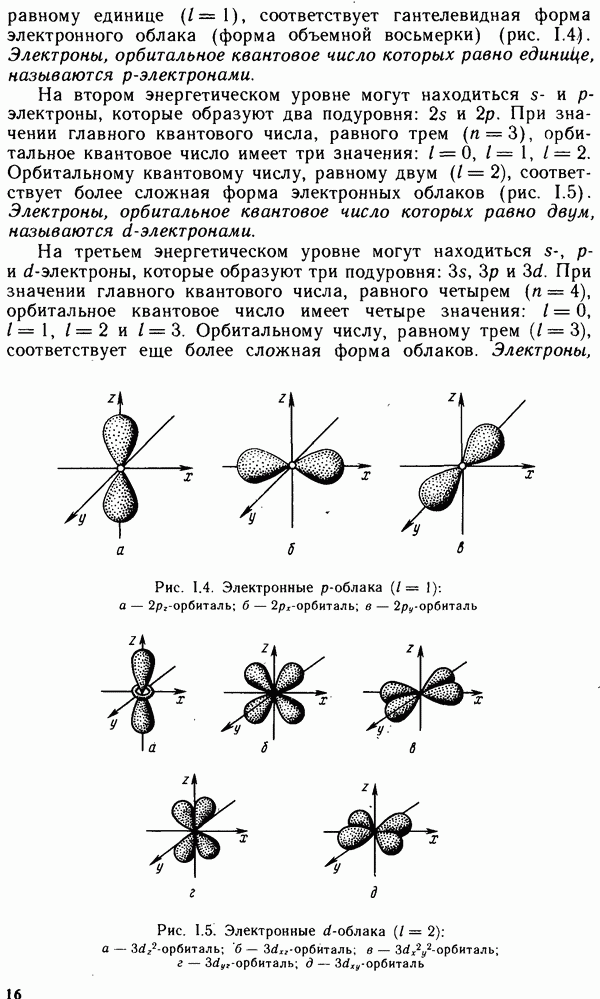
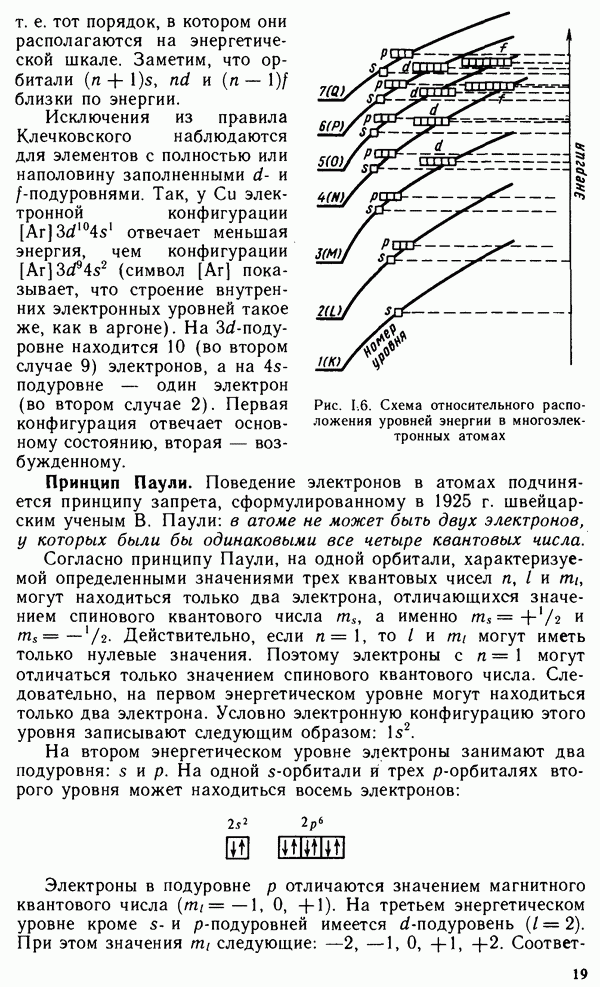
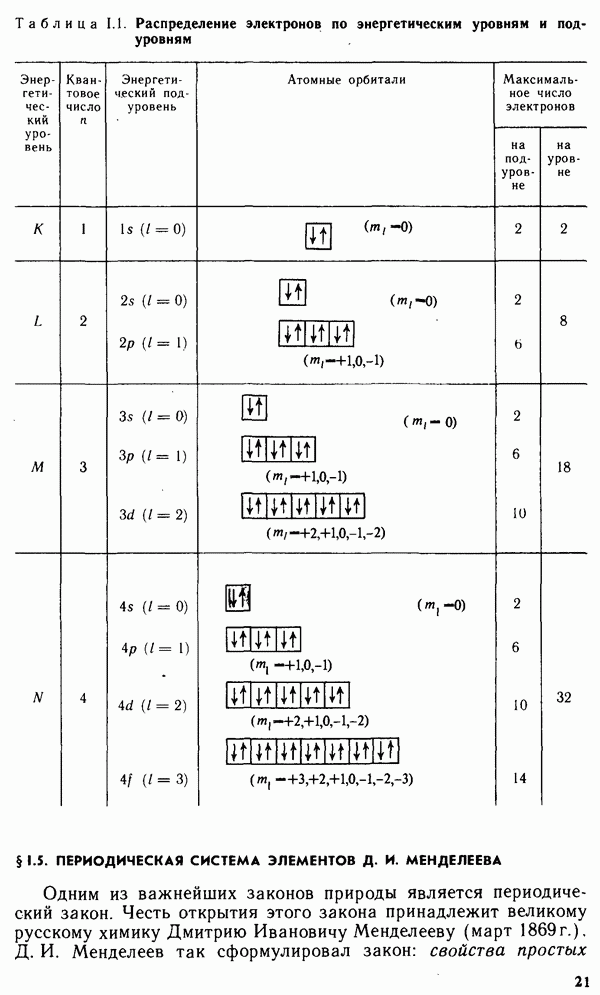
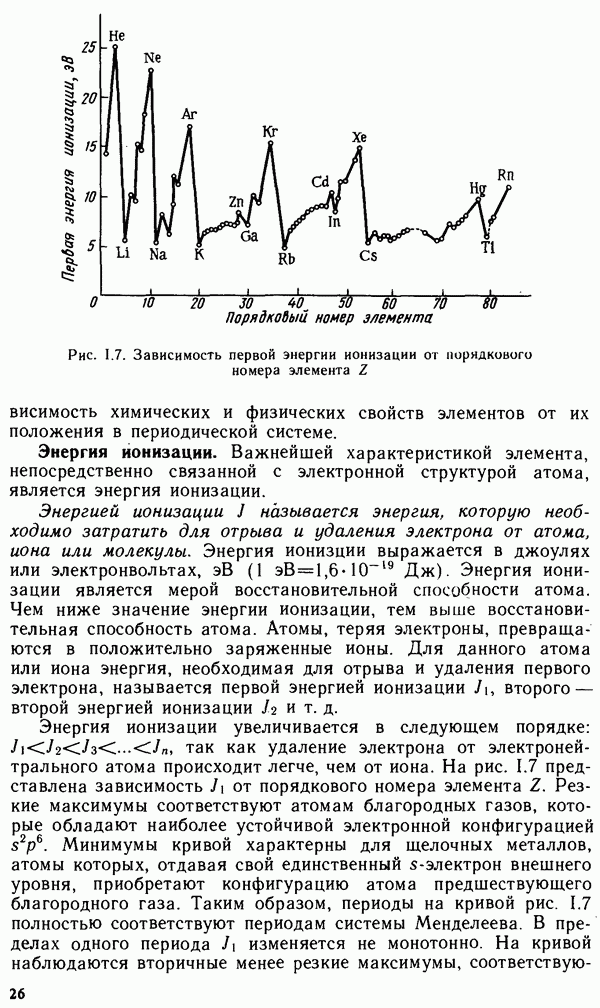
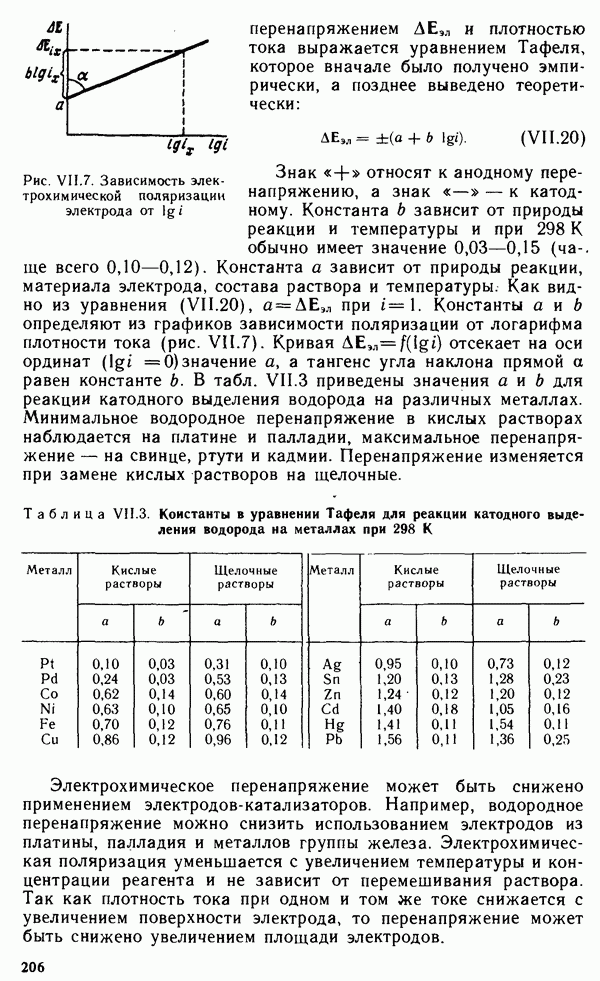
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ VI.4. ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Вода является растворителем для многих веществ. Это обусловлено полярным характером молекул воды и способностью ее молекул образовывать химические связи с другими молекулами. Учитывая широкое распространение водных растворов электролитов и их большую важность для науки и техники, рассмотрим эти растворы более подробно.
Слабые электролиты. Константа диссоциации.
В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно, к нему может быть применен закон действующих масс. Так, для процесса диссоциации уксусной кислоты

константа равновесия  будет равна
будет равна

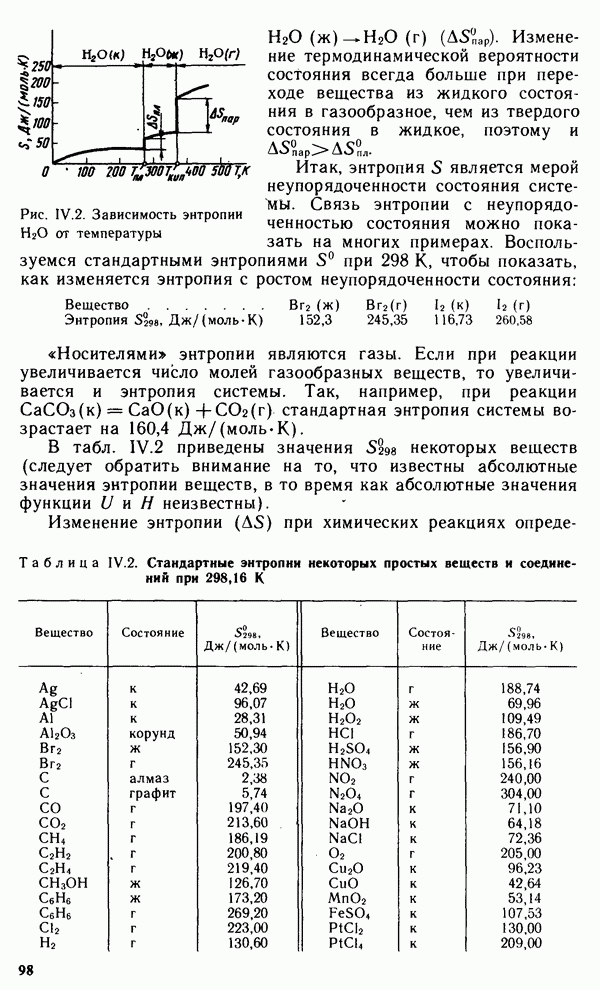
Константу равновесия для процесса диссоциации называют константой диссоциации  Как и любая константа равновесия, константа диссоциации зависит от природы диссоциирующего вещества и растворителя, а также от температуры и не зависит от концентрации раствора. С повышением температуры константа диссоциации обычно уменьшается. Например, константа диссоциации уксусной кислоты при 293, 298 и 373 К соответственно равна
Как и любая константа равновесия, константа диссоциации зависит от природы диссоциирующего вещества и растворителя, а также от температуры и не зависит от концентрации раствора. С повышением температуры константа диссоциации обычно уменьшается. Например, константа диссоциации уксусной кислоты при 293, 298 и 373 К соответственно равна  .
.
В соответствии с принципом Ле Шателье подобная температурная зависимость константы диссоциации указывает на то, что процесс диссоциации является экзотермическим, т. е. суммарная теплота гидратации ионов выше энергии внутримолекулярных связей.
Константа диссоциации представляет собой важную характеристику слабых электролитов, так как указывает на прочность их молекул в данном растворе. Чем меньше константа диссоциации в данном растворителе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы. Учитывая, что степень диссоциации в отличие от константы диссоциации изменяется с концентрацией раствора, необходимо выяснить связь между степенью диссоциации электролита и концентрацией его в растворе. Для этого рассмотрим реакцию диссоциации уксусной кислоты. Если исходную концентрацию раствора принять равной С, а степень диссоциации, соответствующую этой концентрации, а, то число продиссоциированных молекул уксусной кислоты будет равно  Так как при диссоциации каждая молекула распадается на один анион
Так как при диссоциации каждая молекула распадается на один анион  и один катион
и один катион  то равновесная концентрация ионов
то равновесная концентрация ионов  будет совпадать с равновесной концентрацией ионов
будет совпадать с равновесной концентрацией ионов  и составлять
и составлять  Равновесная концентрация нераспавшихся молекул уксусной кислоты будет равна
Равновесная концентрация нераспавшихся молекул уксусной кислоты будет равна  или
или  При этом в соответствии с уравнением
При этом в соответствии с уравнением  константа диссоциации будет
константа диссоциации будет

где 
Уравнение (VI.11) известно в теории растворов как закон Оствальда.
Для растворов слабых электролитов, у которых степень диссоциации меньше единицы, уравнение (VI. 11) можно упростить, считая, что разность (1—а) примерно равна единице. Тогда

Многоосновные слабые кислоты и основания диссоциируют ступенчато, причем константа диссоциации по каждой последующей
ступени всегда на несколько порядков ниже, чем по предыдущей (табл. VI. 1).
Сильные электролиты.
Многие свойства растворов, такие, как электрическая проводимость, температура кипения и замерзания, давление насыщенного пара, зависят как от концентрации раствора, т. е. от числа растворенных в нем частиц, так и от взаимного влияния этих частиц друг на друга. Степень взаимодействия частиц в растворе тем выше, чем больше плотность их зарядов или полярность и чем меньше среднее расстояние между ними.
В растворах слабых электролитов взаимодействие ионов друг с другом относительно невелико вследствие их незначительной концентрации. Поэтому главным фактором, влияющим на перечисленные выше свойства таких растворов, является суммарная концентрация растворенных в них частиц (как ионов, так и молекул), определенная с учетом степени или константы диссоциации.
В растворах сильных электролитов вследствие полной их диссоциации концентрация ионов велика. Поэтому свойства таких растворов будут существенно зависеть от степени взаимодействия входящих в их состав ионов как друг с другом, так и с полярными молекулами растворителя. Взаимодействие ионов в растворах сильных электролитов будет приводить к тому, что катионы и анионы будут испытывать взаимное притяжение, а ионы одного знака заряда будут отталкиваться друг от друга. Поэтому в растворе каждый произвольно выбранный ион будет окружен в среднем во времени преимущественно противоположно заряженными ионами, как, например, в ионных кристаллах.
Однако энергия теплового движения ионов в жидких растворах значительно выше, чем в кристаллах. Поэтому ионы, взаимодействующие с выбранным центральным ионом, располагаются вокруг него не в виде кристаллической решетки, а в виде сферы, которая называется ионной атмосферой (рис. VI.3). Ионные атмосферы обладают следующими характерными особенностями: в их состав входят катионы и анионы. Однако преобладают
Таблица VI.1. Константы диссоциации некоторых электролитов при 298 К


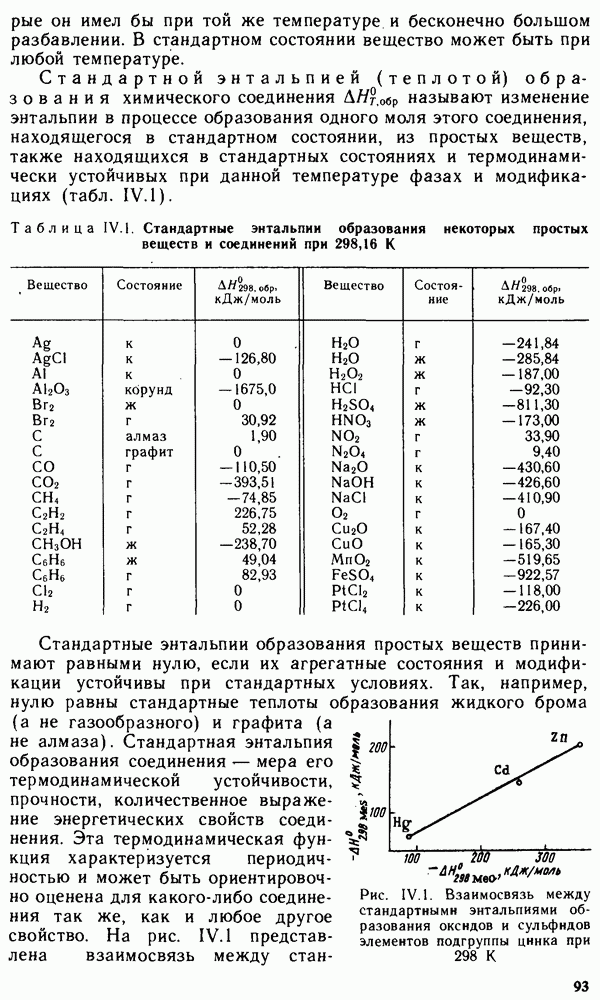
Рис. VI.3. Модель ионной атмосферы
ионы, противоположные по знаку заряда центральному иону. Суммарный заряд ионной атмосферы равен по величине заряду центрального иона и противоположен ему по знаку; все ионы в растворе равноправны, поэтому каждый из них является центральным ионом и одновременно входит в состав ионной атмосферы другого иона; за счет теплового движения ионы, входящие в состав ионной атмосферы, постоянно меняются местами с ионами, находящимися за ее пределами, т. е. ионная атмосфера носит статистический характер.
Введение понятия «ионная атмосфера», предложенного впервые Дебаем и Хюккелем, позволило значительно упростить все расчеты, связанные с процессами, протекающими в растворах сильных электролитов. Вместо практически недоступного расчета энергии взаимодействия отдельных ионов все основные параметры раствора выражают как функцию суммарного взаимодействия входящих в его состав ионов с их ионными атмосферами. Энергия этого взаимодействия зависит от плотности заряда ионной атмосферы и ее среднего радиуса. С ростом концентрации раствора электролита плотность заряда ионной атмосферы растет, а ее средний радиус уменьшается, что увеличивает энергию взаимодействия центральных ионов с их ионными атмосферами.
С ростом концентрации более сильное влияние на свойства раствора начинает оказывать процесс образования сольватов. В результате процесса сольватации изменяются размеры растворенных частиц, плотность их заряда, а также вязкость всего раствора в целом. С увеличением концентрации раствора электролита уменьшается среднее расстояние между противоположно заряженными ионами. При этом растет вероятность образования длительно существующих ионных пар, так называемых ионных двойников и тройников, основное отличие которых от молекул заключается в большей длине связи и наличии взаимодействующих с ионной парой молекул растворителя.
Итак, увеличение концентрации раствора электролита приводит к тому, что во взаимодействии между растворенными частицами более важную роль начинают играть близкодействующие силы химической связи. Природа и энергия этих сил зависит от специфических свойств взаимодействующих частиц. Поэтому с ростом концентрации увеличивается различие в свойствах растворов электролитов одинаковой концентрации, но разного химического состава.
Активность электролитов в водных растворах.
Как указывалось в § VI.2, для применения законов идеальных растворов к реальным системам была введена активность а.
Метод вычисления коэффициента активности у по экспериментальным данным [см. уравнение (VI.8)] позволяет определить лишь значения средних коэффициентов активности электролита. В настоящее время не существует методов экспериментального определения коэффициентов активности отдельных ионов. При необходимости расчета этих величин обычно принимают, что средний коэффициент активности электролита представляет собой среднее геометрическое коэффициентов активности образующих его ионов. Так, для электролита 

Например, для раствора 

для раствора 

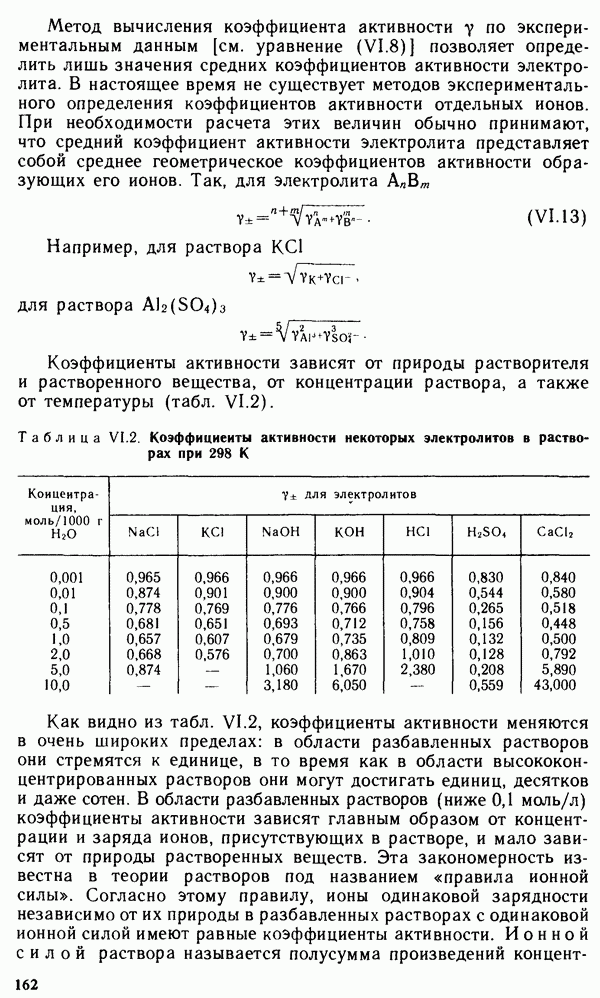
Коэффициенты активности зависят от природы растворителя и растворенного вещества, от концентрации раствора, а также от температуры (табл. VI.2).
Таблица VI.2. Коэффициенты активности некоторых электролитов в растворах при 298 К

Как видно из табл. VI.2, коэффициенты активности меняются в очень широких пределах: в области разбавленных растворов они стремятся к единице, в то время как в области высококонцентрированных растворов они могут достигать единиц, десятков и даже сотен. В области разбавленных растворов (ниже 0,1 моль/л) коэффициенты активности зависят главным образом от концентрации и заряда ионов, присутствующих в растворе, и мало зависят от природы растворенных веществ. Эта закономерность известна в теории растворов под названием «правила ионной силы». Согласно этому правилу, ионы одинаковой зарядности независимо от их природы в разбавленных растворах с одинаковой ионной силой имеют равные коэффициенты активности. Ионной силой раствора называется полусумма произведений концентраций
всех ионов, присутствующих в растворе, на квадрат их заряда:

Правило ионной силы позволяет рассчитать коэффициенты активности отдельных ионов в разбавленных растворах. Коэффициенты активности ионов уменьшаются с увеличением ионной силы растворов и заряда ионов (табл. IV.3).
Таблица VI.3. Коэффициенты активности ионов в водных растворах при

Коэффициенты активности сами по себе не раскрывают природы процессов, протекающих в реальных системах. Они просто позволяют, используя простейшие соотношения, быстро и легко рассчитать реальные свойства растворов. Исходя из этого, в дальнейшем для расчета константы равновесия любого обратимого процесса, протекающего в растворе, вместо концентраций будут использоваться соответствующие активности. Так, для обратимого процесса

отражающего, например, диссоциацию слабого электролита в растворе, константа равновесия будет равна

| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- § 1. ПРЕДМЕТ ХИМИИ
- § 2. ЗНАЧЕНИЕ ХИМИИ В ИЗУЧЕНИИ ПРИРОДЫ И РАЗВИТИИ ТЕХНИКИ
- 1. СТРОЕНИЕ ВЕЩЕСТВА
- Глава I. СТРОЕНИЕ АТОМА И СИСТЕМАТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- § 1.2. КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА
- § 1.3. КВАНТОВЫЕ ЧИСЛА И АТОМНЫЕ ОРБИТАЛИ
- § 1.4. МНОГОЭЛЕКТРОННЫЕ АТОМЫ
- § 1.5. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
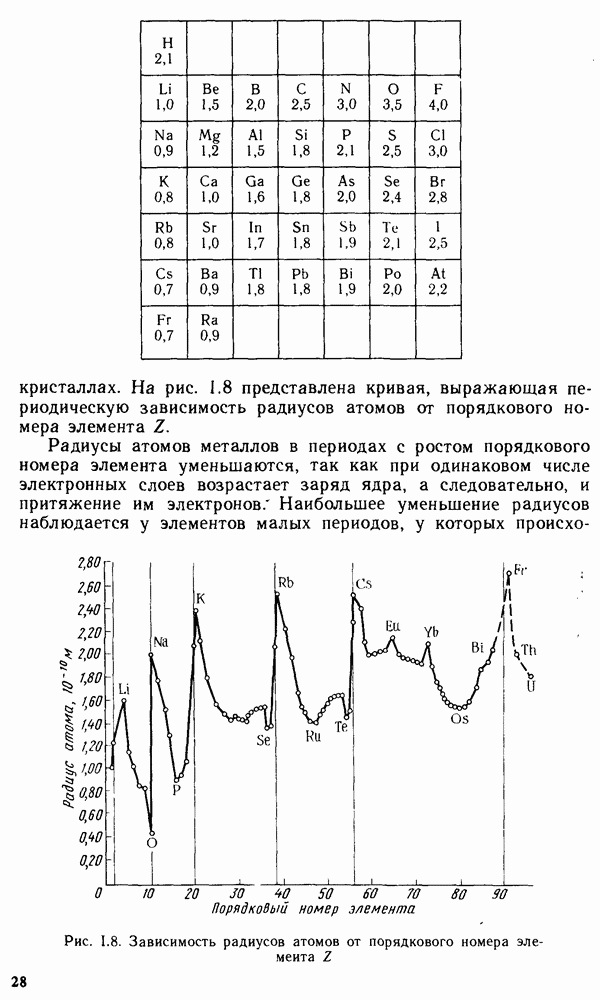
- § 1.6. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- Глава II. ХИМИЧЕСКАЯ СВЯЗЬ
- § II.1. ОСНОВНЫЕ ВИДЫ И ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ
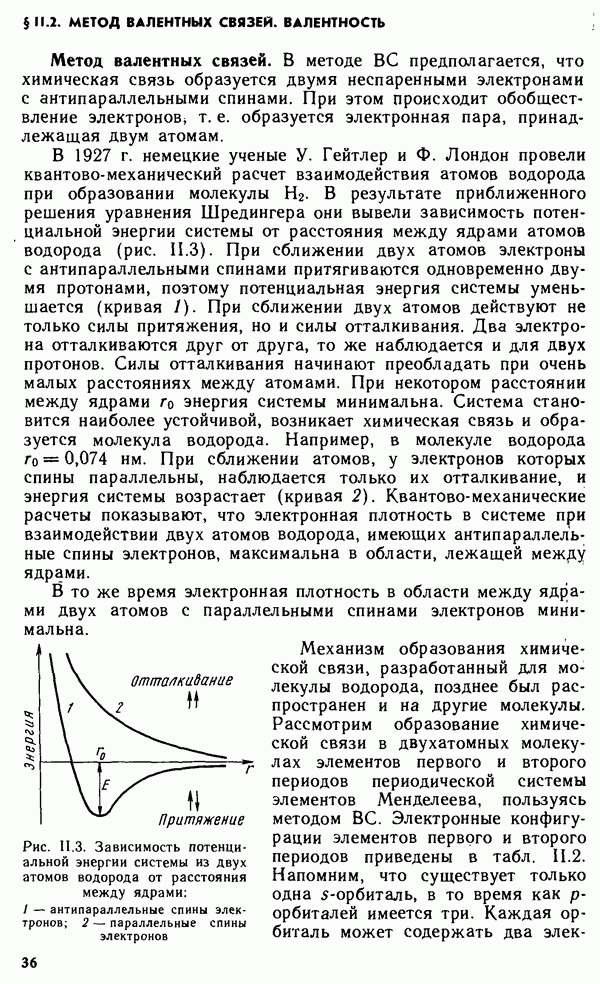
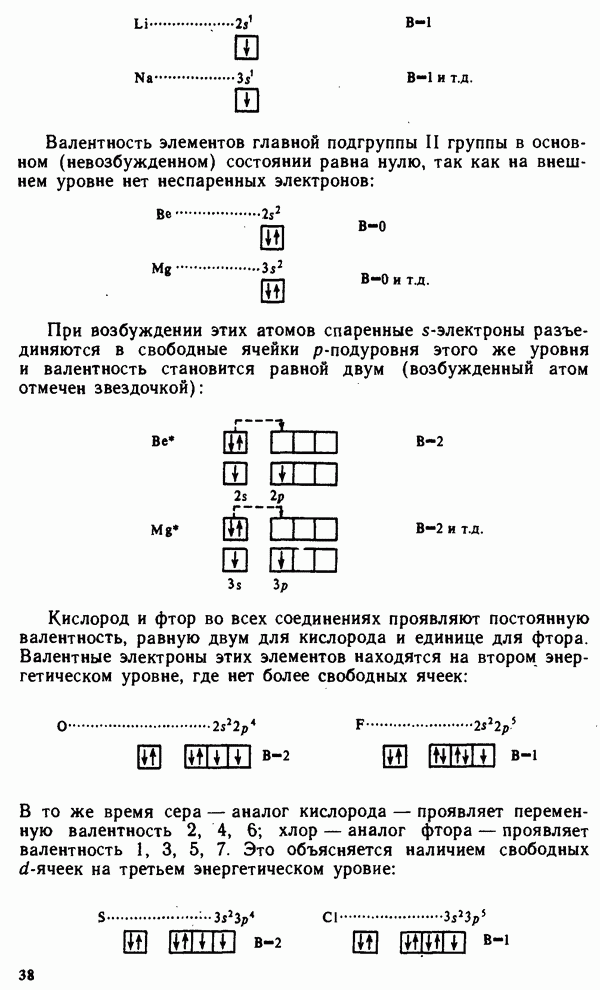
- § II.2. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ. ВАЛЕНТНОСТЬ
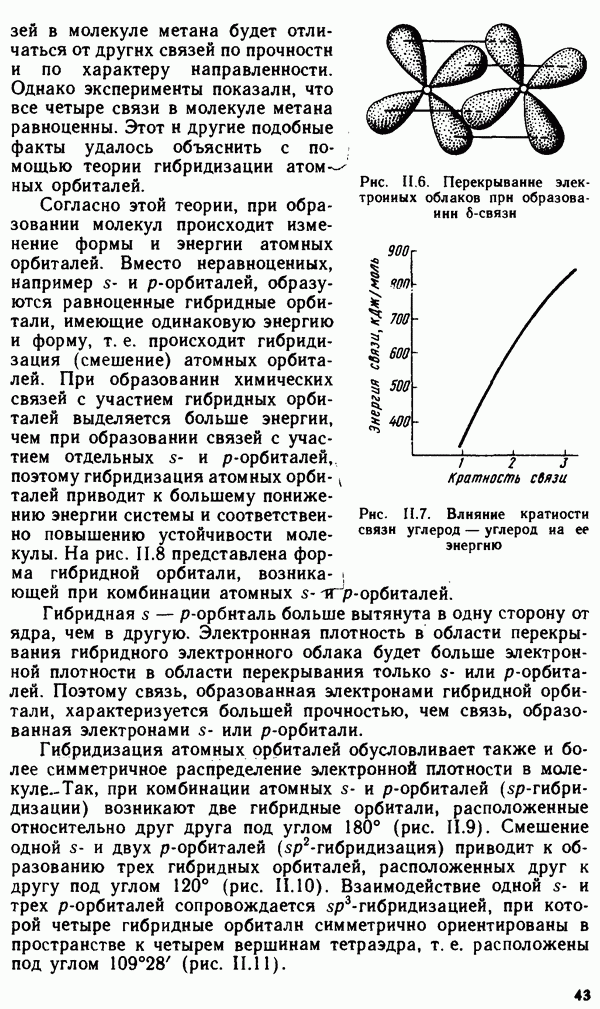
- § II.3. НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. ПРОСТРАНСТВЕННАЯ СТРУКТУРА МОЛЕКУЛ
- § 11.4. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
- § 11.5. ЭЛЕКТРОННАЯ СТРУКТУРА НЕКОТОРЫХ МОЛЕКУЛ
- Глава III. ТИПЫ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ. КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- § III.1. ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ
- § III.2. СВОЙСТВА ВЕЩЕСТВ В РАЗЛИЧНЫХ СОСТОЯНИЯХ
- § III.3. СТРОЕНИЕ КРИСТАЛЛОВ. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ТЕЛАХ
- § III.4. МЕТАЛЛЫ, ПОЛУПРОВОДНИКИ И ДИЭЛЕКТРИКИ
- § III.5. РЕАЛЬНЫЕ КРИСТАЛЛЫ
- 2. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
- Глава IV. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ СРОДСТВО
- § IV.2. ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ И ФАЗОВЫХ ПРЕВРАЩЕНИЙ. ТЕРМОХИМИЧЕСКИЕ ЗАКОНЫ
- § IV.3. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
- § IV.4. ЭНТРОПИЯ. НАПРАВЛЕНИЕ И ПРЕДЕЛ ПРОТЕКАНИЯ ПРОЦЕССОВ В ИЗОЛИРОВАННЫХ СИСТЕМАХ
- § IV.5. ЭНЕРГИЯ ГИББСА И ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА ХИМИЧЕСКОЙ РЕАКЦИИ
- Глава V. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- § V.2. СКОРОСТЬ ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ
- § V.3. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- § V.4. ФИЗИЧЕСКИЕ ВОЗДЕЙСТВИЯ НА ХИМИЧЕСКИЕ РЕАКЦИИ. ЦЕПНЫЕ РЕАКЦИИ
- § V.5. КИНЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ О ХИМИЧЕСКОМ РАВНОВЕСИИ
- § V.6. ФАЗОВЫЕ РАВНОВЕСИЯ ПРАВИЛО ФАЗ
- § V.7. АДСОРБЦИОННОЕ РАВНОВЕСИЕ
- § V.8. КАТАЛИЗ
- 3. РАСТВОРЫ ДИСПЕРСНЫЕ СИСТЕМЫ ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- VI.1. ОБЩИЕ ПОНЯТИЯ О РАСТВОРАХ
- § VI.2. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЖИДКИХ РАСТВОРОВ
- § VI.3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ
- § VI.4. ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- § VI.5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
- § VI.6. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- § VI.7. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ
- § VI.8. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ
- Глава VII. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.1. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- § VII.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.3. ПОТЕНЦИАЛЫ МЕТАЛЛИЧЕСКИХ И ГАЗОВЫХ ЭЛЕКТРОДОВ
- § VII.4. ПОТЕНЦИАЛЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ (РЕДОКСИ-) ЭЛЕКТРОДОВ
- § VII.5. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ. ПОЛЯРИЗАЦИЯ
- § VII.6. ЭЛЕКТРОЛИЗ
- Глава VIII. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- § VIII.1. ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ
- § VIII.2. ХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.4. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
- 4. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- Глава IX. ПРОСТЫЕ ВЕЩЕСТВА И ДВОЙНЫЕ СОЕДИНЕНИЯ. КРАТКИЙ ОБЗОР ХИМИЧЕСКИХ СВОЙСТВ s- И р-ЭЛЕМЕНТОВ
- § IX.2. МЕТАЛЛЫ И СПЛАВЫ. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА
- § IX.3. ДВОЙНЫЕ СОЕДИНЕНИЯ
- § IX.4. СВОЙСТВА МЕТАЛЛОВ ГЛАВНЫХ ПОДГРУПП I И II ГРУПП
- § IX.5. СВОЙСТВА р-ЭЛЕМЕНТОВ III ГРУППЫ
- § IX.6. СВОЙСТВА р-ЭЛЕМЕНТОВ IV ГРУППЫ
- § IX.7. СВОЙСТВА р-ЭЛЕМЕНТОВ V, VI И VII ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ
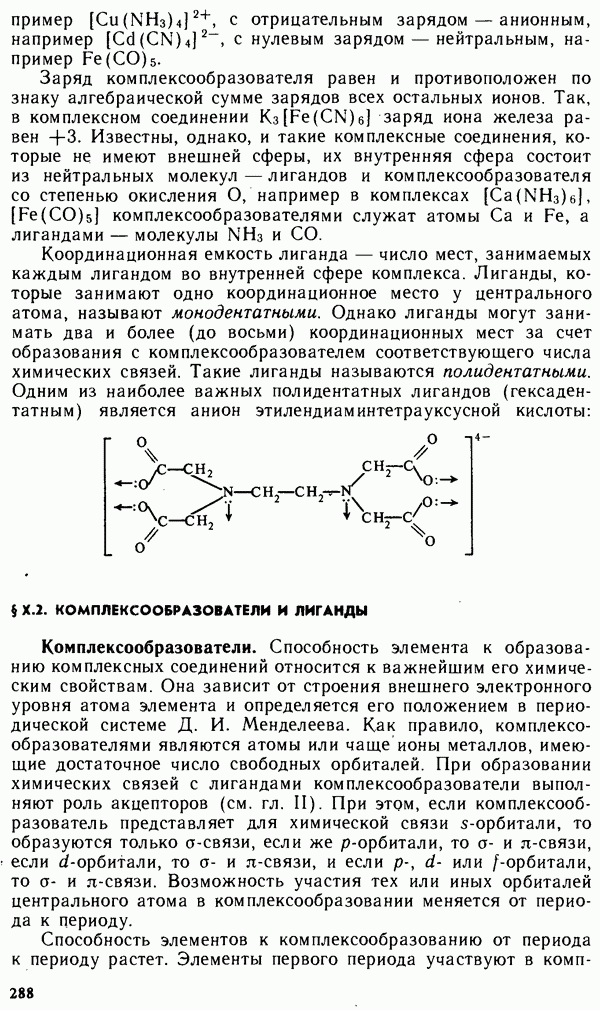
- Глава Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- § Х.1. СТРУКТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИИ
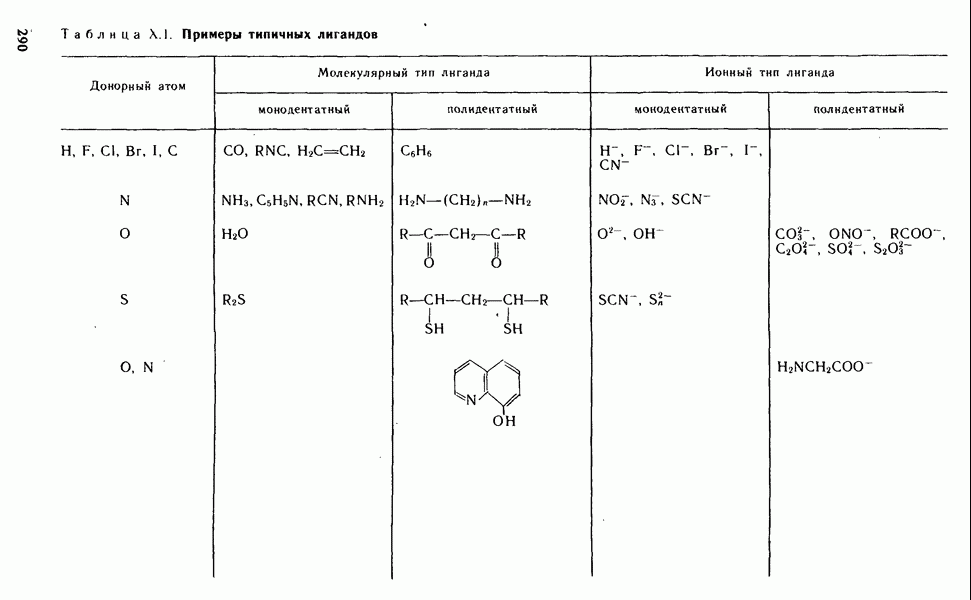
- § Х.2. КОМПЛЕКСООБРАЗОВАТЕЛИ И ЛИГАНДЫ
- § Х.3. НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- § Х.4. МЕТОДЫ РАСЧЕТА ХИМИЧЕСКИХ СВЯЗЕЙ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
- § Х.5. УСТОЙЧИВОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- Глава XI. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- § XI.1. ОСОБЕННОСТИ. ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ И КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- § XI.2. УГЛЕВОДОРОДЫ
- § ХI.3. ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
- 5. СПЕЦИАЛЬНЫЕ ВОПРОСЫ ХИМИИ
- Глава XII. ХИМИЯ КОНСТРУКЦИОННЫХ И ЭЛЕКТРОТЕХНИЧЕСКИХ МАТЕРИАЛОВ
- § XII.2. СВОЙСТВА ПЕРЕХОДНЫХ МЕТАЛЛОВ VIII ГРУППЫ
- § ХII.3. СВОЙСТВА ЭЛЕМЕНТОВ I И II ГРУПП
- § XII.4. ХИМИЯ ПОЛУПРОВОДНИКОВЫХ МАТЕРИАЛОВ
- § XII.5. МЕТОДЫ ПОЛУЧЕНИЯ МАТЕРИАЛОВ ВЫСОКОЙ ЧИСТОТЫ
- Глава XIII. ПОЛИМЕРНЫЕ МАТЕРИАЛЫ И ИХ ПРИМЕНЕНИЕ В ЭНЕРГЕТИКЕ
- § XIII.1. МЕТОДЫ ПОЛУЧЕНИЯ ПОЛИМЕРОВ
- § XIII.2. СТРОЕНИЕ ПОЛИМЕРОВ
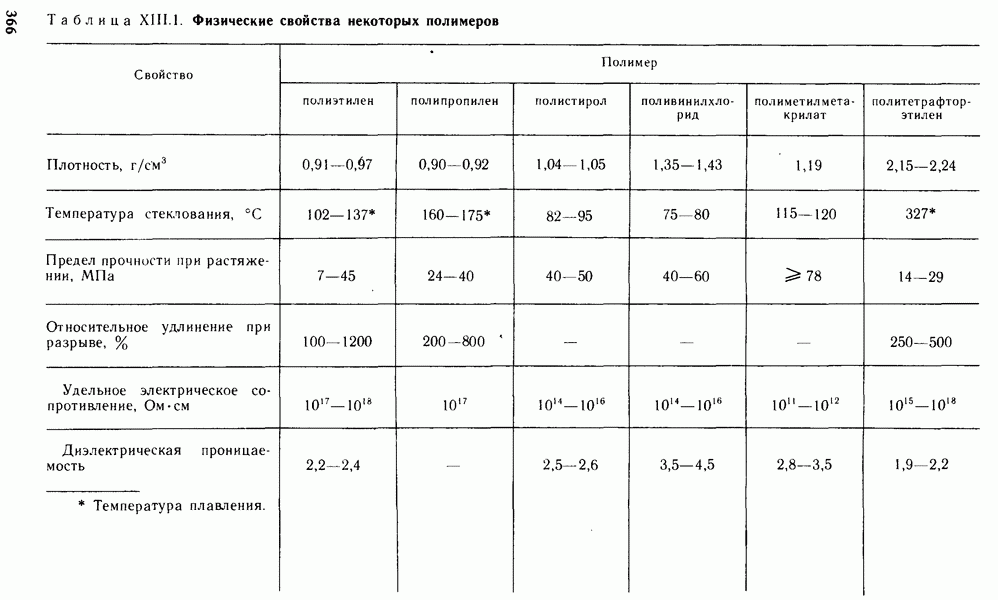
- § XIII.3. СВОЙСТВА ПОЛИМЕРОВ
- § XIII.4. ПРИМЕНЕНИЕ ПОЛИМЕРОВ
- Глава XIV. ХИМИЯ ВОДЫ И ТОПЛИВА. ХИМИЯ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ
- § XIV.1. СТРОЕНИЕ И СВОЙСТВА ВОДЫ
- § XIV.2. ПРИРОДНЫЕ ВОДЫ
- § ХIV.3. ОСНОВНЫЕ МЕТОДЫ ОЧИСТКИ ВОДЫ
- § XIV.4. СОСТАВ И СВОЙСТВА ОРГАНИЧЕСКОГО ТОПЛИВА
- § XIV.5. ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ОБЩЕСТВА
- § XIV.6. ОХРАНА ВОЗДУШНОГО БАССЕЙНА
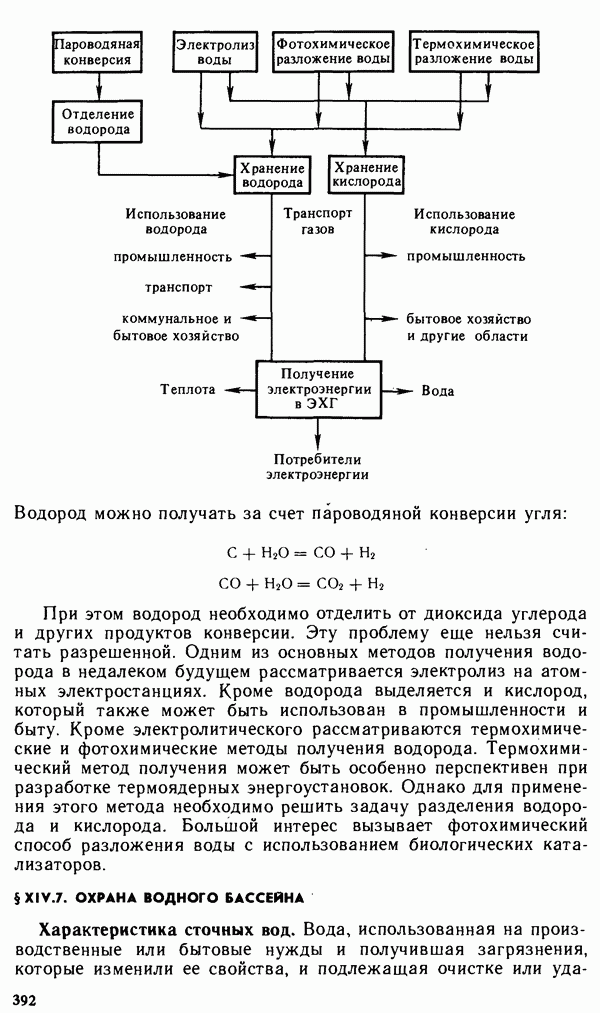
- § XIV.7. ОХРАНА ВОДНОГО БАССЕЙНА
- Глава XV. ЯДЕРНАЯ ХИМИЯ И РАДИОХИМИЯ
- § XV.1. АТОМНОЕ ЯДРО. РАДИОАКТИВНОСТЬ
- § XV.2. ЯДЕРНЫЕ РЕАКЦИИ
- § XV.3. ЯДЕРНАЯ ЭНЕРГЕТИКА
- § XV.4. ХИМИЧЕСКИЕ СВОЙСТВА РАДИОАКТИВНЫХ ЭЛЕМЕНТОВ
- Глава XVI. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ В ЭНЕРГЕТИКЕ, ЭЛЕКТРОНИКЕ И АВТОМАТИКЕ
- § ХVI.1. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА. ЭЛЕКТРОХИМИЧЕСКИЕ ЭНЕРГОУСТАНОВКИ
- § XVI.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ (ХЕМОТРОНЫ)
- § ХVI.3. ЭЛЕКТРОХИМИЧЕСКАЯ АНОДНАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ
- § XVI.4. ПОЛУЧЕНИЕ И СВОЙСТВА ГАЛЬВАНОПОКРЫТИИ
- ЗАКЛЮЧЕНИЕ