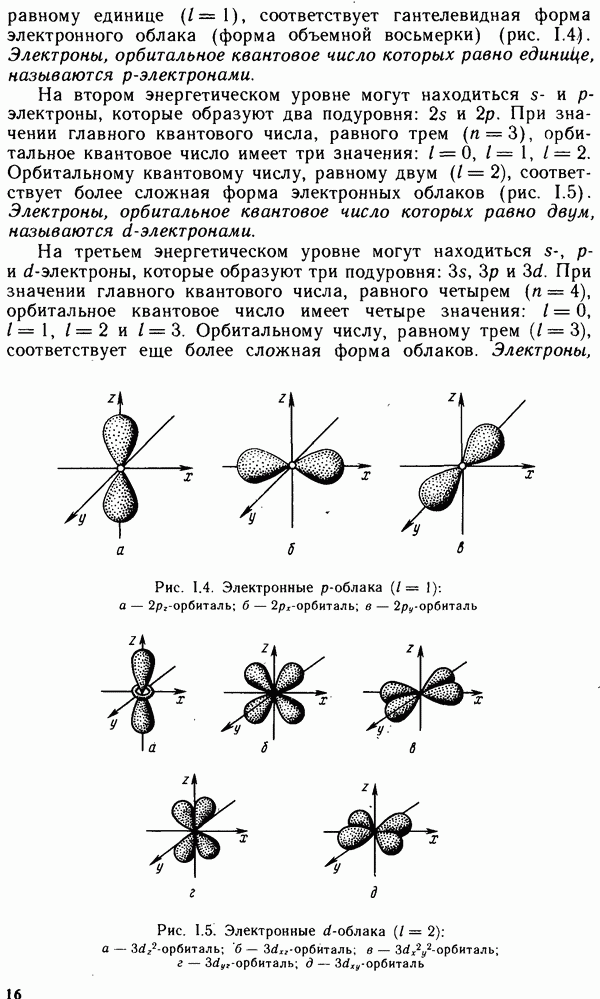
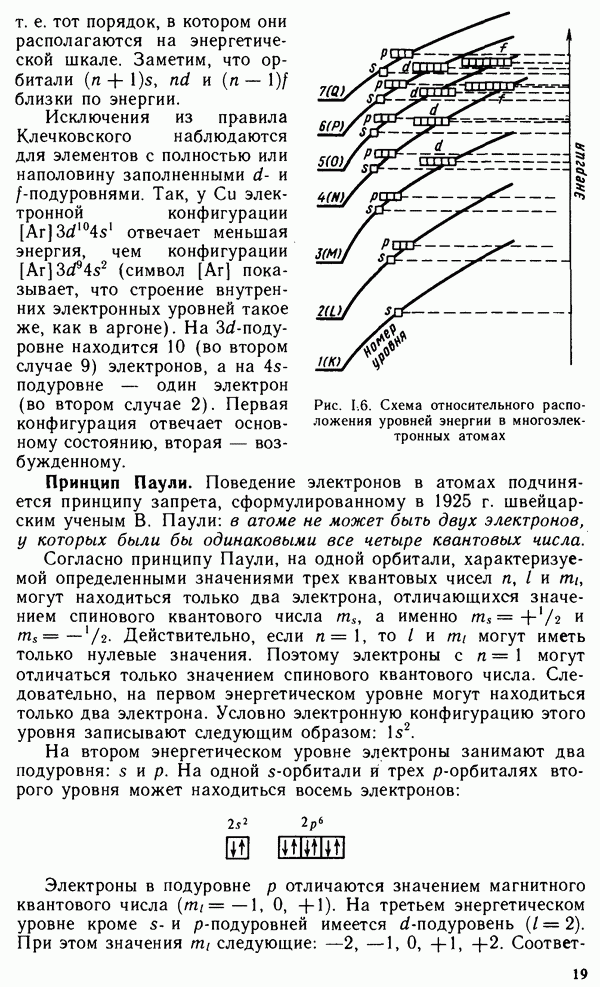
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ ХII.3. СВОЙСТВА ЭЛЕМЕНТОВ I И II ГРУПП
Элементы подгруппы меди.
Медь Cu и ее электронные аналоги — серебро Ag и золото  — являются элементами побочной подгруппы первой группы периодической системы элементов Д. И. Менделеева. Электронная структура атомов элементов подгруппы меди может быть выражена формулой...
— являются элементами побочной подгруппы первой группы периодической системы элементов Д. И. Менделеева. Электронная структура атомов элементов подгруппы меди может быть выражена формулой...  где
где  — номер внешнего электронного слоя, совпадающий с номером периода в периодической системе.
— номер внешнего электронного слоя, совпадающий с номером периода в периодической системе.
Наличие одного неспаренного электрона во внешнем электронном слое атома  объясняет одновалентное состояние
объясняет одновалентное состояние
рассматриваемых металлов. Причем соединения серебра (I) являются единственно устойчивыми для этого элемента.
Энергетический подуровень  предвнешнего электронного слоя в атомах
предвнешнего электронного слоя в атомах  должен быть заполнен девятью электронами:
должен быть заполнен девятью электронами:  «Провал» электрона из внешнего слоя в предвнешний
«Провал» электрона из внешнего слоя в предвнешний  способствует завершению построения подуровня
способствует завершению построения подуровня  но еще не обеспечивает его стабильности. «Провалившийся» электрон в отличие от остальных спаренных электронов подвижен и может при возбуждении атома переходить на внешний электронный слой:
но еще не обеспечивает его стабильности. «Провалившийся» электрон в отличие от остальных спаренных электронов подвижен и может при возбуждении атома переходить на внешний электронный слой:

Поэтому для меди, серебра и золота типичны также степени окисления  Наиболее устойчивы соединения меди, в которых она имеет степень окисления
Наиболее устойчивы соединения меди, в которых она имеет степень окисления  и соединения золота, в которых степень окисления его
и соединения золота, в которых степень окисления его  (
( и др.).
и др.).
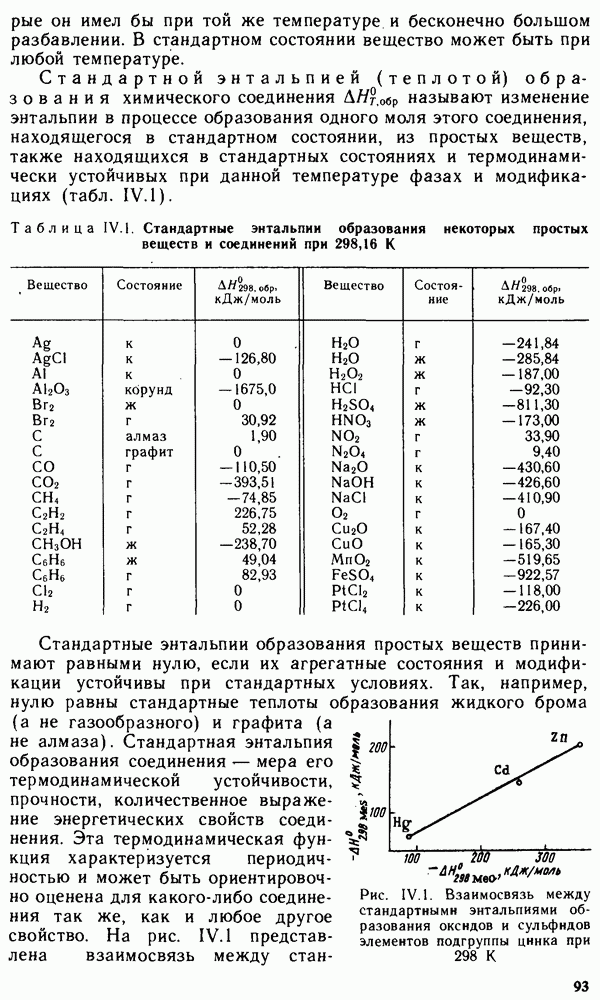
Медь, серебро и золото представляют собой металлы соответственно красного, белого и желтого цвета. Все они (особенно  ) характеризуются исключительной пластичностью. Ниже приведены некоторые константы, характеризующие физико-химические свойства элементов подгруппы меди:
) характеризуются исключительной пластичностью. Ниже приведены некоторые константы, характеризующие физико-химические свойства элементов подгруппы меди:

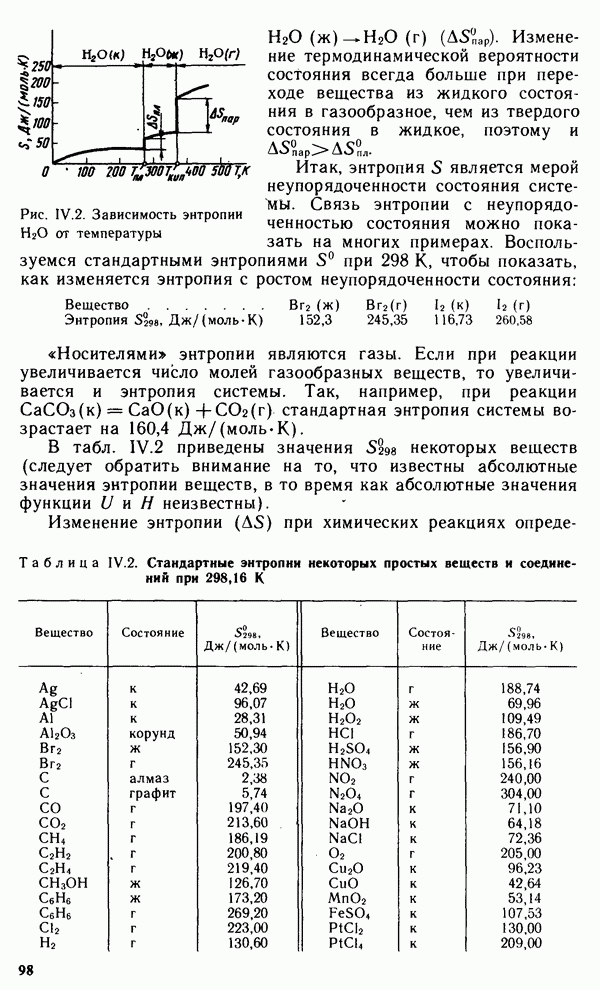
Обращают на себя внимание высокие значения электрической проводимости и теплопроводности меди и ее аналогов. Серебро характеризуется максимальной для металлов электрической проводимостью. Медь по электрической проводимости уступает только серебру. В связи с этим около 40 % всей добываемой меди идет на изготовление электрических проводов и кабелей. Этой области применения металла способствуют исключительная пластичность и тягучесть меди. Из нее можно вытянуть проволоку диаметром 0,001 мм. У всех металлов подгруппы меди положительные стандартные электродные потенциалы, что свидетельствует об их низкой химической активности. В ряду стандартных электродных потенциалов все три металла располагаются правее водорода.
С разбавленными соляной и серной кислотами медь, серебро и золото не взаимодействуют. Азотная кислота растворяет медь и серебро:

Золото растворяется в царской водке:

образуя золотохлористоводородную кислоту. Лучшим растворителем для золота является насыщенная хлором соляная кислота:

Все растворимые соединения меди, серебра и золота ядовиты.
Золото и серебро на воздухе не изменяются, а медь покрывается зеленовато-серой пленкой основных карбонатов  . С кислородом непосредственно взаимодействует только медь:
. С кислородом непосредственно взаимодействует только медь: 
Легче всего меди и ее аналоги реагируют с галогенами (медь реагирует уже при комнатной температуре), образуя соединения; в которых проявляют наиболее типичные для них степени окисления:

Наиболее характерной особенностью большинства соединений  является легкость восстановления их до металлов. При этом в соответствии с положением в ряду стандартных электродных потенциалов легче всего восстанавливается золото. Другая заметно выраженная особенность — склонность соединений Си,
является легкость восстановления их до металлов. При этом в соответствии с положением в ряду стандартных электродных потенциалов легче всего восстанавливается золото. Другая заметно выраженная особенность — склонность соединений Си,  к комплексообразованию. Так, например, труднорастворимый гидроксид Си
к комплексообразованию. Так, например, труднорастворимый гидроксид Си  легко растворяется в аммиаке:
легко растворяется в аммиаке:

иодид серебра  — в избытке иодида калия:
— в избытке иодида калия:

В комплексных катионах и анионах  имеют координационное число, равное двум, а
имеют координационное число, равное двум, а  — равное четырем. Катионы
— равное четырем. Катионы  в аквакомплексах и некоторых других могут иметь координационное число, равное шести. При растворении в воде безводного сульфата меди (II) образуются катионы
в аквакомплексах и некоторых других могут иметь координационное число, равное шести. При растворении в воде безводного сульфата меди (II) образуются катионы  При сильном разбавлении раствора тетрааквакомплексы переходят в гексааквакомплексы
При сильном разбавлении раствора тетрааквакомплексы переходят в гексааквакомплексы  Сульфат меди кристаллизуется из водных растворов с пятью молекулами воды:
Сульфат меди кристаллизуется из водных растворов с пятью молекулами воды:  При нагревании легко удаляется только одна молекула воды, так как четыре молекулы
При нагревании легко удаляется только одна молекула воды, так как четыре молекулы  связаны с
связаны с  донорно-акцепторными связями.
донорно-акцепторными связями.
Медь, серебро и золото очень широко применяются в технике. Во многих областях используются и их соединения. Медь 99,9 %-ной чистоты используют в электротехнике для изготовления электрических проводов, контактов и пр. Большое промышленное значение имеют сплавы меди с другими металлами. Важнейшими из них являются латуни, бронзы и медно-никелевые сплавы. Латунь содержит до  цинка (остальное Си). Из нее изготовляют трубы для конденсаторов и радиаторов, детали механизмов, в частности часовых. Латунь с высоким содержанием меди — томпак — благодаря своему красивому внешнему виду используется для изготовления украшений. Бронзы подразделяются на оловянные, алюминиевые, кремниевые, свинцовые и др. Очень прочными являются бериллиевые бронзы; они применяются для изготовления пружин и других ответственных деталей.
цинка (остальное Си). Из нее изготовляют трубы для конденсаторов и радиаторов, детали механизмов, в частности часовых. Латунь с высоким содержанием меди — томпак — благодаря своему красивому внешнему виду используется для изготовления украшений. Бронзы подразделяются на оловянные, алюминиевые, кремниевые, свинцовые и др. Очень прочными являются бериллиевые бронзы; они применяются для изготовления пружин и других ответственных деталей.
Сплавы меди с никелем подразделяют на конструкционные и электротехнические. К конструкционным относятся мельхиоры
и нейзильберы. Мельхиоры содержат 20—30% никеля и небольшие количества железа и марганца (остальное — медь), а нейзильберы содержат 5—35% никеля и 13—45% цинка (остальное — медь). Вследствие высокой коррозионной стойкости конструкционные медно-никелевые сплавы применяются в энергетике. Из них изготовляют радиаторы, трубопроводы, дистилляционные установки для получения питьевой воды из морской. К электротехническим медно-никелевым сплавам относятся константан  остальное Cu) и манганин (3 % Ni, 12 % Mn, остальное Cu), которые отличаются высоким электрическим сопротивлением, не изменяющимся с температурой. Они идут на изготовление магазинов сопротивления. К электротехническим относится и сплав копель
остальное Cu) и манганин (3 % Ni, 12 % Mn, остальное Cu), которые отличаются высоким электрическим сопротивлением, не изменяющимся с температурой. Они идут на изготовление магазинов сопротивления. К электротехническим относится и сплав копель  остальное Cu), применяемый для изготовления термопар.
остальное Cu), применяемый для изготовления термопар.
Серебро используют для изготовления некоторых аккумуляторов; оно входит в состав припоев. Из золота изготовляют специальные электрические контакты, Поскольку золото очень мягкий металл, его применяют главным образом в сплавах с серебром или медью.
Элементы подгруппы цинка.
Цинк  и его электронные аналоги — кадмий
и его электронные аналоги — кадмий  ртуть
ртуть  — являются элементами побочной подгруппы второй группы периодической системы элементов Д. И. Менделеева. Электронная структура атомов этих элементов может быть выражена формулой
— являются элементами побочной подгруппы второй группы периодической системы элементов Д. И. Менделеева. Электронная структура атомов этих элементов может быть выражена формулой  где
где  — номер внешнего электронного слоя, совпадающий с номером периода, в котором находится элемент.
— номер внешнего электронного слоя, совпадающий с номером периода, в котором находится элемент.
Валентность цинка и его аналогов постоянна и равна двум, что отвечает возбужденному состоянию атомов: 
Электроны стабилизированного (достроенного до 10 электронов при двух электронах на подуровне  — энергетического подуровня при возбуждении атомов не распариваются и не влияют на валентные свойства рассматриваемых элементов.
— энергетического подуровня при возбуждении атомов не распариваются и не влияют на валентные свойства рассматриваемых элементов.
Массовые содержания  в земной коре составляют
в земной коре составляют  соответственно.
соответственно.
Цинк, кадмий и ртуть — белые металлы с синеватым  или серебристым
или серебристым  оттенком. Во влажном воздухе они покрываются оксидными пленками и теряют свой блеск. Кадмий — ковкий и тягучий металл; цинк при обычных условиях довольно хрупок. Все три металла легко образуют сплавы друг с другом и другими металлами.
оттенком. Во влажном воздухе они покрываются оксидными пленками и теряют свой блеск. Кадмий — ковкий и тягучий металл; цинк при обычных условиях довольно хрупок. Все три металла легко образуют сплавы друг с другом и другими металлами.
Сплавы ртути с другими металлами (амальгамы) могут быть «твердыми растворами» (например, амальгама кадмия) и интерметаллическими соединениями. Так, при растирании натрия со ртутью происходит экзотермический процесс образования амальгамы, в которой обнаруживается целый ряд интер-металлидов 
Ниже приведены некоторые константы, характеризующие физико-химические свойства 

Свойства ртути резко отличаются от свойств  и вообще исключительны для металлических веществ. Ртуть имеет очень низкие температуру плавления и электрическую проводимость. Наблюдается также очень резкое падение химической активности металлов при движении по подгруппе сверху вниз: цинк и кадмий в ряду стандартных электродных потенциалов стоят до водорода, а ртуть — после.
и вообще исключительны для металлических веществ. Ртуть имеет очень низкие температуру плавления и электрическую проводимость. Наблюдается также очень резкое падение химической активности металлов при движении по подгруппе сверху вниз: цинк и кадмий в ряду стандартных электродных потенциалов стоят до водорода, а ртуть — после.
Цинк — химически активный металл (степень окисления  во всех соединениях
во всех соединениях  легко растворяется в кислотах и щелочах:
легко растворяется в кислотах и щелочах:

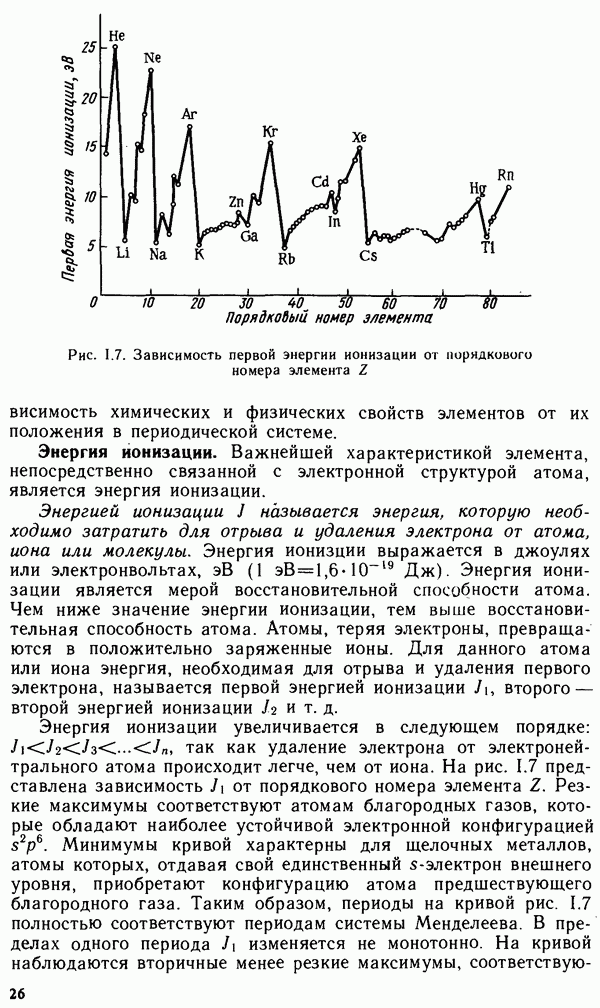
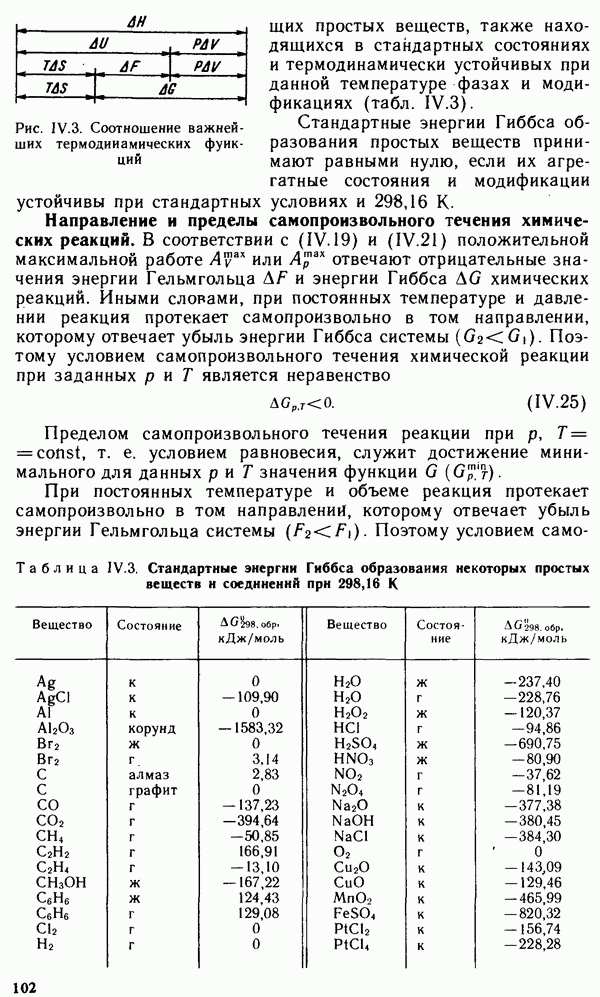
вытесняя из них водород и образуя соответственно положительно заряженные аквакомплексы или отрицательно заряженные гидроксокомплексы. Координационное число комплексообразователя  равно четырем. Скорость взаимодействия цинка с растворами кислот и щелочей зависит от относительной кислотности (щелочности) раствора. Зависимость скорости выделения водорода от pH среды представлена на рис. XII.2.
равно четырем. Скорость взаимодействия цинка с растворами кислот и щелочей зависит от относительной кислотности (щелочности) раствора. Зависимость скорости выделения водорода от pH среды представлена на рис. XII.2.
Кадмий в щелочах практически не растворяется, а в кислотах — менее энергично, чем цинк. Ртуть же растворяется только в кислотах — окислителях:

При действии на избыток ртути разбавленной  образуется соль
образуется соль  в которой ртуть формально одновалентна:
в которой ртуть формально одновалентна:

Однако и в этом нитрате, как и в  ртуть находится в степени окисления
ртуть находится в степени окисления  образуя радикал
образуя радикал  с ковалентной неполярной связью между двумя атомами ртути:
с ковалентной неполярной связью между двумя атомами ртути:  .
.
Аналогично существуют два хлорида

Рис. XII.2. Зависимость скорости коррозии цинка от pH раствора
ртути:  известный под названием «сулема», и
известный под названием «сулема», и  Соединения
Соединения  в зависимости от условий могут быть восстановителями и окислителями. Например:
в зависимости от условий могут быть восстановителями и окислителями. Например:

При нагревании соединения  легко разлагаются по уравнению реакции
легко разлагаются по уравнению реакции  — жидкость).
— жидкость).
Цинк и кадмий по отиошеиию к  и коицентрироваииой
и коицентрироваииой  ведут себя очень активно. Так,
ведут себя очень активно. Так,  восстанавливает
восстанавливает  (разбавленная
(разбавленная  и
и  (концентрированная
(концентрированная  соотсоответственно до
соотсоответственно до 

При нагревании цинк, кадмий и ртуть энергично взаимодействуют со многими неметаллами. Так, при взаимодействии цинка и его аналогов с  образуются оксиды
образуются оксиды  окрашенные в белый, коричневый и красный цвета соответственно. Известен также черный оксид
окрашенные в белый, коричневый и красный цвета соответственно. Известен также черный оксид  . В воде оксиды циика, кадмия и ртути нерастворимы. В ряду
. В воде оксиды циика, кадмия и ртути нерастворимы. В ряду  наблюдается заметное уменьшение устойчивости соедииеиий:
наблюдается заметное уменьшение устойчивости соедииеиий:

Еще более заметно падает термодинамическая устойчивость гидроксидов  Так, гидроксид
Так, гидроксид  получить не удается. При действии щелочей на соли ртути (II) реакция протекает по уравнению
получить не удается. При действии щелочей на соли ртути (II) реакция протекает по уравнению

Оксид и гидроксид циика имеют амфотерный характер и могут растворяться как в кислотах, так и в щелочах. Диалогичные соединения кадмия и ртути амфотериых свойств не проявляют и растворяются только в кислотах.
Соединения  склоииы к комплексообразованию. Так, например, образованием комплексных аммиакатов можно объяснить способность гидроксидов циика и кадмия растворяться в аммиаке:
склоииы к комплексообразованию. Так, например, образованием комплексных аммиакатов можно объяснить способность гидроксидов циика и кадмия растворяться в аммиаке:

Весьма устойчивы галогенные комплексы ртути:

Применение цинка и его аналогов разнообразно. Большая часть цинка используется для оцинкования железа в целях предохранения последнего от коррозии (анодное покрытие), а также для получения различных сплавов (например, латуней, нейзильберов и др.). Цинк применяют в некоторых гальванических элементах.
Кадмий применяют в процессах кадмирования аналогично тому, как цинк — в процессах цинкования. Поскольку электродный потенциал кадмия положительнее электродного потенциала цинка, кадмированные поверхности железных (стальных) деталей более стойки по отношению к агрессивным средам. Такие
детали используются в автомобилях, самолетах и др. В металлургических процессах кадмий идет для получения легкоплавких сплавов. Важной в технике является кадмиевая бронза (~1 % Cd), из которой делают телеграфные, телефонные, троллейбусные провода, поскольку кадмиевая бронза характеризуется большей прочностью и износостойкостью, чем медь. Кадмий используется в щелочных аккумуляторах. Чрезвычайно интересна способность Cd поглощать медленные нейтроны, вследствие чего он применяется в ядерных реакторах для регулирования скорости распада ядерного топлива.
Соединения кадмия очень ядовиты!
Металлическая ртуть используется для изготовления измерительных приборов (манометров, термометров и пр.) и других аппаратов (ртутных кварцевых ламп и пр.). С железом ртуть не образует амальгам, поэтому ртуть можно хранить в стальных емкостях.
Пары ртути очень ядовиты!
Соединения цинка и металлов его подгруппы широко применяются в различных областях промышленности. Сульфид и оксид цинка, легированные некоторыми примесями, входят в группу веществ, обладающих способностью люминесцировать — испускать холодное свечение в результате действия на них лучистой энергии или электронов. Люминесценция имеет большое значение для науки и техники: она лежит в основе люминесцентного анализа, работы телевизионных экранов, действия ламп дневного света. Люминесцирующие вещества называют люминофорами.
Раствор  применяют для травления металлов, при пайке для удаления с поверхности металлов оксидов и гидроксидов.
применяют для травления металлов, при пайке для удаления с поверхности металлов оксидов и гидроксидов.  — каломель используется для изготовления электродов.
— каломель используется для изготовления электродов.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- § 1. ПРЕДМЕТ ХИМИИ
- § 2. ЗНАЧЕНИЕ ХИМИИ В ИЗУЧЕНИИ ПРИРОДЫ И РАЗВИТИИ ТЕХНИКИ
- 1. СТРОЕНИЕ ВЕЩЕСТВА
- Глава I. СТРОЕНИЕ АТОМА И СИСТЕМАТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- § 1.2. КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА
- § 1.3. КВАНТОВЫЕ ЧИСЛА И АТОМНЫЕ ОРБИТАЛИ
- § 1.4. МНОГОЭЛЕКТРОННЫЕ АТОМЫ
- § 1.5. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
- § 1.6. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- Глава II. ХИМИЧЕСКАЯ СВЯЗЬ
- § II.1. ОСНОВНЫЕ ВИДЫ И ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ
- § II.2. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ. ВАЛЕНТНОСТЬ
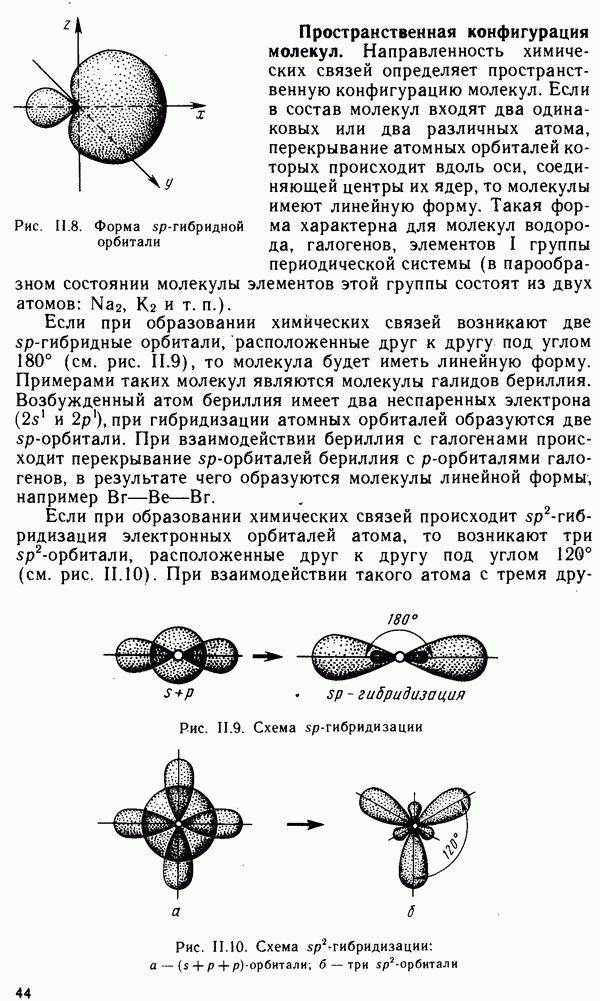
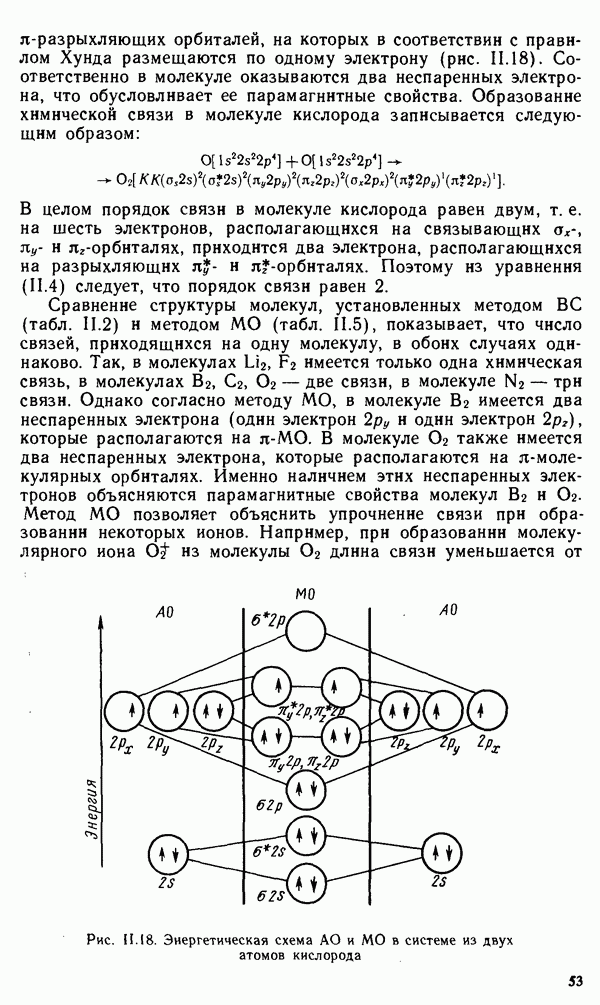
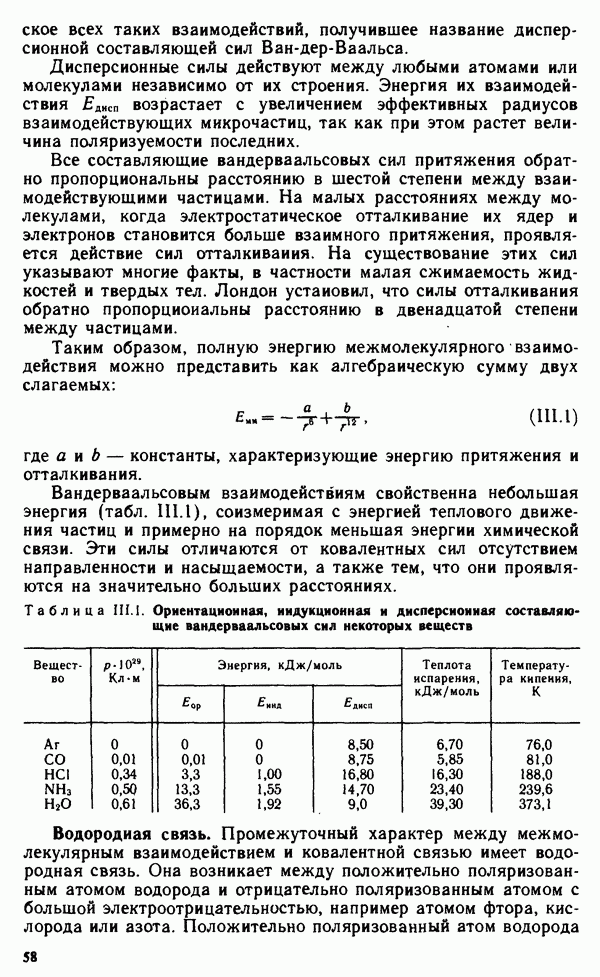
- § II.3. НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. ПРОСТРАНСТВЕННАЯ СТРУКТУРА МОЛЕКУЛ
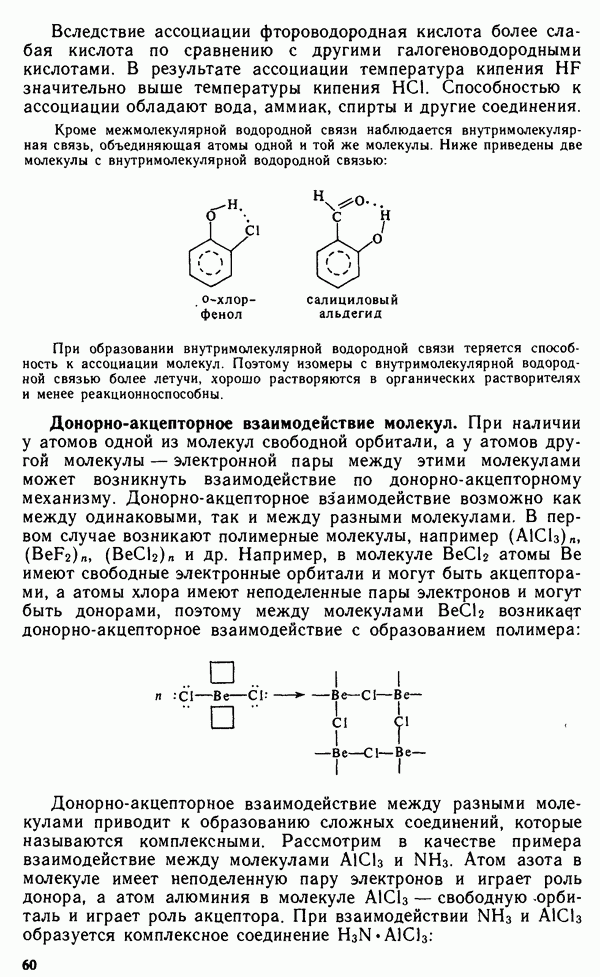
- § 11.4. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
- § 11.5. ЭЛЕКТРОННАЯ СТРУКТУРА НЕКОТОРЫХ МОЛЕКУЛ
- Глава III. ТИПЫ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ. КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- § III.1. ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ
- § III.2. СВОЙСТВА ВЕЩЕСТВ В РАЗЛИЧНЫХ СОСТОЯНИЯХ
- § III.3. СТРОЕНИЕ КРИСТАЛЛОВ. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ТЕЛАХ
- § III.4. МЕТАЛЛЫ, ПОЛУПРОВОДНИКИ И ДИЭЛЕКТРИКИ
- § III.5. РЕАЛЬНЫЕ КРИСТАЛЛЫ
- 2. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
- Глава IV. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ СРОДСТВО
- § IV.2. ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ И ФАЗОВЫХ ПРЕВРАЩЕНИЙ. ТЕРМОХИМИЧЕСКИЕ ЗАКОНЫ
- § IV.3. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
- § IV.4. ЭНТРОПИЯ. НАПРАВЛЕНИЕ И ПРЕДЕЛ ПРОТЕКАНИЯ ПРОЦЕССОВ В ИЗОЛИРОВАННЫХ СИСТЕМАХ
- § IV.5. ЭНЕРГИЯ ГИББСА И ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА ХИМИЧЕСКОЙ РЕАКЦИИ
- Глава V. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- § V.2. СКОРОСТЬ ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ
- § V.3. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- § V.4. ФИЗИЧЕСКИЕ ВОЗДЕЙСТВИЯ НА ХИМИЧЕСКИЕ РЕАКЦИИ. ЦЕПНЫЕ РЕАКЦИИ
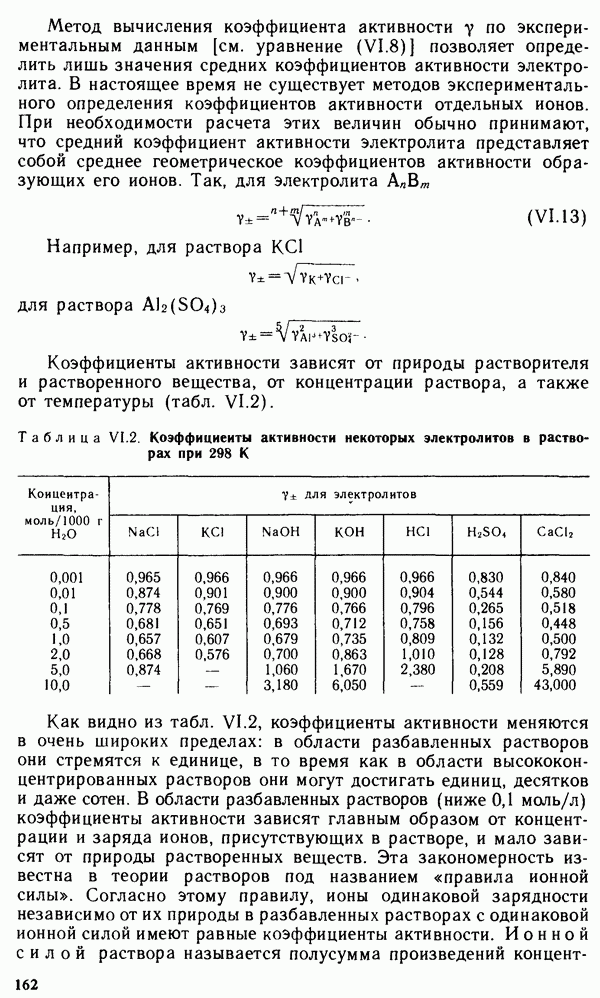
- § V.5. КИНЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ О ХИМИЧЕСКОМ РАВНОВЕСИИ
- § V.6. ФАЗОВЫЕ РАВНОВЕСИЯ ПРАВИЛО ФАЗ
- § V.7. АДСОРБЦИОННОЕ РАВНОВЕСИЕ
- § V.8. КАТАЛИЗ
- 3. РАСТВОРЫ ДИСПЕРСНЫЕ СИСТЕМЫ ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- VI.1. ОБЩИЕ ПОНЯТИЯ О РАСТВОРАХ
- § VI.2. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЖИДКИХ РАСТВОРОВ
- § VI.3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ
- § VI.4. ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- § VI.5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
- § VI.6. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- § VI.7. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ
- § VI.8. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ
- Глава VII. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.1. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- § VII.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.3. ПОТЕНЦИАЛЫ МЕТАЛЛИЧЕСКИХ И ГАЗОВЫХ ЭЛЕКТРОДОВ
- § VII.4. ПОТЕНЦИАЛЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ (РЕДОКСИ-) ЭЛЕКТРОДОВ
- § VII.5. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ. ПОЛЯРИЗАЦИЯ
- § VII.6. ЭЛЕКТРОЛИЗ
- Глава VIII. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- § VIII.1. ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ
- § VIII.2. ХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.4. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
- 4. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- Глава IX. ПРОСТЫЕ ВЕЩЕСТВА И ДВОЙНЫЕ СОЕДИНЕНИЯ. КРАТКИЙ ОБЗОР ХИМИЧЕСКИХ СВОЙСТВ s- И р-ЭЛЕМЕНТОВ
- § IX.2. МЕТАЛЛЫ И СПЛАВЫ. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА
- § IX.3. ДВОЙНЫЕ СОЕДИНЕНИЯ
- § IX.4. СВОЙСТВА МЕТАЛЛОВ ГЛАВНЫХ ПОДГРУПП I И II ГРУПП
- § IX.5. СВОЙСТВА р-ЭЛЕМЕНТОВ III ГРУППЫ
- § IX.6. СВОЙСТВА р-ЭЛЕМЕНТОВ IV ГРУППЫ
- § IX.7. СВОЙСТВА р-ЭЛЕМЕНТОВ V, VI И VII ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ
- Глава Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
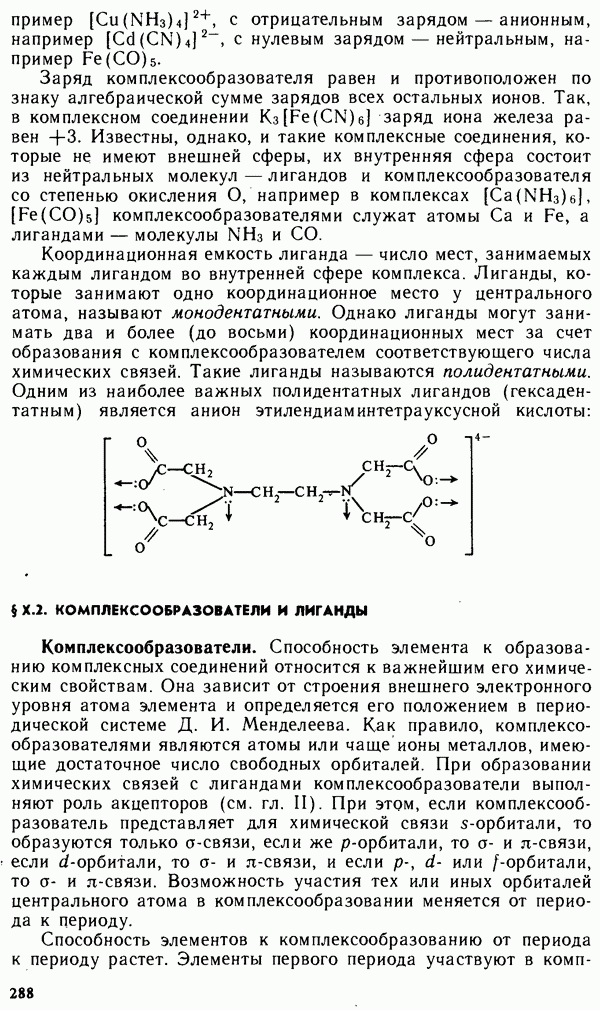
- § Х.1. СТРУКТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИИ
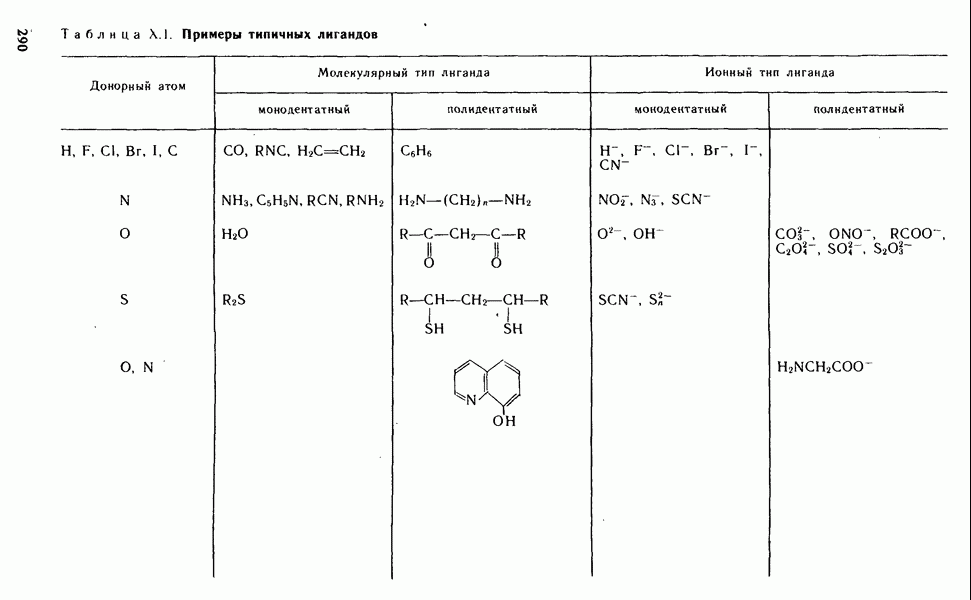
- § Х.2. КОМПЛЕКСООБРАЗОВАТЕЛИ И ЛИГАНДЫ
- § Х.3. НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- § Х.4. МЕТОДЫ РАСЧЕТА ХИМИЧЕСКИХ СВЯЗЕЙ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
- § Х.5. УСТОЙЧИВОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- Глава XI. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- § XI.1. ОСОБЕННОСТИ. ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ И КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- § XI.2. УГЛЕВОДОРОДЫ
- § ХI.3. ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
- 5. СПЕЦИАЛЬНЫЕ ВОПРОСЫ ХИМИИ
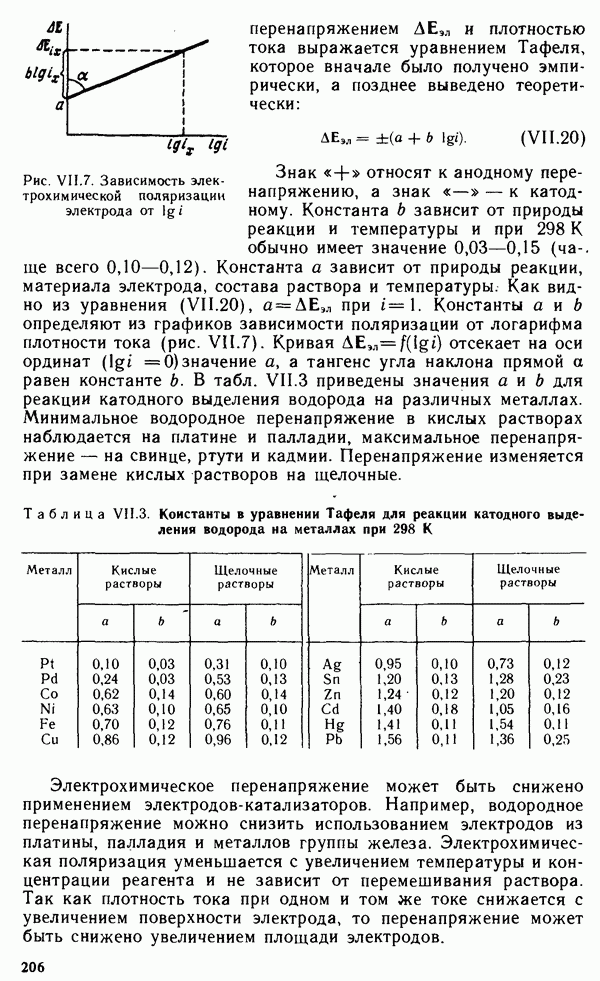
- Глава XII. ХИМИЯ КОНСТРУКЦИОННЫХ И ЭЛЕКТРОТЕХНИЧЕСКИХ МАТЕРИАЛОВ
- § XII.2. СВОЙСТВА ПЕРЕХОДНЫХ МЕТАЛЛОВ VIII ГРУППЫ
- § ХII.3. СВОЙСТВА ЭЛЕМЕНТОВ I И II ГРУПП
- § XII.4. ХИМИЯ ПОЛУПРОВОДНИКОВЫХ МАТЕРИАЛОВ
- § XII.5. МЕТОДЫ ПОЛУЧЕНИЯ МАТЕРИАЛОВ ВЫСОКОЙ ЧИСТОТЫ
- Глава XIII. ПОЛИМЕРНЫЕ МАТЕРИАЛЫ И ИХ ПРИМЕНЕНИЕ В ЭНЕРГЕТИКЕ
- § XIII.1. МЕТОДЫ ПОЛУЧЕНИЯ ПОЛИМЕРОВ
- § XIII.2. СТРОЕНИЕ ПОЛИМЕРОВ
- § XIII.3. СВОЙСТВА ПОЛИМЕРОВ
- § XIII.4. ПРИМЕНЕНИЕ ПОЛИМЕРОВ
- Глава XIV. ХИМИЯ ВОДЫ И ТОПЛИВА. ХИМИЯ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ
- § XIV.1. СТРОЕНИЕ И СВОЙСТВА ВОДЫ
- § XIV.2. ПРИРОДНЫЕ ВОДЫ
- § ХIV.3. ОСНОВНЫЕ МЕТОДЫ ОЧИСТКИ ВОДЫ
- § XIV.4. СОСТАВ И СВОЙСТВА ОРГАНИЧЕСКОГО ТОПЛИВА
- § XIV.5. ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ОБЩЕСТВА
- § XIV.6. ОХРАНА ВОЗДУШНОГО БАССЕЙНА
- § XIV.7. ОХРАНА ВОДНОГО БАССЕЙНА
- Глава XV. ЯДЕРНАЯ ХИМИЯ И РАДИОХИМИЯ
- § XV.1. АТОМНОЕ ЯДРО. РАДИОАКТИВНОСТЬ
- § XV.2. ЯДЕРНЫЕ РЕАКЦИИ
- § XV.3. ЯДЕРНАЯ ЭНЕРГЕТИКА
- § XV.4. ХИМИЧЕСКИЕ СВОЙСТВА РАДИОАКТИВНЫХ ЭЛЕМЕНТОВ
- Глава XVI. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ В ЭНЕРГЕТИКЕ, ЭЛЕКТРОНИКЕ И АВТОМАТИКЕ
- § ХVI.1. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА. ЭЛЕКТРОХИМИЧЕСКИЕ ЭНЕРГОУСТАНОВКИ
- § XVI.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ (ХЕМОТРОНЫ)
- § ХVI.3. ЭЛЕКТРОХИМИЧЕСКАЯ АНОДНАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ
- § XVI.4. ПОЛУЧЕНИЕ И СВОЙСТВА ГАЛЬВАНОПОКРЫТИИ
- ЗАКЛЮЧЕНИЕ