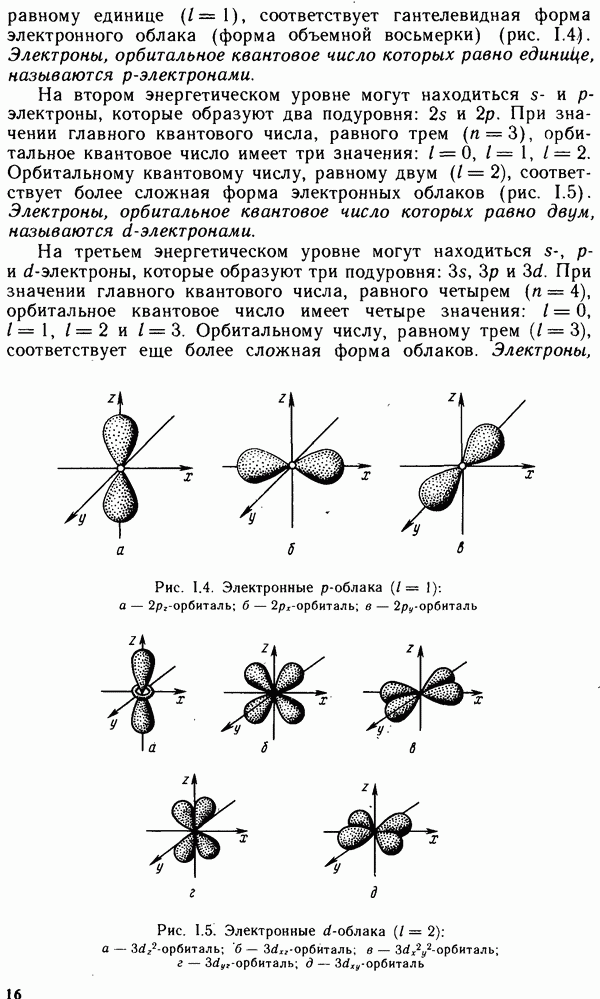
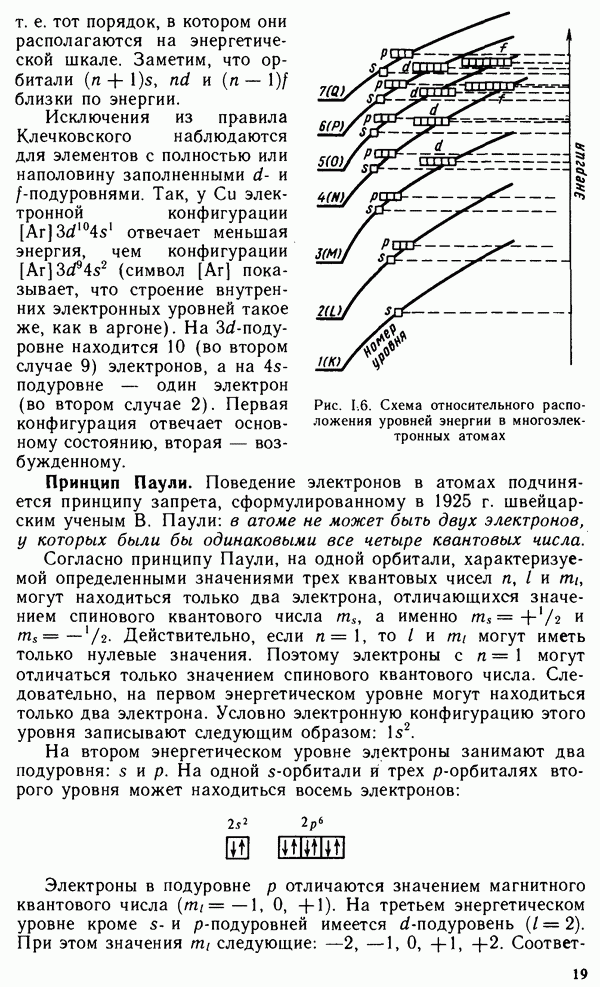
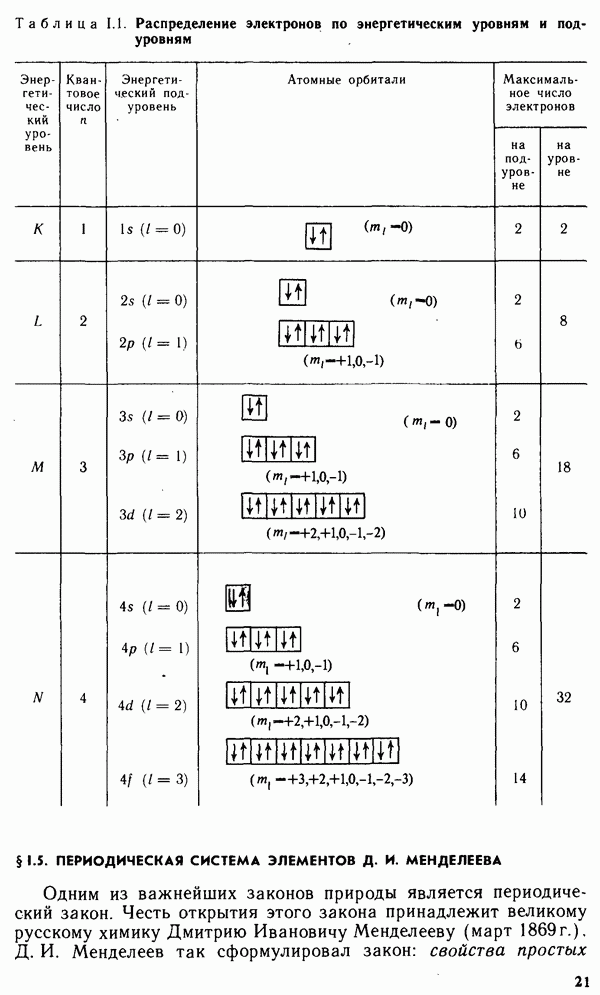
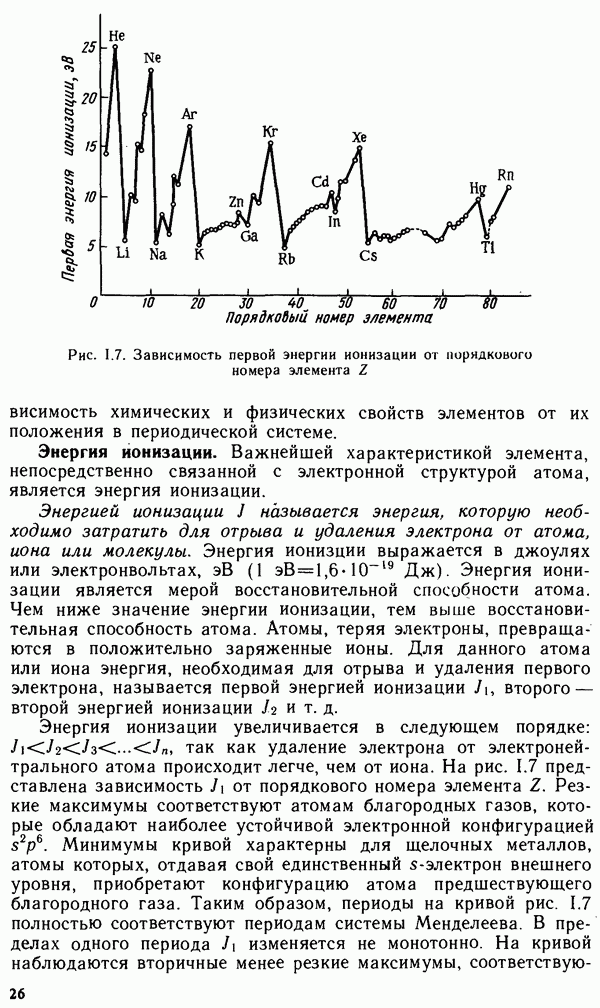
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ IX.4. СВОЙСТВА МЕТАЛЛОВ ГЛАВНЫХ ПОДГРУПП I И II ГРУПП
В главных подгруппах I и И групп периодической системы элементов Д. И. Менделеева расположены  -элементы:
-элементы:  и его электронные аналоги
и его электронные аналоги  — элементы
— элементы  и его электронные аналоги
и его электронные аналоги  — элементы
— элементы 
Элементы подгруппы лития.
Литий, натрий, калий, рубидий, цезий и франций — щелочные металлы, так как гидроксиды натрия и калия издавна называют щелочами.
Атомы щелочных металлов имеют единственный валентный
электрон  и поэтому в соединениях с другими
и поэтому в соединениях с другими
элементами щелочные металлы всегда одновалентны, степень их окисления 
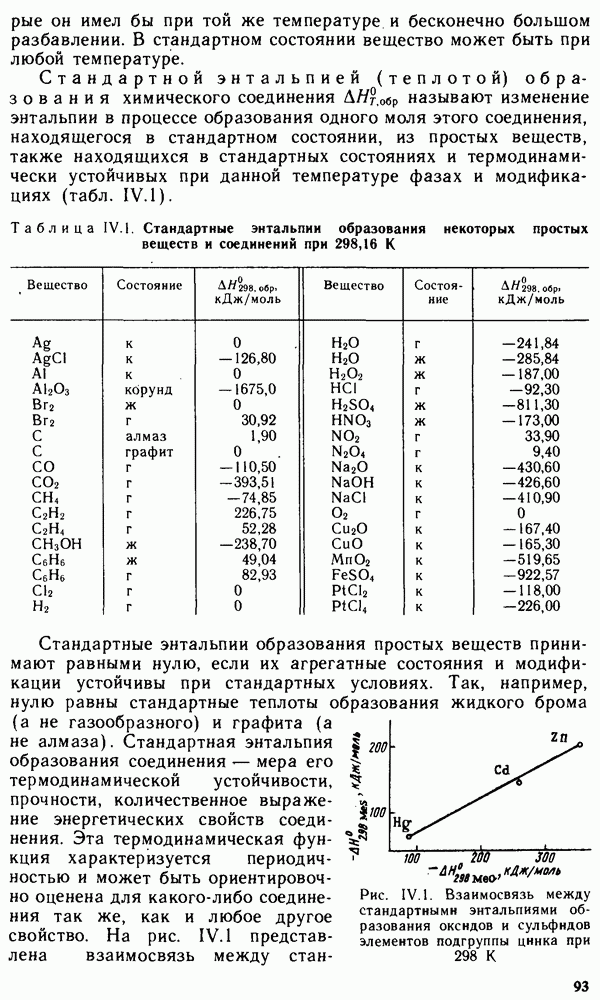
Простые вещества — литий, натрий, калий, рубидий, цезий и франций — мягкие серебристо-белые металлы (за исключением золотисто-желтого цезия). Франций радиоактивен, стабильных изотопов не имеет. Наиболее долгоживущий изотоп  образуется при облучении урана протонами. Свойства франция изучены недостаточно, так как заметных количеств этого металла накопить не удается.
образуется при облучении урана протонами. Свойства франция изучены недостаточно, так как заметных количеств этого металла накопить не удается.
Ниже приведены некоторые константы, характеризующие физико-химические свойства атомов щелочных металлов и соответствующих простых веществ:


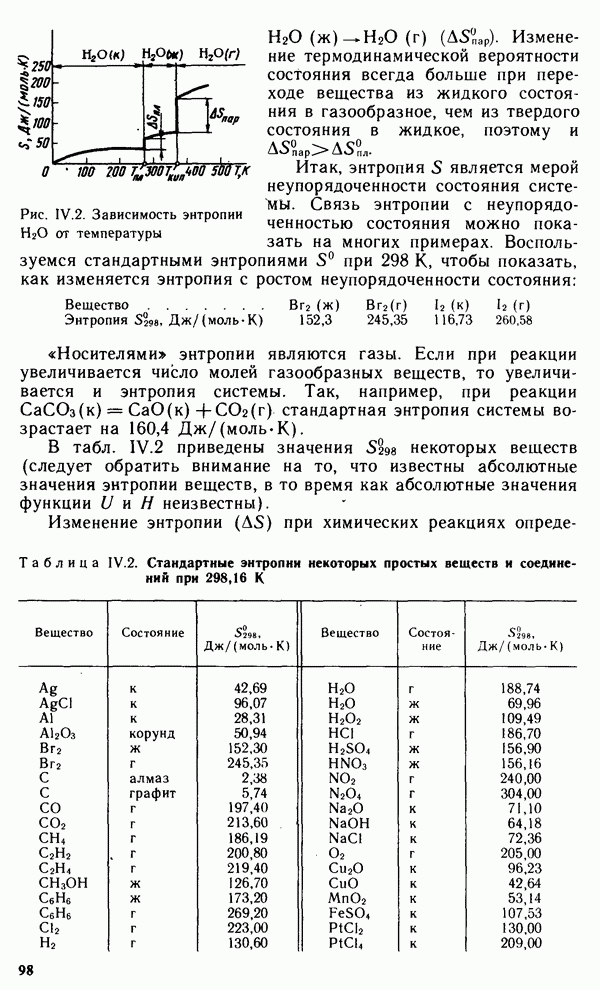
Эти константы показывают, что щелочные металлы относятся к числу легких  и К легче воды) и очень мягких металлов (режутся ножом). Низкие значения энергии ионизации характеризуют высокую восстановительную активность щелочных металлов. Все они энергично разлагают воду, выделяя водород:
и К легче воды) и очень мягких металлов (режутся ножом). Низкие значения энергии ионизации характеризуют высокую восстановительную активность щелочных металлов. Все они энергично разлагают воду, выделяя водород:

Взаимодействие калия с водой сопровождается самовоспламенением выделяющегося водорода, а рубия и цезия — взрывом.
Оксиды и гидроксиды щелочных металлов хорошо растворяются в воде. Гидроксиды  в водных растворах ионизированы практически нацело и являются наиболее сильными основаниями — щелочами.
в водных растворах ионизированы практически нацело и являются наиболее сильными основаниями — щелочами.
Подавляющее большинство солей щелочных металлов хорошо растворимы в воде.
Литий взаимодействует с кислородом и азотом при комнатной температуре, образуя оксид  и нитрид
и нитрид  При температуре
При температуре  литий воспламеняется. При нагревании он реагирует с серой, углеродом, водородом и другими неметаллами, а с галогенами соединяется при обычных условиях. С металлами литий образует интерметаллические соединения.
литий воспламеняется. При нагревании он реагирует с серой, углеродом, водородом и другими неметаллами, а с галогенами соединяется при обычных условиях. С металлами литий образует интерметаллические соединения.
Литий придает сплавам ряд очень ценных свойств. Например, введение  в техническую медь заметно увеличивает ее электрическую проводимость, а у сплавов
в техническую медь заметно увеличивает ее электрическую проводимость, а у сплавов  с содержанием
с содержанием  повышаются коррозионная стойкость и механическая прочность. Важнейшей областью применения лития является атомная энергетика (см. § XV.3).
повышаются коррозионная стойкость и механическая прочность. Важнейшей областью применения лития является атомная энергетика (см. § XV.3).
Натрий при взаимодействии с кислородом образует пероксид  Оксид
Оксид  получают косвенным путем:
получают косвенным путем:

При сплавлении натрия с серой образуются полисульфиды  . С многими металлами натрий образует интерметаллические соединения
. С многими металлами натрий образует интерметаллические соединения  с некоторыми — твердые растворы, а с калием — эвтектический сплав
с некоторыми — твердые растворы, а с калием — эвтектический сплав  с температурой плавления
с температурой плавления  который применяют в атомных реакторах как жидкий теплоноситель, так как он обладает высокими теплоемкостью и теплопроводностью.
который применяют в атомных реакторах как жидкий теплоноситель, так как он обладает высокими теплоемкостью и теплопроводностью.
Калий, рубидий и цезий самовоспламеняются на
воздухе, а также в атмосфере фтора и хлора, а взаимодействие их с жидким бромом сопровождается сильным взрывом.
Вследствие высокой активности рубидия и цезия их атомы легко теряют электроны под действием света (фотоэффект), поэтому  широко применяются для изготовления фотокатодов, используемых в измерительных схемах, устройствах звуковоспроизведения оптических фонограмм, в передающих телевизионных трубках и др.
широко применяются для изготовления фотокатодов, используемых в измерительных схемах, устройствах звуковоспроизведения оптических фонограмм, в передающих телевизионных трубках и др.
Элементы подгруппы бериллия.
Эти элементы, за исключением бериллия и магния, называют щелочноземельными, так как растворы их гидроксидов обладают свойствами щелочей, а оксиды сходны с  и оксидами других металлов, в прошлом называемых «землями».
и оксидами других металлов, в прошлом называемых «землями».
Атомы металлов подгруппы  имеют во внешнем электронном слое два спаренных
имеют во внешнем электронном слое два спаренных  -электрона
-электрона  при возбуждении атомов один
при возбуждении атомов один  -электрон переходит на
-электрон переходит на  -подуровень
-подуровень

поэтому металлы главной подгруппы II группыдвухвалентны и степень их окисления в соединениях с другими элементами равна 
Бериллий — металл серо-стального цвета, твердый и хрупкий. Магний — белый металл; его матовость объясняется образованием на воздухе оксидной пленки. Он мягче и пластичнее бериллия. Кальций и его аналоги  — серебристо-белые металлы, покрывающиеся на воздухе желтоватой пленкой в результате образования оксидов и нитридов.
— серебристо-белые металлы, покрывающиеся на воздухе желтоватой пленкой в результате образования оксидов и нитридов.
Ниже приведены некоторые константы, характеризующие физико-химические свойства атомов рассматриваемых элементов и соответствующих простых веществ:

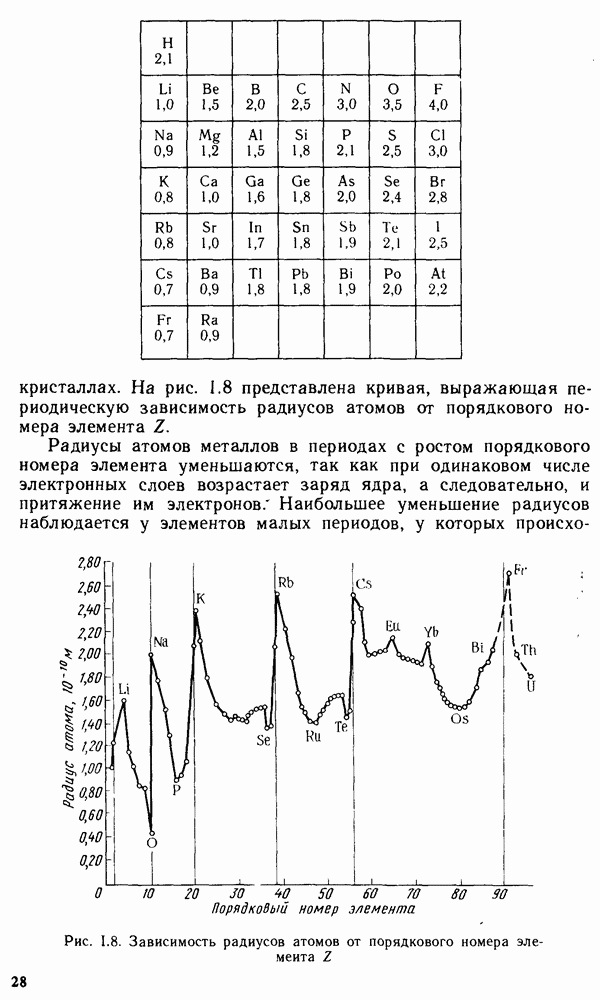
Эти константы показывают, что в ряду рассматриваемых элементов, как и в других главных подгруппах, с увеличением порядкового  номера
номера  энергия ионизации атомов уменьшается, радиусы атомов и ионов увеличиваются, металлические признаки химических элементов усиливаются. Наряду с этим зависимость свойств простых веществ
энергия ионизации атомов уменьшается, радиусы атомов и ионов увеличиваются, металлические признаки химических элементов усиливаются. Наряду с этим зависимость свойств простых веществ  кип, плотность и др.) от
кип, плотность и др.) от  имеет более сложный характер. Это связано с тем, что при переходе от магния к кальцию и от стронция к барию происходит изменение структуры кристаллических решеток металлов:
имеет более сложный характер. Это связано с тем, что при переходе от магния к кальцию и от стронция к барию происходит изменение структуры кристаллических решеток металлов:  кристаллизуются по типу гексагональной решетки (плотнейшая упаковка),
кристаллизуются по типу гексагональной решетки (плотнейшая упаковка),  кубической гранецентрированной, а
кубической гранецентрированной, а  кубической объемно-центрированной.
кубической объемно-центрированной.
Бериллий отличается от  и остальных металлов своей подгруппы высокими температурами плавления и кипения, значительной твердостью, малой электрической проводимостью и меньшим, чем у остальных металлов этой подгруппы, отрицательным значением стандартного электродного потенциала. Таким образом металлические свойства у бериллия выражены слабее, чем у магния и других
и остальных металлов своей подгруппы высокими температурами плавления и кипения, значительной твердостью, малой электрической проводимостью и меньшим, чем у остальных металлов этой подгруппы, отрицательным значением стандартного электродного потенциала. Таким образом металлические свойства у бериллия выражены слабее, чем у магния и других  -металлов II группы. Этим объясняется и до, что ион
-металлов II группы. Этим объясняется и до, что ион  неизвестен ни в растворе, ни в кристаллах. Для бериллия характерны как катионы, так и анионы типа:
неизвестен ни в растворе, ни в кристаллах. Для бериллия характерны как катионы, так и анионы типа: 
По химическим свойствам бериллий во многом сходен с алюминием (диагональное сходство в периодической системе) и является типичным амфотерным элементом. Защитная оксидная пленка препятствует взаимодействию бериллия с водой, но, подобно алюминию,  взаимодействует с водой в присутствии кислот и щелочей, растворяющих оксид бериллия:
взаимодействует с водой в присутствии кислот и щелочей, растворяющих оксид бериллия:

В концентрированных холодных  бериллий, так же как и алюминий, пассивируется.
бериллий, так же как и алюминий, пассивируется.
Соединения бериллия ядовиты!
Бериллий используют для легирования сплавов; добавка его придает сплавам повышенную коррозионную стойкость, высокую прочность и твердость. Наиболее ценными являются сплавы меди с бериллием  (бериллиевые бронзы), содержащие до
(бериллиевые бронзы), содержащие до  Сплавы, легированные бериллием, применяют в самолетостроении, электротехнике и др. Бериллий, являясь высококачественным замедлителем и отражателем нейтронов, широко применяется в высокотемпературных ядерных реакторах. Через тонкие пластины бериллия легко проникают рентгеновские лучи, поэтому его используют для изготовления «окон» рентгеновских трубок.
Сплавы, легированные бериллием, применяют в самолетостроении, электротехнике и др. Бериллий, являясь высококачественным замедлителем и отражателем нейтронов, широко применяется в высокотемпературных ядерных реакторах. Через тонкие пластины бериллия легко проникают рентгеновские лучи, поэтому его используют для изготовления «окон» рентгеновских трубок.
У магния металлические свойства выражены сильнее, чем у бериллия. В частности, он более склонен к образованию ионных связей; ион  вполне устойчив и в растворах, и в кристаллах солей. Магний мягче и пластичнее бериллия.
вполне устойчив и в растворах, и в кристаллах солей. Магний мягче и пластичнее бериллия.
Магний легко окисляется галогенами при комнатной температуре, а при нагревании — серой и азотом. Реакция горения магния сопровождается образованием оксида  тугоплавкого вещества (т. пл. 2800 °С), получившего название жженой магнезии. Мелкокристаллический
тугоплавкого вещества (т. пл. 2800 °С), получившего название жженой магнезии. Мелкокристаллический  химически активен (поглощает
химически активен (поглощает  , растворяется в кислотах), но при сильном прокаливании становится очень твердым и теряет химическую активность.
, растворяется в кислотах), но при сильном прокаливании становится очень твердым и теряет химическую активность.
Гидроксид  проявляет только основные свойства
проявляет только основные свойства  в воде растворяется незначительно (растворимость при
в воде растворяется незначительно (растворимость при 
Магний в основном используется для производства сверхлегких сплавов. Наиболее важный сплав магния — «электрон»  остальное
остальное  благодаря прочности и малой плотности
благодаря прочности и малой плотности  широко применяется в авиастроении и ракетной технике.
широко применяется в авиастроении и ракетной технике.
Щелочноземельные металлы  характеризуются высокой восстановительной активностью и энергично взаимодействуют с большинством неметаллов уже при комнатной температуре. Поэтому щелочноземельные металлы в отличие от
характеризуются высокой восстановительной активностью и энергично взаимодействуют с большинством неметаллов уже при комнатной температуре. Поэтому щелочноземельные металлы в отличие от  хранят под керосином в запаянных сосудах или в плотно закрывающихся металлических банках.
хранят под керосином в запаянных сосудах или в плотно закрывающихся металлических банках.
Оксиды  при взаимодействии с водой образуют растворимые гидроксиды
при взаимодействии с водой образуют растворимые гидроксиды 
Высокая активность щелочноземельных металлов проявляется и в их способности непосредственно соединяться с водородом.
Металлические  применяются не так широко, как
применяются не так широко, как  Кальций применяют при получении сплавов, например сплавы свинца с кальцием используются в аккумуляторах. Стронций применяют при выплавке бронз для их очистки от вредных примесей и в электровакуумной технике (геттер).
Кальций применяют при получении сплавов, например сплавы свинца с кальцием используются в аккумуляторах. Стронций применяют при выплавке бронз для их очистки от вредных примесей и в электровакуумной технике (геттер).
При ядерных испытаниях образуется радиоактивный изотоп стронция  представляющий большую опасность для здоровья и жизни.
представляющий большую опасность для здоровья и жизни.
Применение бария аналогично применению стронция: газопоглотитель (геттер) в вакуумной технике и добавка к некоторым сплавам для освобождения их от растворенных оксидов и сульфидов (барий образует с кислородом и серой нерастворимые в расплавленном металле соединения).
В отличие от ограниченного применения щелочноземельных металлов, вследствие их высокой химической активности, соединения  используются очень широко. Особенно разнообразное применение находят соединения кальция.
используются очень широко. Особенно разнообразное применение находят соединения кальция.
Природные соединения кальция применяются в производстве вяжущих материалов. К вяжущим материалам относятся цемент, гипс, известь и др. Это порошкообразные вещества, которые образуют при смешивании с водой пластичную массу, затвердевающую со временем. Вяжущие материалы применяются в строительном деле для изготовления бетона и приготовления строительных растворов.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- § 1. ПРЕДМЕТ ХИМИИ
- § 2. ЗНАЧЕНИЕ ХИМИИ В ИЗУЧЕНИИ ПРИРОДЫ И РАЗВИТИИ ТЕХНИКИ
- 1. СТРОЕНИЕ ВЕЩЕСТВА
- Глава I. СТРОЕНИЕ АТОМА И СИСТЕМАТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- § 1.2. КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА
- § 1.3. КВАНТОВЫЕ ЧИСЛА И АТОМНЫЕ ОРБИТАЛИ
- § 1.4. МНОГОЭЛЕКТРОННЫЕ АТОМЫ
- § 1.5. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
- § 1.6. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- Глава II. ХИМИЧЕСКАЯ СВЯЗЬ
- § II.1. ОСНОВНЫЕ ВИДЫ И ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ
- § II.2. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ. ВАЛЕНТНОСТЬ
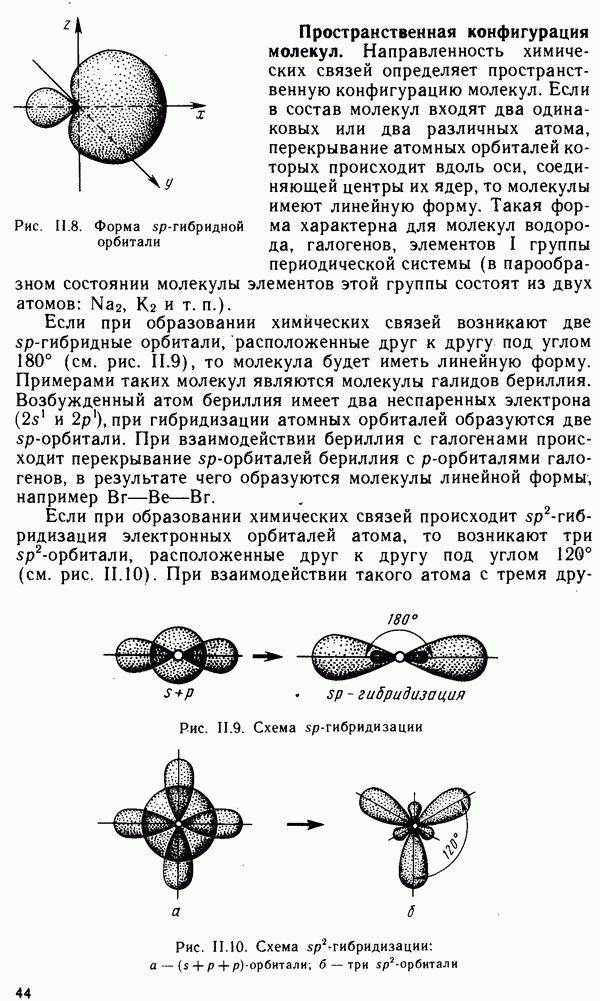
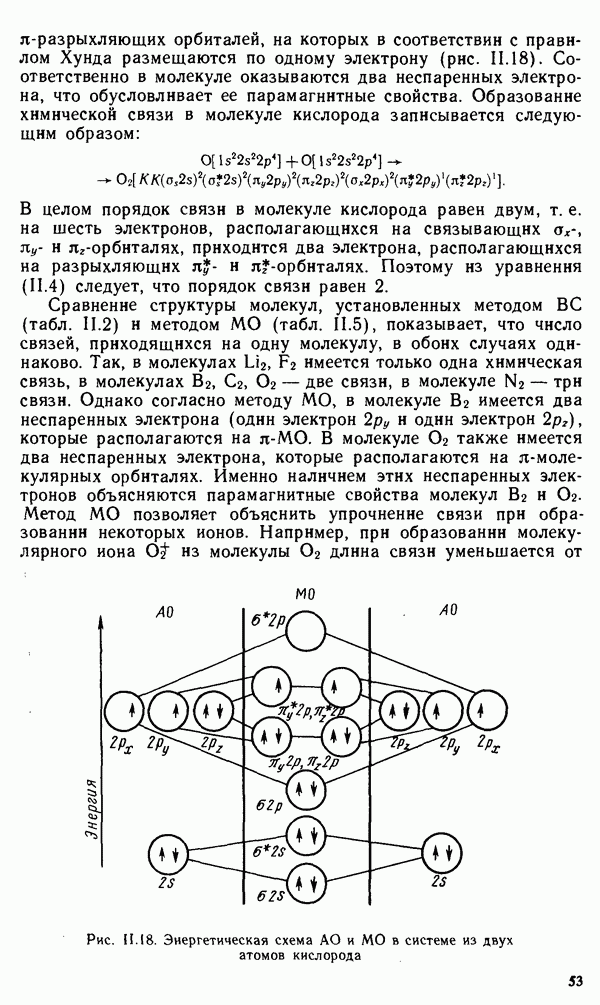
- § II.3. НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. ПРОСТРАНСТВЕННАЯ СТРУКТУРА МОЛЕКУЛ
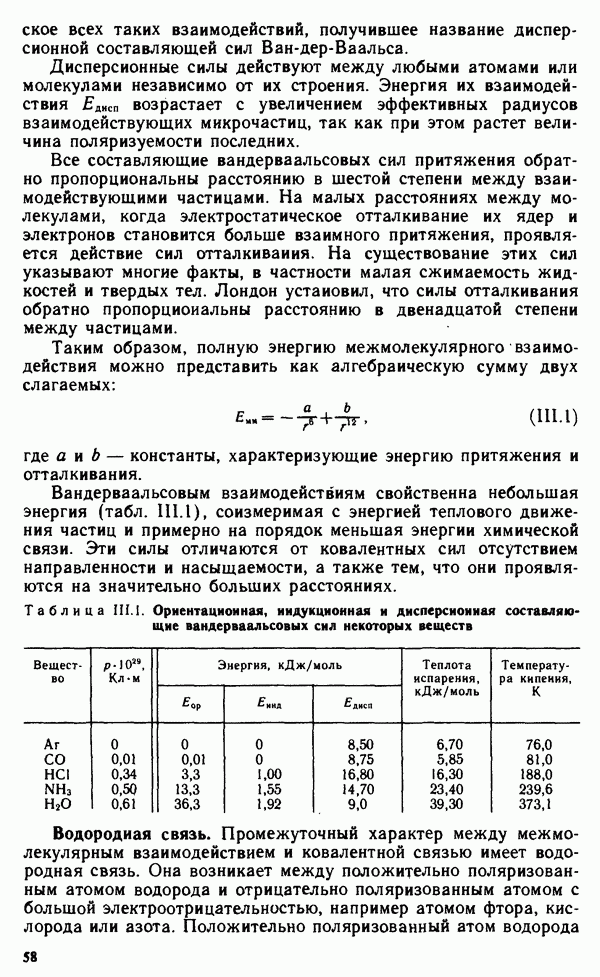
- § 11.4. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
- § 11.5. ЭЛЕКТРОННАЯ СТРУКТУРА НЕКОТОРЫХ МОЛЕКУЛ
- Глава III. ТИПЫ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ. КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- § III.1. ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ
- § III.2. СВОЙСТВА ВЕЩЕСТВ В РАЗЛИЧНЫХ СОСТОЯНИЯХ
- § III.3. СТРОЕНИЕ КРИСТАЛЛОВ. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ТЕЛАХ
- § III.4. МЕТАЛЛЫ, ПОЛУПРОВОДНИКИ И ДИЭЛЕКТРИКИ
- § III.5. РЕАЛЬНЫЕ КРИСТАЛЛЫ
- 2. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
- Глава IV. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ СРОДСТВО
- § IV.2. ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ И ФАЗОВЫХ ПРЕВРАЩЕНИЙ. ТЕРМОХИМИЧЕСКИЕ ЗАКОНЫ
- § IV.3. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
- § IV.4. ЭНТРОПИЯ. НАПРАВЛЕНИЕ И ПРЕДЕЛ ПРОТЕКАНИЯ ПРОЦЕССОВ В ИЗОЛИРОВАННЫХ СИСТЕМАХ
- § IV.5. ЭНЕРГИЯ ГИББСА И ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА ХИМИЧЕСКОЙ РЕАКЦИИ
- Глава V. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- § V.2. СКОРОСТЬ ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ
- § V.3. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- § V.4. ФИЗИЧЕСКИЕ ВОЗДЕЙСТВИЯ НА ХИМИЧЕСКИЕ РЕАКЦИИ. ЦЕПНЫЕ РЕАКЦИИ
- § V.5. КИНЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ О ХИМИЧЕСКОМ РАВНОВЕСИИ
- § V.6. ФАЗОВЫЕ РАВНОВЕСИЯ ПРАВИЛО ФАЗ
- § V.7. АДСОРБЦИОННОЕ РАВНОВЕСИЕ
- § V.8. КАТАЛИЗ
- 3. РАСТВОРЫ ДИСПЕРСНЫЕ СИСТЕМЫ ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- VI.1. ОБЩИЕ ПОНЯТИЯ О РАСТВОРАХ
- § VI.2. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЖИДКИХ РАСТВОРОВ
- § VI.3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ
- § VI.4. ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- § VI.5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
- § VI.6. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- § VI.7. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ
- § VI.8. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ
- Глава VII. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.1. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- § VII.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.3. ПОТЕНЦИАЛЫ МЕТАЛЛИЧЕСКИХ И ГАЗОВЫХ ЭЛЕКТРОДОВ
- § VII.4. ПОТЕНЦИАЛЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ (РЕДОКСИ-) ЭЛЕКТРОДОВ
- § VII.5. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ. ПОЛЯРИЗАЦИЯ
- § VII.6. ЭЛЕКТРОЛИЗ
- Глава VIII. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- § VIII.1. ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ
- § VIII.2. ХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.4. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
- 4. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- Глава IX. ПРОСТЫЕ ВЕЩЕСТВА И ДВОЙНЫЕ СОЕДИНЕНИЯ. КРАТКИЙ ОБЗОР ХИМИЧЕСКИХ СВОЙСТВ s- И р-ЭЛЕМЕНТОВ
- § IX.2. МЕТАЛЛЫ И СПЛАВЫ. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА
- § IX.3. ДВОЙНЫЕ СОЕДИНЕНИЯ
- § IX.4. СВОЙСТВА МЕТАЛЛОВ ГЛАВНЫХ ПОДГРУПП I И II ГРУПП
- § IX.5. СВОЙСТВА р-ЭЛЕМЕНТОВ III ГРУППЫ
- § IX.6. СВОЙСТВА р-ЭЛЕМЕНТОВ IV ГРУППЫ
- § IX.7. СВОЙСТВА р-ЭЛЕМЕНТОВ V, VI И VII ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ
- Глава Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
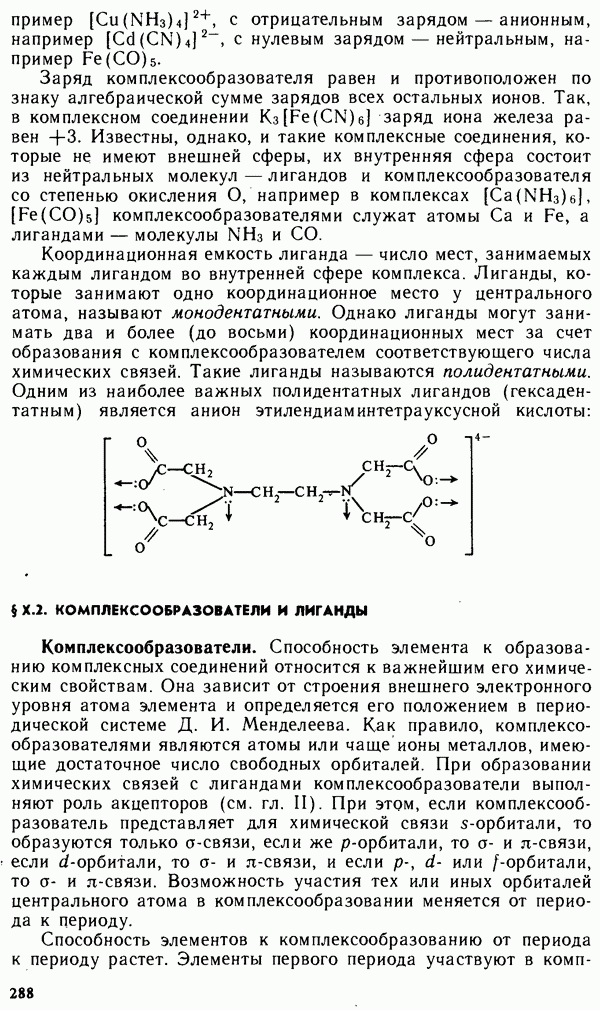
- § Х.1. СТРУКТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИИ
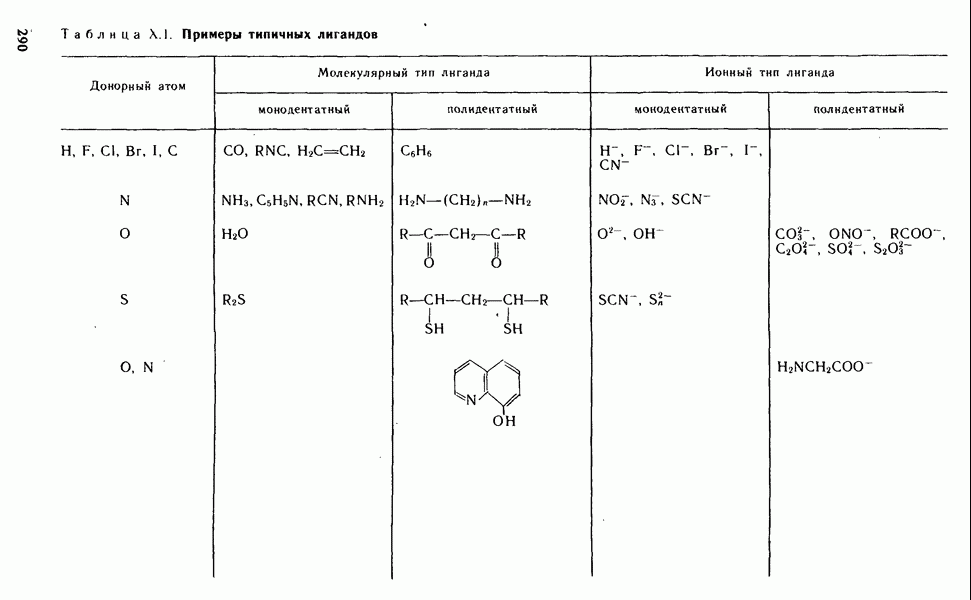
- § Х.2. КОМПЛЕКСООБРАЗОВАТЕЛИ И ЛИГАНДЫ
- § Х.3. НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- § Х.4. МЕТОДЫ РАСЧЕТА ХИМИЧЕСКИХ СВЯЗЕЙ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
- § Х.5. УСТОЙЧИВОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- Глава XI. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- § XI.1. ОСОБЕННОСТИ. ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ И КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- § XI.2. УГЛЕВОДОРОДЫ
- § ХI.3. ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
- 5. СПЕЦИАЛЬНЫЕ ВОПРОСЫ ХИМИИ
- Глава XII. ХИМИЯ КОНСТРУКЦИОННЫХ И ЭЛЕКТРОТЕХНИЧЕСКИХ МАТЕРИАЛОВ
- § XII.2. СВОЙСТВА ПЕРЕХОДНЫХ МЕТАЛЛОВ VIII ГРУППЫ
- § ХII.3. СВОЙСТВА ЭЛЕМЕНТОВ I И II ГРУПП
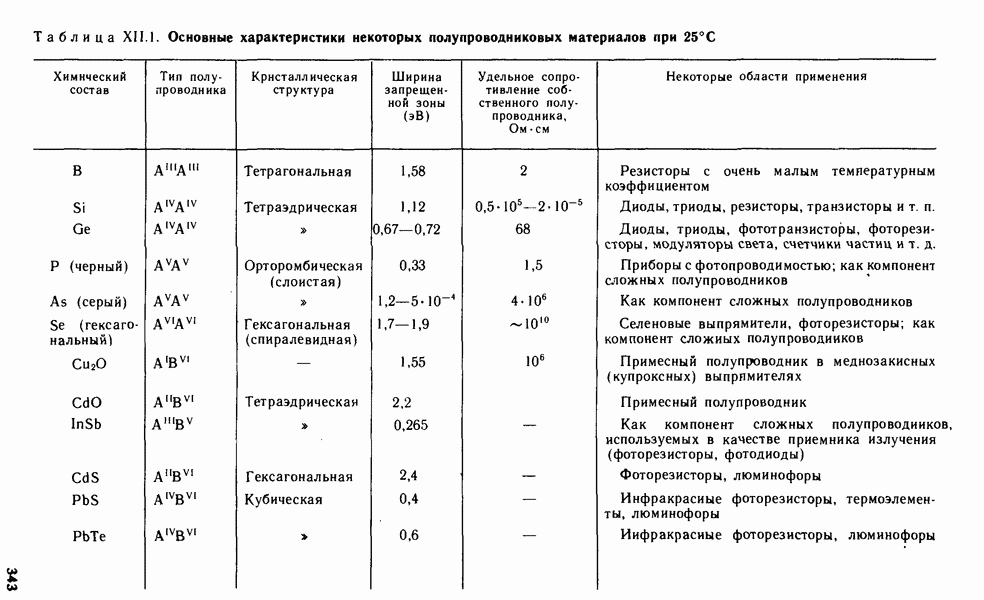
- § XII.4. ХИМИЯ ПОЛУПРОВОДНИКОВЫХ МАТЕРИАЛОВ
- § XII.5. МЕТОДЫ ПОЛУЧЕНИЯ МАТЕРИАЛОВ ВЫСОКОЙ ЧИСТОТЫ
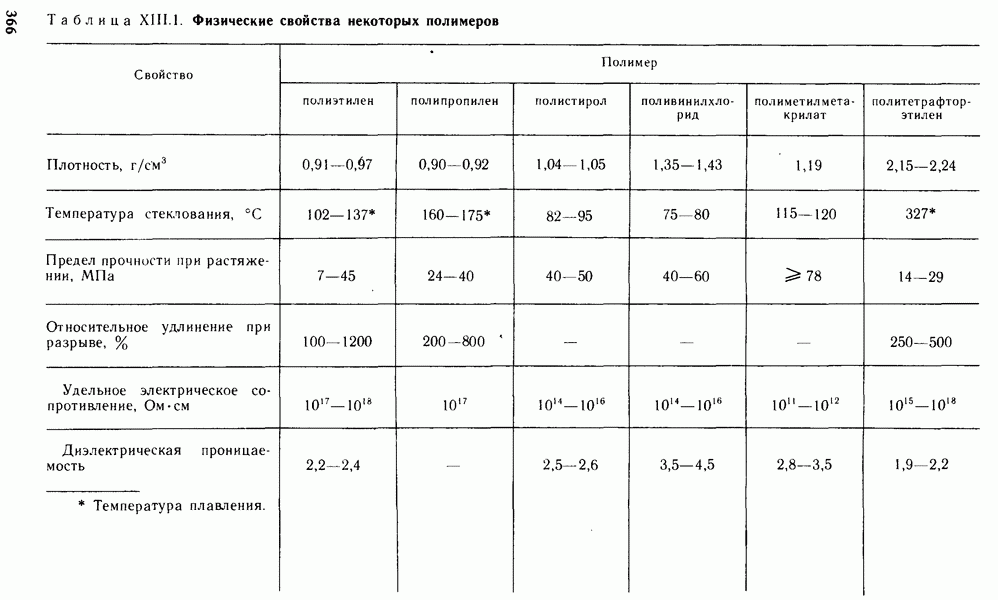
- Глава XIII. ПОЛИМЕРНЫЕ МАТЕРИАЛЫ И ИХ ПРИМЕНЕНИЕ В ЭНЕРГЕТИКЕ
- § XIII.1. МЕТОДЫ ПОЛУЧЕНИЯ ПОЛИМЕРОВ
- § XIII.2. СТРОЕНИЕ ПОЛИМЕРОВ
- § XIII.3. СВОЙСТВА ПОЛИМЕРОВ
- § XIII.4. ПРИМЕНЕНИЕ ПОЛИМЕРОВ
- Глава XIV. ХИМИЯ ВОДЫ И ТОПЛИВА. ХИМИЯ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ
- § XIV.1. СТРОЕНИЕ И СВОЙСТВА ВОДЫ
- § XIV.2. ПРИРОДНЫЕ ВОДЫ
- § ХIV.3. ОСНОВНЫЕ МЕТОДЫ ОЧИСТКИ ВОДЫ
- § XIV.4. СОСТАВ И СВОЙСТВА ОРГАНИЧЕСКОГО ТОПЛИВА
- § XIV.5. ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ОБЩЕСТВА
- § XIV.6. ОХРАНА ВОЗДУШНОГО БАССЕЙНА
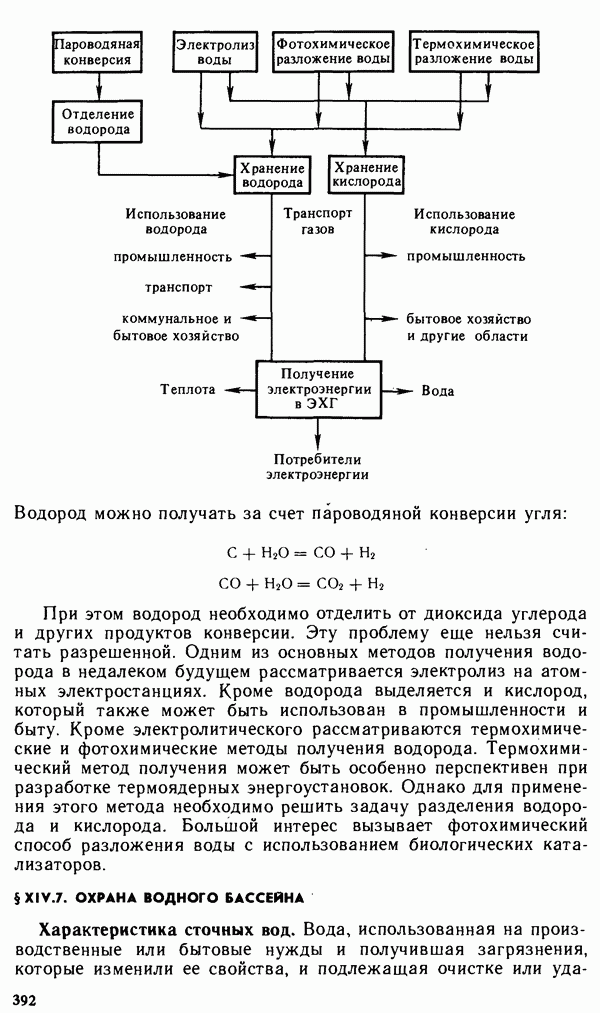
- § XIV.7. ОХРАНА ВОДНОГО БАССЕЙНА
- Глава XV. ЯДЕРНАЯ ХИМИЯ И РАДИОХИМИЯ
- § XV.1. АТОМНОЕ ЯДРО. РАДИОАКТИВНОСТЬ
- § XV.2. ЯДЕРНЫЕ РЕАКЦИИ
- § XV.3. ЯДЕРНАЯ ЭНЕРГЕТИКА
- § XV.4. ХИМИЧЕСКИЕ СВОЙСТВА РАДИОАКТИВНЫХ ЭЛЕМЕНТОВ
- Глава XVI. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ В ЭНЕРГЕТИКЕ, ЭЛЕКТРОНИКЕ И АВТОМАТИКЕ
- § ХVI.1. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА. ЭЛЕКТРОХИМИЧЕСКИЕ ЭНЕРГОУСТАНОВКИ
- § XVI.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ (ХЕМОТРОНЫ)
- § ХVI.3. ЭЛЕКТРОХИМИЧЕСКАЯ АНОДНАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ
- § XVI.4. ПОЛУЧЕНИЕ И СВОЙСТВА ГАЛЬВАНОПОКРЫТИИ
- ЗАКЛЮЧЕНИЕ