| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
1. СТРОЕНИЕ ВЕЩЕСТВА
Глава I. СТРОЕНИЕ АТОМА И СИСТЕМАТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
§ 1.1. ОСНОВНЫЕ СВЕДЕНИЯ О СТРОЕНИИ АТОМА
В далеком прошлом философы Древней Греции предполагали, что вся материя едина, но приобретает те или иные свойства в зависимости от ее «сущности». Некоторые из них утверждали, что вещество состоит из мельчайших частиц, называемых атомами. Научные основы атомно-молекулярного учения были заложены позднее в работах русского ученого М. В. Ломоносова, французских химиков Л. Лавуазье и Ж. Пруста, английского химика Д. Дальтона, итальянского физика А. Авогадро и других исследователей.
Ядерная модель атома.
Одна из первых моделей строения атома была предложены английским физиком
Э. Резерфордом. В опытах по рассеянию а-частиц было показано, что почти вся масса атома сосредоточена в очень малом объеме — положительно заряженном ядре. Согласно модели Резерфорда, вокруг ядра на относительно большом расстоянии непрерывно движутся электроны, причем их число таково, что в целом атом электрически нейтрален. Позднее наличие в атоме тяжелого ядра, окруженного электронами, было подтверждено другими учеными.
Ядро имеет диаметр порядка  и положительный электрический заряд, плотность массы «ядерного вещества» примерно в
и положительный электрический заряд, плотность массы «ядерного вещества» примерно в  раз больше плотности всего вещества. Плотность ядерного электрического заряда также намного превышает плотность заряда вещества в целом, причем здесь также обнаруживается соотношение порядка 1015/1. Положительный ядерный заряд вещества уравновешивается отрицательным зарядом электронов. Величина заряда электрона равна
раз больше плотности всего вещества. Плотность ядерного электрического заряда также намного превышает плотность заряда вещества в целом, причем здесь также обнаруживается соотношение порядка 1015/1. Положительный ядерный заряд вещества уравновешивается отрицательным зарядом электронов. Величина заряда электрона равна  Обычно этот заряд принимают за условную величину, полагая заряд электрона равным —1. Масса электрона те очень мала и составляет
Обычно этот заряд принимают за условную величину, полагая заряд электрона равным —1. Масса электрона те очень мала и составляет  кг. Однако планетарная модель Резерфорда противоречила факту устойчивого существования атомов. В результате ускоренного движения электрона расходуется энергия его электростатического взаимодействия с ядром и согласно расчетам через
кг. Однако планетарная модель Резерфорда противоречила факту устойчивого существования атомов. В результате ускоренного движения электрона расходуется энергия его электростатического взаимодействия с ядром и согласно расчетам через  с электрон должен упасть на ядро.
с электрон должен упасть на ядро.
Атомные спектры.
Согласно модели Резерфорда, энергия атома должна уменьшаться непрерывно за счет излучения, образующего сплошной спектр. Однако экспериментально установлено, что все атомные спектры имеют дискретный (линейчатый) характер. Спектр служит одной из важнейших характеристик атома и отражает его внутреннее строение. На рис. 1.1 приведен линейчатый спектр водорода. В видимой области спектра атома водорода имеются только четыре линии, они обозначаются  . В прилегающей к видимой ультрафиолетовой области имеется еще несколько линий, которые вместе с указанными четырьмя образуют серию линий. Волновые числа линий этой серии выражаются формулой
. В прилегающей к видимой ультрафиолетовой области имеется еще несколько линий, которые вместе с указанными четырьмя образуют серию линий. Волновые числа линий этой серии выражаются формулой

где  — волновое число, равное
— волновое число, равное  (к — длина волны), т. е. оно равно числу волн, укладывающихся на 1 см;
(к — длина волны), т. е. оно равно числу волн, укладывающихся на 1 см;  — постоянная
— постоянная

Рис. 1.1. Видимый спектр атомарного водорода
Ридберга, равная  целое число, которое может принимать значения 3, 4,
целое число, которое может принимать значения 3, 4,
При исследовании спектра водорода в дальней ультрафиолетовой и инфракрасной областях было обнаружено еще несколько серий линий, волновые числа которых выражает общая формула

где  — целые числа.
— целые числа.
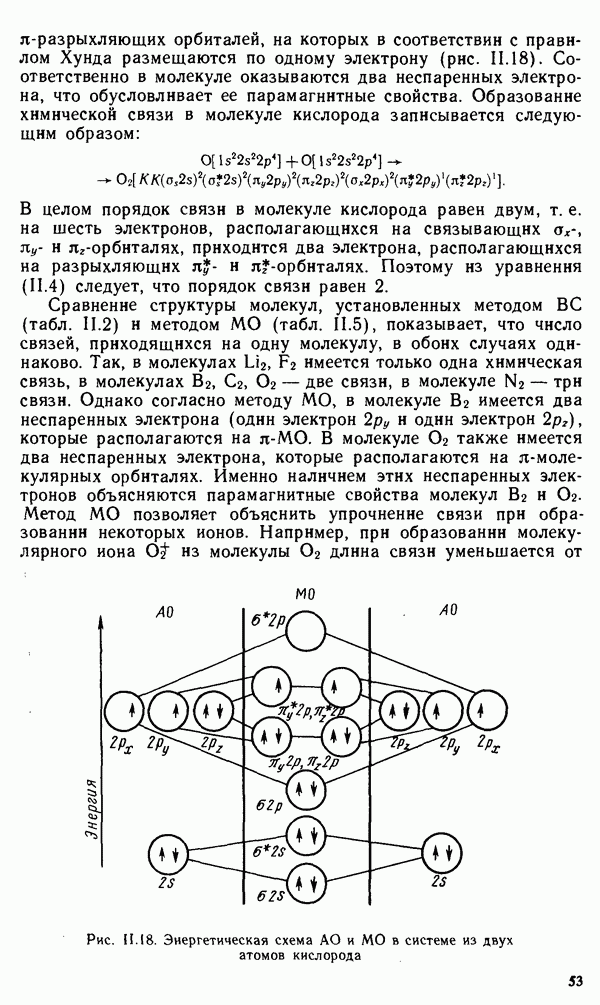
Серии линий были найдены и в спектрах атомов всех других элементов. Однако эти спектры являются более сложными. Так, например, в спектре атома железа насчитывается более 5000 линий, которые, объединяясь в отдельные серии, накладываются друг на друга и усложняют общий вид спектра.
Для объяснения особенностей спектров нагретых тел немецким ученым М. Планком была предложена теория, основанная на предположении, что энергия не излучается атомами непрерывно, а испускается отдельными мельчайшими неделимыми порциями — квантами, величина которых зависит от частоты излучаемого света, а именно

где Е — энергия кванта;  — постоянная Планка, равная
— постоянная Планка, равная  — частота колебаний, равная отношению скорости света с к длине волны.
— частота колебаний, равная отношению скорости света с к длине волны.
Уравнение (1.3) называется уравнением Планка. Оно выражает один из основных законов природы. Согласно этому уравнению, энергия тела может меняться на величины, кратные  подобно тому как электрический заряд может меняться лишь на величину, кратную заряду электрона. Излучая квант света, атом переходит из одного энергетического состояния в другое.
подобно тому как электрический заряд может меняться лишь на величину, кратную заряду электрона. Излучая квант света, атом переходит из одного энергетического состояния в другое.
Теория строения атома водорода по Бору.
На основе модели Резерфорда, учения Эйнштейна о световых квантах (1905), квантовой теории излучения Планка (1900) датским физиком Н. Бором в 1913 г. была предложена теория строения атома водорода. Эта теория позволила объяснить свойства атома и в первую очередь происхождение линий спектра. Бор предположил, что движение электрона в атоме ограничено индивидуальной устойчивой орбитой. До тех пор, пока электрон находится на этой орбите, он не излучает энергии. Если длина круговой орбиты радиусом  равна
равна  то условие устойчивости орбиты следующее:
то условие устойчивости орбиты следующее:

где  — радиус орбиты, на длине которой укладывается
— радиус орбиты, на длине которой укладывается  длин волн. Целое число
длин волн. Целое число  было названо квантовым числом орбиты. Подставив значение к (длины волны электрона), можно определить значение
было названо квантовым числом орбиты. Подставив значение к (длины волны электрона), можно определить значение  Радиус самой внутренней орбиты атома водорода обычно называется боровским радиусом и
Радиус самой внутренней орбиты атома водорода обычно называется боровским радиусом и
обозначается  . При этом
. При этом  нм. Радиусы других орбит определяют с помощью соотношения
нм. Радиусы других орбит определяют с помощью соотношения  Следовательно, расстояния между соседними орбитами постоянно возрастают. Разным разрешенным орбитам (т. е. орбитам, отвечающим условиям постулата Бора) соответствуют разные уровни энергии электронов.
Следовательно, расстояния между соседними орбитами постоянно возрастают. Разным разрешенным орбитам (т. е. орбитам, отвечающим условиям постулата Бора) соответствуют разные уровни энергии электронов.
Квантовое состояние с наименьшей энергией  называют основным, остальные квантовые состояния с большими уровнями энергии
называют основным, остальные квантовые состояния с большими уровнями энергии  называют возбужденными.
называют возбужденными.
При переходе электрона с верхнего уровня на нижний выделяется энергия. Если квантовое число начального состояния (с более высокой энергией  равно
равно  , а квантовое число конечного состояния (с более низкой энергией
, а квантовое число конечного состояния (с более низкой энергией  равно то
равно то

где  — частота электромагнитного излучения;
— частота электромагнитного излучения;  — постоянная Планка.
— постоянная Планка.
Итак, при переходе электрона из одного состояния в другое выделяется энергия в виде излучения. Это объясняет происхождение атомных спектров. Результаты расчетов спектра атома водорода по теории Бора хорошо совпали с экспериментальными данными. Дальнейшие исследования подтвердили идеи Бора о дискретности энергетических уровней в атомах.
Однако теории Бора свойственны и существенные недостатки. Она непригодна для объяснения - строения сложных атомов, начиная с гелия. Даже для атома водорода теория Бора не смогла объяснить тонкую структуру линейчатого спектра. Оказалось, что линии спектра атома представляют собой совокупность близко расположенных друг к другу отдельных линий. Теория Бора не могла предсказать поведения атома водорода в магнитном поле. Возникла необходимость изменить представ-, ление об электроне как о микроскопической заряженной частице, подчиняющейся тем же законам, каким подчиняются, макроскопические тела. Необходимо было разработать новую теорию, применимую к микрочастицам.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- § 1. ПРЕДМЕТ ХИМИИ
- § 2. ЗНАЧЕНИЕ ХИМИИ В ИЗУЧЕНИИ ПРИРОДЫ И РАЗВИТИИ ТЕХНИКИ
- 1. СТРОЕНИЕ ВЕЩЕСТВА
- Глава I. СТРОЕНИЕ АТОМА И СИСТЕМАТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- § 1.2. КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА
- § 1.3. КВАНТОВЫЕ ЧИСЛА И АТОМНЫЕ ОРБИТАЛИ
- § 1.4. МНОГОЭЛЕКТРОННЫЕ АТОМЫ
- § 1.5. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
- § 1.6. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- Глава II. ХИМИЧЕСКАЯ СВЯЗЬ
- § II.1. ОСНОВНЫЕ ВИДЫ И ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ
- § II.2. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ. ВАЛЕНТНОСТЬ
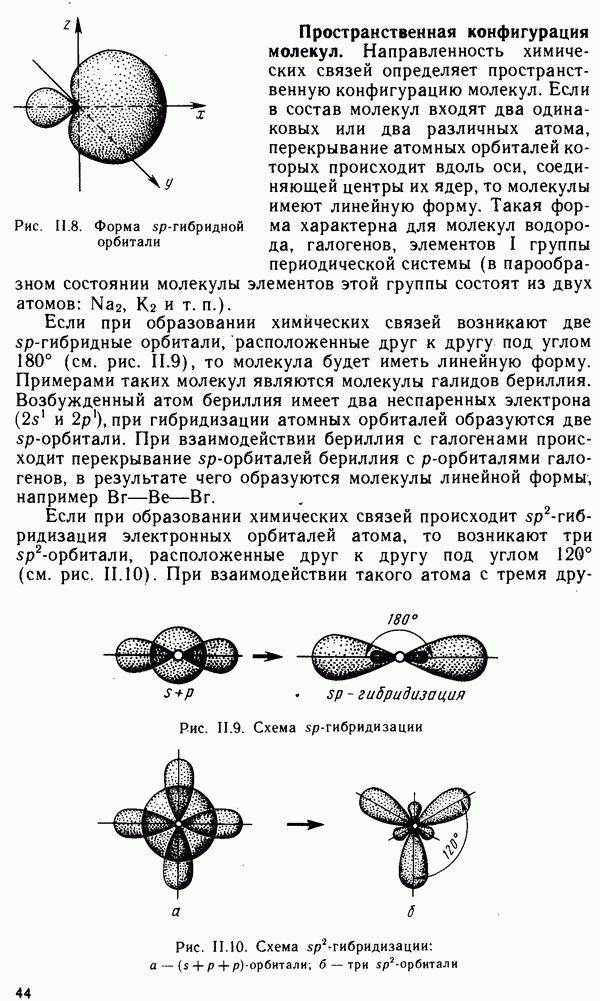
- § II.3. НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. ПРОСТРАНСТВЕННАЯ СТРУКТУРА МОЛЕКУЛ
- § 11.4. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
- § 11.5. ЭЛЕКТРОННАЯ СТРУКТУРА НЕКОТОРЫХ МОЛЕКУЛ
- Глава III. ТИПЫ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ. КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- § III.1. ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ
- § III.2. СВОЙСТВА ВЕЩЕСТВ В РАЗЛИЧНЫХ СОСТОЯНИЯХ
- § III.3. СТРОЕНИЕ КРИСТАЛЛОВ. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ТЕЛАХ
- § III.4. МЕТАЛЛЫ, ПОЛУПРОВОДНИКИ И ДИЭЛЕКТРИКИ
- § III.5. РЕАЛЬНЫЕ КРИСТАЛЛЫ
- 2. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
- Глава IV. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ СРОДСТВО
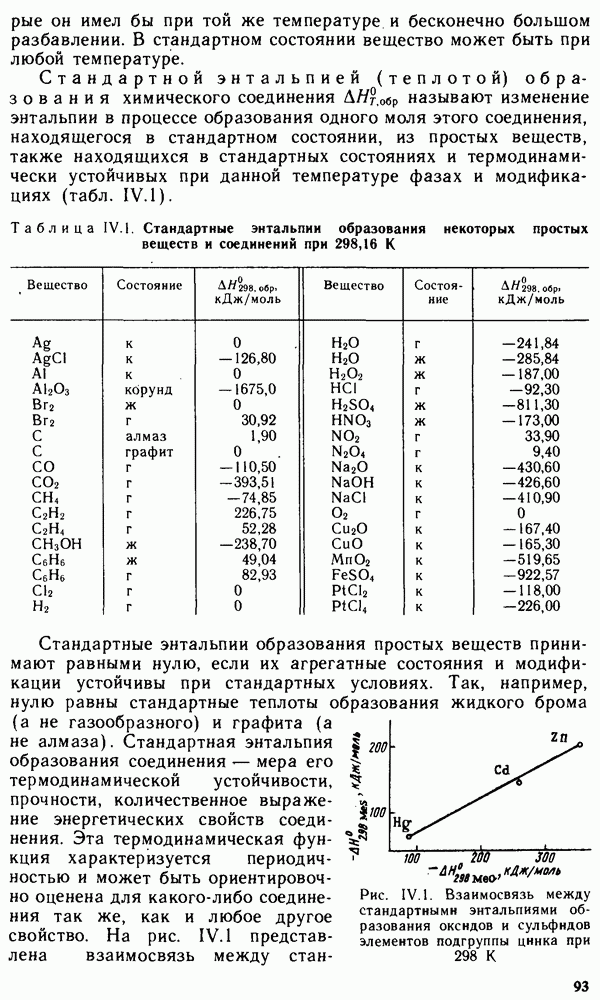
- § IV.2. ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ И ФАЗОВЫХ ПРЕВРАЩЕНИЙ. ТЕРМОХИМИЧЕСКИЕ ЗАКОНЫ
- § IV.3. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
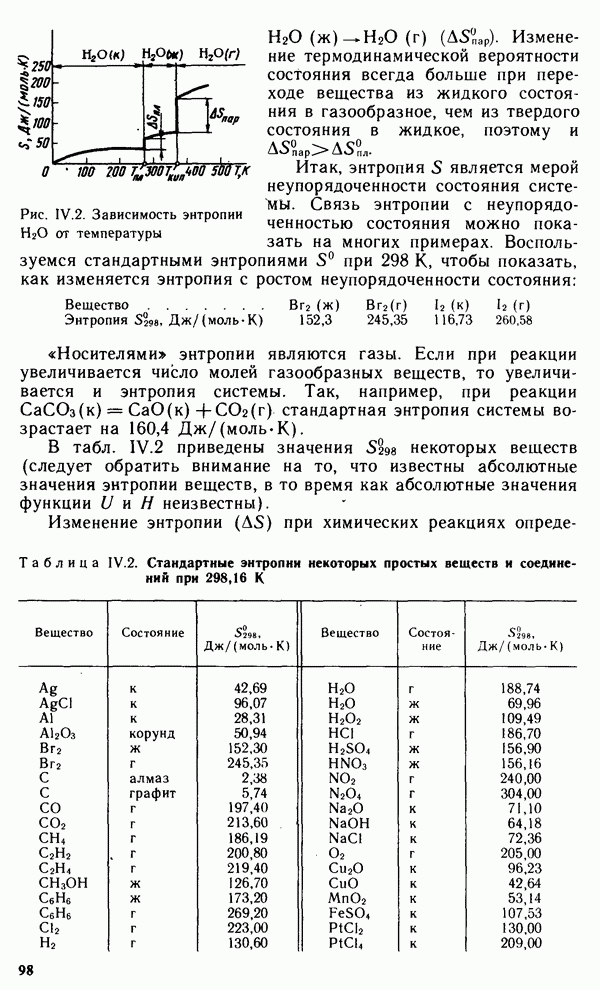
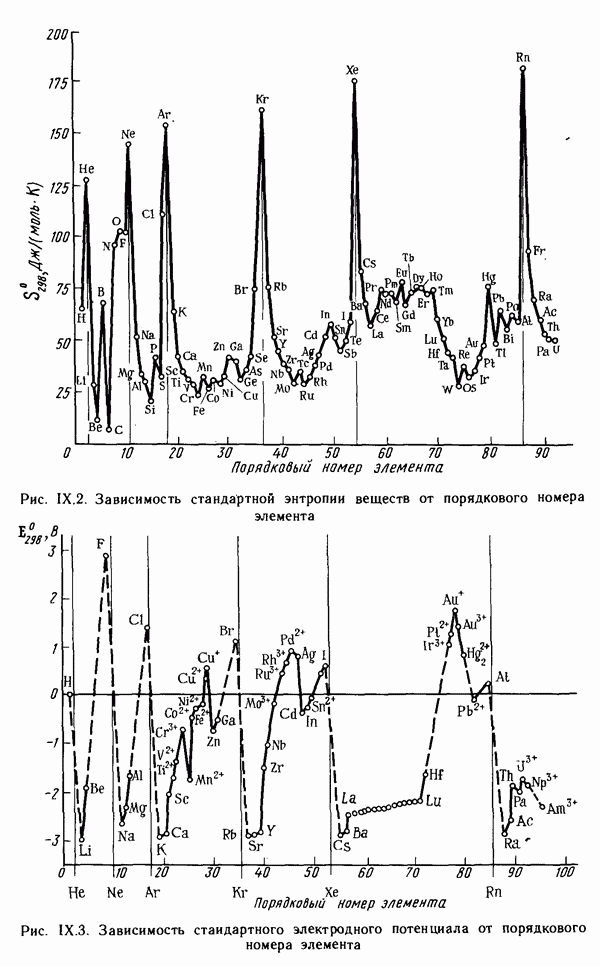
- § IV.4. ЭНТРОПИЯ. НАПРАВЛЕНИЕ И ПРЕДЕЛ ПРОТЕКАНИЯ ПРОЦЕССОВ В ИЗОЛИРОВАННЫХ СИСТЕМАХ
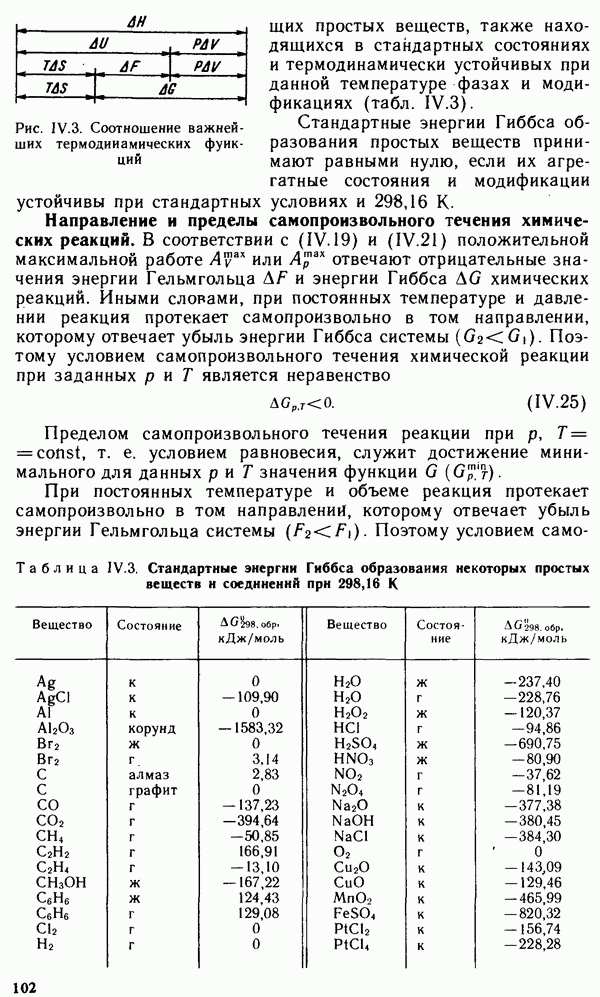
- § IV.5. ЭНЕРГИЯ ГИББСА И ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА ХИМИЧЕСКОЙ РЕАКЦИИ
- Глава V. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- § V.2. СКОРОСТЬ ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ
- § V.3. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
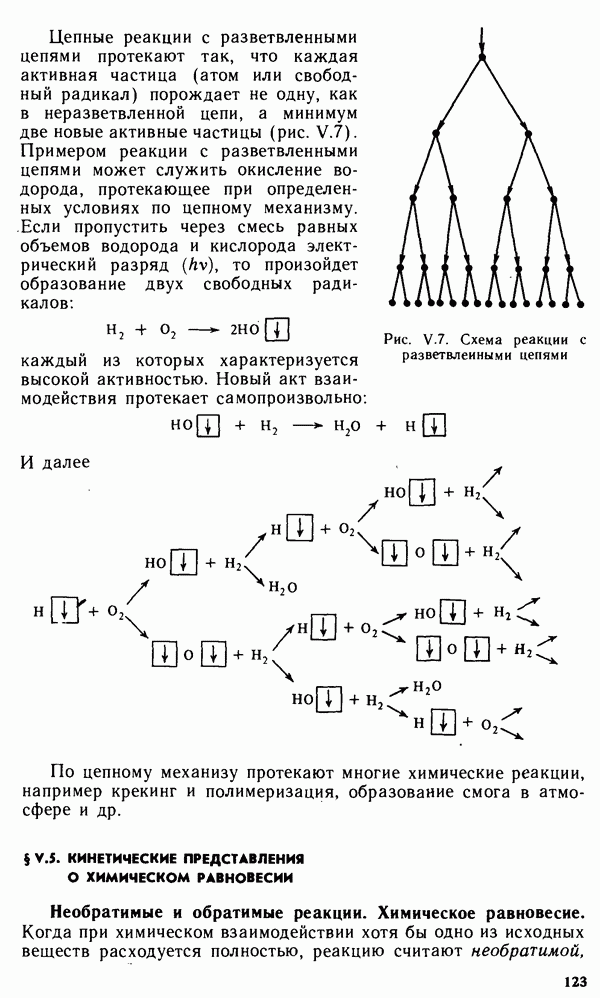
- § V.4. ФИЗИЧЕСКИЕ ВОЗДЕЙСТВИЯ НА ХИМИЧЕСКИЕ РЕАКЦИИ. ЦЕПНЫЕ РЕАКЦИИ
- § V.5. КИНЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ О ХИМИЧЕСКОМ РАВНОВЕСИИ
- § V.6. ФАЗОВЫЕ РАВНОВЕСИЯ ПРАВИЛО ФАЗ
- § V.7. АДСОРБЦИОННОЕ РАВНОВЕСИЕ
- § V.8. КАТАЛИЗ
- 3. РАСТВОРЫ ДИСПЕРСНЫЕ СИСТЕМЫ ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- VI.1. ОБЩИЕ ПОНЯТИЯ О РАСТВОРАХ
- § VI.2. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЖИДКИХ РАСТВОРОВ
- § VI.3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ
- § VI.4. ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- § VI.5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
- § VI.6. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- § VI.7. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ
- § VI.8. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ
- Глава VII. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.1. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- § VII.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.3. ПОТЕНЦИАЛЫ МЕТАЛЛИЧЕСКИХ И ГАЗОВЫХ ЭЛЕКТРОДОВ
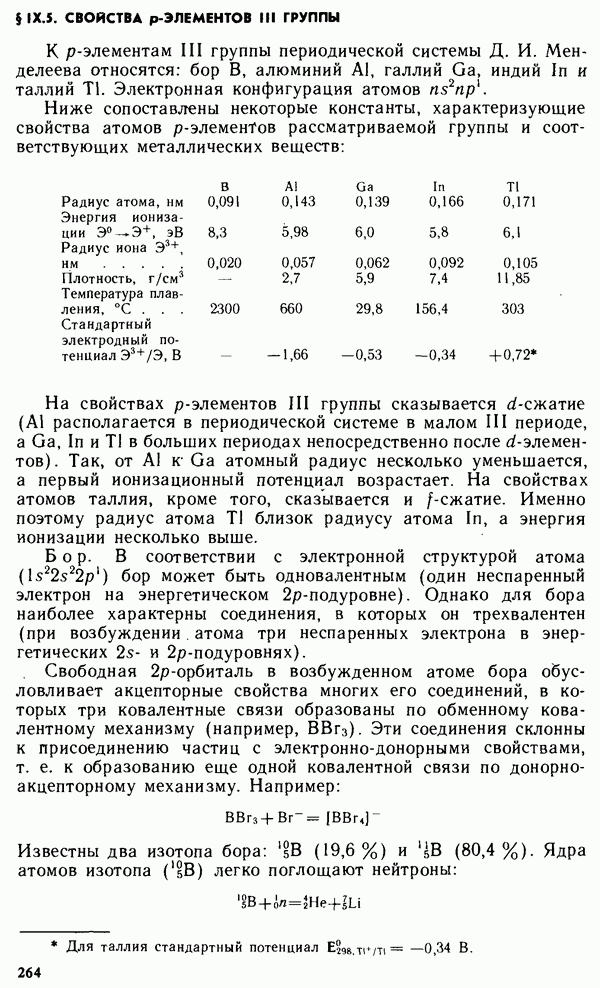
- § VII.4. ПОТЕНЦИАЛЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ (РЕДОКСИ-) ЭЛЕКТРОДОВ
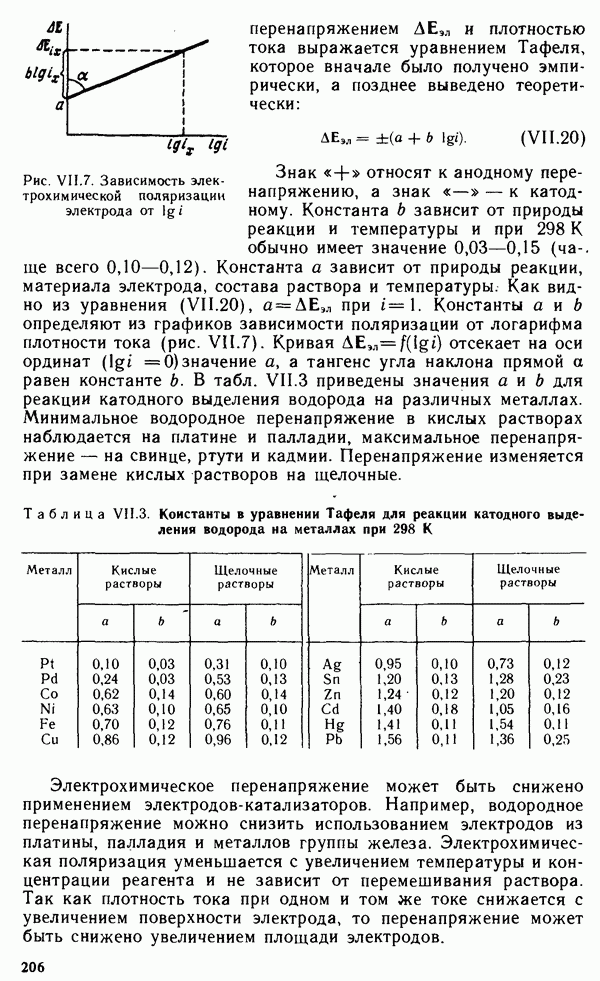
- § VII.5. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ. ПОЛЯРИЗАЦИЯ
- § VII.6. ЭЛЕКТРОЛИЗ
- Глава VIII. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- § VIII.1. ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ
- § VIII.2. ХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.4. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
- 4. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- Глава IX. ПРОСТЫЕ ВЕЩЕСТВА И ДВОЙНЫЕ СОЕДИНЕНИЯ. КРАТКИЙ ОБЗОР ХИМИЧЕСКИХ СВОЙСТВ s- И р-ЭЛЕМЕНТОВ
- § IX.2. МЕТАЛЛЫ И СПЛАВЫ. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА
- § IX.3. ДВОЙНЫЕ СОЕДИНЕНИЯ
- § IX.4. СВОЙСТВА МЕТАЛЛОВ ГЛАВНЫХ ПОДГРУПП I И II ГРУПП
- § IX.5. СВОЙСТВА р-ЭЛЕМЕНТОВ III ГРУППЫ
- § IX.6. СВОЙСТВА р-ЭЛЕМЕНТОВ IV ГРУППЫ
- § IX.7. СВОЙСТВА р-ЭЛЕМЕНТОВ V, VI И VII ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ
- Глава Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
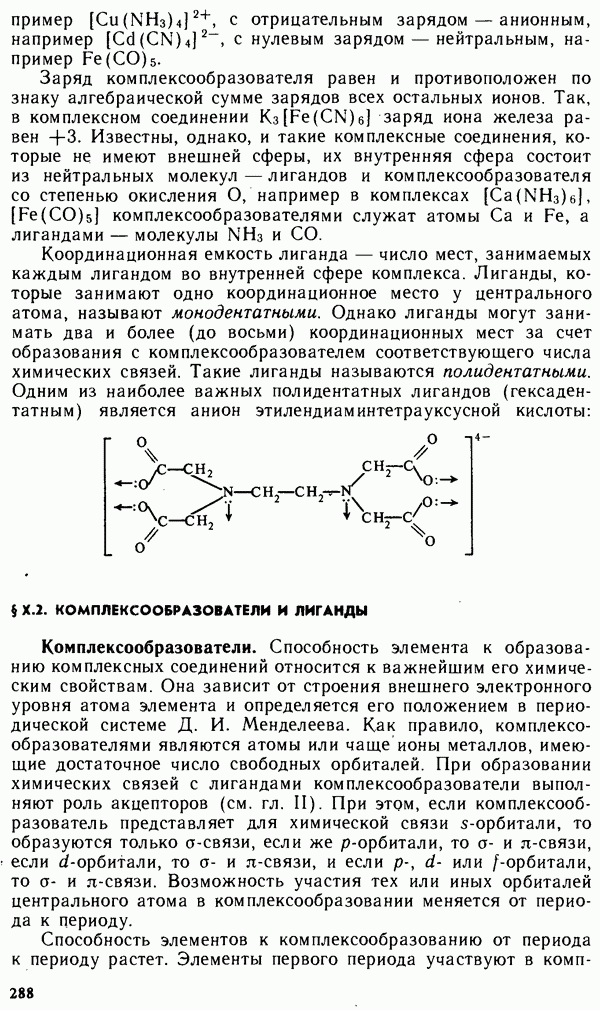
- § Х.1. СТРУКТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИИ
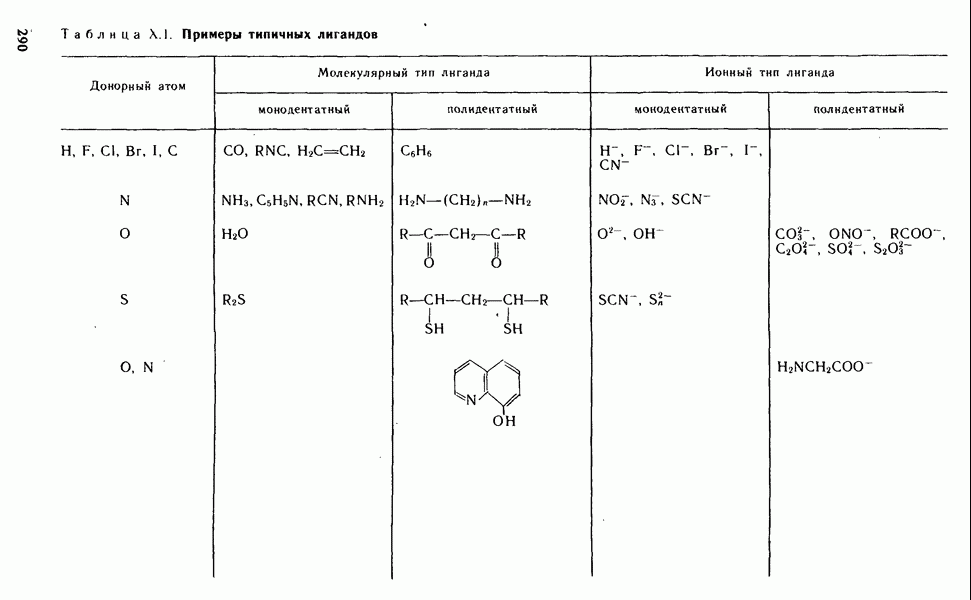
- § Х.2. КОМПЛЕКСООБРАЗОВАТЕЛИ И ЛИГАНДЫ
- § Х.3. НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- § Х.4. МЕТОДЫ РАСЧЕТА ХИМИЧЕСКИХ СВЯЗЕЙ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
- § Х.5. УСТОЙЧИВОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- Глава XI. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- § XI.1. ОСОБЕННОСТИ. ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ И КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- § XI.2. УГЛЕВОДОРОДЫ
- § ХI.3. ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
- 5. СПЕЦИАЛЬНЫЕ ВОПРОСЫ ХИМИИ
- Глава XII. ХИМИЯ КОНСТРУКЦИОННЫХ И ЭЛЕКТРОТЕХНИЧЕСКИХ МАТЕРИАЛОВ
- § XII.2. СВОЙСТВА ПЕРЕХОДНЫХ МЕТАЛЛОВ VIII ГРУППЫ
- § ХII.3. СВОЙСТВА ЭЛЕМЕНТОВ I И II ГРУПП
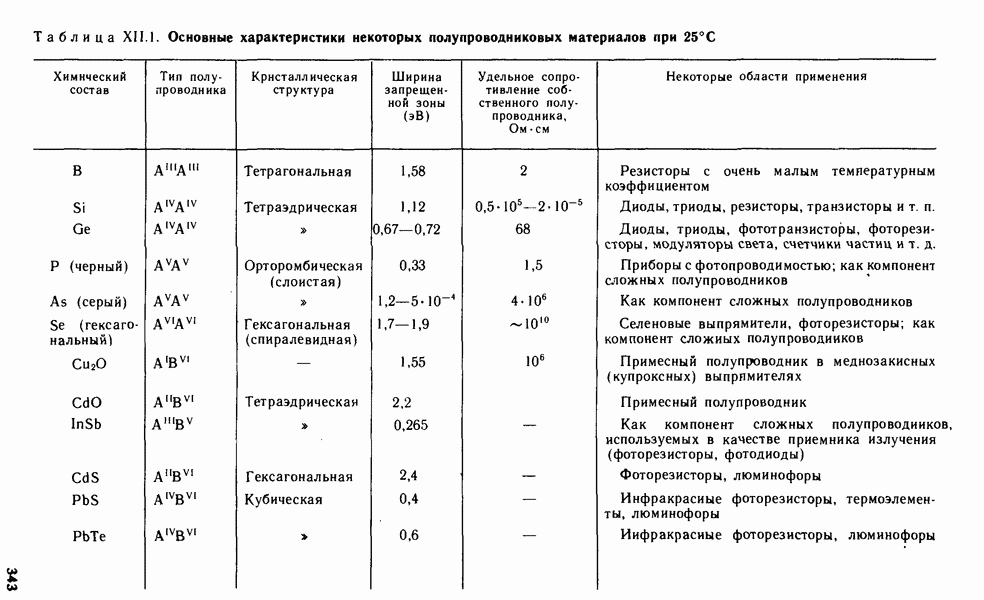
- § XII.4. ХИМИЯ ПОЛУПРОВОДНИКОВЫХ МАТЕРИАЛОВ
- § XII.5. МЕТОДЫ ПОЛУЧЕНИЯ МАТЕРИАЛОВ ВЫСОКОЙ ЧИСТОТЫ
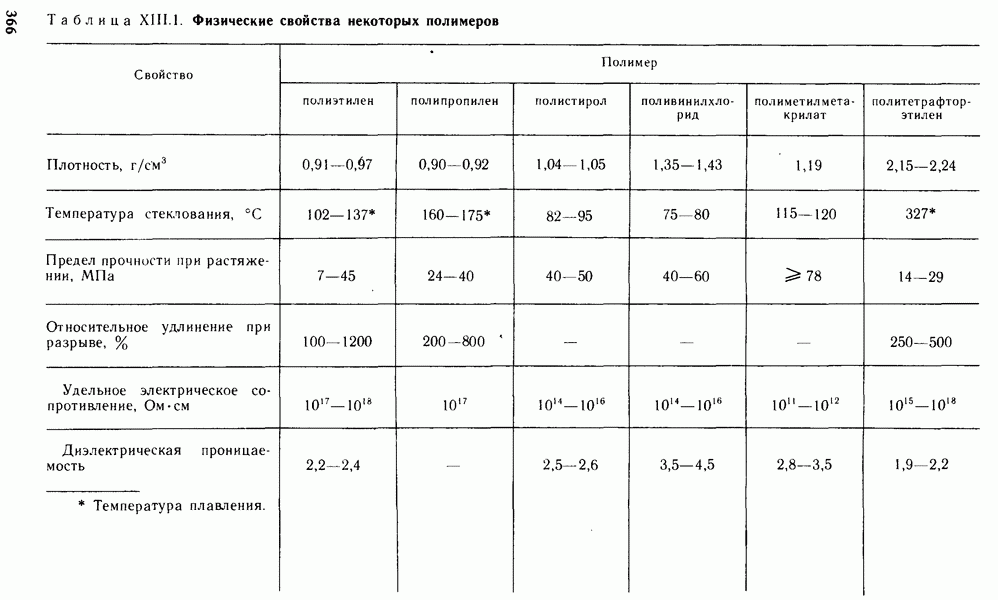
- Глава XIII. ПОЛИМЕРНЫЕ МАТЕРИАЛЫ И ИХ ПРИМЕНЕНИЕ В ЭНЕРГЕТИКЕ
- § XIII.1. МЕТОДЫ ПОЛУЧЕНИЯ ПОЛИМЕРОВ
- § XIII.2. СТРОЕНИЕ ПОЛИМЕРОВ
- § XIII.3. СВОЙСТВА ПОЛИМЕРОВ
- § XIII.4. ПРИМЕНЕНИЕ ПОЛИМЕРОВ
- Глава XIV. ХИМИЯ ВОДЫ И ТОПЛИВА. ХИМИЯ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ
- § XIV.1. СТРОЕНИЕ И СВОЙСТВА ВОДЫ
- § XIV.2. ПРИРОДНЫЕ ВОДЫ
- § ХIV.3. ОСНОВНЫЕ МЕТОДЫ ОЧИСТКИ ВОДЫ
- § XIV.4. СОСТАВ И СВОЙСТВА ОРГАНИЧЕСКОГО ТОПЛИВА
- § XIV.5. ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ОБЩЕСТВА
- § XIV.6. ОХРАНА ВОЗДУШНОГО БАССЕЙНА
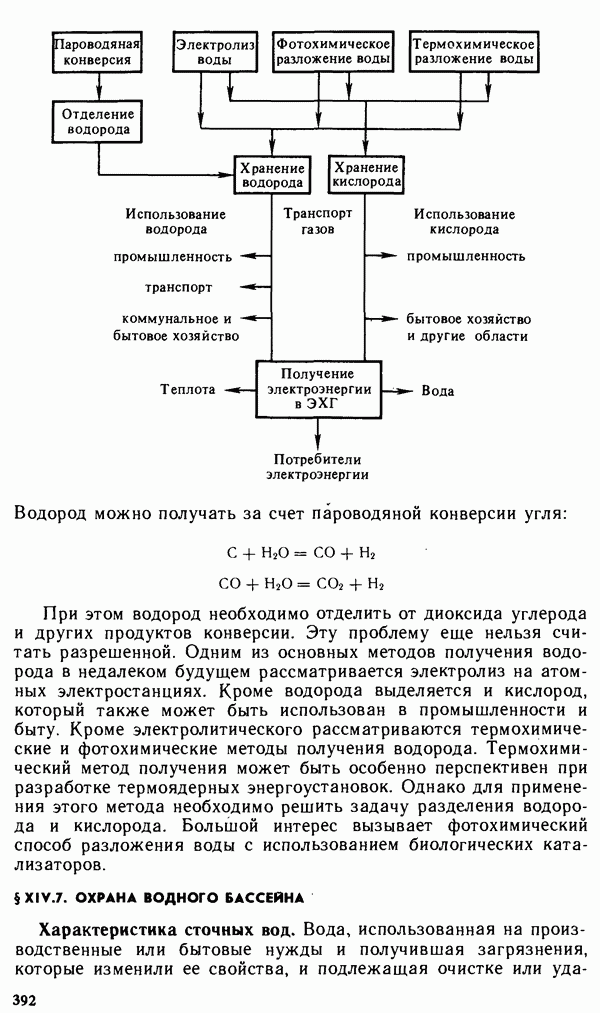
- § XIV.7. ОХРАНА ВОДНОГО БАССЕЙНА
- Глава XV. ЯДЕРНАЯ ХИМИЯ И РАДИОХИМИЯ
- § XV.1. АТОМНОЕ ЯДРО. РАДИОАКТИВНОСТЬ
- § XV.2. ЯДЕРНЫЕ РЕАКЦИИ
- § XV.3. ЯДЕРНАЯ ЭНЕРГЕТИКА
- § XV.4. ХИМИЧЕСКИЕ СВОЙСТВА РАДИОАКТИВНЫХ ЭЛЕМЕНТОВ
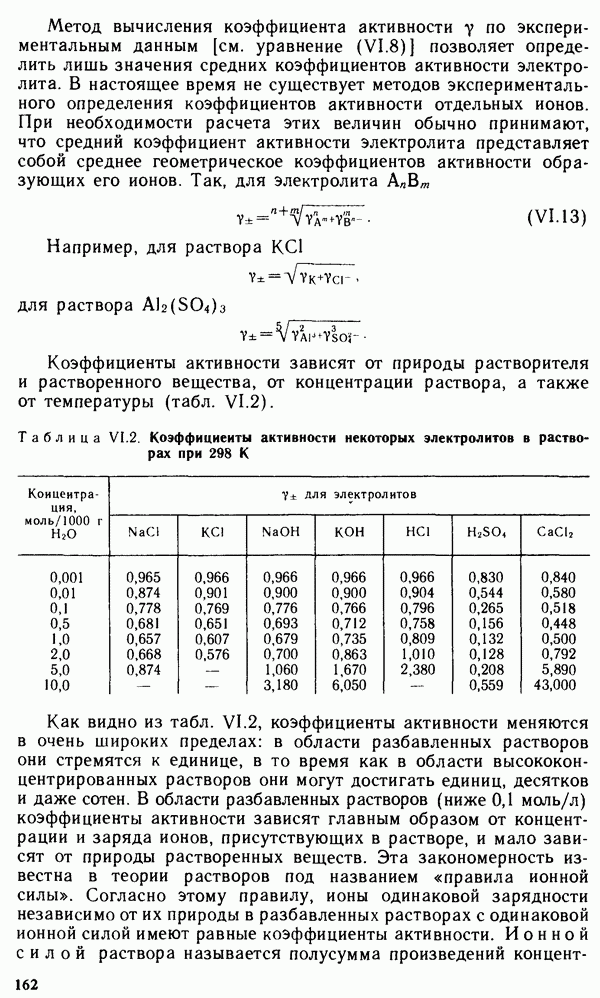
- Глава XVI. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ В ЭНЕРГЕТИКЕ, ЭЛЕКТРОНИКЕ И АВТОМАТИКЕ
- § ХVI.1. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА. ЭЛЕКТРОХИМИЧЕСКИЕ ЭНЕРГОУСТАНОВКИ
- § XVI.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ (ХЕМОТРОНЫ)
- § ХVI.3. ЭЛЕКТРОХИМИЧЕСКАЯ АНОДНАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ
- § XVI.4. ПОЛУЧЕНИЕ И СВОЙСТВА ГАЛЬВАНОПОКРЫТИИ
- ЗАКЛЮЧЕНИЕ