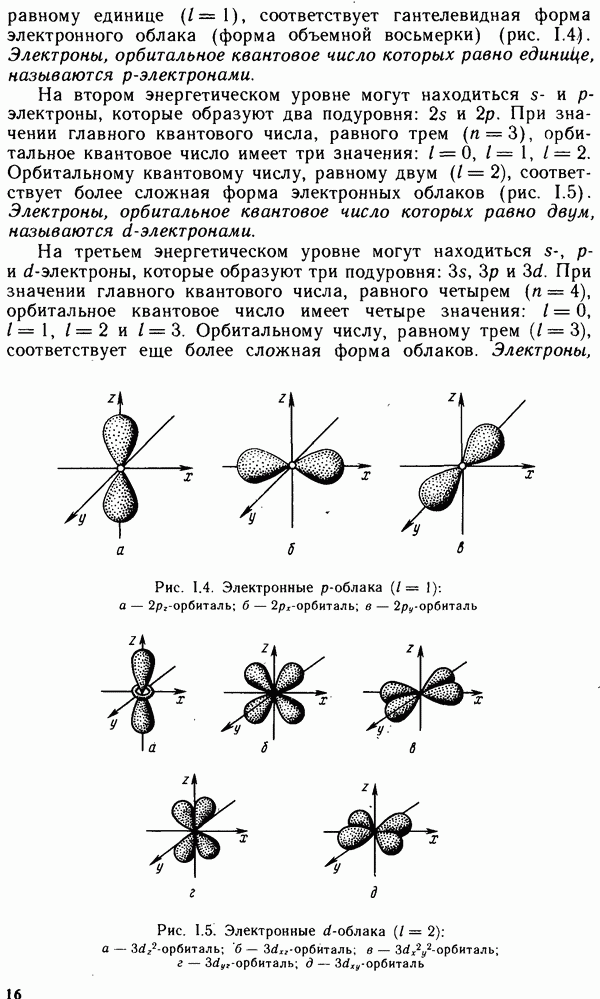
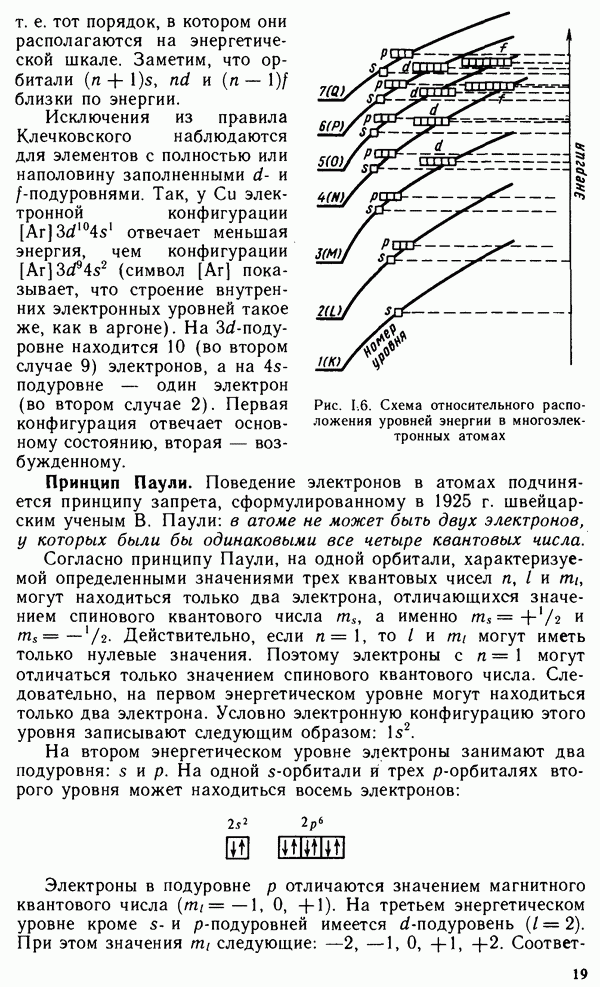
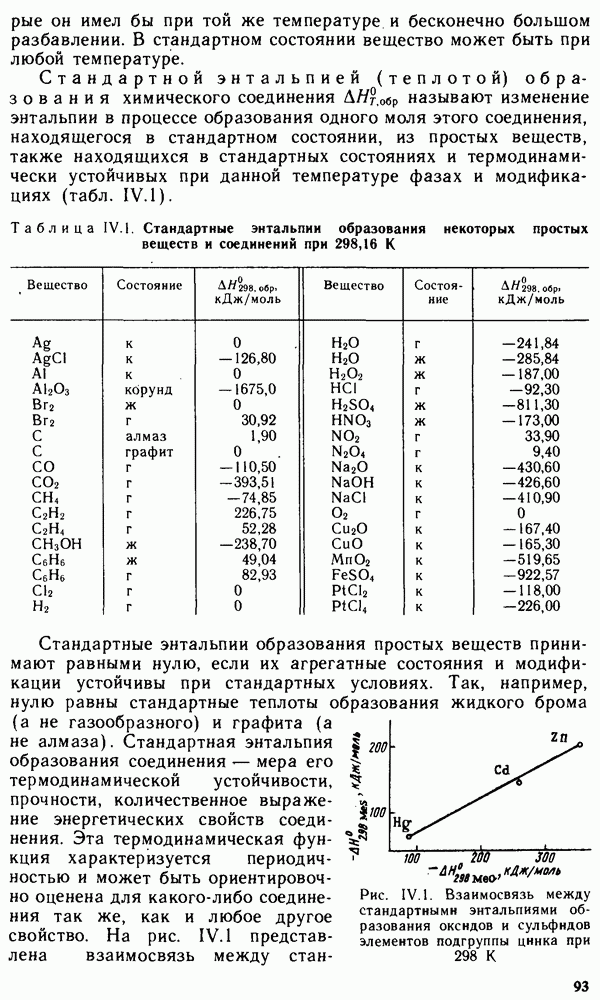
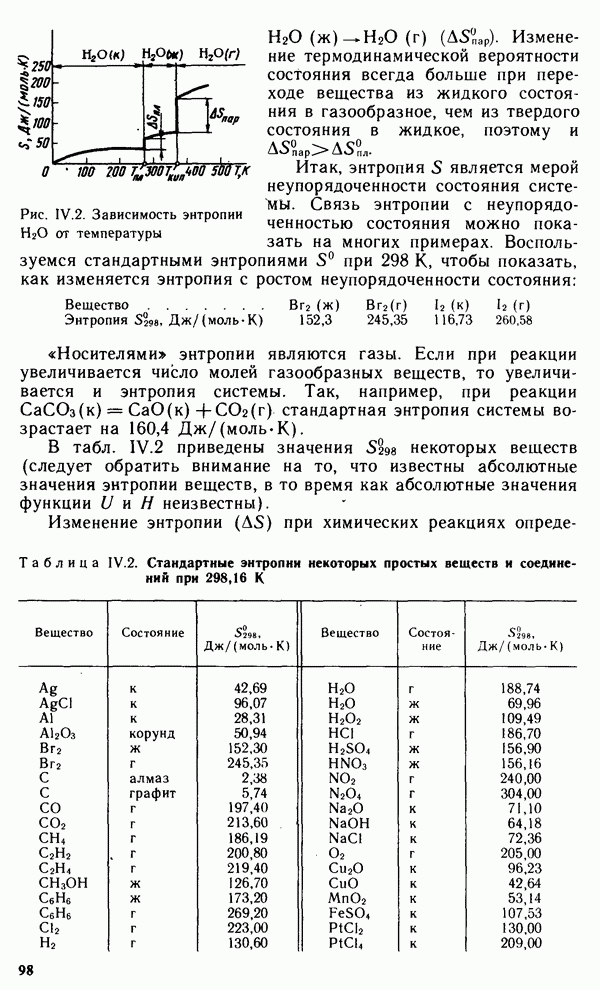
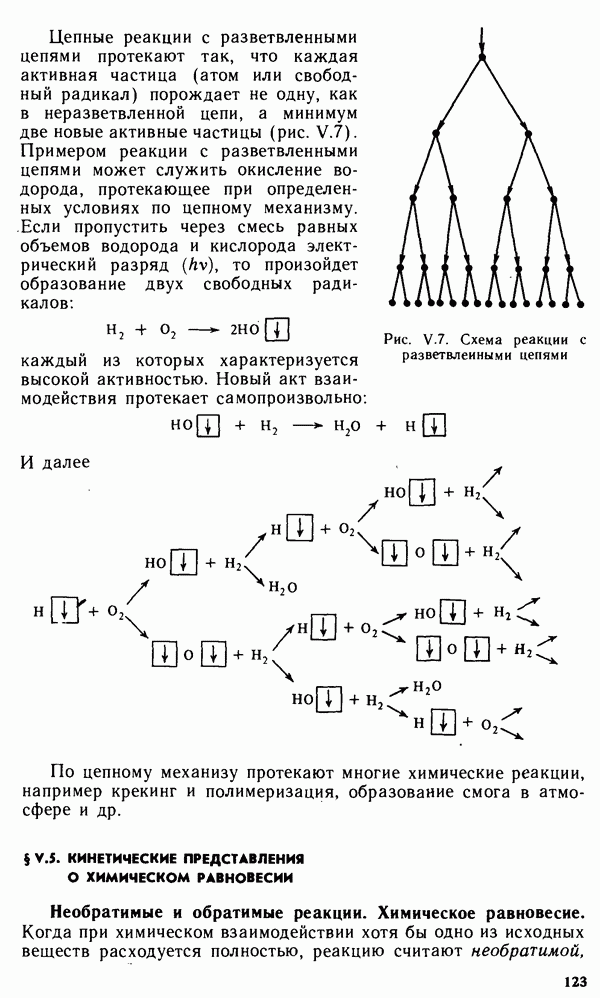
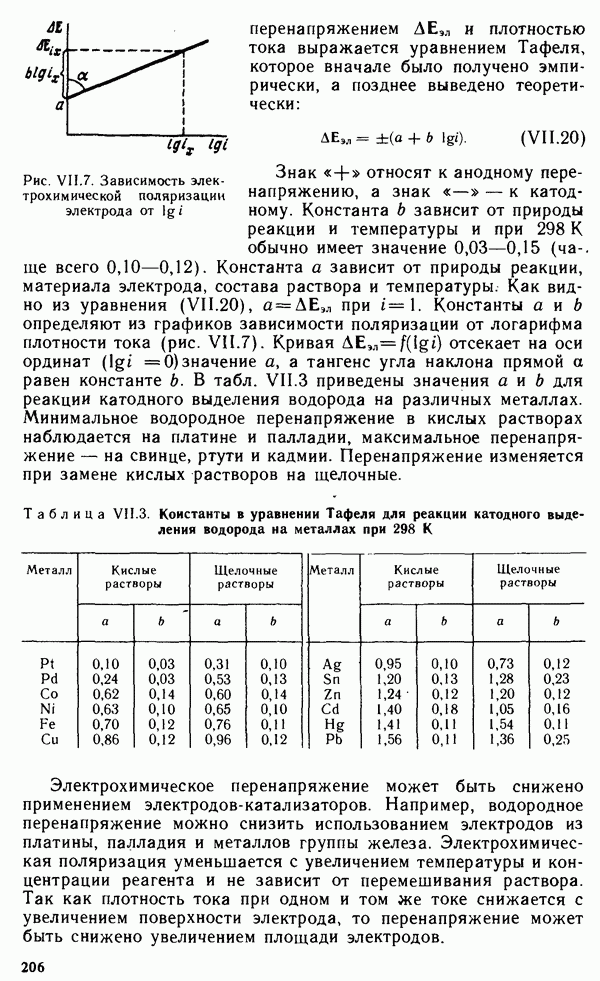
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
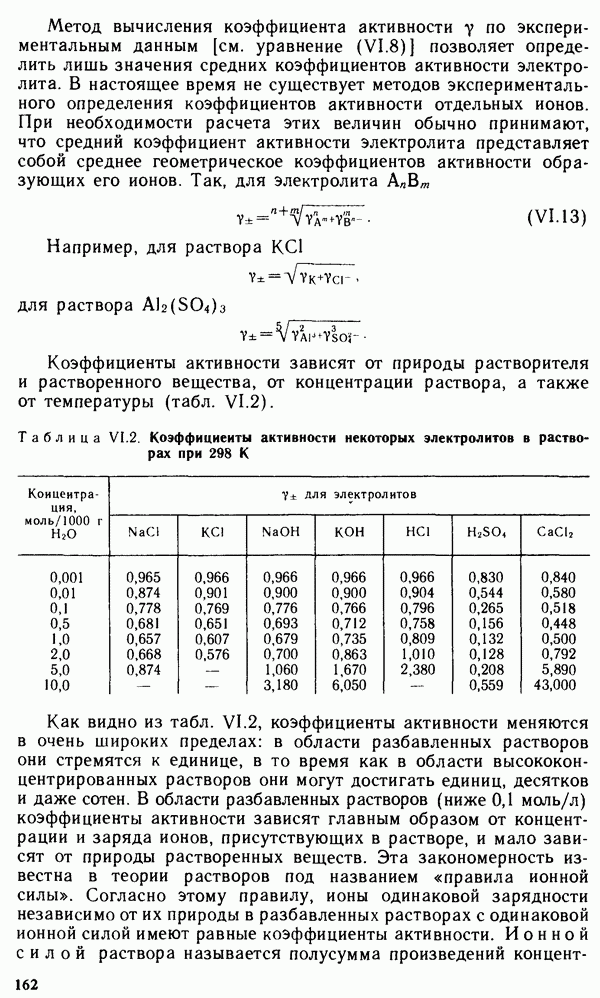
§ VI.8. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ
Кинетическая и агрегативная устойчивость коллоидных систем.
Следствием кинетических свойств коллоидных растворов является их кинетическая устойчивость, которая состоит в том, что концентрация коллоидных растворов одинакова по всему объему системы и при правильном хранении не изменяется во времени.
Электрические свойства коллоидных растворов объясняют их агрегативную устойчивость, которая проявляется в том, что частицы дисперсной фазы в коллоидном растворе не укрупняются, не слипаются. Сохранение коллоидной степени дисперсности во времени обусловлено прежде всего наличием одноименного электрического заряда частиц дисперсной фазы, вызывающего их взаимное отталкивание. С увеличением значения электрокинетического потенциала растет устойчивость коллоидных систем.
Наличие электрического заряда у частиц дисперсной фазы приводит к их значительной гидратации (полярные молекулы воды определенным образом ориентируются относительно заряженных частиц и вступают с ними во взаимодействие). Гидратная оболочка заметно снижает поверхностную энергию дисперсной фазы и тем самым уменьшает Стремление частиц к укрупнению. Гидратная оболочка приводит также к разобщению частиц в коллоидном растворе, что повышает агрегативную устойчивость, а иногда даже обеспечивает сохранение коллоидной степени дисперсности.
Частицы дисперсной фазы некоторых веществ, склонных к образованию золей, проявляют большое сродство к молекулам среды  адсорбируя их в первую очередь. Ядро коллоидной частицы таких золей имеет собственную гидратную оболочку
адсорбируя их в первую очередь. Ядро коллоидной частицы таких золей имеет собственную гидратную оболочку  Формула мицеллы золя
Формула мицеллы золя

Такие коллоидные растворы называют гидрофильными. Гидрофильные коллоидные растворы приближаются по свойствам к истинным растворам. Это, как правило, золи органического происхождения. Коллоидные растворы большинства неорганических веществ имеют гидрофобный характер.
Агрегативная устойчивость гидрофильных золей особенно велика, так как при наличии защитного действия одноименного
заряда коллоидных частиц и общей гидратной оболочки добавляется еще защитное действие гидратной оболочки ядра 
Гели и твердые коллоиды.
При длительном хранении гидрофильные золи переходят в особое «студнеобразное» коллоидное состояние. В таком виде их называют гелями. Структура геля такова, что мицеллы не разрушаются, а просто связываются друг с другом, образуя своеобразные ячейки, внутри которых сохраняется среда  Гель можно высушить, превратив его в твердый коллоид (рис. VI.7).
Гель можно высушить, превратив его в твердый коллоид (рис. VI.7).
Примером гидрофильного золя может служить золь желатина. В продаже имеется твердый коллоид желатина. При набухании в воде образуется гель. При нагревании геля («студня») образуется золь. Все процессы обратимы:

Сохранение во всех состояниях мицеллярной структуры связано с высокой устойчивостью гидрофильной коллоидной системы.
Коагуляция и седиментация. Устойчивость золя можно нарушить, устранив одноименный заряд коллоидных частиц и защитную гидратную оболочку. На границе раздела коллоидная частица — среда устанавливаются два равновесия:

Если сместить равновесие (1) влево, то возрастет число противоионов в коллоидной частице и уменьшится ее заряд. Уменьшение заряда частицы приведет, в свою очередь, к уменьшению числа молекул воды в гидратной оболочке коллоидной частицы, т. е. к смещению равновесия (2) в правую сторону. Устойчивость коллоидной системы нарушится. При некоторых условиях число противоионов в коллоидной частице может стать таким, что их заряд полностью нейтрализует заряд зарядообразующих ионов,

Рис. VI.7. Обратимые процессы перехода золя в гель и геля в твердый коллоид
т. е. коллоидная частица станет незаряженной. При этом  -потенциал становится равным нулю. Такое состояние коллоидной частицы называется изоэлектрическим состоянием. Гидратная оболочка частицы в изоэлектрическом состоянии в значительной мере разрушена. Коллоидные частицы не защищены и при столкновениях слипаются, укрупняются. Процесс укрупнения частиц, потеря агрегативной устойчивости золя называется коагиляцией. Коагуляция золя приводит к потере его кинетической устойчивости, которая выражается в образовании осадка. Этот процесс называют седиментацией.
-потенциал становится равным нулю. Такое состояние коллоидной частицы называется изоэлектрическим состоянием. Гидратная оболочка частицы в изоэлектрическом состоянии в значительной мере разрушена. Коллоидные частицы не защищены и при столкновениях слипаются, укрупняются. Процесс укрупнения частиц, потеря агрегативной устойчивости золя называется коагиляцией. Коагуляция золя приводит к потере его кинетической устойчивости, которая выражается в образовании осадка. Этот процесс называют седиментацией.
Рассмотрим схему нарушения устойчивости коллоидного раствора на примере золя 

На границе раздела дисперсная фаза — дисперсионная среда устанавливаются равновесия согласно (1) и (2):

Коагуляция золя связана со смещением равновесия (1а) в левую сторону, а равновесия (2а) в правую. Состав частиц при этом изменяется: они теряют заряд и защитную гидратную оболочку:

Нейтральные частицы укрупняются (коагулируют) и образуют осадок (седиментируют). Состав осадка

где  — число слипшихся частиц в коагуляте.
— число слипшихся частиц в коагуляте.
Один из методов разрушения коллоидной системы — пропускание постоянного электрического тока через коллоидный раствор. При этом происходит электрохимическое снятие заряда с коллоидной частицы на одном из электродов и последующая потеря частицей гидратной оболочки.
Другой метод разрушения коллоидной системы — введение в коллоидную систему твердого электролита или его концентрированного раствора. При этом происходит гидратация ионов электролита за счет молекул  из дисперсионной среды. Равновесие
из дисперсионной среды. Равновесие  нарушается и смещается в сторону пополнения воды в среде:
нарушается и смещается в сторону пополнения воды в среде:  что приводит к ослаблению защитной гидратной оболочки частицы. Одновременно смещается противоионное равновесие в сторону увеличения числа связанных противоионов. Это происходит потому, что введение электролита в систему резко повышает концентрацию ионов в дисперсионной среде и они проникают внутрь коллоидной частицы, снижая ее заряд. Результатом смещения указанных равновесий является нарушение устойчивости золя, сопровождающееся его коагуляцией и седиментацией.
что приводит к ослаблению защитной гидратной оболочки частицы. Одновременно смещается противоионное равновесие в сторону увеличения числа связанных противоионов. Это происходит потому, что введение электролита в систему резко повышает концентрацию ионов в дисперсионной среде и они проникают внутрь коллоидной частицы, снижая ее заряд. Результатом смещения указанных равновесий является нарушение устойчивости золя, сопровождающееся его коагуляцией и седиментацией.
Коагуляция в процессе водоподготовки.
В природных водах, служащих источником водоснабжения различных промышленных предприятий, всегда содержится некоторое количество органических примесей. Органические примеси, находящиеся в природных водах, создают в основном коллоидные системы. Как правило, их частицы несут отрицательный заряд.
Наличие органических коллоидов в воде затрудняет некоторые процессы подготовки воды для паросиловых установок, а также и процессы самой генерации (получения) пара. В связи с этим водоподготовка предусматривает удаление коллоидных примесей из природных вод. Удаление их фильтрированием воды через какие-либо механические фильтры невозможно, так как размеры коллоидных частиц слишком малы. Поэтому удаление проводят коагуляцией.
Коагуляция осуществляется с помощью специальных реагентов — коагулянтов, обычно сульфатов алюминия или железа. Эти соли, вводимые в определенных количествах в очищаемую воду, подвергаются гидролизу с образованием соответствующих труднорастворимых гидроксидов  Последние в процессе образования дают коллоидные растворы, частицы которых несут заряд, обратный по знаку заряду органических коллоидных частиц, т. е. положительный.
Последние в процессе образования дают коллоидные растворы, частицы которых несут заряд, обратный по знаку заряду органических коллоидных частиц, т. е. положительный.
В результате осуществляется процесс взаимной коагуляции: при взаимодействии двух коллоидных систем происходит уменьшение заряда, дегидратация и, наконец, укрупнение частиц. Образующиеся при этом крупные хлопья могут быть легко удалены с помощью фильтрования или отстаивания.
Электрогазоочистка.
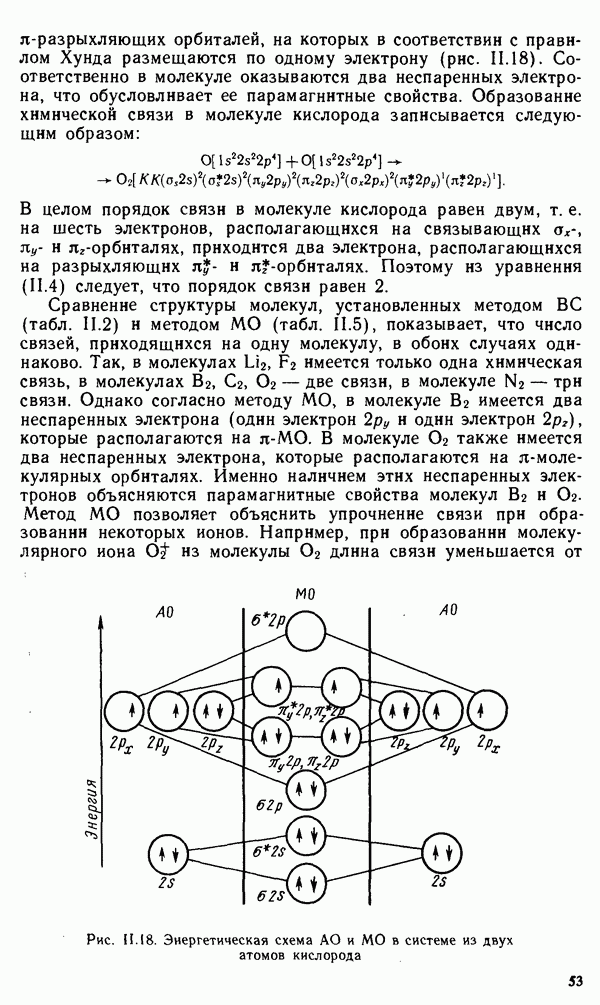
Дымовые газы несут с собой много пылевидных частиц коллоидной степени дисперсности. Особенно много коллоидных примесей выносится при сжигании низкосортного топлива (например, на ТЭЦ). Дымовые газы представляют собой аэрозоли (дисперсионная среда — газ).
При развитом теплоэнергетическом хозяйстве, при большом количестве ТЭЦ окружающее пространство загрязняется дымом. Вследствие высокой дисперсности твердой фазы в дымах очистка их обычными методами (механическими) не может быть обеспечена. Поэтому используются электрические свойства дыма как коллоидной системы. Частицы дымов обладают зарядом, который легко образуется при адсорбции ионов, но заряд этих частиц невелик и может быть разного знака в связи с различным химическим составом частиц. Для очистки дымовых газов используется электрофорез, который проводится при очень больших напряжениях (порядка десятков тысяч вольт). При этом катод, который расположен обычно в середине специальных газовых камер, служит источником сильного потока электронов, ионизирующих газ, благодаря чему частицы дыма получают больший и всегда
отрицательный заряд и быстро переносятся к аноду, которым служат стенки камеры. Со стенок камеры масса пыли оседает на дно.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1. а) Определите эквивалент  в реакциях нейтрализации
в реакциях нейтрализации

б) Определите эквивалент  в обменной реакции
в обменной реакции

в) Определите эквивалент  в реакции
в реакции

Решение, а) В приведенных кислотно-основных реакциях в молекуле  замещаются три иона водорода, а молекула
замещаются три иона водорода, а молекула  взаимодействует с двумя иоиами водорода. Согласно определению (см. § VI.2), эквиваленты фосфорной кислоты и гидроксида магния в этих реакциях равны
взаимодействует с двумя иоиами водорода. Согласно определению (см. § VI.2), эквиваленты фосфорной кислоты и гидроксида магния в этих реакциях равны  соответственно.
соответственно.
б) Эквивалент соли  в обменной реакции можио определить, пользуясь вспомогательными реакциями, протекающими с участием ионов водорода-.
в обменной реакции можио определить, пользуясь вспомогательными реакциями, протекающими с участием ионов водорода-.

Как видно, одна молекула соли  эквивалентна шести иоиам водорода. Следовательно,
эквивалентна шести иоиам водорода. Следовательно,

в) В приведенной реакции ион  восстанавливается одним электроном и, согласно определению (см. § VI.2),
восстанавливается одним электроном и, согласно определению (см. § VI.2),

Пример 2. Сколько цинка растворится в кислоте, если при  и 101 кПа выделится
и 101 кПа выделится  объемом
объемом 
Решение. Ионное уравнение реакции растворения цинка в кислоте

Отсюда эквивалент цинка равен  атома цинка, а фактор эквивалентности водорода —
атома цинка, а фактор эквивалентности водорода —  молекулы водорода:
молекулы водорода: 
Для решения задачи определим количество молей эквивалентов выделившегося водорода при н. у. Для этого приведем объем газа к н. у.:

где  и у — объемы водорода при н. у. и заданных условиях соответственно; Т — заданная температура,
и у — объемы водорода при н. у. и заданных условиях соответственно; Т — заданная температура,  — давление при н. у. и заданных условиях соответственно.
— давление при н. у. и заданных условиях соответственно.
Так как объем моля  при н. у. равен
при н. у. равен  то в данном случае выделилось 112/22
то в данном случае выделилось 112/22  моль
моль  или
или  моль эквивалентов
моль эквивалентов 
По закону эквивалентов моль эквивалентов одного вещества реагирует с молем эквивалентов другого вещества. Массу моля эквивалентов называют молярной массой эквивалента  Таким образом с 0,01 моль эквивалентов водорода должно прореагировать 0,01 моль эквивалентов цинка. Так как
Таким образом с 0,01 моль эквивалентов водорода должно прореагировать 0,01 моль эквивалентов цинка. Так как
 , то
, то  а масса 0,01 моль эквивалентов:
а масса 0,01 моль эквивалентов: 
Пример 3. В воде объемом  растворили
растворили  массой
массой  Вычислите массовую долю
Вычислите массовую долю  кислоты в растворе, титр
кислоты в растворе, титр  молярную
молярную  и нормальную концентрацию
и нормальную концентрацию  моляльность
моляльность  Плотность раствора
Плотность раствора 
Решение. Принимая массу  воды равной
воды равной  рассчитываем массу раствора:
рассчитываем массу раствора:

Следовательно,

По известным массе и плотности раствора найдем его объем:  а титр:
а титр: 
Зная титр раствора, найдем массу  раствора
раствора  и молярную концентрацию
и молярную концентрацию  раствора:
раствора:

Так как  то
то  Нормальная концентрация раствора:
Нормальная концентрация раствора:

Для расчета моляльности  найдем сначала массу
найдем сначала массу  растворителя:
растворителя:

Тогда

Пример 4. Какой объем  серной кислоты
серной кислоты  потребуется для приготовления
потребуется для приготовления  н. раствора?
н. раствора?
Решение. Масса моля эквивалентов  равна
равна 
Для приготовления  н. раствора требуется
н. раствора требуется  Масса
Масса  -ной кислоты
-ной кислоты  Масса
Масса  раствора:
раствора:

Следовательно, для приготовления  надо взять
надо взять  -ной серной кислоты.
-ной серной кислоты.
Пример 5. Определите концентрацию ионов  в
в  . Рассчитайте pH этого раствора при 295 К.
. Рассчитайте pH этого раствора при 295 К.
Решение. Гидроксид аммония — слабый электролит и диссоциирует обратимо:  . В соответствии с законом Оствальда степень диссоциации а равна
. В соответствии с законом Оствальда степень диссоциации а равна

Подставляя значение  из табл. VI. 1, получаем
из табл. VI. 1, получаем

Равновесная концентрация ионов  равна
равна

Водородный показатель равен

Можно считать, что в растворе слабого электролита активность ионов равна их концентрации. Тогда

Соответственно 
Пример 6. Рассчитайте pH раствора, содержащего 
Решение. Так как  сильные электролиты, то они диссоциируют полностью:
сильные электролиты, то они диссоциируют полностью:

Соответственно pH раствора определяем по формуле

Для расчета коэффициента активности необходимо определить ионную силу раствора:

На основании табл. VI.3 путем интерполяции находим  следовательно,
следовательно,

КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
(см. скан)
(см. скан)
(см. скан)
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- § 1. ПРЕДМЕТ ХИМИИ
- § 2. ЗНАЧЕНИЕ ХИМИИ В ИЗУЧЕНИИ ПРИРОДЫ И РАЗВИТИИ ТЕХНИКИ
- 1. СТРОЕНИЕ ВЕЩЕСТВА
- Глава I. СТРОЕНИЕ АТОМА И СИСТЕМАТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- § 1.2. КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА
- § 1.3. КВАНТОВЫЕ ЧИСЛА И АТОМНЫЕ ОРБИТАЛИ
- § 1.4. МНОГОЭЛЕКТРОННЫЕ АТОМЫ
- § 1.5. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
- § 1.6. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- Глава II. ХИМИЧЕСКАЯ СВЯЗЬ
- § II.1. ОСНОВНЫЕ ВИДЫ И ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ
- § II.2. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ. ВАЛЕНТНОСТЬ
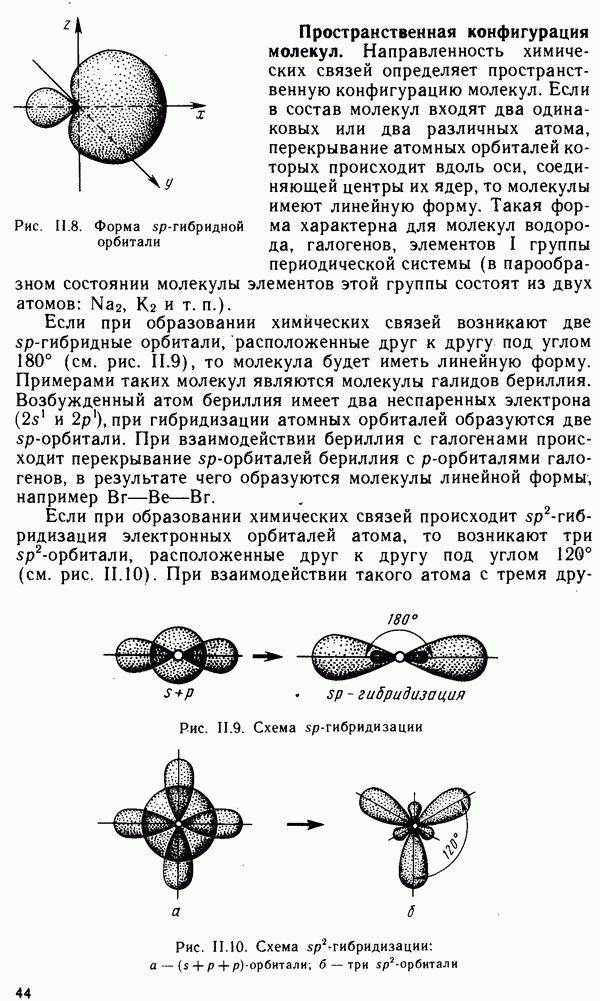
- § II.3. НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. ПРОСТРАНСТВЕННАЯ СТРУКТУРА МОЛЕКУЛ
- § 11.4. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
- § 11.5. ЭЛЕКТРОННАЯ СТРУКТУРА НЕКОТОРЫХ МОЛЕКУЛ
- Глава III. ТИПЫ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ. КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВА
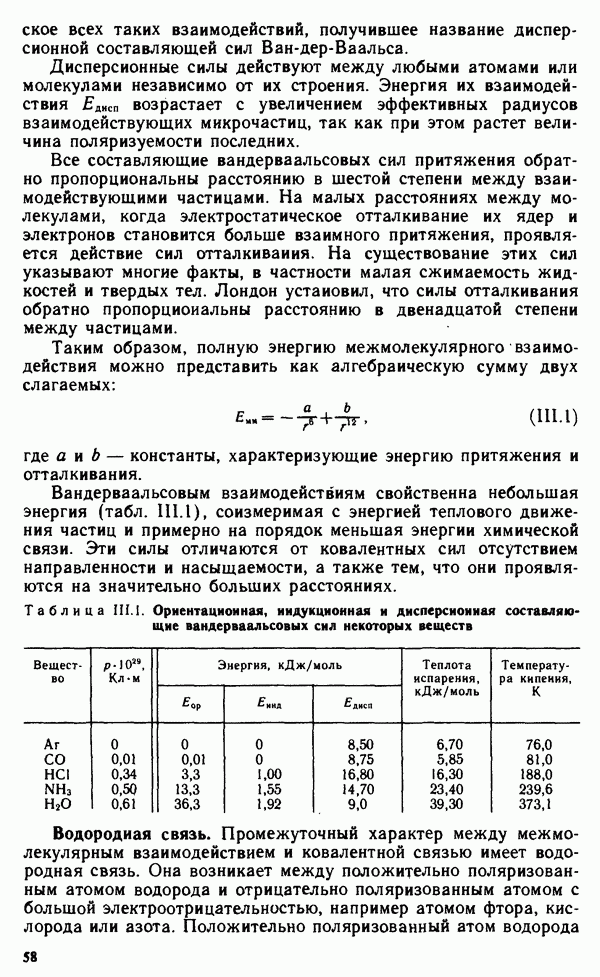
- § III.1. ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ
- § III.2. СВОЙСТВА ВЕЩЕСТВ В РАЗЛИЧНЫХ СОСТОЯНИЯХ
- § III.3. СТРОЕНИЕ КРИСТАЛЛОВ. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ТЕЛАХ
- § III.4. МЕТАЛЛЫ, ПОЛУПРОВОДНИКИ И ДИЭЛЕКТРИКИ
- § III.5. РЕАЛЬНЫЕ КРИСТАЛЛЫ
- 2. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
- Глава IV. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ СРОДСТВО
- § IV.2. ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ И ФАЗОВЫХ ПРЕВРАЩЕНИЙ. ТЕРМОХИМИЧЕСКИЕ ЗАКОНЫ
- § IV.3. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
- § IV.4. ЭНТРОПИЯ. НАПРАВЛЕНИЕ И ПРЕДЕЛ ПРОТЕКАНИЯ ПРОЦЕССОВ В ИЗОЛИРОВАННЫХ СИСТЕМАХ
- § IV.5. ЭНЕРГИЯ ГИББСА И ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА ХИМИЧЕСКОЙ РЕАКЦИИ
- Глава V. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- § V.2. СКОРОСТЬ ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ
- § V.3. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- § V.4. ФИЗИЧЕСКИЕ ВОЗДЕЙСТВИЯ НА ХИМИЧЕСКИЕ РЕАКЦИИ. ЦЕПНЫЕ РЕАКЦИИ
- § V.5. КИНЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ О ХИМИЧЕСКОМ РАВНОВЕСИИ
- § V.6. ФАЗОВЫЕ РАВНОВЕСИЯ ПРАВИЛО ФАЗ
- § V.7. АДСОРБЦИОННОЕ РАВНОВЕСИЕ
- § V.8. КАТАЛИЗ
- 3. РАСТВОРЫ ДИСПЕРСНЫЕ СИСТЕМЫ ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- VI.1. ОБЩИЕ ПОНЯТИЯ О РАСТВОРАХ
- § VI.2. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЖИДКИХ РАСТВОРОВ
- § VI.3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ
- § VI.4. ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- § VI.5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
- § VI.6. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- § VI.7. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ
- § VI.8. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ
- Глава VII. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.1. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- § VII.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.3. ПОТЕНЦИАЛЫ МЕТАЛЛИЧЕСКИХ И ГАЗОВЫХ ЭЛЕКТРОДОВ
- § VII.4. ПОТЕНЦИАЛЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ (РЕДОКСИ-) ЭЛЕКТРОДОВ
- § VII.5. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ. ПОЛЯРИЗАЦИЯ
- § VII.6. ЭЛЕКТРОЛИЗ
- Глава VIII. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- § VIII.1. ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ
- § VIII.2. ХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.4. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
- 4. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- Глава IX. ПРОСТЫЕ ВЕЩЕСТВА И ДВОЙНЫЕ СОЕДИНЕНИЯ. КРАТКИЙ ОБЗОР ХИМИЧЕСКИХ СВОЙСТВ s- И р-ЭЛЕМЕНТОВ
- § IX.2. МЕТАЛЛЫ И СПЛАВЫ. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА
- § IX.3. ДВОЙНЫЕ СОЕДИНЕНИЯ
- § IX.4. СВОЙСТВА МЕТАЛЛОВ ГЛАВНЫХ ПОДГРУПП I И II ГРУПП
- § IX.5. СВОЙСТВА р-ЭЛЕМЕНТОВ III ГРУППЫ
- § IX.6. СВОЙСТВА р-ЭЛЕМЕНТОВ IV ГРУППЫ
- § IX.7. СВОЙСТВА р-ЭЛЕМЕНТОВ V, VI И VII ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ
- Глава Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
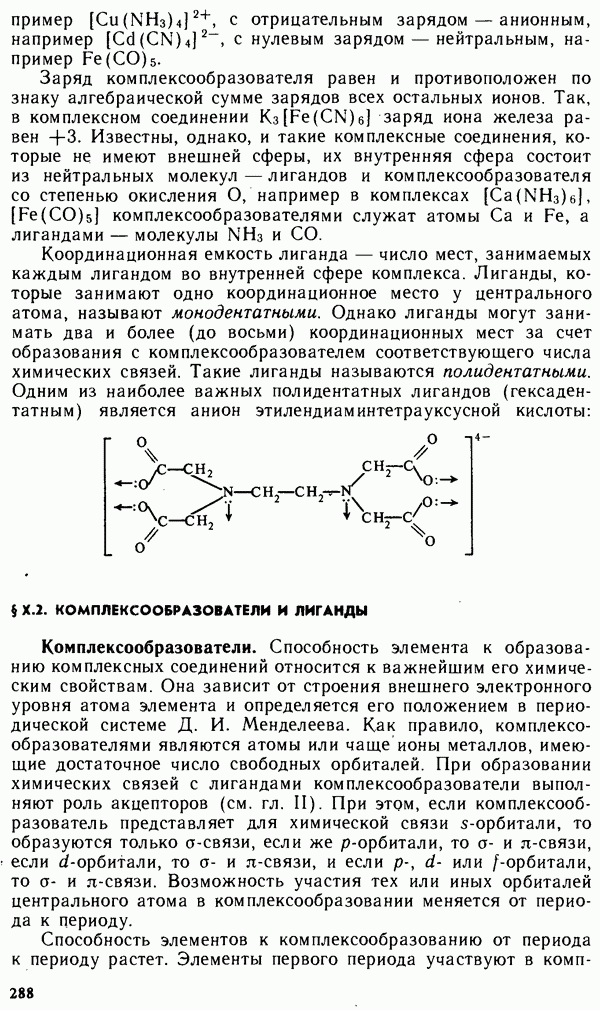
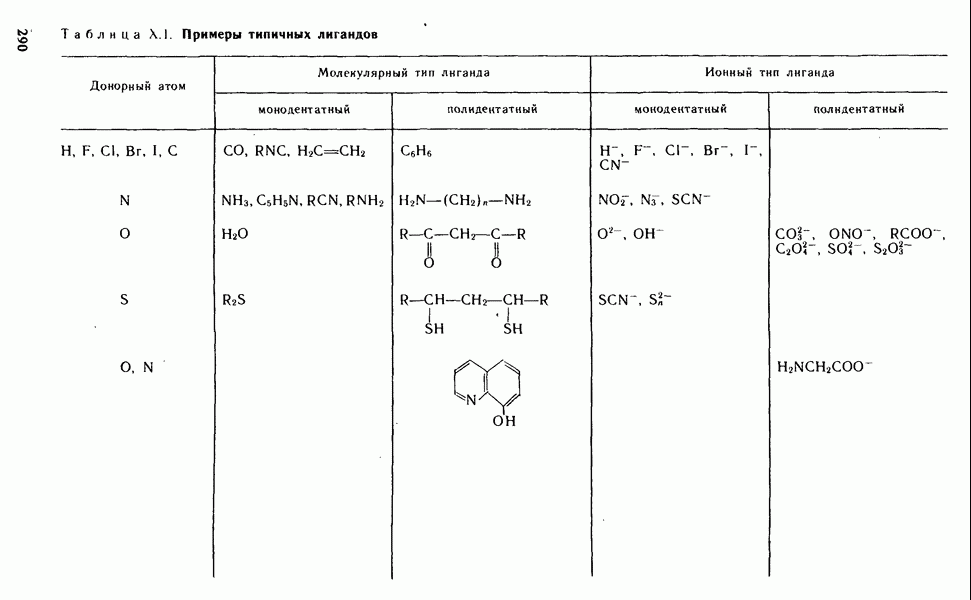
- § Х.1. СТРУКТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИИ
- § Х.2. КОМПЛЕКСООБРАЗОВАТЕЛИ И ЛИГАНДЫ
- § Х.3. НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- § Х.4. МЕТОДЫ РАСЧЕТА ХИМИЧЕСКИХ СВЯЗЕЙ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
- § Х.5. УСТОЙЧИВОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- Глава XI. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- § XI.1. ОСОБЕННОСТИ. ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ И КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- § XI.2. УГЛЕВОДОРОДЫ
- § ХI.3. ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
- 5. СПЕЦИАЛЬНЫЕ ВОПРОСЫ ХИМИИ
- Глава XII. ХИМИЯ КОНСТРУКЦИОННЫХ И ЭЛЕКТРОТЕХНИЧЕСКИХ МАТЕРИАЛОВ
- § XII.2. СВОЙСТВА ПЕРЕХОДНЫХ МЕТАЛЛОВ VIII ГРУППЫ
- § ХII.3. СВОЙСТВА ЭЛЕМЕНТОВ I И II ГРУПП
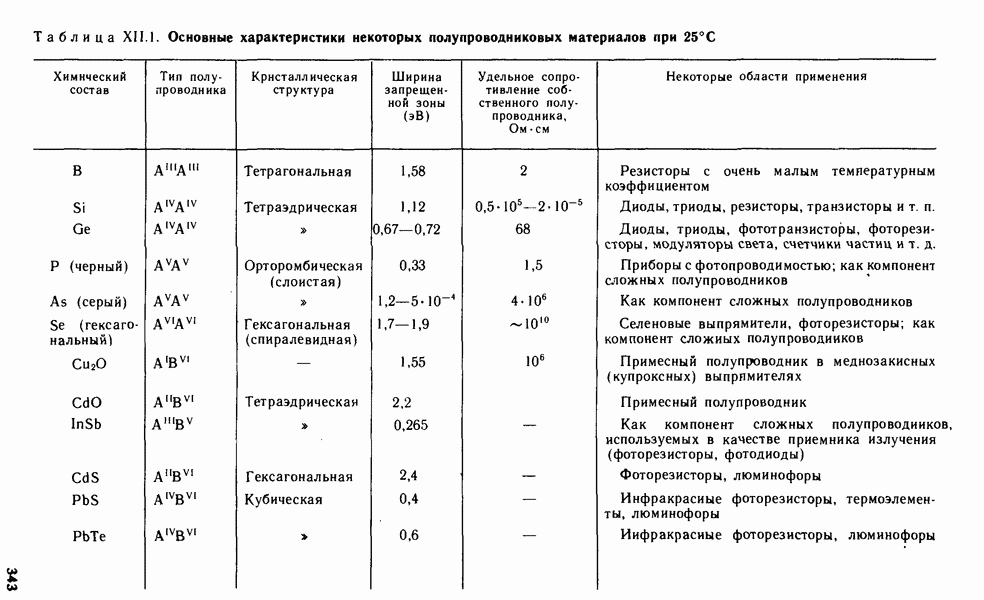
- § XII.4. ХИМИЯ ПОЛУПРОВОДНИКОВЫХ МАТЕРИАЛОВ
- § XII.5. МЕТОДЫ ПОЛУЧЕНИЯ МАТЕРИАЛОВ ВЫСОКОЙ ЧИСТОТЫ
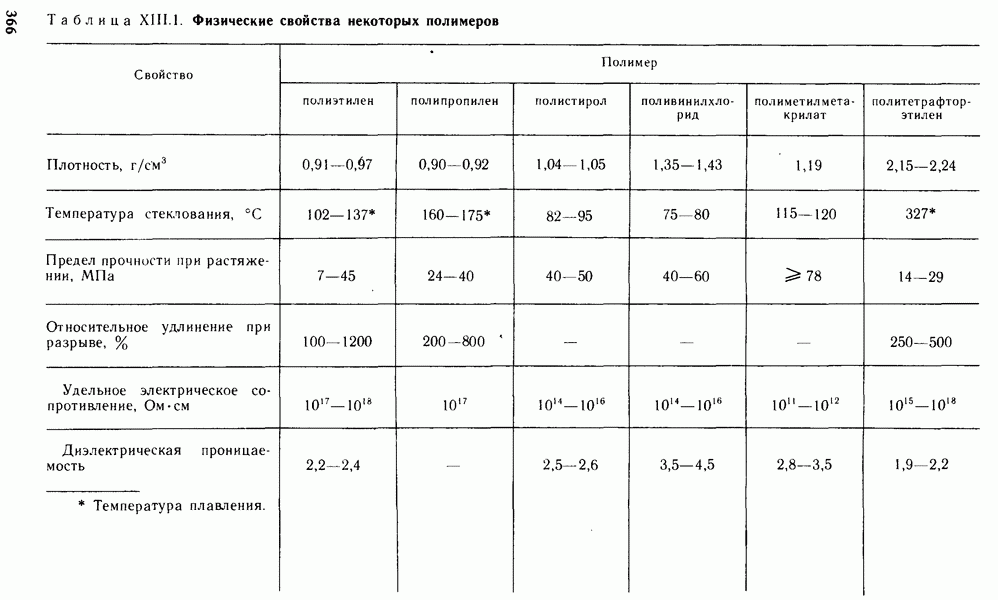
- Глава XIII. ПОЛИМЕРНЫЕ МАТЕРИАЛЫ И ИХ ПРИМЕНЕНИЕ В ЭНЕРГЕТИКЕ
- § XIII.1. МЕТОДЫ ПОЛУЧЕНИЯ ПОЛИМЕРОВ
- § XIII.2. СТРОЕНИЕ ПОЛИМЕРОВ
- § XIII.3. СВОЙСТВА ПОЛИМЕРОВ
- § XIII.4. ПРИМЕНЕНИЕ ПОЛИМЕРОВ
- Глава XIV. ХИМИЯ ВОДЫ И ТОПЛИВА. ХИМИЯ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ
- § XIV.1. СТРОЕНИЕ И СВОЙСТВА ВОДЫ
- § XIV.2. ПРИРОДНЫЕ ВОДЫ
- § ХIV.3. ОСНОВНЫЕ МЕТОДЫ ОЧИСТКИ ВОДЫ
- § XIV.4. СОСТАВ И СВОЙСТВА ОРГАНИЧЕСКОГО ТОПЛИВА
- § XIV.5. ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ОБЩЕСТВА
- § XIV.6. ОХРАНА ВОЗДУШНОГО БАССЕЙНА
- § XIV.7. ОХРАНА ВОДНОГО БАССЕЙНА
- Глава XV. ЯДЕРНАЯ ХИМИЯ И РАДИОХИМИЯ
- § XV.1. АТОМНОЕ ЯДРО. РАДИОАКТИВНОСТЬ
- § XV.2. ЯДЕРНЫЕ РЕАКЦИИ
- § XV.3. ЯДЕРНАЯ ЭНЕРГЕТИКА
- § XV.4. ХИМИЧЕСКИЕ СВОЙСТВА РАДИОАКТИВНЫХ ЭЛЕМЕНТОВ
- Глава XVI. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ В ЭНЕРГЕТИКЕ, ЭЛЕКТРОНИКЕ И АВТОМАТИКЕ
- § ХVI.1. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА. ЭЛЕКТРОХИМИЧЕСКИЕ ЭНЕРГОУСТАНОВКИ
- § XVI.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ (ХЕМОТРОНЫ)
- § ХVI.3. ЭЛЕКТРОХИМИЧЕСКАЯ АНОДНАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ
- § XVI.4. ПОЛУЧЕНИЕ И СВОЙСТВА ГАЛЬВАНОПОКРЫТИИ
- ЗАКЛЮЧЕНИЕ