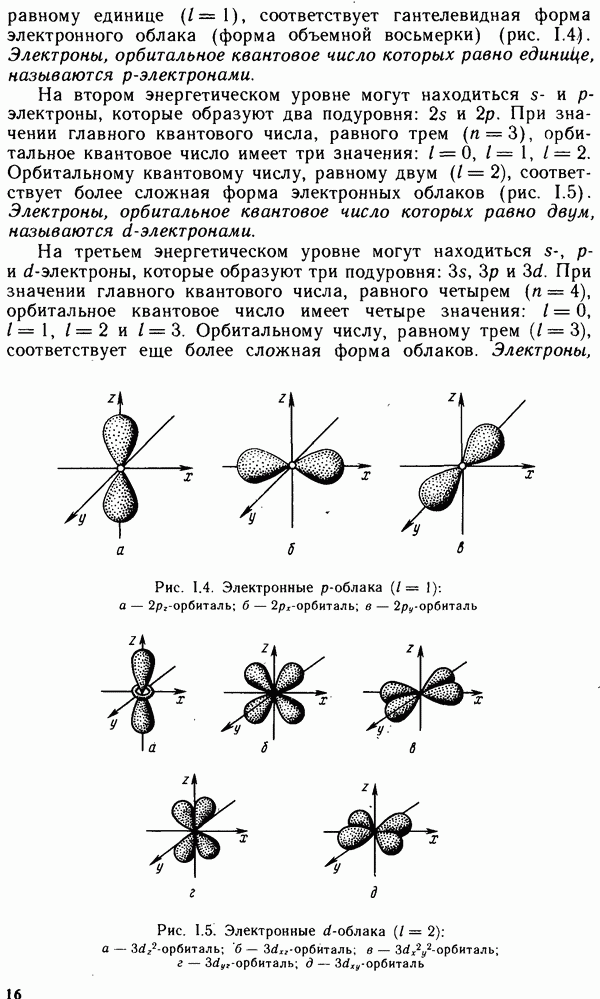
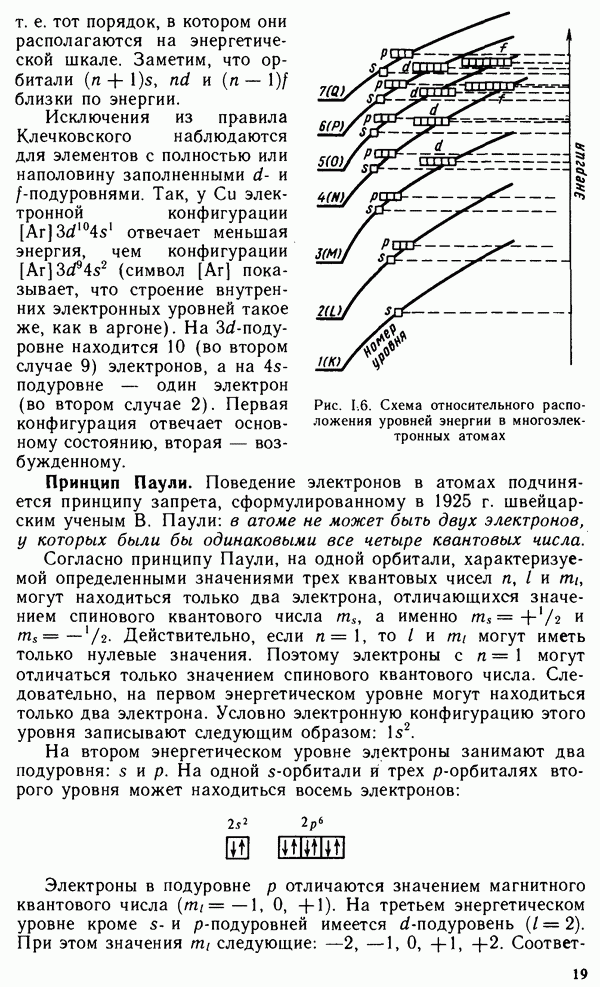
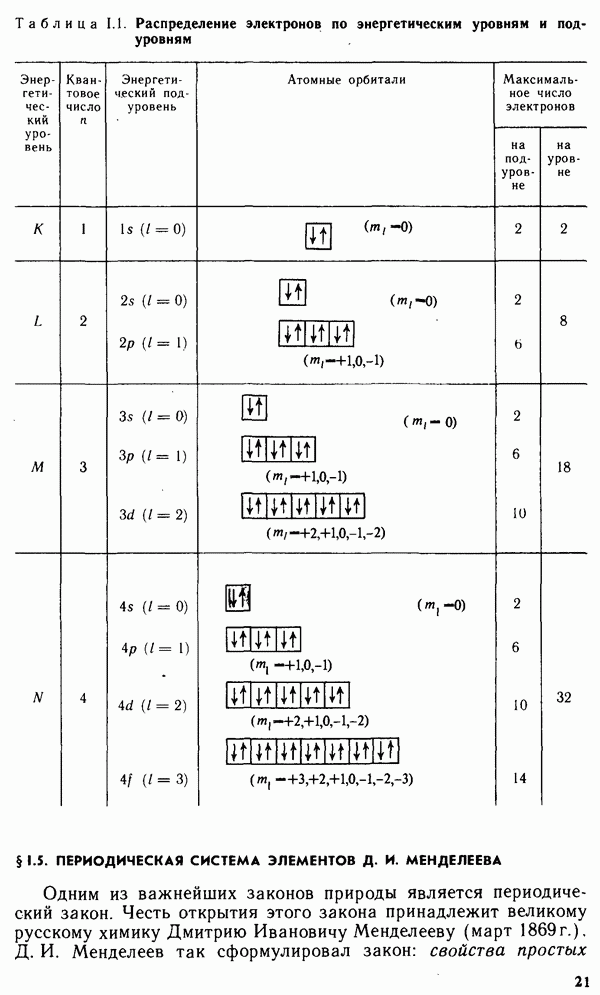
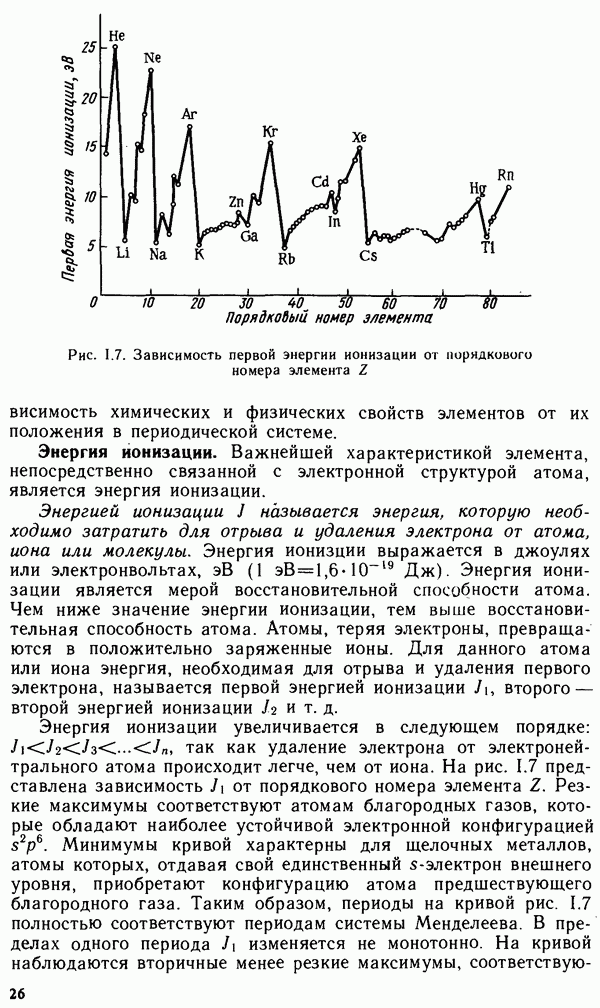
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ VI.2. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЖИДКИХ РАСТВОРОВ
Жидкие растворы рассматриваются более подробно, поскольку они имеют наибольшее распространение и применение.
Способы выражения концентрации растворов.
Концентрацией называют отношение количества (моль) или массы  вещества, содержащегося в растворе, к объему или массе раствора либо растворителя. Наиболее распространены следующие способы выражения концентрации растворов.
вещества, содержащегося в растворе, к объему или массе раствора либо растворителя. Наиболее распространены следующие способы выражения концентрации растворов.
Молярная концентрация  — отношение количества вещества, содержащегося в растворе, к объему раствора
— отношение количества вещества, содержащегося в растворе, к объему раствора  На практике молярную концентрацию выражают обычно в дольных производных единицы объема:
На практике молярную концентрацию выражают обычно в дольных производных единицы объема:  или
или  Так, например,
Так, например,  или
или  При
При  раствор называют одномолярным, при
раствор называют одномолярным, при  — сантимолярным и т.
— сантимолярным и т.  Приняты и такие обозначения: 1 М раствор
Приняты и такие обозначения: 1 М раствор  раствор
раствор 
Молярная концентрация эквивалента (нормальная концентрация)  — это отношение количества вещества эквивалента, содержащегося в растворе, к объему этого раствора
— это отношение количества вещества эквивалента, содержащегося в растворе, к объему этого раствора  На практике нормальную концентрацию по аналогии с молярной выражают в
На практике нормальную концентрацию по аналогии с молярной выражают в  Так, например,
Так, например,  или
или  При
При  раствор называют нормальным, при
раствор называют нормальным, при  — санти-нормальным и т.
— санти-нормальным и т.  Приняты и такие обозначения: 1 н. раствор
Приняты и такие обозначения: 1 н. раствор  н. раствор
н. раствор 
Эквивалентом, называется реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Моль вещества эквивалента содержит  эквивалентов.
эквивалентов.
Зная молярную концентрацию раствора, легко вычислить его нормальную концентрацию и наоборот.
Пример 1.  моль/л, т. е. раствор
моль/л, т. е. раствор  одномолярный (1 М). В одном моле заключено 2 моль эквивалентов
одномолярный (1 М). В одном моле заключено 2 моль эквивалентов  так как эквивалент равен
так как эквивалент равен  Следовательно, при
Следовательно, при  концентрация вещества
концентрация вещества
эквивалента 
Пример 2. Химическая формула гидроксида калия —  эквивалент гидроксида калия —
эквивалент гидроксида калия —  из этого следует, что молярная и нормальная концентрации раствора
из этого следует, что молярная и нормальная концентрации раствора  числеиио совпадают;
числеиио совпадают; 
Моляльность  — отношение количества вещества, содержащегося в растворе, к массе растворителя
— отношение количества вещества, содержащегося в растворе, к массе растворителя  Например,
Например,  или
или 
Молярная доля N — отношение количества вещества одного из компонентов раствора к общему количеству вещества всех компонентов раствора. Молярная доля некоторого компонента  в растворе
в растворе  обычно выражается в процентах
обычно выражается в процентах 
Титр раствора Т — масса вещества, содержащаяся в одном кубическом сантиметре (одном миллилитре) раствора  Например,
Например,  раствора содержится
раствора содержится 
Массовая доля  — отношение массы данного компонента в растворе к массе всего раствора. Массовая доля выражается обычно в процентах и показывает, сколько граммов данного компонента содержится в
— отношение массы данного компонента в растворе к массе всего раствора. Массовая доля выражается обычно в процентах и показывает, сколько граммов данного компонента содержится в  раствора.
раствора.
Растворимость.
Способность одного вещества растворяться в другом при заданных условиях имеет количественное выражение, называемое растворимостью, Растворимость всегда равна концентрации насыщенно  при данных условиях раствора. Понятие «насыщенный раствор» связано с обратимостью процесса растворения. На границе раздела вещество — растворитель одновременно идут два процесса: растворение и выделение вещества из раствора. Если скорости этих процессов равны, система находится в состоянии динамического равновесия
при данных условиях раствора. Понятие «насыщенный раствор» связано с обратимостью процесса растворения. На границе раздела вещество — растворитель одновременно идут два процесса: растворение и выделение вещества из раствора. Если скорости этих процессов равны, система находится в состоянии динамического равновесия  отвечающего насыщению раствора.
отвечающего насыщению раствора.
Всякий раствор, концентрация которого при заданных условиях меньше растворимости вещества, является ненасыщенным: скорость растворения при контакте вещества с растворителем больше скорости выделения вещества из раствора  При определенных условиях можно получить раствор, концентрация вещества в котором больше растворимости. Такой раствор называют пересыщенным: контакт раствора с веществом вызывает выделение вещества из раствора
При определенных условиях можно получить раствор, концентрация вещества в котором больше растворимости. Такой раствор называют пересыщенным: контакт раствора с веществом вызывает выделение вещества из раствора  Концентрация пересыщенного раствора падает до тех пор, пока не становится равной растворимости вещества при данных условиях.
Концентрация пересыщенного раствора падает до тех пор, пока не становится равной растворимости вещества при данных условиях.
Поскольку понятие насыщения раствора связано с равновесием процесса растворения, его можно относить только к определенным условиям: раствор, насыщенный при одной температуре, может стать ненасыщенным (или пересыщенным) при другой. Таким образом, растворимость вещества является функцией температуры, а если растворяемое вещество газообразно, то и функцией давления газа над раствором. Чаще всего растворимость
твердых веществ при повышении температуры увеличивается, а жидких и газообразных — уменьшается.
Растворимость жидкостей в жидкостях определяется прежде всего характером связей между молекулами этих жидкостей. Вещества с одинаковым характером связей имеют большую тенденцию к взаимной растворимости, или, короче, подобное растворяется в подобном. Так, полярные и ионные вещества хорошо растворимы в полярных растворителях, неполярные — в неполярных растворителях.
Закон Рауля. Для количественного описания свойств растворов используют модель идеального раствора. Идеальным называют раствор, в котором силы (межмолекулярного взаимодействия отдельных компонентов (например,  одинаковы и между компонентами нет химического взаимодействия. Образование такого раствора сопровождается нулевым тепловым эффектом
одинаковы и между компонентами нет химического взаимодействия. Образование такого раствора сопровождается нулевым тепловым эффектом  каждый компонент ведет себя в идеальном растворе независимо от остальных компонентов, и свойства раствора при данных условиях определяются только концентрацией растворенного вещества. Из реальных растворов лишь разбавленные растворы неэлектролитов могут по своим свойствам приближаться к идеальным.
каждый компонент ведет себя в идеальном растворе независимо от остальных компонентов, и свойства раствора при данных условиях определяются только концентрацией растворенного вещества. Из реальных растворов лишь разбавленные растворы неэлектролитов могут по своим свойствам приближаться к идеальным.
В 80-х годах XIX столетия французский ученый Рауль, исследуя свойства разбавленных растворов малолетучих неэлектролитов, установил, что относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества:

где  давление насыщенного пара растворителя А над чистым растворителем и над раствором соответственно;
давление насыщенного пара растворителя А над чистым растворителем и над раствором соответственно;  — число молей растворителя А в растворе;
— число молей растворителя А в растворе;  — число молей растворенного малолетучего неэлектролита В в растворе.
— число молей растворенного малолетучего неэлектролита В в растворе.
Из закона Рауля вытекает, что при некоторой температуре Т давление насыщенного пара растворителя над чистым растворителем  всегда больше, чем над раствором
всегда больше, чем над раствором  При этом разность
При этом разность  тем значительнее, чем выше концентрация растворенного вещества.
тем значительнее, чем выше концентрация растворенного вещества.
Кипение и замерзание растворов.
Следствием снижения давления насыщенного пара растворителя над раствором является повышение температуры кипения раствора Акип по сравнению с чистым растворителем и понижением температуры его замерзания 
Часто из растворов переходит в пар при кипении или кристаллизуется при замерзании только растворитель, вследствие чего концентрация раствора по мере его кипения или замерзания возрастает. Это, в свою очередь, приводит к еще большему повышению температуры кипения или понижению температуры замерзания раствора. Таким образом, раствор в отличие от чистого растворителя кипит или замерзает не при постоянной температуре,

Рис. VI. 1. Зависимость давления насыщенного пара от температуры над чистым растворителем (а) и раствором малолетучего неэлектролита с концентрацией 
а в некотором температурном интервале. Так, если раствор кипит, то начало температурного интервала называют температурой кипения раствора, а конец — температурой конденсации. Если же раствор замерзает, то начало температурного интервала называют температурой кристаллизации, а конец — температурой плавления.
Всякая жидкость начичает кипеть при той температуре, при которой давление ее насыщенного пара достигает внешнего (атмосферного) давления. Так, вода при давлении 101 кПа кипит при  потому, что при этой температуре
потому, что при этой температуре  кПа. Поскольку при заданной температуре
кПа. Поскольку при заданной температуре  всегда больше
всегда больше  давление насыщенного водяного пара над раствором при
давление насыщенного водяного пара над раствором при  не достигает 101 кПа и раствор при
не достигает 101 кПа и раствор при  не закипает. Чтобы
не закипает. Чтобы  стало равным 101 кПа, требуется еще некоторое повышение температуры Двеличина которого зависит от концентрации раствора. Температура кипения водного раствора выше
стало равным 101 кПа, требуется еще некоторое повышение температуры Двеличина которого зависит от концентрации раствора. Температура кипения водного раствора выше  (рис. IV. I), причем Д/Кип тем больше, чем выше концентрация раствора.
(рис. IV. I), причем Д/Кип тем больше, чем выше концентрация раствора.
При замерзании жидкостей кристаллизация начинается при той температуре, при которой давление насыщенного пара над жидкой фазой становится равным давлению насыщенного пара над твердой фазой. Так, вода замерзает при  потому, что при этой температуре давление насыщенных паров
потому, что при этой температуре давление насыщенных паров  над жидкостью и над льдом одинаково (0,61 кПа). Поскольку при заданной температуре давление насыщенного водяного пара над раствором меньше, чем над чистой водой
над жидкостью и над льдом одинаково (0,61 кПа). Поскольку при заданной температуре давление насыщенного водяного пара над раствором меньше, чем над чистой водой  то при
то при  значение рнго не достигает 0,61 кПа и раствор при
значение рнго не достигает 0,61 кПа и раствор при  не замерзает. При более низких температурах давление насыщенных паров
не замерзает. При более низких температурах давление насыщенных паров  над жидкой и твердой фазами становится одним и тем же, раствор замерзает (рис. VI. 1). Температура замерзания раствора тем ниже, чем больше его концентрация.
над жидкой и твердой фазами становится одним и тем же, раствор замерзает (рис. VI. 1). Температура замерзания раствора тем ниже, чем больше его концентрация.
Для разбавленных растворов малолетучих неэлектролитов повышение температуры кипения  и понижение температуры замерзания
и понижение температуры замерзания  не зависят от природы растворенного вещества и прямо пропорциональны числу молей растворенного вещества
не зависят от природы растворенного вещества и прямо пропорциональны числу молей растворенного вещества 

где  — эбулиоскопическая постоянная;
— эбулиоскопическая постоянная;  криоскопическая постоянная;
криоскопическая постоянная;  - удельна» теплота испарения и плавления растворителя Соответственно,
- удельна» теплота испарения и плавления растворителя Соответственно,

Рис. VI.2. Схема осмометра:
 — раствор; 2 — вода; 3 — полупроницаемая перегородка
— раствор; 2 — вода; 3 — полупроницаемая перегородка
 — температура испарения и плавления растворителя.
— температура испарения и плавления растворителя.
Уравнения (VI.2) и (VI.3) применяют для расчета молярных масс малолетучих неэлектролитов, подставив вместо  соотношение
соотношение  где
где  — масса растворенного вещества; М — молярная масса вещества:
— масса растворенного вещества; М — молярная масса вещества:

и

При определении молярных масс неэлектролитов методами эбулиоскопии и криоскопии значения  находят экспериментально.
находят экспериментально.
Осмотическое давление.
Раствор представляет собой однородную систему. Частицы растворенного вещества и растворителя находятся в беспорядочном тепловом движении и равномерно распределяются по всему объему раствора. Однако движение частиц растворенного вещества и растворителя может стать направленным, если привести в соприкосновение два раствора с разными концентрациями  Молекулы растворителя и растворенного вещества будут диффундировать преимущественно в том направлении, где их концентрация ниже. Так, например, если
Молекулы растворителя и растворенного вещества будут диффундировать преимущественно в том направлении, где их концентрация ниже. Так, например, если  то молекулы растворителя с большей скоростью будут переходить в раствор с концентрацией
то молекулы растворителя с большей скоростью будут переходить в раствор с концентрацией  а молекулы растворенного вещества — в раствор с концентрацией
а молекулы растворенного вещества — в раствор с концентрацией  Такая двусторонняя диффузия приведет к выравниванию концентраций
Такая двусторонняя диффузия приведет к выравниванию концентраций 
Диффузия может стать односторонней, если растворы разделить полупроницаемой перегородкой, пропускающей только молекулы растворителя. При условии, что  молекулы растворителя с большей скоростью будут диффундировать в направлении
молекулы растворителя с большей скоростью будут диффундировать в направлении  и объем раствора с концентрацией
и объем раствора с концентрацией  несколько возрастет. Такая односторонняя диффузия растворителя через полупроницаемую перегородку называется осмосом. Схема осмометра представлена на рис. VI.2. Столб жидкости с высотой
несколько возрастет. Такая односторонняя диффузия растворителя через полупроницаемую перегородку называется осмосом. Схема осмометра представлена на рис. VI.2. Столб жидкости с высотой  образовался за счет осмоса. Осмос прекращается тогда, когда скорости перехода молекул растворителя через полупроницаемую перегородку в обоих направлениях становятся одинаковыми. Для количественной характеристики осмотических свойств растворов но отношению к чистому растворителю вводится понятие об
образовался за счет осмоса. Осмос прекращается тогда, когда скорости перехода молекул растворителя через полупроницаемую перегородку в обоих направлениях становятся одинаковыми. Для количественной характеристики осмотических свойств растворов но отношению к чистому растворителю вводится понятие об
осмотическом давлении, равном силе, приходящейся на единицу площади поверхности и заставляющей проникать молекулы растворителя через полупроницаемую перегородку.
Осмотическое давление росм численно равно гидростатическому давлению столба жидкости высотой Л, препятствующему односторонней диффузии растворителя. Осмотическое давление зависит от температуры раствора и его концентрации и не зависит от природы растворителя и растворенного вещества.
Закон Вант-Гоффа.
В 1886 г. Вант-Гофф показал, что для разбавленных растворов неэлектролитов зависимость осмотического давления от температуры и концентрации выражается уравнением (закон Вант-Гоффа)

где С — молярная концентрация раствора неэлектролита, 
По уравнению Вант-Гоффа можно определять молярную концентрацию, а соответственно и молярную массу веществ (осмотический метод).
Активность.
Законы Рауля и Вант-Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов. По мере повышения концентрации растворенного вещества возрастают отклонения от законов идеальных растворов. Эти отклонения обусловлены различного рода взаимодействиями между частицами растворенного вещества, а также растворенного вещества и растворителя. Учет влияния на свойства растворов этих взаимодействий очень сложен и не всегда практически осуществим. Поэтому было предложено сохранить для описания свойств растворов все общие закономерности, применимые к идеальным растворам, но вместо входящей в них концентрации компонентов ввести активность. Активность а связана с концентрацией следующим соотношением

где у — коэффициент активности, который формально учитывает все виды взаимодействия частиц в данном растворе, приводящие к отклонению от свойств идеального раствора.
Коэффициент активности вычисляют по экспериментальным данным. Для этого измеряют какое-либо из свойств раствора (например, температуру кипения или замерзания) и определяют коэффициент активности как частное от деления экспериментально полученной величины на теоретически рассчитанную по законам идеальных растворов:

Числитель и знаменатель имеют одну и ту же размерность, поэтому коэффициент активности — безразмерная величина.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- § 1. ПРЕДМЕТ ХИМИИ
- § 2. ЗНАЧЕНИЕ ХИМИИ В ИЗУЧЕНИИ ПРИРОДЫ И РАЗВИТИИ ТЕХНИКИ
- 1. СТРОЕНИЕ ВЕЩЕСТВА
- Глава I. СТРОЕНИЕ АТОМА И СИСТЕМАТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- § 1.2. КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА
- § 1.3. КВАНТОВЫЕ ЧИСЛА И АТОМНЫЕ ОРБИТАЛИ
- § 1.4. МНОГОЭЛЕКТРОННЫЕ АТОМЫ
- § 1.5. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
- § 1.6. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- Глава II. ХИМИЧЕСКАЯ СВЯЗЬ
- § II.1. ОСНОВНЫЕ ВИДЫ И ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ
- § II.2. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ. ВАЛЕНТНОСТЬ
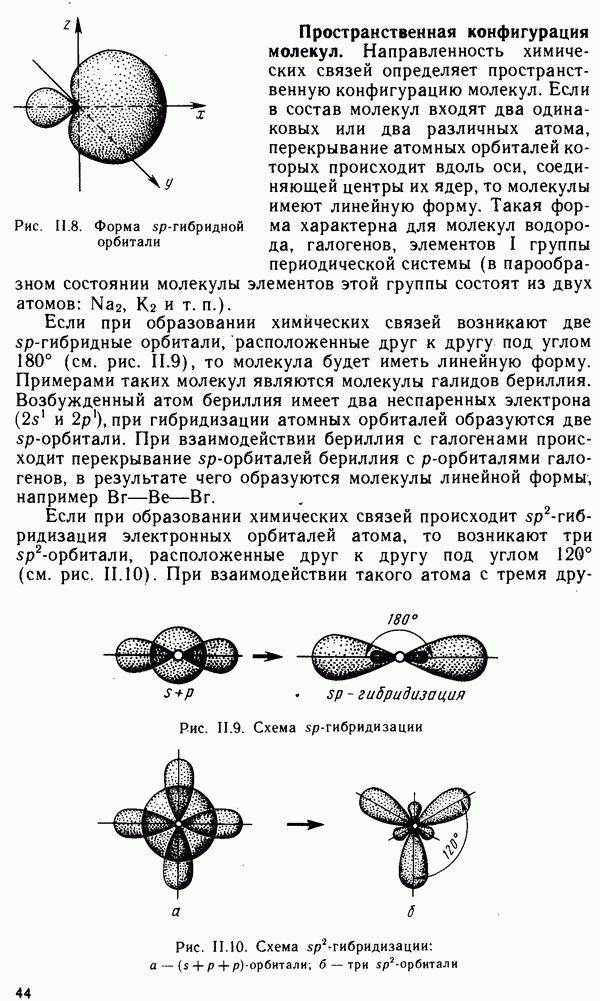
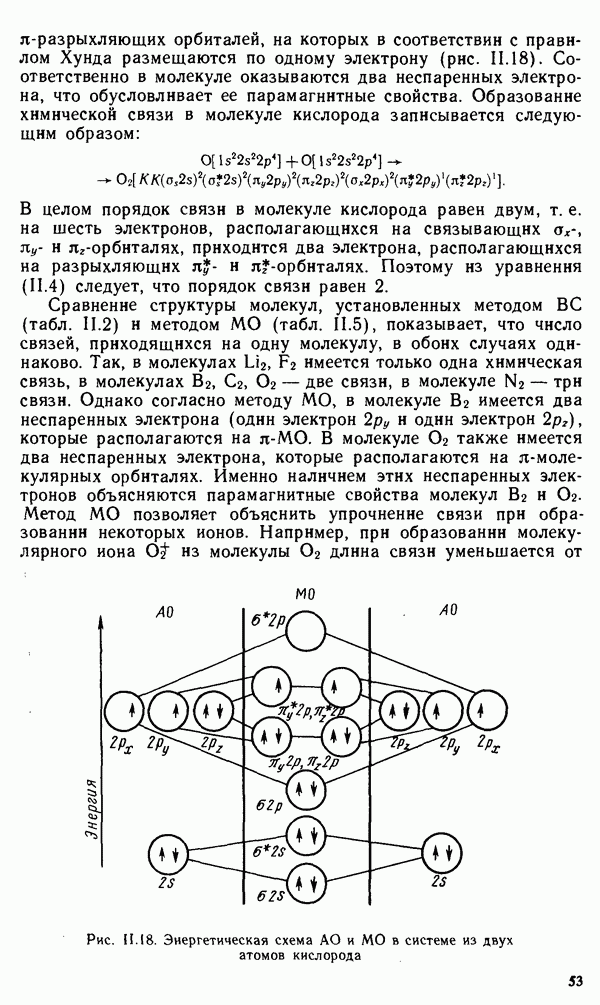
- § II.3. НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. ПРОСТРАНСТВЕННАЯ СТРУКТУРА МОЛЕКУЛ
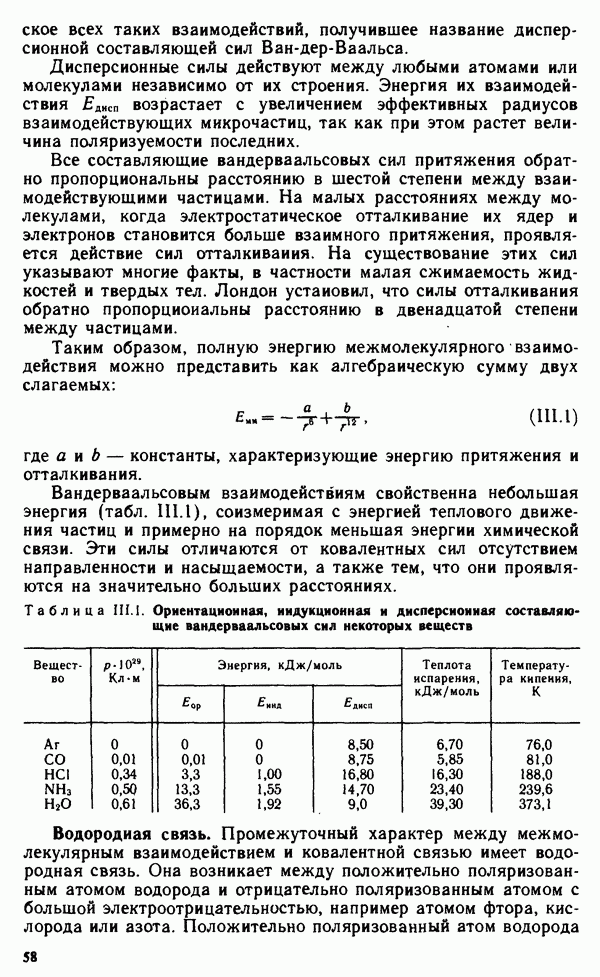
- § 11.4. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
- § 11.5. ЭЛЕКТРОННАЯ СТРУКТУРА НЕКОТОРЫХ МОЛЕКУЛ
- Глава III. ТИПЫ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ. КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- § III.1. ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ
- § III.2. СВОЙСТВА ВЕЩЕСТВ В РАЗЛИЧНЫХ СОСТОЯНИЯХ
- § III.3. СТРОЕНИЕ КРИСТАЛЛОВ. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ТЕЛАХ
- § III.4. МЕТАЛЛЫ, ПОЛУПРОВОДНИКИ И ДИЭЛЕКТРИКИ
- § III.5. РЕАЛЬНЫЕ КРИСТАЛЛЫ
- 2. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
- Глава IV. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ СРОДСТВО
- § IV.2. ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ И ФАЗОВЫХ ПРЕВРАЩЕНИЙ. ТЕРМОХИМИЧЕСКИЕ ЗАКОНЫ
- § IV.3. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
- § IV.4. ЭНТРОПИЯ. НАПРАВЛЕНИЕ И ПРЕДЕЛ ПРОТЕКАНИЯ ПРОЦЕССОВ В ИЗОЛИРОВАННЫХ СИСТЕМАХ
- § IV.5. ЭНЕРГИЯ ГИББСА И ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА ХИМИЧЕСКОЙ РЕАКЦИИ
- Глава V. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- § V.2. СКОРОСТЬ ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ
- § V.3. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- § V.4. ФИЗИЧЕСКИЕ ВОЗДЕЙСТВИЯ НА ХИМИЧЕСКИЕ РЕАКЦИИ. ЦЕПНЫЕ РЕАКЦИИ
- § V.5. КИНЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ О ХИМИЧЕСКОМ РАВНОВЕСИИ
- § V.6. ФАЗОВЫЕ РАВНОВЕСИЯ ПРАВИЛО ФАЗ
- § V.7. АДСОРБЦИОННОЕ РАВНОВЕСИЕ
- § V.8. КАТАЛИЗ
- 3. РАСТВОРЫ ДИСПЕРСНЫЕ СИСТЕМЫ ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- VI.1. ОБЩИЕ ПОНЯТИЯ О РАСТВОРАХ
- § VI.2. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЖИДКИХ РАСТВОРОВ
- § VI.3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ
- § VI.4. ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- § VI.5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
- § VI.6. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- § VI.7. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ
- § VI.8. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ
- Глава VII. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.1. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- § VII.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.3. ПОТЕНЦИАЛЫ МЕТАЛЛИЧЕСКИХ И ГАЗОВЫХ ЭЛЕКТРОДОВ
- § VII.4. ПОТЕНЦИАЛЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ (РЕДОКСИ-) ЭЛЕКТРОДОВ
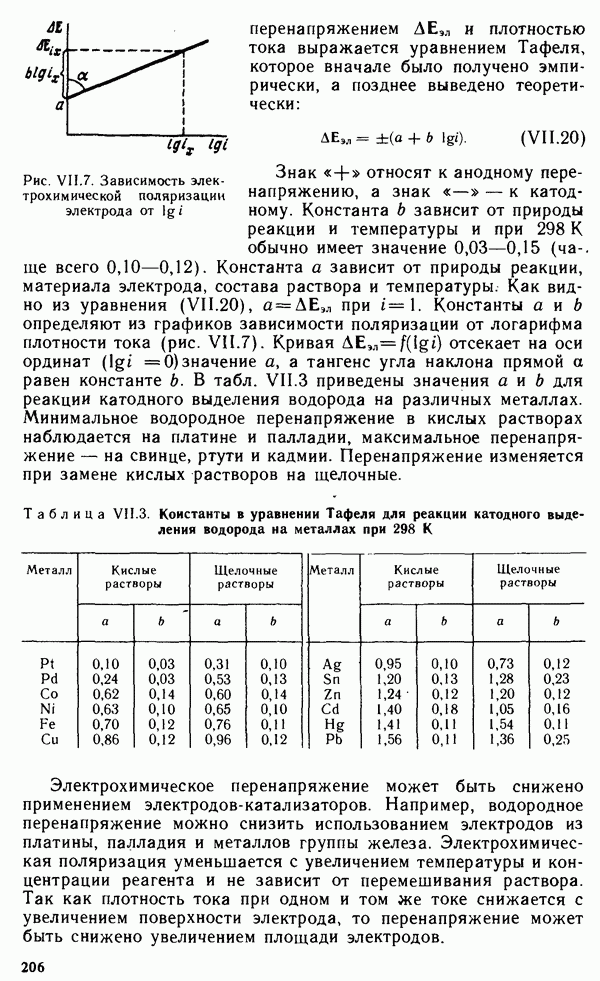
- § VII.5. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ. ПОЛЯРИЗАЦИЯ
- § VII.6. ЭЛЕКТРОЛИЗ
- Глава VIII. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- § VIII.1. ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ
- § VIII.2. ХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.4. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
- 4. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- Глава IX. ПРОСТЫЕ ВЕЩЕСТВА И ДВОЙНЫЕ СОЕДИНЕНИЯ. КРАТКИЙ ОБЗОР ХИМИЧЕСКИХ СВОЙСТВ s- И р-ЭЛЕМЕНТОВ
- § IX.2. МЕТАЛЛЫ И СПЛАВЫ. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА
- § IX.3. ДВОЙНЫЕ СОЕДИНЕНИЯ
- § IX.4. СВОЙСТВА МЕТАЛЛОВ ГЛАВНЫХ ПОДГРУПП I И II ГРУПП
- § IX.5. СВОЙСТВА р-ЭЛЕМЕНТОВ III ГРУППЫ
- § IX.6. СВОЙСТВА р-ЭЛЕМЕНТОВ IV ГРУППЫ
- § IX.7. СВОЙСТВА р-ЭЛЕМЕНТОВ V, VI И VII ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ
- Глава Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
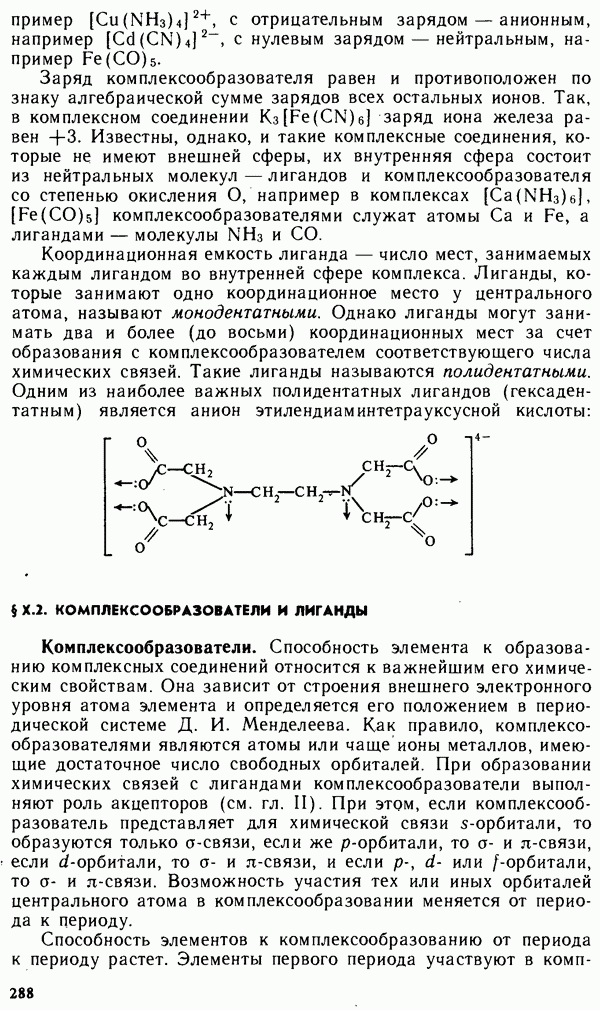
- § Х.1. СТРУКТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИИ
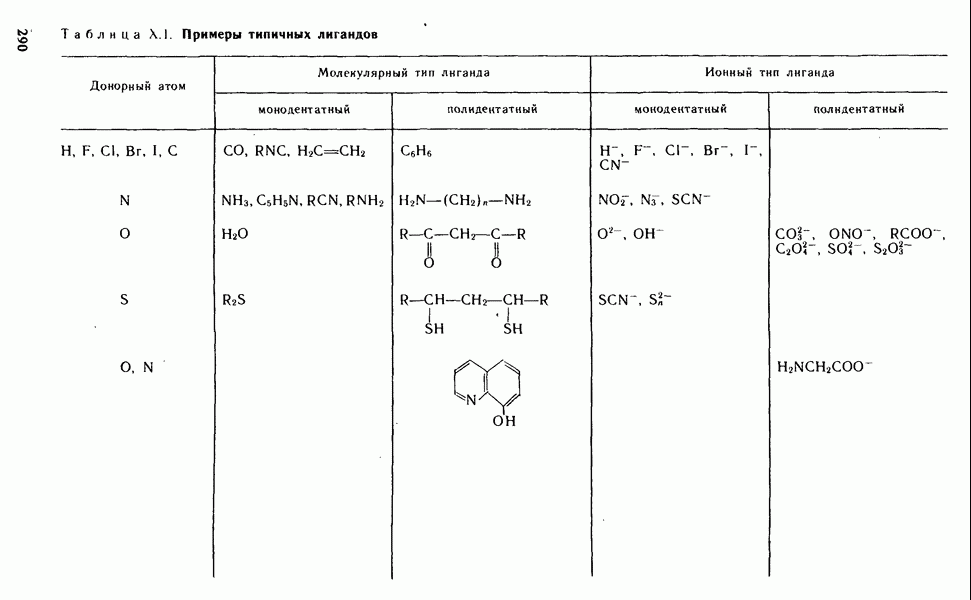
- § Х.2. КОМПЛЕКСООБРАЗОВАТЕЛИ И ЛИГАНДЫ
- § Х.3. НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- § Х.4. МЕТОДЫ РАСЧЕТА ХИМИЧЕСКИХ СВЯЗЕЙ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
- § Х.5. УСТОЙЧИВОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- Глава XI. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- § XI.1. ОСОБЕННОСТИ. ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ И КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- § XI.2. УГЛЕВОДОРОДЫ
- § ХI.3. ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
- 5. СПЕЦИАЛЬНЫЕ ВОПРОСЫ ХИМИИ
- Глава XII. ХИМИЯ КОНСТРУКЦИОННЫХ И ЭЛЕКТРОТЕХНИЧЕСКИХ МАТЕРИАЛОВ
- § XII.2. СВОЙСТВА ПЕРЕХОДНЫХ МЕТАЛЛОВ VIII ГРУППЫ
- § ХII.3. СВОЙСТВА ЭЛЕМЕНТОВ I И II ГРУПП
- § XII.4. ХИМИЯ ПОЛУПРОВОДНИКОВЫХ МАТЕРИАЛОВ
- § XII.5. МЕТОДЫ ПОЛУЧЕНИЯ МАТЕРИАЛОВ ВЫСОКОЙ ЧИСТОТЫ
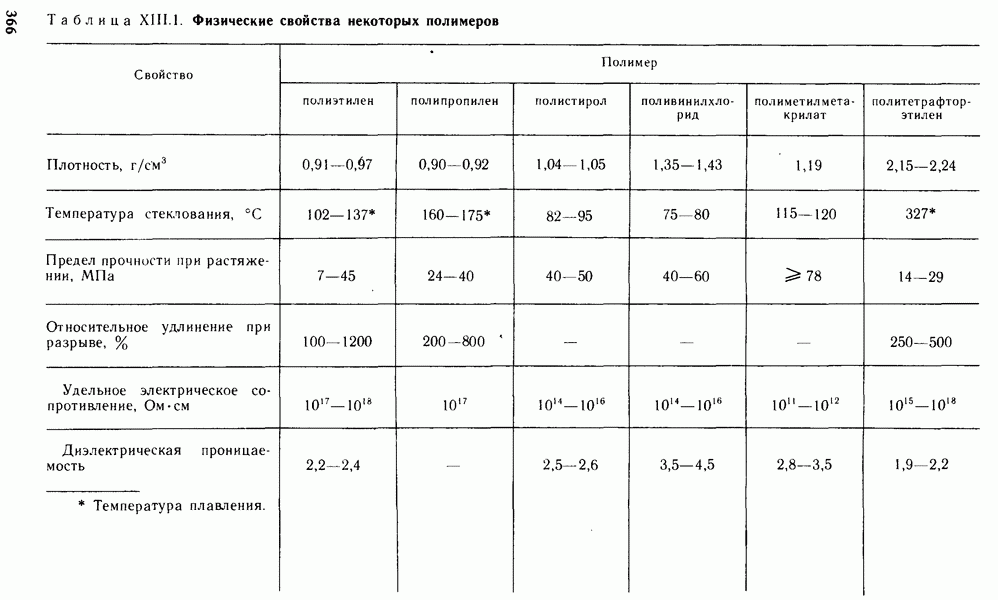
- Глава XIII. ПОЛИМЕРНЫЕ МАТЕРИАЛЫ И ИХ ПРИМЕНЕНИЕ В ЭНЕРГЕТИКЕ
- § XIII.1. МЕТОДЫ ПОЛУЧЕНИЯ ПОЛИМЕРОВ
- § XIII.2. СТРОЕНИЕ ПОЛИМЕРОВ
- § XIII.3. СВОЙСТВА ПОЛИМЕРОВ
- § XIII.4. ПРИМЕНЕНИЕ ПОЛИМЕРОВ
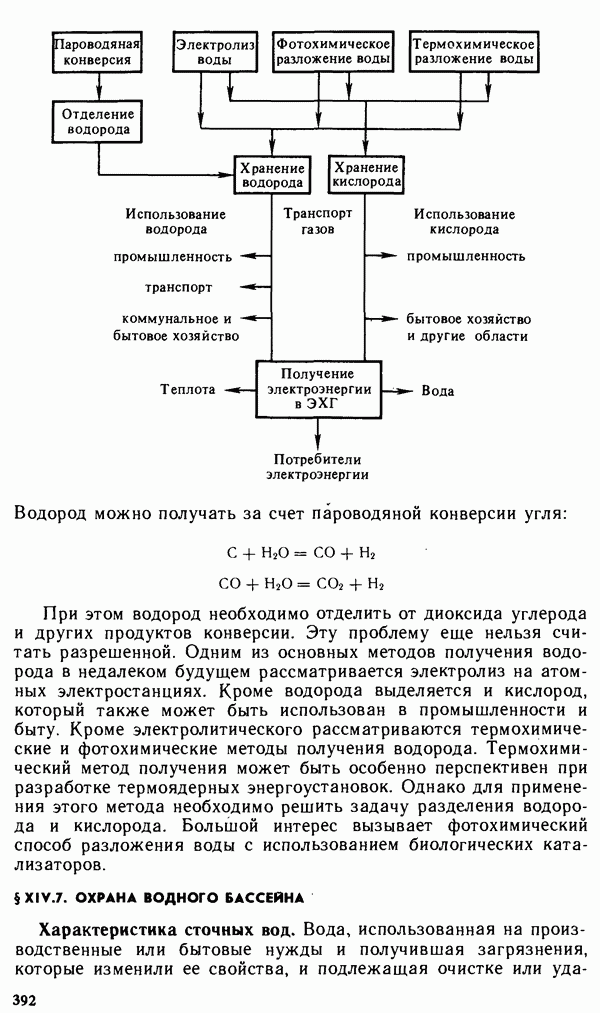
- Глава XIV. ХИМИЯ ВОДЫ И ТОПЛИВА. ХИМИЯ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ
- § XIV.1. СТРОЕНИЕ И СВОЙСТВА ВОДЫ
- § XIV.2. ПРИРОДНЫЕ ВОДЫ
- § ХIV.3. ОСНОВНЫЕ МЕТОДЫ ОЧИСТКИ ВОДЫ
- § XIV.4. СОСТАВ И СВОЙСТВА ОРГАНИЧЕСКОГО ТОПЛИВА
- § XIV.5. ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ОБЩЕСТВА
- § XIV.6. ОХРАНА ВОЗДУШНОГО БАССЕЙНА
- § XIV.7. ОХРАНА ВОДНОГО БАССЕЙНА
- Глава XV. ЯДЕРНАЯ ХИМИЯ И РАДИОХИМИЯ
- § XV.1. АТОМНОЕ ЯДРО. РАДИОАКТИВНОСТЬ
- § XV.2. ЯДЕРНЫЕ РЕАКЦИИ
- § XV.3. ЯДЕРНАЯ ЭНЕРГЕТИКА
- § XV.4. ХИМИЧЕСКИЕ СВОЙСТВА РАДИОАКТИВНЫХ ЭЛЕМЕНТОВ
- Глава XVI. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ В ЭНЕРГЕТИКЕ, ЭЛЕКТРОНИКЕ И АВТОМАТИКЕ
- § ХVI.1. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА. ЭЛЕКТРОХИМИЧЕСКИЕ ЭНЕРГОУСТАНОВКИ
- § XVI.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ (ХЕМОТРОНЫ)
- § ХVI.3. ЭЛЕКТРОХИМИЧЕСКАЯ АНОДНАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ
- § XVI.4. ПОЛУЧЕНИЕ И СВОЙСТВА ГАЛЬВАНОПОКРЫТИИ
- ЗАКЛЮЧЕНИЕ