| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 1.5. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
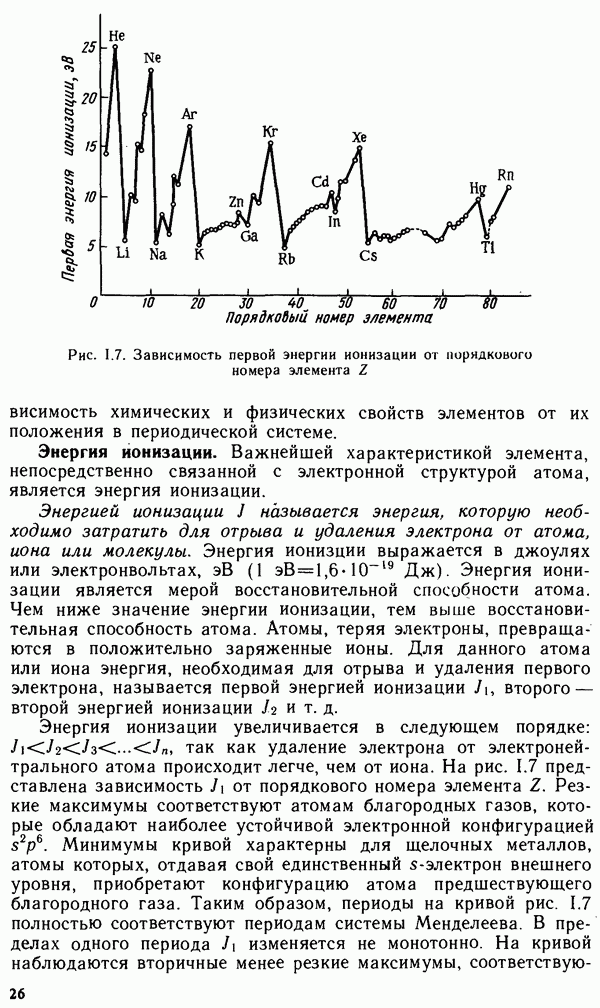
Одним из важнейших законов природы является периодический закон. Честь открытия этого закона принадлежит великому русскому химику Дмитрию Ивановичу Менделееву (март 1869 г.), Д. И. Менделеев так сформулировал закон: свойства простых
тел, также формы и свойства соединений элементов находятся в периодической зависимости от атомных весов элементов.
Периодический закон был создан на основе анализа макроскопических свойств элементов и их соединений. Менделеев полагал, что периодический закон является отражением глубоких закономерностей строения вещества. Выражением периодического закона служит таблица, наглядно отражающая эти закономерности и получившая название периодической системы элементов Д. И. Менделеева.
В настоящее время известно несколько сотен вариантов периодической системы элементов, но все они в своей основе содержат предложенные Менделеевым принципы ее построения. Наибольшее распространение получили короткая и длинная формы периодической системы элементов (см. первый и второй форзацы книги).
Развитие науки подтвердило гениальное предвидение Менделеева о том, что периодическому закону не грозит разрушение, а обещаются только надстройка и развитие. Дальнейшие исследования показали, что свойства элементов зависят прежде всего от заряда атомных ядер. Заряд ядра определяет электронное строение атома, которое раскрывает физический смысл периодического закона.
В 1914 г. английским ученым Г. Мозли был открыт следующий закон: корень квадратный из волнового числа определенной линии характеристического рентгеновского спектра элемента есть линейная функция заряда ядра, или, что то же, порядкового номера элемента:

где  — волновое число (величина, обратная длине волны); А — коэффициент пропорциональности;
— волновое число (величина, обратная длине волны); А — коэффициент пропорциональности;  — порядковый номер элемента;
— порядковый номер элемента;  — константа, зависящая от серии линий в рентгеновском спектре.
— константа, зависящая от серии линий в рентгеновском спектре.
Благодаря исследованиям Мозли было доказано, что заряд ядра численно равен порядковому номеру элемента. Работы Мозли также подтвердили правильность расположения элементов в периодической системе Д. И. Менделеева. Таким образом, заряд ядра атома или порядковый номер элемента определяют электронное строение атомов и соответственно свойства элементов. Поэтому в настоящее время периодический закон имеет формулировку: свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома или порядкового номера элемента.
Периодическая система элементов отражает электронное строение атомов. Каждый период начинается элементом, в атоме которого появляется электрон с новым значением главного квантового числа  При этом номер периода совпадает со значением
При этом номер периода совпадает со значением  внешнего энергетического уровня,
внешнего энергетического уровня,
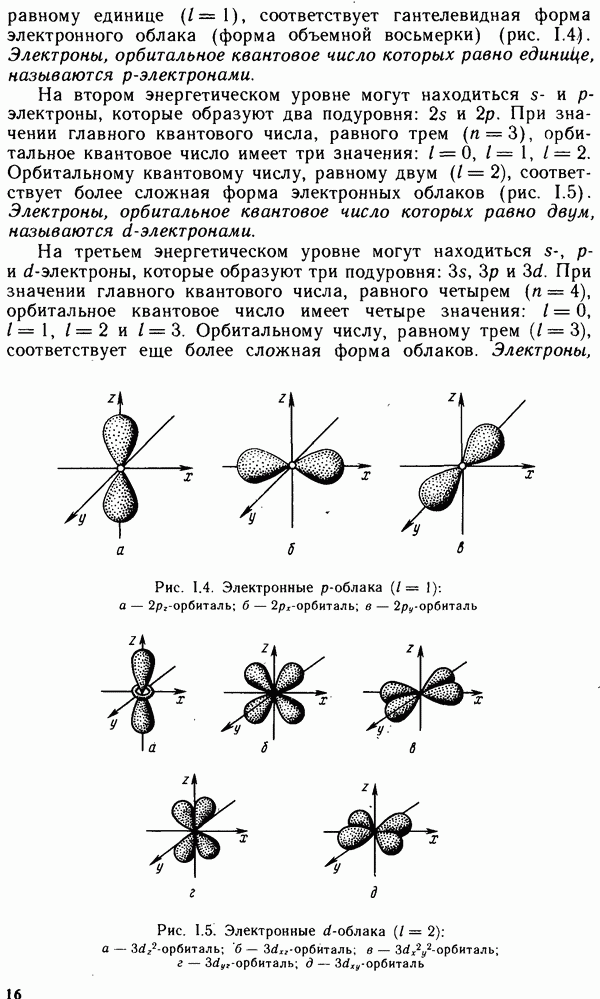
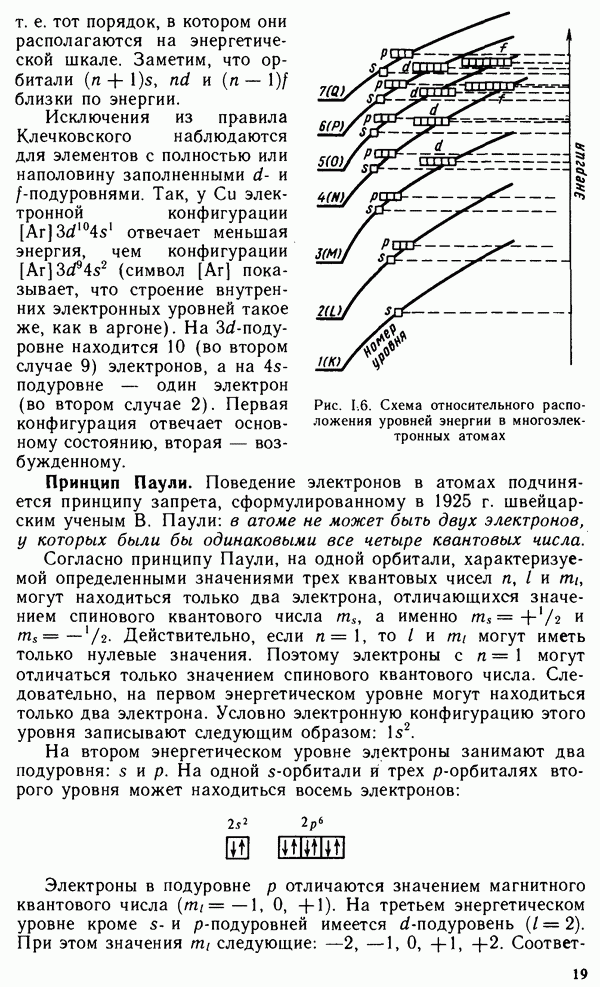
Первый период системы состоит из двух элементов — водорода и гелия. У водорода единственный электрон занимает самую низкую энергетическую орбиталь  гелия на этой орбитали находятся два электрона с антипараллельными спинами. Таким образом, у атома гелия полностью сформирован
гелия на этой орбитали находятся два электрона с антипараллельными спинами. Таким образом, у атома гелия полностью сформирован  -энергетический уровень, или К-слой.
-энергетический уровень, или К-слой.
У элементов второго периода начинается заполнение  -энер-гетического уровня, или
-энер-гетического уровня, или  -слоя. Второй период начинается с
-слоя. Второй период начинается с  в атоме которого имеется три электрона. Два из них находятся в К-слое, как и у атома гелия, третий электрон располагается в
в атоме которого имеется три электрона. Два из них находятся в К-слое, как и у атома гелия, третий электрон располагается в  -слое. У элементов второго периода также сначала заполняется
-слое. У элементов второго периода также сначала заполняется  -подуровень, а затем
-подуровень, а затем  -подуровень. У последнего элемента этого периода — неона все s- и
-подуровень. У последнего элемента этого периода — неона все s- и  -орбитали при
-орбитали при  заполнены. Элементы, в атомах которых в последнюю очередь заполняется
заполнены. Элементы, в атомах которых в последнюю очередь заполняется  -подуровень, называются
-подуровень, называются  -элементами, а
-элементами, а  -подуровень —
-подуровень —  лементами. Электронное строение атомов благородных газов служит остовом строения атомов последующих элементов.
лементами. Электронное строение атомов благородных газов служит остовом строения атомов последующих элементов.
Третий период начинается с натрия, в атоме которого заполняется М-энергетический уровень, или М-слой. Электронная конфигурация натрия  или
или  показывает, что остовом атома натрия служит электронная структура неона. У следующих за натрием элементов происходит заполнение s- и
показывает, что остовом атома натрия служит электронная структура неона. У следующих за натрием элементов происходит заполнение s- и  -орбиталей при
-орбиталей при  Однако при главном квантовом числе, равном трем, не используются все возможности заполнения вакантных орбиталей. При
Однако при главном квантовом числе, равном трем, не используются все возможности заполнения вакантных орбиталей. При  пять
пять  -орбиталей
-орбиталей  на каждой из которых может разместиться по два электрона, остаются свободными (10 вакансий). Несмотря на это, у элементов четвертого периода, у калия и кальция, начинает заполняться четвертый энергетический уровень, или
на каждой из которых может разместиться по два электрона, остаются свободными (10 вакансий). Несмотря на это, у элементов четвертого периода, у калия и кальция, начинает заполняться четвертый энергетический уровень, или  -слой
-слой 
У следующих после кальция десяти элементов, начиная со скандия, происходит формирование З-подуровня. Энергия отталкивания З-электронов меньше энергии их притяжения к ядру в связи с возрастанием его заряда. Поэтому З-подуровень энергетически более выгоден по сравнению с  -подуровнем. У атомов этих десяти элементов — от скандия
-подуровнем. У атомов этих десяти элементов — от скандия  до цинка
до цинка  — происходит заполнение соседнего с внешним энергетического подуровня.
— происходит заполнение соседнего с внешним энергетического подуровня.
Элементы, в атомах которых в последнюю очередь заполняется d-подуровень, называются  лементами. В каждом большом периоде d-элементы располагаются вслед за
лементами. В каждом большом периоде d-элементы располагаются вслед за  -эле-ментами, которые начинают период. Пятый период также начинается
-эле-ментами, которые начинают период. Пятый период также начинается  -элементами — рубидием и стронцием, за ними располагаются 10 элементов, в атомах которых формируется
-элементами — рубидием и стронцием, за ними располагаются 10 элементов, в атомах которых формируется  -подуро-вень. У атомов последних шести элементов пятого периода, начиная с индия и заканчивая ксеноном, формируется
-подуро-вень. У атомов последних шести элементов пятого периода, начиная с индия и заканчивая ксеноном, формируется  -подуровень. При этом
-подуровень. При этом  и
и  -подуровни остаются полностью вакантными, пятый же период полностью завершен. Эта закономерность четко прослеживается, начиная с третьего периода.
-подуровни остаются полностью вакантными, пятый же период полностью завершен. Эта закономерность четко прослеживается, начиная с третьего периода.
У первых двух элементов шестого периода электроны заполняют  -подуровень шестого энергетического уровня. Далее, как
-подуровень шестого энергетического уровня. Далее, как
и во всех больших периодах, начинает заполняться d-подуровень соседнего с внешним, в данном случае пятого уровня. Затем заполнение d-подуровня прерывается и энергетически более выгодным становится заполнение  -подуровня четвертого уровня. А у следующих четырнадцати элементов — лантаноидов — формируется
-подуровня четвертого уровня. А у следующих четырнадцати элементов — лантаноидов — формируется  -подуровень четвертого уровня, или
-подуровень четвертого уровня, или  -слоя. Формирование четвертого энергетического уровня завершается у атома лютеция
-слоя. Формирование четвертого энергетического уровня завершается у атома лютеция  . После заполнения
. После заполнения  -подуровня четвертого уровня у атомов элементов от гафния
-подуровня четвертого уровня у атомов элементов от гафния  до ртути
до ртути  продолжает заполняться d-подуровень пятого уровня. И далее следует шесть элементов, в атомах которых заполняется
продолжает заполняться d-подуровень пятого уровня. И далее следует шесть элементов, в атомах которых заполняется  -подуровень внешнего, т. е. шестого, энергетического уровня.
-подуровень внешнего, т. е. шестого, энергетического уровня.
Аналогичный порядок формирования энергетических уровней и у атомов элементов седьмого периода. У четырнадцати элементов этого периода от тория  до лоуренсия
до лоуренсия  — актиноидов — формируется
— актиноидов — формируется  -подуровень пятого уровня.
-подуровень пятого уровня.
Элементы, в атомах которых заполняется в последнюю очередь  -подуровень, называются
-подуровень, называются  -элементами. Они располагаются или в семействе лантаноидов (шестой период) или в семействе актиноидов (седьмой период). Оценка электронного строения и важнейших свойств пока неизвестных элементов седьмого периода показывает, что они должны быть аналогами соответствующих элементов шестого периода. Для элементов восьмого периода (состоящего согласно теории из 50 элементов) предполагается сложный характер изменения химических свойств по мере роста порядкового номера, который связан с нарушением последовательности заполнения энергетических подуровней в атомах.
-элементами. Они располагаются или в семействе лантаноидов (шестой период) или в семействе актиноидов (седьмой период). Оценка электронного строения и важнейших свойств пока неизвестных элементов седьмого периода показывает, что они должны быть аналогами соответствующих элементов шестого периода. Для элементов восьмого периода (состоящего согласно теории из 50 элементов) предполагается сложный характер изменения химических свойств по мере роста порядкового номера, который связан с нарушением последовательности заполнения энергетических подуровней в атомах.
Группы делятся на подгруппы — главную и побочную. К главным подгруппам принадлежат элементы, для атомов которых  равно номеру периода, а
равно номеру периода, а  равно нулю или единице, т. е. элементы, в атомах которых происходит заполнение энергетического уровня с данным
равно нулю или единице, т. е. элементы, в атомах которых происходит заполнение энергетического уровня с данным  К побочным подгруппам принадлежат элементы, в атомах которых происходит заполнение подуровней, оставшихся незавершенными. Для элементов побочных подгрупп
К побочным подгруппам принадлежат элементы, в атомах которых происходит заполнение подуровней, оставшихся незавершенными. Для элементов побочных подгрупп  заполняемого уровня меньше номера периода, а
заполняемого уровня меньше номера периода, а  равно двум или трем.
равно двум или трем.
Первый, второй и третий периоды периодической системы содержат элементы только главных подгрупп. С максимальным числом электронов, находящихся на s-, р- и d-подуровнях, связано число элементов в каждом периоде (кроме первого), а именно 8 элементов главных подгрупп, а в больших периодах — еще и по 10 элементов побочных подгрупп. Электронная структура атомов однозначно определяется зарядом ядра. По мере роста заряда происходит закономерная периодическая повторяемость электронных структур атомов, а следовательно, и повторяемость свойств элементов.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- § 1. ПРЕДМЕТ ХИМИИ
- § 2. ЗНАЧЕНИЕ ХИМИИ В ИЗУЧЕНИИ ПРИРОДЫ И РАЗВИТИИ ТЕХНИКИ
- 1. СТРОЕНИЕ ВЕЩЕСТВА
- Глава I. СТРОЕНИЕ АТОМА И СИСТЕМАТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- § 1.2. КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА
- § 1.3. КВАНТОВЫЕ ЧИСЛА И АТОМНЫЕ ОРБИТАЛИ
- § 1.4. МНОГОЭЛЕКТРОННЫЕ АТОМЫ
- § 1.5. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
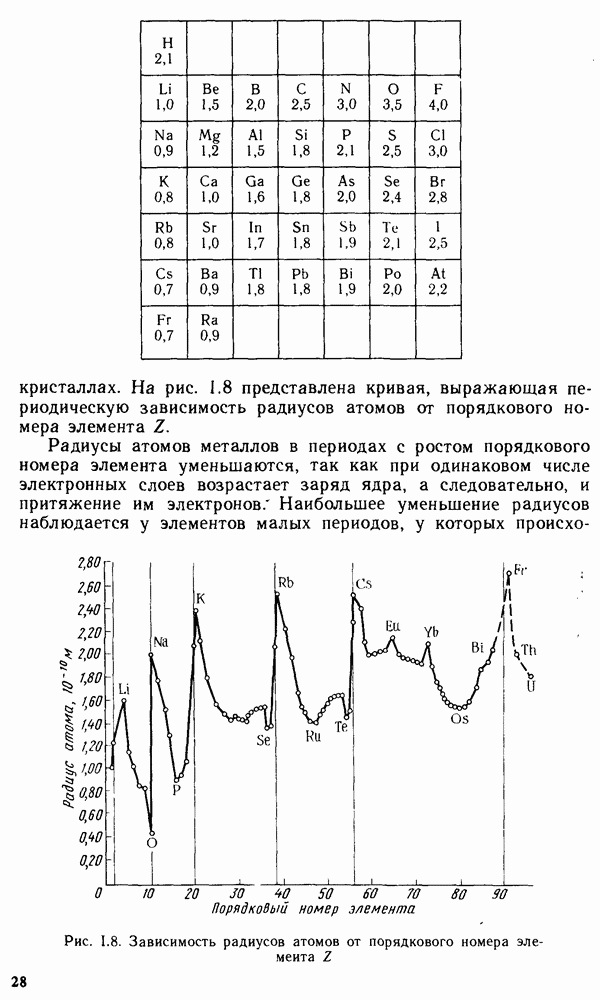
- § 1.6. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- Глава II. ХИМИЧЕСКАЯ СВЯЗЬ
- § II.1. ОСНОВНЫЕ ВИДЫ И ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ
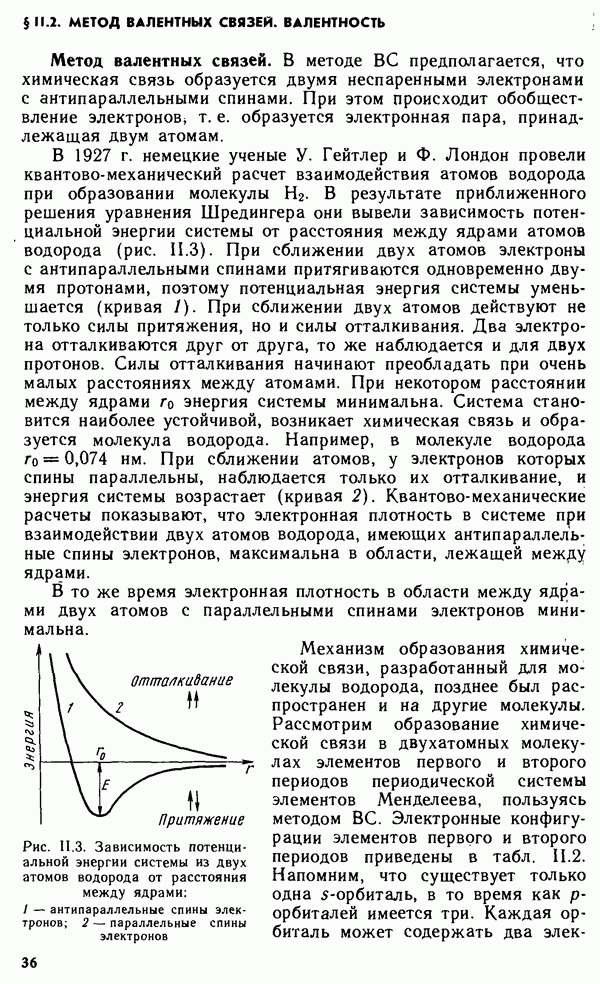
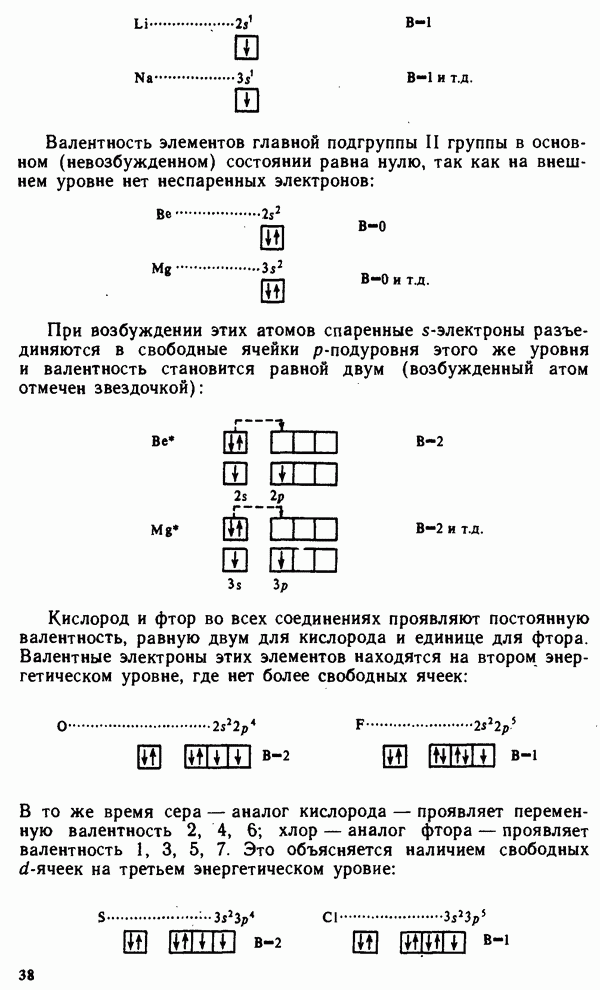
- § II.2. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ. ВАЛЕНТНОСТЬ
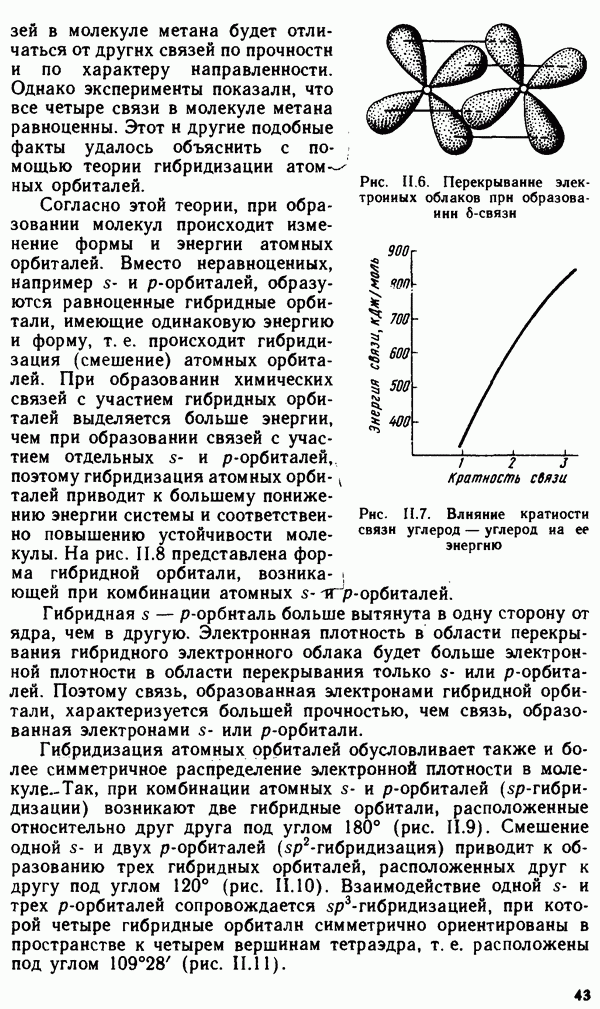
- § II.3. НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. ПРОСТРАНСТВЕННАЯ СТРУКТУРА МОЛЕКУЛ
- § 11.4. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
- § 11.5. ЭЛЕКТРОННАЯ СТРУКТУРА НЕКОТОРЫХ МОЛЕКУЛ
- Глава III. ТИПЫ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ. КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- § III.1. ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ
- § III.2. СВОЙСТВА ВЕЩЕСТВ В РАЗЛИЧНЫХ СОСТОЯНИЯХ
- § III.3. СТРОЕНИЕ КРИСТАЛЛОВ. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ТЕЛАХ
- § III.4. МЕТАЛЛЫ, ПОЛУПРОВОДНИКИ И ДИЭЛЕКТРИКИ
- § III.5. РЕАЛЬНЫЕ КРИСТАЛЛЫ
- 2. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
- Глава IV. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ СРОДСТВО
- § IV.2. ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ И ФАЗОВЫХ ПРЕВРАЩЕНИЙ. ТЕРМОХИМИЧЕСКИЕ ЗАКОНЫ
- § IV.3. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
- § IV.4. ЭНТРОПИЯ. НАПРАВЛЕНИЕ И ПРЕДЕЛ ПРОТЕКАНИЯ ПРОЦЕССОВ В ИЗОЛИРОВАННЫХ СИСТЕМАХ
- § IV.5. ЭНЕРГИЯ ГИББСА И ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА ХИМИЧЕСКОЙ РЕАКЦИИ
- Глава V. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- § V.2. СКОРОСТЬ ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ
- § V.3. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- § V.4. ФИЗИЧЕСКИЕ ВОЗДЕЙСТВИЯ НА ХИМИЧЕСКИЕ РЕАКЦИИ. ЦЕПНЫЕ РЕАКЦИИ
- § V.5. КИНЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ О ХИМИЧЕСКОМ РАВНОВЕСИИ
- § V.6. ФАЗОВЫЕ РАВНОВЕСИЯ ПРАВИЛО ФАЗ
- § V.7. АДСОРБЦИОННОЕ РАВНОВЕСИЕ
- § V.8. КАТАЛИЗ
- 3. РАСТВОРЫ ДИСПЕРСНЫЕ СИСТЕМЫ ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
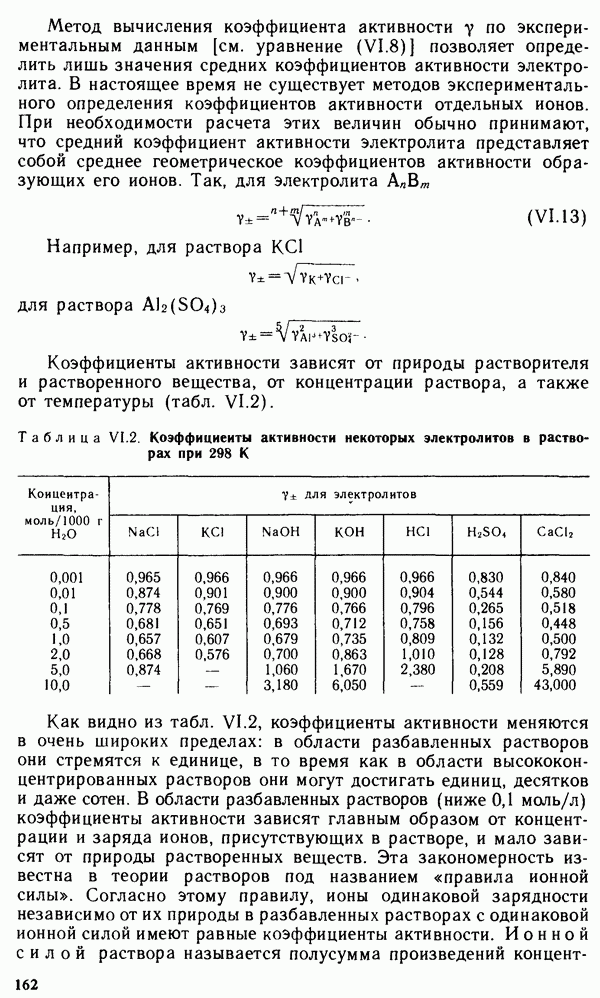
- VI.1. ОБЩИЕ ПОНЯТИЯ О РАСТВОРАХ
- § VI.2. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЖИДКИХ РАСТВОРОВ
- § VI.3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ
- § VI.4. ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- § VI.5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
- § VI.6. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- § VI.7. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ
- § VI.8. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ
- Глава VII. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.1. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- § VII.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.3. ПОТЕНЦИАЛЫ МЕТАЛЛИЧЕСКИХ И ГАЗОВЫХ ЭЛЕКТРОДОВ
- § VII.4. ПОТЕНЦИАЛЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ (РЕДОКСИ-) ЭЛЕКТРОДОВ
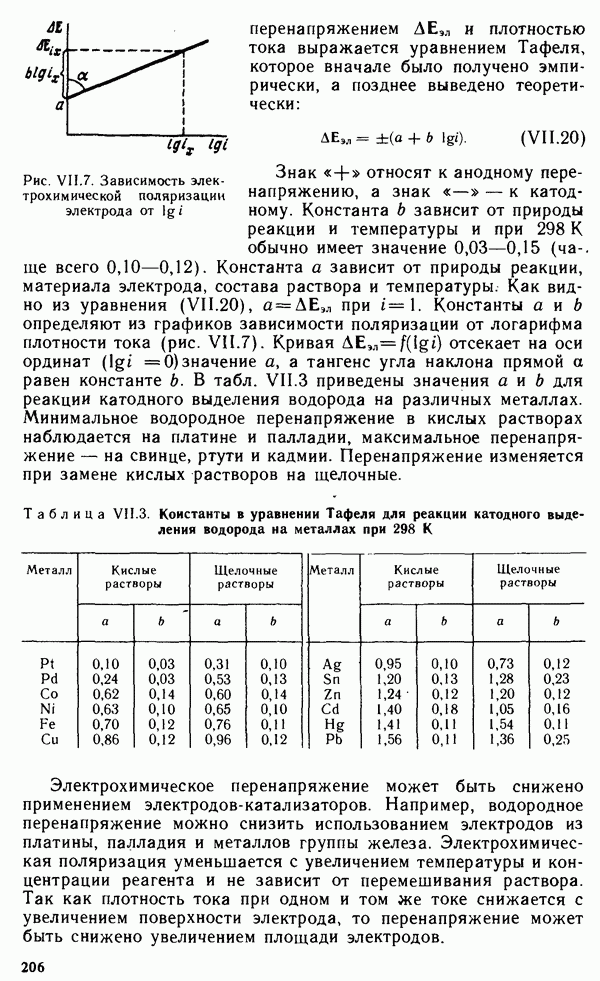
- § VII.5. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ. ПОЛЯРИЗАЦИЯ
- § VII.6. ЭЛЕКТРОЛИЗ
- Глава VIII. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- § VIII.1. ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ
- § VIII.2. ХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.4. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
- 4. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- Глава IX. ПРОСТЫЕ ВЕЩЕСТВА И ДВОЙНЫЕ СОЕДИНЕНИЯ. КРАТКИЙ ОБЗОР ХИМИЧЕСКИХ СВОЙСТВ s- И р-ЭЛЕМЕНТОВ
- § IX.2. МЕТАЛЛЫ И СПЛАВЫ. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА
- § IX.3. ДВОЙНЫЕ СОЕДИНЕНИЯ
- § IX.4. СВОЙСТВА МЕТАЛЛОВ ГЛАВНЫХ ПОДГРУПП I И II ГРУПП
- § IX.5. СВОЙСТВА р-ЭЛЕМЕНТОВ III ГРУППЫ
- § IX.6. СВОЙСТВА р-ЭЛЕМЕНТОВ IV ГРУППЫ
- § IX.7. СВОЙСТВА р-ЭЛЕМЕНТОВ V, VI И VII ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ
- Глава Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
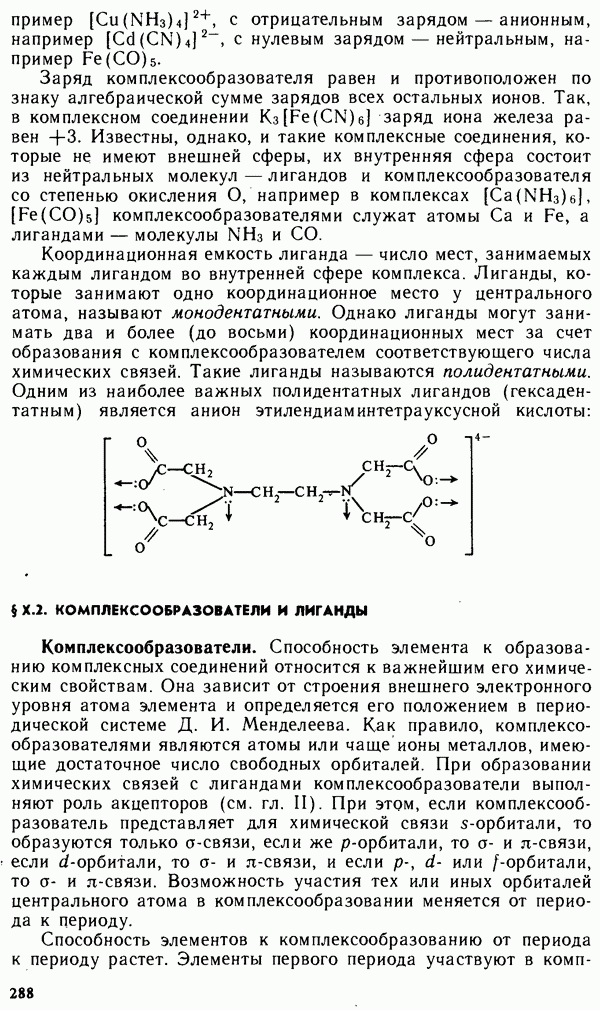
- § Х.1. СТРУКТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИИ
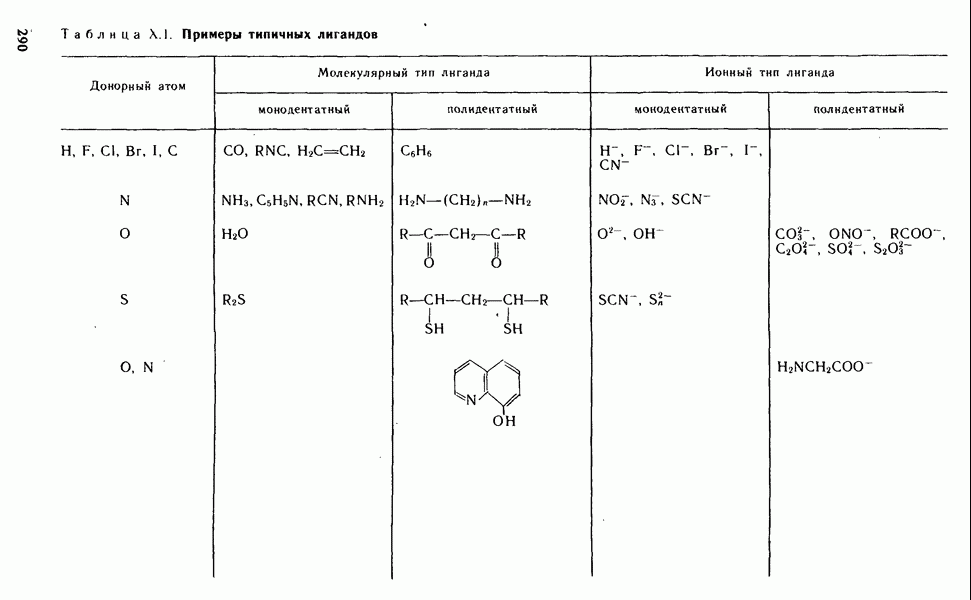
- § Х.2. КОМПЛЕКСООБРАЗОВАТЕЛИ И ЛИГАНДЫ
- § Х.3. НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- § Х.4. МЕТОДЫ РАСЧЕТА ХИМИЧЕСКИХ СВЯЗЕЙ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
- § Х.5. УСТОЙЧИВОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- Глава XI. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- § XI.1. ОСОБЕННОСТИ. ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ И КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- § XI.2. УГЛЕВОДОРОДЫ
- § ХI.3. ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
- 5. СПЕЦИАЛЬНЫЕ ВОПРОСЫ ХИМИИ
- Глава XII. ХИМИЯ КОНСТРУКЦИОННЫХ И ЭЛЕКТРОТЕХНИЧЕСКИХ МАТЕРИАЛОВ
- § XII.2. СВОЙСТВА ПЕРЕХОДНЫХ МЕТАЛЛОВ VIII ГРУППЫ
- § ХII.3. СВОЙСТВА ЭЛЕМЕНТОВ I И II ГРУПП
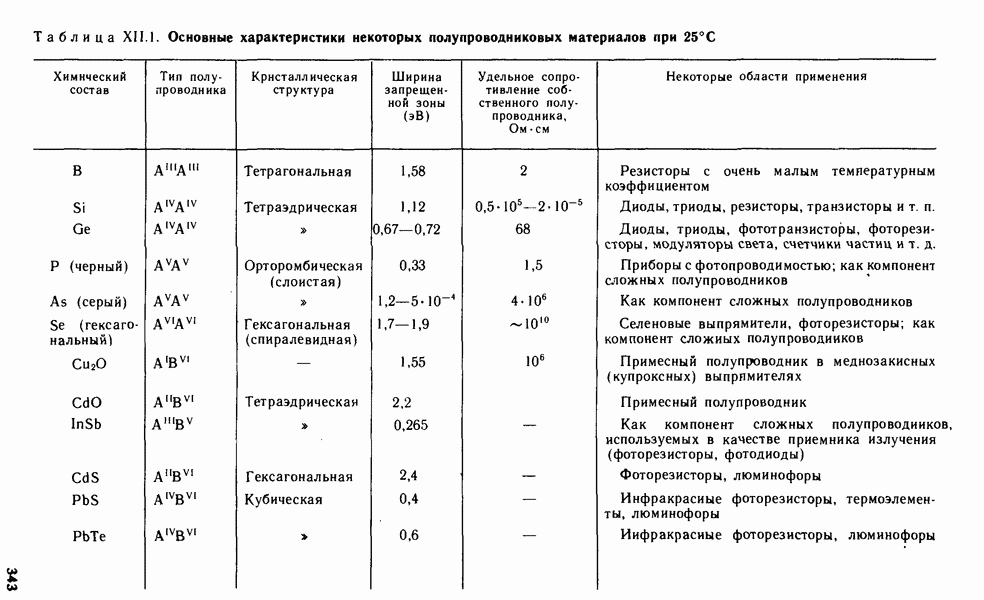
- § XII.4. ХИМИЯ ПОЛУПРОВОДНИКОВЫХ МАТЕРИАЛОВ
- § XII.5. МЕТОДЫ ПОЛУЧЕНИЯ МАТЕРИАЛОВ ВЫСОКОЙ ЧИСТОТЫ
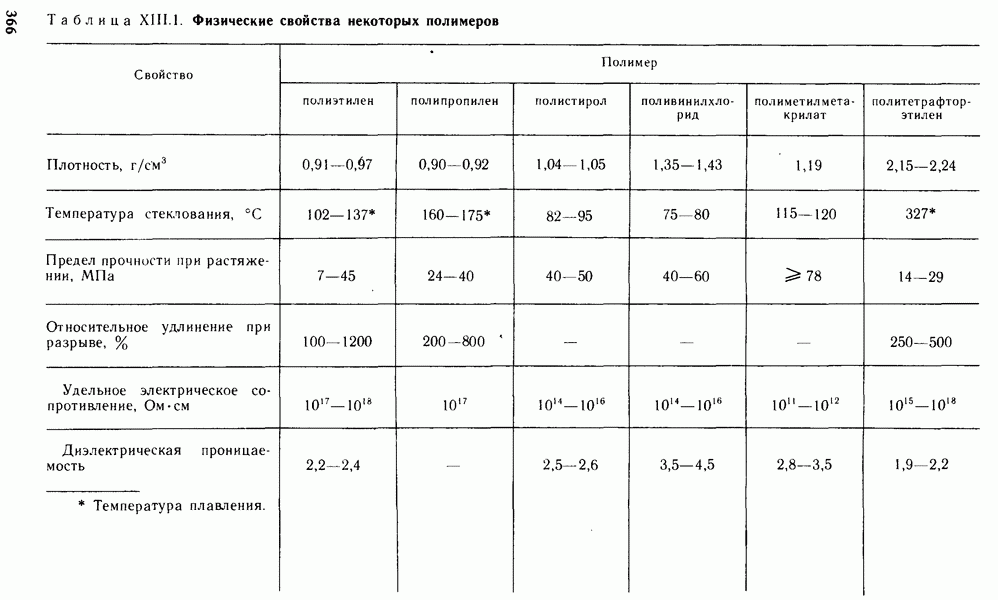
- Глава XIII. ПОЛИМЕРНЫЕ МАТЕРИАЛЫ И ИХ ПРИМЕНЕНИЕ В ЭНЕРГЕТИКЕ
- § XIII.1. МЕТОДЫ ПОЛУЧЕНИЯ ПОЛИМЕРОВ
- § XIII.2. СТРОЕНИЕ ПОЛИМЕРОВ
- § XIII.3. СВОЙСТВА ПОЛИМЕРОВ
- § XIII.4. ПРИМЕНЕНИЕ ПОЛИМЕРОВ
- Глава XIV. ХИМИЯ ВОДЫ И ТОПЛИВА. ХИМИЯ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ
- § XIV.1. СТРОЕНИЕ И СВОЙСТВА ВОДЫ
- § XIV.2. ПРИРОДНЫЕ ВОДЫ
- § ХIV.3. ОСНОВНЫЕ МЕТОДЫ ОЧИСТКИ ВОДЫ
- § XIV.4. СОСТАВ И СВОЙСТВА ОРГАНИЧЕСКОГО ТОПЛИВА
- § XIV.5. ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ОБЩЕСТВА
- § XIV.6. ОХРАНА ВОЗДУШНОГО БАССЕЙНА
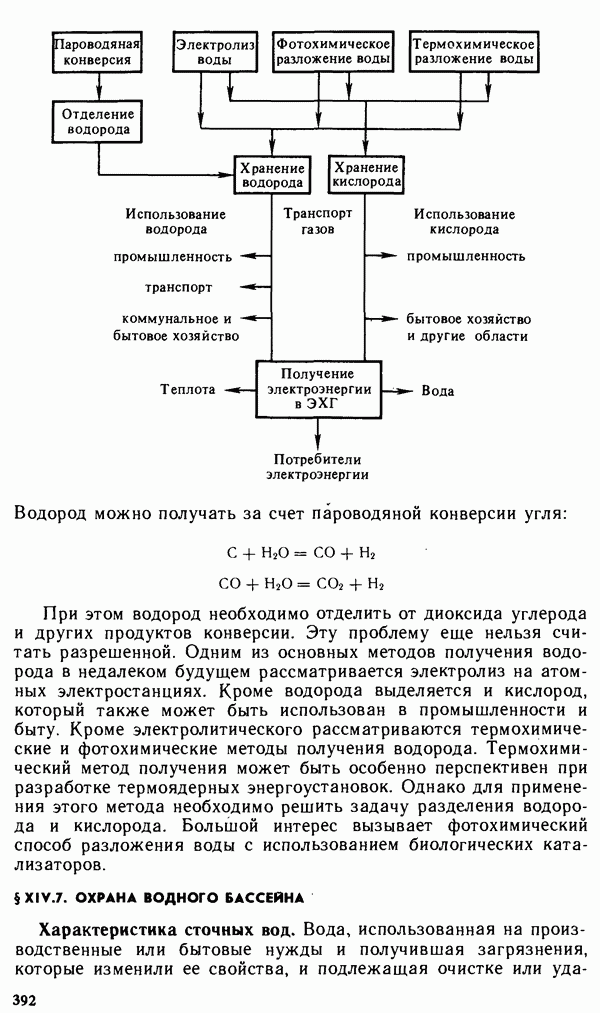
- § XIV.7. ОХРАНА ВОДНОГО БАССЕЙНА
- Глава XV. ЯДЕРНАЯ ХИМИЯ И РАДИОХИМИЯ
- § XV.1. АТОМНОЕ ЯДРО. РАДИОАКТИВНОСТЬ
- § XV.2. ЯДЕРНЫЕ РЕАКЦИИ
- § XV.3. ЯДЕРНАЯ ЭНЕРГЕТИКА
- § XV.4. ХИМИЧЕСКИЕ СВОЙСТВА РАДИОАКТИВНЫХ ЭЛЕМЕНТОВ
- Глава XVI. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ В ЭНЕРГЕТИКЕ, ЭЛЕКТРОНИКЕ И АВТОМАТИКЕ
- § ХVI.1. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА. ЭЛЕКТРОХИМИЧЕСКИЕ ЭНЕРГОУСТАНОВКИ
- § XVI.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ (ХЕМОТРОНЫ)
- § ХVI.3. ЭЛЕКТРОХИМИЧЕСКАЯ АНОДНАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ
- § XVI.4. ПОЛУЧЕНИЕ И СВОЙСТВА ГАЛЬВАНОПОКРЫТИИ
- ЗАКЛЮЧЕНИЕ