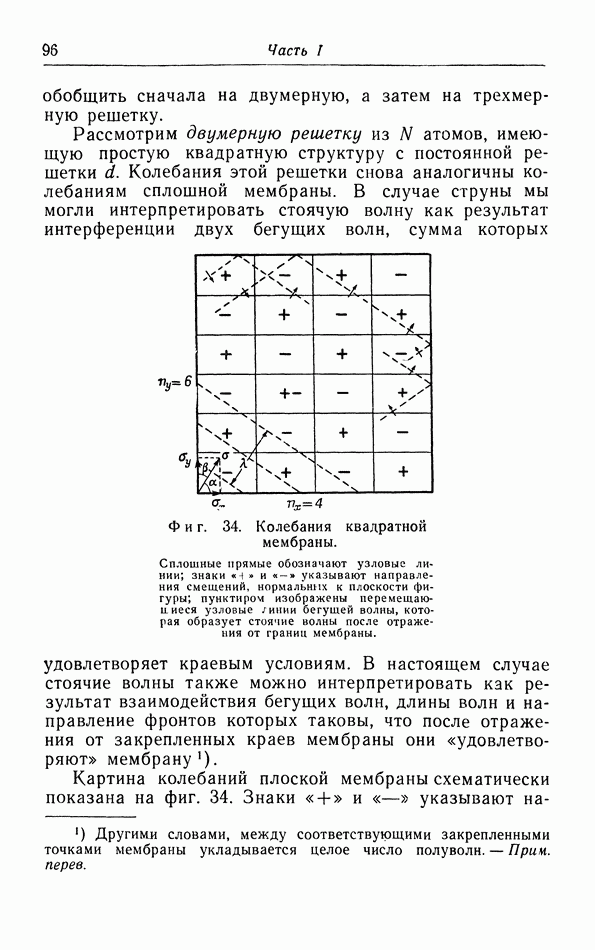
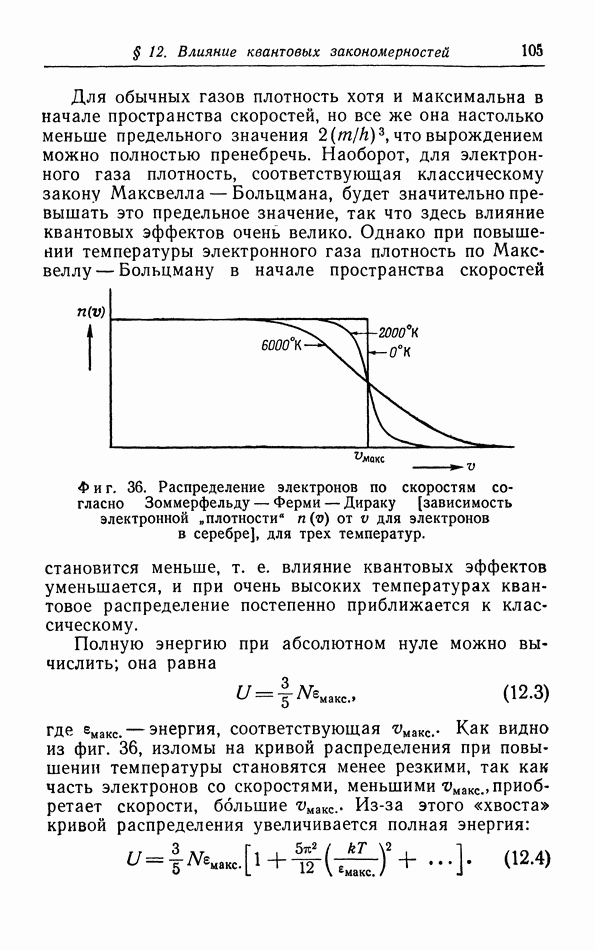
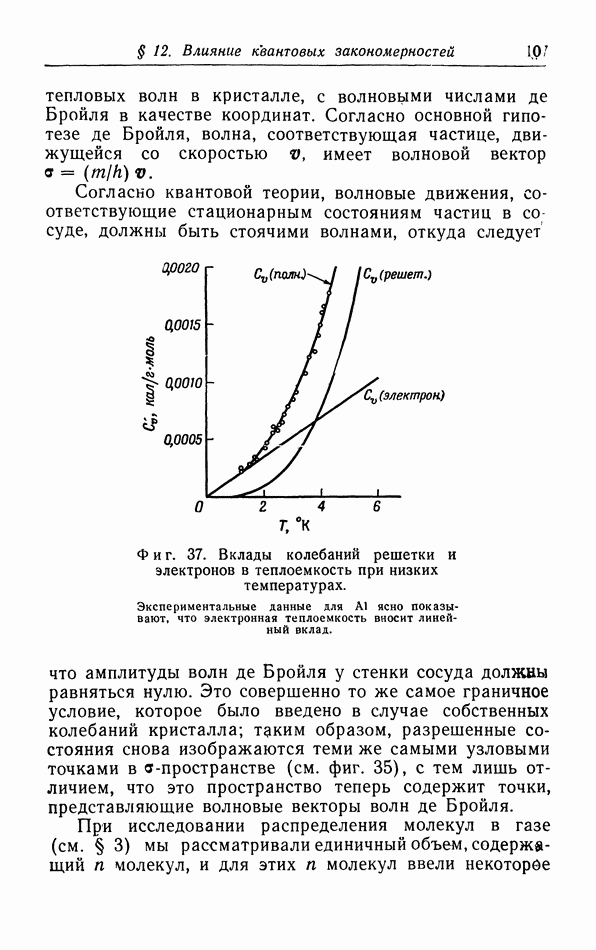
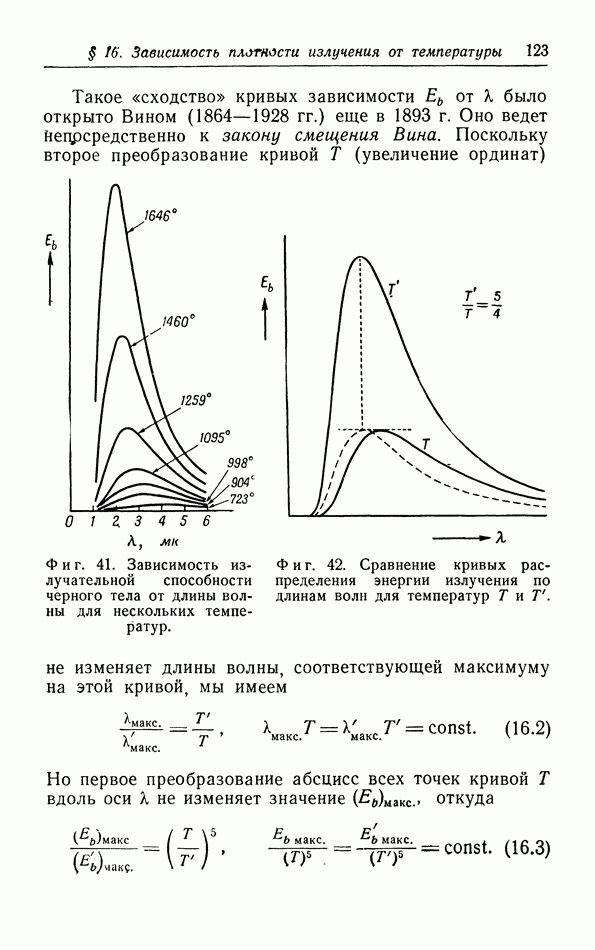
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
в. Взаимодействие молекул.
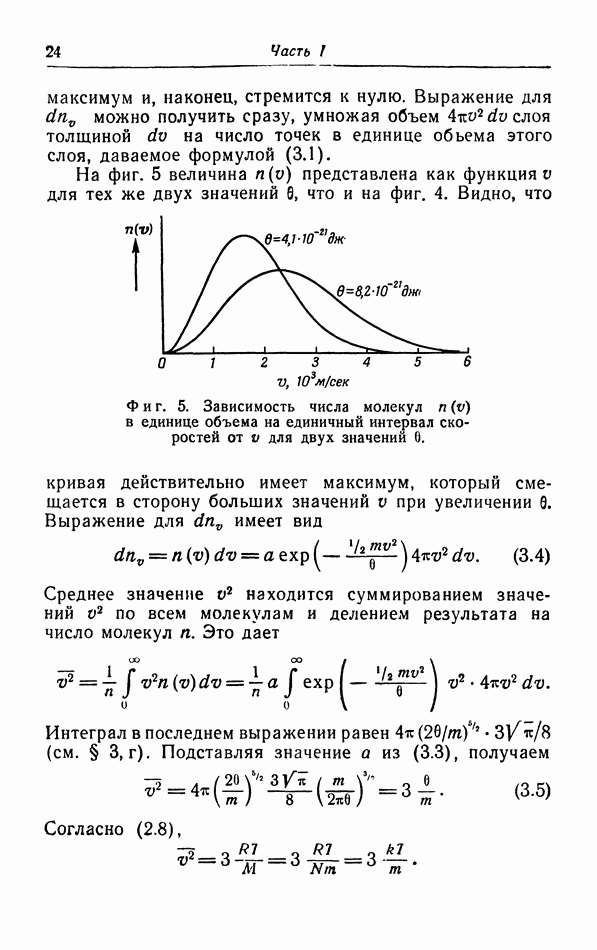
Постоянные a и b в уравнении  Ваальса можно вычислить по найденным
Ваальса можно вычислить по найденным
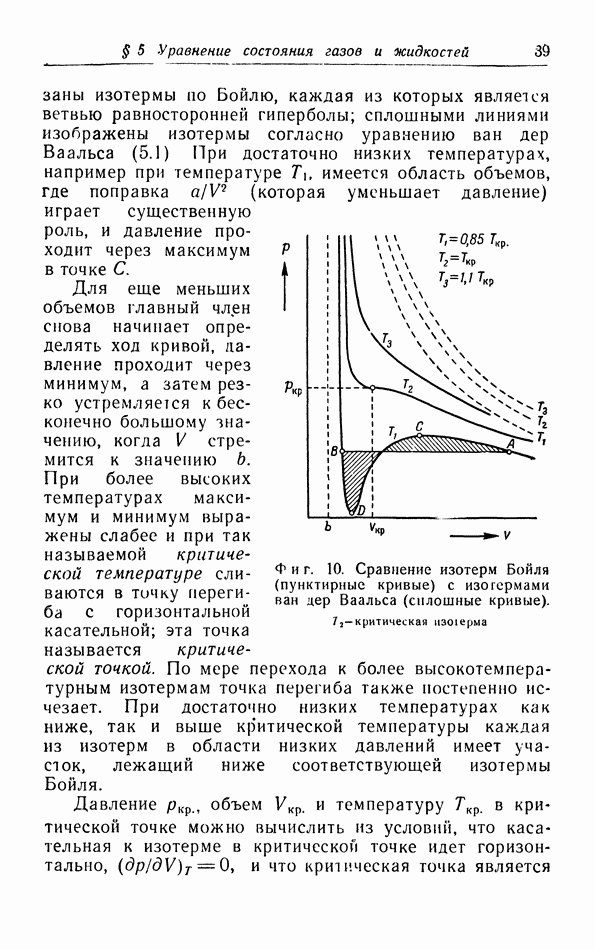
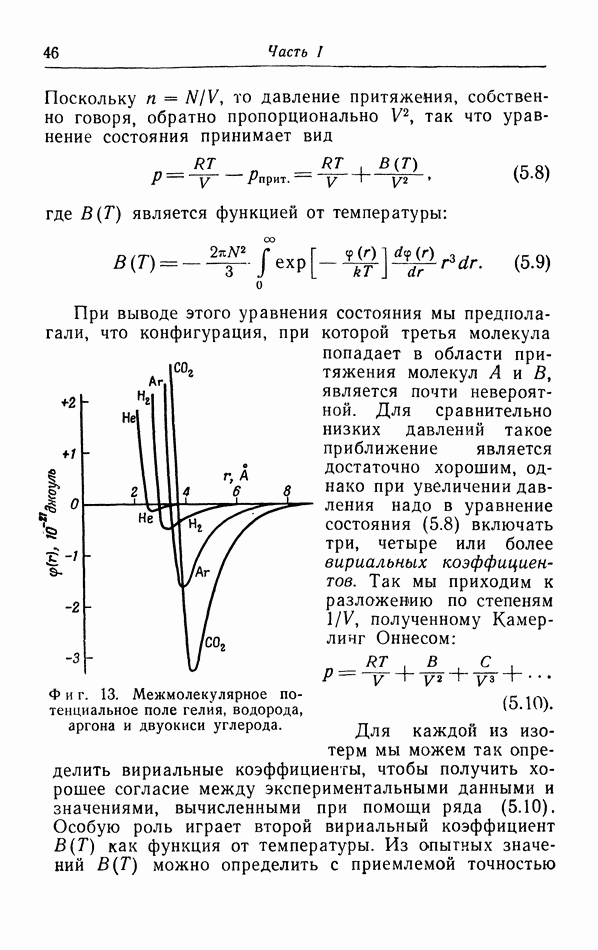
на опыте значениям критических величин. При этом обнаруживается, что хотя уравнение (5.1) качественно описывает изотермы, однако получить количественное согласие с опытными кривыми при постоянных значениях a и b невозможно. Дело в том, что при выводе уравнения (5.1) мы сделали ряд предположений, справедливых лишь для сравнительно разреженных газов, и, кроме того, использовали также весьма упрощенную картину взаимодействия между молекулами. Этому вопросу мы теперь уделим несколько большее внимание.
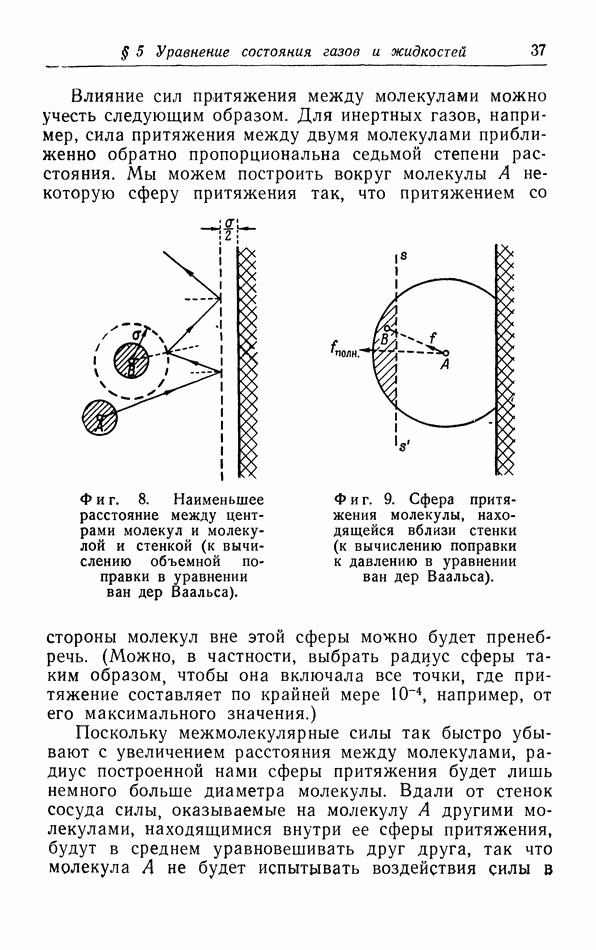
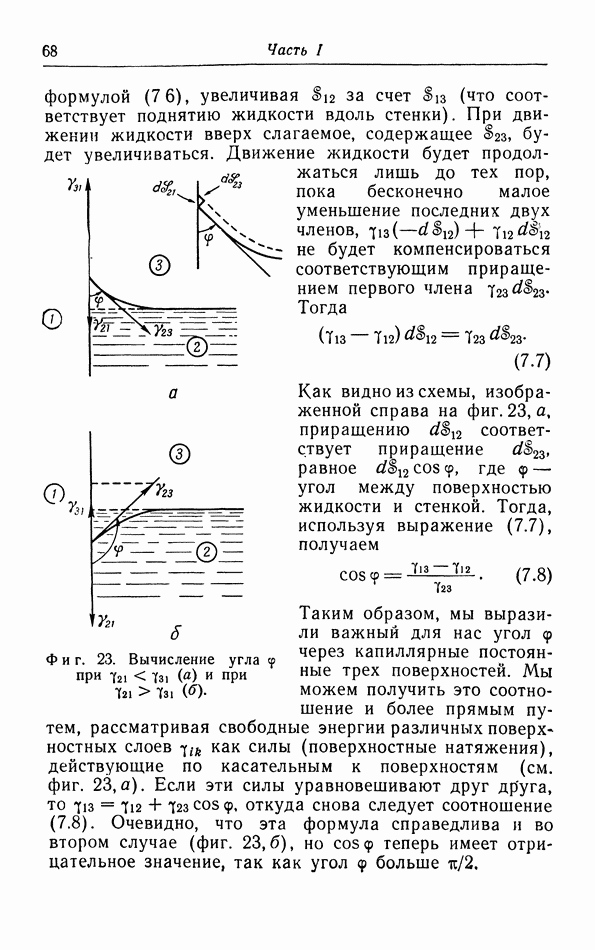
Рассмотрение структуры агомов и молекул показывает, что они, естественно, не имеют геометрически определенного диаметра. Мы можем лишь полагать, что если молекулы сближаются в такой степени, что их электронные облака начинают заметно возмущать друг друга, то электроны различных молекул будут очень резко отталкивать друг друга с силой, которая быстро возрастает при дальнейшем уменьшении расстояния между молекулами. Поскольку возрастание этой силы происходит весьма резко, целесообразно ввести эффективный диаметр молекул, определяемый как расстояние между молекулами, при котором сила отталкивания начинает играть главную роль.
Если расстояние между молекулами больше эффективного диаметра, то молекулы притягивают друг друга. Наличие сил притяжения связано с тем обстоятельством, что хотя вращающиеся вокруг ядер электроны полностью компенсируют заряды этих ядер и молекула в целом является электрически нейтральной, все же электрическое поле вне молекулы полностью не исчезает, так что остается взаимодействие, обусловленное электрическими диполями, квадруполями и т. д.
Если расстояние  между молекулами уменьшается, то сила притяжения возрастает пропорционально
между молекулами уменьшается, то сила притяжения возрастает пропорционально  и на расстоянии
и на расстоянии  (фиг. 11) сила отталкивания и сила притяжения уравновешивают друг друга. При дальнейшем сближении сила
(фиг. 11) сила отталкивания и сила притяжения уравновешивают друг друга. При дальнейшем сближении сила  между молекулами является отталкивающей. Этой межмолекулярной силе
между молекулами является отталкивающей. Этой межмолекулярной силе  соответствует межмолекулярная потенциальная энергия, определяющая межмолекулярное потенциальное поле.
соответствует межмолекулярная потенциальная энергия, определяющая межмолекулярное потенциальное поле.
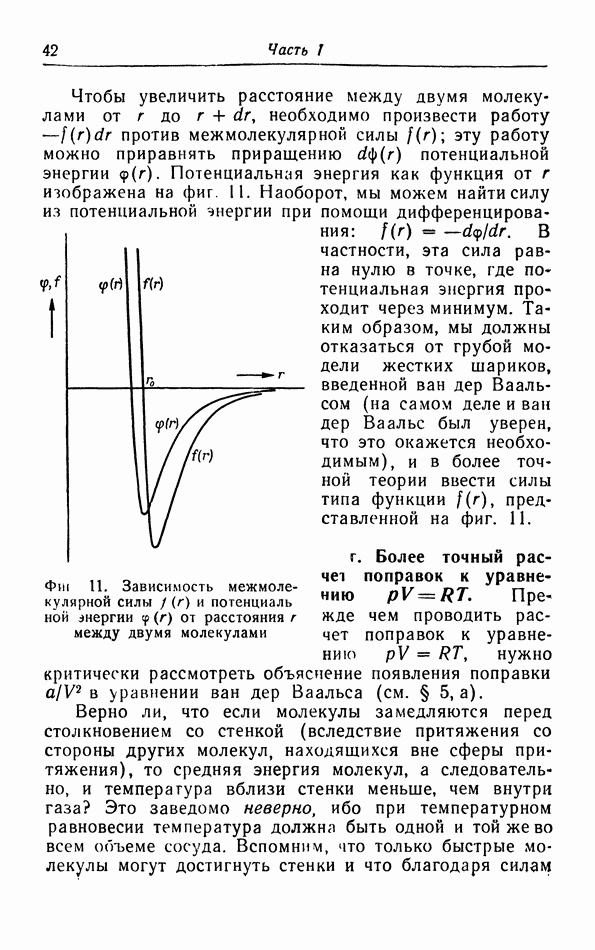
Чтобы увеличить расстояние между двумя молекулами от  до
до  необходимо произвести работу
необходимо произвести работу  против межмолекулярной силы
против межмолекулярной силы  эту работу можно приравнять приращению
эту работу можно приравнять приращению  потенциальной энергии
потенциальной энергии  Потенциальная энергия как функция от
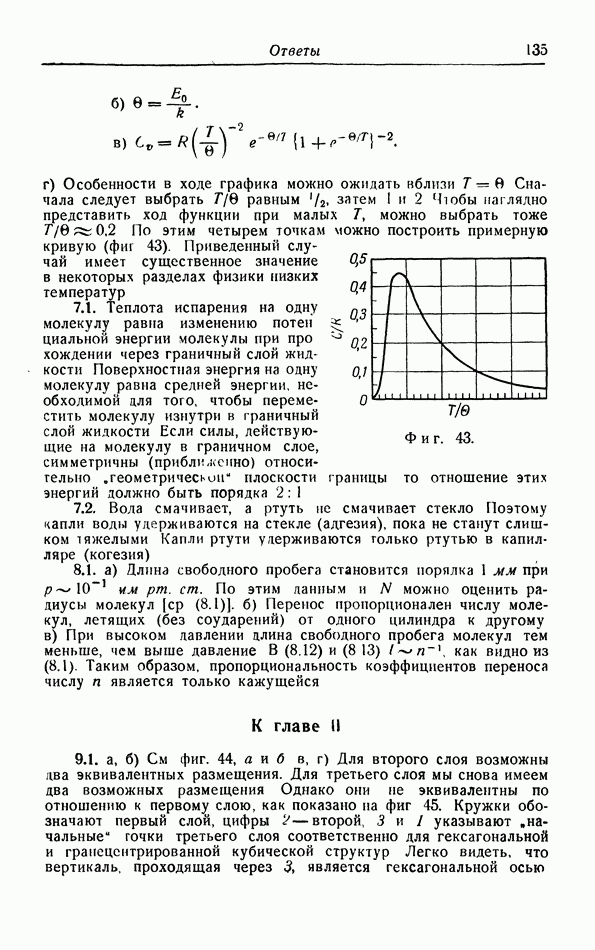
Потенциальная энергия как функция от  изображена на фиг. 11. Наоборот, мы можем найти силу из потенциальной энергии при помощи дифференцирования:
изображена на фиг. 11. Наоборот, мы можем найти силу из потенциальной энергии при помощи дифференцирования:  . В частности, эта сила равна нулю в точке, где по тенциальная энергия про ходит через минимум. Таким образом, мы должны отказаться от грубой модели жестких шариков, введенной ван дер Ваальсом (на самом деле и ван дер Ваальс был уверен, что это окажется необходимым), и в более точной теории ввести силы типа функции
. В частности, эта сила равна нулю в точке, где по тенциальная энергия про ходит через минимум. Таким образом, мы должны отказаться от грубой модели жестких шариков, введенной ван дер Ваальсом (на самом деле и ван дер Ваальс был уверен, что это окажется необходимым), и в более точной теории ввести силы типа функции  представленной на фиг. 11.
представленной на фиг. 11.

Фиг. 11. Зависимость межмолекулярной силы  и потенциаль ной энергии
и потенциаль ной энергии  от расстояния
от расстояния  между двумя молекулами
между двумя молекулами
| << Предыдущий параграф | Следующий параграф >> |
- Предисловие к русскому изданию
- ГЛАВА I. Газы и жидкости
- § 1. Молекулярная структура газов и жидкостей
- § 2. Кинетическая теория идеального газа
- б. Расчет давления в кинетической теории газов.
- в. Расчет удельной теплоемкости в кинетической теории газов.
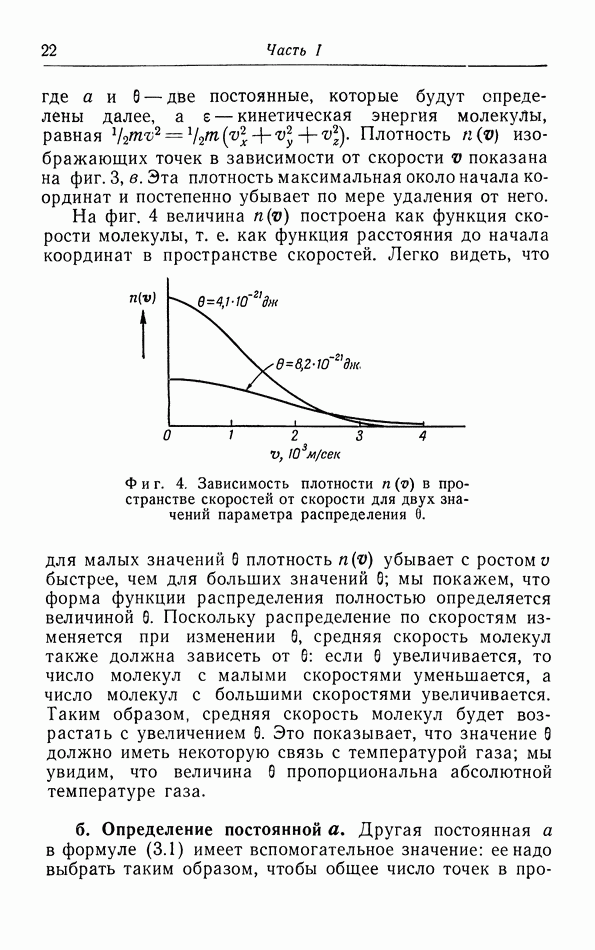
- § 3. Распределение молекул по скорости их движения
- г. Средняя квадратичная и средняя скорости.
- д. Броуновское движение.
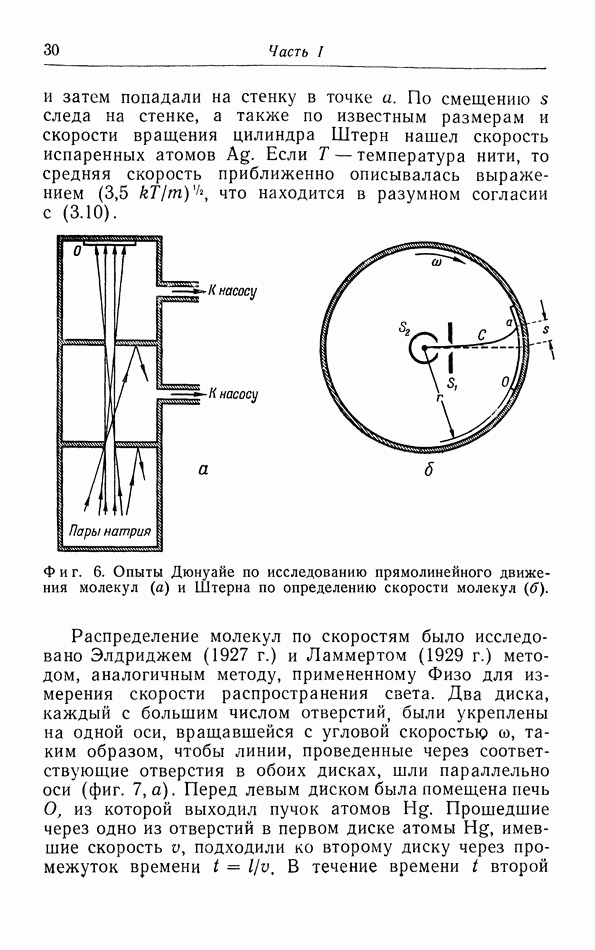
- е. Опыты с молекулярными пучками.
- § 4. Общее распределение молекул по энергиям
- б. Возбужденные состояния.
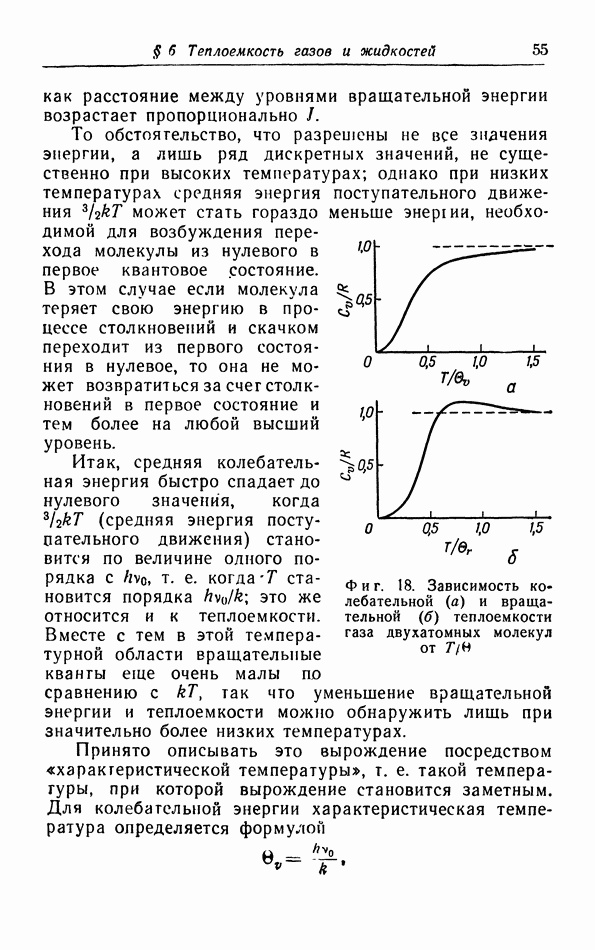
- в. вращательная и колебательная энергии.
- г. Потенциальная энергия тяготения.
- д. Потенциальная энергия межмолекулярных сил.
- § 5. Уравнение состояния газов и жидкостей
- б. Обсуждение уравнения ван дер Ваальса.
- в. Взаимодействие молекул.
- г. Более точный расчет поправок к уравнению pV=RT.
- д. Закон соответственных состояний.
- е. Жидкая фаза.
- § 6. Теплоемкость газов и жидкостей
- б. Классическая теория колебательной теплоемкости.
- в. Квантовая теория теплоемкости.
- г. Расчет колебательной теплоемкости двухатомной молекулы.
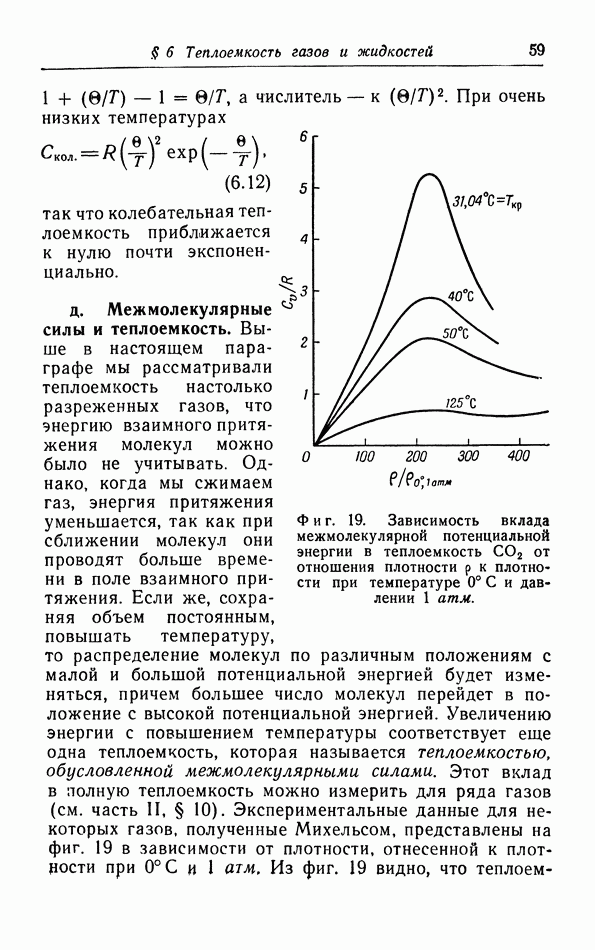
- д. Межмолекулярные силы и теплоемкость.
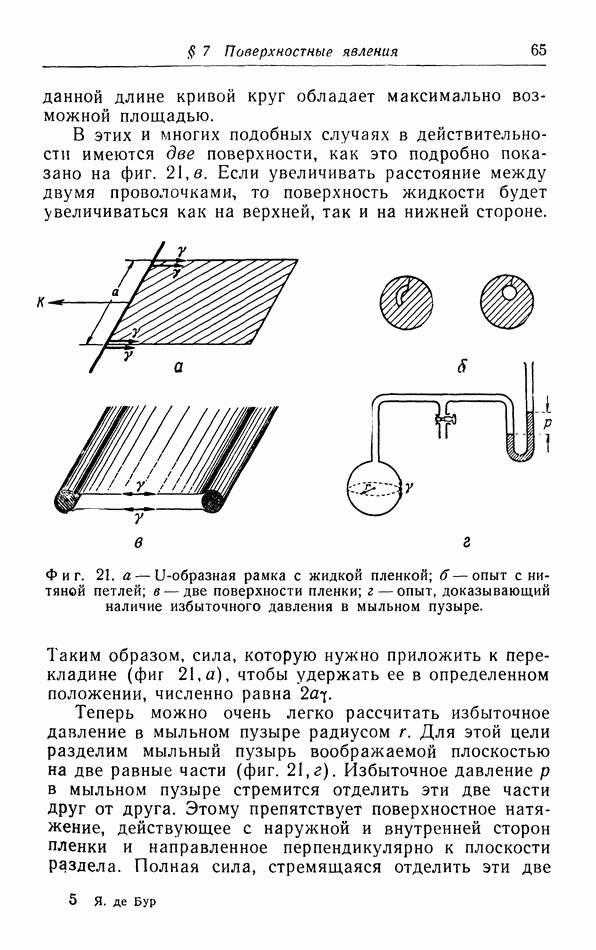
- § 7. Поверхностные явления
- б. Жидкие пленки.
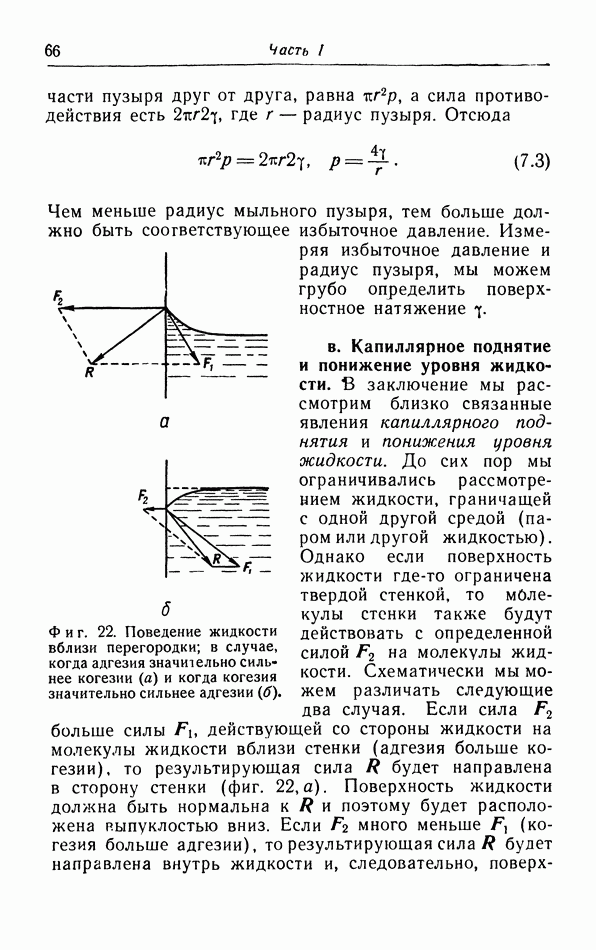
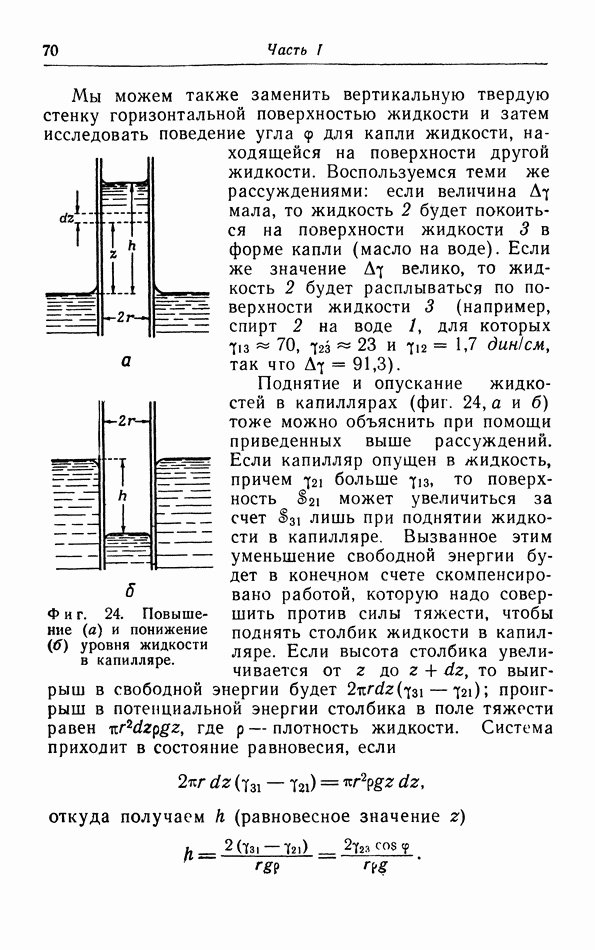
- в. Капиллярное поднятие и понижение уровня жидкости.
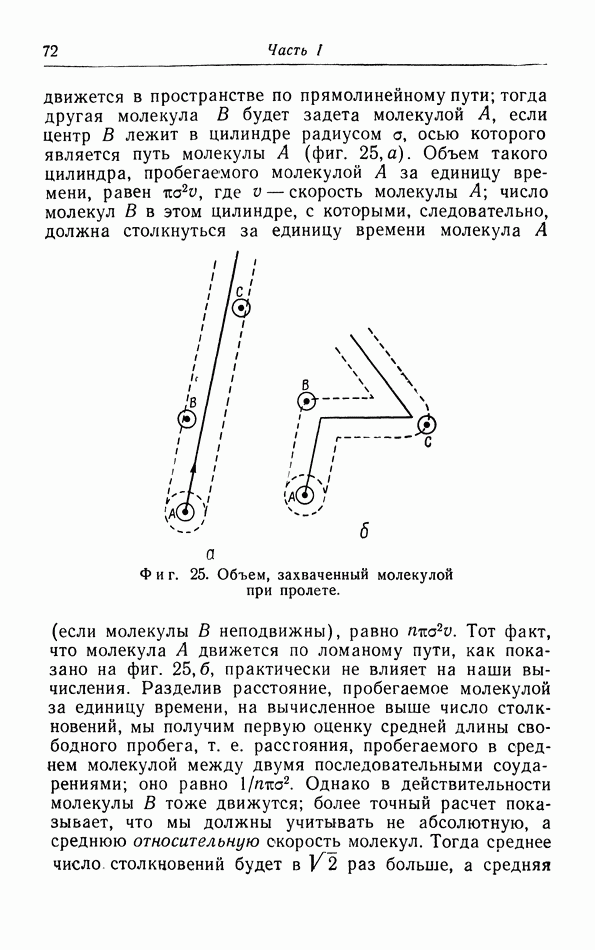
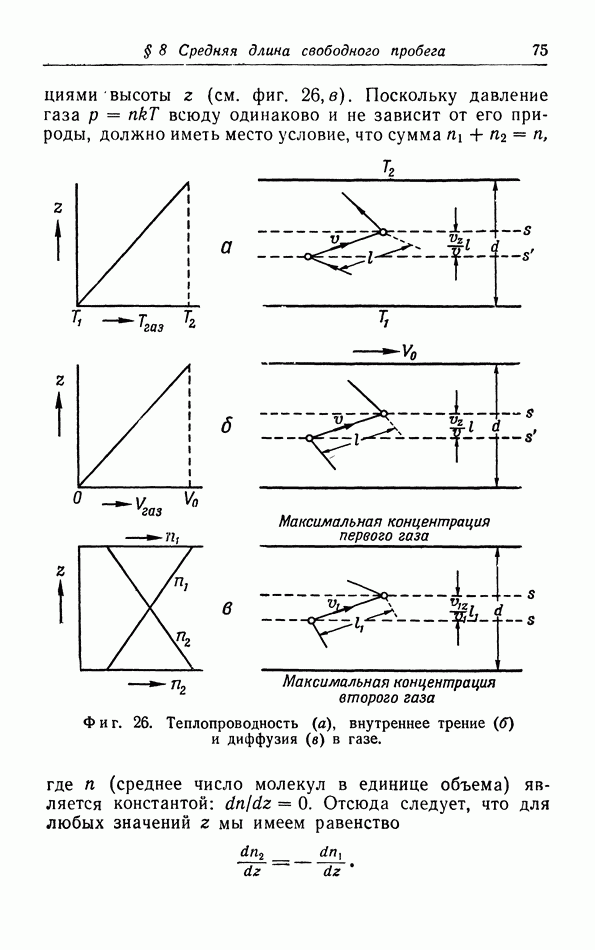
- § 8. Средняя длина свободного пробега, теплопроводность, вязкость и диффузия
- ГЛАВА II. Твердые тела
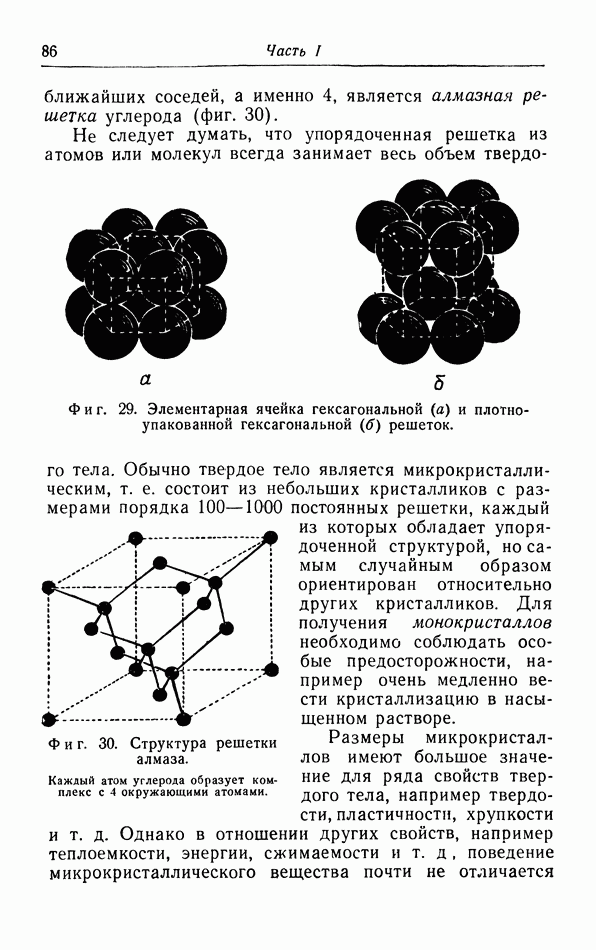
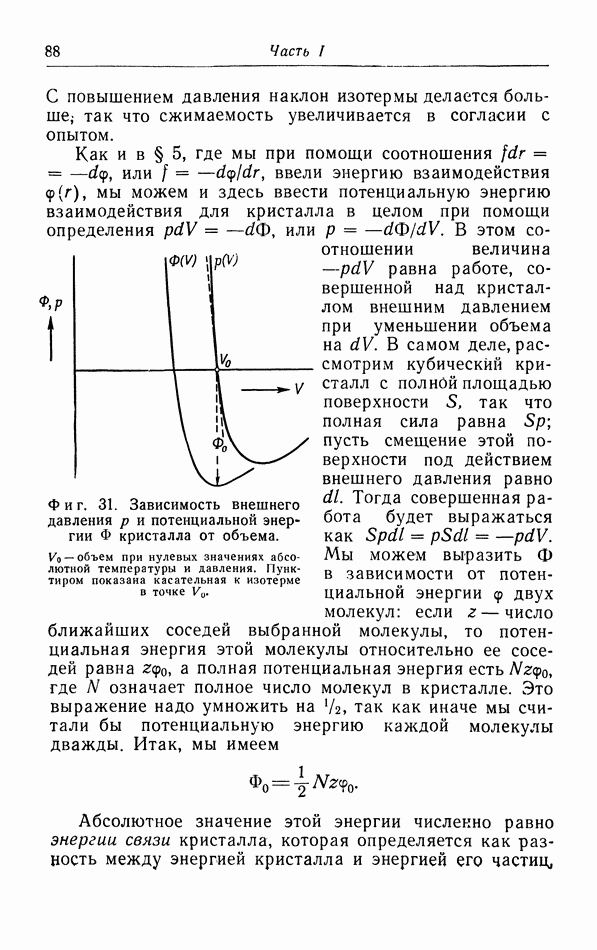
- § 9. Структура твердых тел
- § 10. Уравнение состояния твердых тел
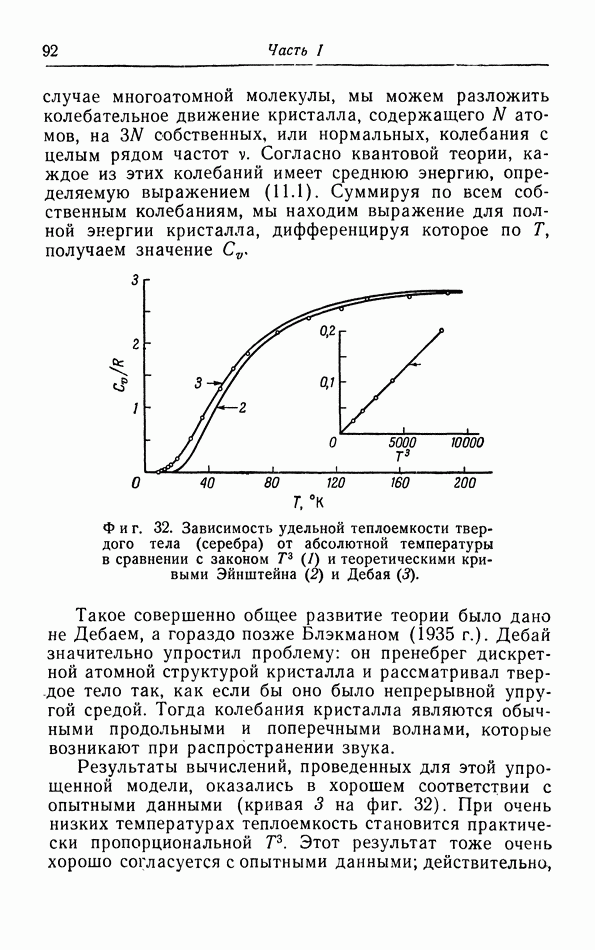
- § 11. Теплоемкость твердых тел
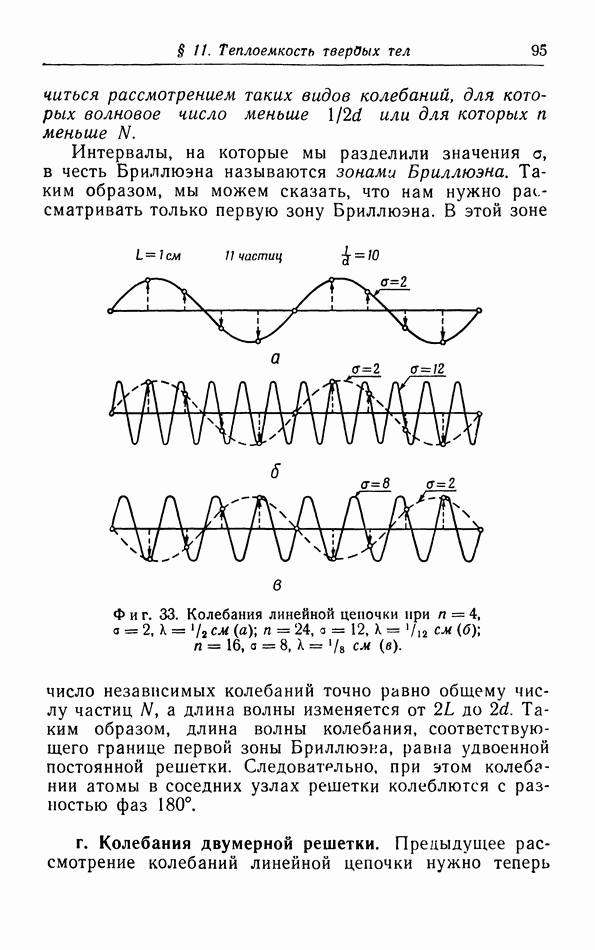
- в. Колебания линейной цепочки.
- г. Колебания двумерной решетки.
- д. Колебания трехмерной решетки.
- е. Теория Дебая.
- § 12. Влияние квантовых закономерностей на распределение частиц по скоростям
- ГЛАВА III. Излучение
- § 13. Тепловое излучение и свет
- § 14. Испускание, поглощение и плотность излучения
- б. Яркость и излучательная способность.
- в. Плотность излучения.
- г. Закон Кирхгофа.
- § 15. Фотонная гипотеза. Давление излучения
- § 16. Зависимость плотности излучения от температуры и длины волны
- б. Закон смещения Вина.
- в. Закон излучения Релея — Джинса.
- г. Закон излучения Планка.
- ГЛАВА I. Первый закон термодинамики
- § 1. Термодинамическое состояние и его изменения
- § 2. Работа при квазистатических процессах
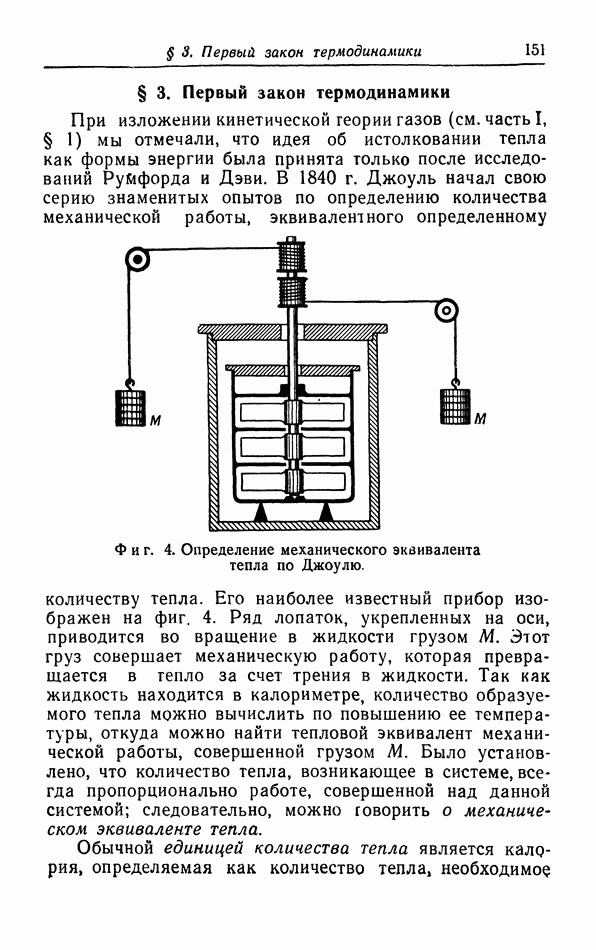
- § 3. Первый закон термодинамики
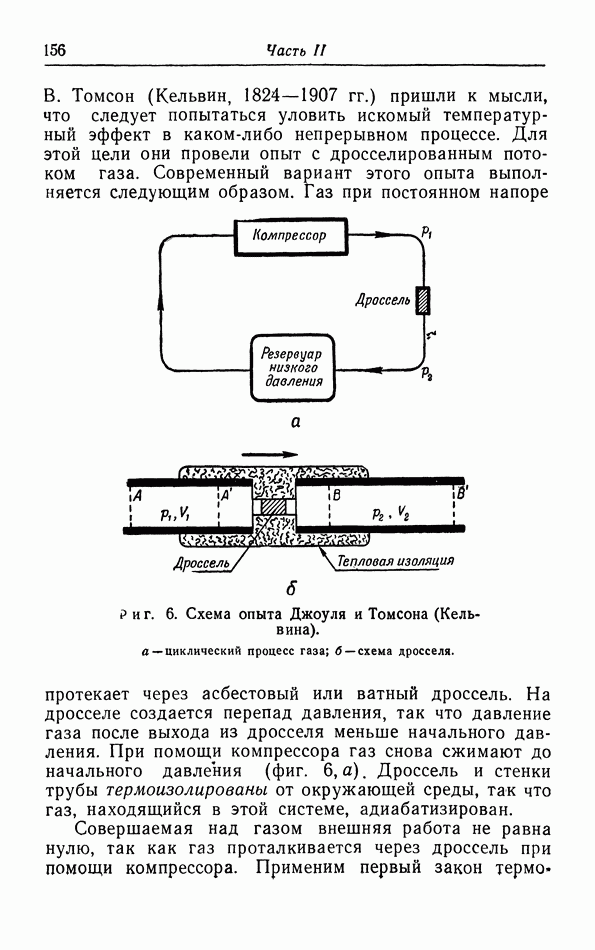
- § 4. Опыты Джоуля и Томсона
- § 5. Дальнейшие приложения первого закона
- б. Теплоемкость.
- в. Работа при адиабатических процессах.
- ГЛАВА II. Второй закон термодинамики
- § 6. Работа и теплота в циклических процессах
- § 7. Второе начало термодинамики и его различные формулировки
- § 8. Температура
- § 9. Энтропия и второй закон термодинамики
- § 10. Применения второго закона термодинамики
- в. Изэнтропические изменения состояния.
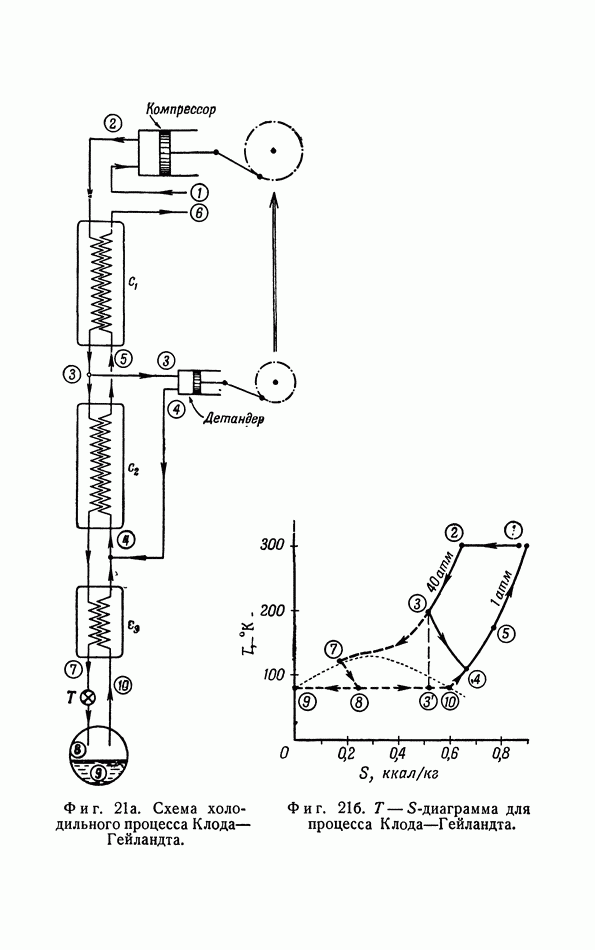
- г. Изэнтропические холодильные процессы (процесс Ж. Клода).
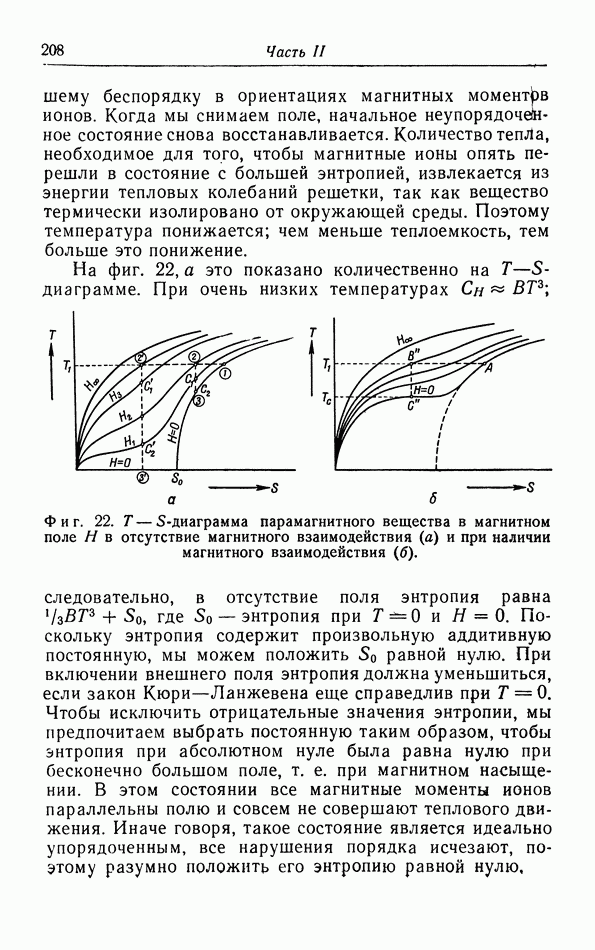
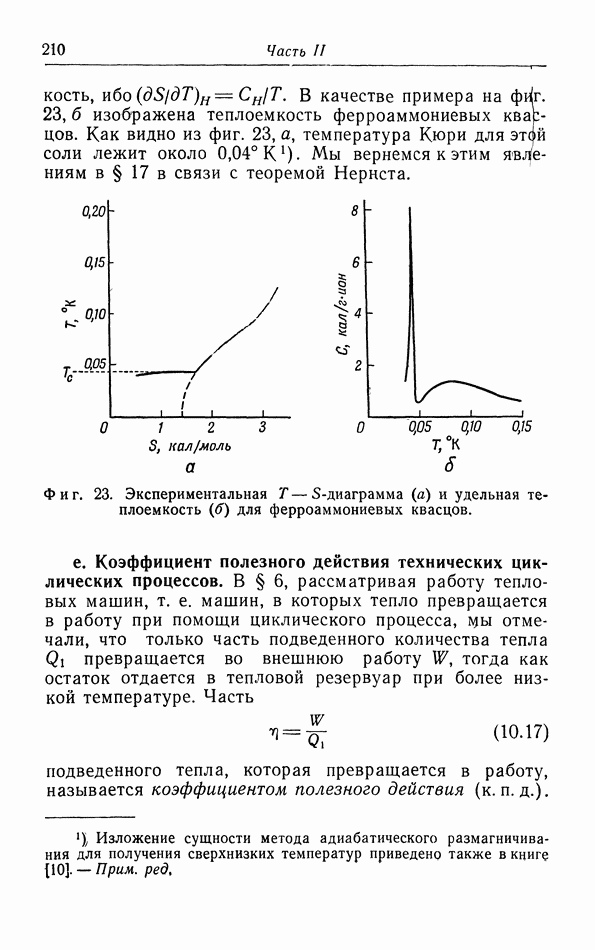
- д. Иззнтропические холодильные процессы (адиабатическое размагничивание).
- е. Коэффициент полезного действия технических циклических процессов.
- ГЛАВА III. Характеристические функции
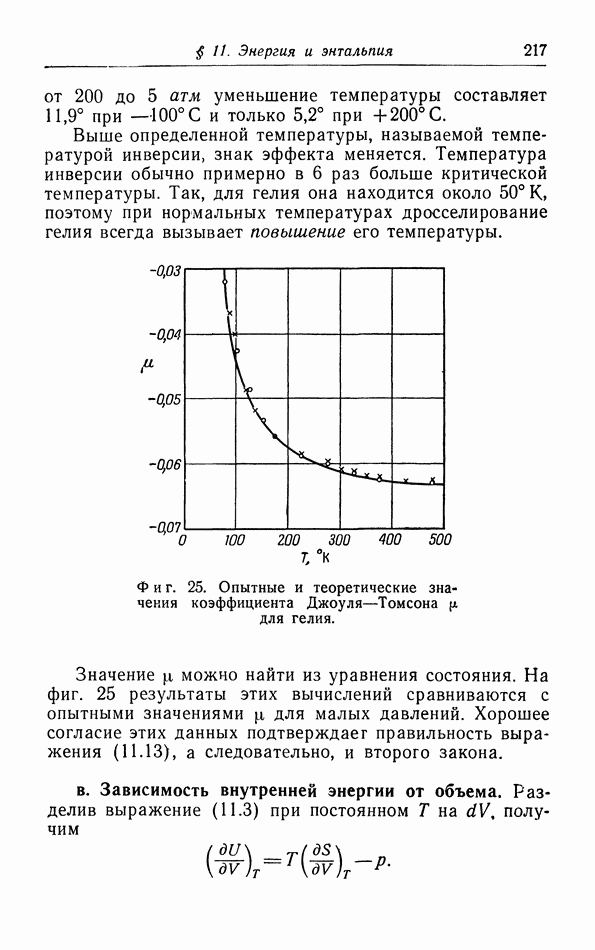
- § 11. Энергия и энтальпия
- б. Расчет процессов Джоуля и Джоуля — Томсона (Кельвина).
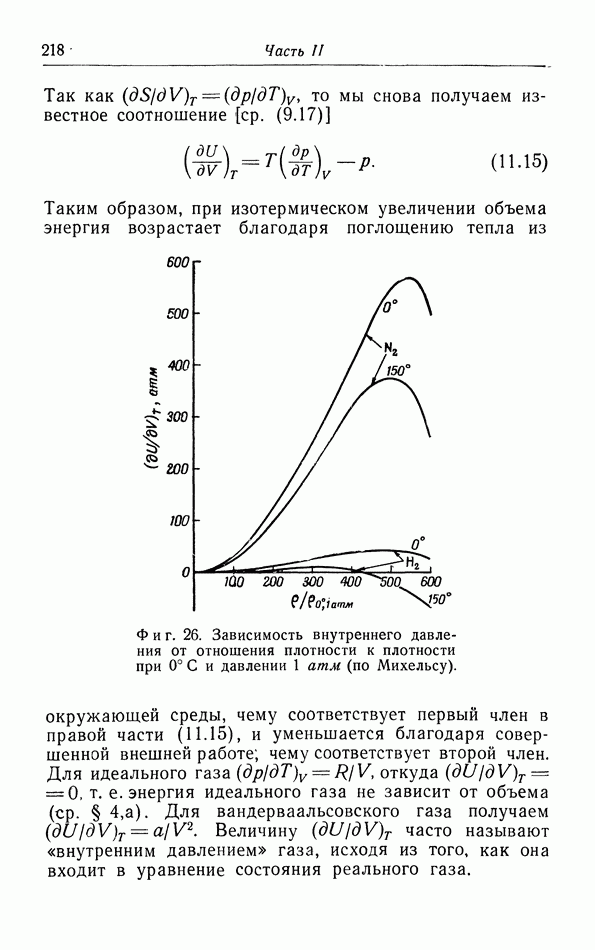
- в. Зависимость внутренней энергии от объема.
- г. Вывод закона Стефана — Больцмана.
- д. Характеристические функции U и H.
- § 12. Свободная энергия
- б. Свободная энергия и поверхностное натяжение.
- в. Свободная энергия и гальванические элементы.
- § 13. Свободная энтальпия и термодинамический потенциал
- б. Термодинамический потенциал.
- в. Системы с более чем одним компонентом.
- § 14. Соотношения Максвелла
- ГЛАВА IV. Неквазистатические процессы. Равновесие
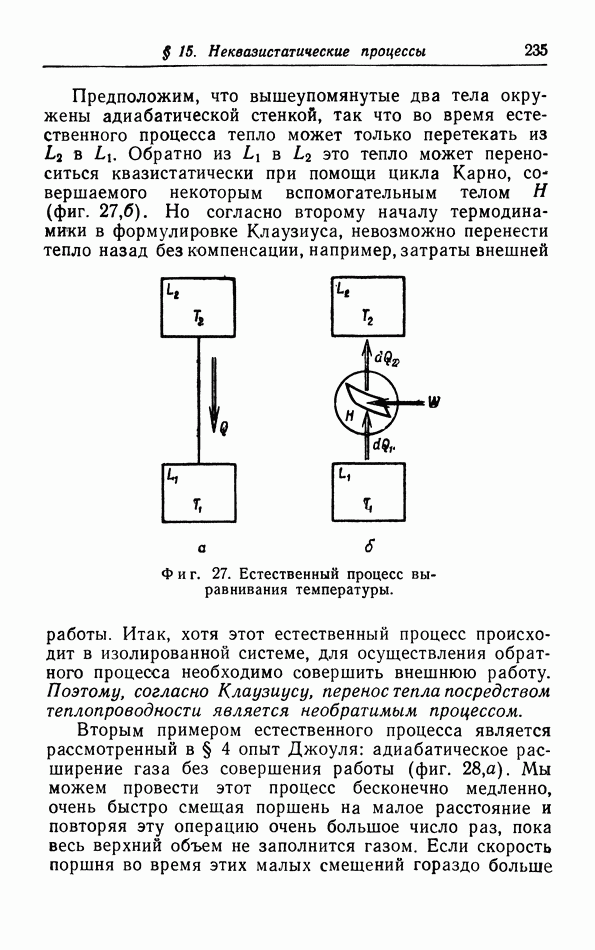
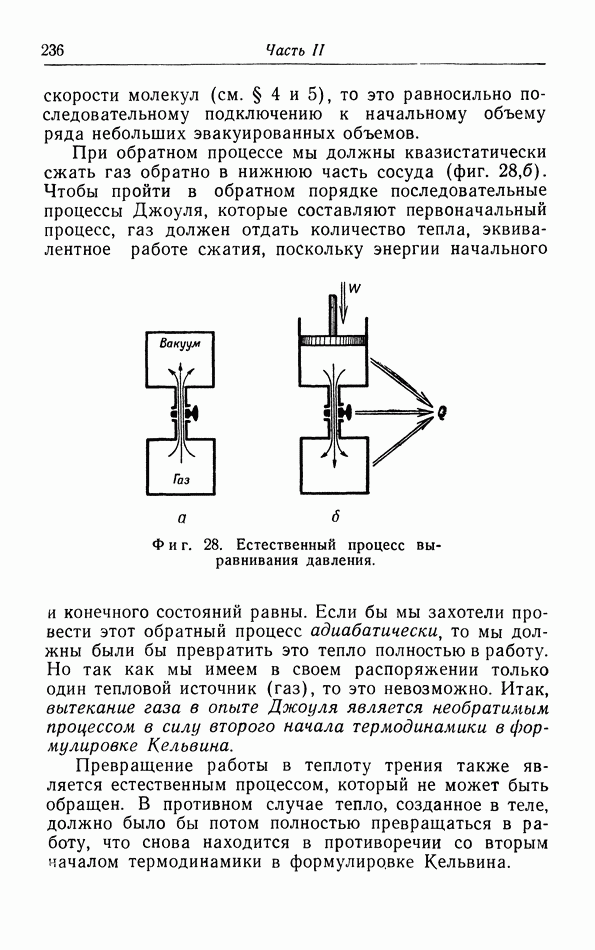
- § 15. Неквазистатические процессы
- б. Подвод тепла и изменение энтропии.
- в. Увеличение энтропии в адиабатических системах.
- г. Неквазистатический изотермический процесс.
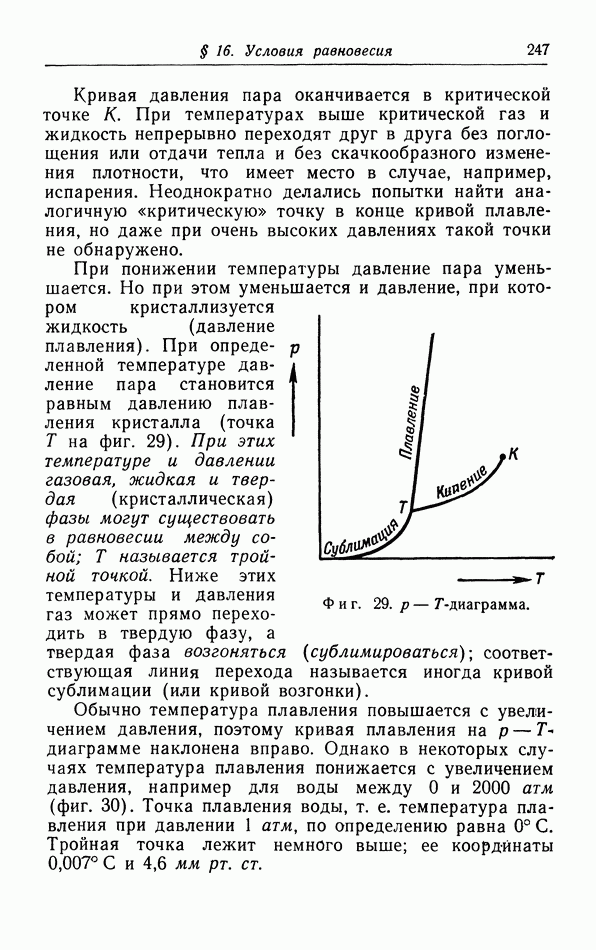
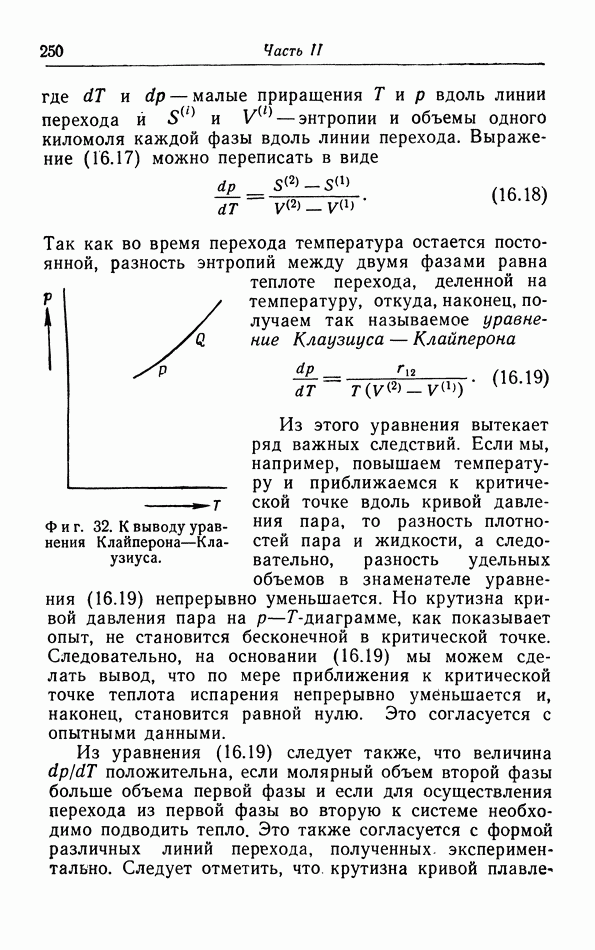
- § 16. Условия равновесия
- б. Первое условие равновесия.
- в. Второе условие равновесия.
- г. Третье условие равновесия.
- д. p-T-диаграмма.
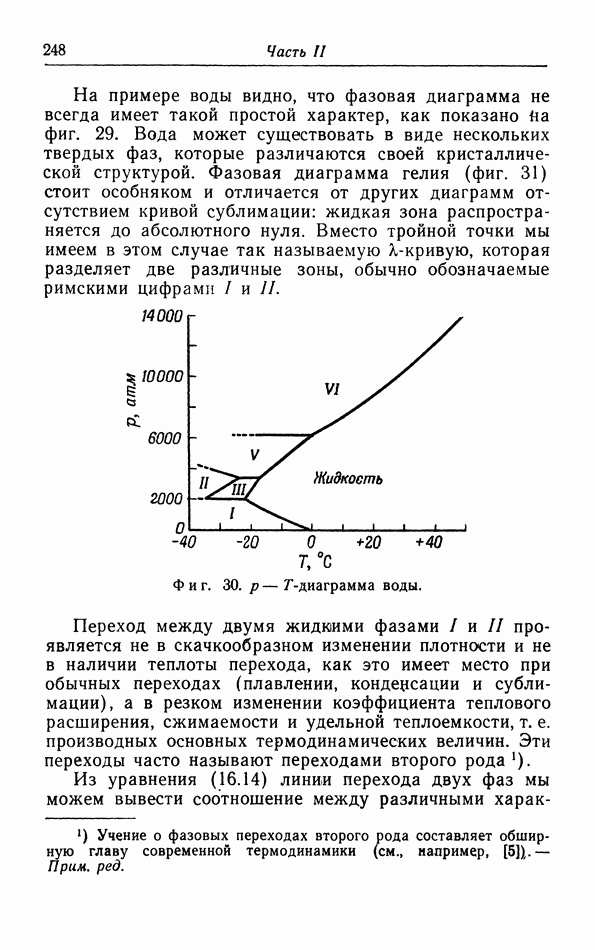
- е. Равновесие фаз в случае более чем одного компонента. Правило фаз.
- ГЛАВА V. Теорема Нернста
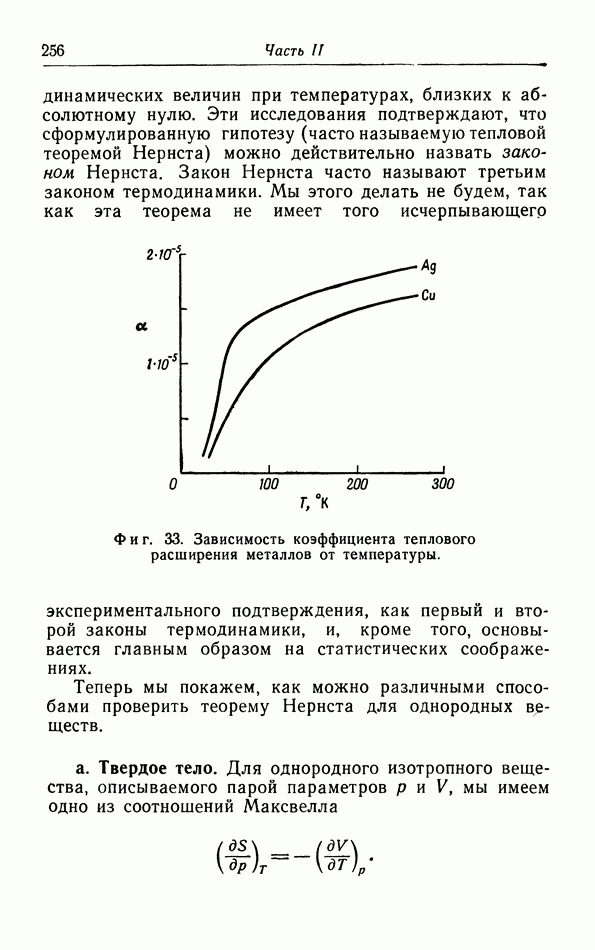
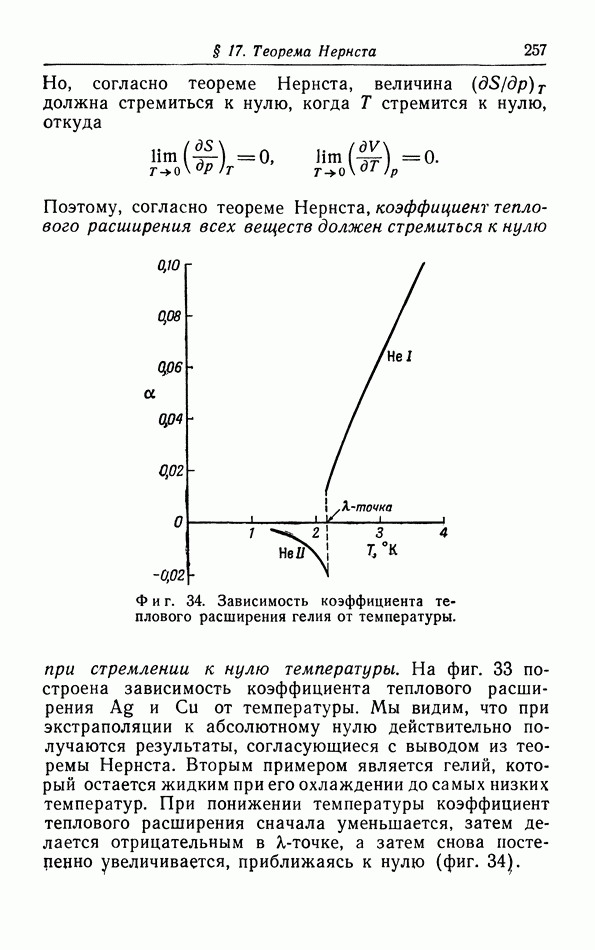
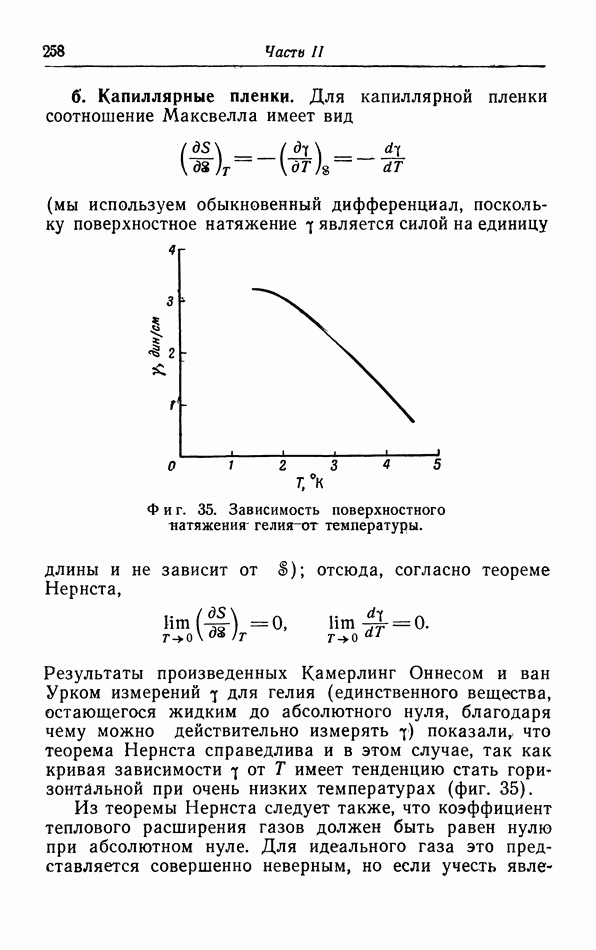
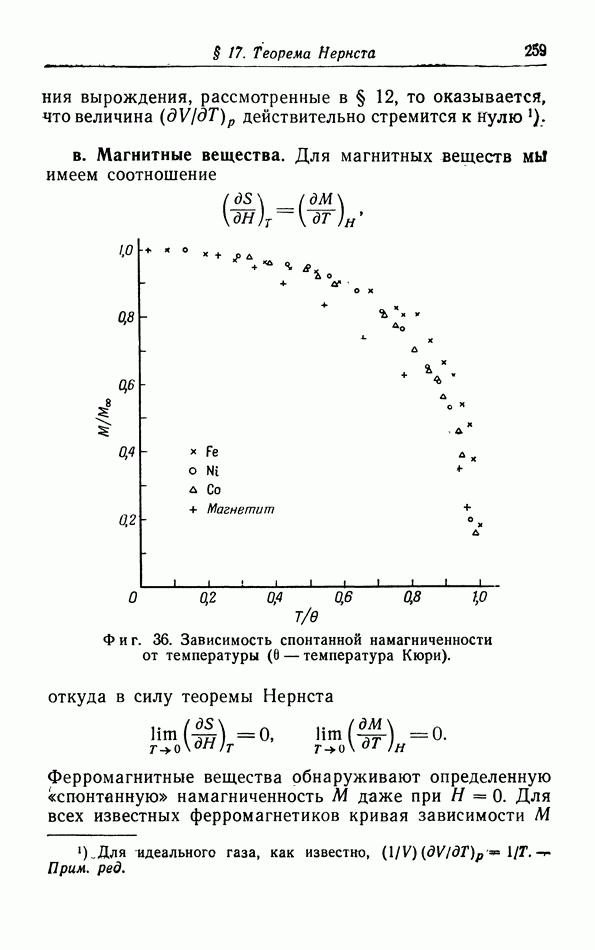
- § 17. Теорема Нернста
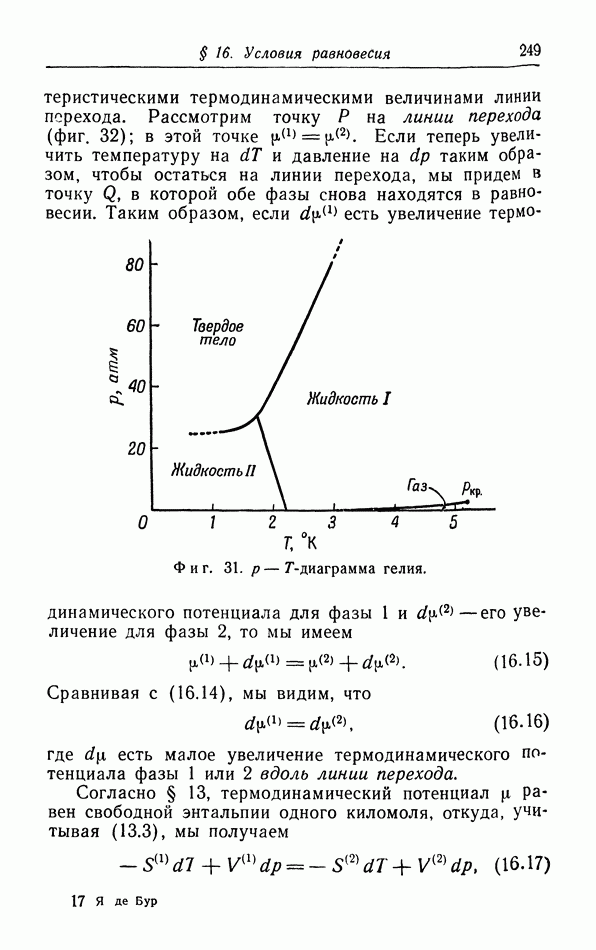
- § 18. Применение теоремы Нернста к фазовым переходам