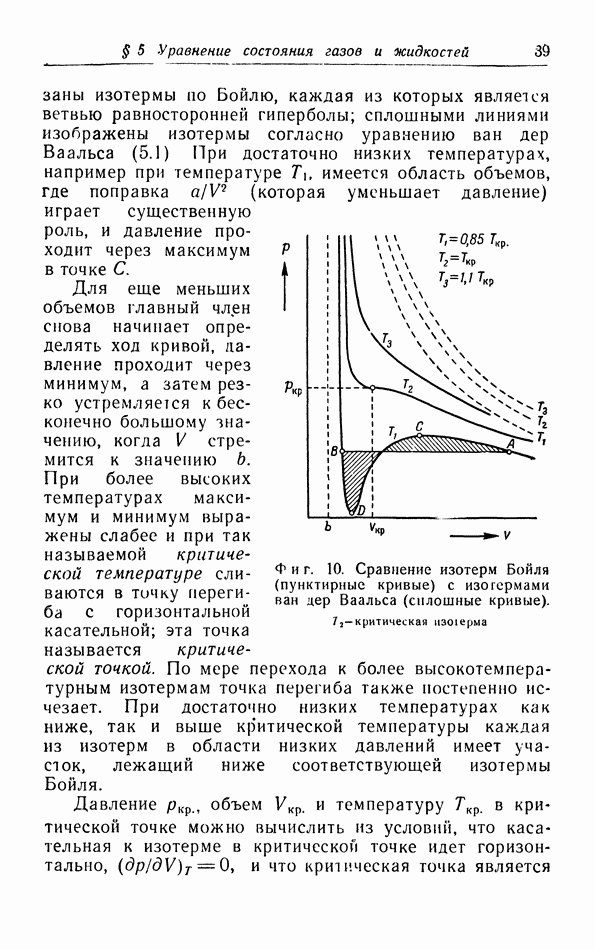
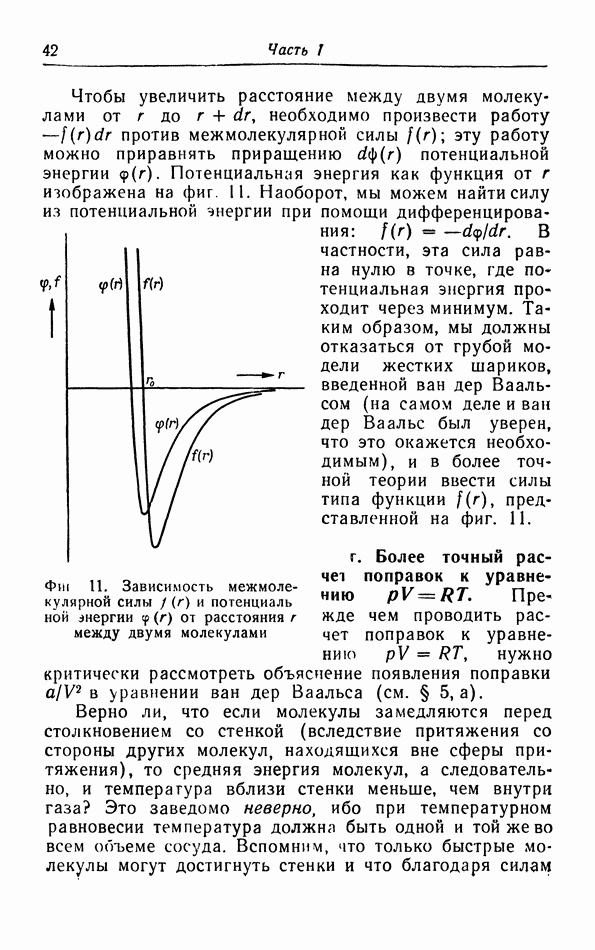
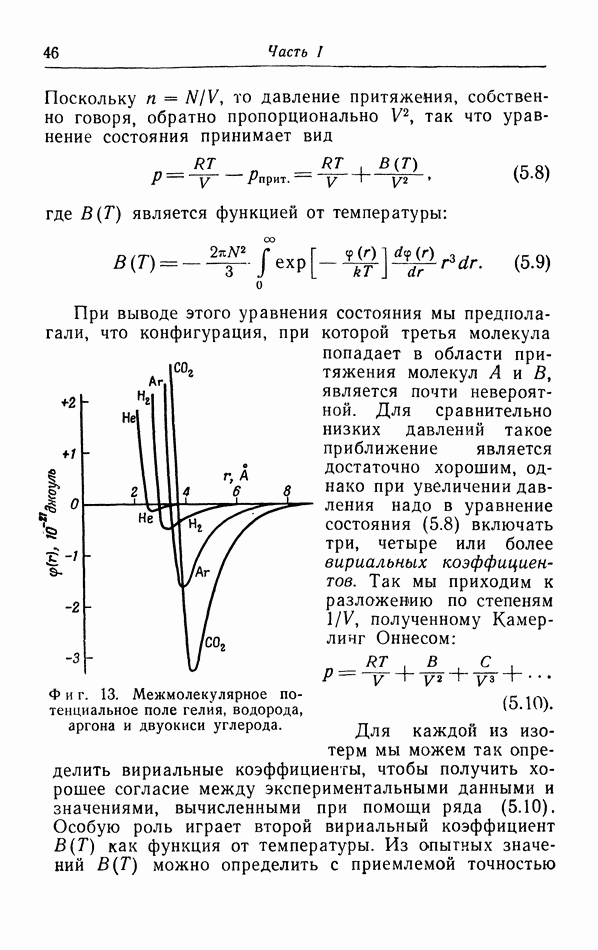
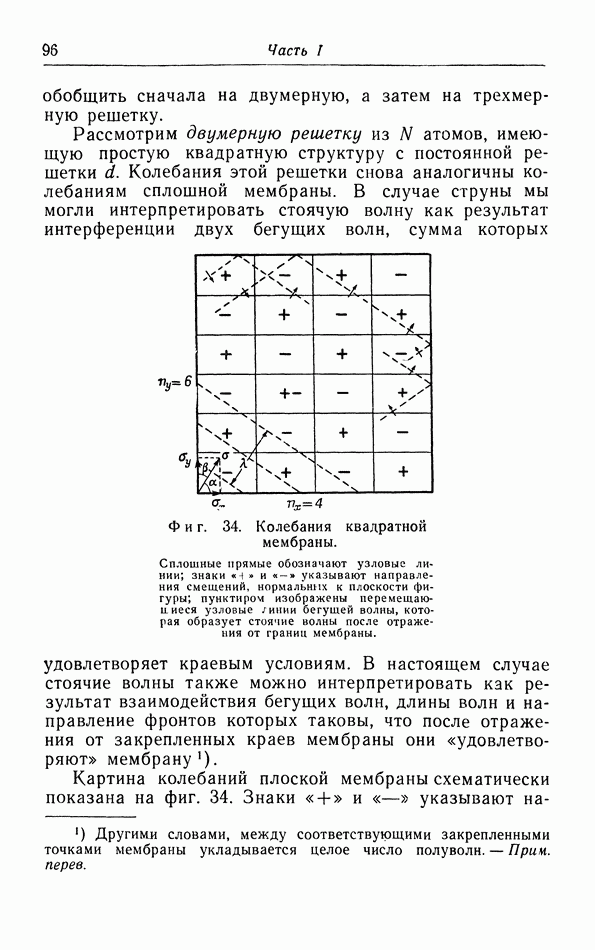
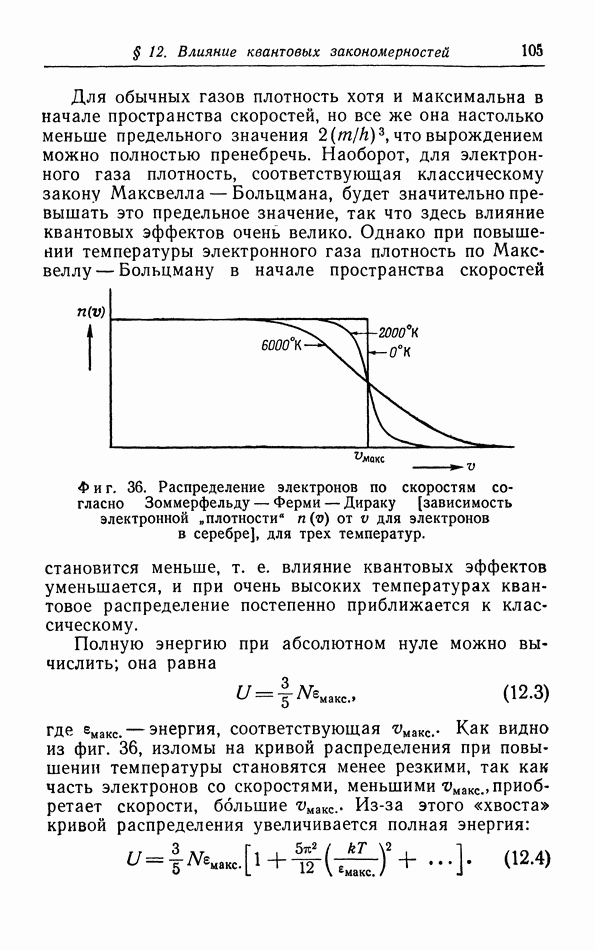
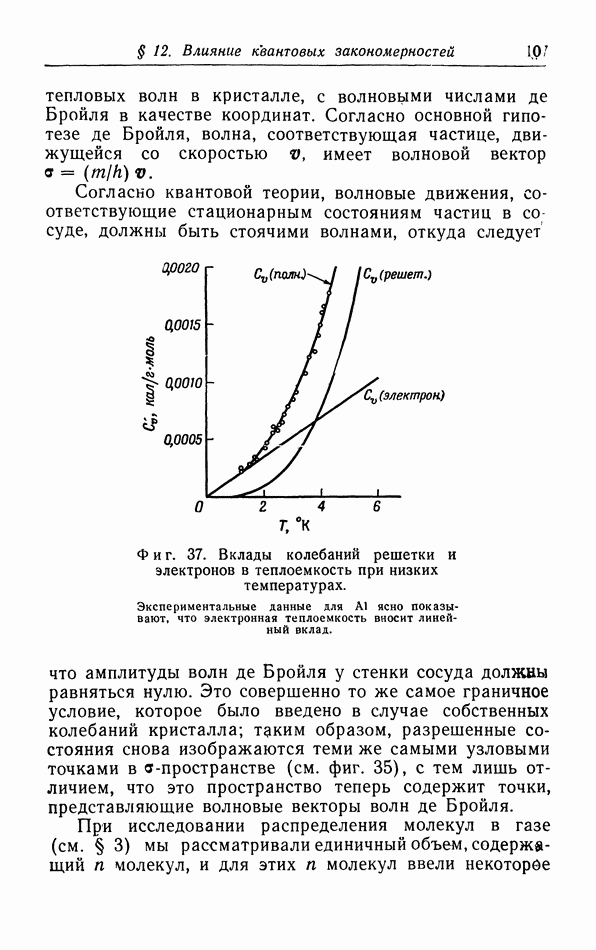
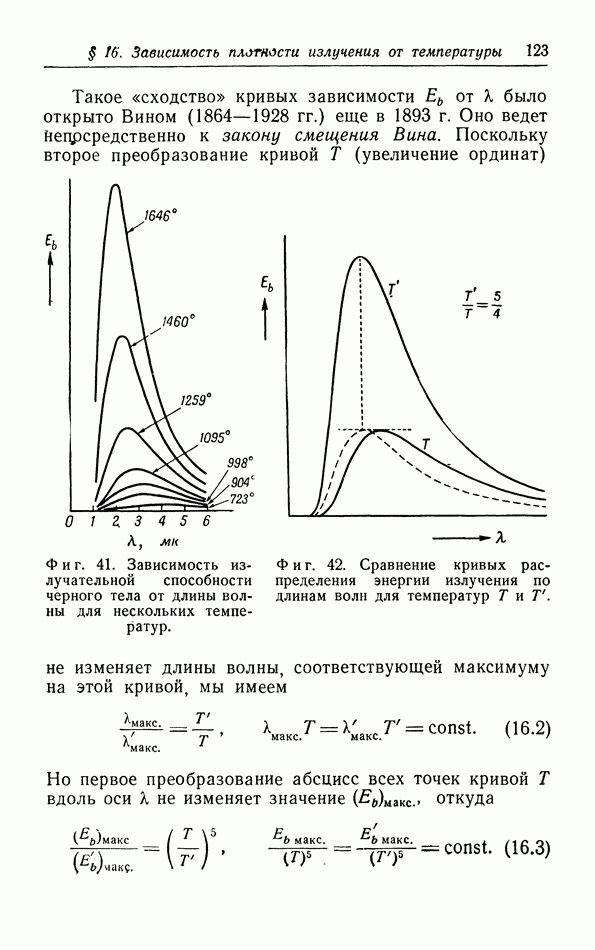
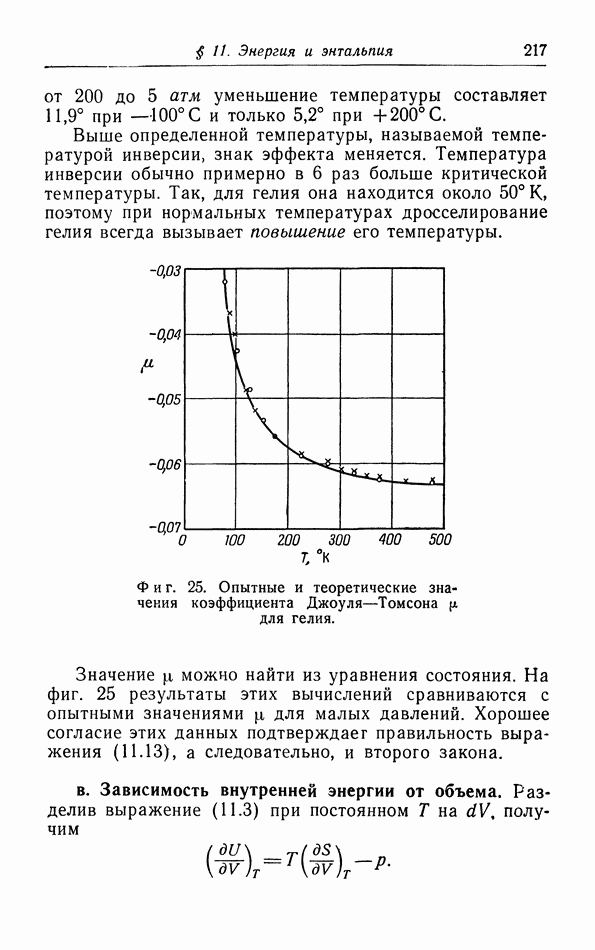
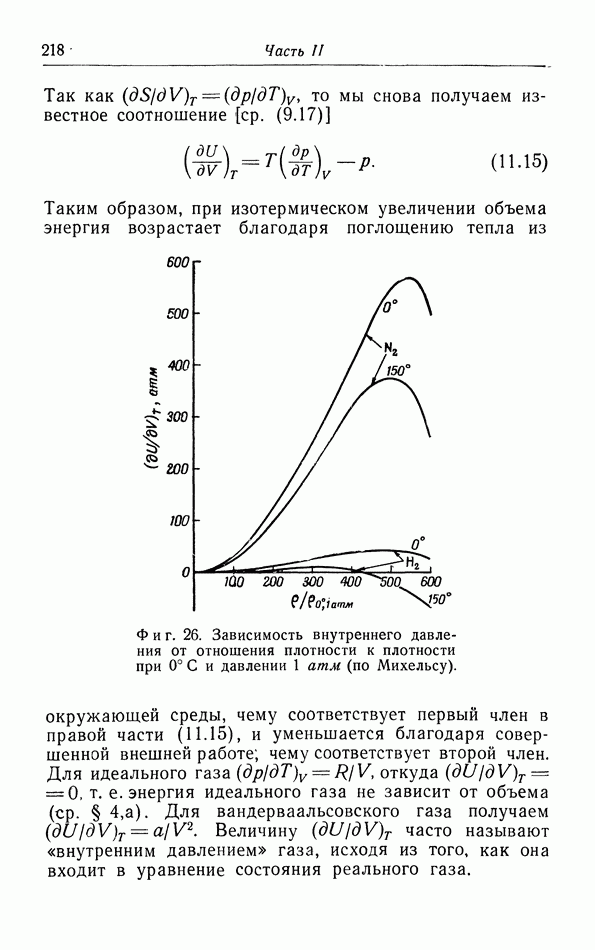
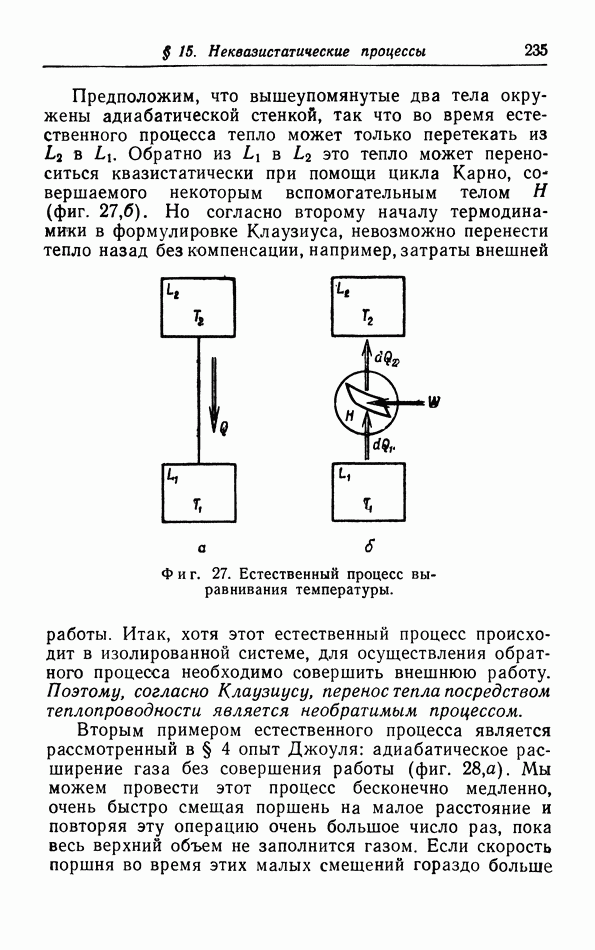
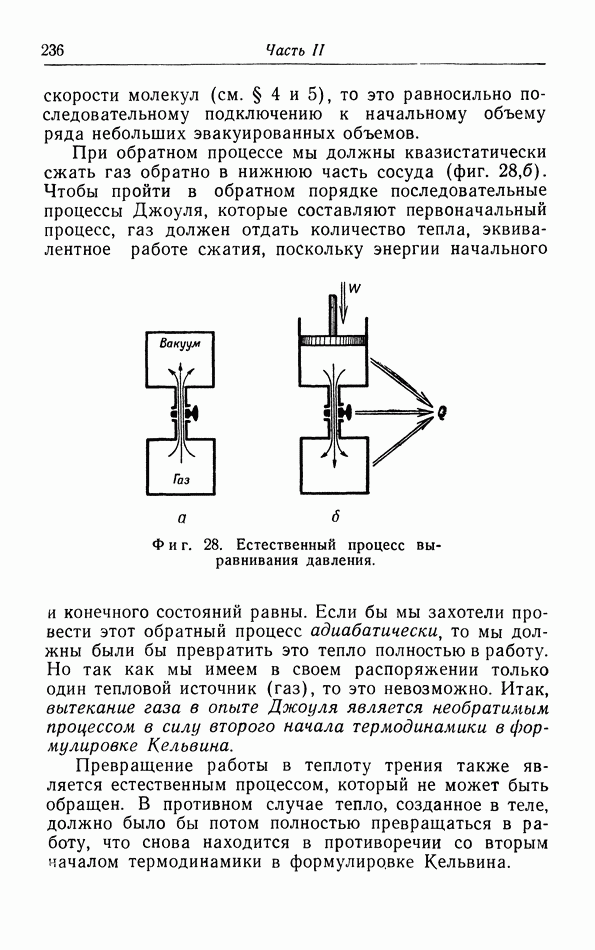
| << Предыдущий параграф | Следующий параграф >> |
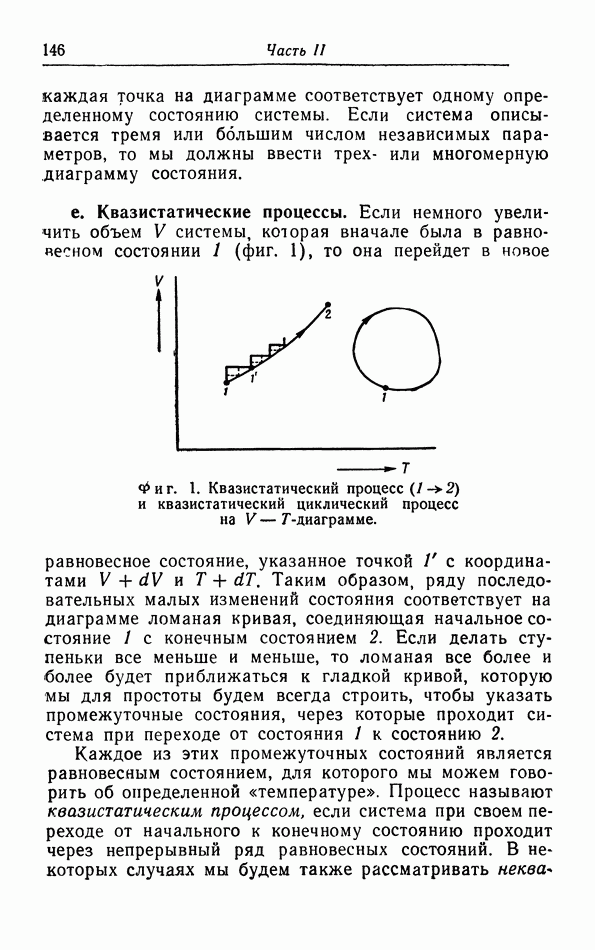
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
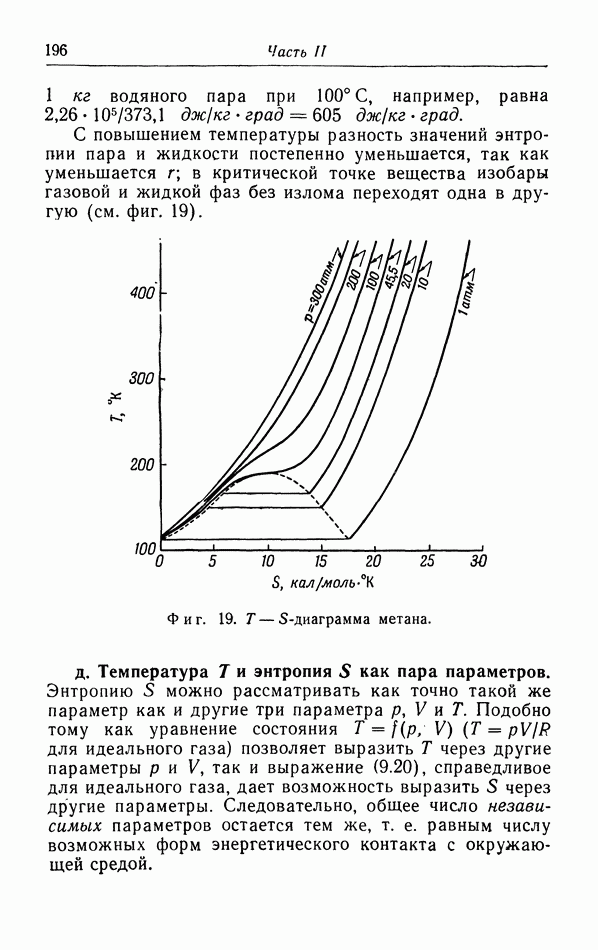
§ 6. Теплоемкость газов и жидкостей
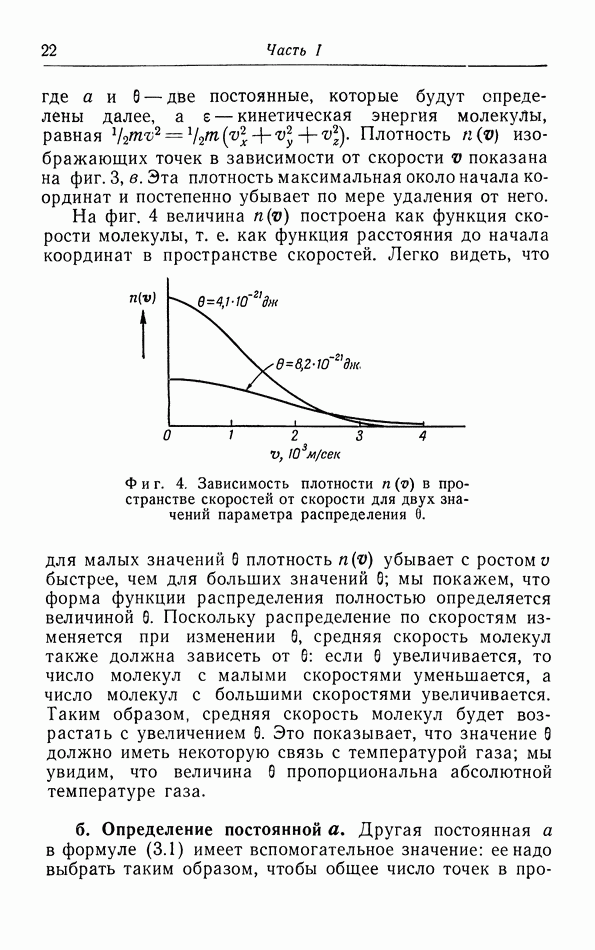
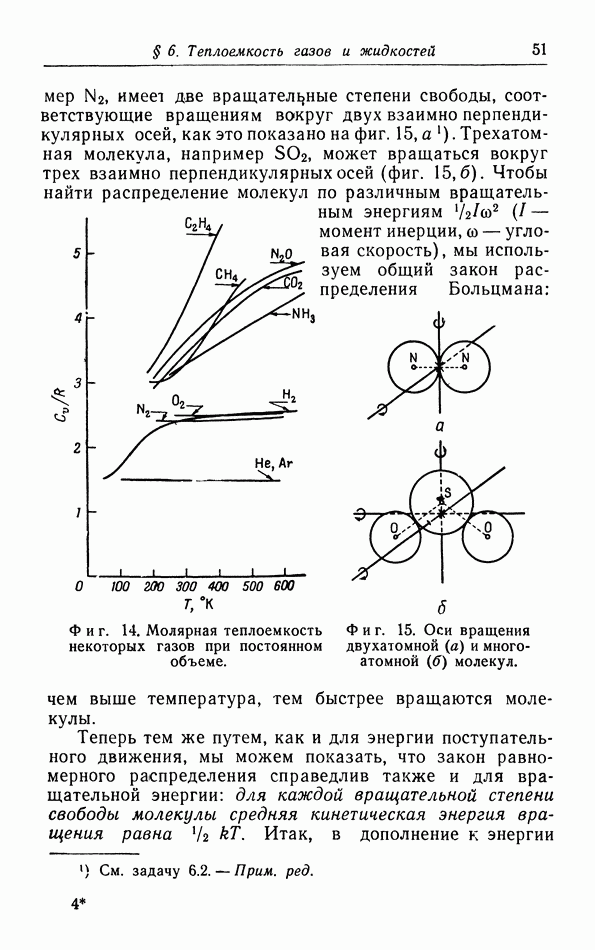
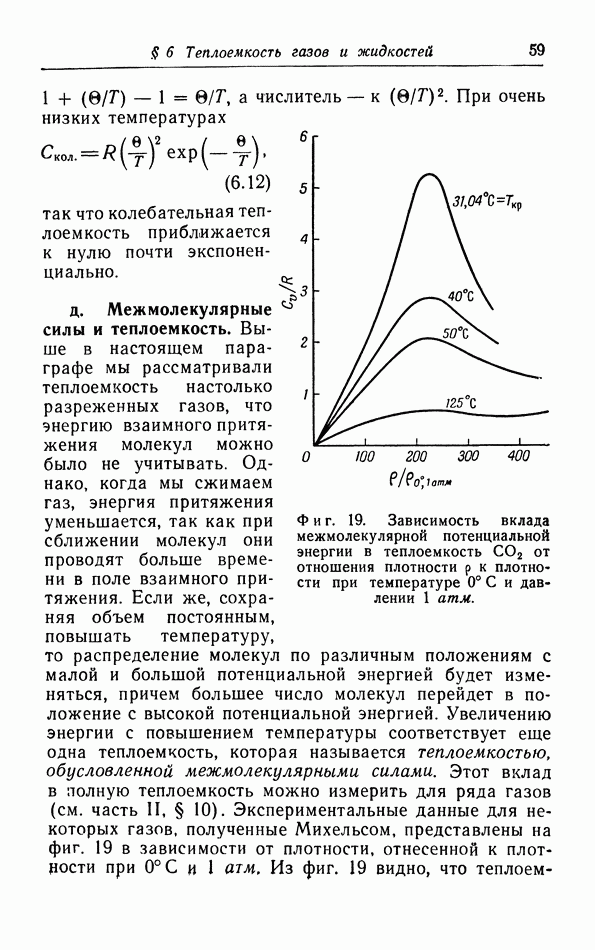
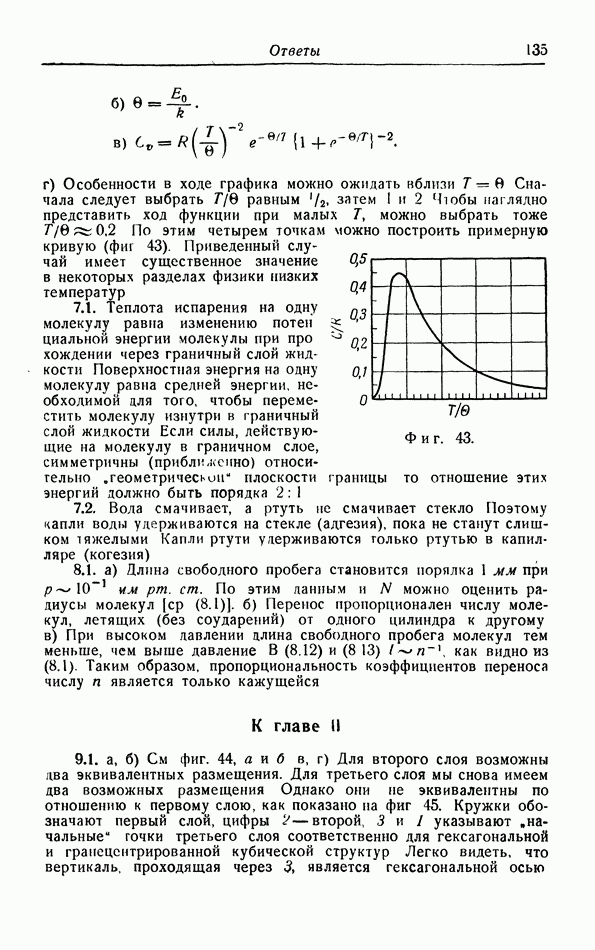
Как мы уже заметили в § 2 [формула (2 11)], из элементарной кинетической теории газов следует, что теплоемкость газов при постоянном объеме должна быть равной  или примерно 3 кал на 1 моль. На фиг. 14 построены молярные теплоемкости ряда газов в зависимости от температуры. Можно видеть, что указанной выше теплоемкостью обладают только одноатомные газы. Теплоемкость водорода и азота составляет, например, около
или примерно 3 кал на 1 моль. На фиг. 14 построены молярные теплоемкости ряда газов в зависимости от температуры. Можно видеть, что указанной выше теплоемкостью обладают только одноатомные газы. Теплоемкость водорода и азота составляет, например, около  при комнатной температуре, а некоторые другие газы имеют еще большую теплоемкость, в особенности при более высоких температурах. Эти различия объясняются тем, что в простой теории, изложенной в § 2, мы не учли всех вкладов в энергию газа.
при комнатной температуре, а некоторые другие газы имеют еще большую теплоемкость, в особенности при более высоких температурах. Эти различия объясняются тем, что в простой теории, изложенной в § 2, мы не учли всех вкладов в энергию газа.
а. Классическая теория вращательной теплоемкости.
Прежде всего отметим, что молекула может вращаться вокруг различных осей. Двухатомная молекула,
например  имеет две вращательные степени свободы, соответствующие вращениям вокруг двух взаимно перпендикулярных осей, как это показано на фиг. 15, а
имеет две вращательные степени свободы, соответствующие вращениям вокруг двух взаимно перпендикулярных осей, как это показано на фиг. 15, а  Трехатомная молекула, например
Трехатомная молекула, например  может вращаться вокруг трех взаимно перпендикулярных осей (фиг. 15,б). Чтобы найти распределение молекул по различным вращательным энергиям
может вращаться вокруг трех взаимно перпендикулярных осей (фиг. 15,б). Чтобы найти распределение молекул по различным вращательным энергиям  момент инерции,
момент инерции,  — угловая скорость), мы используем общий закон распределения Больцмана: чем выше температура, тем быстрее вращаются молекулы.
— угловая скорость), мы используем общий закон распределения Больцмана: чем выше температура, тем быстрее вращаются молекулы.

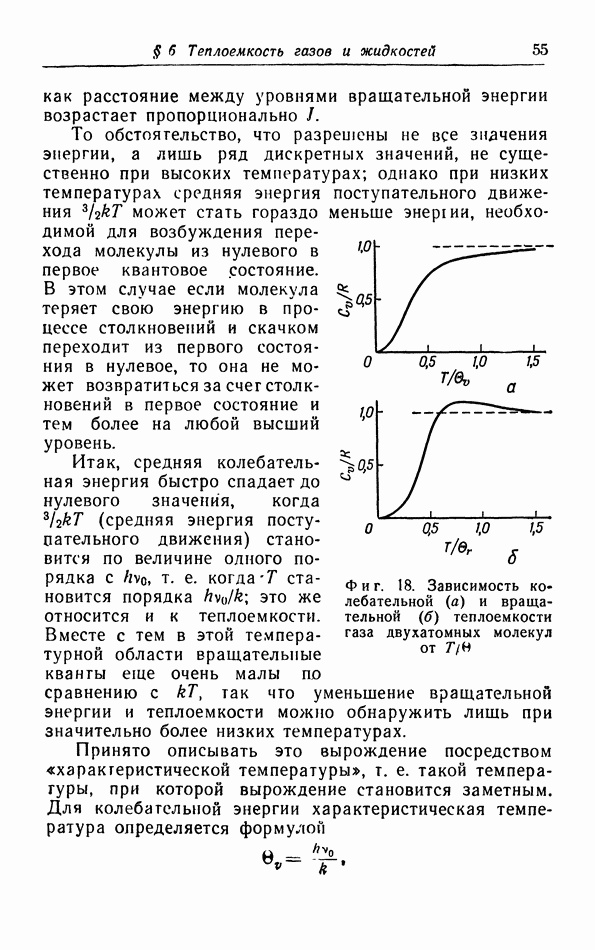
Фиг. 14. Молярная теплоемкость некоторых газов при постоянном объеме.

Фиг. 15. Оси вращения двухатомной  и многоатомной
и многоатомной  молекул.
молекул.
Теперь тем же путем, как и для энергии поступательного движения, мы можем показать, что закон равномерного распределения справедлив также и для вращательной энергии: для каждой вращательной степени свободы молекулы средняя кинетическая энергия вращения равна  Итак, в дополнение к энергии
Итак, в дополнение к энергии
поступательного движения мы получаем вклад от вращения, равный  для двухатомной молекулы и
для двухатомной молекулы и  для многоатомной молекулы. Увеличение теплоемкости, обусловленное молекулярным вращением, будет соответственно составлять
для многоатомной молекулы. Увеличение теплоемкости, обусловленное молекулярным вращением, будет соответственно составлять 
| << Предыдущий параграф | Следующий параграф >> |
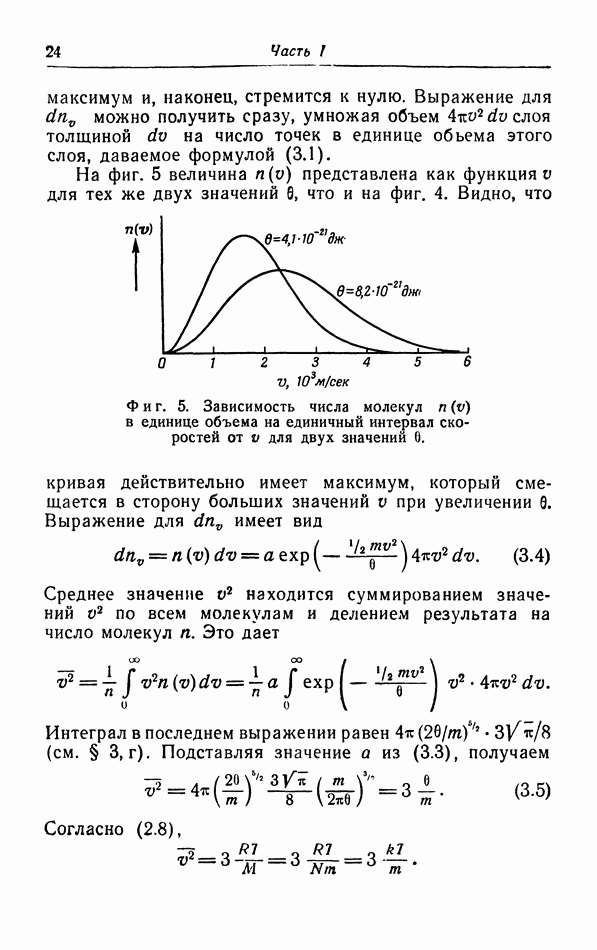
Оглавление
- Предисловие к русскому изданию
- ГЛАВА I. Газы и жидкости
- § 1. Молекулярная структура газов и жидкостей
- § 2. Кинетическая теория идеального газа
- б. Расчет давления в кинетической теории газов.
- в. Расчет удельной теплоемкости в кинетической теории газов.
- § 3. Распределение молекул по скорости их движения
- г. Средняя квадратичная и средняя скорости.
- д. Броуновское движение.
- е. Опыты с молекулярными пучками.
- § 4. Общее распределение молекул по энергиям
- б. Возбужденные состояния.
- в. вращательная и колебательная энергии.
- г. Потенциальная энергия тяготения.
- д. Потенциальная энергия межмолекулярных сил.
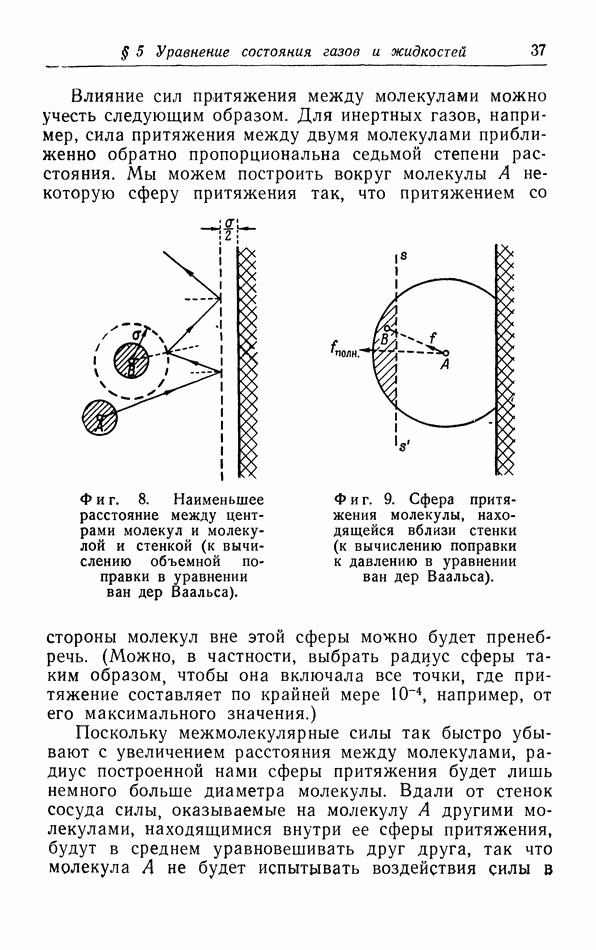
- § 5. Уравнение состояния газов и жидкостей
- б. Обсуждение уравнения ван дер Ваальса.
- в. Взаимодействие молекул.
- г. Более точный расчет поправок к уравнению pV=RT.
- д. Закон соответственных состояний.
- е. Жидкая фаза.
- § 6. Теплоемкость газов и жидкостей
- б. Классическая теория колебательной теплоемкости.
- в. Квантовая теория теплоемкости.
- г. Расчет колебательной теплоемкости двухатомной молекулы.
- д. Межмолекулярные силы и теплоемкость.
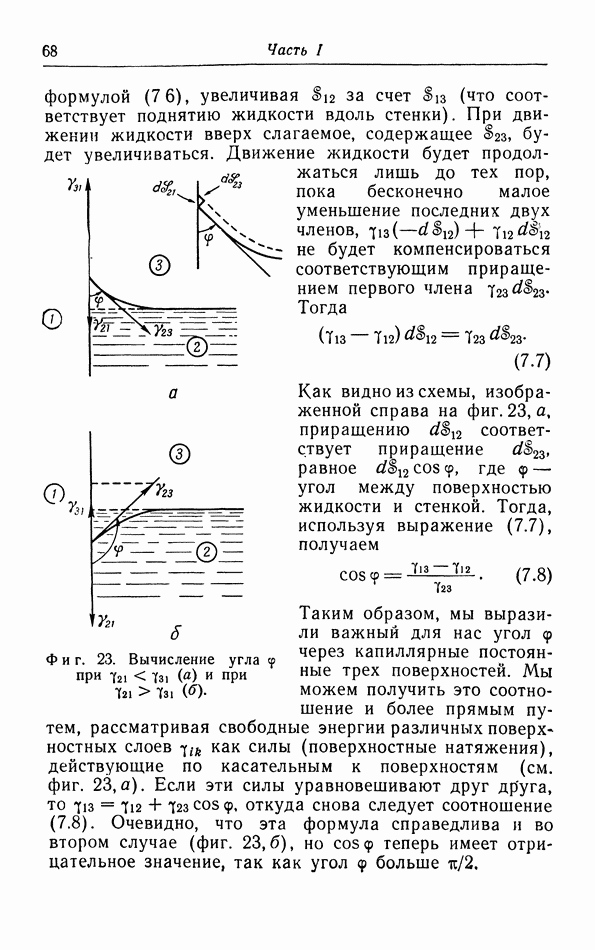
- § 7. Поверхностные явления
- б. Жидкие пленки.
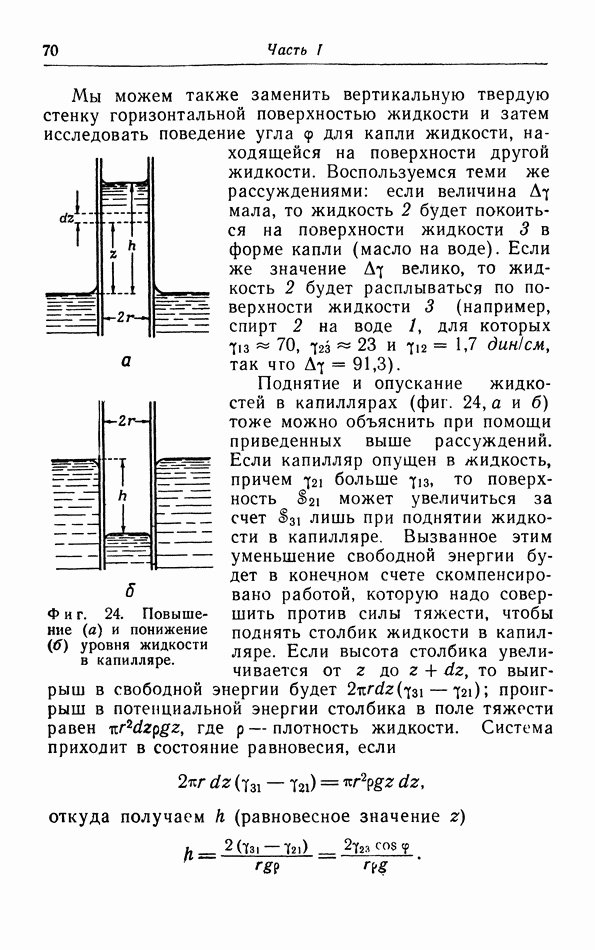
- в. Капиллярное поднятие и понижение уровня жидкости.
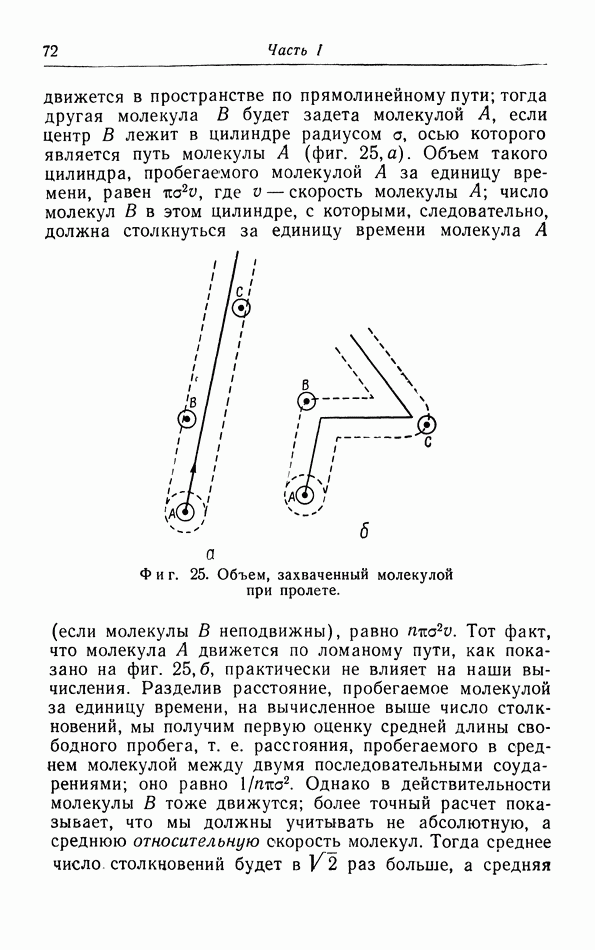
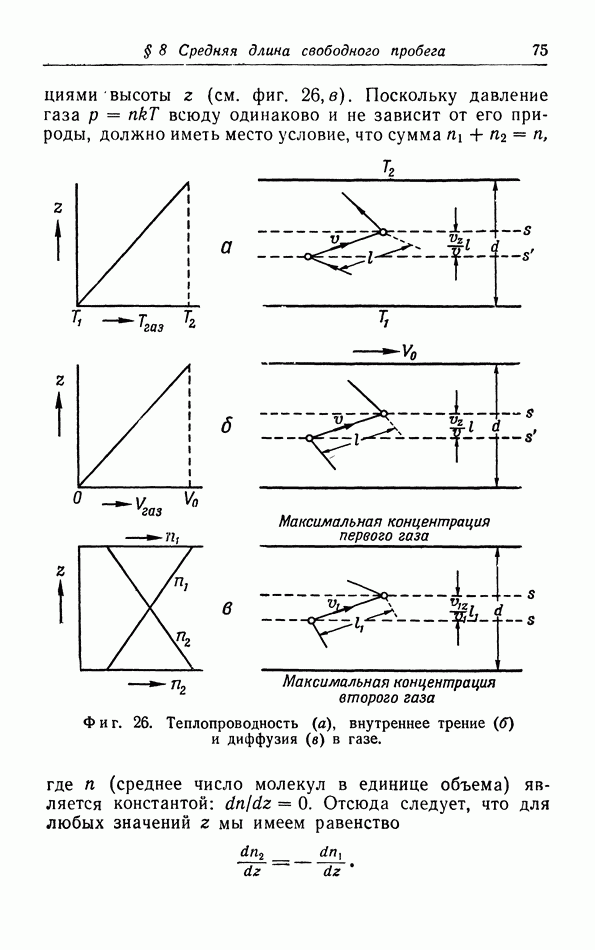
- § 8. Средняя длина свободного пробега, теплопроводность, вязкость и диффузия
- ГЛАВА II. Твердые тела
- § 9. Структура твердых тел
- § 10. Уравнение состояния твердых тел
- § 11. Теплоемкость твердых тел
- в. Колебания линейной цепочки.
- г. Колебания двумерной решетки.
- д. Колебания трехмерной решетки.
- е. Теория Дебая.
- § 12. Влияние квантовых закономерностей на распределение частиц по скоростям
- ГЛАВА III. Излучение
- § 13. Тепловое излучение и свет
- § 14. Испускание, поглощение и плотность излучения
- б. Яркость и излучательная способность.
- в. Плотность излучения.
- г. Закон Кирхгофа.
- § 15. Фотонная гипотеза. Давление излучения
- § 16. Зависимость плотности излучения от температуры и длины волны
- б. Закон смещения Вина.
- в. Закон излучения Релея — Джинса.
- г. Закон излучения Планка.
- ГЛАВА I. Первый закон термодинамики
- § 1. Термодинамическое состояние и его изменения
- § 2. Работа при квазистатических процессах
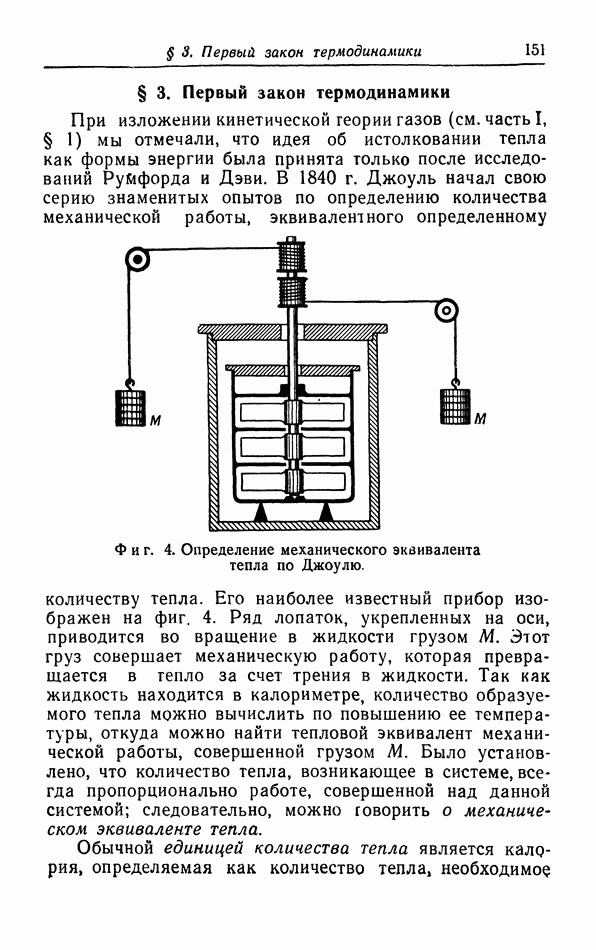
- § 3. Первый закон термодинамики
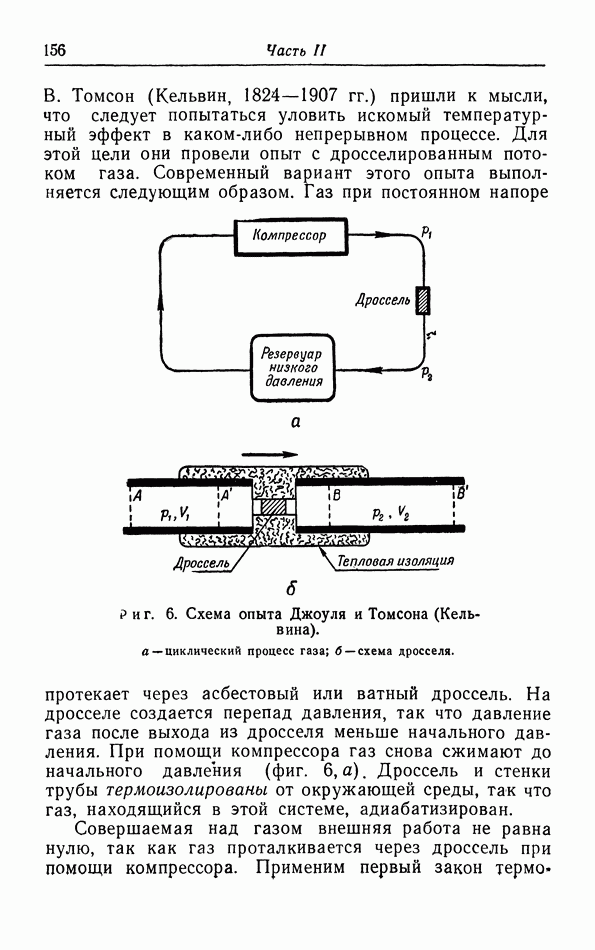
- § 4. Опыты Джоуля и Томсона
- § 5. Дальнейшие приложения первого закона
- б. Теплоемкость.
- в. Работа при адиабатических процессах.
- ГЛАВА II. Второй закон термодинамики
- § 6. Работа и теплота в циклических процессах
- § 7. Второе начало термодинамики и его различные формулировки
- § 8. Температура
- § 9. Энтропия и второй закон термодинамики
- § 10. Применения второго закона термодинамики
- в. Изэнтропические изменения состояния.
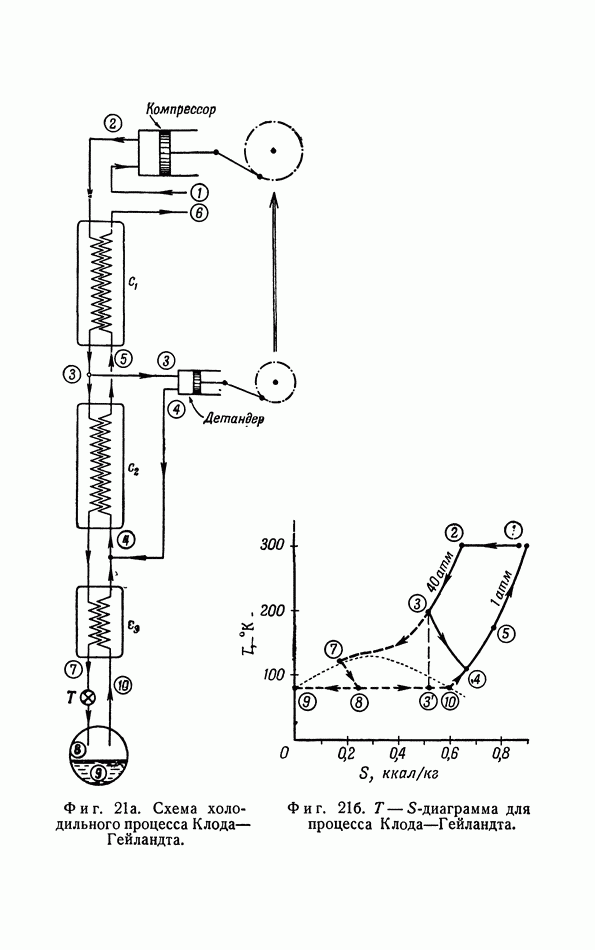
- г. Изэнтропические холодильные процессы (процесс Ж. Клода).
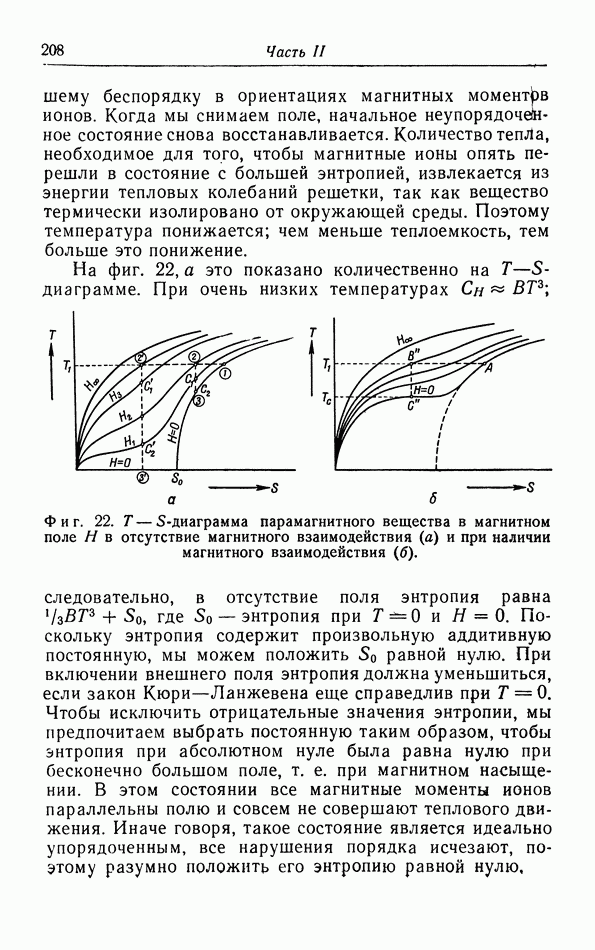
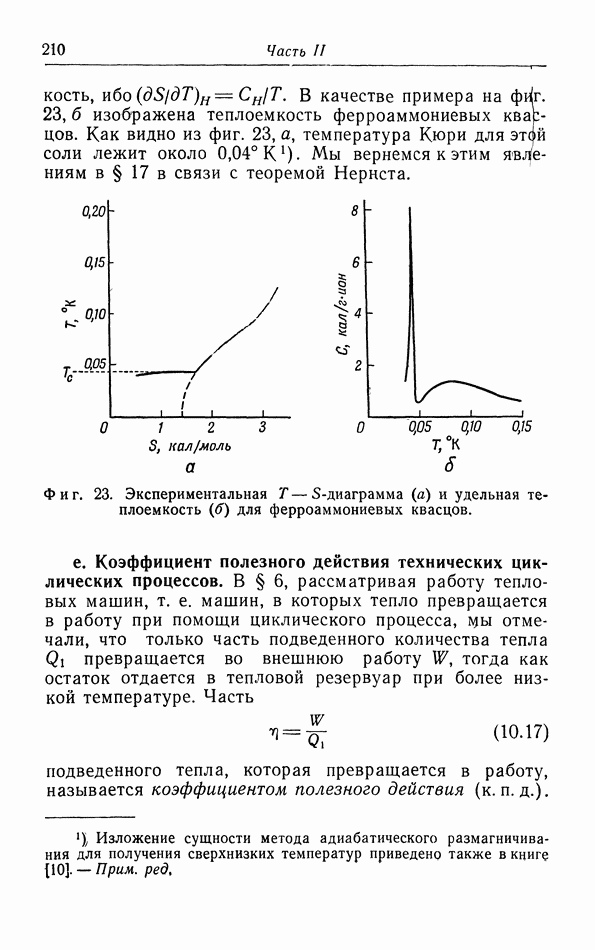
- д. Иззнтропические холодильные процессы (адиабатическое размагничивание).
- е. Коэффициент полезного действия технических циклических процессов.
- ГЛАВА III. Характеристические функции
- § 11. Энергия и энтальпия
- б. Расчет процессов Джоуля и Джоуля — Томсона (Кельвина).
- в. Зависимость внутренней энергии от объема.
- г. Вывод закона Стефана — Больцмана.
- д. Характеристические функции U и H.
- § 12. Свободная энергия
- б. Свободная энергия и поверхностное натяжение.
- в. Свободная энергия и гальванические элементы.
- § 13. Свободная энтальпия и термодинамический потенциал
- б. Термодинамический потенциал.
- в. Системы с более чем одним компонентом.
- § 14. Соотношения Максвелла
- ГЛАВА IV. Неквазистатические процессы. Равновесие
- § 15. Неквазистатические процессы
- б. Подвод тепла и изменение энтропии.
- в. Увеличение энтропии в адиабатических системах.
- г. Неквазистатический изотермический процесс.
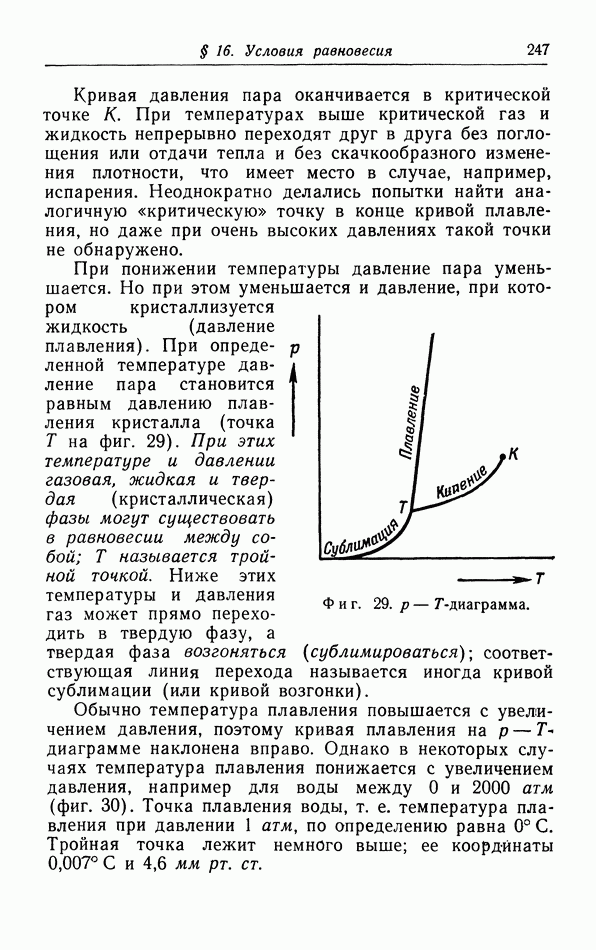
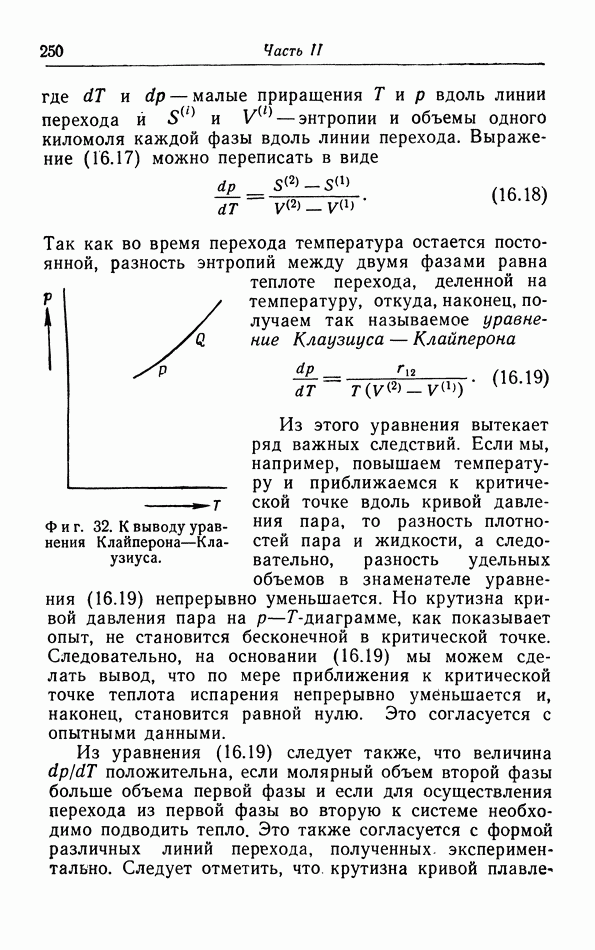
- § 16. Условия равновесия
- б. Первое условие равновесия.
- в. Второе условие равновесия.
- г. Третье условие равновесия.
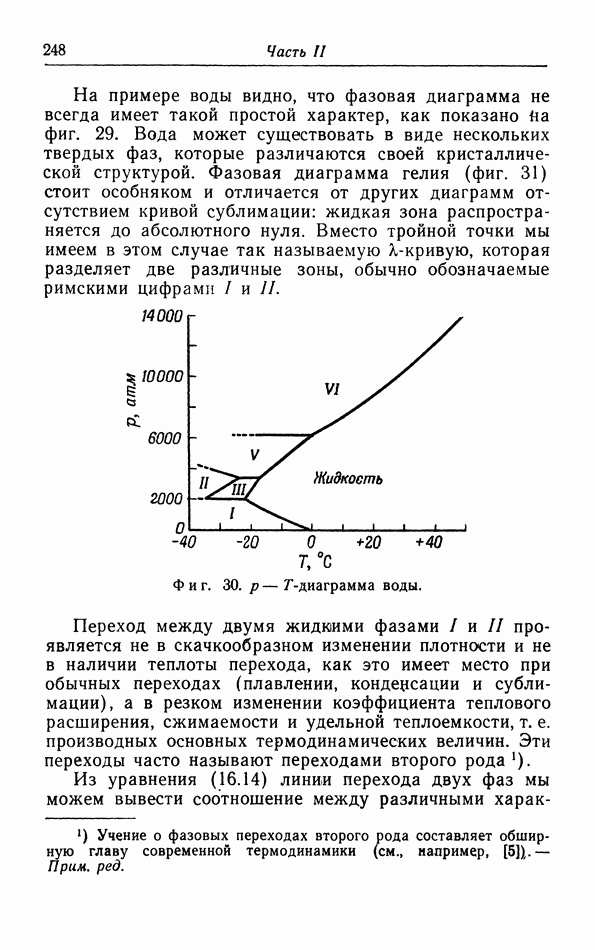
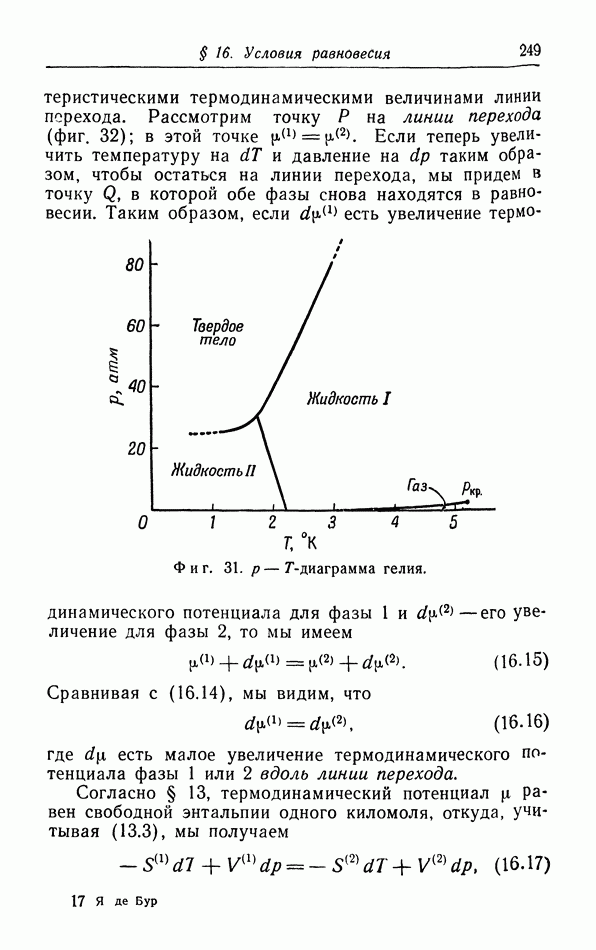
- д. p-T-диаграмма.
- е. Равновесие фаз в случае более чем одного компонента. Правило фаз.
- ГЛАВА V. Теорема Нернста
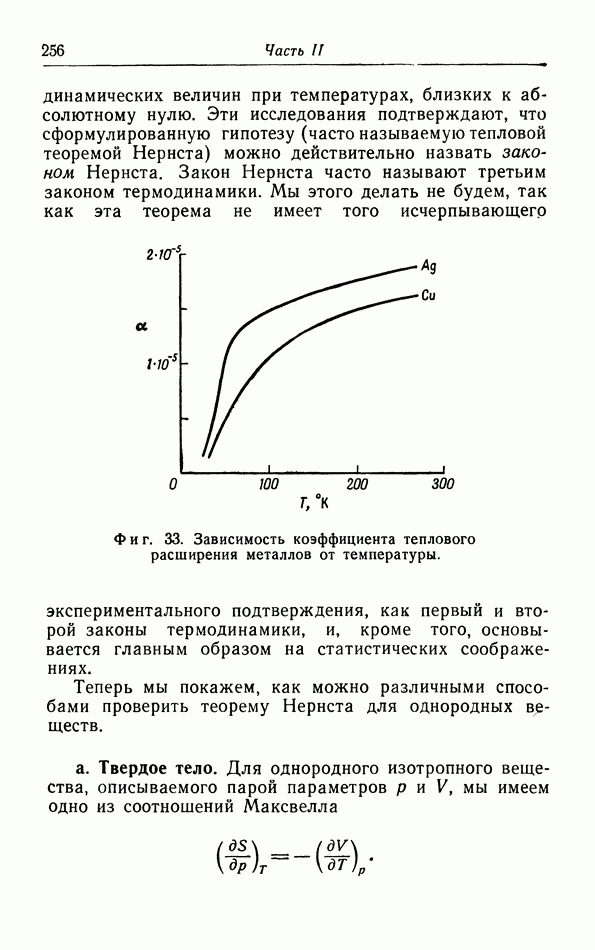
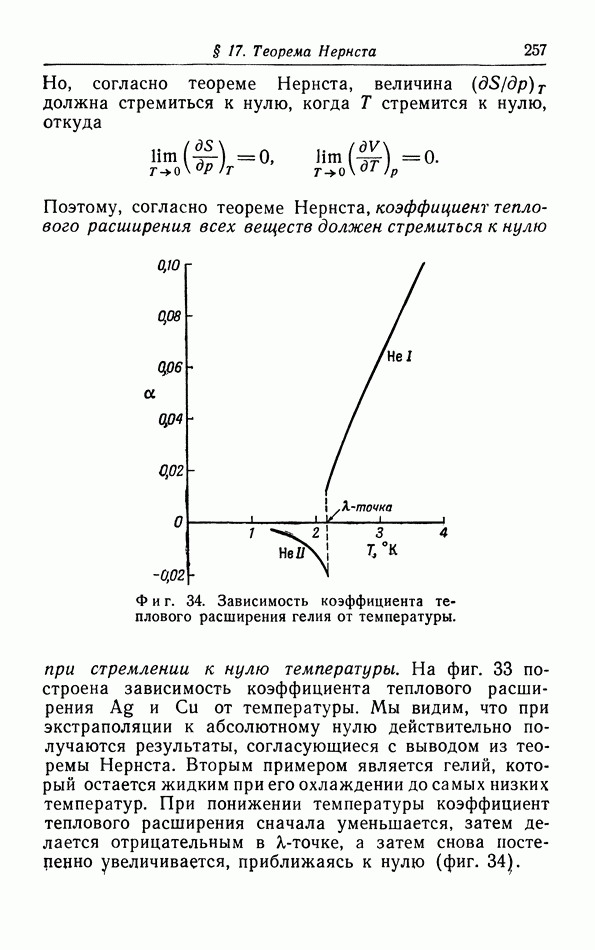
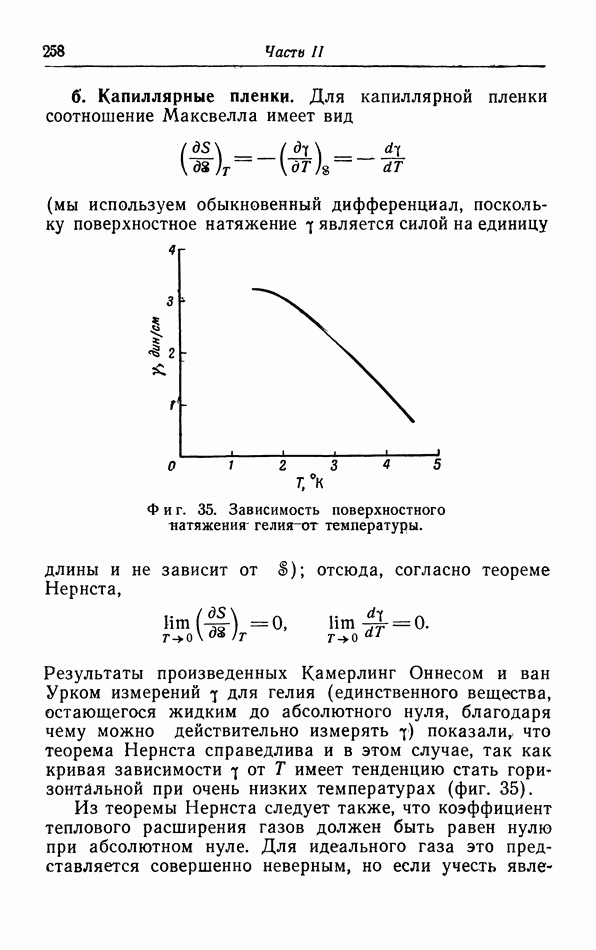
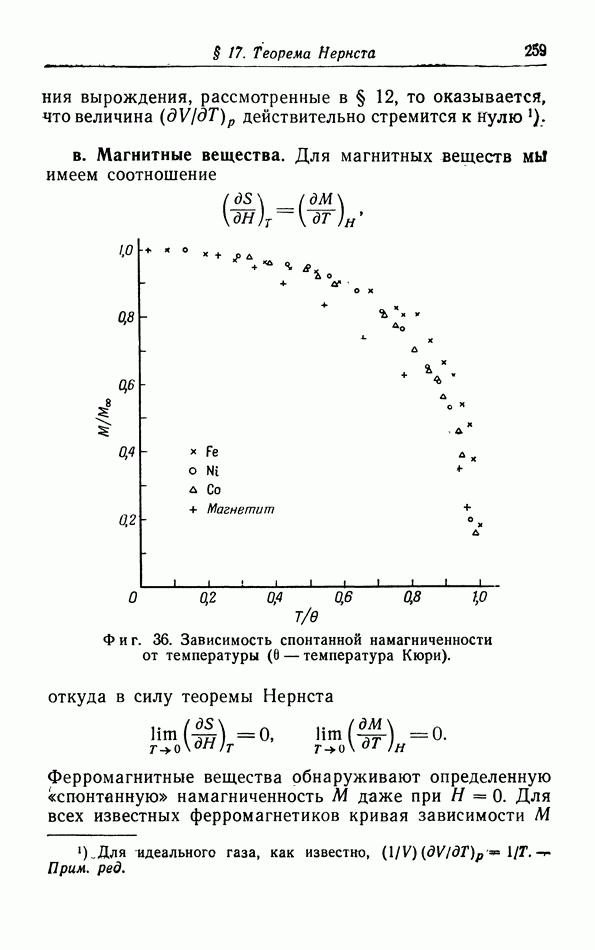
- § 17. Теорема Нернста
- § 18. Применение теоремы Нернста к фазовым переходам