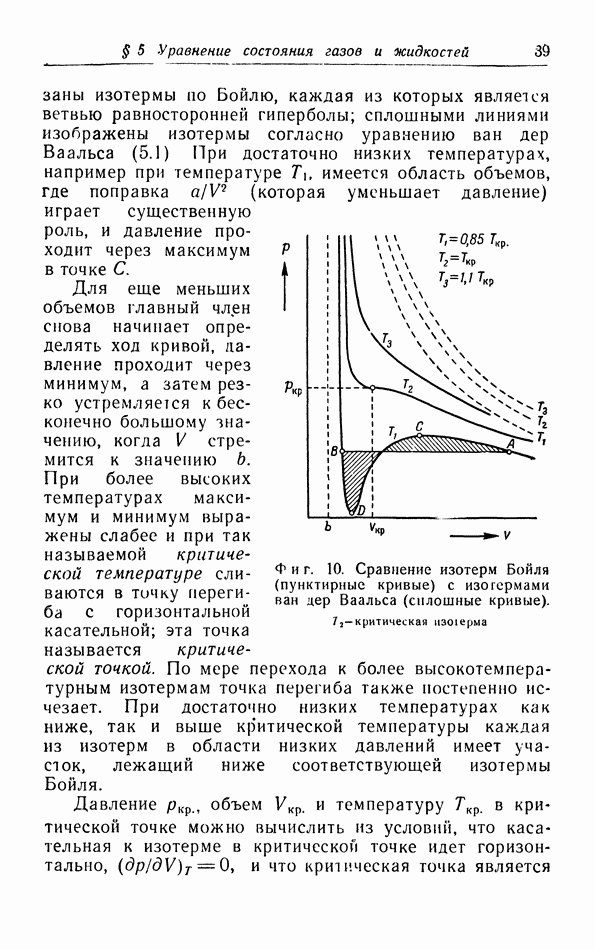
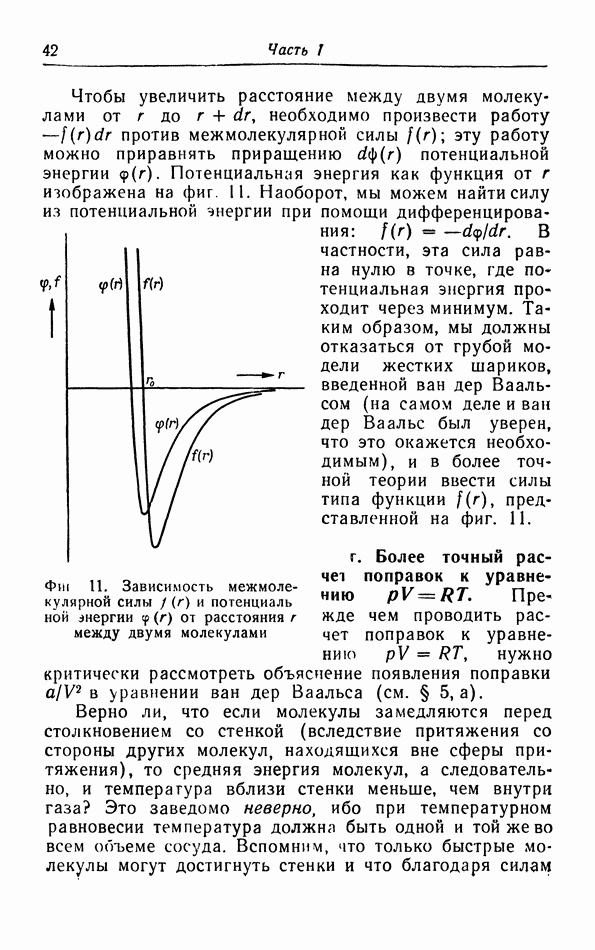
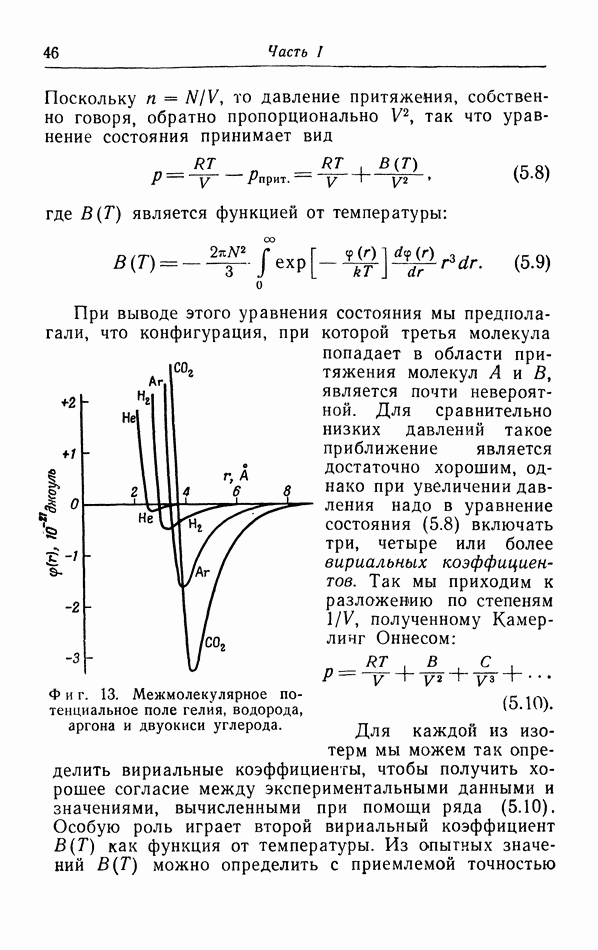
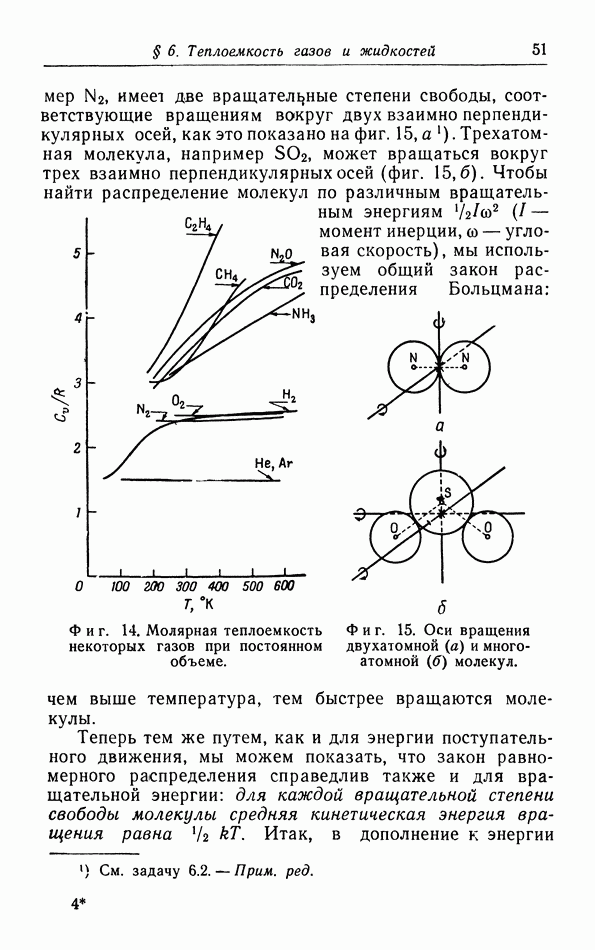
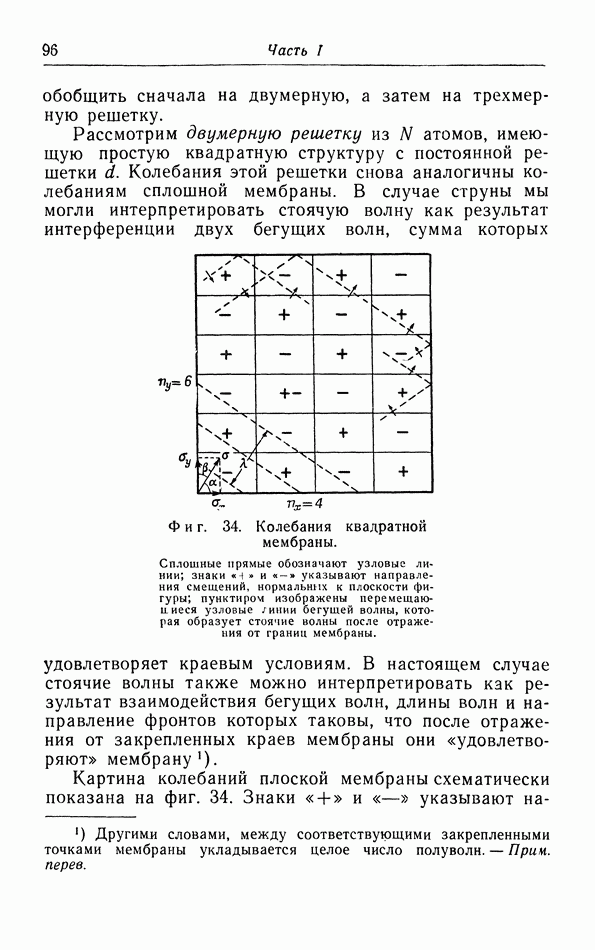
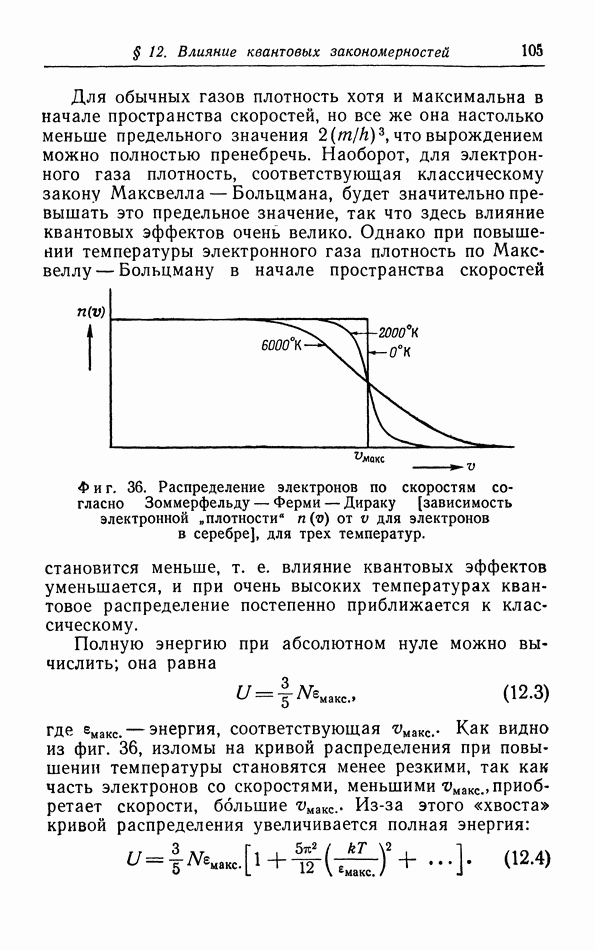
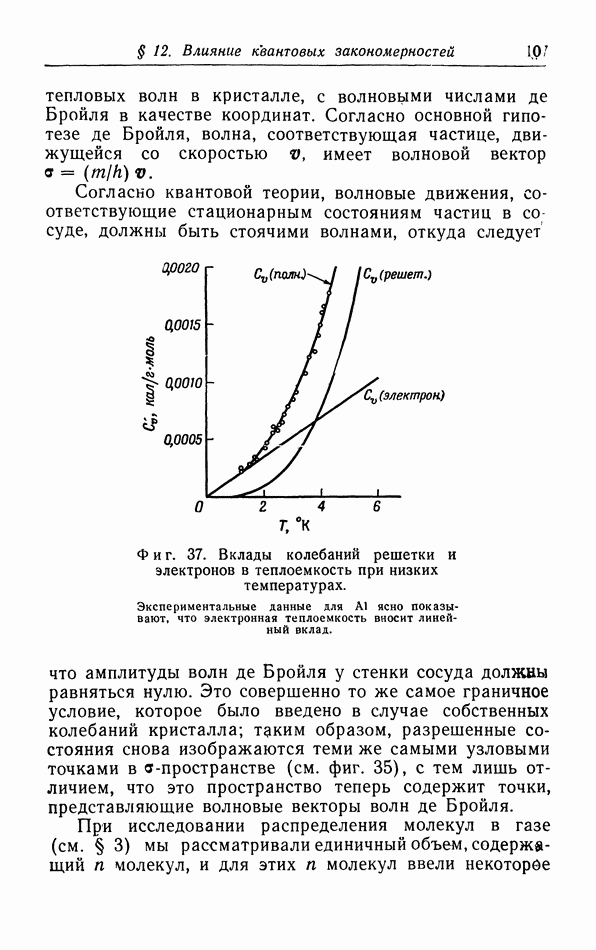
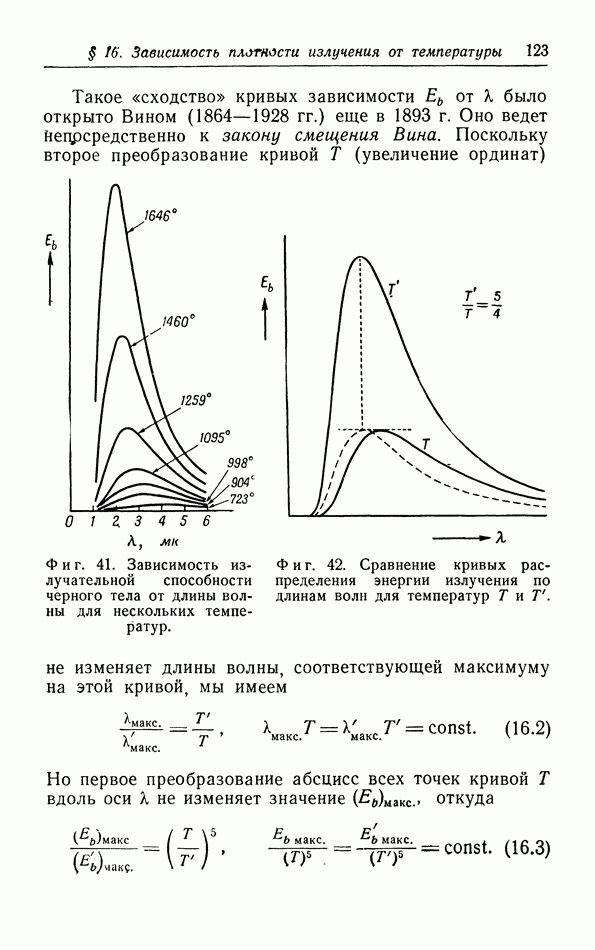
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
д. p-T-диаграмма.
Таким образом, выражение (16.14) должно определять истинное равновесное давление пара при заданной температуре. Так как и являются функциями от давления и температуры соответствующих фаз, (16.14) является уравнением линии перехода между двумя фазами. Таким образом уравнение линии перехода, например кривой давления пара или кривой плавления, представляет собой соотношение между  и
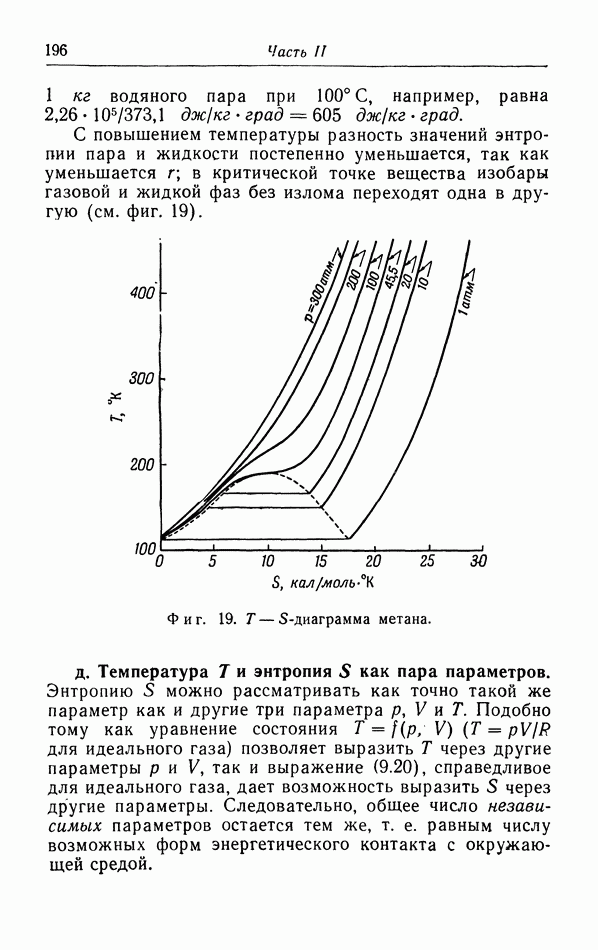
и  Поэтому наилучшим способом изображения различных фаз является
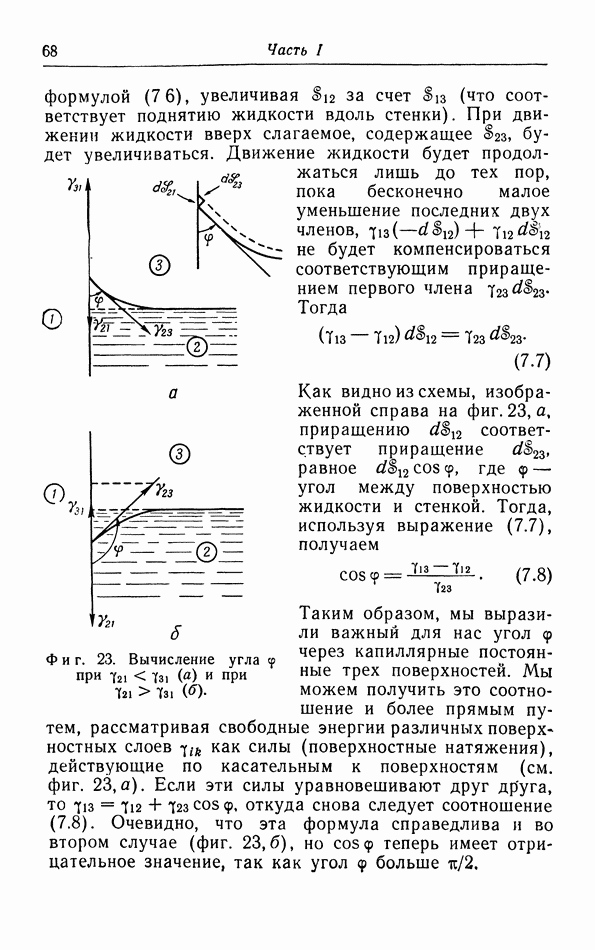
Поэтому наилучшим способом изображения различных фаз является  -диаграмма, На фиг. 29 показана обычная
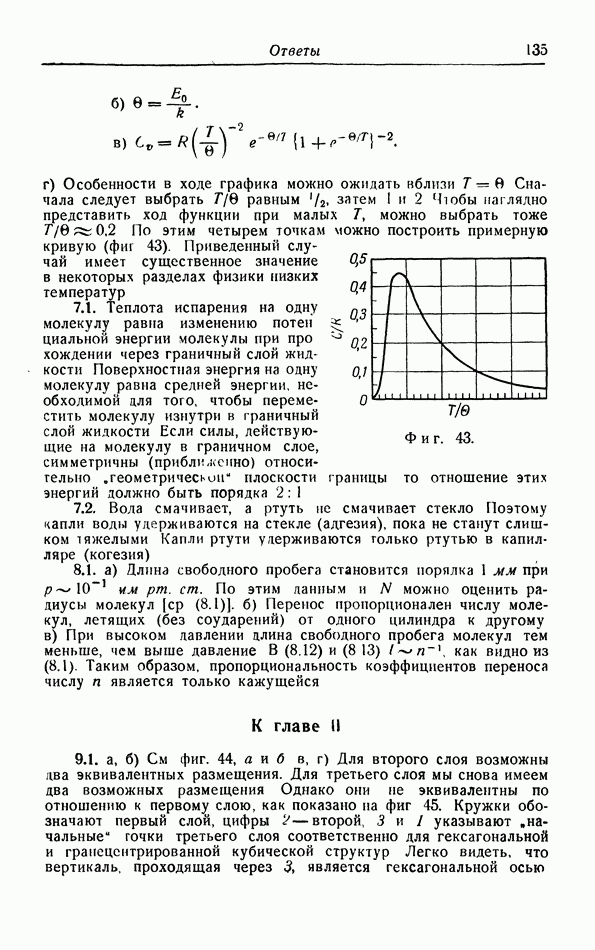
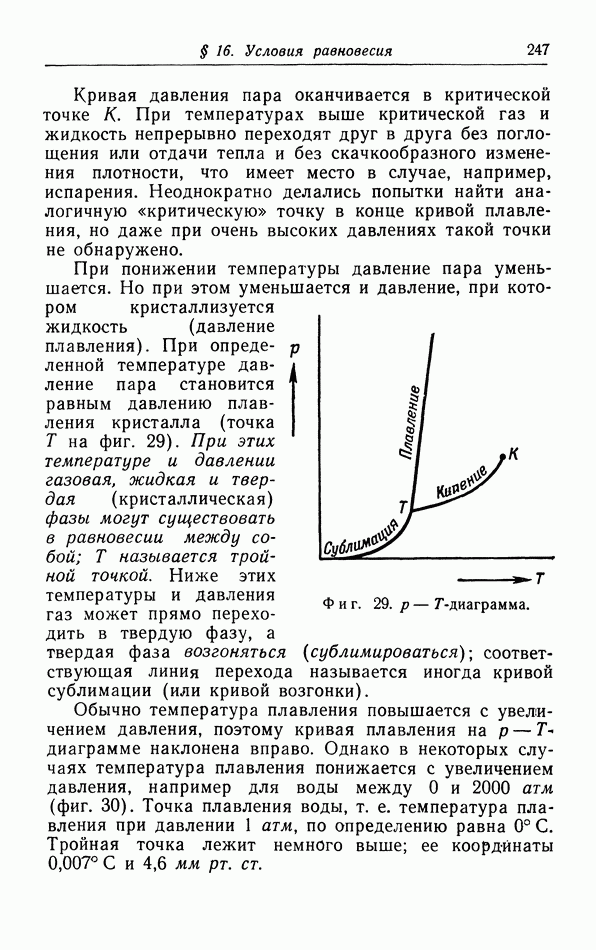
-диаграмма, На фиг. 29 показана обычная  -диаграмма. Кривая давления пара разделяет газовую и жидкую фазы, а кривая плавления — жидкую и твердую фазы.
-диаграмма. Кривая давления пара разделяет газовую и жидкую фазы, а кривая плавления — жидкую и твердую фазы.
Кривая давления пара оканчивается в критической точке К. При температурах выше критической газ и жидкость непрерывно переходят друг в друга без поглощения или отдачи тепла и без скачкообразного изменения плотности, что имеет место в случае, например, испарения. Неоднократно делались попытки найти аналогичную «критическую» точку в конце кривой плавления, но даже при очень высоких давлениях такой точки не обнаружено.
При понижении температуры давление пара уменьшается. Но при этом уменьшается и давление, при котором кристаллизуется жидкость (давление плавления). При определенной температуре давление пара становится равным давлению плавления кристалла (точка  на фиг. 29). При этих температуре и давлении газовая, жидкая и твердая (кристаллическая) фазы могут сушествовать в равновесии между собой;
на фиг. 29). При этих температуре и давлении газовая, жидкая и твердая (кристаллическая) фазы могут сушествовать в равновесии между собой;  называется тройной точкой. Ниже этих температуры и давления газ может прямо переходить в твердую фазу, а твердая фаза возгоняться (сублимироваться); соответствующая линия перехода называется иногда кривой сублимации (или кривой возгонки).
называется тройной точкой. Ниже этих температуры и давления газ может прямо переходить в твердую фазу, а твердая фаза возгоняться (сублимироваться); соответствующая линия перехода называется иногда кривой сублимации (или кривой возгонки).

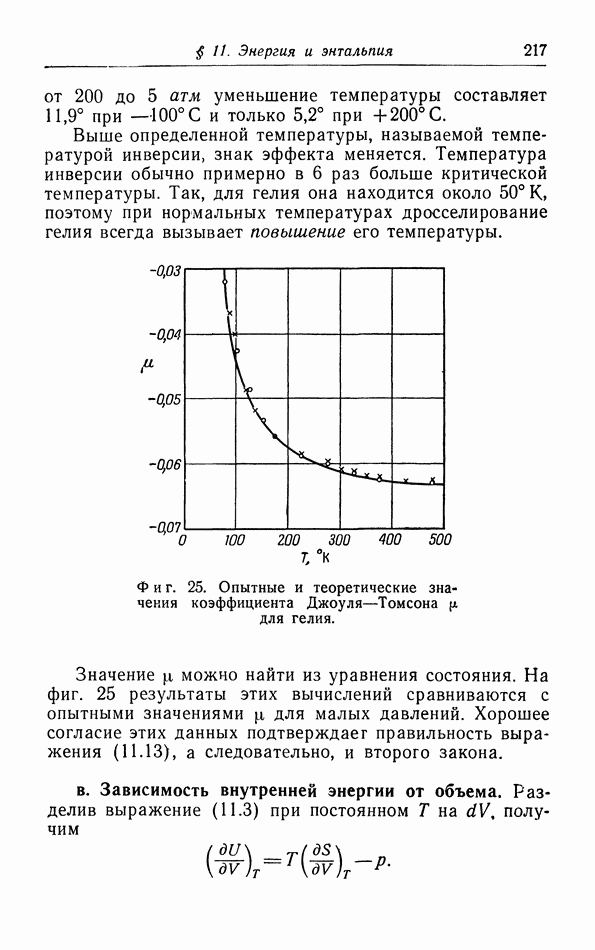
Фиг. 29.  -диаграмма.
-диаграмма.
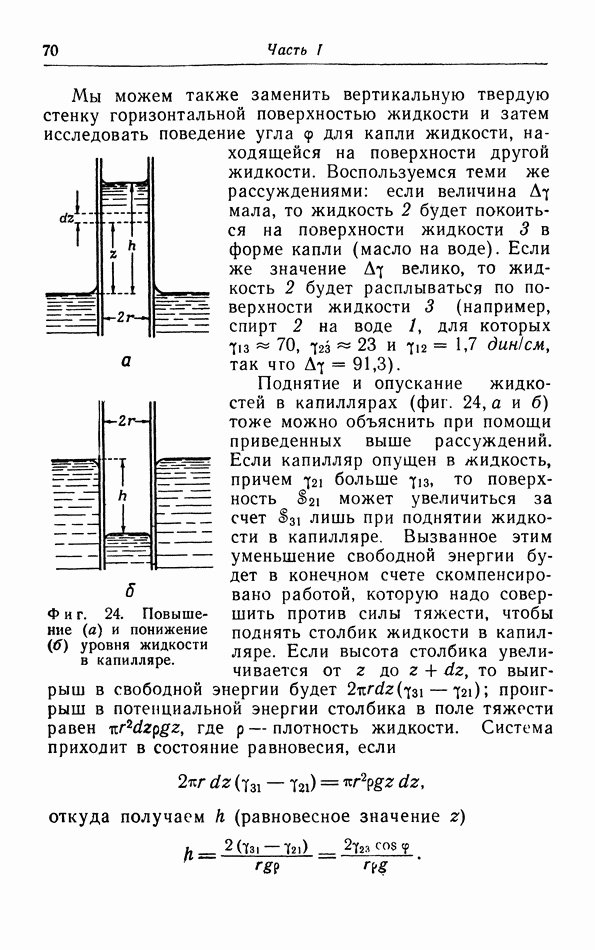
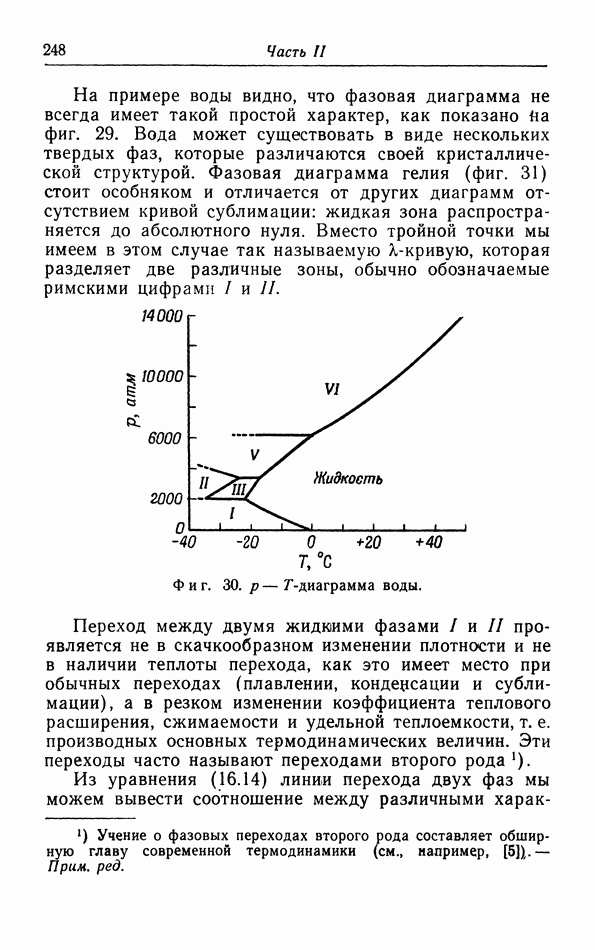
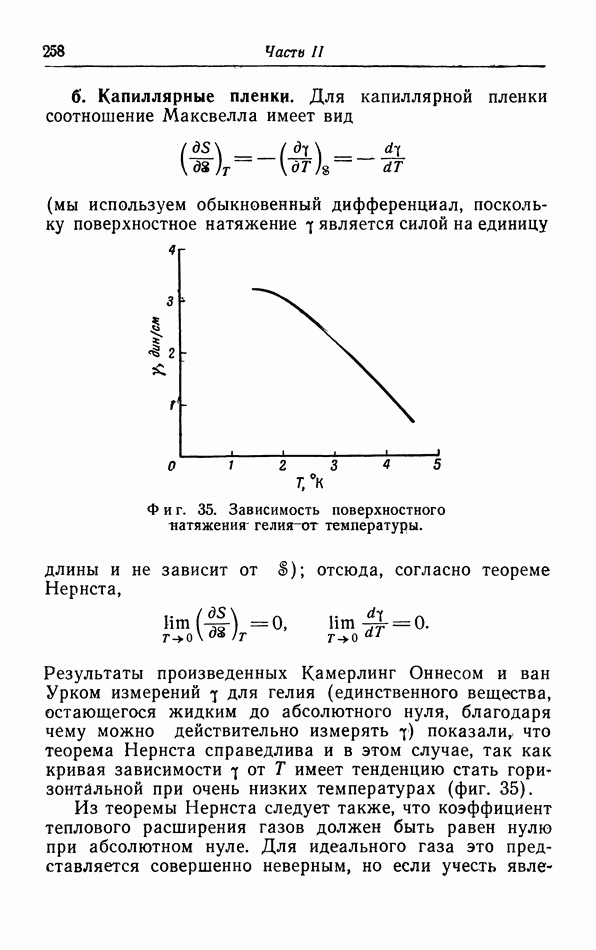
Обычно температура плавления повышается с увеличением давления, поэтому кривая плавления на  диаграмме наклонена вправо. Однако в некоторых случаях температура плавления понижается с увеличением давления, например для воды между О и 2000 атм (фиг. 30). Точка плавления воды, т. е. температура плавления при давлении 1 атм, по определению равна 0° С. Тройная точка лежит немного выше; ее координаты 0,007 С и 4,6 мм рт. ст.
диаграмме наклонена вправо. Однако в некоторых случаях температура плавления понижается с увеличением давления, например для воды между О и 2000 атм (фиг. 30). Точка плавления воды, т. е. температура плавления при давлении 1 атм, по определению равна 0° С. Тройная точка лежит немного выше; ее координаты 0,007 С и 4,6 мм рт. ст.
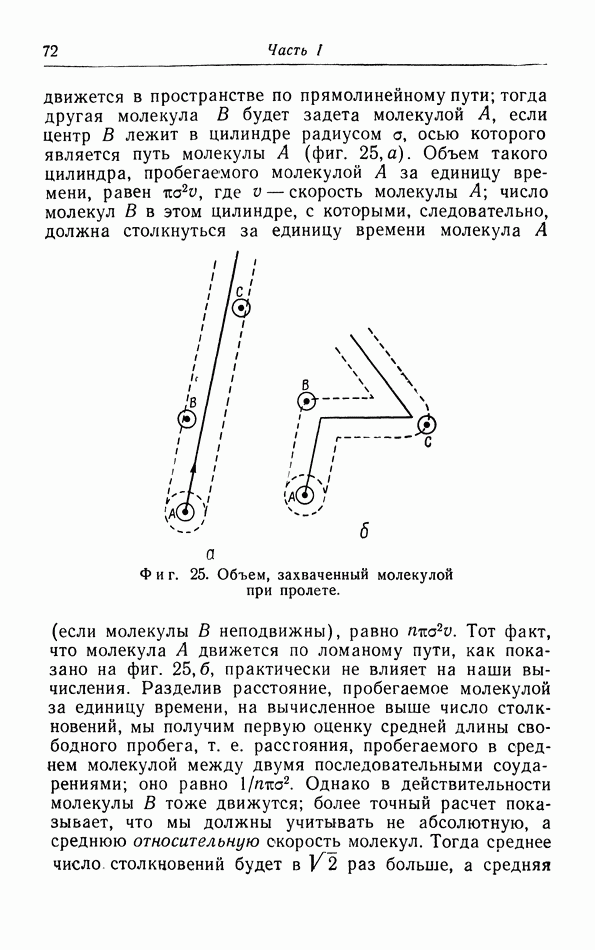
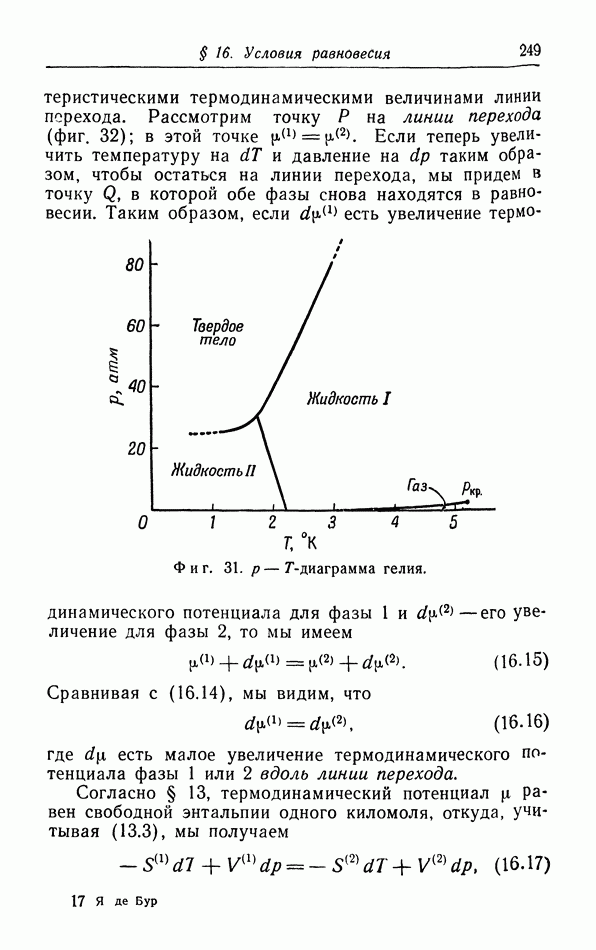
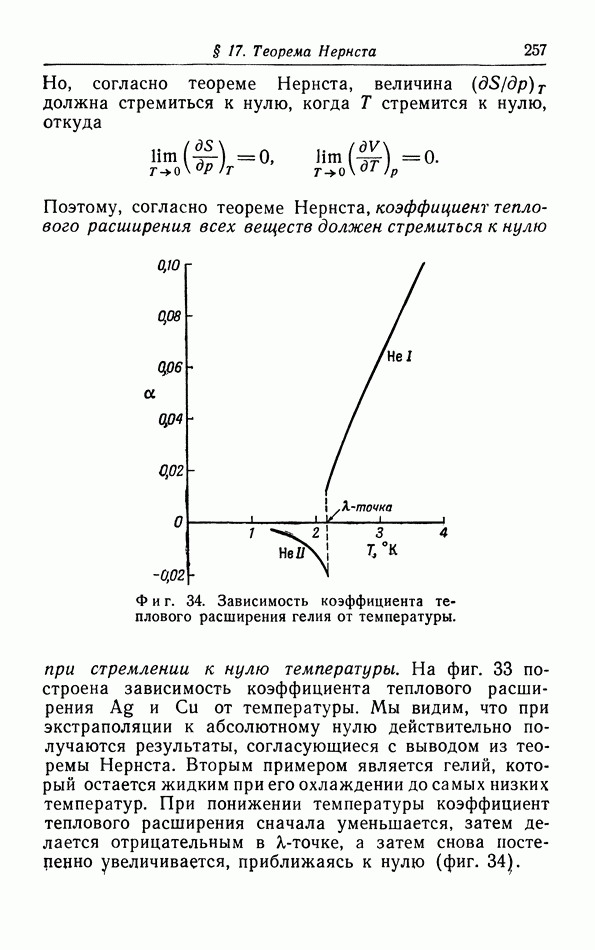
На примере воды видно, что фазовая диаграмма не всегда имеет такой простой характер, как показано На фиг. 29. Вода может существовать в виде нескольких твердых фаз, которые различаются своей кристаллической структурой. Фазовая диаграмма гелия (фиг. 31) стоит особняком и отличается от других диаграмм отсутствием кривой сублимации: жидкая зона распространяется до абсолютного нуля. Вместо тройной точки мы имеем в этом случае так называемую  -кривую, которая разделяет две различные зоны, обычно обозначаемые римскими цифрами
-кривую, которая разделяет две различные зоны, обычно обозначаемые римскими цифрами 

Фиг. 30.  -диаграмма воды.
-диаграмма воды.
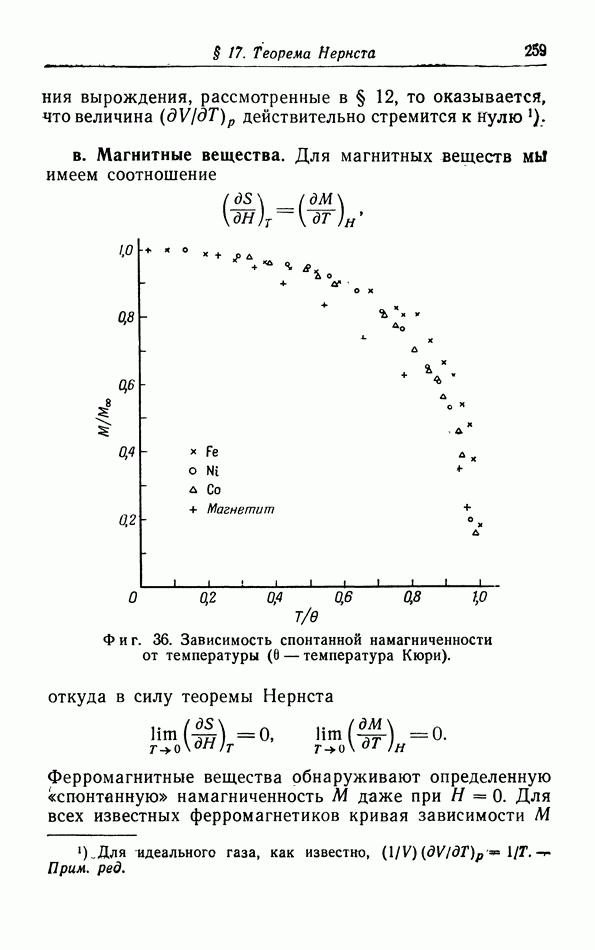
Переход между двумя жидмими фазами I и II проявляется не в скачкообразном изменении плотности и не в наличии теплоты перехода, как это имеет место при обычных переходах (плавлении, конденсации и сублимации), а в резком изменении коэффициента теплового расширения, сжимаемости и удельной теплоемкости, т. е. производных основных термодинамических величин. Эти переходы часто называют переходами второго рода
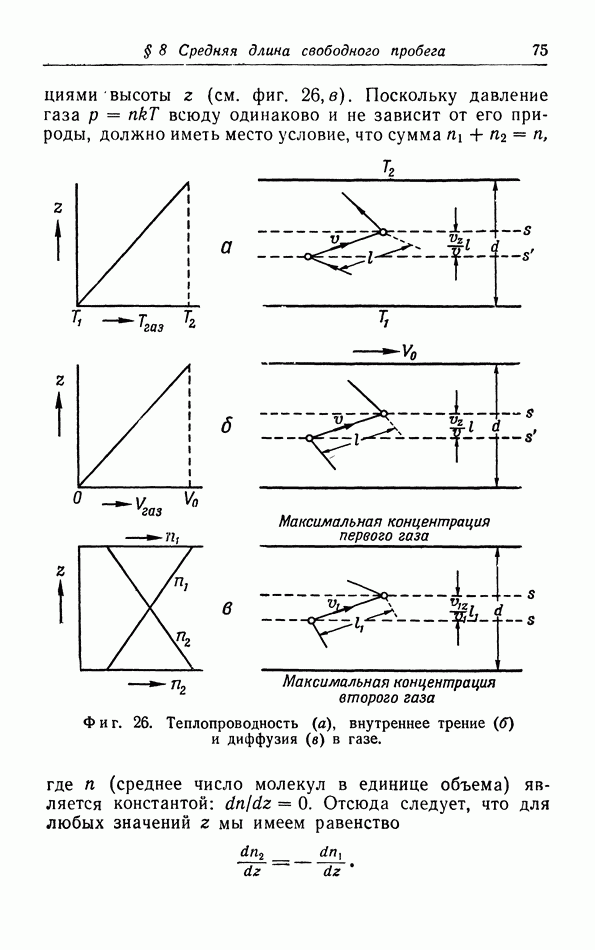
Из уравнения (16.14) линии перехода двух фаз мы можем вывести соотношение между различными
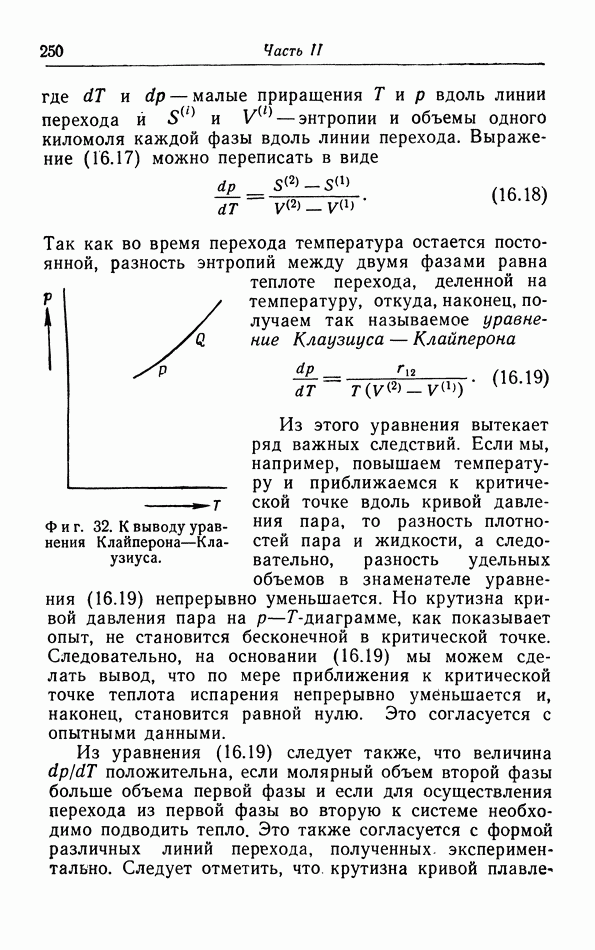
характеристическими термодинамическими величинами линии перехода. Рассмотрим точку  на линии перехода (фиг. 32); в этой точке
на линии перехода (фиг. 32); в этой точке  Если теперь увеличить температуру на
Если теперь увеличить температуру на  и давление на
и давление на  таким образом, чтобы остаться на линии перехода, мы придем в точку
таким образом, чтобы остаться на линии перехода, мы придем в точку  в которой обе фазы снова находятся в равновесии.
в которой обе фазы снова находятся в равновесии.

Фиг.  -диаграмма гелия.
-диаграмма гелия.
Таким образом, если есть увеличение термодинамического потенциала для фазы 1 и  — его увеличение для фазы 2, то мы имеем
— его увеличение для фазы 2, то мы имеем

Сравнивая с (16.14), мы видим, что

где  есть малое увеличение термодинамического потенциала фазы 1 или 2 вдоль линии перехода.
есть малое увеличение термодинамического потенциала фазы 1 или 2 вдоль линии перехода.
Согласно § 13, термодинамический потенциал  равен свободной энтальпии одного киломоля, откуда, учитывая (13.3), мы получаем
равен свободной энтальпии одного киломоля, откуда, учитывая (13.3), мы получаем

где  — малые приращения
— малые приращения  вдоль линии перехода и
вдоль линии перехода и  — энтропии и объемы одного киломоля каждой фазы вдоль линии перехода. Выражение (16.17) можно переписать в виде
— энтропии и объемы одного киломоля каждой фазы вдоль линии перехода. Выражение (16.17) можно переписать в виде


Фиг. 32. К выводу уравнения Клайперона-Клаузиуса.
Так как во время перехода температура остается постоянной, разность энтропий между двумя фазами равна теплоте перехода, деленной на температуру, откуда, наконец, получаем так называемое уравнение Клаузиуса — Клайперона

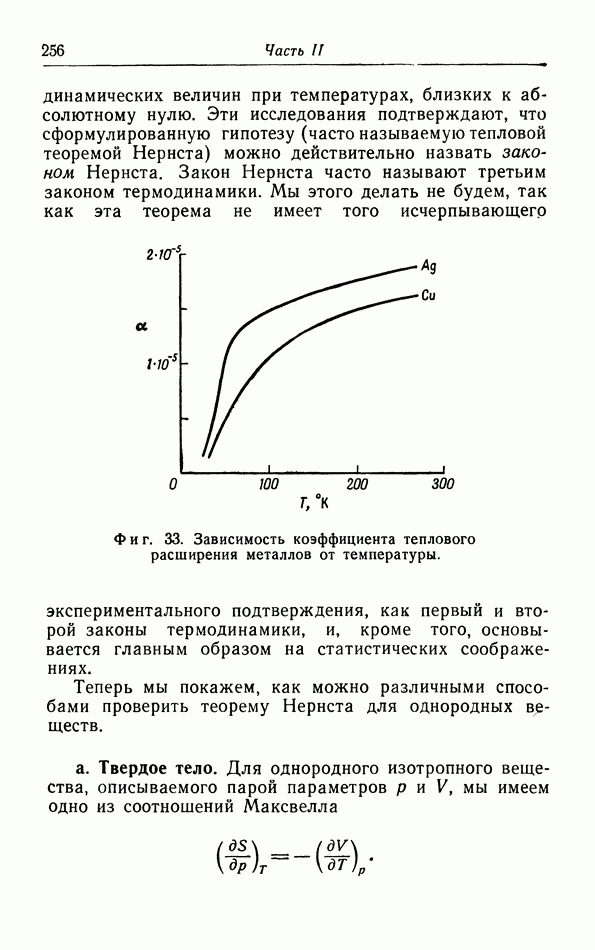
Из этого уравнения вытекает ряд важных следствий. Если мы, например, повышаем температуру и приближаемся к критической точке вдоль кривой давления пара, то разность плотностей пара и жидкости, а следовательно, разность удельных объемов в знаменателе уравнения (16.19) непрерывно уменьшается. Но крутизна кривой давления пара на p-T-диаграмме, как показывает опыт, не становится бесконечной в критической точке. Следовательно, на основании (16.19) мы можем сделать вывод, что по мере приближения к критической точке теплота испарения непрерывно уменьшается и, наконец, становится равной нулю. Это согласуется с опытными данными.
Из уравнения (16.19) следует также, что величина  положительна, если молярный объем второй фазы больше объема первой фазы и если для осуществления перехода из первой фазы во вторую к системе необходимо подводить тепло. Это также согласуется с формой различных линий перехода, полученных экспериментально. Следует отметить, что крутизна кривой
положительна, если молярный объем второй фазы больше объема первой фазы и если для осуществления перехода из первой фазы во вторую к системе необходимо подводить тепло. Это также согласуется с формой различных линий перехода, полученных экспериментально. Следует отметить, что крутизна кривой
плавления воды отрицательна, несмотря на то что величина  положительна. Уравнение (16.19) показывает, что в этом случае объем второй фазы (воды) должен быть меньше объема первой фазы (льда), тогда как обычно твердая фаза имеет меньший молярный объем. Эти особые свойства воды уже давно известны из опыта.
положительна. Уравнение (16.19) показывает, что в этом случае объем второй фазы (воды) должен быть меньше объема первой фазы (льда), тогда как обычно твердая фаза имеет меньший молярный объем. Эти особые свойства воды уже давно известны из опыта.
| << Предыдущий параграф | Следующий параграф >> |
- Предисловие к русскому изданию
- ГЛАВА I. Газы и жидкости
- § 1. Молекулярная структура газов и жидкостей
- § 2. Кинетическая теория идеального газа
- б. Расчет давления в кинетической теории газов.
- в. Расчет удельной теплоемкости в кинетической теории газов.
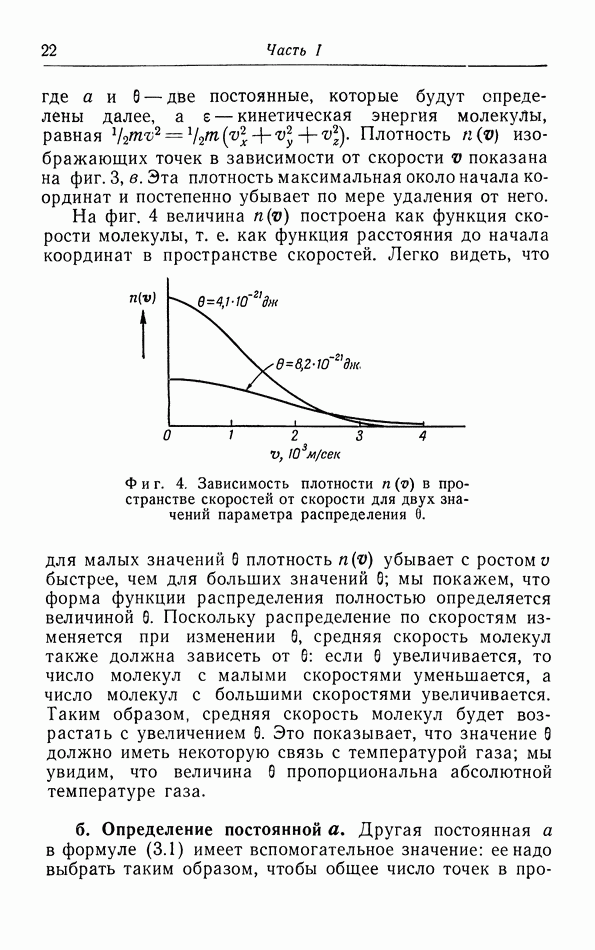
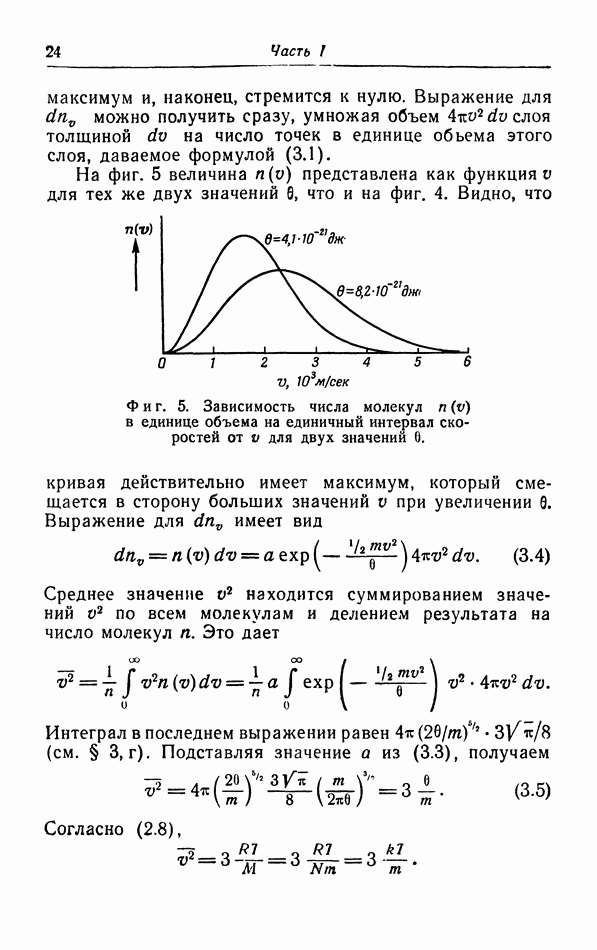
- § 3. Распределение молекул по скорости их движения
- г. Средняя квадратичная и средняя скорости.
- д. Броуновское движение.
- е. Опыты с молекулярными пучками.
- § 4. Общее распределение молекул по энергиям
- б. Возбужденные состояния.
- в. вращательная и колебательная энергии.
- г. Потенциальная энергия тяготения.
- д. Потенциальная энергия межмолекулярных сил.
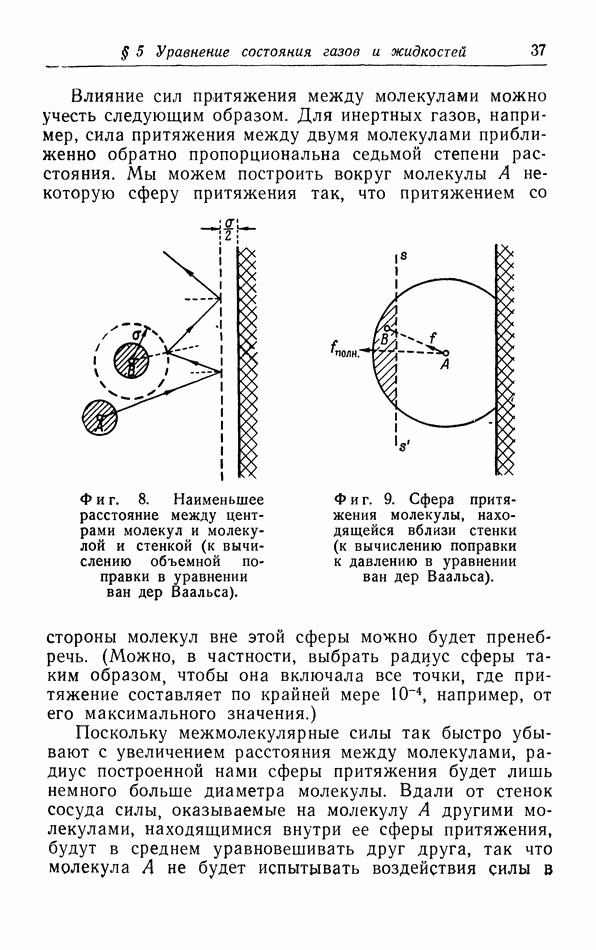
- § 5. Уравнение состояния газов и жидкостей
- б. Обсуждение уравнения ван дер Ваальса.
- в. Взаимодействие молекул.
- г. Более точный расчет поправок к уравнению pV=RT.
- д. Закон соответственных состояний.
- е. Жидкая фаза.
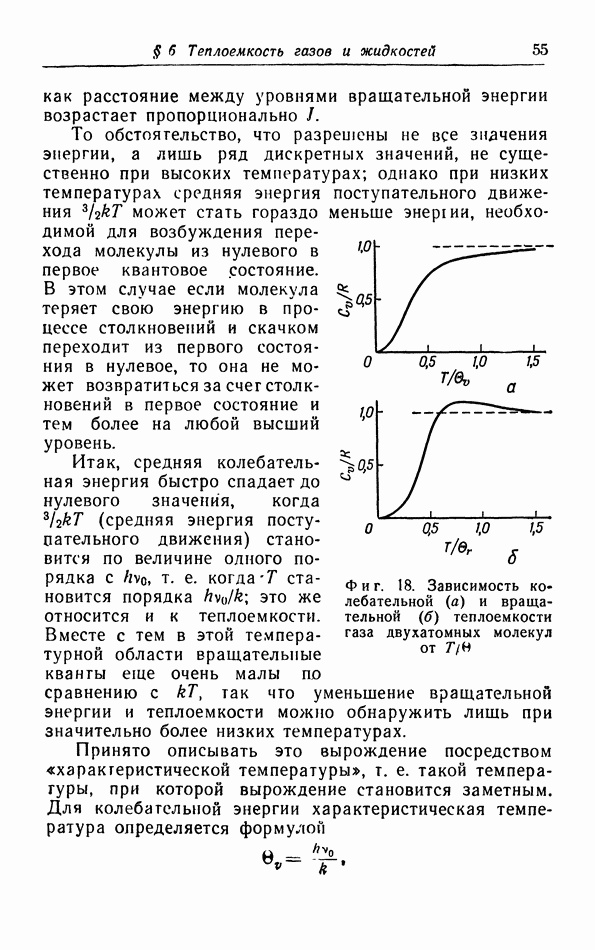
- § 6. Теплоемкость газов и жидкостей
- б. Классическая теория колебательной теплоемкости.
- в. Квантовая теория теплоемкости.
- г. Расчет колебательной теплоемкости двухатомной молекулы.
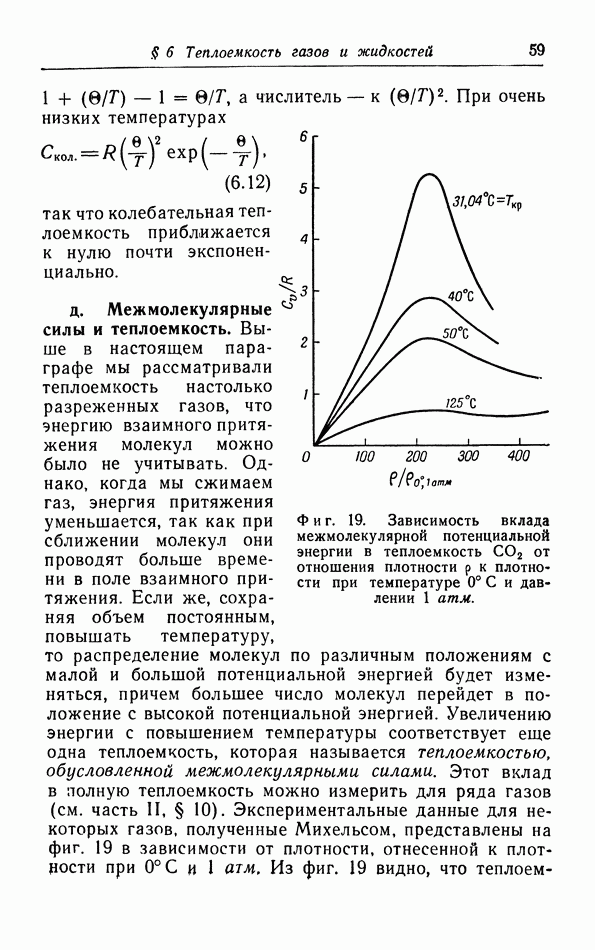
- д. Межмолекулярные силы и теплоемкость.
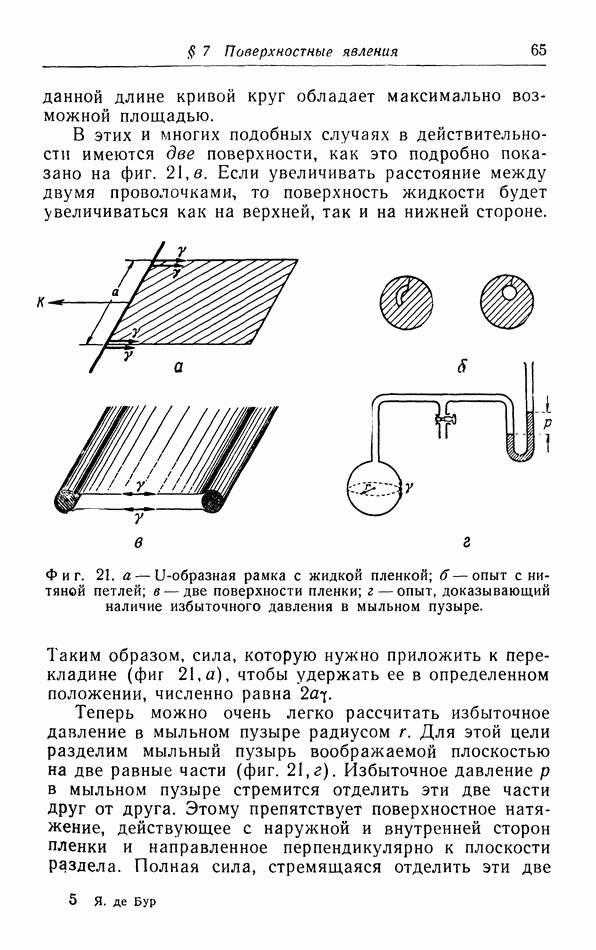
- § 7. Поверхностные явления
- б. Жидкие пленки.
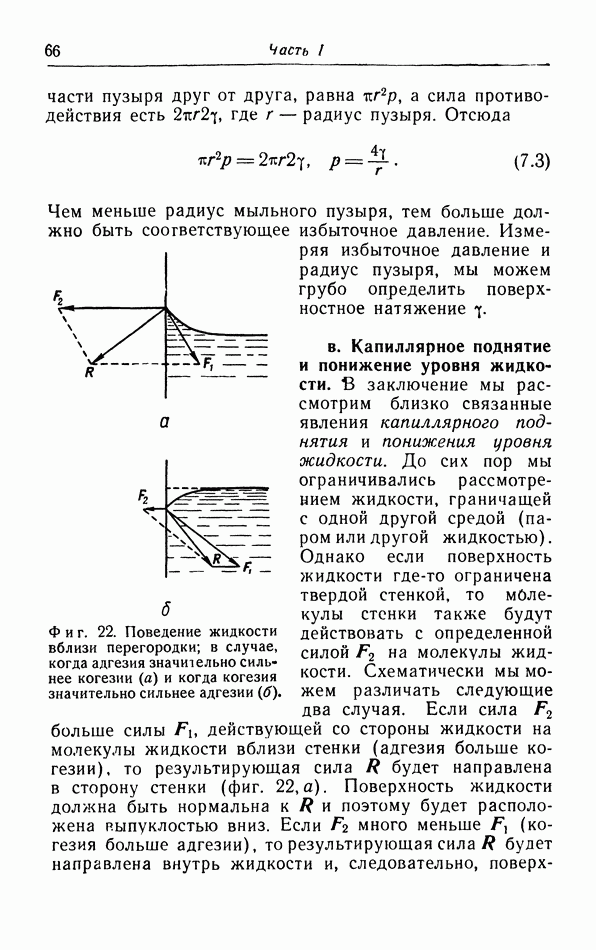
- в. Капиллярное поднятие и понижение уровня жидкости.
- § 8. Средняя длина свободного пробега, теплопроводность, вязкость и диффузия
- ГЛАВА II. Твердые тела
- § 9. Структура твердых тел
- § 10. Уравнение состояния твердых тел
- § 11. Теплоемкость твердых тел
- в. Колебания линейной цепочки.
- г. Колебания двумерной решетки.
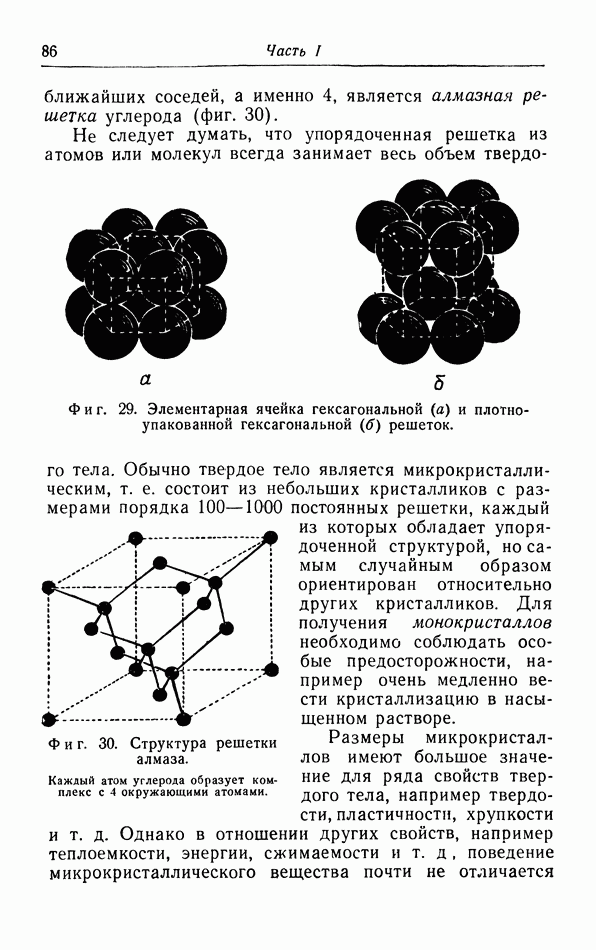
- д. Колебания трехмерной решетки.
- е. Теория Дебая.
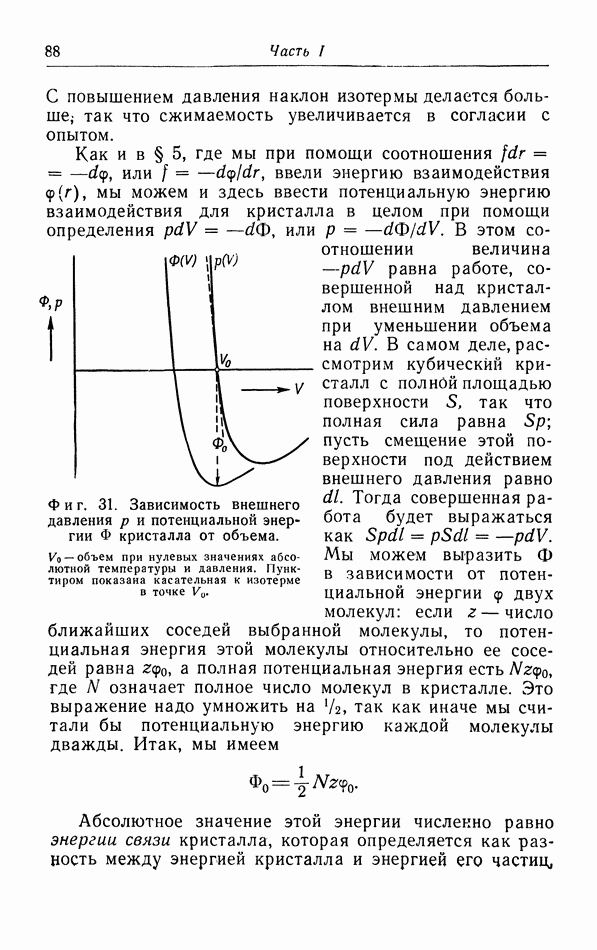
- § 12. Влияние квантовых закономерностей на распределение частиц по скоростям
- ГЛАВА III. Излучение
- § 13. Тепловое излучение и свет
- § 14. Испускание, поглощение и плотность излучения
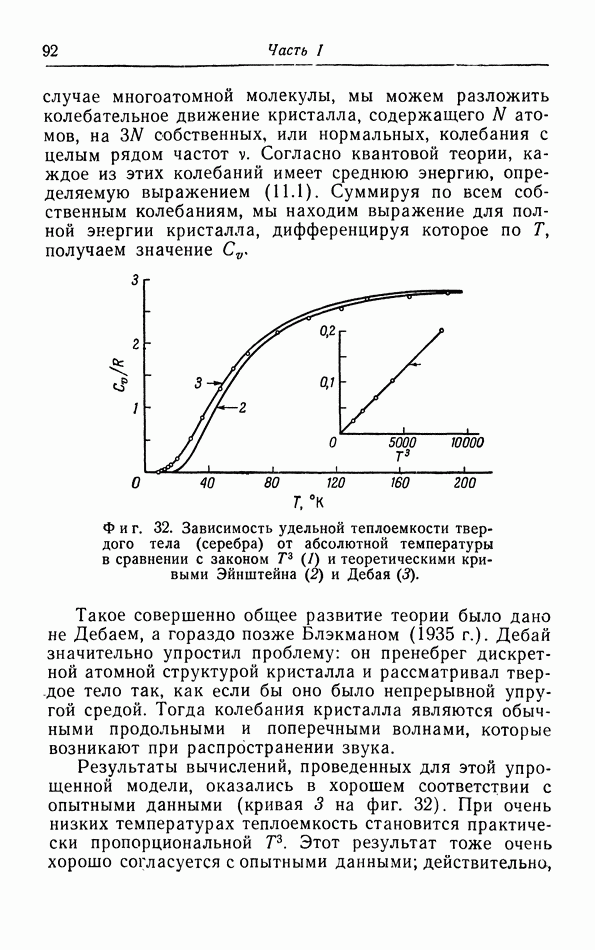
- б. Яркость и излучательная способность.
- в. Плотность излучения.
- г. Закон Кирхгофа.
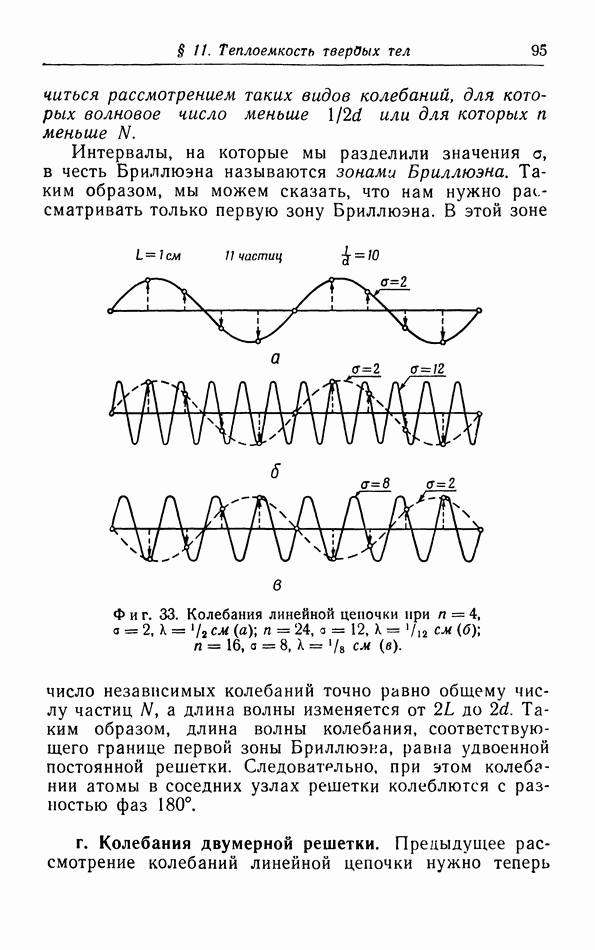
- § 15. Фотонная гипотеза. Давление излучения
- § 16. Зависимость плотности излучения от температуры и длины волны
- б. Закон смещения Вина.
- в. Закон излучения Релея — Джинса.
- г. Закон излучения Планка.
- ГЛАВА I. Первый закон термодинамики
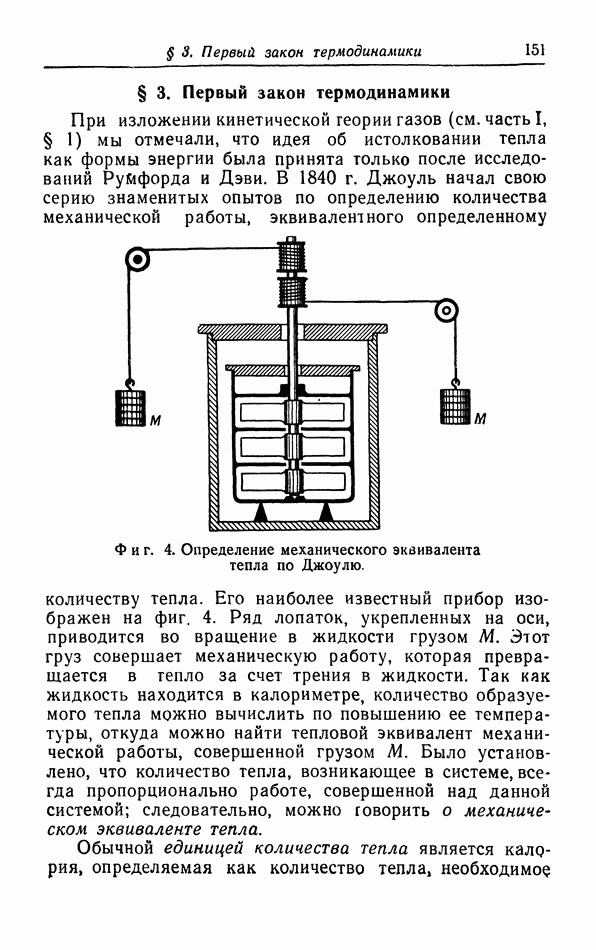
- § 1. Термодинамическое состояние и его изменения
- § 2. Работа при квазистатических процессах
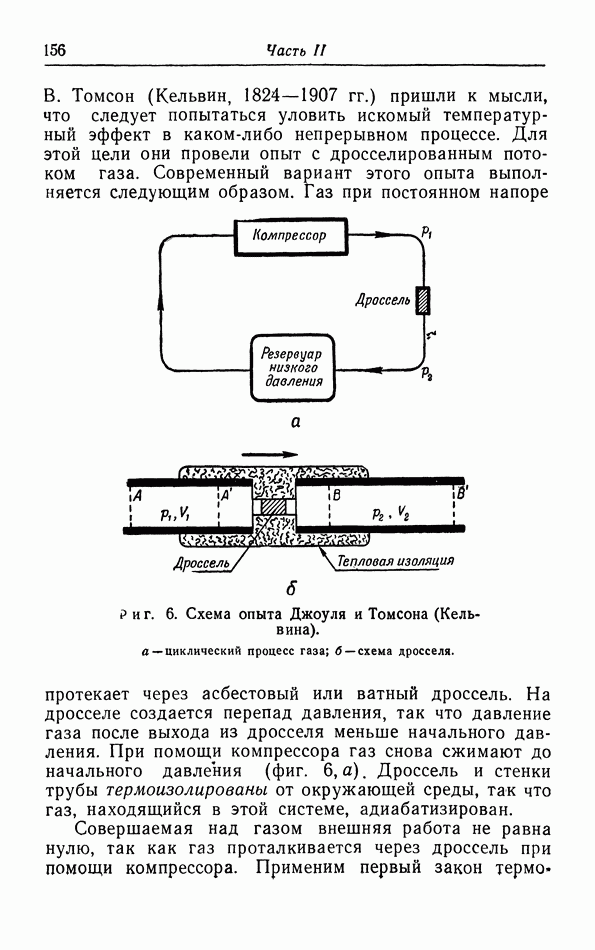
- § 3. Первый закон термодинамики
- § 4. Опыты Джоуля и Томсона
- § 5. Дальнейшие приложения первого закона
- б. Теплоемкость.
- в. Работа при адиабатических процессах.
- ГЛАВА II. Второй закон термодинамики
- § 6. Работа и теплота в циклических процессах
- § 7. Второе начало термодинамики и его различные формулировки
- § 8. Температура
- § 9. Энтропия и второй закон термодинамики
- § 10. Применения второго закона термодинамики
- в. Изэнтропические изменения состояния.
- г. Изэнтропические холодильные процессы (процесс Ж. Клода).
- д. Иззнтропические холодильные процессы (адиабатическое размагничивание).
- е. Коэффициент полезного действия технических циклических процессов.
- ГЛАВА III. Характеристические функции
- § 11. Энергия и энтальпия
- б. Расчет процессов Джоуля и Джоуля — Томсона (Кельвина).
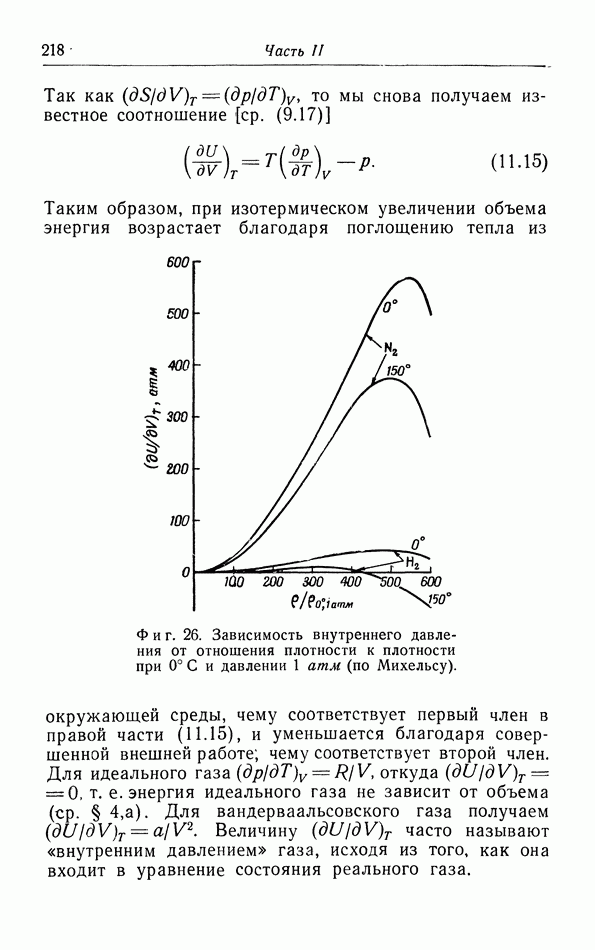
- в. Зависимость внутренней энергии от объема.
- г. Вывод закона Стефана — Больцмана.
- д. Характеристические функции U и H.
- § 12. Свободная энергия
- б. Свободная энергия и поверхностное натяжение.
- в. Свободная энергия и гальванические элементы.
- § 13. Свободная энтальпия и термодинамический потенциал
- б. Термодинамический потенциал.
- в. Системы с более чем одним компонентом.
- § 14. Соотношения Максвелла
- ГЛАВА IV. Неквазистатические процессы. Равновесие
- § 15. Неквазистатические процессы
- б. Подвод тепла и изменение энтропии.
- в. Увеличение энтропии в адиабатических системах.
- г. Неквазистатический изотермический процесс.
- § 16. Условия равновесия
- б. Первое условие равновесия.
- в. Второе условие равновесия.
- г. Третье условие равновесия.
- д. p-T-диаграмма.
- е. Равновесие фаз в случае более чем одного компонента. Правило фаз.
- ГЛАВА V. Теорема Нернста
- § 17. Теорема Нернста
- § 18. Применение теоремы Нернста к фазовым переходам