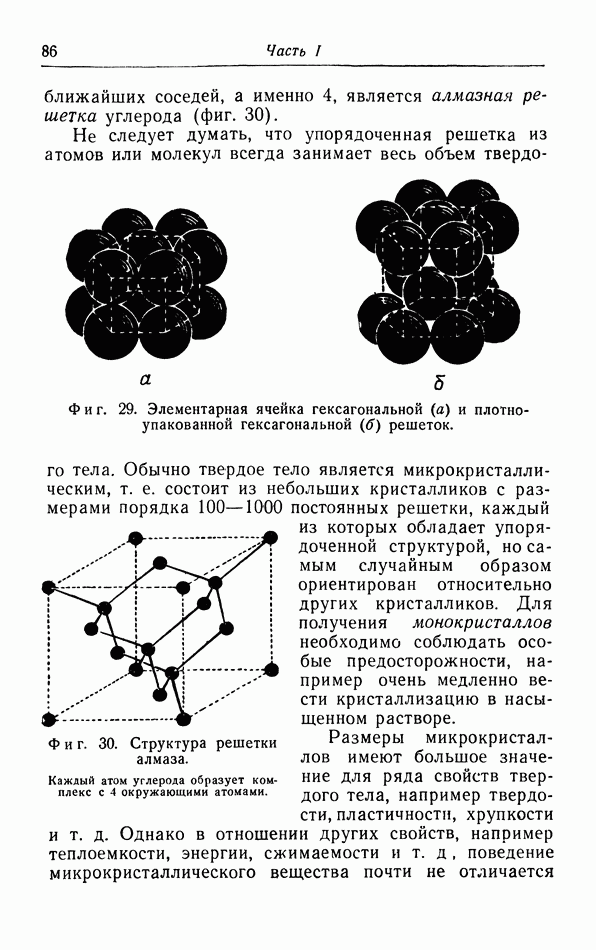
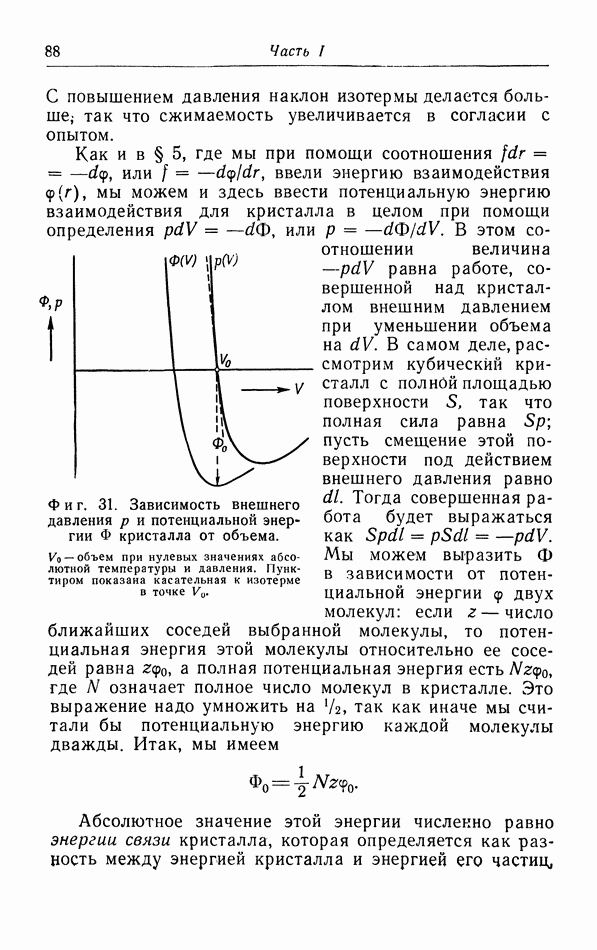
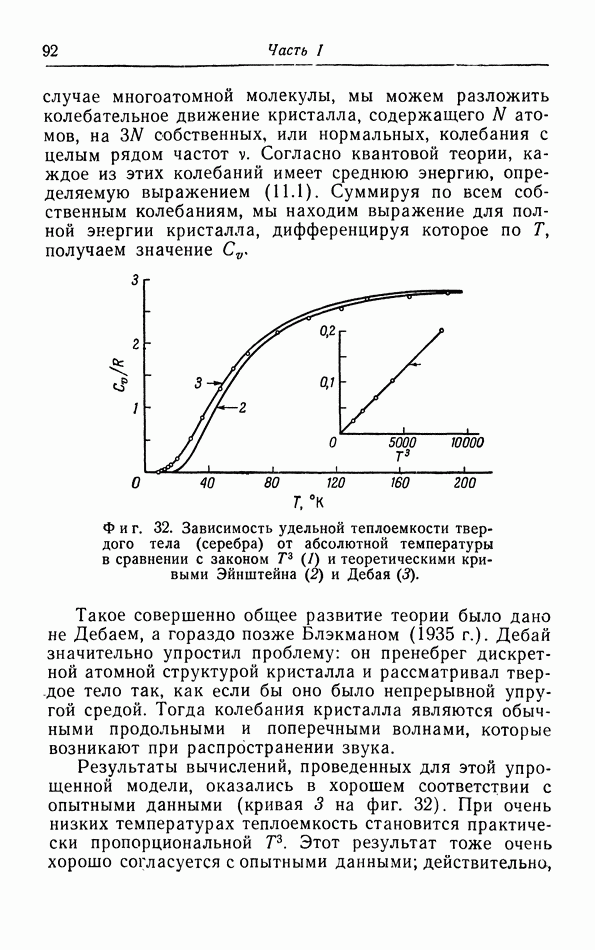
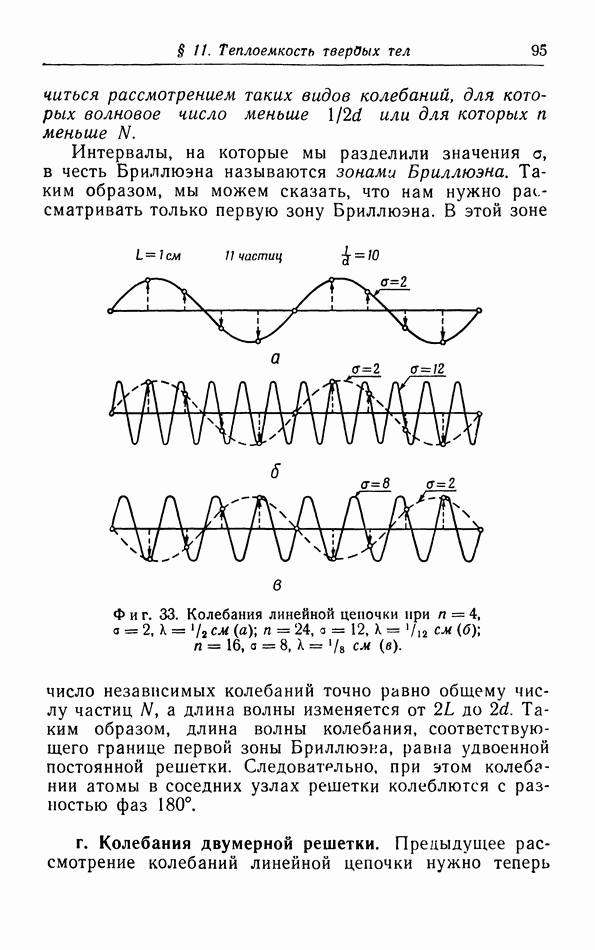
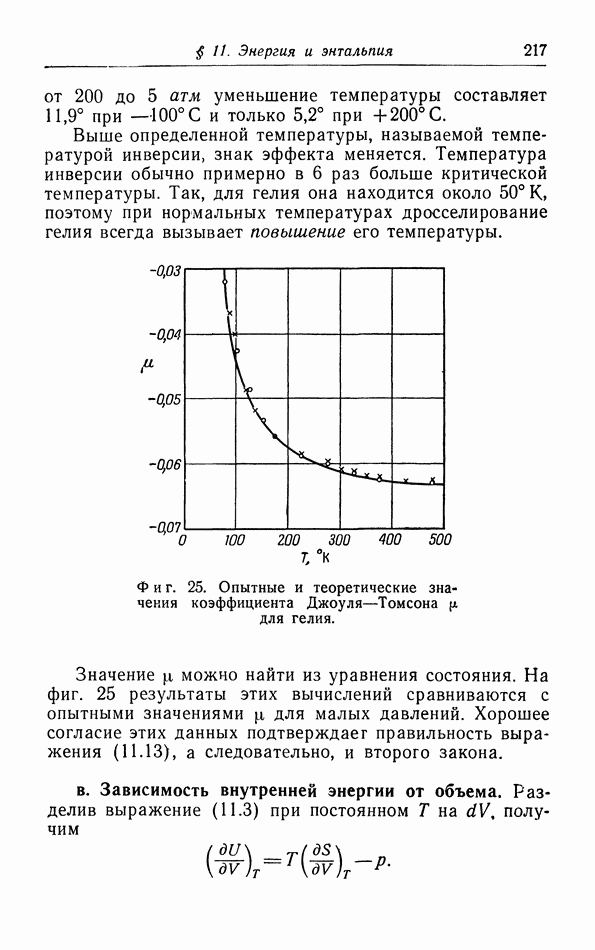
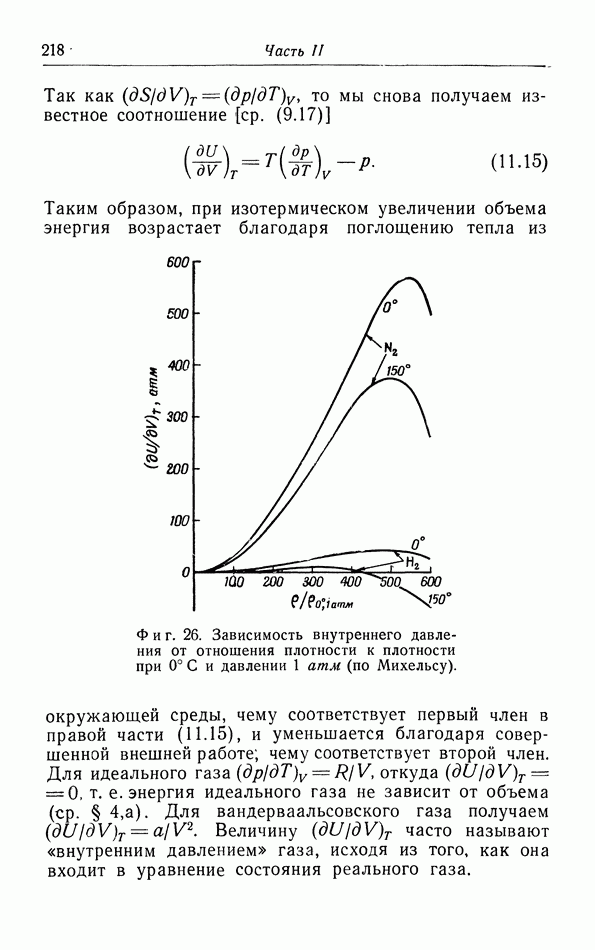
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ГЛАВА I. Первый закон термодинамики
§ 1. Термодинамическое состояние и его изменения
а. Введение.
Прежде чем обсуждать собственно термодинамику, коротко определим цель и предмет исследований этой области физики.
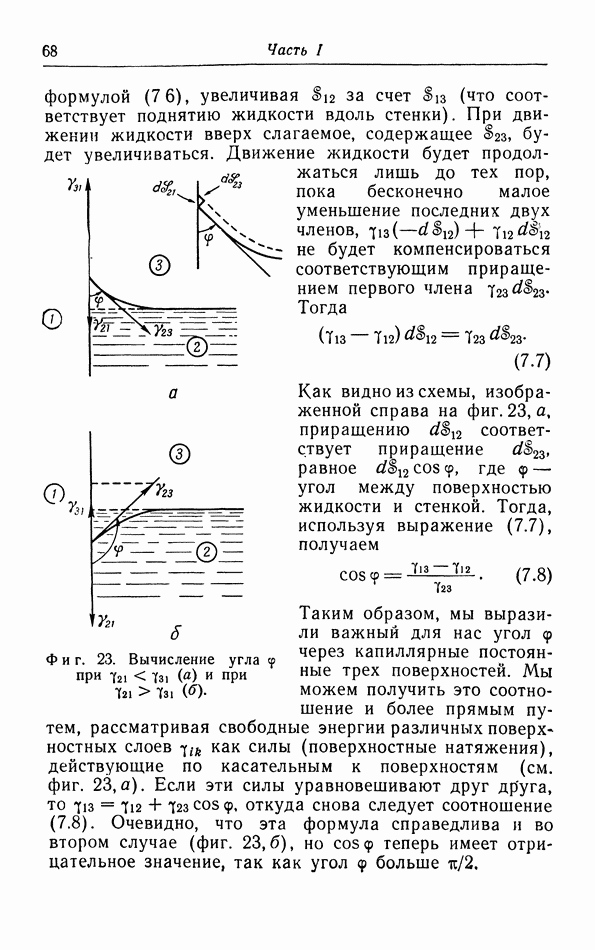
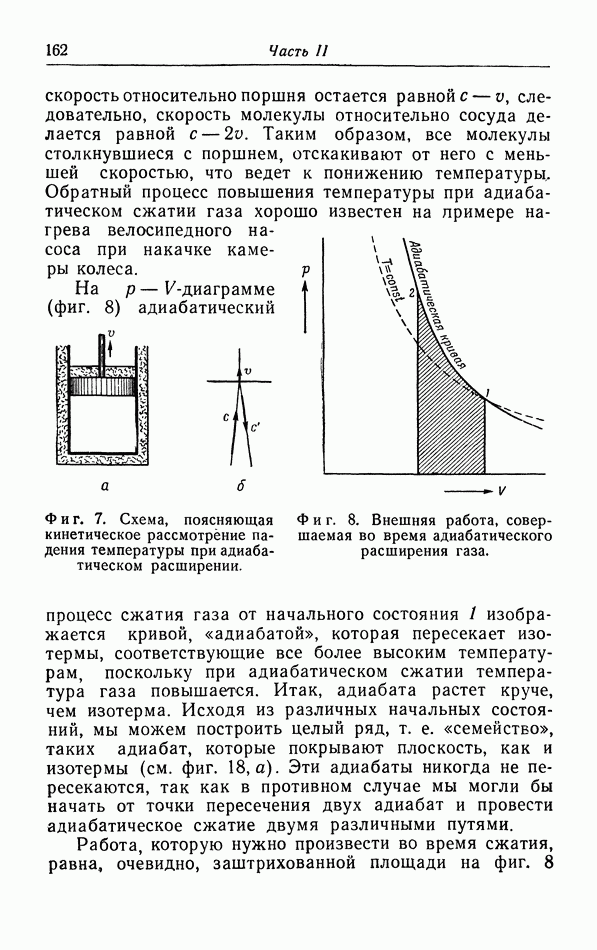
В качестве первого примера рассмотрим некоторое количество газа, содержащегося в цилиндре, закрытом подвижным поршнем. Когда мы вдвигаем поршень, давление газа увеличивается; кроме того, как показывают опыты, при этом обычно повышается температура газа. Вследствие теплопроводности стенок тепло переходит от газа к окружающей среде, пока их температуры не станут одинаковыми; этот процесс в свою очередь изменяет давление. В качестве второго примера рассмотрим магнитный материал. Если этот материал поместить в поле магнита, он становится магнитно поляризованным; поляризация часто сопровождается изменением объема материала и выделением тепла, которое, в свою очередь, уходит в окружающую среду.
Итак, мы имеем дело с довольно сложной картиной, поскольку системы, которые мы рассматриваем (газ в цилиндре, магнитное вещество), могут различными путями осуществлять «энергетический контакт» с окружающей средой (за счет теплообмена, работы внешнего магнитного поля или силы, приложенной к поршню и т. д.). Чтобы можно было произвести точный расчет этого обмена энергией, ограничимся обсуждением таких систем, у которых «энергетический контакт» полностью контролируемый и управляемый. Мы можем управлять обменом тепла между системой и внешней средой, окружив нашу систему или тепловым резервуаром с определенной температурой (термостатом) или абсолютно изолирующими стенками которые называются
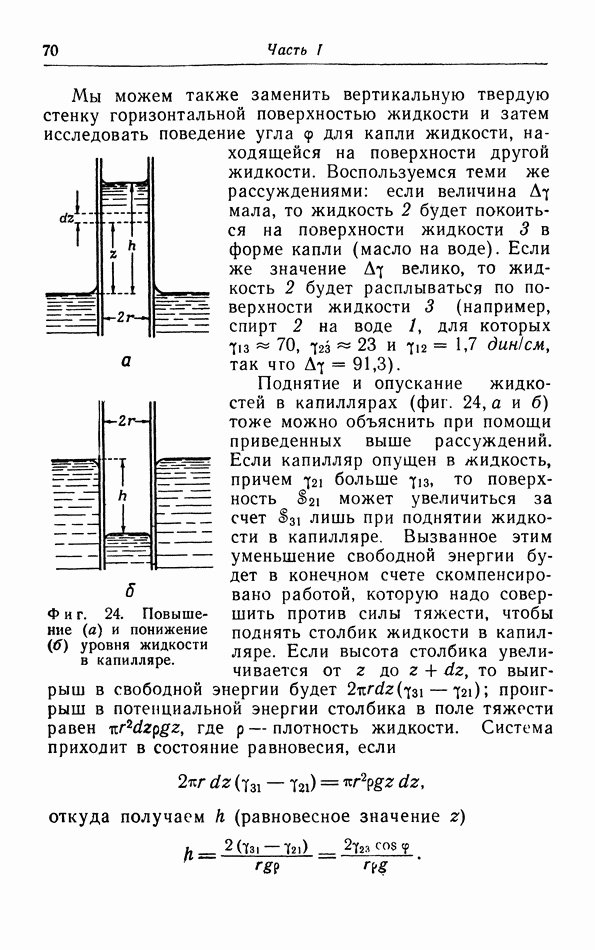
адиабатическими стенками. Механическим обменом энергией между системой и внешней средой в случае газа можно управлять по желанию, или сохраняя постоянное давление при помощи действия определенной силы на поршень, или удерживая объем при определенном постоянном значении.
б. Равновесие.
Рассмотрим теперь некоторую систему, для которой все определяющие внешние величины сохраняются постоянными, например газ в цилиндре, поршень которого удерживается в определенном положении, причем сам цилиндр находится в тепловой бане с заданной температурой. Спустя некоторое время наступает состояние видимого покоя: возможные потоки в газе замирают, разности давлений и температур исчезают. Это не означает, конечно, что в этом состоянии равновесия вообще отсутствует какое-либо движение. Наоборот, молекулы газа продолжают непрерывно двигаться, соударяться и обмениваться друг с другом энергией. Но эти формы движения незаметны в макроскопическом масилтабе, и их описание не входит в задачу термодинамики.
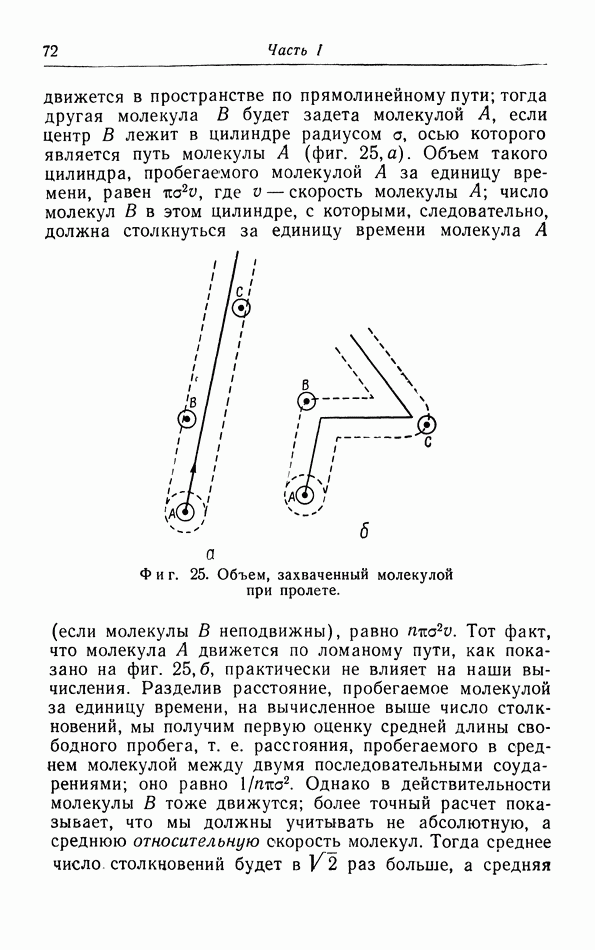
в. Уравнение состояния.
Наоборот, молекулярно-кинетическая теория тепла, которая имеет дело с этими микроскопическими явлениями, стремится объяснить функциональное соотношение между такими различными величинами, как давление, объем и температура, определяющими макроскопическое состояние системы. Это соотношение называется уравнением состояния. В части I, § 2, 5 и 10 мы использовали, например, кинетическую теорию газов, чтобы найти соотношение между давлением, объемом и температурой — уравнение состояния  которое позволяет выразить каждую из этих трех величин через две другие. В теории электричества макроскопическое соотношение между напряженностью магнитного поля
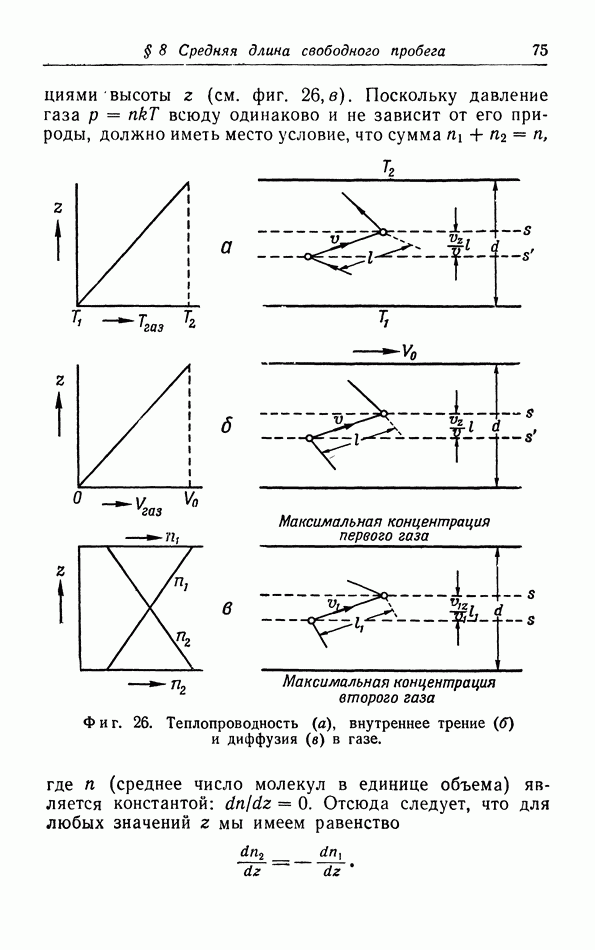
которое позволяет выразить каждую из этих трех величин через две другие. В теории электричества макроскопическое соотношение между напряженностью магнитного поля  намагниченностью
намагниченностью  и температурой
и температурой  выводится из свойств микроскопической структуры, в этом случае мы также можем говорить об уравнении состояния
выводится из свойств микроскопической структуры, в этом случае мы также можем говорить об уравнении состояния  однако оказывается, что
однако оказывается, что  зависит также от объема V, так что мы
зависит также от объема V, так что мы
должны записывать уравнение состояния в виде 
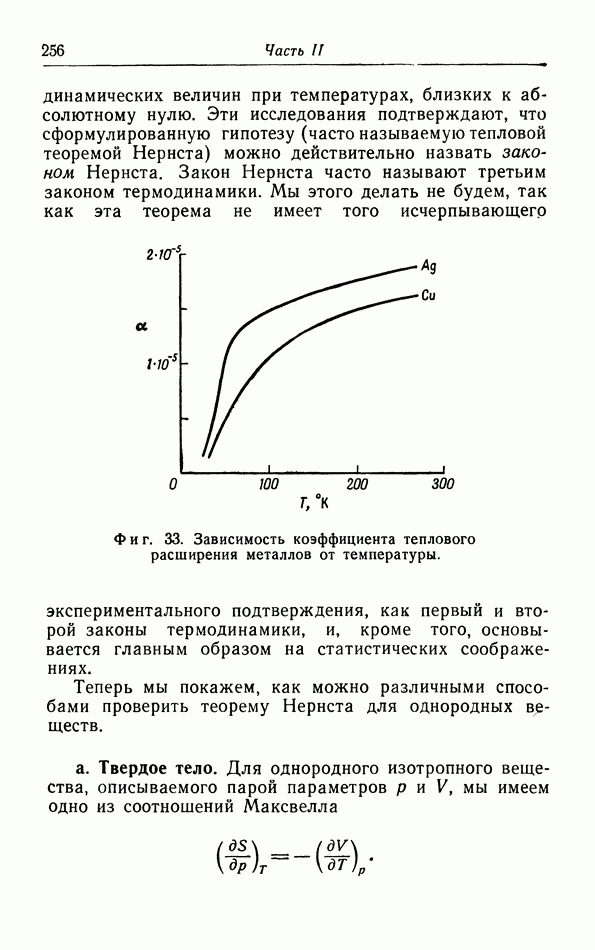
Из уравнения состояния можно вывести другие величины: коэффициент теплового расширения  термический коэффициент давления
термический коэффициент давления  изменение намагниченности с температурой
изменение намагниченности с температурой  и другие; все они могут быть измерены на опыте. Поскольку эти величины выражают зависимость от температуры, они называются термическими) величинами.
и другие; все они могут быть измерены на опыте. Поскольку эти величины выражают зависимость от температуры, они называются термическими) величинами.
Молекулярно-кинетическая теория дает также объяснение различных калорических величин: энергии газа, твердого тела или магнитного вещества, по которой определяется затем теплоемкость. Поэтому соотношение  или
или  из которого можно непосредственно получить теплоемкость путем дифференцирования по
из которого можно непосредственно получить теплоемкость путем дифференцирования по  называется калорическим уравнением состояния.
называется калорическим уравнением состояния.
г. Термодинамика.
Итак, молекулярно-кинетическая теория объясняет уравнение состояния и калорическое уравнение состояния.  наоборот, устанавливает обилие соотношения между физическими величинами системы, для которой существенное значение имеет температура. Термодинамика основывается на двух законах, выведенных из опыта, и не интересуется вопросом атомистического объяснения этих величин. Получаемые соотношения являются обычно соотношениями между термической и калорической величинами. В качестве примера приведем уравнение Клапейрона — Клаузиуса
наоборот, устанавливает обилие соотношения между физическими величинами системы, для которой существенное значение имеет температура. Термодинамика основывается на двух законах, выведенных из опыта, и не интересуется вопросом атомистического объяснения этих величин. Получаемые соотношения являются обычно соотношениями между термической и калорической величинами. В качестве примера приведем уравнение Клапейрона — Клаузиуса

В котором  (изменение давления насыщенного пара в зависимости от температуры) есть термическая величина, а
(изменение давления насыщенного пара в зависимости от температуры) есть термическая величина, а  (молярная теплота испарения) есть калорическая величина;
(молярная теплота испарения) есть калорическая величина;  разность молярных объемов пара и жидкости при рассматриваемой температуре.
разность молярных объемов пара и жидкости при рассматриваемой температуре.
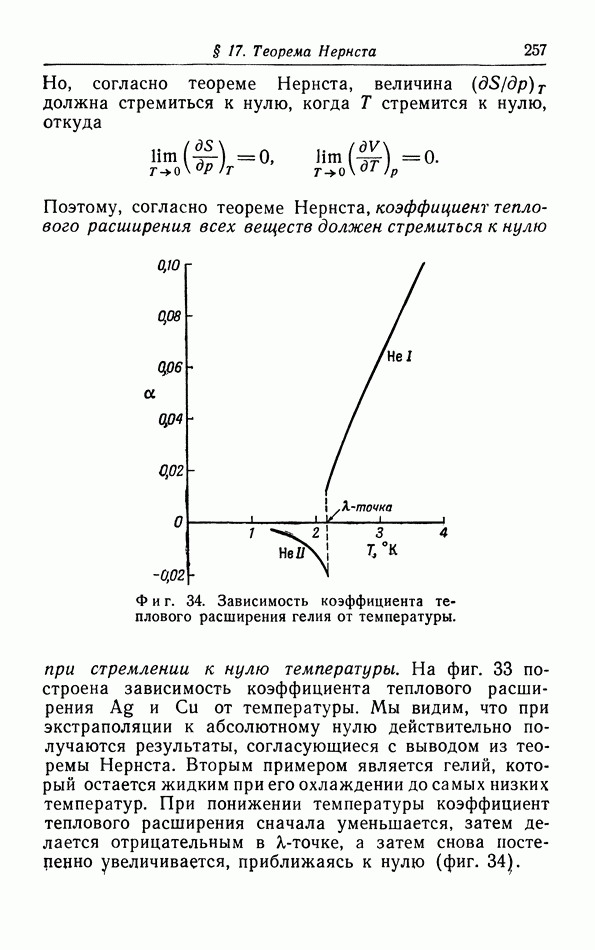
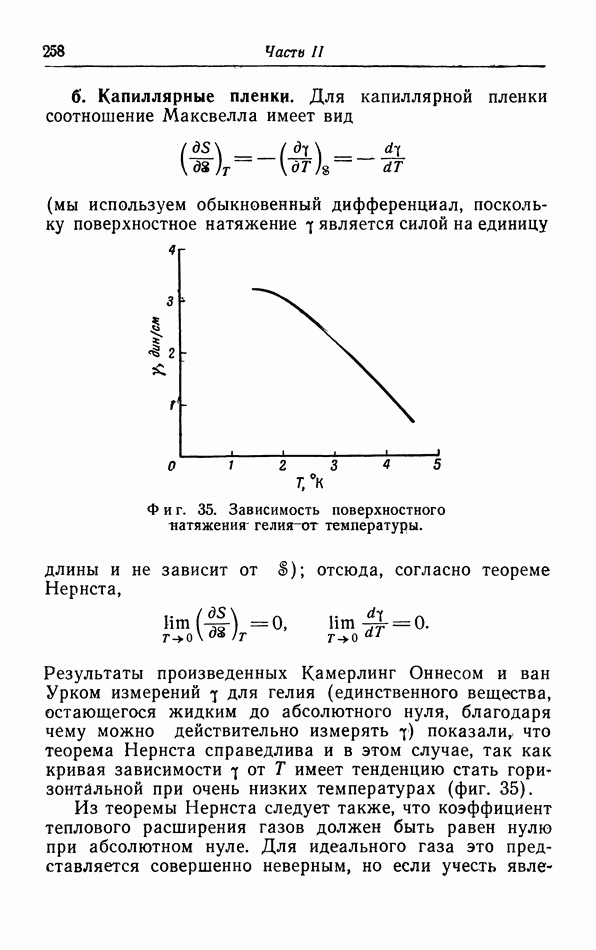
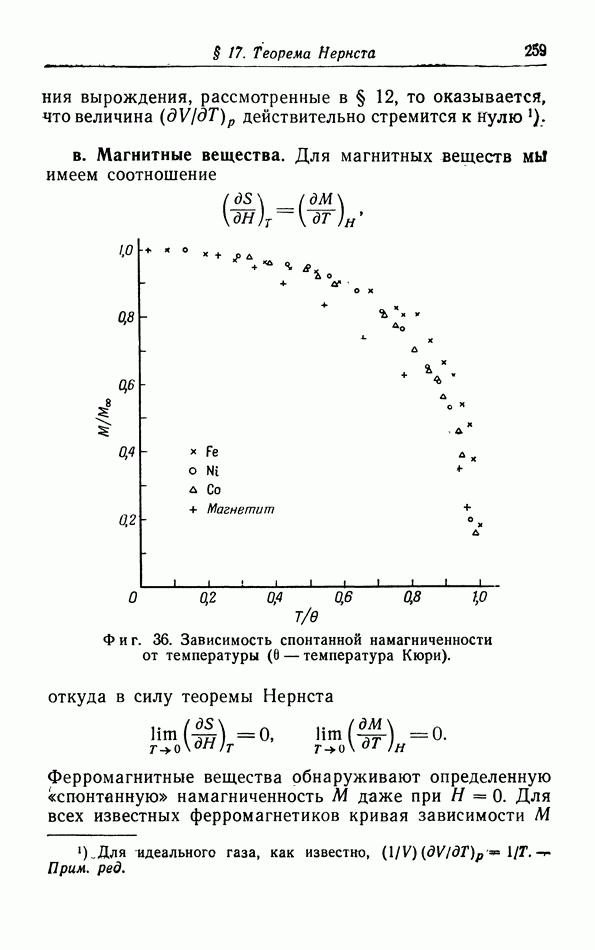
Из предыдущего ясно, что термодинамика приложима лишь к тем системам, которые состоят из большого число частиц, например к макроскопическому
количеству газа, жидкости или твердого тела. Если мы попытаемся исследовать настолько малые количества, что число частиц в них уже не является большим, например равно 100 или 1000, то выводы термодинамики уже неприменимы.
д. Зависимые и независимые параметры.
Величины, которые определяют состояние системы в термодинамическом равновесии, называются параметрами системы, как, например, объем V, температура  Однако не все возможные параметры необходимы для однозначного определения состояния системы. Состояние газа, например, определяется заданием двух из трех величин
Однако не все возможные параметры необходимы для однозначного определения состояния системы. Состояние газа, например, определяется заданием двух из трех величин  Для определения состояния магнитного материала в магнитном поле достаточны два из трех параметров Ну
Для определения состояния магнитного материала в магнитном поле достаточны два из трех параметров Ну  Можно заметить, что число этих независимых параметров равно числу путей, которыми к системе можно подвести энергию (в любой форче): тепло, механическую или электрическую работу и т. д. Если, например, мы хотим описать поведение магнитно-поляризованного материала при сжатии, то нужно ввести или объем V, или давление
Можно заметить, что число этих независимых параметров равно числу путей, которыми к системе можно подвести энергию (в любой форче): тепло, механическую или электрическую работу и т. д. Если, например, мы хотим описать поведение магнитно-поляризованного материала при сжатии, то нужно ввести или объем V, или давление  как дополнительный независимый параметр. Если, кроме того, мы помещаем материал в электрическое поле, то нужно ввести или напряженность поля или электрическую поляризацию
как дополнительный независимый параметр. Если, кроме того, мы помещаем материал в электрическое поле, то нужно ввести или напряженность поля или электрическую поляризацию  в качестве нового параметра и т. д.
в качестве нового параметра и т. д.
Каждой форме энергетического контакта соответствуют два параметра:  и V соответствуют внешнему давлению,
и V соответствуют внешнему давлению,  и
и  -магнитному полю,
-магнитному полю,  и
и  электрическому полю и т. д. На первый взгляд кажется, что тепловой контакт является ксключением из этого правила. Однако в гл. II мы увидим, что и в этом случае имеется второй параметр, хотя мы и не рассматривали его в кинетических теориях.
электрическому полю и т. д. На первый взгляд кажется, что тепловой контакт является ксключением из этого правила. Однако в гл. II мы увидим, что и в этом случае имеется второй параметр, хотя мы и не рассматривали его в кинетических теориях.
Два параметра каждой из приведенных выше пар всегда имеют различный характер: интенсивными называются параметры, величина которых не зависит от размеров системы. Например, давление  и температура
и температура  суть параметры, которые могут иметь одно значение во всем объеме вещества, причем их значения не меняются, если мы разделим систему на ряд меньших
суть параметры, которые могут иметь одно значение во всем объеме вещества, причем их значения не меняются, если мы разделим систему на ряд меньших
систем. Вторым типом параметров являются экстенсивные параметры, значения которых зависят от количества вещества. Если мы разделим некоторую систему на две части, ее объем также делится на две части. Поляризацию и намагниченность можно также рассматривать как экстенсивные параметры, что мы обсудим более подробно в § 5, г.
Таким образом, каждой форме энергетического контакта с окружающей средой соответствует одна пара параметров, один из которых является интенсивным, а другой — экстенсивным, но только один из этих параметров является независимым. При помощи уравнения состояния каждый параметр можно выразить через другой параметр и другие независимые параметры.
Рассмотрим, например, магнитный материал в магнитном поле. Здесь в качестве независимых параметров можно выбрать  и
и  тогда уравнение состояния
тогда уравнение состояния

выражает зависимый параметр  через
через  Если возможно также и изменение давления, то в качестве нового независимого параметра можно выбрать
Если возможно также и изменение давления, то в качестве нового независимого параметра можно выбрать  Тогда уравнение состояния должно быть преобразовано к виду
Тогда уравнение состояния должно быть преобразовано к виду

а V также становится функцией от независимых параметров

Итак, при появлении каждого нового вида энергетического контакта с окружаюией средой число параметров увеличивается на два, а число уравнений состояния на одно, так что число независимых параметров увеличивается на единицу.
Состояние термодинамической системы можно представить на диаграмме, число измерений которой равно числу независимых параметров системы. Таким образом, состояние газа в поршне с цилиндром может быть изображено на диаграмме, представляющей собой две взаимно перцендикулярные оси, вдоль которых откладываются  и
и  или,
или,  желанию,
желанию,  Следовательно,
Следовательно,
каждая точка на диаграмме соответствует одному определенному состоянию системы. Если система описывается тремя или большим числом независимых параметров, то мы должны ввести трех- или многомерную диаграмму состояния.
е. Квазистатические процессы.
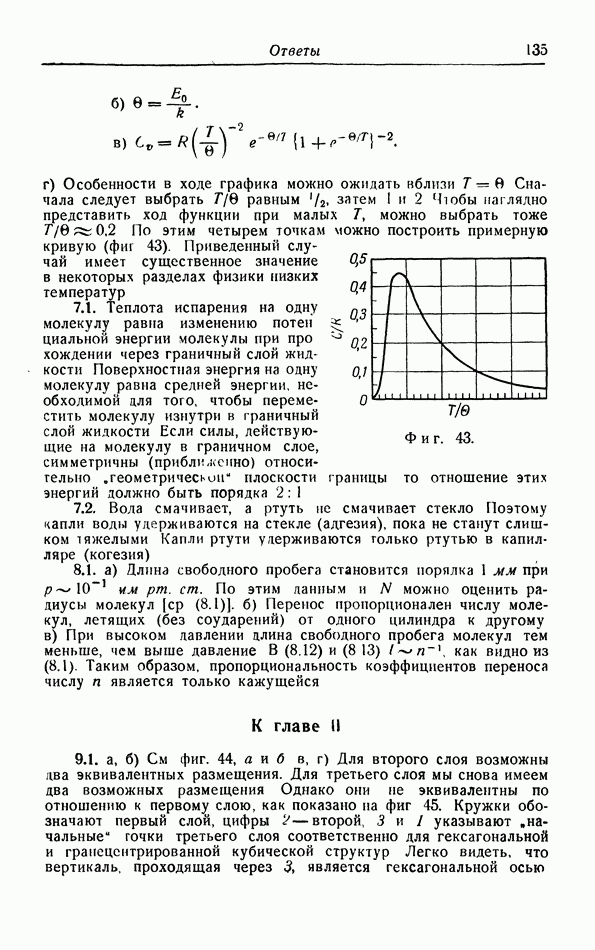
Если немного увеличить объем V системы, которая вначале была в равновесном состоянии 1 (фиг. 1), то она перейдет в новое равновесное состояние, указанное точкой  с координатами
с координатами  Таким образом, ряду последовательных малых изменений состояния соответствует на диаграмме ломаная кривая, соединяющая начальное состояние 1 с конечным состоянием 2. Если делать ступеньки все меньше и меньше, то ломаная все более и более будет приближаться к гладкой кривой, которую мы для простоты будем всегда строить, чтобы указать промежуточные состояния, через которые проходит система при переходе от состояния 1 к состоянию 2.
Таким образом, ряду последовательных малых изменений состояния соответствует на диаграмме ломаная кривая, соединяющая начальное состояние 1 с конечным состоянием 2. Если делать ступеньки все меньше и меньше, то ломаная все более и более будет приближаться к гладкой кривой, которую мы для простоты будем всегда строить, чтобы указать промежуточные состояния, через которые проходит система при переходе от состояния 1 к состоянию 2.
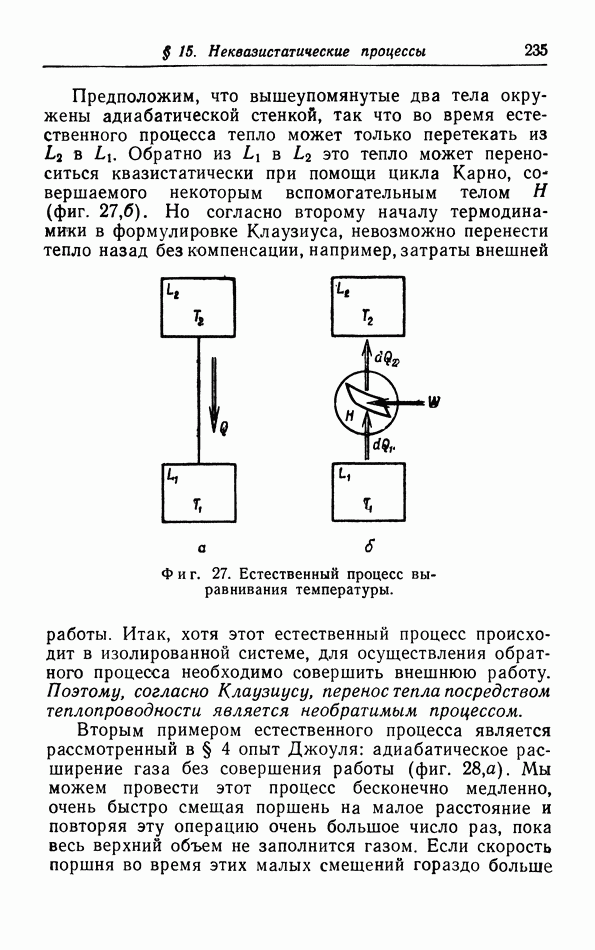
Каждое из этих промежуточных состояний является равновесным состоянием, для которого мы можем говорить об определенной «температуре». Процесс называют квазистатическим процессом, если система при своем переходе от начального к конечному состоянию проходит через непрерывный ряд равновесных состояний. В некоторых случаях мы будем также рассматривать неква

Фиг. 1. Квазистатический процесс  и квазистатический циклический процесс на
и квазистатический циклический процесс на  -диаграмме.
-диаграмме.
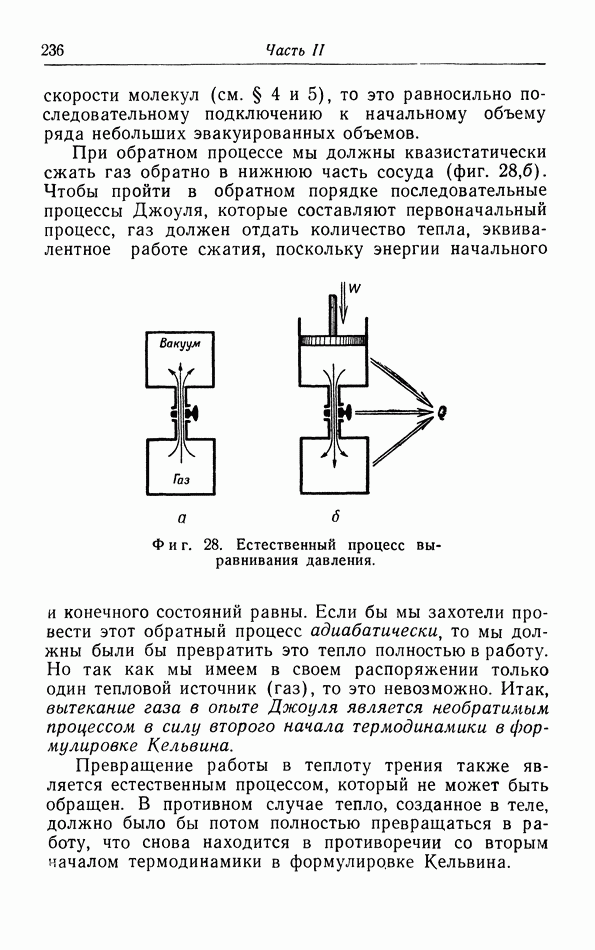
зистатические процессы. Такой процесс имеет место, например, когда газ свободно расширяется в вакуум; конечно, начальное и конечное состояния определяются однозначно, но невозможно указать промежуточные состояния, через которые проходит вся масса газа в процессе такого расширения. Промежуточные состояния, через которые проходит газ, невозможно указать и в том случае, когда давление газа изменяется с такой скоростью, что газ не успевает следовать за этими изменениями и возникают завихрения.
Принципиальное различие между квазистатическим и неквазистатическим процессами состоит в том, что процесс первого типа может быть проведен в обратном направлении, поэтому квазистатические процессы называют также обратимыми процессами. В противоположность этому неквазистатические процессы необратимы из-за возникающих в течение этих процессов ряда явлений, которые существенно необратимы; так, завихрения в газе затухают «сами по себе» под влиянием сил трения в газе, и их энергия превращается в тепловую энергию газа. Обратный процесс, т. е. образование вихрей из беспорядочного теплового движения молекул не возможен. Мы вернемся к этим неквазистатическим процессам в § 15.
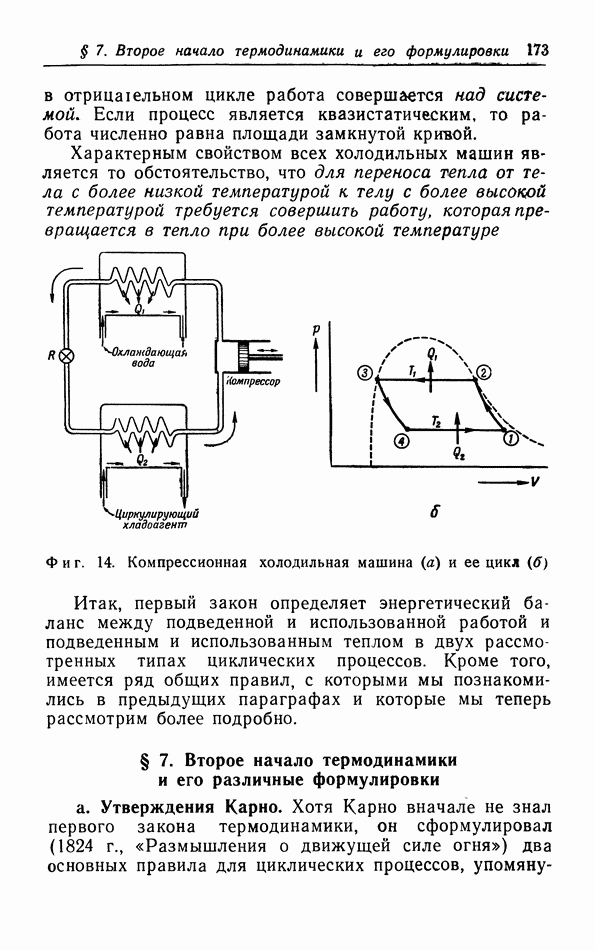
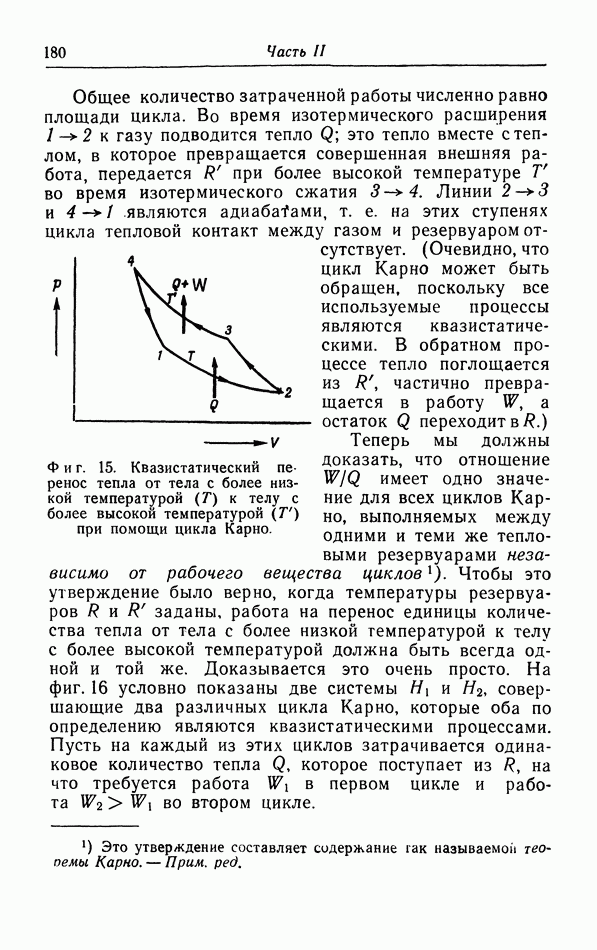
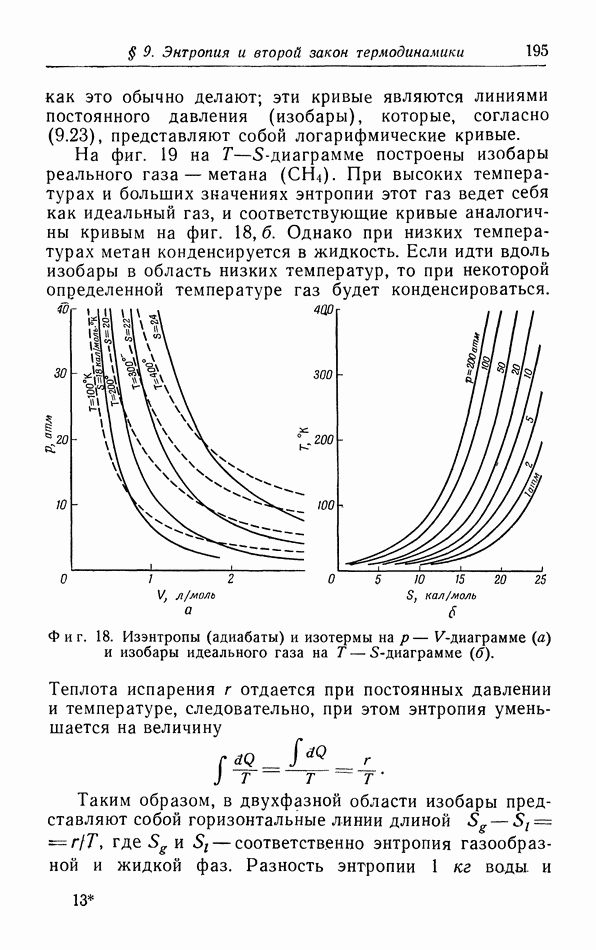
Особое значение имеют циклические процессы, для которых конечное состояние совпадает с начальным. Квазистатический циклический процесс может быть представлен на  -диаграмме (см. фиг. 1) замкнутой кривой. Имеется бесчисленное количество примеров таких циклических процессов, особенно в технических приложениях термодинамики Рассмотрим для примера холодильник, в котором пар
-диаграмме (см. фиг. 1) замкнутой кривой. Имеется бесчисленное количество примеров таких циклических процессов, особенно в технических приложениях термодинамики Рассмотрим для примера холодильник, в котором пар  сначала сжимается в жидкость, затем испаряется, поглощая при этом тепло из подлежащего охлаждению объекта, и, наконец, скова возвращается в компрессор для повторного сжатия. Охлаждающая жидкость подвергается циклическому процессу, во время которого тепло непрерывно поглощается из охлаждаемого объекта; это тепло передается окружающей среде, имеющей комнатную температуру. Более подробно эти циклические процессы будут рассмотрены в § 6.
сначала сжимается в жидкость, затем испаряется, поглощая при этом тепло из подлежащего охлаждению объекта, и, наконец, скова возвращается в компрессор для повторного сжатия. Охлаждающая жидкость подвергается циклическому процессу, во время которого тепло непрерывно поглощается из охлаждаемого объекта; это тепло передается окружающей среде, имеющей комнатную температуру. Более подробно эти циклические процессы будут рассмотрены в § 6.
| << Предыдущий параграф | Следующий параграф >> |
- Предисловие к русскому изданию
- ГЛАВА I. Газы и жидкости
- § 1. Молекулярная структура газов и жидкостей
- § 2. Кинетическая теория идеального газа
- б. Расчет давления в кинетической теории газов.
- в. Расчет удельной теплоемкости в кинетической теории газов.
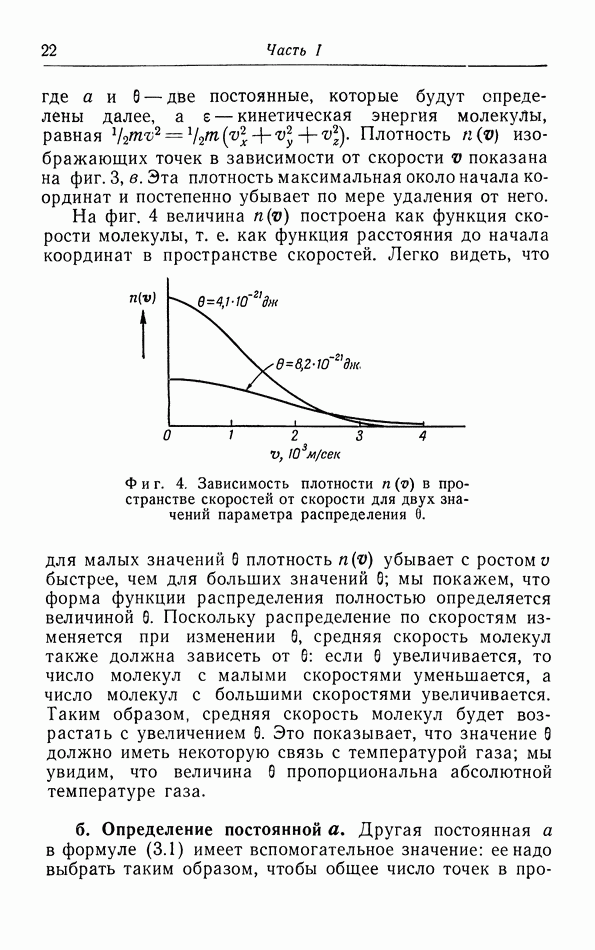
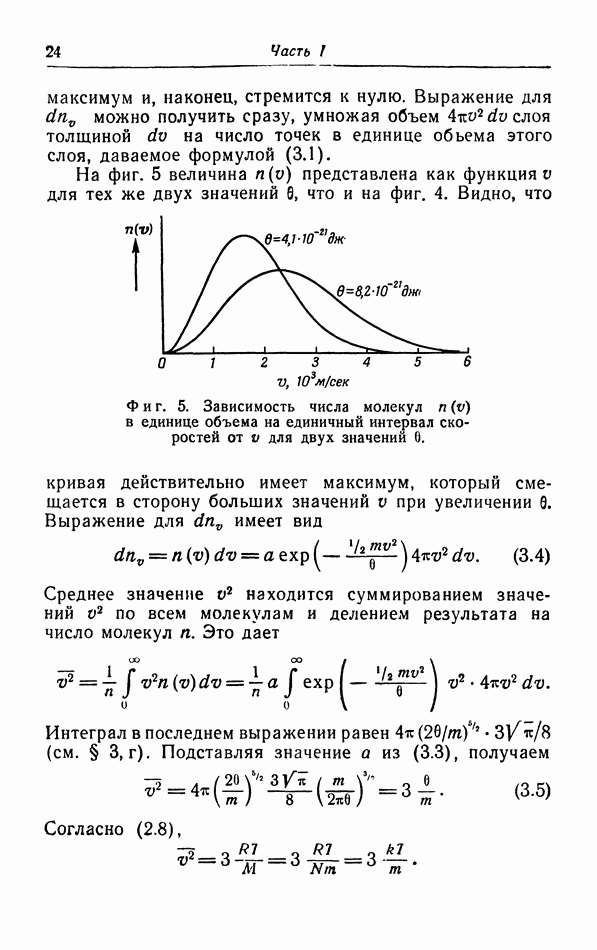
- § 3. Распределение молекул по скорости их движения
- г. Средняя квадратичная и средняя скорости.
- д. Броуновское движение.
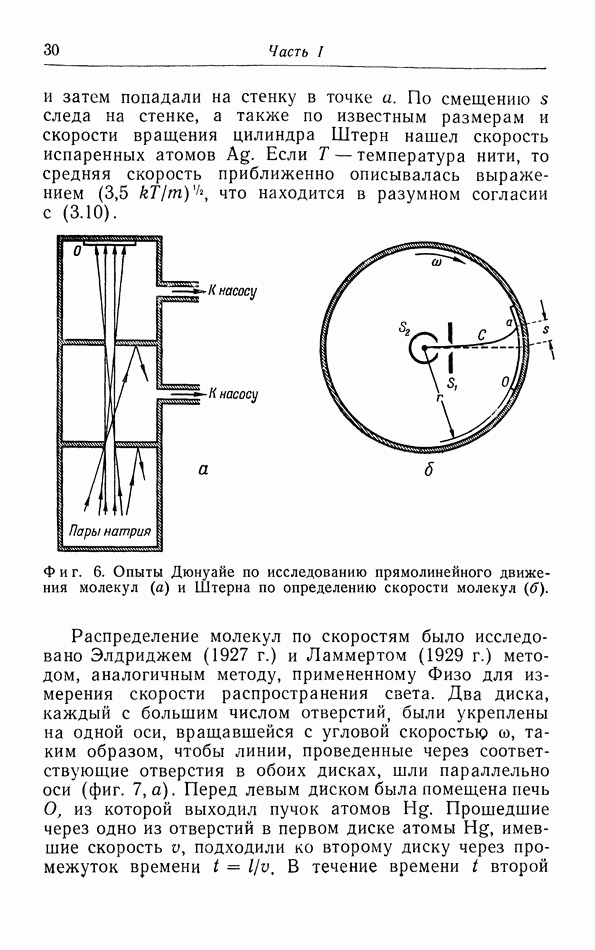
- е. Опыты с молекулярными пучками.
- § 4. Общее распределение молекул по энергиям
- б. Возбужденные состояния.
- в. вращательная и колебательная энергии.
- г. Потенциальная энергия тяготения.
- д. Потенциальная энергия межмолекулярных сил.
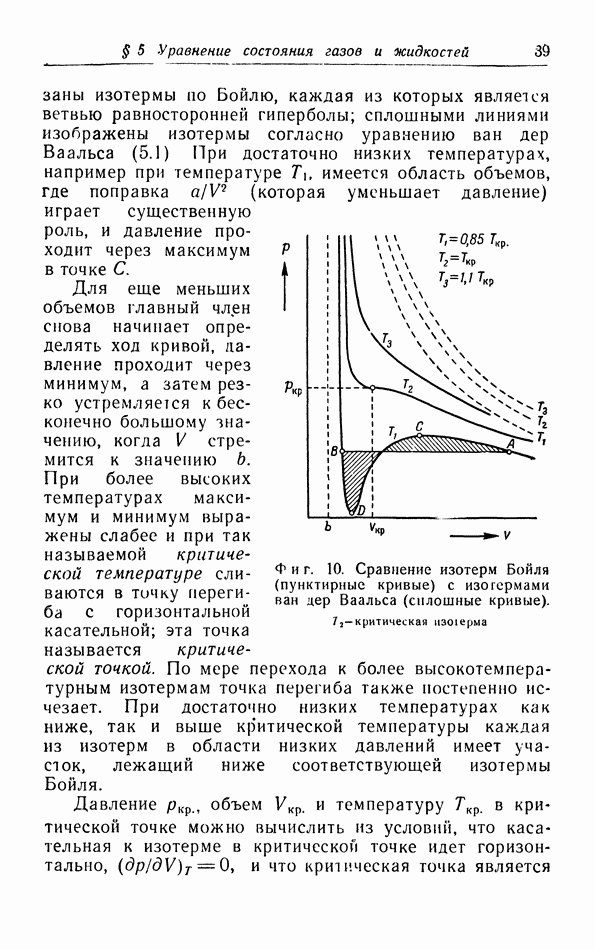
- § 5. Уравнение состояния газов и жидкостей
- б. Обсуждение уравнения ван дер Ваальса.
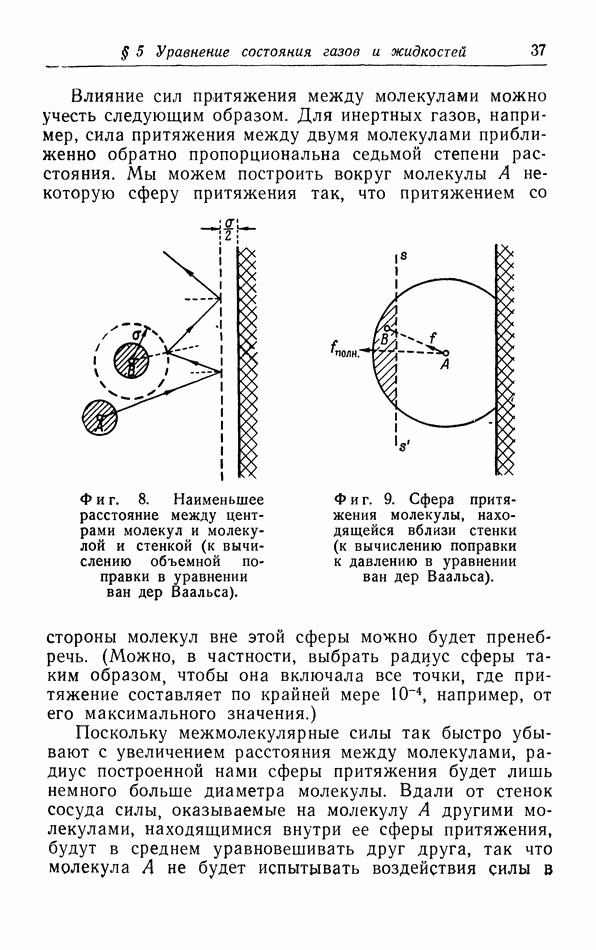
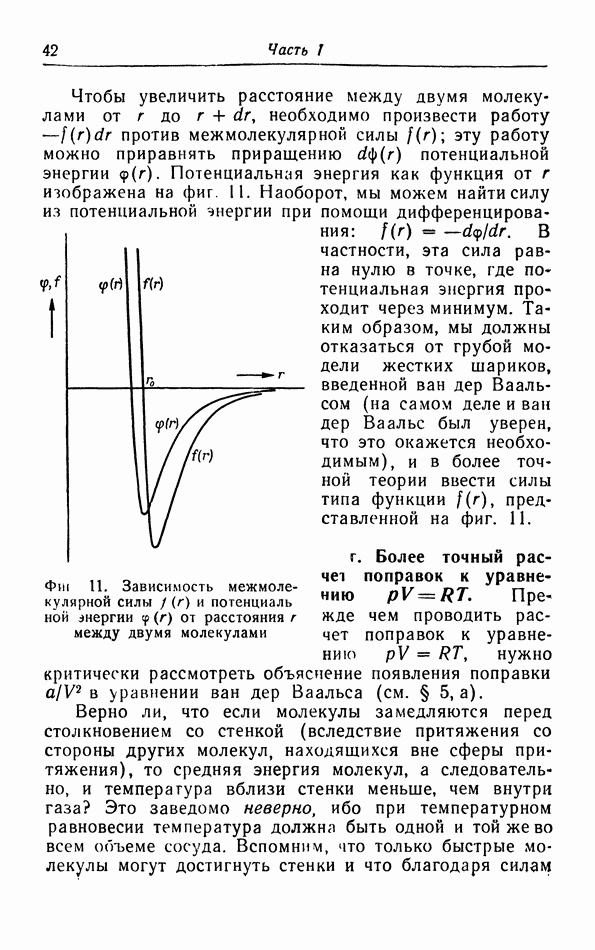
- в. Взаимодействие молекул.
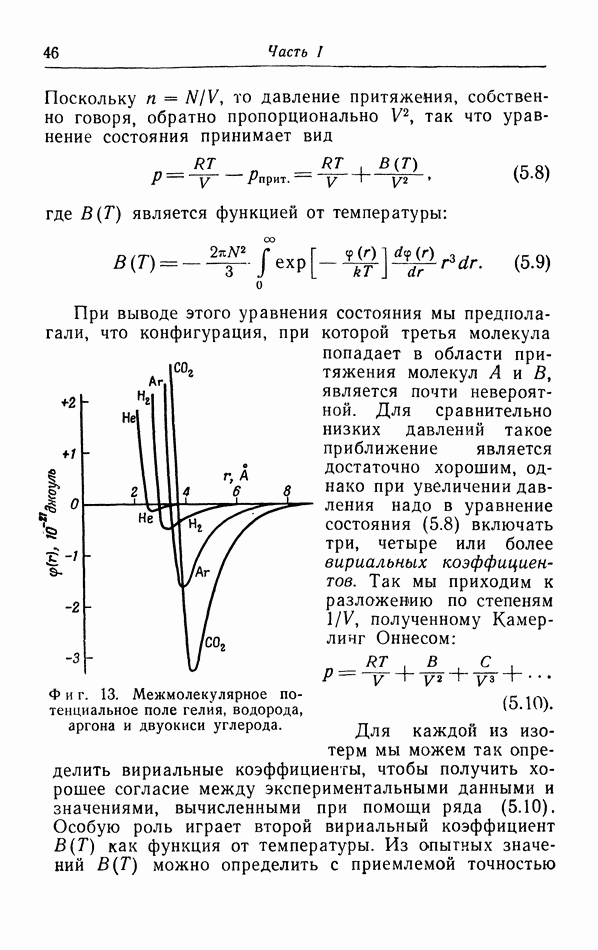
- г. Более точный расчет поправок к уравнению pV=RT.
- д. Закон соответственных состояний.
- е. Жидкая фаза.
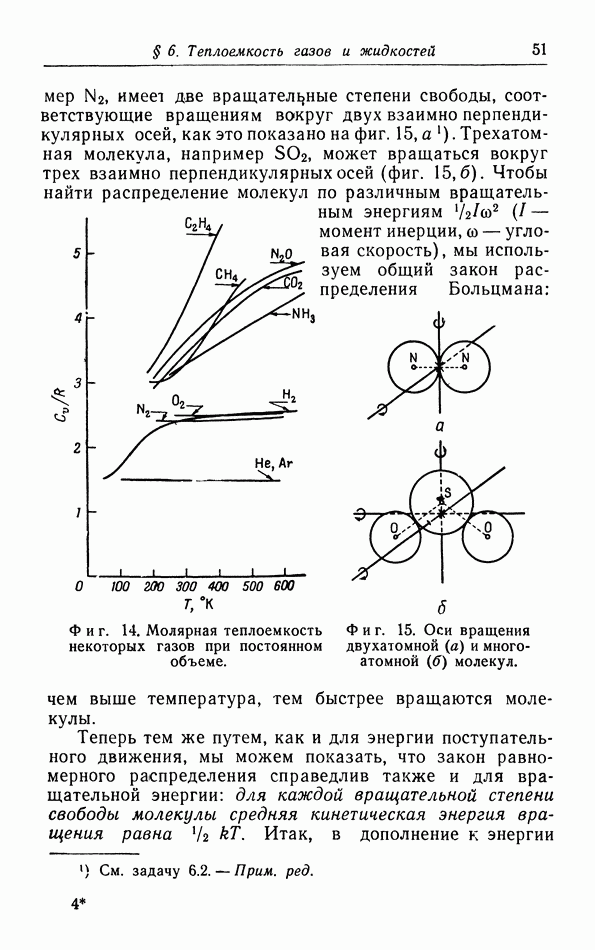
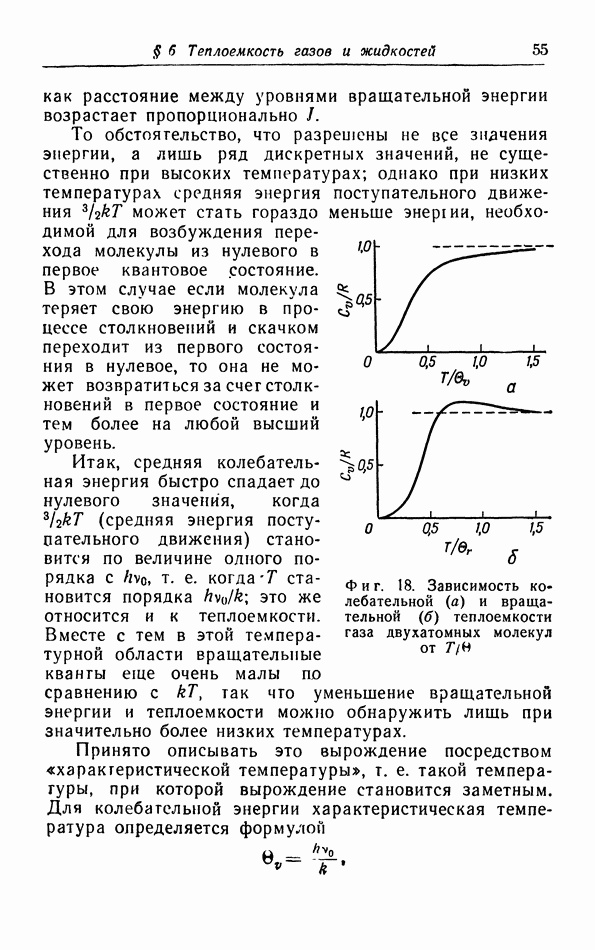
- § 6. Теплоемкость газов и жидкостей
- б. Классическая теория колебательной теплоемкости.
- в. Квантовая теория теплоемкости.
- г. Расчет колебательной теплоемкости двухатомной молекулы.
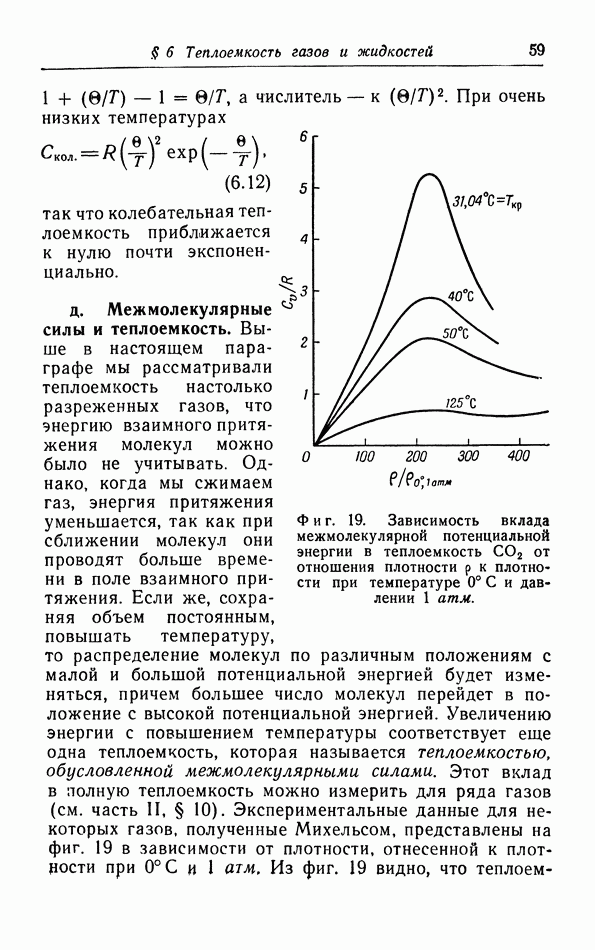
- д. Межмолекулярные силы и теплоемкость.
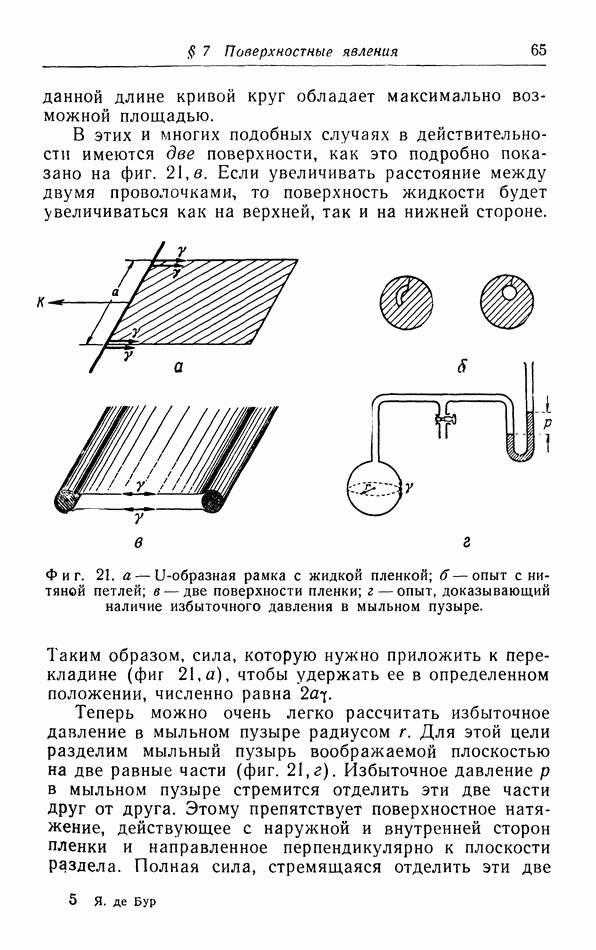
- § 7. Поверхностные явления
- б. Жидкие пленки.
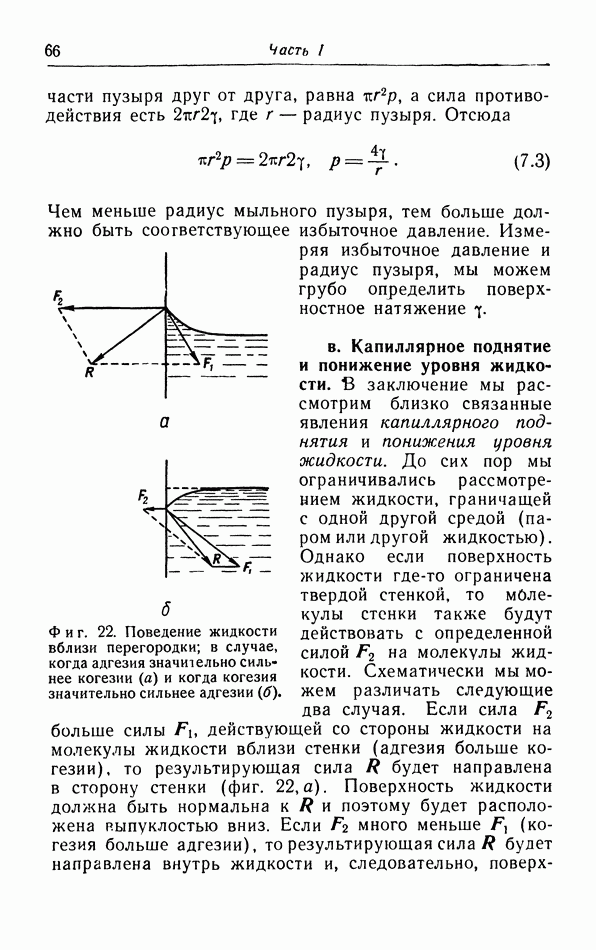
- в. Капиллярное поднятие и понижение уровня жидкости.
- § 8. Средняя длина свободного пробега, теплопроводность, вязкость и диффузия
- ГЛАВА II. Твердые тела
- § 9. Структура твердых тел
- § 10. Уравнение состояния твердых тел
- § 11. Теплоемкость твердых тел
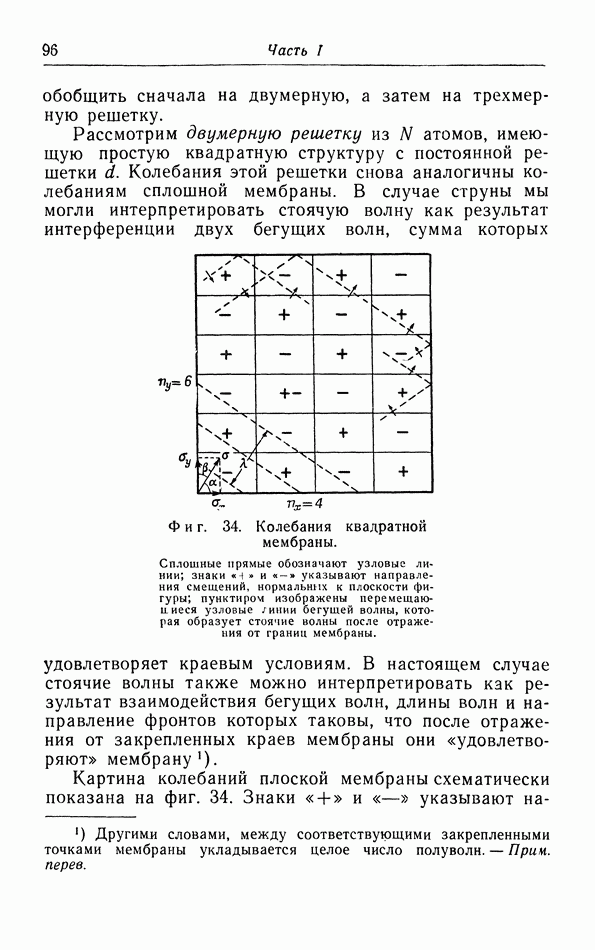
- в. Колебания линейной цепочки.
- г. Колебания двумерной решетки.
- д. Колебания трехмерной решетки.
- е. Теория Дебая.
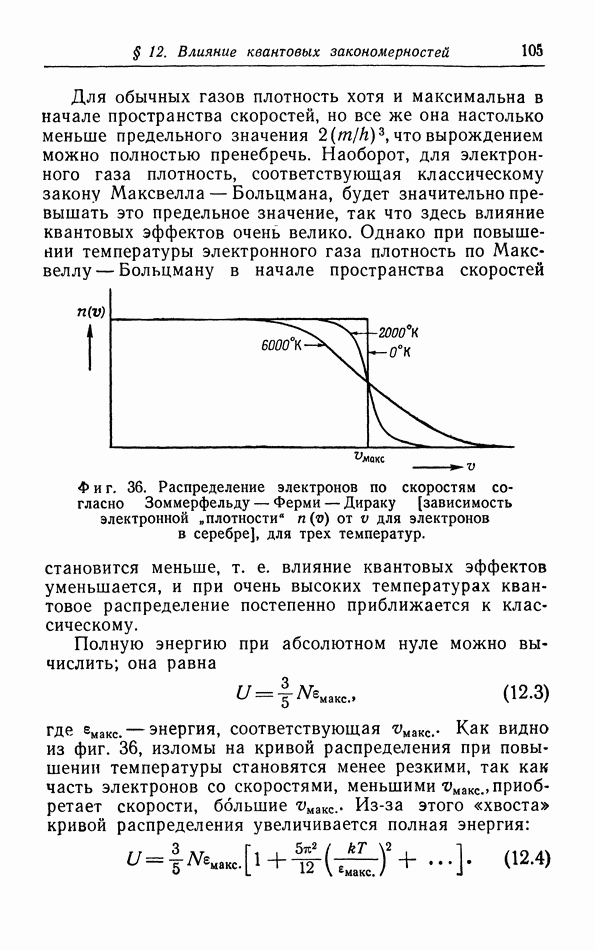
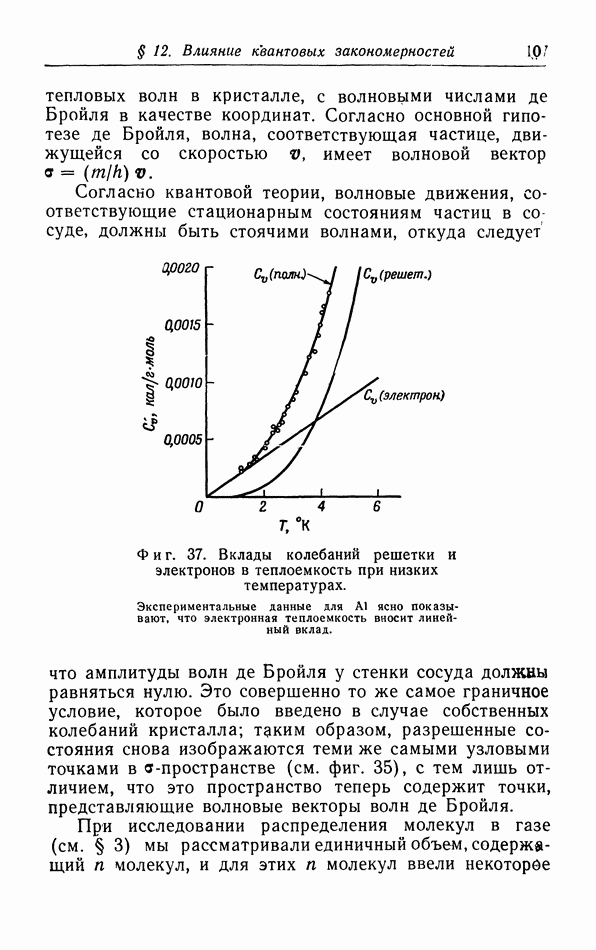
- § 12. Влияние квантовых закономерностей на распределение частиц по скоростям
- ГЛАВА III. Излучение
- § 13. Тепловое излучение и свет
- § 14. Испускание, поглощение и плотность излучения
- б. Яркость и излучательная способность.
- в. Плотность излучения.
- г. Закон Кирхгофа.
- § 15. Фотонная гипотеза. Давление излучения
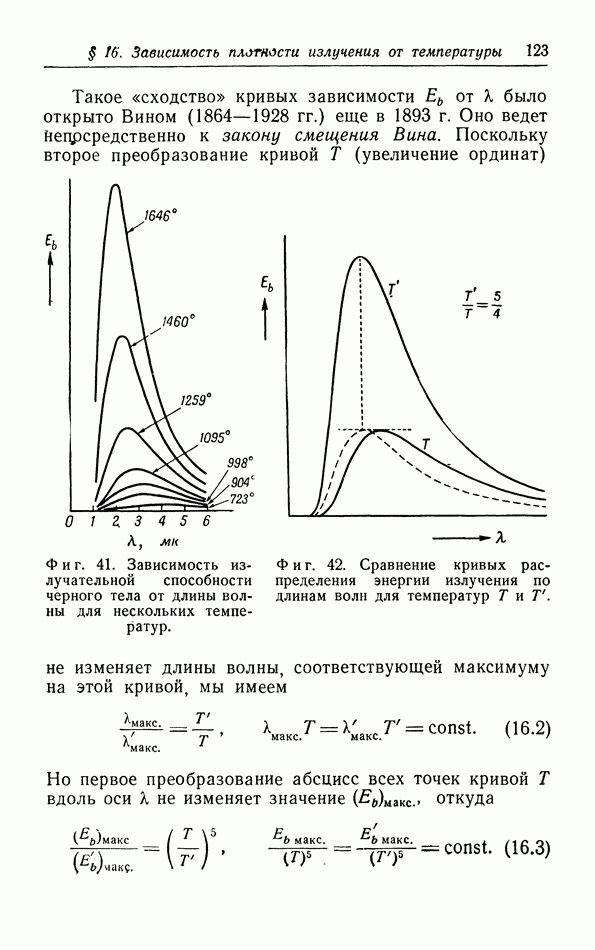
- § 16. Зависимость плотности излучения от температуры и длины волны
- б. Закон смещения Вина.
- в. Закон излучения Релея — Джинса.
- г. Закон излучения Планка.
- ГЛАВА I. Первый закон термодинамики
- § 1. Термодинамическое состояние и его изменения
- § 2. Работа при квазистатических процессах
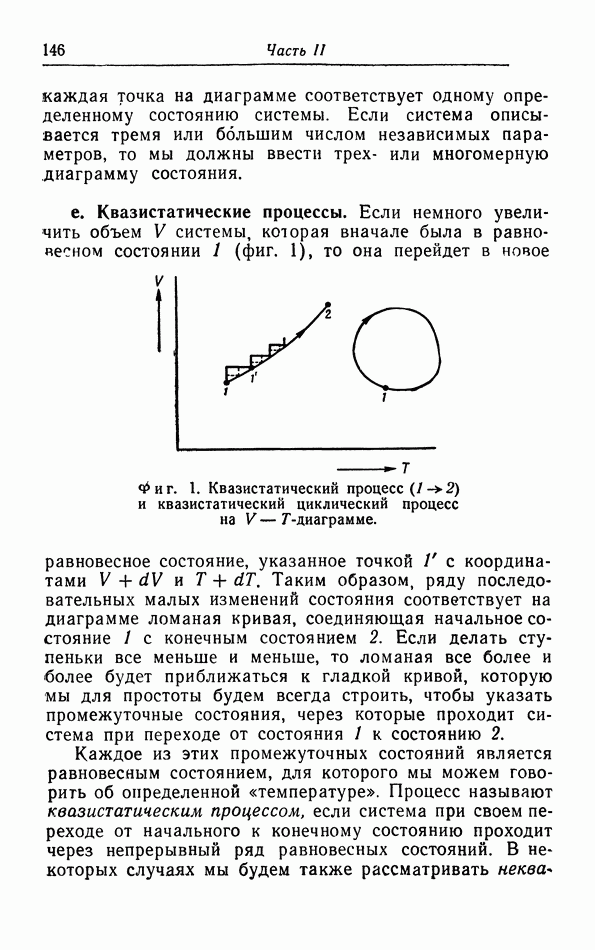
- § 3. Первый закон термодинамики
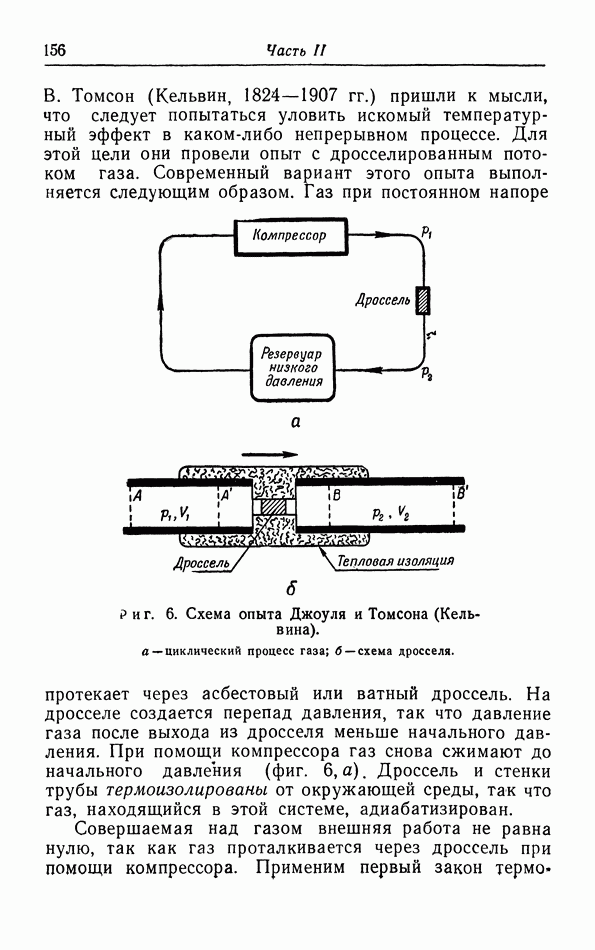
- § 4. Опыты Джоуля и Томсона
- § 5. Дальнейшие приложения первого закона
- б. Теплоемкость.
- в. Работа при адиабатических процессах.
- ГЛАВА II. Второй закон термодинамики
- § 6. Работа и теплота в циклических процессах
- § 7. Второе начало термодинамики и его различные формулировки
- § 8. Температура
- § 9. Энтропия и второй закон термодинамики
- § 10. Применения второго закона термодинамики
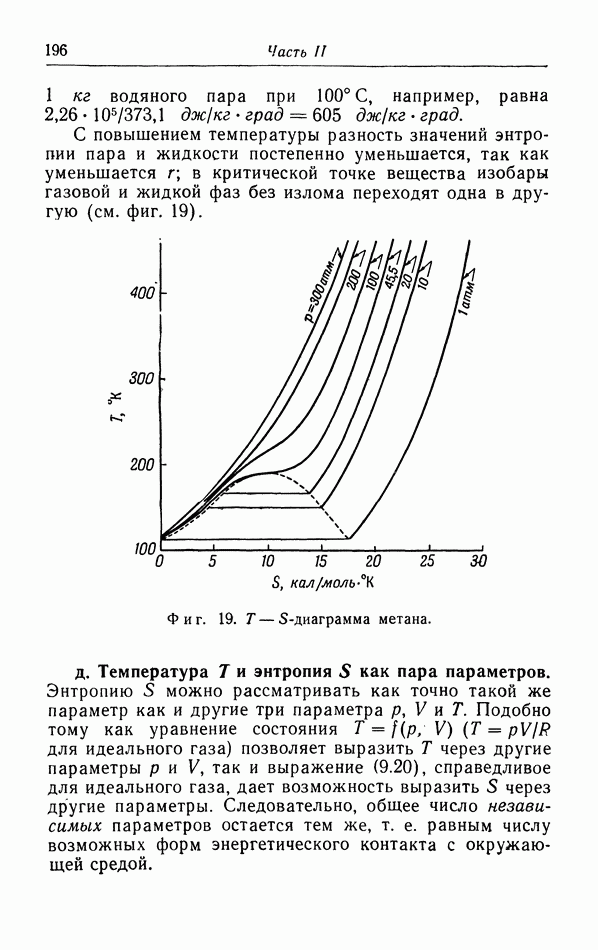
- в. Изэнтропические изменения состояния.
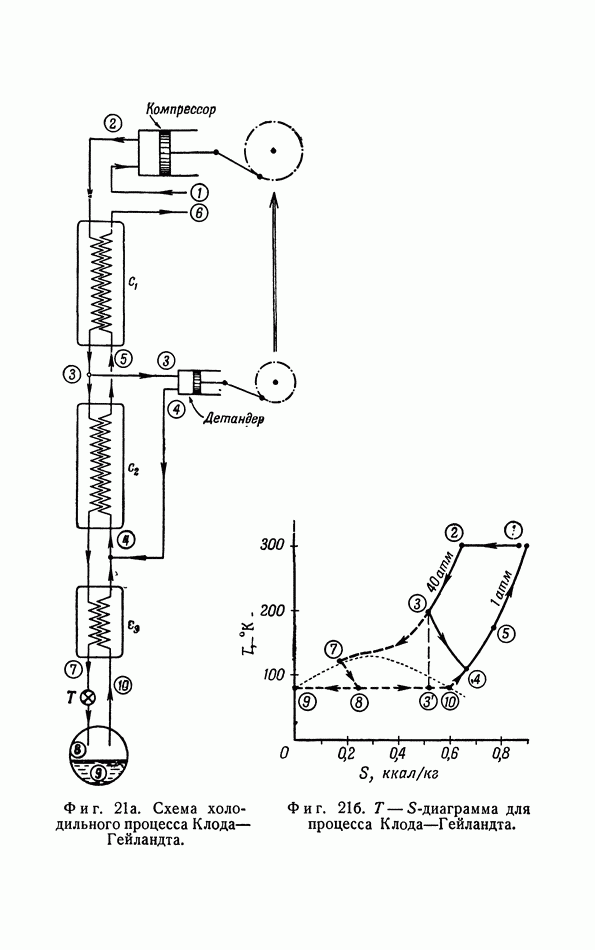
- г. Изэнтропические холодильные процессы (процесс Ж. Клода).
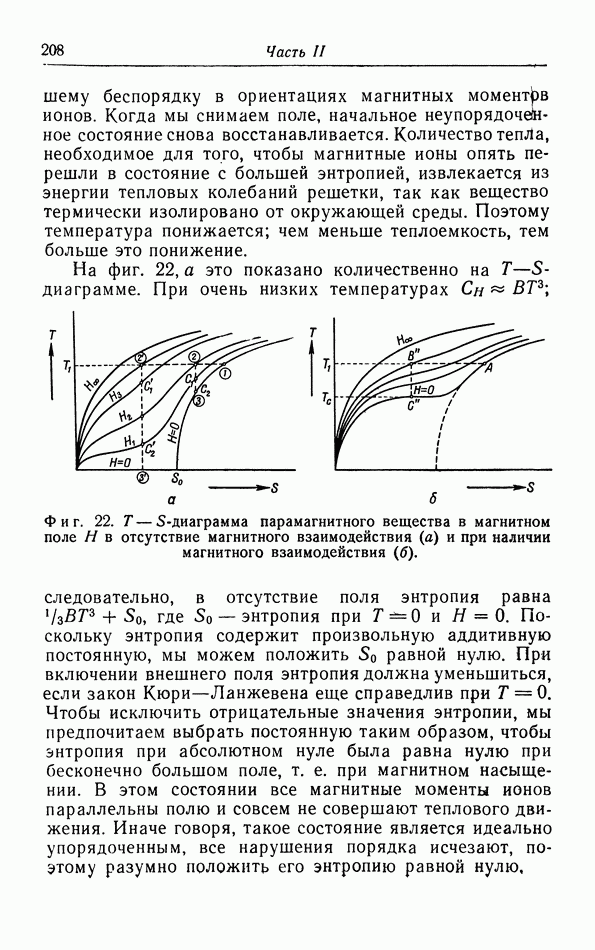
- д. Иззнтропические холодильные процессы (адиабатическое размагничивание).
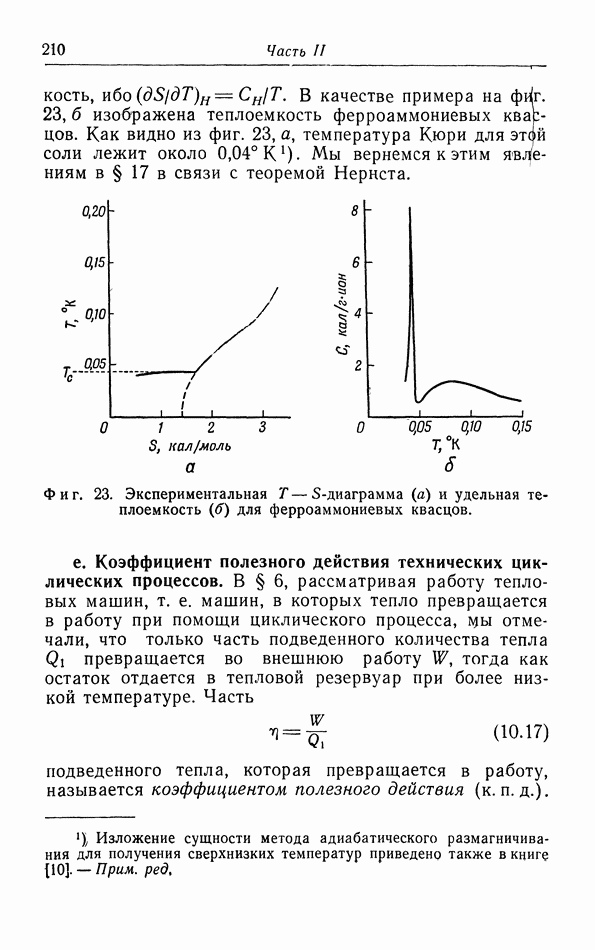
- е. Коэффициент полезного действия технических циклических процессов.
- ГЛАВА III. Характеристические функции
- § 11. Энергия и энтальпия
- б. Расчет процессов Джоуля и Джоуля — Томсона (Кельвина).
- в. Зависимость внутренней энергии от объема.
- г. Вывод закона Стефана — Больцмана.
- д. Характеристические функции U и H.
- § 12. Свободная энергия
- б. Свободная энергия и поверхностное натяжение.
- в. Свободная энергия и гальванические элементы.
- § 13. Свободная энтальпия и термодинамический потенциал
- б. Термодинамический потенциал.
- в. Системы с более чем одним компонентом.
- § 14. Соотношения Максвелла
- ГЛАВА IV. Неквазистатические процессы. Равновесие
- § 15. Неквазистатические процессы
- б. Подвод тепла и изменение энтропии.
- в. Увеличение энтропии в адиабатических системах.
- г. Неквазистатический изотермический процесс.
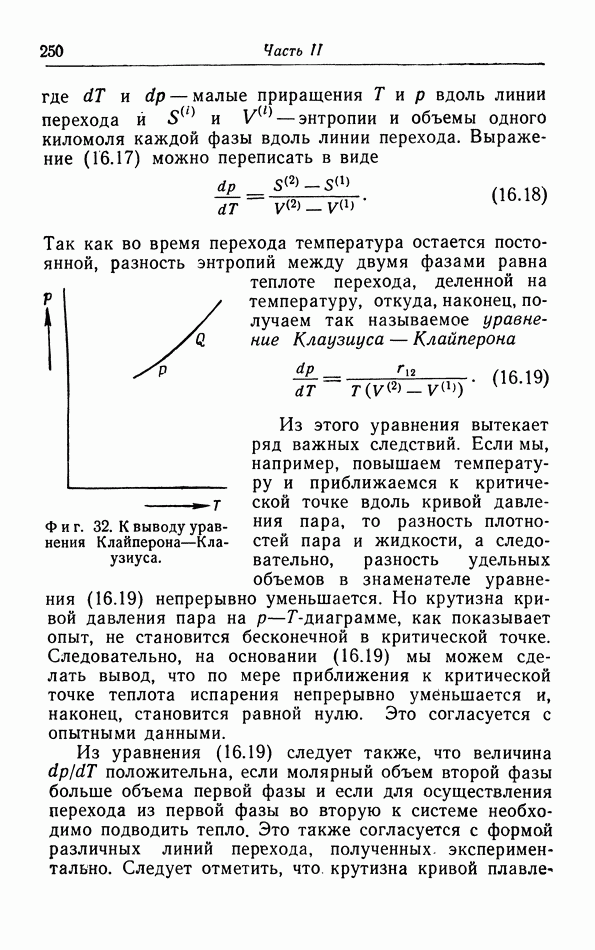
- § 16. Условия равновесия
- б. Первое условие равновесия.
- в. Второе условие равновесия.
- г. Третье условие равновесия.
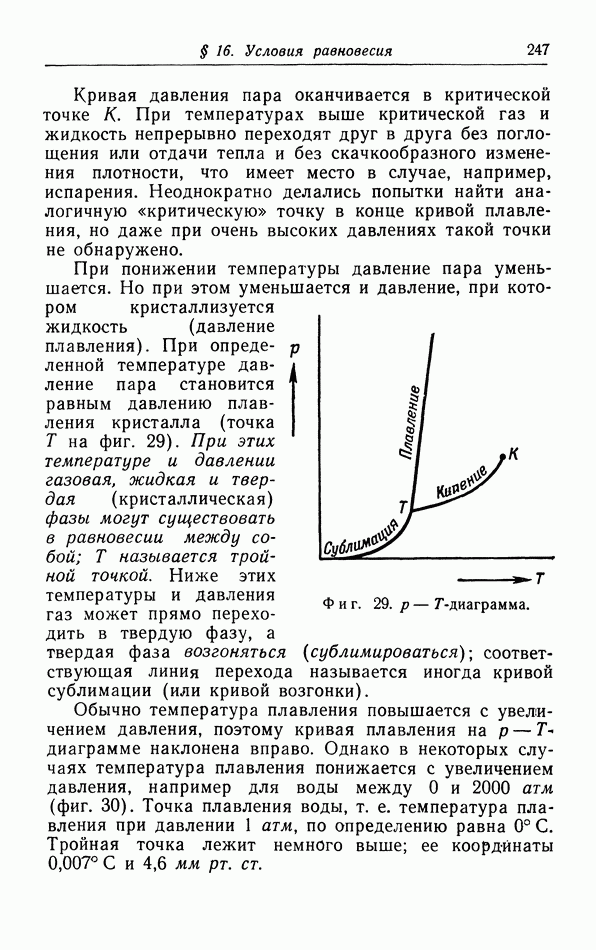
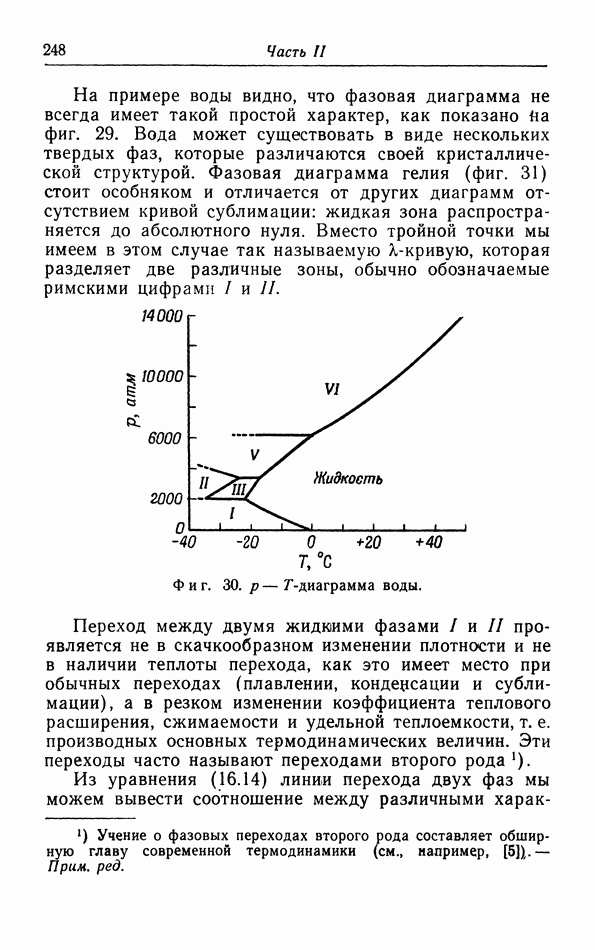
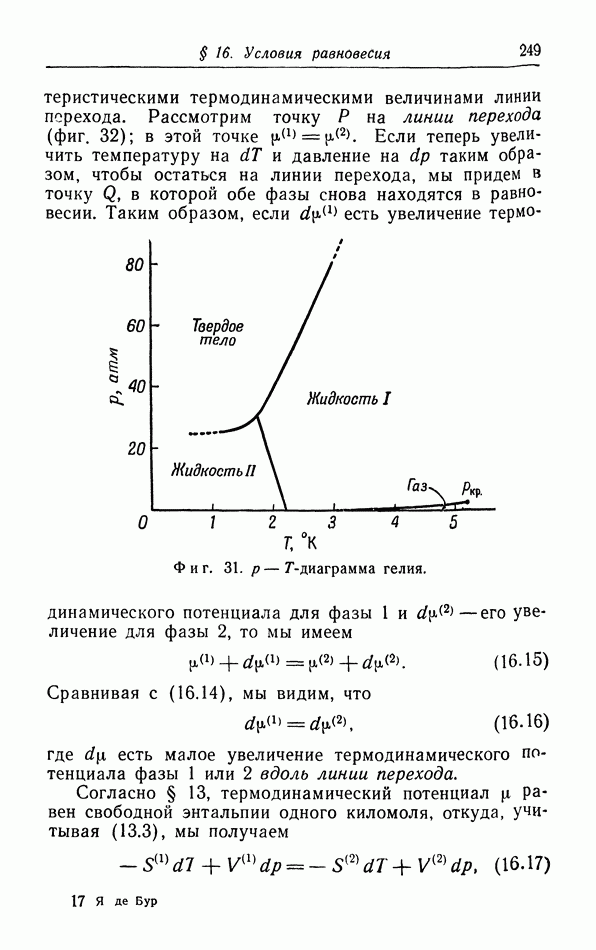
- д. p-T-диаграмма.
- е. Равновесие фаз в случае более чем одного компонента. Правило фаз.
- ГЛАВА V. Теорема Нернста
- § 17. Теорема Нернста
- § 18. Применение теоремы Нернста к фазовым переходам