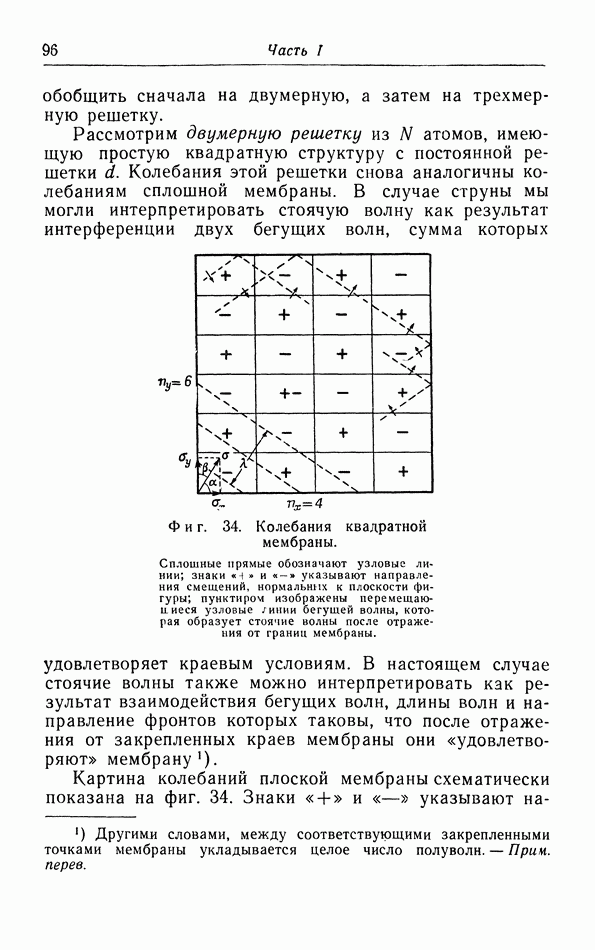
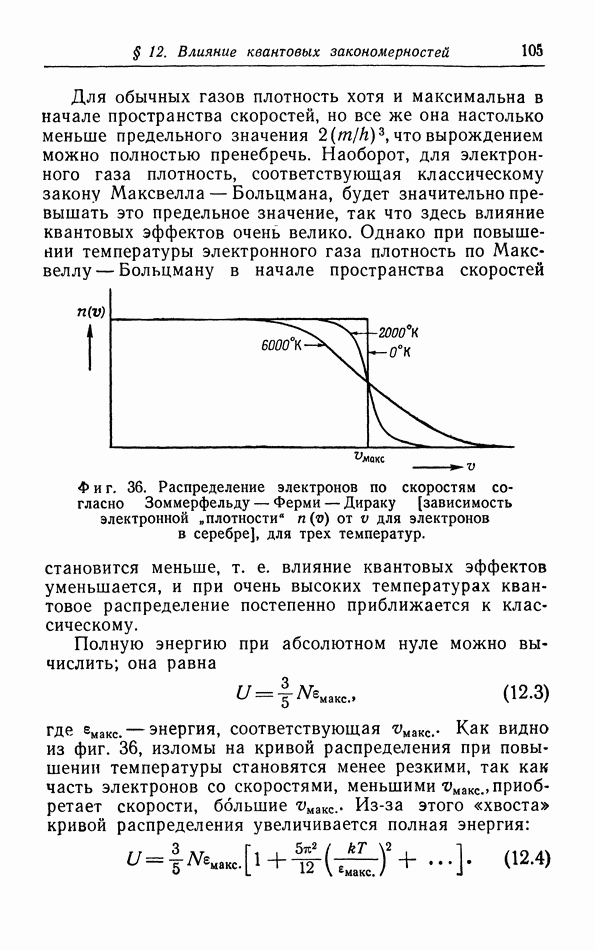
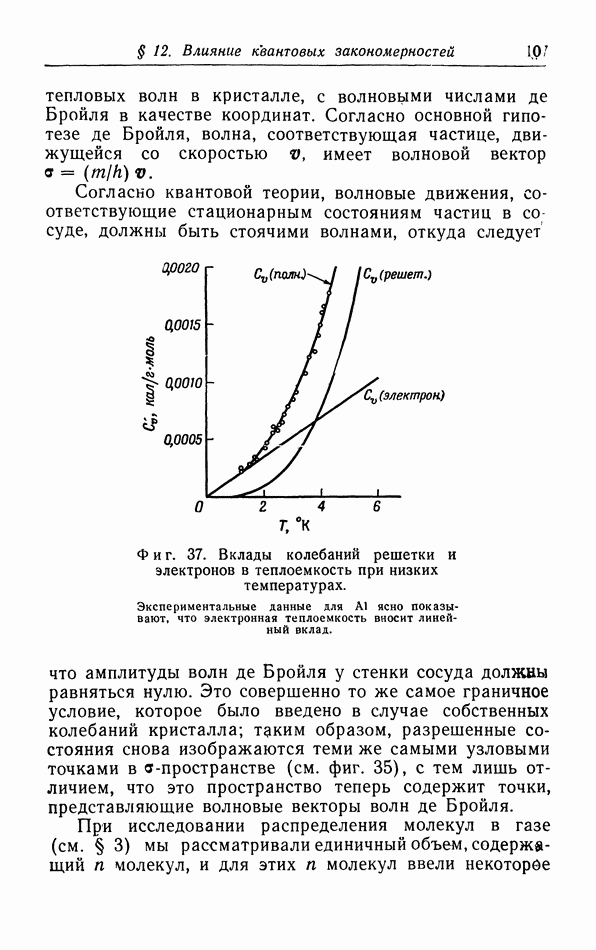
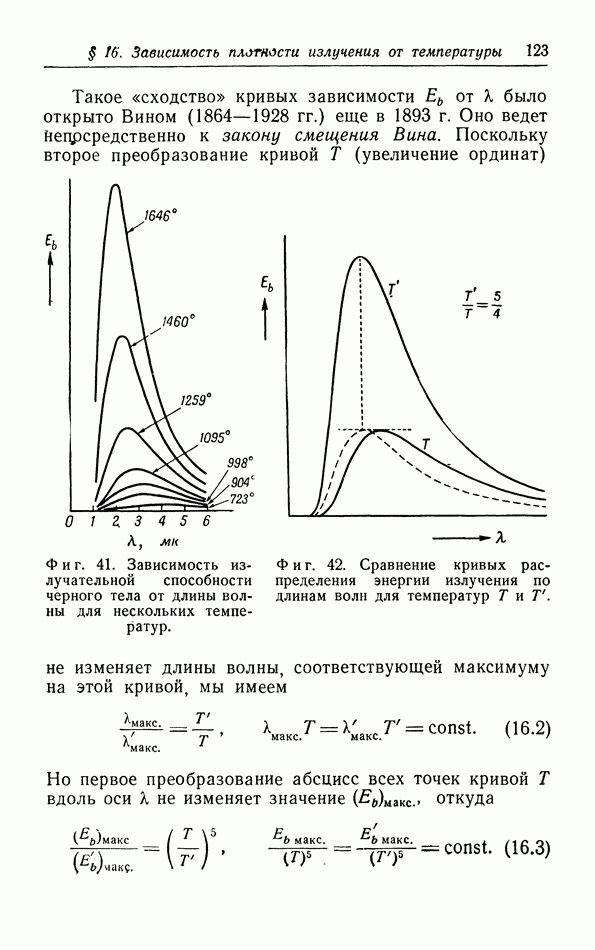
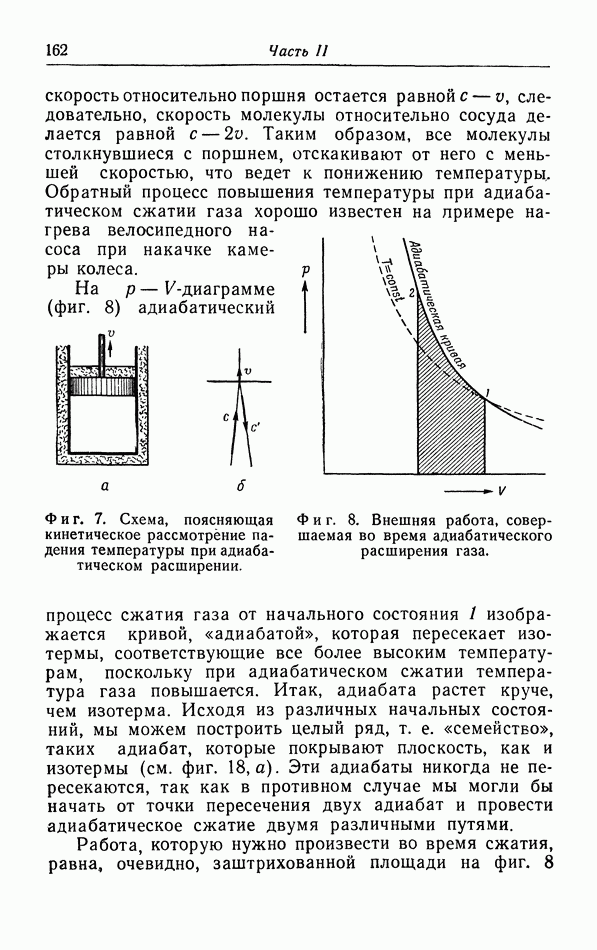
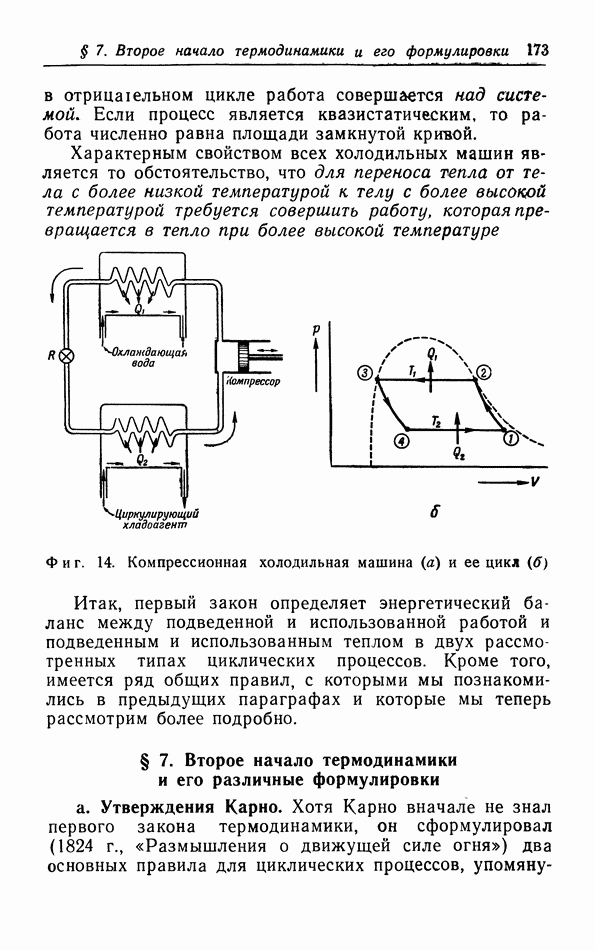
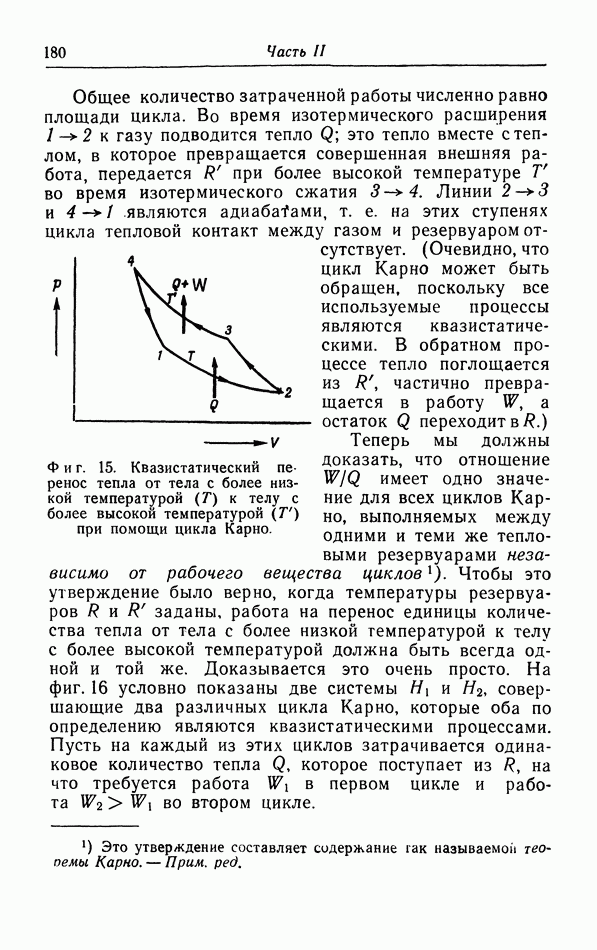
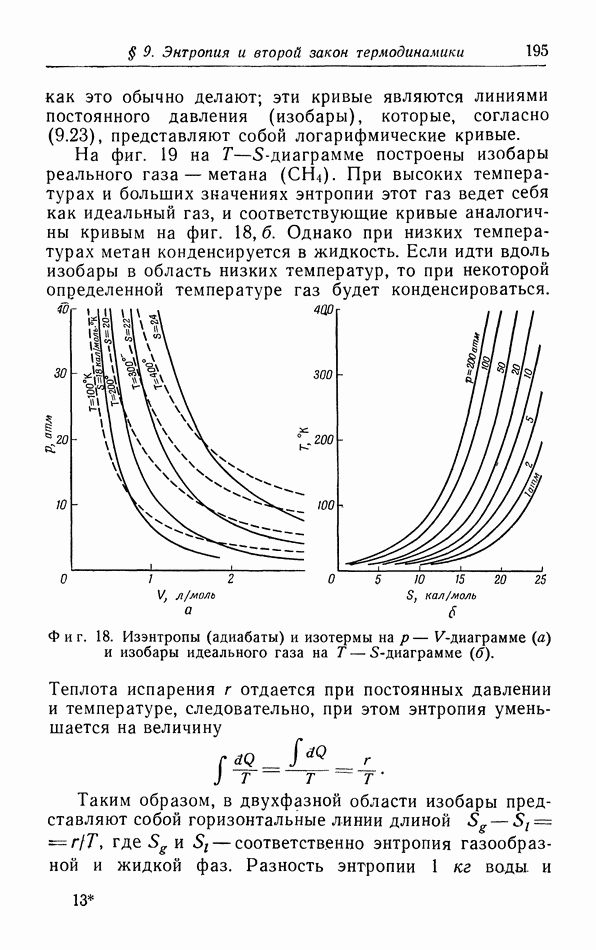
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
е. Жидкая фаза.
Уравнение ван дер Ваальса является уравнением состояния не только газовой, но и жидкой фазы. Рассмотрим жидкость, находящуюся под давлением собственных паров при температуре много меньшей, чем ее критическая температура. Давлением паров  можно почти всегда пренебречь по сравнению с давлением притяжения Для
можно почти всегда пренебречь по сравнению с давлением притяжения Для  например, давление паров при комнатной температуре равно 0,012 мм рт. ст., в то время как давление притяжения в жидкости имеет величину порядка 1000—10 000 атм. Тогда уравнение ван дер Ваальса приобретает вид
например, давление паров при комнатной температуре равно 0,012 мм рт. ст., в то время как давление притяжения в жидкости имеет величину порядка 1000—10 000 атм. Тогда уравнение ван дер Ваальса приобретает вид

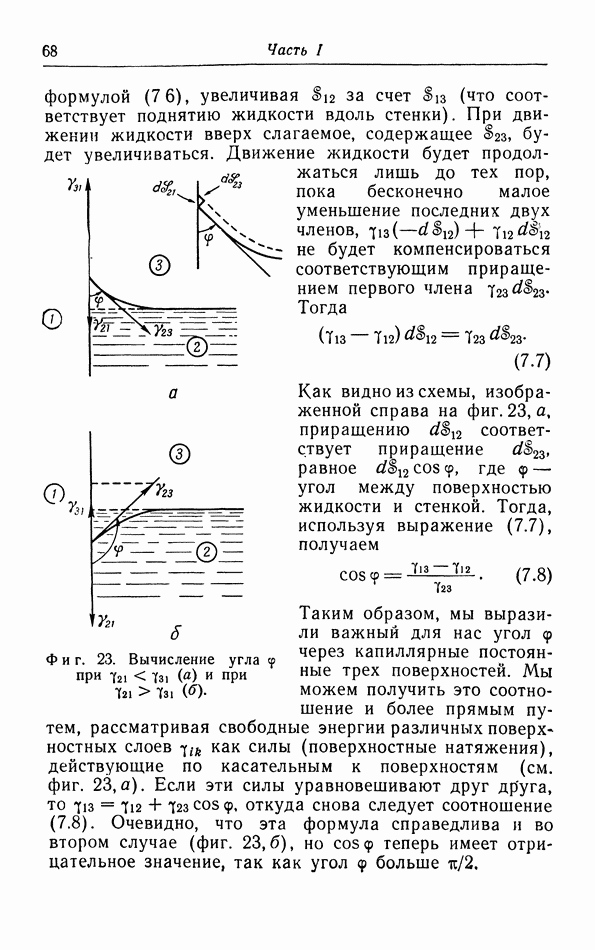
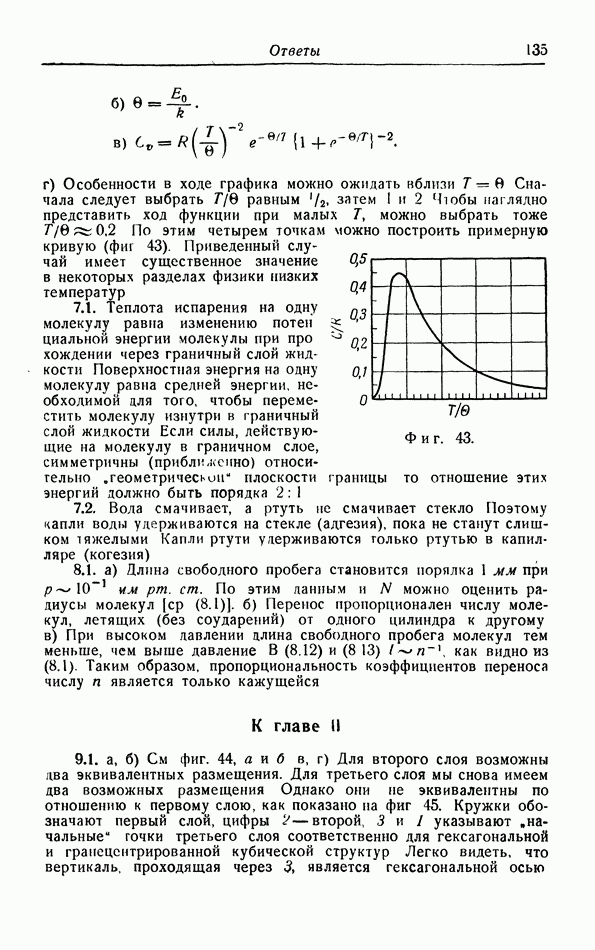
Таким образом, давление притяжения  уравновешивается «термическим давлением»
уравновешивается «термическим давлением»  Номере того как жидкость расширяется при нагревании, термическое давление падает, пока оно снова не придет в равновесие с давлением притяжения
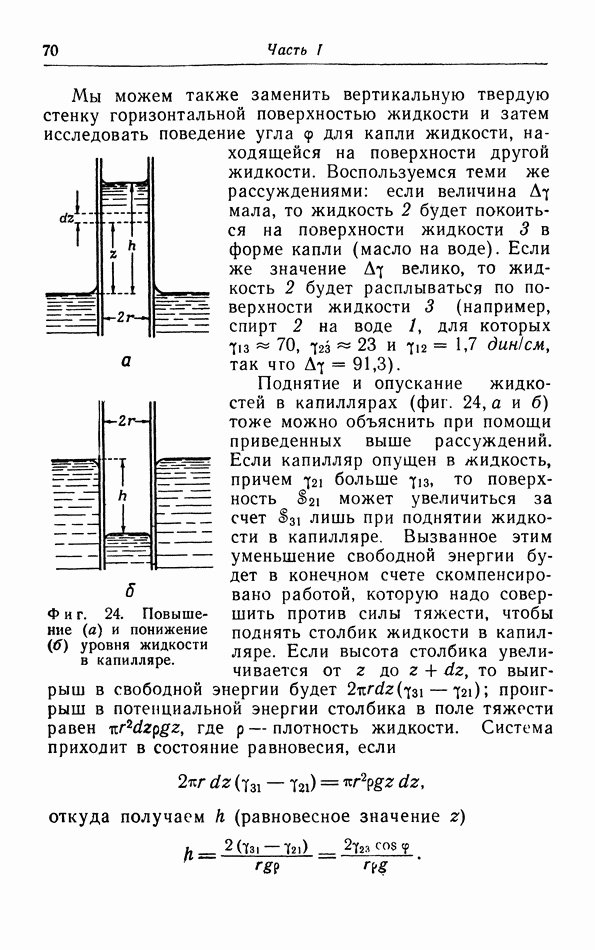
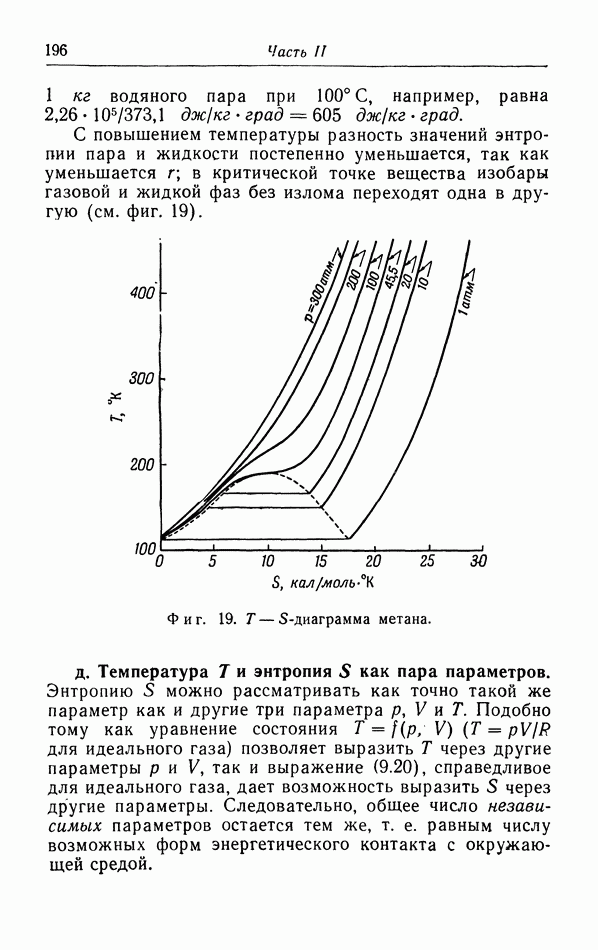
Номере того как жидкость расширяется при нагревании, термическое давление падает, пока оно снова не придет в равновесие с давлением притяжения  которое падает менее быстро. Этим объясняется, по крайней мере в принципе, расширение жидкостей при повышении температуры. Когда температура приближается к критической, плотность жидкости становится все меньше; при критической температуре плотность настолько мала, что такое же самое состояние может быть получено сжатием газовой фазы при этой температуре. В этом случае газ непрерывно переходит в жидкую фазу, и при температурах выше критической переход из газовой фазы в жидкую уже не
которое падает менее быстро. Этим объясняется, по крайней мере в принципе, расширение жидкостей при повышении температуры. Когда температура приближается к критической, плотность жидкости становится все меньше; при критической температуре плотность настолько мала, что такое же самое состояние может быть получено сжатием газовой фазы при этой температуре. В этом случае газ непрерывно переходит в жидкую фазу, и при температурах выше критической переход из газовой фазы в жидкую уже не
поддается наблюдению. Это непрерывное взаимное превращение газов и жидкостей, а также возможность описания обеих этих фаз с одной точки зрения и с помощью одного уравнения состояния были также впервые установлены ван дер Ваальсом.
Ранее мы уже рассмотрели те изменения в жидкости, которые имеют место при повышении температуры, причем показали, что выше критической температуры жидкость ведет себя как сжатый газ. Теперь мы будем понижать температуру: при определенной температуре жидкость переходит в твердую фазу, В § 9 мы покажем, что молекулы в твердом теле образуют правильную решетку, причем они совершают малые колебания около своих положений равновесия. Твердое состояние полностью определяется взаимным притяжением молекул, которое удерживает молекулы в узлах упорядоченной решетки. Тепловое движение оказывает теперь лишь малое возмущающее влияние. Однако при температуре плавления амплитуды колебаний молекул около их положений равновесия становятся столь большими, что твердое состояние делается нестабильным и тело плавится.
Хотя в жидкости тепловое движение настолько интенсивно, что упорядоченное состояние, характерное для твердой фазы, полностью исчезает, энергия притяжения остается господствующим фактором, как и в случае твердого гела. Исоледования при помощи рентгеновских лучей показали, что даже выше температуры плавления в жидкости сохраняется некоторый порядок во взаимном расположении молекул, однако при дальнейшем повышении температуры этот порядок постепенно исчезает.
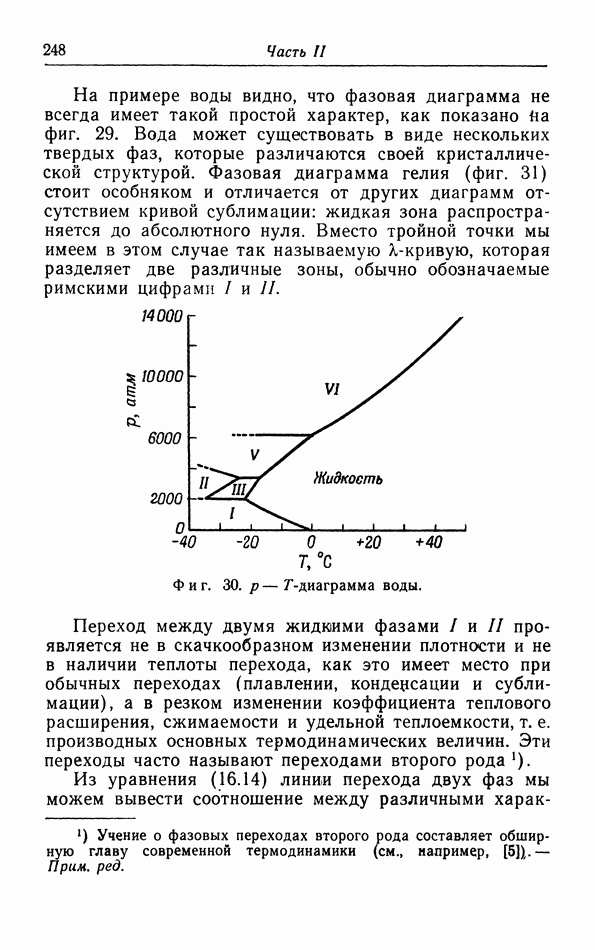
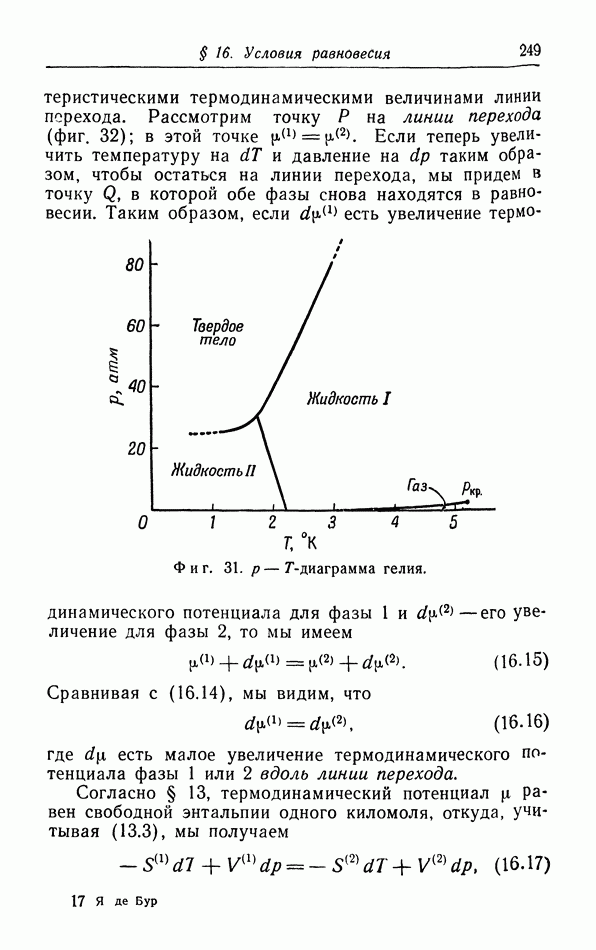
Мы видим, таким образом, что при низких температурах свойства жидкости приближаются к свойствам твердого тела, тогда как при повышении температуры жидкость делается все более и более подобной газу и может даже непрерывно перейти в газовую фазу. Переход же в твердую фазу происходит всегда скачком; все попытки осуществить непрерывный переход из жидкой фазы в твердую при очень высоких давлениях оказались безуспешными; до сих пор не обнаружено
случая существования критической точки перехода из жидкой фазы в твердую. Правда, имеется ряд жидкостей, вроде сургуча и различных стекйл, которые при понижении температуры становятся все более и более вязкими и постепенно переходят в аморфную твердую фазу; однако в большинстве случаев это твердое состояние является нестабильным.
Последовательность образования разных фаз в процессе понижения температуры (газ — жидкость — твердое тело) в ряде случаев имеет более сложный характер, чем описано выше Примером являются жидкости, которые состоят из длинных молекул, в частности  -азоксианизол. Ниже определенной температуры, при которой эти жидкости еще не затвердевают, они обнаруживают свойства кристаллов (двойное лучепреломление и т. д.), обусловленные взаимной ориентацией молекул. Итак, мы можем сказать, что эти жидкости отвердевают с точки зрения ориентации их молекул, и лишь при более низких температурах они отвердевают также и с точки зрения пространственного расположения молекул.
-азоксианизол. Ниже определенной температуры, при которой эти жидкости еще не затвердевают, они обнаруживают свойства кристаллов (двойное лучепреломление и т. д.), обусловленные взаимной ориентацией молекул. Итак, мы можем сказать, что эти жидкости отвердевают с точки зрения ориентации их молекул, и лишь при более низких температурах они отвердевают также и с точки зрения пространственного расположения молекул.
| << Предыдущий параграф | Следующий параграф >> |
- Предисловие к русскому изданию
- ГЛАВА I. Газы и жидкости
- § 1. Молекулярная структура газов и жидкостей
- § 2. Кинетическая теория идеального газа
- б. Расчет давления в кинетической теории газов.
- в. Расчет удельной теплоемкости в кинетической теории газов.
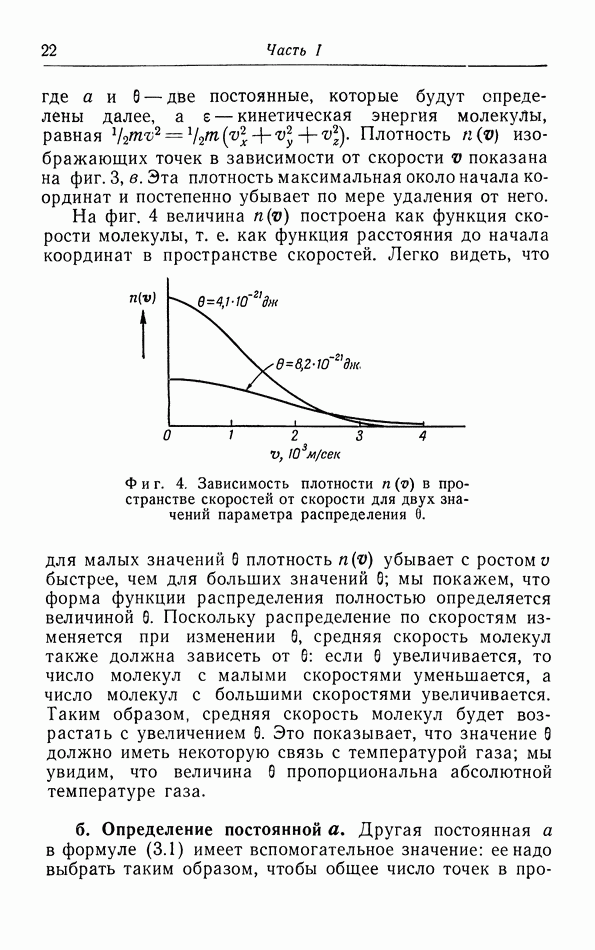
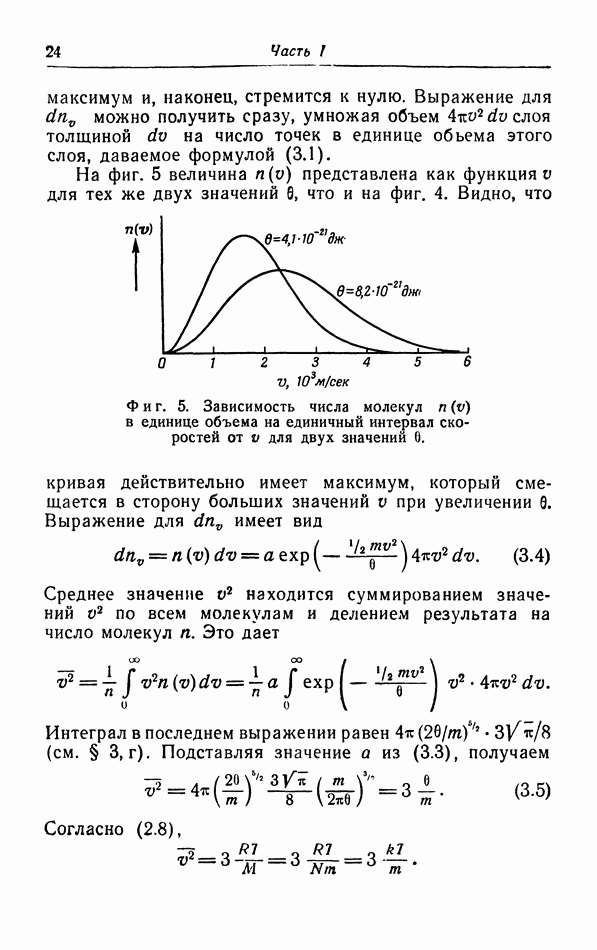
- § 3. Распределение молекул по скорости их движения
- г. Средняя квадратичная и средняя скорости.
- д. Броуновское движение.
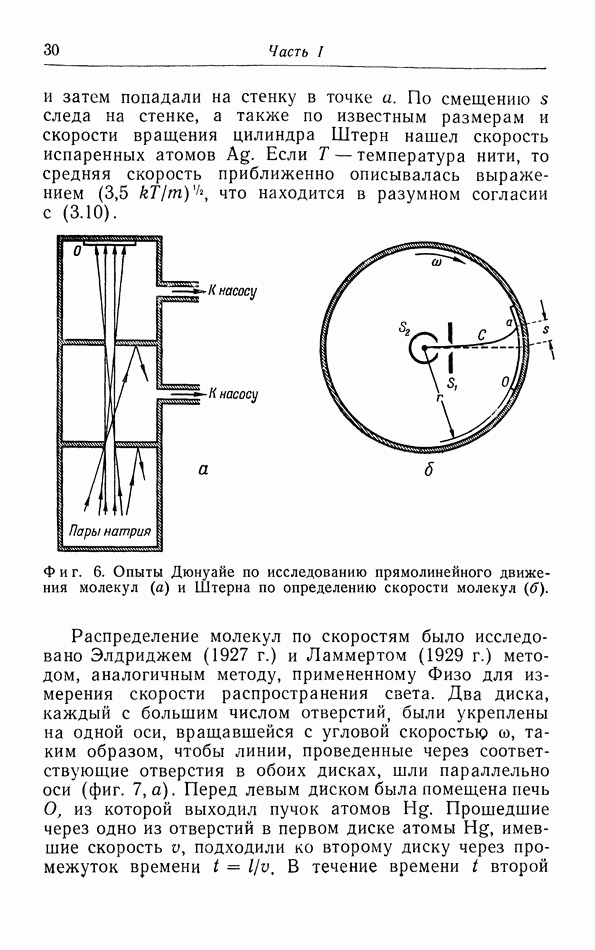
- е. Опыты с молекулярными пучками.
- § 4. Общее распределение молекул по энергиям
- б. Возбужденные состояния.
- в. вращательная и колебательная энергии.
- г. Потенциальная энергия тяготения.
- д. Потенциальная энергия межмолекулярных сил.
- § 5. Уравнение состояния газов и жидкостей
- б. Обсуждение уравнения ван дер Ваальса.
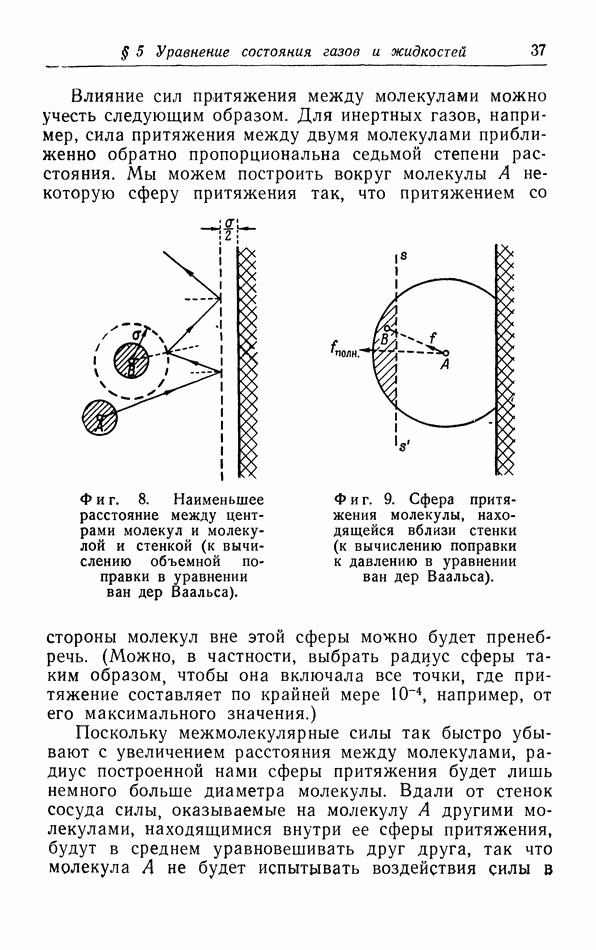
- в. Взаимодействие молекул.
- г. Более точный расчет поправок к уравнению pV=RT.
- д. Закон соответственных состояний.
- е. Жидкая фаза.
- § 6. Теплоемкость газов и жидкостей
- б. Классическая теория колебательной теплоемкости.
- в. Квантовая теория теплоемкости.
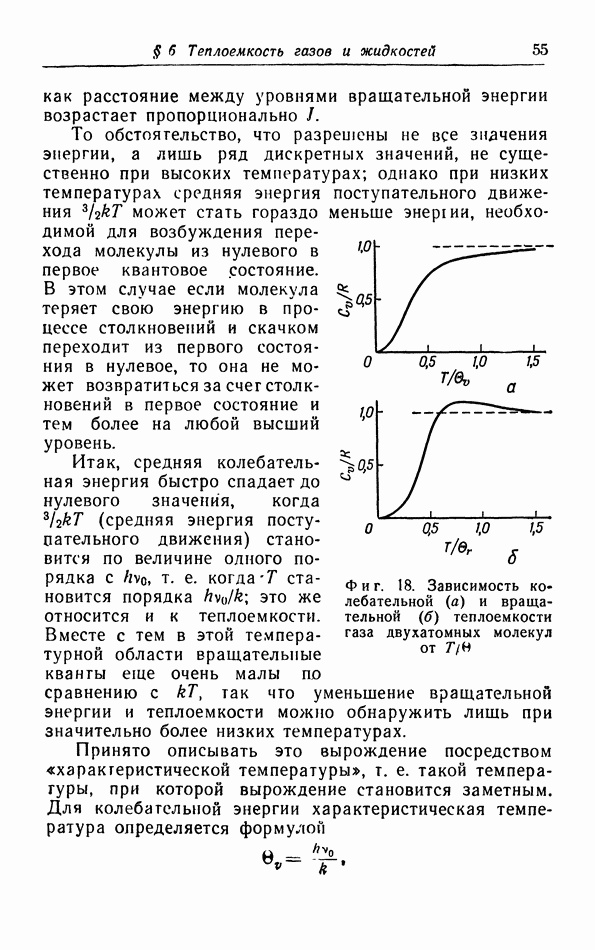
- г. Расчет колебательной теплоемкости двухатомной молекулы.
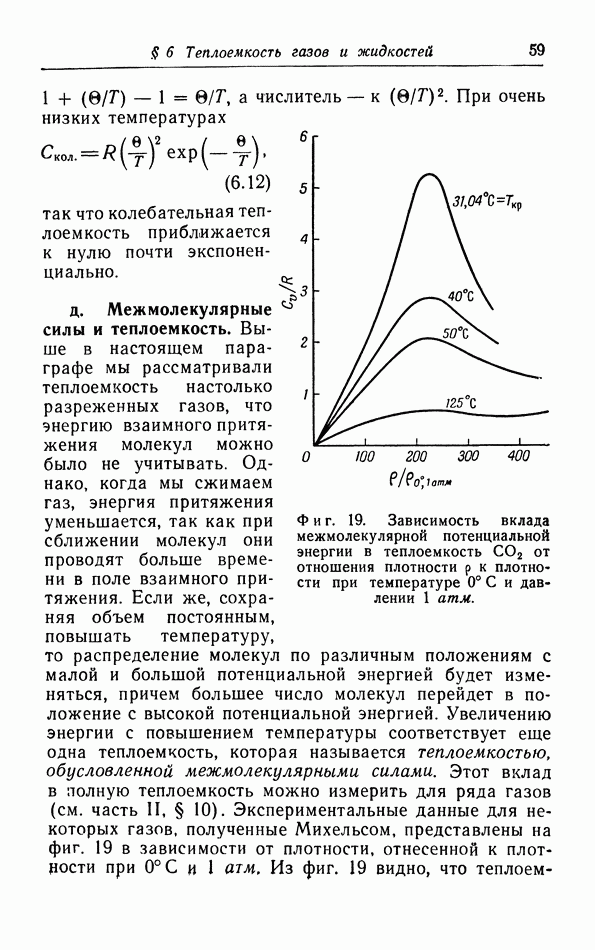
- д. Межмолекулярные силы и теплоемкость.
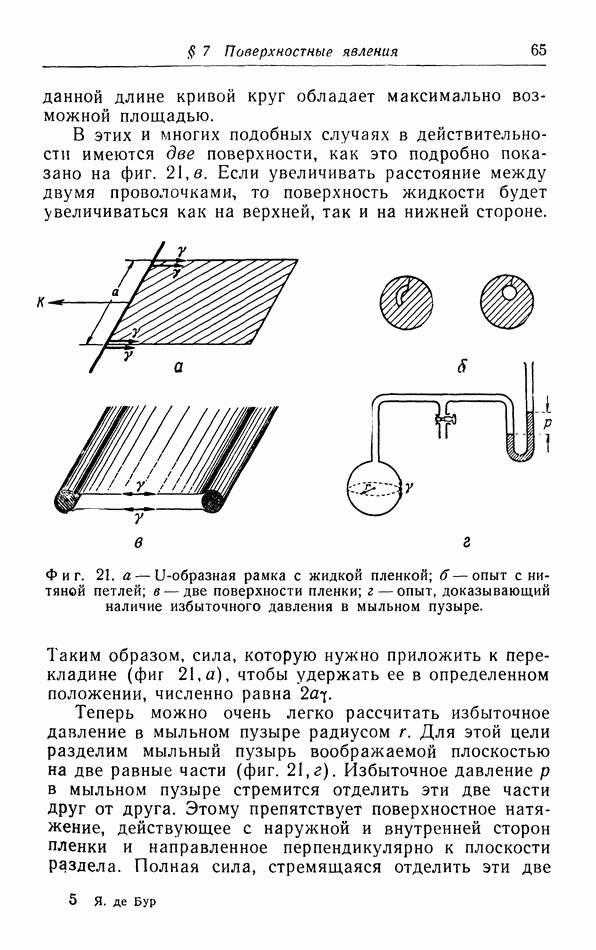
- § 7. Поверхностные явления
- б. Жидкие пленки.
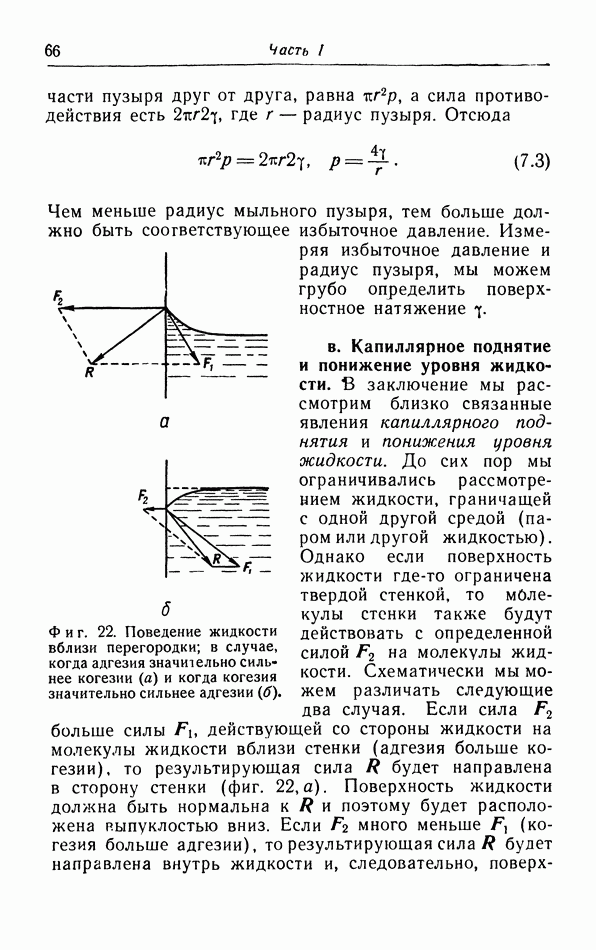
- в. Капиллярное поднятие и понижение уровня жидкости.
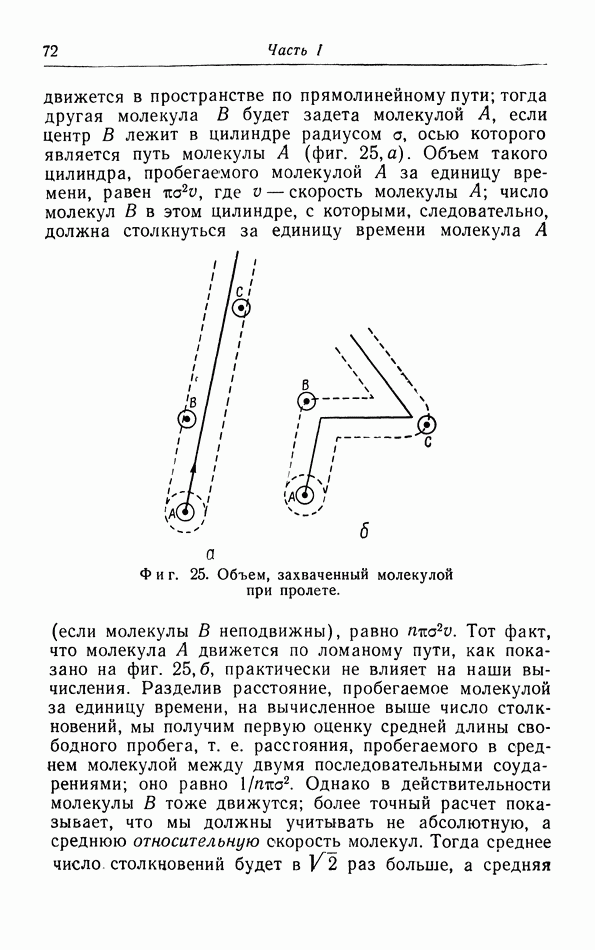
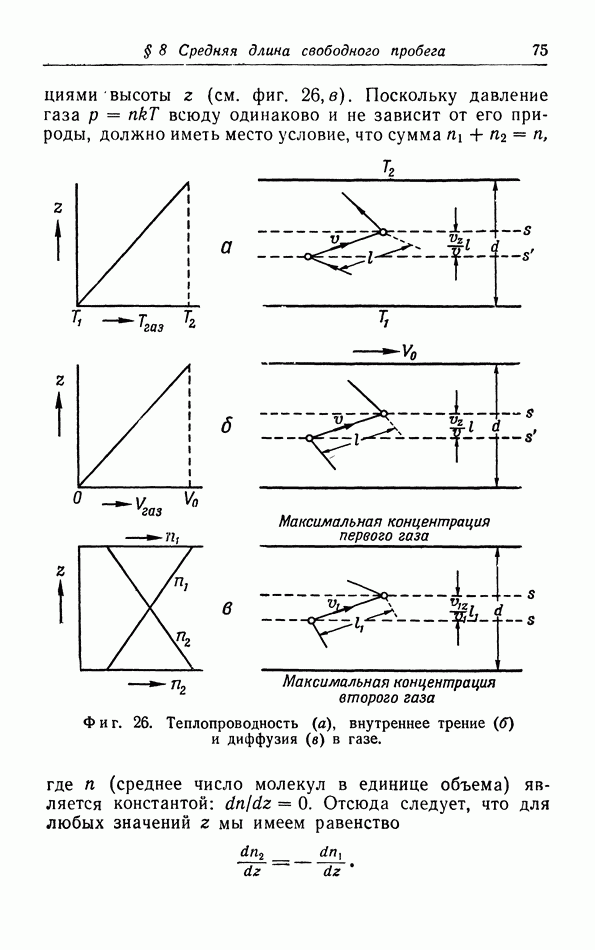
- § 8. Средняя длина свободного пробега, теплопроводность, вязкость и диффузия
- ГЛАВА II. Твердые тела
- § 9. Структура твердых тел
- § 10. Уравнение состояния твердых тел
- § 11. Теплоемкость твердых тел
- в. Колебания линейной цепочки.
- г. Колебания двумерной решетки.
- д. Колебания трехмерной решетки.
- е. Теория Дебая.
- § 12. Влияние квантовых закономерностей на распределение частиц по скоростям
- ГЛАВА III. Излучение
- § 13. Тепловое излучение и свет
- § 14. Испускание, поглощение и плотность излучения
- б. Яркость и излучательная способность.
- в. Плотность излучения.
- г. Закон Кирхгофа.
- § 15. Фотонная гипотеза. Давление излучения
- § 16. Зависимость плотности излучения от температуры и длины волны
- б. Закон смещения Вина.
- в. Закон излучения Релея — Джинса.
- г. Закон излучения Планка.
- ГЛАВА I. Первый закон термодинамики
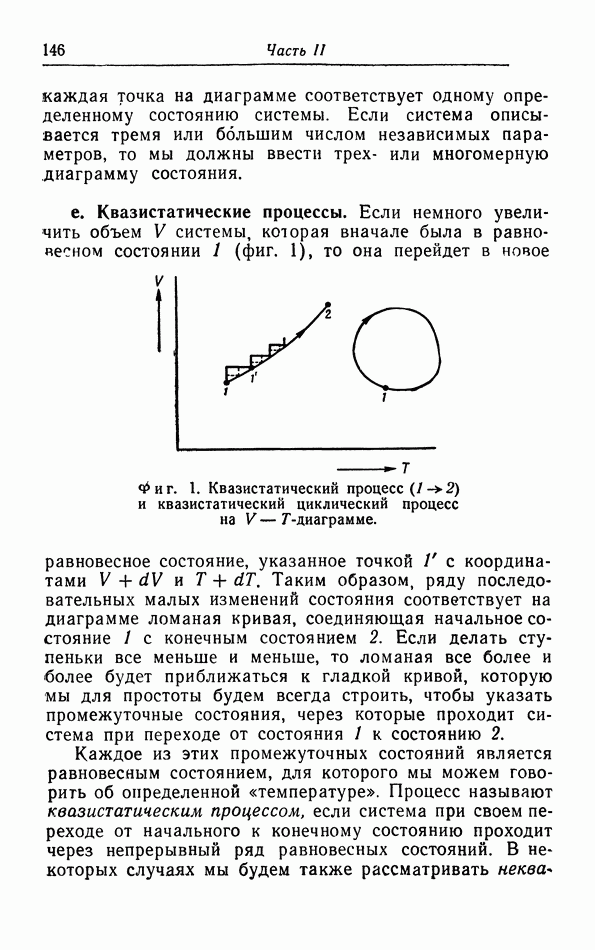
- § 1. Термодинамическое состояние и его изменения
- § 2. Работа при квазистатических процессах
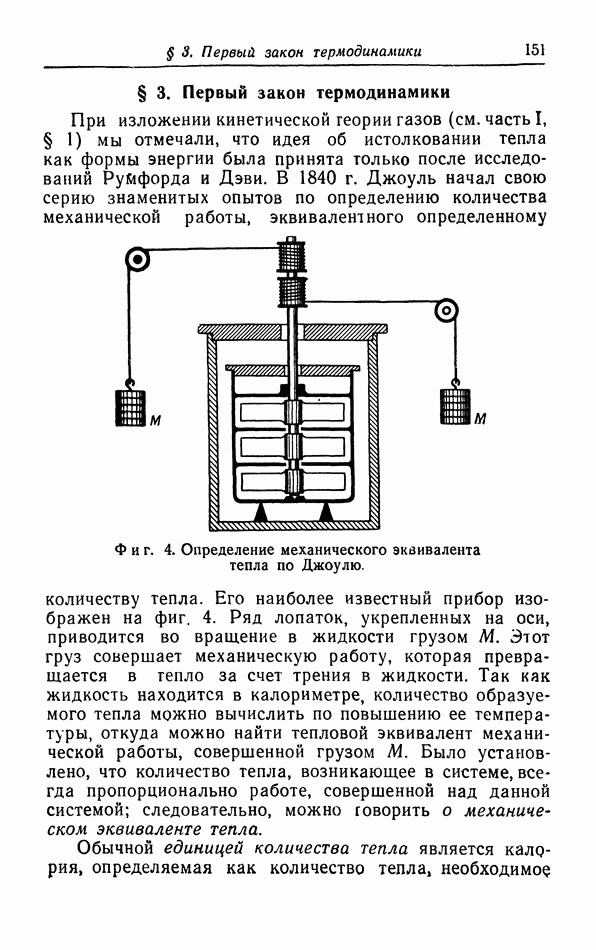
- § 3. Первый закон термодинамики
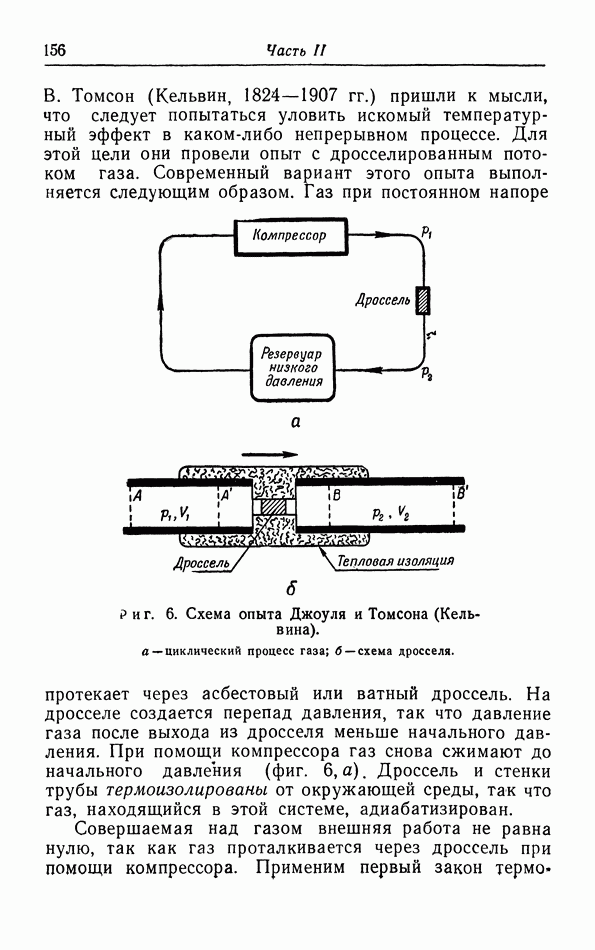
- § 4. Опыты Джоуля и Томсона
- § 5. Дальнейшие приложения первого закона
- б. Теплоемкость.
- в. Работа при адиабатических процессах.
- ГЛАВА II. Второй закон термодинамики
- § 6. Работа и теплота в циклических процессах
- § 7. Второе начало термодинамики и его различные формулировки
- § 8. Температура
- § 9. Энтропия и второй закон термодинамики
- § 10. Применения второго закона термодинамики
- в. Изэнтропические изменения состояния.
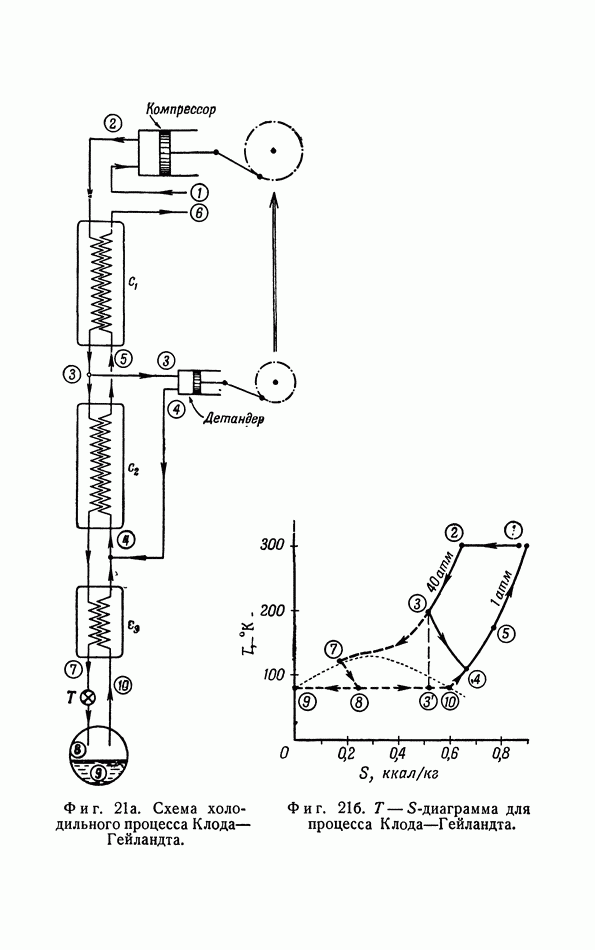
- г. Изэнтропические холодильные процессы (процесс Ж. Клода).
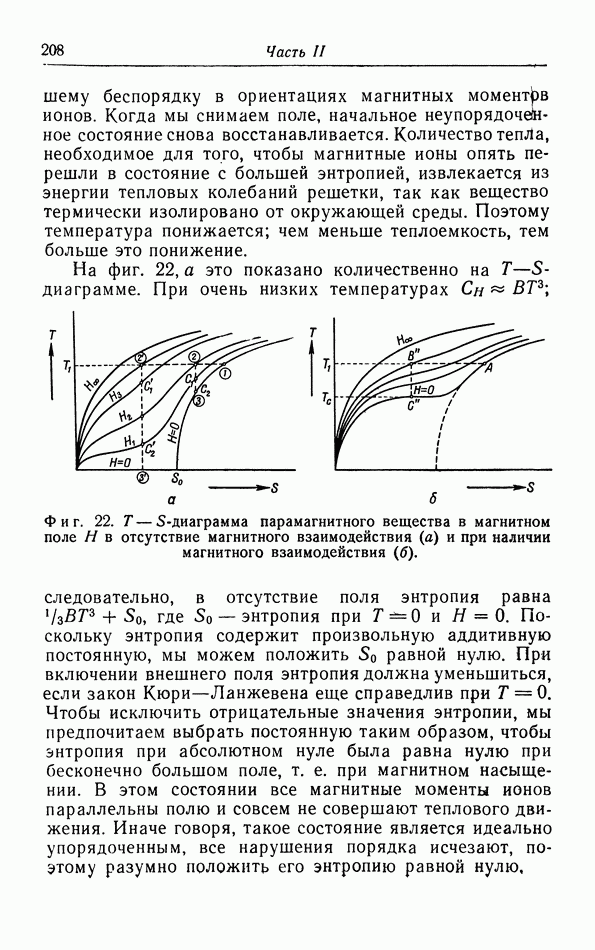
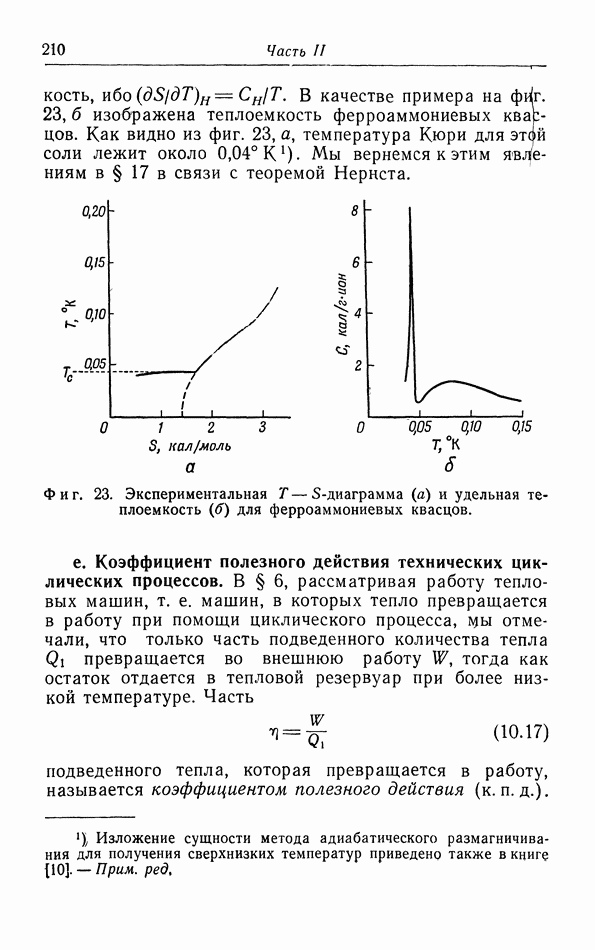
- д. Иззнтропические холодильные процессы (адиабатическое размагничивание).
- е. Коэффициент полезного действия технических циклических процессов.
- ГЛАВА III. Характеристические функции
- § 11. Энергия и энтальпия
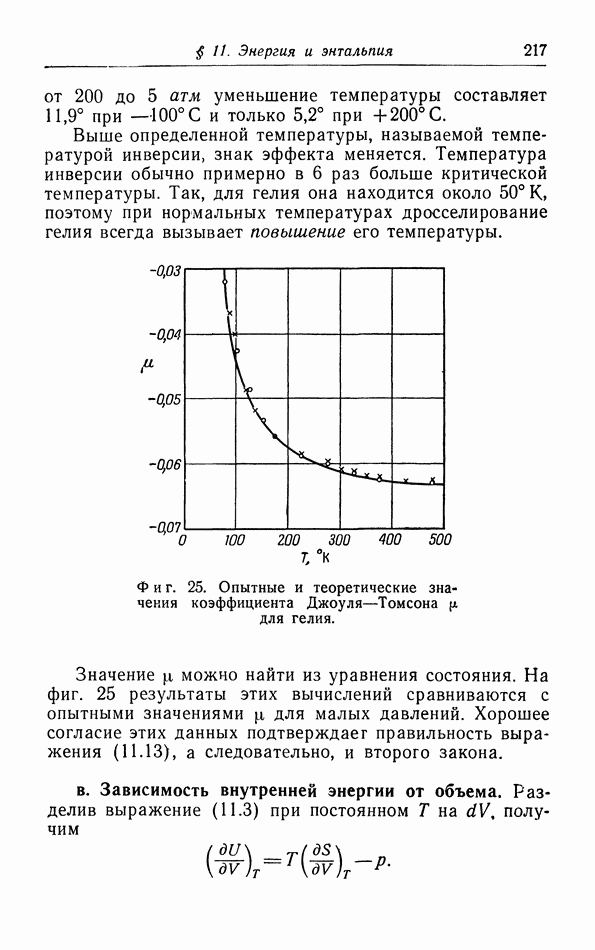
- б. Расчет процессов Джоуля и Джоуля — Томсона (Кельвина).
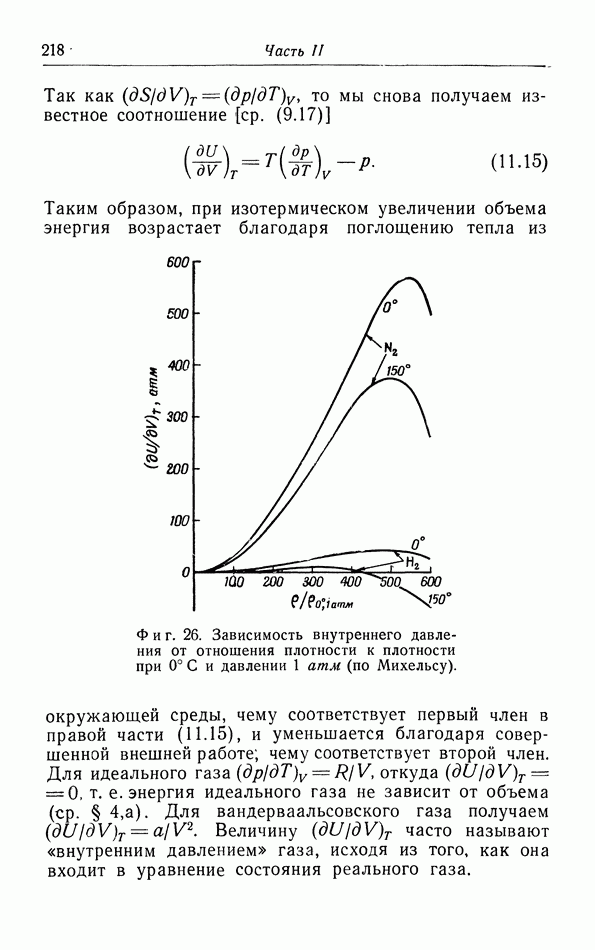
- в. Зависимость внутренней энергии от объема.
- г. Вывод закона Стефана — Больцмана.
- д. Характеристические функции U и H.
- § 12. Свободная энергия
- б. Свободная энергия и поверхностное натяжение.
- в. Свободная энергия и гальванические элементы.
- § 13. Свободная энтальпия и термодинамический потенциал
- б. Термодинамический потенциал.
- в. Системы с более чем одним компонентом.
- § 14. Соотношения Максвелла
- ГЛАВА IV. Неквазистатические процессы. Равновесие
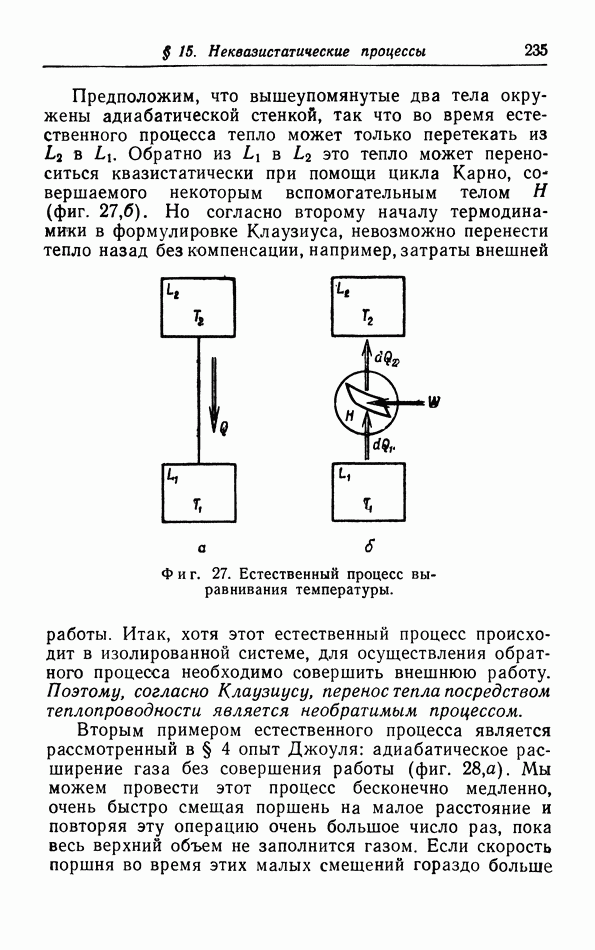
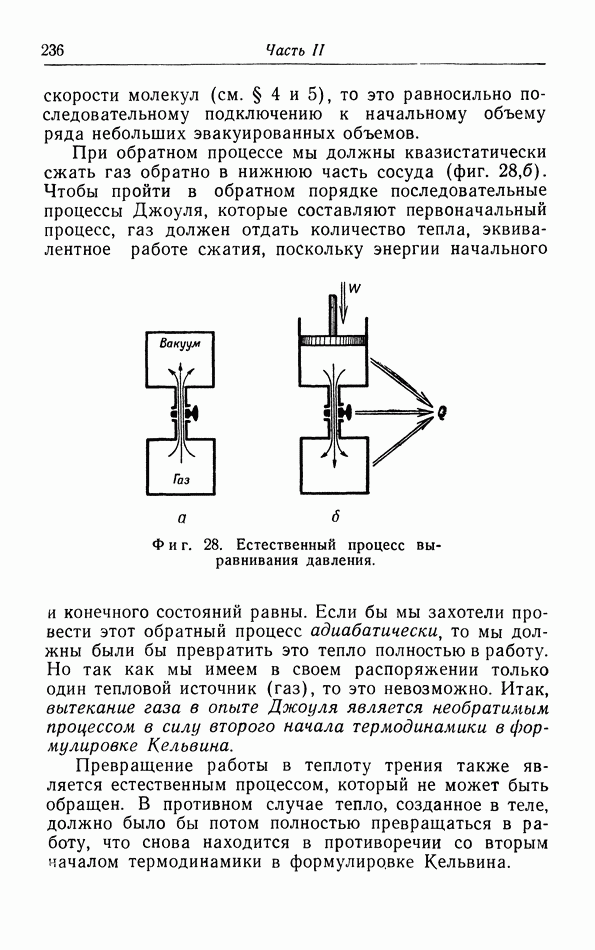
- § 15. Неквазистатические процессы
- б. Подвод тепла и изменение энтропии.
- в. Увеличение энтропии в адиабатических системах.
- г. Неквазистатический изотермический процесс.
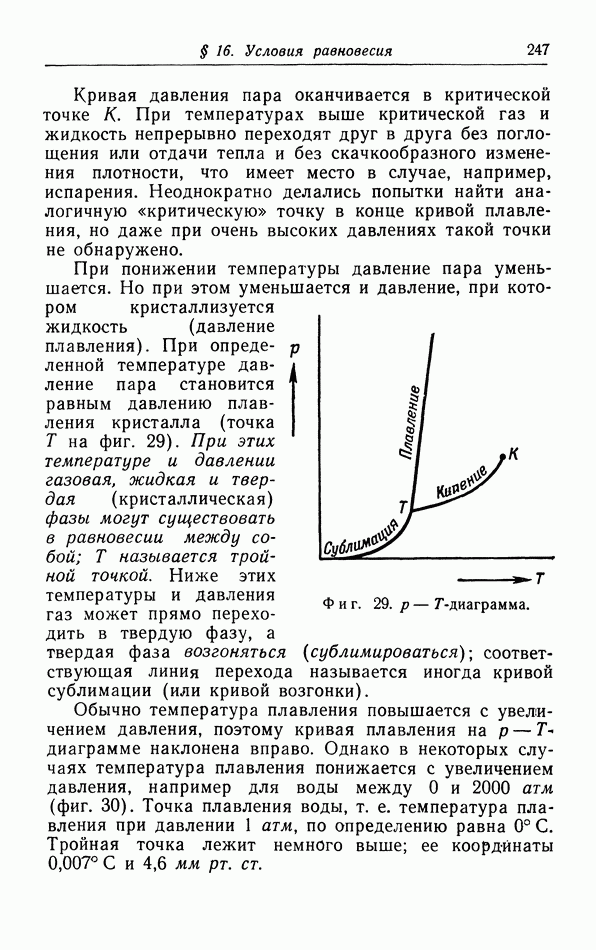
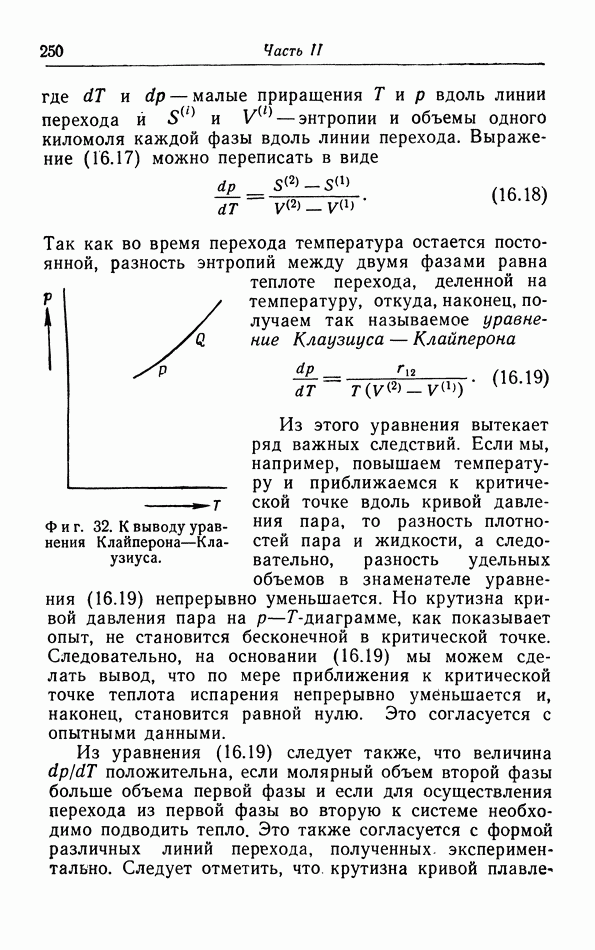
- § 16. Условия равновесия
- б. Первое условие равновесия.
- в. Второе условие равновесия.
- г. Третье условие равновесия.
- д. p-T-диаграмма.
- е. Равновесие фаз в случае более чем одного компонента. Правило фаз.
- ГЛАВА V. Теорема Нернста
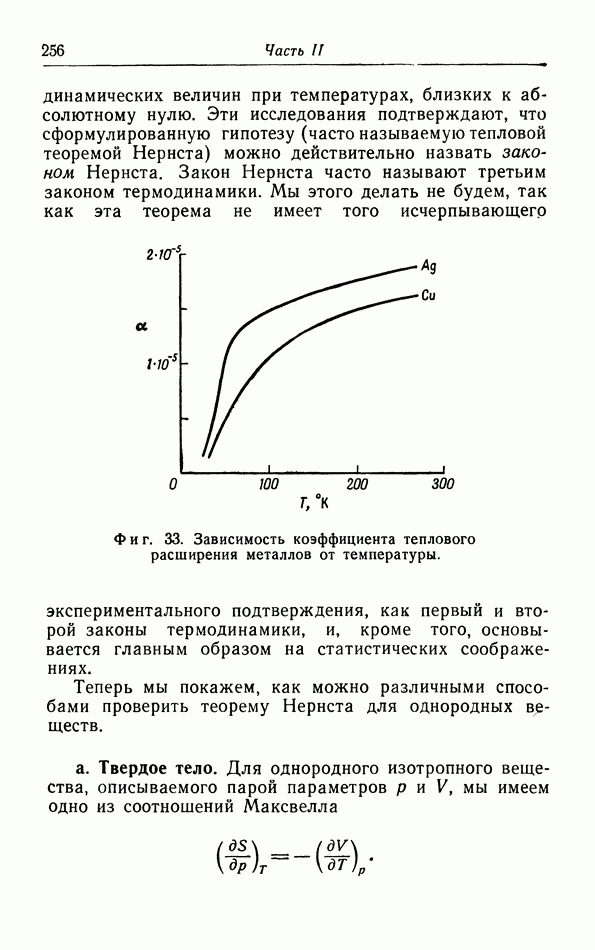
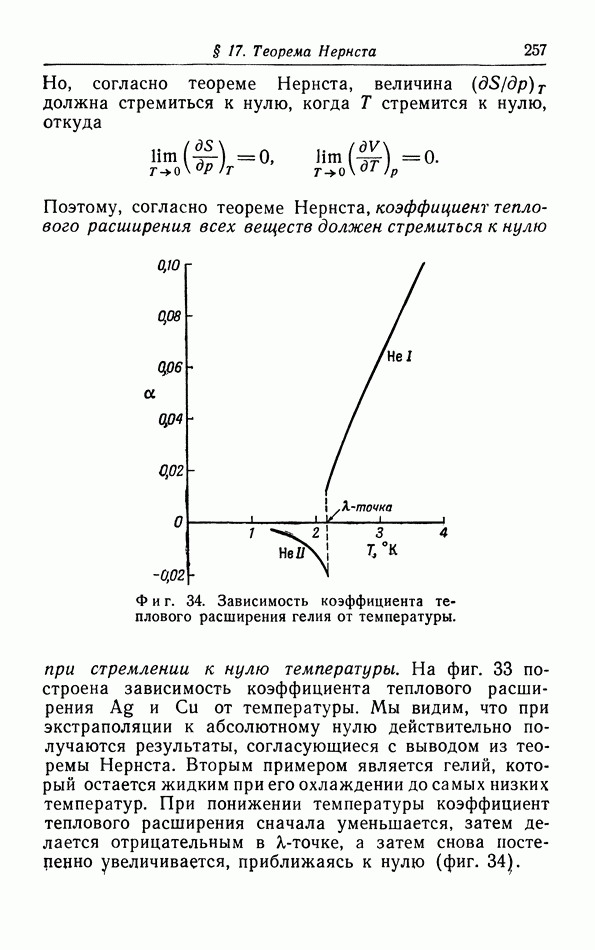
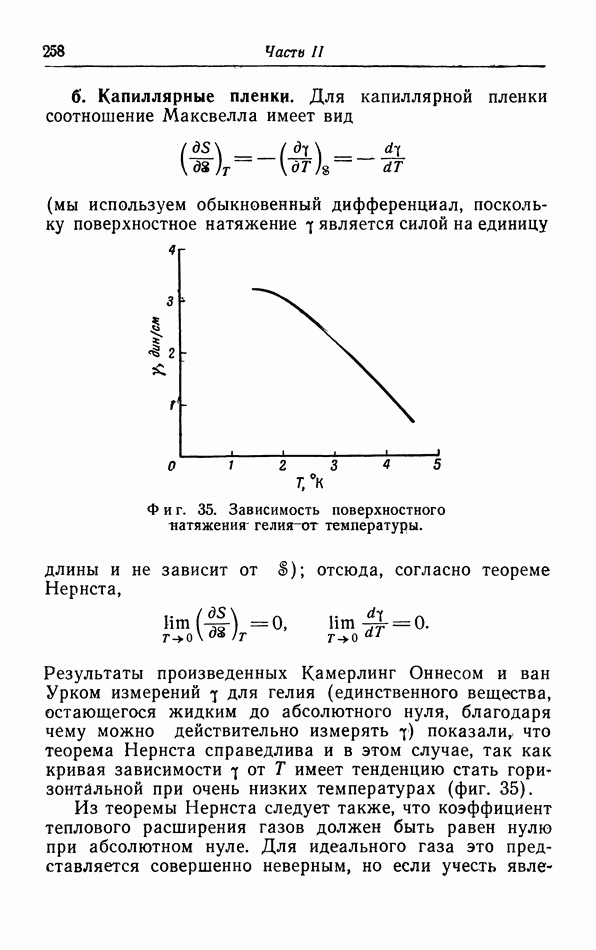
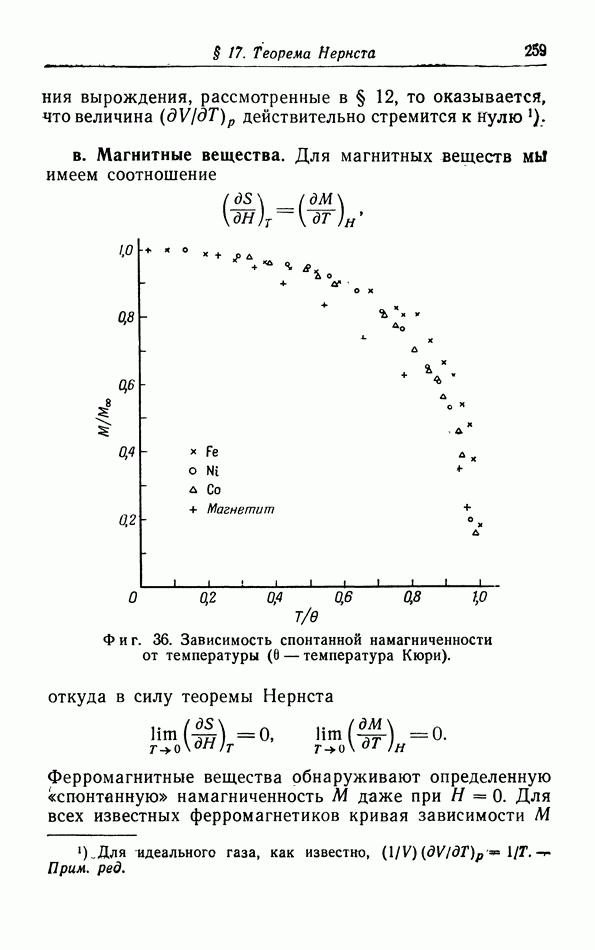
- § 17. Теорема Нернста
- § 18. Применение теоремы Нернста к фазовым переходам