| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
§ 9. Обнаружение PO4-ионов
Свойства фосфатов. Ортофосфорная кислота — трехосновная кислота; она образует три ряда солей: средние соли — фосфаты и два ряда кислых солей — гидрофосфаты и дигидрофосфаты. Водные растворы фосфатов и гидрофосфатов щелочных металлов обладают щелочной реакцией, а дигидрофосфатов — кислой. Приводимые уравнения и константы равновесия подтверждают это:

Это означает, что ортофосфорная кислота электролитически диссоциирует по типу кислоты — реакция ее водного раствора сильнокислая. Образующиеся в процессе электролитической диссоциации фосфорной кислоты дигидро- и гидрофосфат-ионы способны, реагировать как по типу кислот, так и по типу оснований; фосфат-ионы реагируют с водой как основания. Реакция водного раствора  — кислая,
— кислая,  щелочная и
щелочная и  — сильнощелочная.
— сильнощелочная.
Большинство фосфатов в воде нерастворимо. Это обстоятельство сильно усложняет обычный ход анализа катионов в присутствии  . Поэтому для анализа смеси катионов в присутствии
. Поэтому для анализа смеси катионов в присутствии  применяют специальные методы (см. гл. VI, § 22).
применяют специальные методы (см. гл. VI, § 22).
Растворимы в воде фосфаты, гидро- и дигидрофосфаты щелочных металлов и аммония, а также дигидрофосфаты многих металлов. Остальные фосфаты растворимы (кроме фосфатов и гидрофосфатов циркония и висмута) в минеральных кислотах. Нерастворимы в уксусной кислоте  .
.
Соли фосфорной кислоты большей частью бесцветны или окрашены в желтый цвет, соли окрашенных катионов имеют различные цвета.
Реакция с солями железа (III). Растворы солей железа (III) образуют с фосфат-ионами нерастворимый в уксусной кислоте желтоватобелый осадок фосфата железа  (см. гл. VI, § 2).
(см. гл. VI, § 2).
Более эффектной реакцией является взаимодействие  с роданидом железа, сопровождающееся не только образованием осадка фосфата железа, но и обесцвечиванием кроваво-красной окраски раствора
с роданидом железа, сопровождающееся не только образованием осадка фосфата железа, но и обесцвечиванием кроваво-красной окраски раствора  :
:

Реакция с магнезиальной смесью. Магнезиальная смесь  с фосфатами образует белый кристаллический осадок
с фосфатами образует белый кристаллический осадок  (см. гл. IV, § 11). Реакции мешают
(см. гл. IV, § 11). Реакции мешают  .
.
Реакция с молибдатом аммония. Поместите несколько капель исследуемого раствора в маленький тигель или в фарфоровую чашку, прибавьте 2—3 капли концентрированной  и выпарьте смесь под тягой досуха. При этом из нее удаляется
и выпарьте смесь под тягой досуха. При этом из нее удаляется  , мешающий открытию фосфатов при помощи молибдата аммония. В отсутствие
, мешающий открытию фосфатов при помощи молибдата аммония. В отсутствие  (и восстановителей) операцию выпаривания с азотной кислотой опускают. К сухому остатку прибавьте 2—3 капли концентрированной
(и восстановителей) операцию выпаривания с азотной кислотой опускают. К сухому остатку прибавьте 2—3 капли концентрированной  капли раствора
капли раствора  и 5—6 капель азотнокислого раствора
и 5—6 капель азотнокислого раствора  . Смесь нагрейте. В присутствии
. Смесь нагрейте. В присутствии  уже на холоду появляется желтый осадок фосфоромолибдата аммония
уже на холоду появляется желтый осадок фосфоромолибдата аммония  :
:

или  , т. е. аммониевая соль фосфорномолибденовой кислоты
, т. е. аммониевая соль фосфорномолибденовой кислоты  .
.
Фосфоромолибдат аммония легко растворяется в водном растворе аммиака:

Условия проведения реакции. 1. Реакцию следует проводить в растворе, кислотность которого соответствует концентрированным растворам азотной кислоты  .
.
2. Нагревание ускоряет образование осадка.
3. Нитрат аммония и избыток молибдата способствуют выделению осадка.
4. Арсенат-ионы, дающие аналогичную реакцию при нагревании с молибдатом аммония, должны быть предварительно отделены. При кипячении азотнокислого раствора осадок может получиться и за счет  , окисляющегося азотной кислотой до
, окисляющегося азотной кислотой до  . Если реакцию проводят на холоду, то
. Если реакцию проводят на холоду, то  можно не отделять.
можно не отделять.
В присутствии тартратов и оксалатов  не реагирует с молибдатом аммония (см. ниже).
не реагирует с молибдатом аммония (см. ниже).
5. Некоторые соединения (например, соли рубидия) ускоряют процесс образования осадка фосфоромолибдата аммония, причем в присутствии таких соединений реакция идет даже в очень разбавленных растворах фосфатов.
6. Восстановители и  мешают реакции, так как восстанавливают
мешают реакции, так как восстанавливают
 до молибденовой сини.
до молибденовой сини.
Реакция с молибдатом аммония и бензидином. Поместите в пробирку 2—3 капли раствора фосфата натрия, 1—2 капли концентрированной HNO3, 2—3 капли винной кислоты, 12 капель азотнокислого раствора  и 5 капель раствора ацетата натрия. При этом образуется фосфорномолибденовая кислота. К полученному раствору прибавьте водный раствор аммиака до нейтральной реакции и 2—3 капли уксуснокислого раствора бензидина. В присутствии
и 5 капель раствора ацетата натрия. При этом образуется фосфорномолибденовая кислота. К полученному раствору прибавьте водный раствор аммиака до нейтральной реакции и 2—3 капли уксуснокислого раствора бензидина. В присутствии  появится синее окрашивание.
появится синее окрашивание.
Реакции мешают восстановители и некоторые окислители, поэтому их удаляют предварительным кипячением и выпариванием раствора с 2—3 каплями концентрированной  .
.
Реакцию можно провести также капельным методом. На фильтровальную бумагу поместите каплю исследуемого раствора и каплю азотч нокислого раствора  , содержащего винную или щавелевую кислоту. Бумагу слегка нагрейте над электрической плиткой. Затем прибавьте 1—2 капли уксуснокислого раствора бензидина и внесите бумагу в пары аммиака для нейтрализации кислоты. В присутствии
, содержащего винную или щавелевую кислоту. Бумагу слегка нагрейте над электрической плиткой. Затем прибавьте 1—2 капли уксуснокислого раствора бензидина и внесите бумагу в пары аммиака для нейтрализации кислоты. В присутствии  появляется синее пятно.
появляется синее пятно.
Фосфорномолибденовая кислота  и ее соли [например,
и ее соли [например,  являются сильными окислителями. Они окисляют многиё неорганические и органические соединения, которые не окисляются свободной молибденовой кислотой. Например, бензидин не окисляется молибденовой кислотой, но легко окисляется фосфорномолибденовой кислотой и фосформолибдатом аммония в уксуснокислой среде. При этом образуются два окрашенных в интенсивно синий цвет химических соединения: бензидиновая синь — продукт окисления бензидина и молибденовая синь — продукт восстановления молибденовой кислоты.
являются сильными окислителями. Они окисляют многиё неорганические и органические соединения, которые не окисляются свободной молибденовой кислотой. Например, бензидин не окисляется молибденовой кислотой, но легко окисляется фосфорномолибденовой кислотой и фосформолибдатом аммония в уксуснокислой среде. При этом образуются два окрашенных в интенсивно синий цвет химических соединения: бензидиновая синь — продукт окисления бензидина и молибденовая синь — продукт восстановления молибденовой кислоты.
Мышьяково-, германо- и кремнемолибденовая кислоты —  , а также их соли вступают с бензидином в подобную реакцию. Однако при определенных условиях проведения реакции можно открыть фосфат-ионы в присутствии анионов мышьяковой, германиевой и кремневой кислот. Для этой цели к испытуемому раствору прибавляют винную кислоту (или сегнетову соль
, а также их соли вступают с бензидином в подобную реакцию. Однако при определенных условиях проведения реакции можно открыть фосфат-ионы в присутствии анионов мышьяковой, германиевой и кремневой кислот. Для этой цели к испытуемому раствору прибавляют винную кислоту (или сегнетову соль  ), которая препятствует образованию мышьяково-, германиево- и кремнемолибденовой кислот.
), которая препятствует образованию мышьяково-, германиево- и кремнемолибденовой кислот.
Реакция фосфат-ионов с молибдатом аммония и бензидином очень чувствительна; при помощи этой реакции можно открыть ничтожные количества  .
.
Открываемый минимум —  предельная концентрация
предельная концентрация  предельное разбавление— 1 000 000.
предельное разбавление— 1 000 000.
Условия проведения реакции. 1. При осаждении фосфоромолибдата аммония  среды должен быть значительно меньше 7; перед добавлением бензидина свободную кислоту нейтрализуют аммиаком.
среды должен быть значительно меньше 7; перед добавлением бензидина свободную кислоту нейтрализуют аммиаком.
2. Реакцию проводят на холоду во избежание образования мышьяковомолибденовой соли.
3. Добавление в анализируемый раствор винной кислоты или гидро-тартрата натрия препятствует образованию мышьяково-, германо- и кремнемолибденовой кислот.
4. Рекомендуется в раствор перед добавлением бензидина приливать раствор ацетата натрия.
5. Интенсивность появляющегося синего окрашивания зависит от содержания фосфорной кислоты, поэтому слишком разбавленные растворы предварительно концентрируют выпариванием.
6. Указанную реакцию нельзя проводить в присутствии реагентов, восстанавливающих молибденовую- кислоту до молибденовой сини. Этой реакции мешают также некоторые окислители  .
.
7. В присутствии избытка молибдата аммония образование фосфоромолибдата аммония проходит лучше.
8. Оксалаты и фториды, образующие устойчивые комплексные соединения с молибденом, мешают полному осаждению фосфатов в виде фосфорномолибденовой кислоты.
Вредное влияние оксалатов может быть устранено окислением их перманганатом в кислой среде, а помехи, вызываемые фторидами, устраняются добавлением бериллие-вых солей. При этом происходит демаскирование молибдат-ионов благодаря образованию более прочного комплексного иона 

| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ
- ВВЕДЕНИЕ
- § 1. Анализ и синтез
- § 2. Предмет аналитической химии
- § 3. Развитие аналитической химии
- § 4. Качественный и количественный анализ
- ГЛАВА I. ПРИМЕНЕНИЕ ЗАКОНА ДЕЙСТВИЯ МАСС В АНАЛИТИЧЕСКОЙ ХИМИИ
- § 1. Влияние среды на состояние ионов в растворах
- § 2. Обратимые и необратимые аналитические реакции
- § 3. Направление аналитических реакций; правила обменного разложения
- § 4. Закон действия масс и следствие из него
- § 5. Границы применимости закона действия масс
- § 6. Сильные и слабые электролиты
- § 7. Активность
- § 8. Коэффициент активности и ионная сила
- Б. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ (В ГОМОГЕННЫХ СИСТЕМАХ)
- § 9. Гомогенные и гетерогенные системы
- § 10. Ионное произведение воды
- § 11. Ионы гидроксония
- § 12. Равновесие ионов в водных растворах; понятие о pH
- § 13. Равновесие в водных растворах слабых электролитов
- § 14. Влияние сильных кислот или сильных оснований на степень электролитической диссоциации слабых электролитов
- § 15. Приближенные формулы для расчета [H+] и [OH-] в водных растворах кислот и оснований
- В. РАВНОВЕСИЯ В БУФЕРНЫХ РАСТВОРАХ
- § 16. Буферные растворы
- § 17. Применение буферных растворов в химическом анализе
- Г. РАВНОВЕСИЯ В РАСТВОРАХ ГИДРОЛИЗУЮЩИХСЯ СОЛЕЙ
- § 18. Теоретические основы гидролиза
- § 19. Механизм гидролитического расщепления
- § 20. Подавление и усиление гидролиза солей
- Д. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ТИПИЧНО АМФОТЕРНЫХ ЭЛЕКТРОЛИТОВ
- § 21. Поведение амфотерных гидроокисей в водных растворах
- § 22. Константы электролитической диссоциации амфотерных гидроокисей
- Е. РАВНОВЕСИЯ В СИСТЕМАХ: ОСАДОК-НАСЫЩЕННЫЙ РАСТВОР
- § 23. Осаждение как один из основных методов химического анализа
- § 24. Произведение растворимости
- § 25. Произведение активностей
- § 26. Вычисление растворимости электролитов в воде по величине произведения растворимости
- § 27. Влияние различных факторов на растворимость малорастворимых электролитов
- Ж. ОСНОВЫ ТЕОРИИ ОБРАЗОВАНИЯ И РАЗЛОЖЕНИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИИ, ПРИМЕНЯЕМЫХ В АНАЛИТИЧЕСКОЙ ХИМИИ
- § 28. Характеристика комплексных соединений, имеющих значение в химическом анализе
- § 29. Квантовомеханические представления о строении комплексов
- § 30. Равновесия в растворах комплексных соединений
- § 31. Константы нестойкости комплексов
- § 32. Внутрикомплексные соединения
- § 33. Методы разложения и образования комплексов, применяемых в аналитической химии
- § 34. Применение метода комплексообразования в химическом анализе
- ГЛАВА II. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ, ПРИМЕНЯЕМЫХ В АНАЛИТИЧЕСКОЙ ХИМИИ
- § 1. Окисление—восстановление как один из основных методов химического анализа
- § 2. Направление реакций окисления—восстановления
- § 3. Окислительно-восстановительные потенциалы
- § 4. Зависимость между величинами окислительно-восстановительных потенциалов и условиями, в которых протекают реакции окисления—восстановления
- § 5. Вычисление окислительно-восстановительных потенциалов
- § 6. Вычисление окислительно-восстановительных потенциалов с учетом коэффициентов активности
- ГЛАВА III. ВВЕДЕНИЕ В КАЧЕСТВЕННЫЙ АНАЛИЗ
- § 1. Обнаружение отдельных элементов
- § 2. Анализ мокрым и сухим путем
- § 3. Химические и физические методы качественного анализа
- § 4. Макро-, полумикро- и микрометоды
- § 5. Капельный анализ
- § 6. Микрокристаллоскопический анализ
- § 7. Метод растирания порошков
- § 8. Методы анализа, основанные на нагревании и сплавлении веществ
- § 9. Спектральный качественный анализ
- § 10. Хроматографический метод анализа
- § 11. Кинетические методы анализа
- Б. УСЛОВИЯ ВЫПОЛНЕНИЯ КАЧЕСТВЕННЫХ РЕАКЦИЙ
- § 12. Специфичность и чувствительность реакций
- § 13. Максимальная чувствительность аналитических реактивов
- § 14. Способы повышения чувствительности реакций
- § 15. Маскировка мешающих ионов
- § 16. Определение pH среды
- § 17. Регулирование pH среды в процессе аналитических определений
- В. РЕАКТИВЫ
- § 18. Понятие о химических реактивах
- § 19. Концентрация применяемых реактивов
- § 20. Техника пользования реактивами
- Г. ПОСУДА И ПРИБОРЫ, ПРИМЕНЯЕМЫЕ В КАЧЕСТВЕННОМ АНАЛИЗЕ
- § 21. Химическая посуда
- § 22. Приборы
- Д. АНАЛИТИЧЕСКИЕ ГРУППЫ
- § 23. Дробный и систематический анализ
- § 24. Аналитическая классификация катионов
- § 25. Сводные таблицы действия реактивов на катионы и анионы
- Е. ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА И АНАЛИТИЧЕСКАЯ КЛАССИФИКАЦИЯ ИОНОВ
- § 26. Значение периодического закона в аналитической химии
- § 27. Периодическая система элементов Д. И. Менделеева как классификация атомов по их строению
- § 28. Зависимость некоторых химических свойств элементов от положения их в периодической системе Д. И. Менделеева
- § 29. Растворимость химических соединений в связи с положением элементов в периодической системе Д. И. Менделеева
- § 30. Открытие новых аналитических реакций
- § 31. Аналитические группы и периодическая система элементов Д. И. Менделеева
- ОБНАРУЖЕНИЕ ИНДИВИДУАЛЬНЫХ КАТИОНОВ И АНАЛИЗ СМЕСЕЙ КАТИОНОВ
- § 1. Характеристика первой аналитической группы катионов
- § 2. Общие реакции катионов первой аналитической группы
- РЕАКЦИИ КАТИОНОВ 1-й ПОДГРУППЫ
- § 3. Обнаружение NН-ионов
- § 4. Методы разложения и удаления солей аммония
- § 5. Обнаружение K-ионов
- § 6. Обнаружение Rb-ионов
- § 7. Обнаружение Cs-ионов
- § 8. Анализ смеси катионов первой подгруппы
- РЕАКЦИИ КАТИОНОВ 2-й ПОДГРУППЫ
- § 9. Обнаружение Li-ионов
- § 10. Обнаружение Na-ионов
- § 11. Обнаружение Mg-ионов
- § 12. Обзор действия реактивов на катионы первой аналитической группы
- § 13. Анализ смеси катионов второй подгруппы
- § 14. Анализ смеси ионов
- § 15. Анализ смеси ионов
- ГЛАВА V. ВТОРАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ
- § 1. Характеристика второй аналитической группы катионов
- § 2. Общие реакции катионов второй аналитической группы
- § 3. Обнаружение Ca-ионов
- § 4. Обнаружение Sr-ионов
- § 5. Обнаружение Ba-ионов
- § 6. Обзор действия реактивов на катионы второй аналитической группы
- § 7. Основы теории осаждения катионов второй аналитической группы групповым реактивом—карбонатом аммония
- § 8. Систематический ход анализа смеси катионов первой и второй аналитических групп
- § 9. Систематический ход анализа смеси катионов первой и второй аналитических групп в присутствии ионов
- § 10. Теоретические основы перевода сульфатов катионов второй аналитической группы в карбонаты
- ГЛАВА VI. ТРЕТЬЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ
- § 1. Характеристика третьей аналитической группы катионов
- § 2. Общие реакции катионов третьей аналитической группы
- § 3. Обнаружение Be-ионов
- § 4. Обнаружение Al-ионов
- § 5. Обнаружение ионов титана (IV)
- § 6. Обнаружение Cr-ионов
- § 7. Обнаружение Mn-ионов
- § 8. Обнаружение Fe-ионов
- § 9. Обнаружение Fe-ионов
- § 10. Обнаружение Co-ионов
- § 13. Обнаружение ионов циркония (IV)
- § 14. Обнаружение UO-ионов
- § 15. Обзор действия реактивов на катионы третьей аналитической группы
- § 16. Использование коллоидных систем в химическом анализе
- § 17. Основы теории осаждения катионов третьей аналитической группы групповым реактивом — сульфидом аммония
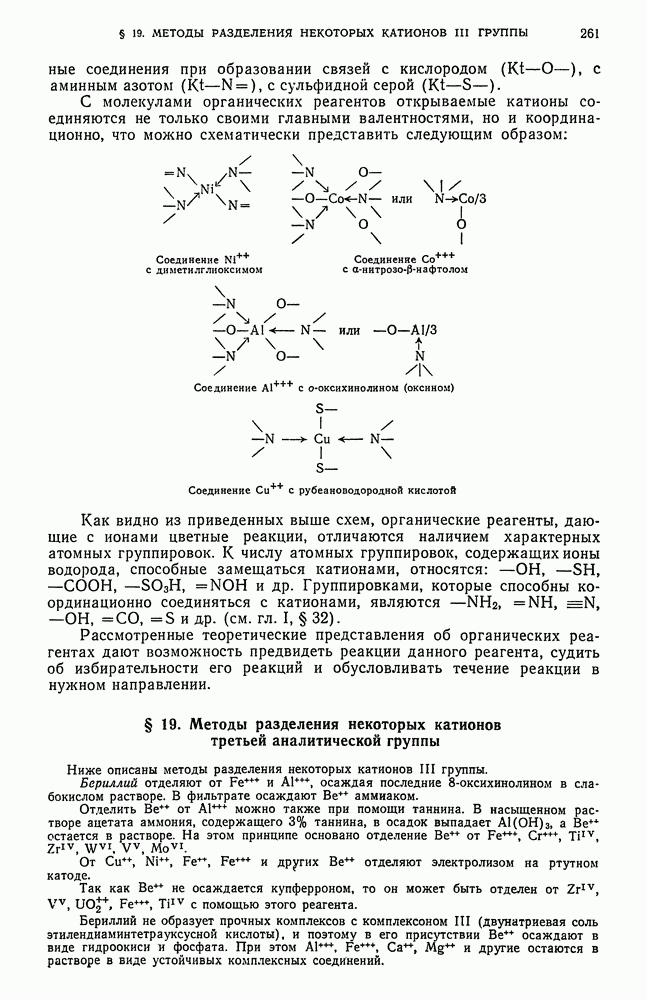
- § 18. Теоретические основы применения органических реактивов в качественном анализе неорганических веществ
- § 19. Методы разделения некоторых катионов третьей аналитической группы
- § 20. Систематический ход анализа смеси катионов третьей аналитической группы
- § 21. Систематический ход анализа смеси катионов первой, второй и третьей аналитических групп
- § 22. Систематический ход анализа смеси катионов первой, второй и третьей аналитических групп в присутствии PO-ионов
- ГЛАВА VII. ЧЕТВЕРТАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ
- § 1. Характеристика четвертой аналитической группы катионов
- § 2. Общие реакции катионов четвертой аналитической группы
- РЕАКЦИИ КАТИОНОВ ПЕРВОЙ ПОДГРУППЫ (ПОДГРУППЫ МЕДИ)
- § 3. Обнаружение Hg-ионов
- § 4. Обнаружение Cu-ионов
- § 5. Обнаружение Cd-ионов
- § 6. Обнаружение Bi-ионов
- РЕАКЦИИ КАТИОНОВ ВТОРОЙ ПОДГРУППЫ (ПОДГРУППЫ МЫШЬЯКА)
- § 7. Обнаружение ионов мышьяка (III)
- § 8. Обнаружение ионов мышьяка (V)
- § 9. Общие реакции обнаружения
- § 10. Обнаружение ионов сурьмы (III)
- § 11. Обнаружение ионов сурьмы (V)
- § 12. Общие реакции обнаружения Sb
- § 13. Обнаружение ионов олова (II)
- § 14. Обнаружение ионов олова (IV)
- § 15. Общие реакции обнаружения ионов олова (II) и олова (IV)
- § 16. Отделение ионов олова от других ирнов четвертой аналитической группы
- § 17. Обнаружение ионов германия (IV)
- § 18. Отделение ионов германия от других ионов четвертой аналитической группы
- § 19. Обзор действия реактивов на катионы четвертой аналитической группы
- § 20. Основы теории осаждения сульфидов катионов четвертой аналитической группы групповым реактивом — сероводородом
- § 21. Систематический ход анализа смеси катионов четвертой аналитической группы
- ГЛАВА VIII. ПЯТАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ (ГРУППА СЕРЕБРА)
- § 1. Характеристика пятой аналитической группы катионов
- § 2. Общие реакции катионов пятой аналитической группы
- § 3. Обнаружение Ag-ионов
- § 4. Обнаружение [Hg]-ионов
- § 5. Обнаружение Pb-ионов
- § 6. Обзор действия реактивов на катионы пятой аналитической группы
- § 7. Систематический ход анализа смеси катионов пятой аналитической группы
- ГЛАВА IX. АНАЛИЗ СМЕСИ ИОНОВ ВСЕХ ПЯТИ АНАЛИТИЧЕСКИХ ГРУПП
- § 1. Сероводородный метод анализа
- § 2. Недостатки сероводородного метода анализа
- § 3. Ошибки, возникающие при анализе смеси ионов пяти аналитических групп
- § 4. Бессероводородные методы анализа
- ОБНАРУЖЕНИЕ ИНДИВИДУАЛЬНЫХ АНИОНОВ И АНАЛИЗ СМЕСЕЙ АНИОНОВ
- § 1. Аналитическая классификация анионов
- § 2. Групповые реактивы на анионы
- § 3. Классификация методов анализа анионов
- ГЛАВА XI. ПЕРВАЯ АНАЛИТИЧЕСКАЯ ГРУППА АНИОНОВ
- § 1. Характеристика первой группы анионов
- § 2. Реакции анионов первой группы
- § 3. Обнаружение CI-ионов
- § 4. Обнаружение Br-ионов
- § 5. Обнаружение I-ионов
- § 6. Обнаружение CN-ионов
- § 7. Обнаружение SCN-ионов
- § 8. Обнаружение [Fe(CN)]-ионов
- § 9. Обнаружение Fe(CN)-ионов
- § 10. Обнаружение NO-ионов
- § 11. Обнаружение NO2-ионов
- § 12. Обнаружение S-ионов
- § 13. Обнаружение CH3COOO-ионов
- § 14. Обнаружение BrO3-ионов
- § 15. Обнаружение ClO3-ионов
- § 16. Обнаружение ClO4-ионов
- § 17. Обзор действия реактивов на анионы первой группы
- МЕТОДЫ АНАЛИЗА НЕКОТОРЫХ СМЕСЕЙ АНИОНОВ
- § 18. Анализ смеси Cl, Br и I-ионов
- § 19. Анализ смеси Cl, Br, I и SCN-ионов
- § 20. Анализ смеси Cl, ClO3 и ClO4-ионов
- § 21. Анализ смеси NO2 и NO3-ионов
- § 22. Анализ смеси анионов первой группы
- ГЛАВА XII. ВТОРАЯ АНАЛИТИЧЕСКАЯ ГРУППА АНИОНОВ
- § 1. Характеристика второй группы анионов
- § 2. Общие реакции анионов второй группы
- § 3. Обнаружение SO3-ионов
- § 4. Обнаружение S2O3-ионов
- § 5. Обнаружение S2O3 в присутствии SO3-ионов
- § 6. Обнаружение SO4-ионов
- § 7. Обнаружение CO3-ионов
- § 8. Обнаружение CO3-ионов в присутствии SO3 и S2O3-ионов
- § 9. Обнаружение PO4-ионов
- § 10. Обнаружение CrO4-ионов
- § 11. Обнаружение AsO3-ионов
- § 12. Обнаружение AsO4-ионов
- § 13. Обнаружение BO2 и BO3-ионов
- § 14. Обнаружение SiO3-ионов
- § 15. Обнаружение F-ионов
- § 16. Обнаружение C2O4-ионов
- § 17. Обнаружение VO3-ионов
- § 18. Обнаружение MoO4-ионов
- § 19. Обнаружение WO4-ионов
- § 20. Обзор действия реактивов на анионы второй группы
- МЕТОДЫ АНАЛИЗА НЕКОТОРЫХ СМЕСЕЙ АНИОНОВ
- § 21. Анализ смеси ионов
- § 22. Анализ смеси SO3, SO4, S2O3 и CO3-ионов
- § 23. Анализ смеси VO2, MoO4 и WO4-ионов
- § 24. Анализ смеси анионов второй группы
- § 25. Анализ смеси анионов первой и второй групп
- ГЛАВА XIII. ОБНАРУЖЕНИЕ СВОБОДНЫХ МЕТАЛЛОВ И НЕМЕТАЛЛОВ, ИДЕНТИФИЦИРОВАНИЕ СОЛЕЙ И ДРУГИХ ИНДИВИДУАЛЬНЫХ СОЕДИНЕНИЙ И АНАЛИЗ ИХ СМЕСЕЙ
- § 1. Подготовка вещества к анализу
- § 2. Предварительные испытания
- § 3. Растворение анализируемого вещества в воде, кислотах и щелочах
- § 4. Переведение в растворимое состояние веществ, нерастворимых в воде, кислотах и щелочах
- § 5. Анализ неизвестного вещества
- § 6. Обнаружение свободных элементов
- § 7. Идентифицирование солей и других индивидуальных соединений
- § 8. Обнаружение микропримесей
- § 9. Анализ сплавов
- § 10. Анализ силикатов и алюмосиликатов
- § 11. Анализ смеси неорганических веществ
- § 12. Экспрессный метод анализа смесей катионов и анионов
- § 13. Идентифицирование нерастворимых веществ
- ЛИТЕРАТУРА