| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 11. Обнаружение NO2-ионов
Свойства нитритов. Нитриты в кислой среде и сама азотистая кислота обладают свойствами окислителя и восстановителя:

В реакциях с сильными восстановителями ( и др.)
и др.)  проявляет себя как окислитель:
проявляет себя как окислитель:

При взаимодействии с окислителями  нитриты ведут себя как восстановители:
нитриты ведут себя как восстановители:

При нагревании  подвергается реакции диспропорционирования с образованием окиси азота и азотной кислоты:
подвергается реакции диспропорционирования с образованием окиси азота и азотной кислоты:

Следовательно, азотистую кислоту нельзя отделять от азотной кислоты методом термического разложения (кипячением). Как показывает приведенное выше уравнение,  , разлагаясь, частично переходит в азотную кислоту, что может вызвать ошибку при последующем определении
, разлагаясь, частично переходит в азотную кислоту, что может вызвать ошибку при последующем определении  .
.
Соли азотистой кислоты, в отличие от самой азотистой кислоты, являются относительно устойчивыми соединениями. В сухом состоянии некоторые из них плавятся без разложения  , другие
, другие  при нагревании или прокаливании разлагаются:
при нагревании или прокаливании разлагаются:

Нитриты образуют комплексные соединения, например  .
.
Все соли азотистой кислоты растворимы в воде. Наименее растворим нитрит серебра. Анион азотистой кислоты бесцветен; соли неокрашенных катионов тоже бесцветны.
Реакция образования гексанитрокобальта (III) калия  . Поместите в пробирку 5 капель испытуемого раствора, содержащего
. Поместите в пробирку 5 капель испытуемого раствора, содержащего  капель раствора
капель раствора  капли разбавленной уксусной кислоты и 3 капли раствора
капли разбавленной уксусной кислоты и 3 капли раствора  . При этом появляется желтый кристаллический осадок гексанитрокобальтата (III) калия
. При этом появляется желтый кристаллический осадок гексанитрокобальтата (III) калия  (см. гл. IV, § 5).
(см. гл. IV, § 5).  не мешает обнаружению
не мешает обнаружению  .
.
Окисление иодидов. Нитриты окисляют иодиды в кислой среде. Реакция сопровождается выделением элементарного иода:

Если реакцию проводить в присутствии индикатора крахмала, или еще лучше на фильтровальной бумаге, пропитанной крахмалом, то можно обнаружить даже следы нитритов по появлению синего окрашивания.
Эта реакция очень чувствительна. Открываемый минимум —  предельная концентрация —
предельная концентрация —  ; предельное разбавление - 10 000000.
; предельное разбавление - 10 000000.
Поместите на фильтровальную бумагу, предварительно пропитан-  крахмальным раствором, последовательно по 1 капле 2 н. раствора уксусной кислоты, испытуемого раствора и 0,1 н. раствора иодида калия. В присутствии
крахмальным раствором, последовательно по 1 капле 2 н. раствора уксусной кислоты, испытуемого раствора и 0,1 н. раствора иодида калия. В присутствии  появляется синее пятно или кольцо.
появляется синее пятно или кольцо.
Реакции мешают другие окислители, окисляющие иодиды.
Реакция с сульфатом железа (II). В отличие от условий проведения аналогичной реакции (см. § 10) с  кислотность раствора при открытии
кислотность раствора при открытии  должна соответствовать кислотности разбавленного раствора уксусной кислоты. Остальные условия проведения реакции те же, что и при открытии
должна соответствовать кислотности разбавленного раствора уксусной кислоты. Остальные условия проведения реакции те же, что и при открытии  . Реакция применима для открытия нитрит-ионов в присутствии нитрат-ионов, если проводить ее в слабокислой среде.
. Реакция применима для открытия нитрит-ионов в присутствии нитрат-ионов, если проводить ее в слабокислой среде.
Реакция с перманганатом калия. Поместите в пробирку 3—5 капель раствора  капли разбавленной
капли разбавленной  и нагрейте смесь до
и нагрейте смесь до  . Затем добавьте несколько капель раствора
. Затем добавьте несколько капель раствора  или
или  . При этом раствор
. При этом раствор  обесцвечивается, так как в кислой среде происходит окисление
обесцвечивается, так как в кислой среде происходит окисление  до
до  переходит в
переходит в  .
.
Следует придерживаться указанного порядка добавления реактивов, так как подкисленные растворы нитритов быстро разлагается с выделением окислов азота.
Условия проведения реакции.  раствора должен быть немного меньше 7.
раствора должен быть немного меньше 7.
2. Нагревание (не до кипения) благоприятствует течению реакции.
3. Другие восстановители, окисляющиеся перманганатом, мешают обнаружению  .
.
Действие реактива Грисса. Азотистая кислота и ее соли (нитриты) реагируют с ароматическими аминами в кислой среде с образованием диазосоединений. Получаемые при этом соединения при сочетании с каким-либо ароматическим амином образуют азосоединения, отличающиеся интенсивной окраской. На образовании азосоединений основаны весьма чувствительные и характерные реакции на нитрит-ионы.
Для обнаружения очень малых количеств  особенно пригодными являются реактив Грисса, представляющий собой раствор 5 г .
особенно пригодными являются реактив Грисса, представляющий собой раствор 5 г . -фенилендиамина в
-фенилендиамина в  воды, подкисленной серной кислотой, или реактив Грисса — Илосвая, представляющий собой смесь
воды, подкисленной серной кислотой, или реактив Грисса — Илосвая, представляющий собой смесь  двух растворов: раствора 0,5 г сульфаниловой кислоты в
двух растворов: раствора 0,5 г сульфаниловой кислоты в  -ной уксусной кислоты и раствора 0,2 г а-нафтиламина в
-ной уксусной кислоты и раствора 0,2 г а-нафтиламина в  воды и
воды и  -ной уксусной кислоты. Реактив Грисса окрашивает бесцветные растворы, содержащие даже следы нитритов, в коричневый цвет, а реактив Грисса — Илосвая — в красный цвет:
-ной уксусной кислоты. Реактив Грисса окрашивает бесцветные растворы, содержащие даже следы нитритов, в коричневый цвет, а реактив Грисса — Илосвая — в красный цвет:

Реакцию проводят на часовом стекле или на фарфоровой пластинке. Для обнаружения нитритов 2—3 капли испытуемого раствора подкисляют 1—2 каплями уксусной кислоты и затем к подкисленному раствору прибавляют 5 капель свежеприготовленного реактива Грисса или Грисса — Илосвая, перемешивают стеклянной палочкой и дают постоять на холоду некоторое время (не более 5—10 мин). При этом в присутствии  появляется соответственно желто-коричневое или красное окрашивание.
появляется соответственно желто-коричневое или красное окрашивание.
Реакции мешают окислители, окисляющие азотистую кислоту.
Открываемый минимум —  предельная концентрация -
предельная концентрация -  ; предельное разбавление — 5 000 000.
; предельное разбавление — 5 000 000.
Реакция восстановления нитритов цинком. Эта реакция выполняется так же, как описано в § 10 при выполнении восстановления цинком нитратов.
Способы удаления азотистой кислоты и нитритов. Азотистая кислота и ее соли восстанавливаются до элементарного азота при нагревании их с солями аммония (а), мочевиной (б) и некоторыми другими азотсо-держащими соединениями:

Эти реакции широко применяются в качественном анализе для разложения нитритов, мешающих открытию других ионов. Если, однако, эта реакция должна предшествовать открытию  , то нужно иметь в виду, что возможны ошибки. Дело в том, что даже продолжительное кипячение нитритов с мочевиной не приводит к полному их разложению, а, с другой стороны, в кислой среде азотистая кислота, диспропорционируя, превращается в азотную кислоту, что может вызвать ошибку впоследствии, при обнаружении
, то нужно иметь в виду, что возможны ошибки. Дело в том, что даже продолжительное кипячение нитритов с мочевиной не приводит к полному их разложению, а, с другой стороны, в кислой среде азотистая кислота, диспропорционируя, превращается в азотную кислоту, что может вызвать ошибку впоследствии, при обнаружении  .
.
В капельном анализе можно пользоваться более совершенным приемом удаления нитритов, например разложением азотистой кислоты и ее солей азидом натрия:

Лучшим способом разложения нитритов является реакция обменного разложения нитритов с сульфаминовой кислотой:

Удаление нитритов из раствора с помощью азида натрия или сульфаминовой кислоты проводят обычно при кипячении в пробирке или капельным методом (на часовом стекле с одной каплей раствора).
Среда по возможности должна быть нейтральной или слабокислой  Окислители, окисляющие нитрит-ионы в нитрат-ионы, должны отсутствовать, если в дальнейшем необходимо определение нитрат-ионов. Соли тяжелых металлов, образующие с
Окислители, окисляющие нитрит-ионы в нитрат-ионы, должны отсутствовать, если в дальнейшем необходимо определение нитрат-ионов. Соли тяжелых металлов, образующие с  комплексные соединения, следует предварительно отделить.
комплексные соединения, следует предварительно отделить.
Однако надо иметь в виду, что все рекомендуемые методы разложения нитритов посредством солей аммония, мочевины, азида натрия, сульфаминовой кислоты и т. п. страдают весьма существенными недостатками и не всегда приводят к определенным результатам. Все указанные реактивы разлагают нитрит-ионы с образованием нитрат-ионов. Кроме того, избыток реактивов, разлагающих нитриты, разрушает имеющиеся в анализируемом растворе нитраты. Поэтому ни один из этих методов разложения нитритов не может считаться вполне пригодным для удаления нитритов и последующего открытия нитратов.
Б. М. Красовицкий, Л. А. Кочергина, Н. П. Комарь и И. У. Мартынченко разработали новый метод удаления  и количественный метод определения
и количественный метод определения  в растворах, содержащих нитриты.
в растворах, содержащих нитриты.
Метод основан на реакции, протекающей между о-аминоанилидом дифеновой кислоты (нитритон А) и нитрит-ионами. Нитритон А связывает и осаждает нитрит-ионы.
Реакция протекает, по-видимому, в две фазы согласно следующим уравнениям:

Н. П. Комарь и И. У. Мартынченко разработали также метод определения нитрит-ионов в виде бензолсульфанил-о-фенилендиазимида (триазола), образующегося при взаимодействии  с о-аминоаншщ-дом бензолсульфоновой кислоты (нитритоном Б).
с о-аминоаншщ-дом бензолсульфоновой кислоты (нитритоном Б).
Нитритон Б практически полностью осаждает  согласно следующему уравнению реакции:
согласно следующему уравнению реакции:

Количественное удаление  достигается при
достигается при  , лучше всего в пределах
, лучше всего в пределах  . При соотношении 1 г-иона
. При соотношении 1 г-иона  на 1,5 моль нитритона Б полнота осаждения достигается за 10—15 мин.
на 1,5 моль нитритона Б полнота осаждения достигается за 10—15 мин.
Реакция с  -аминоанилидом бензолсульфоновой кислоты (нитритоном Б). Поместите в пробирку 5 капель разбавленного раствора
-аминоанилидом бензолсульфоновой кислоты (нитритоном Б). Поместите в пробирку 5 капель разбавленного раствора  , подкислите его каплей 3 М раствора
, подкислите его каплей 3 М раствора  добавьте несколько капель сернокислого раствора нитритона Б до полного осаждения. Отцентри-фугируйте осадок и, применив какую-либо чувствительную реакцию на
добавьте несколько капель сернокислого раствора нитритона Б до полного осаждения. Отцентри-фугируйте осадок и, применив какую-либо чувствительную реакцию на  (например, реакцию
(например, реакцию  в полноте удаления
в полноте удаления  и анализируемого раствора.
и анализируемого раствора.
Осаждение следует вести при  . Образуемый осадок частично растворяется в кислотах и щелочах, а также в спирте. Нагревание способствует растворению.
. Образуемый осадок частично растворяется в кислотах и щелочах, а также в спирте. Нагревание способствует растворению.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ
- ВВЕДЕНИЕ
- § 1. Анализ и синтез
- § 2. Предмет аналитической химии
- § 3. Развитие аналитической химии
- § 4. Качественный и количественный анализ
- ГЛАВА I. ПРИМЕНЕНИЕ ЗАКОНА ДЕЙСТВИЯ МАСС В АНАЛИТИЧЕСКОЙ ХИМИИ
- § 1. Влияние среды на состояние ионов в растворах
- § 2. Обратимые и необратимые аналитические реакции
- § 3. Направление аналитических реакций; правила обменного разложения
- § 4. Закон действия масс и следствие из него
- § 5. Границы применимости закона действия масс
- § 6. Сильные и слабые электролиты
- § 7. Активность
- § 8. Коэффициент активности и ионная сила
- Б. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ (В ГОМОГЕННЫХ СИСТЕМАХ)
- § 9. Гомогенные и гетерогенные системы
- § 10. Ионное произведение воды
- § 11. Ионы гидроксония
- § 12. Равновесие ионов в водных растворах; понятие о pH
- § 13. Равновесие в водных растворах слабых электролитов
- § 14. Влияние сильных кислот или сильных оснований на степень электролитической диссоциации слабых электролитов
- § 15. Приближенные формулы для расчета [H+] и [OH-] в водных растворах кислот и оснований
- В. РАВНОВЕСИЯ В БУФЕРНЫХ РАСТВОРАХ
- § 16. Буферные растворы
- § 17. Применение буферных растворов в химическом анализе
- Г. РАВНОВЕСИЯ В РАСТВОРАХ ГИДРОЛИЗУЮЩИХСЯ СОЛЕЙ
- § 18. Теоретические основы гидролиза
- § 19. Механизм гидролитического расщепления
- § 20. Подавление и усиление гидролиза солей
- Д. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ТИПИЧНО АМФОТЕРНЫХ ЭЛЕКТРОЛИТОВ
- § 21. Поведение амфотерных гидроокисей в водных растворах
- § 22. Константы электролитической диссоциации амфотерных гидроокисей
- Е. РАВНОВЕСИЯ В СИСТЕМАХ: ОСАДОК-НАСЫЩЕННЫЙ РАСТВОР
- § 23. Осаждение как один из основных методов химического анализа
- § 24. Произведение растворимости
- § 25. Произведение активностей
- § 26. Вычисление растворимости электролитов в воде по величине произведения растворимости
- § 27. Влияние различных факторов на растворимость малорастворимых электролитов
- Ж. ОСНОВЫ ТЕОРИИ ОБРАЗОВАНИЯ И РАЗЛОЖЕНИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИИ, ПРИМЕНЯЕМЫХ В АНАЛИТИЧЕСКОЙ ХИМИИ
- § 28. Характеристика комплексных соединений, имеющих значение в химическом анализе
- § 29. Квантовомеханические представления о строении комплексов
- § 30. Равновесия в растворах комплексных соединений
- § 31. Константы нестойкости комплексов
- § 32. Внутрикомплексные соединения
- § 33. Методы разложения и образования комплексов, применяемых в аналитической химии
- § 34. Применение метода комплексообразования в химическом анализе
- ГЛАВА II. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ, ПРИМЕНЯЕМЫХ В АНАЛИТИЧЕСКОЙ ХИМИИ
- § 1. Окисление—восстановление как один из основных методов химического анализа
- § 2. Направление реакций окисления—восстановления
- § 3. Окислительно-восстановительные потенциалы
- § 4. Зависимость между величинами окислительно-восстановительных потенциалов и условиями, в которых протекают реакции окисления—восстановления
- § 5. Вычисление окислительно-восстановительных потенциалов
- § 6. Вычисление окислительно-восстановительных потенциалов с учетом коэффициентов активности
- ГЛАВА III. ВВЕДЕНИЕ В КАЧЕСТВЕННЫЙ АНАЛИЗ
- § 1. Обнаружение отдельных элементов
- § 2. Анализ мокрым и сухим путем
- § 3. Химические и физические методы качественного анализа
- § 4. Макро-, полумикро- и микрометоды
- § 5. Капельный анализ
- § 6. Микрокристаллоскопический анализ
- § 7. Метод растирания порошков
- § 8. Методы анализа, основанные на нагревании и сплавлении веществ
- § 9. Спектральный качественный анализ
- § 10. Хроматографический метод анализа
- § 11. Кинетические методы анализа
- Б. УСЛОВИЯ ВЫПОЛНЕНИЯ КАЧЕСТВЕННЫХ РЕАКЦИЙ
- § 12. Специфичность и чувствительность реакций
- § 13. Максимальная чувствительность аналитических реактивов
- § 14. Способы повышения чувствительности реакций
- § 15. Маскировка мешающих ионов
- § 16. Определение pH среды
- § 17. Регулирование pH среды в процессе аналитических определений
- В. РЕАКТИВЫ
- § 18. Понятие о химических реактивах
- § 19. Концентрация применяемых реактивов
- § 20. Техника пользования реактивами
- Г. ПОСУДА И ПРИБОРЫ, ПРИМЕНЯЕМЫЕ В КАЧЕСТВЕННОМ АНАЛИЗЕ
- § 21. Химическая посуда
- § 22. Приборы
- Д. АНАЛИТИЧЕСКИЕ ГРУППЫ
- § 23. Дробный и систематический анализ
- § 24. Аналитическая классификация катионов
- § 25. Сводные таблицы действия реактивов на катионы и анионы
- Е. ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА И АНАЛИТИЧЕСКАЯ КЛАССИФИКАЦИЯ ИОНОВ
- § 26. Значение периодического закона в аналитической химии
- § 27. Периодическая система элементов Д. И. Менделеева как классификация атомов по их строению
- § 28. Зависимость некоторых химических свойств элементов от положения их в периодической системе Д. И. Менделеева
- § 29. Растворимость химических соединений в связи с положением элементов в периодической системе Д. И. Менделеева
- § 30. Открытие новых аналитических реакций
- § 31. Аналитические группы и периодическая система элементов Д. И. Менделеева
- ОБНАРУЖЕНИЕ ИНДИВИДУАЛЬНЫХ КАТИОНОВ И АНАЛИЗ СМЕСЕЙ КАТИОНОВ
- § 1. Характеристика первой аналитической группы катионов
- § 2. Общие реакции катионов первой аналитической группы
- РЕАКЦИИ КАТИОНОВ 1-й ПОДГРУППЫ
- § 3. Обнаружение NН-ионов
- § 4. Методы разложения и удаления солей аммония
- § 5. Обнаружение K-ионов
- § 6. Обнаружение Rb-ионов
- § 7. Обнаружение Cs-ионов
- § 8. Анализ смеси катионов первой подгруппы
- РЕАКЦИИ КАТИОНОВ 2-й ПОДГРУППЫ
- § 9. Обнаружение Li-ионов
- § 10. Обнаружение Na-ионов
- § 11. Обнаружение Mg-ионов
- § 12. Обзор действия реактивов на катионы первой аналитической группы
- § 13. Анализ смеси катионов второй подгруппы
- § 14. Анализ смеси ионов
- § 15. Анализ смеси ионов
- ГЛАВА V. ВТОРАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ
- § 1. Характеристика второй аналитической группы катионов
- § 2. Общие реакции катионов второй аналитической группы
- § 3. Обнаружение Ca-ионов
- § 4. Обнаружение Sr-ионов
- § 5. Обнаружение Ba-ионов
- § 6. Обзор действия реактивов на катионы второй аналитической группы
- § 7. Основы теории осаждения катионов второй аналитической группы групповым реактивом—карбонатом аммония
- § 8. Систематический ход анализа смеси катионов первой и второй аналитических групп
- § 9. Систематический ход анализа смеси катионов первой и второй аналитических групп в присутствии ионов
- § 10. Теоретические основы перевода сульфатов катионов второй аналитической группы в карбонаты
- ГЛАВА VI. ТРЕТЬЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ
- § 1. Характеристика третьей аналитической группы катионов
- § 2. Общие реакции катионов третьей аналитической группы
- § 3. Обнаружение Be-ионов
- § 4. Обнаружение Al-ионов
- § 5. Обнаружение ионов титана (IV)
- § 6. Обнаружение Cr-ионов
- § 7. Обнаружение Mn-ионов
- § 8. Обнаружение Fe-ионов
- § 9. Обнаружение Fe-ионов
- § 10. Обнаружение Co-ионов
- § 13. Обнаружение ионов циркония (IV)
- § 14. Обнаружение UO-ионов
- § 15. Обзор действия реактивов на катионы третьей аналитической группы
- § 16. Использование коллоидных систем в химическом анализе
- § 17. Основы теории осаждения катионов третьей аналитической группы групповым реактивом — сульфидом аммония
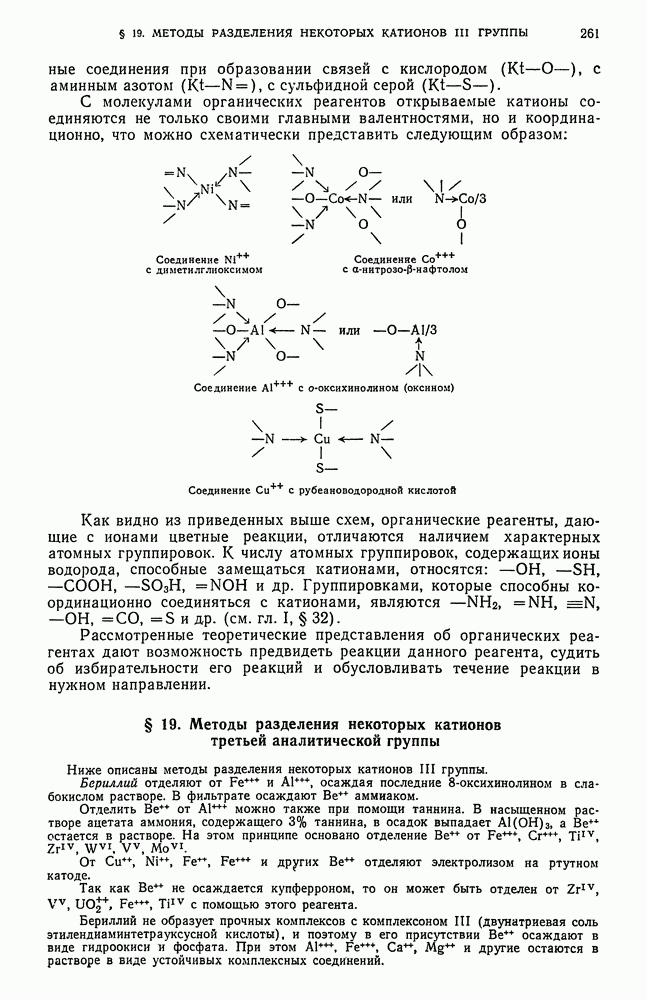
- § 18. Теоретические основы применения органических реактивов в качественном анализе неорганических веществ
- § 19. Методы разделения некоторых катионов третьей аналитической группы
- § 20. Систематический ход анализа смеси катионов третьей аналитической группы
- § 21. Систематический ход анализа смеси катионов первой, второй и третьей аналитических групп
- § 22. Систематический ход анализа смеси катионов первой, второй и третьей аналитических групп в присутствии PO-ионов
- ГЛАВА VII. ЧЕТВЕРТАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ
- § 1. Характеристика четвертой аналитической группы катионов
- § 2. Общие реакции катионов четвертой аналитической группы
- РЕАКЦИИ КАТИОНОВ ПЕРВОЙ ПОДГРУППЫ (ПОДГРУППЫ МЕДИ)
- § 3. Обнаружение Hg-ионов
- § 4. Обнаружение Cu-ионов
- § 5. Обнаружение Cd-ионов
- § 6. Обнаружение Bi-ионов
- РЕАКЦИИ КАТИОНОВ ВТОРОЙ ПОДГРУППЫ (ПОДГРУППЫ МЫШЬЯКА)
- § 7. Обнаружение ионов мышьяка (III)
- § 8. Обнаружение ионов мышьяка (V)
- § 9. Общие реакции обнаружения
- § 10. Обнаружение ионов сурьмы (III)
- § 11. Обнаружение ионов сурьмы (V)
- § 12. Общие реакции обнаружения Sb
- § 13. Обнаружение ионов олова (II)
- § 14. Обнаружение ионов олова (IV)
- § 15. Общие реакции обнаружения ионов олова (II) и олова (IV)
- § 16. Отделение ионов олова от других ирнов четвертой аналитической группы
- § 17. Обнаружение ионов германия (IV)
- § 18. Отделение ионов германия от других ионов четвертой аналитической группы
- § 19. Обзор действия реактивов на катионы четвертой аналитической группы
- § 20. Основы теории осаждения сульфидов катионов четвертой аналитической группы групповым реактивом — сероводородом
- § 21. Систематический ход анализа смеси катионов четвертой аналитической группы
- ГЛАВА VIII. ПЯТАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ (ГРУППА СЕРЕБРА)
- § 1. Характеристика пятой аналитической группы катионов
- § 2. Общие реакции катионов пятой аналитической группы
- § 3. Обнаружение Ag-ионов
- § 4. Обнаружение [Hg]-ионов
- § 5. Обнаружение Pb-ионов
- § 6. Обзор действия реактивов на катионы пятой аналитической группы
- § 7. Систематический ход анализа смеси катионов пятой аналитической группы
- ГЛАВА IX. АНАЛИЗ СМЕСИ ИОНОВ ВСЕХ ПЯТИ АНАЛИТИЧЕСКИХ ГРУПП
- § 1. Сероводородный метод анализа
- § 2. Недостатки сероводородного метода анализа
- § 3. Ошибки, возникающие при анализе смеси ионов пяти аналитических групп
- § 4. Бессероводородные методы анализа
- ОБНАРУЖЕНИЕ ИНДИВИДУАЛЬНЫХ АНИОНОВ И АНАЛИЗ СМЕСЕЙ АНИОНОВ
- § 1. Аналитическая классификация анионов
- § 2. Групповые реактивы на анионы
- § 3. Классификация методов анализа анионов
- ГЛАВА XI. ПЕРВАЯ АНАЛИТИЧЕСКАЯ ГРУППА АНИОНОВ
- § 1. Характеристика первой группы анионов
- § 2. Реакции анионов первой группы
- § 3. Обнаружение CI-ионов
- § 4. Обнаружение Br-ионов
- § 5. Обнаружение I-ионов
- § 6. Обнаружение CN-ионов
- § 7. Обнаружение SCN-ионов
- § 8. Обнаружение [Fe(CN)]-ионов
- § 9. Обнаружение Fe(CN)-ионов
- § 10. Обнаружение NO-ионов
- § 11. Обнаружение NO2-ионов
- § 12. Обнаружение S-ионов
- § 13. Обнаружение CH3COOO-ионов
- § 14. Обнаружение BrO3-ионов
- § 15. Обнаружение ClO3-ионов
- § 16. Обнаружение ClO4-ионов
- § 17. Обзор действия реактивов на анионы первой группы
- МЕТОДЫ АНАЛИЗА НЕКОТОРЫХ СМЕСЕЙ АНИОНОВ
- § 18. Анализ смеси Cl, Br и I-ионов
- § 19. Анализ смеси Cl, Br, I и SCN-ионов
- § 20. Анализ смеси Cl, ClO3 и ClO4-ионов
- § 21. Анализ смеси NO2 и NO3-ионов
- § 22. Анализ смеси анионов первой группы
- ГЛАВА XII. ВТОРАЯ АНАЛИТИЧЕСКАЯ ГРУППА АНИОНОВ
- § 1. Характеристика второй группы анионов
- § 2. Общие реакции анионов второй группы
- § 3. Обнаружение SO3-ионов
- § 4. Обнаружение S2O3-ионов
- § 5. Обнаружение S2O3 в присутствии SO3-ионов
- § 6. Обнаружение SO4-ионов
- § 7. Обнаружение CO3-ионов
- § 8. Обнаружение CO3-ионов в присутствии SO3 и S2O3-ионов
- § 9. Обнаружение PO4-ионов
- § 10. Обнаружение CrO4-ионов
- § 11. Обнаружение AsO3-ионов
- § 12. Обнаружение AsO4-ионов
- § 13. Обнаружение BO2 и BO3-ионов
- § 14. Обнаружение SiO3-ионов
- § 15. Обнаружение F-ионов
- § 16. Обнаружение C2O4-ионов
- § 17. Обнаружение VO3-ионов
- § 18. Обнаружение MoO4-ионов
- § 19. Обнаружение WO4-ионов
- § 20. Обзор действия реактивов на анионы второй группы
- МЕТОДЫ АНАЛИЗА НЕКОТОРЫХ СМЕСЕЙ АНИОНОВ
- § 21. Анализ смеси ионов
- § 22. Анализ смеси SO3, SO4, S2O3 и CO3-ионов
- § 23. Анализ смеси VO2, MoO4 и WO4-ионов
- § 24. Анализ смеси анионов второй группы
- § 25. Анализ смеси анионов первой и второй групп
- ГЛАВА XIII. ОБНАРУЖЕНИЕ СВОБОДНЫХ МЕТАЛЛОВ И НЕМЕТАЛЛОВ, ИДЕНТИФИЦИРОВАНИЕ СОЛЕЙ И ДРУГИХ ИНДИВИДУАЛЬНЫХ СОЕДИНЕНИЙ И АНАЛИЗ ИХ СМЕСЕЙ
- § 1. Подготовка вещества к анализу
- § 2. Предварительные испытания
- § 3. Растворение анализируемого вещества в воде, кислотах и щелочах
- § 4. Переведение в растворимое состояние веществ, нерастворимых в воде, кислотах и щелочах
- § 5. Анализ неизвестного вещества
- § 6. Обнаружение свободных элементов
- § 7. Идентифицирование солей и других индивидуальных соединений
- § 8. Обнаружение микропримесей
- § 9. Анализ сплавов
- § 10. Анализ силикатов и алюмосиликатов
- § 11. Анализ смеси неорганических веществ
- § 12. Экспрессный метод анализа смесей катионов и анионов
- § 13. Идентифицирование нерастворимых веществ
- ЛИТЕРАТУРА