| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 3. Растворение анализируемого вещества в воде, кислотах и щелочах
Определение растворимости проводят с малыми количествами испытуемого вещества. Твердое вещество прежде всего следует растворить в воде (сначала в холодной, потом в горячей). Если вещество полностью в воде не растворяется, то осадок следует отцентрифугировать или отделить с помощью микропипетки (рис. 55). Часть водного экстракта собирают на часовое стекло и выпаривают на водяной бане. Если вещество растворимо хотя бы частично, то после выпаривания на часовом стекле остается остаток.
Затем исследуемое вещество пробуют растворить в разбавленной хлористоводородной кислоте. Если вещество не растворяется в разбавленной кислоте, то его растворяют в концентрированной хлористоводородной кислоте. Так же испытывают отношение веществ к азотной, серной, фтористоводородной (в платиновой или в полиэтиленовой посуде!) и хлорной кислотам, к царской водке, раствору аммиака, едким щелочам, органическим растворителям.
При растворении исследуемого вещества в воде, кислотах и основаниях следует внимательно наблюдать за происходящими явлениями сопутствующими процессам растворения.
Например, действие воды может сопровождаться гидролитическим расщеплением растворяемого вещества. При этом образуются осадки основных солей и гидроокисей, а раствор становится кислым или щелочным.
Действие соляной кислоты часто сопровождается выделением газообразного водорода (что указывает на наличие свободных металлов), газообразного хлора (что указывает на присутствие окислителей).
Действие азотной кислоты вызывает выделение окислов азота (что указывает на присутствие восстановителей) и т. д.
Желательно подобрать такой растворитель, в котором анализируемое вещество растворяется без остатка. Очень часто бывает, что анализируемая смесь частично растворяется в одном растворителе, частично в другом. Например, часть вещества растворяется в воде, часть — в хлористоводородной кислоте, а остаток — в растворе аммиака. В таких случаях пробуют из этих отдельных растворов сделать общую смесь, характеризующуюся кислой реакцией среды. Иногда при смешении вновь образуется осадок, тогда каждую часть исследуемого вещества (растворимую и нерастворимую) анализируют отдельно. Иногда образующийся при смешении осадок не мешает дальнейшему ходу анализа. Например, если смешать водную вытяжку, в которой находятся растворимые в воде соединения (например,  ) с хлористоводородным раствором, в котором содержатся ионы ранее не растворившихся в воде соединений (например,
) с хлористоводородным раствором, в котором содержатся ионы ранее не растворившихся в воде соединений (например,  ), и аммиачный раствор, содержащий, видимо, аммиакаты (например,
), и аммиачный раствор, содержащий, видимо, аммиакаты (например,  ), то в осадок могут выпасть (вследствие нейтрализации аммиака) растворимые в аммиаке соединения (например,
), то в осадок могут выпасть (вследствие нейтрализации аммиака) растворимые в аммиаке соединения (например,  ), которые нисколько не мешают дальнейшему ходу анализа катионов.
), которые нисколько не мешают дальнейшему ходу анализа катионов.
Если все же после рекомендуемой обработки остается нерастворимый остаток, то его анализируют отдельно.
Нерастворимые в воде и кислотах вещества переводят в раствор другими методами (см. § 4).
Растворение солей и других соединений. При растворении соли или другого соединения поступают так, как указано выше. Если предварительно было установлено, что исследуемое вещество частично растворяется в воде, то сначала следует экстрагировать водой всю ту его часть, которая растворима в воде, а затем подвергнуть анализу на катионы и анионы.
Нерастворяющийся остаток обычно затем пробуют растворить в кислотах. При этом в случае частичного растворения анализируемого вещества желательно всякий раз извлекать из него все то, что растворяется в данном растворителе.

Рис. 5. Микропипетки Малярова: 1, 2 - стеклянные трубки; 3 — кружок фильтровальной бумаги; 4 — зажим.
При растворении в кислотах нерастворимых в воде соединений не следует забывать, что некоторые катионы при взаимодействии с хлористоводородной и серной кислотами образуют осадок малорастворимых хлоридов и сульфатов, а при взаимодействии с азотной кислотой могут протекать нежелательные процессы окисления.
Как правило, следует избегать избытка кислот.
Растворение металлов. Металлы (за исключением щелочных металлов,  ) не реагируют с водой и
) не реагируют с водой и  переходят в раствор. Растворение металлов в кислотах обычно сопровождается выделением газообразного водорода, например:
переходят в раствор. Растворение металлов в кислотах обычно сопровождается выделением газообразного водорода, например:

Однако  всегда при растворении металла в кислоте наблюдается выделение водорода. Так, при растворении металлов в азотной кислоте вместо водорода выделяются окислы азота:
всегда при растворении металла в кислоте наблюдается выделение водорода. Так, при растворении металлов в азотной кислоте вместо водорода выделяются окислы азота:

При действии на некоторые металлы концентрированной серной кислоты выделяется двуокигь серы:

Способность металлов вступать во взаимодействие с водой и кислотами с образованием тех или иных продуктов реакций зависит от величин нормальных окислительно-восстановительных потенциалов реагирующих веществ.
Чем ниже нормальный окислительно-восстановительный  , тем легче металл растворяется в воде и кислотах. Рассмотрим, например, ряд окислительно-восстановительных потенциалов:
, тем легче металл растворяется в воде и кислотах. Рассмотрим, например, ряд окислительно-восстановительных потенциалов:

В этом ряду наименьшим окислительно-восстановительным потенциалом обладает кальций  , наивысшим — золото
, наивысшим — золото  . И действительно, кальций растворяется не только в кислотах, но и в воде, а золото не растворяется ни в воде, ни в кислотах. Цинк, потенциал которого отрицательный, но меньше потенциала кальция, уже не растворяется в воде, но растворяется в хлористоводородной, серной и азотной кислотах. Медь и ртуть, окислительно-восстановительные потенциалы которых положительны, не растворяются в хлористоводородной, серной и азотной кислотах с выделением водорода. Это объясняется тем, что ионы водорода не окисляют металлы, обладающие положительным потенциалом. Такие металлы, как Си,
. И действительно, кальций растворяется не только в кислотах, но и в воде, а золото не растворяется ни в воде, ни в кислотах. Цинк, потенциал которого отрицательный, но меньше потенциала кальция, уже не растворяется в воде, но растворяется в хлористоводородной, серной и азотной кислотах. Медь и ртуть, окислительно-восстановительные потенциалы которых положительны, не растворяются в хлористоводородной, серной и азотной кислотах с выделением водорода. Это объясняется тем, что ионы водорода не окисляют металлы, обладающие положительным потенциалом. Такие металлы, как Си,  , окисляясь азотной и серной кислотами, способны восстанавливать их соответственно до окислов азота и двуокиси серы.
, окисляясь азотной и серной кислотами, способны восстанавливать их соответственно до окислов азота и двуокиси серы.
При растворении в азотной и хлорной кислотах сплавов, содержащих сурьму, олово, мышьяк, фосфор, вольфрам, серу и т. п., образуются, соответствующие кислоты, например:

При растворении металлов или сплавов в царской водке образуются хлориды металлов или комплексные соединения. Действие царской водки основано на окислении и комплексообразовании (см. гл. XI, § 10).
Некоторые металлы и неметаллы ( и др.) растворяются в щелочах. Поэтому при анализе некоторые сплавы (например, алюминиевые) растворяют в
и др.) растворяются в щелочах. Поэтому при анализе некоторые сплавы (например, алюминиевые) растворяют в  -ном растворе
-ном растворе  . В раствор переходят алюминий, цинк, олово, кремний; в осадке остаются железо, магний, марганец, медь и другие нерастворимые в щелочах компоненты исследуемых сплавов.
. В раствор переходят алюминий, цинк, олово, кремний; в осадке остаются железо, магний, марганец, медь и другие нерастворимые в щелочах компоненты исследуемых сплавов.
Растворение сплавов. Изучением природы сплавов занимается металлография. Для исследования сплавов в металлографии пользуются термическим анализом, микроскопическим изучением шлифов и рентгеноструктурным анализом. Описание этих методов не входит в задачу курса качественного анализа. Поэтому в дальнейшем речь будет идти лишь о качественном химическом анализе сплавов.
В зависимости от основных элементов, входящих в состав сплавов, их делят на группы (черные, цветные, легкие и т. д.).
Некоторые сплавы можно различить по внешнему виду, как, например, легко отличить чугун от бронзы и баббита. Это значительно облегчает выбор схемы анализа.
Перед химическим анализом сплавы растворяют в кислотах или щелочах или сплавляют с  и др. Сплав измельчают: с помощью сверла получают стружку, с помощью пилы или грубого напильника — опилки; если сплав хрупкий, то его измельчают в стальной ступке. Если сплав не растворяется в серной, хлористоводородной или азотной кислотах, то его обрабатывают царской водкой. Сплавы, содержащие алюминий и цинк, реагируют с едкими щелочами с выделением водорода и образованием цинкатов, алюминатов.
и др. Сплав измельчают: с помощью сверла получают стружку, с помощью пилы или грубого напильника — опилки; если сплав хрупкий, то его измельчают в стальной ступке. Если сплав не растворяется в серной, хлористоводородной или азотной кислотах, то его обрабатывают царской водкой. Сплавы, содержащие алюминий и цинк, реагируют с едкими щелочами с выделением водорода и образованием цинкатов, алюминатов.
При растворении в азотной кислоте сплава, содержащего олово и сурьму, образуются осадки метаоловянной и сурьмяной кислот, которые затем сплавляют с  и углем. При этом сурьма и олово восстанавливаются до металлов, их отделяют, растворяют в
и углем. При этом сурьма и олово восстанавливаются до металлов, их отделяют, растворяют в  и полученные растворы анализируют. Если сплав содержит углерод или графит, то после растворения его в кислоте остается черный остаток. Остаток может также содержать кремневую кислоту.
и полученные растворы анализируют. Если сплав содержит углерод или графит, то после растворения его в кислоте остается черный остаток. Остаток может также содержать кремневую кислоту.
При анализе сплавов главным образом устанавливают, какие металлы входят в его состав; кроме того, проверяют присутствие в сплаве углерода, кремния, фосфора, мышьяка и т. п. Для этого образец сплава растворяют в окислительной среде и тем самым переводят углерод в  и т. п., т. е. в соединения, которые легко обнаружить с помощью качественных реакций.
и т. п., т. е. в соединения, которые легко обнаружить с помощью качественных реакций.
Лучшими растворителями сплавов являются серная и азотная кислоты вследствие того, что при растворении в них металлов образуются нелетучие соединения; кроме того, в указанных кислотах растворяются и такие металлы, которые не реагируют с хлористоводородной кислотой.
Растворение ведут под тягой. Перед концом растворения смесь нагревают (лучше всего на водяной бане, чтобы не было перегрева). Полученный раствор выпаривают почти досуха, затем разбавляют водой и далее анализируют обычными способами. Если при растворении сплава образуется нерастворимый осадок, то его отфильтровывают и анализируют отдельно.
Иногда для ускорения растворения металла в серной кислоте к ней добавляют концентрированную перекись водорода (пергидроль).
Если сплав растворяют в щелочи, то при этом в раствор полностью переходят алюминий и цинк и частично другие металлы. Смесь разбавляют водой и фильтруют. Нерастворившийся остаток после тщательного промывания горячей водой растворяют в кислотах. Щелочной и кислый растворы анализируют раздельно.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ
- ВВЕДЕНИЕ
- § 1. Анализ и синтез
- § 2. Предмет аналитической химии
- § 3. Развитие аналитической химии
- § 4. Качественный и количественный анализ
- ГЛАВА I. ПРИМЕНЕНИЕ ЗАКОНА ДЕЙСТВИЯ МАСС В АНАЛИТИЧЕСКОЙ ХИМИИ
- § 1. Влияние среды на состояние ионов в растворах
- § 2. Обратимые и необратимые аналитические реакции
- § 3. Направление аналитических реакций; правила обменного разложения
- § 4. Закон действия масс и следствие из него
- § 5. Границы применимости закона действия масс
- § 6. Сильные и слабые электролиты
- § 7. Активность
- § 8. Коэффициент активности и ионная сила
- Б. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ (В ГОМОГЕННЫХ СИСТЕМАХ)
- § 9. Гомогенные и гетерогенные системы
- § 10. Ионное произведение воды
- § 11. Ионы гидроксония
- § 12. Равновесие ионов в водных растворах; понятие о pH
- § 13. Равновесие в водных растворах слабых электролитов
- § 14. Влияние сильных кислот или сильных оснований на степень электролитической диссоциации слабых электролитов
- § 15. Приближенные формулы для расчета [H+] и [OH-] в водных растворах кислот и оснований
- В. РАВНОВЕСИЯ В БУФЕРНЫХ РАСТВОРАХ
- § 16. Буферные растворы
- § 17. Применение буферных растворов в химическом анализе
- Г. РАВНОВЕСИЯ В РАСТВОРАХ ГИДРОЛИЗУЮЩИХСЯ СОЛЕЙ
- § 18. Теоретические основы гидролиза
- § 19. Механизм гидролитического расщепления
- § 20. Подавление и усиление гидролиза солей
- Д. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ТИПИЧНО АМФОТЕРНЫХ ЭЛЕКТРОЛИТОВ
- § 21. Поведение амфотерных гидроокисей в водных растворах
- § 22. Константы электролитической диссоциации амфотерных гидроокисей
- Е. РАВНОВЕСИЯ В СИСТЕМАХ: ОСАДОК-НАСЫЩЕННЫЙ РАСТВОР
- § 23. Осаждение как один из основных методов химического анализа
- § 24. Произведение растворимости
- § 25. Произведение активностей
- § 26. Вычисление растворимости электролитов в воде по величине произведения растворимости
- § 27. Влияние различных факторов на растворимость малорастворимых электролитов
- Ж. ОСНОВЫ ТЕОРИИ ОБРАЗОВАНИЯ И РАЗЛОЖЕНИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИИ, ПРИМЕНЯЕМЫХ В АНАЛИТИЧЕСКОЙ ХИМИИ
- § 28. Характеристика комплексных соединений, имеющих значение в химическом анализе
- § 29. Квантовомеханические представления о строении комплексов
- § 30. Равновесия в растворах комплексных соединений
- § 31. Константы нестойкости комплексов
- § 32. Внутрикомплексные соединения
- § 33. Методы разложения и образования комплексов, применяемых в аналитической химии
- § 34. Применение метода комплексообразования в химическом анализе
- ГЛАВА II. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ, ПРИМЕНЯЕМЫХ В АНАЛИТИЧЕСКОЙ ХИМИИ
- § 1. Окисление—восстановление как один из основных методов химического анализа
- § 2. Направление реакций окисления—восстановления
- § 3. Окислительно-восстановительные потенциалы
- § 4. Зависимость между величинами окислительно-восстановительных потенциалов и условиями, в которых протекают реакции окисления—восстановления
- § 5. Вычисление окислительно-восстановительных потенциалов
- § 6. Вычисление окислительно-восстановительных потенциалов с учетом коэффициентов активности
- ГЛАВА III. ВВЕДЕНИЕ В КАЧЕСТВЕННЫЙ АНАЛИЗ
- § 1. Обнаружение отдельных элементов
- § 2. Анализ мокрым и сухим путем
- § 3. Химические и физические методы качественного анализа
- § 4. Макро-, полумикро- и микрометоды
- § 5. Капельный анализ
- § 6. Микрокристаллоскопический анализ
- § 7. Метод растирания порошков
- § 8. Методы анализа, основанные на нагревании и сплавлении веществ
- § 9. Спектральный качественный анализ
- § 10. Хроматографический метод анализа
- § 11. Кинетические методы анализа
- Б. УСЛОВИЯ ВЫПОЛНЕНИЯ КАЧЕСТВЕННЫХ РЕАКЦИЙ
- § 12. Специфичность и чувствительность реакций
- § 13. Максимальная чувствительность аналитических реактивов
- § 14. Способы повышения чувствительности реакций
- § 15. Маскировка мешающих ионов
- § 16. Определение pH среды
- § 17. Регулирование pH среды в процессе аналитических определений
- В. РЕАКТИВЫ
- § 18. Понятие о химических реактивах
- § 19. Концентрация применяемых реактивов
- § 20. Техника пользования реактивами
- Г. ПОСУДА И ПРИБОРЫ, ПРИМЕНЯЕМЫЕ В КАЧЕСТВЕННОМ АНАЛИЗЕ
- § 21. Химическая посуда
- § 22. Приборы
- Д. АНАЛИТИЧЕСКИЕ ГРУППЫ
- § 23. Дробный и систематический анализ
- § 24. Аналитическая классификация катионов
- § 25. Сводные таблицы действия реактивов на катионы и анионы
- Е. ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА И АНАЛИТИЧЕСКАЯ КЛАССИФИКАЦИЯ ИОНОВ
- § 26. Значение периодического закона в аналитической химии
- § 27. Периодическая система элементов Д. И. Менделеева как классификация атомов по их строению
- § 28. Зависимость некоторых химических свойств элементов от положения их в периодической системе Д. И. Менделеева
- § 29. Растворимость химических соединений в связи с положением элементов в периодической системе Д. И. Менделеева
- § 30. Открытие новых аналитических реакций
- § 31. Аналитические группы и периодическая система элементов Д. И. Менделеева
- ОБНАРУЖЕНИЕ ИНДИВИДУАЛЬНЫХ КАТИОНОВ И АНАЛИЗ СМЕСЕЙ КАТИОНОВ
- § 1. Характеристика первой аналитической группы катионов
- § 2. Общие реакции катионов первой аналитической группы
- РЕАКЦИИ КАТИОНОВ 1-й ПОДГРУППЫ
- § 3. Обнаружение NН-ионов
- § 4. Методы разложения и удаления солей аммония
- § 5. Обнаружение K-ионов
- § 6. Обнаружение Rb-ионов
- § 7. Обнаружение Cs-ионов
- § 8. Анализ смеси катионов первой подгруппы
- РЕАКЦИИ КАТИОНОВ 2-й ПОДГРУППЫ
- § 9. Обнаружение Li-ионов
- § 10. Обнаружение Na-ионов
- § 11. Обнаружение Mg-ионов
- § 12. Обзор действия реактивов на катионы первой аналитической группы
- § 13. Анализ смеси катионов второй подгруппы
- § 14. Анализ смеси ионов
- § 15. Анализ смеси ионов
- ГЛАВА V. ВТОРАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ
- § 1. Характеристика второй аналитической группы катионов
- § 2. Общие реакции катионов второй аналитической группы
- § 3. Обнаружение Ca-ионов
- § 4. Обнаружение Sr-ионов
- § 5. Обнаружение Ba-ионов
- § 6. Обзор действия реактивов на катионы второй аналитической группы
- § 7. Основы теории осаждения катионов второй аналитической группы групповым реактивом—карбонатом аммония
- § 8. Систематический ход анализа смеси катионов первой и второй аналитических групп
- § 9. Систематический ход анализа смеси катионов первой и второй аналитических групп в присутствии ионов
- § 10. Теоретические основы перевода сульфатов катионов второй аналитической группы в карбонаты
- ГЛАВА VI. ТРЕТЬЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ
- § 1. Характеристика третьей аналитической группы катионов
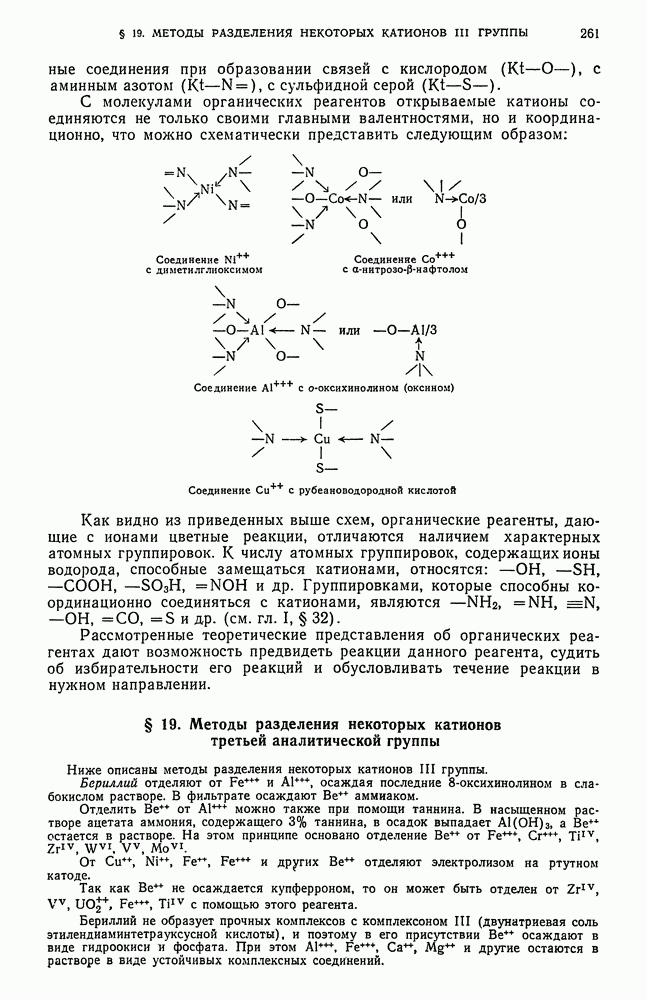
- § 2. Общие реакции катионов третьей аналитической группы
- § 3. Обнаружение Be-ионов
- § 4. Обнаружение Al-ионов
- § 5. Обнаружение ионов титана (IV)
- § 6. Обнаружение Cr-ионов
- § 7. Обнаружение Mn-ионов
- § 8. Обнаружение Fe-ионов
- § 9. Обнаружение Fe-ионов
- § 10. Обнаружение Co-ионов
- § 13. Обнаружение ионов циркония (IV)
- § 14. Обнаружение UO-ионов
- § 15. Обзор действия реактивов на катионы третьей аналитической группы
- § 16. Использование коллоидных систем в химическом анализе
- § 17. Основы теории осаждения катионов третьей аналитической группы групповым реактивом — сульфидом аммония
- § 18. Теоретические основы применения органических реактивов в качественном анализе неорганических веществ
- § 19. Методы разделения некоторых катионов третьей аналитической группы
- § 20. Систематический ход анализа смеси катионов третьей аналитической группы
- § 21. Систематический ход анализа смеси катионов первой, второй и третьей аналитических групп
- § 22. Систематический ход анализа смеси катионов первой, второй и третьей аналитических групп в присутствии PO-ионов
- ГЛАВА VII. ЧЕТВЕРТАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ
- § 1. Характеристика четвертой аналитической группы катионов
- § 2. Общие реакции катионов четвертой аналитической группы
- РЕАКЦИИ КАТИОНОВ ПЕРВОЙ ПОДГРУППЫ (ПОДГРУППЫ МЕДИ)
- § 3. Обнаружение Hg-ионов
- § 4. Обнаружение Cu-ионов
- § 5. Обнаружение Cd-ионов
- § 6. Обнаружение Bi-ионов
- РЕАКЦИИ КАТИОНОВ ВТОРОЙ ПОДГРУППЫ (ПОДГРУППЫ МЫШЬЯКА)
- § 7. Обнаружение ионов мышьяка (III)
- § 8. Обнаружение ионов мышьяка (V)
- § 9. Общие реакции обнаружения
- § 10. Обнаружение ионов сурьмы (III)
- § 11. Обнаружение ионов сурьмы (V)
- § 12. Общие реакции обнаружения Sb
- § 13. Обнаружение ионов олова (II)
- § 14. Обнаружение ионов олова (IV)
- § 15. Общие реакции обнаружения ионов олова (II) и олова (IV)
- § 16. Отделение ионов олова от других ирнов четвертой аналитической группы
- § 17. Обнаружение ионов германия (IV)
- § 18. Отделение ионов германия от других ионов четвертой аналитической группы
- § 19. Обзор действия реактивов на катионы четвертой аналитической группы
- § 20. Основы теории осаждения сульфидов катионов четвертой аналитической группы групповым реактивом — сероводородом
- § 21. Систематический ход анализа смеси катионов четвертой аналитической группы
- ГЛАВА VIII. ПЯТАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ (ГРУППА СЕРЕБРА)
- § 1. Характеристика пятой аналитической группы катионов
- § 2. Общие реакции катионов пятой аналитической группы
- § 3. Обнаружение Ag-ионов
- § 4. Обнаружение [Hg]-ионов
- § 5. Обнаружение Pb-ионов
- § 6. Обзор действия реактивов на катионы пятой аналитической группы
- § 7. Систематический ход анализа смеси катионов пятой аналитической группы
- ГЛАВА IX. АНАЛИЗ СМЕСИ ИОНОВ ВСЕХ ПЯТИ АНАЛИТИЧЕСКИХ ГРУПП
- § 1. Сероводородный метод анализа
- § 2. Недостатки сероводородного метода анализа
- § 3. Ошибки, возникающие при анализе смеси ионов пяти аналитических групп
- § 4. Бессероводородные методы анализа
- ОБНАРУЖЕНИЕ ИНДИВИДУАЛЬНЫХ АНИОНОВ И АНАЛИЗ СМЕСЕЙ АНИОНОВ
- § 1. Аналитическая классификация анионов
- § 2. Групповые реактивы на анионы
- § 3. Классификация методов анализа анионов
- ГЛАВА XI. ПЕРВАЯ АНАЛИТИЧЕСКАЯ ГРУППА АНИОНОВ
- § 1. Характеристика первой группы анионов
- § 2. Реакции анионов первой группы
- § 3. Обнаружение CI-ионов
- § 4. Обнаружение Br-ионов
- § 5. Обнаружение I-ионов
- § 6. Обнаружение CN-ионов
- § 7. Обнаружение SCN-ионов
- § 8. Обнаружение [Fe(CN)]-ионов
- § 9. Обнаружение Fe(CN)-ионов
- § 10. Обнаружение NO-ионов
- § 11. Обнаружение NO2-ионов
- § 12. Обнаружение S-ионов
- § 13. Обнаружение CH3COOO-ионов
- § 14. Обнаружение BrO3-ионов
- § 15. Обнаружение ClO3-ионов
- § 16. Обнаружение ClO4-ионов
- § 17. Обзор действия реактивов на анионы первой группы
- МЕТОДЫ АНАЛИЗА НЕКОТОРЫХ СМЕСЕЙ АНИОНОВ
- § 18. Анализ смеси Cl, Br и I-ионов
- § 19. Анализ смеси Cl, Br, I и SCN-ионов
- § 20. Анализ смеси Cl, ClO3 и ClO4-ионов
- § 21. Анализ смеси NO2 и NO3-ионов
- § 22. Анализ смеси анионов первой группы
- ГЛАВА XII. ВТОРАЯ АНАЛИТИЧЕСКАЯ ГРУППА АНИОНОВ
- § 1. Характеристика второй группы анионов
- § 2. Общие реакции анионов второй группы
- § 3. Обнаружение SO3-ионов
- § 4. Обнаружение S2O3-ионов
- § 5. Обнаружение S2O3 в присутствии SO3-ионов
- § 6. Обнаружение SO4-ионов
- § 7. Обнаружение CO3-ионов
- § 8. Обнаружение CO3-ионов в присутствии SO3 и S2O3-ионов
- § 9. Обнаружение PO4-ионов
- § 10. Обнаружение CrO4-ионов
- § 11. Обнаружение AsO3-ионов
- § 12. Обнаружение AsO4-ионов
- § 13. Обнаружение BO2 и BO3-ионов
- § 14. Обнаружение SiO3-ионов
- § 15. Обнаружение F-ионов
- § 16. Обнаружение C2O4-ионов
- § 17. Обнаружение VO3-ионов
- § 18. Обнаружение MoO4-ионов
- § 19. Обнаружение WO4-ионов
- § 20. Обзор действия реактивов на анионы второй группы
- МЕТОДЫ АНАЛИЗА НЕКОТОРЫХ СМЕСЕЙ АНИОНОВ
- § 21. Анализ смеси ионов
- § 22. Анализ смеси SO3, SO4, S2O3 и CO3-ионов
- § 23. Анализ смеси VO2, MoO4 и WO4-ионов
- § 24. Анализ смеси анионов второй группы
- § 25. Анализ смеси анионов первой и второй групп
- ГЛАВА XIII. ОБНАРУЖЕНИЕ СВОБОДНЫХ МЕТАЛЛОВ И НЕМЕТАЛЛОВ, ИДЕНТИФИЦИРОВАНИЕ СОЛЕЙ И ДРУГИХ ИНДИВИДУАЛЬНЫХ СОЕДИНЕНИЙ И АНАЛИЗ ИХ СМЕСЕЙ
- § 1. Подготовка вещества к анализу
- § 2. Предварительные испытания
- § 3. Растворение анализируемого вещества в воде, кислотах и щелочах
- § 4. Переведение в растворимое состояние веществ, нерастворимых в воде, кислотах и щелочах
- § 5. Анализ неизвестного вещества
- § 6. Обнаружение свободных элементов
- § 7. Идентифицирование солей и других индивидуальных соединений
- § 8. Обнаружение микропримесей
- § 9. Анализ сплавов
- § 10. Анализ силикатов и алюмосиликатов
- § 11. Анализ смеси неорганических веществ
- § 12. Экспрессный метод анализа смесей катионов и анионов
- § 13. Идентифицирование нерастворимых веществ
- ЛИТЕРАТУРА