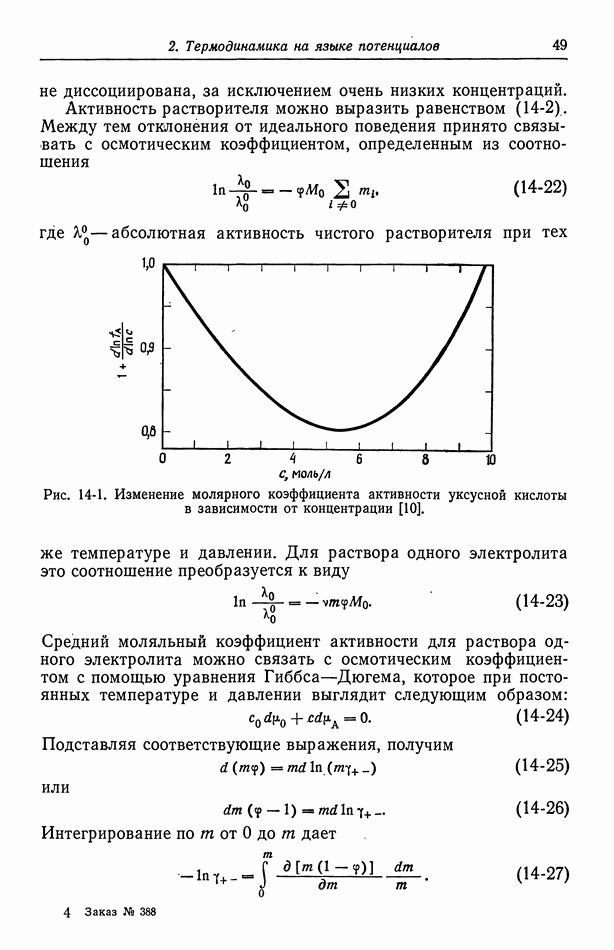
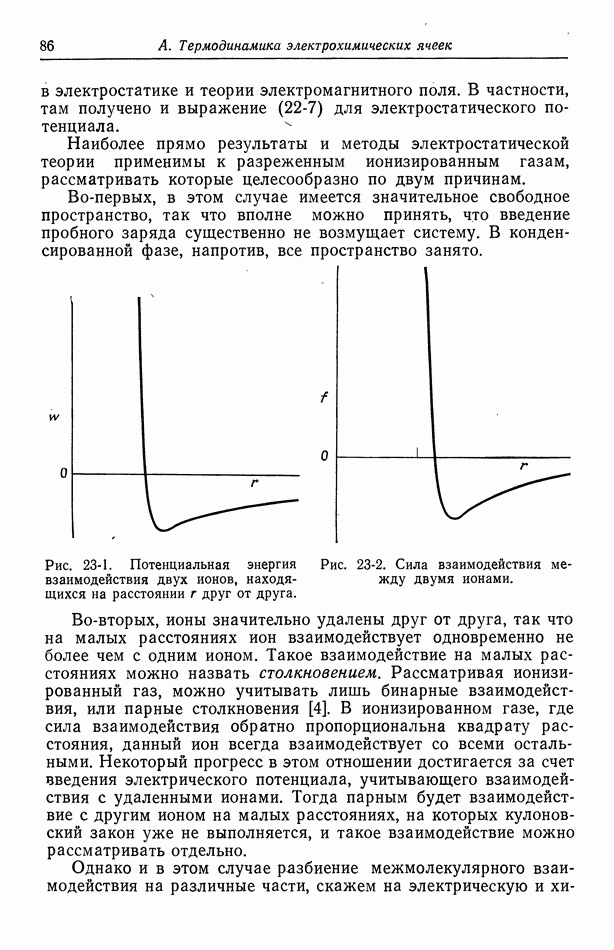
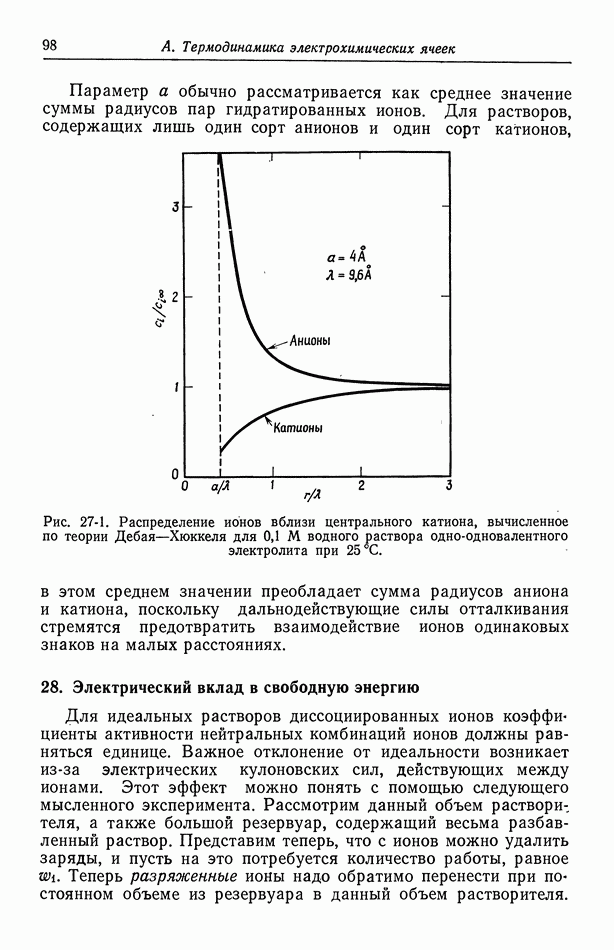
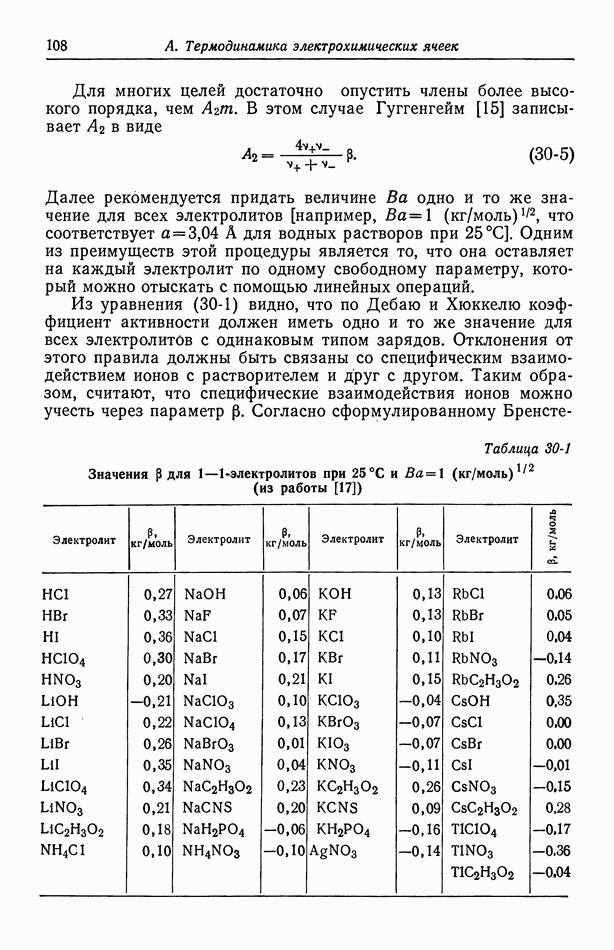
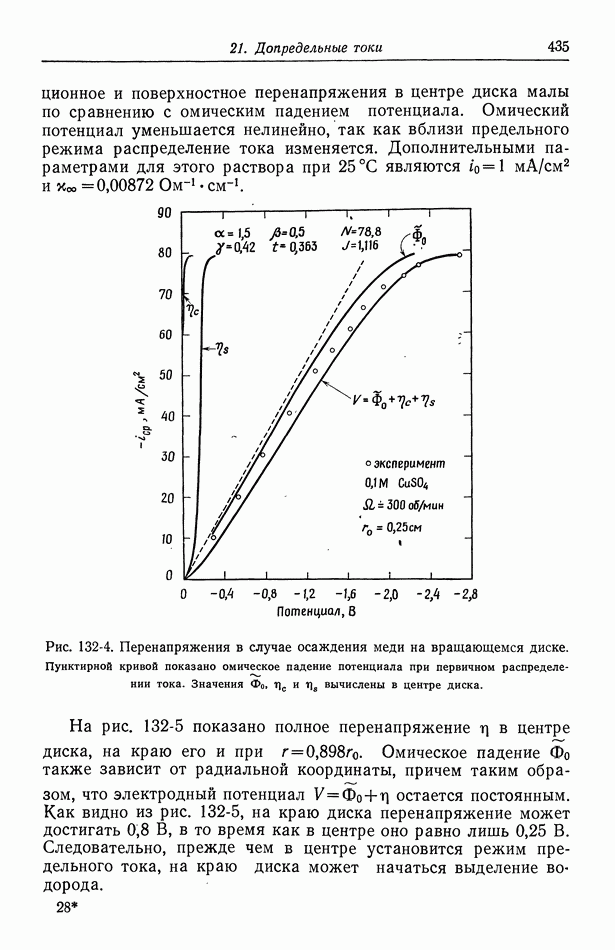
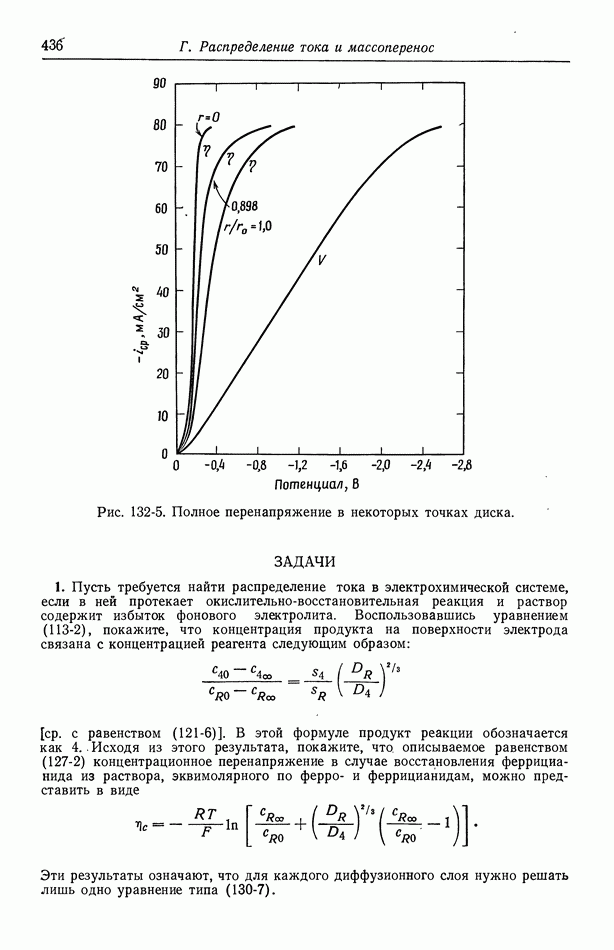
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
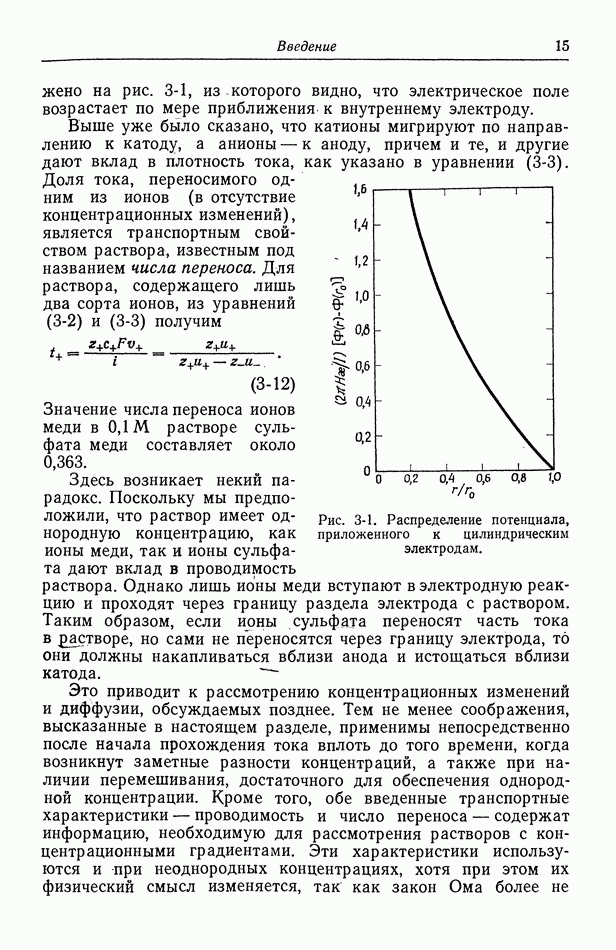
15. Ячейка с раствором однородной концентрации
Считается, что ячейки, обсуждаемые в данном разделе, содержат раствор одного электролита с концентрацией, однородной по всей ячейке. В большинстве руководств по физической химии, электрохимии или термодинамике проводится различие между ячейками без переноса и ячейками с переносом, в зависимости от того, имеются ли концентрационные градиенты в растворе электролита. Как мы увидим, это разделение несколько субъективно, за исключением простейших случаев. Скорее такое деление зависит от того, хотим ли мы игнорировать существующие концентрационные градиенты.
Примером ячейки с одним и тем же раствором является ячейка с двумя электродами из одинакового металла, погруженными в один и тот же раствор соли металла, из которого сделаны электроды. Для определенности рассмотрим ячейку

Фазовое равновесие между несколькими фазами описывается уравнением (12-5), например

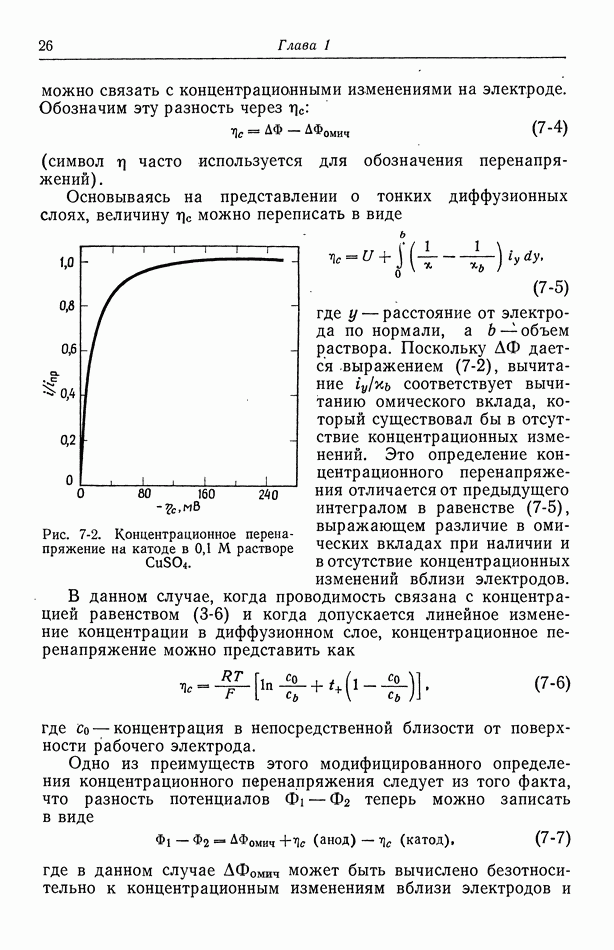
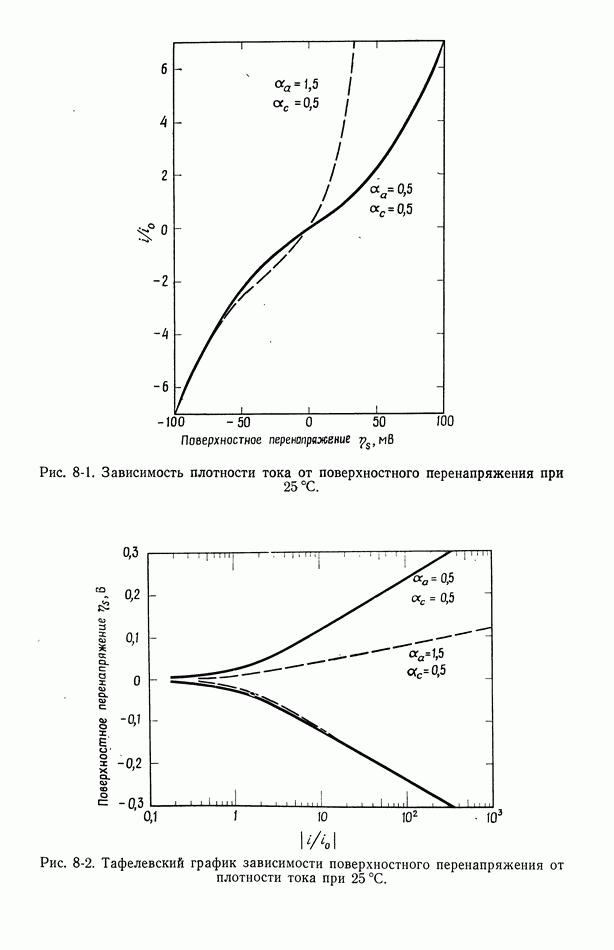
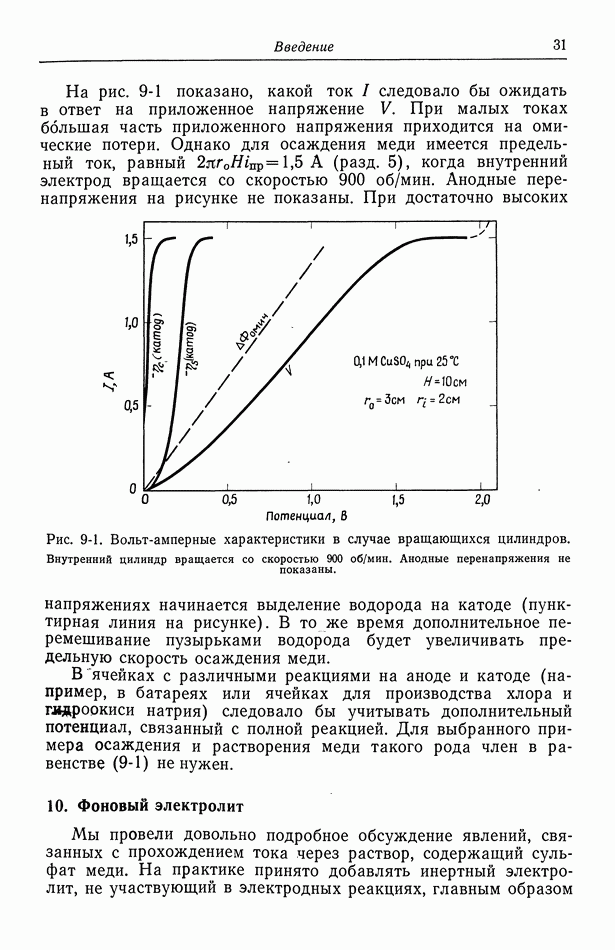
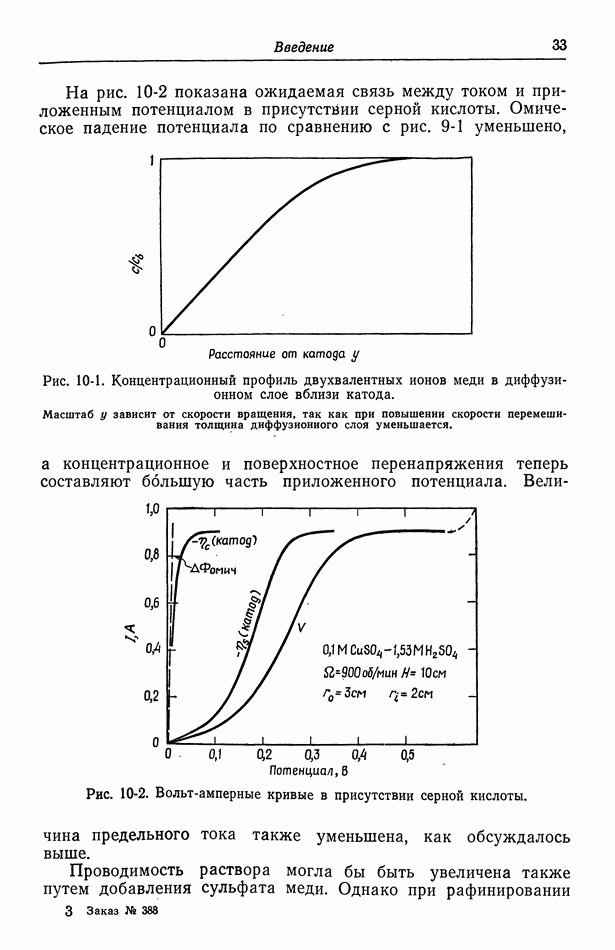
Аналогично ионы меди находятся в равновесии между раствором  и электродом
и электродом  а электроны — в равновесии между электродом
а электроны — в равновесии между электродом  и платиновым проводником а.
и платиновым проводником а.
Потенциал ячейки  связан с разностью электрических потенциалов между а и
связан с разностью электрических потенциалов между а и  а также с разностью электрохимических потенциалов электронов в этих проводниках соотношениями
а также с разностью электрохимических потенциалов электронов в этих проводниках соотношениями

(в настоящей главе  будет обозначать потенциал правого электрода относительно левого). Ввиду условий фазового равновесия это можно переписать в виде
будет обозначать потенциал правого электрода относительно левого). Ввиду условий фазового равновесия это можно переписать в виде

С помощью уравнения (12-3) потенциал ячейки можно выразить через химические потенциалы меди в обоих электродах:

Если электроды одинаковы, то потенциал ячейки будет равен нулю. Если же один из электродов выполнен из сплава меди с другим металлом, то получится ненулевой потенциал. Здесь предполагается, что единственным следствием введения инородного металла является изменение химического потенциала меди в этом электроде; инородный металл должен лишь незначительно растворяться в электролите, замещая ионы меди.
Вот следующая ячейка этого типа:

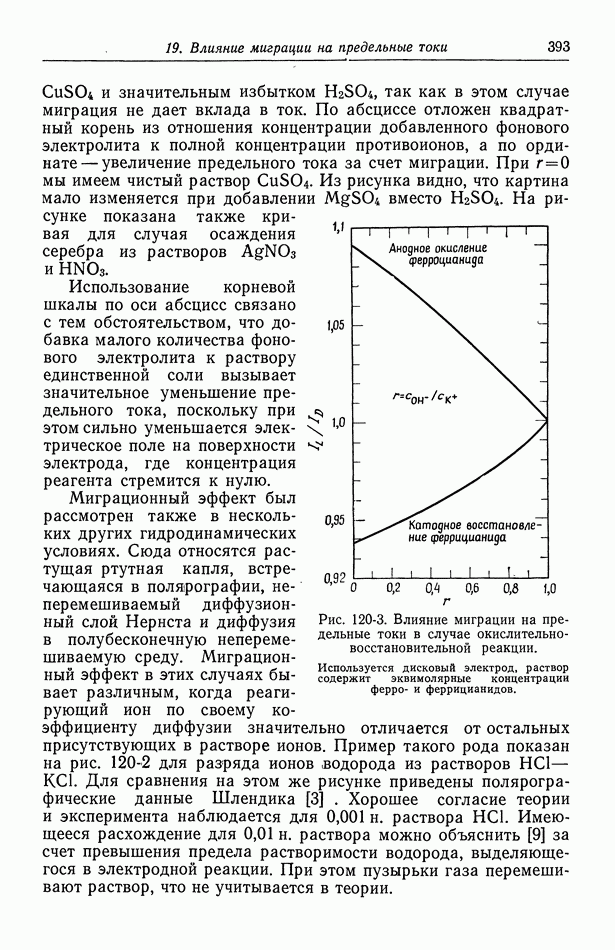
в которой  амальгама свинца. С помощью аналогичного анализа получаем потенциал ячейки:
амальгама свинца. С помощью аналогичного анализа получаем потенциал ячейки:

Такая ячейка дает возможность определить термодинамические свойства амальгамы свинца в зависимости от состава амальгамы, что является наиболее распространенным применением системы этого типа.
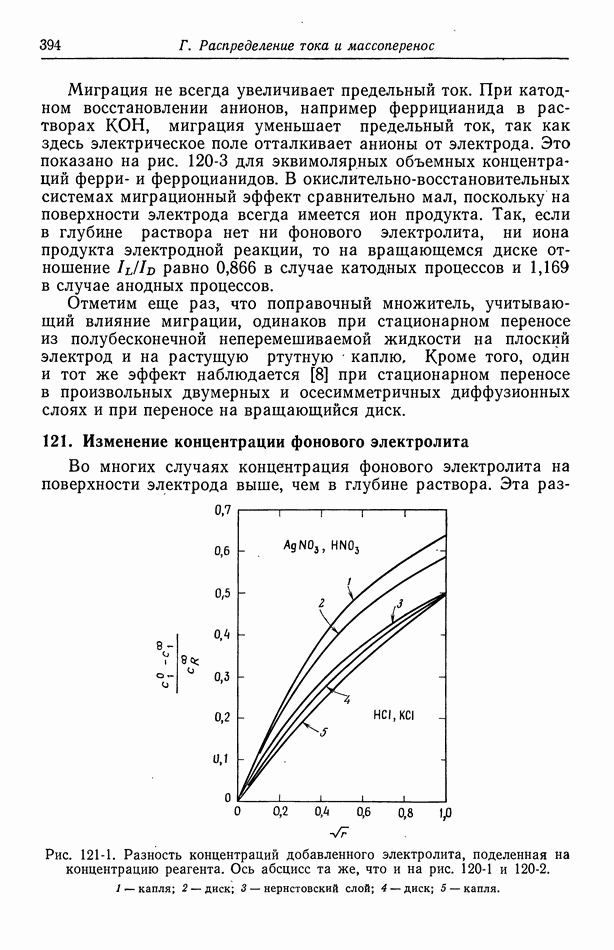
Приведенные выше ячейки действительно имеют однородную концентрацию, и их термодинамические свойства и электрические потенциалы связаны уравнением (15-6) или (15-8). Описанная в разд. 12 ячейка обычно рассматривается как имеющая всюду один и тот же электролит. Особой системой является

где раствором электролита служит раствор хлорида лития в диметилсульфоксиде  слабо растворяется в
слабо растворяется в  амальгама таллия.
амальгама таллия.
Для электрода справа равновесия между фазами  можно представить в виде
можно представить в виде

Далее, как обычно, выразим потенциал ячейки через электрохимические потенциалы электронов в проводниках, используем условия фазового равновесия, сопоставив их с условиями в растворах вблизи электродов, и, наконец, составим из электрохимических потенциалов заряженных компонентов химические потенциалы нейтральных компонентов всюду, где это возможно. В результате получим

Таким образом, потенциал ячейки связан с термодинамическими
свойствами нейтрального компонента, хотя фазовые равновесия выражались с помощью заряженных компонентов. Это будет всегда справедливо для ячеек, которые допускают чисто термодинамическое рассмотрение. Измерение потенциала приведенной ячейки можно использовать для изучения термодинамических свойств растворов хлорида лития в диметилсульфоксиде.
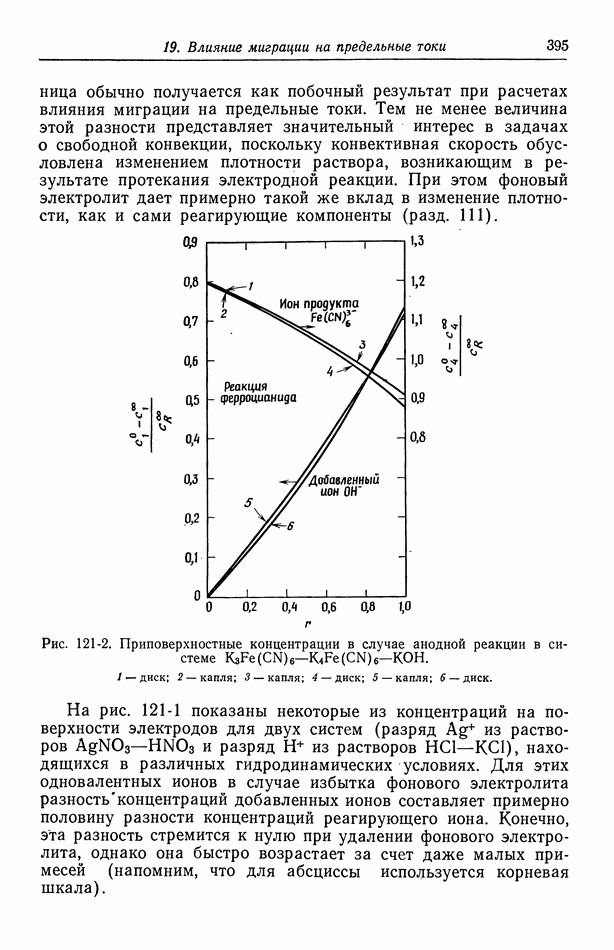
Из предшествующего рассмотрения может показаться, что предположение об однородном составе здесь выполняется. Однако известно, что в растворе будет присутствовать хлорид таллия, хотя и в малых количествах. Наличие этого дополнительного электролита изменяет химический потенциал в непосредственной близости от электрода амальгама таллия — хлорид таллия. Нельзя, конечно, допускать, чтобы хлорид таллия насытил весь раствор, поскольку он будет спонтанно реагировать с металлическим литием. Следовательно, возникнет градиент концентрации  и электрохимического потенциала иона хлора, так что уже нельзя считать, что оба электрода контактируют с одним и тем же раствором электролита. Эту картину можно представить в виде
и электрохимического потенциала иона хлора, так что уже нельзя считать, что оба электрода контактируют с одним и тем же раствором электролита. Эту картину можно представить в виде

Здесь фаза  отличается от фазы
отличается от фазы  благодаря растворенному
благодаря растворенному  причем эти фазы соединены контактной или переходной областью, в которой концентрация хлорида таллия изменяется от точки к точке.
причем эти фазы соединены контактной или переходной областью, в которой концентрация хлорида таллия изменяется от точки к точке.
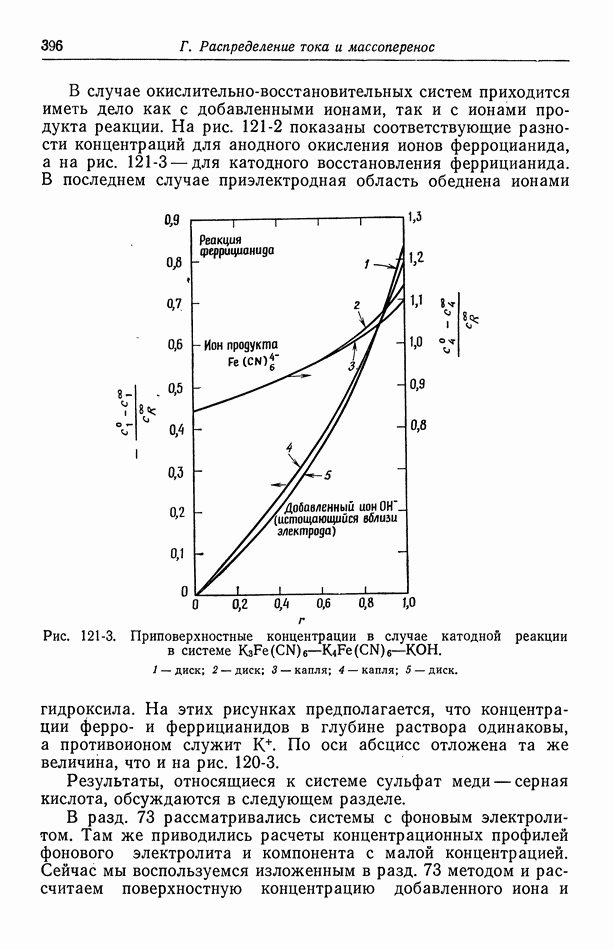
Теперь можно записать равновесия между фазами 

Раствор  фактически способствует равновесию между амальгамой
фактически способствует равновесию между амальгамой  и твердой солью
и твердой солью  Вместо равенства (15-11) мы имеем
Вместо равенства (15-11) мы имеем

Мы видим, что это равенство совпадает с равенством (15-11), если бы можно было пренебречь разностью электрохимических потенциалов иона хлора в растворах вблизи обоих электродов. Одна лишь термодинамика не позволяет вычислить эту разность, так как в области контакта происходит необратимый процесс диффузии и эту область необходимо рассматривать на основе законов переноса в растворах электролитов. В соответствии с обсуждением, проводимым в следующем разделе, в этой системе при отсутствии тока градиент электрохимического потенциала ионов хлора можно выразить через характеристики соли:

где — число переноса компонента  в неподвижном растворителе. Из этого равенства видно, что чем менее растворима соль (в данном случае
в неподвижном растворителе. Из этого равенства видно, что чем менее растворима соль (в данном случае  тем меньше величина
тем меньше величина  и тем ближе к однородному составу раствор. При этом равенство (15-14) можно с хорошей точностью заменить на (15-11).
и тем ближе к однородному составу раствор. При этом равенство (15-14) можно с хорошей точностью заменить на (15-11).
Целью настоящего раздела было проиллюстрировать применение условий фазового равновесия, описанных в разд. 12, к типичным системам, содержащим однородный по всей ячейке раствор электролита. В первых двух исследованных случаях термодинамические свойства раствора не влияют на потенциал ячейки. Ячейка, рассмотренная в третьем примере, может использоваться для изучения термодинамических свойств раствора электролита, хотя, строго говоря, эта ячейка не относится к настоящему разделу. Ошибки, возникающие при пренебрежении концентрационными градиентами в таких ячейках, будут оценены в разд. 18.
Результаты предыдущих примеров можно применять к ячейкам с двумя (или более) электролитами в растворе однородной концентрации при выполнении следующих условий:
1. Второй электролит изменяет термодинамические свойства первого электролита в растворе, но не реагирует с ним и не образует осадка или газа, а также не реагирует самопроизвольно с электродами.
2. Второй электролит не участвует в фазовых равновесиях, а изменяет лишь термодинамические свойства раствора.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- Глава 1. ВВЕДЕНИЕ
- 1. Термодинамика, кинетика электродных процессов и процессы переноса
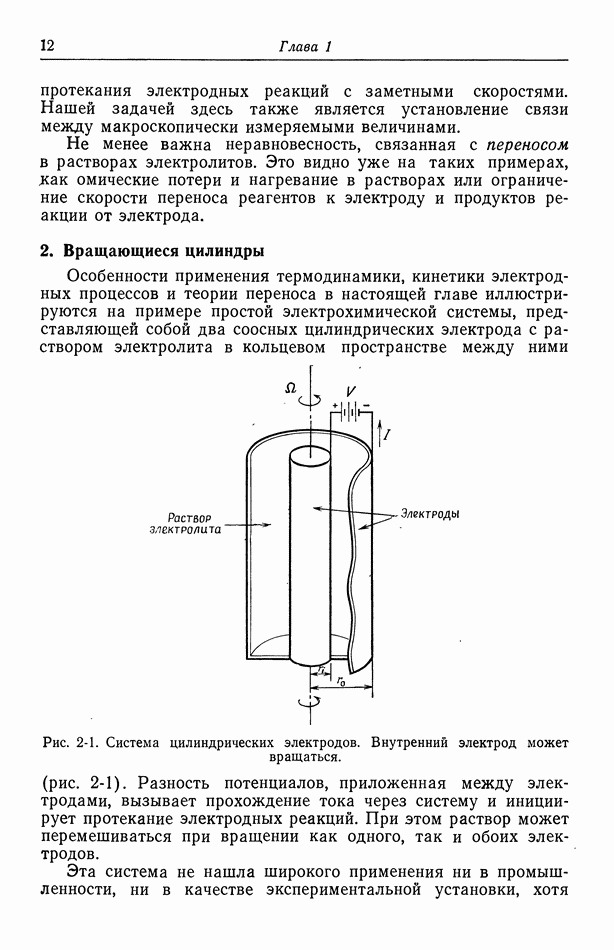
- 2. Вращающиеся цилиндры
- 3. Прохождение тока в электролитах
- 4. Течение жидкости
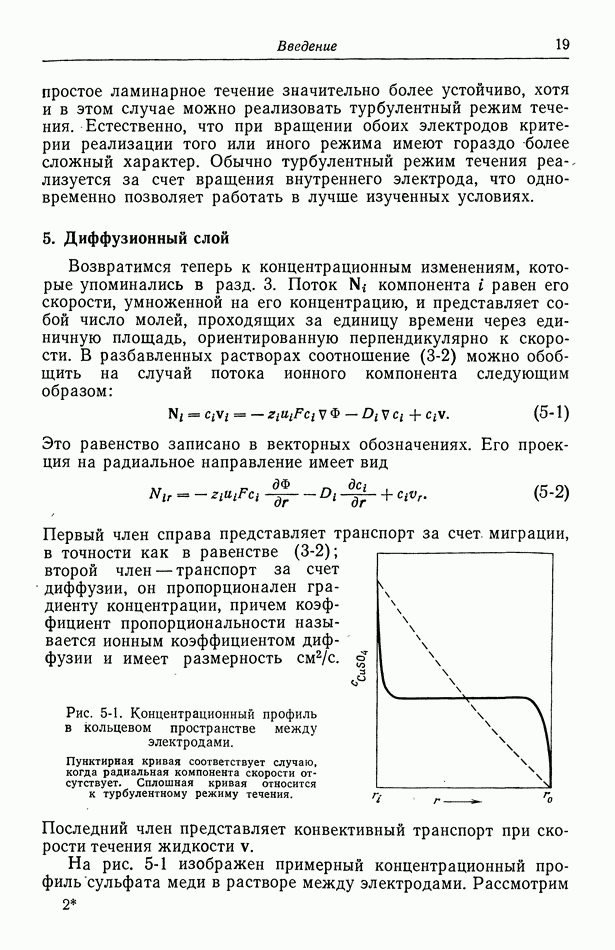
- 5. Диффузионный слой
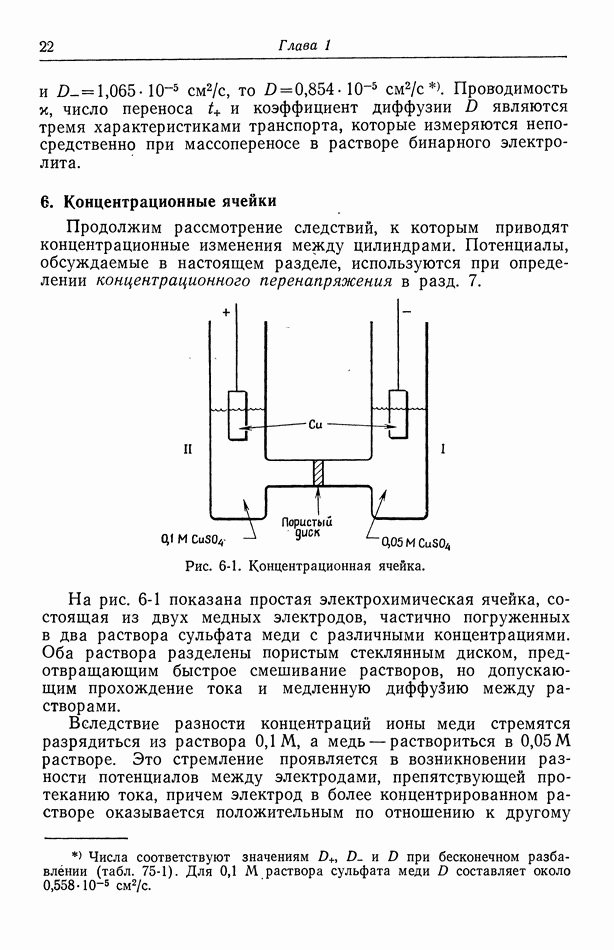
- 6. Концентрационные ячейки
- 7. Концентрационное перенапряжение
- 8. Поверхностное перенапряжение
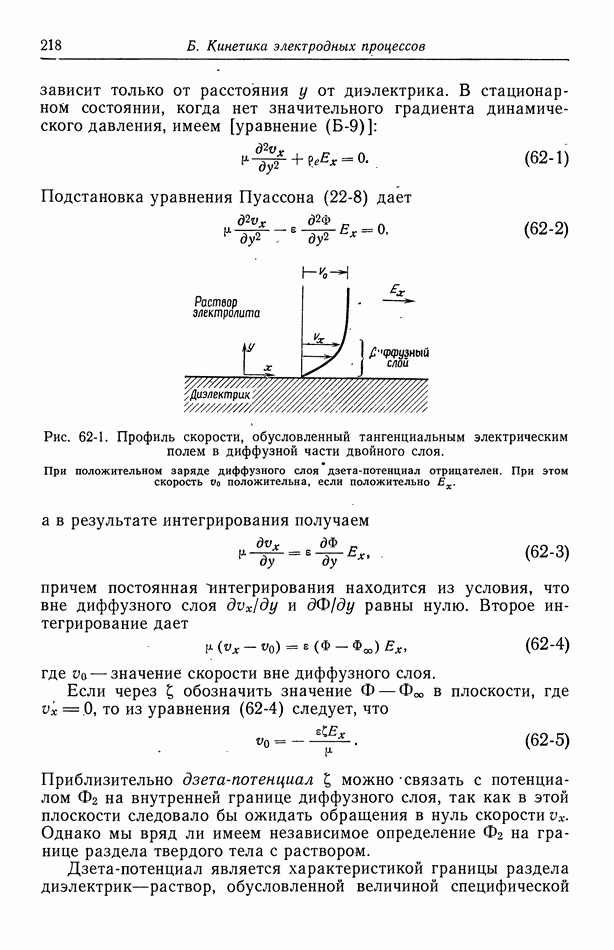
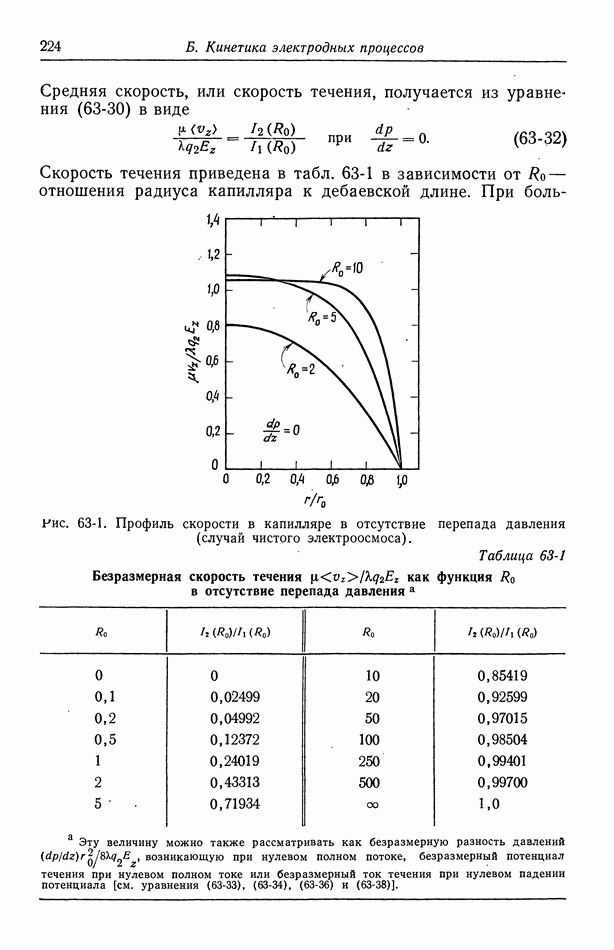
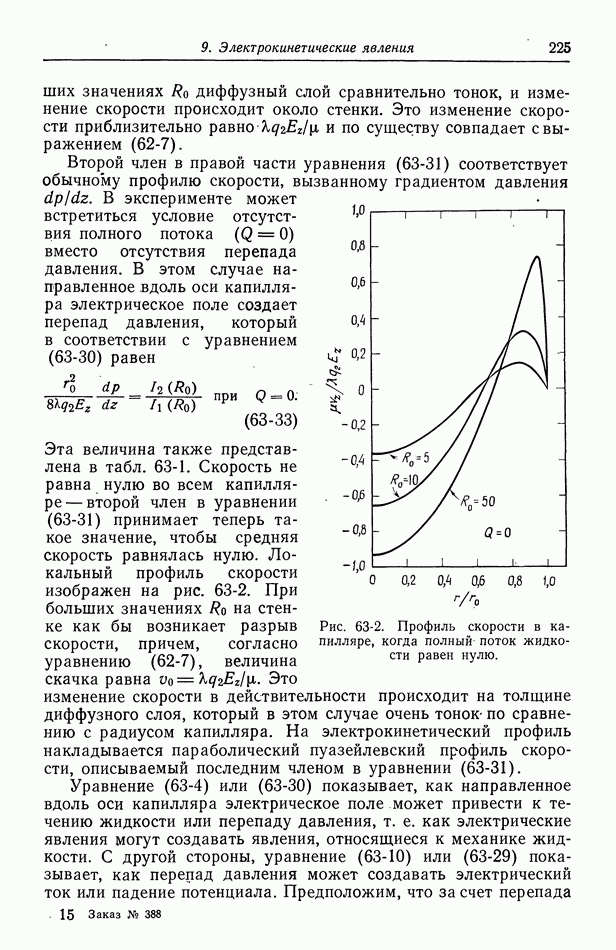
- 9. Потенциал ячейки
- 10. Фоновый электролит
- 11. Свободная конвекция
- Часть А. ТЕРМОДИНАМИКА ЭЛЕКТРОХИМИЧЕСКИХ ЯЧЕЕК
- Глава 2. ТЕРМОДИНАМИКА НА ЯЗЫКЕ ЭЛЕКТРОХИМИЧЕСКИХ ПОТЕНЦИАЛОВ
- 12. Равновесие фаз
- 13. Химический и электрохимический потенциалы
- 14. Определение некоторых термодинамических функций
- 15. Ячейка с раствором однородной концентрации
- 16. Процессы переноса в областях контакта
- 17. Ячейка с одним электролитом переменной концентрации
- 18. Ячейка с двумя электролитами, концентрация одного из которых почти однородна
- 19. Ячейка с двумя электролитами переменной концентрации
- 20. Стандартный потенциал ячейки и коэффициенты активности
- Глава 3. ЭЛЕКТРИЧЕСКИЙ ПОТЕНЦИАЛ
- 22. Электростатический потенциал
- 23. Межмолекулярные силы
- 24. Внешний и внутренний потенциалы
- 25. Потенциалы электродов сравнения
- 26. Электрический потенциал в термодинамике
- Глава 4. КОЭФФИЦИЕНТЫ АКТИВНОСТИ
- 27. Распределение ионов в разбавленных растворах
- 28. Электрический вклад в свободную энергию
- 29. Недостатки модели Дебая-Хюккеля
- 30. Растворы бинарных электролитов
- 31. Многокомпонентные растворы
- 32. Измерение коэффициентов активности
- 33. Слабые электролиты
- Глава 5. ЭЛЕКТРОДЫ СРАВНЕНИЯ
- 34. Критерии выбора электродов сравнения
- 35. Экспериментальные факторы, влияющие на выбор электродов сравнения
- 36. Водородный электрод
- 37. Каломельный электрод и другие электроды типа ртуть—соль ртути
- 38. Окиснортутный электрод
- 39. Электроды типа серебро—галогенид серебра
- 40. Потенциалы относительно данного электрода сравнения
- Глава 6. ПОТЕНЦИАЛЫ ЯЧЕЕК С ПЕРЕНОСОМ
- 41. Уравнение Нернста
- 42. Типы жидкостных соединений
- 43. Формулы для потенциалов жидкостных соединений
- 44. Определение концентрационных профилей
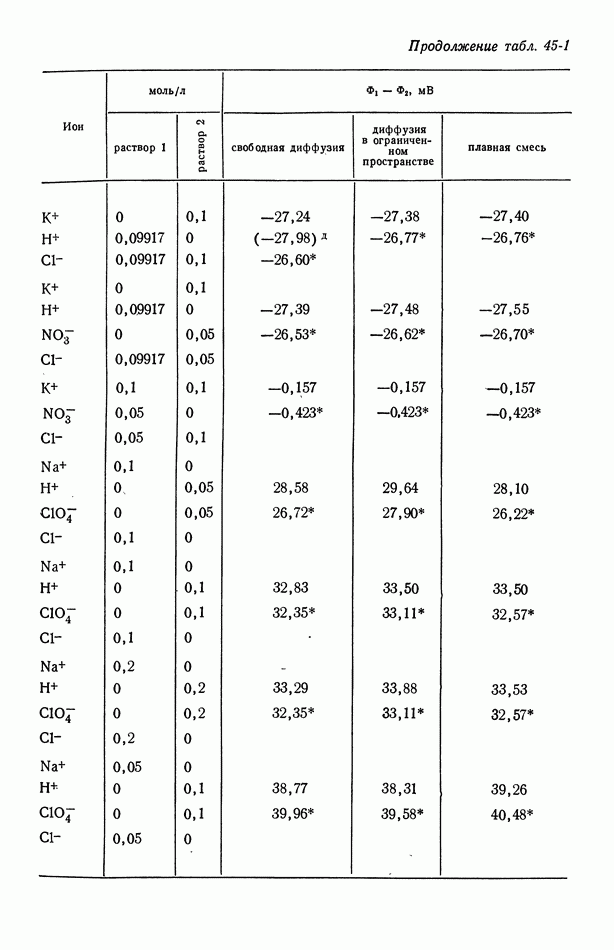
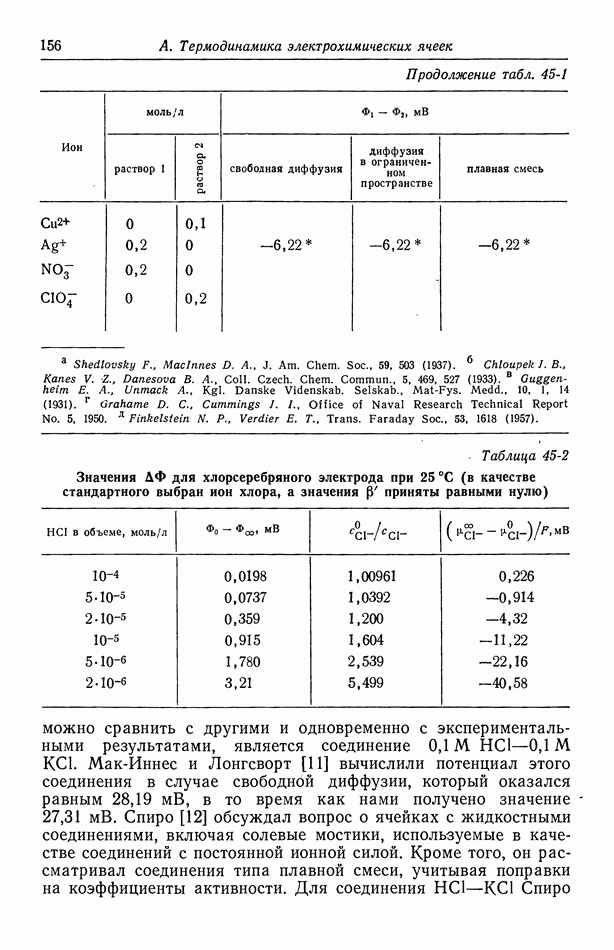
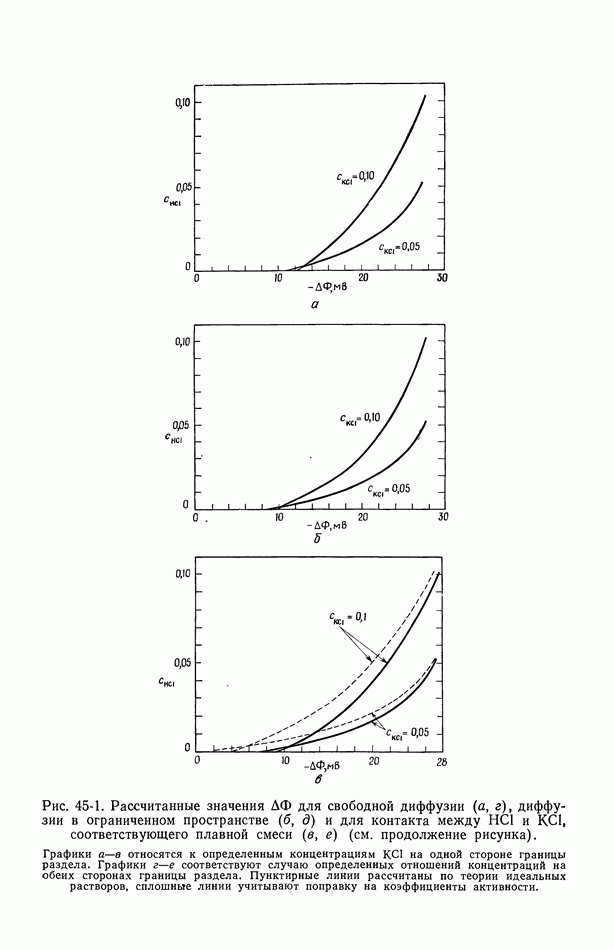
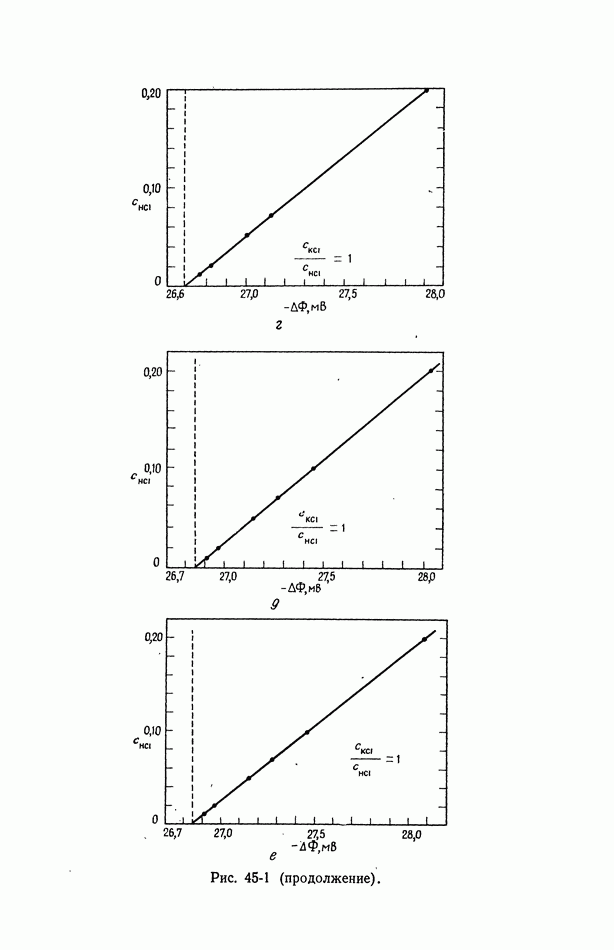
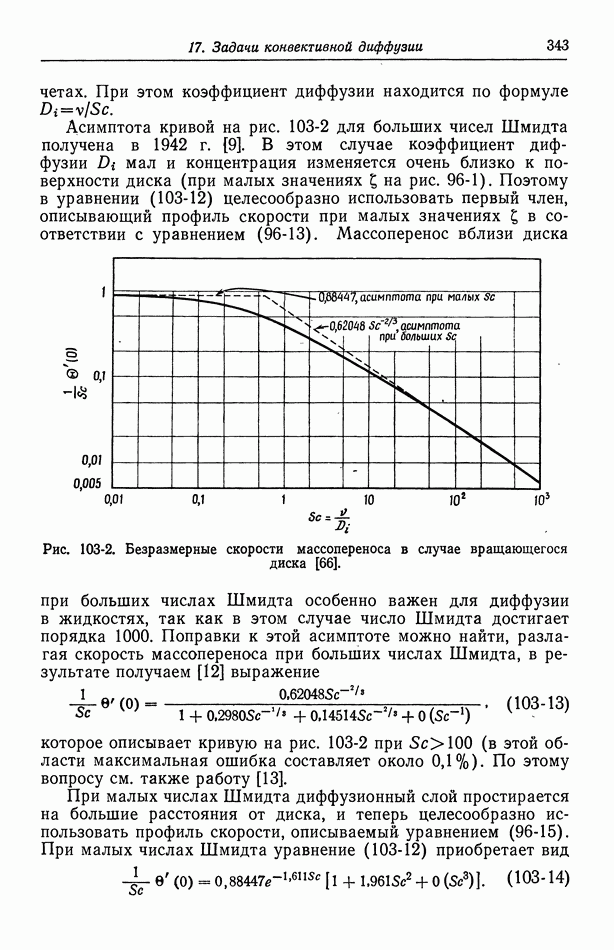
- 45. Численные результаты
- 46. Ячейки с жидкостным соединением
- 47. Поправки к уравнению Нернста
- 48. Мембранные потенциалы
- Часть Б. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ И ДРУГИЕ ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
- Глава 7. СТРОЕНИЕ ЭЛЕКТРИЧЕСКОГО ДВОЙНОГО СЛОЯ
- 50. Изотерма адсорбции Гиббса
- 51. Уравнение Липпмана
- 52. Диффузная часть двойного слоя
- 53. Емкость двойного слоя в отсутствие специфической адсорбции
- 54. Специфическая адсорбция на границе раздела электрод—раствор
- Глава 8. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ
- 55. Гетерогенные электродные реакции
- 56. Зависимость плотности тока от поверхностного перенапряжения
- 57. Модели в кинетике электродных процессов
- 58. Влияние строения двойного слоя
- 59. Кислородный электрод
- 60. Методы измерения
- 61. Одновременно протекающие реакции
- Глава 9. ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ
- 62. Разрывная скорость на границе раздела
- 63. Электроосмос и потенциал течения
- 64. Электрофорез
- 65. Потенциал осаждения
- Глава 10. ЭЛЕКТРОКАПИЛЛЯРНЫЕ ЯВЛЕНИЯ
- 67. Электрокапиллярное движение ртутных капель
- 68. Потенциалы осаждения для падающих ртутных капель
- Часть В. ПРОЦЕССЫ ПЕРЕНОСА В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- Глава 11. БЕСКОНЕЧНО РАЗБАВЛЕННЫЕ РАСТВОРЫ
- 70. Проводимость, диффузионные потенциалы и числа переноса
- 71. Сохранение заряда
- 72. Бинарный электролит
- 73. Фоновый электролит
- 74. Многокомпонентная диффузия, возникающая при исключении электрического поля
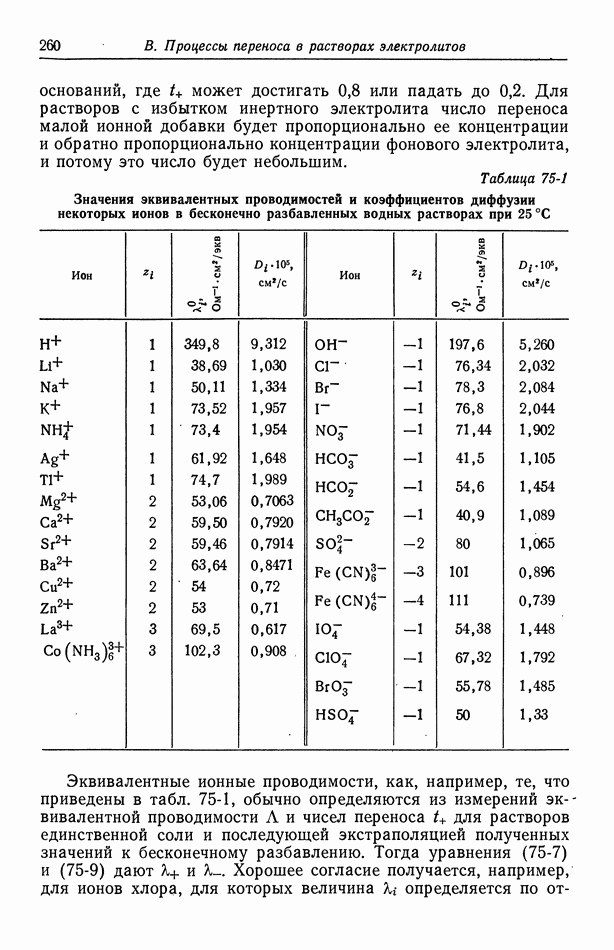
- 75. Подвижности и коэффициенты диффузии
- 76. Электронейтральность и уравнение Лапласа
- 77. Умеренно разбавленные растворы
- Глава 12. КОНЦЕНТРИРОВАННЫЕ РАСТВОРЫ
- 79. Бинарный электролит
- 80. Стандартные скорости
- 81. Потенциал
- 82. Связь с теорией разбавленных растворов
- 83. Многокомпонентный транспорт
- 84. Потенциалы жидкостного соединения
- Глава 13. ТЕПЛОВЫЕ ЭФФЕКТЫ
- 85. Термодиффузия
- 86. Выделение и перенос тепла
- 87. Тепловыделение на границе раздела фаз
- 88. Термогальванические ячейки
- Глава 14. ХАРАКТЕРИСТИКИ ПЕРЕНОСА
- 89. Бесконечно разбавленные растворы
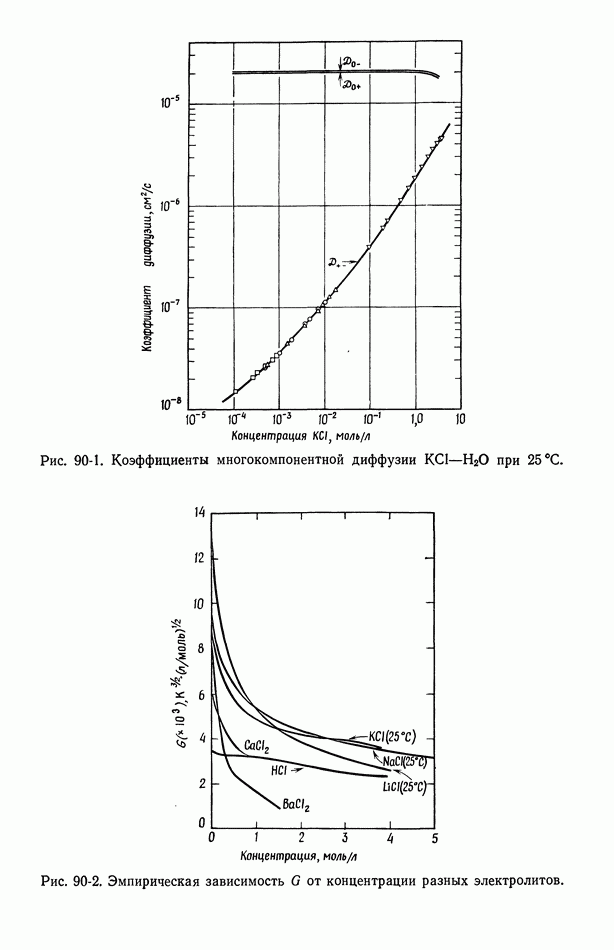
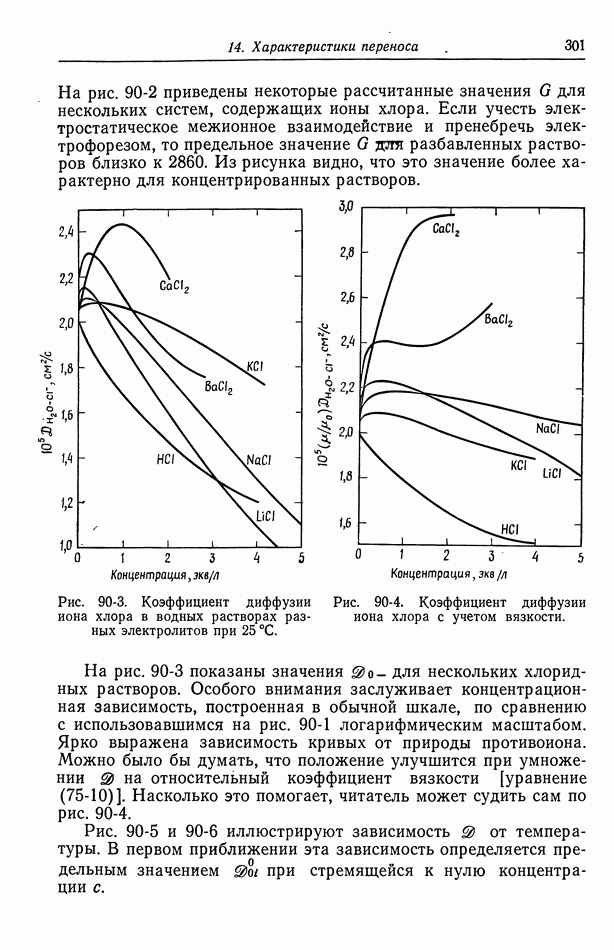
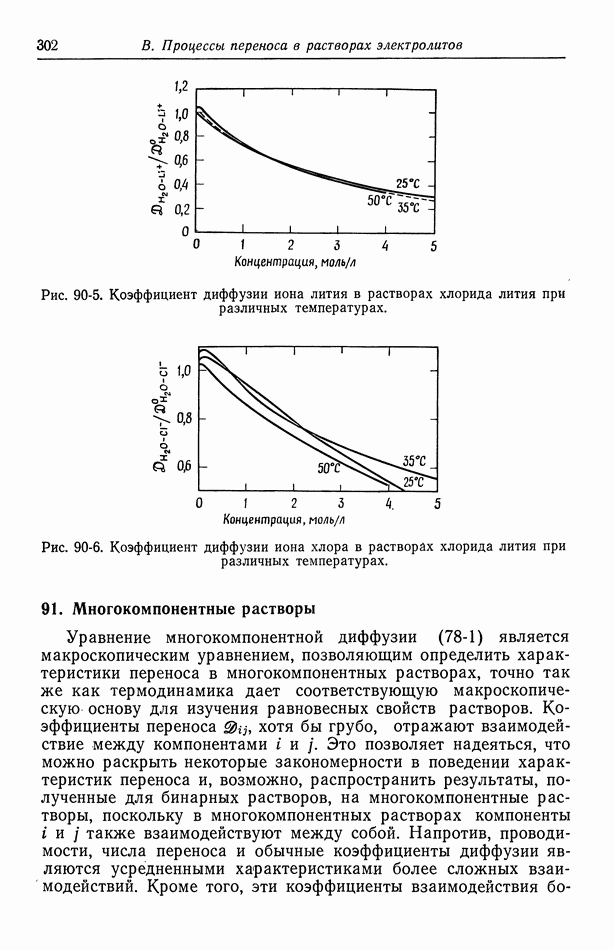
- 90. Растворы, содержащие одну соль
- 91. Многокомпонентные растворы
- 92. Интегральные коэффициенты диффузии
- Глава 15. МЕХАНИКА ЖИДКИХ СРЕД
- 93. Баланс массы и импульса
- 94. Напряжение в ньютоновской жидкости
- 95. Граничные условия
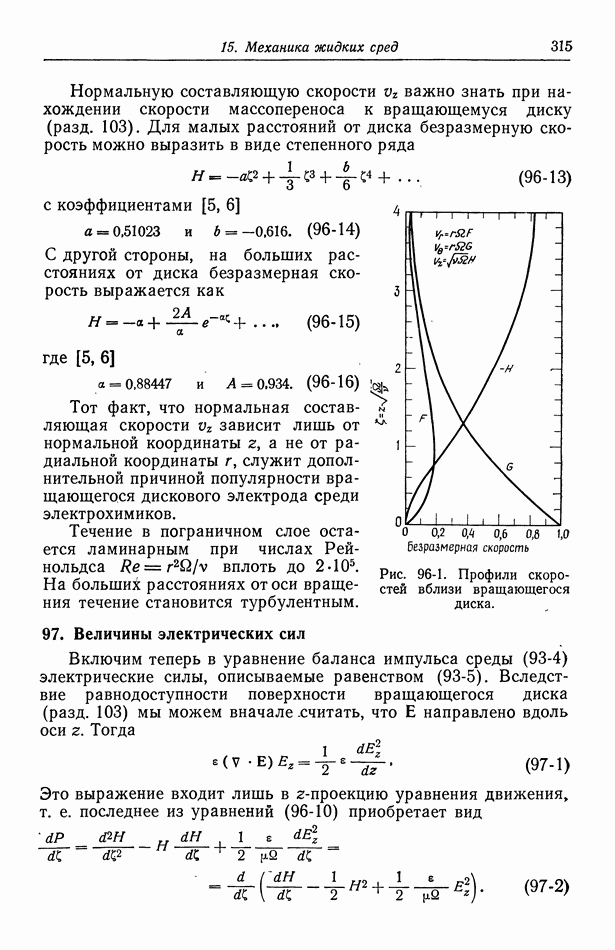
- 96. Течение жидкости к вращающемуся диску
- 97. Величины электрических сил
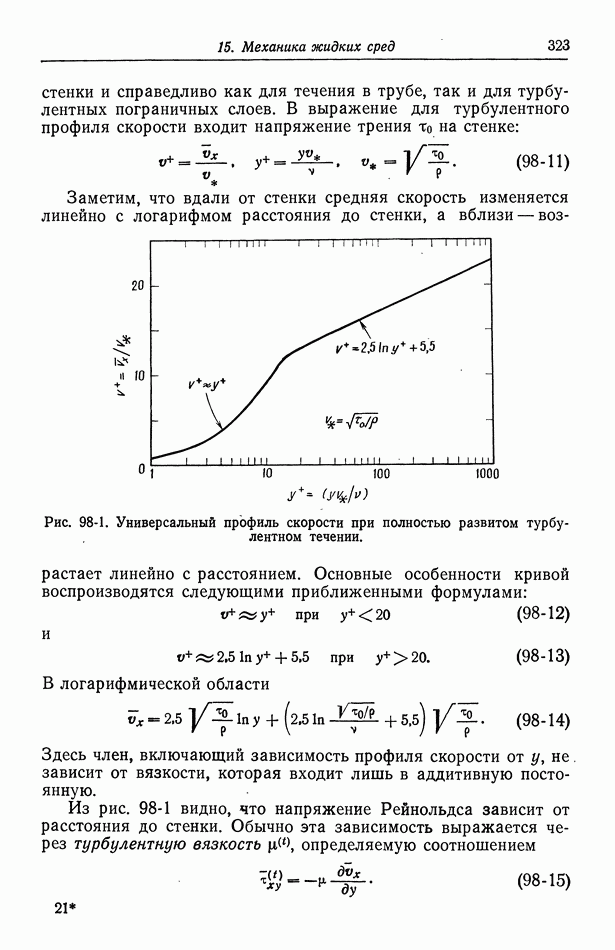
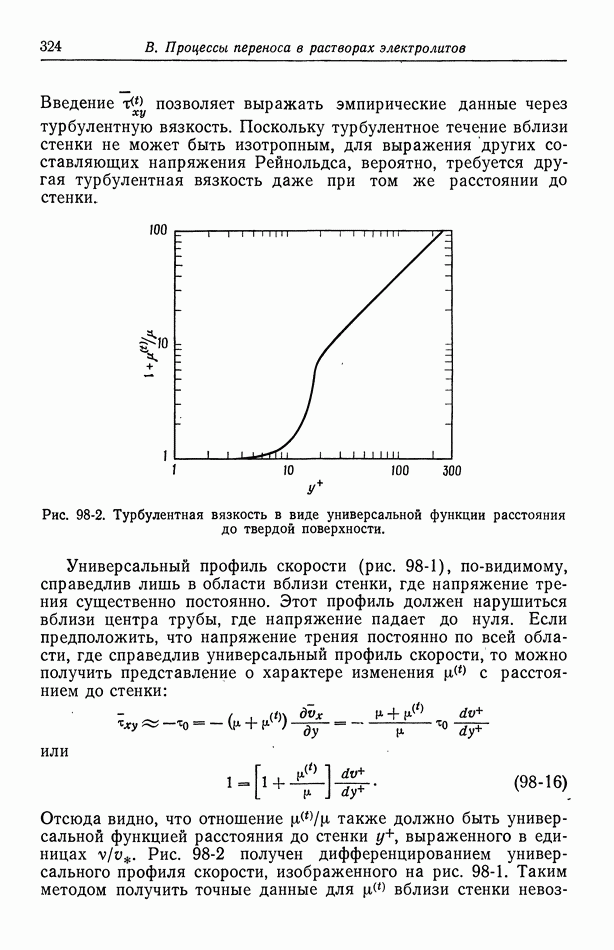
- 98. Турбулентное течение
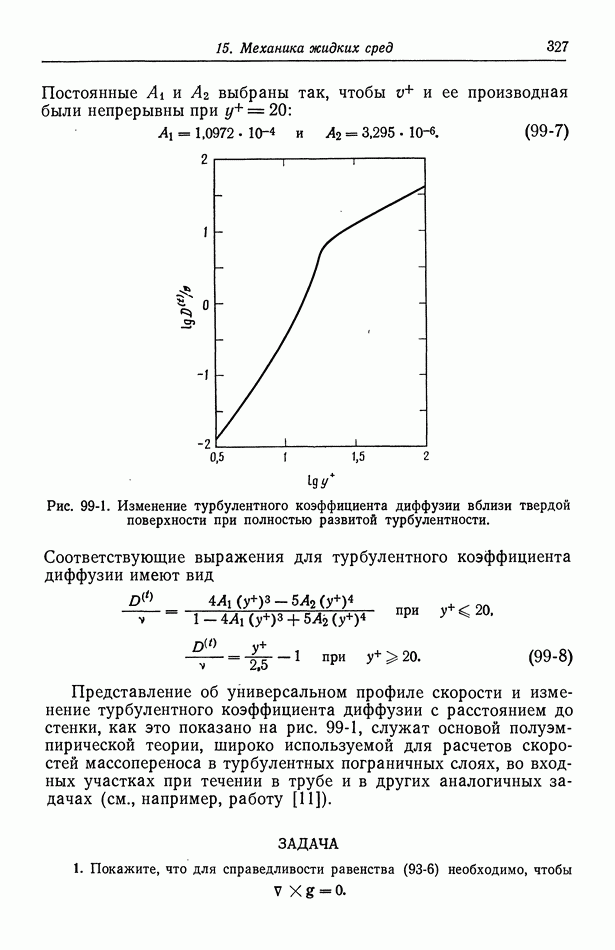
- 99. Массоперенос в турбулентном потоке
- Часть Г. РАСПРЕДЕЛЕНИЕ ТОКА И МАССОПЕРЕНОС В ЭЛЕКТРОХИМИЧЕСКИХ СИСТЕМАХ
- Глава 16. ОСНОВНЫЕ УРАВНЕНИЯ
- 100. Перенос в разбавленных растворах
- 101. Кинетика электродных процессов
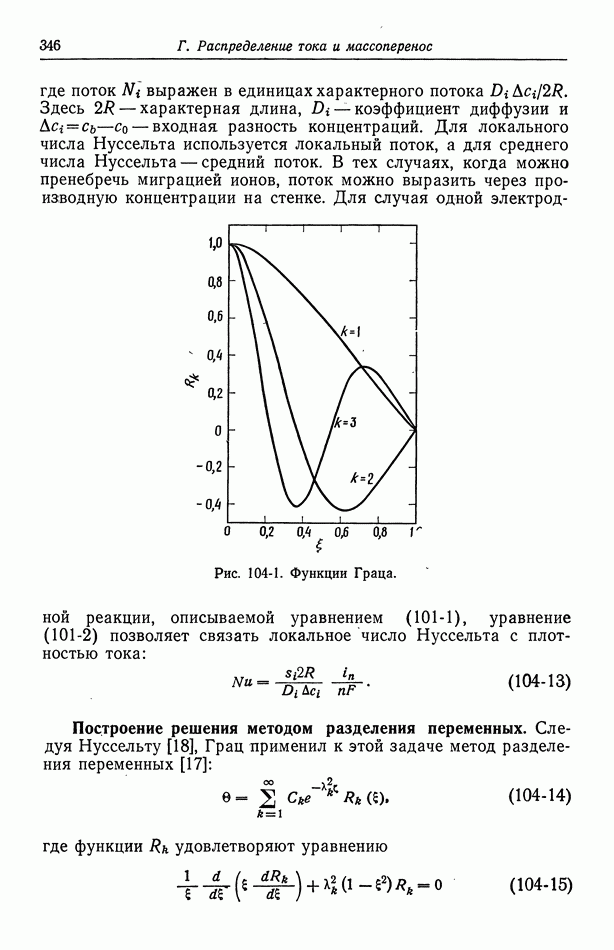
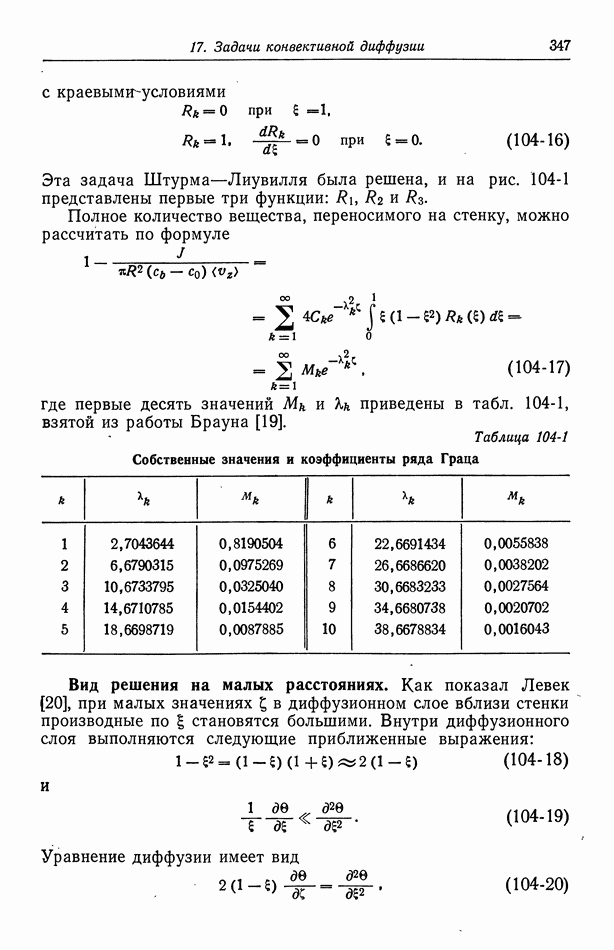
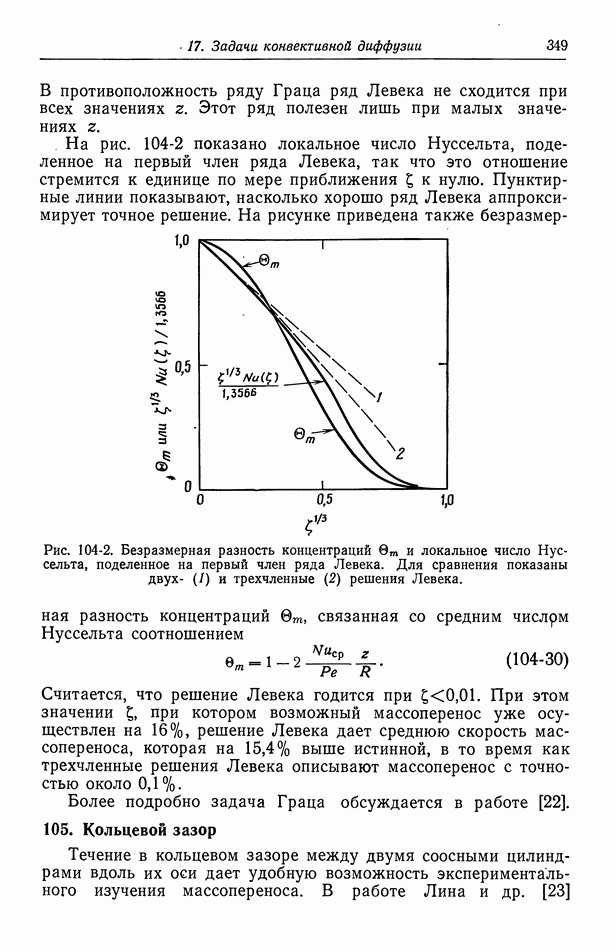
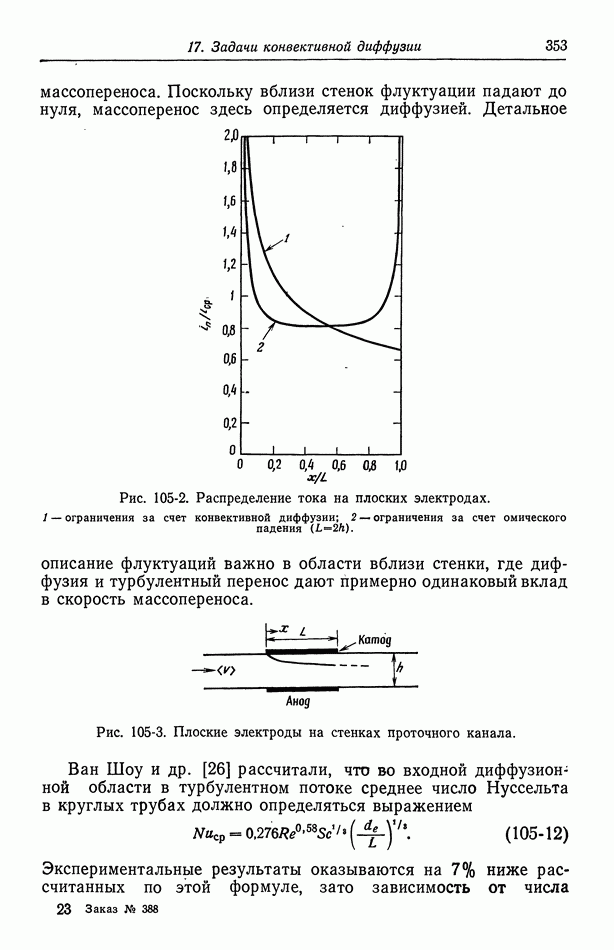
- Глава 17. ЗАДАЧИ КОНВЕКТИВНОЙ ДИФФУЗИИ
- 102. Упрощенное описание конвективной диффузии
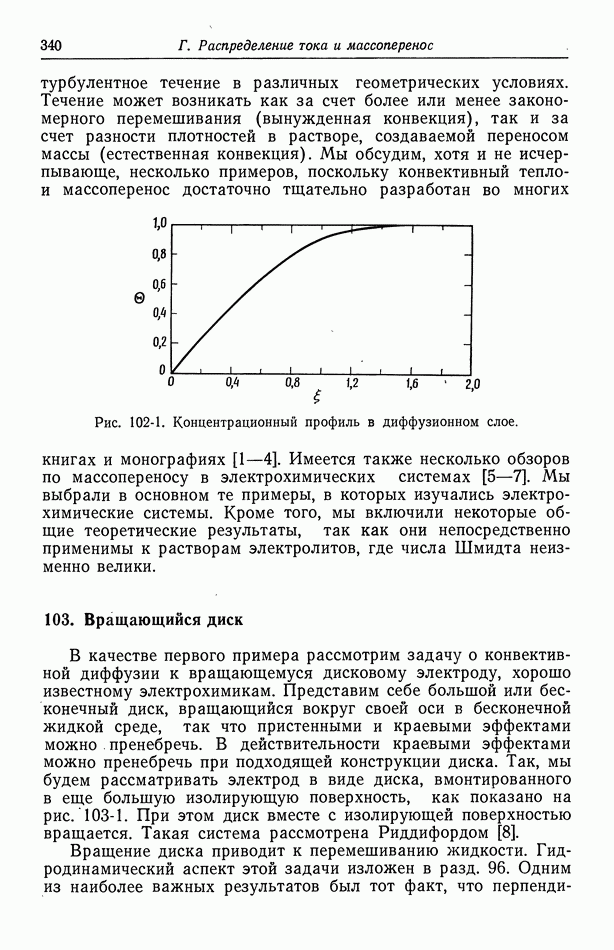
- 103. Вращающийся диск
- 104. Задача Граца
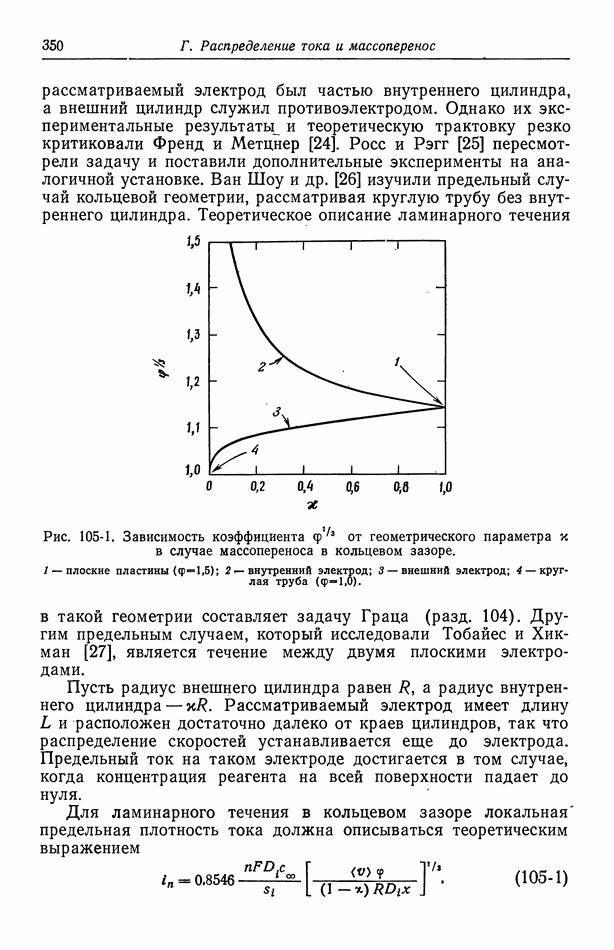
- 105. Кольцевой зазор
- 106. Двумерные диффузионные слои при вынужденной ламинарной конвекции
- 107. Осесимметричные диффузионные слои при вынужденной ламинарной конвекции
- 108. Плоская пластина в свободном потоке
- 109. Вращающиеся цилиндры
- 110. Растущие ртутные капли
- 112. Наложение свободной и вынужденной конвекции
- 113. Ограничения за счет поверхностных реакций
- 114. Бинарные и концентрированные растворы
- Глава 18. ПРИЛОЖЕНИЯ ТЕОРИИ ПОТЕНЦИАЛА
- 115. Упрощения в задачах теории потенциала
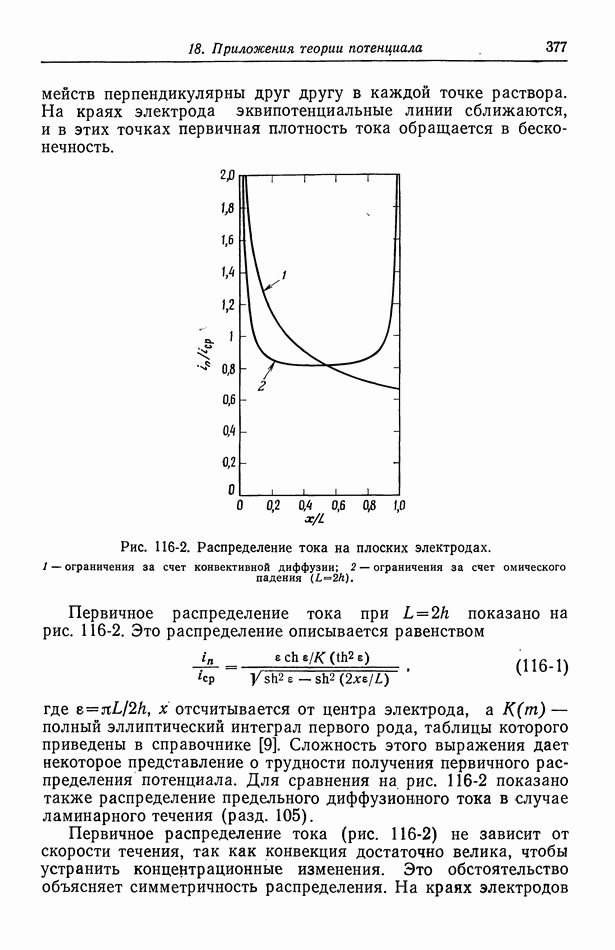
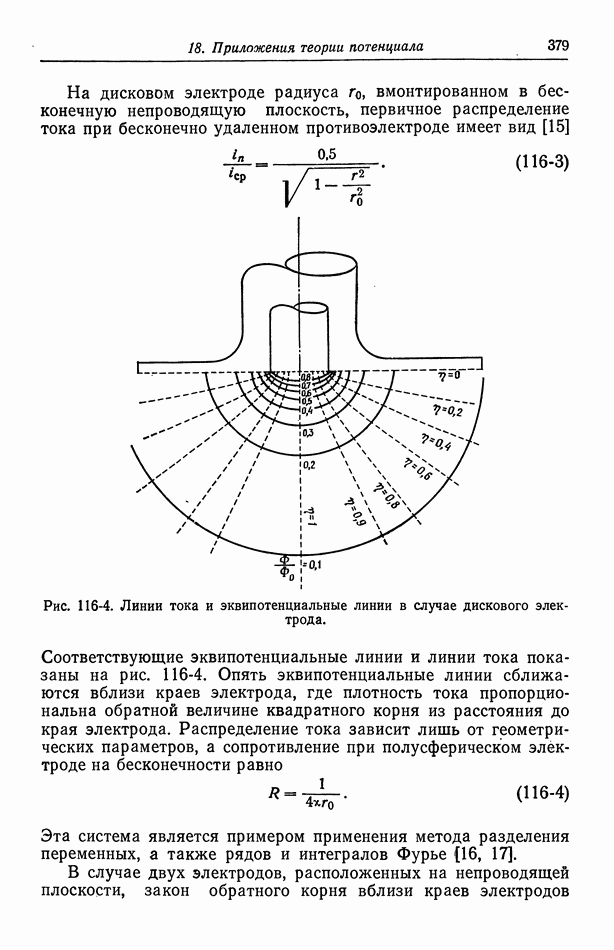
- 116. Первичное распределение тока
- 117. Вторичное распределение тока
- 118. Численное решение методом конечных разностей
- Глава 19. ВЛИЯНИЕ МИГРАЦИИ НА ПРЕДЕЛЬНЫЕ ТОКИ
- 120. Поправочный множитель в случае предельных токов
- 121. Изменение концентрации фонового электролита
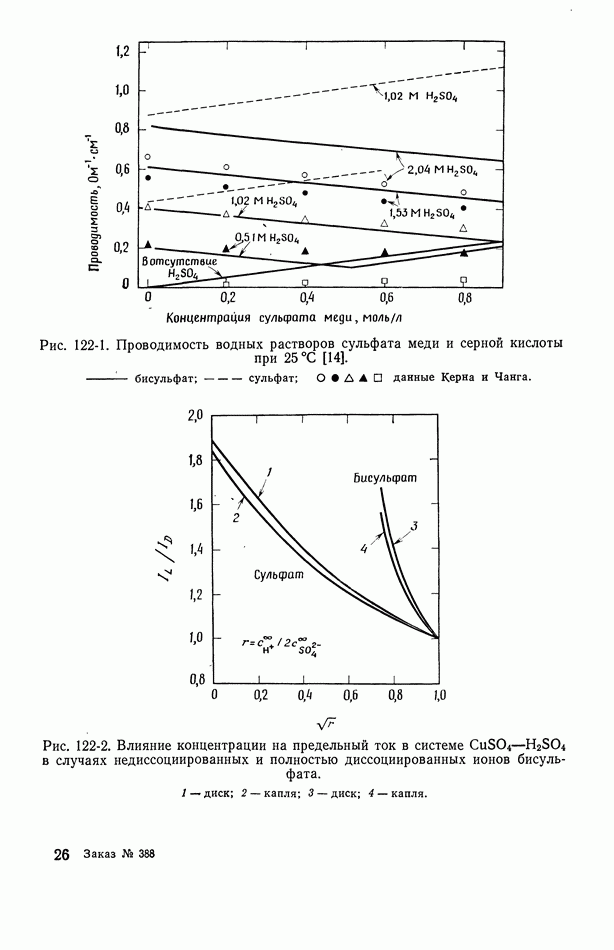
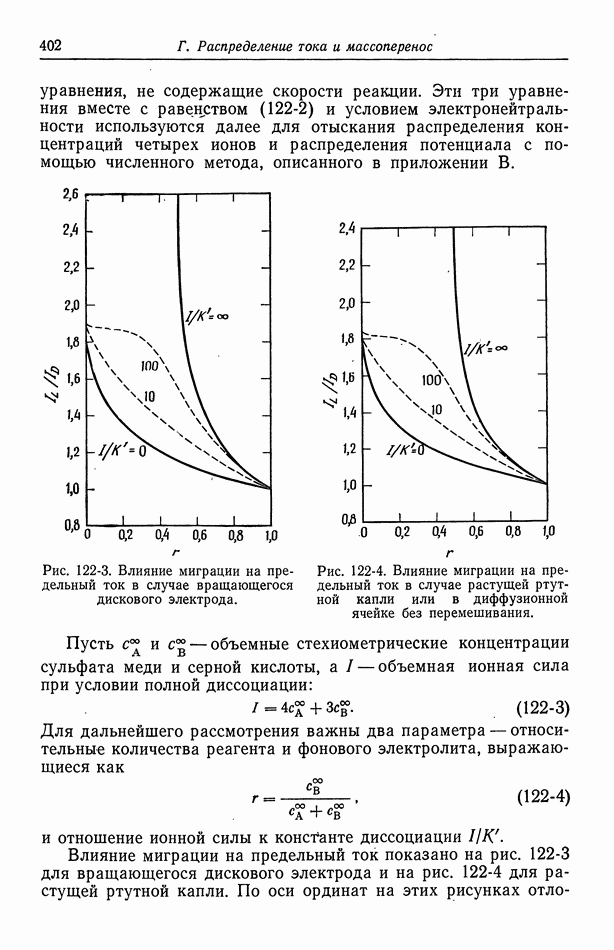
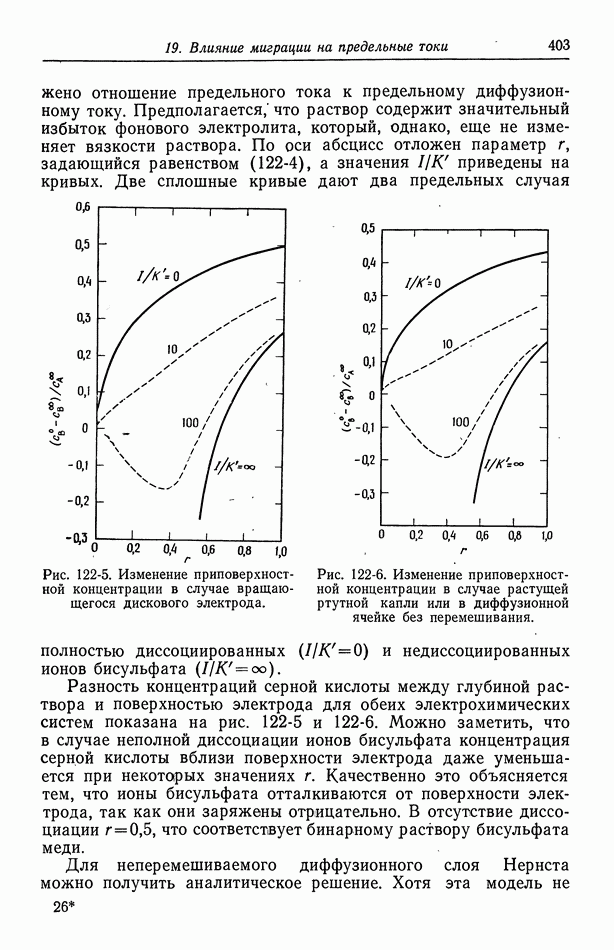
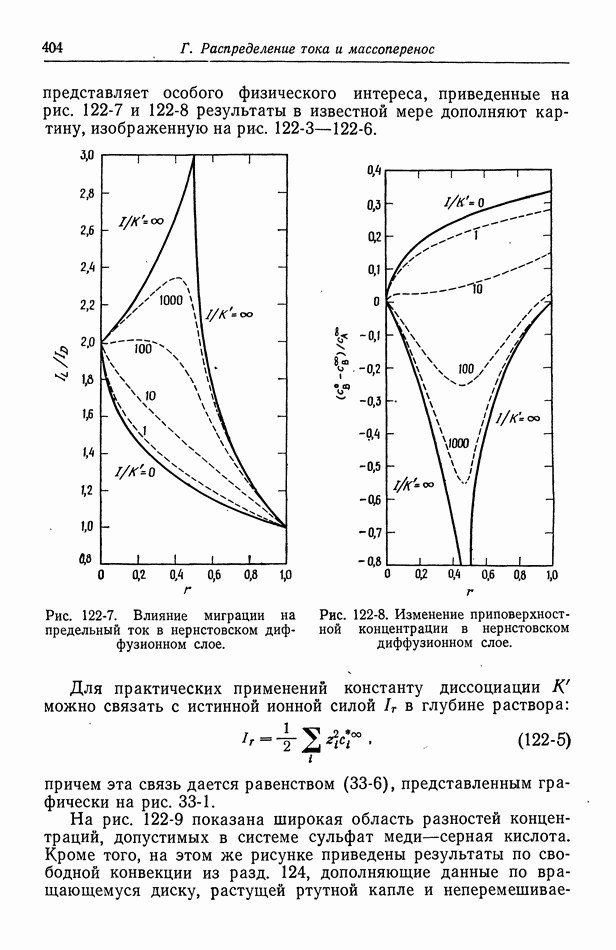
- 122. Роль ионов бисульфата
- 123. Парадоксы с фоновым электролитом
- 124. Предельные токи в случае свободной конвекции
- Глава 20. КОНЦЕНТРАЦИОННОЕ ПЕРЕНАПРЯЖЕНИЕ
- 126. Бинарный электролит
- 127. Фоновый электролит
- 128. Численные расчеты
- Глава 21. ДОПРЕДЕЛЬНЫЕ ТОКИ
- 129. Объем раствора
- 130. Диффузионные слои
- 131. Граничные условия и метод решения
- 132. Результаты для вращающегося диска
- Приложение А. ПАРЦИАЛЬНЫЕ МОЛЯРНЫЕ ОБЪЕМЫ
- Приложение Б. ВЕКТОРЫ И ТЕНЗОРЫ
- Приложение В. ЧИСЛЕННОЕ РЕШЕНИЕ СИСТЕМЫ ОБЫКНОВЕННЫХ ДИФФЕРЕНЦИАЛЬНЫХ УРАВНЕНИЙ