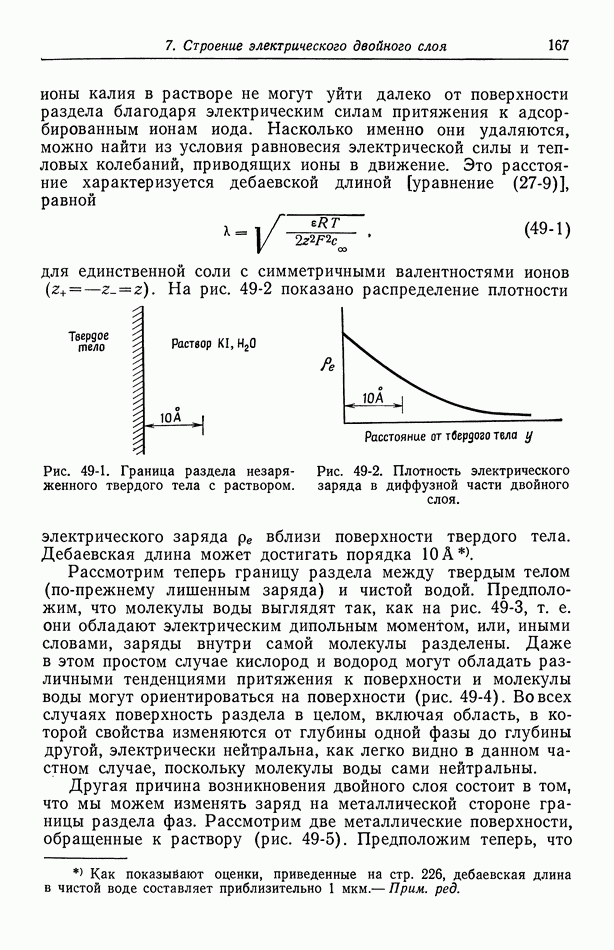
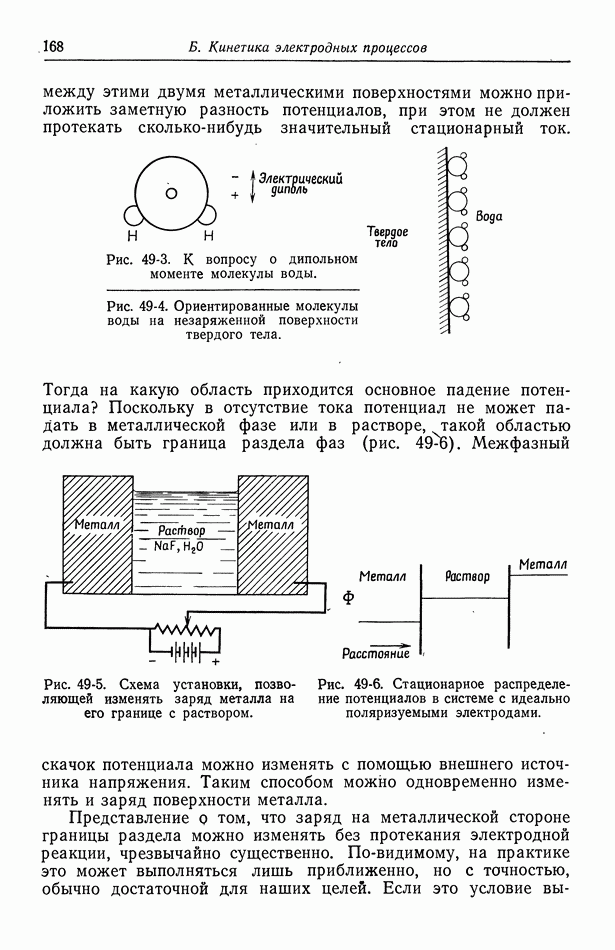
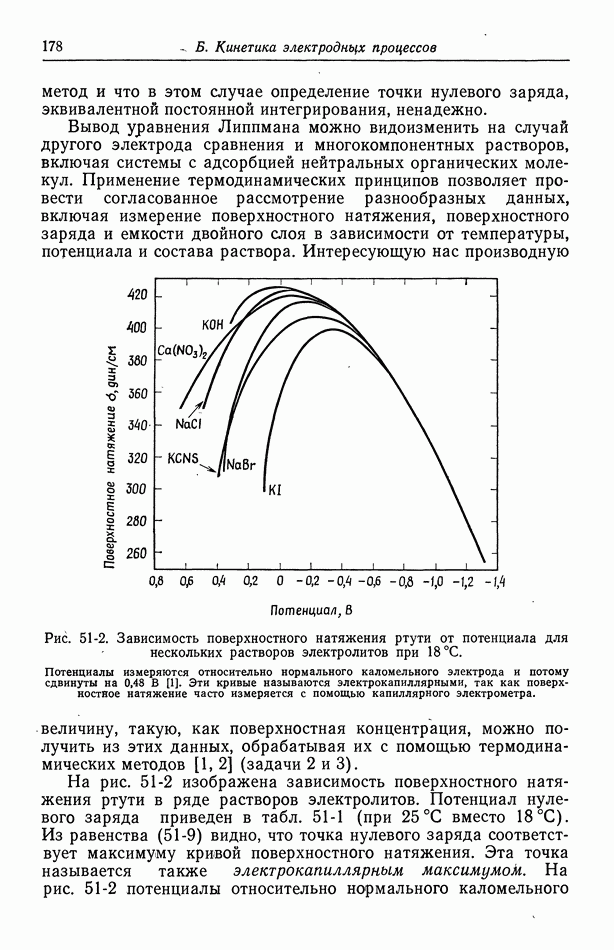
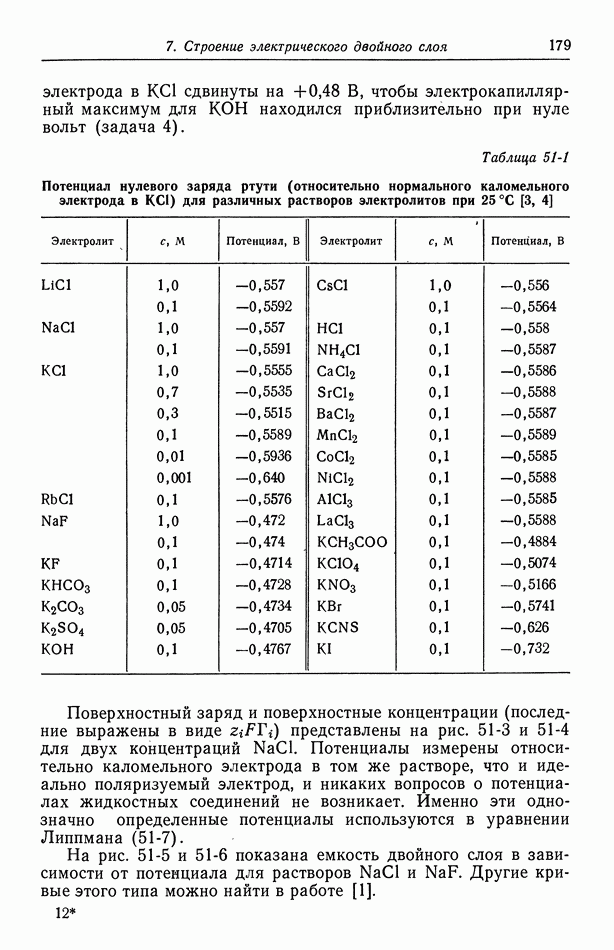
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
61. Одновременно протекающие реакции
Мы изучали отдельные электродные реакции, но этот идеальный случай реализуется не всегда. Если одновременно протекают две или более реакции, то проще всего считать, что каждая реакция протекает независимо и полная плотность тока является суммой плотностей нескольких реакций [20—23]. В этом случае потенциал разомкнутой цепи не является равновесным потенциалом, соответствующим какой-либо из этих реакций, но является смешанным или коррозионным потенциалом. При разомкнутой цепи равновесия нет — одна реакция протекает в анодном направлении, а другая — в катодном, так что полная плотность тока равна нулю. Таким образом, даже следы примесей могут затруднить измерение равновесного потенциала кислородного электрода (разд. 59).
То же самое происходит в коррозионных процессах. Анодным процессом может служить растворение железа

а катодным — восстановление кислорода

Эти процессы сопряжены, так что возникающие в реакции (61-1) электроны потребляются реакцией (61-2), причем полный ток на железе равен нулю. Следовательно, скорость коррозии можно определить по скорости переноса кислорода к корродирующей поверхности. Коррозия в водных средах часто является электрохимическим процессом.
Однако не все коррозионные процессы протекают в виде одновременных реакций. Когда в контакте находятся разнородные металлы, легко может возникнуть электрохимическая ячейка. Процесс анодного растворения преимущественно может протекать на одном металле, в то время как на другом в основном будет происходить процесс катодного восстановления кислорода или выделения водорода. В других случаях, например при точечной коррозии, анодный и катодный процессы могут протекать в различных частях одного и того же металла. Анализ этих систем требует рассмотрения омического падения потенциала и концентрационных изменений в растворе [23] и не может ограничиться электрохимическими реакциями на поверхности.
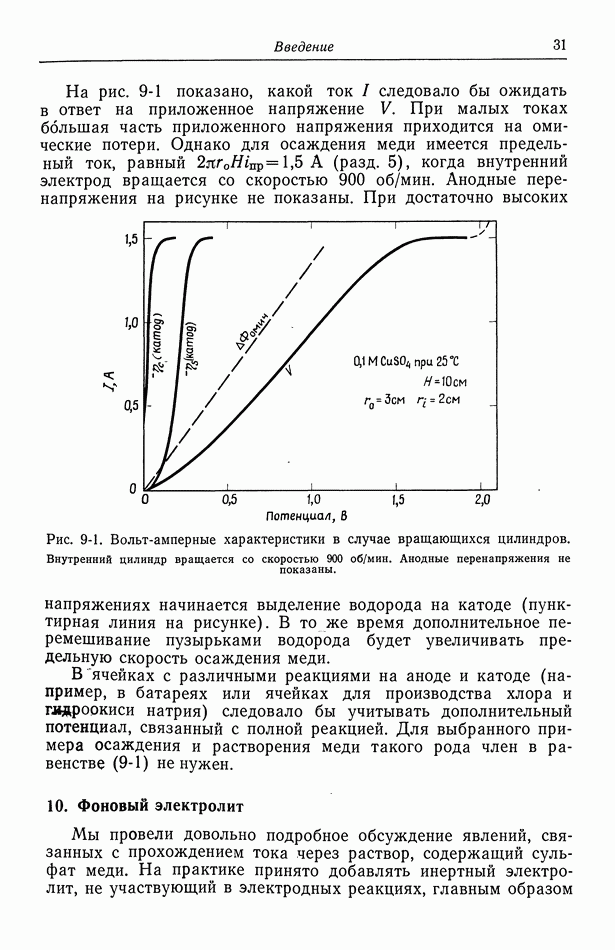
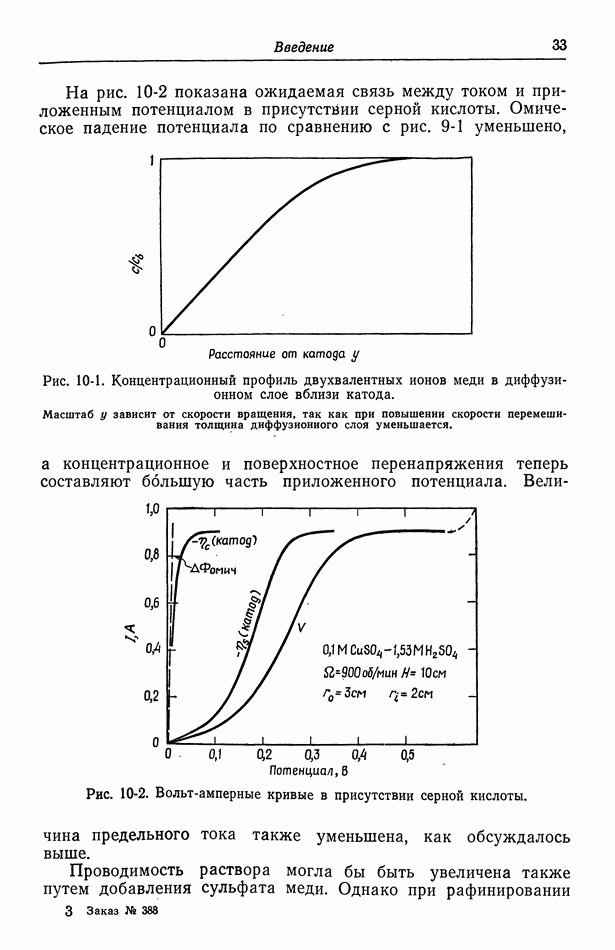
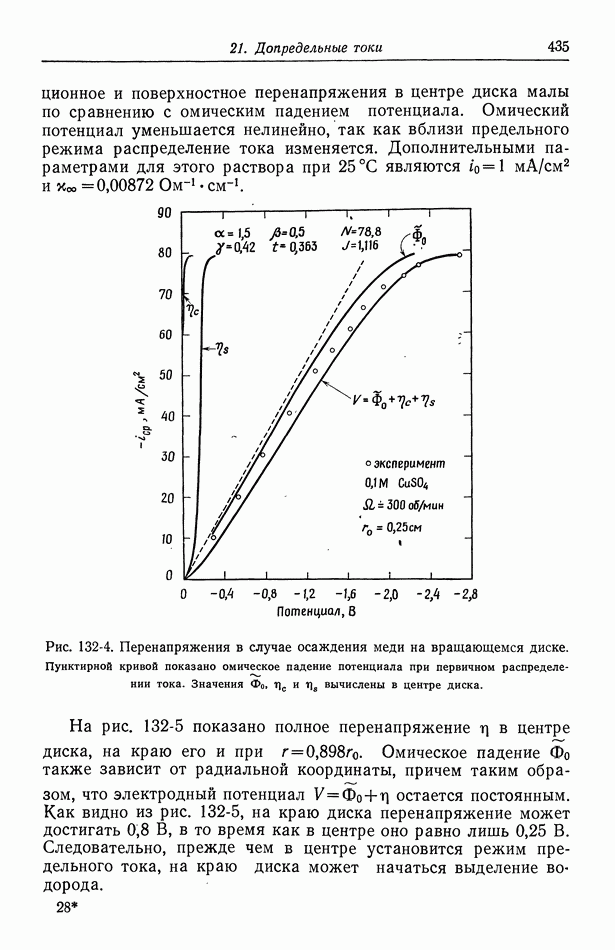
Одновременно протекающие реакции встречаются также, когда, например, превышается предельный ток осаждения меди и начинается выделение водорода. Это показано на рис. 9-1 и 10-2.
Поведение пассивирующихся металлов [23] в корродирующих системах заслуживает специального упоминания. Для этих
металлов увеличение агрессивности коррозионной среды может привести к пассивации и уменьшению скорости коррозии. Это легко достигается путем положительного заряжения металла, что является основой анодной защиты. Для пары железо—кислород увеличение скорости перемешивания, способствующее повышению скорости переноса кислорода к поверхности, может вызвать пассивацию металла и уменьшение скорости коррозии.
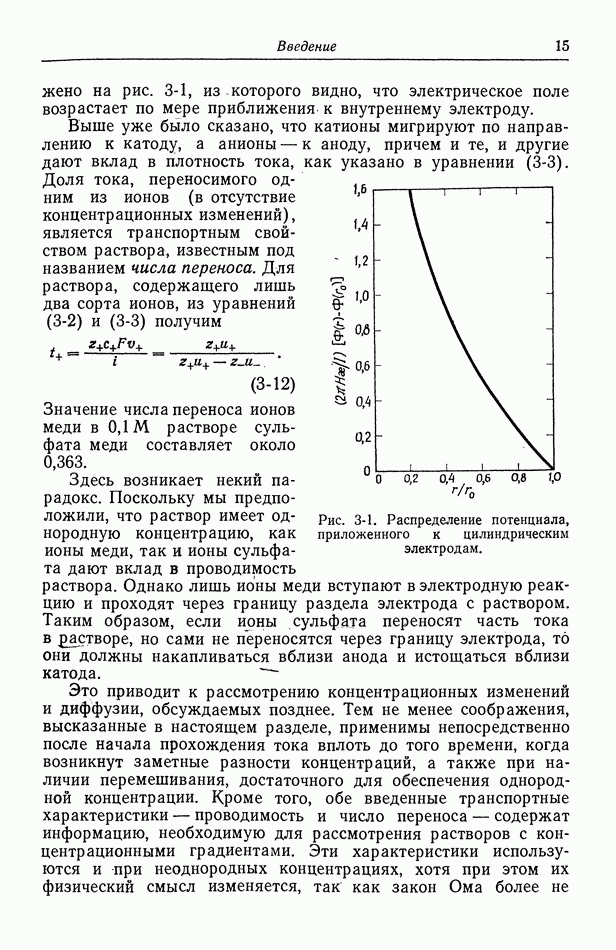
Наконец, рассмотрим реакцию восстановления кислорода, считая реакции (59-2) и (59-3) одновременными. Представим себе, что вблизи металла имеется неперемешиваемый диффузионный слой толщиной  и обозначим кислород и перекись водорода как компоненты
и обозначим кислород и перекись водорода как компоненты  соответственно. Поскольку реакция (59-2) протекает значительно быстрее, чем реакция (59-3), возникающая в первой реакции перекись водорода может диффундировать от поверхности, вместо того чтобы участвовать во второй реакции. Условие материального баланса для кислорода и перекиси водорода принимает вид
соответственно. Поскольку реакция (59-2) протекает значительно быстрее, чем реакция (59-3), возникающая в первой реакции перекись водорода может диффундировать от поверхности, вместо того чтобы участвовать во второй реакции. Условие материального баланса для кислорода и перекиси водорода принимает вид

Уравнение (61-3) описывает скорость диффузии кислорода к поверхности, причем кислород потребляется в реакции (59-2) [индексы 2 и 3 обозначают реакции (59-2) и (59-3)]. Уравнение (61-4) описывает скорость диффузии перекиси водорода от поверхности, причем эта скорость равна разности между скоростями ее образования в реакции (59-2) и потребления в реакции (59-3).
При 25 °С концентрация насыщенного раствора кислорода равна  при парциальном давлении 1 атм (поправленном на давление паров воды, но не на коэффициенты летучести в газовой фазе), а коэффициент диффузии равен
при парциальном давлении 1 атм (поправленном на давление паров воды, но не на коэффициенты летучести в газовой фазе), а коэффициент диффузии равен  Данные о концентрации насыщенного раствора и коэффициенте диффузии кислорода в зависимости от концентрации гидроокиси калия приведены, в частности, в работе Дэвиса и др. [24].
Данные о концентрации насыщенного раствора и коэффициенте диффузии кислорода в зависимости от концентрации гидроокиси калия приведены, в частности, в работе Дэвиса и др. [24].
Для кислых или нейтральных сред примем, что реакции (59-2) и (59-3) имеют псевдопервый порядок по кислороду и перекиси, и запишем

где постоянные  могут теперь зависеть от рН, а потенциал V измеряется относительно водородного электрода в том же растворе (разд. 40).
могут теперь зависеть от рН, а потенциал V измеряется относительно водородного электрода в том же растворе (разд. 40).
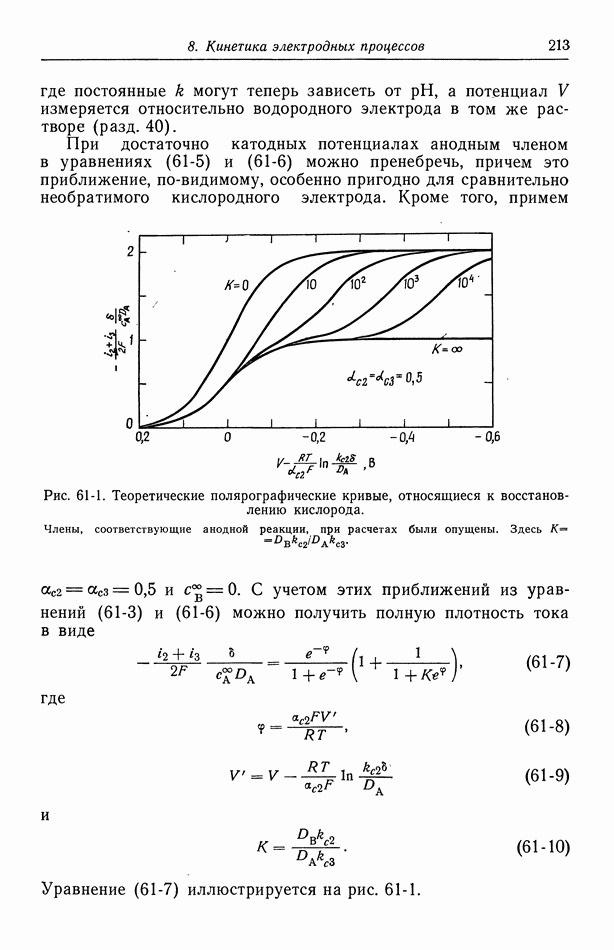
При достаточно катодных потенциалах анодным членом в уравнениях (61-5) и (61-6) можно пренебречь, причем это приближение, по-видимому, особенно пригодно для сравнительно необратимого кислородного электрода. Кроме того, примем 

Рис. 61-1. Теоретические полярографические кривые, относящиеся к восстановлению кислорода. Члены, соответствующие анодной реакции, при расчетах были опущены. Здесь 
С учетом этих приближений из уравнений (61-3) и (61-6) можно получить полную плотность тока в виде

где

и

Уравнение (61-7) иллюстрируется на рис. 61-1.
На рис. 61-1 изображен предельный ток восстановления кислорода и перекиси водорода (ср. с рис. 9-1 и 10-2). При малых значениях К процессы протекают одновременно, при больших значениях К процессы становятся четко различимыми. При очень малых и больших значениях К ток достигает половины своего значения на плато при  что может служить основой метода определения
что может служить основой метода определения  Это значение V известно как потенциал полуволны.
Это значение V известно как потенциал полуволны.
Положение второй волны относительно первой зависит от значения  т. е. от медленности реакции (59-3) по сравнению с реакцией (59-2). Полярографические кривые восстановления кислорода на ртути [25, 26] позволяют думать, что значение К для этой системы равно
т. е. от медленности реакции (59-3) по сравнению с реакцией (59-2). Полярографические кривые восстановления кислорода на ртути [25, 26] позволяют думать, что значение К для этой системы равно  Более строгий анализ должен учитывать возможность отличия
Более строгий анализ должен учитывать возможность отличия  друг от друга и от 0,5. В таком анализе, по-видимому, необходимо также принимать во внимание анодный член в уравнении (61-5).
друг от друга и от 0,5. В таком анализе, по-видимому, необходимо также принимать во внимание анодный член в уравнении (61-5).
Можно сопоставить восстановление двухвалентного иона меди с восстановлением кислорода. Поскольку реакция (57-2) быстрее реакции (57-3), восстановление одновалентного иона меди будет протекать одновременно с восстановлением двухвалентных ионов меди до одновалентных и можно будет различить лишь одну полярографическую волну. С другой стороны, реакция (59-2) быстрее реакции (59-3), и при восстановлении кислорода наблюдаются обе волны.
ЗАДАЧИ
(см. скан)
(см. скан)
СПИСОК ОБОЗНАЧЕНИЙ
(см. скан)
(см. скан)
СПИСОК ЛИТЕРАТУРЫ
(см. скан)
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
(см. скан)
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- Глава 1. ВВЕДЕНИЕ
- 1. Термодинамика, кинетика электродных процессов и процессы переноса
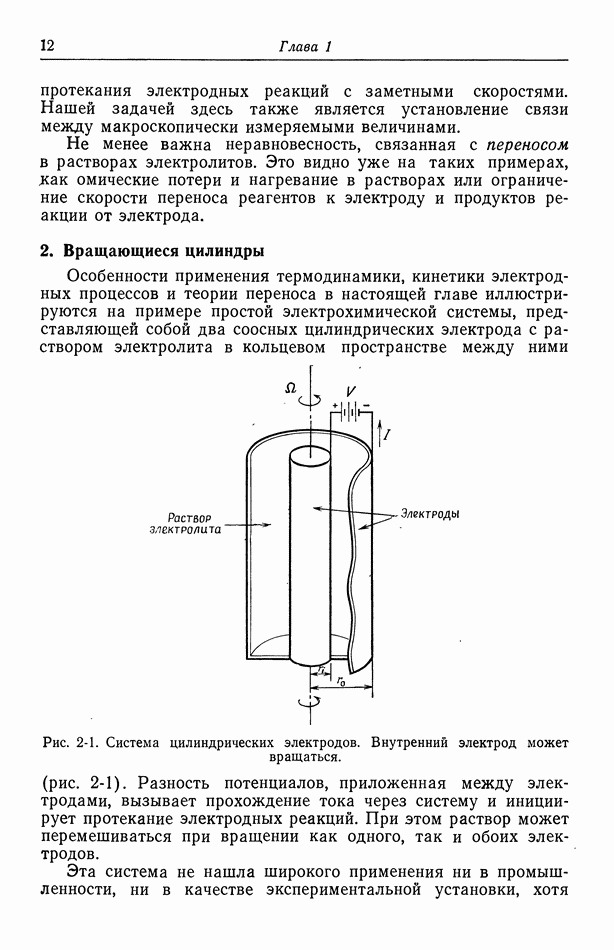
- 2. Вращающиеся цилиндры
- 3. Прохождение тока в электролитах
- 4. Течение жидкости
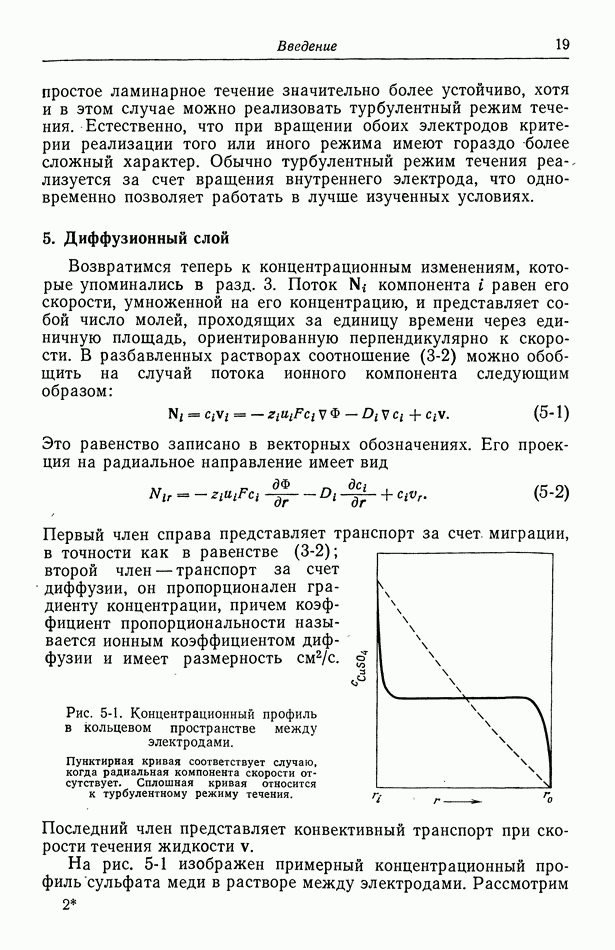
- 5. Диффузионный слой
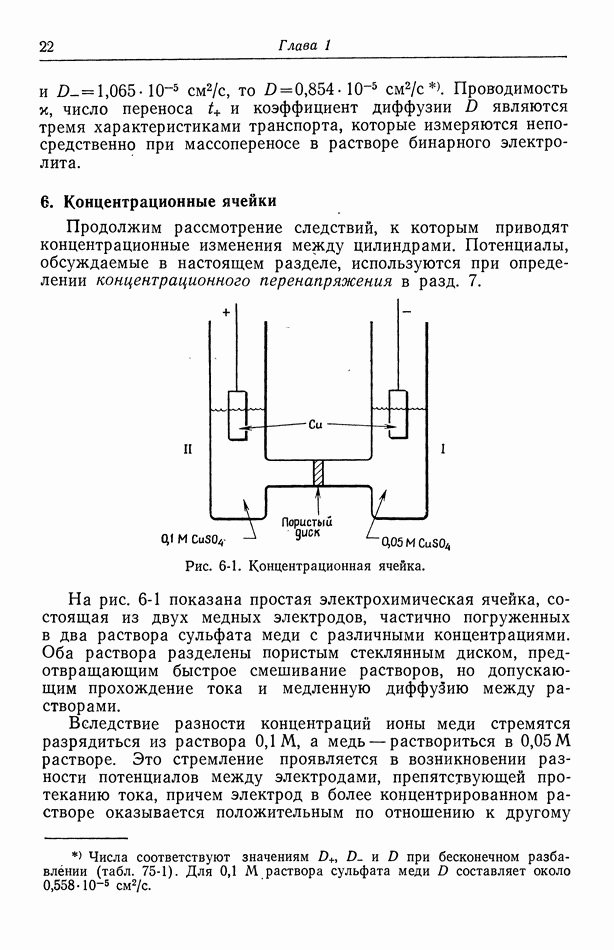
- 6. Концентрационные ячейки
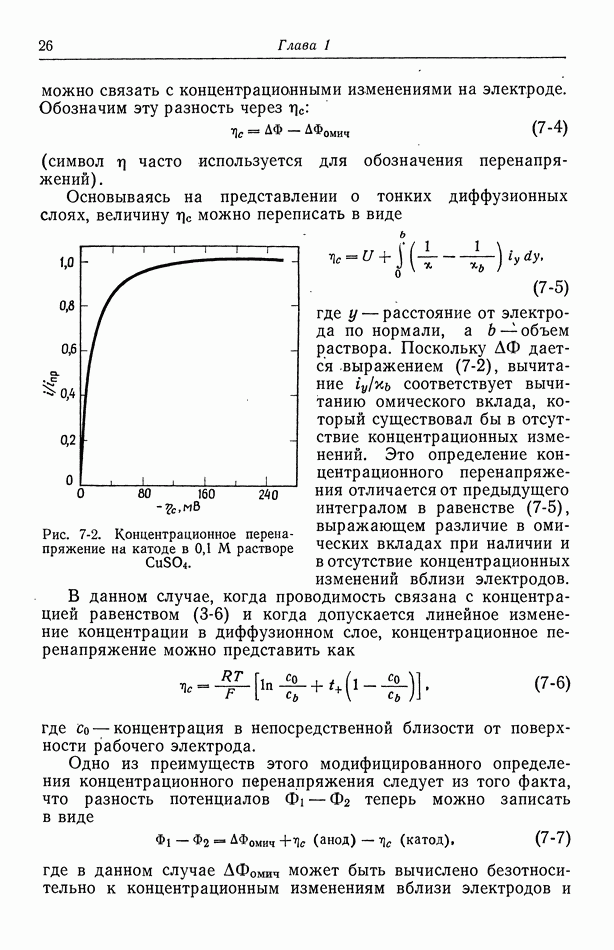
- 7. Концентрационное перенапряжение
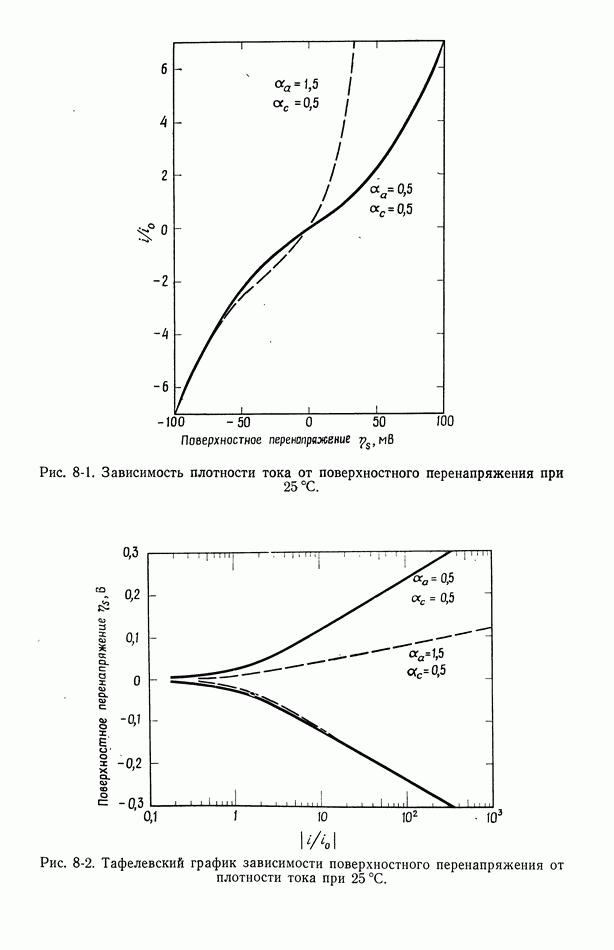
- 8. Поверхностное перенапряжение
- 9. Потенциал ячейки
- 10. Фоновый электролит
- 11. Свободная конвекция
- Часть А. ТЕРМОДИНАМИКА ЭЛЕКТРОХИМИЧЕСКИХ ЯЧЕЕК
- Глава 2. ТЕРМОДИНАМИКА НА ЯЗЫКЕ ЭЛЕКТРОХИМИЧЕСКИХ ПОТЕНЦИАЛОВ
- 12. Равновесие фаз
- 13. Химический и электрохимический потенциалы
- 14. Определение некоторых термодинамических функций
- 15. Ячейка с раствором однородной концентрации
- 16. Процессы переноса в областях контакта
- 17. Ячейка с одним электролитом переменной концентрации
- 18. Ячейка с двумя электролитами, концентрация одного из которых почти однородна
- 19. Ячейка с двумя электролитами переменной концентрации
- 20. Стандартный потенциал ячейки и коэффициенты активности
- Глава 3. ЭЛЕКТРИЧЕСКИЙ ПОТЕНЦИАЛ
- 22. Электростатический потенциал
- 23. Межмолекулярные силы
- 24. Внешний и внутренний потенциалы
- 25. Потенциалы электродов сравнения
- 26. Электрический потенциал в термодинамике
- Глава 4. КОЭФФИЦИЕНТЫ АКТИВНОСТИ
- 27. Распределение ионов в разбавленных растворах
- 28. Электрический вклад в свободную энергию
- 29. Недостатки модели Дебая-Хюккеля
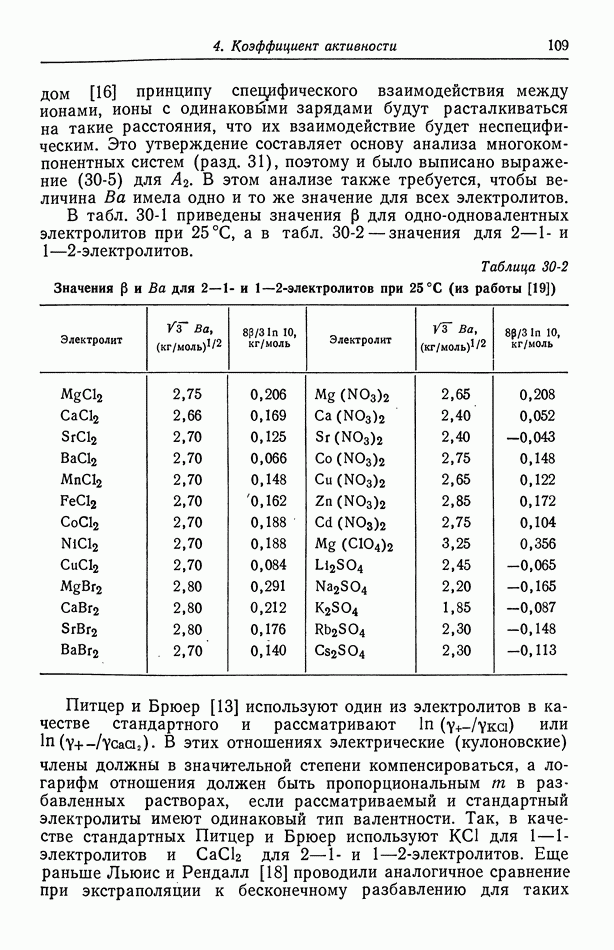
- 30. Растворы бинарных электролитов
- 31. Многокомпонентные растворы
- 32. Измерение коэффициентов активности
- 33. Слабые электролиты
- Глава 5. ЭЛЕКТРОДЫ СРАВНЕНИЯ
- 34. Критерии выбора электродов сравнения
- 35. Экспериментальные факторы, влияющие на выбор электродов сравнения
- 36. Водородный электрод
- 37. Каломельный электрод и другие электроды типа ртуть—соль ртути
- 38. Окиснортутный электрод
- 39. Электроды типа серебро—галогенид серебра
- 40. Потенциалы относительно данного электрода сравнения
- Глава 6. ПОТЕНЦИАЛЫ ЯЧЕЕК С ПЕРЕНОСОМ
- 41. Уравнение Нернста
- 42. Типы жидкостных соединений
- 43. Формулы для потенциалов жидкостных соединений
- 44. Определение концентрационных профилей
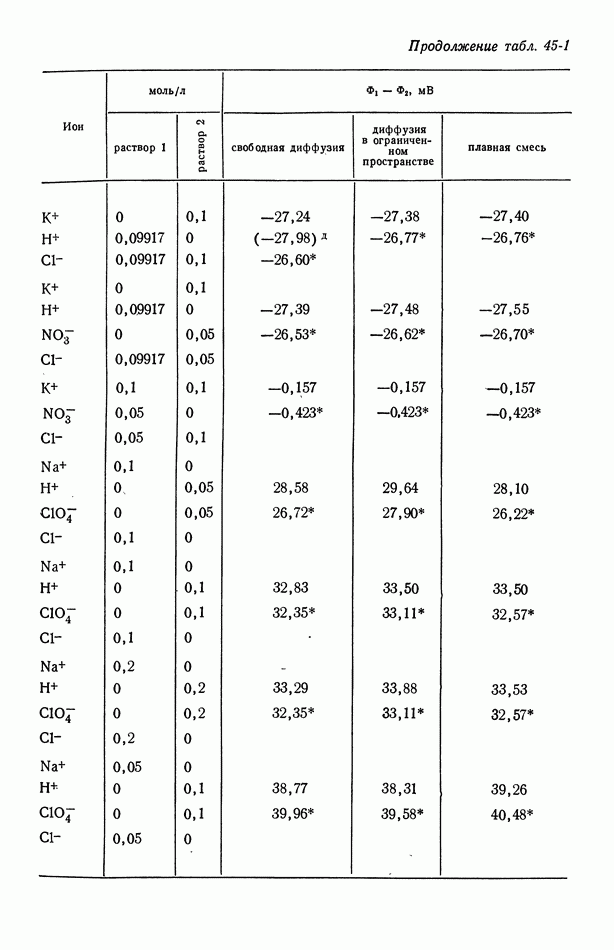
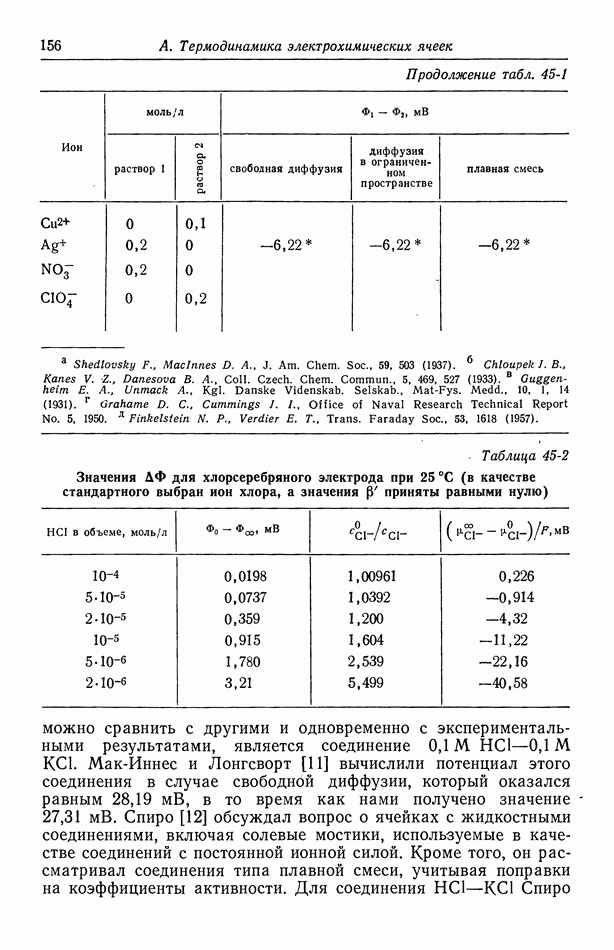
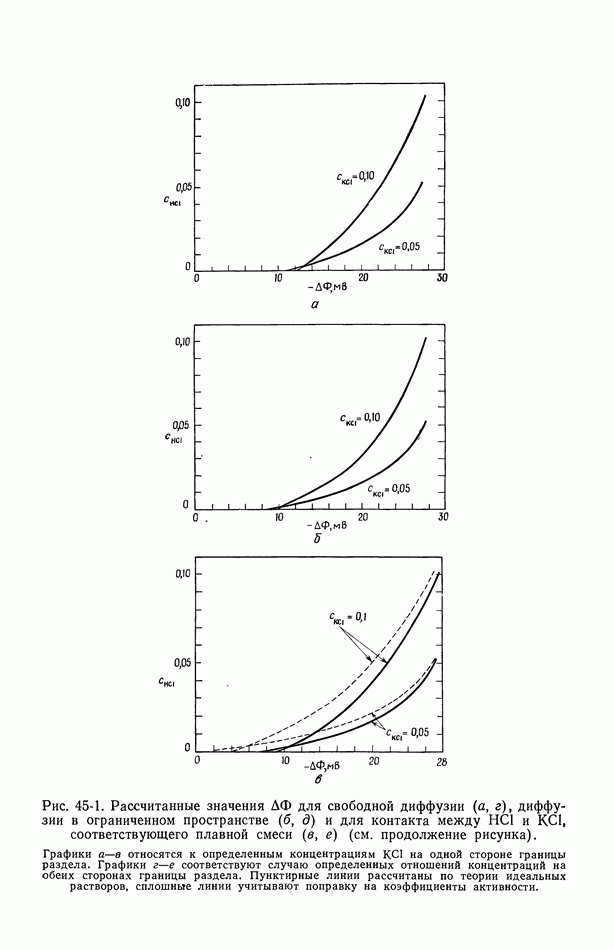
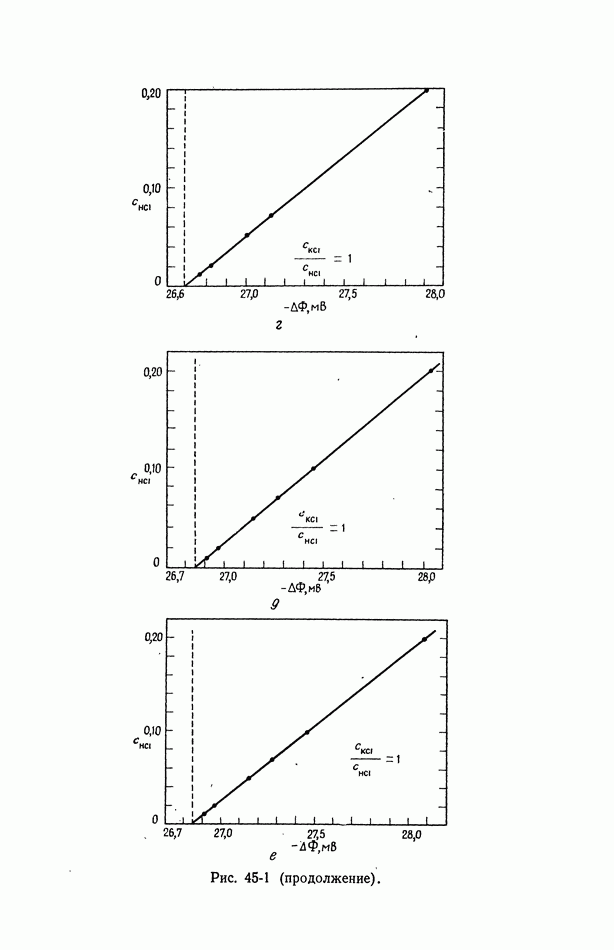
- 45. Численные результаты
- 46. Ячейки с жидкостным соединением
- 47. Поправки к уравнению Нернста
- 48. Мембранные потенциалы
- Часть Б. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ И ДРУГИЕ ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
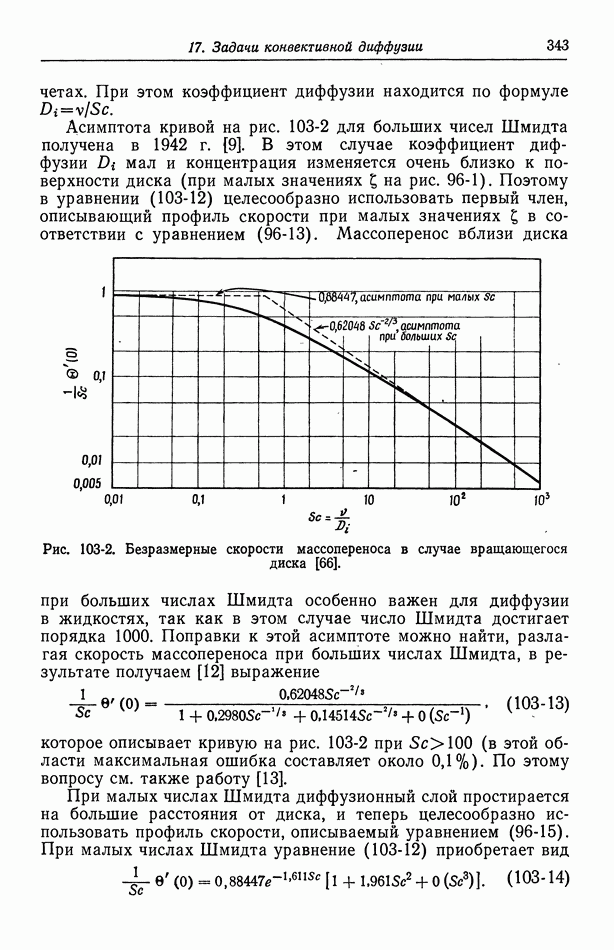
- Глава 7. СТРОЕНИЕ ЭЛЕКТРИЧЕСКОГО ДВОЙНОГО СЛОЯ
- 50. Изотерма адсорбции Гиббса
- 51. Уравнение Липпмана
- 52. Диффузная часть двойного слоя
- 53. Емкость двойного слоя в отсутствие специфической адсорбции
- 54. Специфическая адсорбция на границе раздела электрод—раствор
- Глава 8. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ
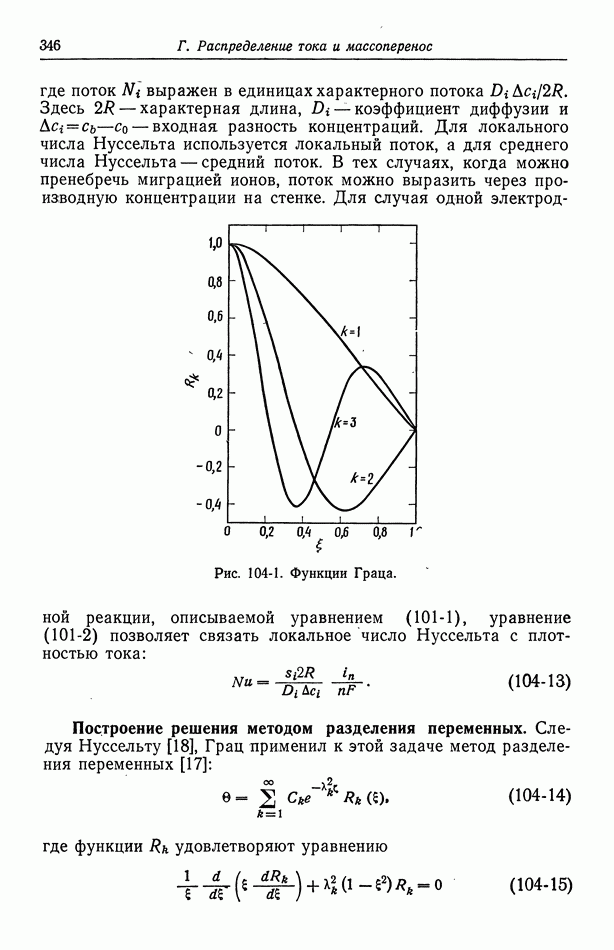
- 55. Гетерогенные электродные реакции
- 56. Зависимость плотности тока от поверхностного перенапряжения
- 57. Модели в кинетике электродных процессов
- 58. Влияние строения двойного слоя
- 59. Кислородный электрод
- 60. Методы измерения
- 61. Одновременно протекающие реакции
- Глава 9. ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ
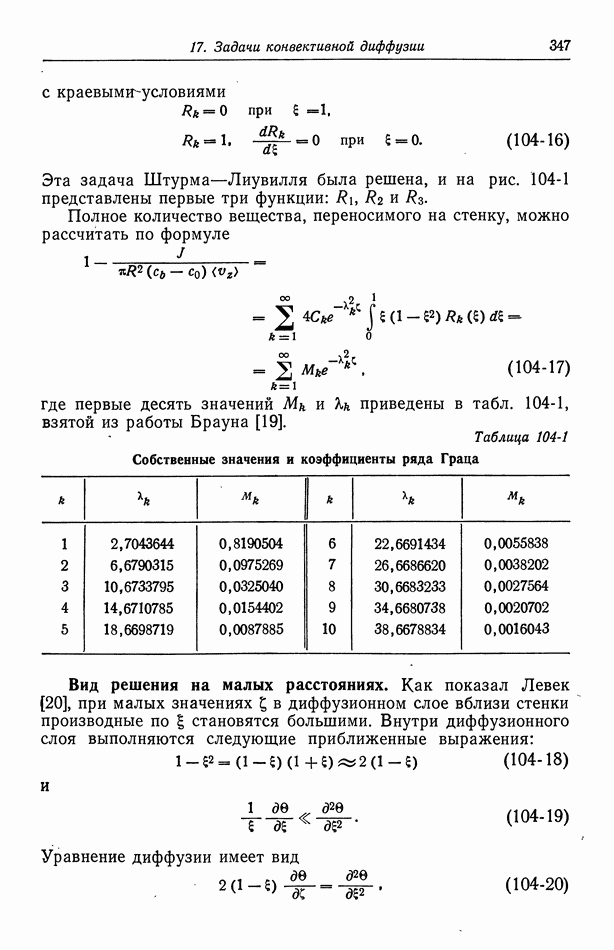
- 62. Разрывная скорость на границе раздела
- 63. Электроосмос и потенциал течения
- 64. Электрофорез
- 65. Потенциал осаждения
- Глава 10. ЭЛЕКТРОКАПИЛЛЯРНЫЕ ЯВЛЕНИЯ
- 67. Электрокапиллярное движение ртутных капель
- 68. Потенциалы осаждения для падающих ртутных капель
- Часть В. ПРОЦЕССЫ ПЕРЕНОСА В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- Глава 11. БЕСКОНЕЧНО РАЗБАВЛЕННЫЕ РАСТВОРЫ
- 70. Проводимость, диффузионные потенциалы и числа переноса
- 71. Сохранение заряда
- 72. Бинарный электролит
- 73. Фоновый электролит
- 74. Многокомпонентная диффузия, возникающая при исключении электрического поля
- 75. Подвижности и коэффициенты диффузии
- 76. Электронейтральность и уравнение Лапласа
- 77. Умеренно разбавленные растворы
- Глава 12. КОНЦЕНТРИРОВАННЫЕ РАСТВОРЫ
- 79. Бинарный электролит
- 80. Стандартные скорости
- 81. Потенциал
- 82. Связь с теорией разбавленных растворов
- 83. Многокомпонентный транспорт
- 84. Потенциалы жидкостного соединения
- Глава 13. ТЕПЛОВЫЕ ЭФФЕКТЫ
- 85. Термодиффузия
- 86. Выделение и перенос тепла
- 87. Тепловыделение на границе раздела фаз
- 88. Термогальванические ячейки
- Глава 14. ХАРАКТЕРИСТИКИ ПЕРЕНОСА
- 89. Бесконечно разбавленные растворы
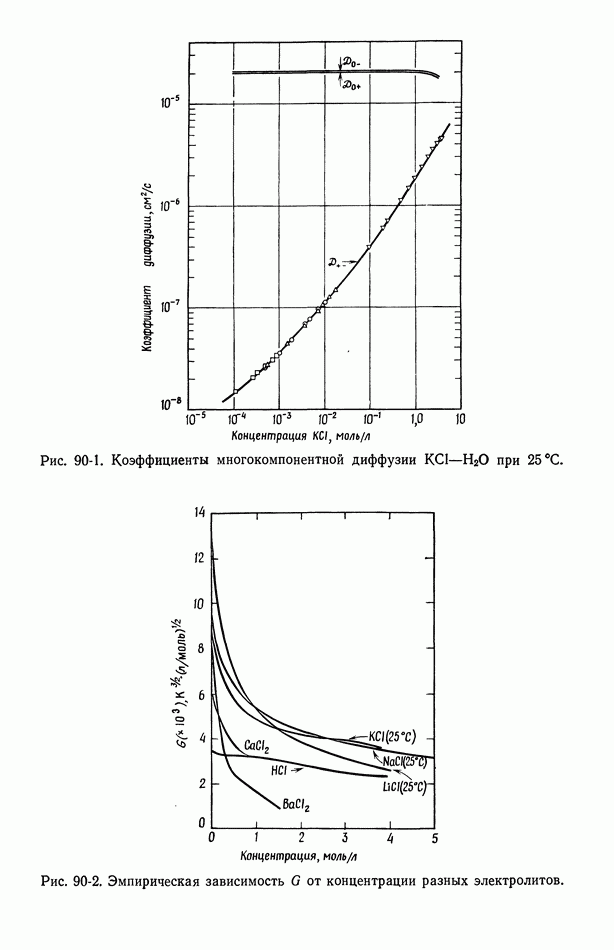
- 90. Растворы, содержащие одну соль
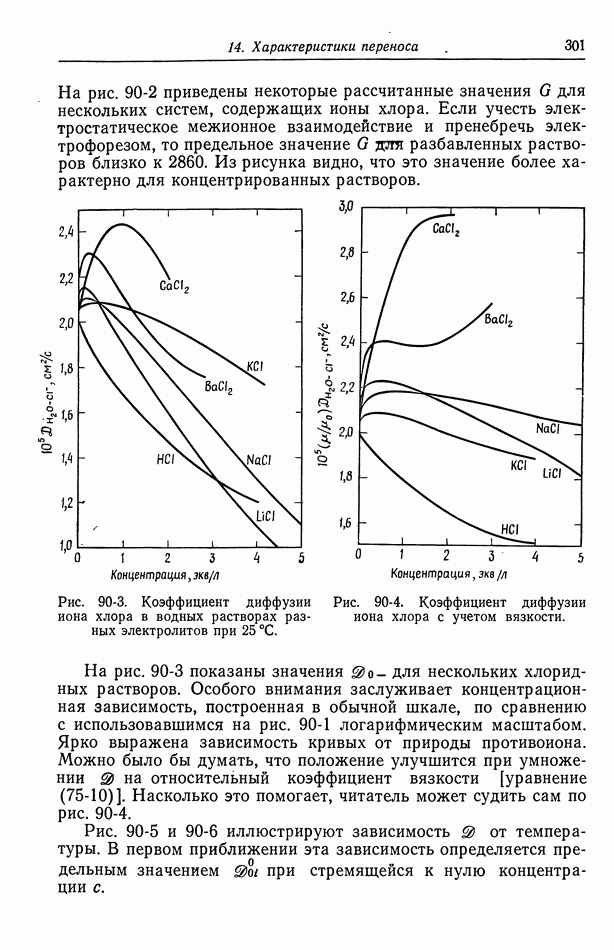
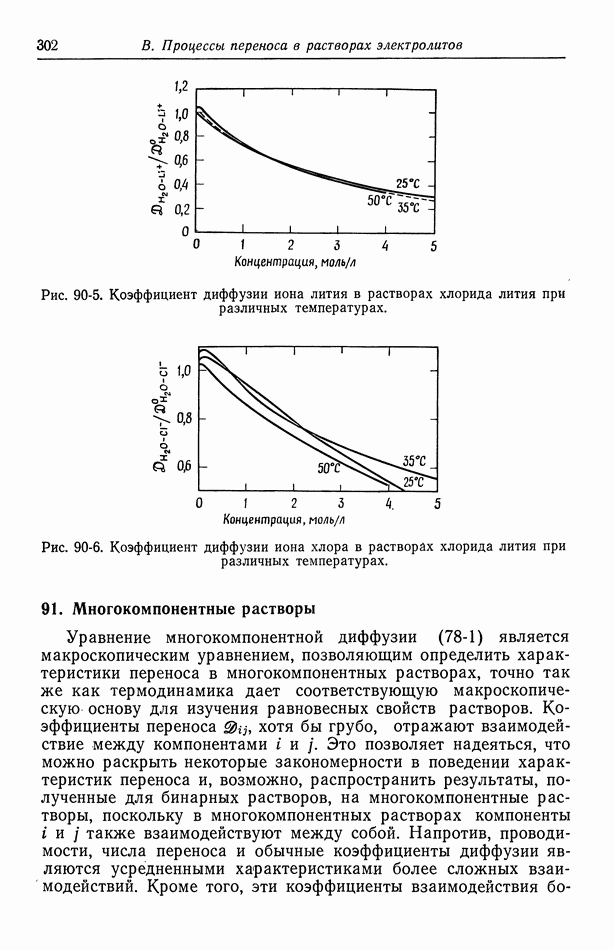
- 91. Многокомпонентные растворы
- 92. Интегральные коэффициенты диффузии
- Глава 15. МЕХАНИКА ЖИДКИХ СРЕД
- 93. Баланс массы и импульса
- 94. Напряжение в ньютоновской жидкости
- 95. Граничные условия
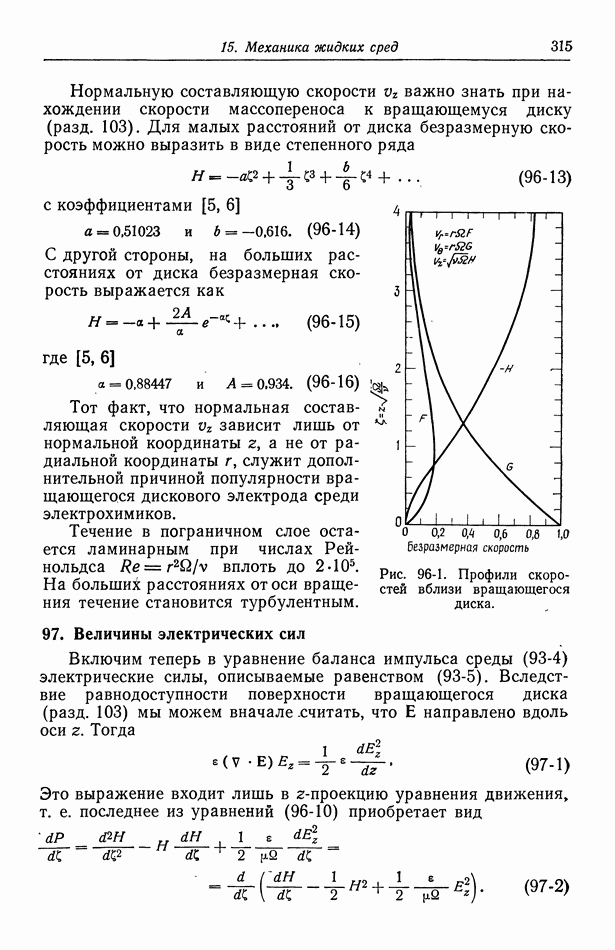
- 96. Течение жидкости к вращающемуся диску
- 97. Величины электрических сил
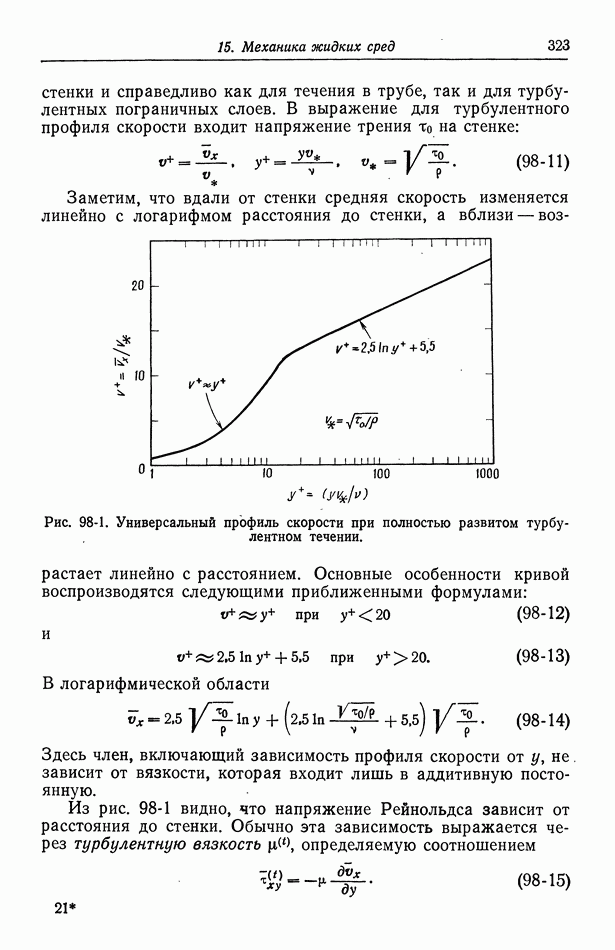
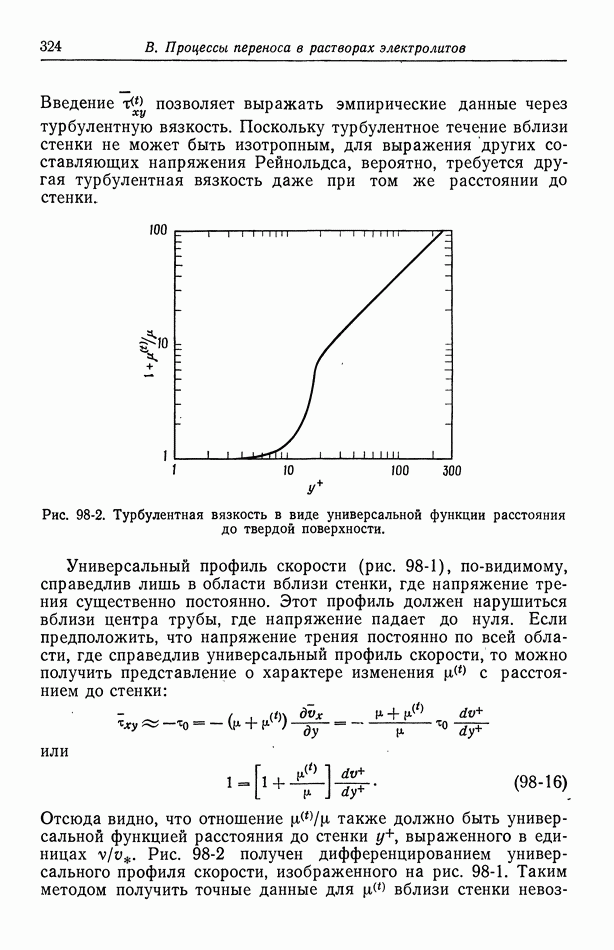
- 98. Турбулентное течение
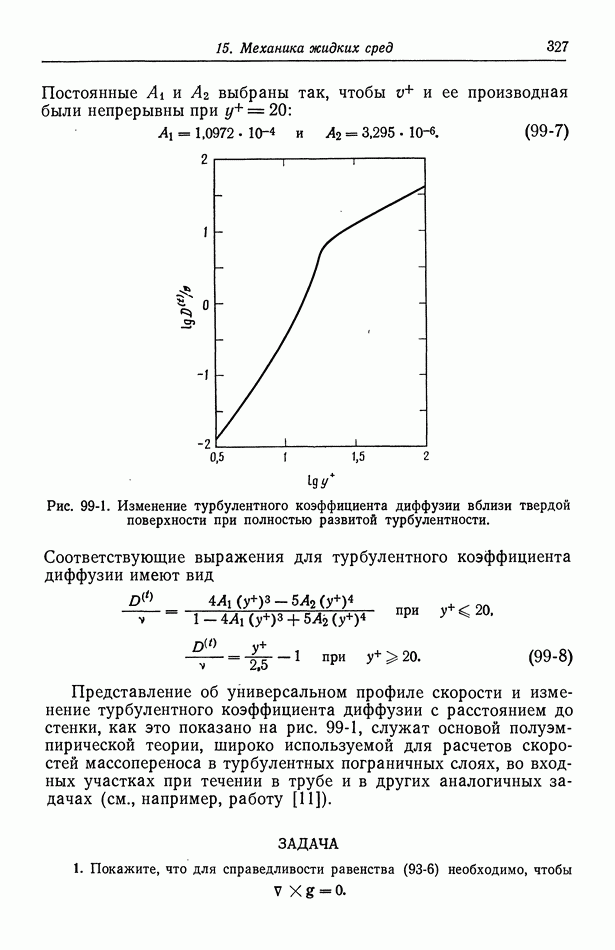
- 99. Массоперенос в турбулентном потоке
- Часть Г. РАСПРЕДЕЛЕНИЕ ТОКА И МАССОПЕРЕНОС В ЭЛЕКТРОХИМИЧЕСКИХ СИСТЕМАХ
- Глава 16. ОСНОВНЫЕ УРАВНЕНИЯ
- 100. Перенос в разбавленных растворах
- 101. Кинетика электродных процессов
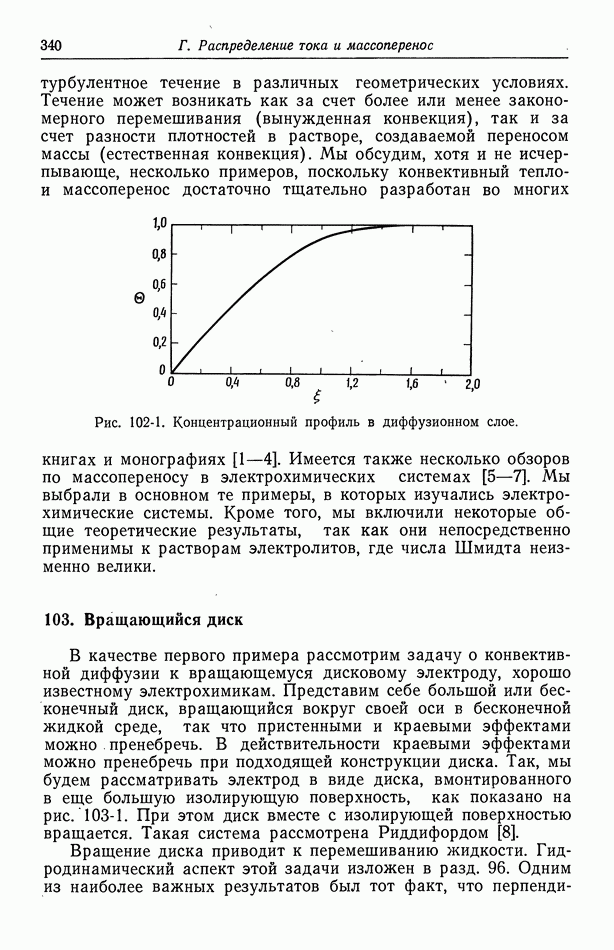
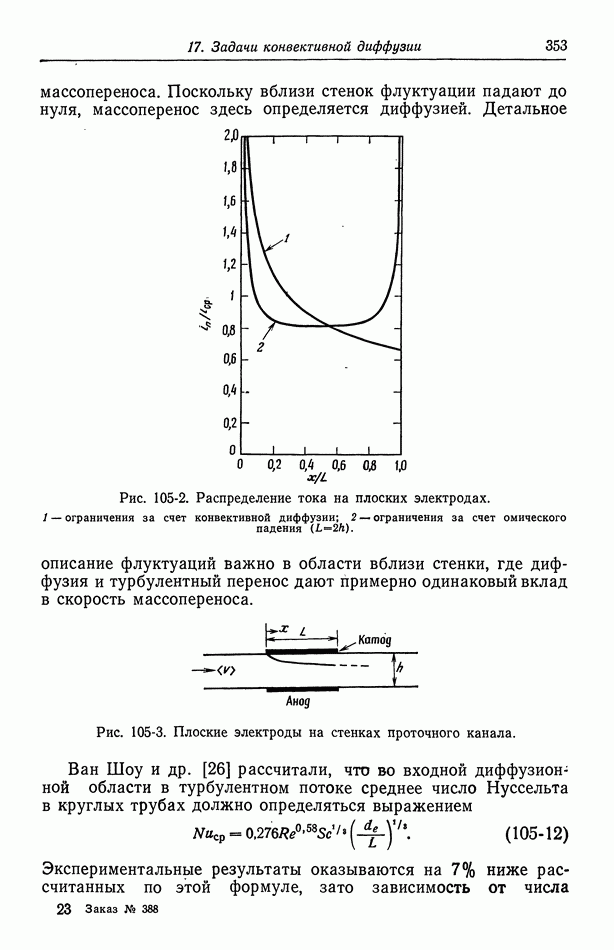
- Глава 17. ЗАДАЧИ КОНВЕКТИВНОЙ ДИФФУЗИИ
- 102. Упрощенное описание конвективной диффузии
- 103. Вращающийся диск
- 104. Задача Граца
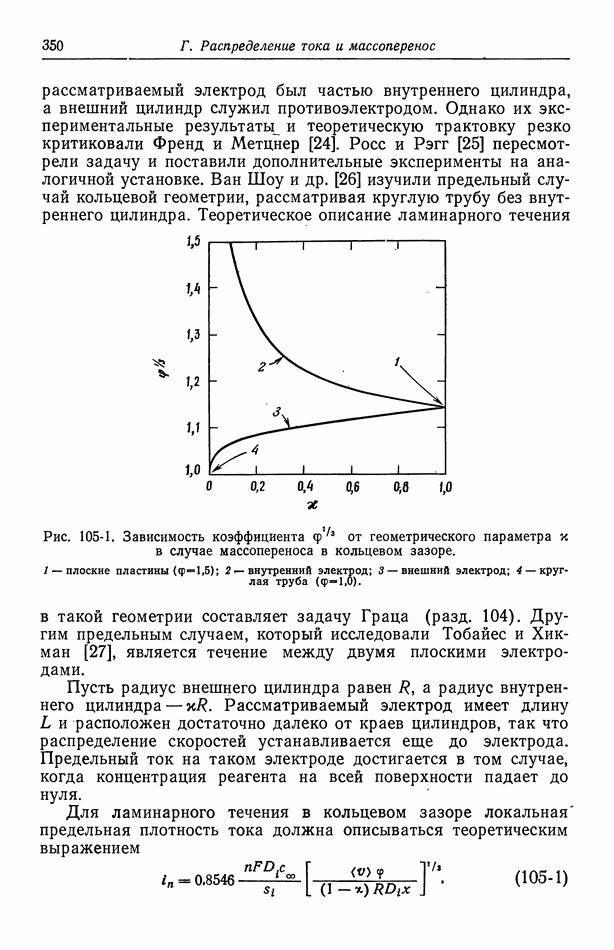
- 105. Кольцевой зазор
- 106. Двумерные диффузионные слои при вынужденной ламинарной конвекции
- 107. Осесимметричные диффузионные слои при вынужденной ламинарной конвекции
- 108. Плоская пластина в свободном потоке
- 109. Вращающиеся цилиндры
- 110. Растущие ртутные капли
- 112. Наложение свободной и вынужденной конвекции
- 113. Ограничения за счет поверхностных реакций
- 114. Бинарные и концентрированные растворы
- Глава 18. ПРИЛОЖЕНИЯ ТЕОРИИ ПОТЕНЦИАЛА
- 115. Упрощения в задачах теории потенциала
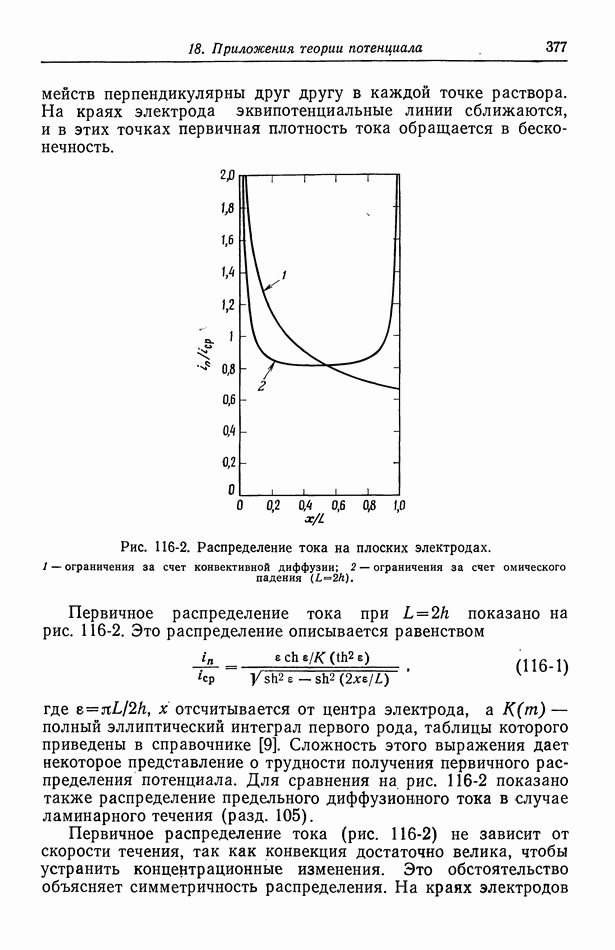
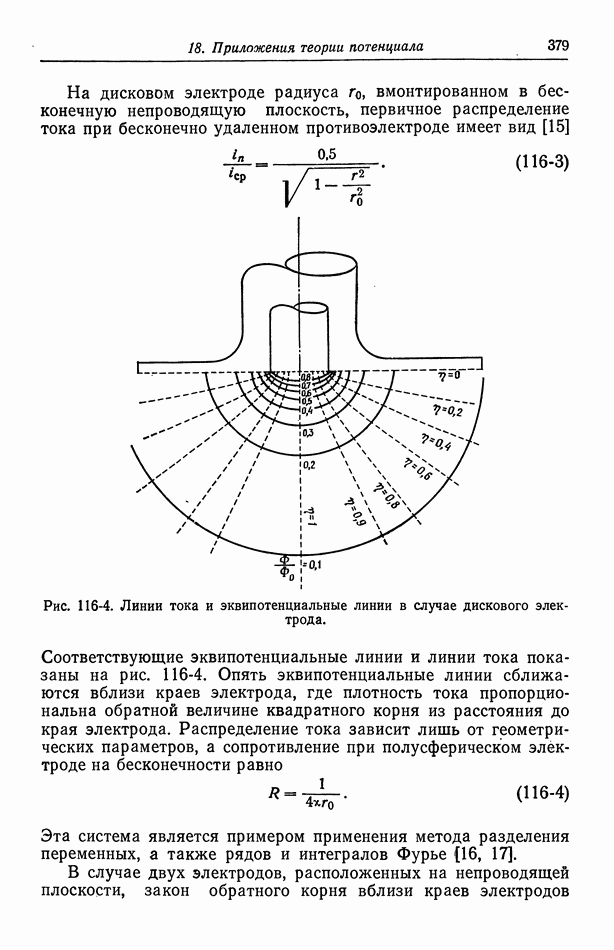
- 116. Первичное распределение тока
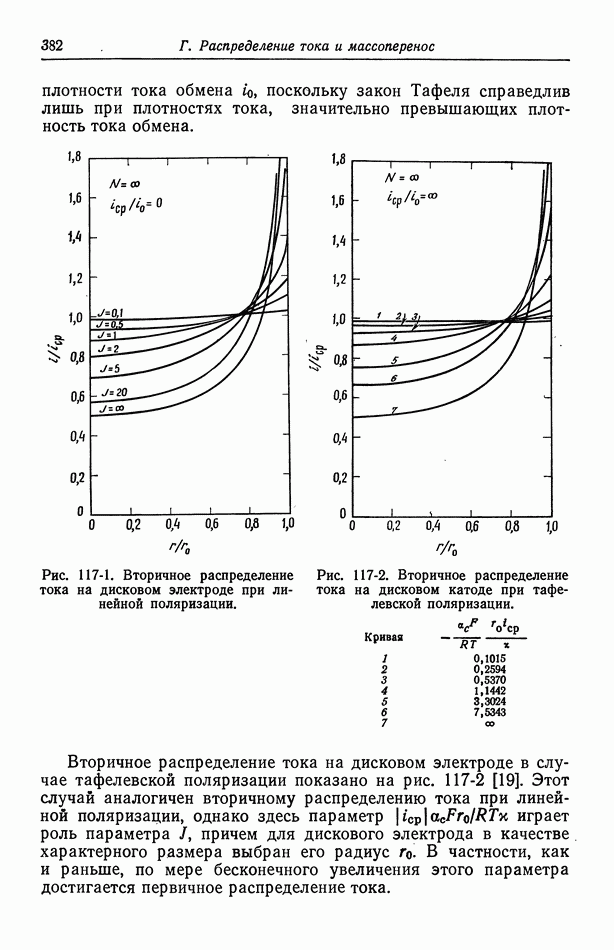
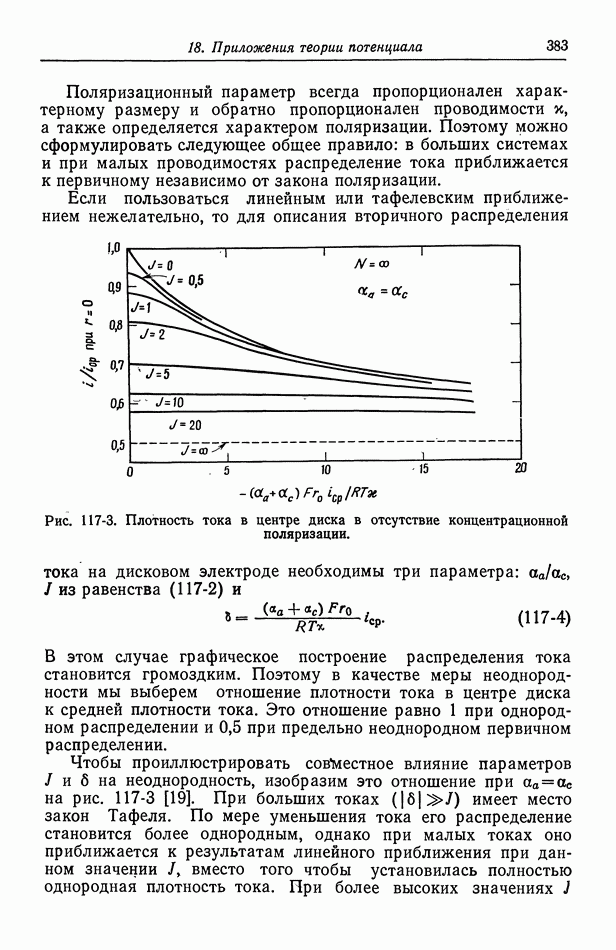
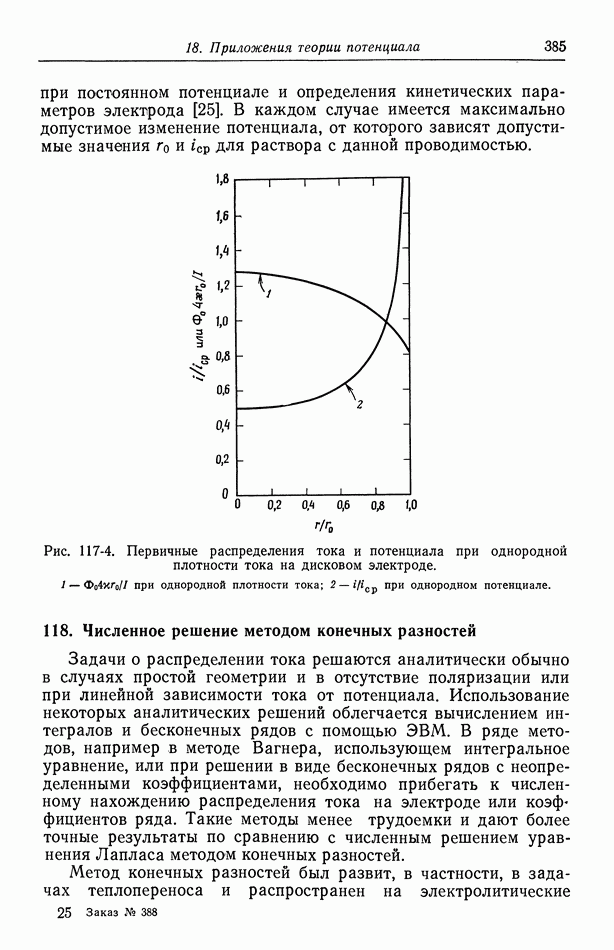
- 117. Вторичное распределение тока
- 118. Численное решение методом конечных разностей
- Глава 19. ВЛИЯНИЕ МИГРАЦИИ НА ПРЕДЕЛЬНЫЕ ТОКИ
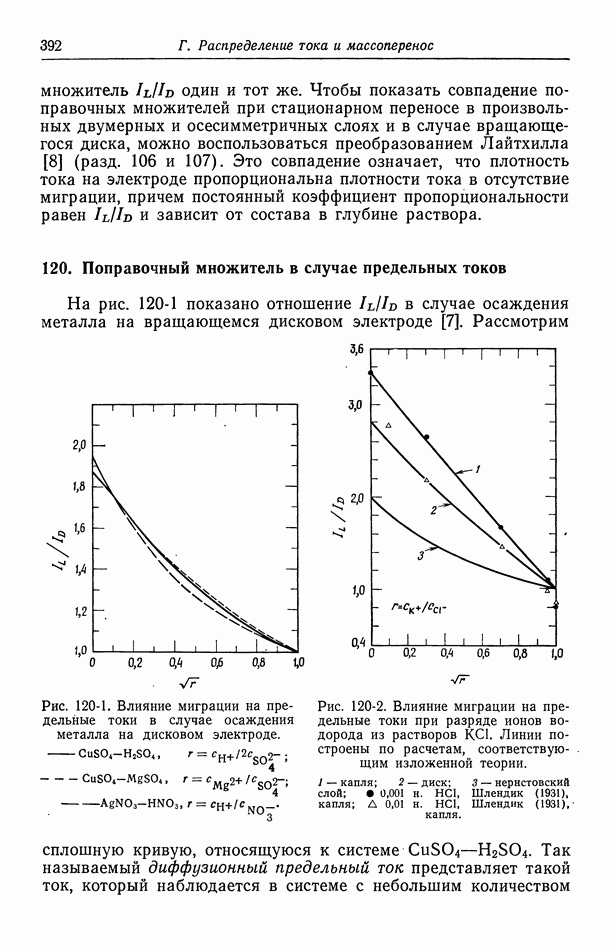
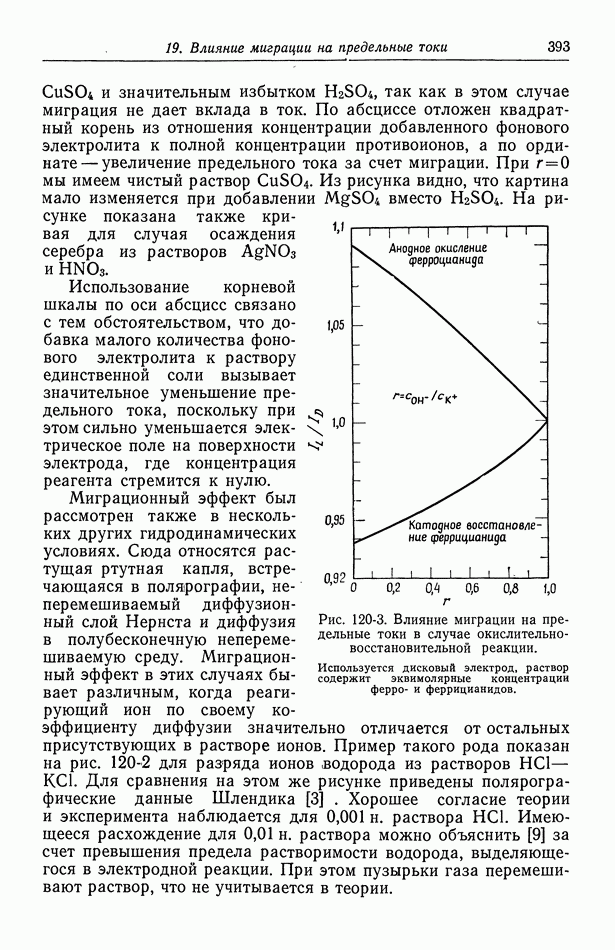
- 120. Поправочный множитель в случае предельных токов
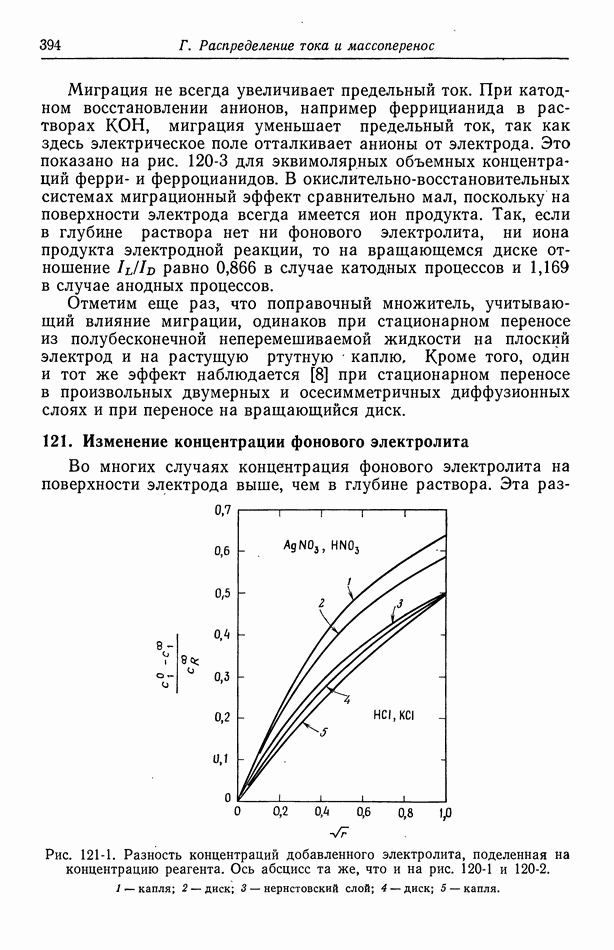
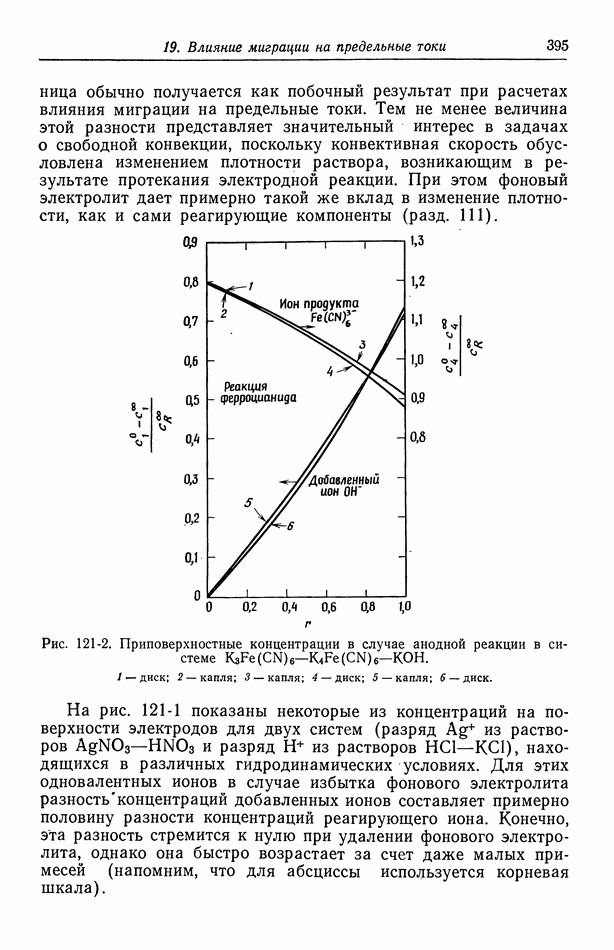
- 121. Изменение концентрации фонового электролита
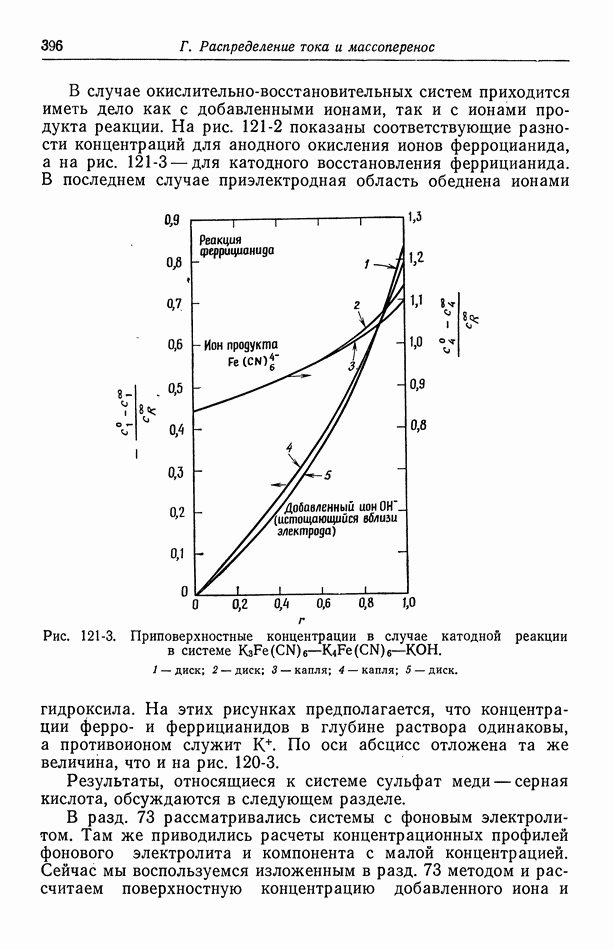
- 122. Роль ионов бисульфата
- 123. Парадоксы с фоновым электролитом
- 124. Предельные токи в случае свободной конвекции
- Глава 20. КОНЦЕНТРАЦИОННОЕ ПЕРЕНАПРЯЖЕНИЕ
- 126. Бинарный электролит
- 127. Фоновый электролит
- 128. Численные расчеты
- Глава 21. ДОПРЕДЕЛЬНЫЕ ТОКИ
- 129. Объем раствора
- 130. Диффузионные слои
- 131. Граничные условия и метод решения
- 132. Результаты для вращающегося диска
- Приложение А. ПАРЦИАЛЬНЫЕ МОЛЯРНЫЕ ОБЪЕМЫ
- Приложение Б. ВЕКТОРЫ И ТЕНЗОРЫ
- Приложение В. ЧИСЛЕННОЕ РЕШЕНИЕ СИСТЕМЫ ОБЫКНОВЕННЫХ ДИФФЕРЕНЦИАЛЬНЫХ УРАВНЕНИЙ