| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
30. Растворы бинарных электролитов
В настоящем разделе мы рассмотрим растворы одного электролита, диссоциирующего на  катионов с зарядовым числом
катионов с зарядовым числом  анионов с зарядовым числом
анионов с зарядовым числом  Термодинамические свойства таких растворов изучались довольно интенсивно; коэффициенты активности и осмотические коэффициенты рассмотрены в книгах [13, 14].
Термодинамические свойства таких растворов изучались довольно интенсивно; коэффициенты активности и осмотические коэффициенты рассмотрены в книгах [13, 14].
Поскольку по отдельности ионные коэффициенты активности могут зависеть от электрического состояния фазы, в уравнении (28-17) такие коэффициенты следует скомбинировать в средний моляльный коэффициент активности 

Из уравнения (28-25) получается соответствующая форма осмотического коэффициента:

Для учета эффектов, которыми теория Дебая-Хюккеля пренебрегала, к этим выражениям можно добавить дополнительные члены

где равенство (30-4) было выведено из уравнения (30-3) с помощью уравнения Гиббса-Дюгема (14-26). Значения коэффициентов А можно определить эмпирически, сопоставляя уравнение (30-3) с данными по коэффициенту активности или уравнение (30-4) с данными по осмотическому коэффициенту. Для получения хорошего совпадения необходимо оставлять достаточное число членов в этих выражениях, но особого значения полученным таким образом коэффициентам А придавать не стоит.
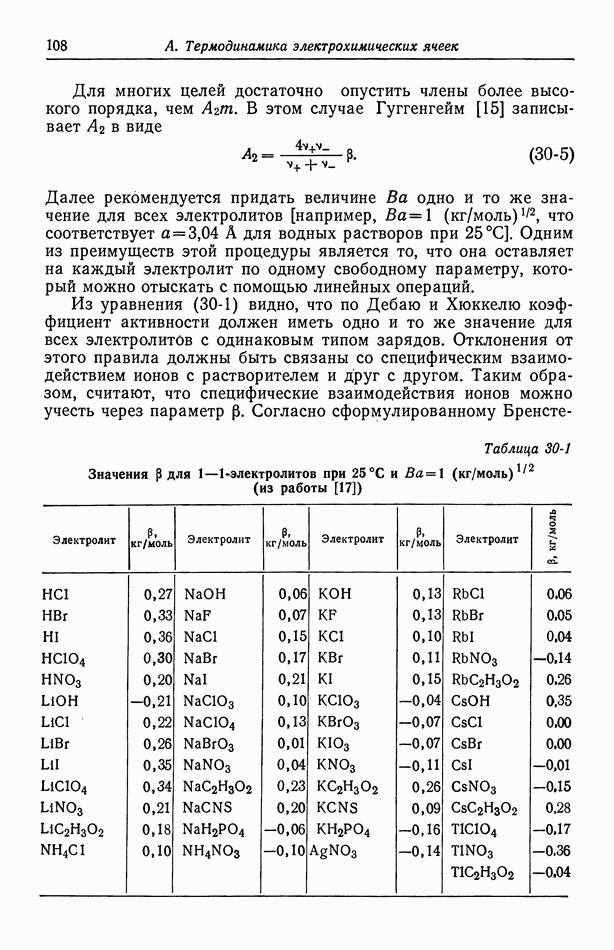
Для многих целей достаточно опустить члены более высокого порядка, чем  . В этом случае Гуггенгейм [15] записывает
. В этом случае Гуггенгейм [15] записывает  в виде
в виде

Далее рекомендуется придать величине  одно и то же значение для всех электролитов [например,
одно и то же значение для всех электролитов [например,  что соответствует
что соответствует  для водных растворов при
для водных растворов при  Одним из преимуществ этой процедуры является то, что она оставляет на каждый электролит по одному свободному параметру, который можно отыскать с помощью линейных операций.
Одним из преимуществ этой процедуры является то, что она оставляет на каждый электролит по одному свободному параметру, который можно отыскать с помощью линейных операций.
Из уравнения (30-1) видно, что по Дебаю и Хюккелю коэффициент активности должен иметь одно и то же значение для всех электролитов с одинаковым типом зарядов. Отклонения от этого правила должны быть связаны со специфическим взаимодействием ионов с растворителем и друг с другом. Таким образом, считают, что специфические взаимодействия ионов можно учесть через параметр  Согласно сформулированному
Согласно сформулированному
Таблица 30-1 (см. скан) Значения  для
для  -электролитов при
-электролитов при  (из работы [17])
(из работы [17])
Бренстедом [16] принципу специфического взаимодействия между ионами, ионы с одинаковыми зарядами будут расталкиваться на такие расстояния, что их взаимодействие будет неспецифическим. Это утверждение составляет основу анализа многокомпонентных систем (разд. 31), поэтому и было выписано выражение (30-5) для  В этом анализе также требуется, чтобы величина
В этом анализе также требуется, чтобы величина  имела одно и то же значение для всех электролитов.
имела одно и то же значение для всех электролитов.
В табл. 30-1 приведены значения  для одно-одновалентных электролитов при
для одно-одновалентных электролитов при  а в табл. 30-2 — значения для 2—1- и 1-2-электролитов.
а в табл. 30-2 — значения для 2—1- и 1-2-электролитов.
Таблица 30-2 (см. скан) Значения  для 2-1- и
для 2-1- и  -электролитов при
-электролитов при  (из работы [19])
(из работы [19])
Питцер и Брюер [13] используют один из электролитов в качестве стандартного и рассматривают  или
или  . В этих отношениях электрические (кулоновские) члены должны в значительной степени компенсироваться, а логарифм отношения должен быть пропорциональным
. В этих отношениях электрические (кулоновские) члены должны в значительной степени компенсироваться, а логарифм отношения должен быть пропорциональным  в разбавленных растворах, если рассматриваемый и стандартный электролиты имеют одинаковый тип валентности. Так, в качестве стандартных Питцер и Брюер используют
в разбавленных растворах, если рассматриваемый и стандартный электролиты имеют одинаковый тип валентности. Так, в качестве стандартных Питцер и Брюер используют  для 1 —
для 1 —  -электролитов и
-электролитов и  для
для  и
и  -электролитов. Еще раньше Льюис и Рендалл [18] проводили аналогичное сравнение при экстраполяции к бесконечному разбавлению для таких
-электролитов. Еще раньше Льюис и Рендалл [18] проводили аналогичное сравнение при экстраполяции к бесконечному разбавлению для таких
электролитов, для которых данные при низких концентрациях либо отсутствовали, либо были ненадежны. Питцер и Брюер не нашли подходящих стандартных электролитов более высоких типов валентности, для которых можно было бы получить согласующиеся данные.

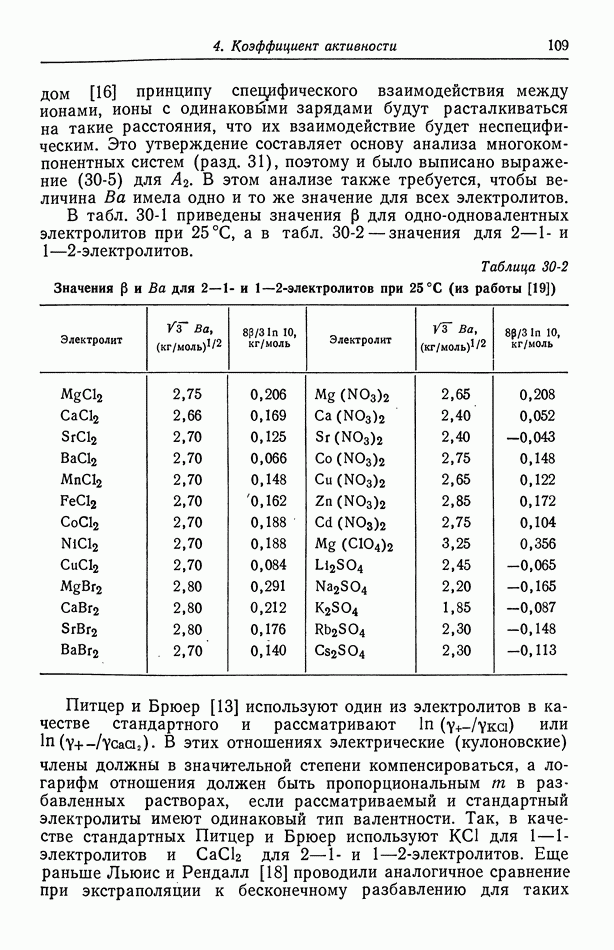
Рис. 30-1. Средние моляльные коэффициенты активности  (из работы [13]) и
(из работы [13]) и  (из работы [20]) и отношение этих коэффициентов.
(из работы [20]) и отношение этих коэффициентов.

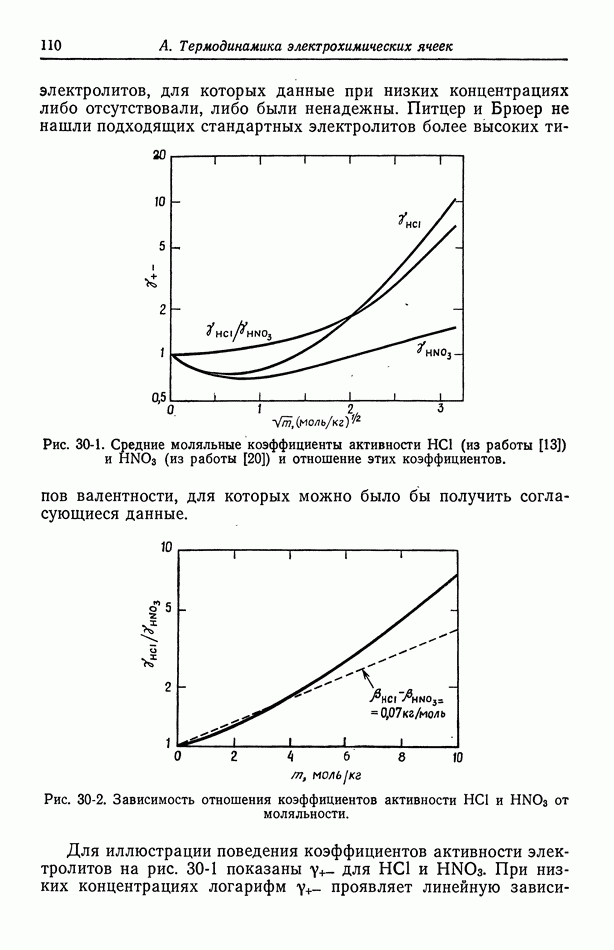
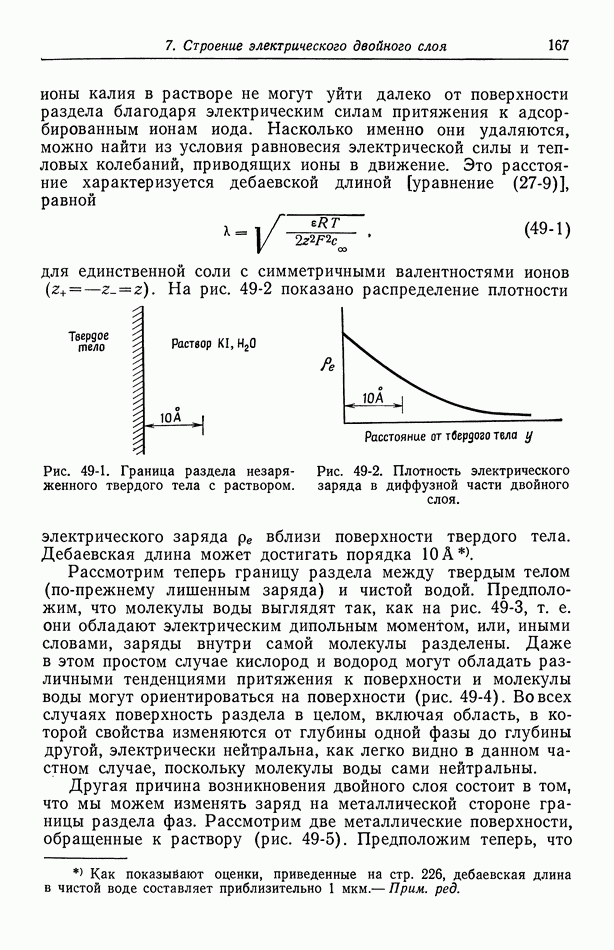
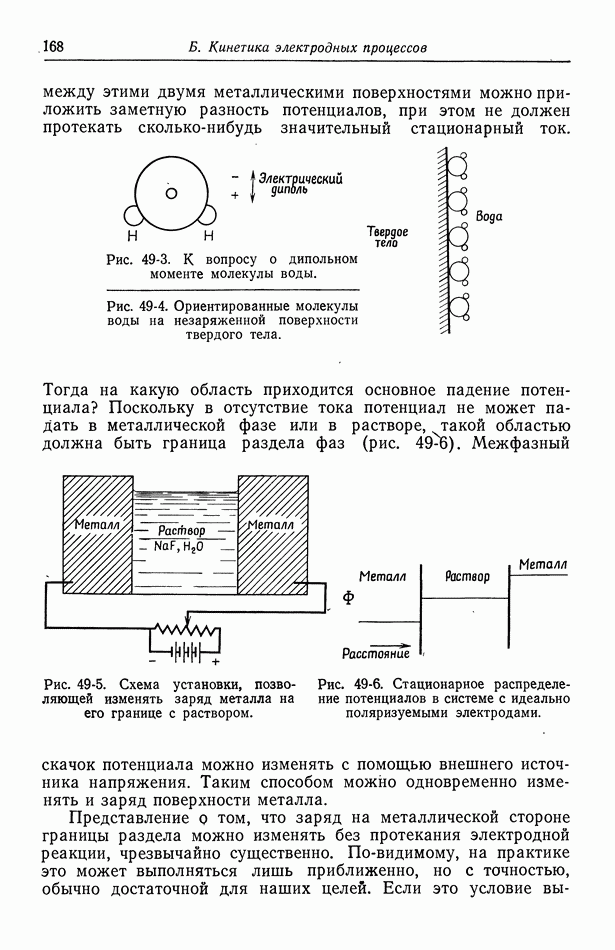
Рис. 30-2. Зависимость отношения коэффициентов активности  от моляльности.
от моляльности.
Для иллюстрации поведения коэффициентов активности электролитов на рис. 30-1 показаны  для
для  и
и  При низких концентрациях логарифм
При низких концентрациях логарифм  проявляет линейную
проявляет линейную
зависимость от  в соответствии с уравнением (30-1) или (30-3), причем при низких концентрациях значения для
в соответствии с уравнением (30-1) или (30-3), причем при низких концентрациях значения для  и
и  приближаются друг к другу. Следовательно, в отношении
приближаются друг к другу. Следовательно, в отношении  электрические эффекты стремятся скомпенсироваться, и, как показано на рис. 30-2, это отношение при низких концентрациях обнаруживает линейную зависимость от
электрические эффекты стремятся скомпенсироваться, и, как показано на рис. 30-2, это отношение при низких концентрациях обнаруживает линейную зависимость от  Наклон этой кривой должен быть пропорциональным разности
Наклон этой кривой должен быть пропорциональным разности 
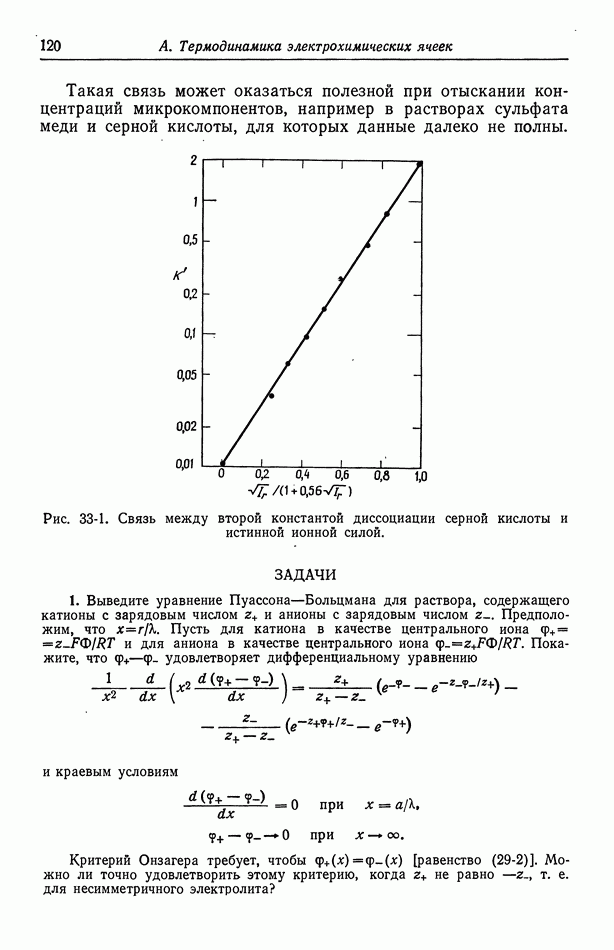
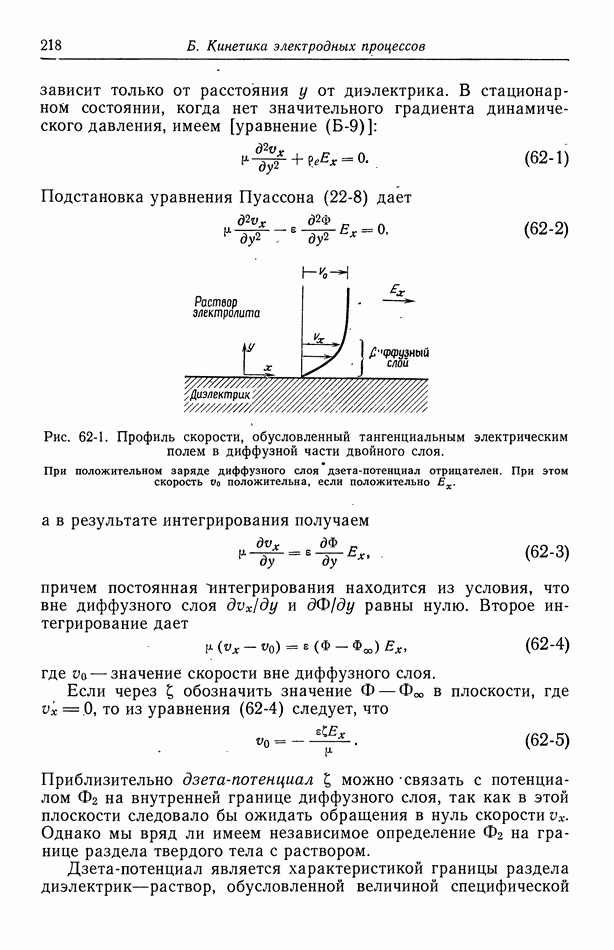
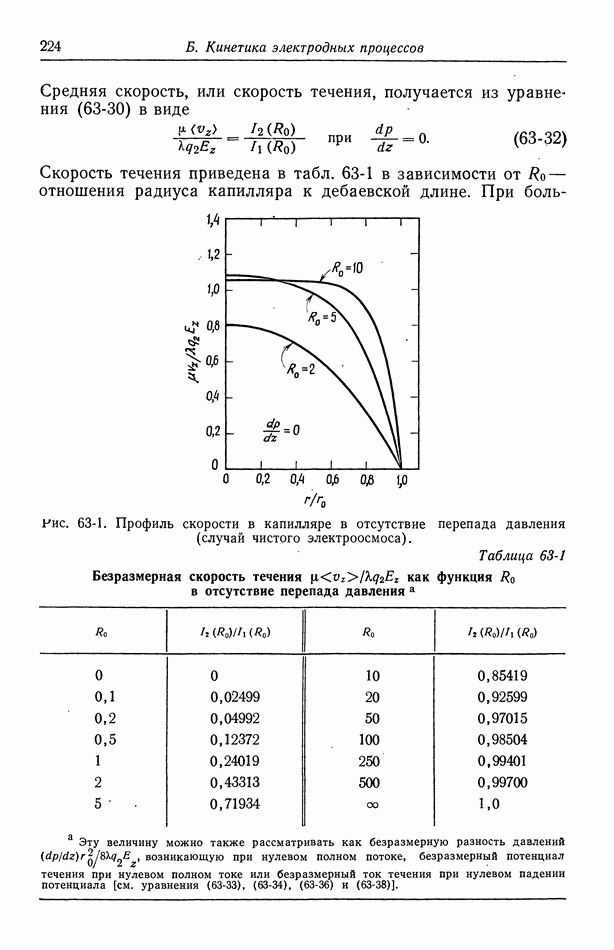
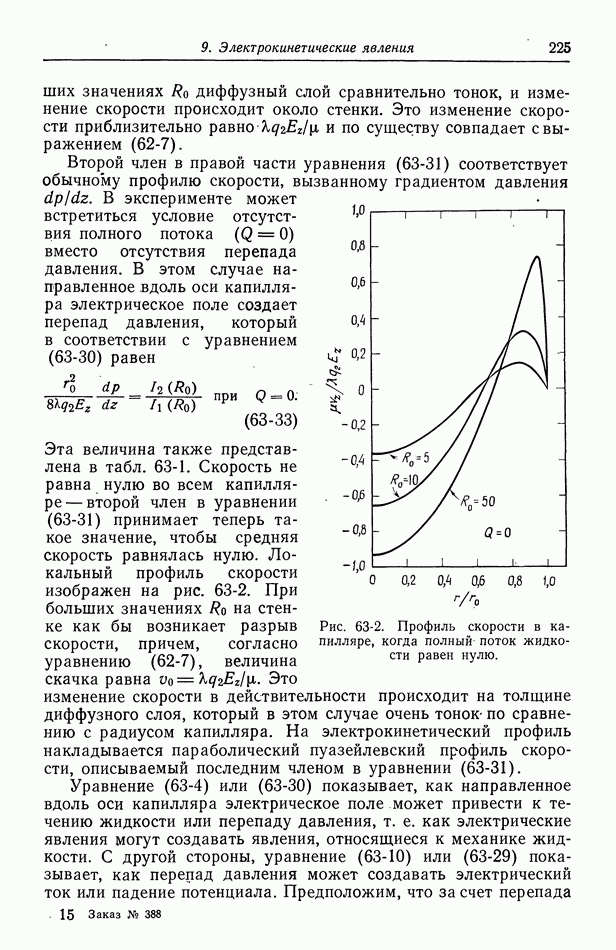
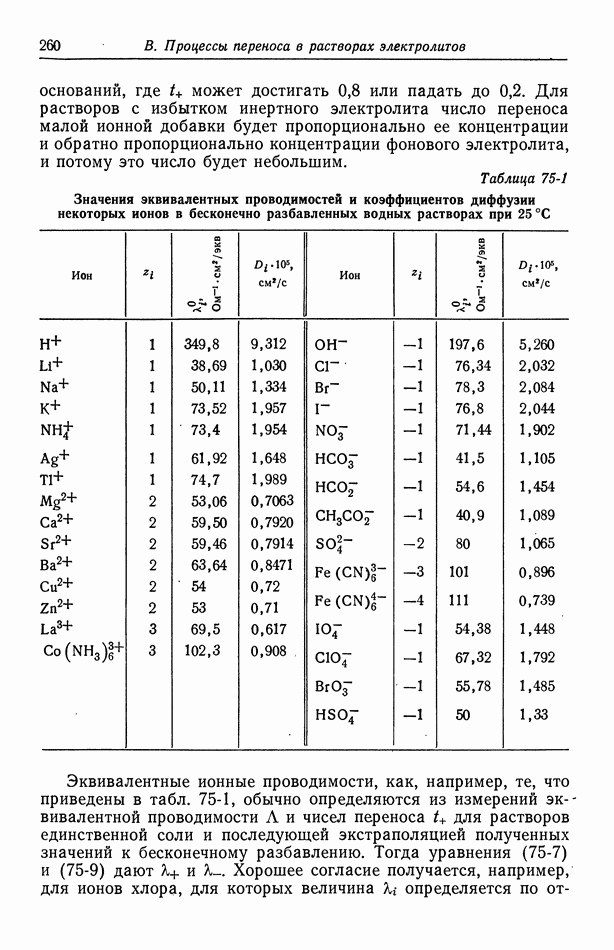
Робинсон и Стоке [14], основываясь на химической модели гидратации, получают двухпараметрическое уравнение, которое можно привести в соответствие с данными по коэффициенту активности.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- Глава 1. ВВЕДЕНИЕ
- 1. Термодинамика, кинетика электродных процессов и процессы переноса
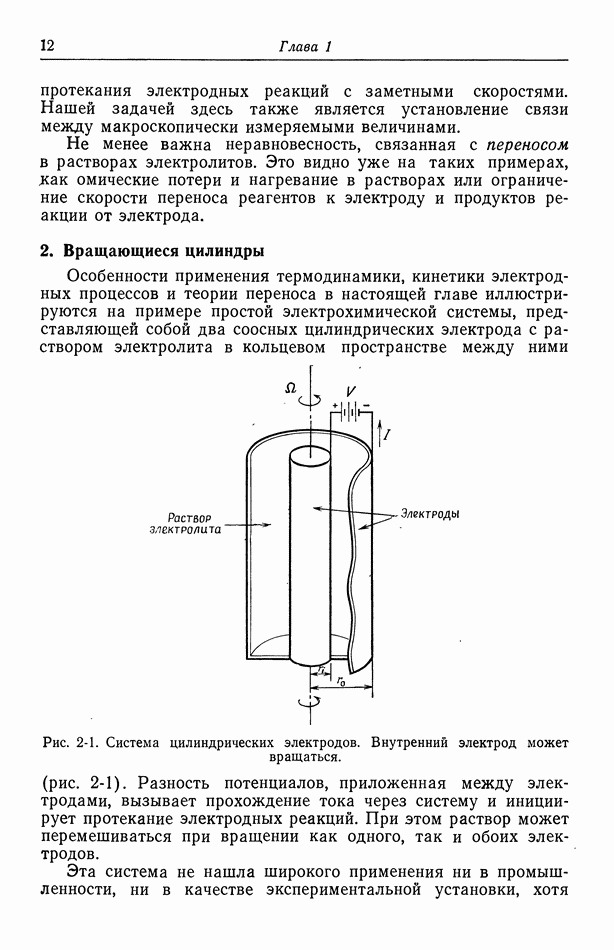
- 2. Вращающиеся цилиндры
- 3. Прохождение тока в электролитах
- 4. Течение жидкости
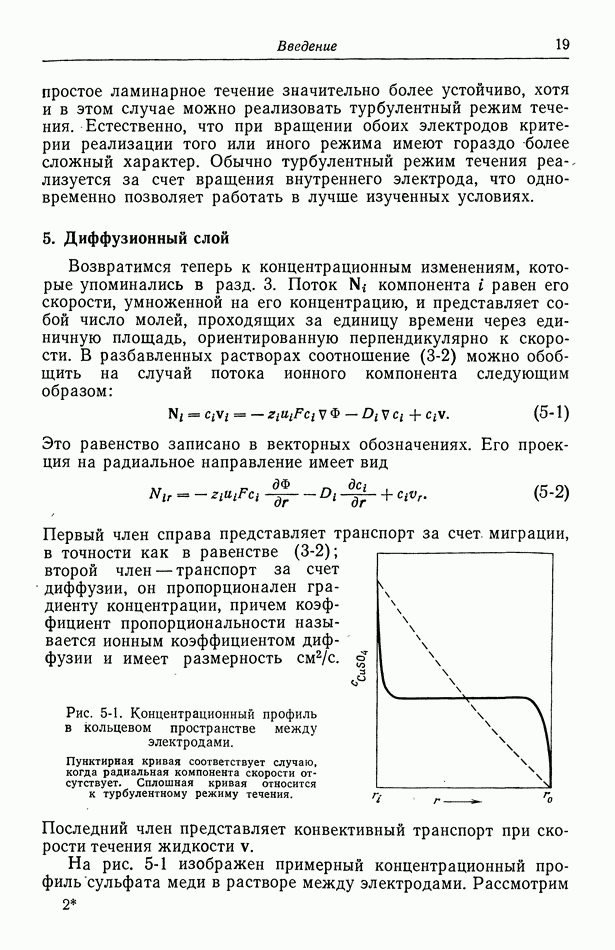
- 5. Диффузионный слой
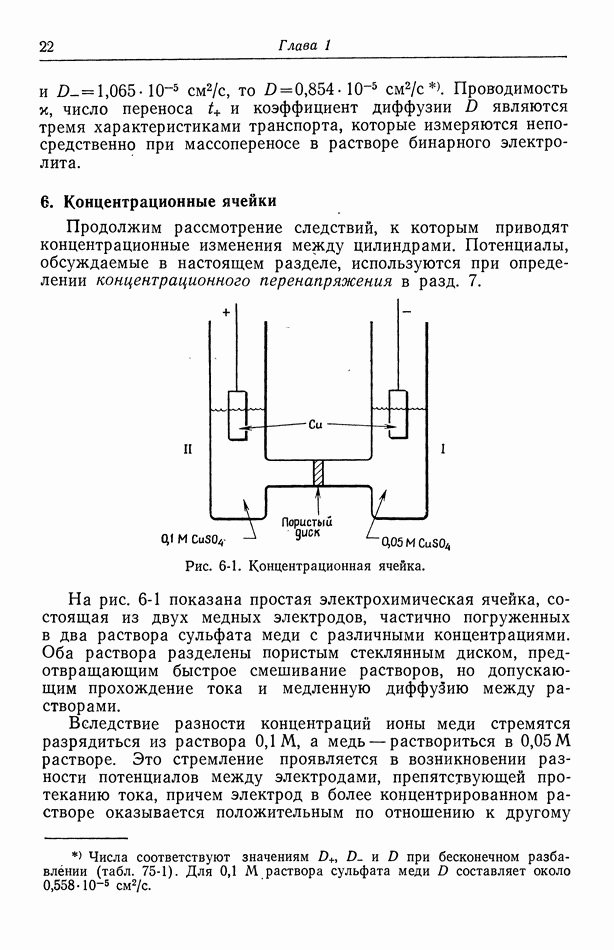
- 6. Концентрационные ячейки
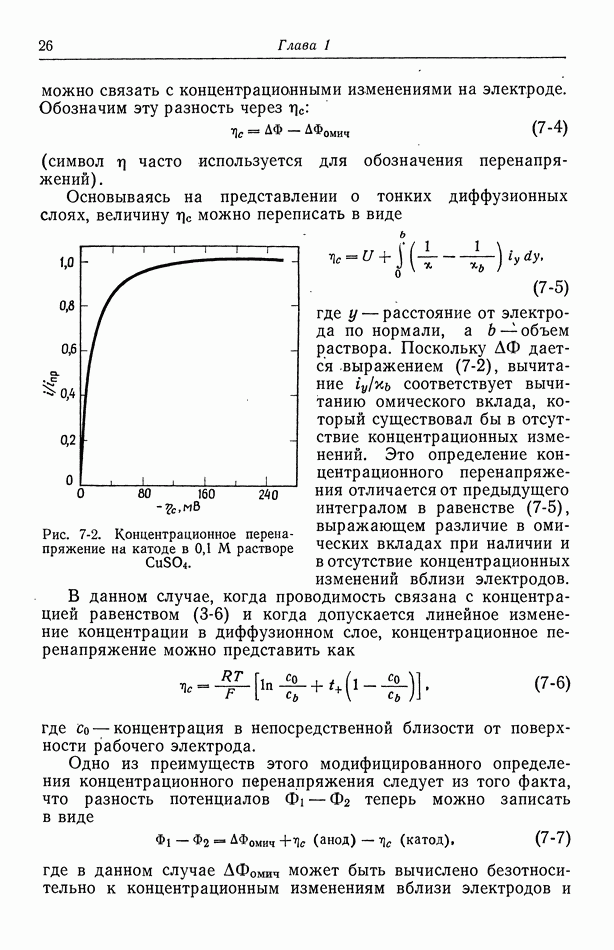
- 7. Концентрационное перенапряжение
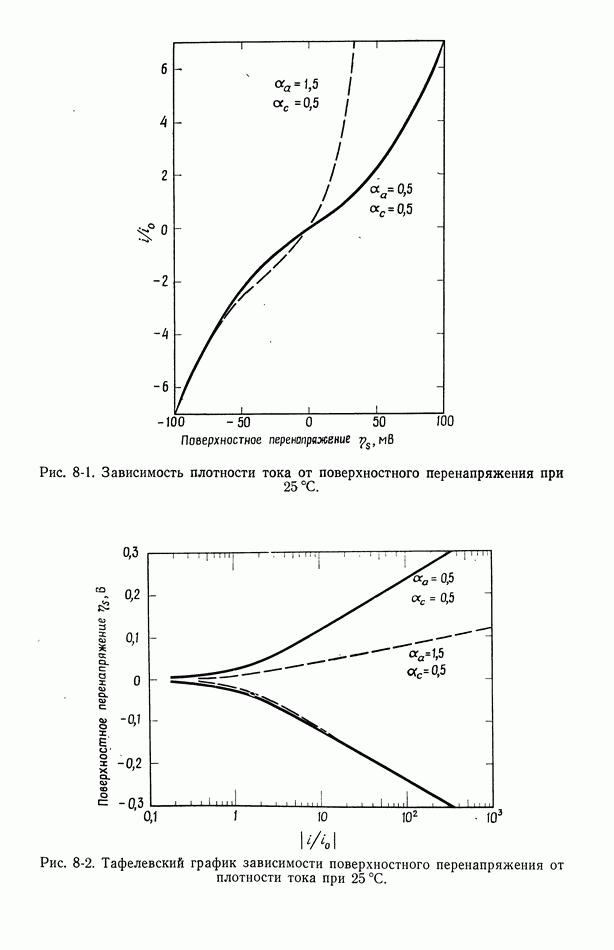
- 8. Поверхностное перенапряжение
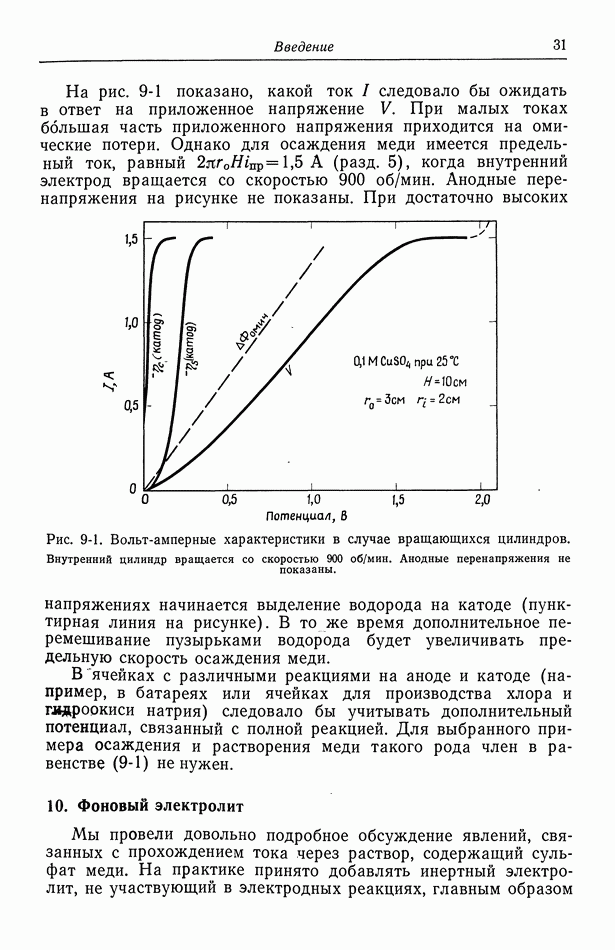
- 9. Потенциал ячейки
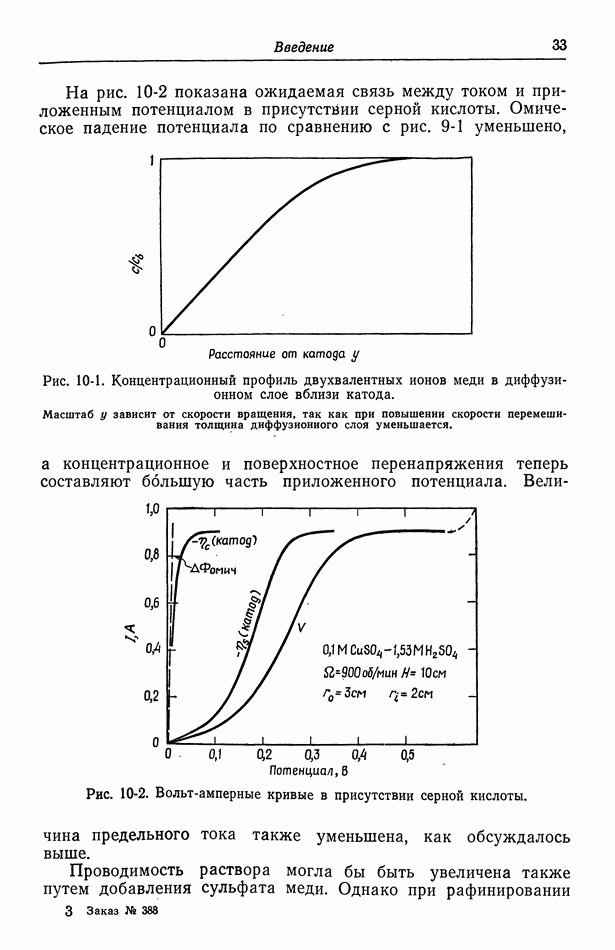
- 10. Фоновый электролит
- 11. Свободная конвекция
- Часть А. ТЕРМОДИНАМИКА ЭЛЕКТРОХИМИЧЕСКИХ ЯЧЕЕК
- Глава 2. ТЕРМОДИНАМИКА НА ЯЗЫКЕ ЭЛЕКТРОХИМИЧЕСКИХ ПОТЕНЦИАЛОВ
- 12. Равновесие фаз
- 13. Химический и электрохимический потенциалы
- 14. Определение некоторых термодинамических функций
- 15. Ячейка с раствором однородной концентрации
- 16. Процессы переноса в областях контакта
- 17. Ячейка с одним электролитом переменной концентрации
- 18. Ячейка с двумя электролитами, концентрация одного из которых почти однородна
- 19. Ячейка с двумя электролитами переменной концентрации
- 20. Стандартный потенциал ячейки и коэффициенты активности
- Глава 3. ЭЛЕКТРИЧЕСКИЙ ПОТЕНЦИАЛ
- 22. Электростатический потенциал
- 23. Межмолекулярные силы
- 24. Внешний и внутренний потенциалы
- 25. Потенциалы электродов сравнения
- 26. Электрический потенциал в термодинамике
- Глава 4. КОЭФФИЦИЕНТЫ АКТИВНОСТИ
- 27. Распределение ионов в разбавленных растворах
- 28. Электрический вклад в свободную энергию
- 29. Недостатки модели Дебая-Хюккеля
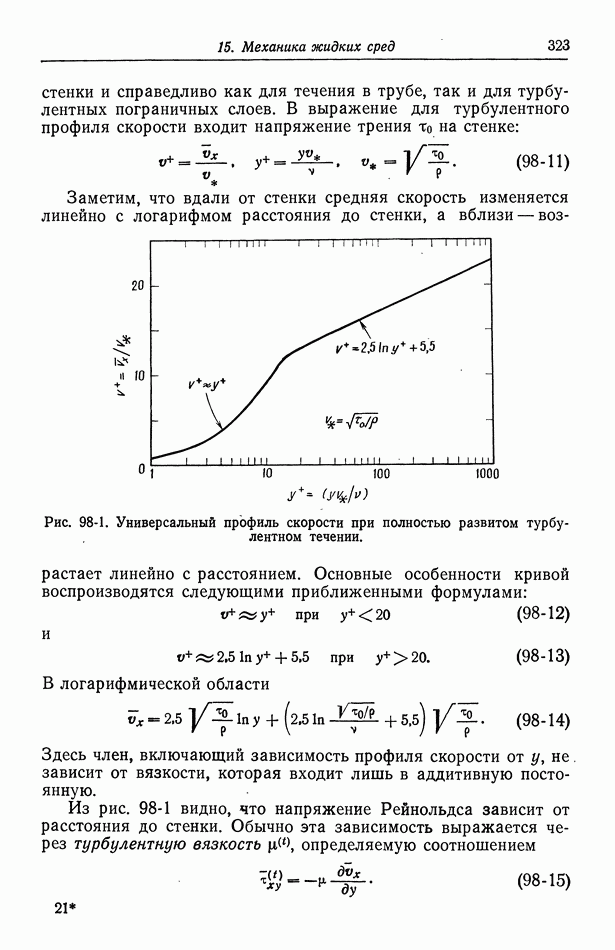
- 30. Растворы бинарных электролитов
- 31. Многокомпонентные растворы
- 32. Измерение коэффициентов активности
- 33. Слабые электролиты
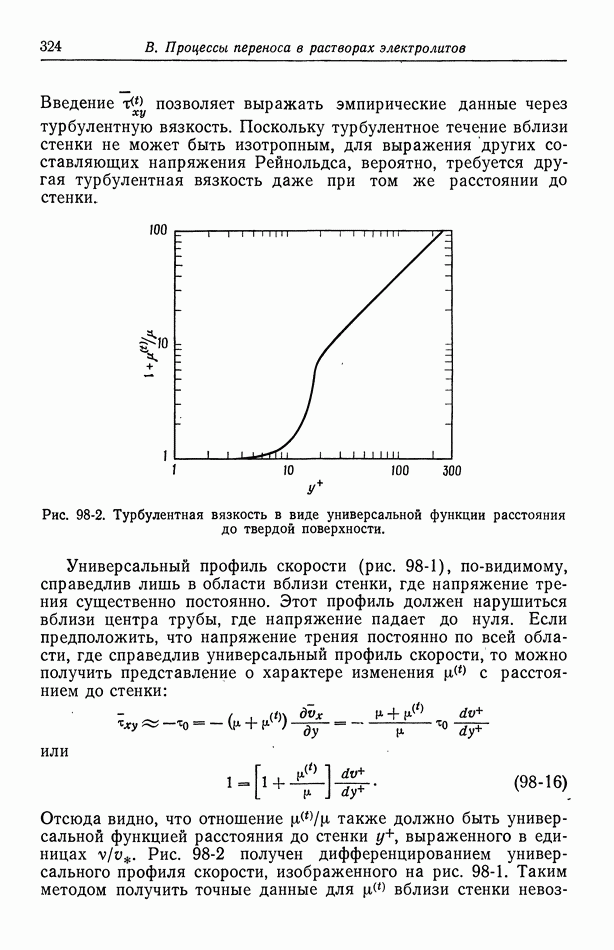
- Глава 5. ЭЛЕКТРОДЫ СРАВНЕНИЯ
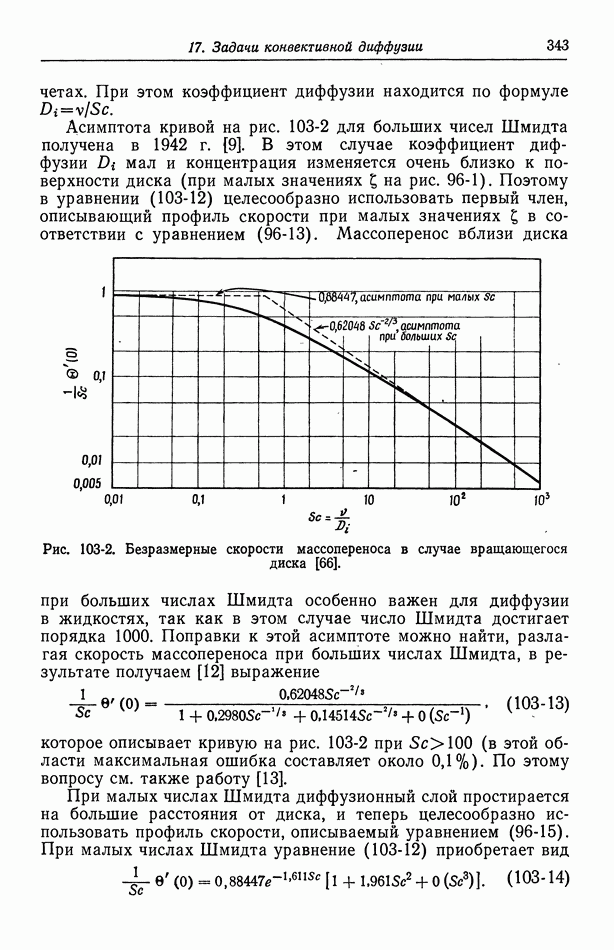
- 34. Критерии выбора электродов сравнения
- 35. Экспериментальные факторы, влияющие на выбор электродов сравнения
- 36. Водородный электрод
- 37. Каломельный электрод и другие электроды типа ртуть—соль ртути
- 38. Окиснортутный электрод
- 39. Электроды типа серебро—галогенид серебра
- 40. Потенциалы относительно данного электрода сравнения
- Глава 6. ПОТЕНЦИАЛЫ ЯЧЕЕК С ПЕРЕНОСОМ
- 41. Уравнение Нернста
- 42. Типы жидкостных соединений
- 43. Формулы для потенциалов жидкостных соединений
- 44. Определение концентрационных профилей
- 45. Численные результаты
- 46. Ячейки с жидкостным соединением
- 47. Поправки к уравнению Нернста
- 48. Мембранные потенциалы
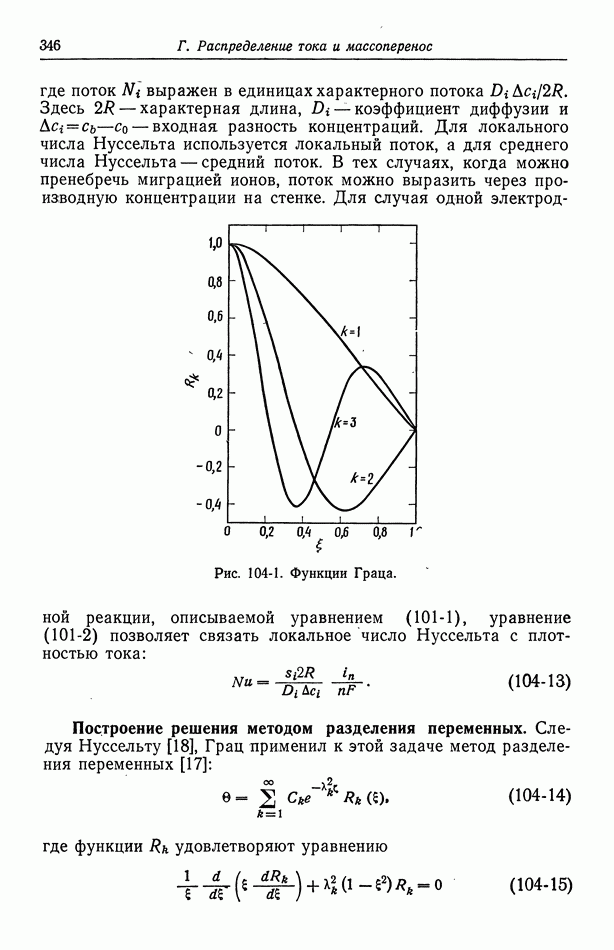
- Часть Б. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ И ДРУГИЕ ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
- Глава 7. СТРОЕНИЕ ЭЛЕКТРИЧЕСКОГО ДВОЙНОГО СЛОЯ
- 50. Изотерма адсорбции Гиббса
- 51. Уравнение Липпмана
- 52. Диффузная часть двойного слоя
- 53. Емкость двойного слоя в отсутствие специфической адсорбции
- 54. Специфическая адсорбция на границе раздела электрод—раствор
- Глава 8. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ
- 55. Гетерогенные электродные реакции
- 56. Зависимость плотности тока от поверхностного перенапряжения
- 57. Модели в кинетике электродных процессов
- 58. Влияние строения двойного слоя
- 59. Кислородный электрод
- 60. Методы измерения
- 61. Одновременно протекающие реакции
- Глава 9. ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ
- 62. Разрывная скорость на границе раздела
- 63. Электроосмос и потенциал течения
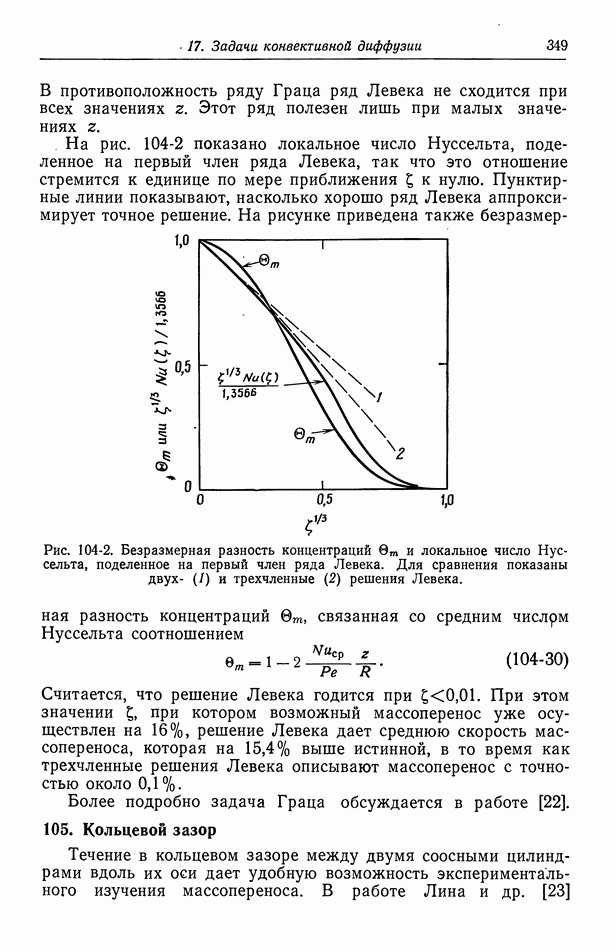
- 64. Электрофорез
- 65. Потенциал осаждения
- Глава 10. ЭЛЕКТРОКАПИЛЛЯРНЫЕ ЯВЛЕНИЯ
- 67. Электрокапиллярное движение ртутных капель
- 68. Потенциалы осаждения для падающих ртутных капель
- Часть В. ПРОЦЕССЫ ПЕРЕНОСА В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- Глава 11. БЕСКОНЕЧНО РАЗБАВЛЕННЫЕ РАСТВОРЫ
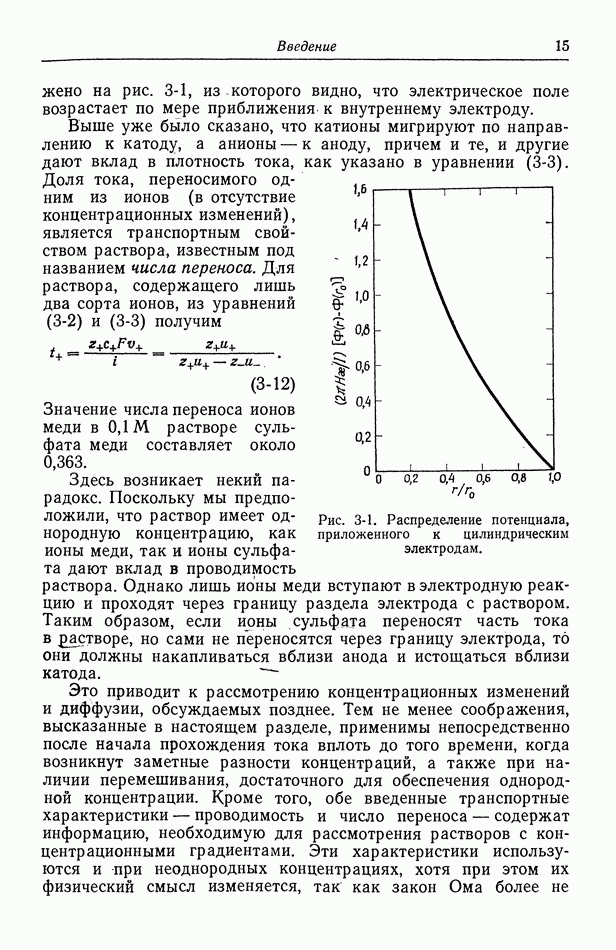
- 70. Проводимость, диффузионные потенциалы и числа переноса
- 71. Сохранение заряда
- 72. Бинарный электролит
- 73. Фоновый электролит
- 74. Многокомпонентная диффузия, возникающая при исключении электрического поля
- 75. Подвижности и коэффициенты диффузии
- 76. Электронейтральность и уравнение Лапласа
- 77. Умеренно разбавленные растворы
- Глава 12. КОНЦЕНТРИРОВАННЫЕ РАСТВОРЫ
- 79. Бинарный электролит
- 80. Стандартные скорости
- 81. Потенциал
- 82. Связь с теорией разбавленных растворов
- 83. Многокомпонентный транспорт
- 84. Потенциалы жидкостного соединения
- Глава 13. ТЕПЛОВЫЕ ЭФФЕКТЫ
- 85. Термодиффузия
- 86. Выделение и перенос тепла
- 87. Тепловыделение на границе раздела фаз
- 88. Термогальванические ячейки
- Глава 14. ХАРАКТЕРИСТИКИ ПЕРЕНОСА
- 89. Бесконечно разбавленные растворы
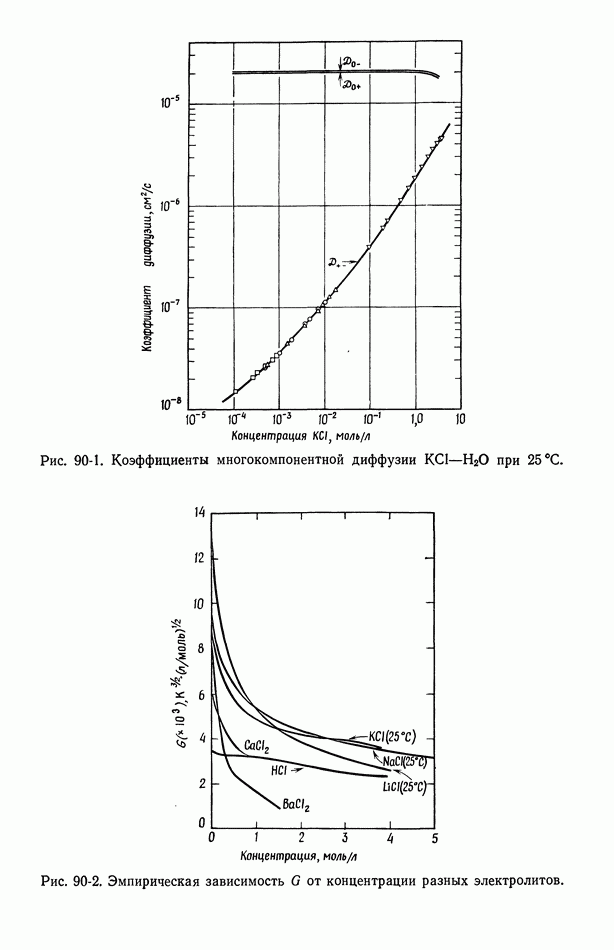
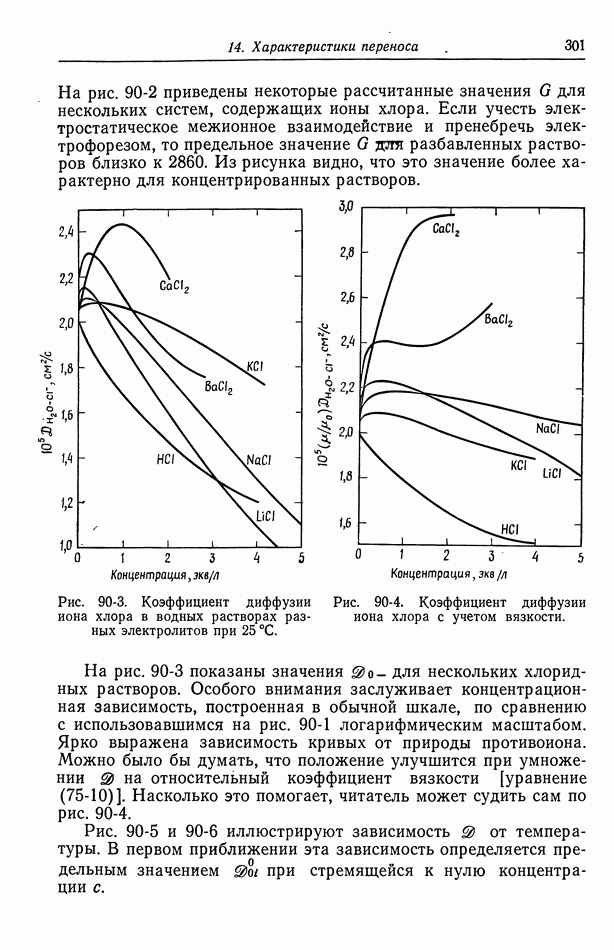
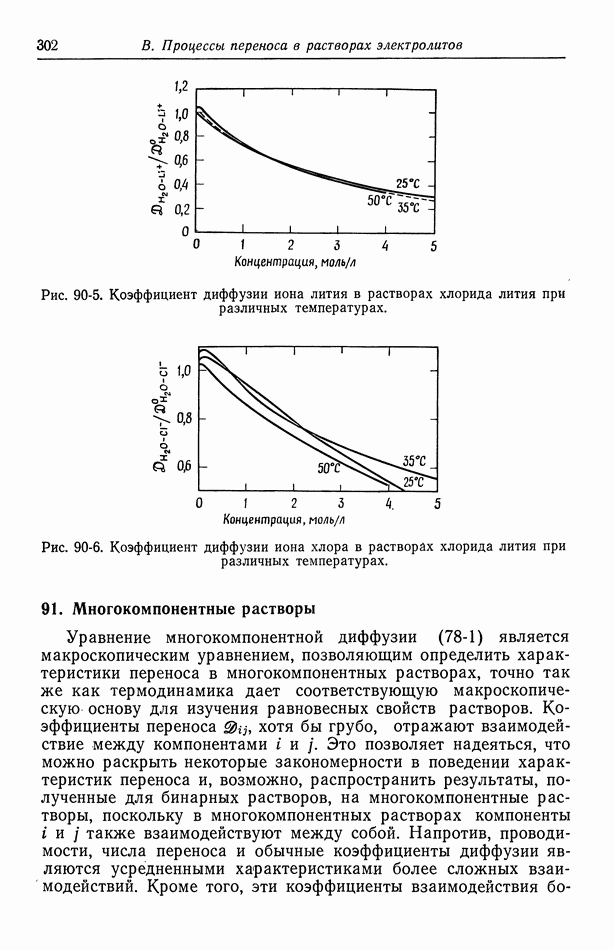
- 90. Растворы, содержащие одну соль
- 91. Многокомпонентные растворы
- 92. Интегральные коэффициенты диффузии
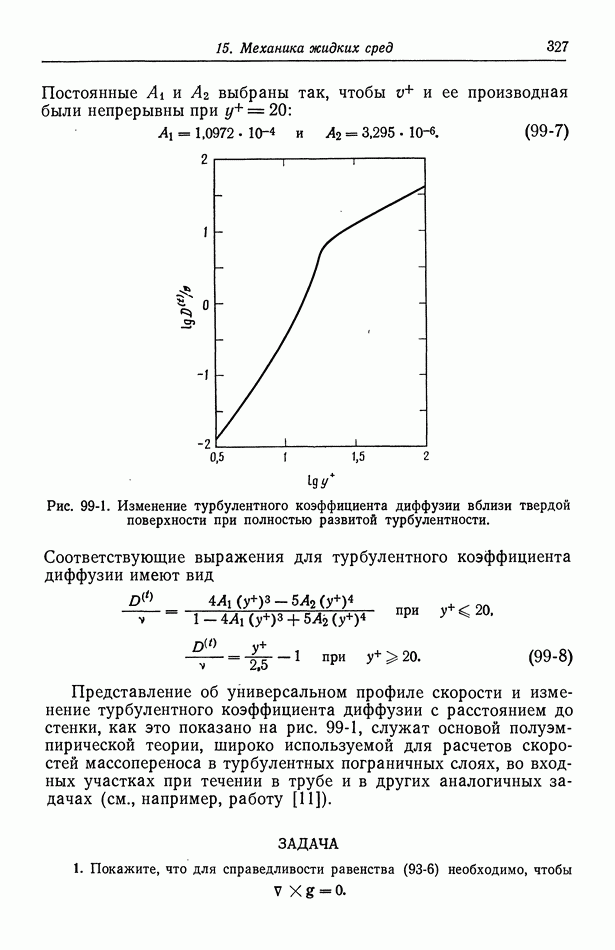
- Глава 15. МЕХАНИКА ЖИДКИХ СРЕД
- 93. Баланс массы и импульса
- 94. Напряжение в ньютоновской жидкости
- 95. Граничные условия
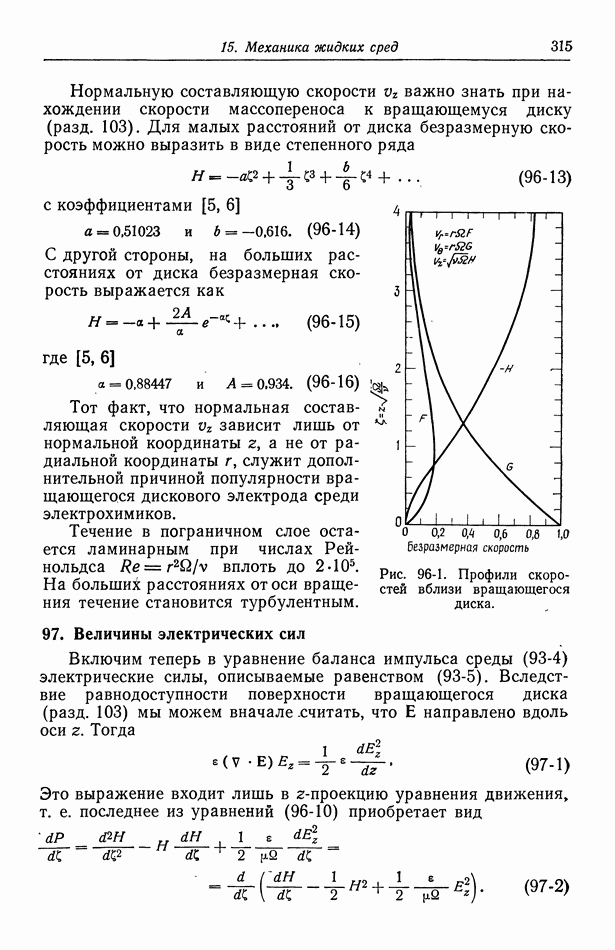
- 96. Течение жидкости к вращающемуся диску
- 97. Величины электрических сил
- 98. Турбулентное течение
- 99. Массоперенос в турбулентном потоке
- Часть Г. РАСПРЕДЕЛЕНИЕ ТОКА И МАССОПЕРЕНОС В ЭЛЕКТРОХИМИЧЕСКИХ СИСТЕМАХ
- Глава 16. ОСНОВНЫЕ УРАВНЕНИЯ
- 100. Перенос в разбавленных растворах
- 101. Кинетика электродных процессов
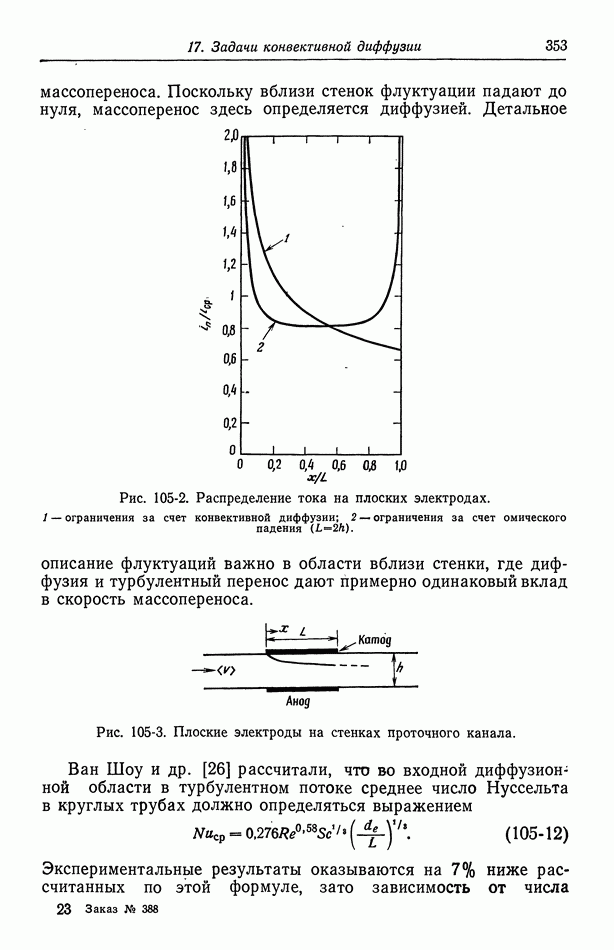
- Глава 17. ЗАДАЧИ КОНВЕКТИВНОЙ ДИФФУЗИИ
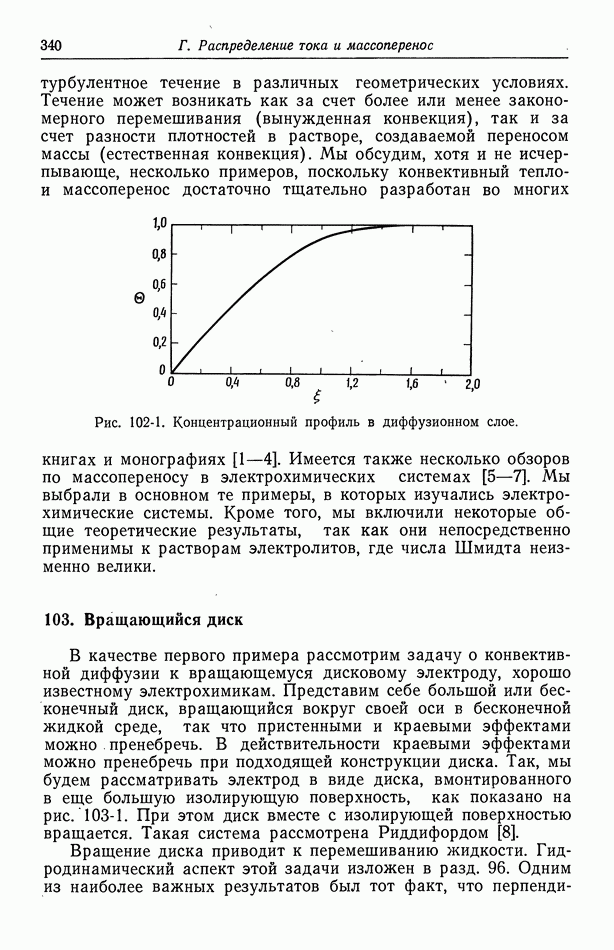
- 102. Упрощенное описание конвективной диффузии
- 103. Вращающийся диск
- 104. Задача Граца
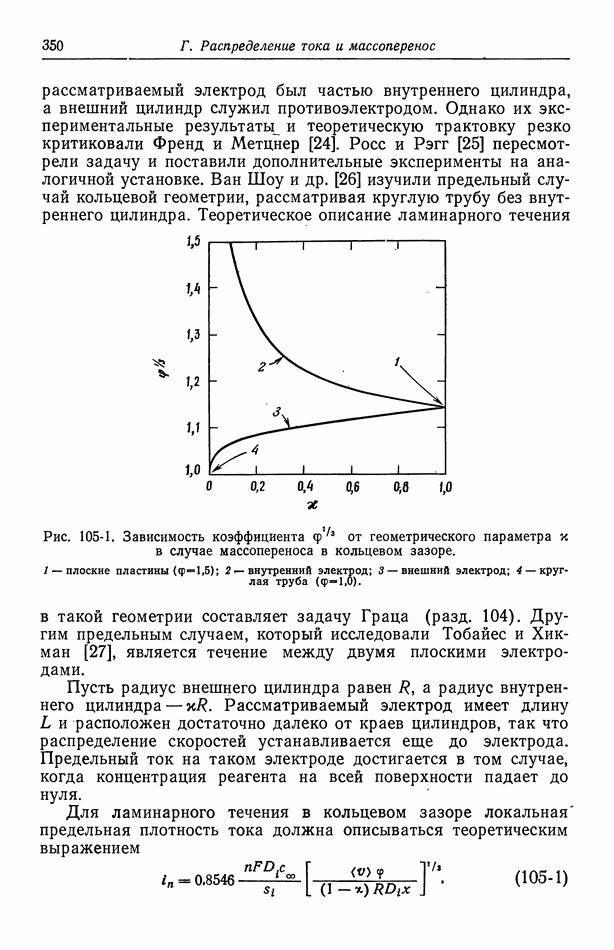
- 105. Кольцевой зазор
- 106. Двумерные диффузионные слои при вынужденной ламинарной конвекции
- 107. Осесимметричные диффузионные слои при вынужденной ламинарной конвекции
- 108. Плоская пластина в свободном потоке
- 109. Вращающиеся цилиндры
- 110. Растущие ртутные капли
- 112. Наложение свободной и вынужденной конвекции
- 113. Ограничения за счет поверхностных реакций
- 114. Бинарные и концентрированные растворы
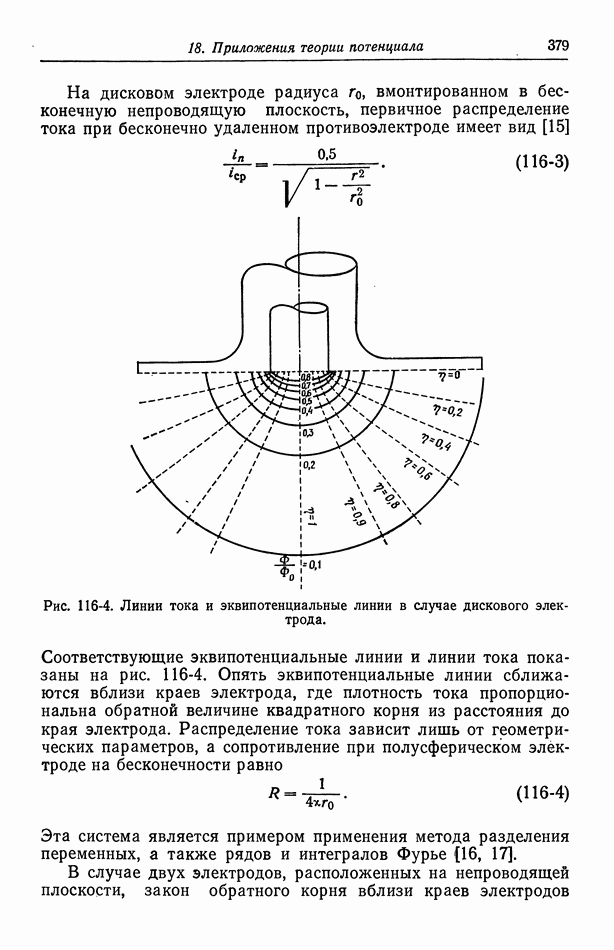
- Глава 18. ПРИЛОЖЕНИЯ ТЕОРИИ ПОТЕНЦИАЛА
- 115. Упрощения в задачах теории потенциала
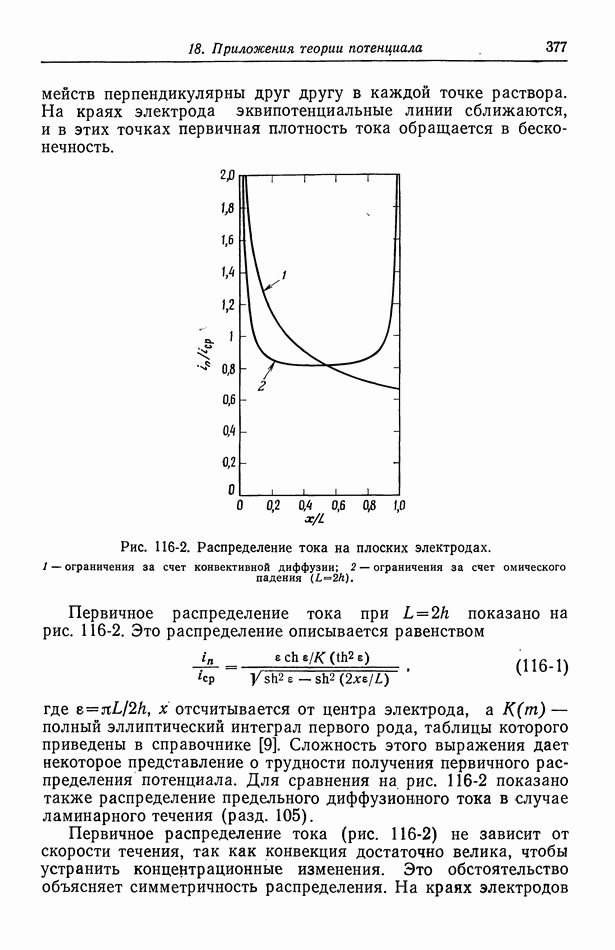
- 116. Первичное распределение тока
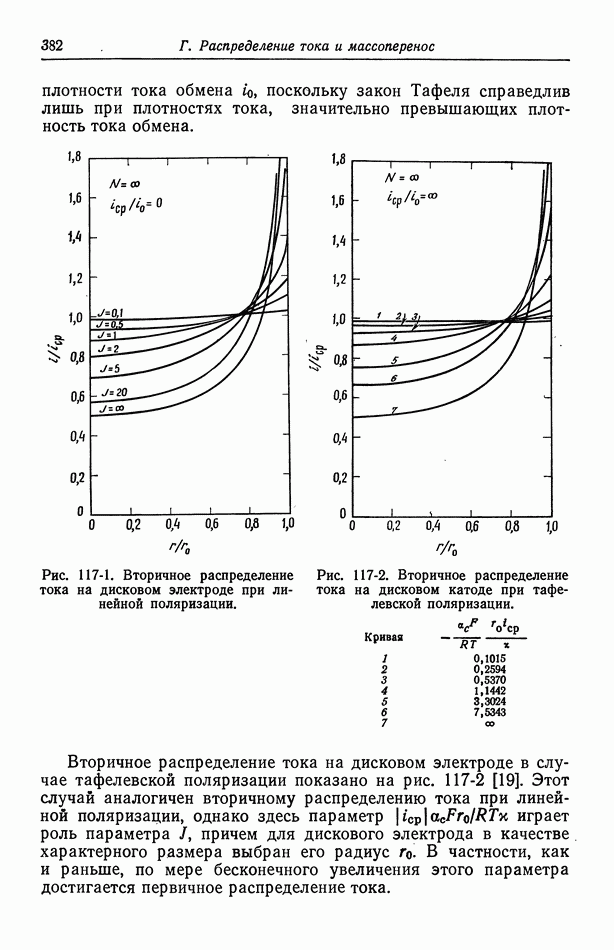
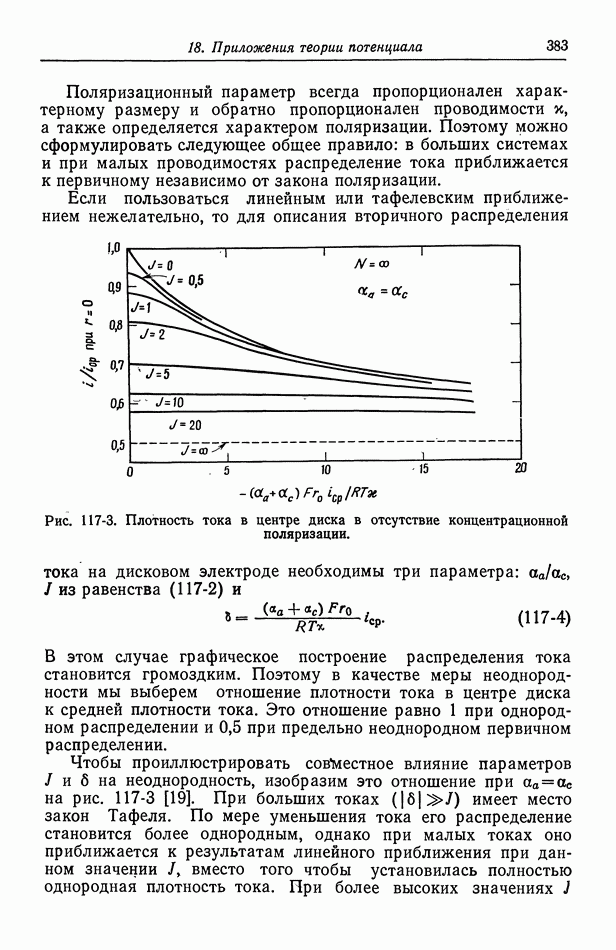
- 117. Вторичное распределение тока
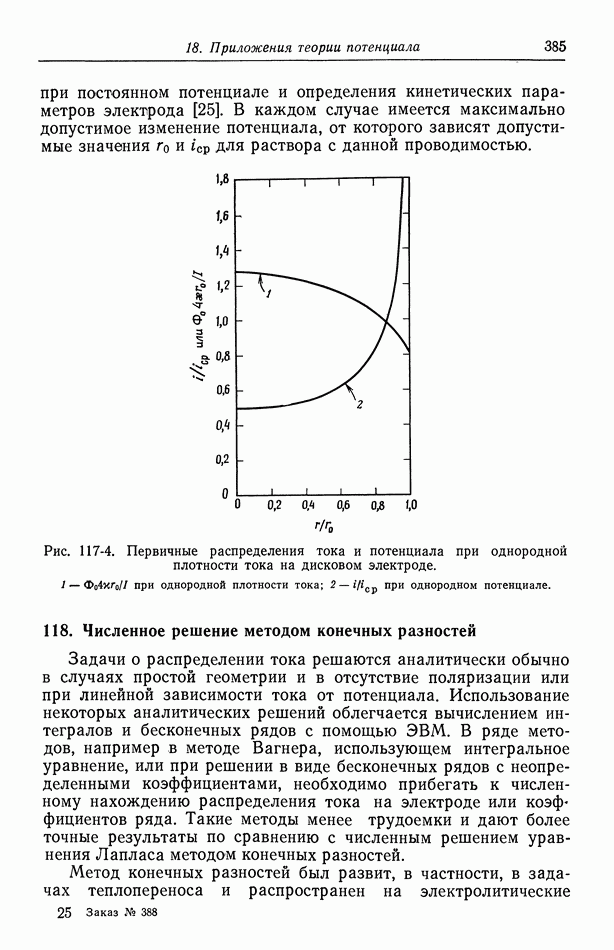
- 118. Численное решение методом конечных разностей
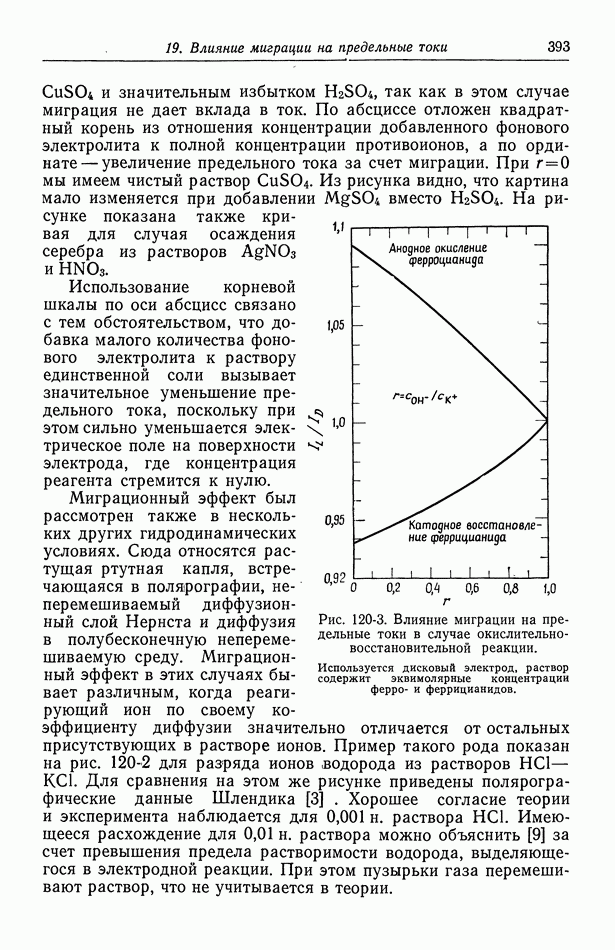
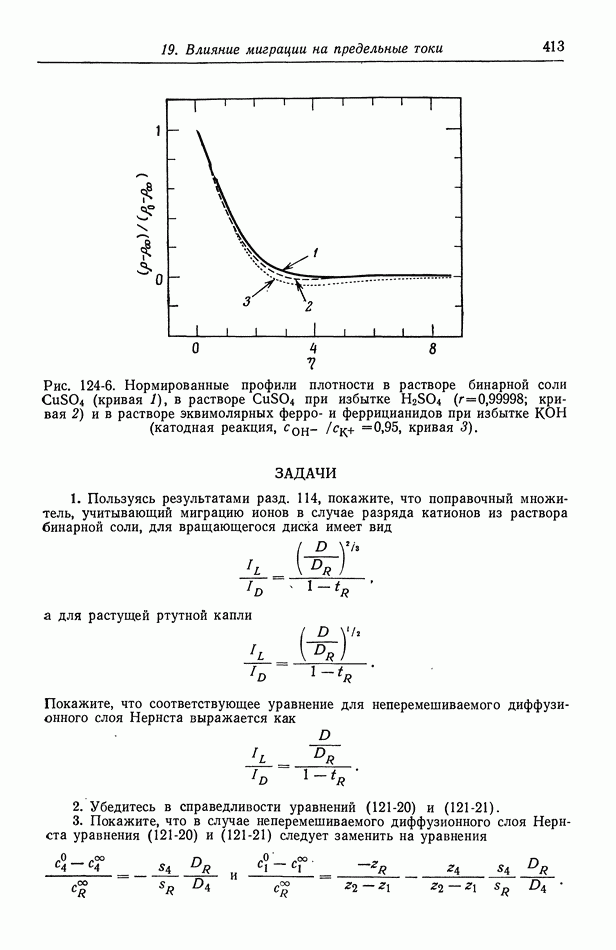
- Глава 19. ВЛИЯНИЕ МИГРАЦИИ НА ПРЕДЕЛЬНЫЕ ТОКИ
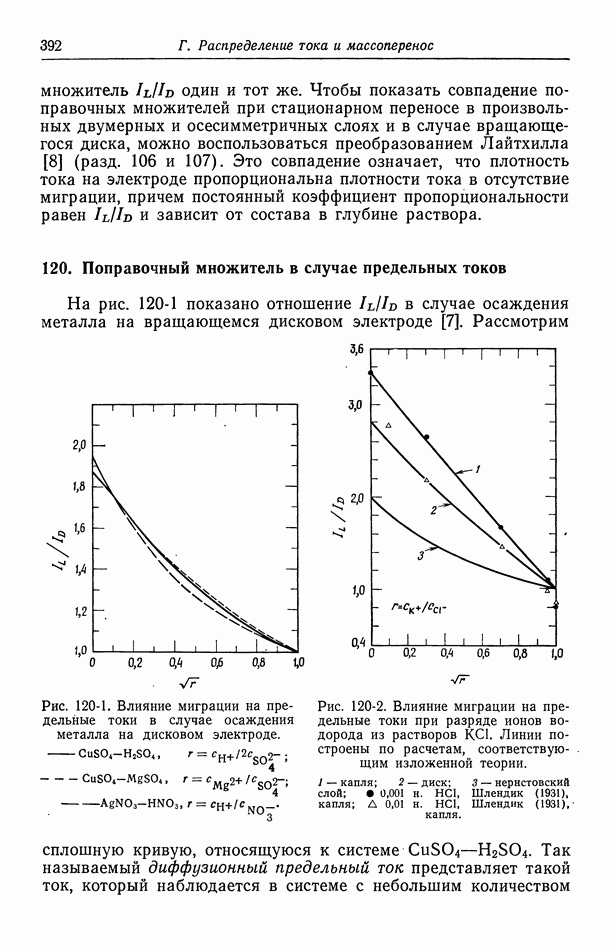
- 120. Поправочный множитель в случае предельных токов
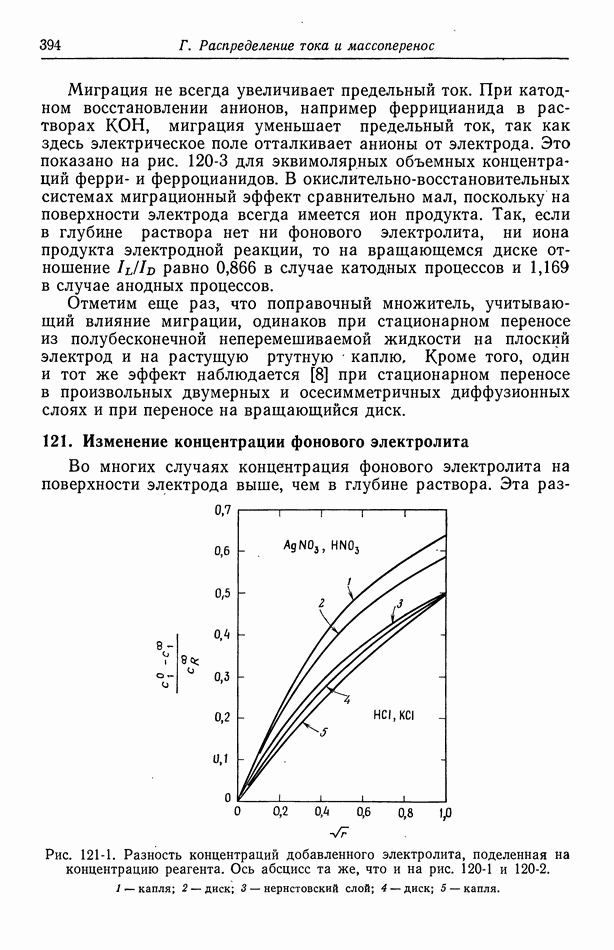
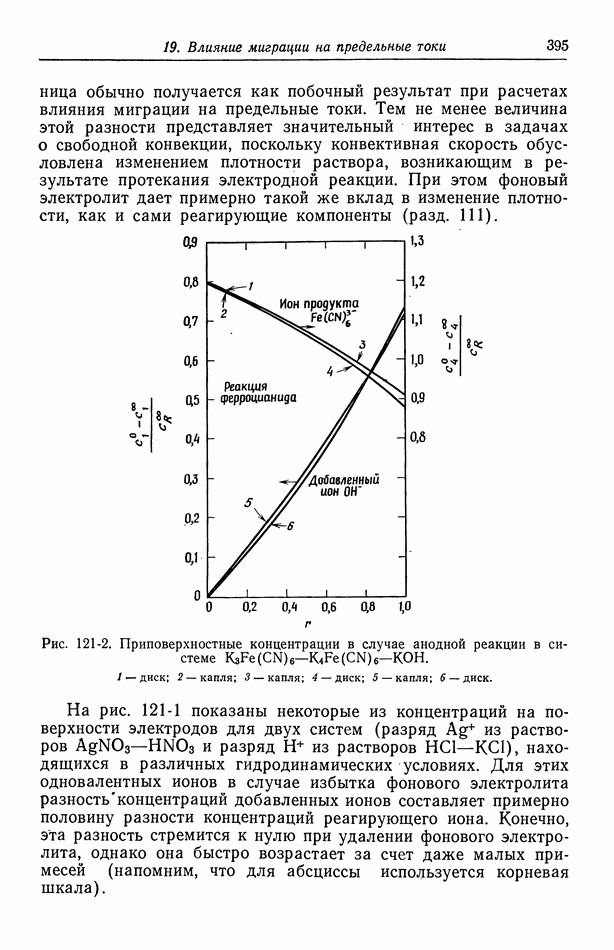
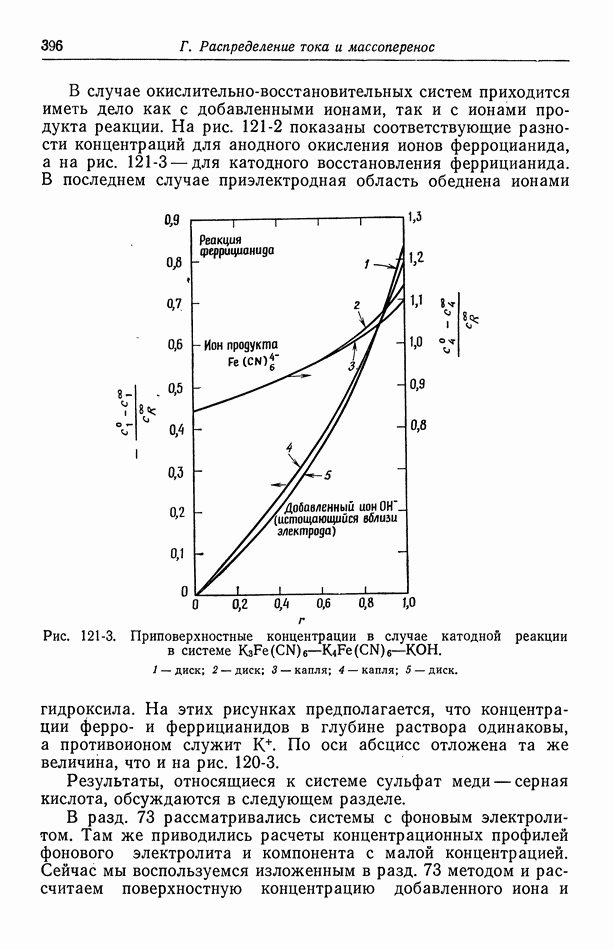
- 121. Изменение концентрации фонового электролита
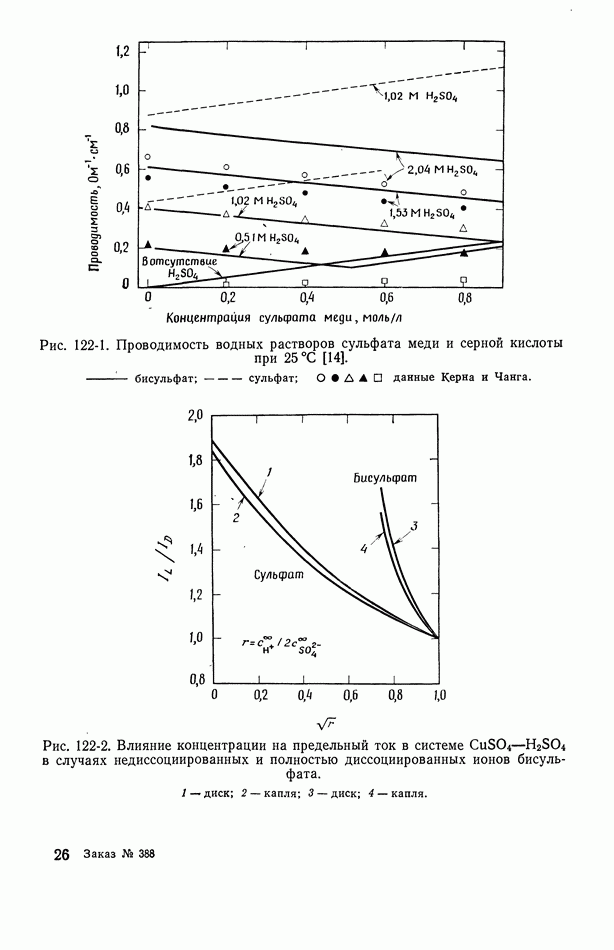
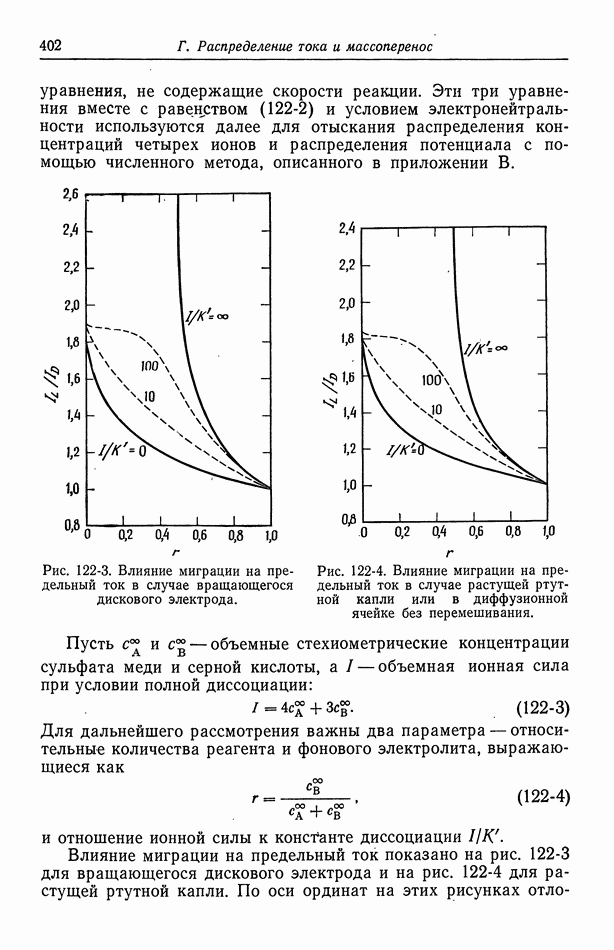
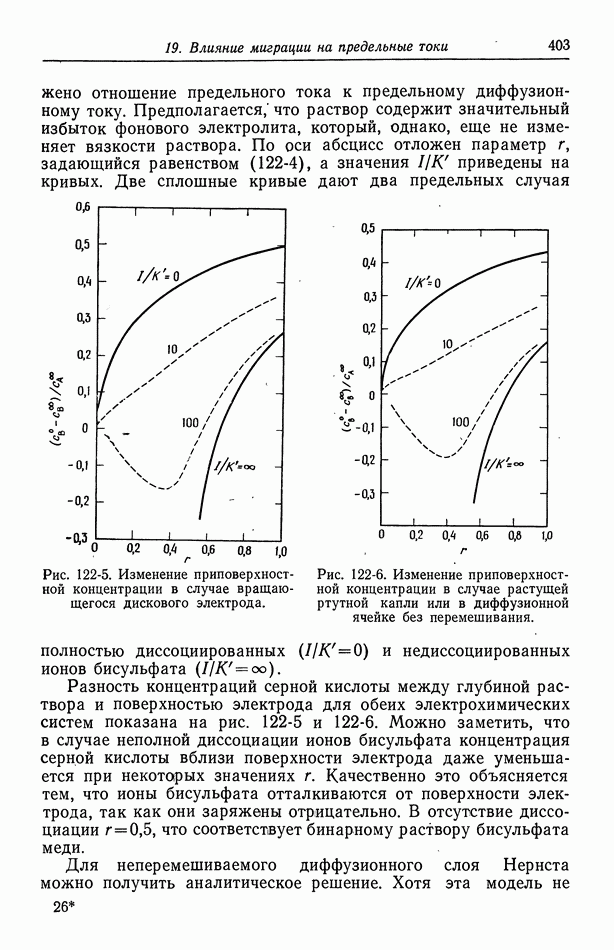
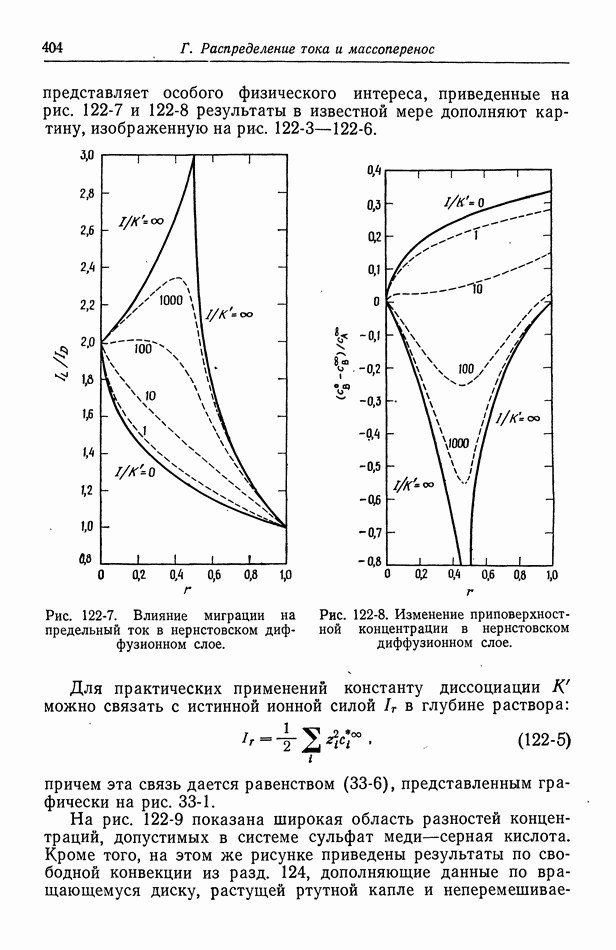
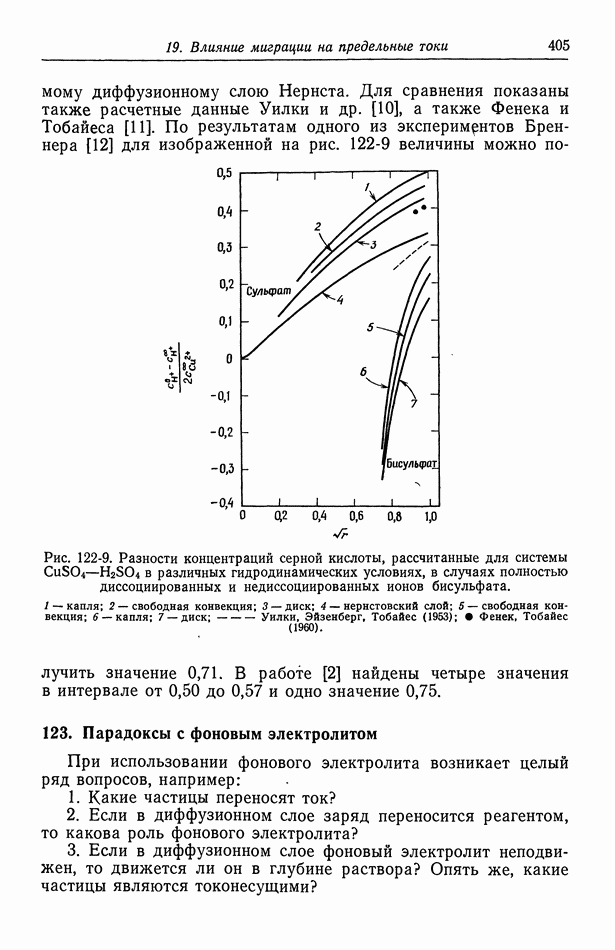
- 122. Роль ионов бисульфата
- 123. Парадоксы с фоновым электролитом
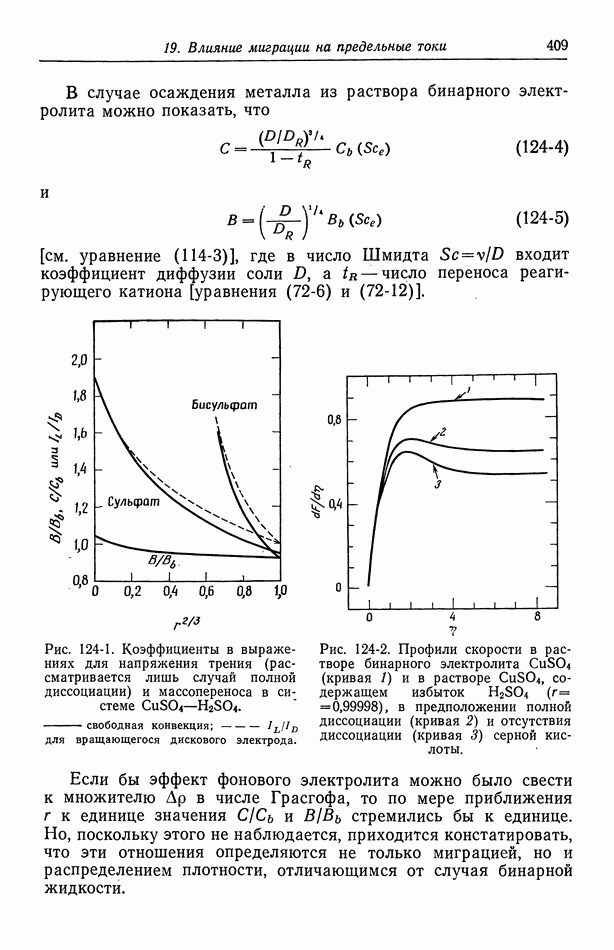
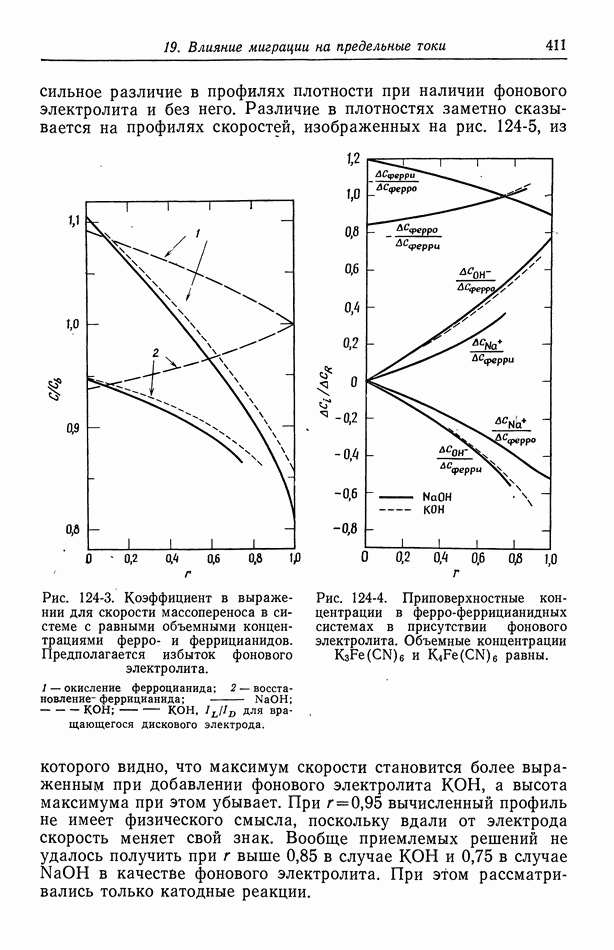
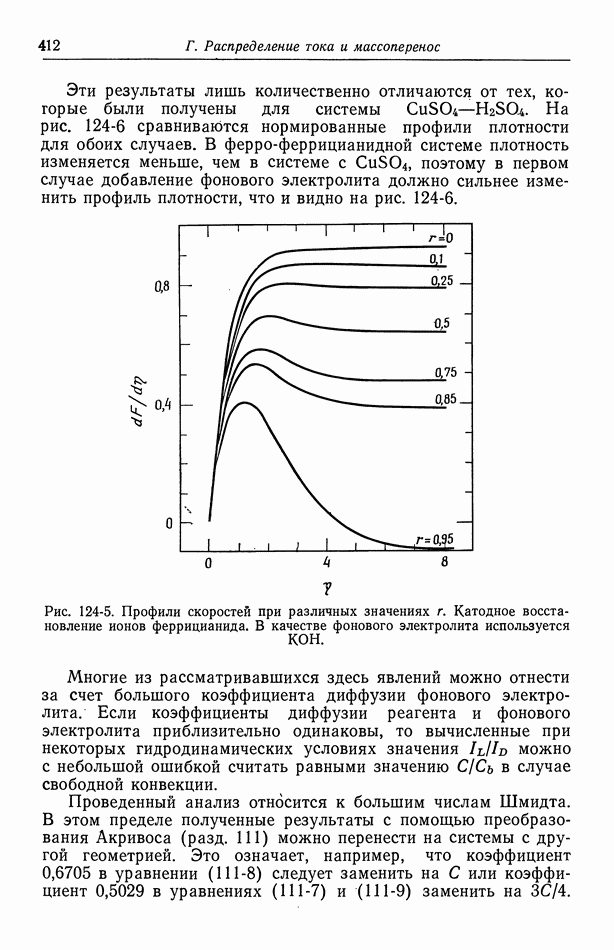
- 124. Предельные токи в случае свободной конвекции
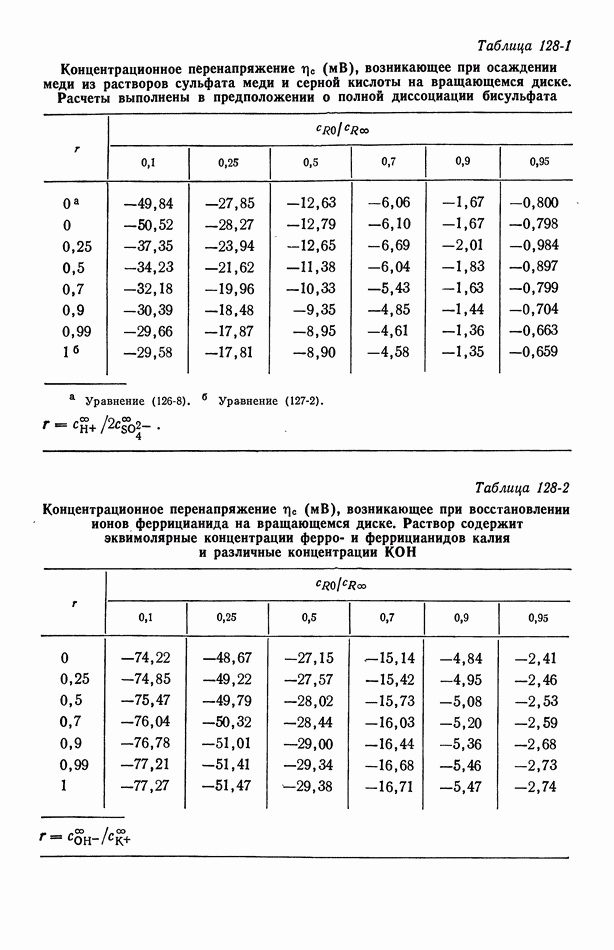
- Глава 20. КОНЦЕНТРАЦИОННОЕ ПЕРЕНАПРЯЖЕНИЕ
- 126. Бинарный электролит
- 127. Фоновый электролит
- 128. Численные расчеты
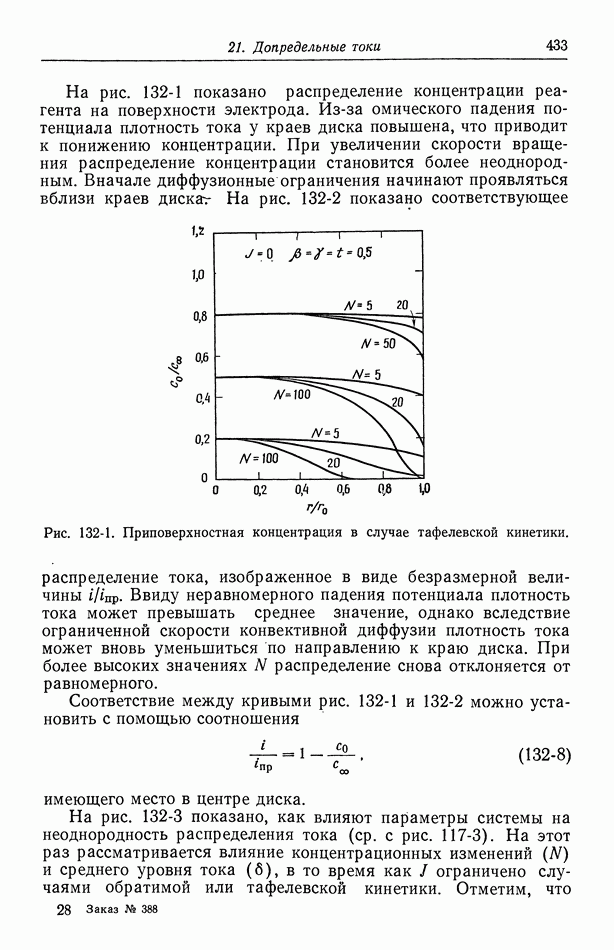
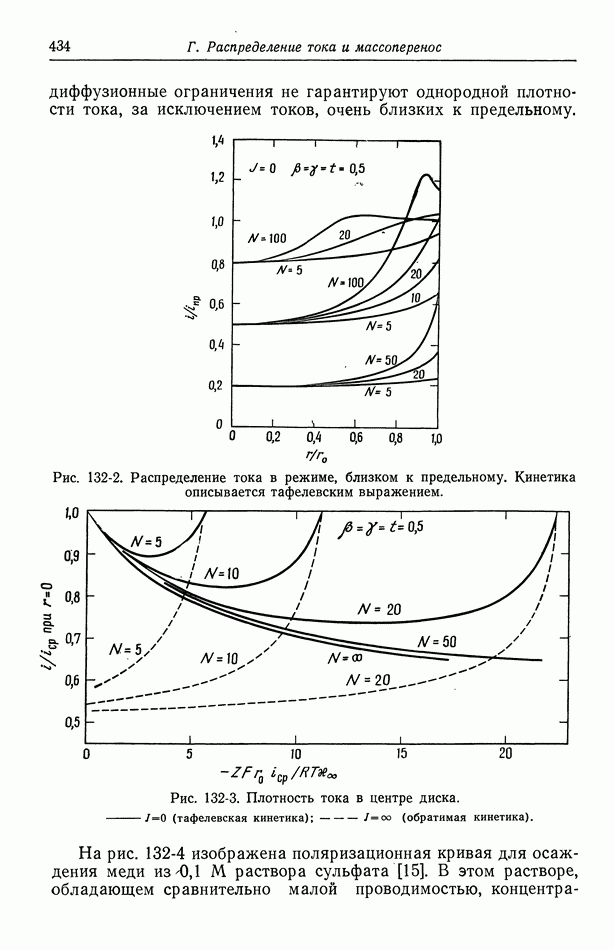
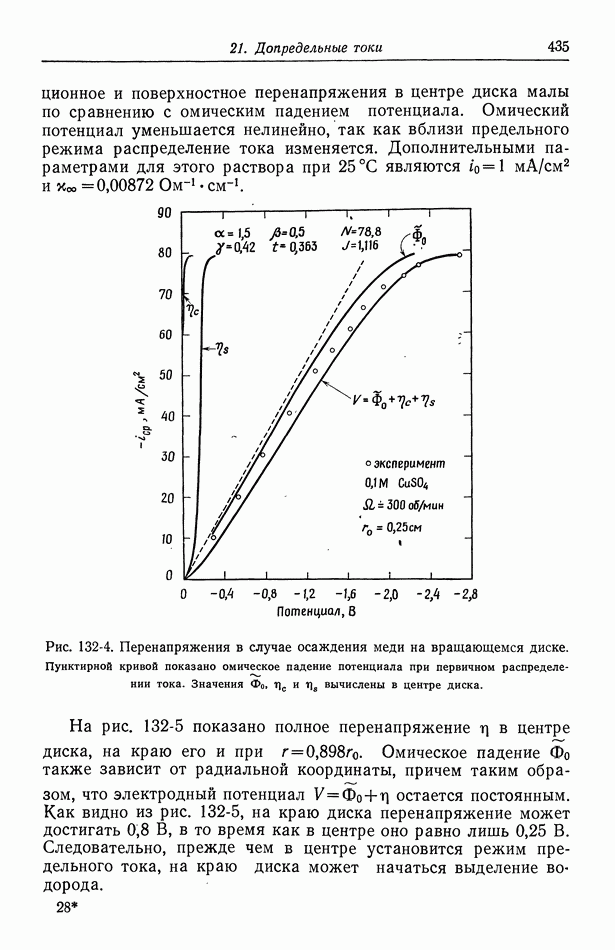
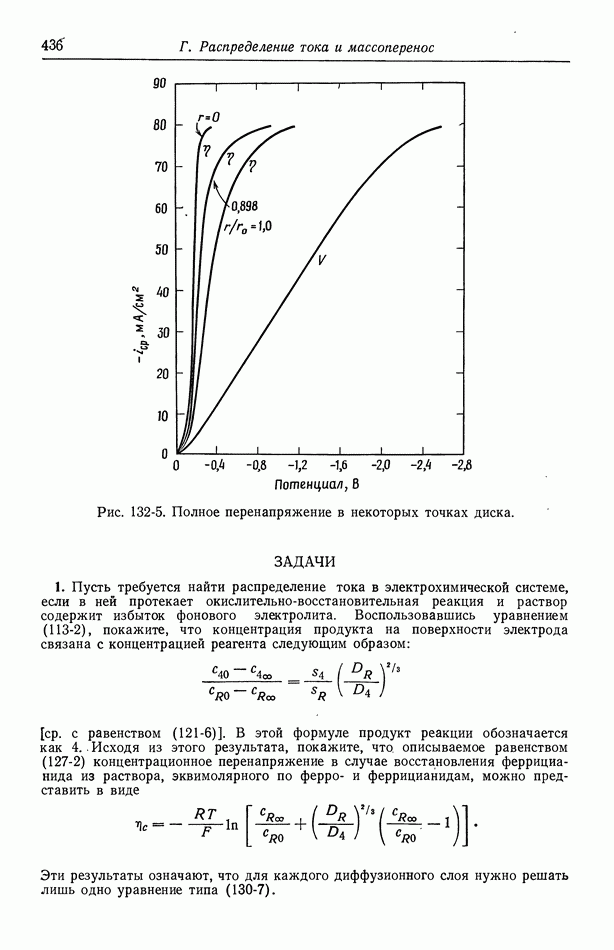
- Глава 21. ДОПРЕДЕЛЬНЫЕ ТОКИ
- 129. Объем раствора
- 130. Диффузионные слои
- 131. Граничные условия и метод решения
- 132. Результаты для вращающегося диска
- Приложение А. ПАРЦИАЛЬНЫЕ МОЛЯРНЫЕ ОБЪЕМЫ
- Приложение Б. ВЕКТОРЫ И ТЕНЗОРЫ
- Приложение В. ЧИСЛЕННОЕ РЕШЕНИЕ СИСТЕМЫ ОБЫКНОВЕННЫХ ДИФФЕРЕНЦИАЛЬНЫХ УРАВНЕНИЙ