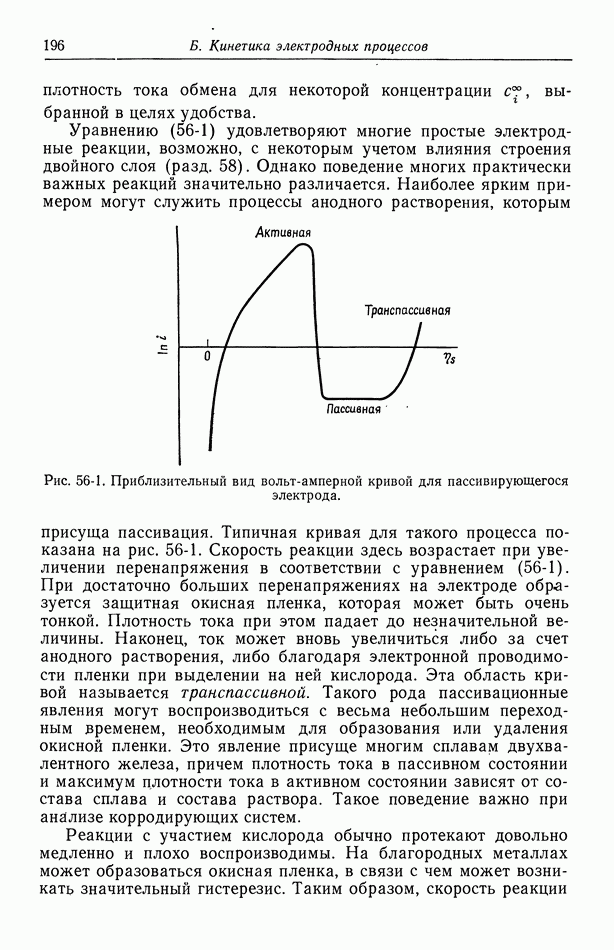
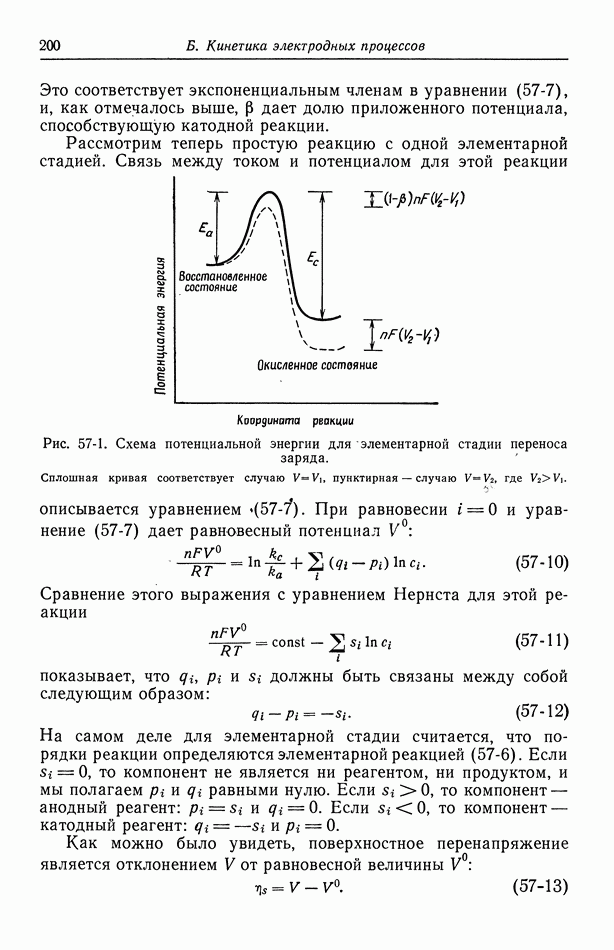
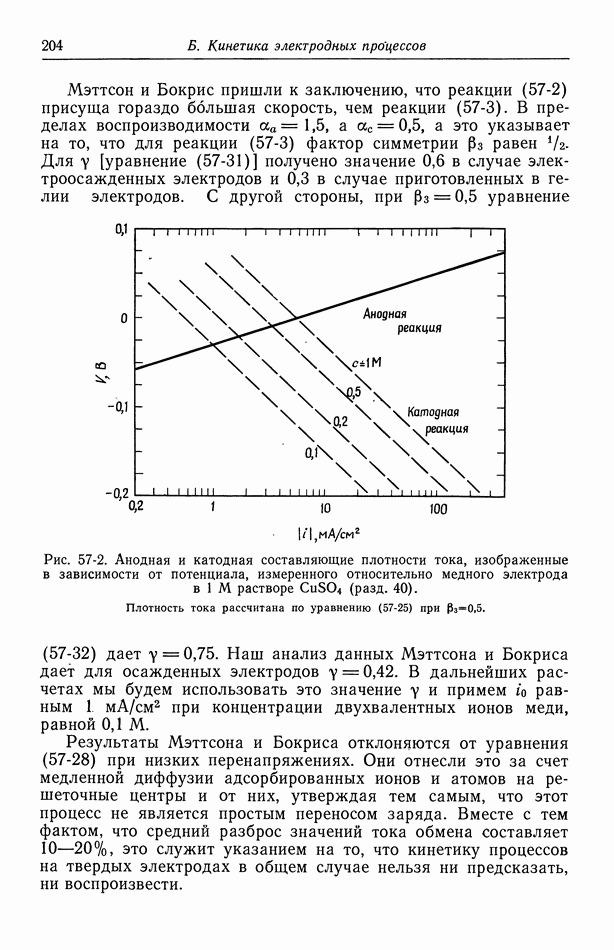
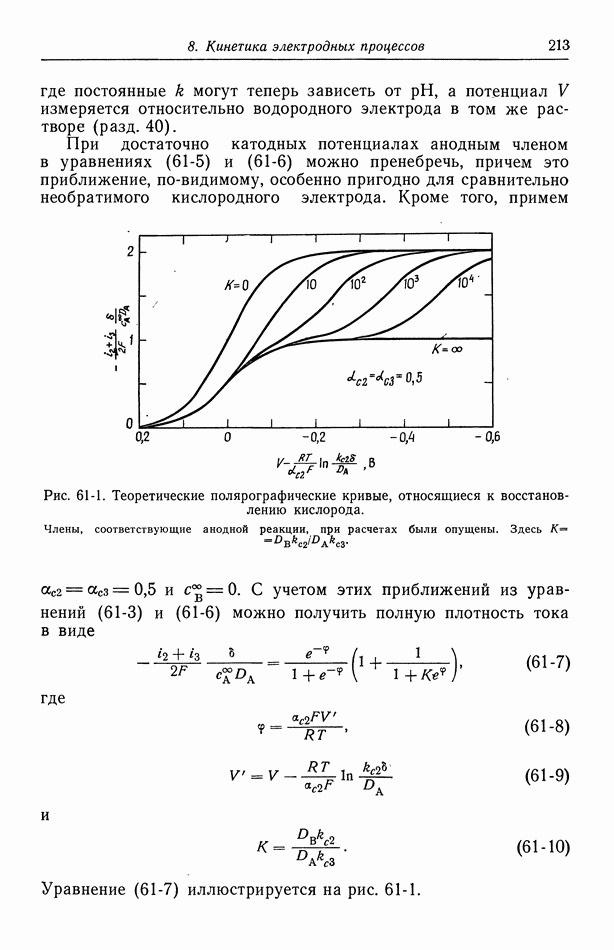
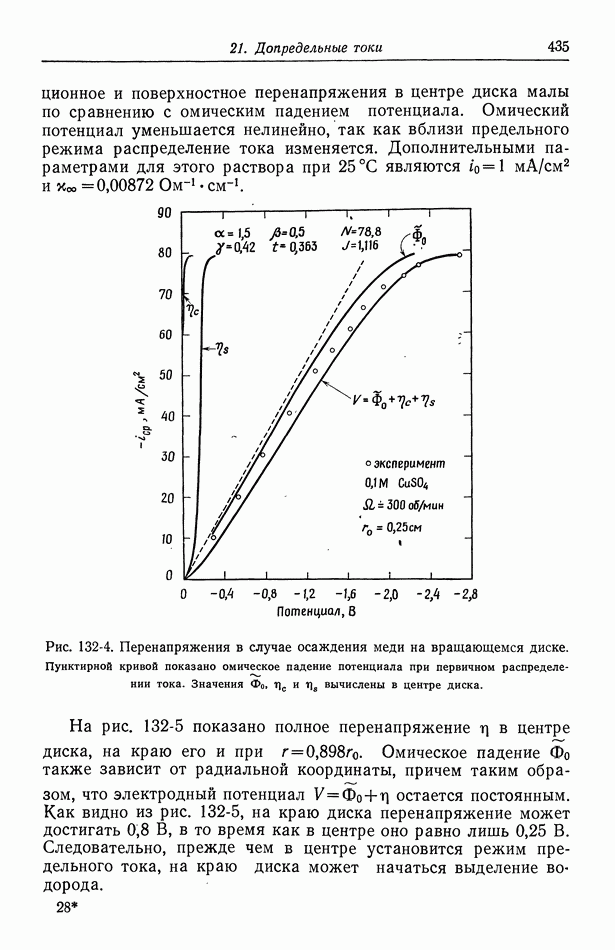
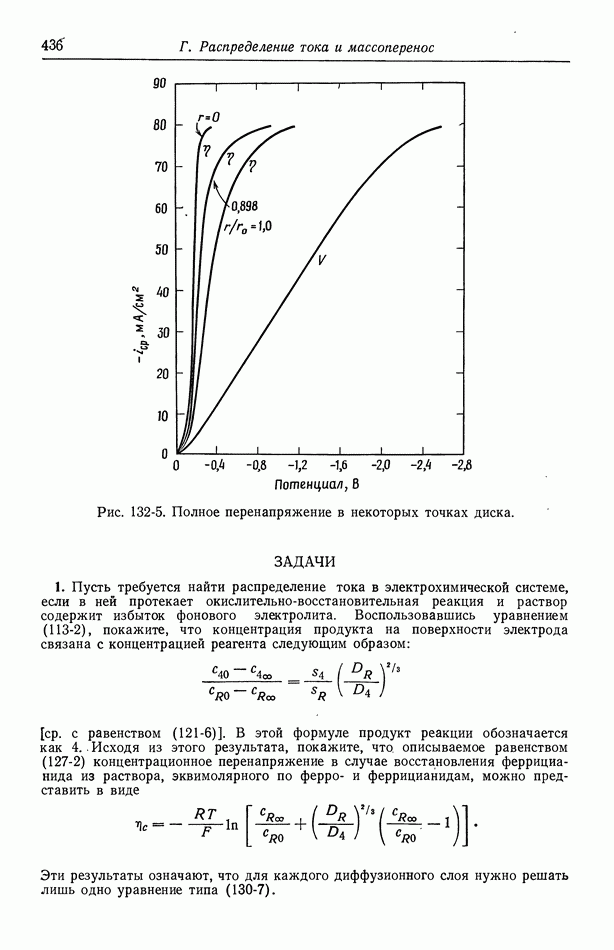
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
36. Водородный электрод
В этом и следующих трех разделах описаны электроды сравнения, широко используемые в электрохимии. В этих разделах не преследуется цель дать полное описание процесса изготовления электрода сравнения. Эти распространенные электроды сравнения обсуждаются лишь для иллюстрации наиболее важных факторов, которые следует учитывать при выборе и изготовлении электродов сравнения. Поэтому мы. не обсуждаем методы очистки реактивов и вопросы устройства ячеек, играющие важную роль в экспериментальной работе.
Водородный электрод является лучшим электродом сравнения в водных растворах, и не только потому, что его потенциал принят в качестве стандартного, с которым сравниваются все остальные электроды, но и благодаря легкости его изготовления и высочайшей воспроизводимости. Другое преимущество водородного электрода — широкая область его применимости. Этот электрод можно использовать в большом диапазоне температур, давлений и рН, а также во многих неводных или частично водных растворах. Недостатком водородного электрода является то, что его равновесное состояние зависит от каталитической активности поверхности металла. Так, на его воспроизводимость и стабильность влияют состояние и возраст металлической поверхности.
Механизм реакций, протекающих на водородном электроде, до сих пор не выяснен. Однако можно считать, что до электрохимического превращения присутствующие в растворе молекулы водорода должны диссоциировать на атомы водорода:

Поскольку реакция диссоциации молекул водорода имеет большую энергию активации по сравнению с теплотой диссоциации
(103,2 ккал/моль), равновесие может установиться лишь с помощью катализатора. Поэтому металлическая фаза водородного электрода не только проводит электроны, но и действует как катализатор.
Общие требования к хорошему металлу для водородного электрода сводятся к следующему:
1. Металл должен быть благородным и сам не должен реагировать или растворяться в жидкой фазе.
2. Металл должен быть хорошим катализатором для реакции диссоциации водорода, т. е. необходимо, чтобы он адсорбировал на поверхности атомы водорода, но не реагировал с ними до образования устойчивого гидрида.
3. Кристаллическая решетка металла не должна поглощать атомы водорода, иначе равновесие водородного электрода будет нарушено.
4. Поверхность металла должна состоять из мелкодисперсного осадка. Поскольку каталитическая активность поверхности металла связана с дефектами решетки, состоящая из мелкодисперсного осадка поверхность металла увеличивает не только истинную поверхность металла, но и число активных каталитических центров.
5. В неводных или частично водных растворах металл не должен катализировать посторонние неэлектрохимические реакции гидрогенизации.
Палладий — наилучший катализатор диссоциации водорода, но он не годится для водородного электрода, так как в его металлическую фазу проникает большое количество атомов водорода. После этого атомы водорода теряют контакт с жидкой фазой, с которой они должны оставаться в равновесии. Удовлетворительные результаты дает тонкий слой палладия, осажденный на золоте или платине. Наилучшим металлом для водородного электрода является платинированная платина благодаря своей большой площади поверхности, хотя она и несколько проницаема для атомов водорода. В тех случаях, когда наличие платинированной платины в растворе ускоряет какие-либо посторонние реакции гидрогенизации в неводных или частично водных растворах, можно использовать полированную платину или золото. Поверхность полированной платины или золота следует активировать анодной обработкой или химически с помощью сильно окисляющих реагентов, таких, как хромовая кислота или царская водка. В качестве катализаторов для реакции диссоциации водорода пригодны также переходные металлы благодаря своим не полностью заселенным d-орбиталям.
Иногда бывает весьма желательно удалить некоторые вносимые газообразным водородом примеси. Так, кислород окисляет поверхность металла. Получающийся окисел реагирует
с растворенным водородом и уменьшает его концентрацию вблизи электрода, сдвигая таким образом потенциал водородного электрода в положительную сторону. Однако кислород может повысить каталитическую активность металла и увеличить срок службы электрода. Поэтому при использовании электродов из полированной платины или золота желательно, чтобы в растворе имелись следы кислорода. Находящаяся в растворе двуокись углерода может изменить его рН. Другие примеси, такие, как соединения мышьяка и серы, могут действовать как каталитические яды и сокращать срок службы электрода.
Возникающий при электролитическом процессе газообразный водород имеет высокую чистоту, но он не пригоден для водородных электродов, поскольку содержит некоторое количество раствора и не свободен от кислорода. Вполне удовлетворителен выпускаемый промышленностью чистый водород после его очистки от кислорода и пропускания через порошковый очиститель, содержащий гидроокись калия в качестве поглотителя углекислого газа. Обычно процесс удаления кислорода сводится к пропусканию водорода через стандартный поглотитель кислорода, содержащий активный при комнатной температуре платиновый катализатор. Другой метод удаления кислорода состоит в пропускании газообразного водорода через чистую трубку из кварцевого стекла, содержащую горячую восстановленную медь (450—700 °С) или горячий палладированный или платинированный асбест (200 °С).
Если где-то используется соединительная резиновая трубка, то она должна быть предварительно обработана кипячением в растворе каустической соды, чисто вымыта и затем выдержана в течение суток в газообразном водороде, так как из резины могут поступать соединения серы.
Для поддержания постоянной концентрации электролита перед поступлением в ячейку газообразный водород должен быть предварительно насыщен растворителем до такого давления паров, которое имеет раствор электролита при той же температуре.
Примеси влияют на стабильность водородных электродов по следующим причинам:
1. Сами примеси могут восстанавливаться растворенным газообразным водородом с образованием растворимых продуктов. Это может привести к значительному уменьшению .концентрации молекулярного водорода в растворе и к положительному сдвигу потенциала водородного электрода. К этой категории примесей относятся кислород,  д.
д.
2. Катионы некоторых металлов, таких, как серебро, ртуть, медь, свинец и т. д., могут восстанавливаться ,и осаждаться в твердом виде, покрывая поверхность электрода и изменяя его свойства.
3. Примеси, подобные соединениям мышьяка и серы, а также некоторые органические соединения могут адсорбироваться на активных центрах поверхности металла и парализовать каталитическую активность.
Даже в отсутствие примесей каталитическая активность поверхности металла может нарушаться водородным ядом. Под этим подразумевается уничтожение активных центров на поверхности металла реакцией рекомбинации атомов водорода. Поскольку каталитическое действие поверхности металла связано с дефектами кристалла, активные центры находятся в более высоких энергетических состояниях, чем поверхность идеального кристалла. За счет большой энергии, выделяемой при слиянии - атомов водорода, активные центры могут перейти в состояние с пониженной энергией (поверхность идеального кристалла) и потерять свою каталитическую активность. Перед употреблением старого или долго проработавшего водородного электрода его следует повторно активировать или платинировать. -
В водных растворах водородный электрод может применяться в широком диапазоне рН. Он использовался в щелочных растворах вплоть до моляльности  и в растворах серной кислоты до моляльности
и в растворах серной кислоты до моляльности  но в нейтральных растворах в отсутствие буфера этот электрод не применим. Дело в том, что потенциал водородного электрода весьма чувствителен к рН. В нейтральных растворах, через которые пропускается хотя бы незначительный ток, рН вблизи электрода изменяется довольно заметно.
но в нейтральных растворах в отсутствие буфера этот электрод не применим. Дело в том, что потенциал водородного электрода весьма чувствителен к рН. В нейтральных растворах, через которые пропускается хотя бы незначительный ток, рН вблизи электрода изменяется довольно заметно.
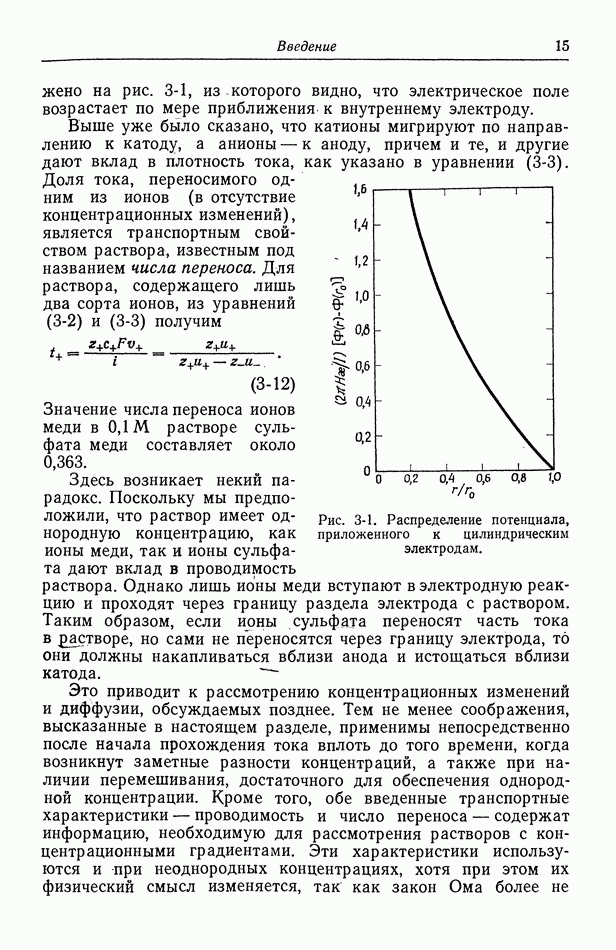
Давление газообразного водорода можно точно измерить барометром. Однако в большинстве конструкций ячеек водород пропускается через раствор в виде пузырьков. Поэтому при вычислении потенциала следует использовать эффективное давление газообразного водорода. Для водных растворов эффективное давление можно рассчитать по эмпирическому уравнению

где  — барометрическое давление (мм рт. ст.), Рраств Давление паров раствора
— барометрическое давление (мм рт. ст.), Рраств Давление паров раствора  глубина погружения распылителя водорода
глубина погружения распылителя водорода  Напомним, что при расчете потенциала должны использоваться летучести (задача 2-14).
Напомним, что при расчете потенциала должны использоваться летучести (задача 2-14).
Водородный электрод можно также применять во многих неводных и частично водных растворах, особенно в спиртовых.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- Глава 1. ВВЕДЕНИЕ
- 1. Термодинамика, кинетика электродных процессов и процессы переноса
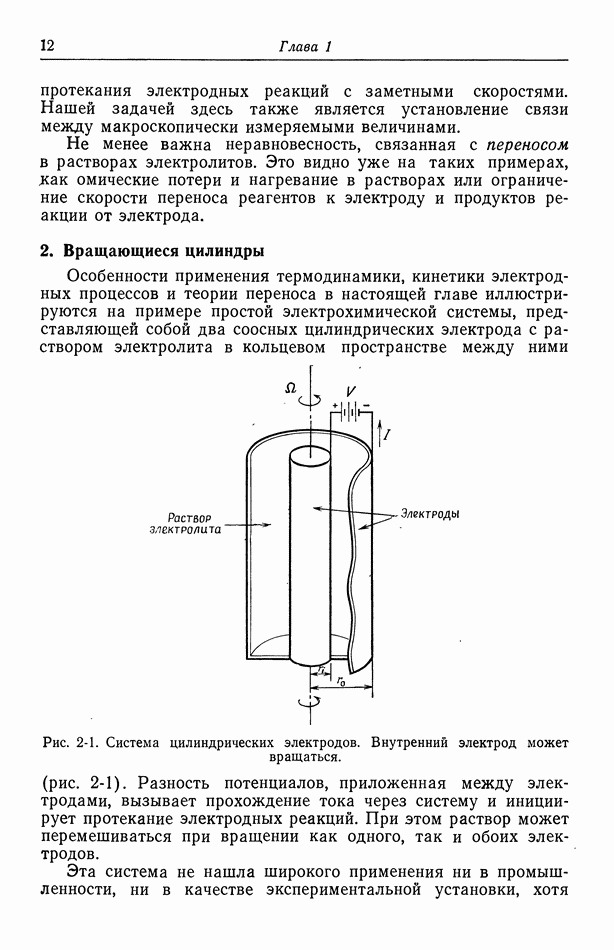
- 2. Вращающиеся цилиндры
- 3. Прохождение тока в электролитах
- 4. Течение жидкости
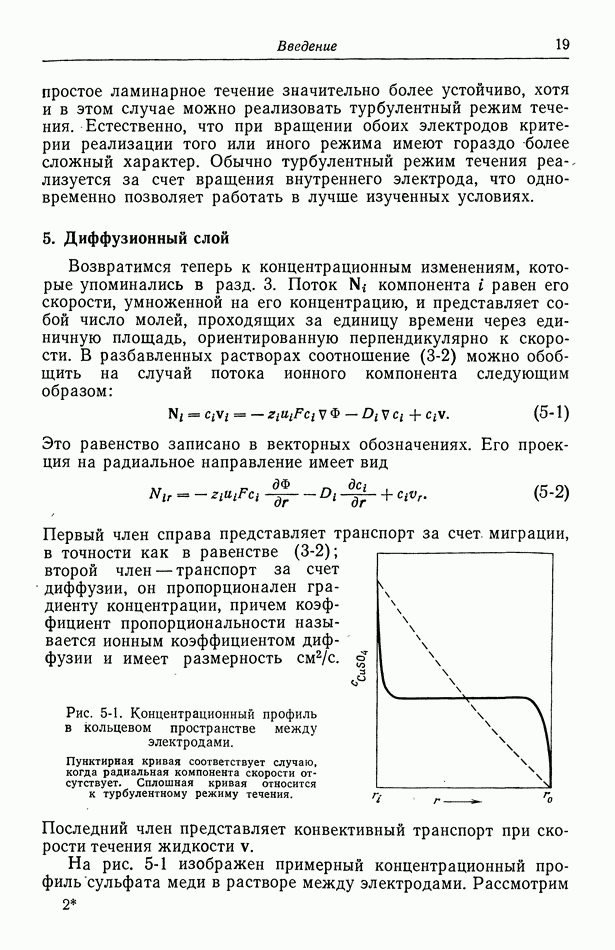
- 5. Диффузионный слой
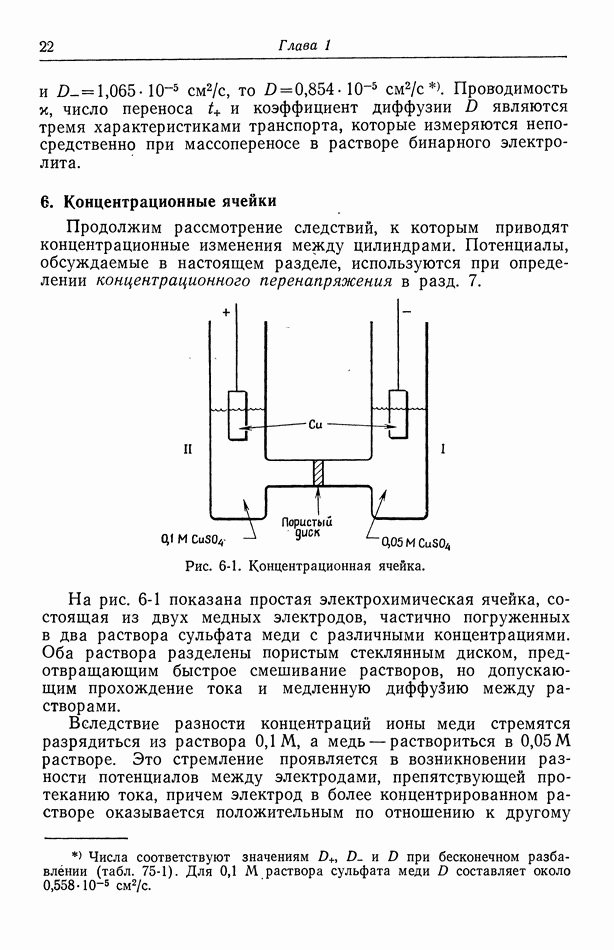
- 6. Концентрационные ячейки
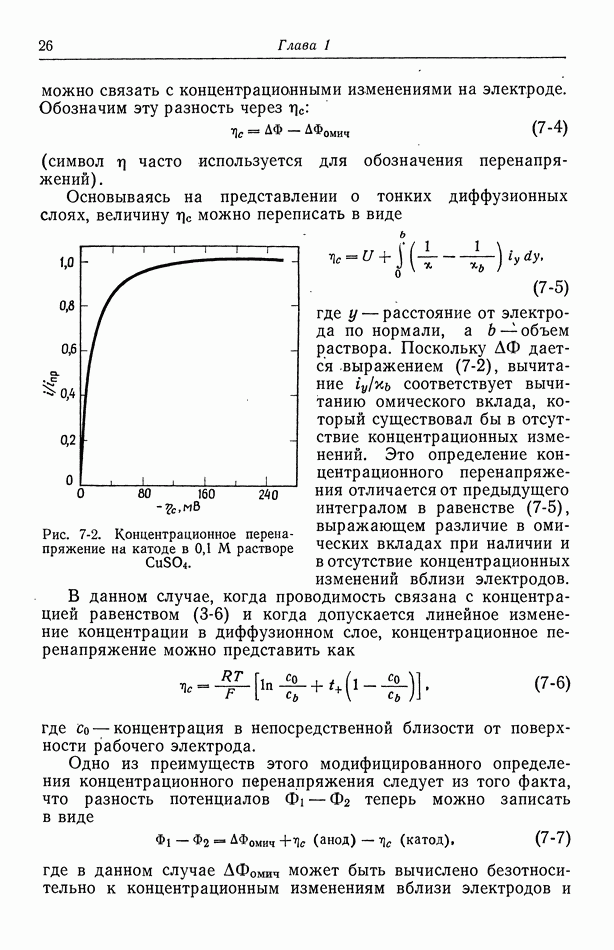
- 7. Концентрационное перенапряжение
- 8. Поверхностное перенапряжение
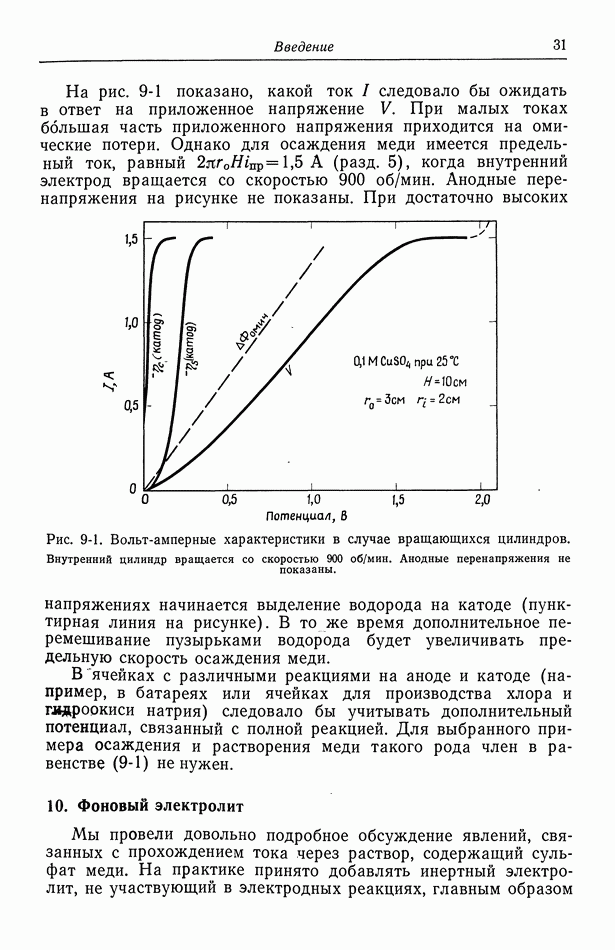
- 9. Потенциал ячейки
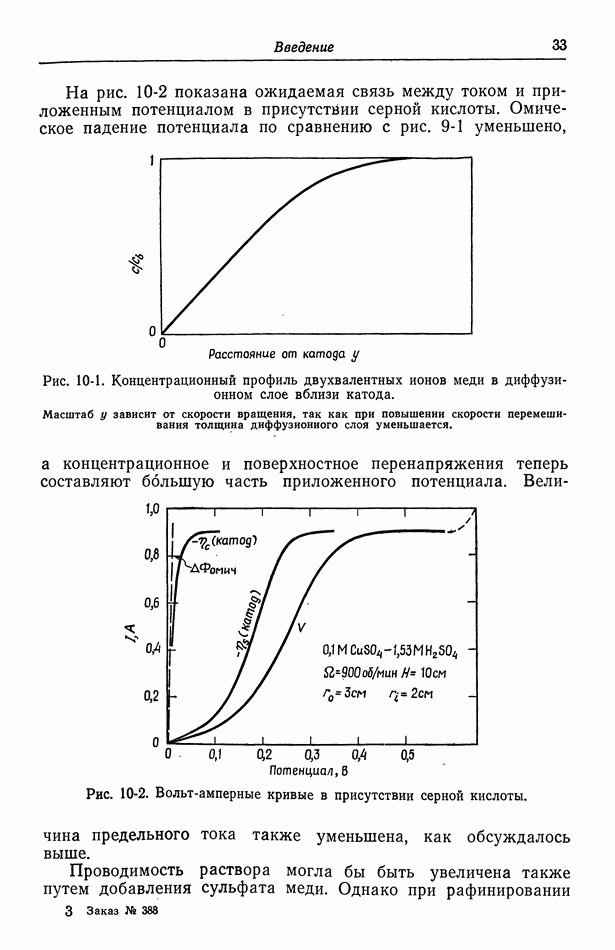
- 10. Фоновый электролит
- 11. Свободная конвекция
- Часть А. ТЕРМОДИНАМИКА ЭЛЕКТРОХИМИЧЕСКИХ ЯЧЕЕК
- Глава 2. ТЕРМОДИНАМИКА НА ЯЗЫКЕ ЭЛЕКТРОХИМИЧЕСКИХ ПОТЕНЦИАЛОВ
- 12. Равновесие фаз
- 13. Химический и электрохимический потенциалы
- 14. Определение некоторых термодинамических функций
- 15. Ячейка с раствором однородной концентрации
- 16. Процессы переноса в областях контакта
- 17. Ячейка с одним электролитом переменной концентрации
- 18. Ячейка с двумя электролитами, концентрация одного из которых почти однородна
- 19. Ячейка с двумя электролитами переменной концентрации
- 20. Стандартный потенциал ячейки и коэффициенты активности
- Глава 3. ЭЛЕКТРИЧЕСКИЙ ПОТЕНЦИАЛ
- 22. Электростатический потенциал
- 23. Межмолекулярные силы
- 24. Внешний и внутренний потенциалы
- 25. Потенциалы электродов сравнения
- 26. Электрический потенциал в термодинамике
- Глава 4. КОЭФФИЦИЕНТЫ АКТИВНОСТИ
- 27. Распределение ионов в разбавленных растворах
- 28. Электрический вклад в свободную энергию
- 29. Недостатки модели Дебая-Хюккеля
- 30. Растворы бинарных электролитов
- 31. Многокомпонентные растворы
- 32. Измерение коэффициентов активности
- 33. Слабые электролиты
- Глава 5. ЭЛЕКТРОДЫ СРАВНЕНИЯ
- 34. Критерии выбора электродов сравнения
- 35. Экспериментальные факторы, влияющие на выбор электродов сравнения
- 36. Водородный электрод
- 37. Каломельный электрод и другие электроды типа ртуть—соль ртути
- 38. Окиснортутный электрод
- 39. Электроды типа серебро—галогенид серебра
- 40. Потенциалы относительно данного электрода сравнения
- Глава 6. ПОТЕНЦИАЛЫ ЯЧЕЕК С ПЕРЕНОСОМ
- 41. Уравнение Нернста
- 42. Типы жидкостных соединений
- 43. Формулы для потенциалов жидкостных соединений
- 44. Определение концентрационных профилей
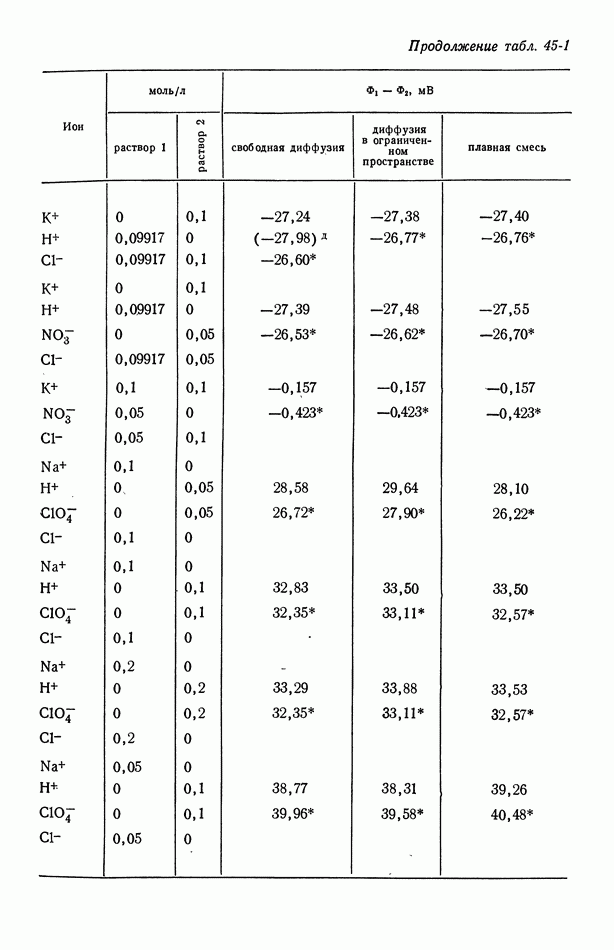
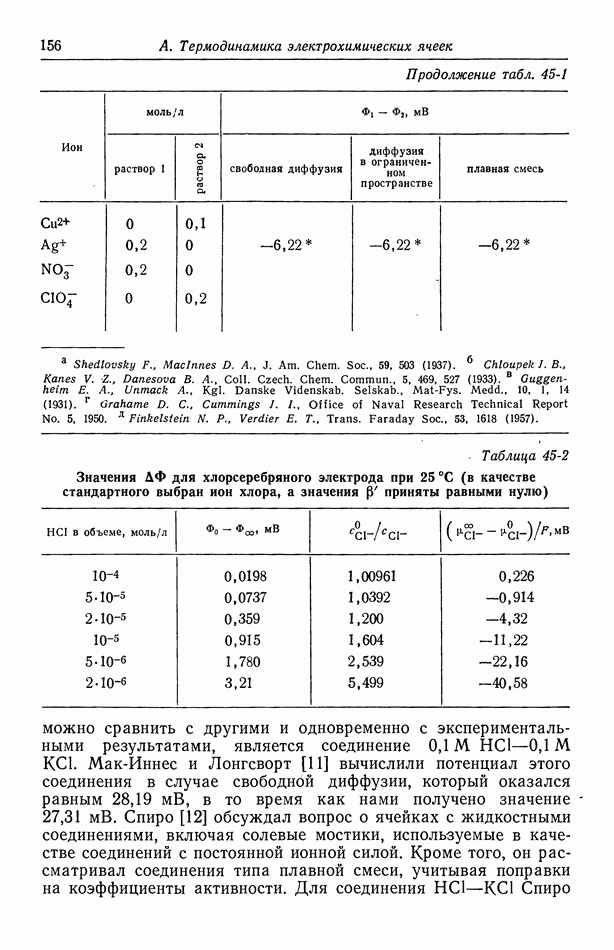
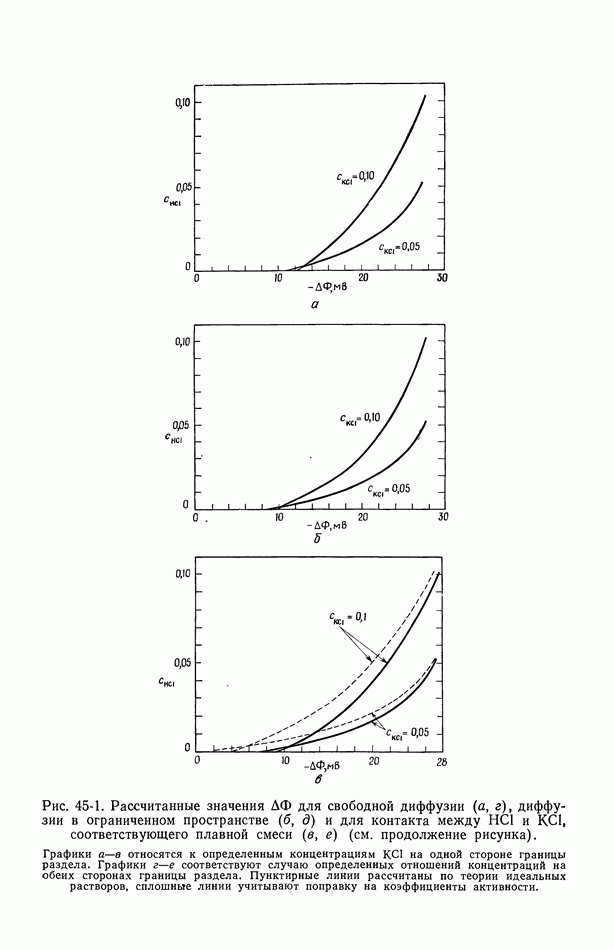
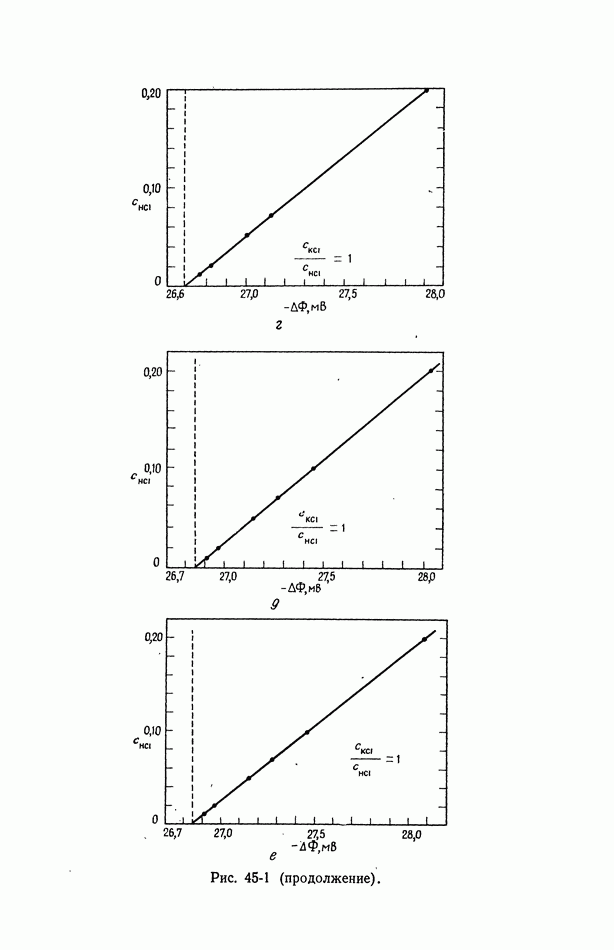
- 45. Численные результаты
- 46. Ячейки с жидкостным соединением
- 47. Поправки к уравнению Нернста
- 48. Мембранные потенциалы
- Часть Б. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ И ДРУГИЕ ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
- Глава 7. СТРОЕНИЕ ЭЛЕКТРИЧЕСКОГО ДВОЙНОГО СЛОЯ
- 50. Изотерма адсорбции Гиббса
- 51. Уравнение Липпмана
- 52. Диффузная часть двойного слоя
- 53. Емкость двойного слоя в отсутствие специфической адсорбции
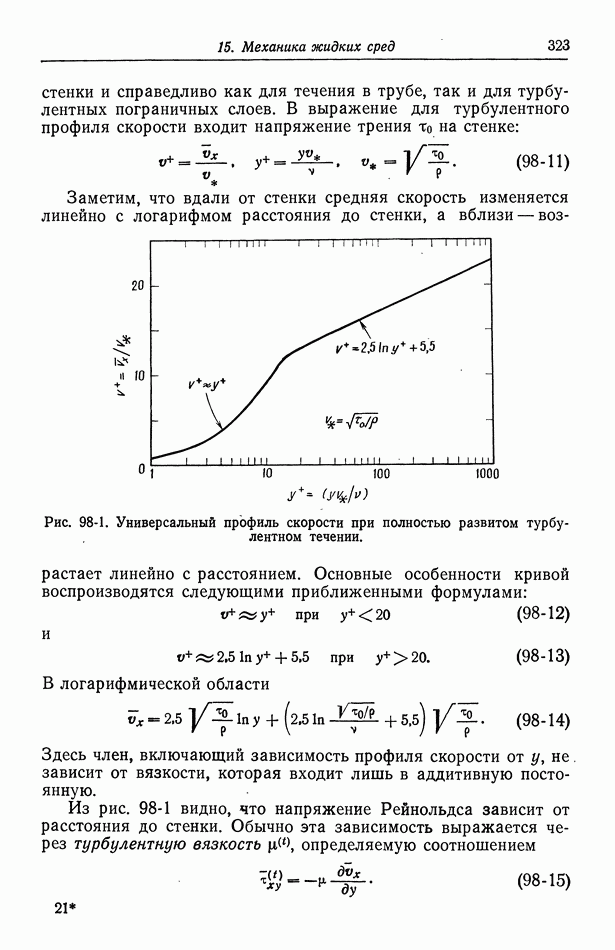
- 54. Специфическая адсорбция на границе раздела электрод—раствор
- Глава 8. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ
- 55. Гетерогенные электродные реакции
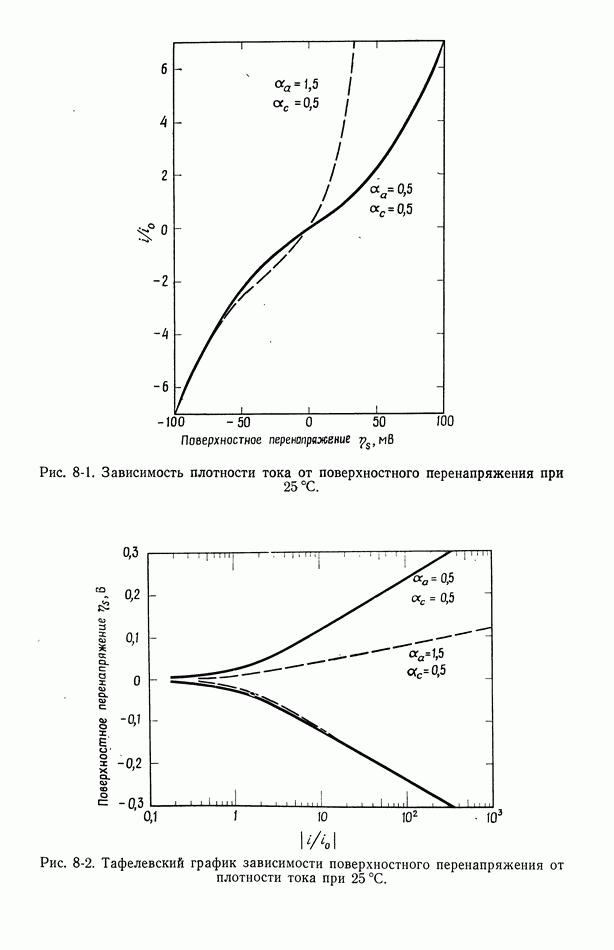
- 56. Зависимость плотности тока от поверхностного перенапряжения
- 57. Модели в кинетике электродных процессов
- 58. Влияние строения двойного слоя
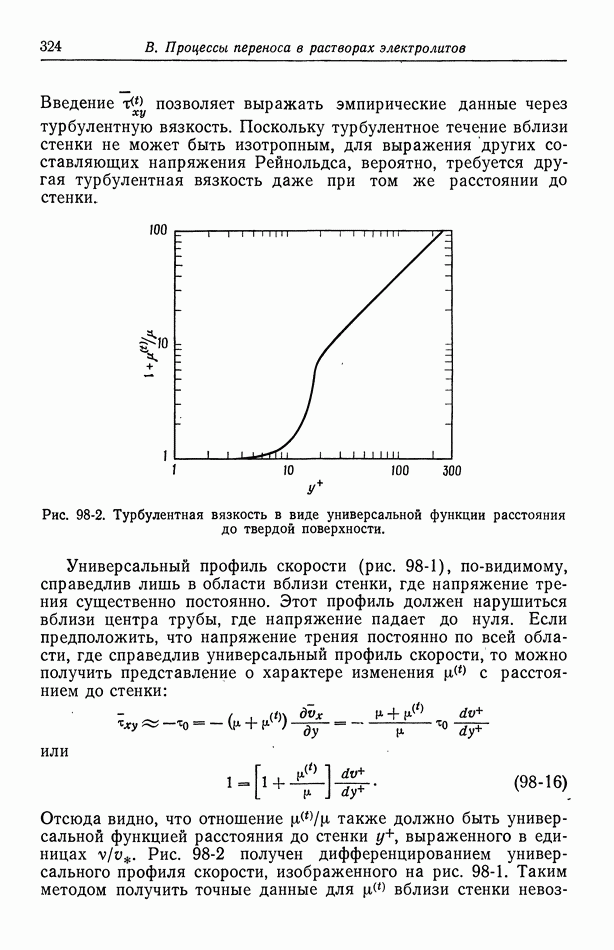
- 59. Кислородный электрод
- 60. Методы измерения
- 61. Одновременно протекающие реакции
- Глава 9. ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ
- 62. Разрывная скорость на границе раздела
- 63. Электроосмос и потенциал течения
- 64. Электрофорез
- 65. Потенциал осаждения
- Глава 10. ЭЛЕКТРОКАПИЛЛЯРНЫЕ ЯВЛЕНИЯ
- 67. Электрокапиллярное движение ртутных капель
- 68. Потенциалы осаждения для падающих ртутных капель
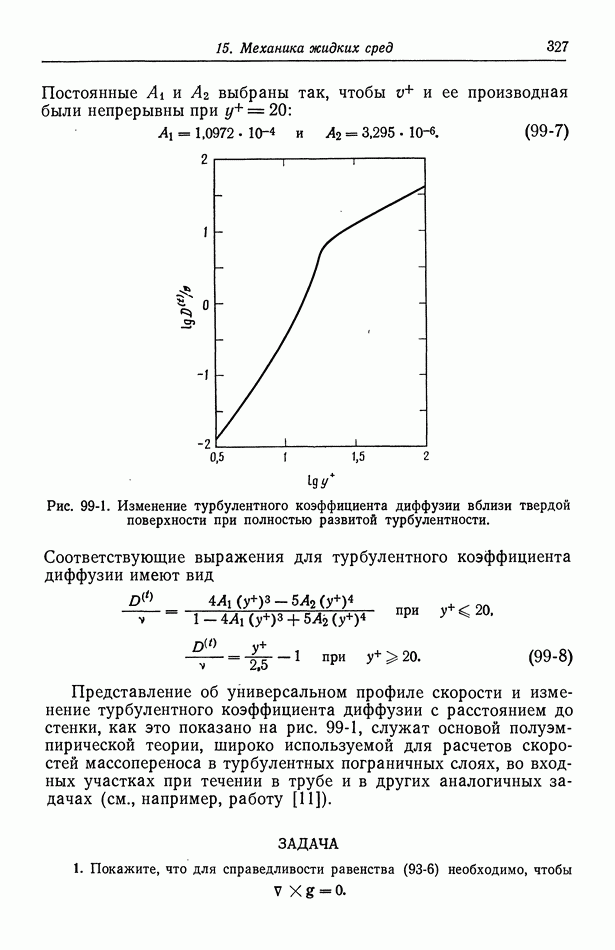
- Часть В. ПРОЦЕССЫ ПЕРЕНОСА В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- Глава 11. БЕСКОНЕЧНО РАЗБАВЛЕННЫЕ РАСТВОРЫ
- 70. Проводимость, диффузионные потенциалы и числа переноса
- 71. Сохранение заряда
- 72. Бинарный электролит
- 73. Фоновый электролит
- 74. Многокомпонентная диффузия, возникающая при исключении электрического поля
- 75. Подвижности и коэффициенты диффузии
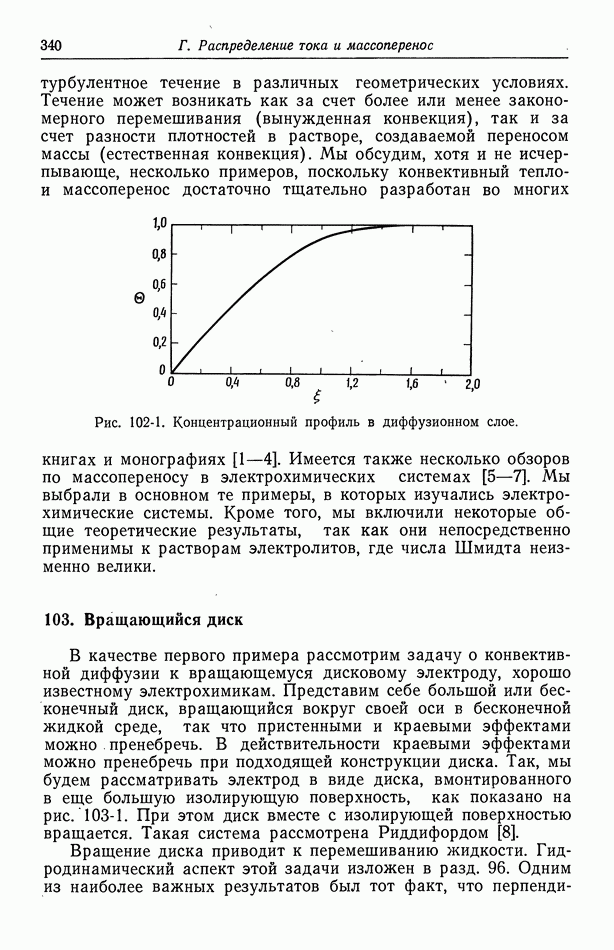
- 76. Электронейтральность и уравнение Лапласа
- 77. Умеренно разбавленные растворы
- Глава 12. КОНЦЕНТРИРОВАННЫЕ РАСТВОРЫ
- 79. Бинарный электролит
- 80. Стандартные скорости
- 81. Потенциал
- 82. Связь с теорией разбавленных растворов
- 83. Многокомпонентный транспорт
- 84. Потенциалы жидкостного соединения
- Глава 13. ТЕПЛОВЫЕ ЭФФЕКТЫ
- 85. Термодиффузия
- 86. Выделение и перенос тепла
- 87. Тепловыделение на границе раздела фаз
- 88. Термогальванические ячейки
- Глава 14. ХАРАКТЕРИСТИКИ ПЕРЕНОСА
- 89. Бесконечно разбавленные растворы
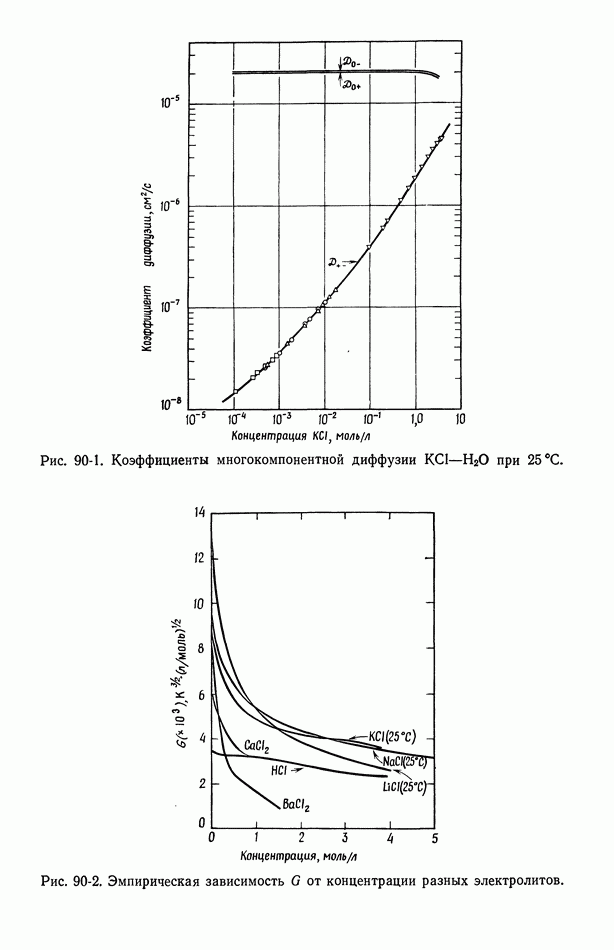
- 90. Растворы, содержащие одну соль
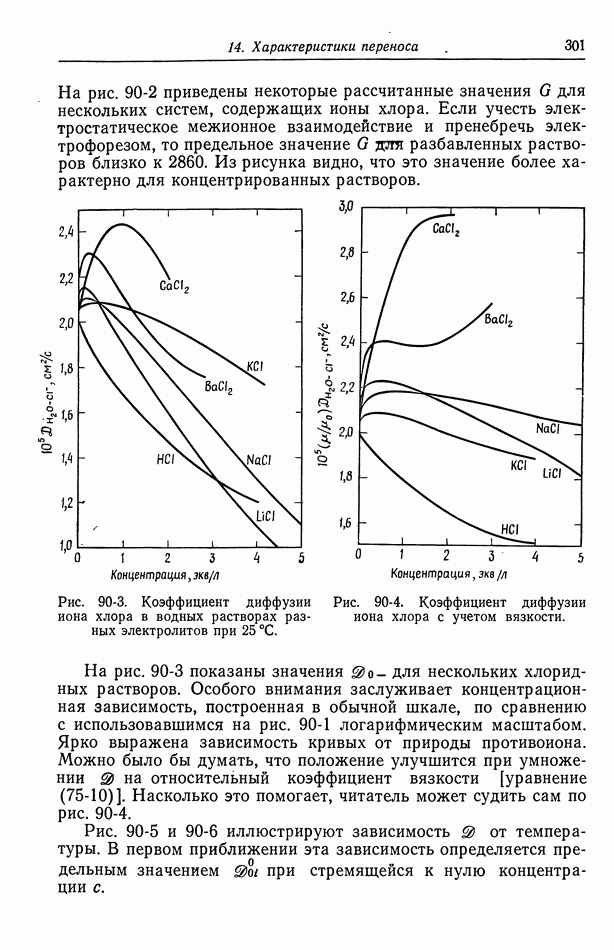
- 91. Многокомпонентные растворы
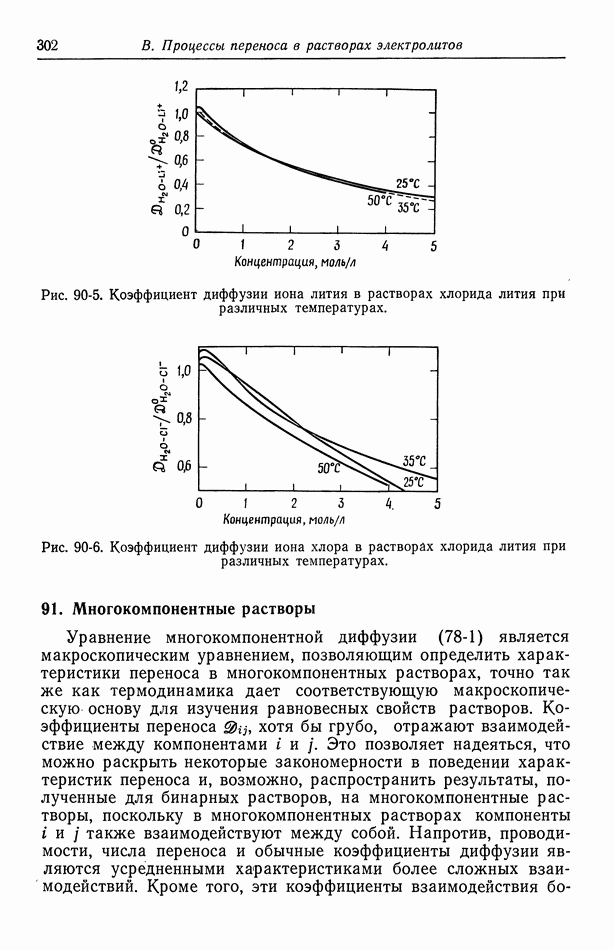
- 92. Интегральные коэффициенты диффузии
- Глава 15. МЕХАНИКА ЖИДКИХ СРЕД
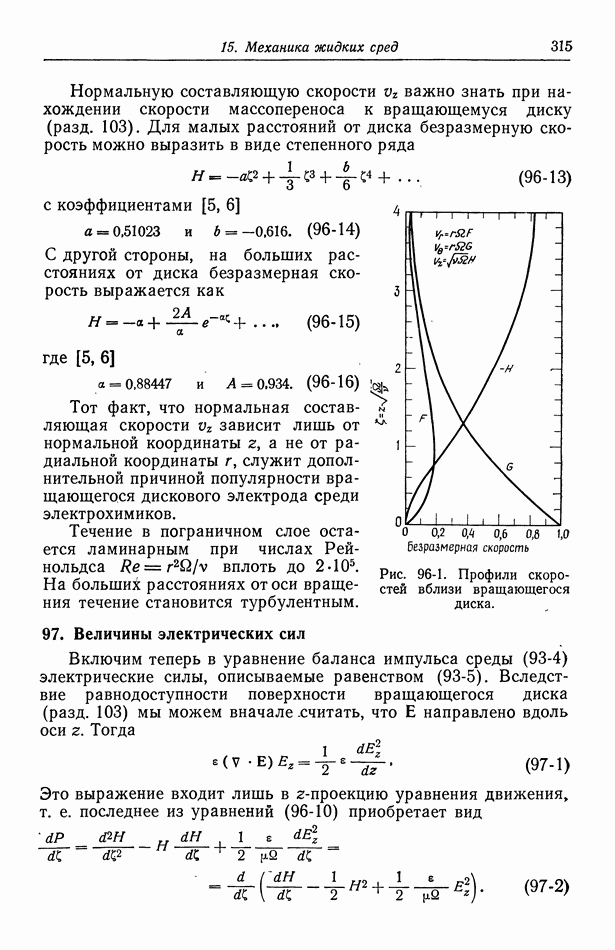
- 93. Баланс массы и импульса
- 94. Напряжение в ньютоновской жидкости
- 95. Граничные условия
- 96. Течение жидкости к вращающемуся диску
- 97. Величины электрических сил
- 98. Турбулентное течение
- 99. Массоперенос в турбулентном потоке
- Часть Г. РАСПРЕДЕЛЕНИЕ ТОКА И МАССОПЕРЕНОС В ЭЛЕКТРОХИМИЧЕСКИХ СИСТЕМАХ
- Глава 16. ОСНОВНЫЕ УРАВНЕНИЯ
- 100. Перенос в разбавленных растворах
- 101. Кинетика электродных процессов
- Глава 17. ЗАДАЧИ КОНВЕКТИВНОЙ ДИФФУЗИИ
- 102. Упрощенное описание конвективной диффузии
- 103. Вращающийся диск
- 104. Задача Граца
- 105. Кольцевой зазор
- 106. Двумерные диффузионные слои при вынужденной ламинарной конвекции
- 107. Осесимметричные диффузионные слои при вынужденной ламинарной конвекции
- 108. Плоская пластина в свободном потоке
- 109. Вращающиеся цилиндры
- 110. Растущие ртутные капли
- 112. Наложение свободной и вынужденной конвекции
- 113. Ограничения за счет поверхностных реакций
- 114. Бинарные и концентрированные растворы
- Глава 18. ПРИЛОЖЕНИЯ ТЕОРИИ ПОТЕНЦИАЛА
- 115. Упрощения в задачах теории потенциала
- 116. Первичное распределение тока
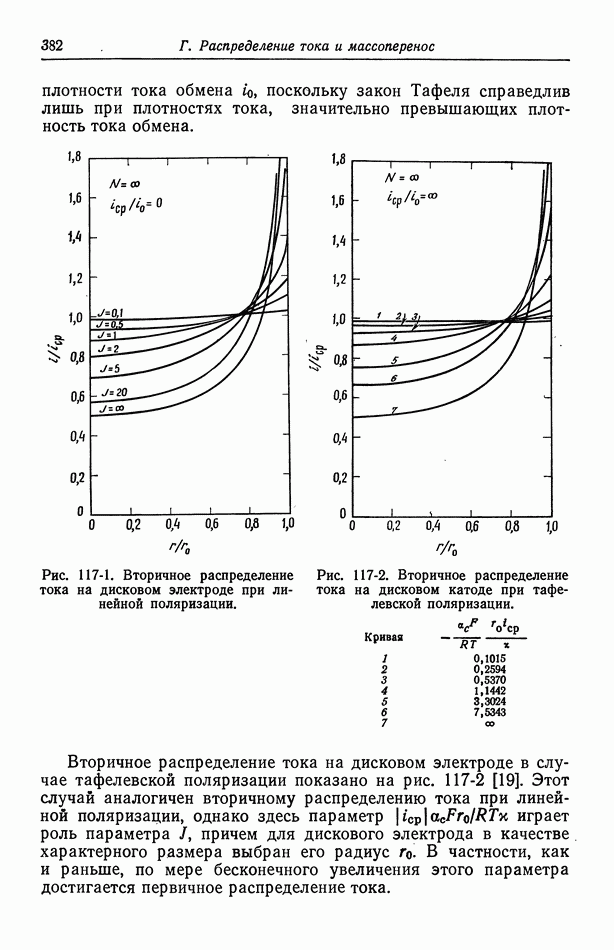
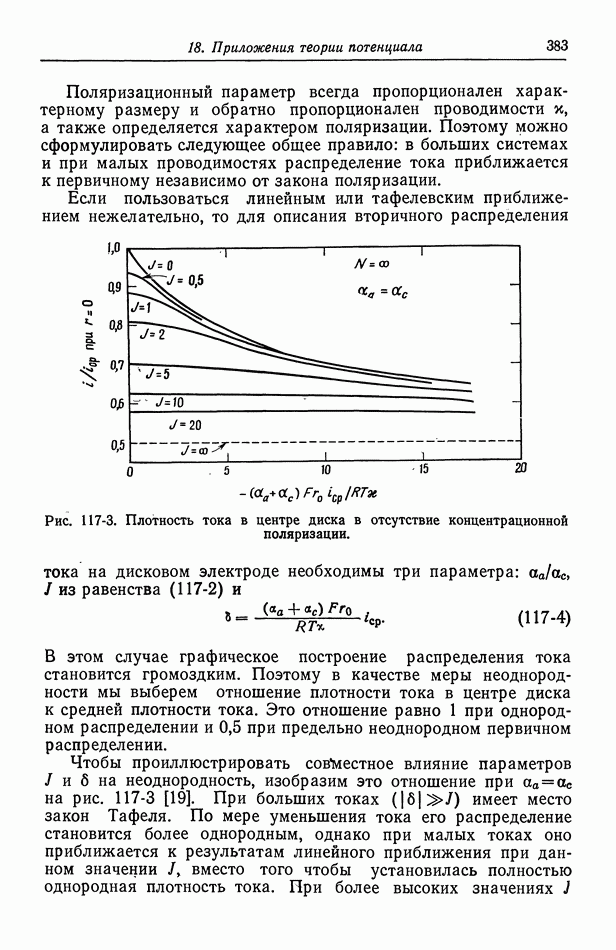
- 117. Вторичное распределение тока
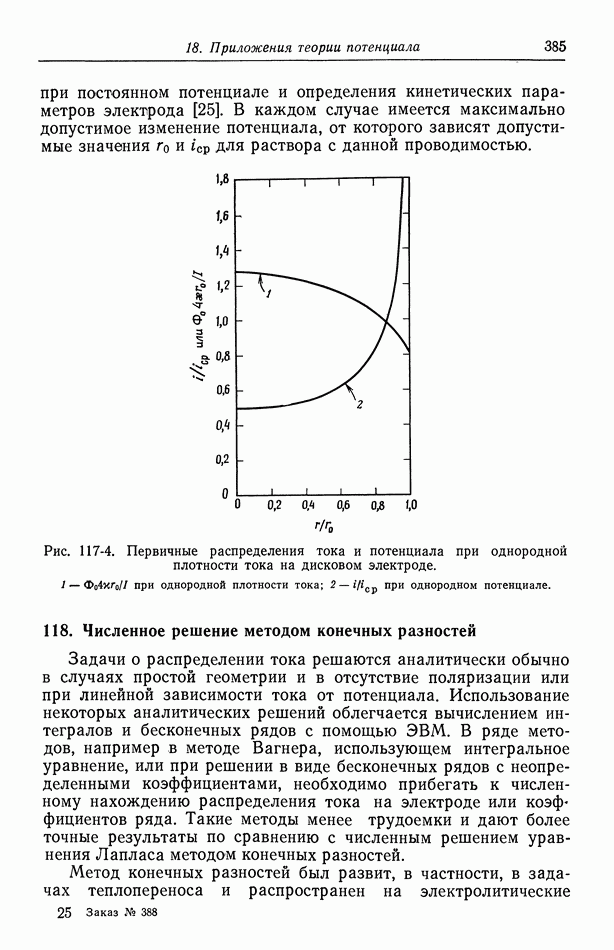
- 118. Численное решение методом конечных разностей
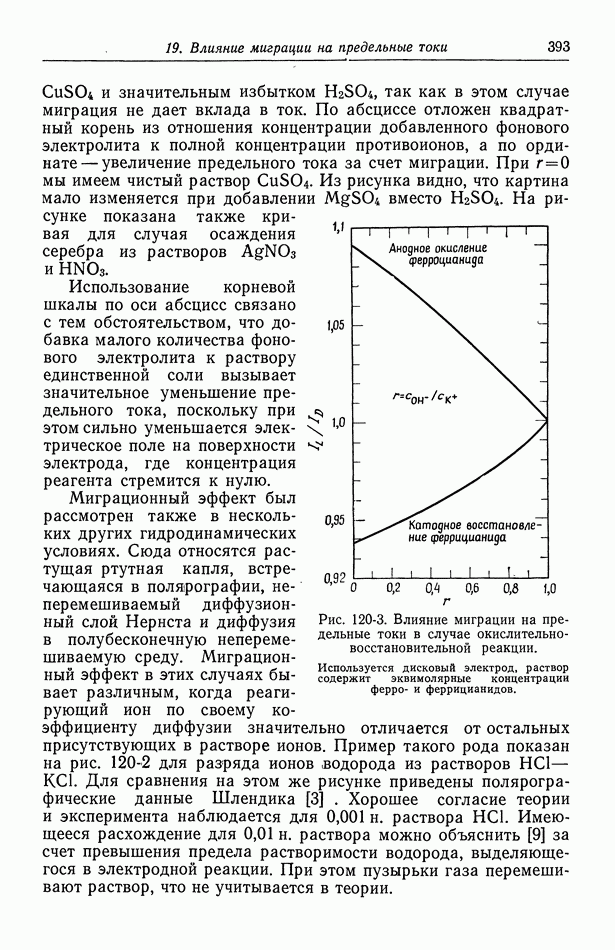
- Глава 19. ВЛИЯНИЕ МИГРАЦИИ НА ПРЕДЕЛЬНЫЕ ТОКИ
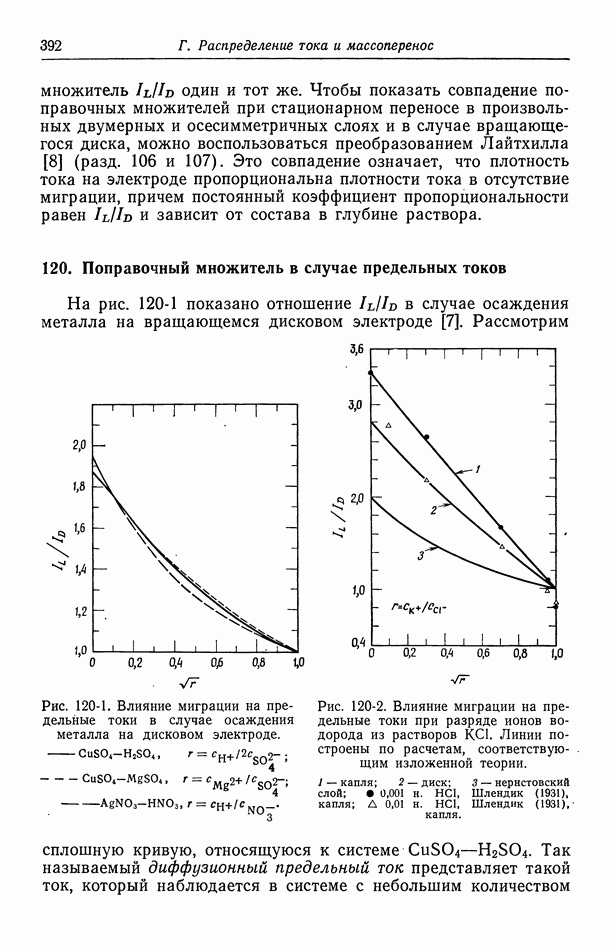
- 120. Поправочный множитель в случае предельных токов
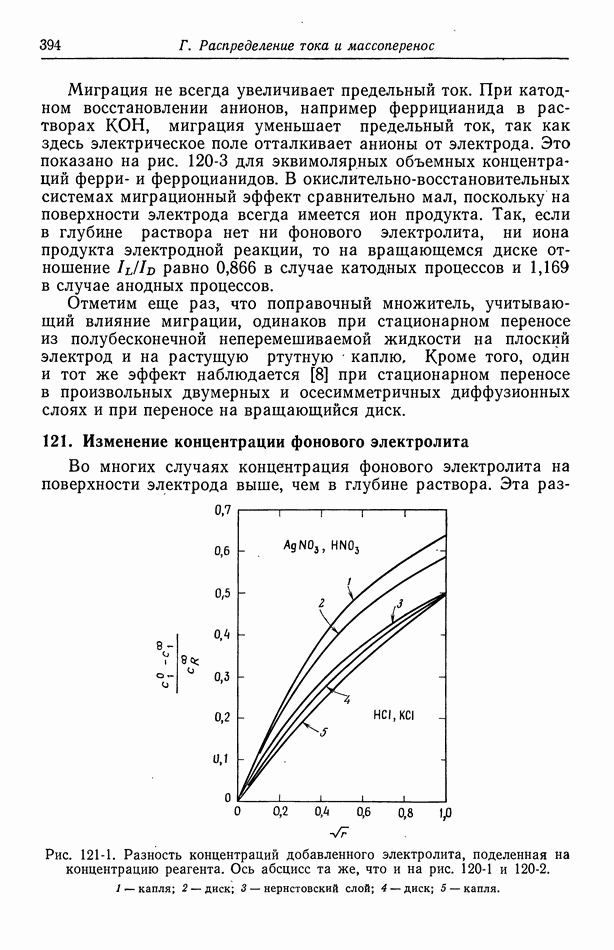
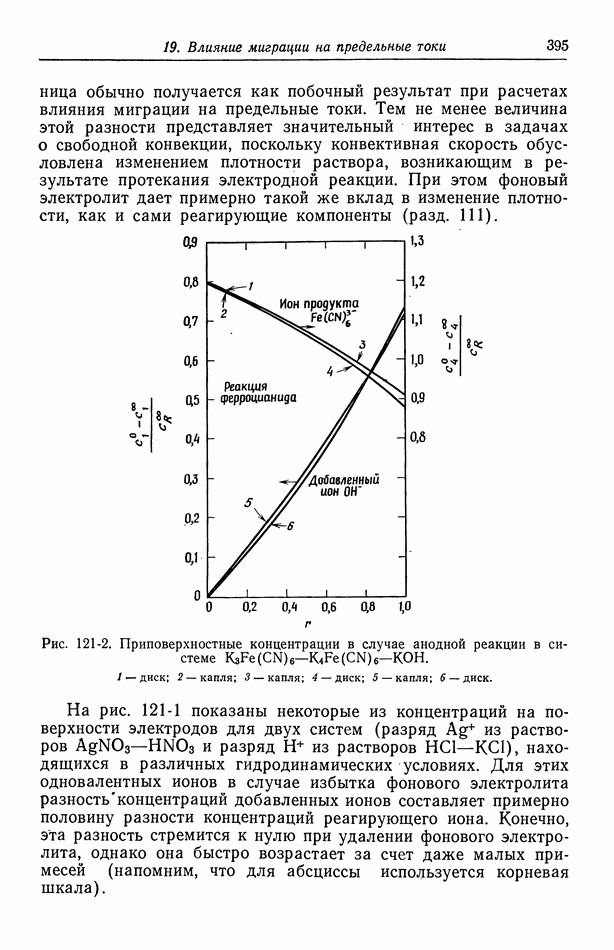
- 121. Изменение концентрации фонового электролита
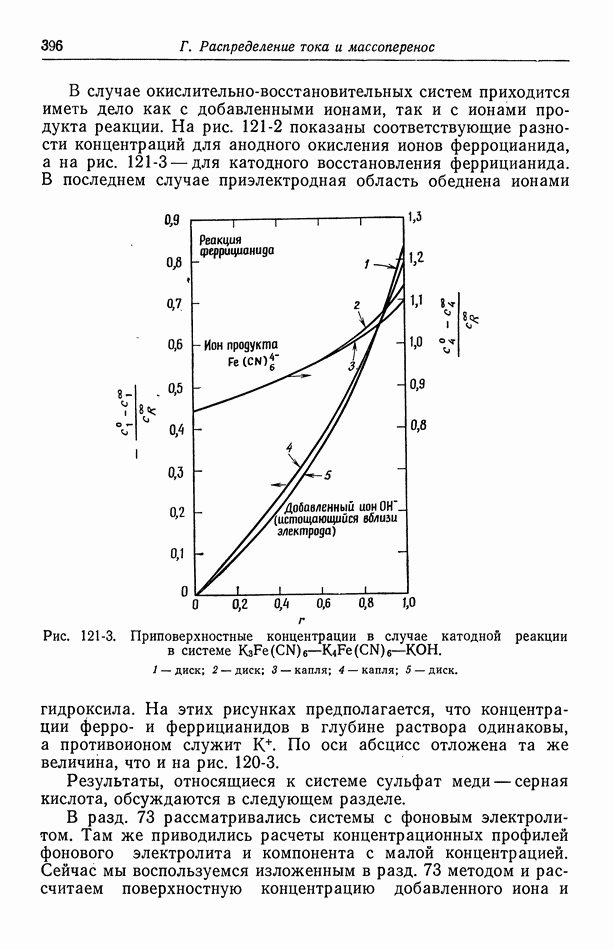
- 122. Роль ионов бисульфата
- 123. Парадоксы с фоновым электролитом
- 124. Предельные токи в случае свободной конвекции
- Глава 20. КОНЦЕНТРАЦИОННОЕ ПЕРЕНАПРЯЖЕНИЕ
- 126. Бинарный электролит
- 127. Фоновый электролит
- 128. Численные расчеты
- Глава 21. ДОПРЕДЕЛЬНЫЕ ТОКИ
- 129. Объем раствора
- 130. Диффузионные слои
- 131. Граничные условия и метод решения
- 132. Результаты для вращающегося диска
- Приложение А. ПАРЦИАЛЬНЫЕ МОЛЯРНЫЕ ОБЪЕМЫ
- Приложение Б. ВЕКТОРЫ И ТЕНЗОРЫ
- Приложение В. ЧИСЛЕННОЕ РЕШЕНИЕ СИСТЕМЫ ОБЫКНОВЕННЫХ ДИФФЕРЕНЦИАЛЬНЫХ УРАВНЕНИЙ