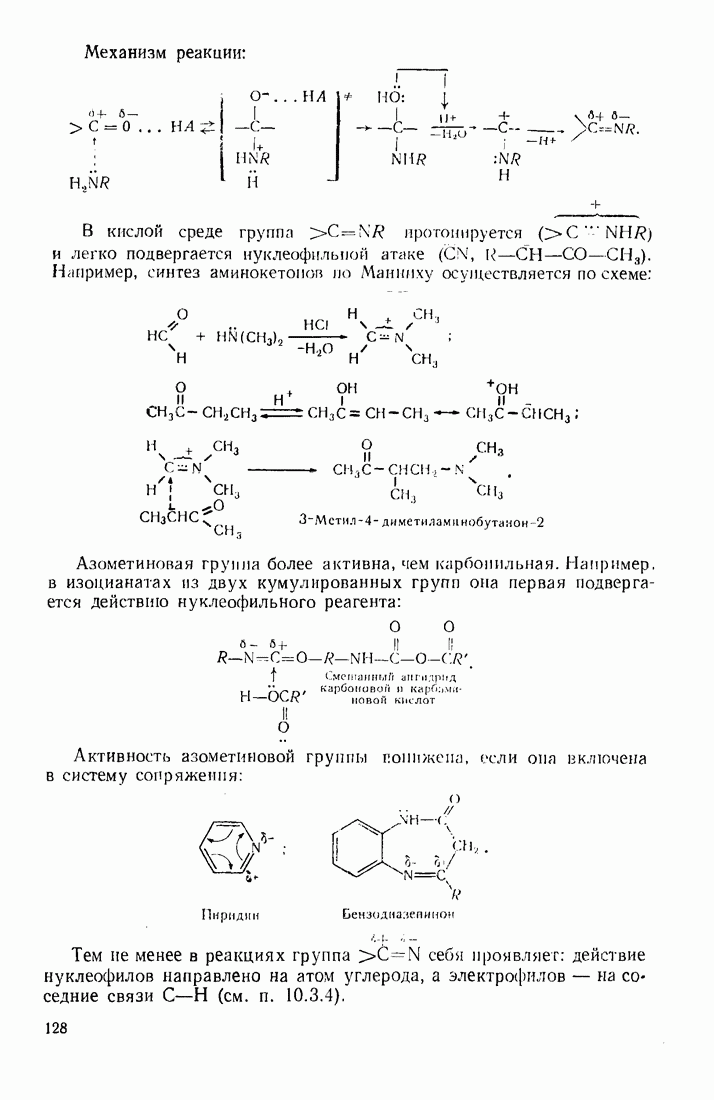
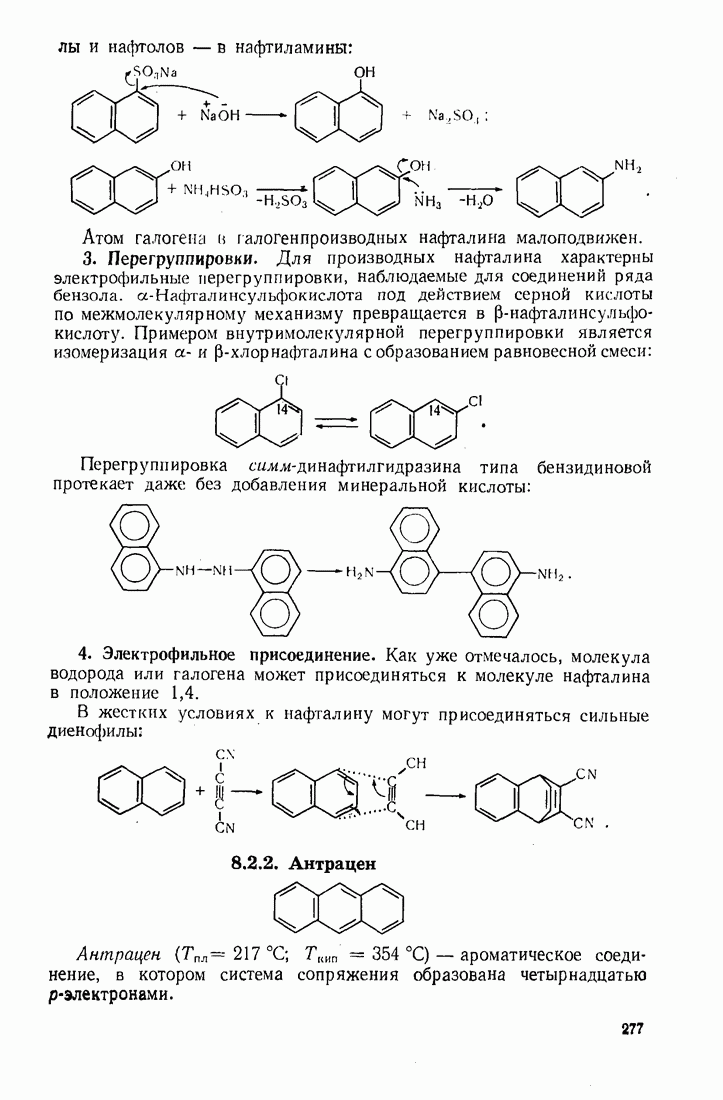
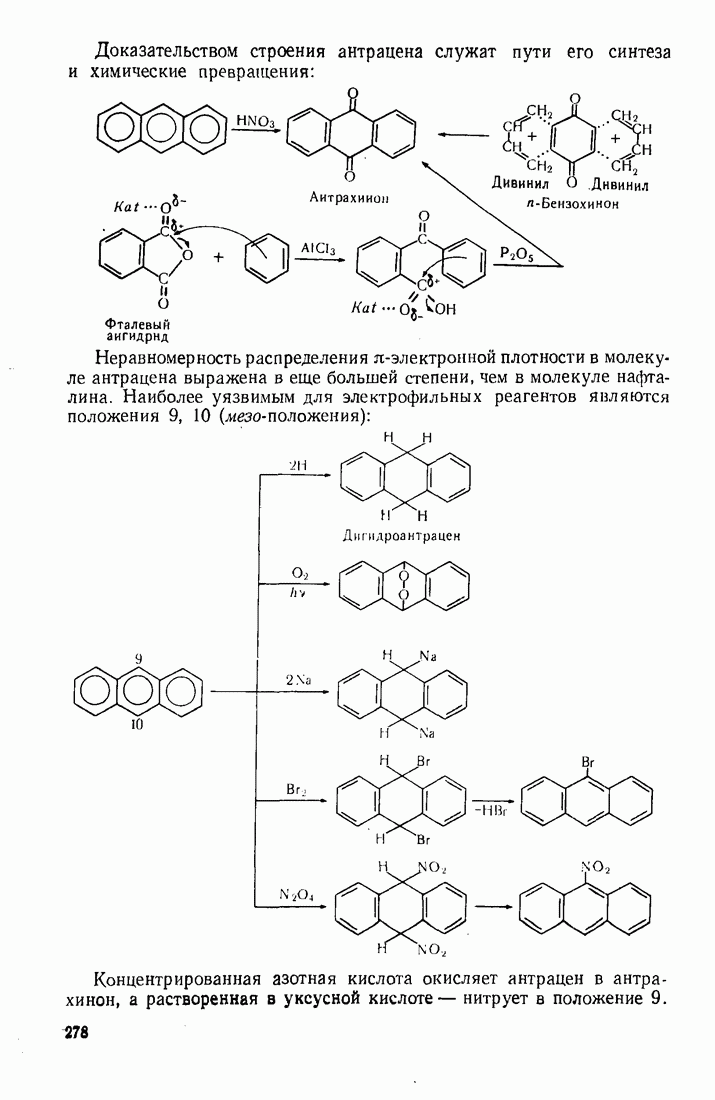
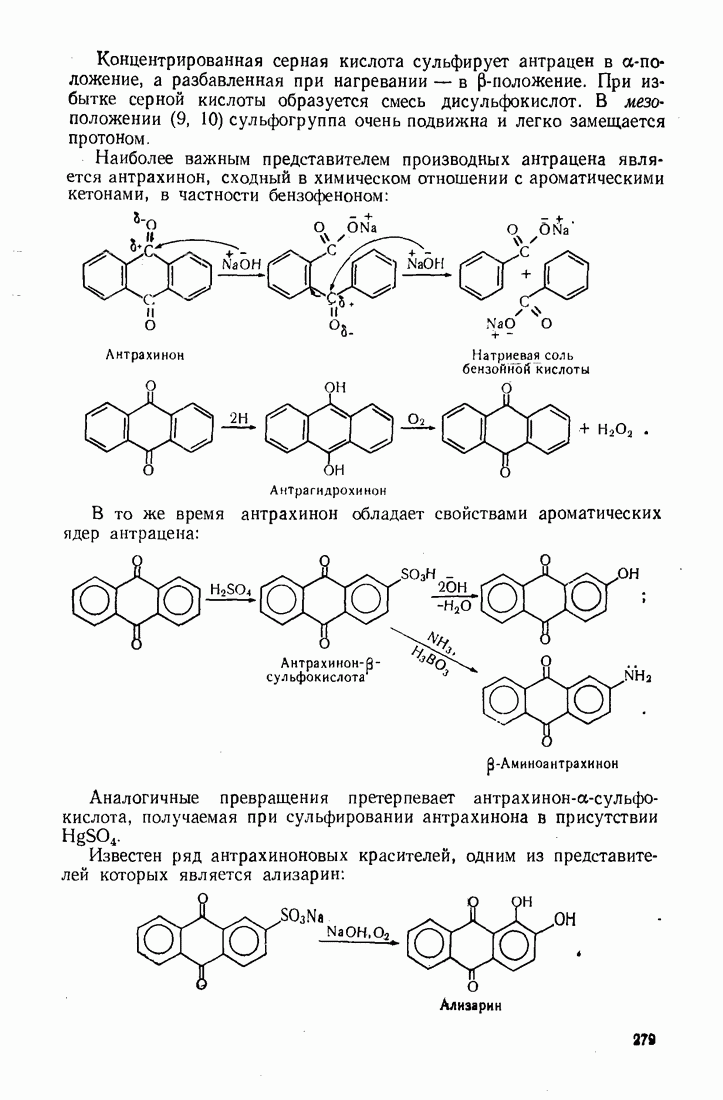
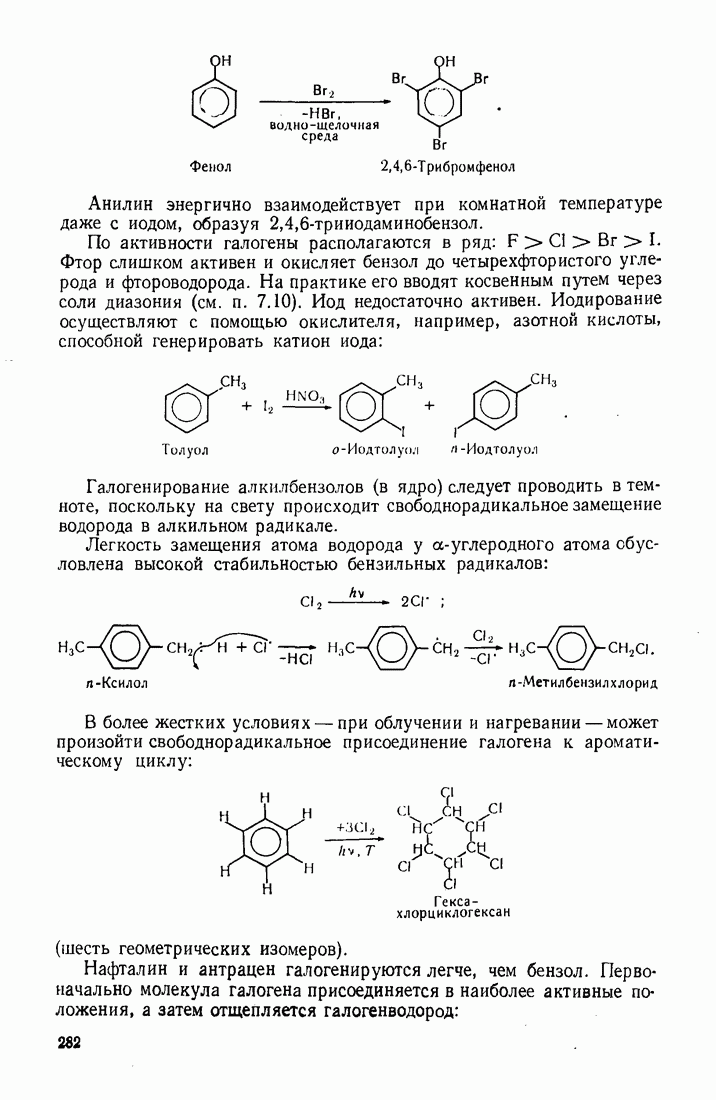
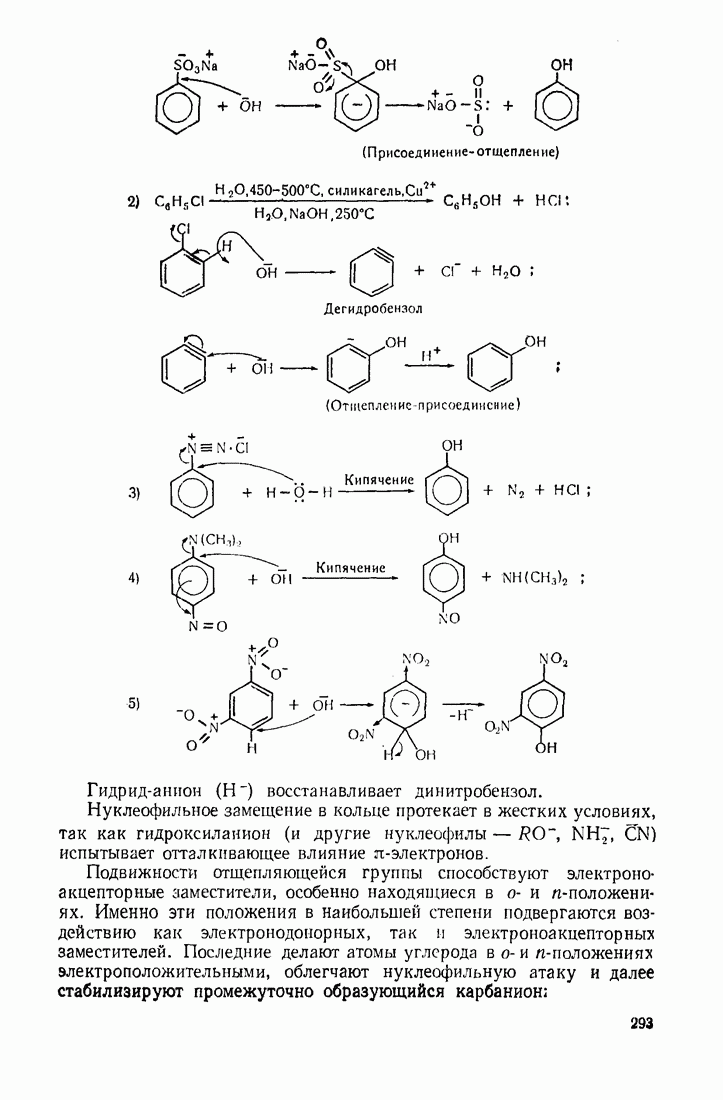
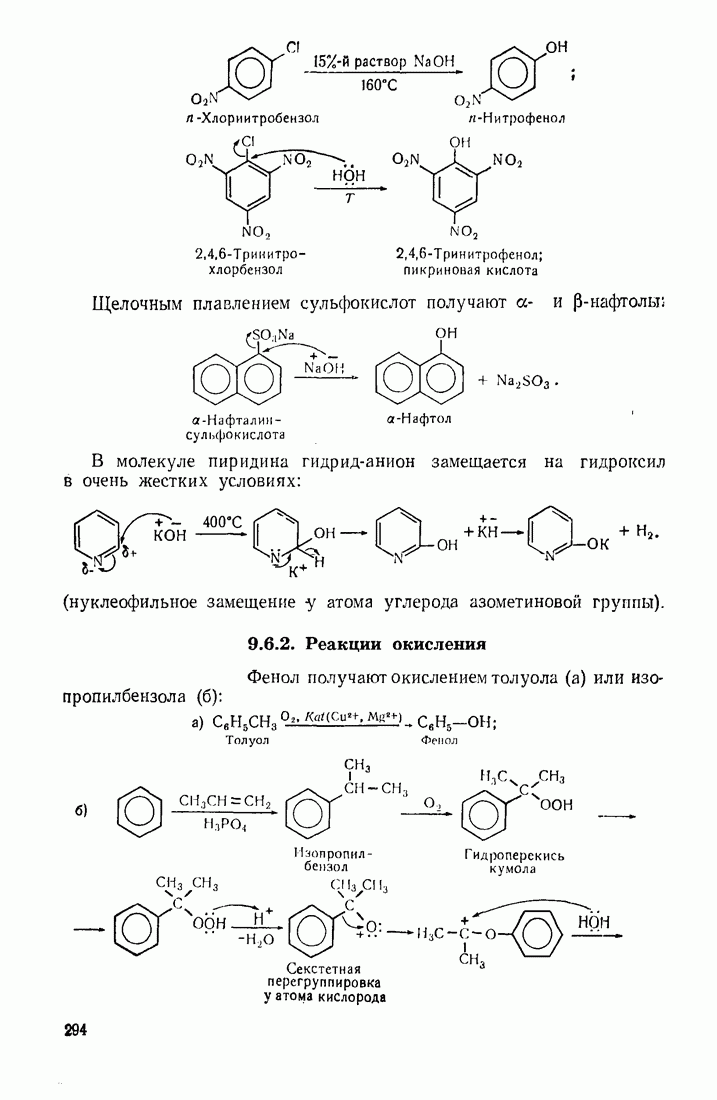
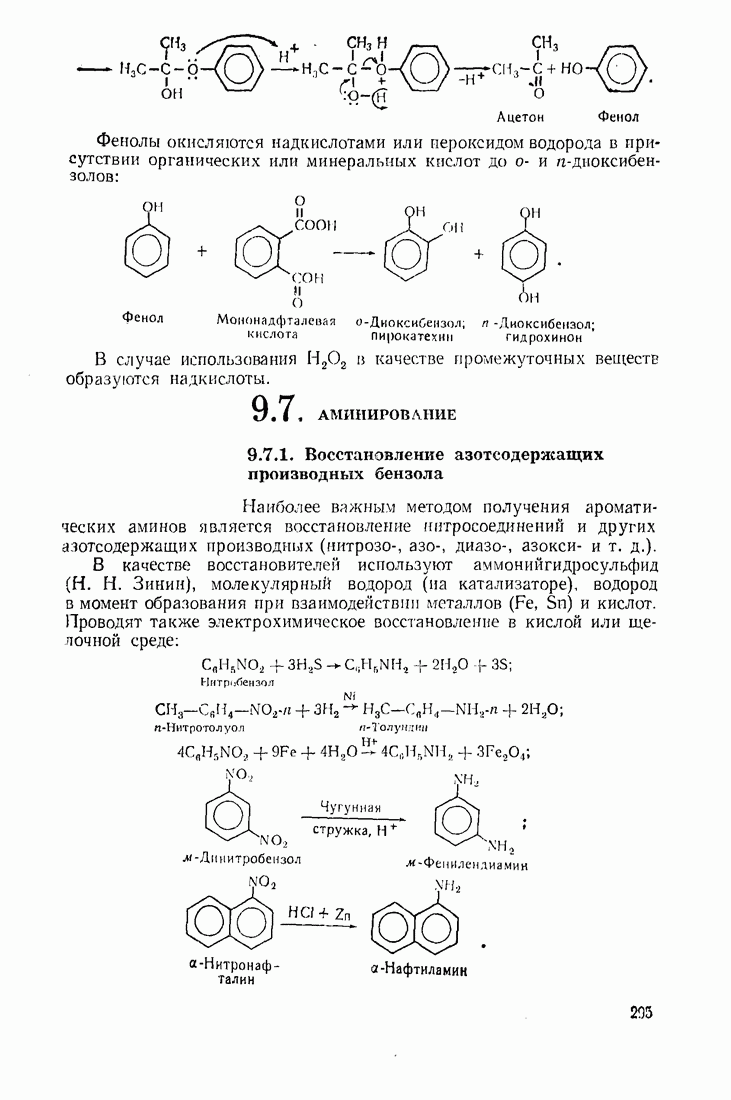
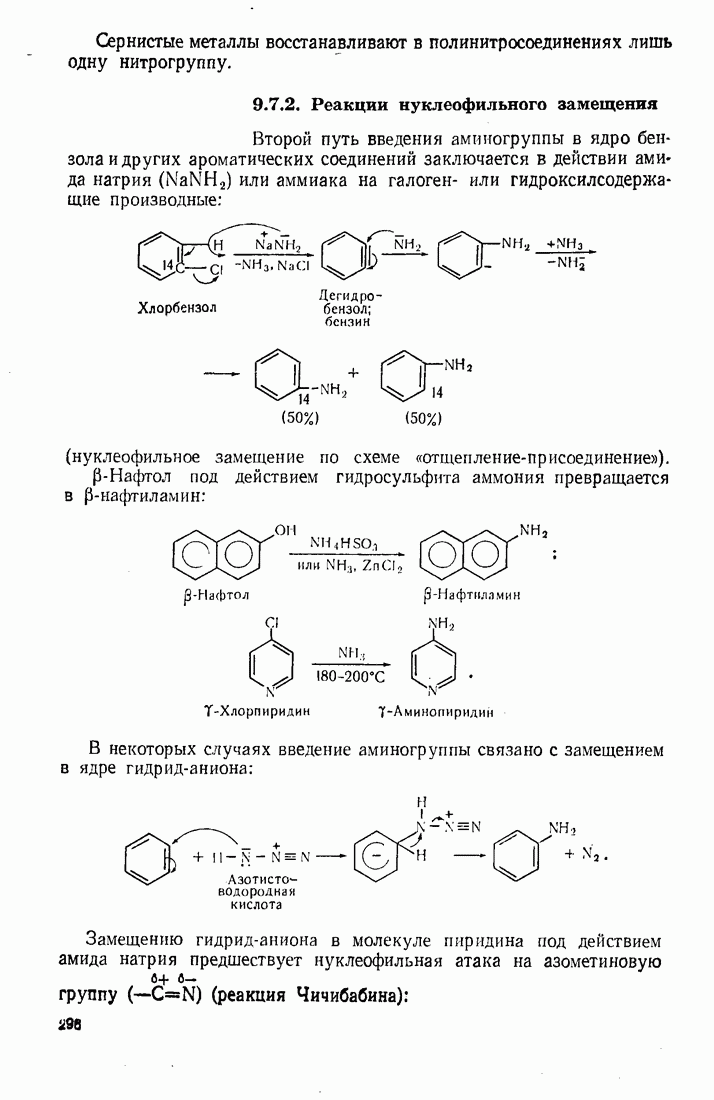
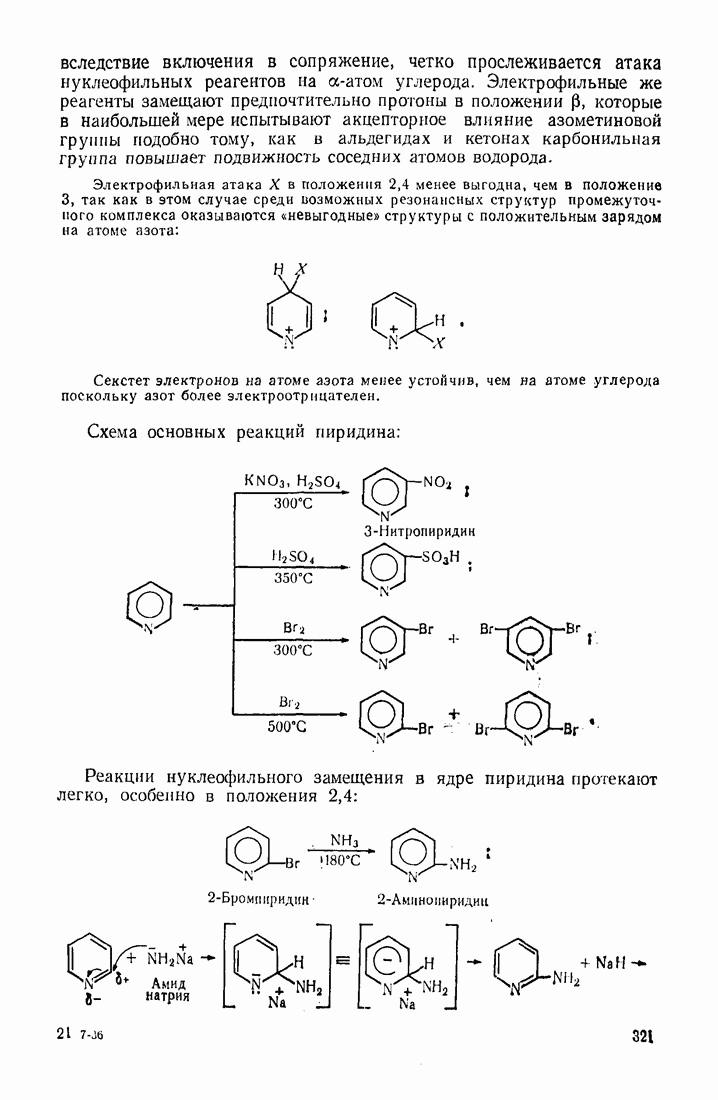
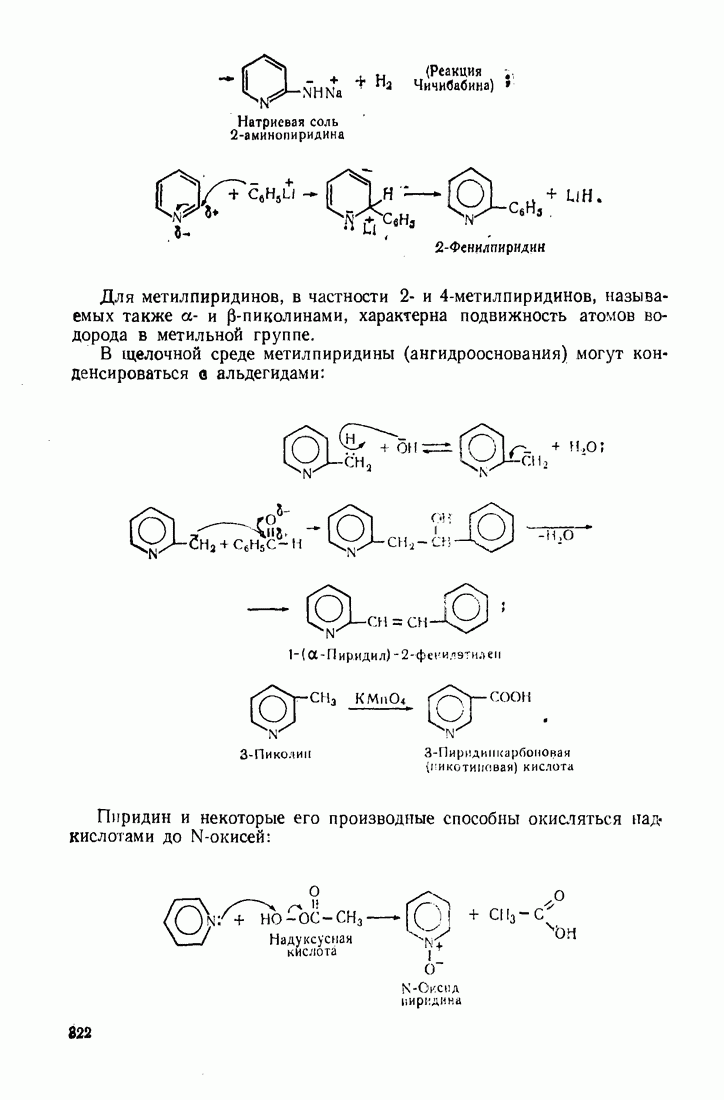
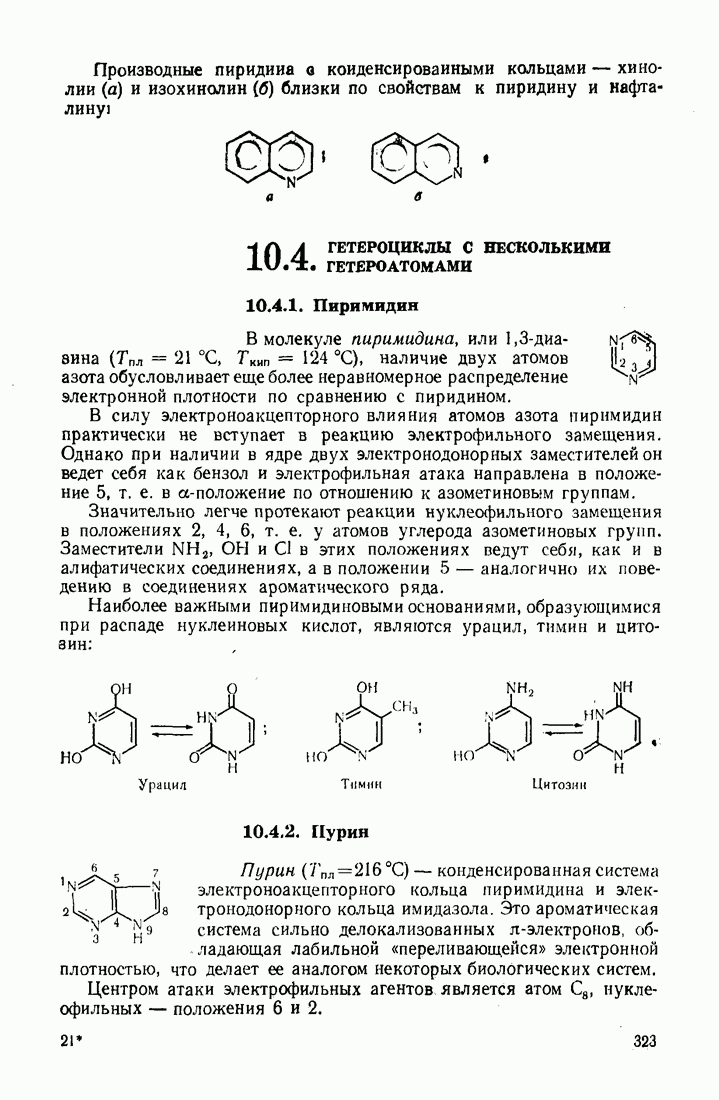
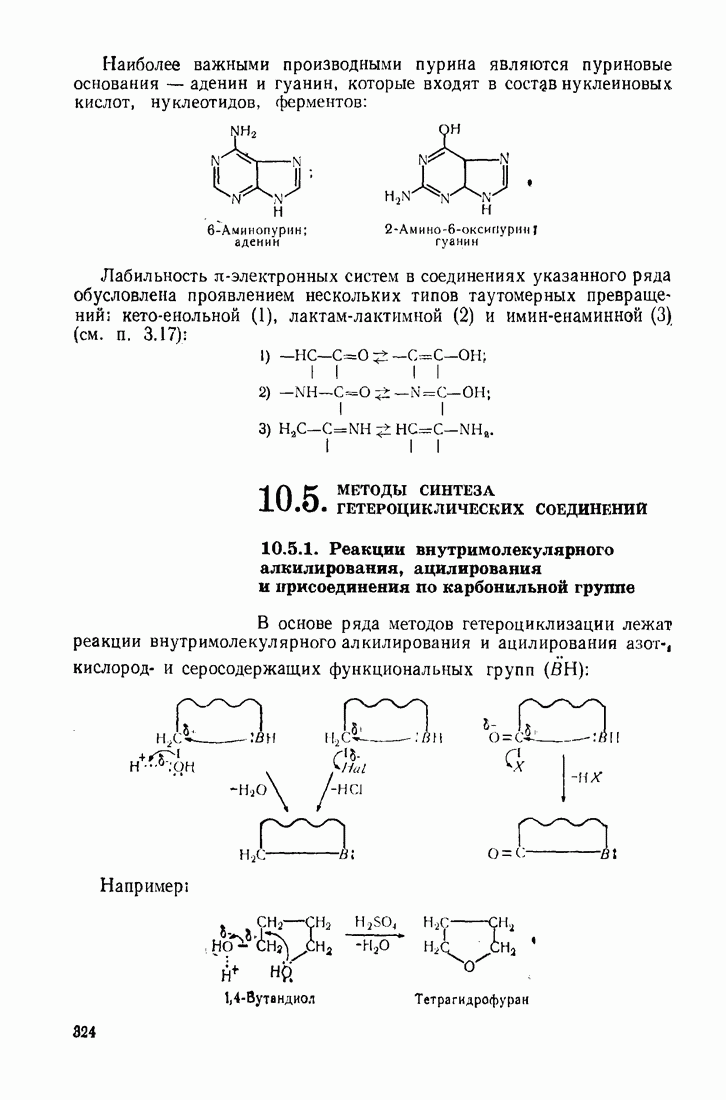
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
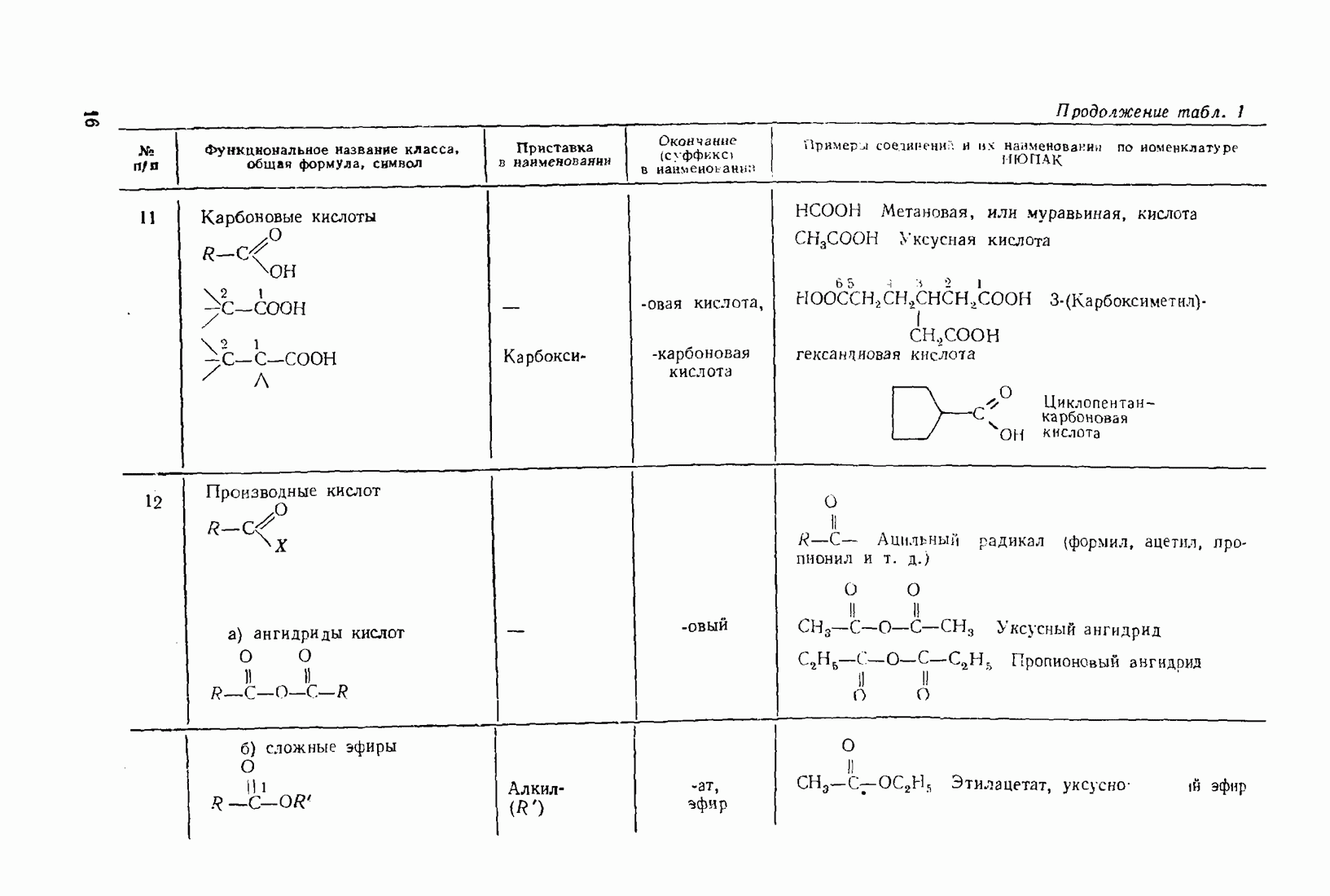
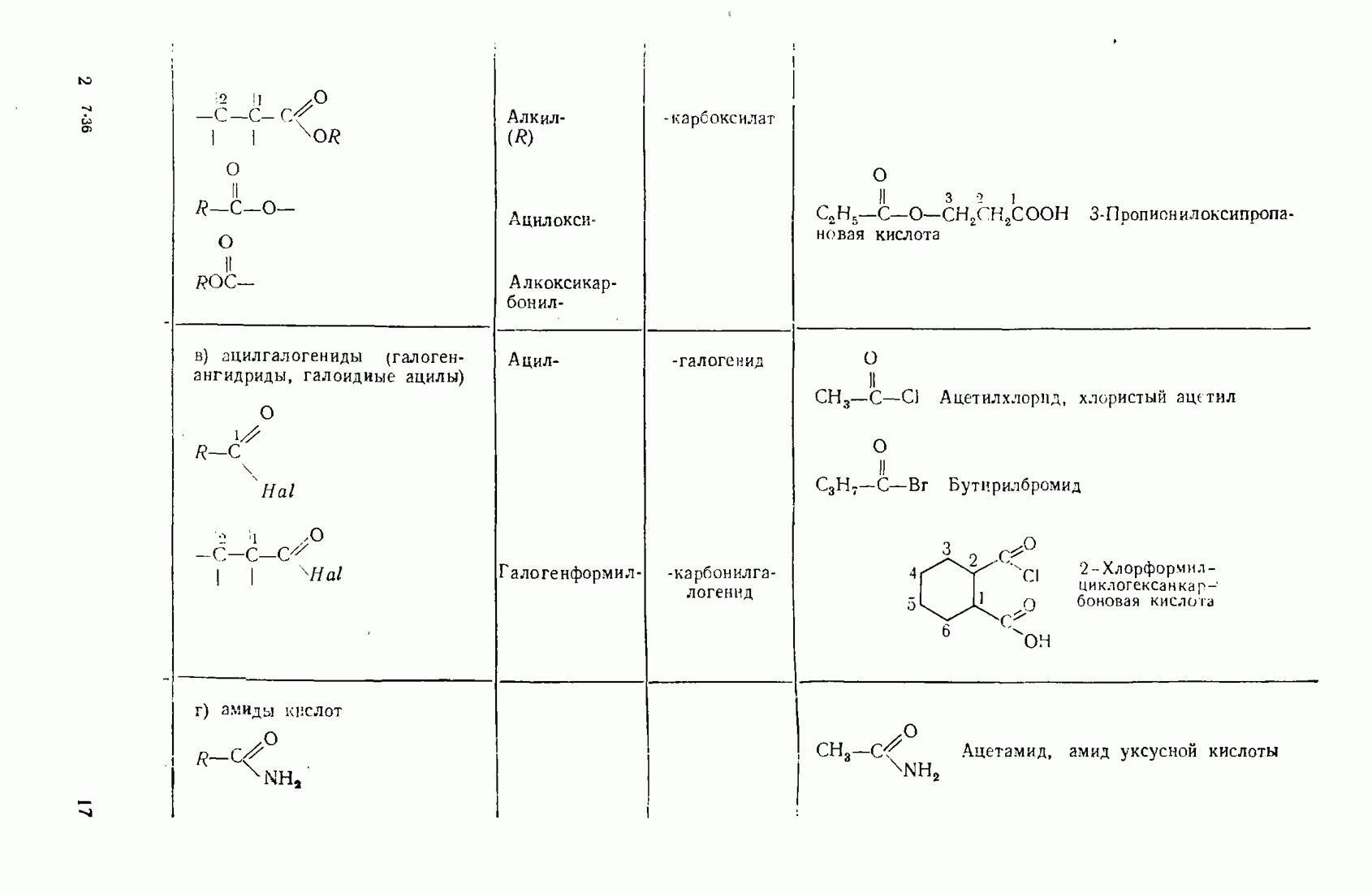
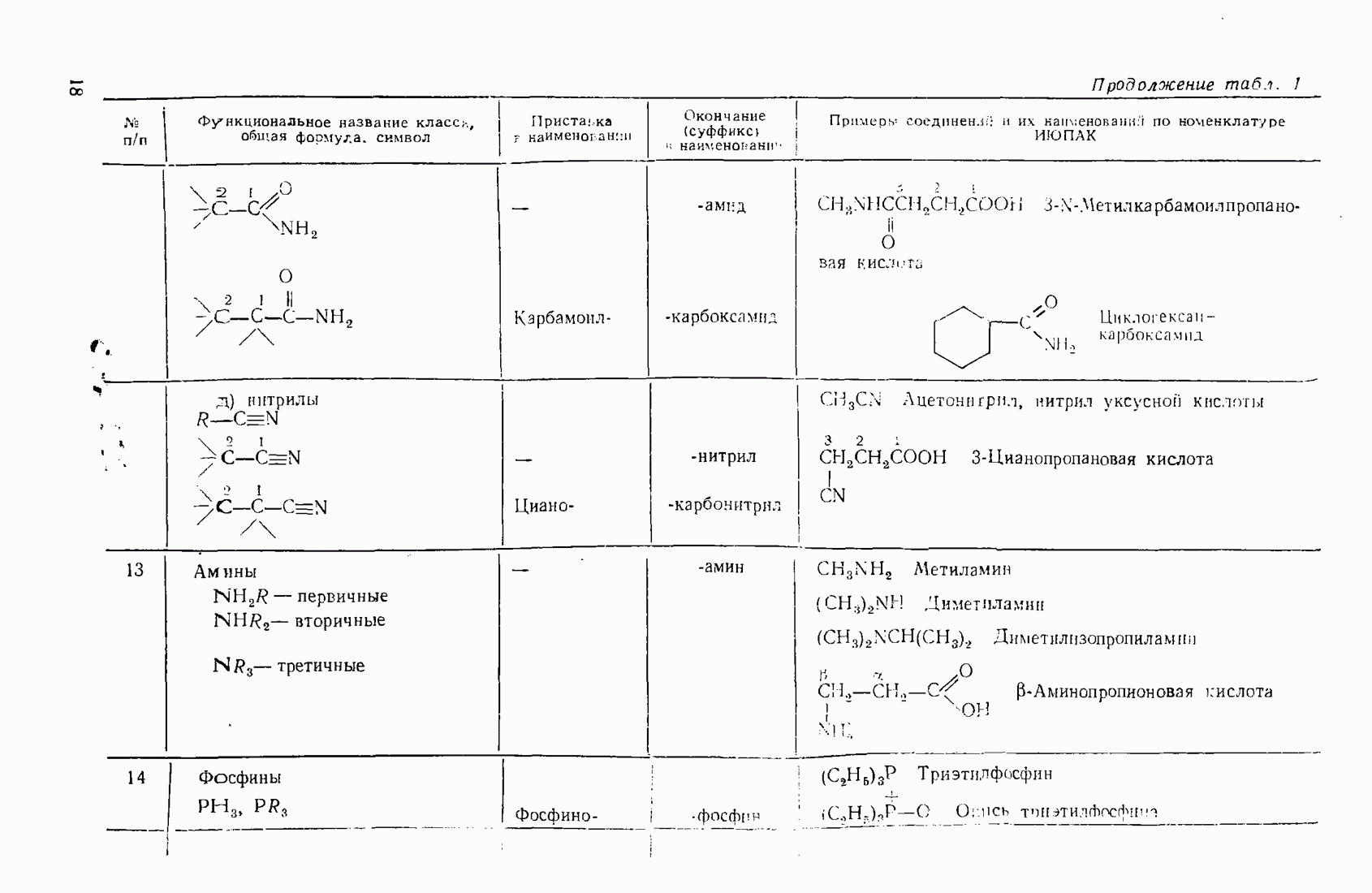
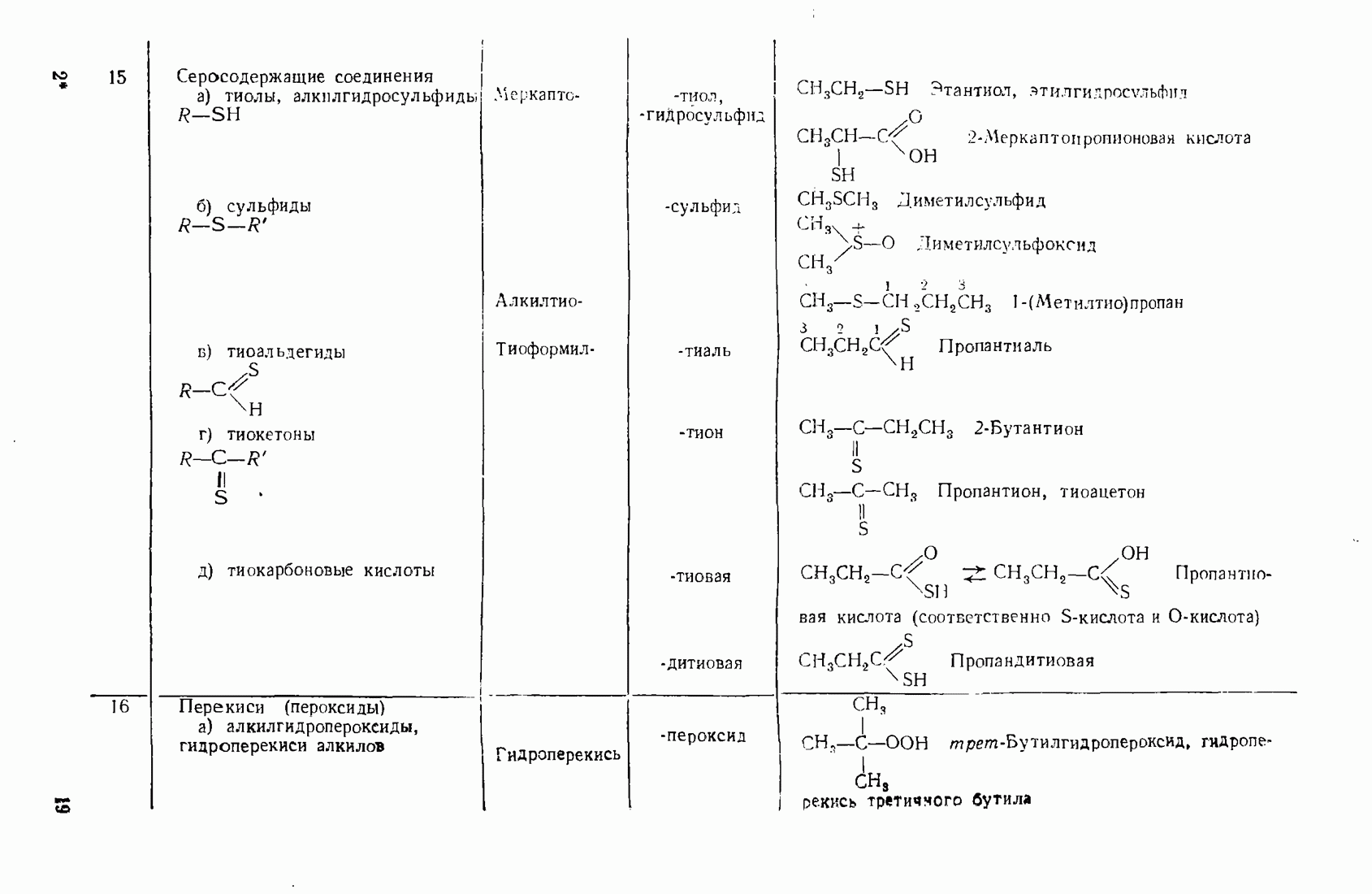
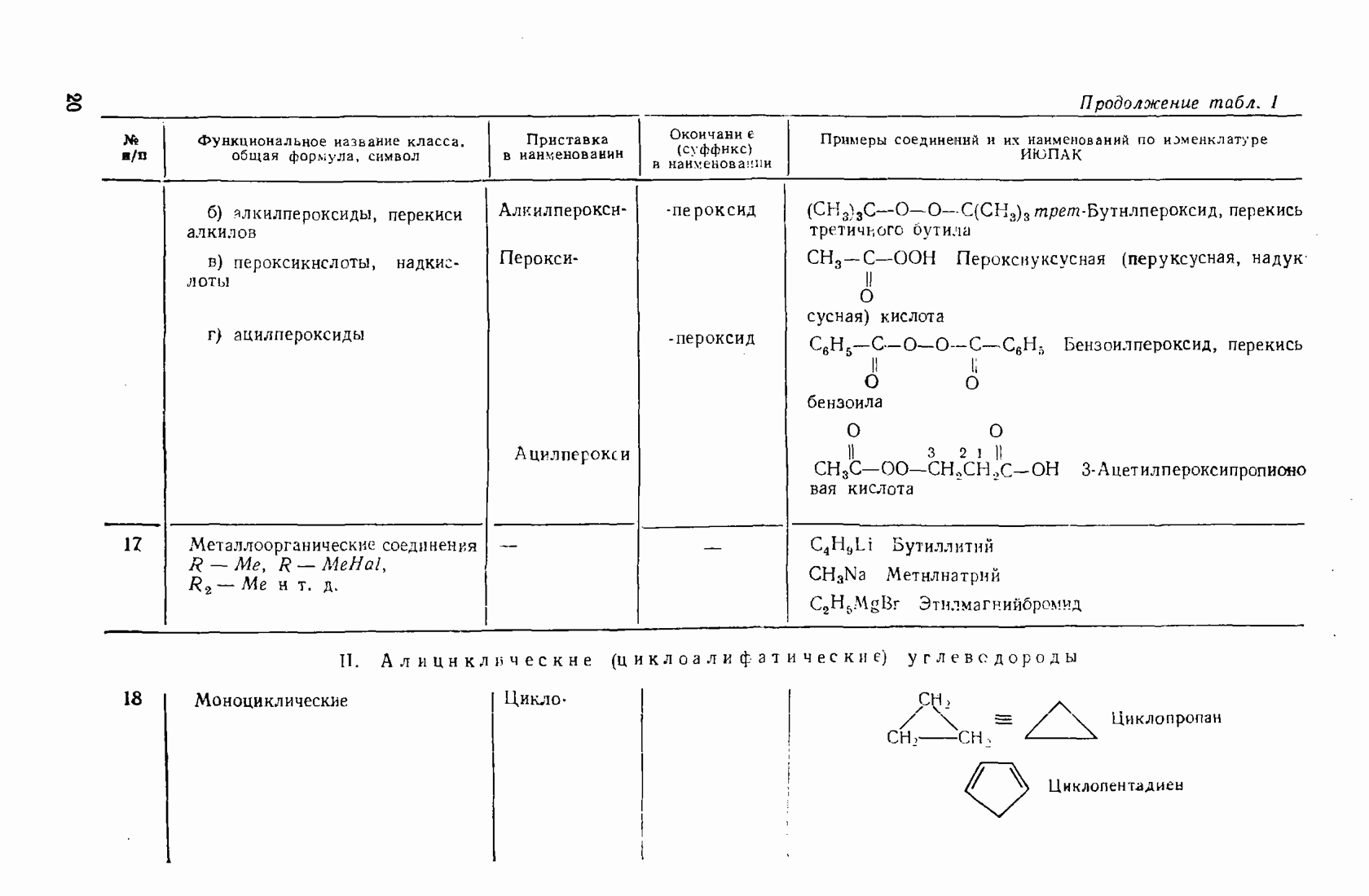
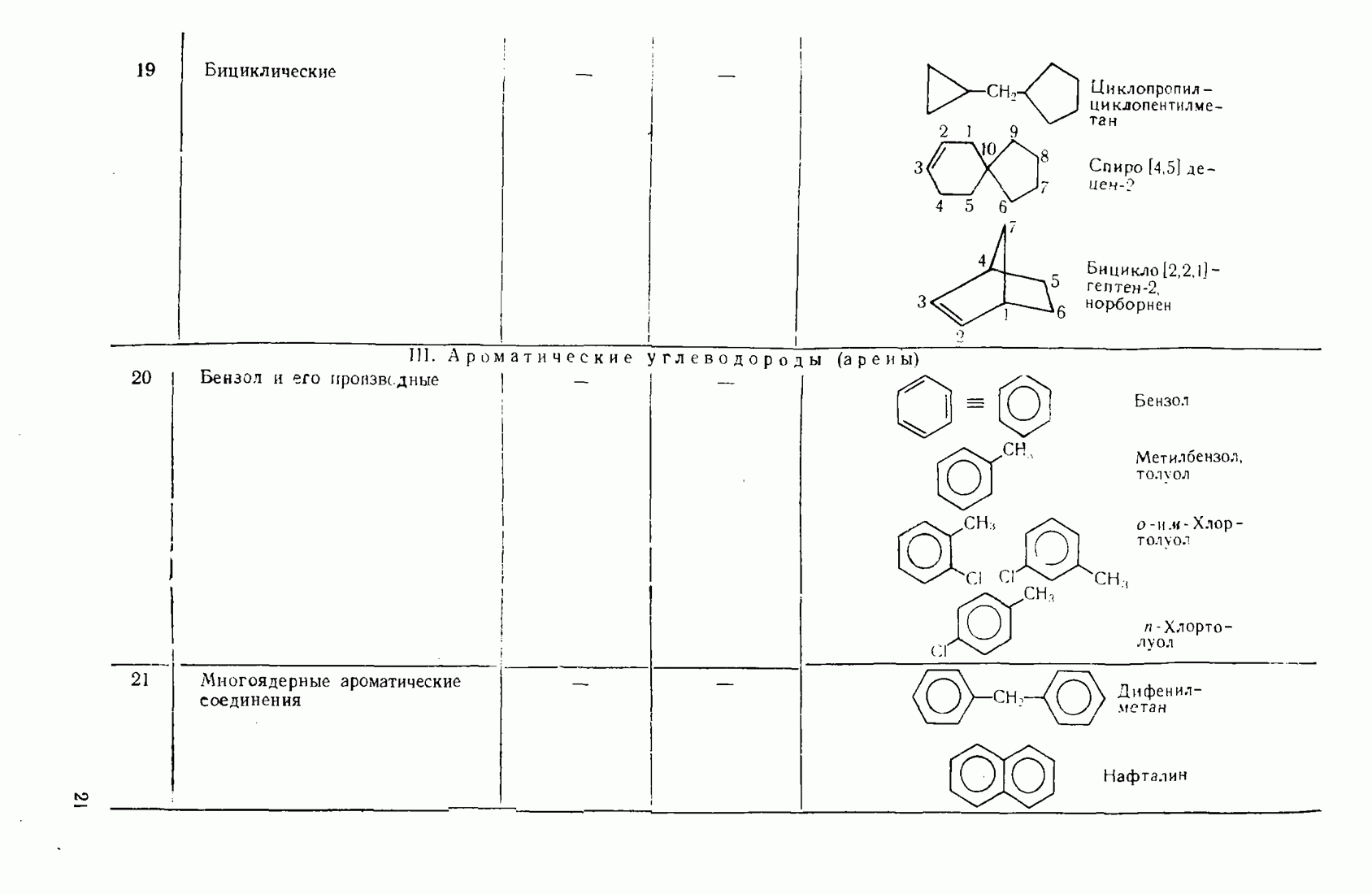
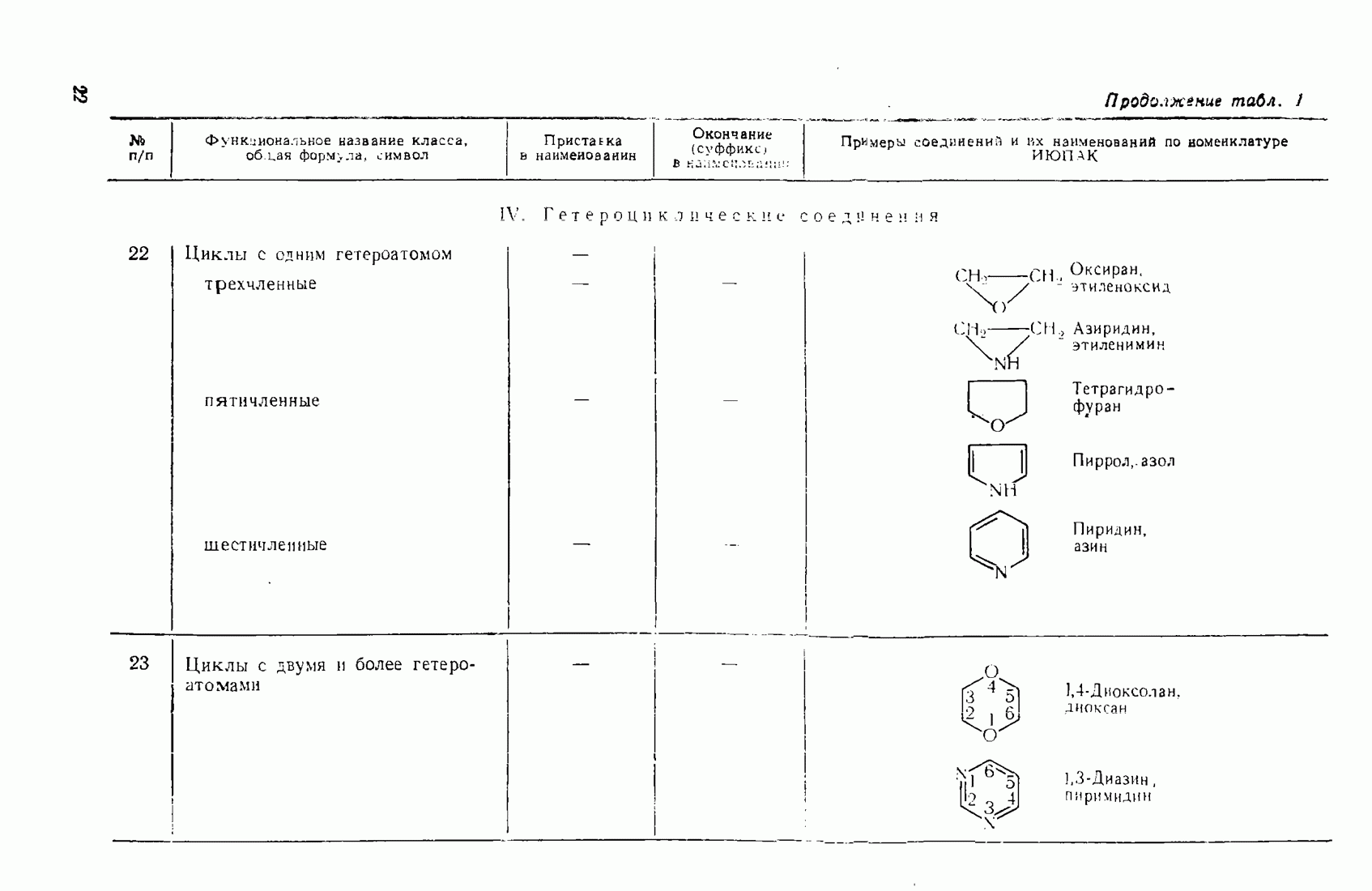
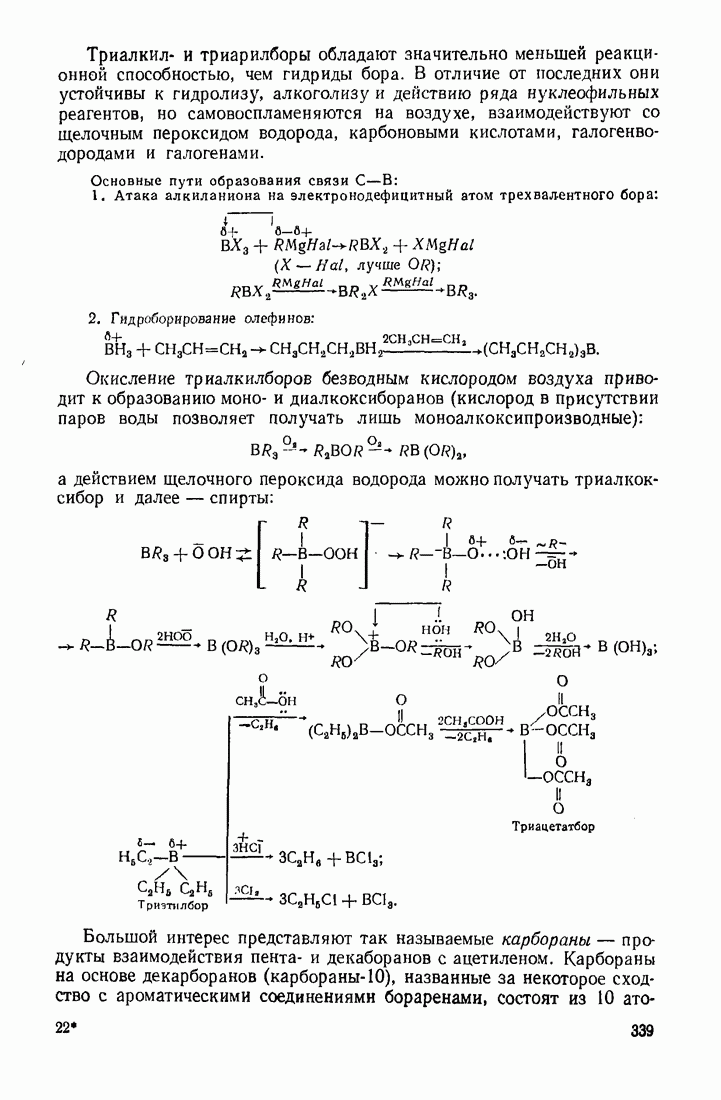
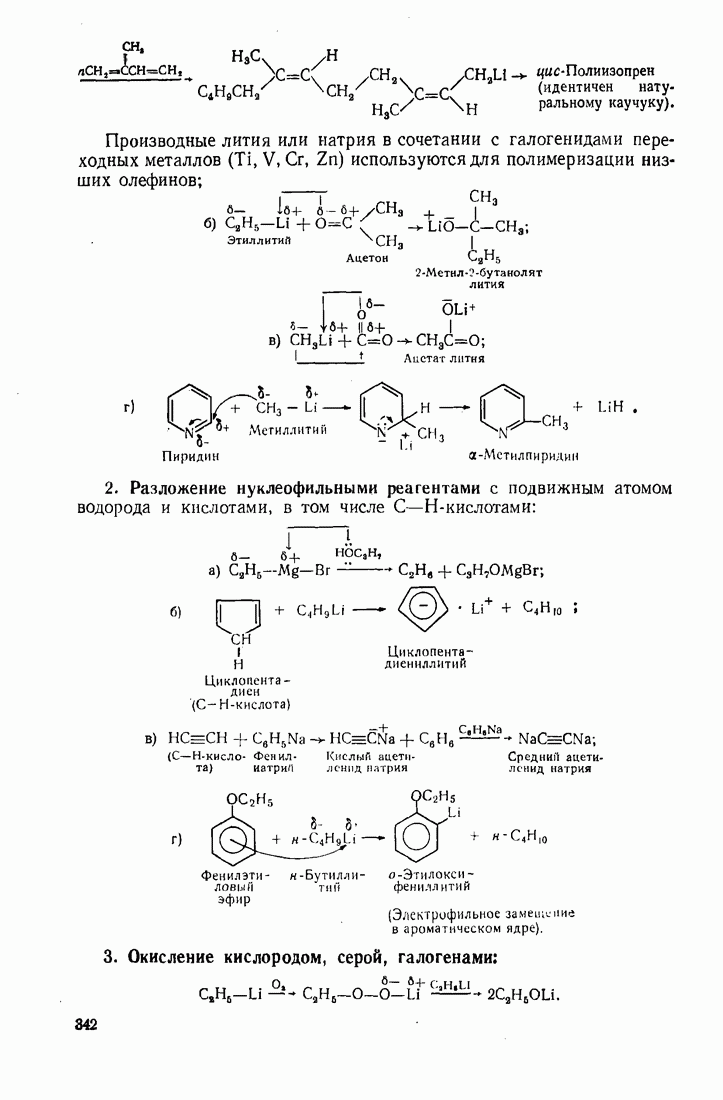
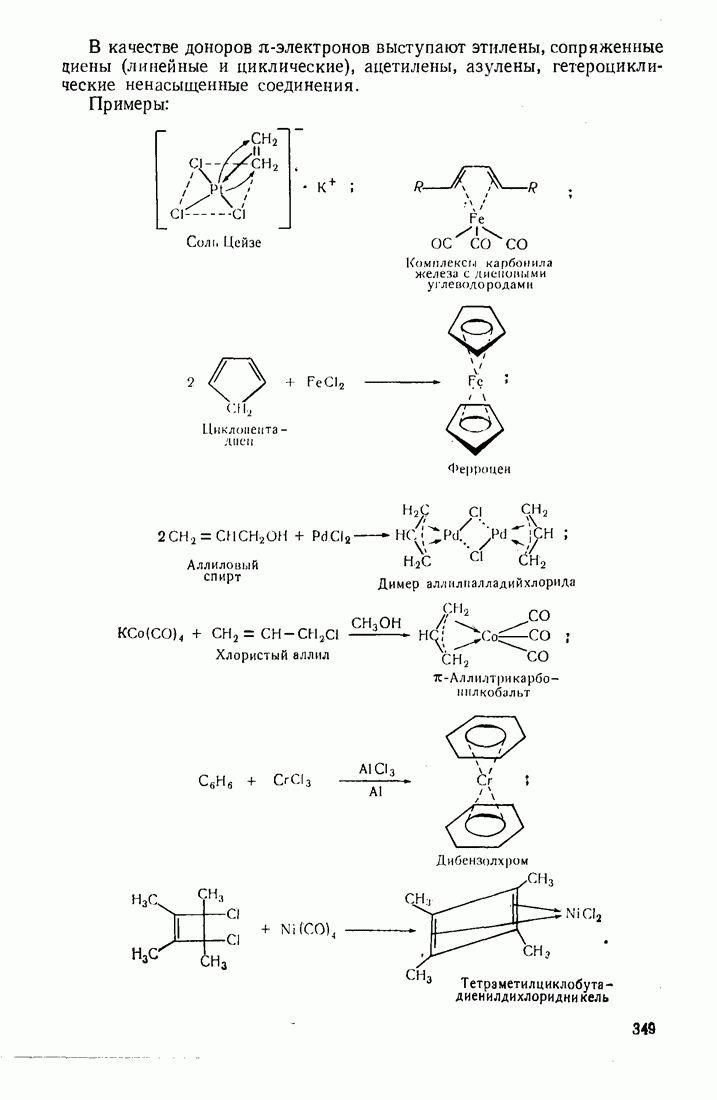
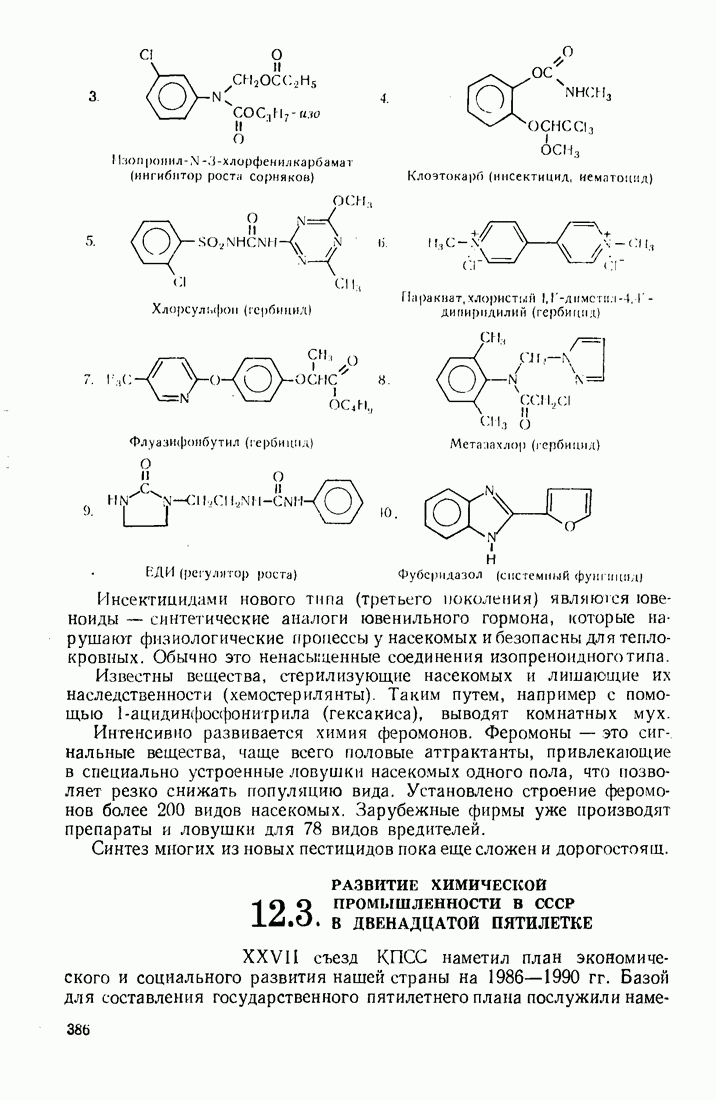
6. Некоторые понятия физической органической химии
6.1. СВЯЗЬ СОСТАВА И СТРОЕНИЯ СОЕДИНЕНИЙ С ФИЗИЧЕСКИМИ СВОЙСТВАМИ
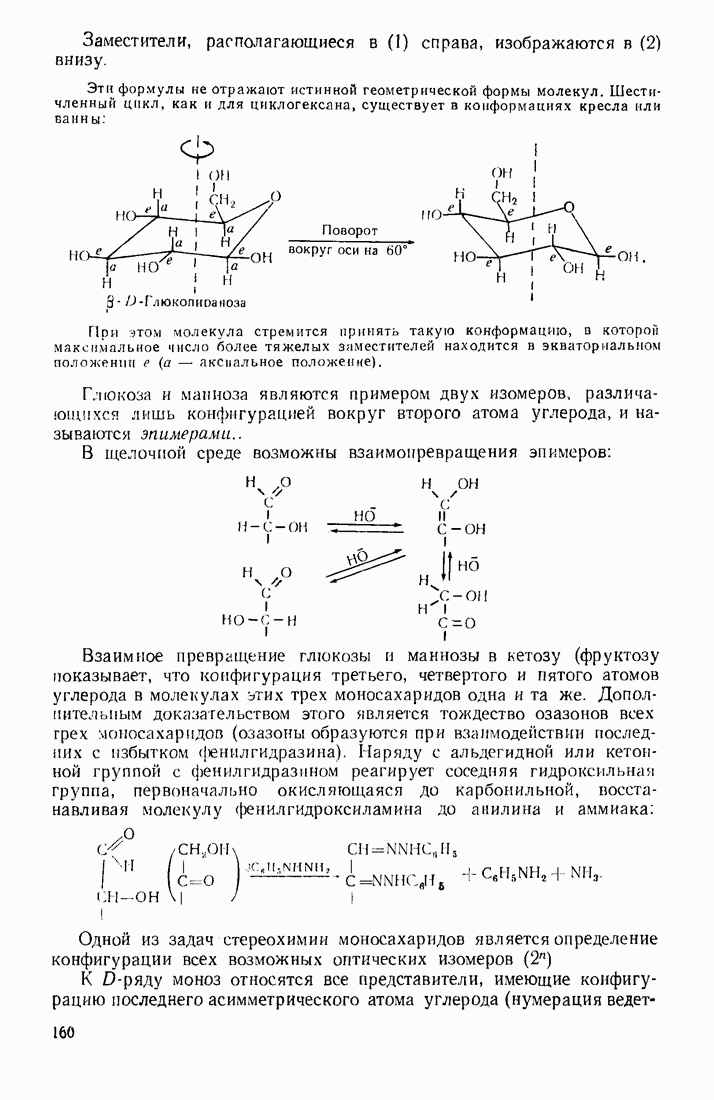
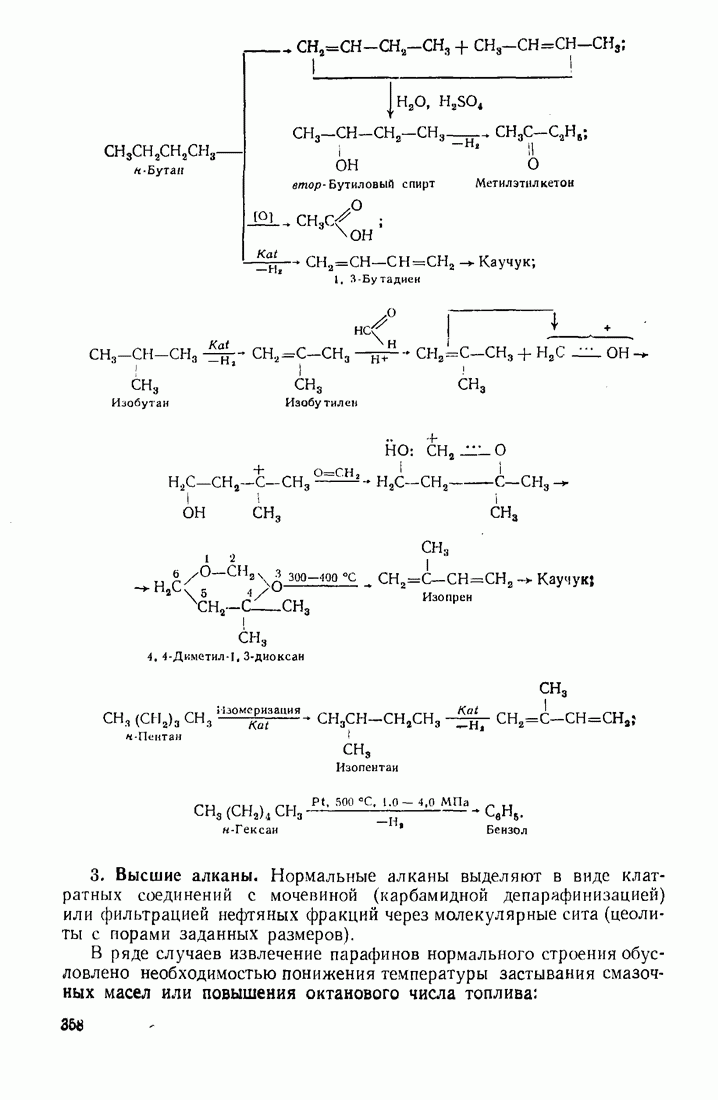
Родоначальники всех классов соединений алифатического ряда — алканы. При нормальных условиях углеводороды  представляют собой газы,
представляют собой газы,  жидкости,
жидкости,  и выше — твердые вещества. В начале ряда
и выше — твердые вещества. В начале ряда  при удлинении углеродной цепи на один атом температура кипения повышается на 25—30 °С. Наиболее высокой температурой кипения и плотностью и ряду изомеров обладают нормальные углеводороды, вероятно, в связи с наиболее плотной упаковкой молекул.
при удлинении углеродной цепи на один атом температура кипения повышается на 25—30 °С. Наиболее высокой температурой кипения и плотностью и ряду изомеров обладают нормальные углеводороды, вероятно, в связи с наиболее плотной упаковкой молекул.
Парафиновые углеводороды нормального строения образуют так называемые клатратные соединения с мочевиной, располагаясь в пустотах ее кристаллической решетки. Эта особенность используется для отделения нормальных углеводородов и их производных от родственных соединении с разветвленной структурой. Нормальные углеводороды кристаллизуются с мочевиной в спиртовых или ацетоновых растворах.
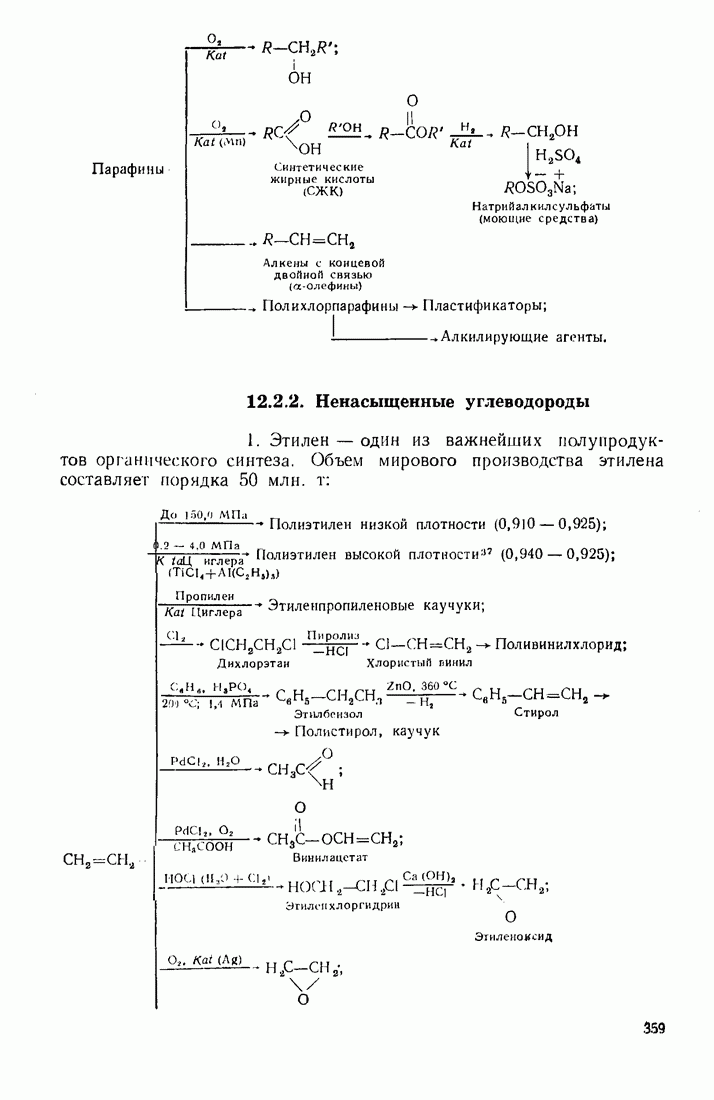
Олефины (алкены)  ацетилены (алкины) по физическим свойствам близки к соответствующим алканам. Начиная с пентена и бутнна, ненасыщенные углеводороды представляют собой жидкости.
ацетилены (алкины) по физическим свойствам близки к соответствующим алканам. Начиная с пентена и бутнна, ненасыщенные углеводороды представляют собой жидкости.
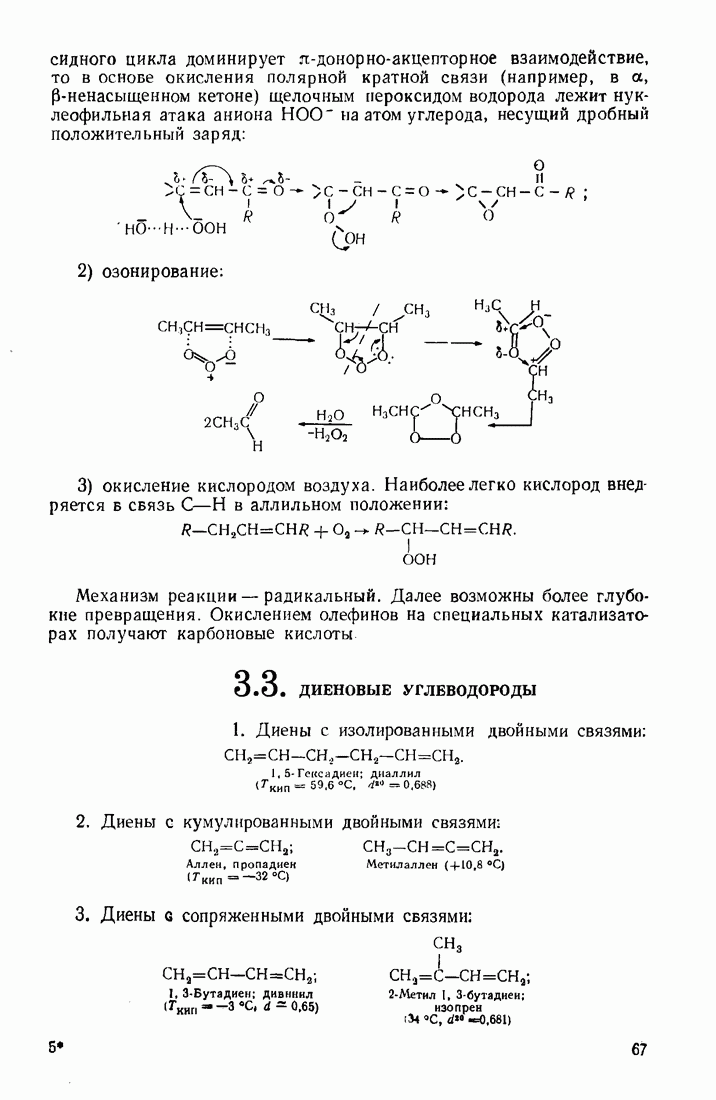
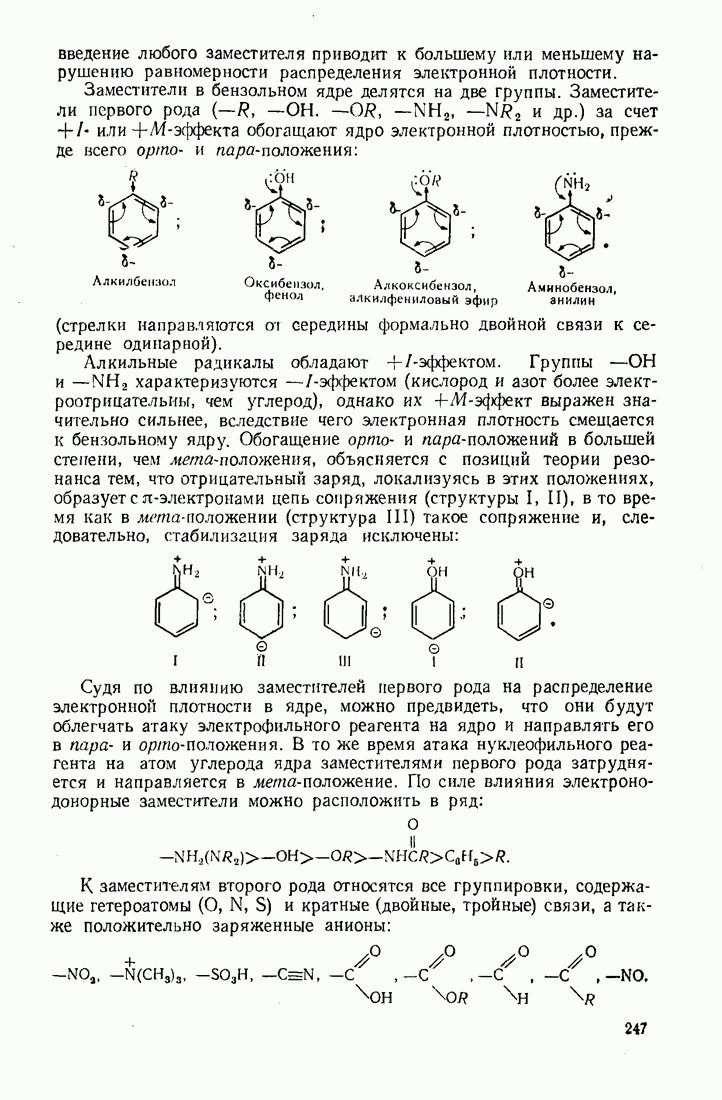
Введение в углеводородные цепи заместителей, содержащих гетероатомы  и др.), существенным образом изменяет физические свойства вещества. В связи с повышением полярности связей и молекул в целом усиливаются межмолекулярные взаимодействия, что приводит к повышению температур кипения и плавления. Особенно заметны эти изменения при введении групп, образующих межмолекулярные водородные связи:
и др.), существенным образом изменяет физические свойства вещества. В связи с повышением полярности связей и молекул в целом усиливаются межмолекулярные взаимодействия, что приводит к повышению температур кипения и плавления. Особенно заметны эти изменения при введении групп, образующих межмолекулярные водородные связи:  (табл. 6).
(табл. 6).
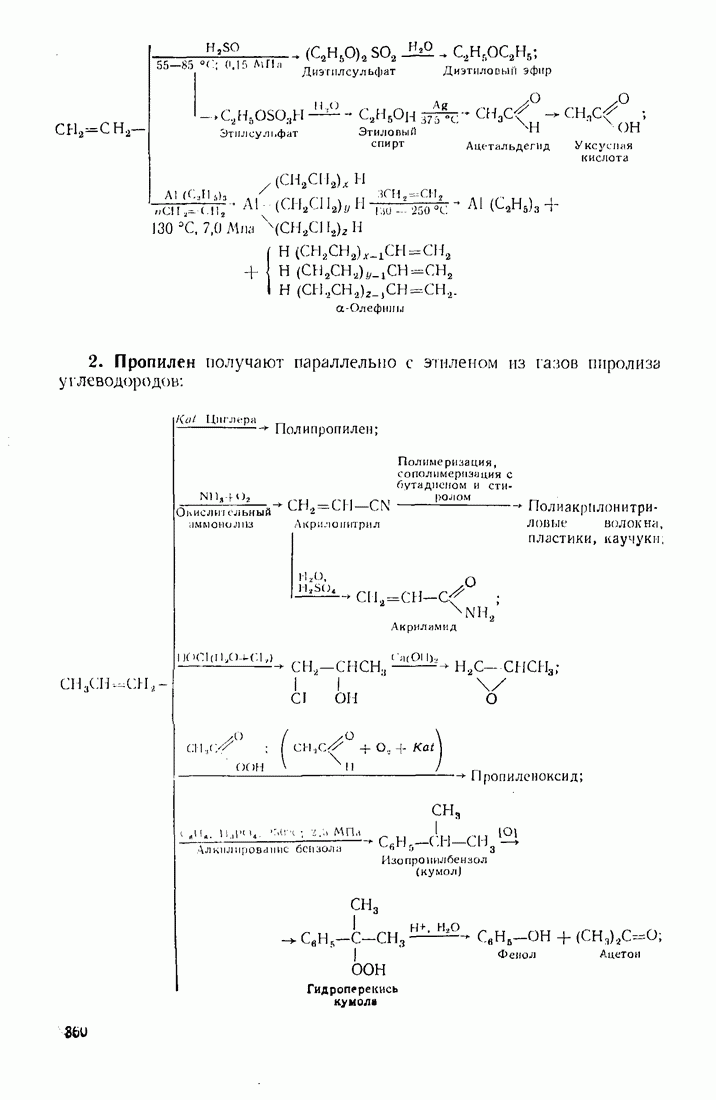
Сравнивая изомерные диметиловый эфир и этиловый спирт, можно видеть различия в температурах кипения, обусловленные высокой степенью самоассоциации этанола.
По сравнению с диметиловым эфиром более высококипящим оказывается и близкий ему по составу ацетальдегид вследствие его высокой полярности:

Меркаптаны в отличие от спиртов малоассоциированы и поэтому кипят при более низких температурах. Высокая полярность и способность молекул образовывать водородные связи обусловливают хорошую растворимость вещества во многих растворителях (см. п. 6.4), особенно в тех, которые склонны к  -комплексообразованию (вода, спирты, кислоты).
-комплексообразованию (вода, спирты, кислоты).
Разветвление углеродного скелета в ряду изомерных производных углеводородов понижает температуру кипения, что можно наблюдать на примере спиртов (табл. 7).
Увеличение количества гидроксильных групп в молекуле повышает температуру кипения и вязкость за счет возрастания интенсивности водородных связей.
Низшие представители спиртов, кислот, альдегидов, кетонов, аминов растворимы в воде, поскольку функциональная группа занимает значительную часть молекулы. По мере увеличения алкильного радикала, обладающего гидрофобными (водоотталкивающими) свойствами, растворимость уменьшается. Высокомолекулярные производные близки по свойствам к соответствующим алканам и не растворимы в воде и многих других растворителях.
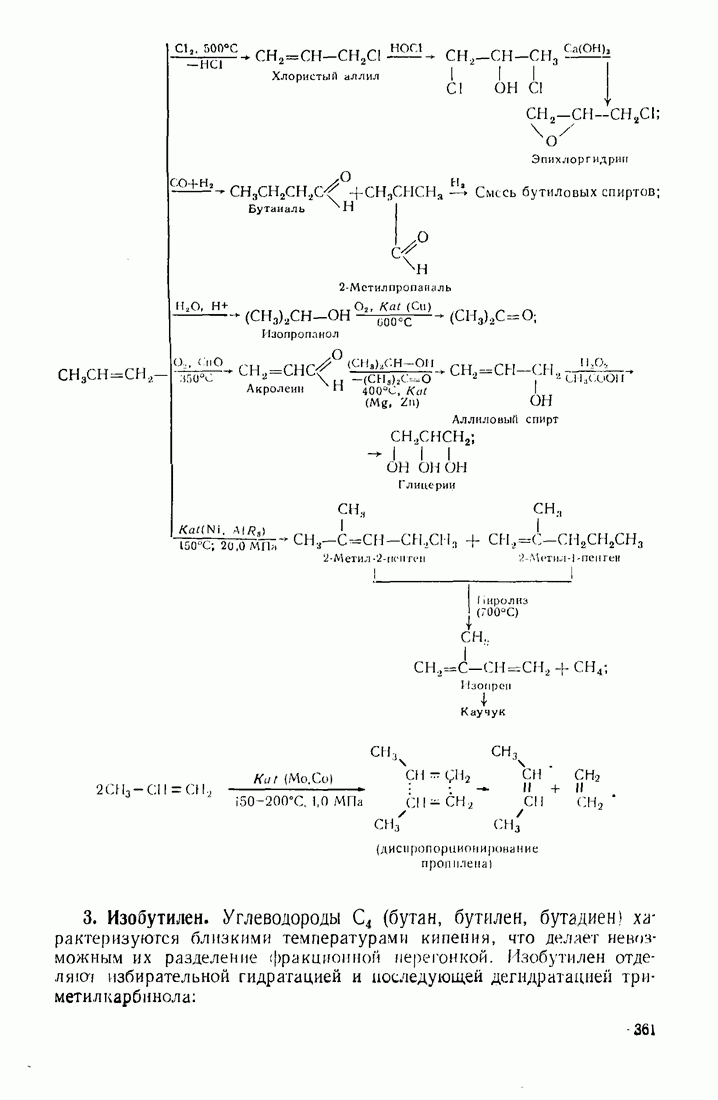
Введение в алканы и алкены галогенов приводит к резкому повышению плотности и температуры кипения. Хлороформ ( ) и
) и
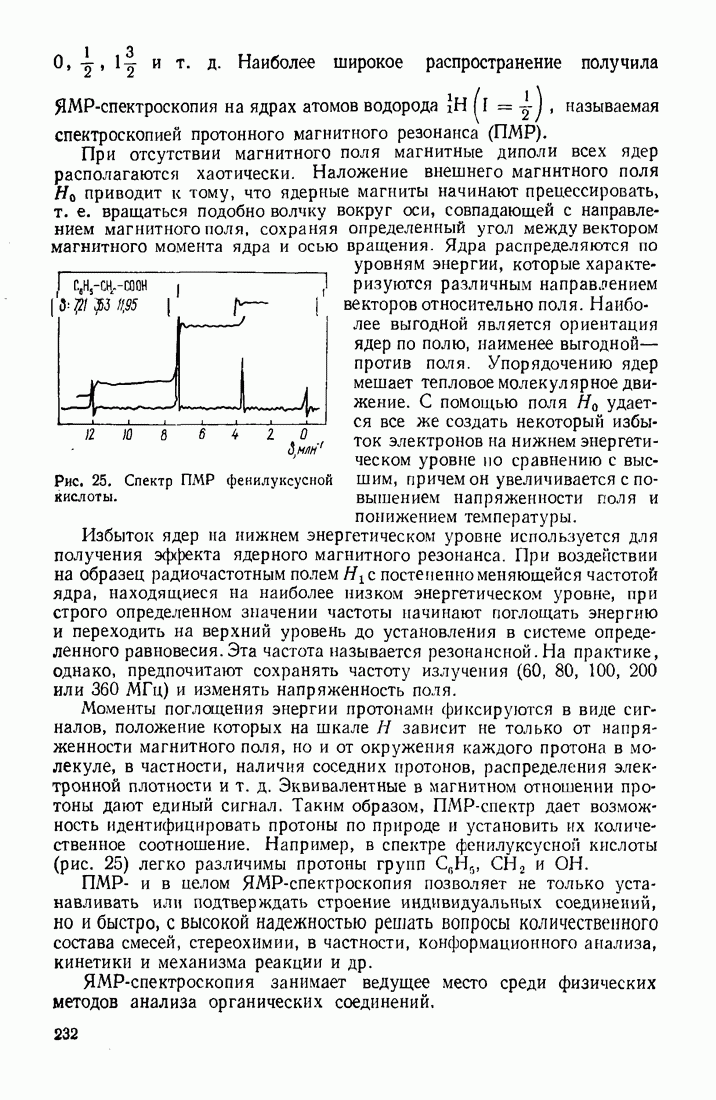
Таблица 6. (см. скан) Температуры кипения органических веществ различной природы
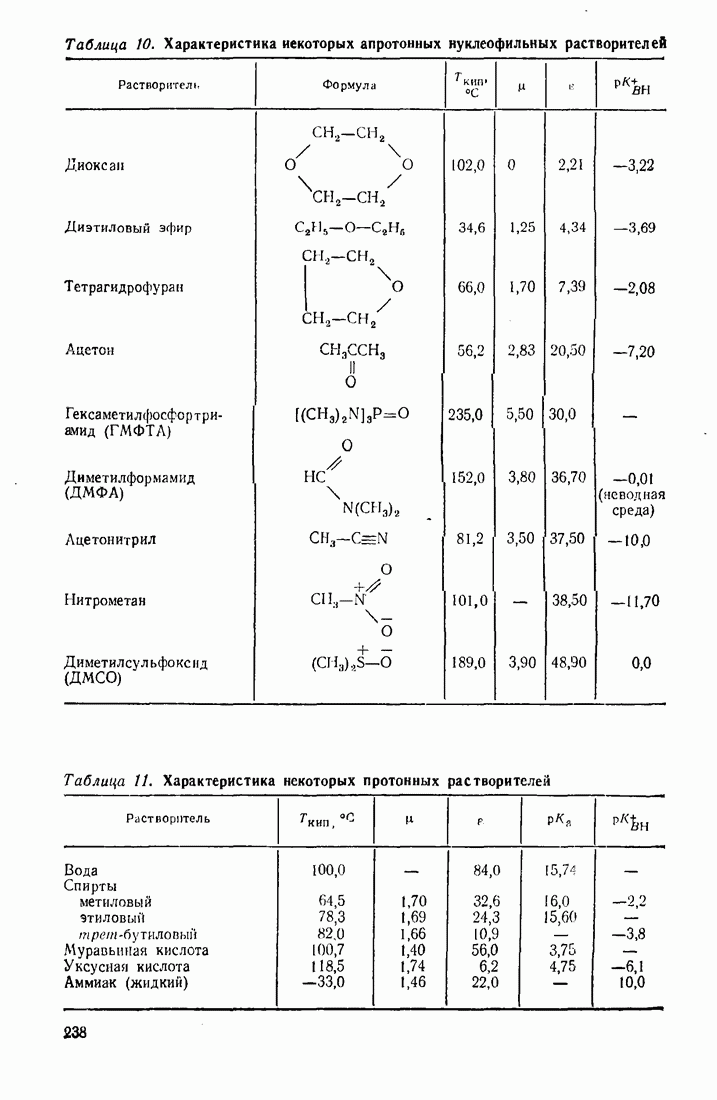
Таблица 7. (см. скан) Температура кипения спиртов различной природы
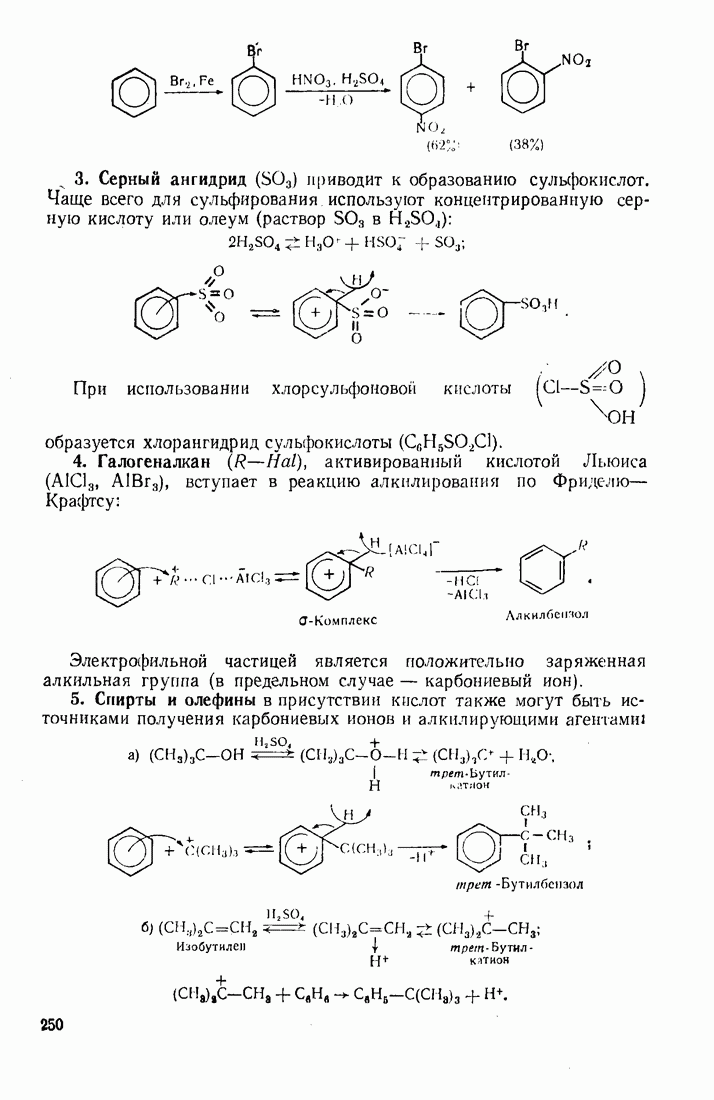
четыреххлористый углерод  тяжелые жидкости, их плотность составляет соответственно 1,498 и 1,595. Температуры кипения галогеналканов повышаются с удлинением углеродной цепи и накоплением в молекуле атомов галогена. Этому способствует также повышение атомной массы галогена — бромоформ тяжелее хлороформа.
тяжелые жидкости, их плотность составляет соответственно 1,498 и 1,595. Температуры кипения галогеналканов повышаются с удлинением углеродной цепи и накоплением в молекуле атомов галогена. Этому способствует также повышение атомной массы галогена — бромоформ тяжелее хлороформа.
| << Предыдущий параграф | Следующий параграф >> |
- Предисловие
- 1. Введение
- 1.1. Предмет органической химии
- 1.2. Основные этапы развития органической химии
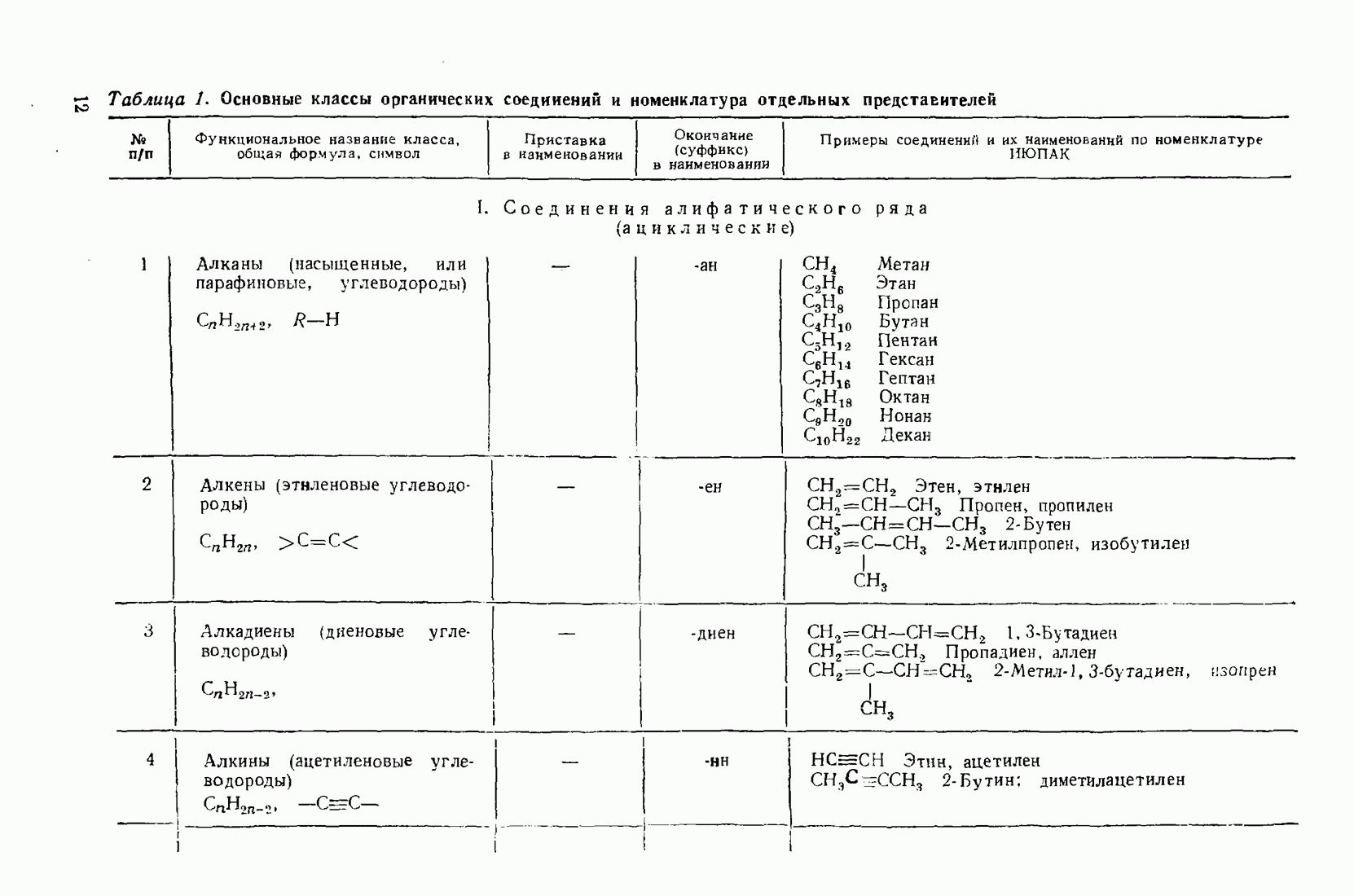
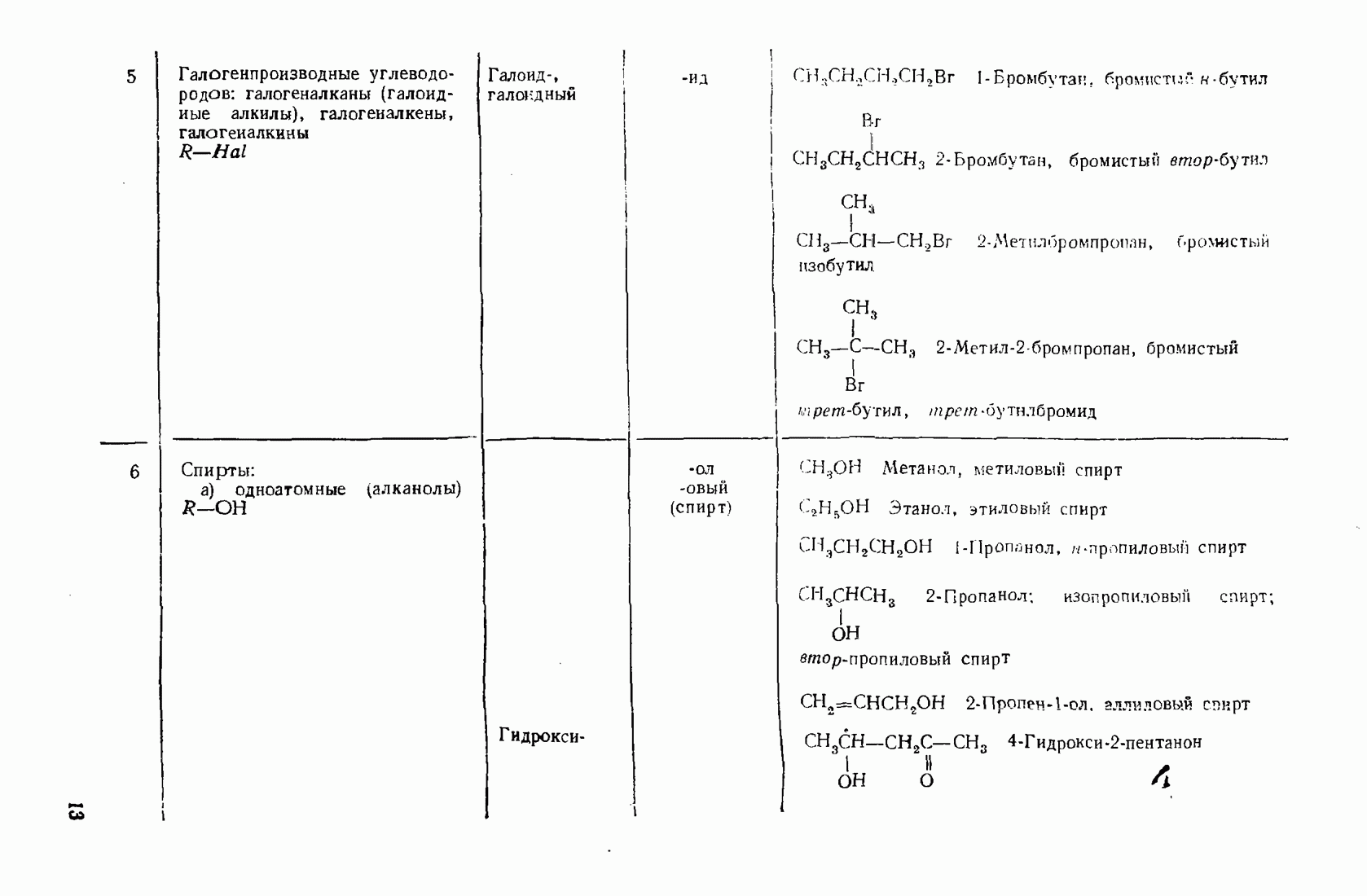
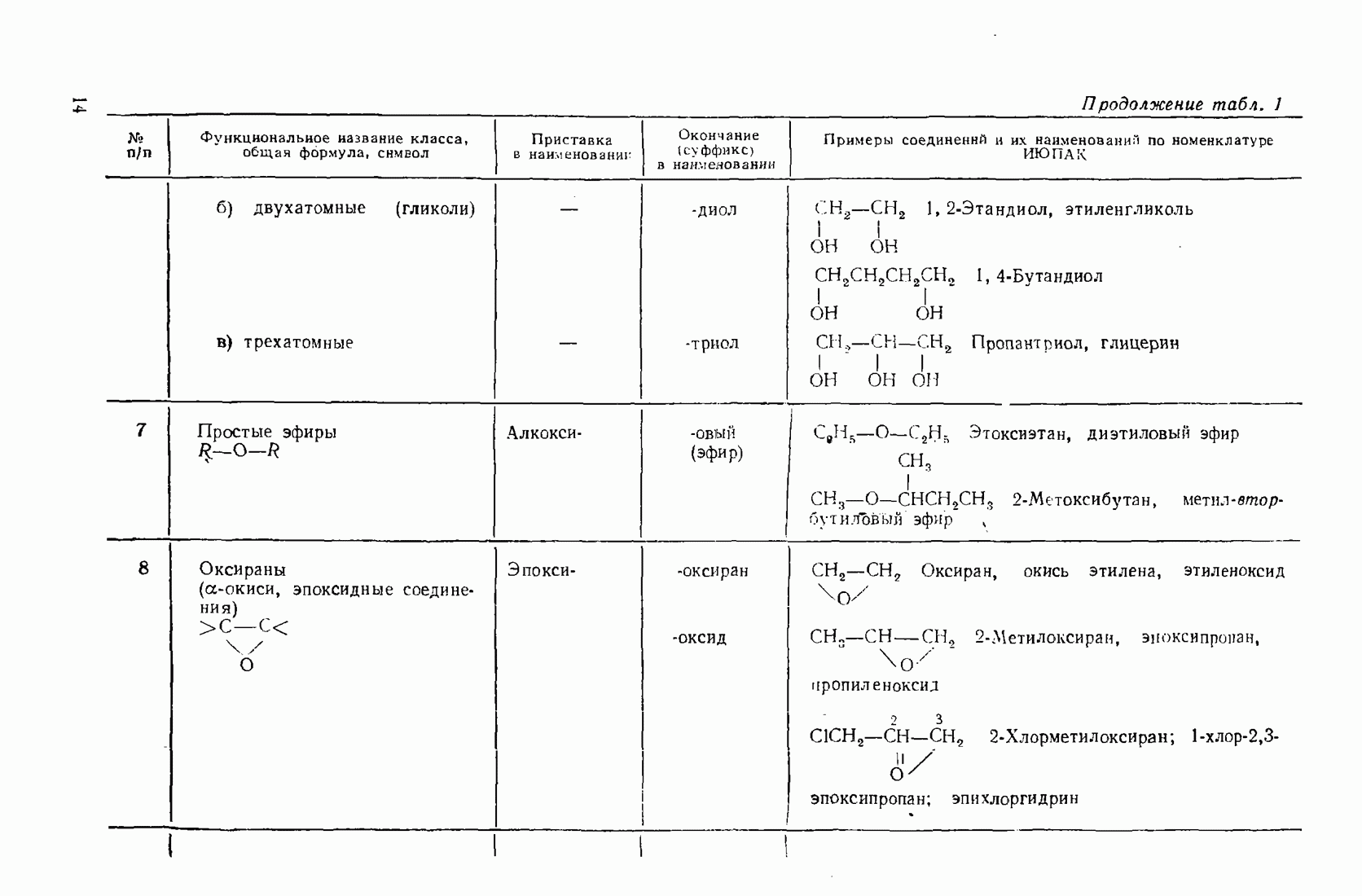
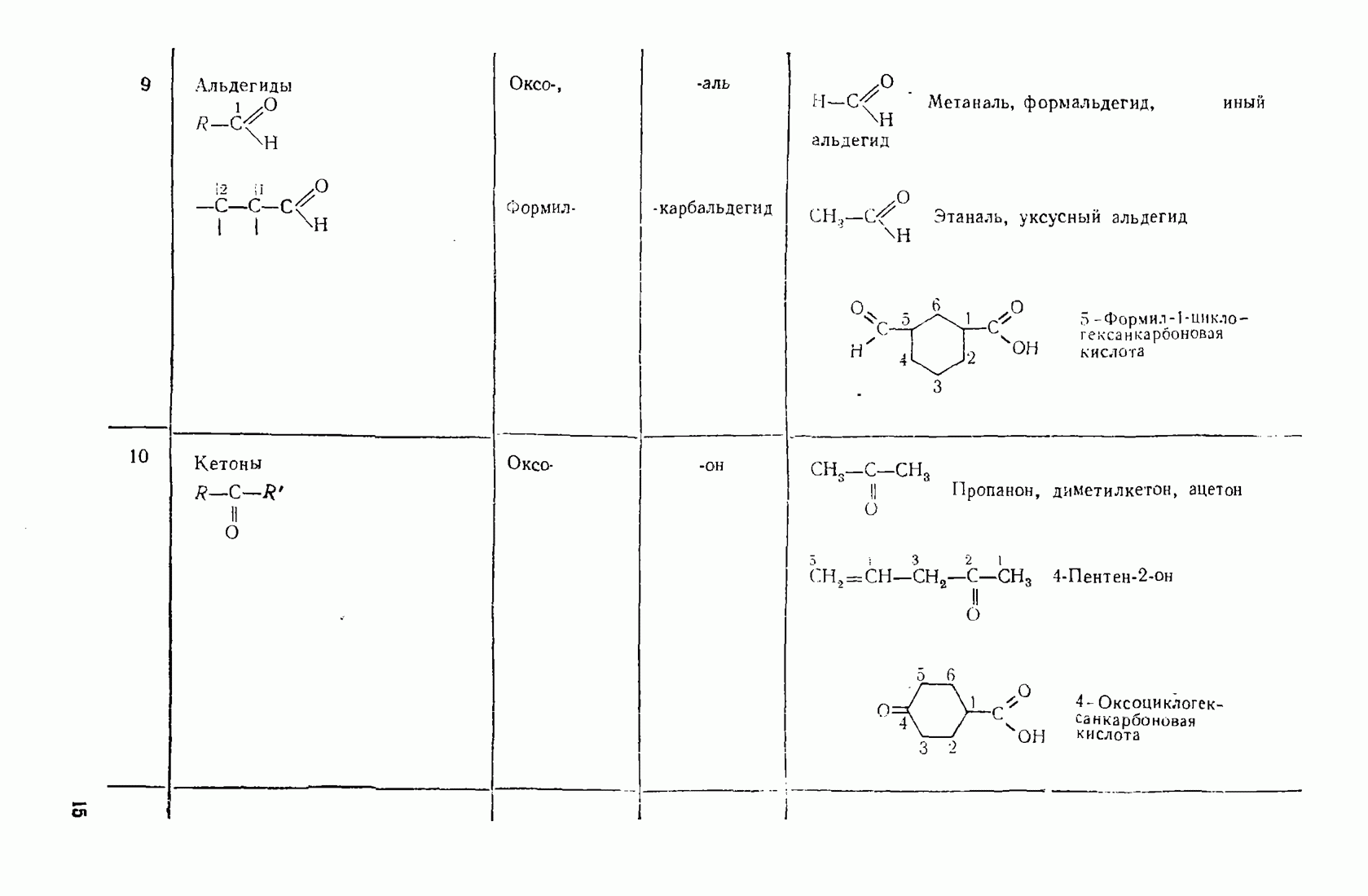
- 1.3. Классификация и номенклатура органических соединений
- 2 Общие теоретические положения органической химии
- 2.1. Природа химической связи
- 2.1.1. Типы химических связей
- 2.1.2. Молекулярные орбитали
- 2.2. ТИПЫ ЭЛЕКТРОННЫХ СМЕЩЕНИЙ В МОЛЕКУЛАХ
- 2.3. ОБЩИЕ ПРЕДСТАВЛЕНИЯ ОБ ОРГАНИЧЕСКОЙ РЕАКЦИИ
- 2.4. КЛАССИФИКАЦИЯ РЕАГЕНТОВ И РЕАКЦИЙ
- 2.5. КРАТКАЯ ХАРАКТЕРИСТИКА РЕАКЦИОННОЙ СПОСОБНОСТИ НЕКОТОРЫХ СОЕДИНЕНИЙ АЛИФАТИЧЕСКОГО РЯДА
- 2.5.1. Алканы (парафины)
- 2.5.2. Непредельные углеводороды
- 2.5.3. Галогеналканы (галоидные алкилы R-Hal)
- 2.5.4. Спирты (R0Н)
- 2.5.5. Альдегиды и кетоны
- 2.5.6. Карбоновые кислоты (R-СООН) и их производные (R-СО-X)
- 2.5.7. Амины (NH2R, NHR2, NR3)
- 3. Реакционная способность соединений алифатического ряда
- 3.1. Алканы (насыщенные углеводороды)
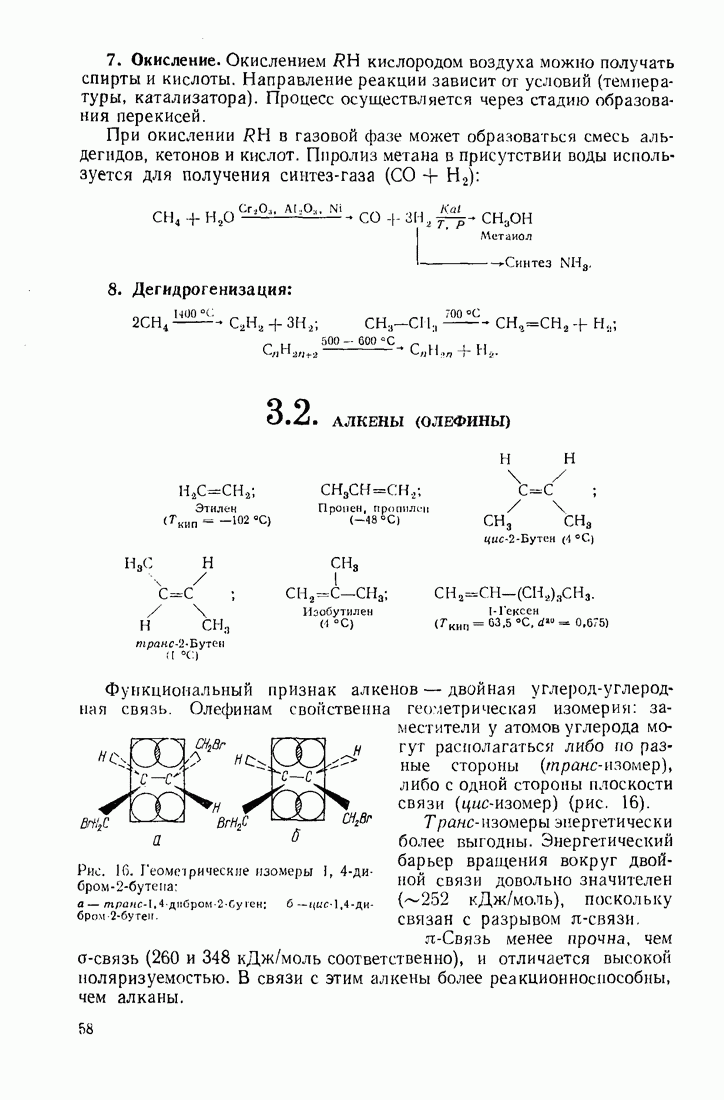
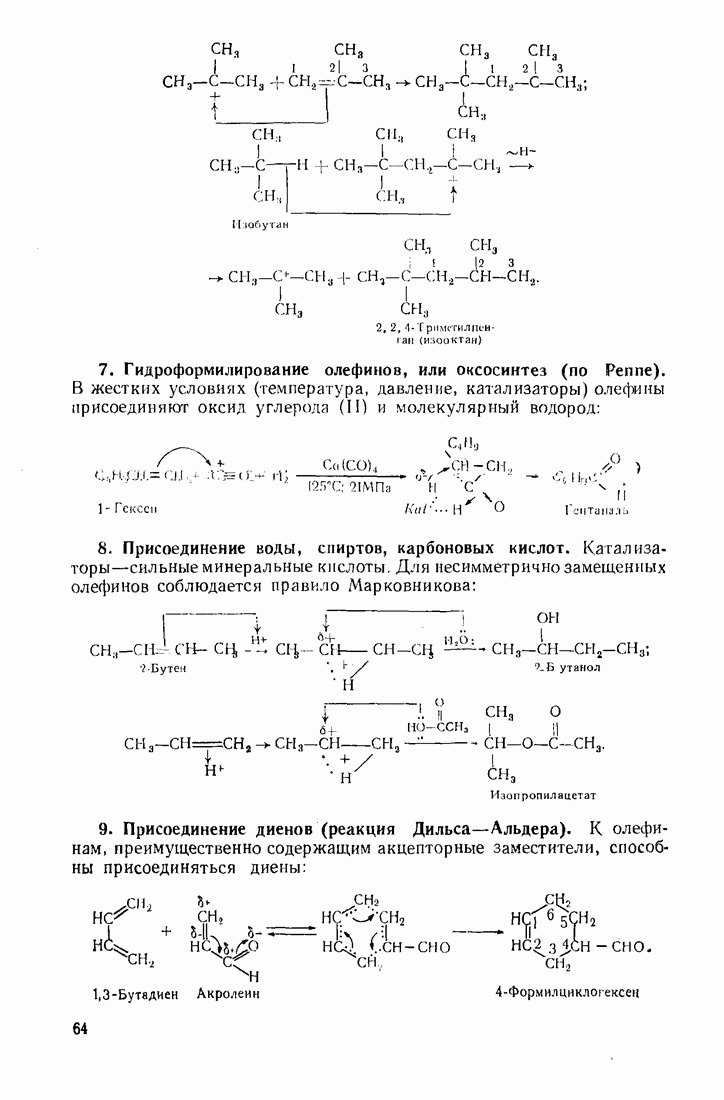
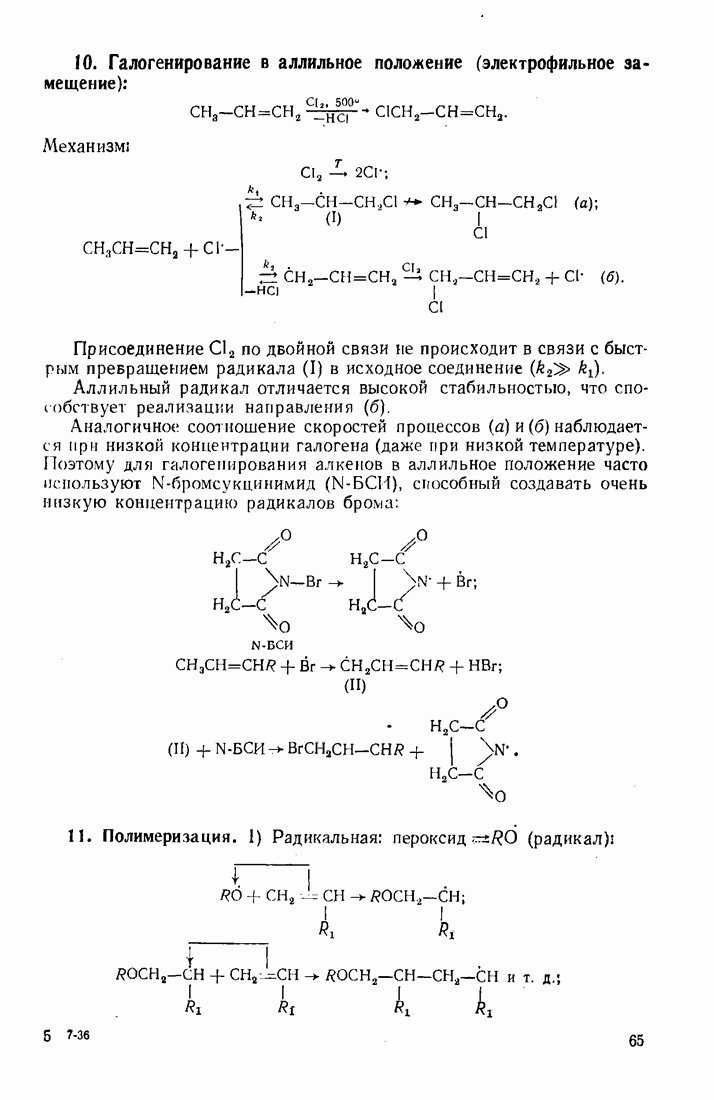
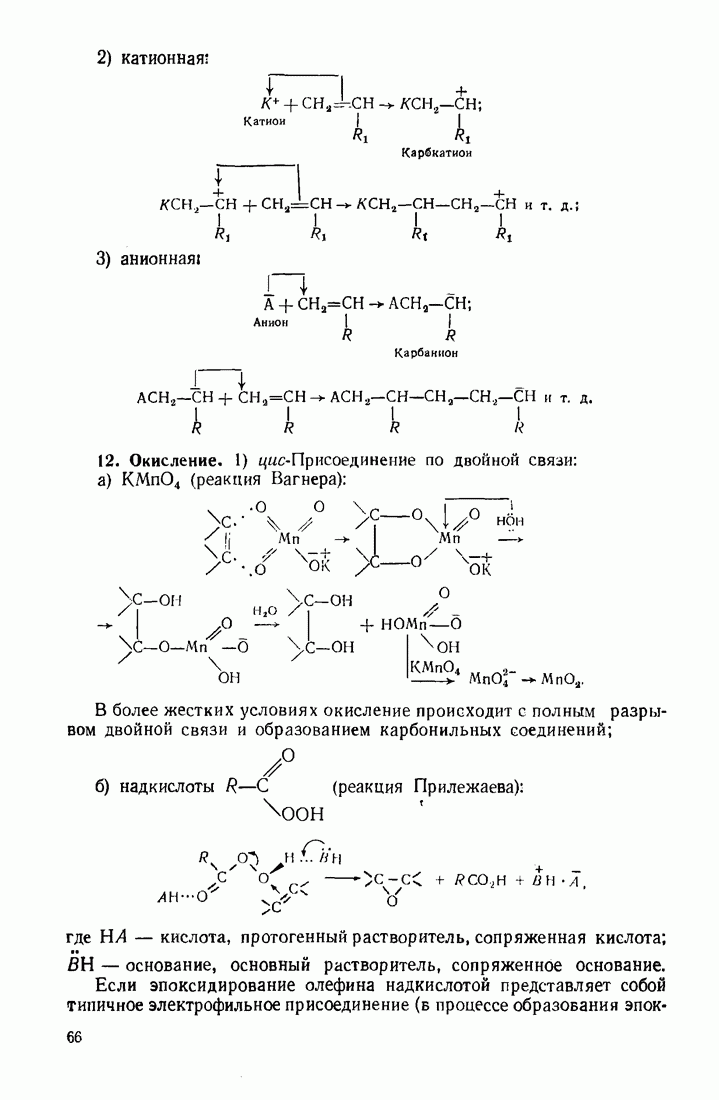
- 3.2. АЛКЕНЫ (ОЛЕФИНЫ)
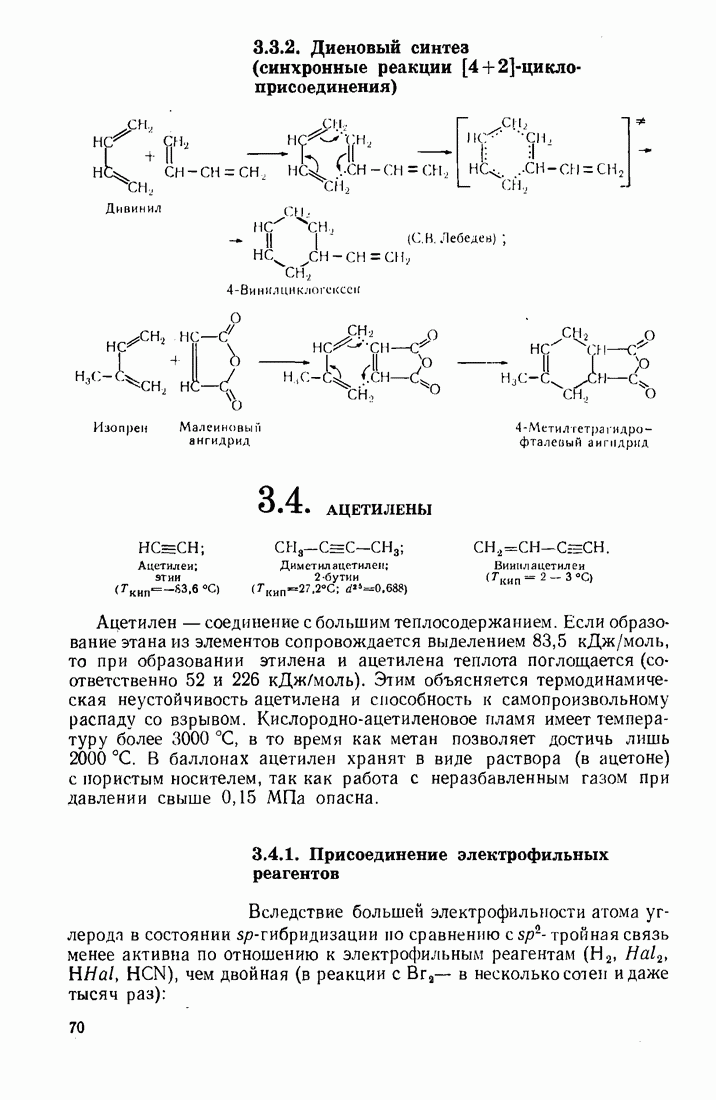
- 3.3. ДИЕНОВЫЕ УГЛЕВОДОРОДЫ
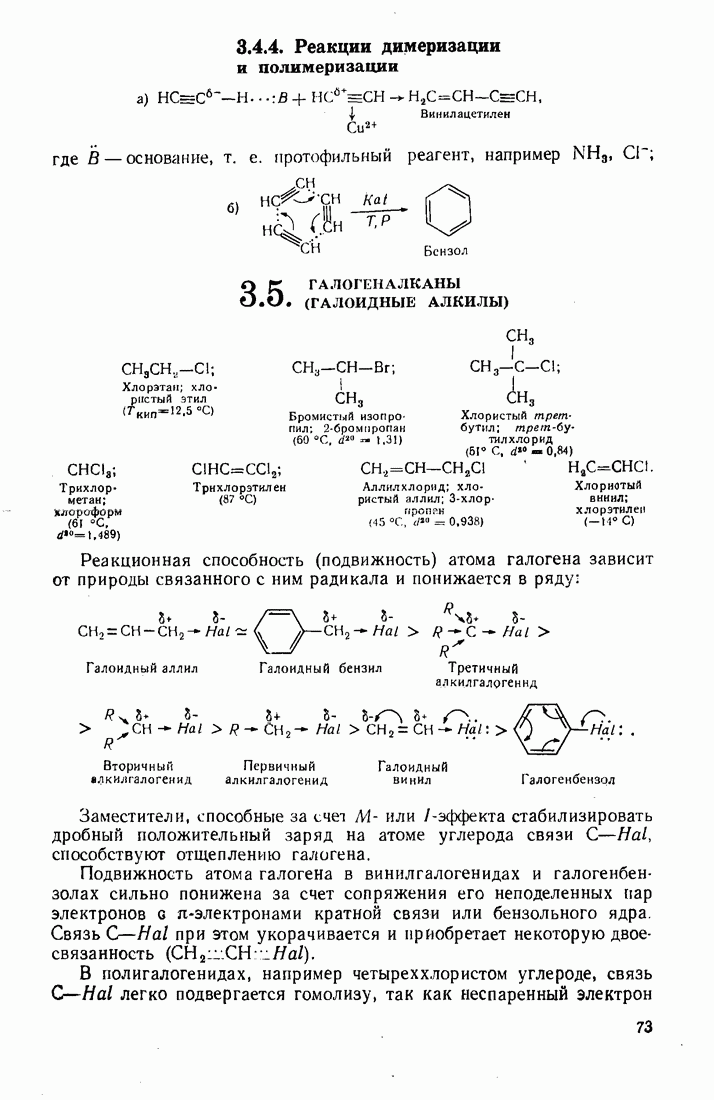
- 3.4. АЦЕТИЛЕНЫ
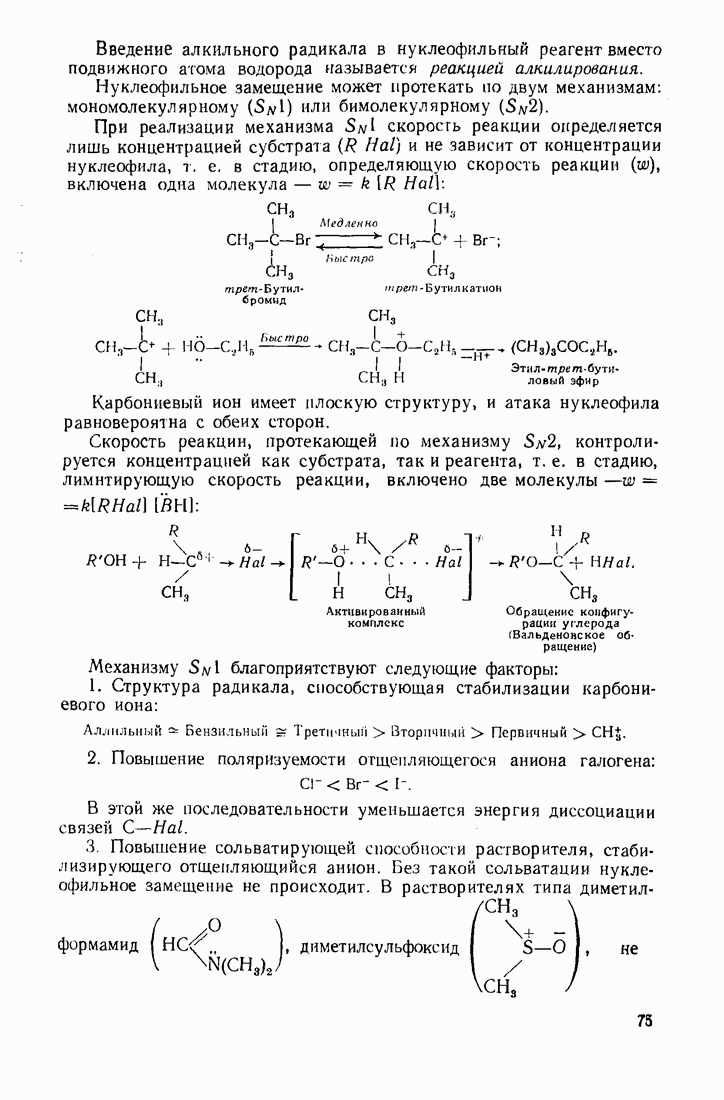
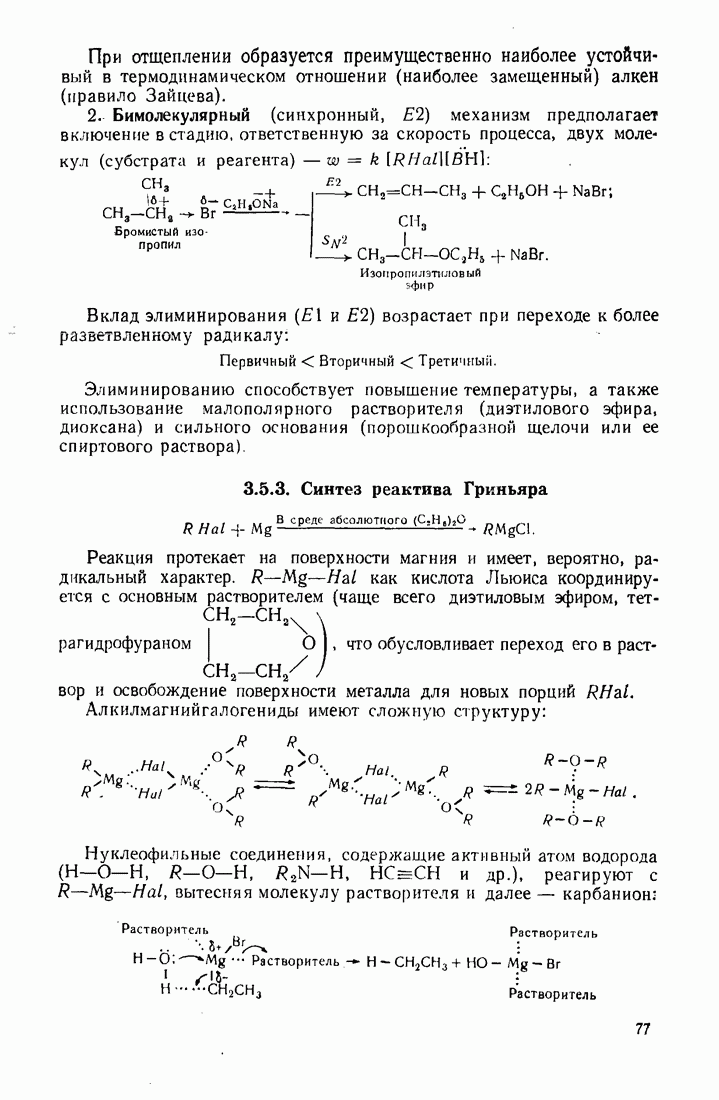
- 3.5. ГАЛОГЕНАЛКАНЫ (ГАЛОИДНЫЕ АЛКИЛЫ)
- 3.6. СПИРТЫ
- 3.7. ПРОСТЫЕ ЭФИРЫ (R-O-R)
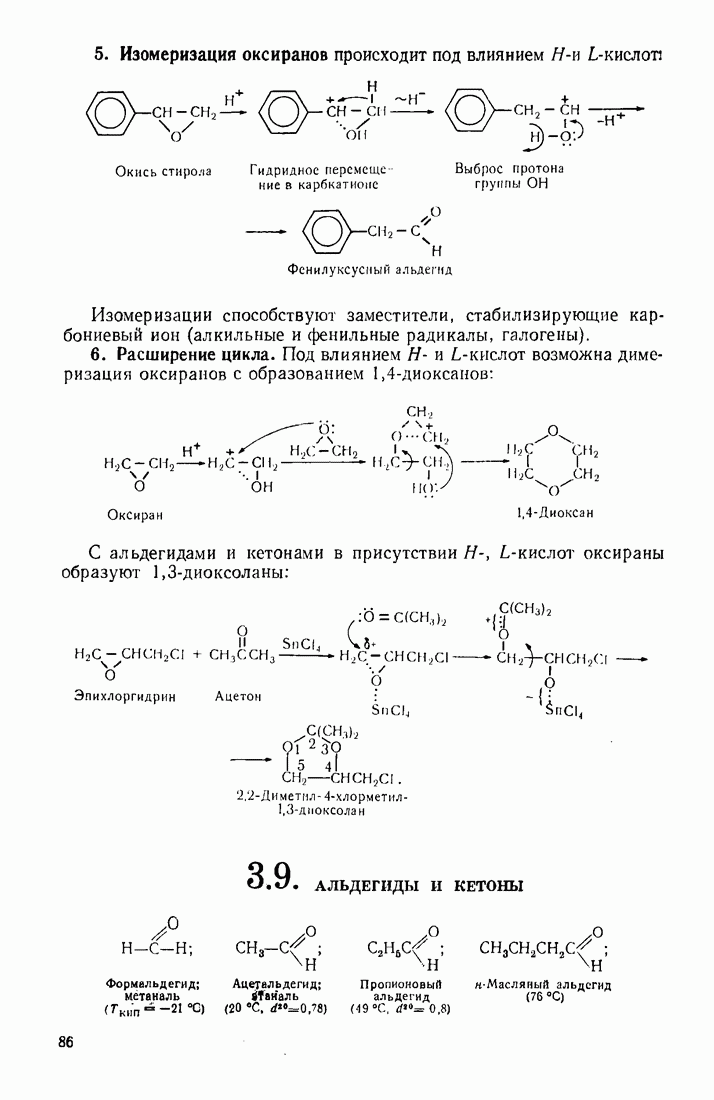
- 3.8. ОКСИРАНЫ (ЭПОКСИДНЫЕ СОЕДИНЕНИЯ, a-ОКИСИ)
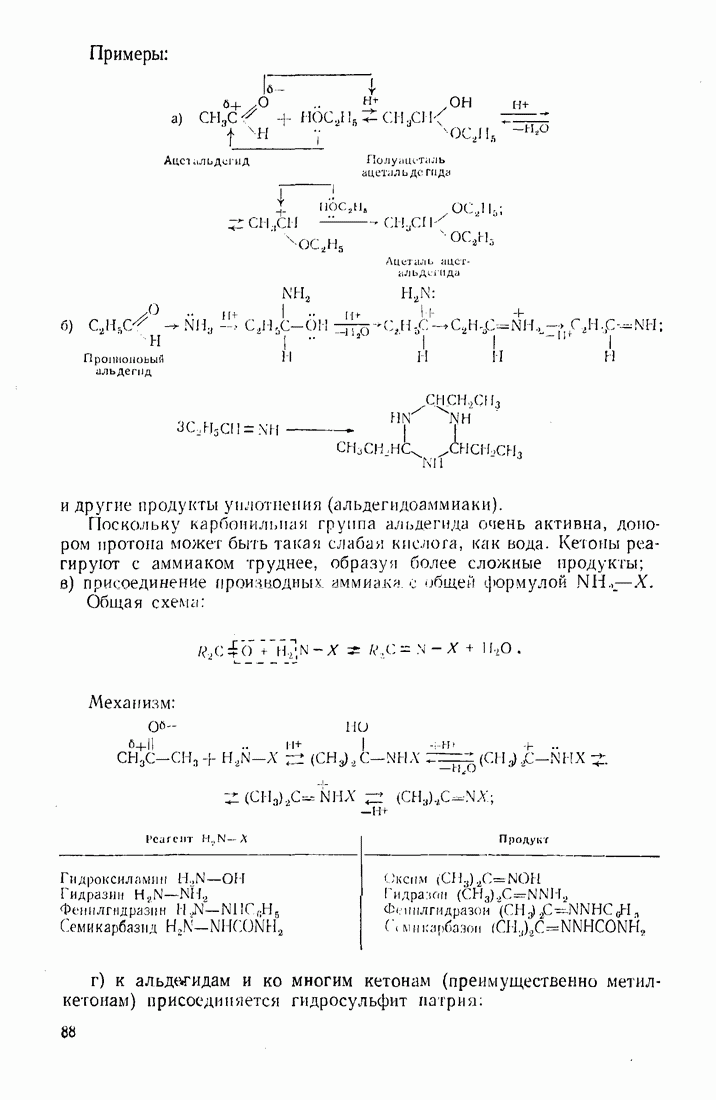
- 3.9. АЛЬДЕГИДЫ И КЕТОНЫ
- 3.10. КАРБОНОВЫЕ КИСЛОТЫ
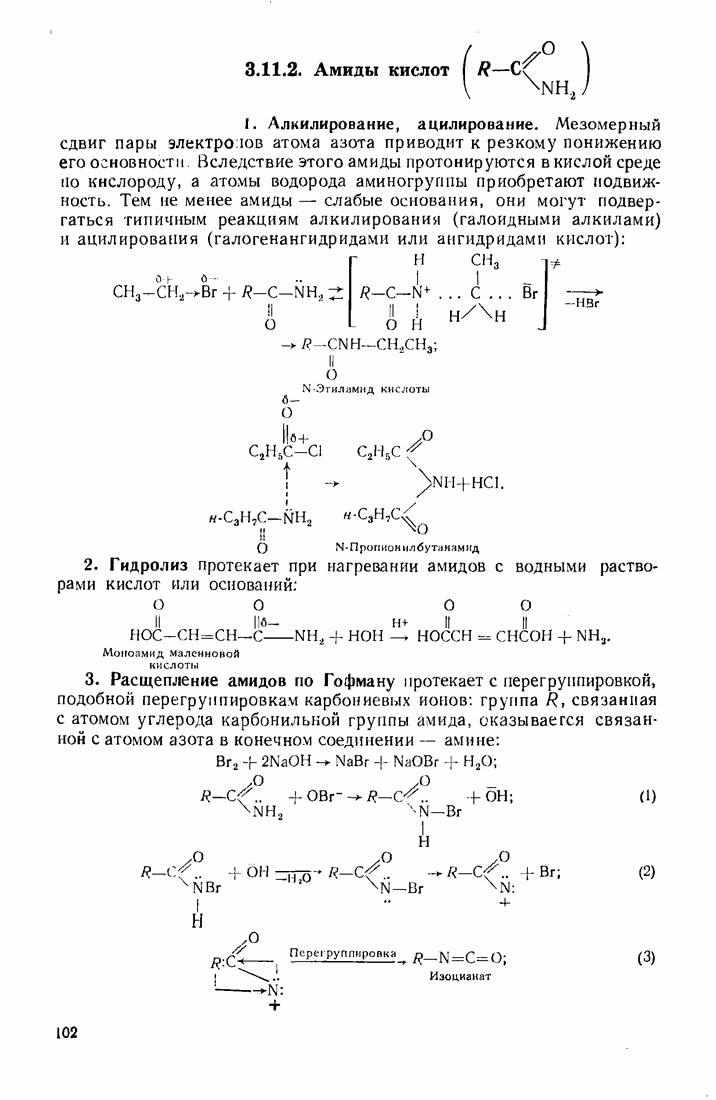
- 3.11. НЕКОТОРЫЕ ПРОИЗВОДНЫЕ КИСЛОТ
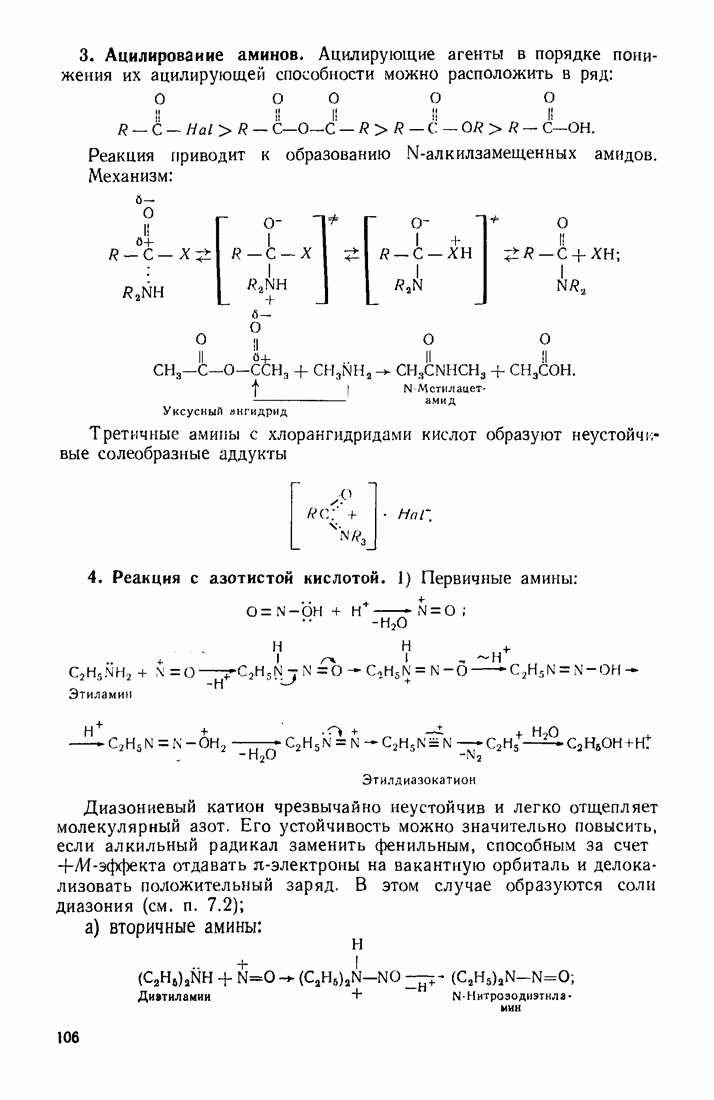
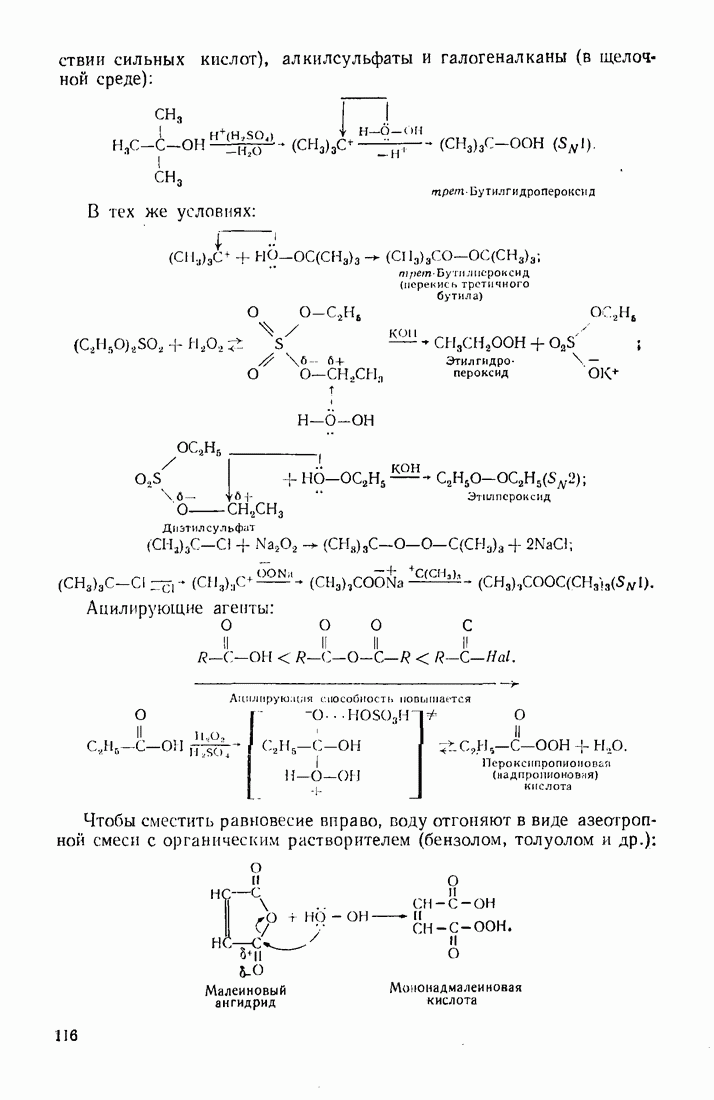
- 3.12. АМИНЫ
- 3.13. ФОСФОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- 3.14. СЕРООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
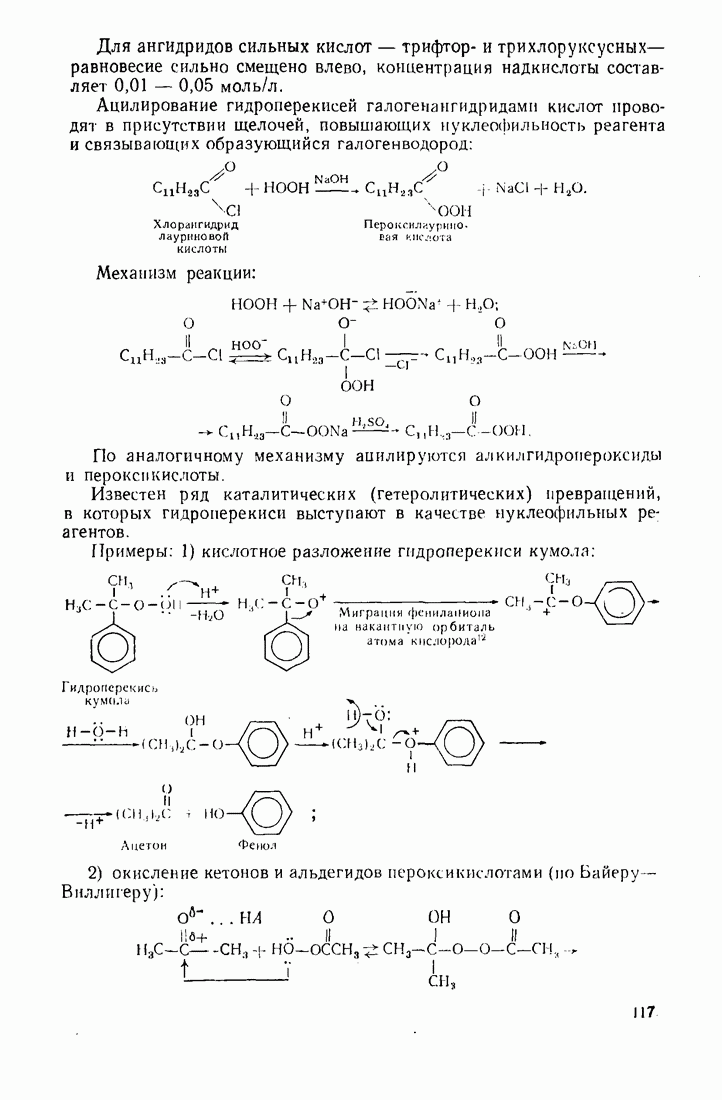
- 3.15. ОРГАНИЧЕСКИЕ ПЕРЕКИСИ (ПЕРОКСИДНЫЕ СОЕДИНЕНИЯ)
- 3.16. ПРОИЗВОДНЫЕ УГОЛЬНОЙ КИСЛОТЫ
- 3.17. ГЕТЕРОАНАЛОГИ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
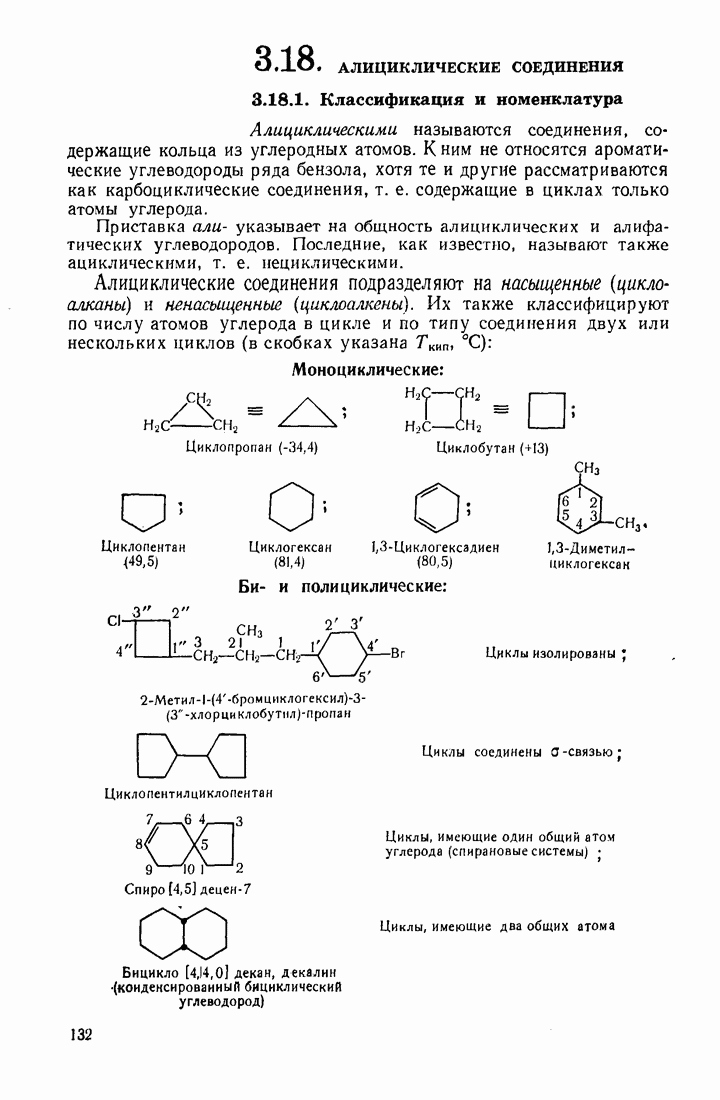
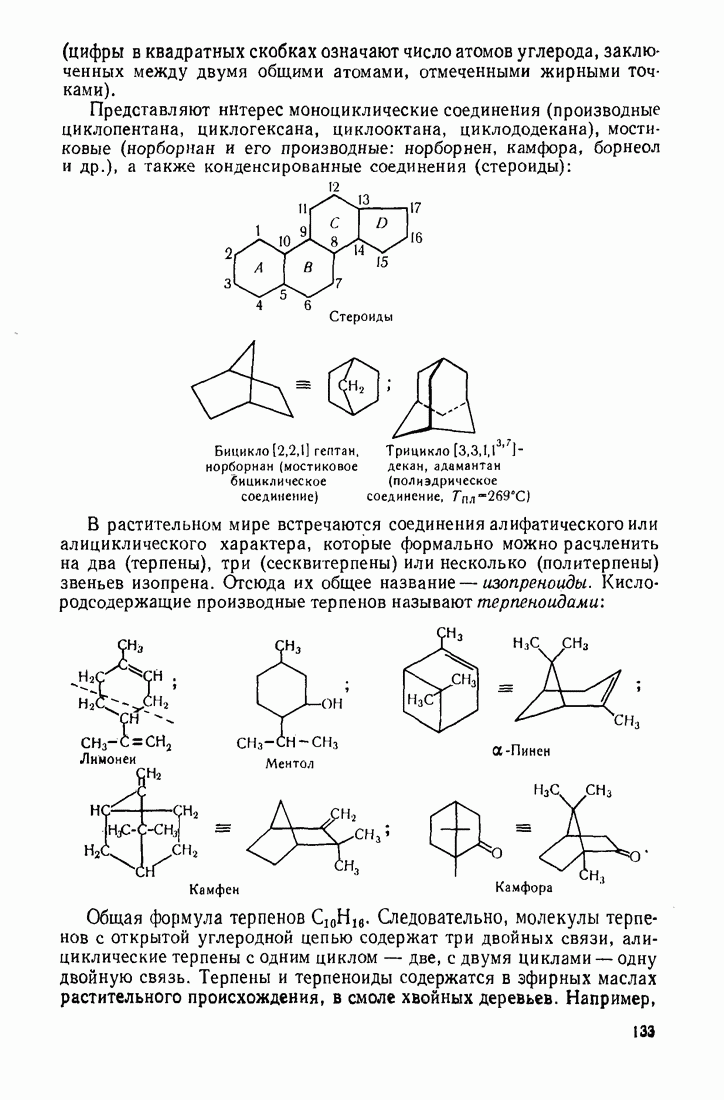
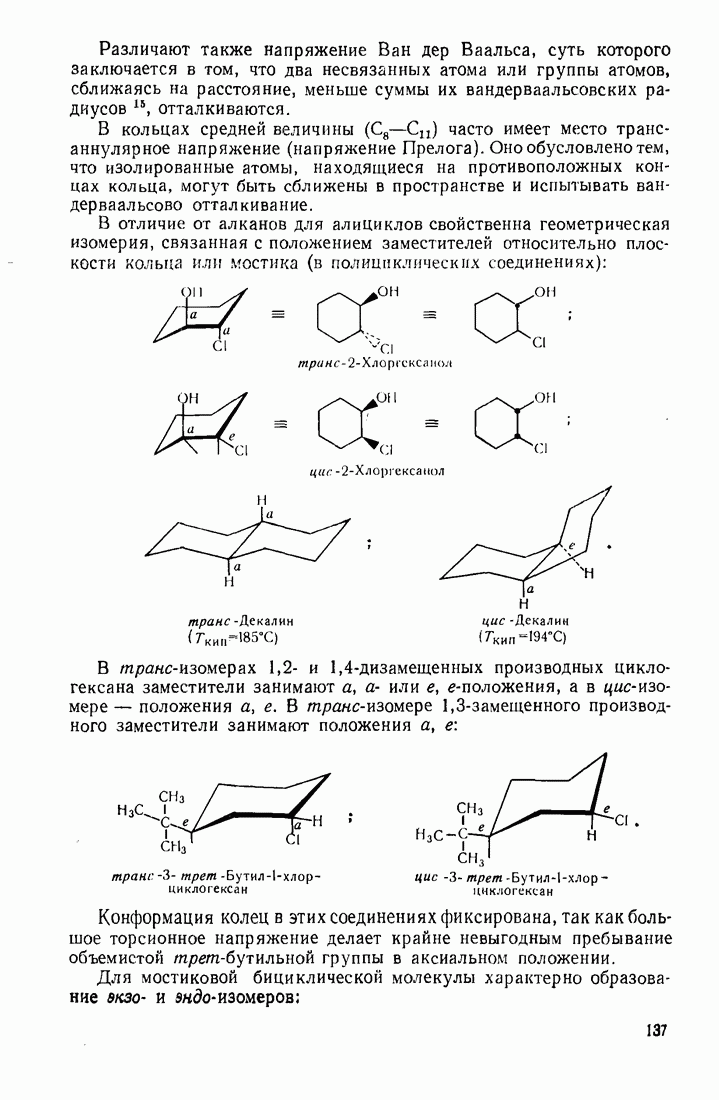
- 3.18. АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
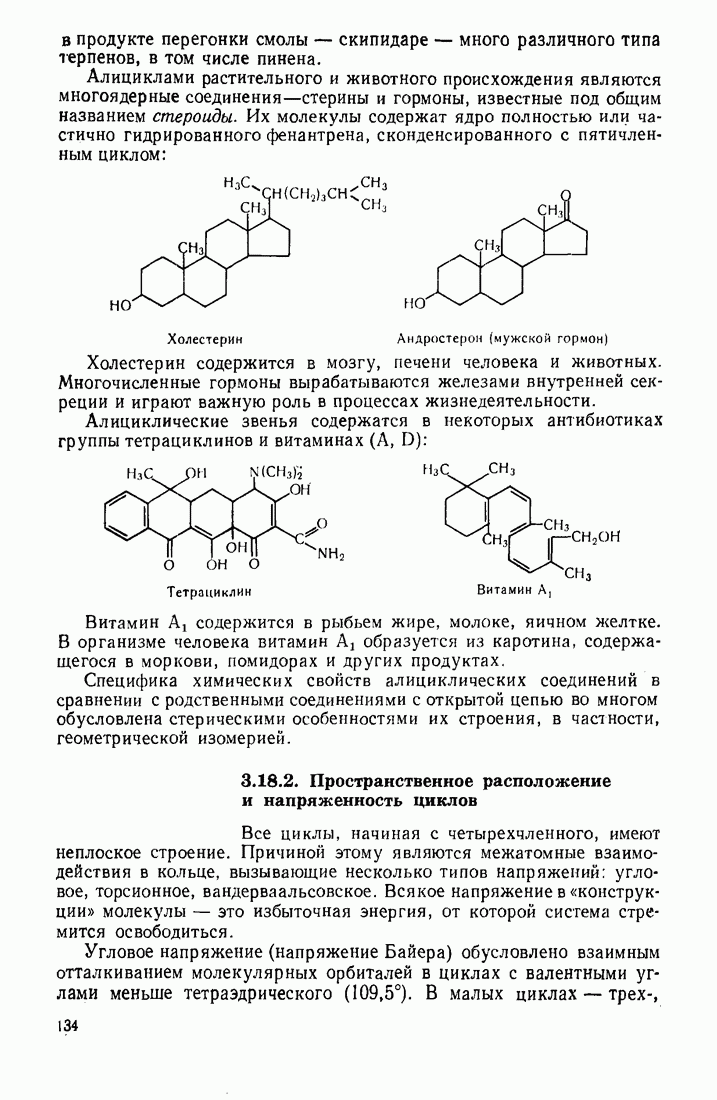
- 3.18.2. Пространственное расположение и напряженность циклов
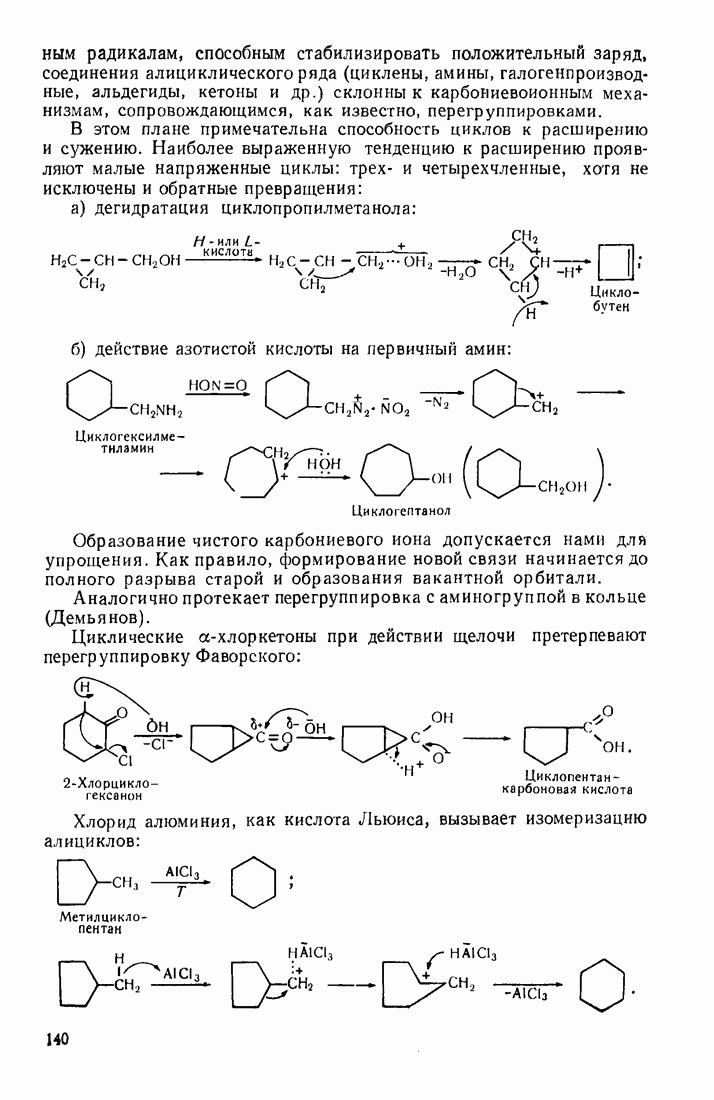
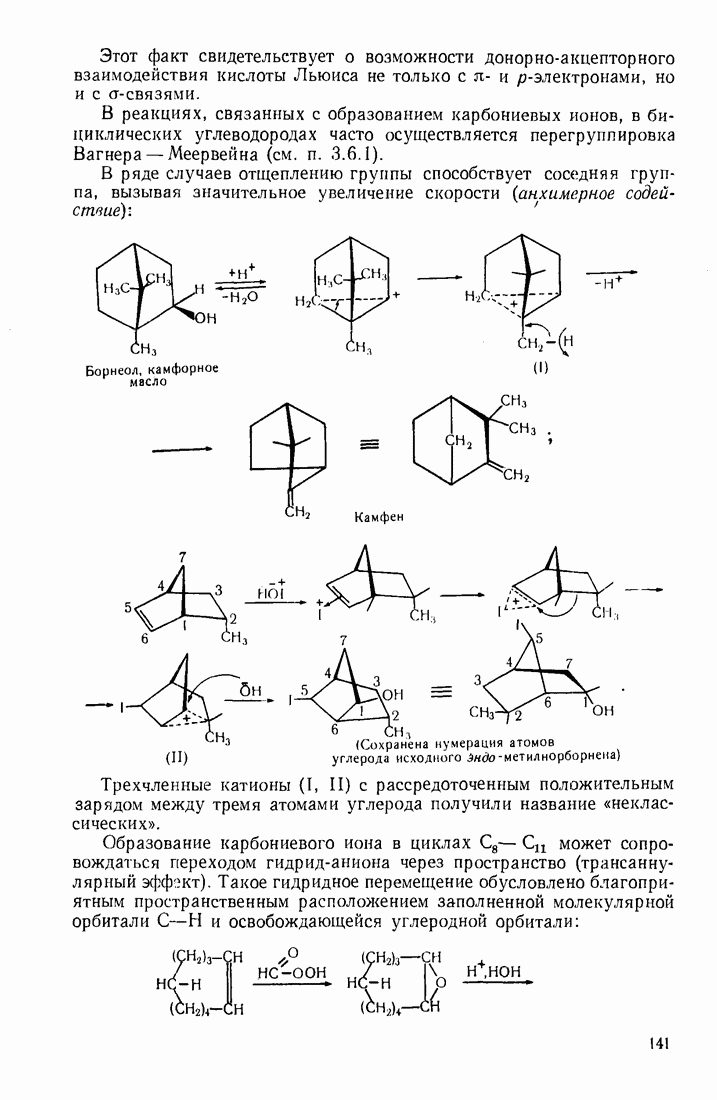
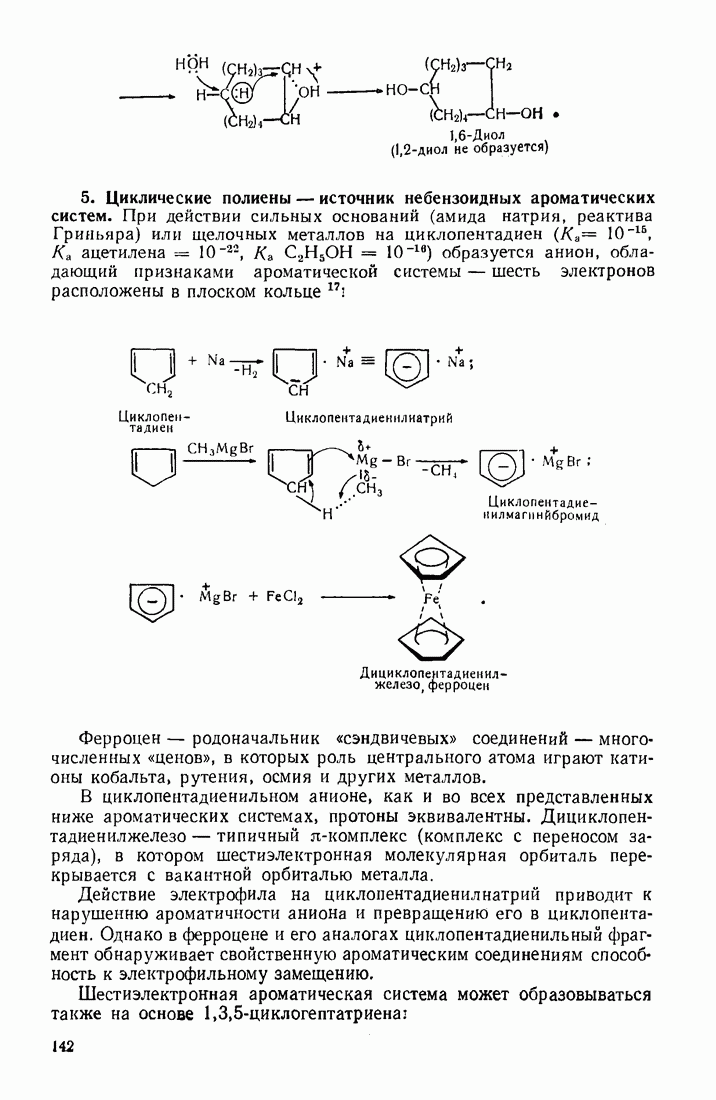
- 3.18.3. Особенности химических свойств алициклических соединений
- 4. Полифункциональные производные алифатического ряда
- 4.1. ДВУХОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ
- 4.2. НЕПРЕДЕЛЬНЫЕ КИСЛОТЫ
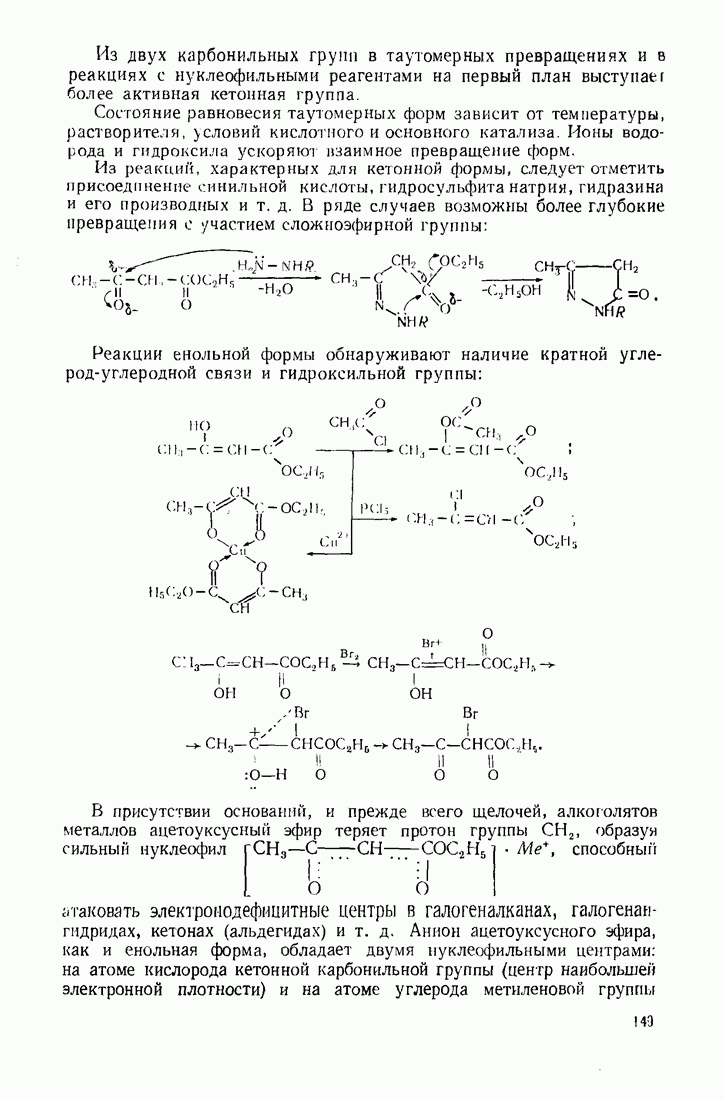
- 4.3. ОКСОКИСЛОТЫ (АЛЬДЕГИДО- И КЕТОКИСЛОТЫ)
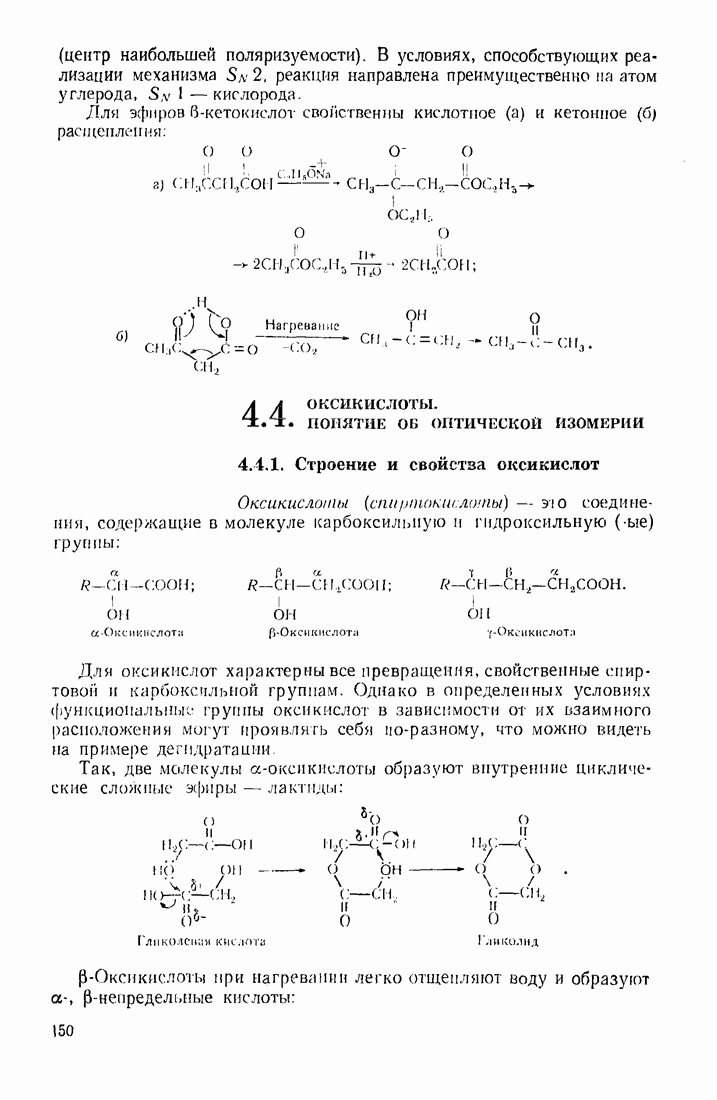
- 4.4. ОКСИКИСЛОТЫ. ПОНЯТИЕ ОБ ОПТИЧЕСКОЙ ИЗОМЕРИИ
- 4.5. УГЛЕВОДЫ
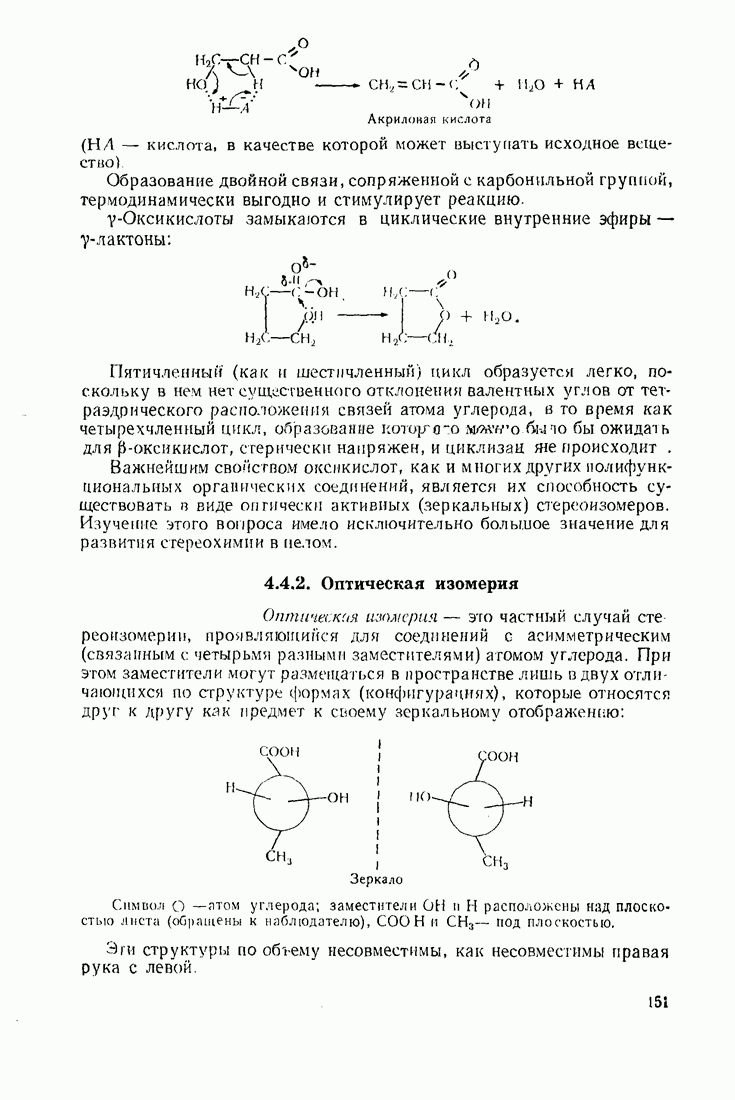
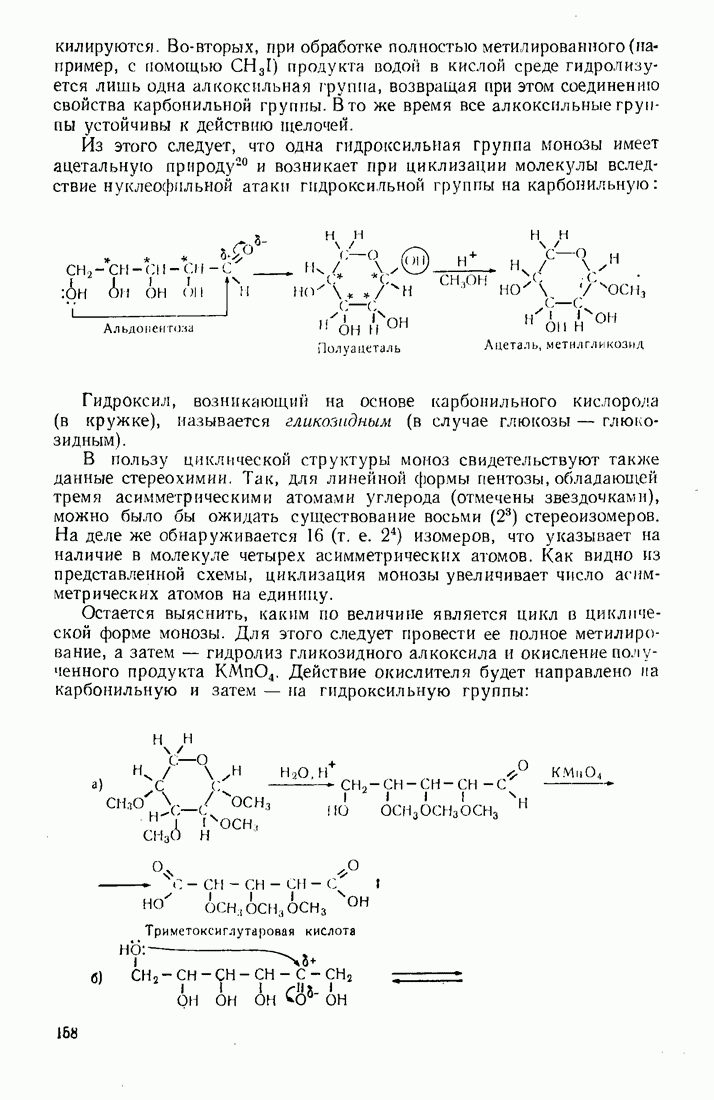
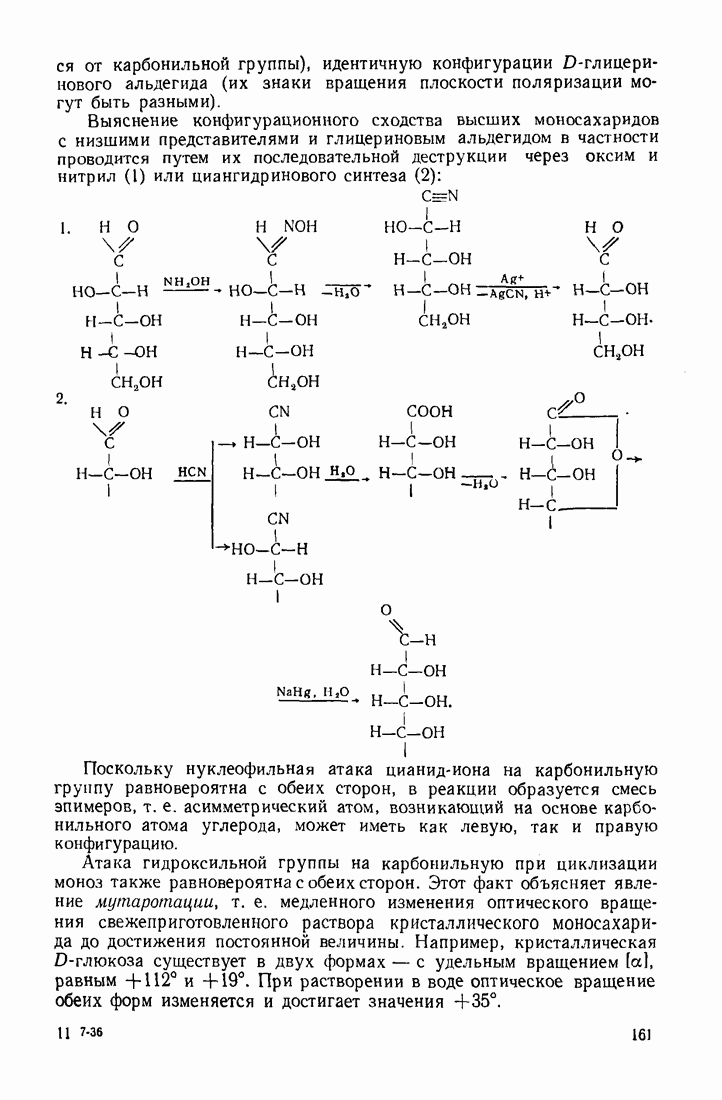
- 4.5.2. Стереохимия моносахаридов
- 4.5.3. Дисахариды
- 4.5.4. Полисахариды
- 4.5.5. Нахождение в природе и пути превращения углеводов
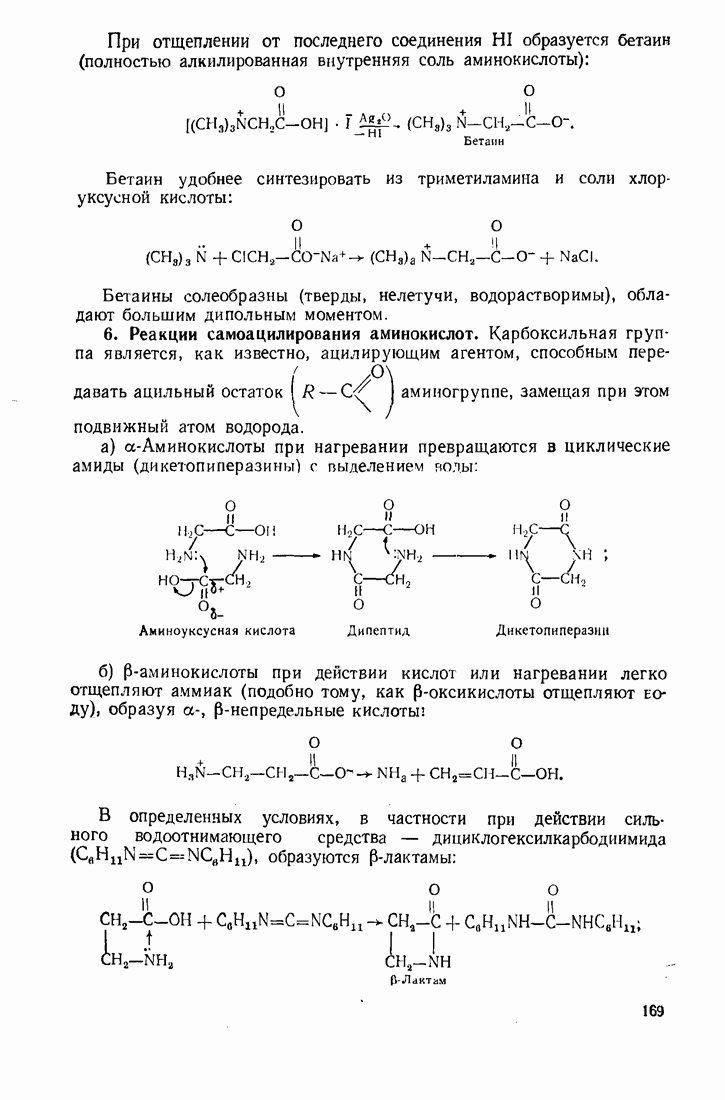
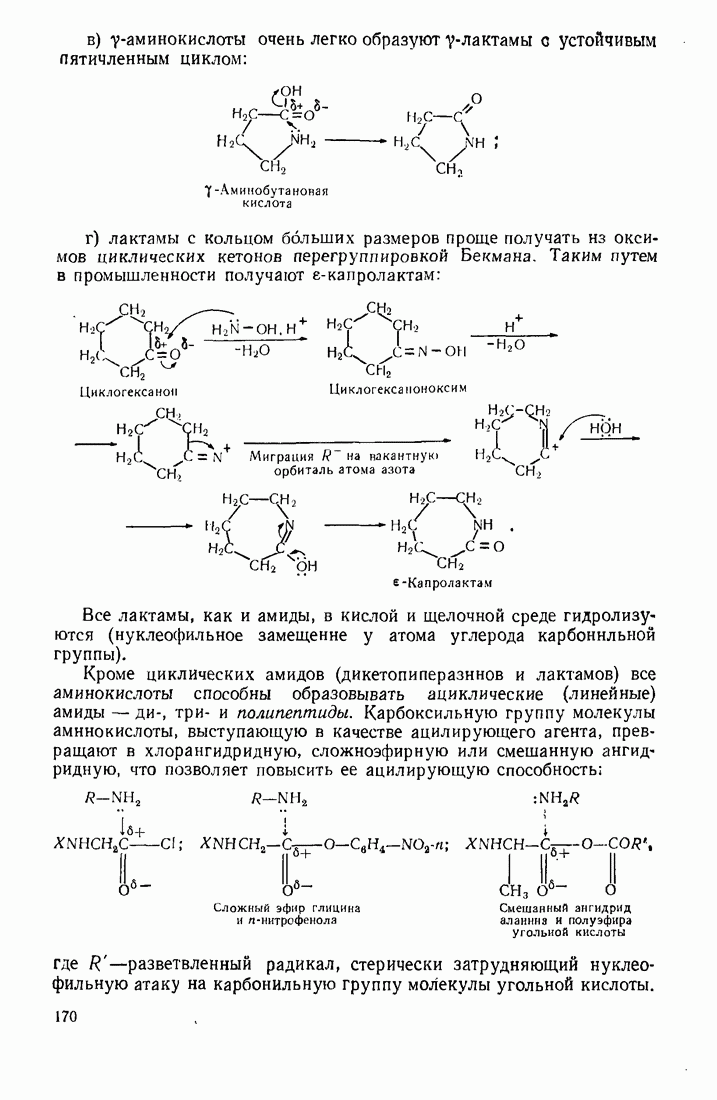
- 4.6. АМИНОКИСЛОТЫ
- 5. Методы синтеза органических юединений алифатическою рада
- 5.1. АЛКИЛИРОВАНИЕ
- 5.2. АЦИЛИРОВАНИЕ
- 5.3. ГАЛОГЕНИРОВАНИЕ
- 5.4. ГИДРОКСИЛИРОВАНИЕ
- 5.5. КАРБОНИЛИРОВАНИЕ (ВВЕДЕНИЕ КАРБОНИЛЬНОЙ ГРУППЫ)
- 5.6. КАРБОКСИЛИРОВАНИЕ
- 5.7. ЭПОКСИДИРОВАНИЕ (ОКСИРАНИРОВАИИЕ)
- 5.8. АМИНИРОВАНИЕ
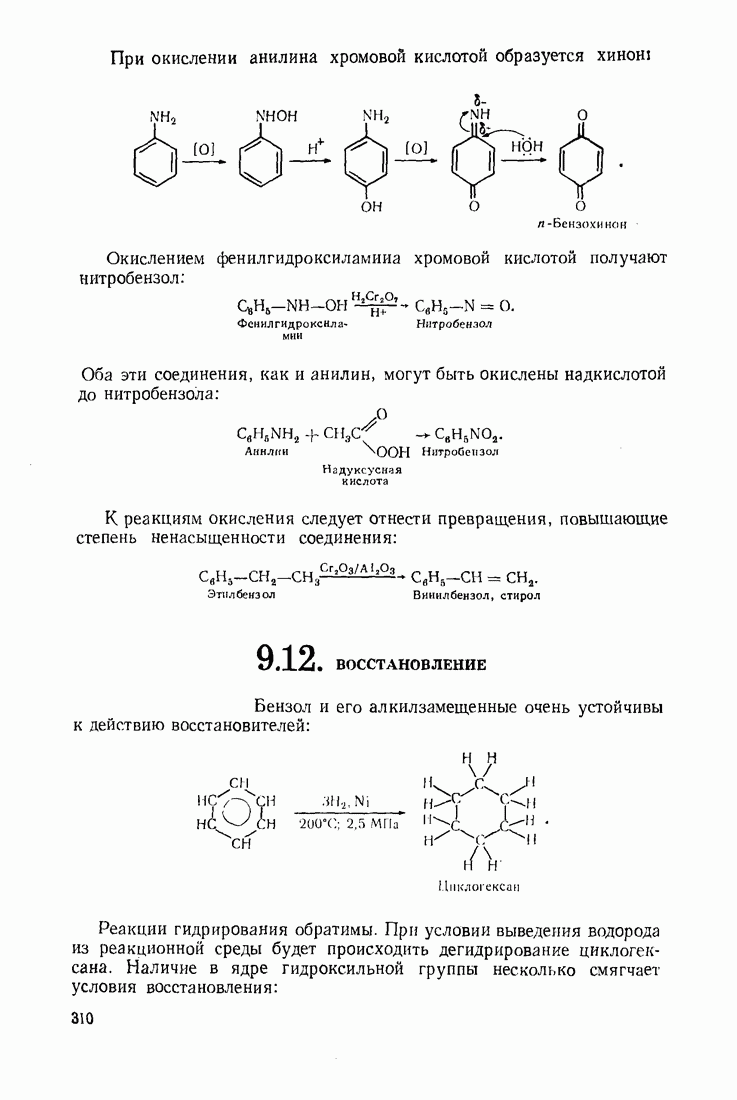
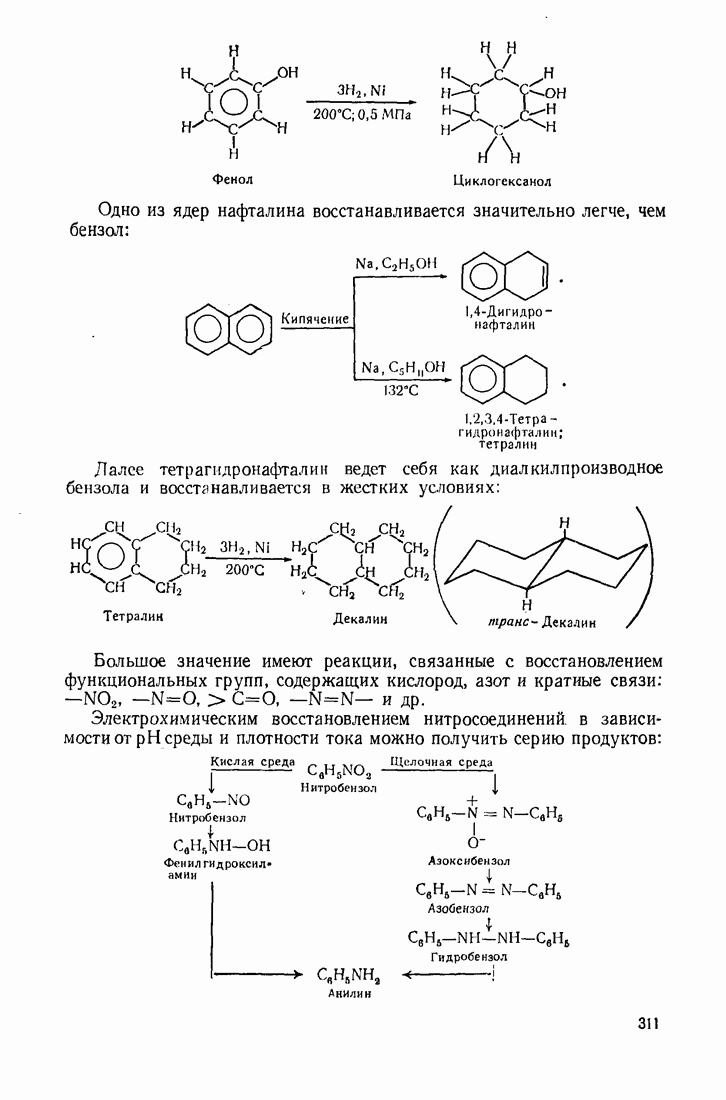
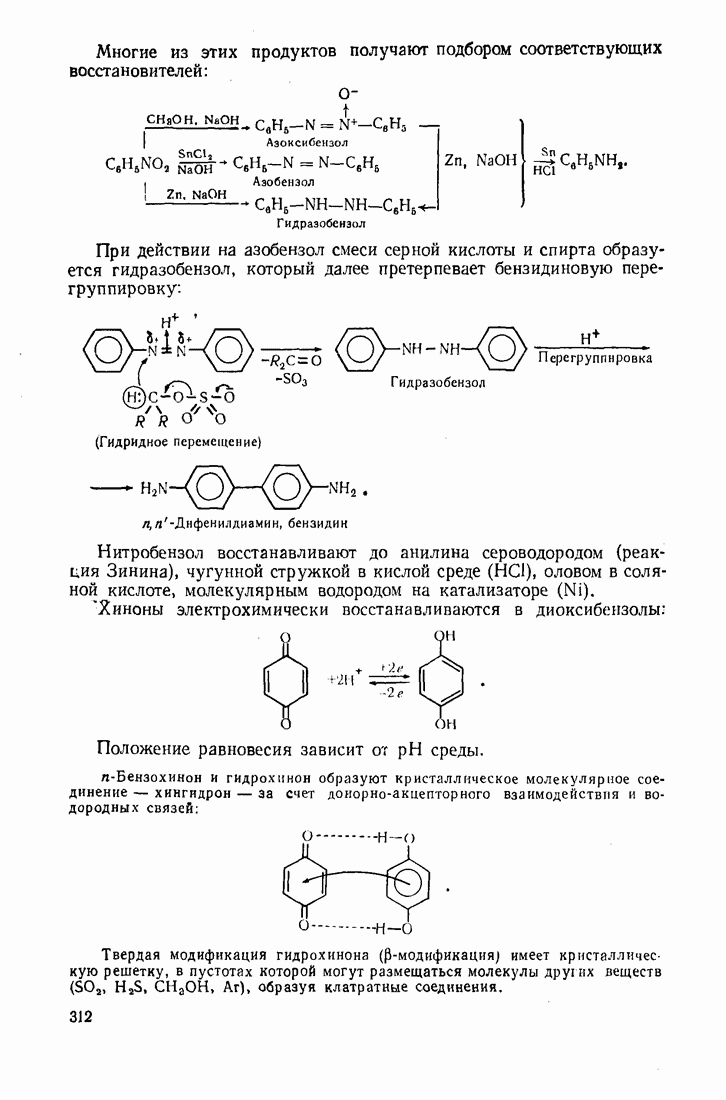
- 5.9. ОКИСЛЕНИЕ
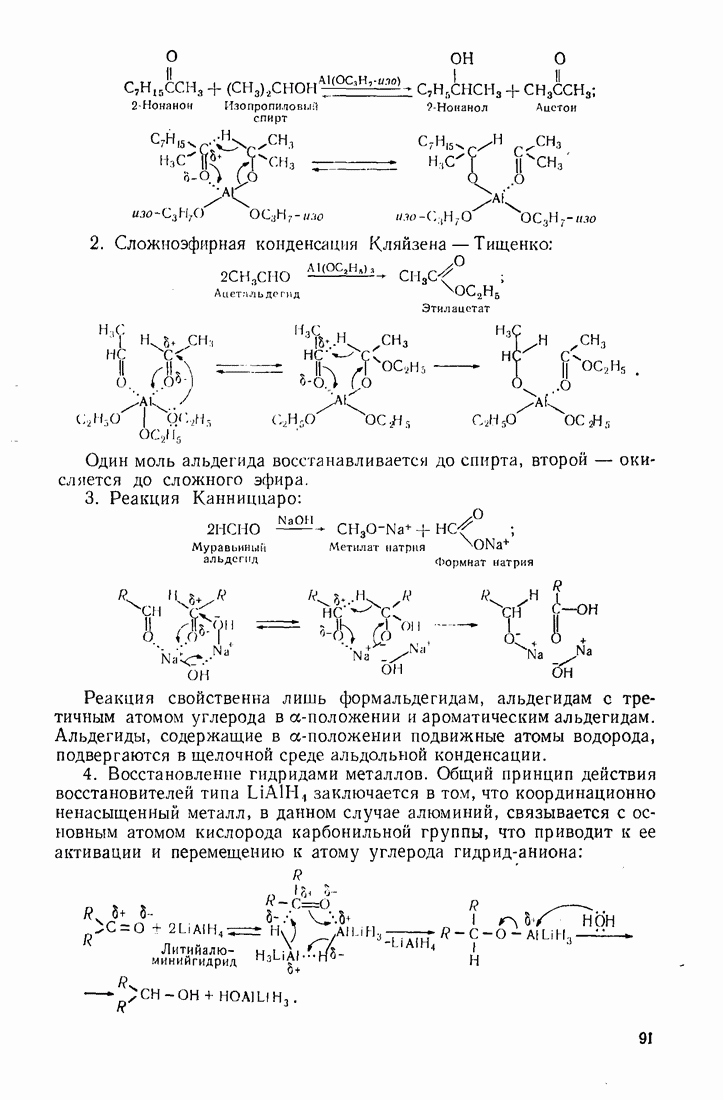
- 5.10. ВОССТАНОВЛЕНИЕ
- 5.11. АЛКАНЫ
- 5.12 АЛКЕНЫ
- 5.13. ДИЕНОВЫЕ УГЛЕВОДОРОДЫ (1,3-ДИЕНЫ)
- 5.14. АЦЕТИЛЕНЫ
- 5.15 АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
- 5.16. ГАЛОГЕН АЛКАНЫ
- 5.17. СПИРТЫ
- 5.18. АЛЬДЕГИДЫ И КЕТОНЫ
- 5.19. КАРБОНОВЫЕ КИСЛОТЫ
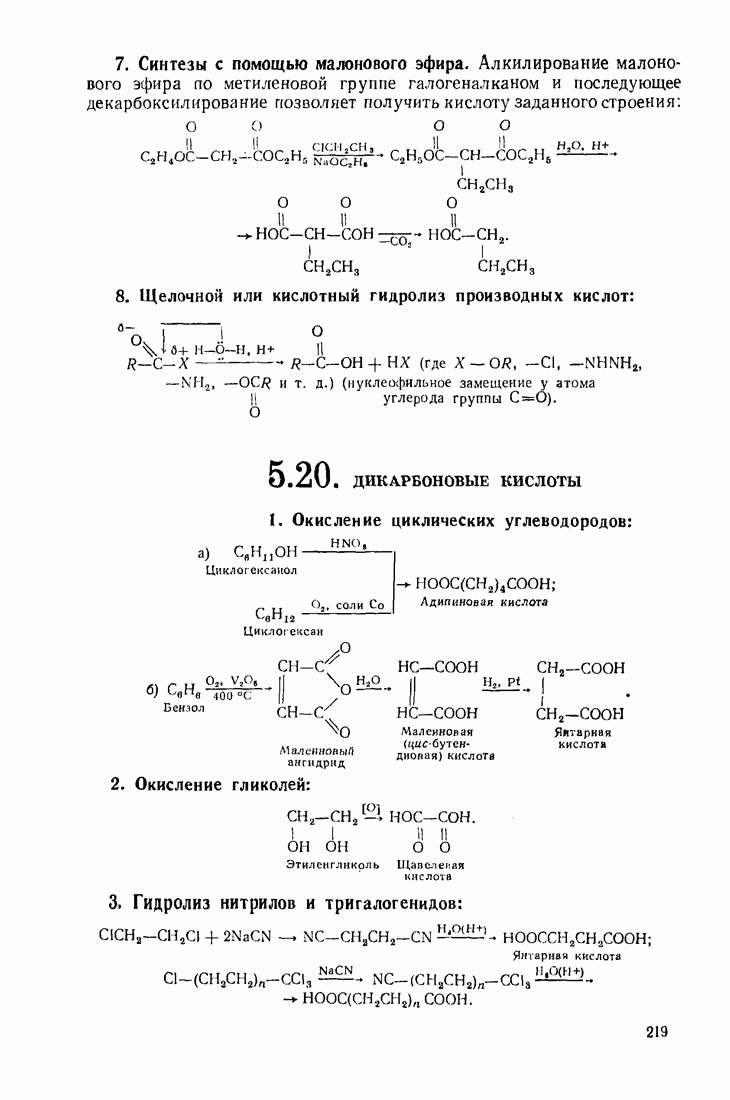
- 5.20. ДИКАРБОНОВЫЕ КИСЛОТЫ
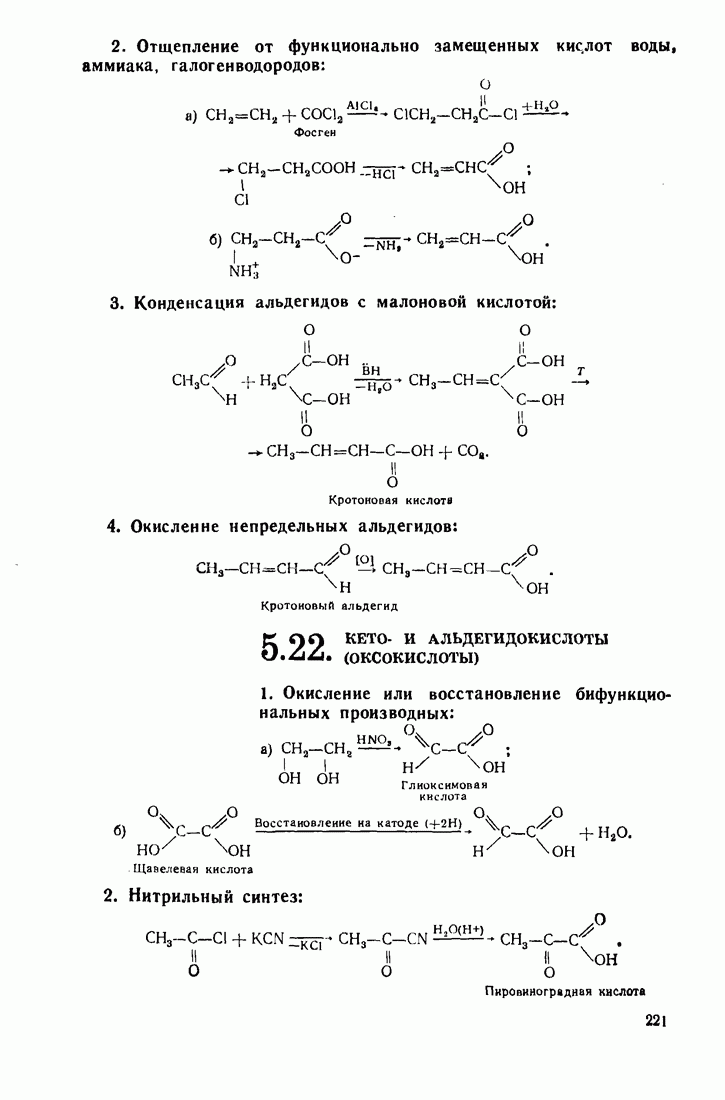
- 5.21. НЕПРЕДЕЛЬНЫЕ КИСЛОТЫ
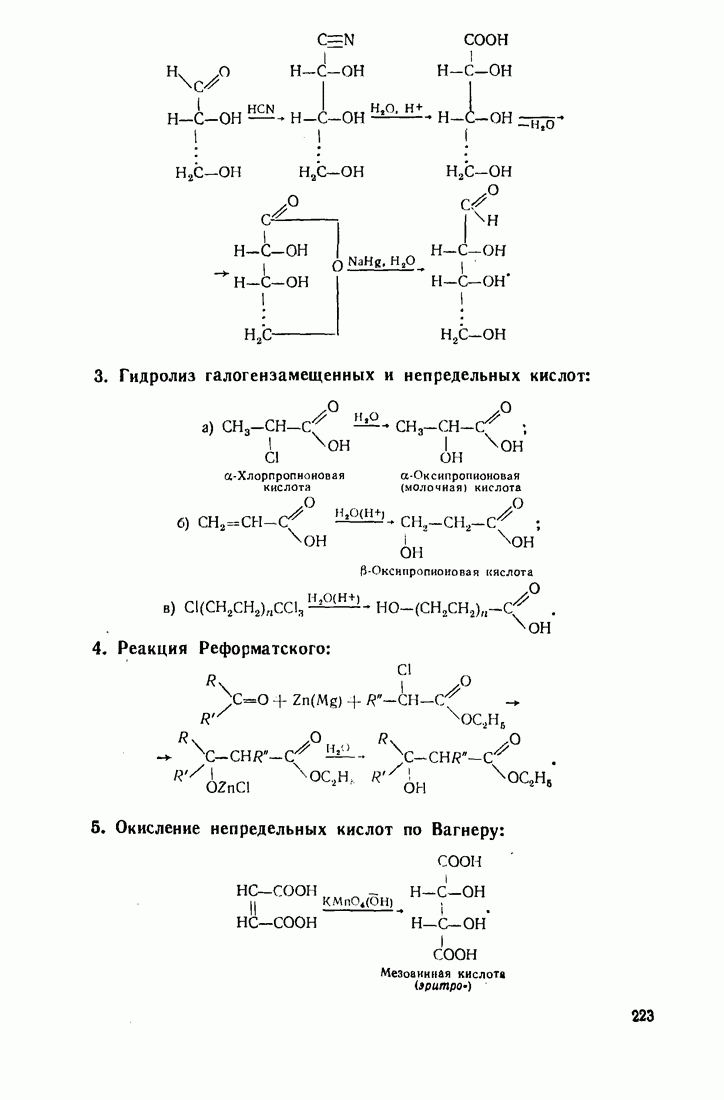
- 5.22. КЕТО- И АЛЬДЕГИДОКИСЛОТЫ (ОКСОКИСЛОТЫ)
- 5.23. ОКСИКИСЛОТЫ
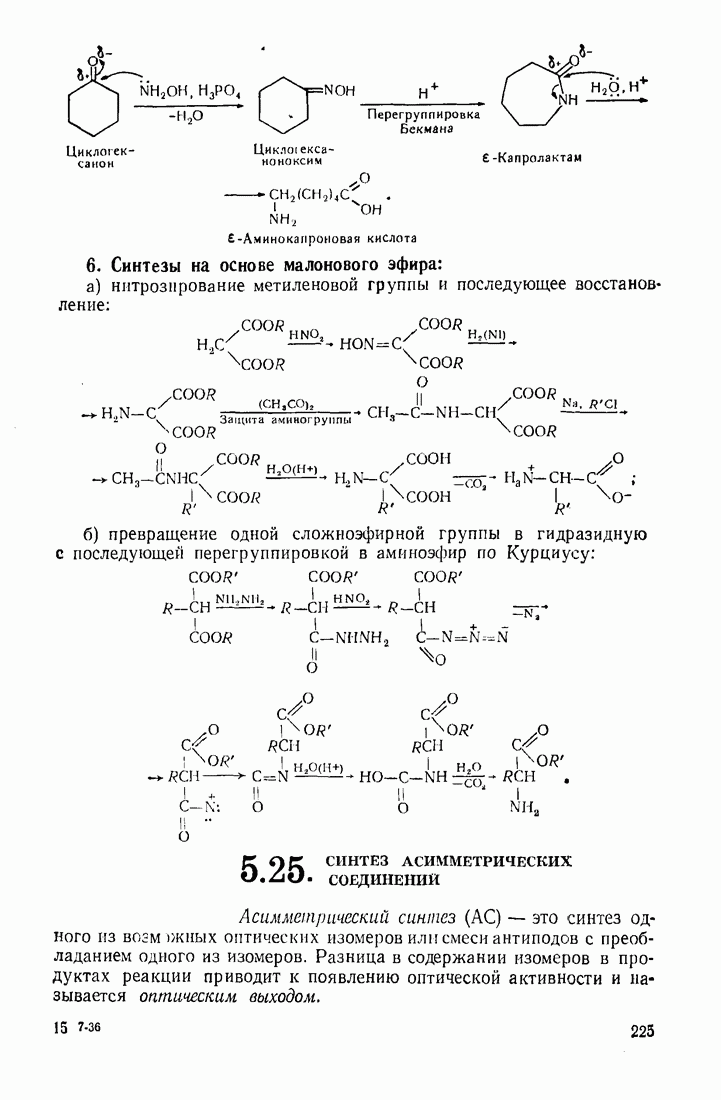
- 5.24. АМИНОКИСЛОТЫ
- 5.25 СИНТЕЗ АСИММЕТРИЧЕСКИХ СОЕДИНЕНИЙ
- 6. Некоторые понятия физической органической химии
- 6.1. СВЯЗЬ СОСТАВА И СТРОЕНИЯ СОЕДИНЕНИЙ С ФИЗИЧЕСКИМИ СВОЙСТВАМИ
- 6.2. ИДЕНТИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- 6.3. КИСЛОТЫ И ОСНОВАНИЯ В ОРГАНИЧЕСКОЙ ХИМИИ
- 6.4. ОРГАНИЧЕСКИЕ РАСТВОРИТЕЛИ И ИХ ВЛИЯНИЕ НА СКОРОСТЬ И МЕХАНИЗМ РЕАКЦИЙ
- 6.5. КАТАЛИЗ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- 7. Бензол и его производные
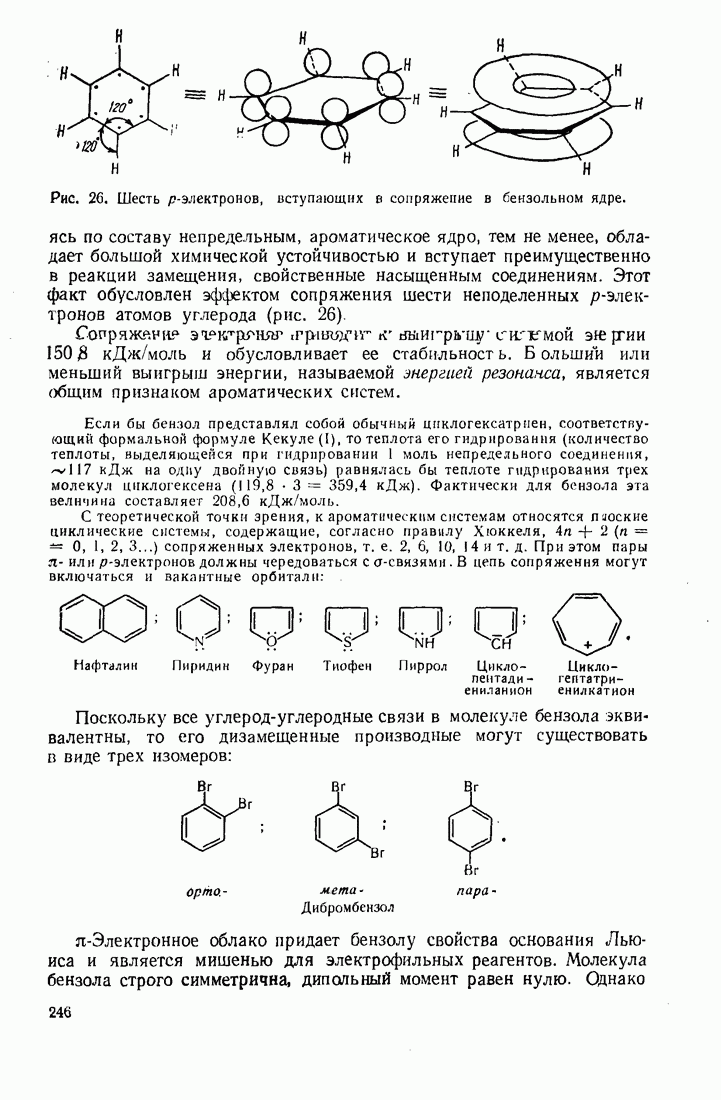
- 7.1. СТРОЕНИЕ БЕНЗОЛА. РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ
- 7.2. ЭЛЕКТРОФИЛЬНОЕ ЗАМЕЩЕНИЕ В БЕНЗОЛЬНОМ ЯДРЕ
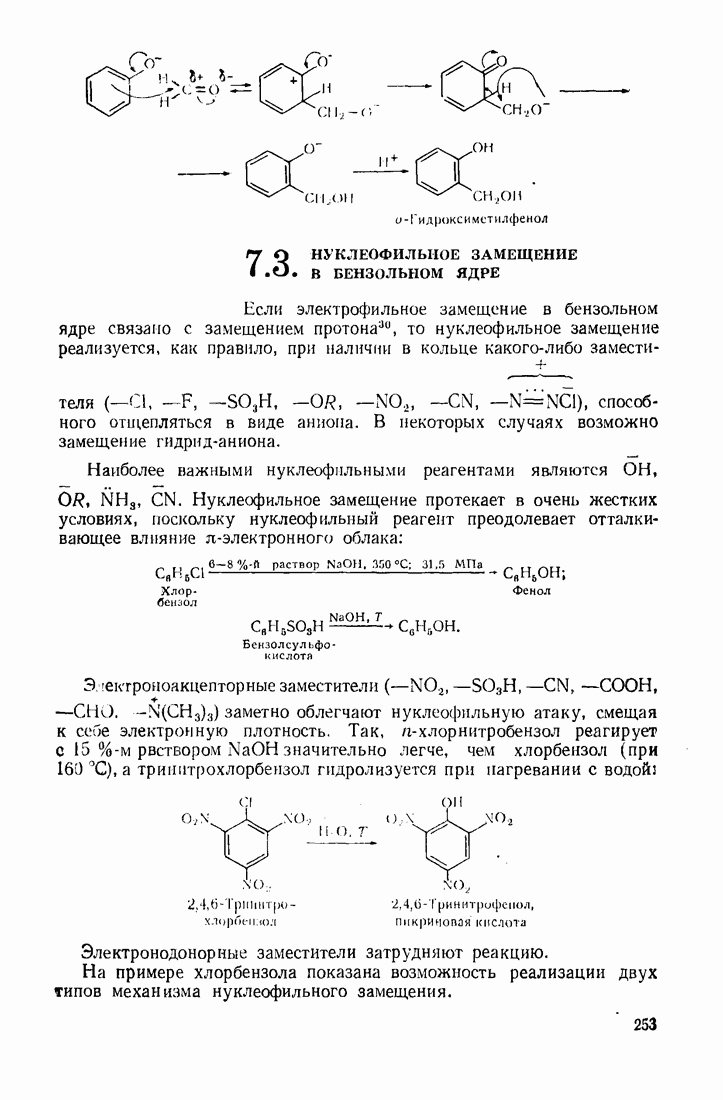
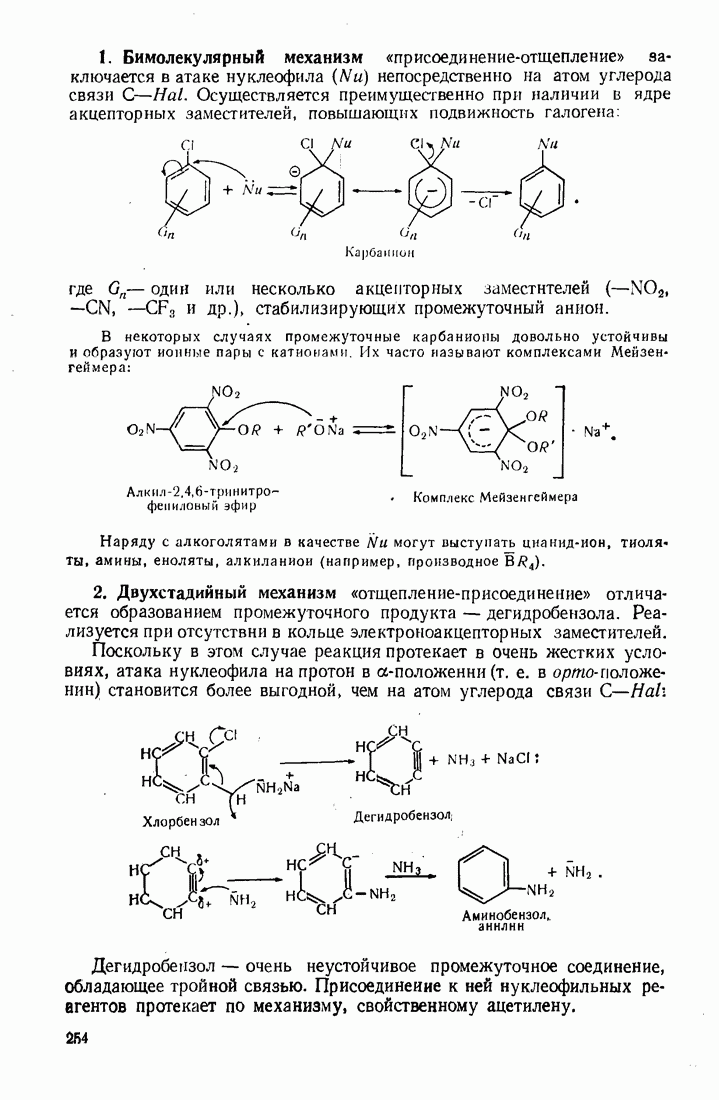
- 7.3. НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ В БЕНЗОЛЬНОМ ЯДРЕ
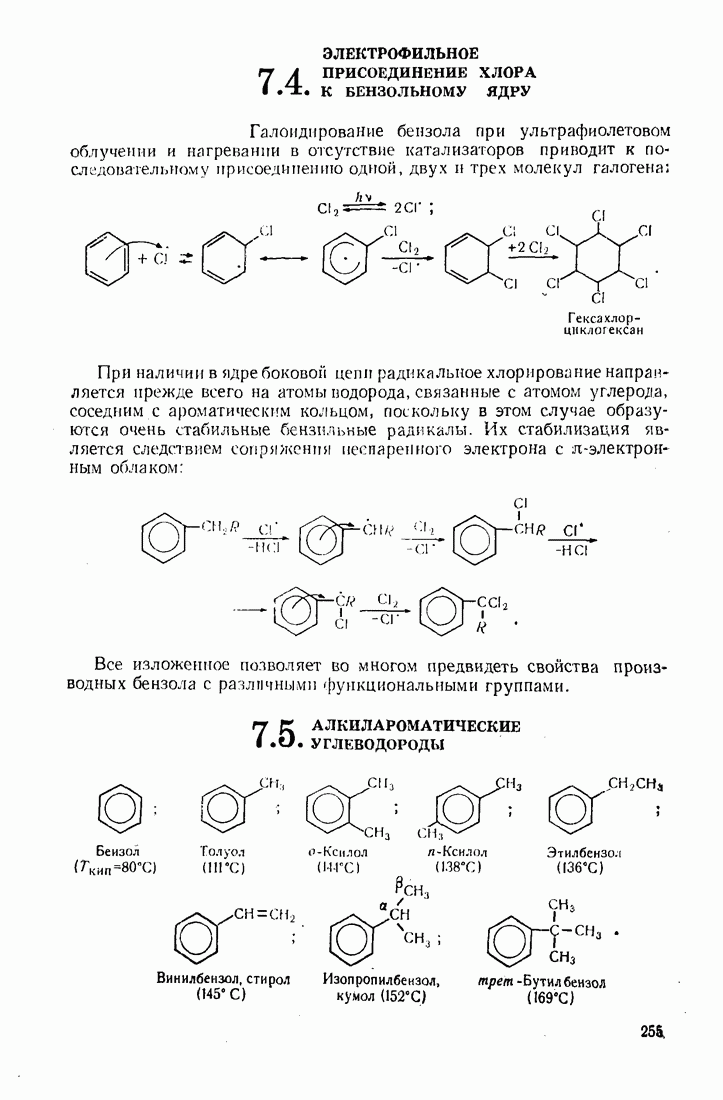
- 7.4. ЭЛЕКТРОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ ХЛОРА К БЕНЗОЛЬНОМУ ЯДРУ
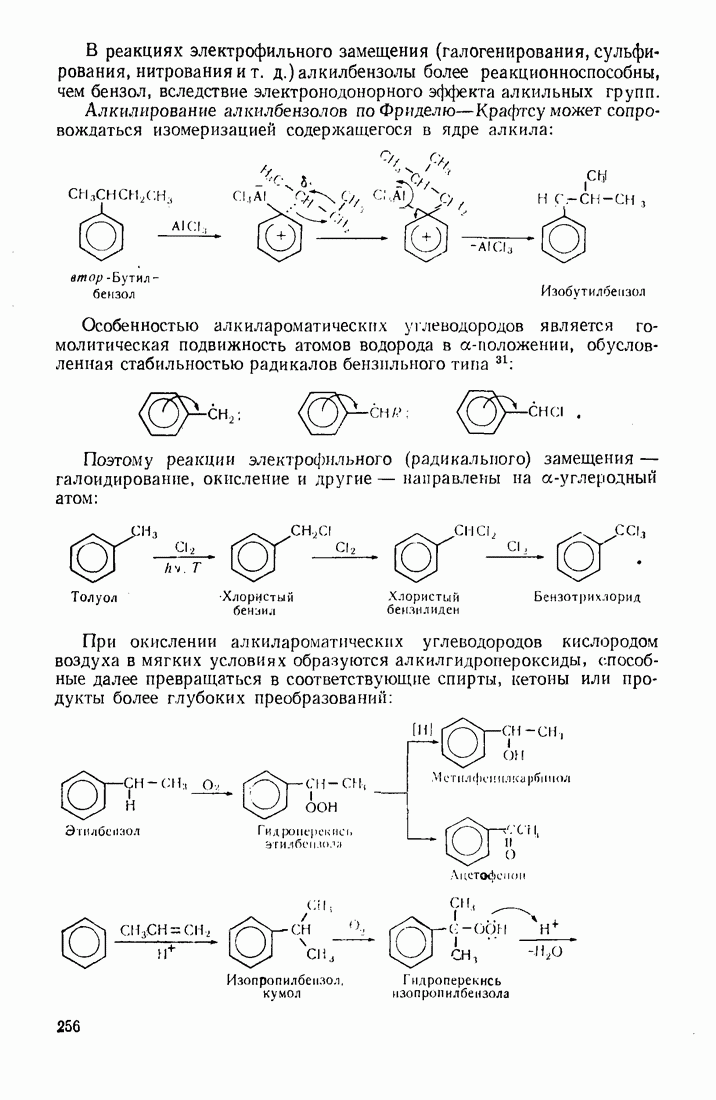
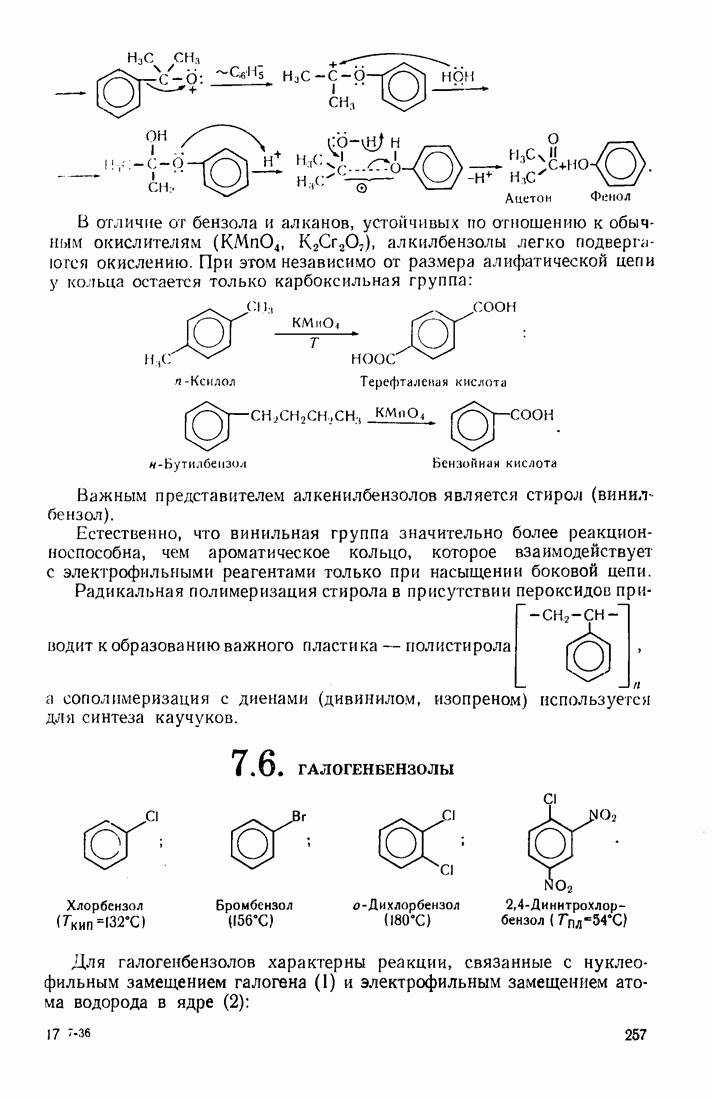
- 7.5. АЛКИЛАРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
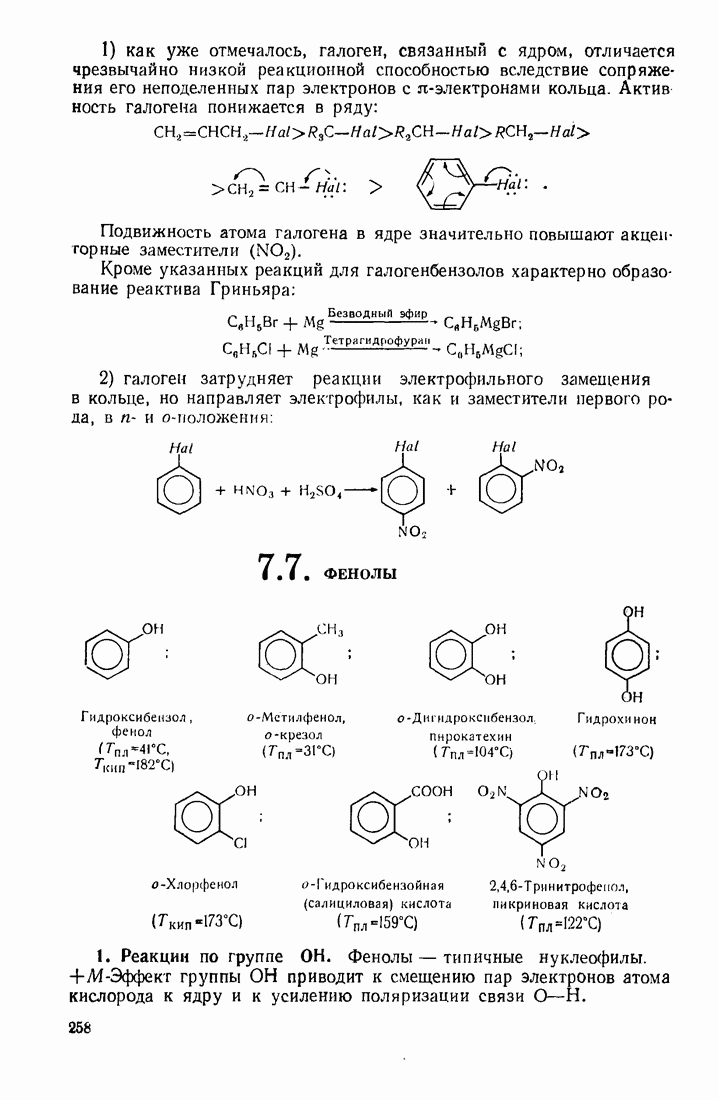
- 7.6. ГАЛОГЕНБЕНЗОЛЫ
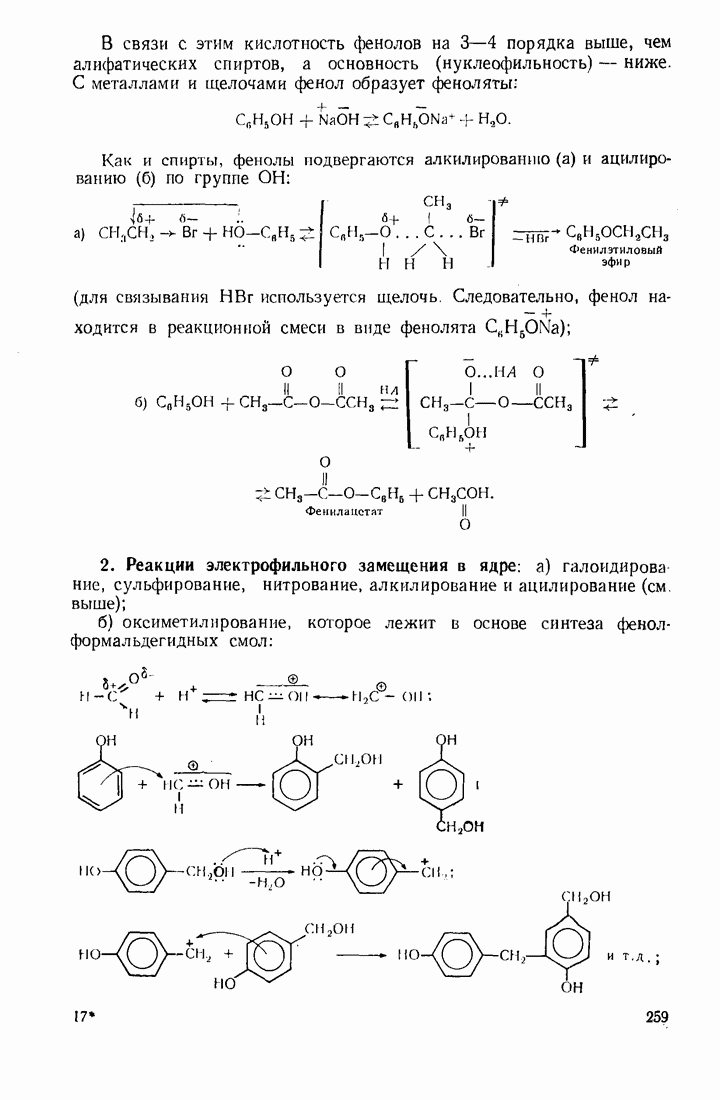
- 7.7. ФЕНОЛЫ
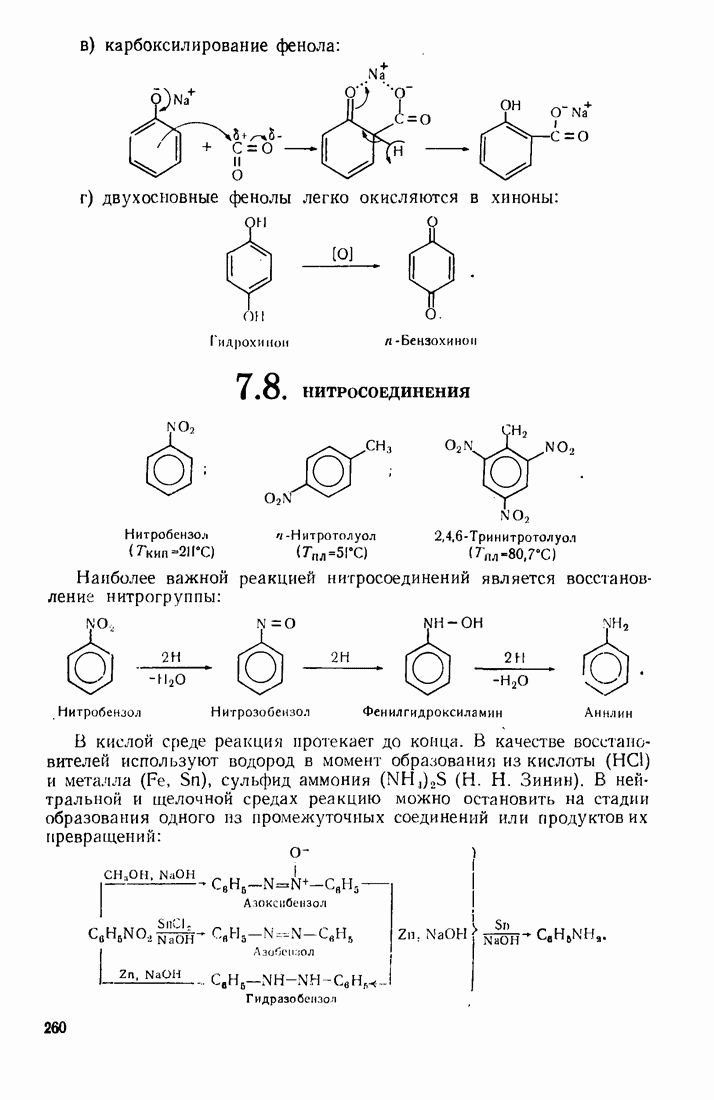
- 7.8. НИТРОСОЕД ИНЕНИЯ
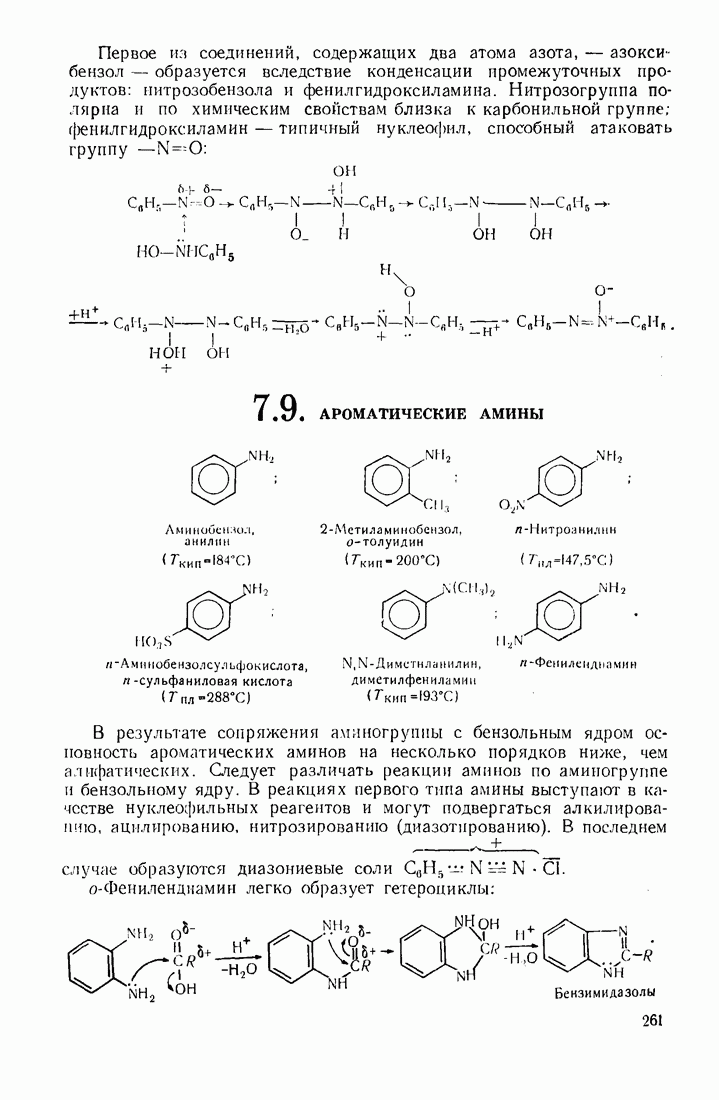
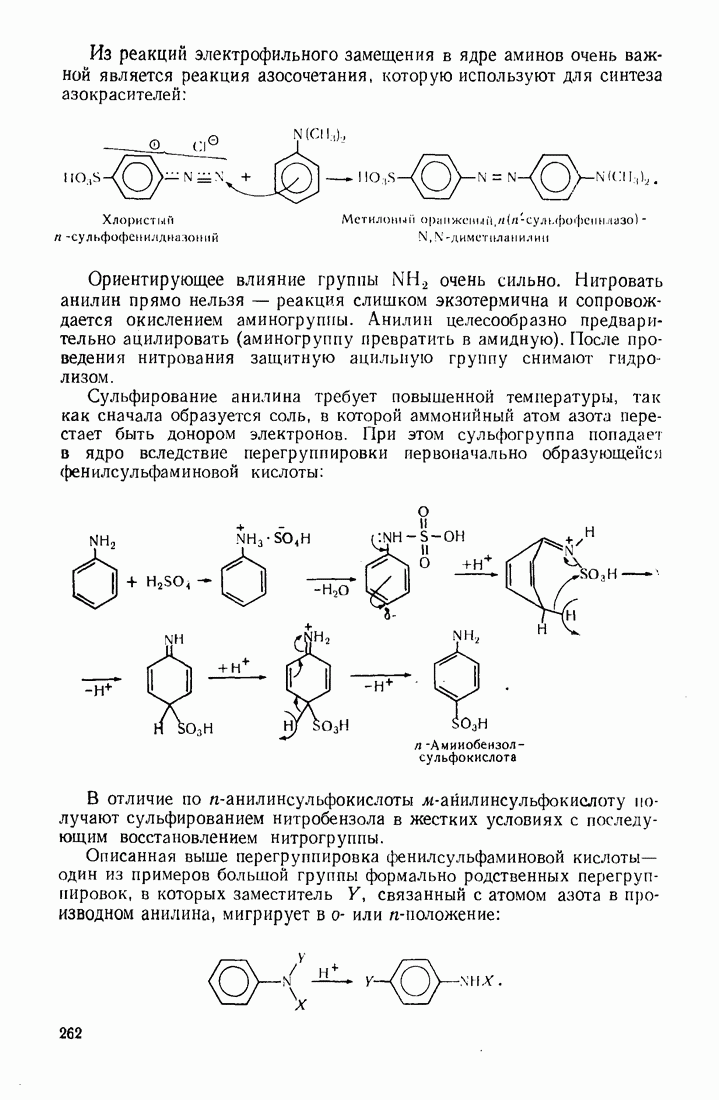
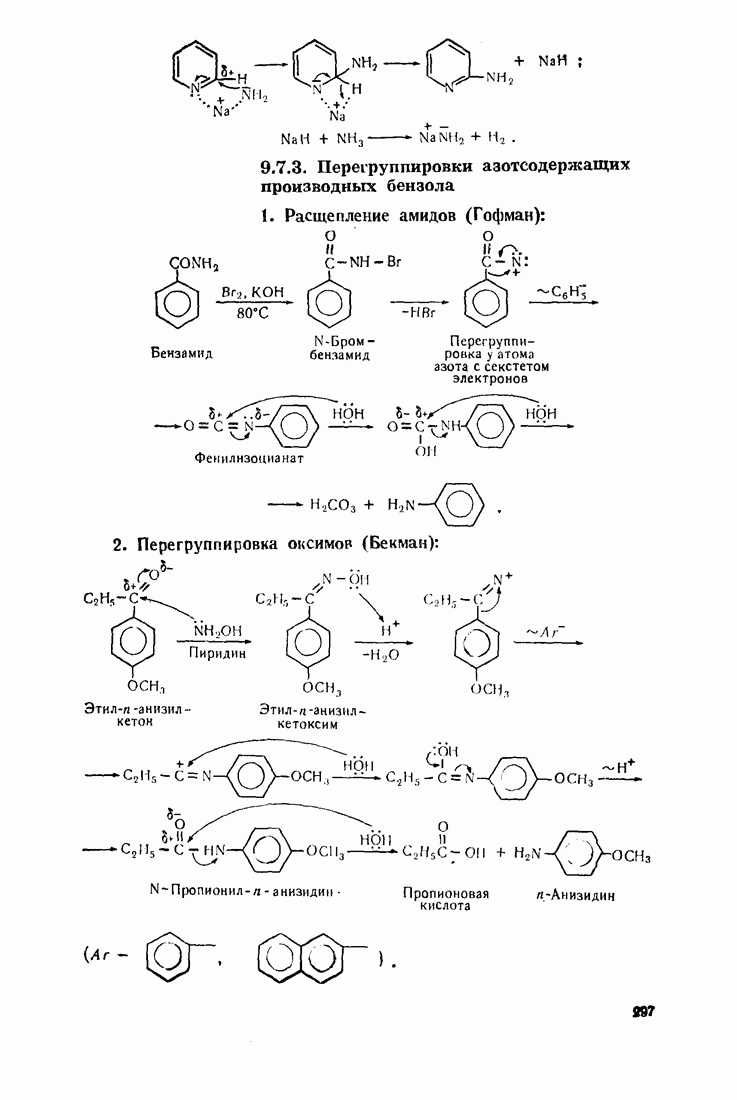
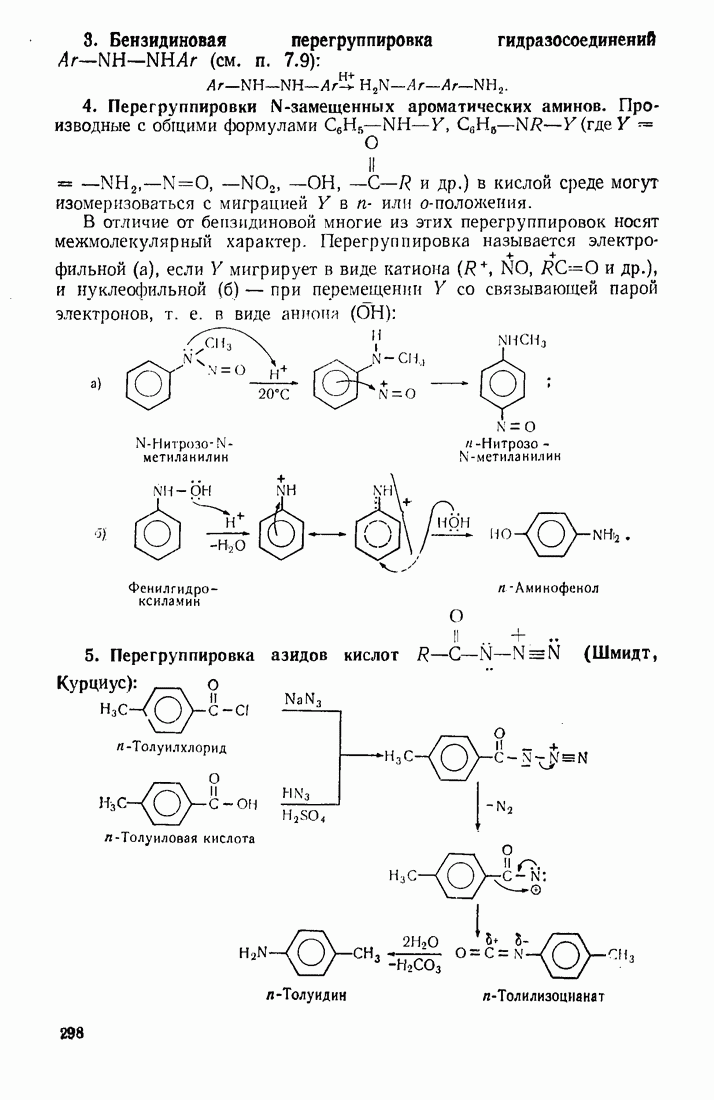
- 7.9. АРОМАТИЧЕСКИЕ АМИНЫ
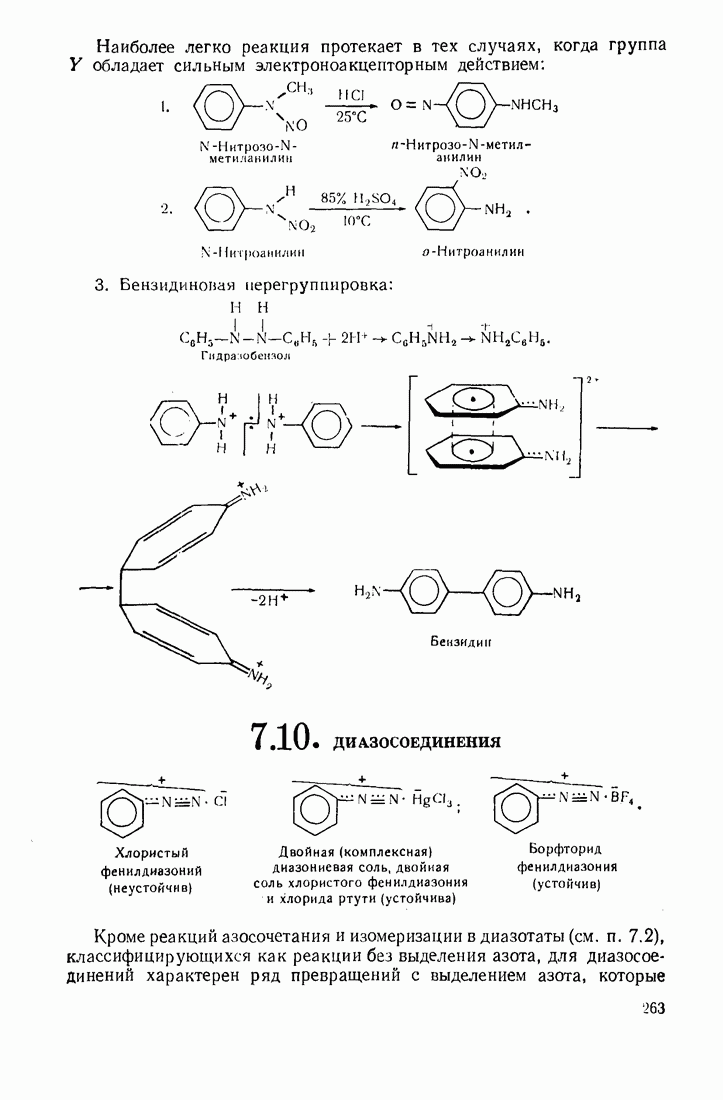
- 7.10. ДИАЗОСОЕДИНЕНИЯ
- 7.11. АЗОСОЕДИНЕНИЯ
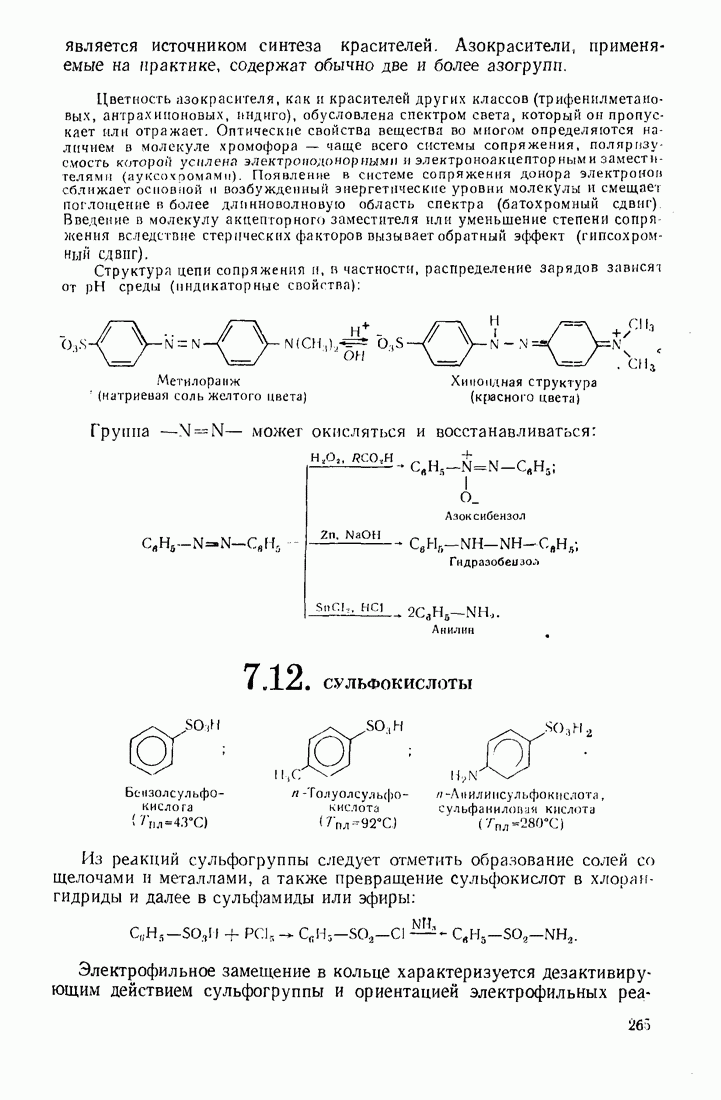
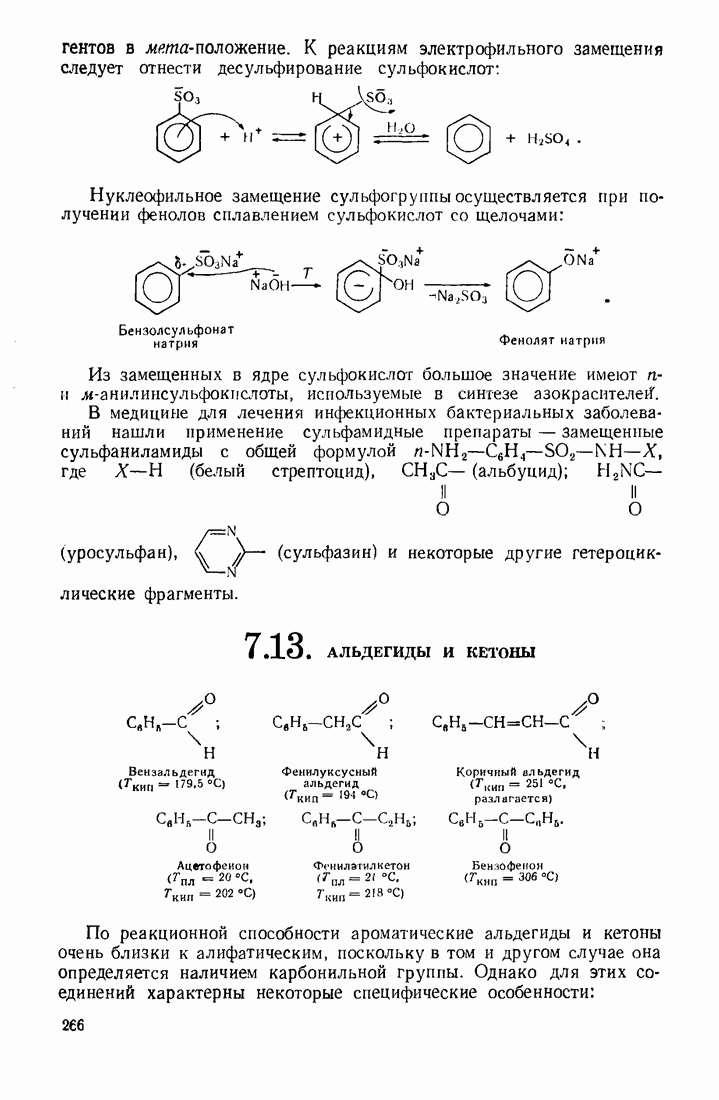
- 7.12. СУЛЬФОКИСЛОТЫ
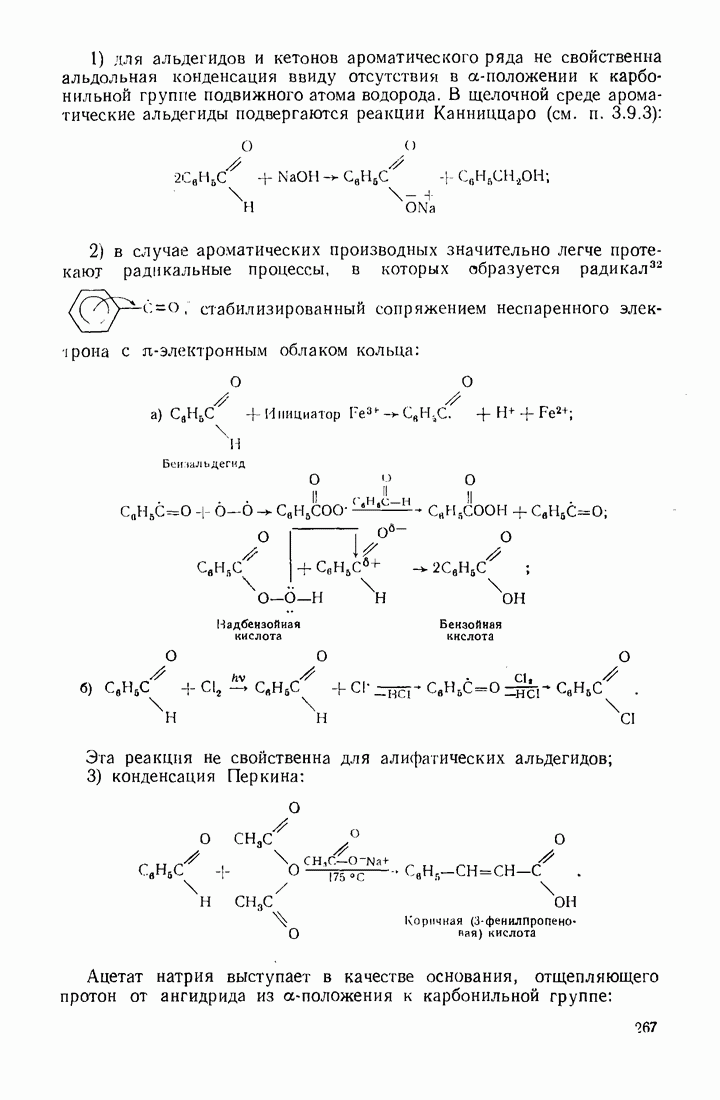
- 7.13. АЛЬДЕГИДЫ И КЕТОНЫ
- 8. Многоядерные ароматические соединения
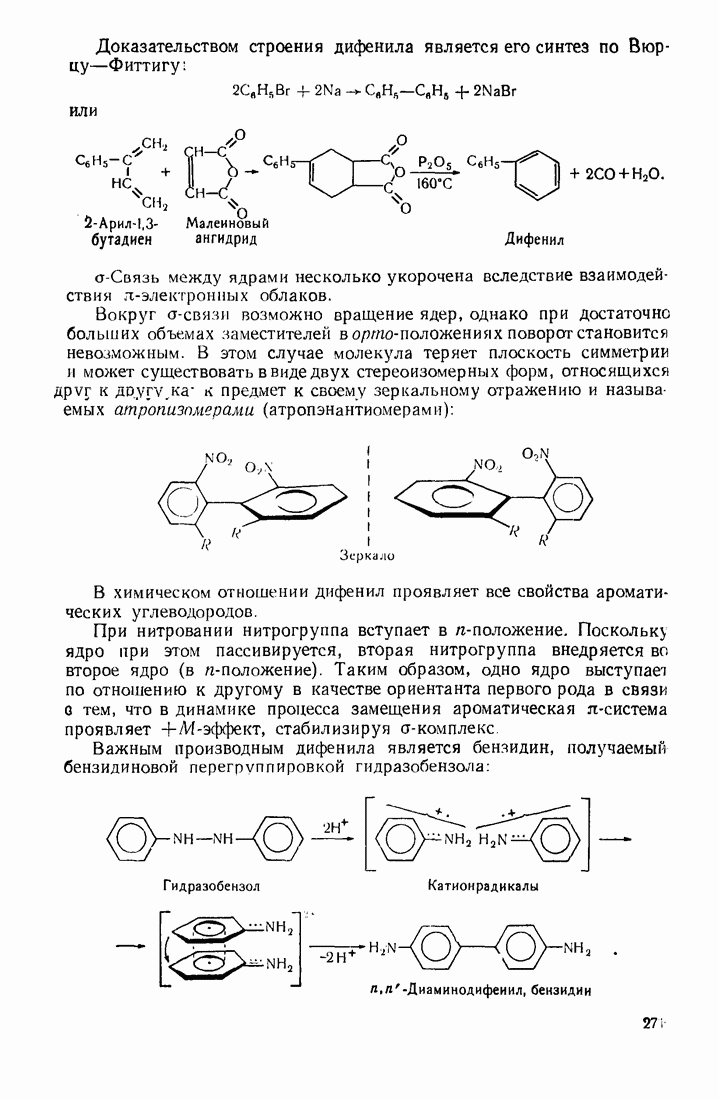
- 8.1. СОЕДИНЕНИЯ С ИЗОЛИРОВАННЫМИ БЕНЗОЛЬНЫМИ ЯДРАМИ
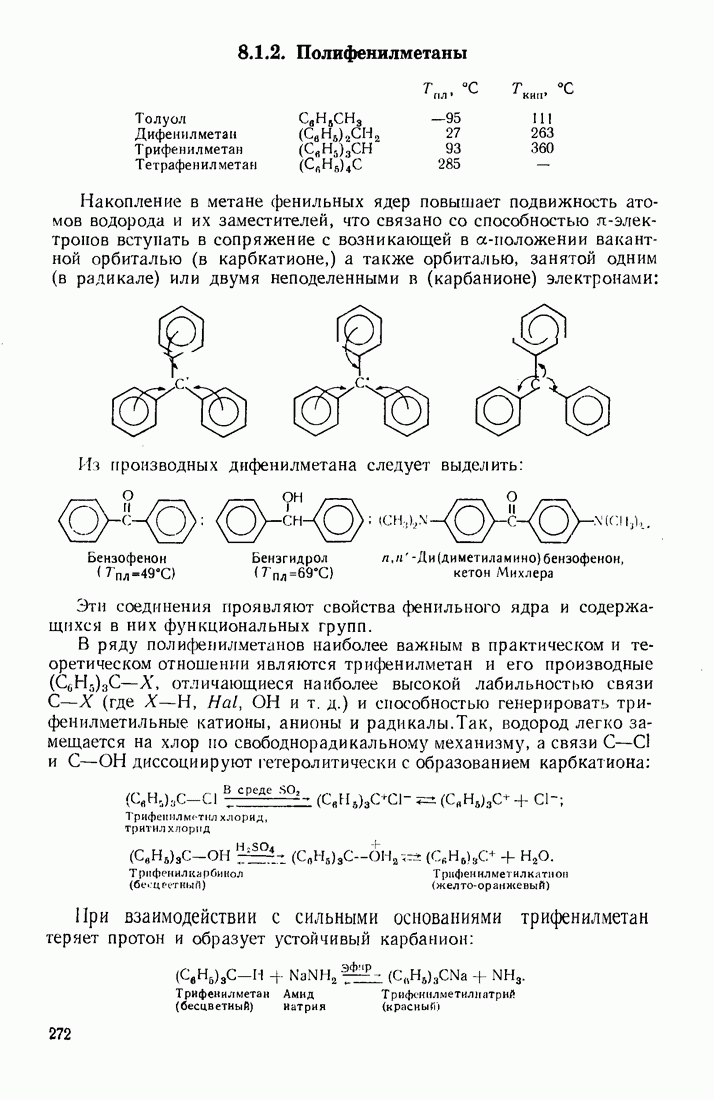
- 8.1.2. Полифенилметаны
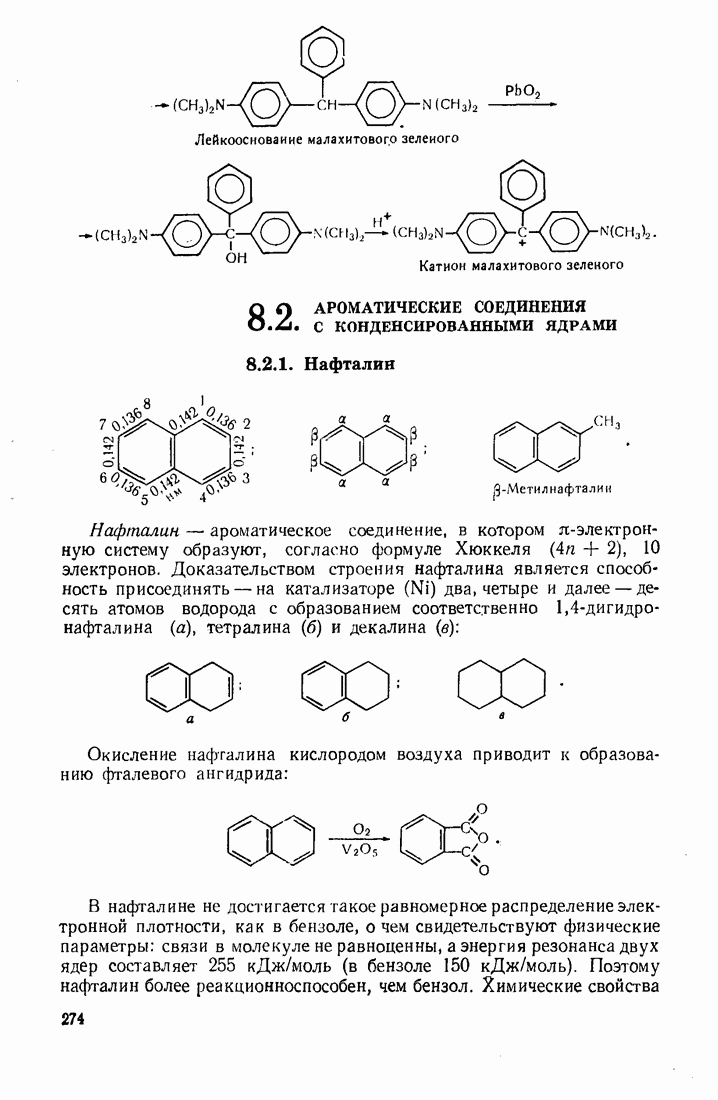
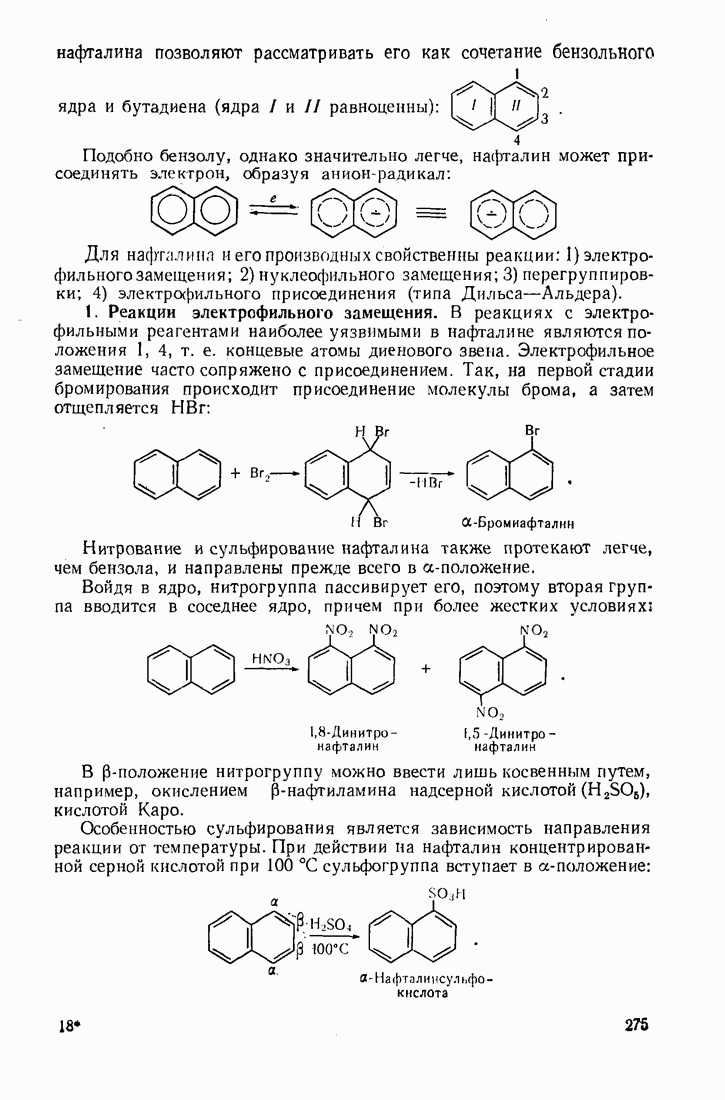
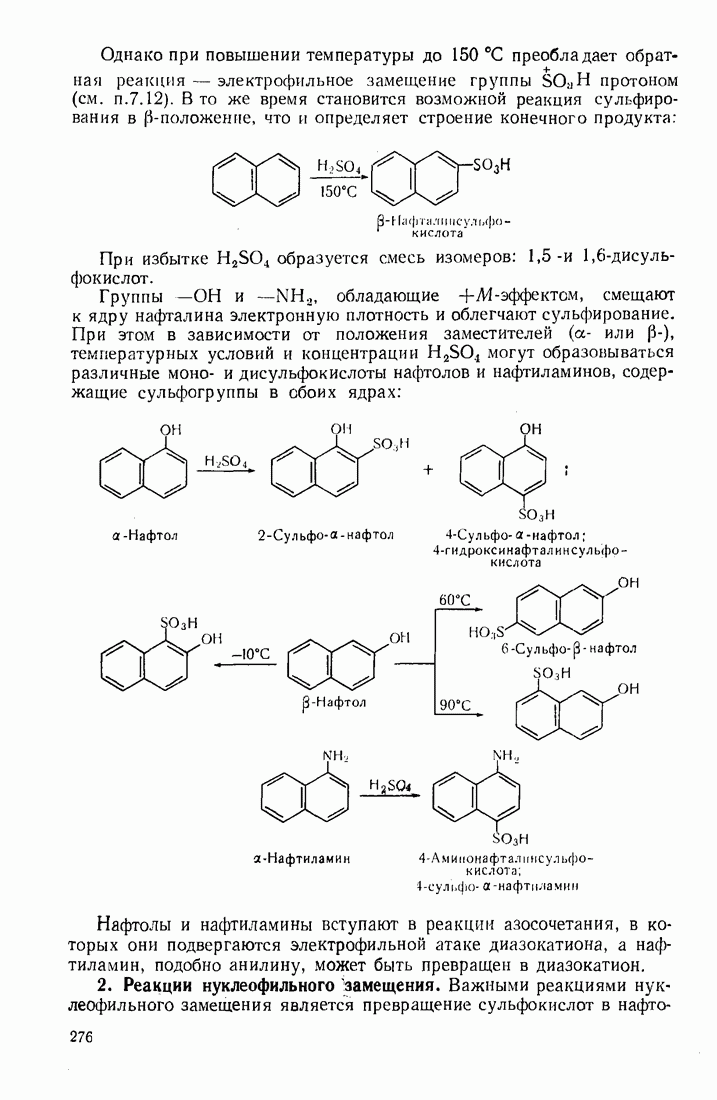
- 8.2. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ С КОНДЕНСИРОВАННЫМИ ЯДРАМИ
- 8.2.2. Антрацен
- 8.2.3. Фенантрен
- 9. Методы синтеза в ряду ароматических соединений
- 9.1. ГАЛОГЕНИРОВАНИЕ
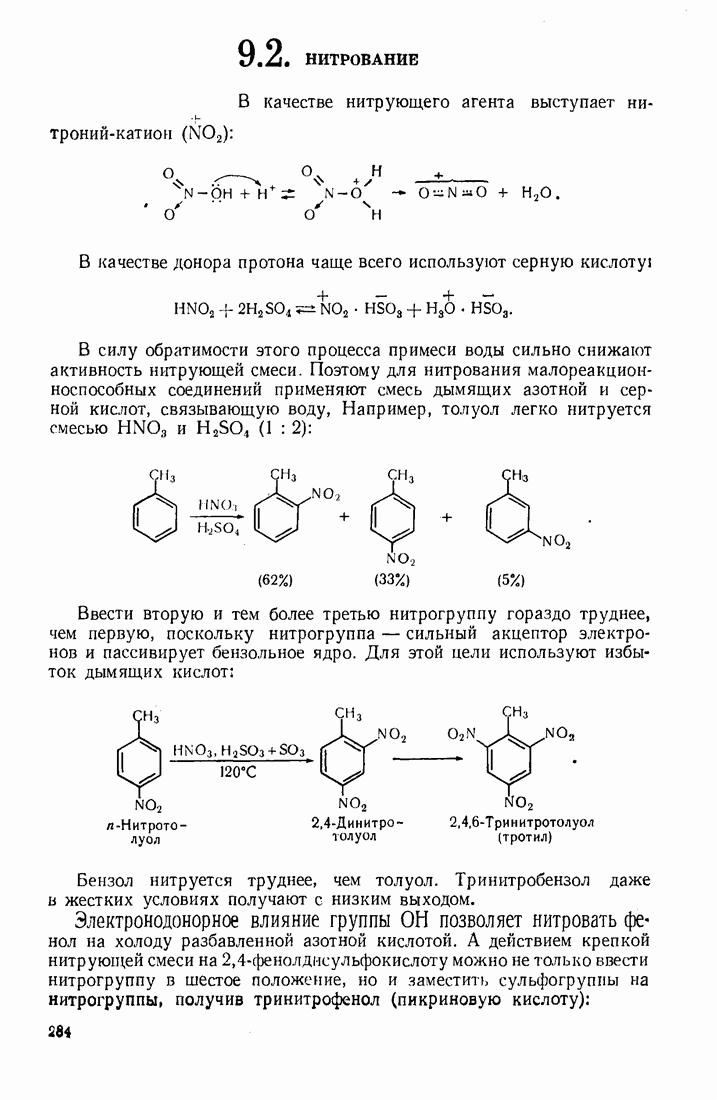
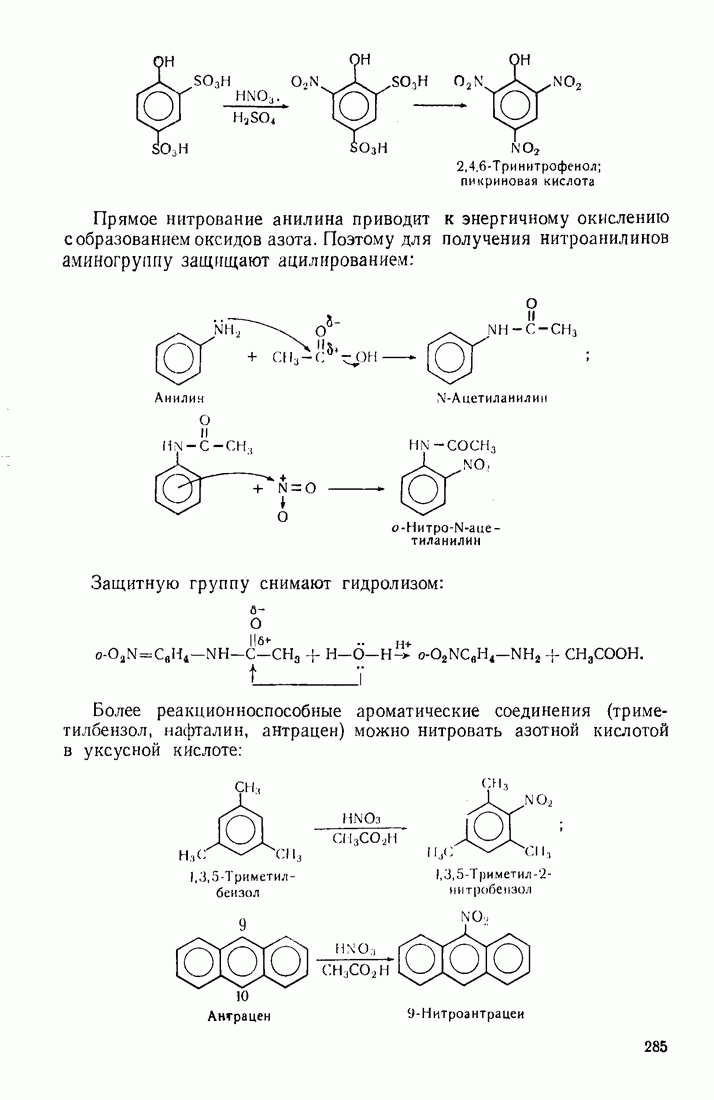
- 9.2. НИТРОВАНИЕ
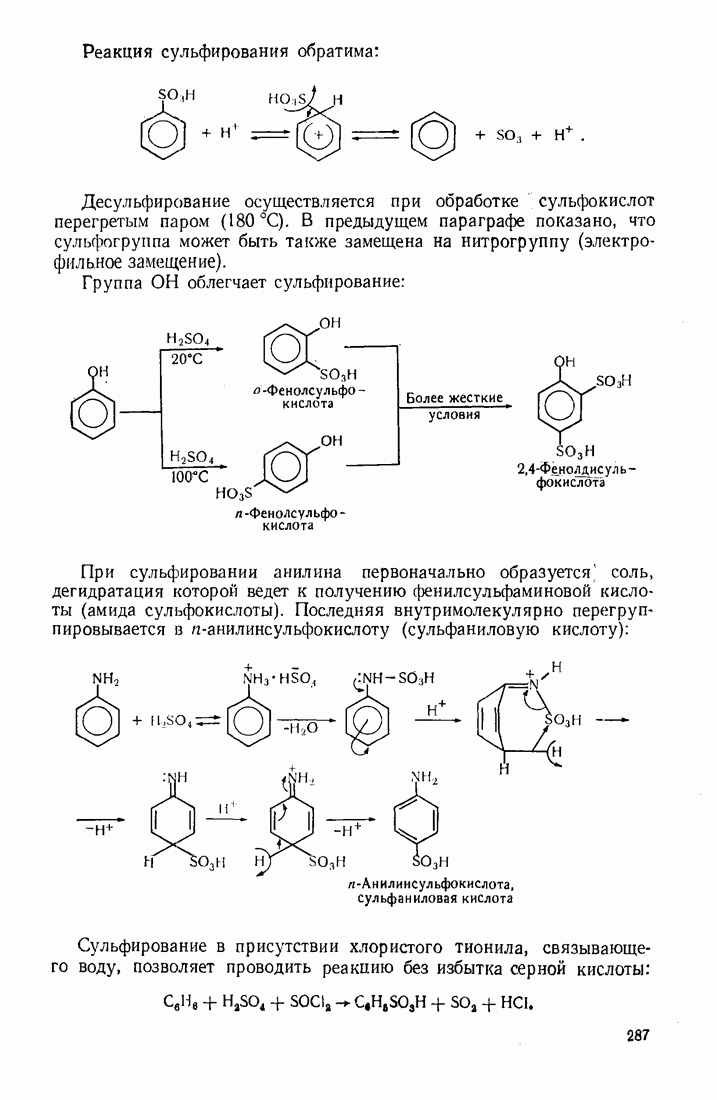
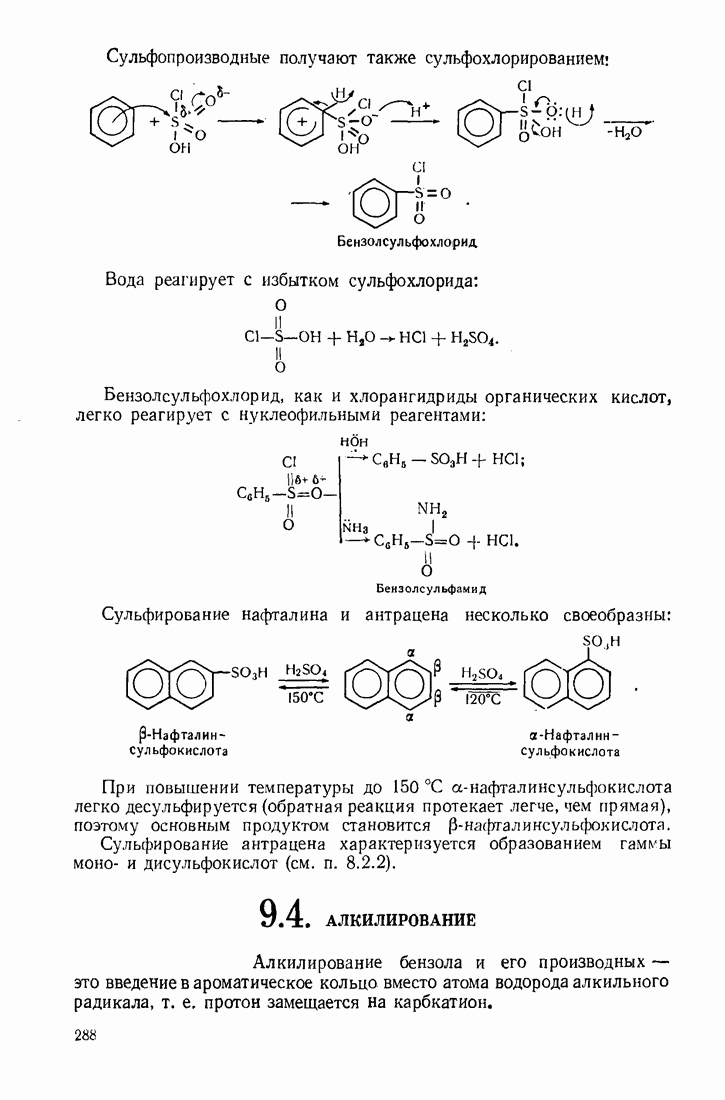
- 9.3. СУЛЬФИРОВАНИЕ
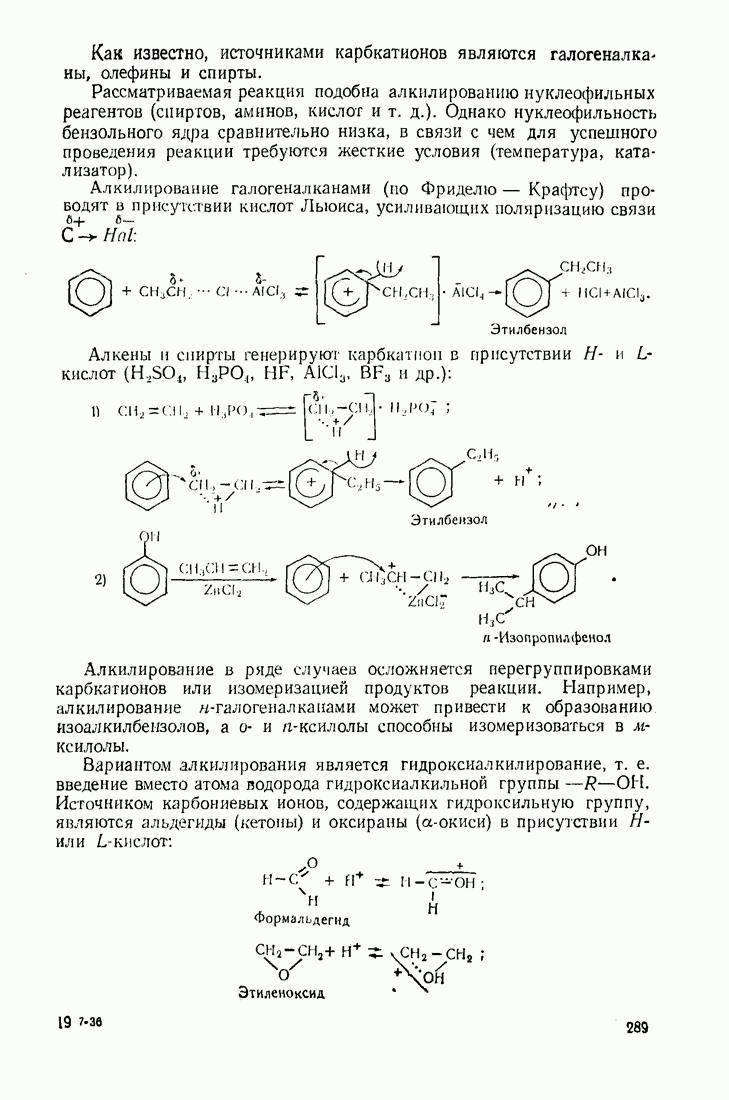
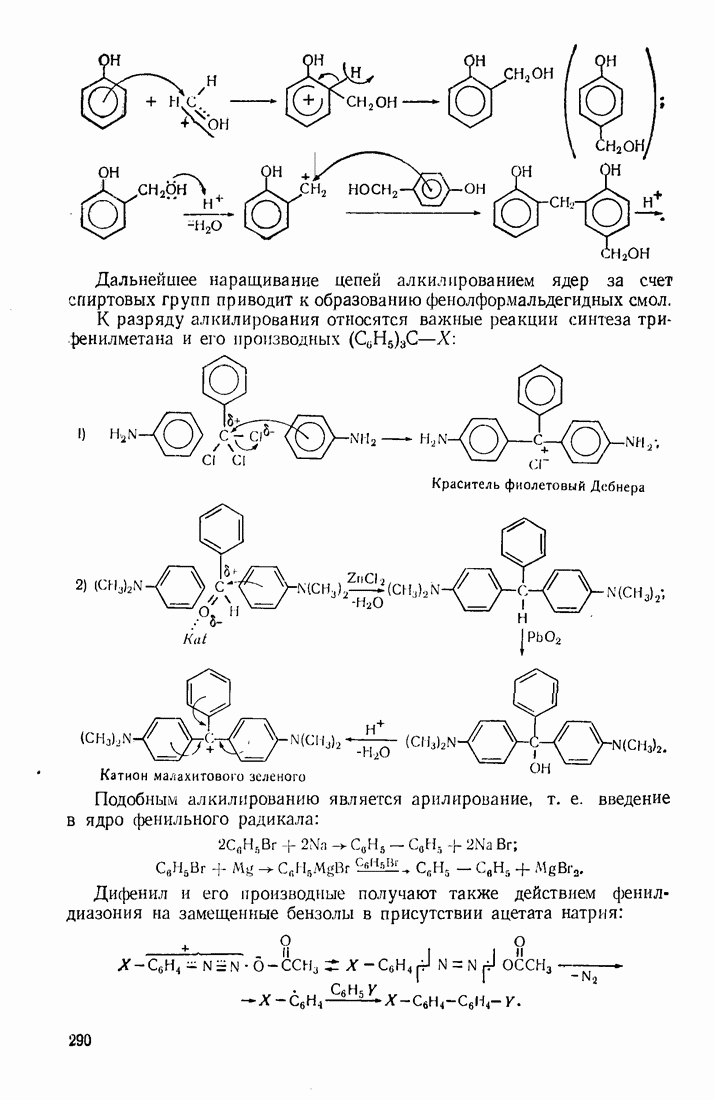
- 9.4. АЛКИЛИРОВАНИЕ
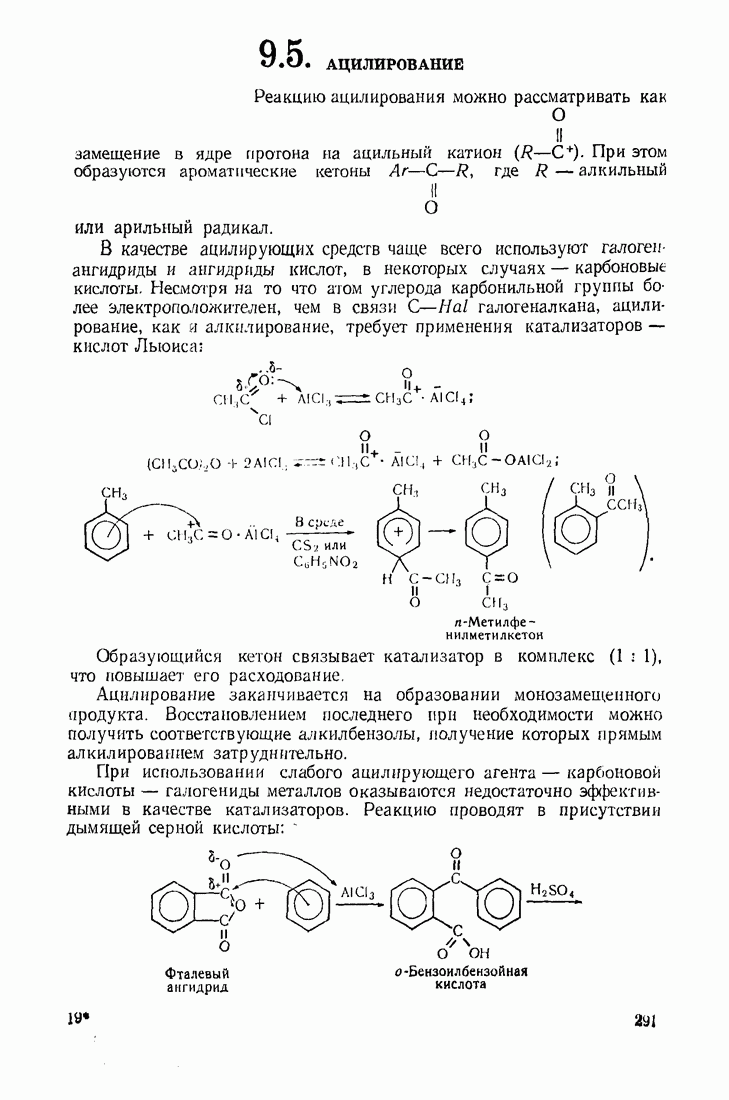
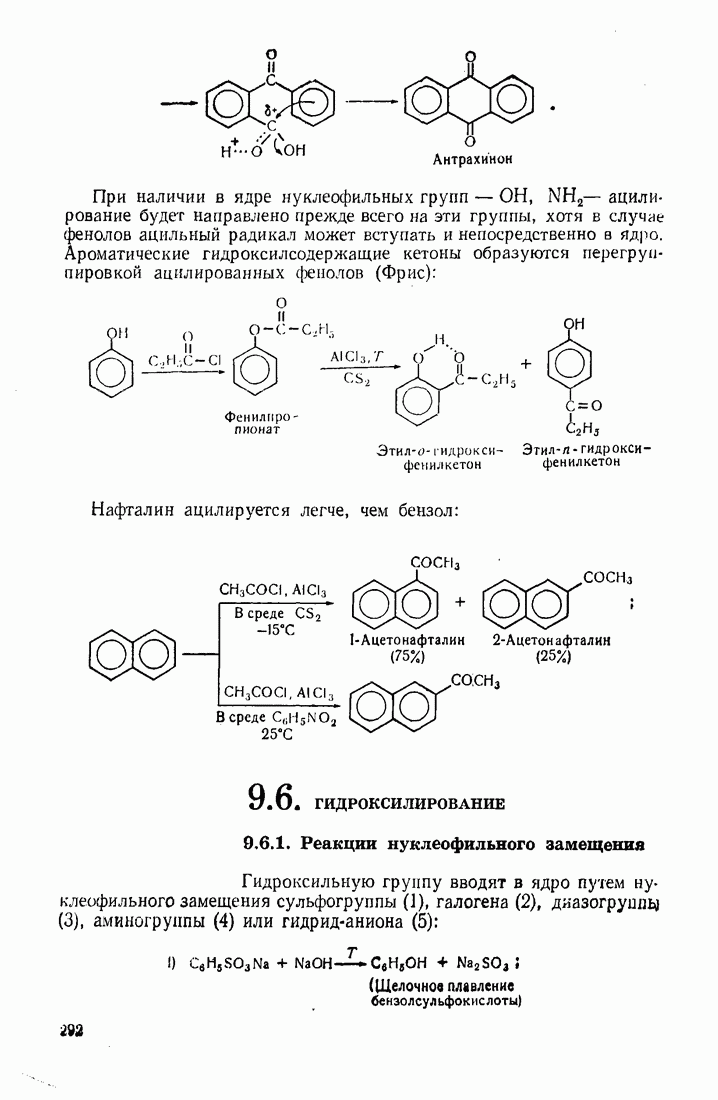
- 9.5. АЦИЛИРОВАНИЕ
- 9.6. ГИДРОКСИЛИРОВАНИЕ
- 9.7. АМИНИРОВАНИЕ
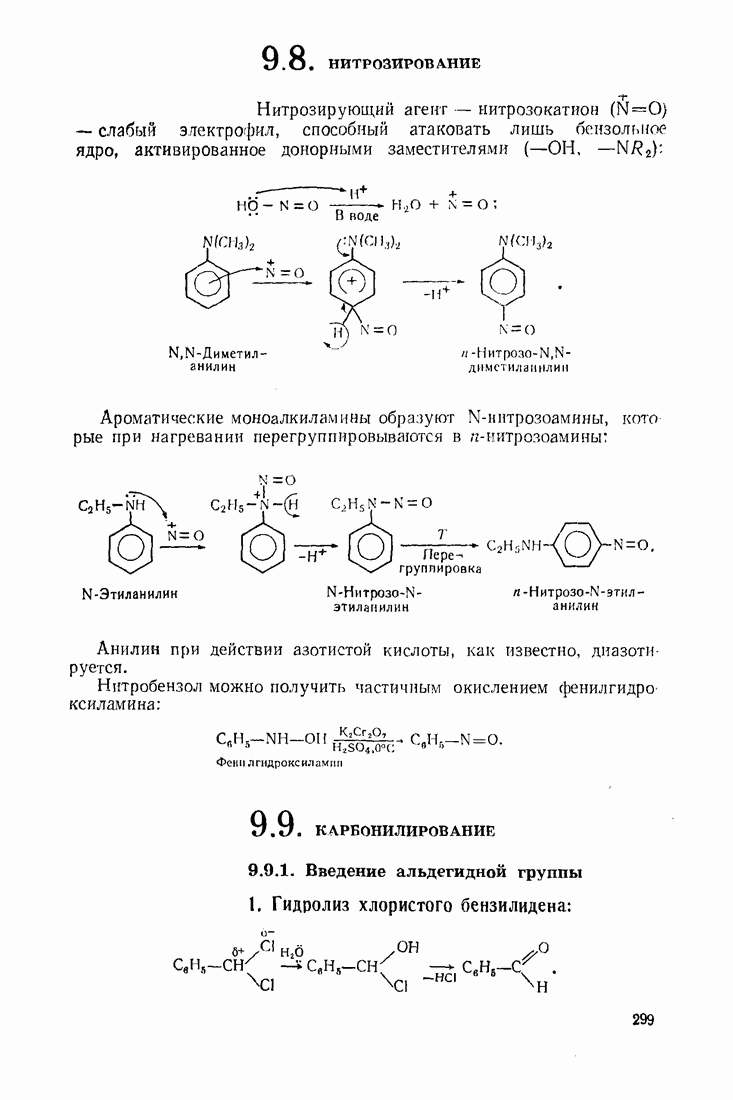
- 9.8. НИТРОЗИРОВАНИЕ
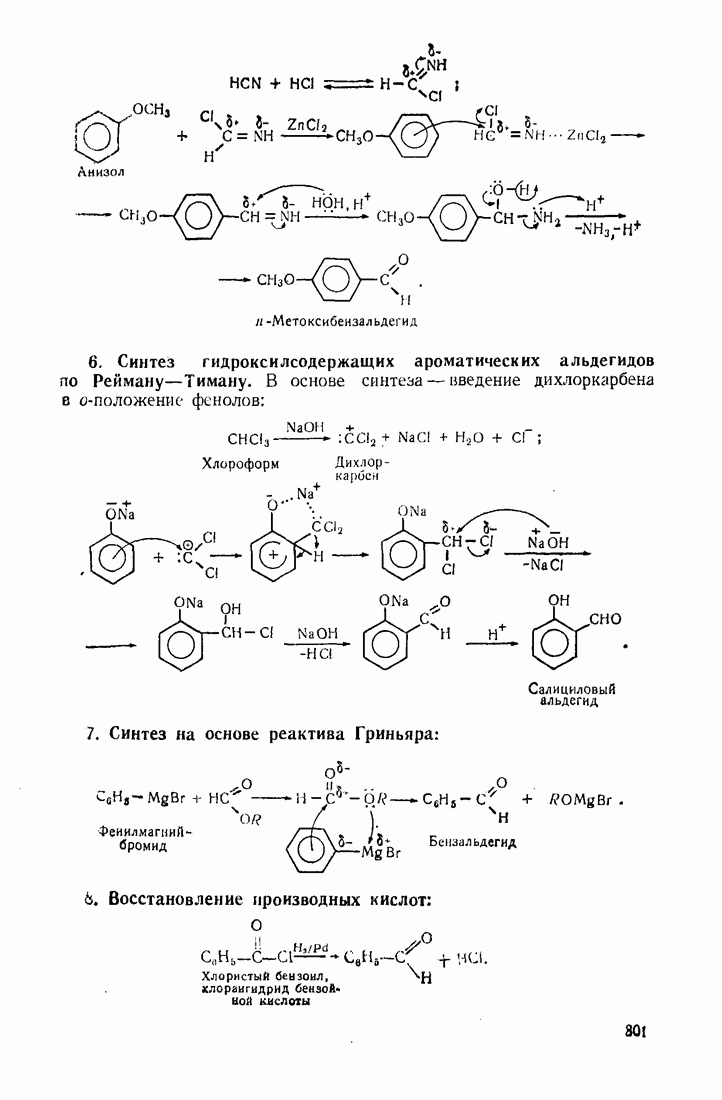
- 9.9. КАРБОНИЛИРОВАНИЕ
- 9.10. КАРБОКСИЛИРОВАНИЕ
- 9.11. ОКИСЛЕНИЕ
- 9.12. ВОССТАНОВЛЕНИЕ
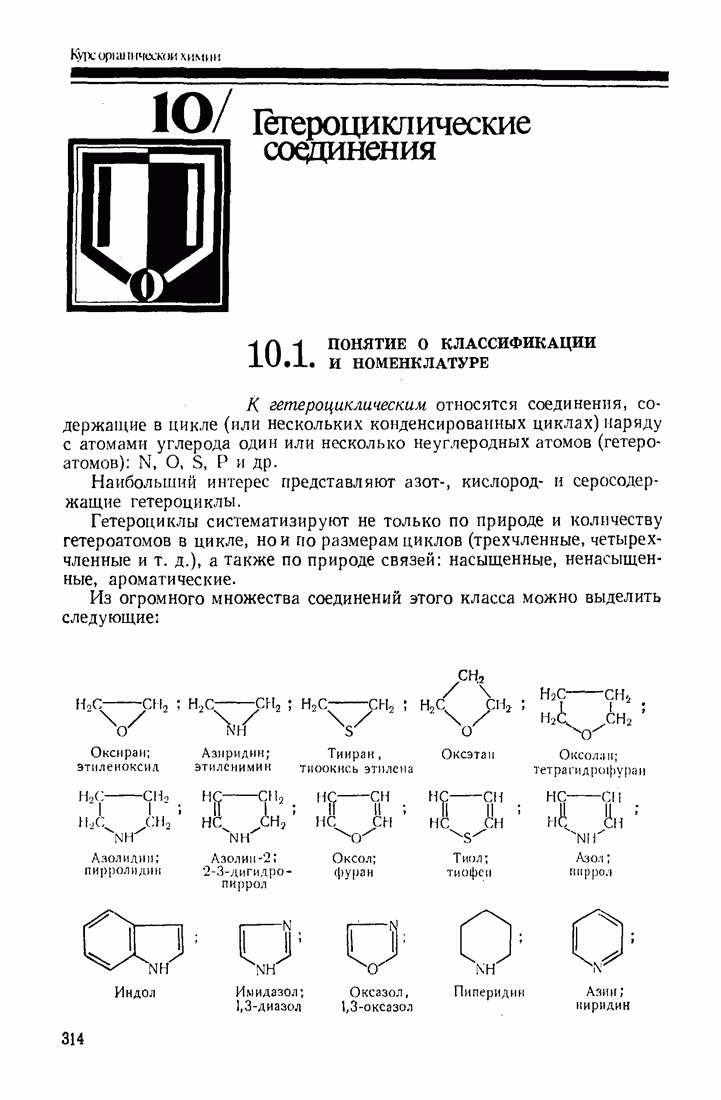
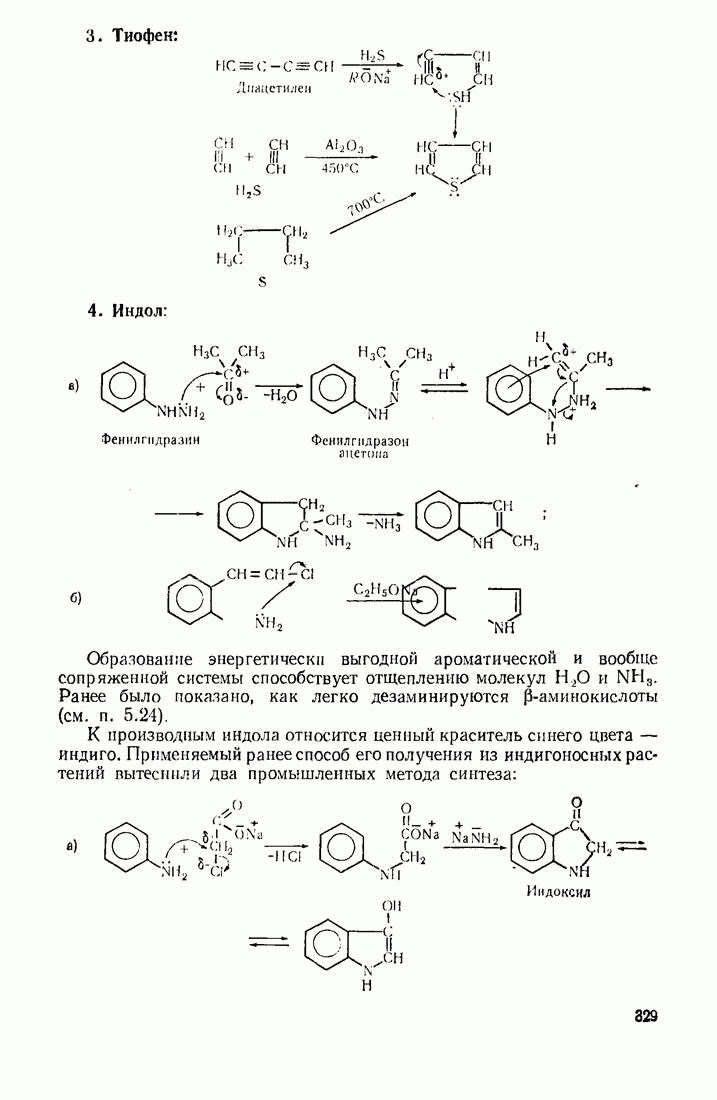
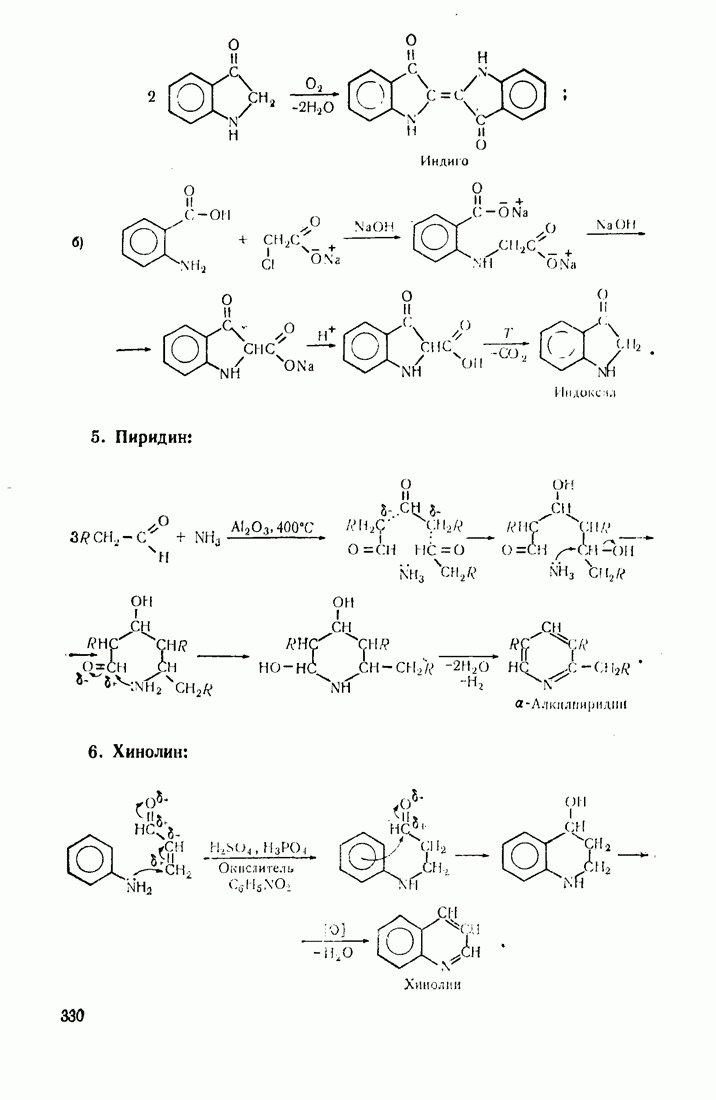
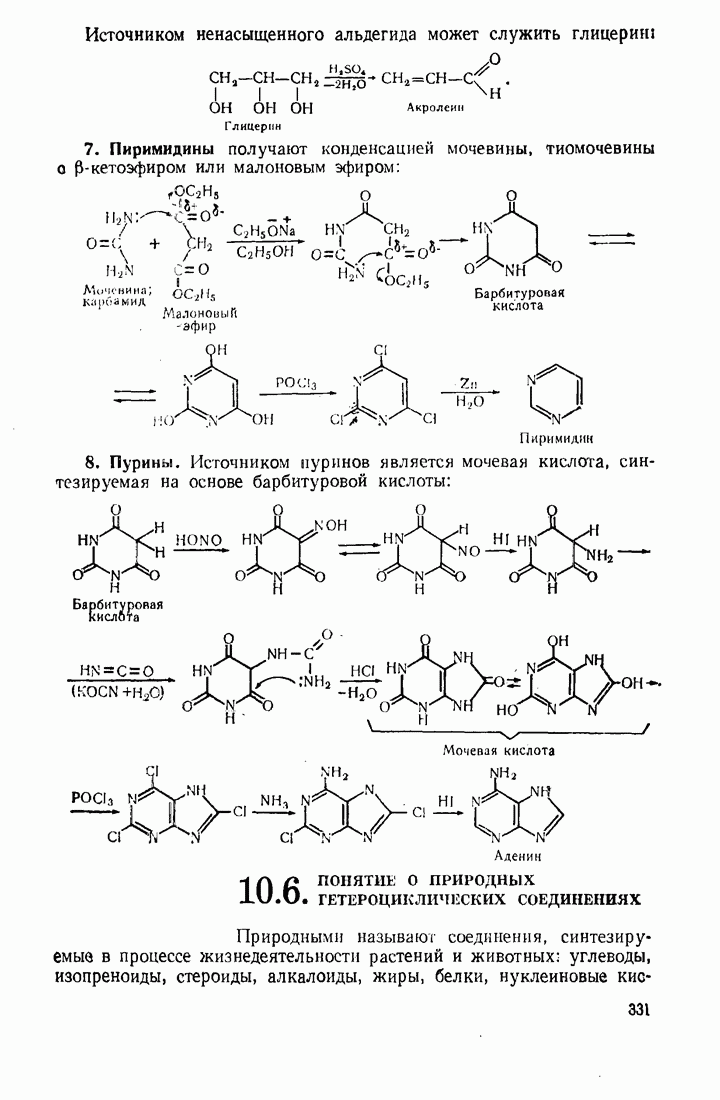
- 10. Гетероциклические соединения
- 10.2. ОБЩАЯ ХАРАКТЕРИСТИКА СТРОЕНИЯ И РЕАКЦИОННОЙ СПОСОБНОСТИ
- 10.3. ПЯТИ- И ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С ОДНИМ ГЕТЕРОАТОМОМ
- 10.4. ГЕТЕРОЦИКЛЫ С НЕСКОЛЬКИМИ ГЕТЕРОАТОМАМИ
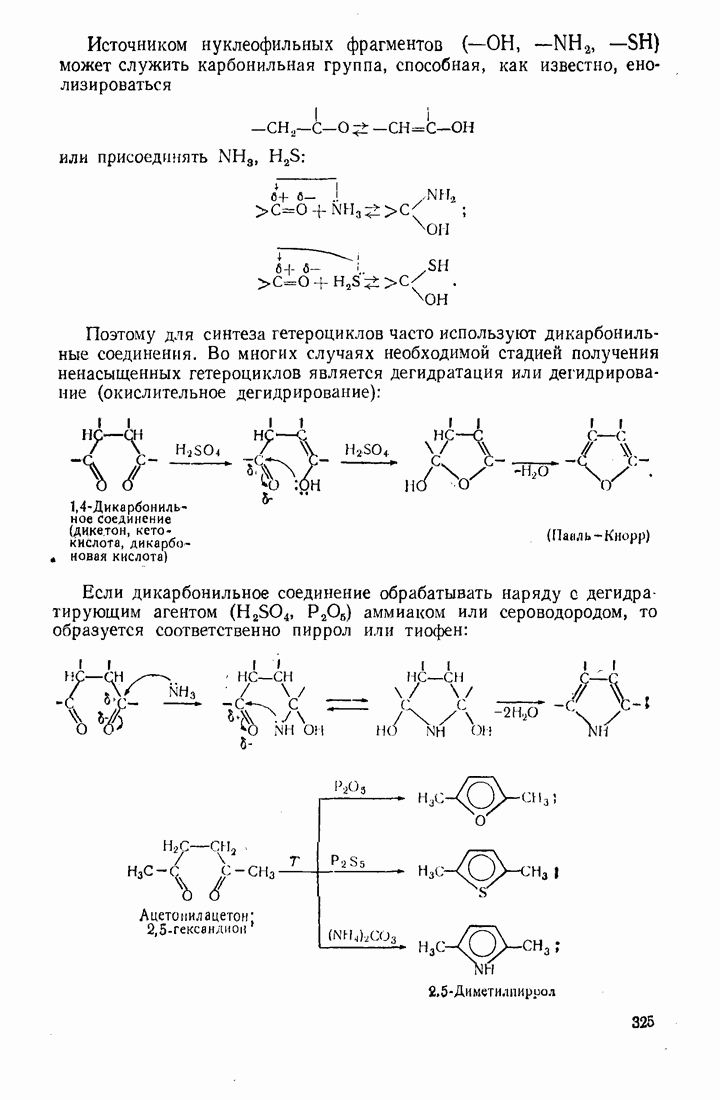
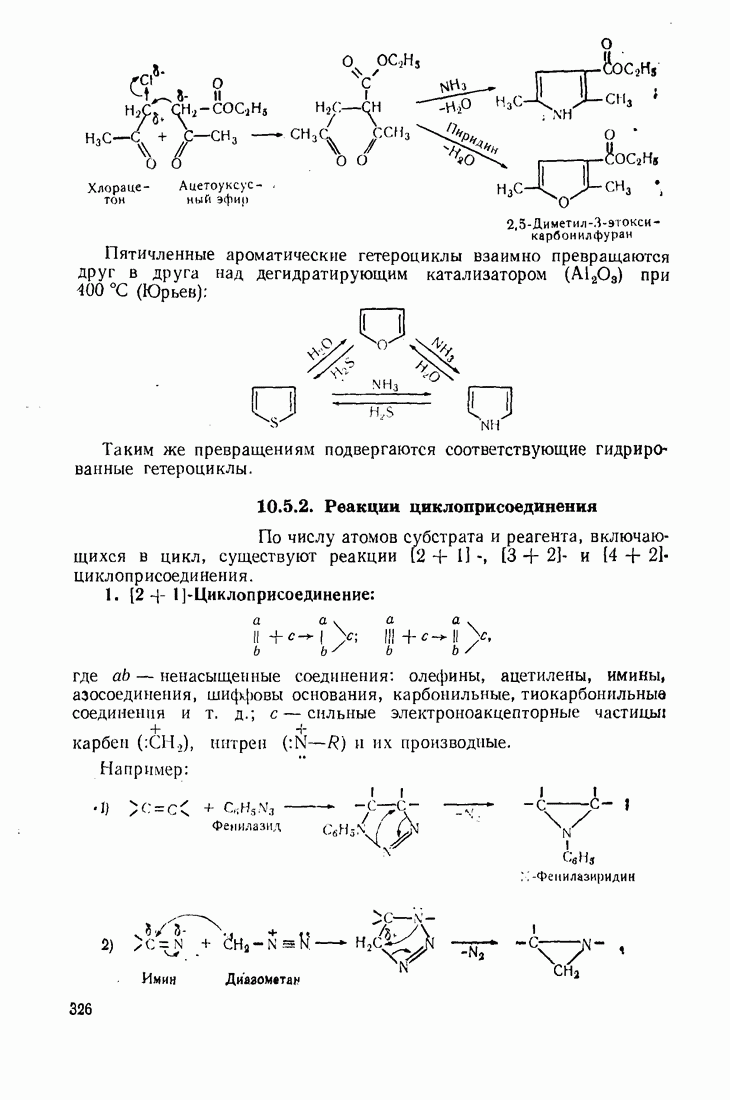
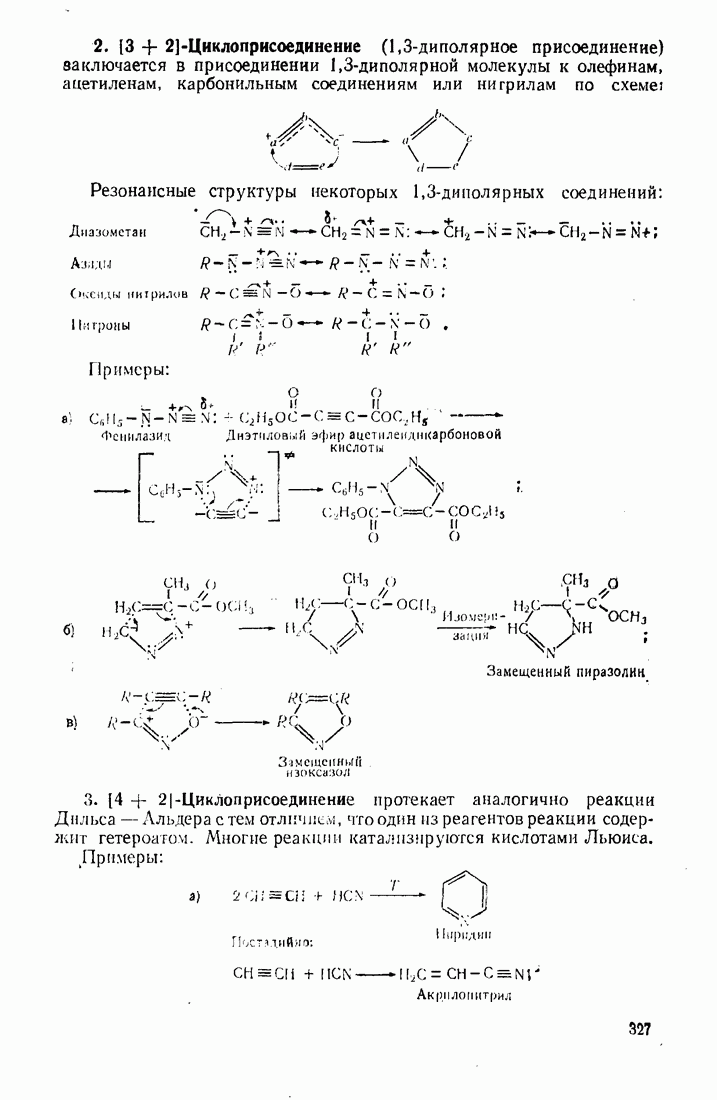
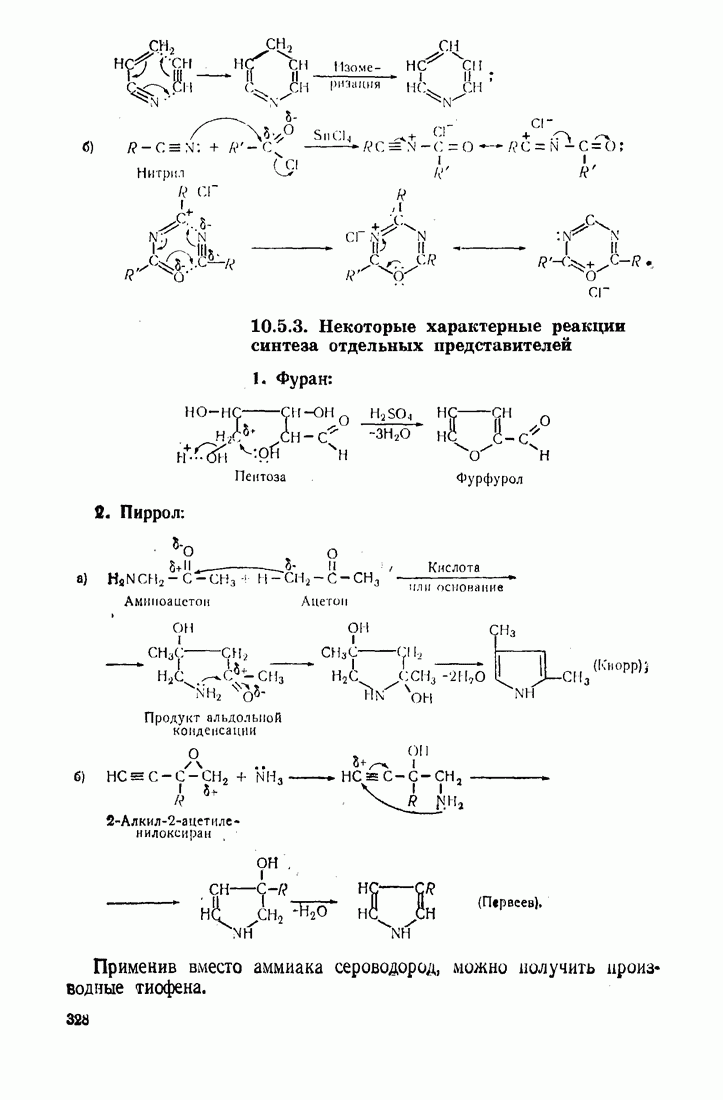
- 10.5. МЕТОДЫ СИНТЕЗА ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
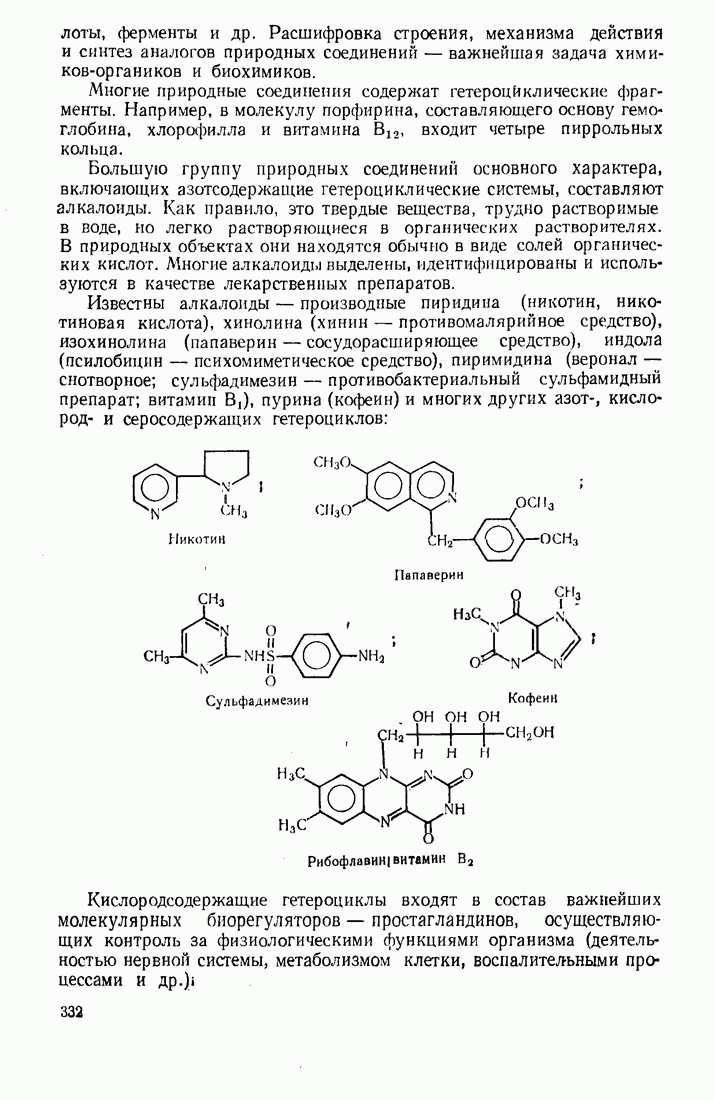
- 10.6. П0НЯТИЕ О ПРИРОДНЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЯХ
- 11. Зпементоорганические соединения
- 11.2. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ НЕКОТОРЫХ НЕМЕТАЛЛОВ
- 11.3. МЕГАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- 11.4. ОРГАНИЧЕСКИЕ ПРОИЗВОДНЫЕ ПЕРЕХОДНЫХ МЕТАЛЛОВ
- 12. Сырье и основные направления развития промышленности органического синтеза
- 12.1.1. Нефть и сопутствующий природный газ
- 12.1.2. Углехимическое сырье
- 12.1.3. Лесохимическое и сельскохозяйственное сырье
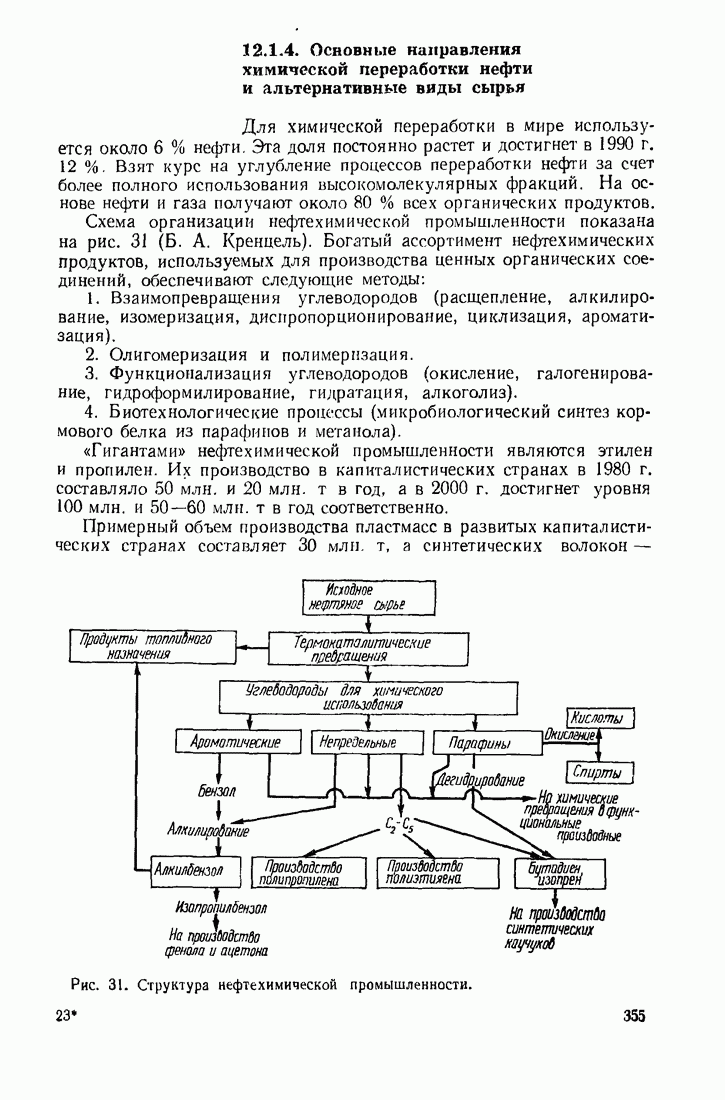
- 12.1.4. Основные направления химической переработки нефти и альтернативные виды сырья
- 12.2. ПУТИ ИСПОЛЬЗОВАНИЯ УГЛЕВОДОРОДОВ И ИХ ПРОИЗВОДНЫХ
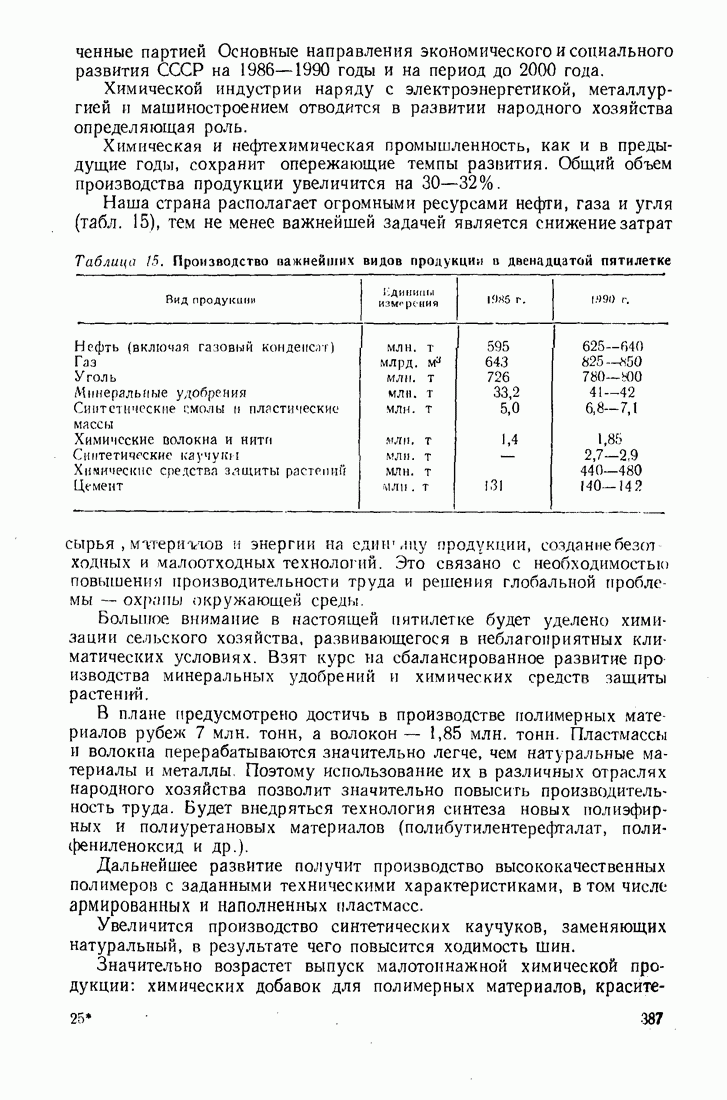
- 12.3. РАЗВИТИЕ ХИМИЧЕСКОЙ ПРОМЫШЛЕННОСТИ В СССР В ДВЕНАДЦАТОЙ ПЯТИЛЕТКЕ