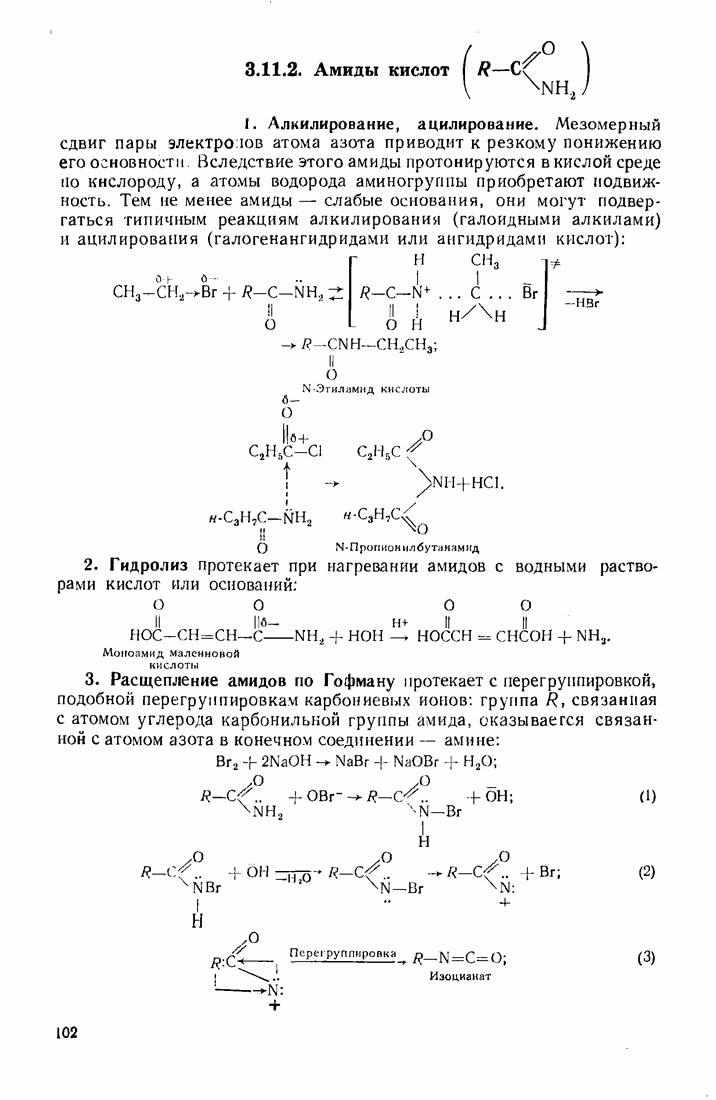
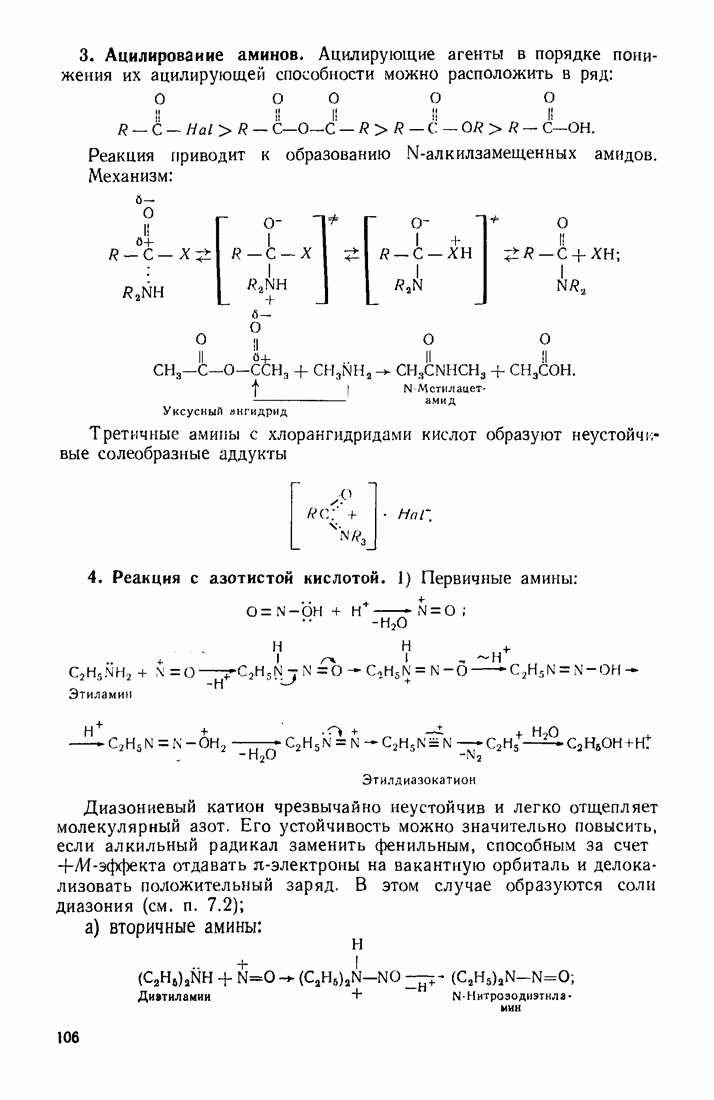
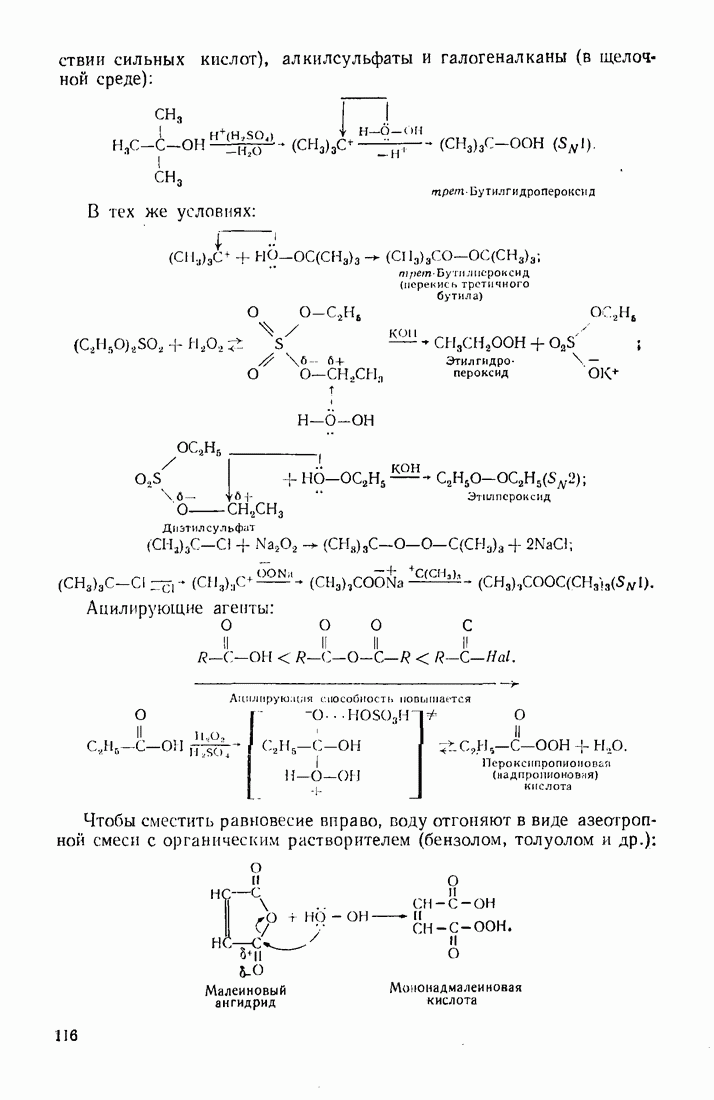
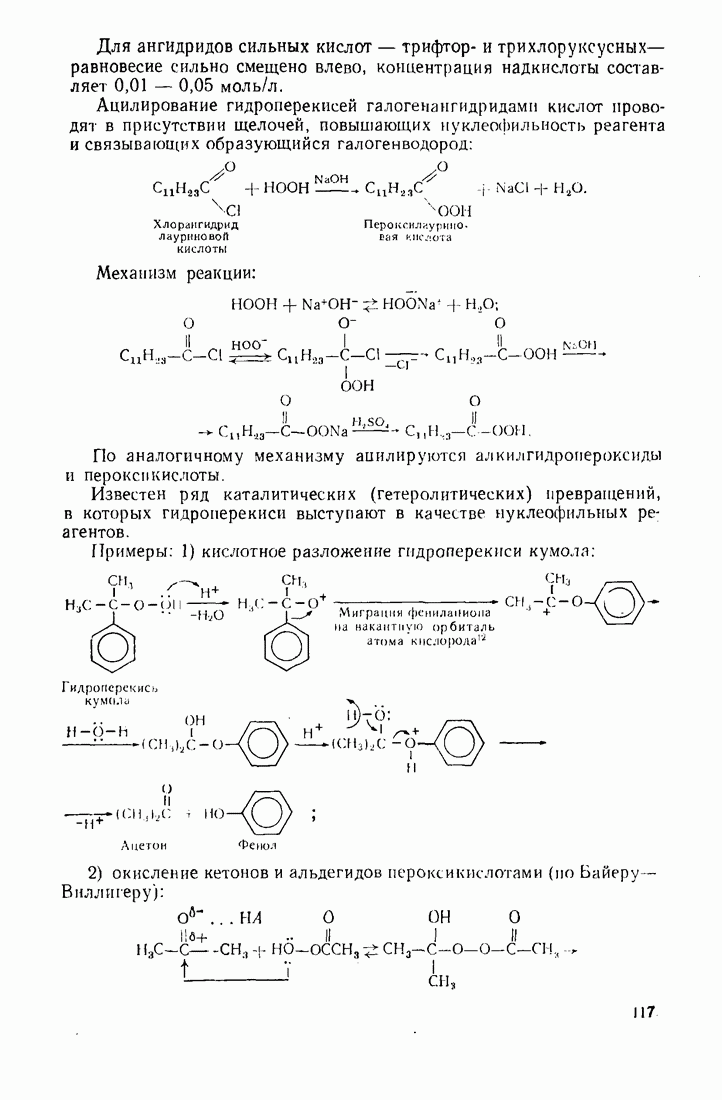
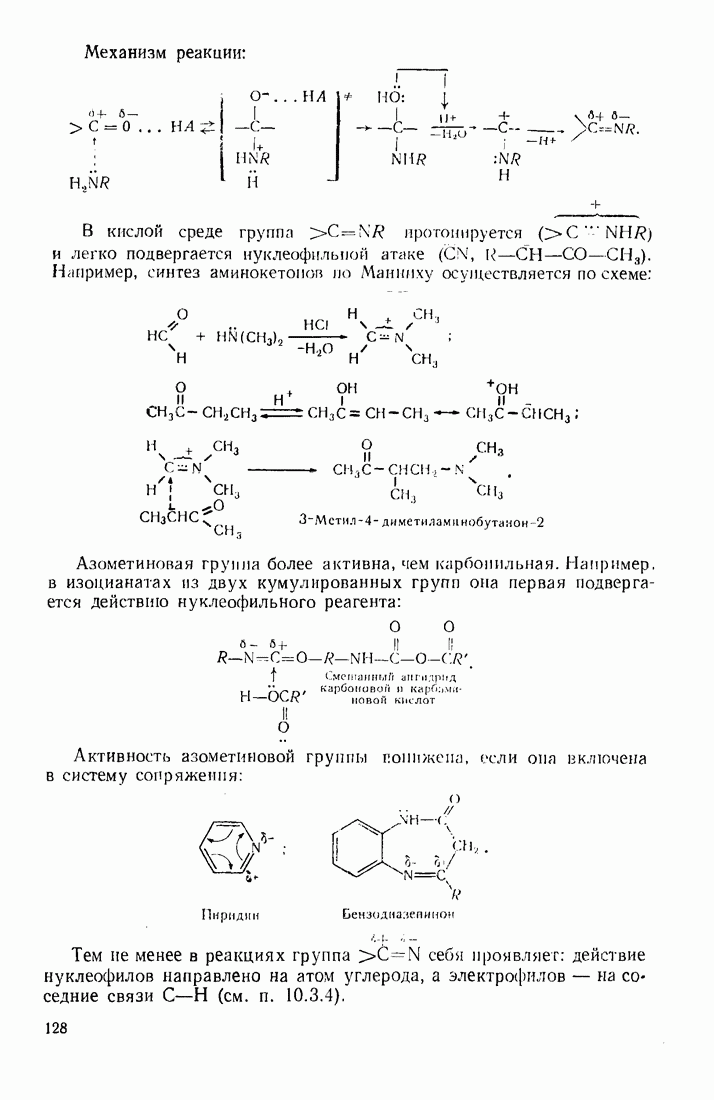
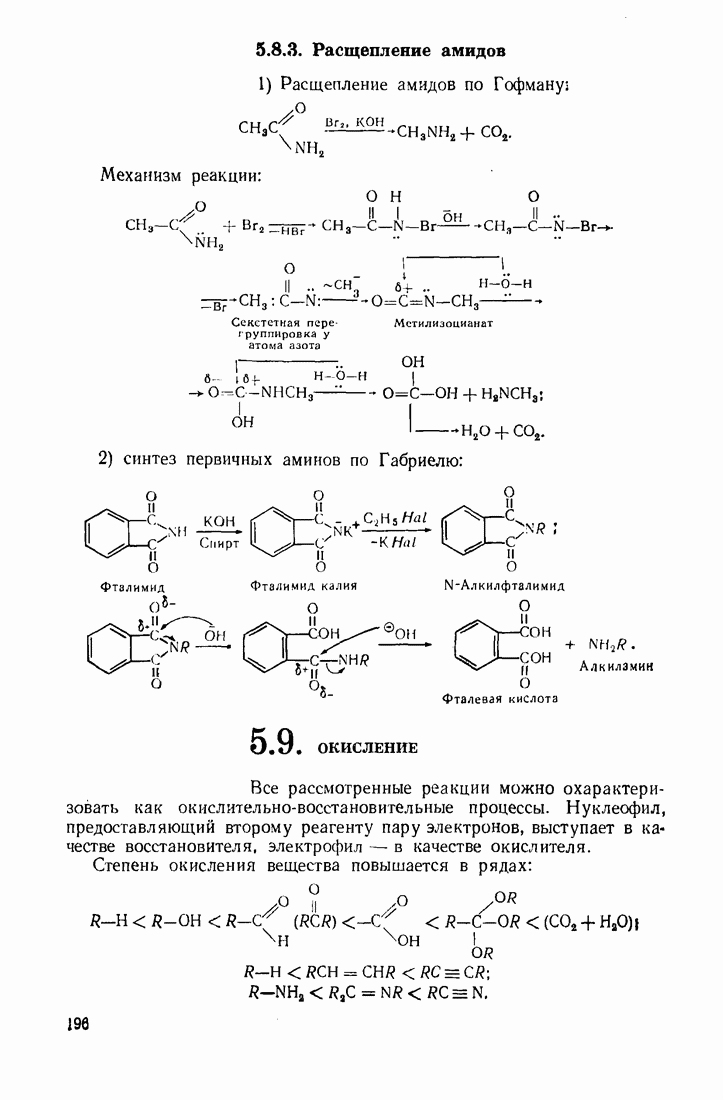
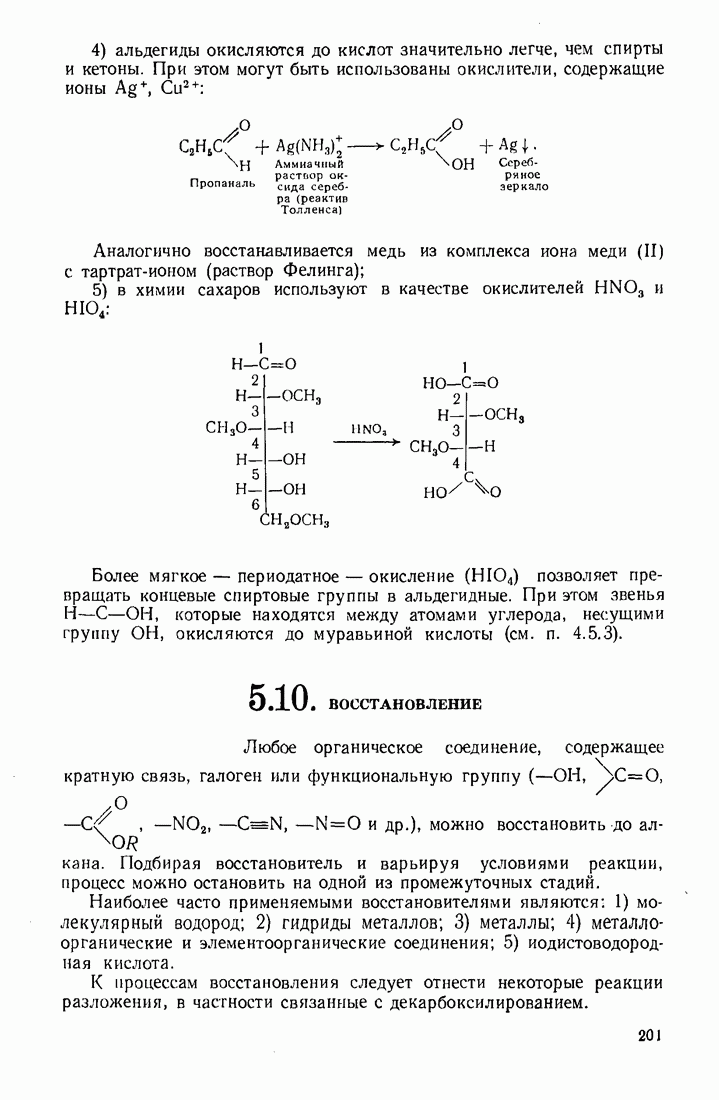
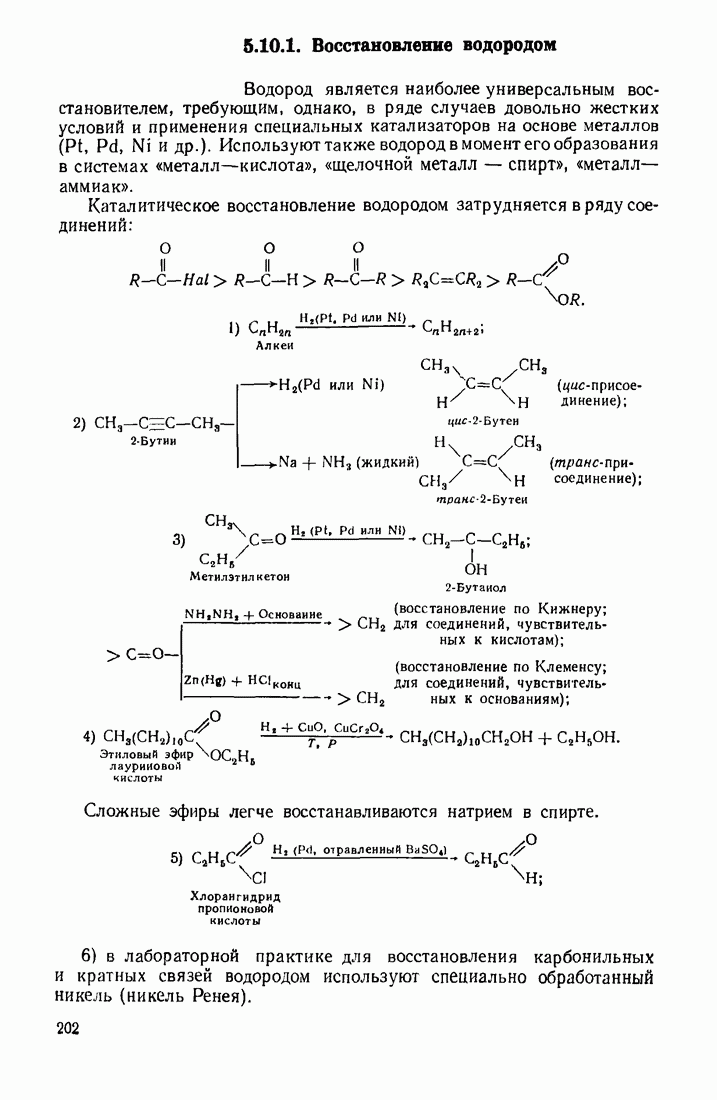
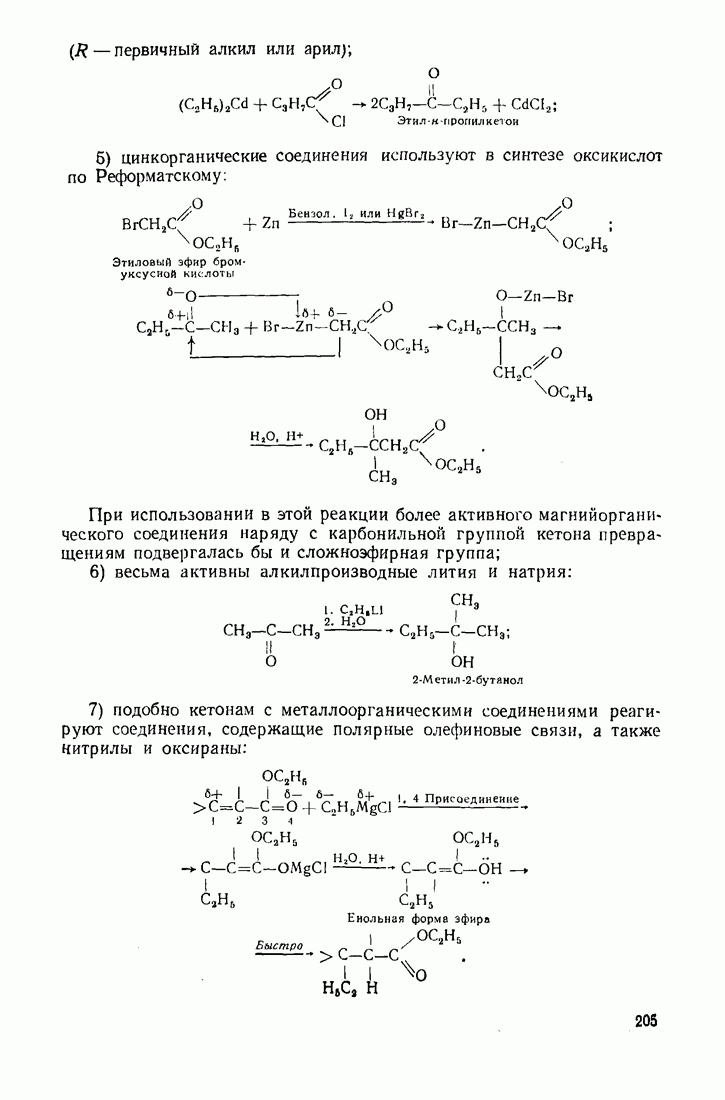
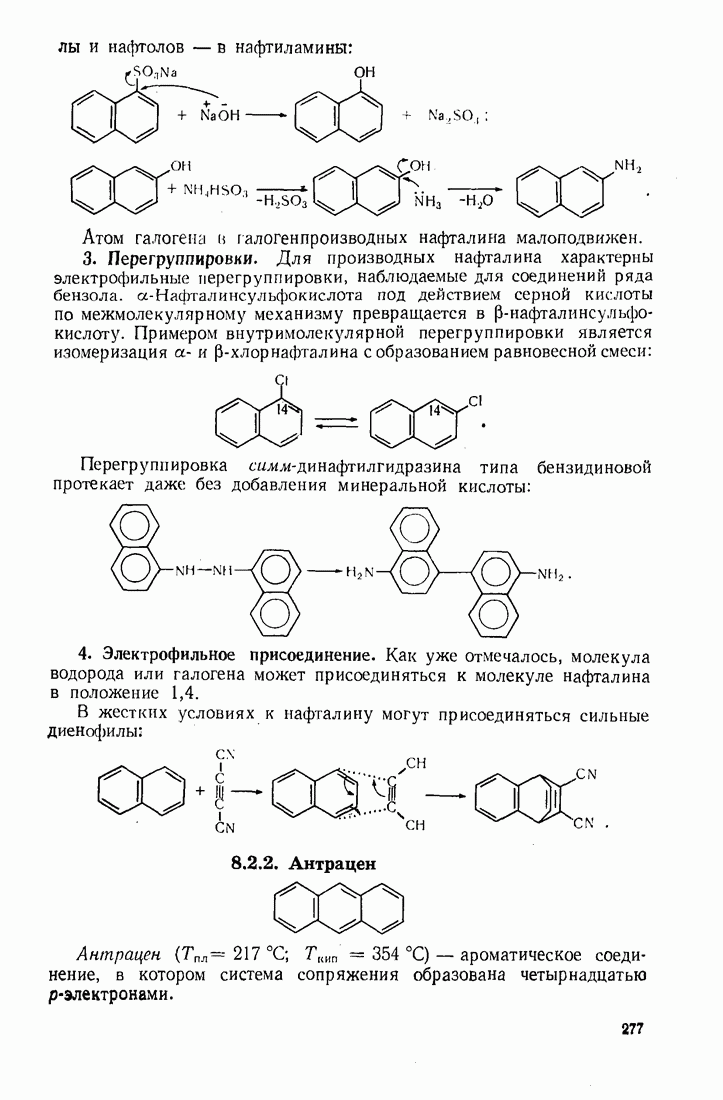
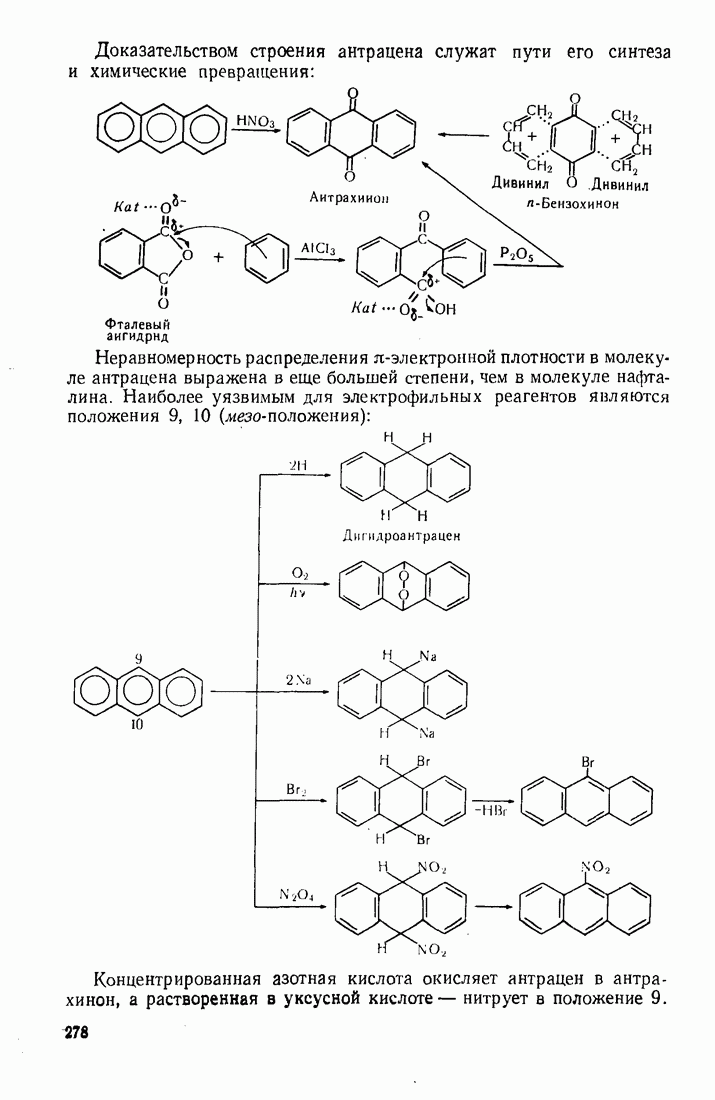
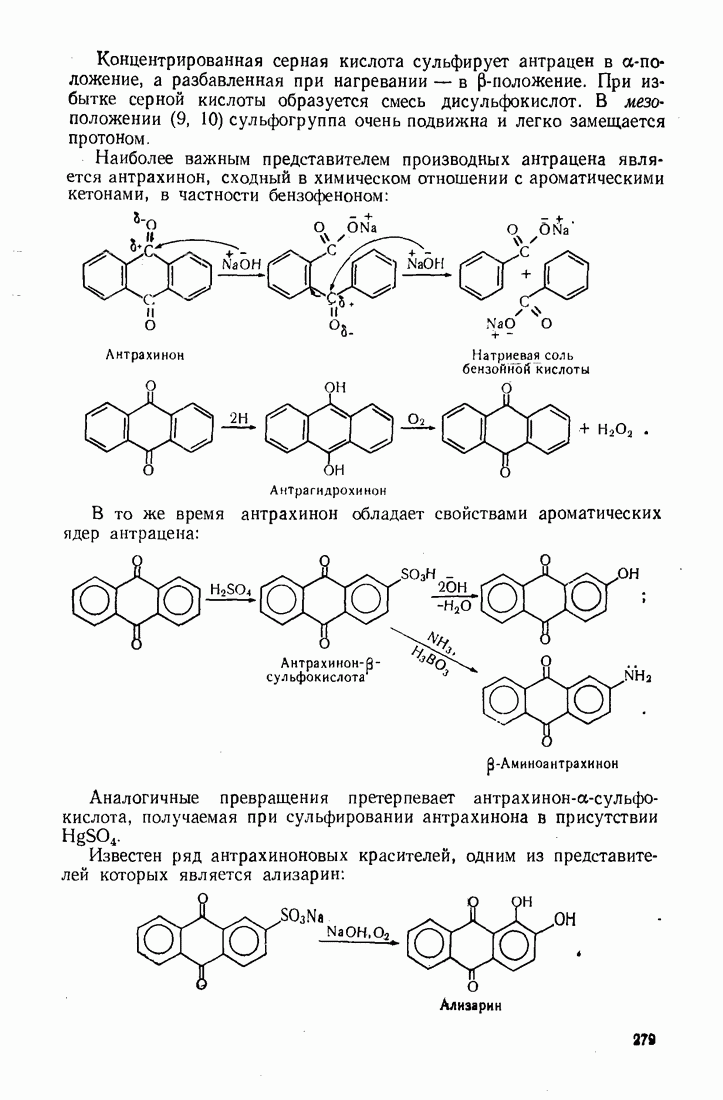
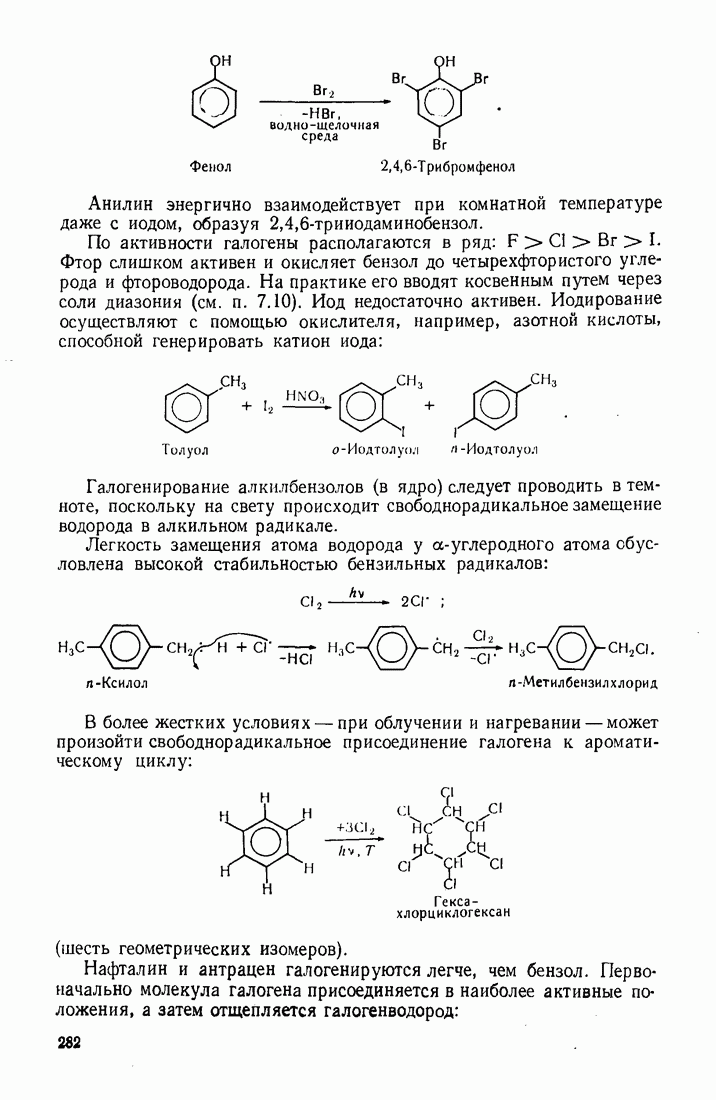
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
6.5. КАТАЛИЗ ОРГАНИЧЕСКИХ РЕАКЦИЙ
Катализ — это ускорение реакции в присутствии веществ (катализаторов), которые участвуют в промежуточных стадиях, но полностью регенерируются в конце процесса. Известно также явление отрицательного катализа, связанное с тем, что некоторые вещества тормозят (ингибируют) реакцию.
Катализаторы не сдвигают равновесные процессы влево или вправо, а лишь ускоряют его установление. Катализ может быть гомогенным и гетерогенным. При гетерогенном катализе реакция протекает на границе раздела фаз катализатор — вещество.
Обычно катализатор образует комплекс с субстратом или реагентом, активируя реакционный центр. В соответствии с природой катализаторов и характером электронных перемещений в реакционных системах выделяют несколько типов катализа: кислотно-основный, координационно-комплексный, окислительно-восстановительный и ферментативный.
Кислотный катализ осуществляется типичными Н- и L-кислотами (минеральными, карбоновыми кислотами,  и др.),
и др.),
основный — щелочами, оксидами металлов, аминами и другими L-основаниями. Если в реакции участвуют недиссоциированные молекулы кислоты  или несколько имеющихся в растворе кислот, в том числе сопряженных
или несколько имеющихся в растворе кислот, в том числе сопряженных  то катализ называют общим. Скорость реакции в этом случае зависит от концентрации кислоты.
то катализ называют общим. Скорость реакции в этом случае зависит от концентрации кислоты.
При ускорении реакции протоном, чаще всего в виде  осуществляется так называемый специфический катализ. Скорость реакции определяется активностью водородных ионов и зависит от рН среды.
осуществляется так называемый специфический катализ. Скорость реакции определяется активностью водородных ионов и зависит от рН среды.
Подобные соотношения характеризуют и основный катализ. Каталитическое действие кислот и оснований, как правило, коррелируется с их силой, т. е. константой диссоциации, что выражается с помощью эмпирического уравнения Бренстеда.
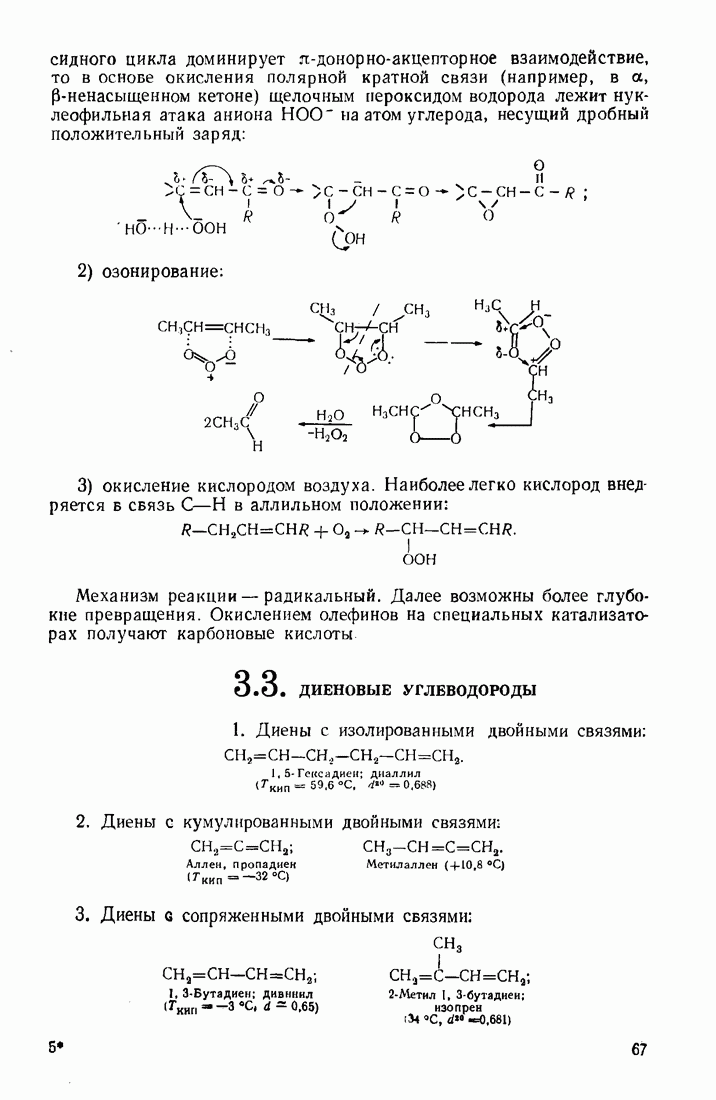
Роль кислотного катализа заключается в основном в активации субстрата. Молекула кислоты или протон координируется по центру, несущему избыточную электронную плотность, усиливает поляризацию субстрата и облегчает атаку нуклеофильного реагента:

Следует, однако, помнить, что кислота не только активизирует субстрат, но и связывает нуклеофил-основание  Поэтому скорость реакции имеет экстремальную зависимость от концентрации кислоты. Максимальная скорость в ряде случаев достигается при полунейтрализации основания, т. е. при
Поэтому скорость реакции имеет экстремальную зависимость от концентрации кислоты. Максимальная скорость в ряде случаев достигается при полунейтрализации основания, т. е. при 
Основание обычно повышает нуклеофильность реагента, усиливая его поляризацию, или генерирует новую нуклеофильную частицу;

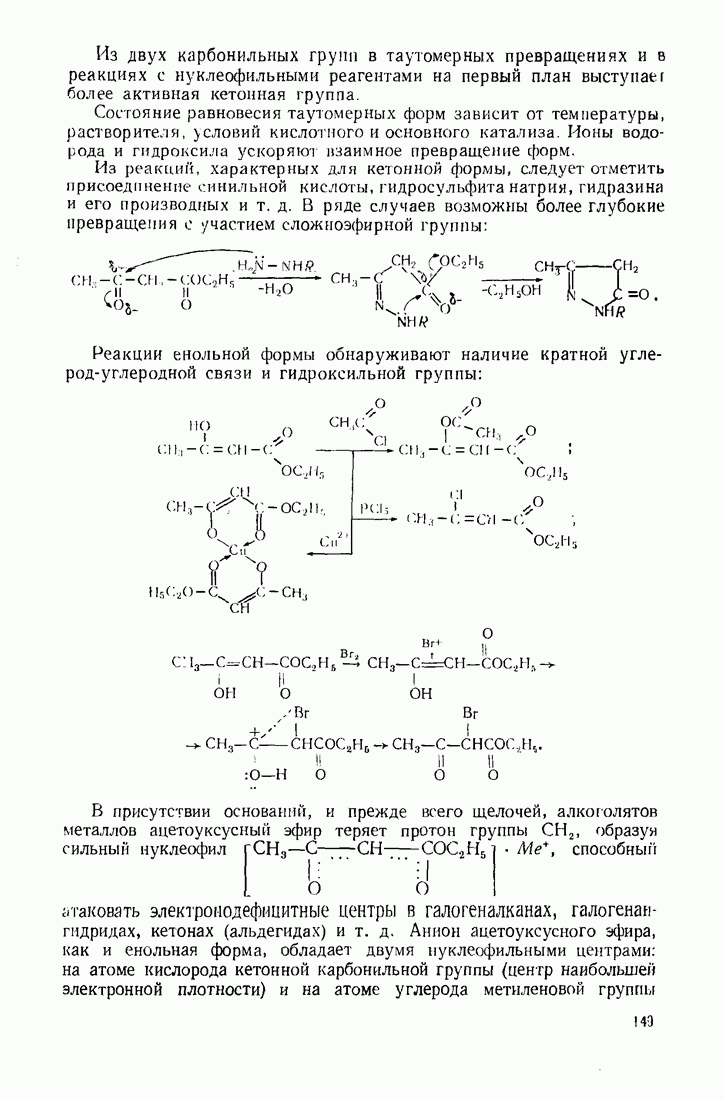
Необходимо также учитывать, что кислоты и основания заключают в себе электрофильную (катион) и нуклеофильную (анион) частицы, способные одновременно участвовать в гетеролитическом процессе и осуществлять таким образом бифункциональный катализ. Например, енолизациюкарбонильных соединений могут вызыватькак  -лоты, так и основания.
-лоты, так и основания.
Под действием катализатора основного характера в некоторых случаях возможна активизация субстрата (электрофильной компоненты). Этот тип катализа называется нуклеофильным. Например,
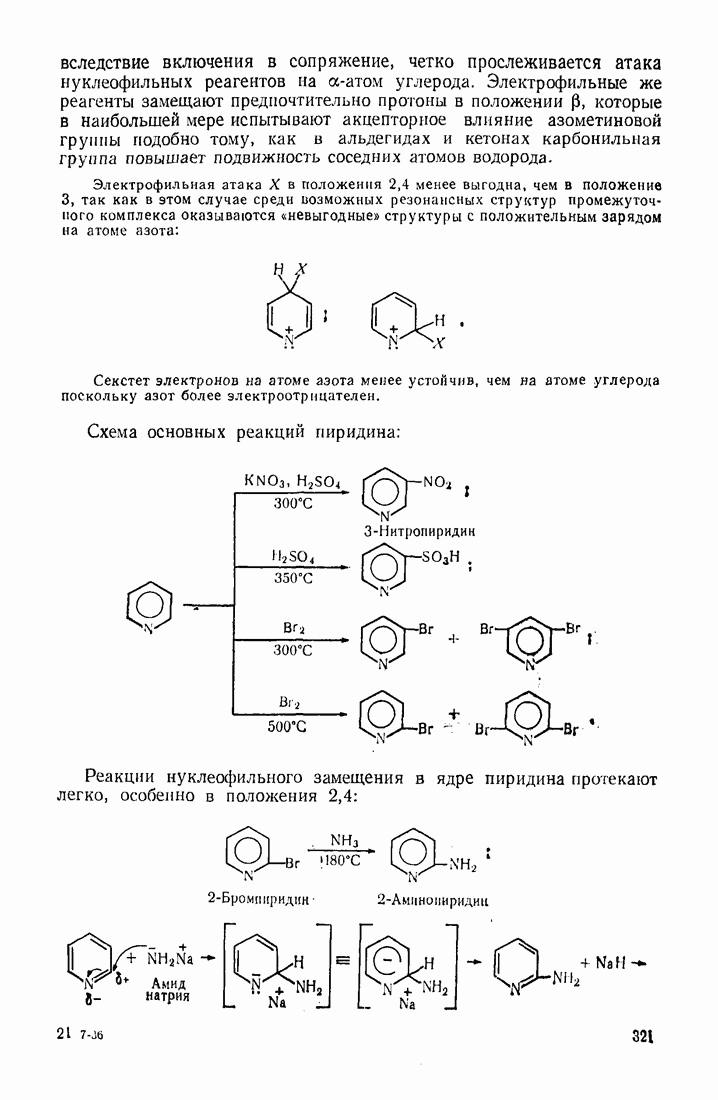
реакция ацилирования анилина значительно ускоряется аминами, пиридином, оксидом пиридина и протекает по схеме:

Нуклеофильный катализ проявляется в тех случаях, когда: 1) катализатор по нуклеофильности превосходит реагент; 2) промежуточный продукт (I) более активен, чем исходный электрофильный реагент, и термодинамически менее устойчив, чем конечный продукт.
Нуклеофнльность не всегда равнозначна основности. Так, основность пиридина на пять порядков выше основности окиси пиридина, однако по каталитической активности окись пиридина значительно сильнее. Здесь играют роль стерические эффекты, поляризуемость катализатора и другие факторы.
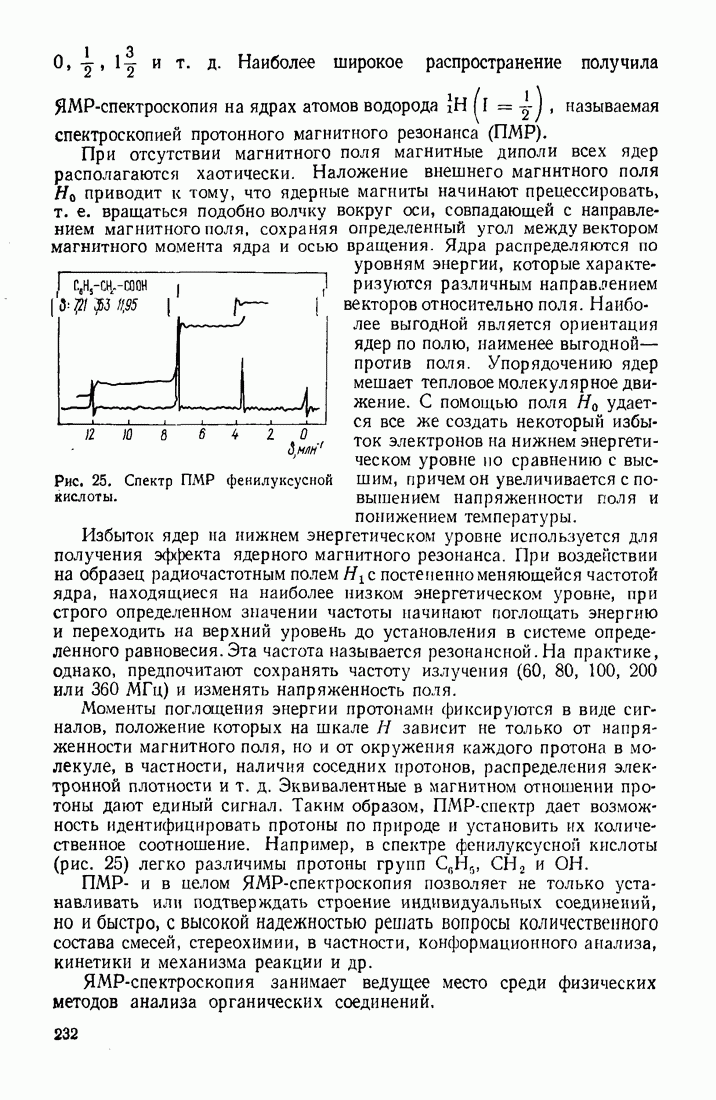
Нуклеофильный и общий основный катализы кинетически трудно различимы.
Координационно-комплексный катализ осуществляется в тех случаях, когда кислоты и основания Льюиса, выступающие в роли катализаторов, образуют с одним из реагентов донорно-акцепторный комплекс, зачастую довольно стабильный. В ходе реакции и субстрат, и реагент оказываются включенными в координационную сферу катализатора, исходное состояние которого восстанавливается после образования конечного продукта.
Большей частью для катализа используются соединения переходных металлов VIII группы  и др.). Координационное число их комплексов изменяется от 2 до 8.
и др.). Координационное число их комплексов изменяется от 2 до 8.
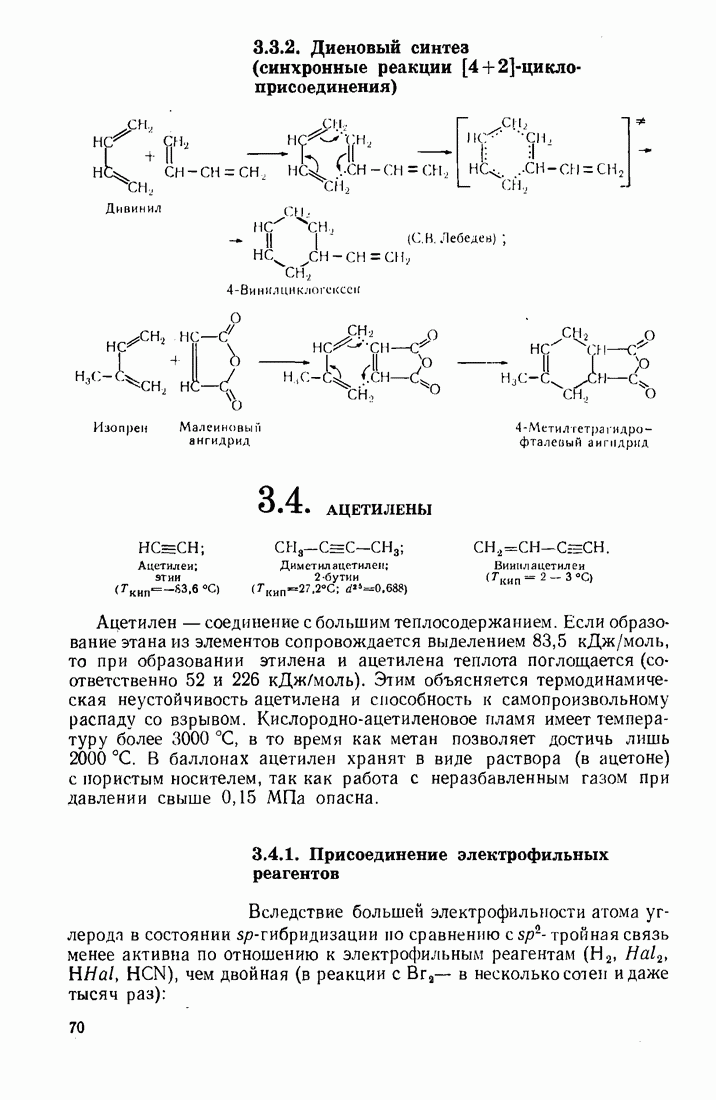
В числе многих реакций, основанных на использовании координационно-комплексного катализа, можно назвать следующие:
1. Гидратация ацетилена в присутствии солей 
2. Гидрирование олефинов (катализаторы — комплексы 
3. Полимеризация олефинов (катализатор Циглера-Натта).
4. Оксосинтез  (катализаторы — комплексы Со).
(катализаторы — комплексы Со).
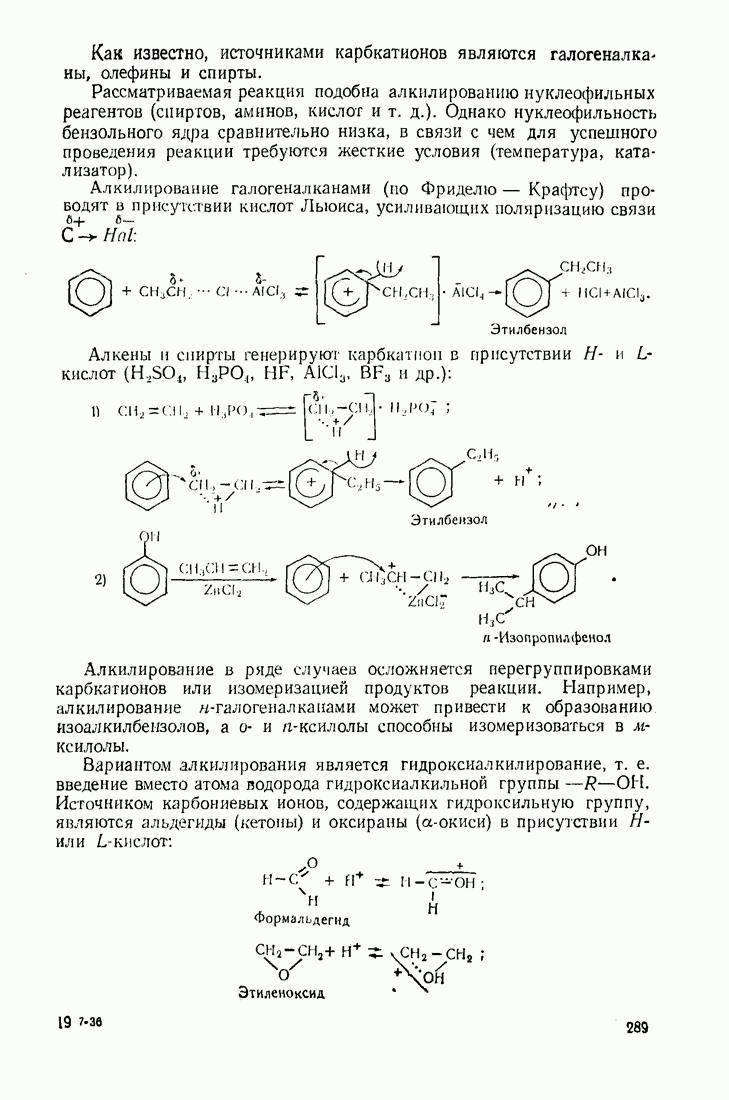
5. Алкилирование и ацилирование ароматических соединений по Фриделю — Крафтсу (катализатор 
Окислительно-восстановительный катализ наблюдается в радикальных процессах и связан с одноэлектронными переходами между катализатором и реагентами. В качестве катализаторов используются металлы 4—6 периодов таблицы Менделеева с незаполненными  -оболочками
-оболочками  и др.), а также некоторые их оксиды и сульфиды.
и др.), а также некоторые их оксиды и сульфиды.
Применение таких катализаторов часто сопряжено с использованием источников стабильных радикалов (инициаторов): в зависимости от природы и валентного состояния катализатор может принимать или отдавать электрон, стимулируя процесс образования радикалов, продолжающих цепь.
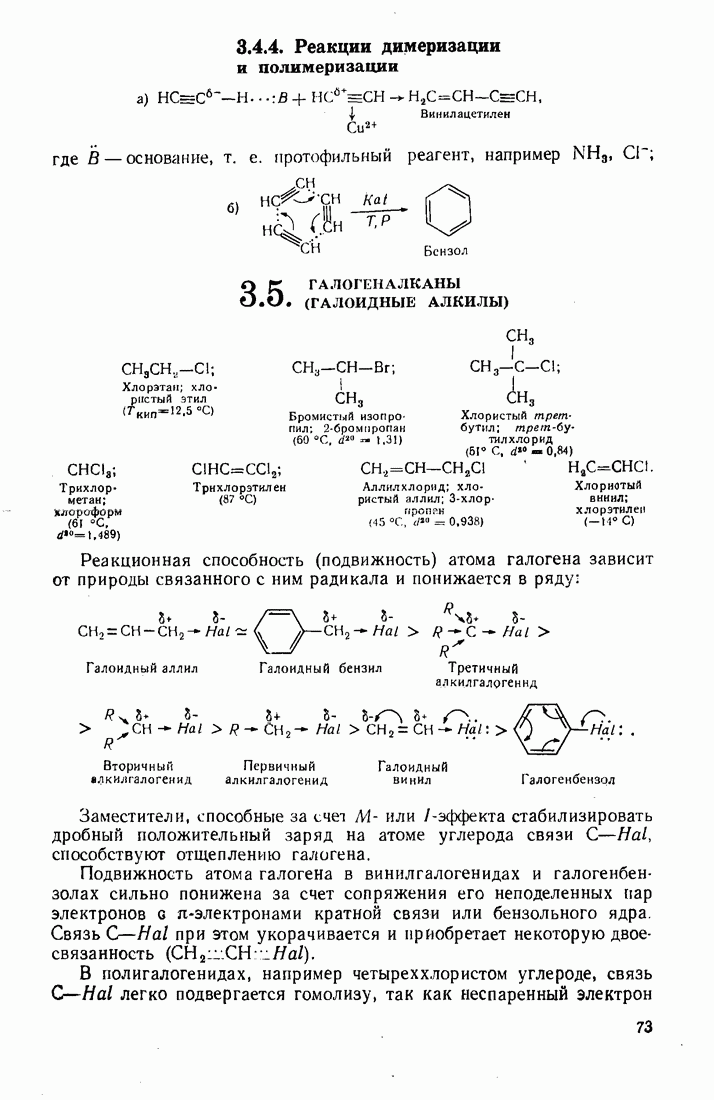
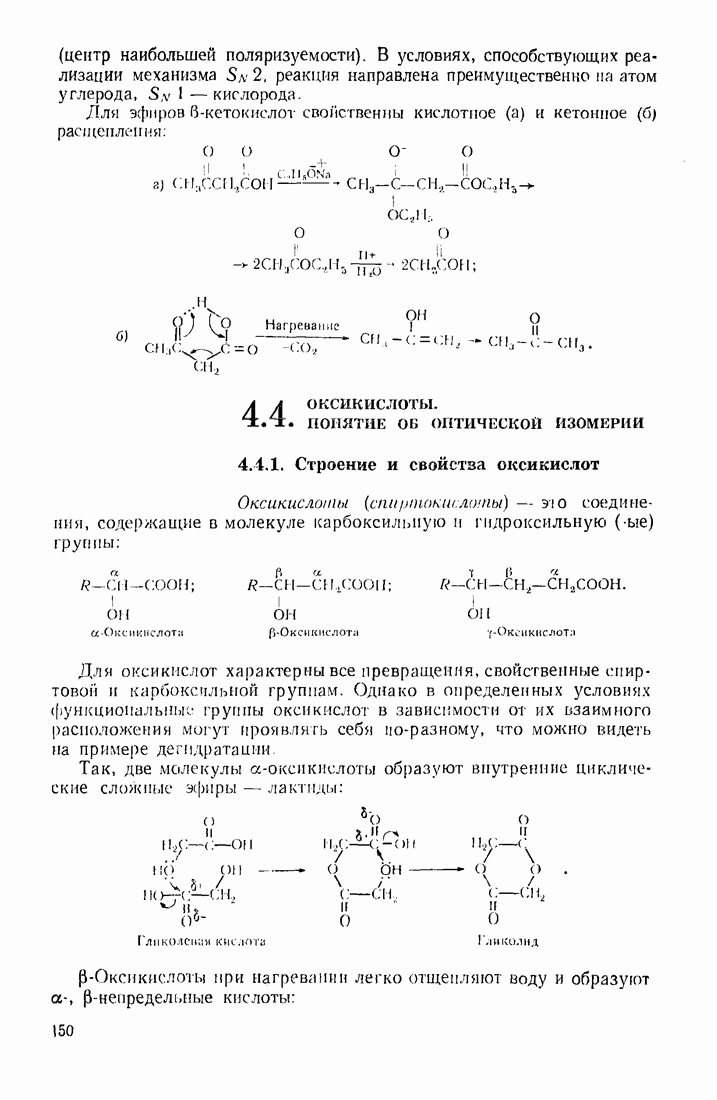
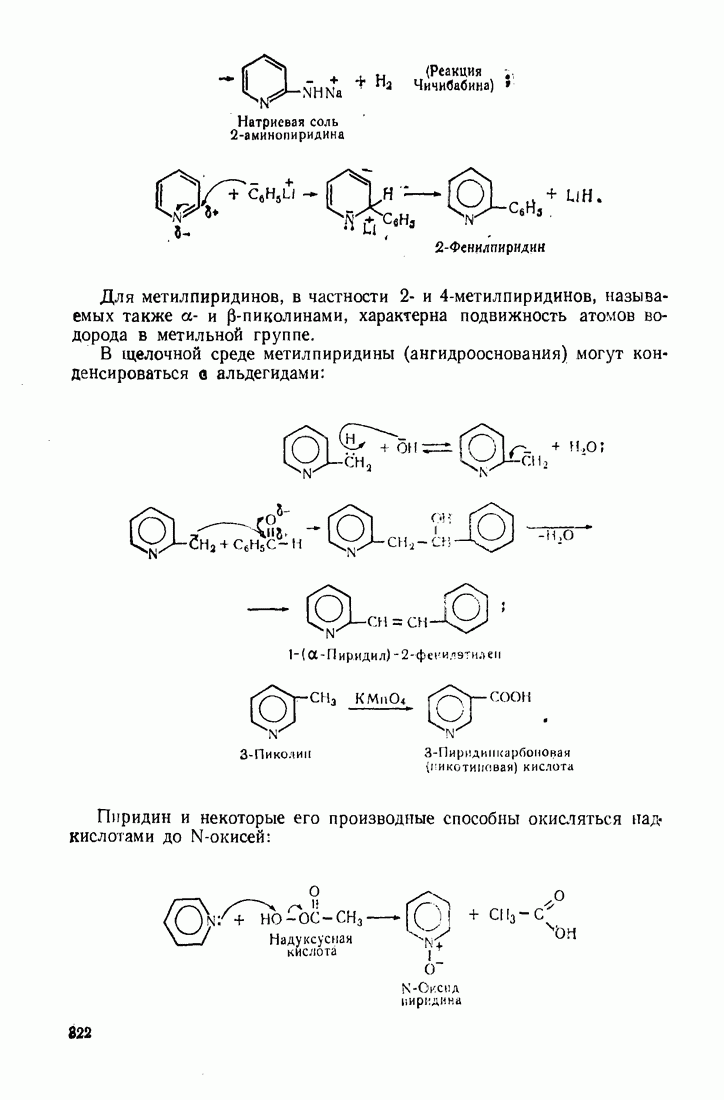
Так, тяжелые металлы катализируют автоокисление альдегидов, превращая богатый энергией радикал водорода в протон:

Выгодным для системы является также превращение радикала  в гидроксил-анион, что инициирует радикальные реакции с участием перекисей:
в гидроксил-анион, что инициирует радикальные реакции с участием перекисей:

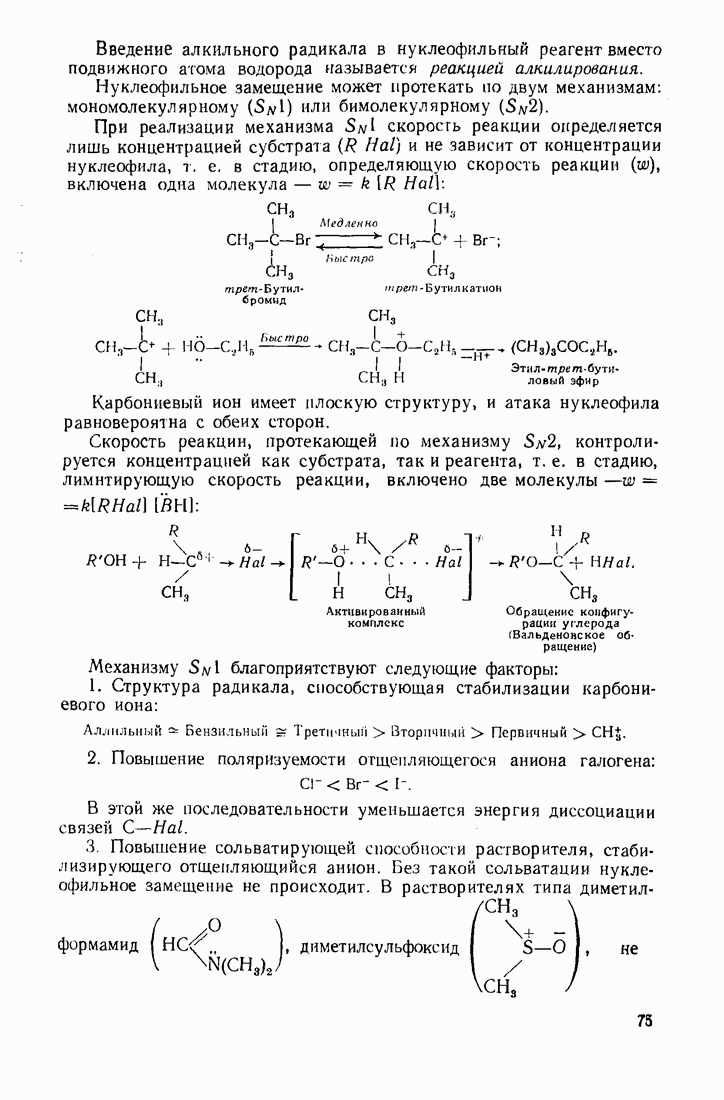
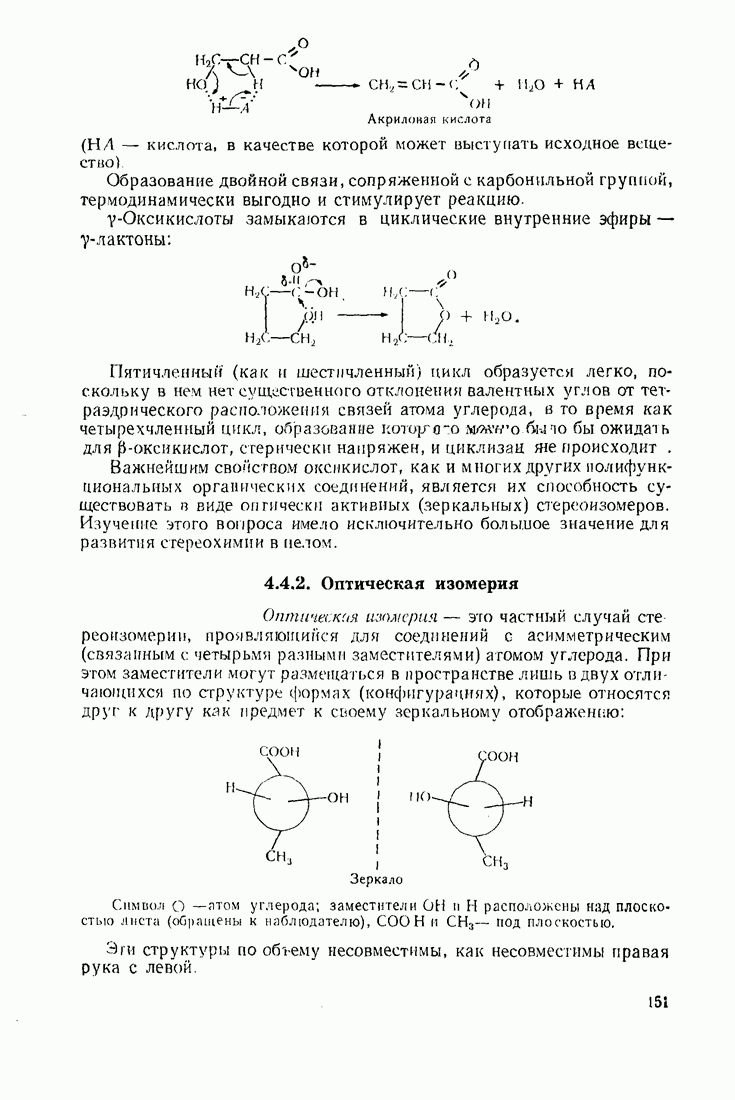
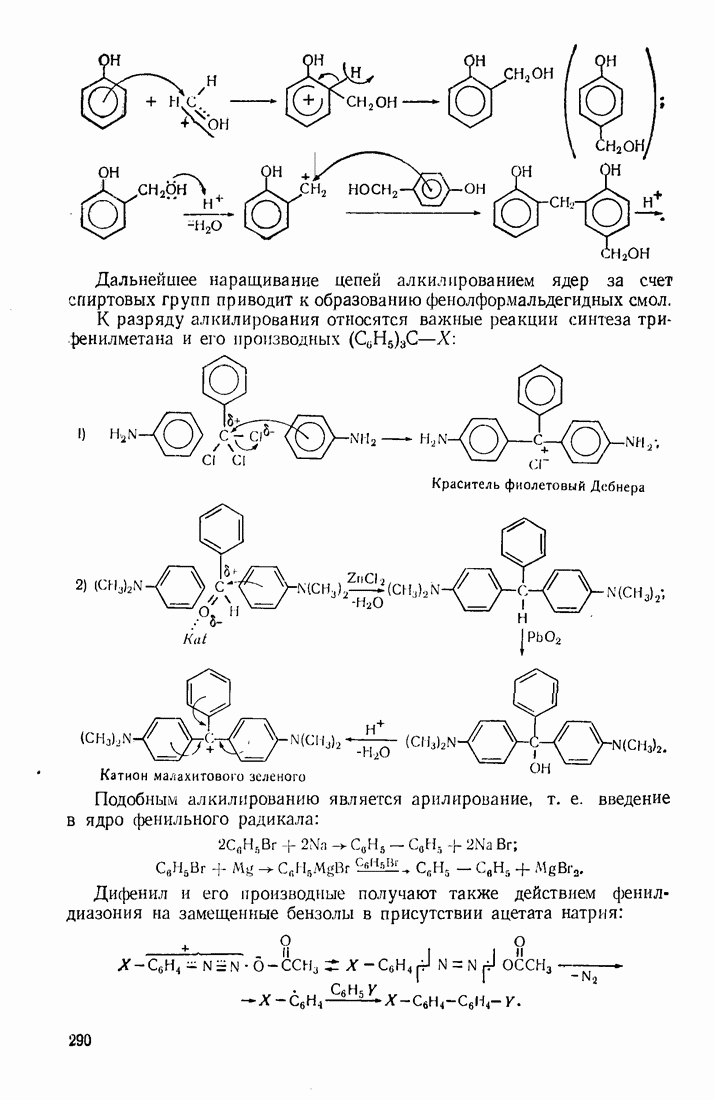
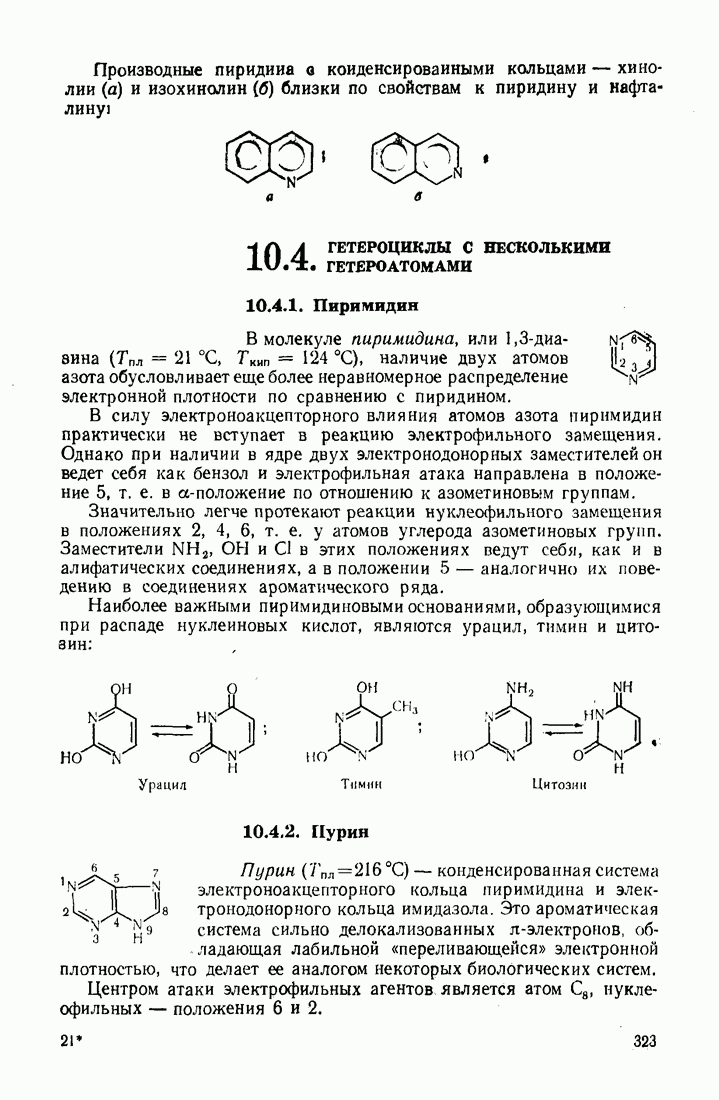
Ион металла  выступает в качестве носителя цепи радикальных превращений в реакциях распада солей диазония:
выступает в качестве носителя цепи радикальных превращений в реакциях распада солей диазония:

Ферментативный катализ осуществляется в биологических системах и представляет собой чрезвычайно сложное и разнообразное явление. Он может заключать в себе элементы трех вышеупомянутых типов катализа.
Особенностью ферментативного катализа является матричный эффект. Каталитический центр «вмонтирован» в матрицу сложного сочетания макромолекул, которая подходит, как ключ к замку, лишь к строго определенной системе реагентов. Это обусловливает чрезвычайно высокую селективность катализа в биологических объектах, причем один активный центр катализатора может вызвать сотни тысяч превращений.
| << Предыдущий параграф | Следующий параграф >> |
- Предисловие
- 1. Введение
- 1.1. Предмет органической химии
- 1.2. Основные этапы развития органической химии
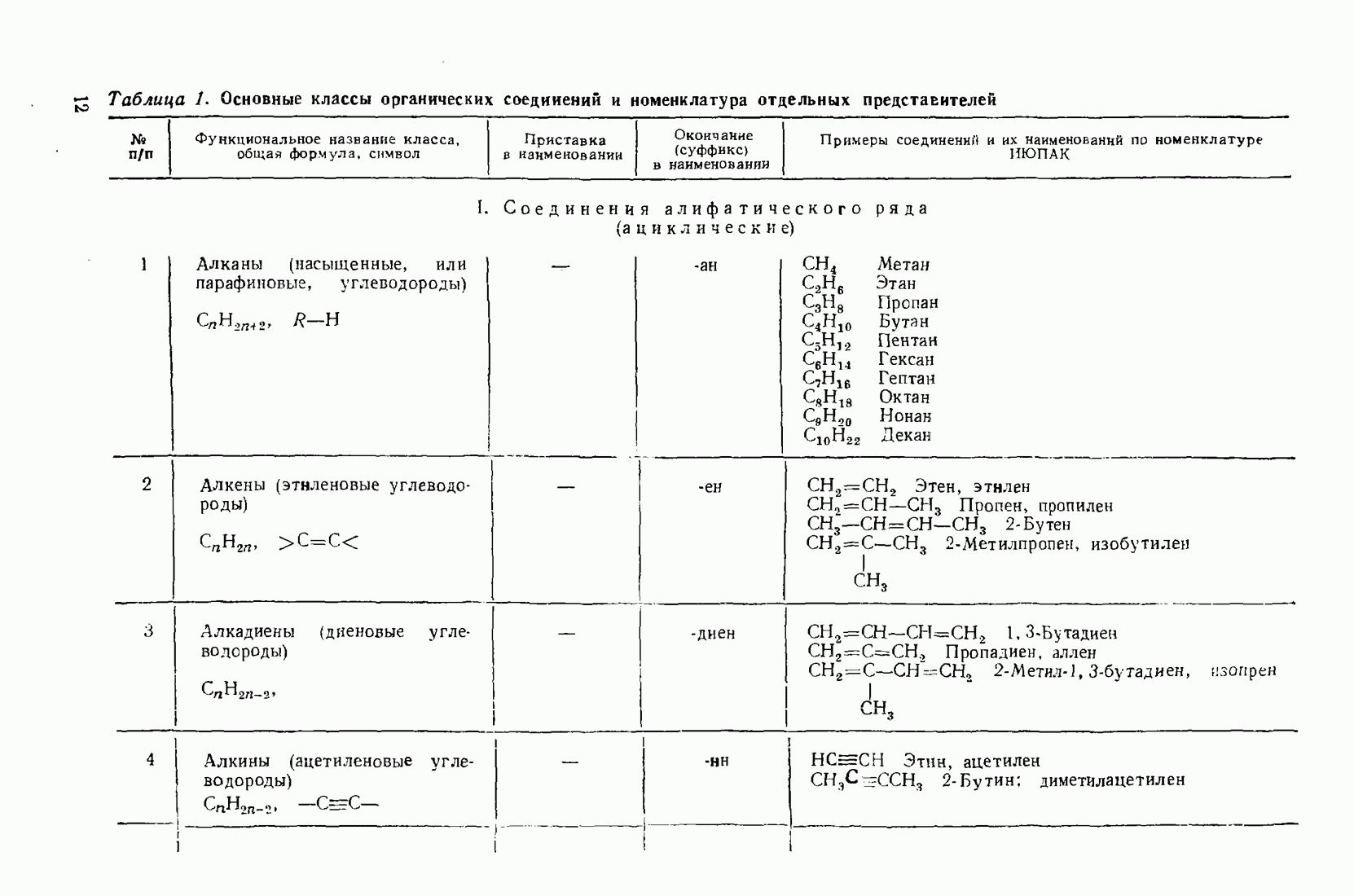
- 1.3. Классификация и номенклатура органических соединений
- 2 Общие теоретические положения органической химии
- 2.1. Природа химической связи
- 2.1.1. Типы химических связей
- 2.1.2. Молекулярные орбитали
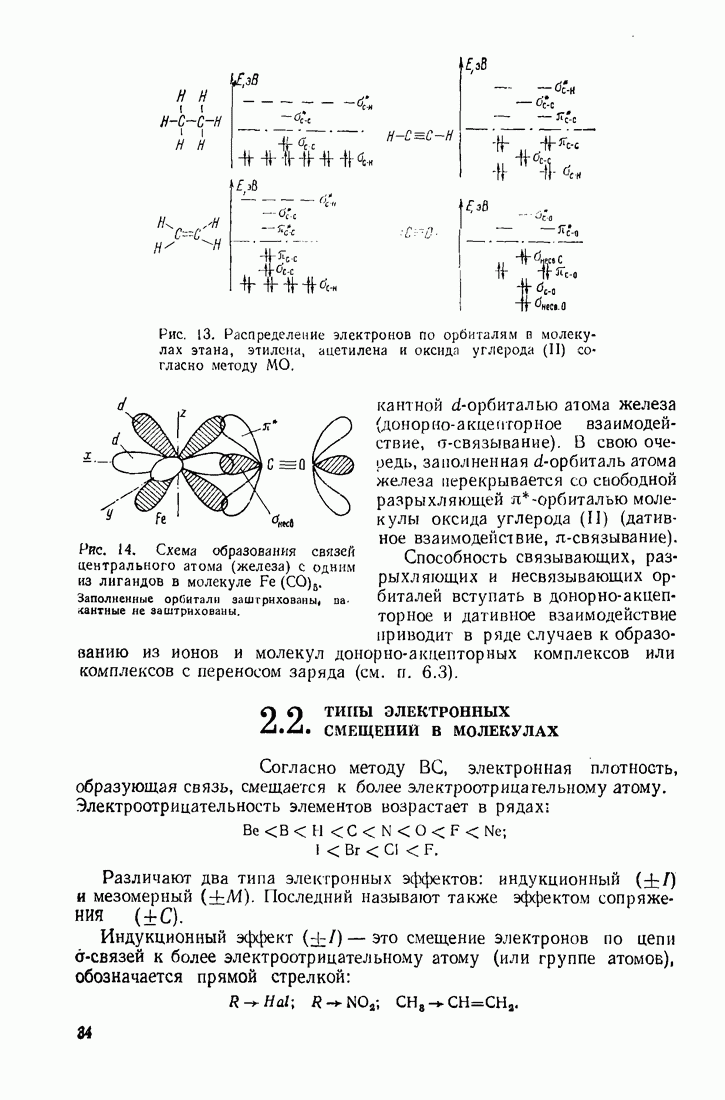
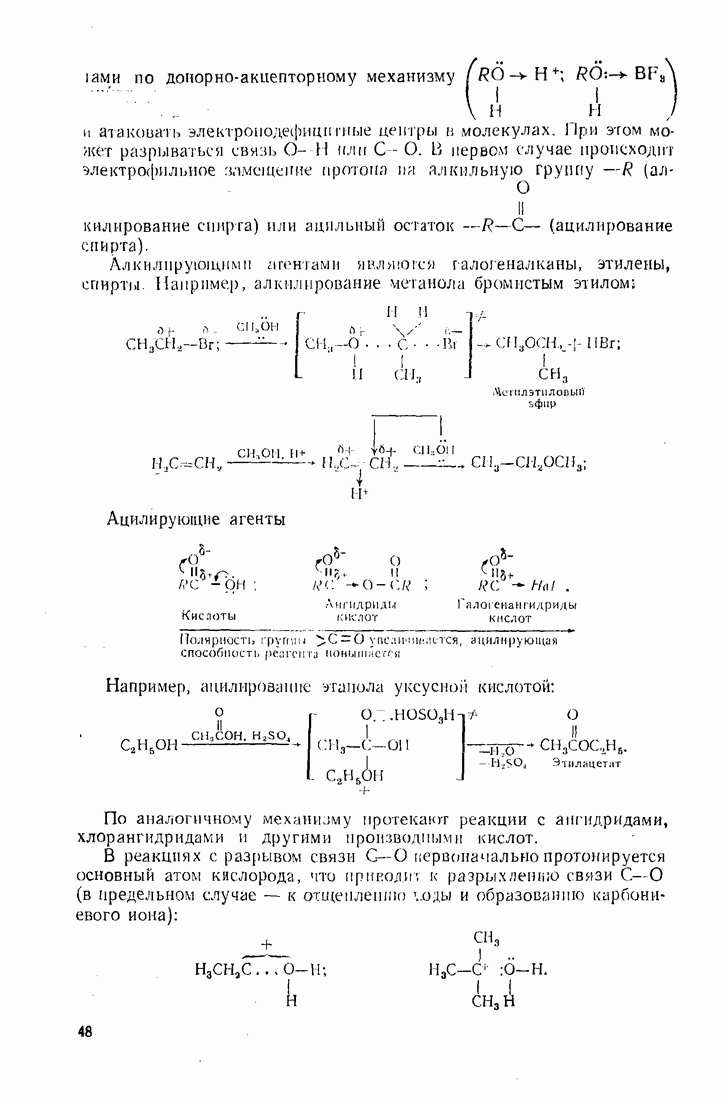
- 2.2. ТИПЫ ЭЛЕКТРОННЫХ СМЕЩЕНИЙ В МОЛЕКУЛАХ
- 2.3. ОБЩИЕ ПРЕДСТАВЛЕНИЯ ОБ ОРГАНИЧЕСКОЙ РЕАКЦИИ
- 2.4. КЛАССИФИКАЦИЯ РЕАГЕНТОВ И РЕАКЦИЙ
- 2.5. КРАТКАЯ ХАРАКТЕРИСТИКА РЕАКЦИОННОЙ СПОСОБНОСТИ НЕКОТОРЫХ СОЕДИНЕНИЙ АЛИФАТИЧЕСКОГО РЯДА
- 2.5.1. Алканы (парафины)
- 2.5.2. Непредельные углеводороды
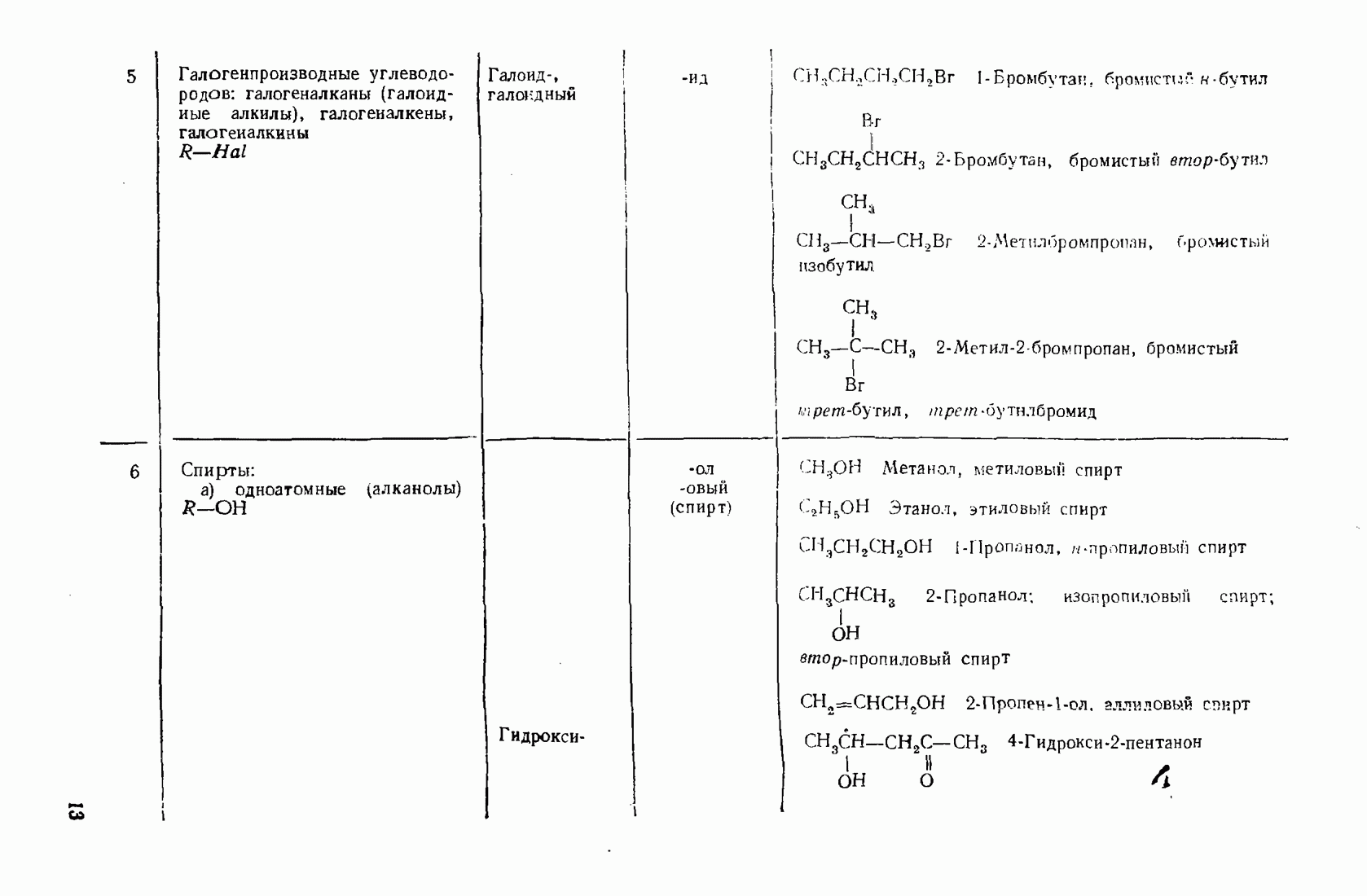
- 2.5.3. Галогеналканы (галоидные алкилы R-Hal)
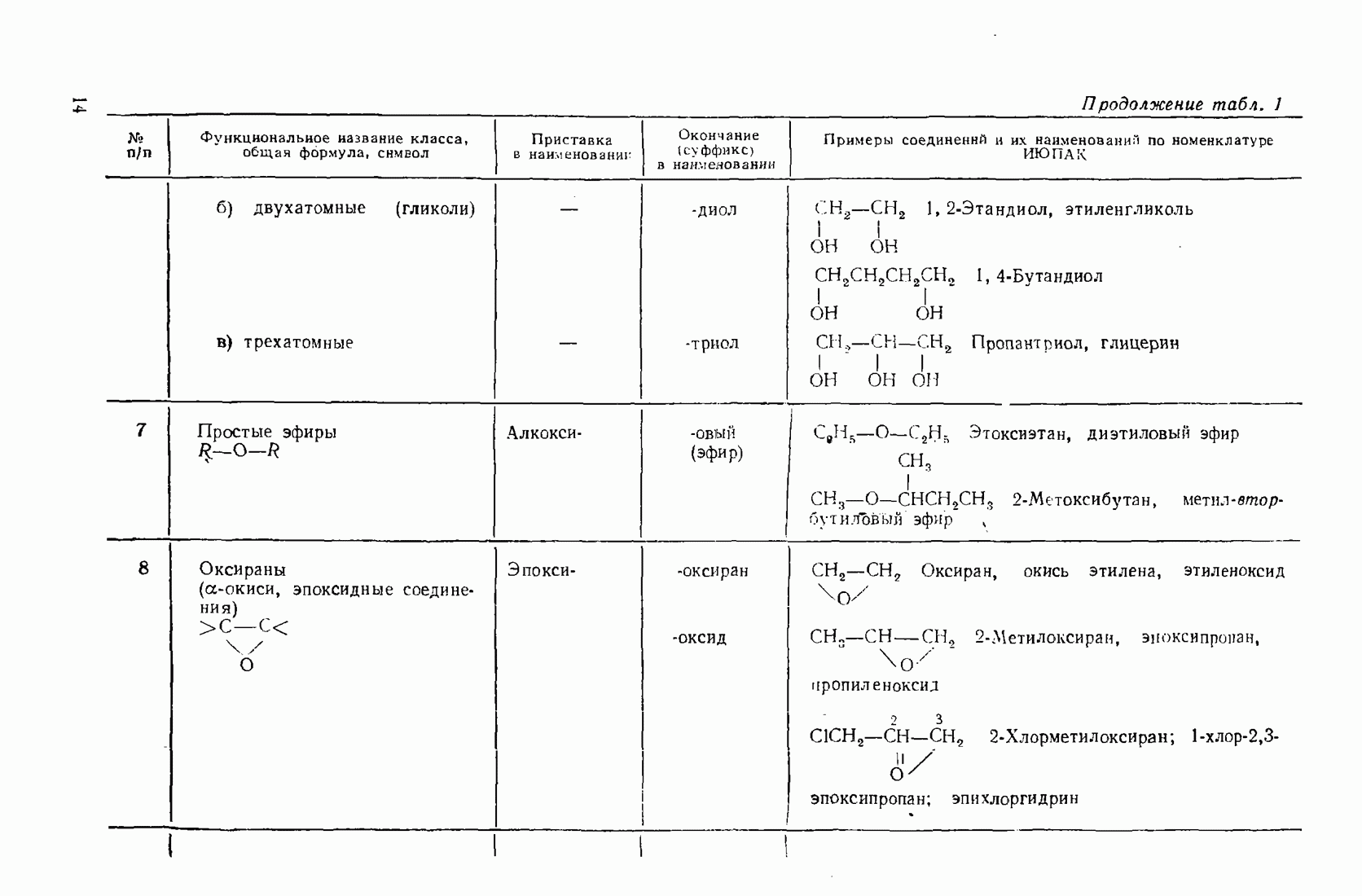
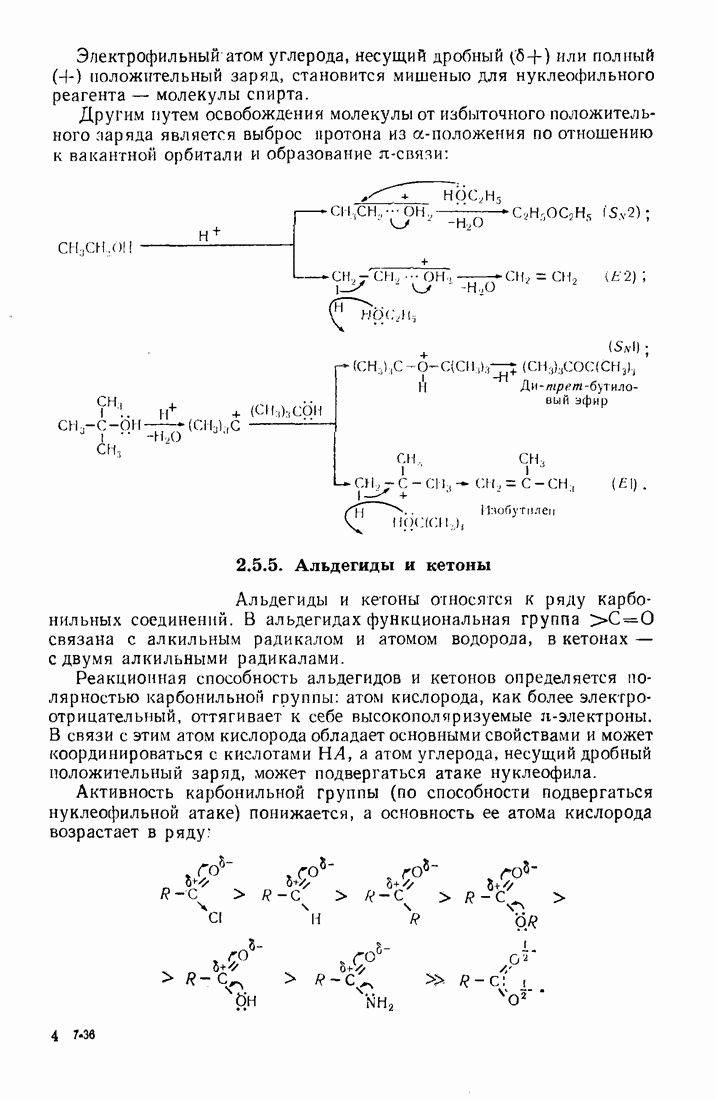
- 2.5.4. Спирты (R0Н)
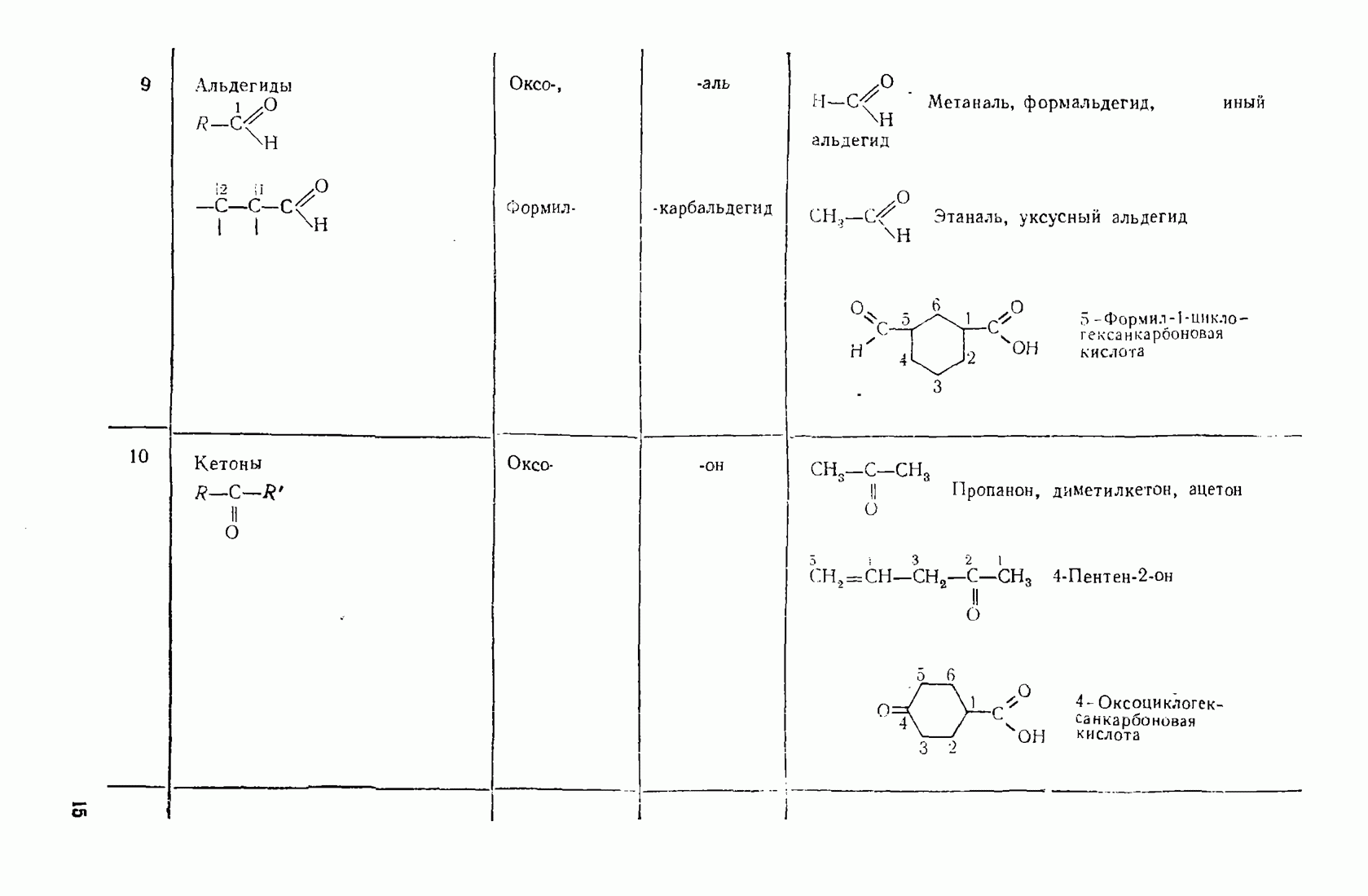
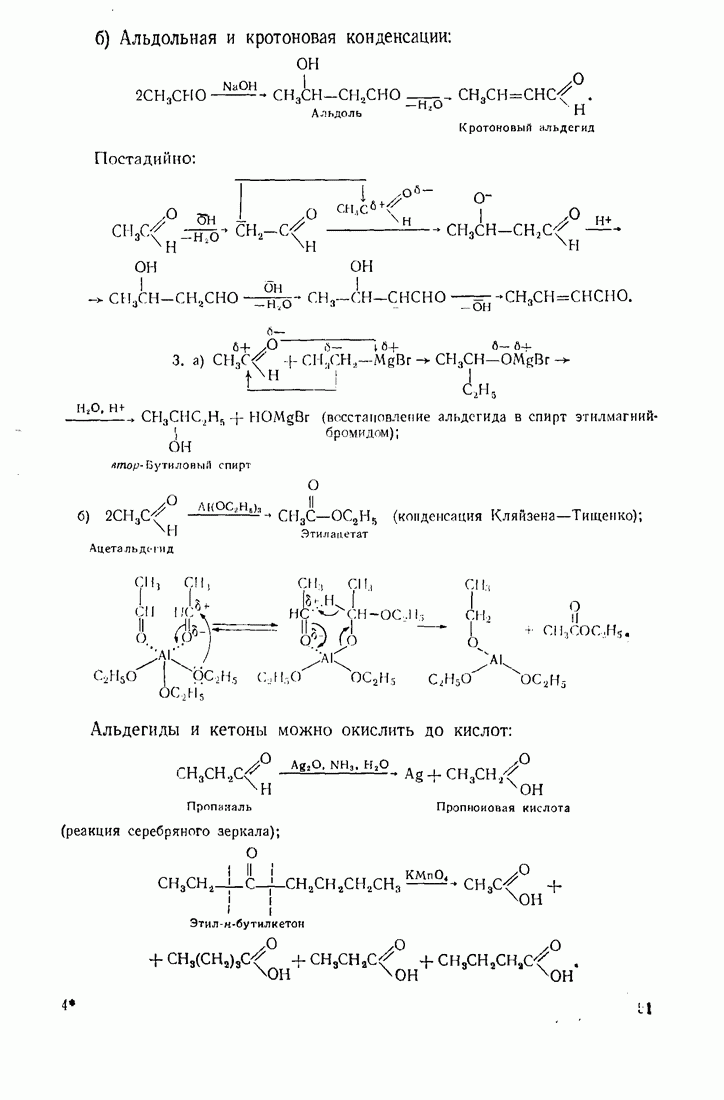
- 2.5.5. Альдегиды и кетоны
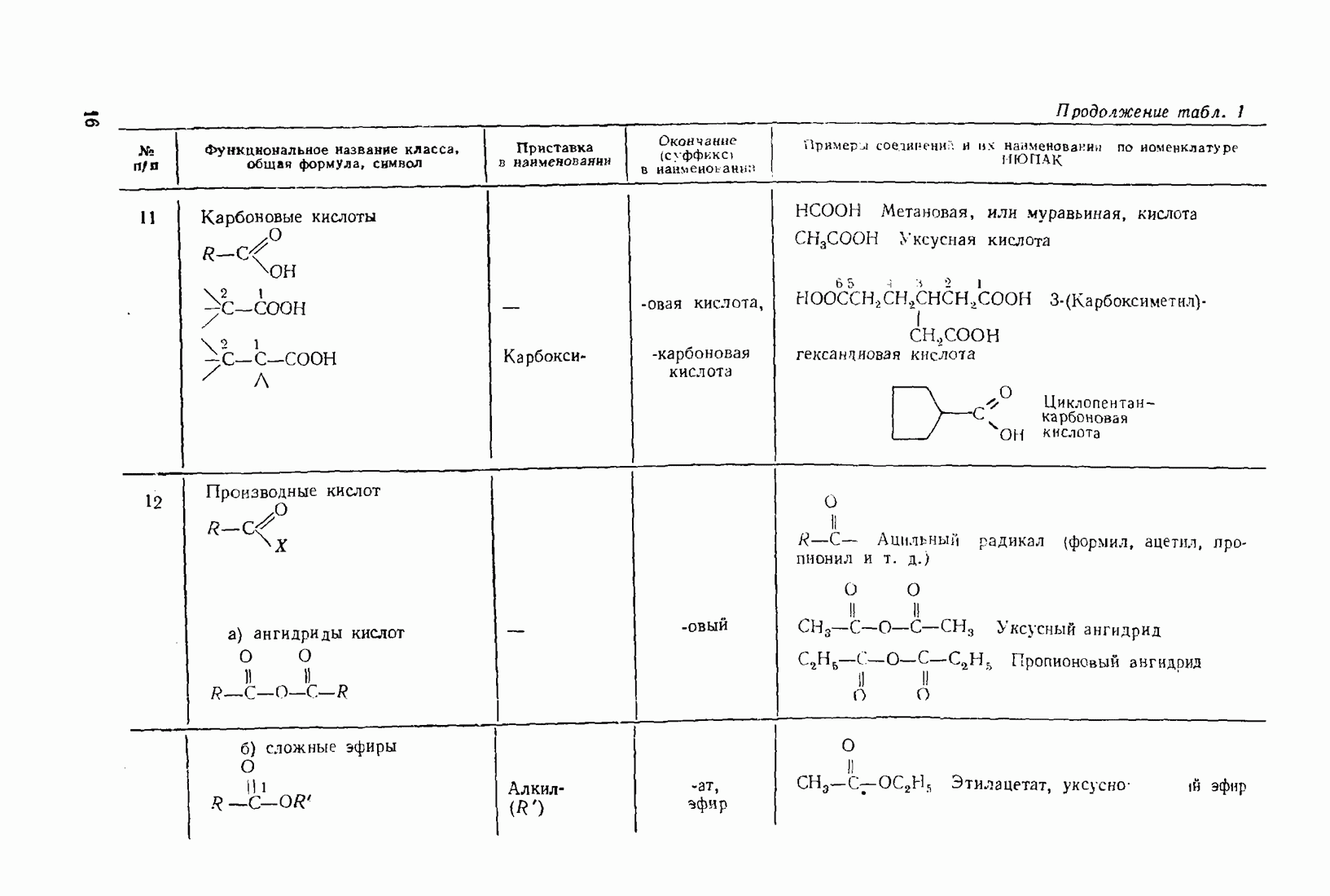
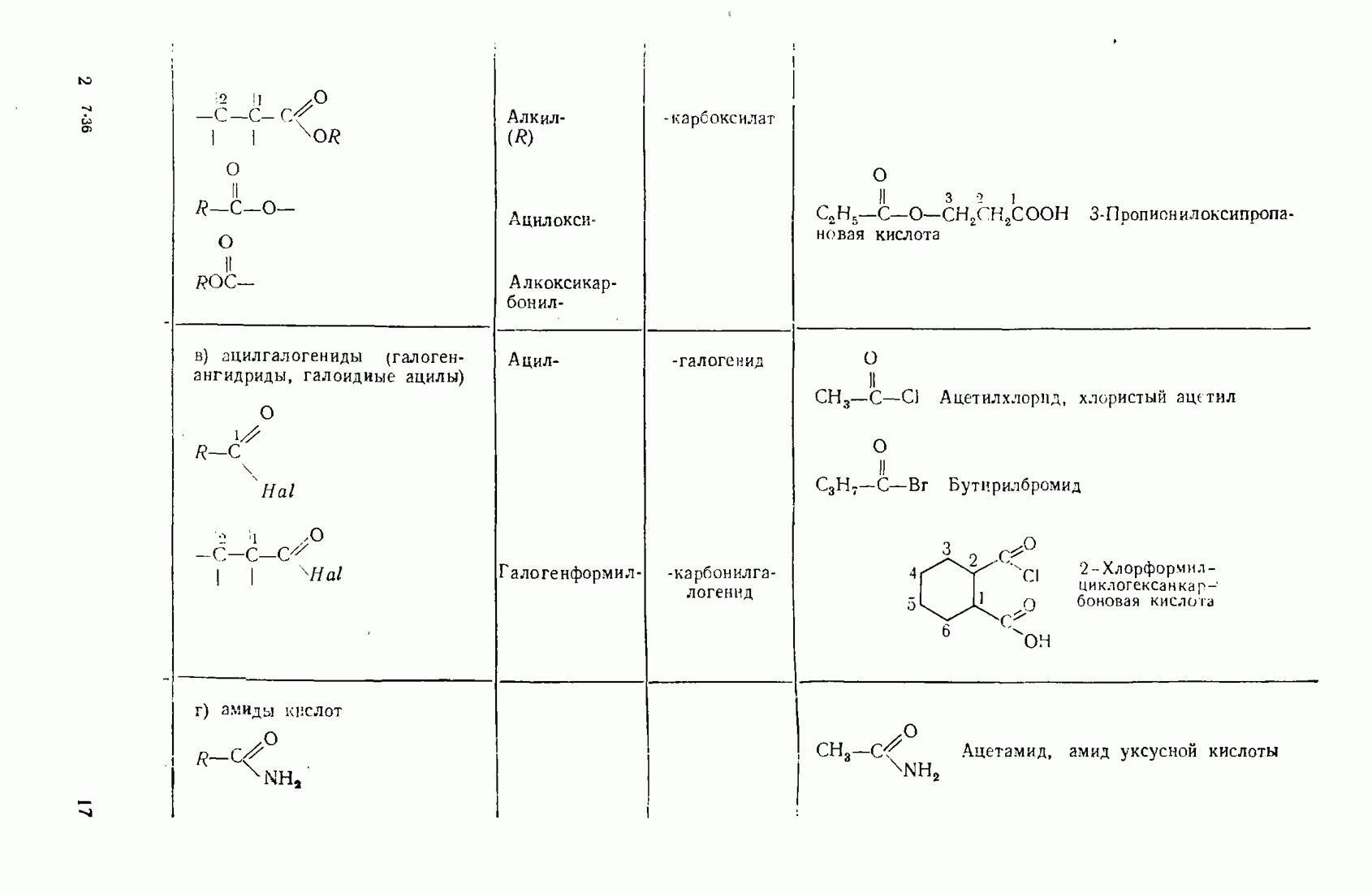
- 2.5.6. Карбоновые кислоты (R-СООН) и их производные (R-СО-X)
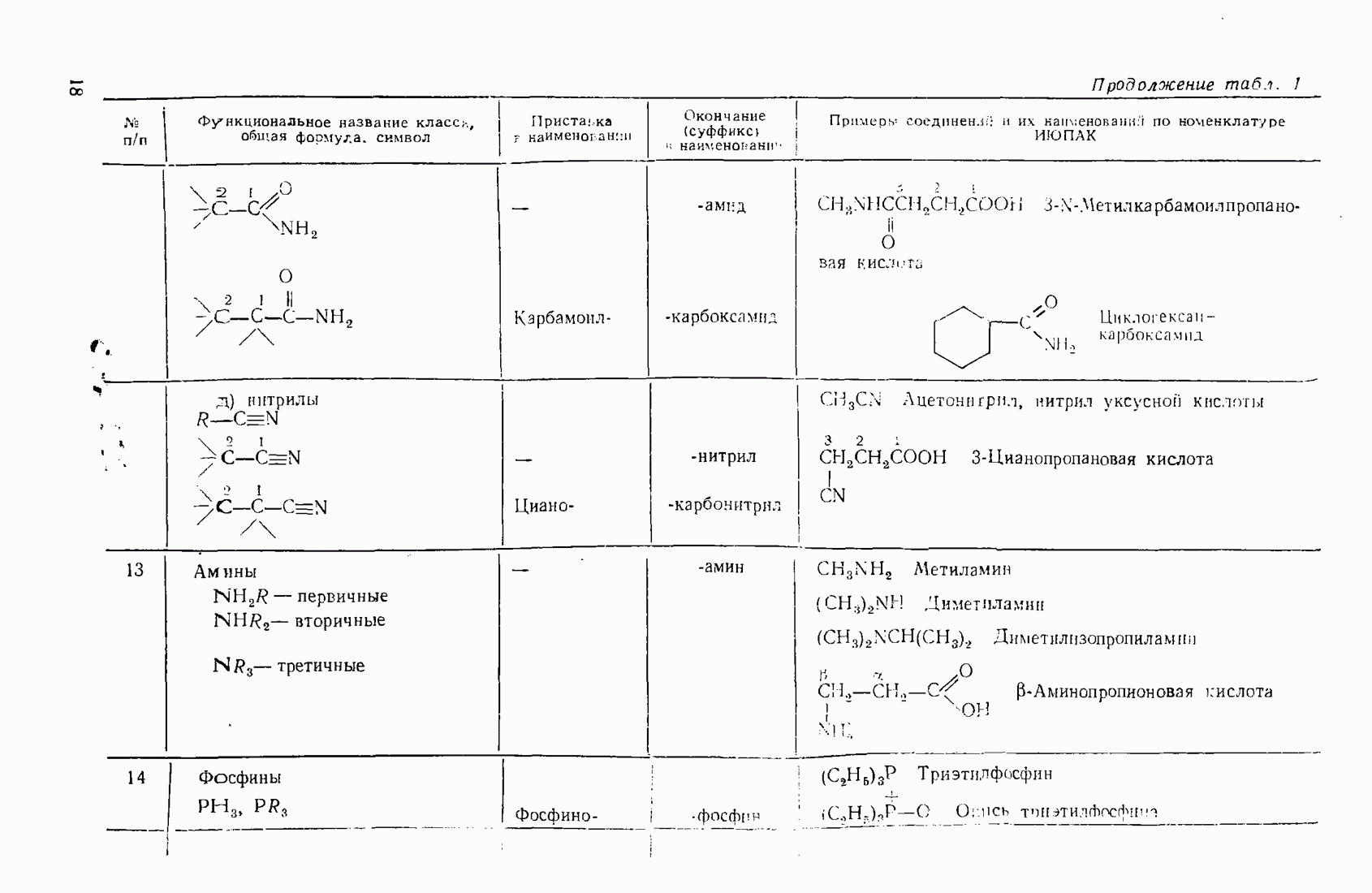
- 2.5.7. Амины (NH2R, NHR2, NR3)
- 3. Реакционная способность соединений алифатического ряда
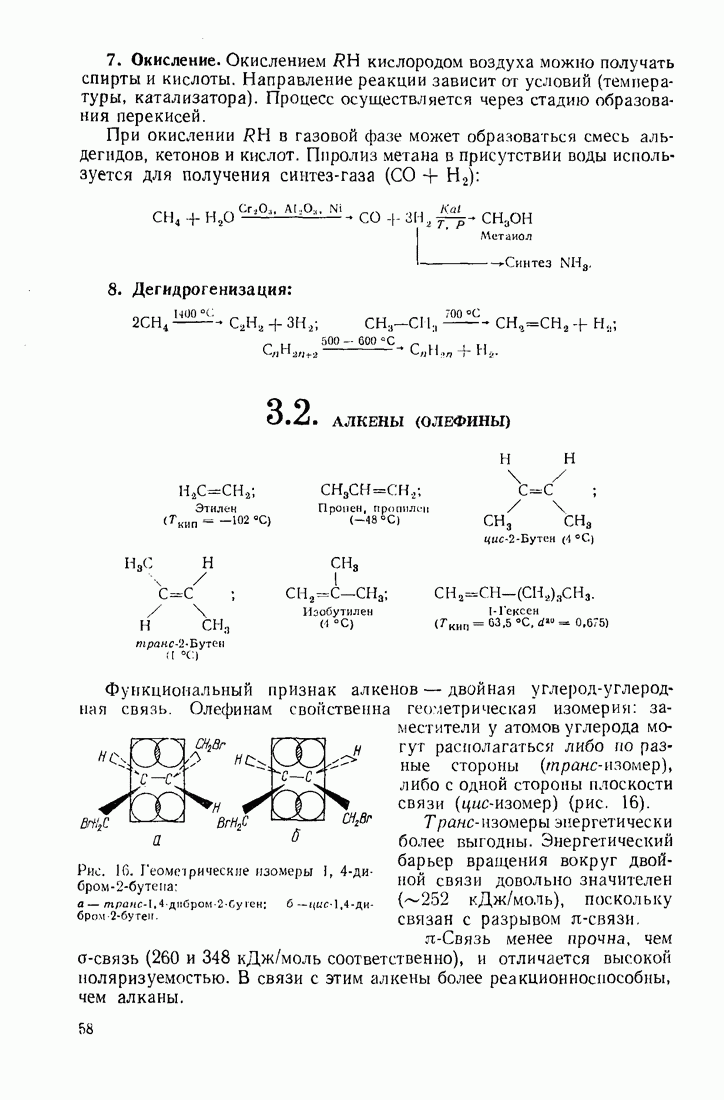
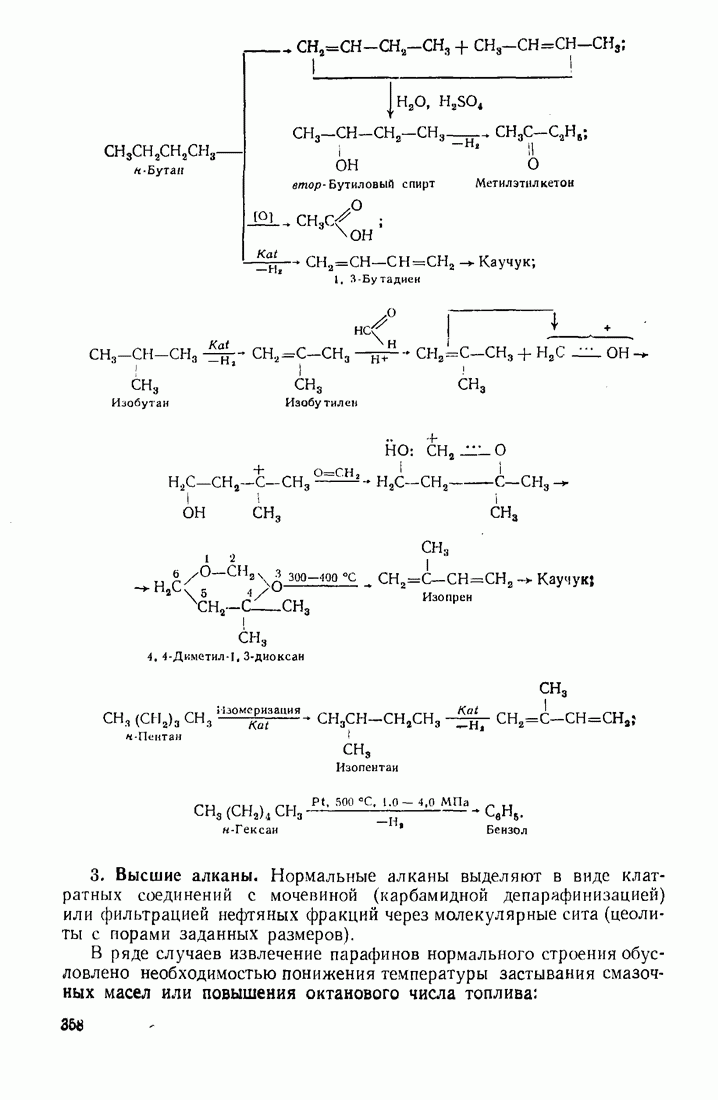
- 3.1. Алканы (насыщенные углеводороды)
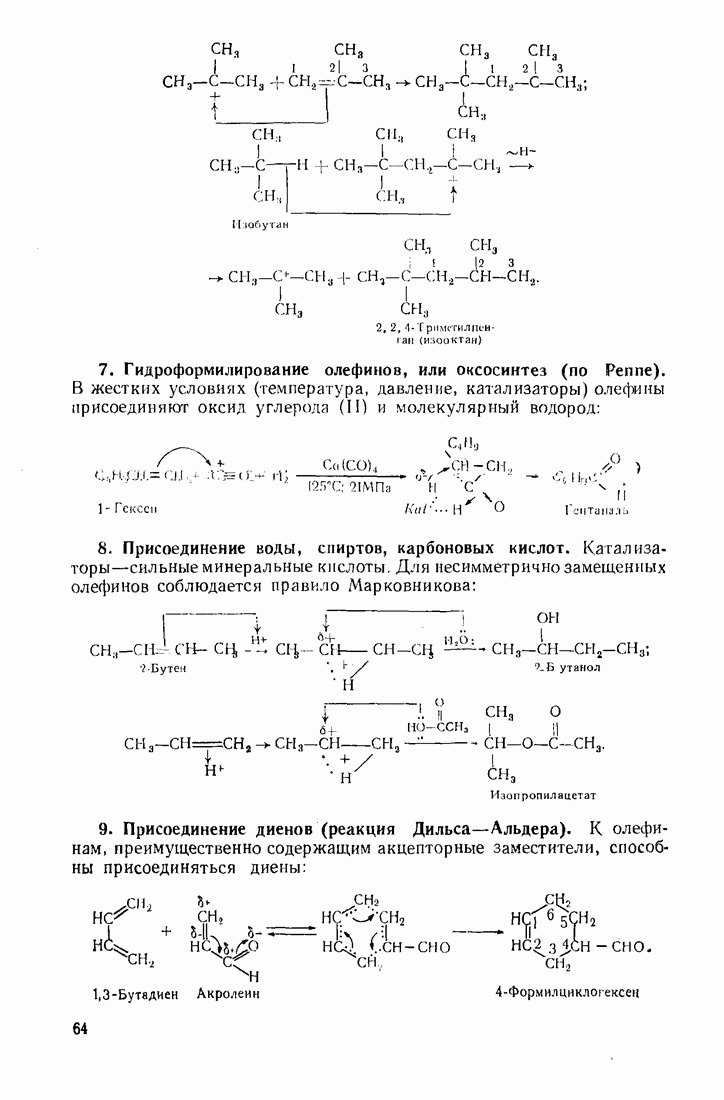
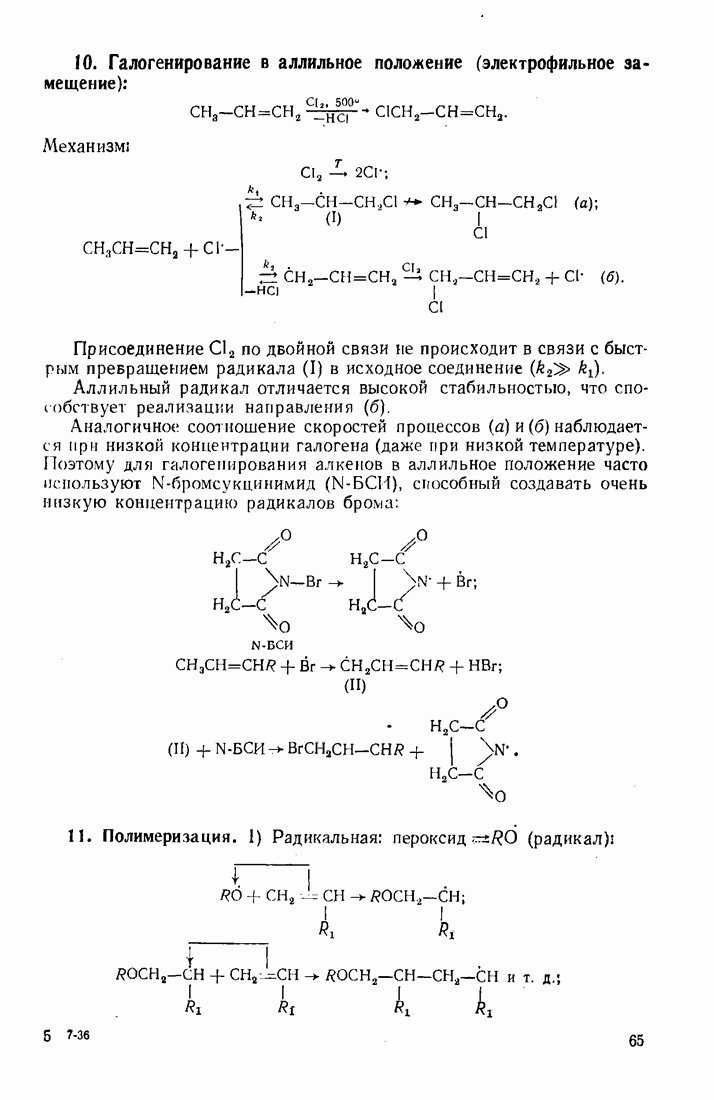
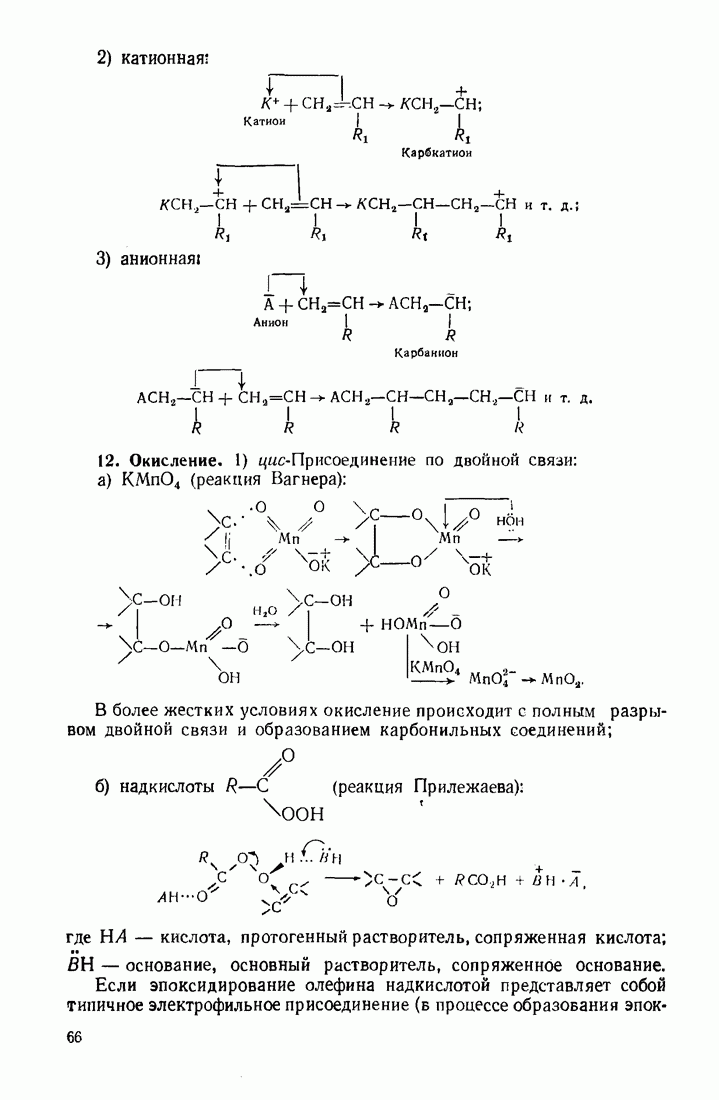
- 3.2. АЛКЕНЫ (ОЛЕФИНЫ)
- 3.3. ДИЕНОВЫЕ УГЛЕВОДОРОДЫ
- 3.4. АЦЕТИЛЕНЫ
- 3.5. ГАЛОГЕНАЛКАНЫ (ГАЛОИДНЫЕ АЛКИЛЫ)
- 3.6. СПИРТЫ
- 3.7. ПРОСТЫЕ ЭФИРЫ (R-O-R)
- 3.8. ОКСИРАНЫ (ЭПОКСИДНЫЕ СОЕДИНЕНИЯ, a-ОКИСИ)
- 3.9. АЛЬДЕГИДЫ И КЕТОНЫ
- 3.10. КАРБОНОВЫЕ КИСЛОТЫ
- 3.11. НЕКОТОРЫЕ ПРОИЗВОДНЫЕ КИСЛОТ
- 3.12. АМИНЫ
- 3.13. ФОСФОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
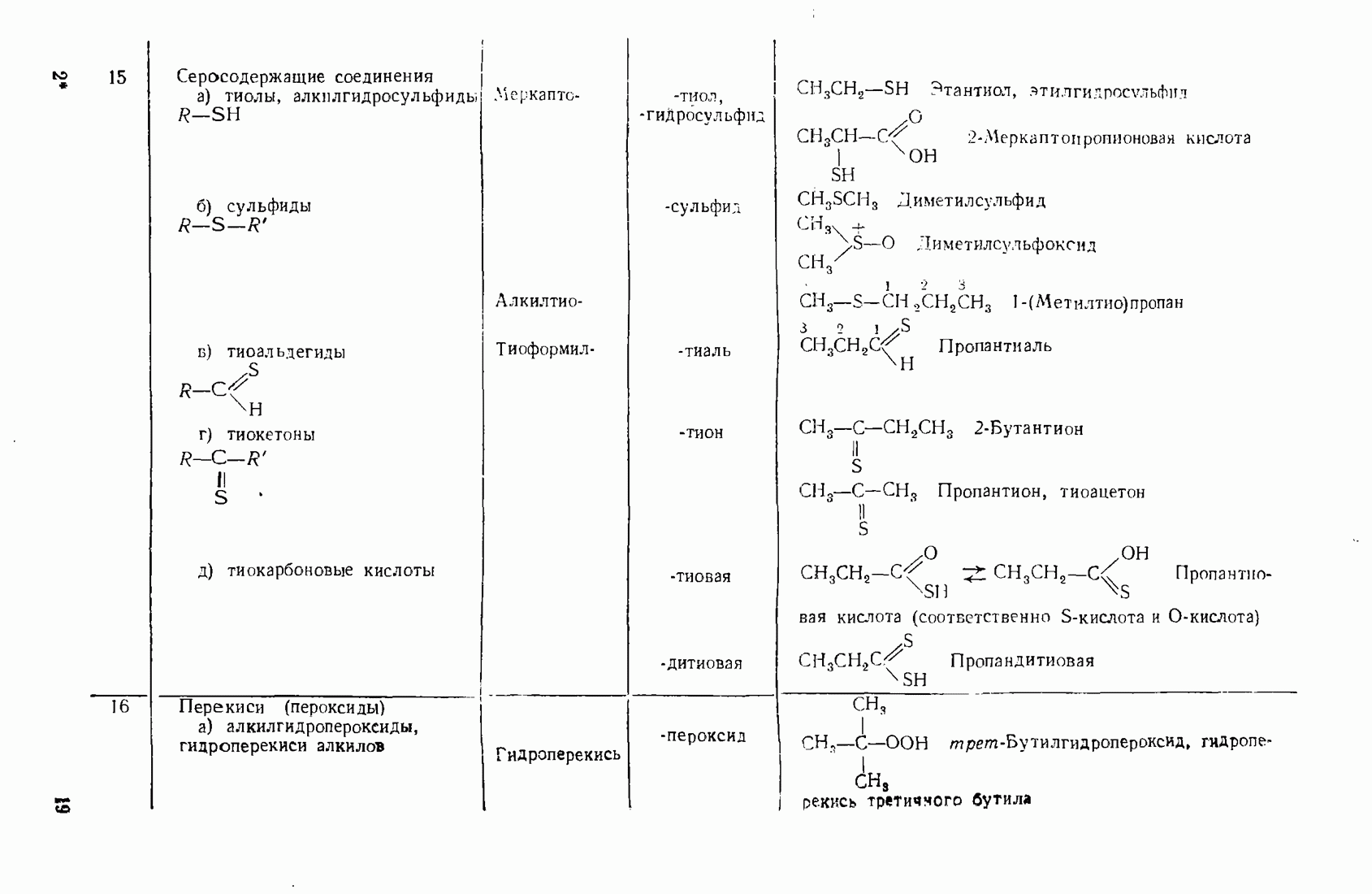
- 3.14. СЕРООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- 3.15. ОРГАНИЧЕСКИЕ ПЕРЕКИСИ (ПЕРОКСИДНЫЕ СОЕДИНЕНИЯ)
- 3.16. ПРОИЗВОДНЫЕ УГОЛЬНОЙ КИСЛОТЫ
- 3.17. ГЕТЕРОАНАЛОГИ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
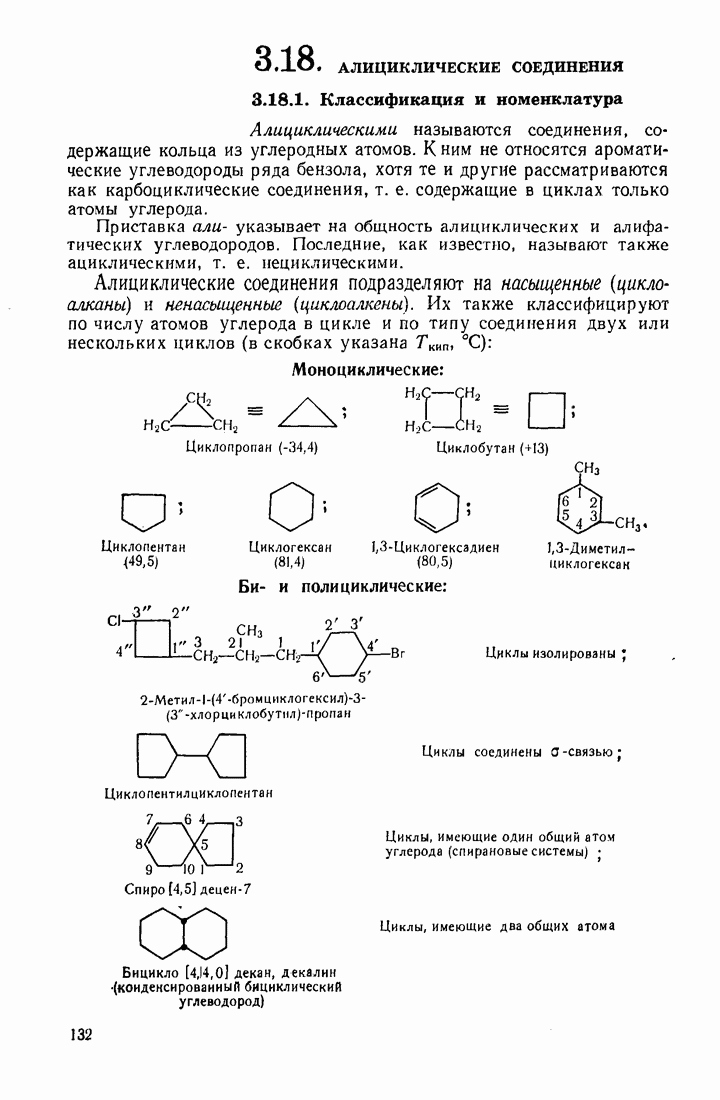
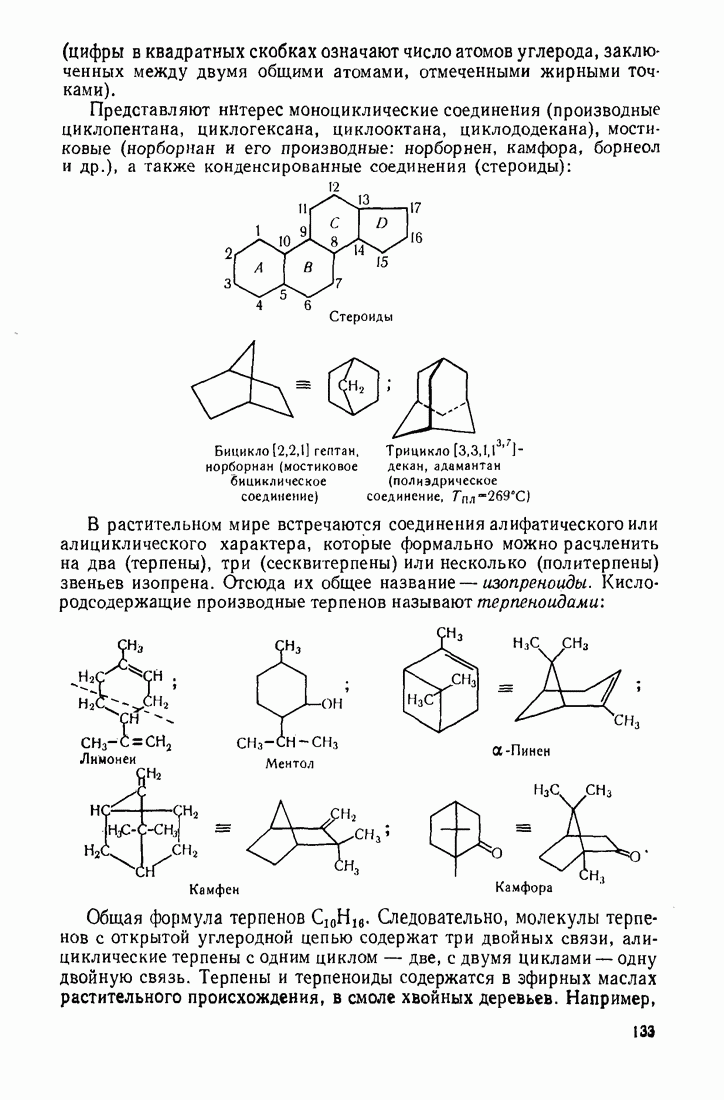
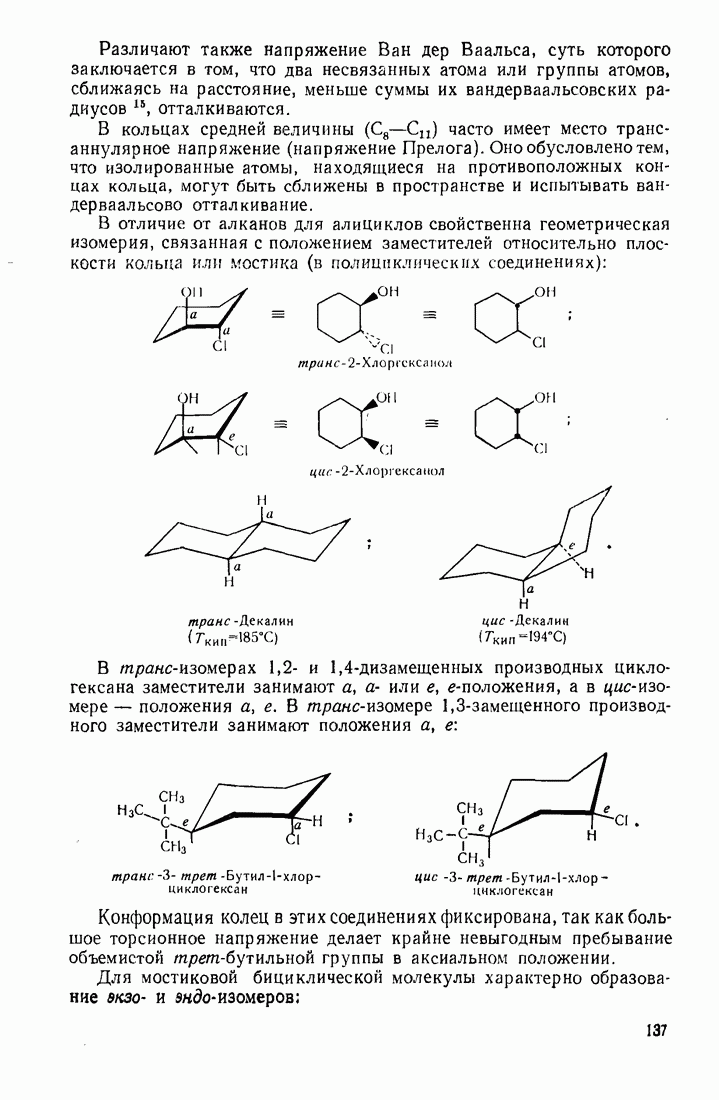
- 3.18. АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
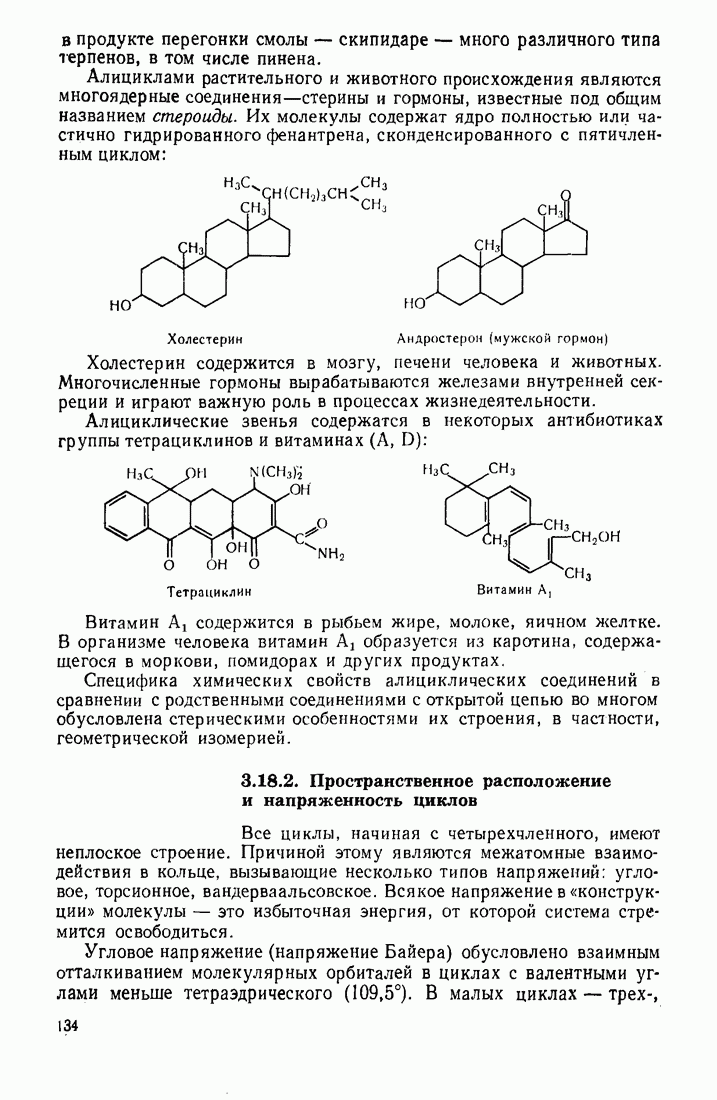
- 3.18.2. Пространственное расположение и напряженность циклов
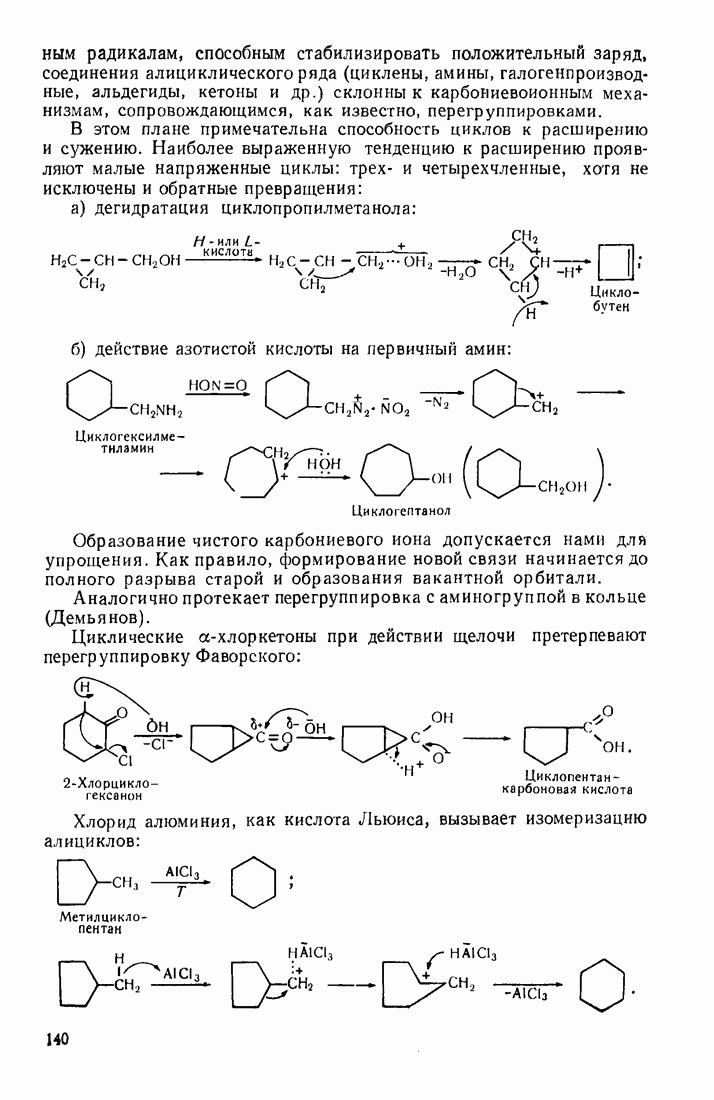
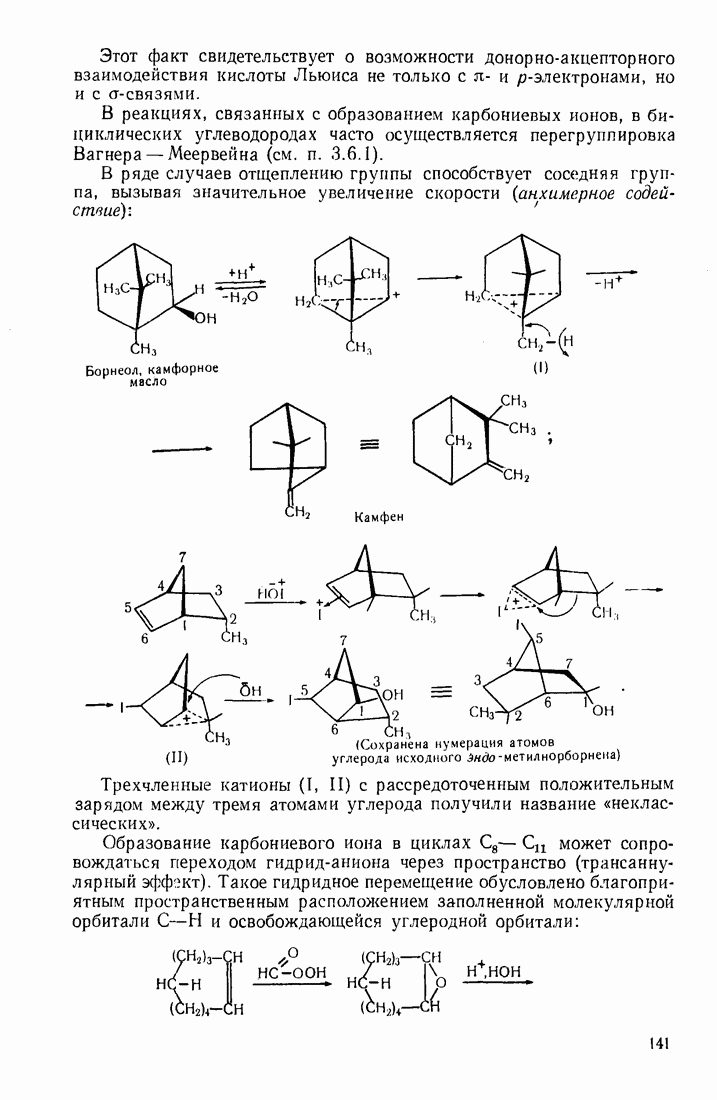
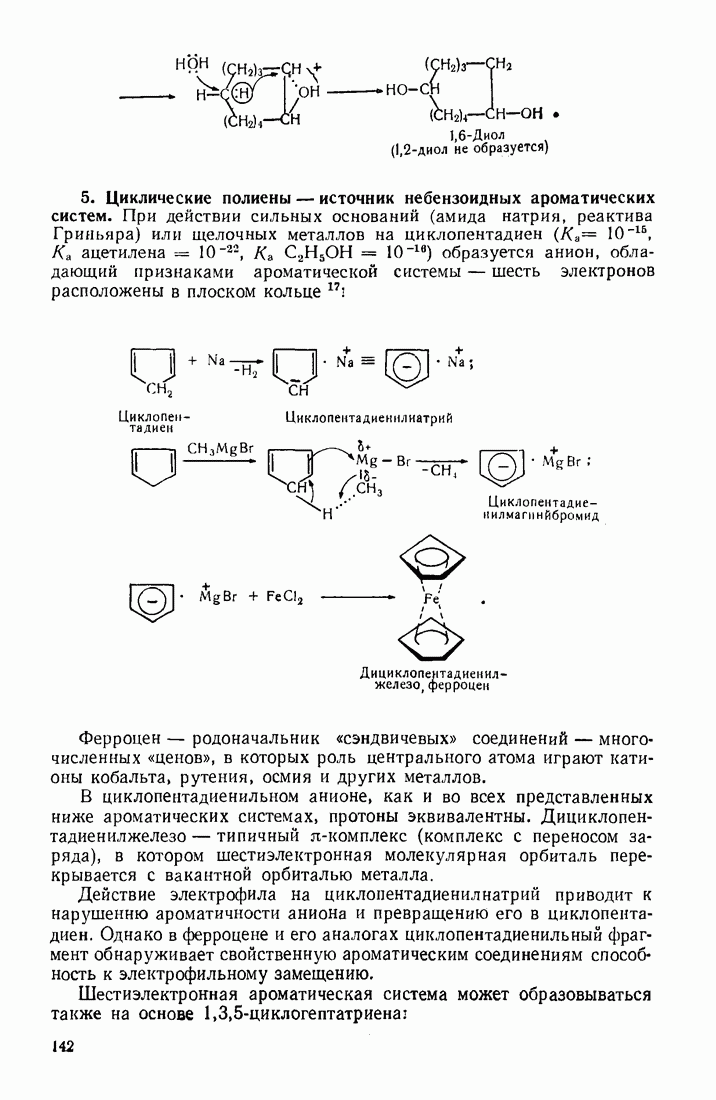
- 3.18.3. Особенности химических свойств алициклических соединений
- 4. Полифункциональные производные алифатического ряда
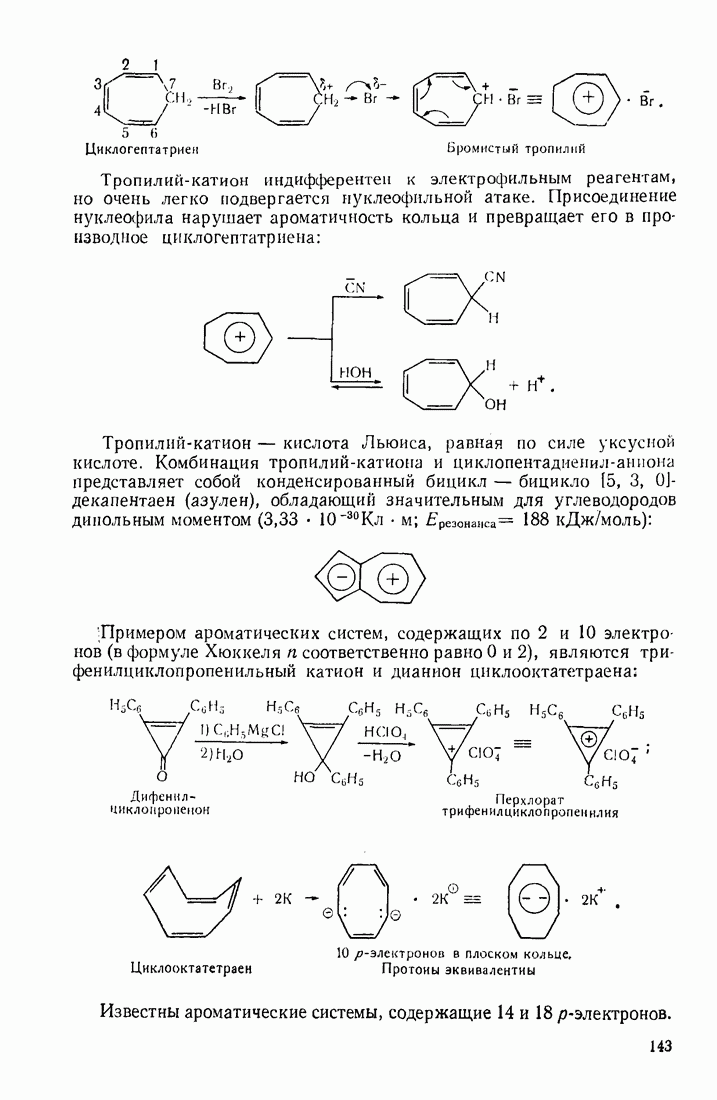
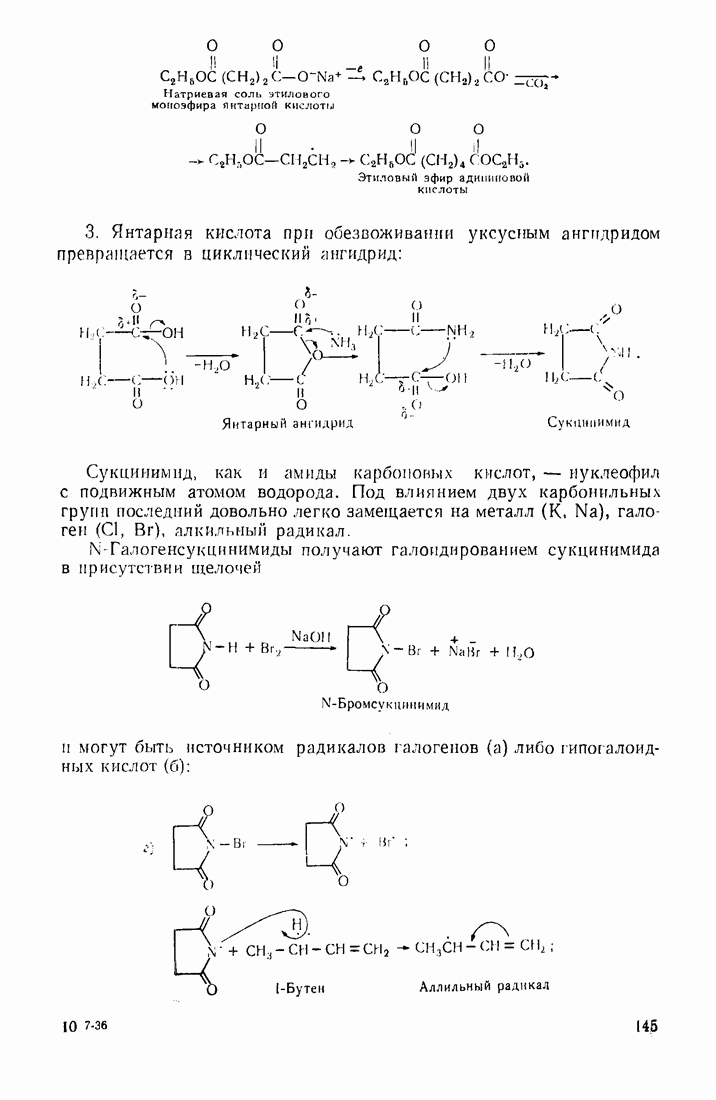
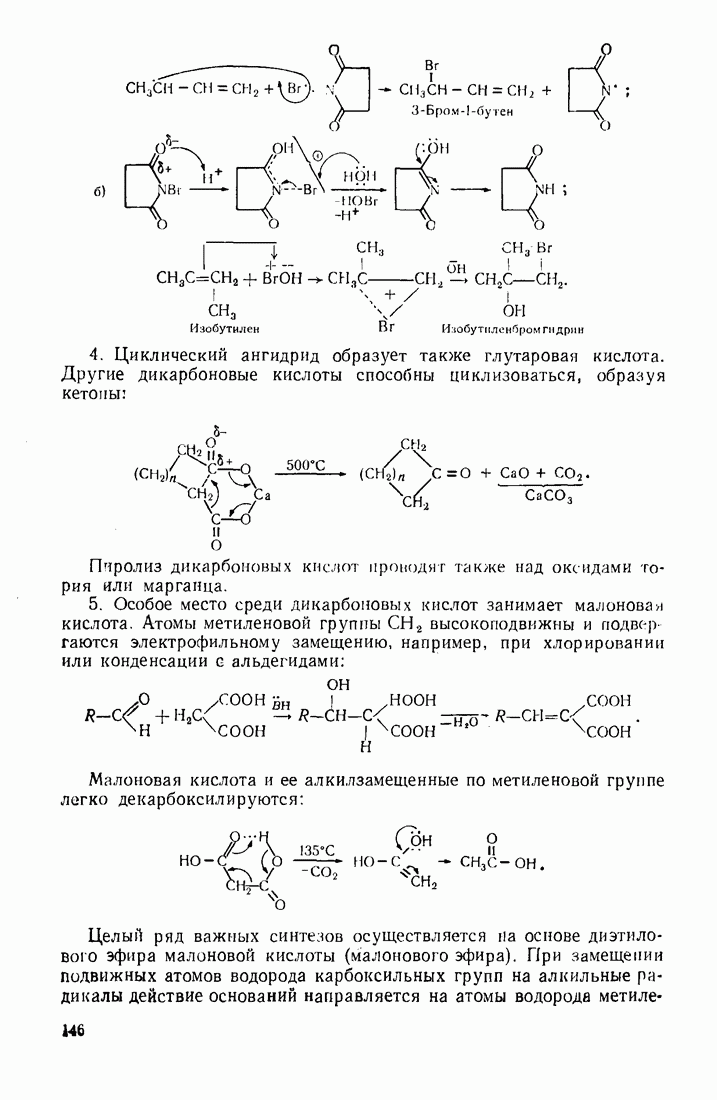
- 4.1. ДВУХОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ
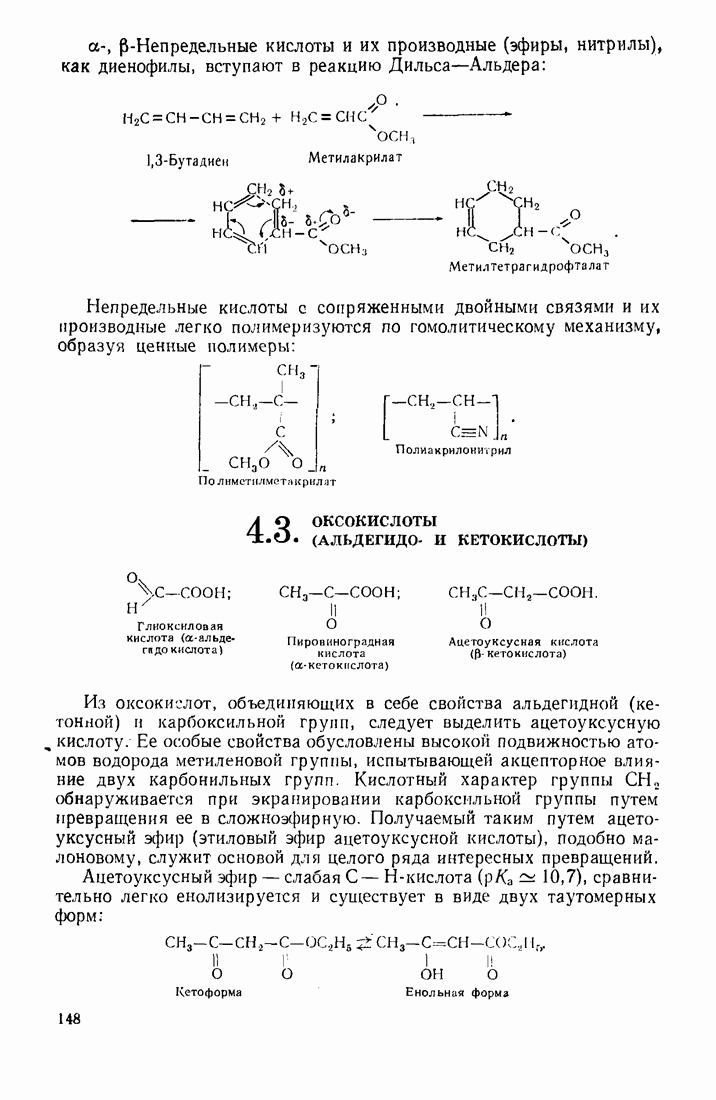
- 4.2. НЕПРЕДЕЛЬНЫЕ КИСЛОТЫ
- 4.3. ОКСОКИСЛОТЫ (АЛЬДЕГИДО- И КЕТОКИСЛОТЫ)
- 4.4. ОКСИКИСЛОТЫ. ПОНЯТИЕ ОБ ОПТИЧЕСКОЙ ИЗОМЕРИИ
- 4.5. УГЛЕВОДЫ
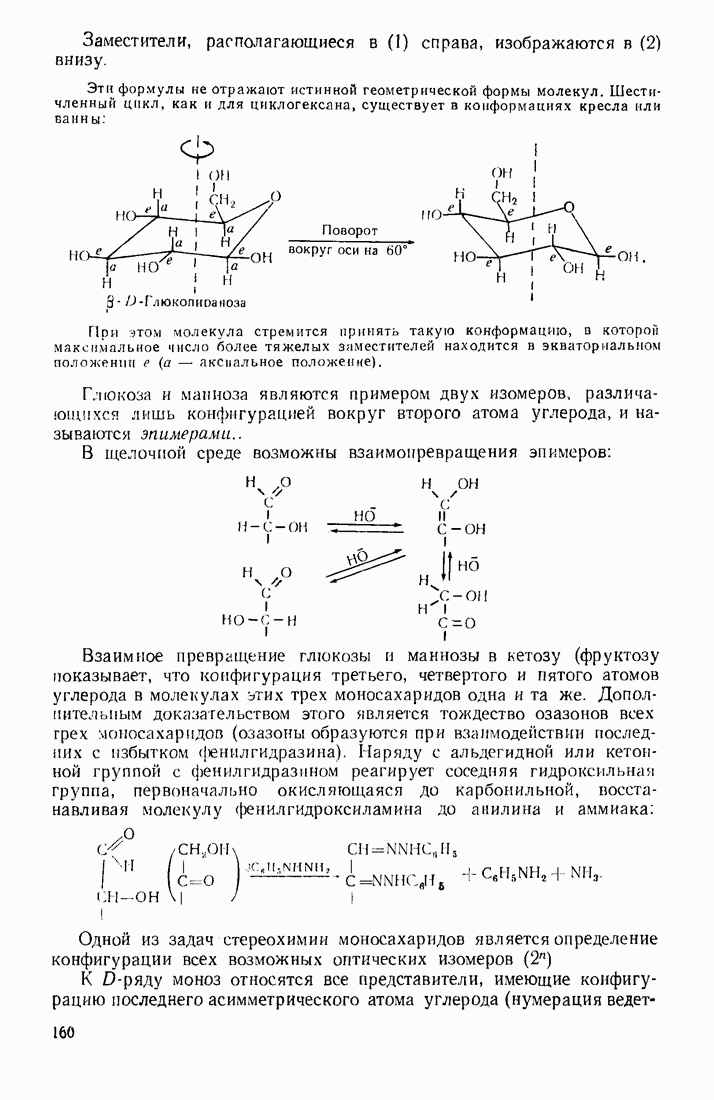
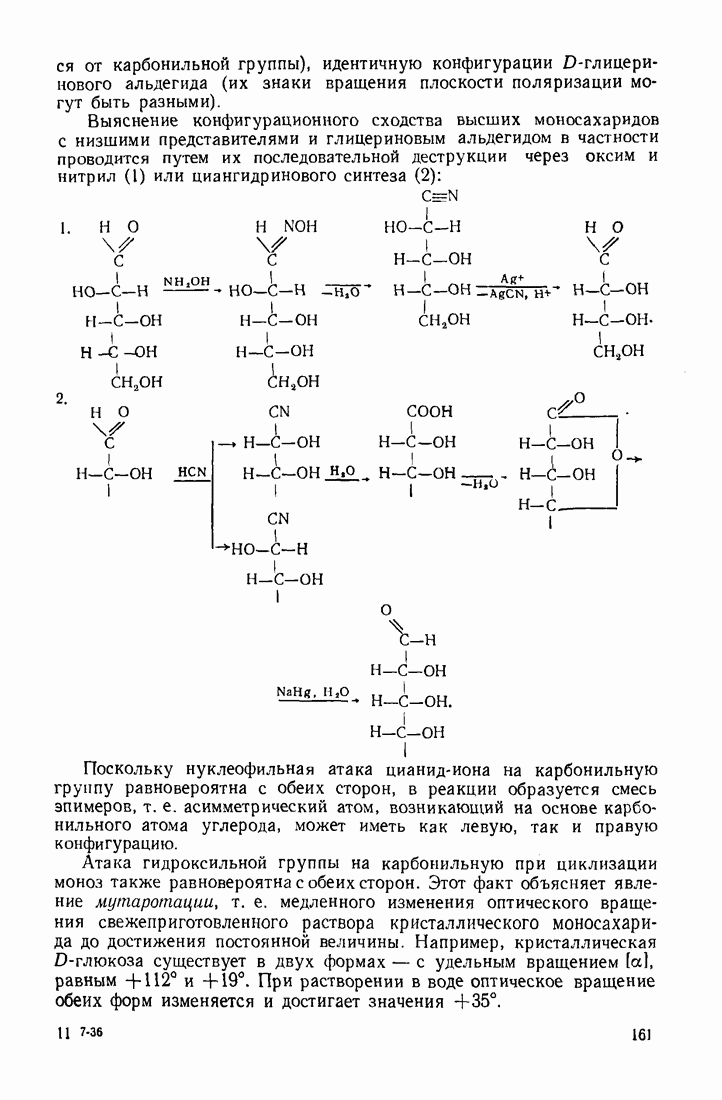
- 4.5.2. Стереохимия моносахаридов
- 4.5.3. Дисахариды
- 4.5.4. Полисахариды
- 4.5.5. Нахождение в природе и пути превращения углеводов
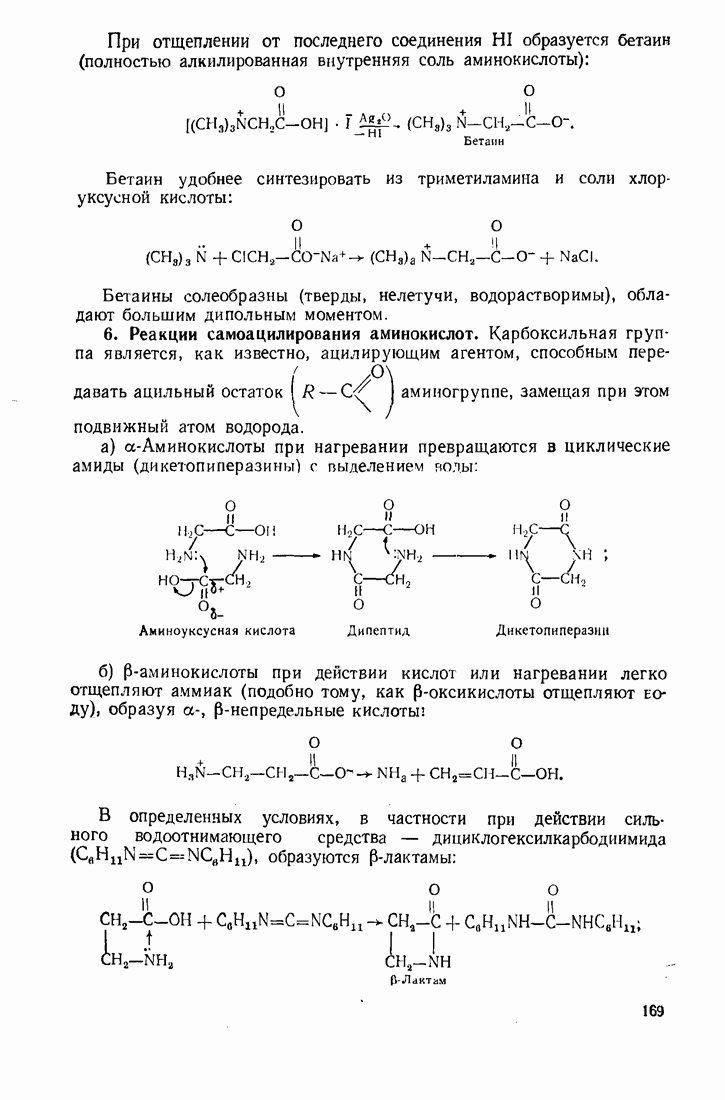
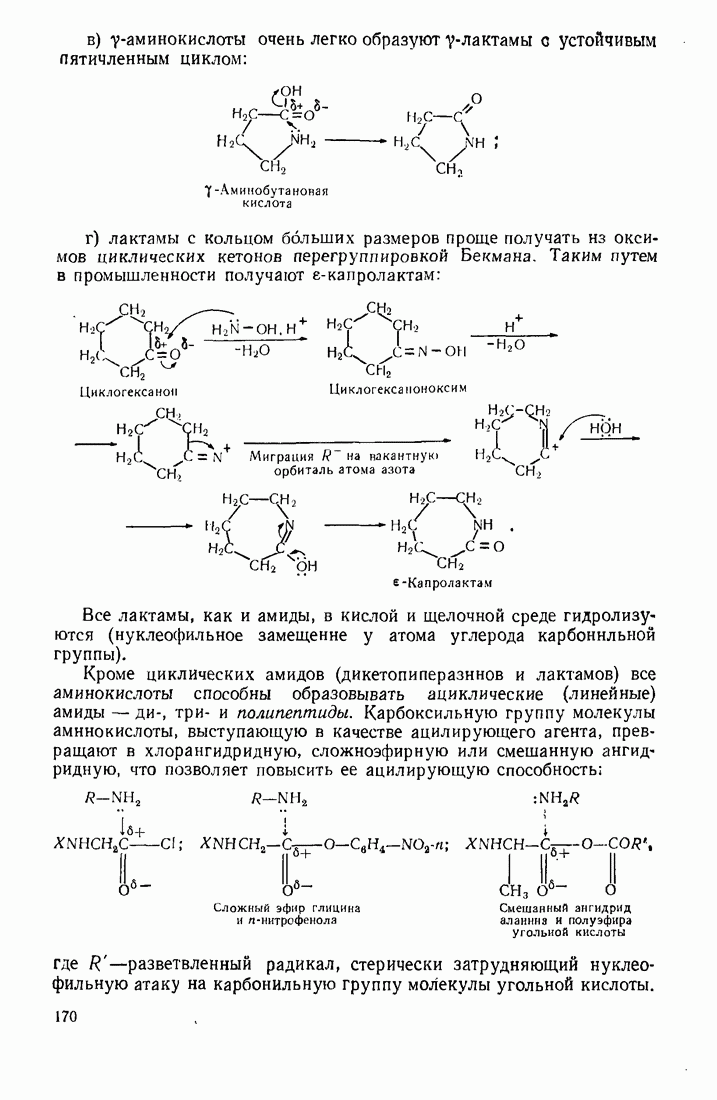
- 4.6. АМИНОКИСЛОТЫ
- 5. Методы синтеза органических юединений алифатическою рада
- 5.1. АЛКИЛИРОВАНИЕ
- 5.2. АЦИЛИРОВАНИЕ
- 5.3. ГАЛОГЕНИРОВАНИЕ
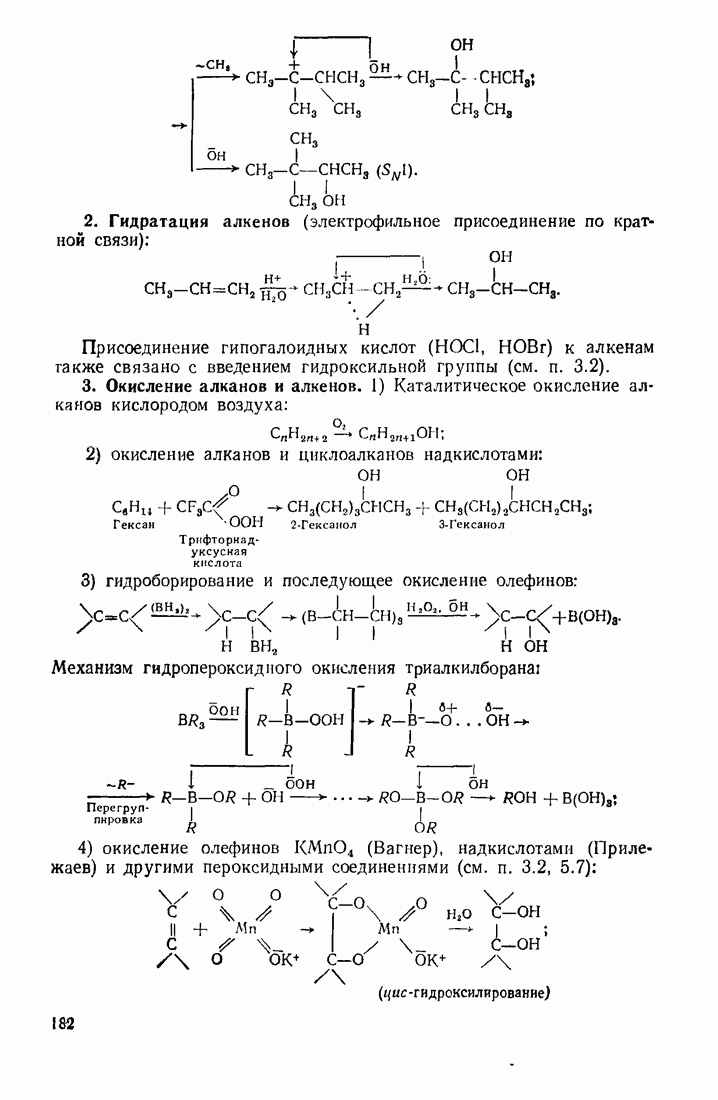
- 5.4. ГИДРОКСИЛИРОВАНИЕ
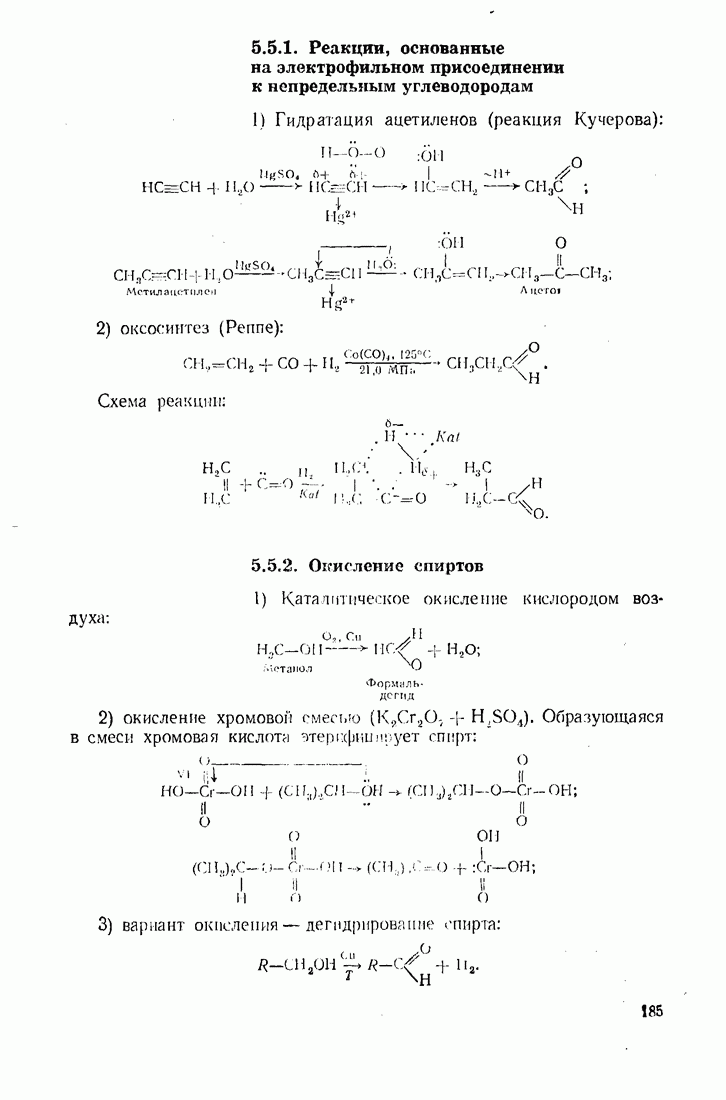
- 5.5. КАРБОНИЛИРОВАНИЕ (ВВЕДЕНИЕ КАРБОНИЛЬНОЙ ГРУППЫ)
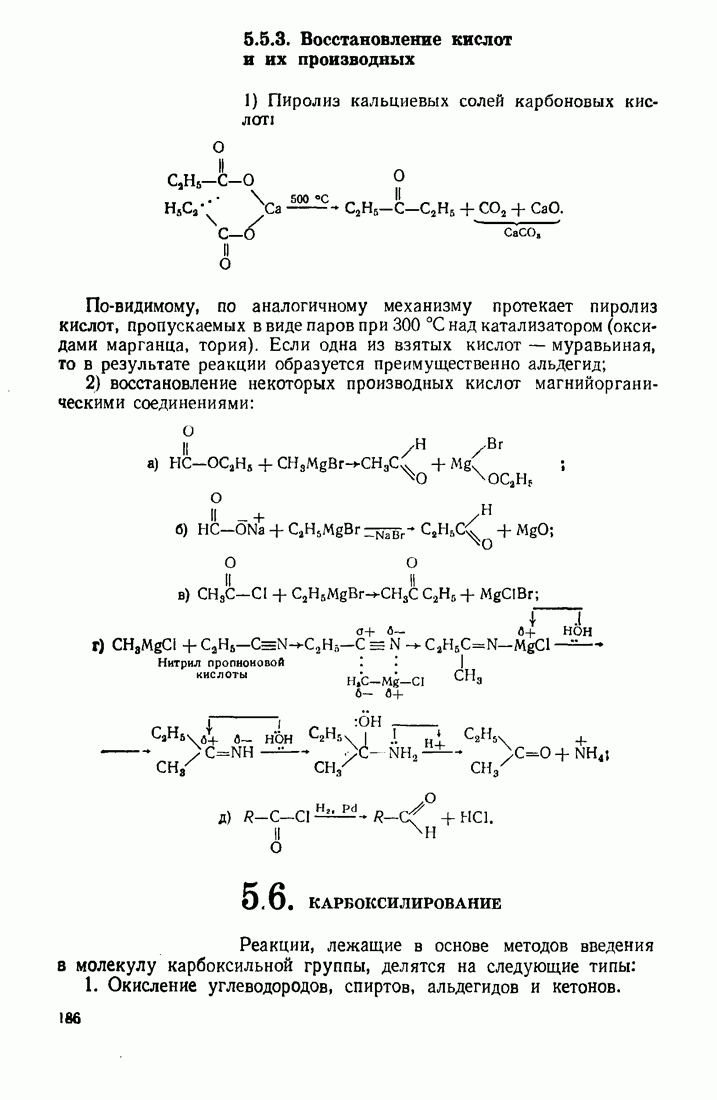
- 5.6. КАРБОКСИЛИРОВАНИЕ
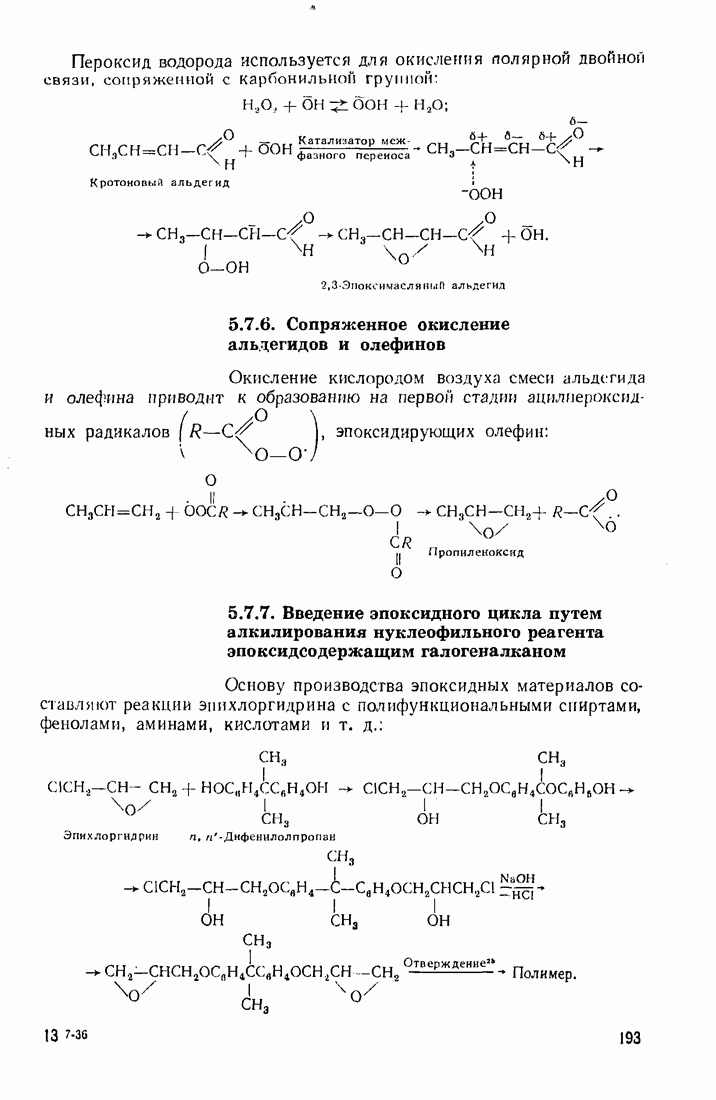
- 5.7. ЭПОКСИДИРОВАНИЕ (ОКСИРАНИРОВАИИЕ)
- 5.8. АМИНИРОВАНИЕ
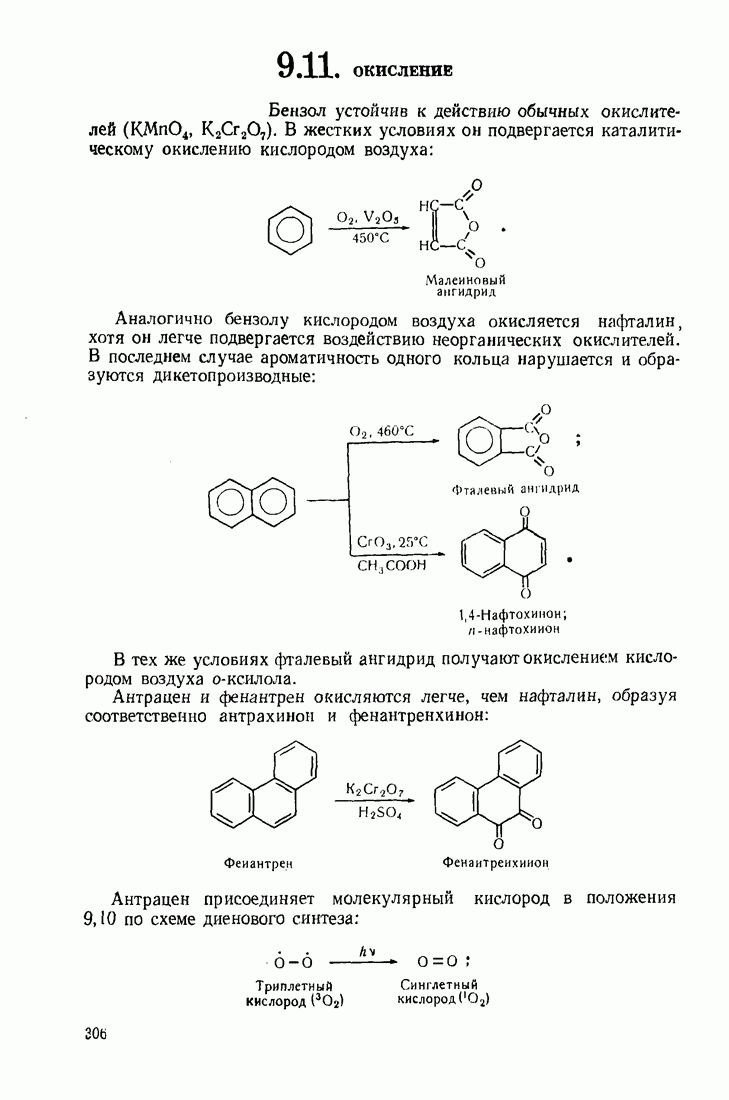
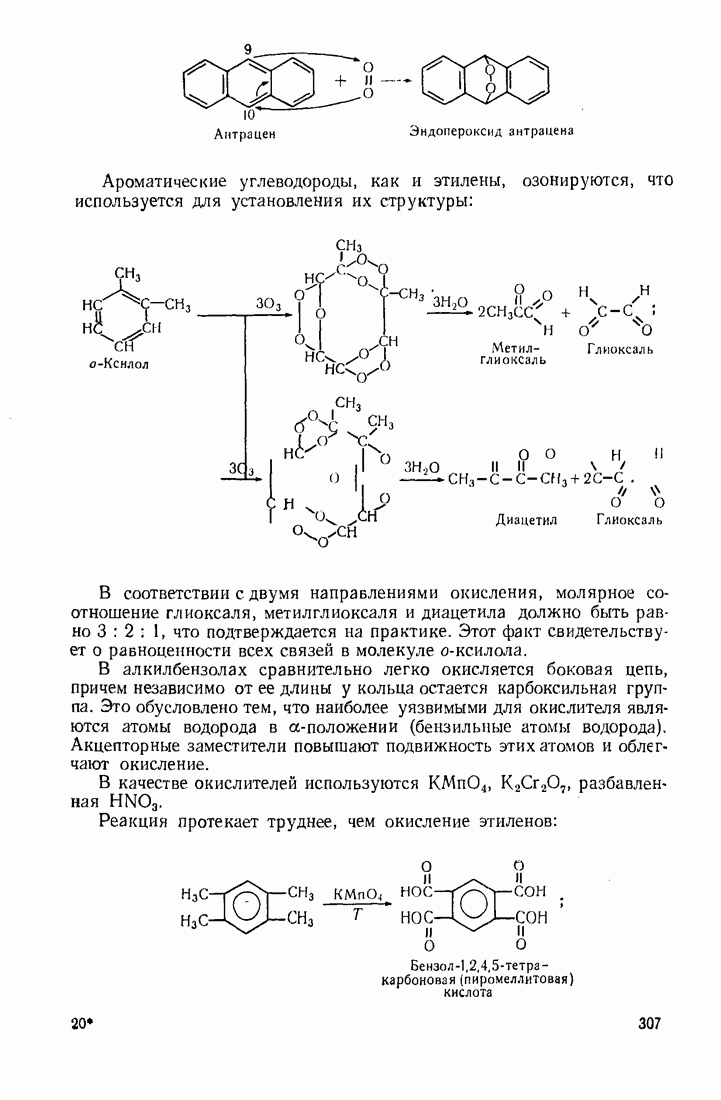
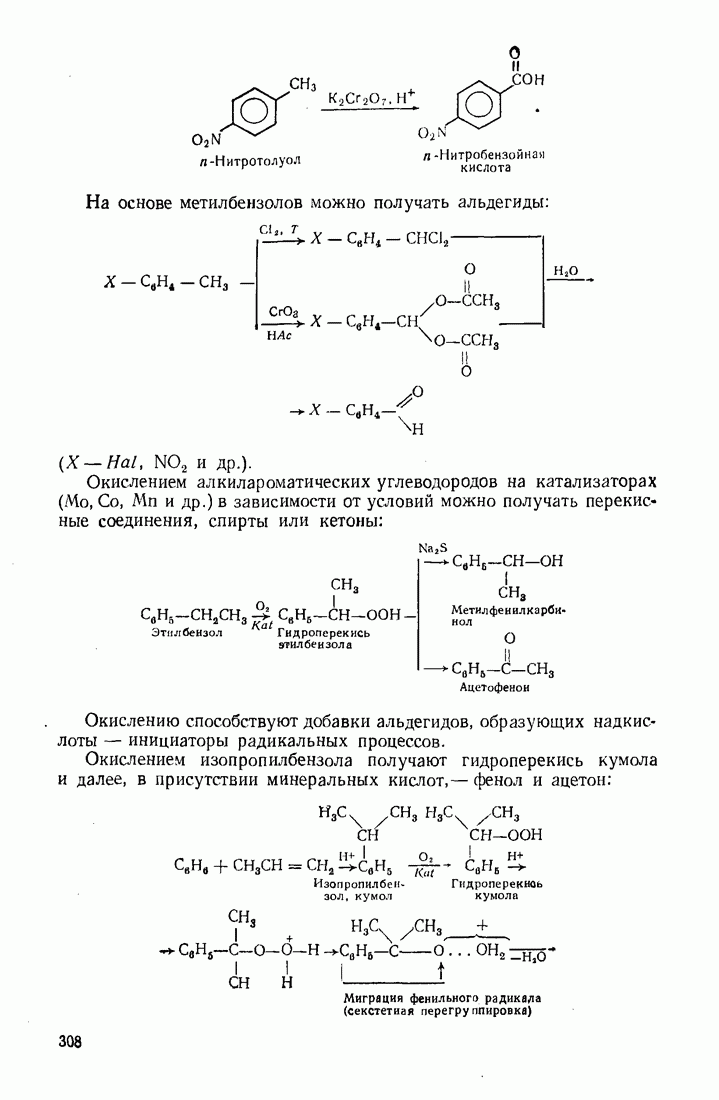
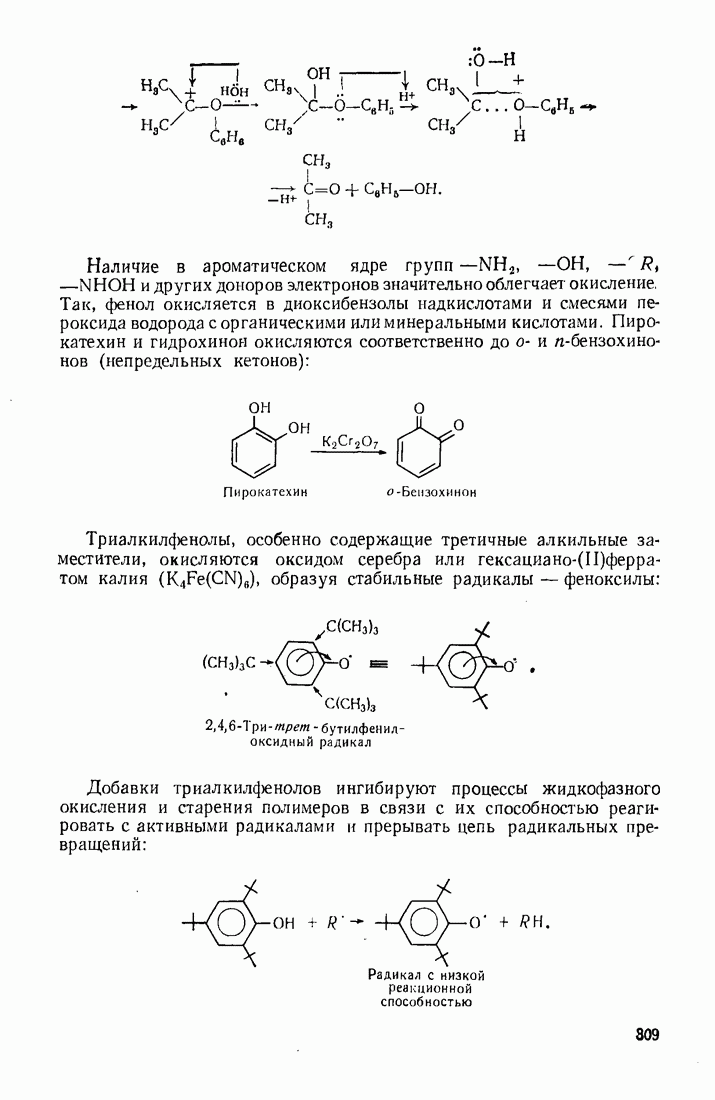
- 5.9. ОКИСЛЕНИЕ
- 5.10. ВОССТАНОВЛЕНИЕ
- 5.11. АЛКАНЫ
- 5.12 АЛКЕНЫ
- 5.13. ДИЕНОВЫЕ УГЛЕВОДОРОДЫ (1,3-ДИЕНЫ)
- 5.14. АЦЕТИЛЕНЫ
- 5.15 АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
- 5.16. ГАЛОГЕН АЛКАНЫ
- 5.17. СПИРТЫ
- 5.18. АЛЬДЕГИДЫ И КЕТОНЫ
- 5.19. КАРБОНОВЫЕ КИСЛОТЫ
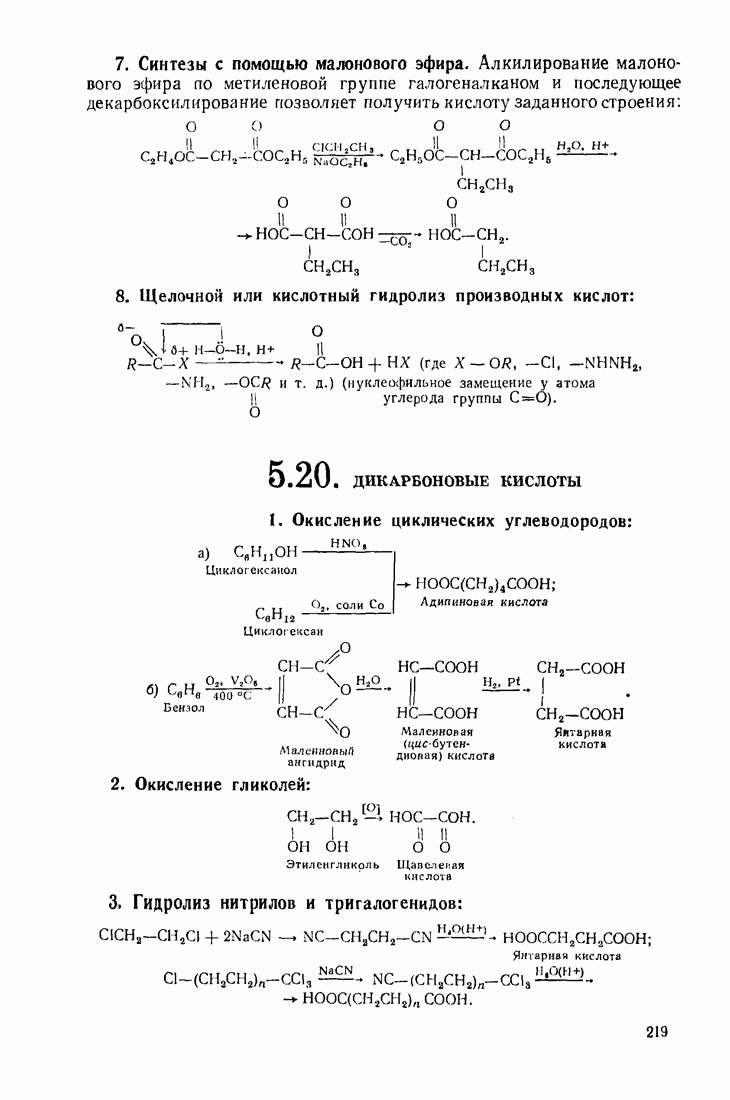
- 5.20. ДИКАРБОНОВЫЕ КИСЛОТЫ
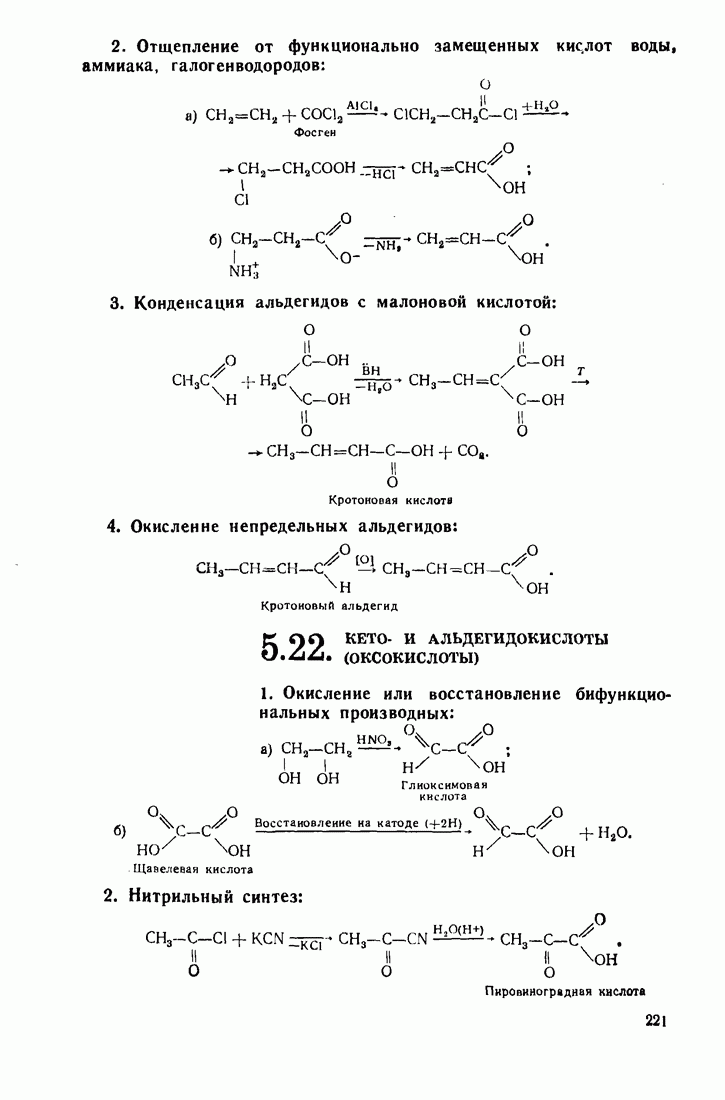
- 5.21. НЕПРЕДЕЛЬНЫЕ КИСЛОТЫ
- 5.22. КЕТО- И АЛЬДЕГИДОКИСЛОТЫ (ОКСОКИСЛОТЫ)
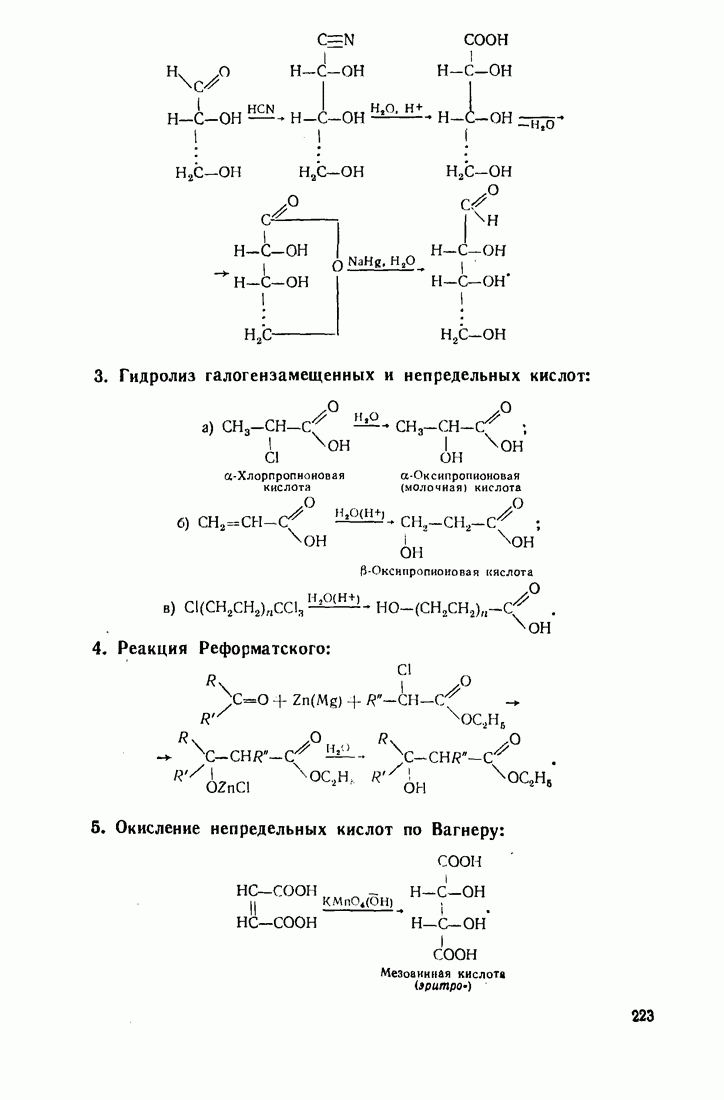
- 5.23. ОКСИКИСЛОТЫ
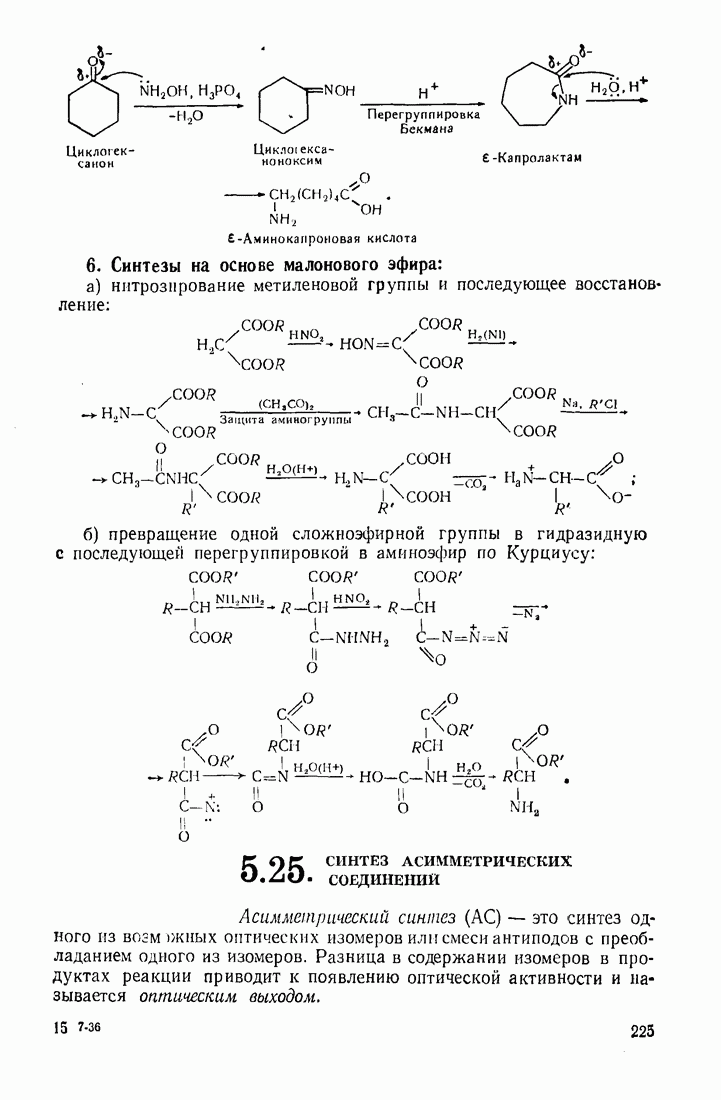
- 5.24. АМИНОКИСЛОТЫ
- 5.25 СИНТЕЗ АСИММЕТРИЧЕСКИХ СОЕДИНЕНИЙ
- 6. Некоторые понятия физической органической химии
- 6.1. СВЯЗЬ СОСТАВА И СТРОЕНИЯ СОЕДИНЕНИЙ С ФИЗИЧЕСКИМИ СВОЙСТВАМИ
- 6.2. ИДЕНТИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- 6.3. КИСЛОТЫ И ОСНОВАНИЯ В ОРГАНИЧЕСКОЙ ХИМИИ
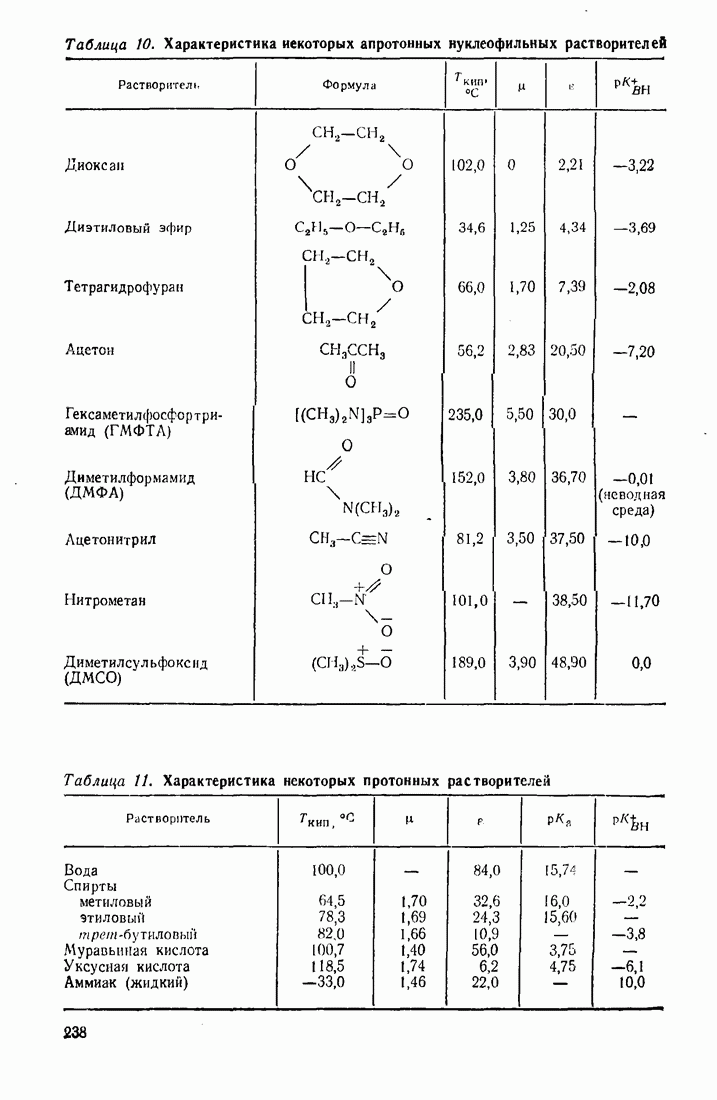
- 6.4. ОРГАНИЧЕСКИЕ РАСТВОРИТЕЛИ И ИХ ВЛИЯНИЕ НА СКОРОСТЬ И МЕХАНИЗМ РЕАКЦИЙ
- 6.5. КАТАЛИЗ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- 7. Бензол и его производные
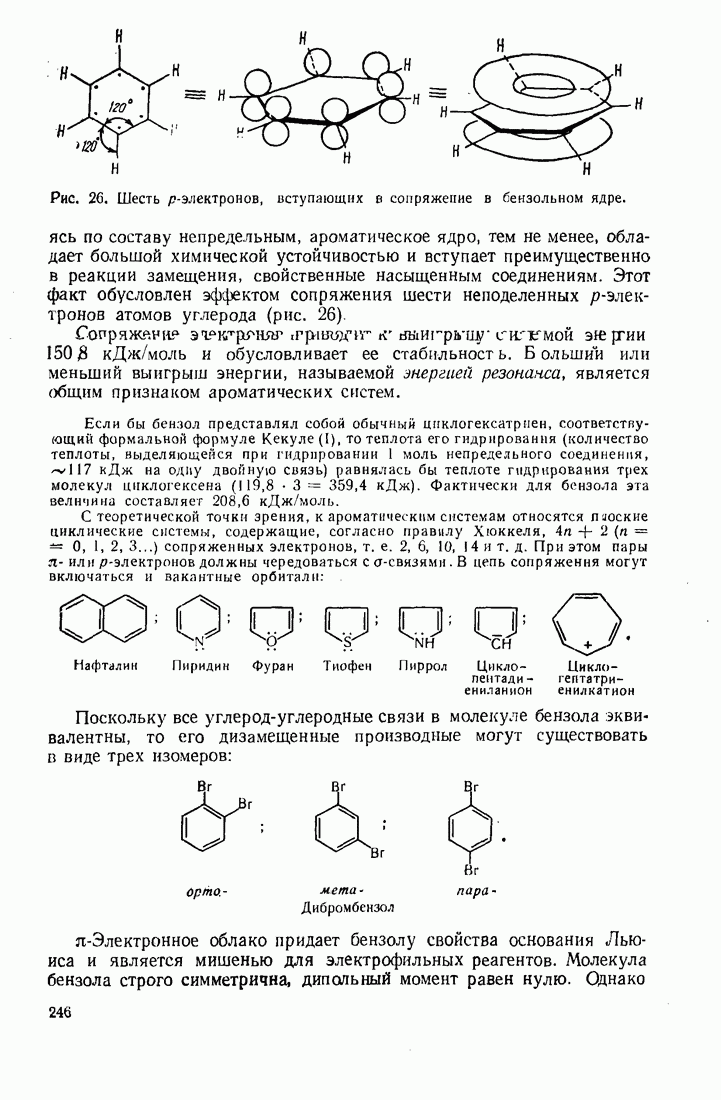
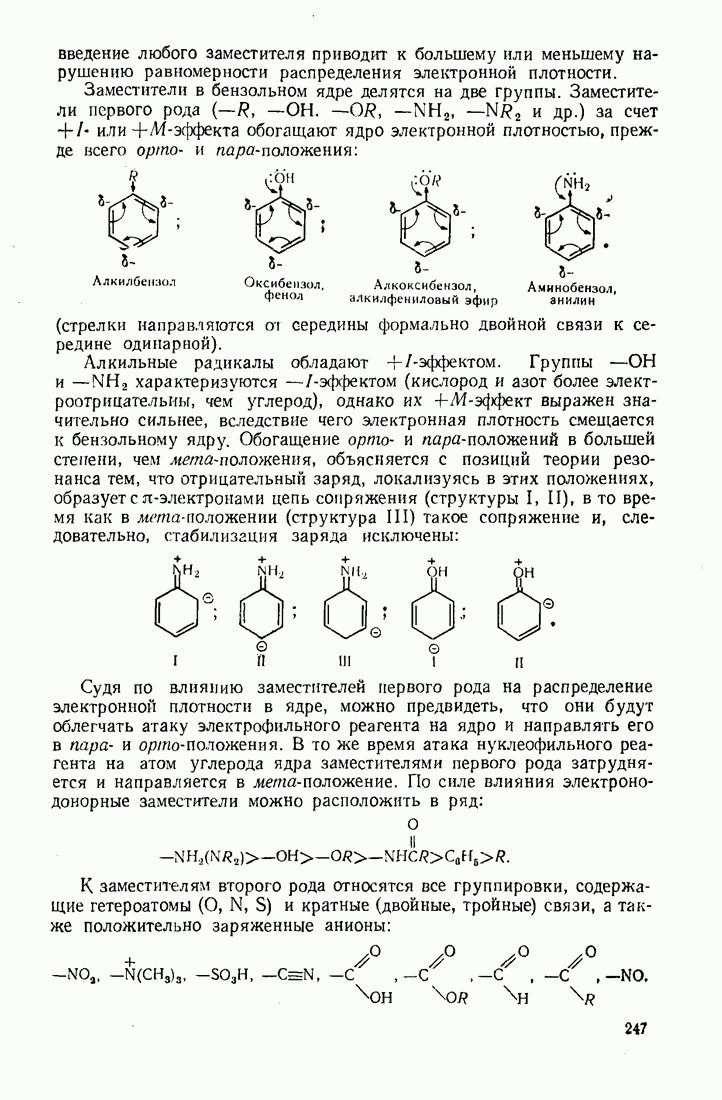
- 7.1. СТРОЕНИЕ БЕНЗОЛА. РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ
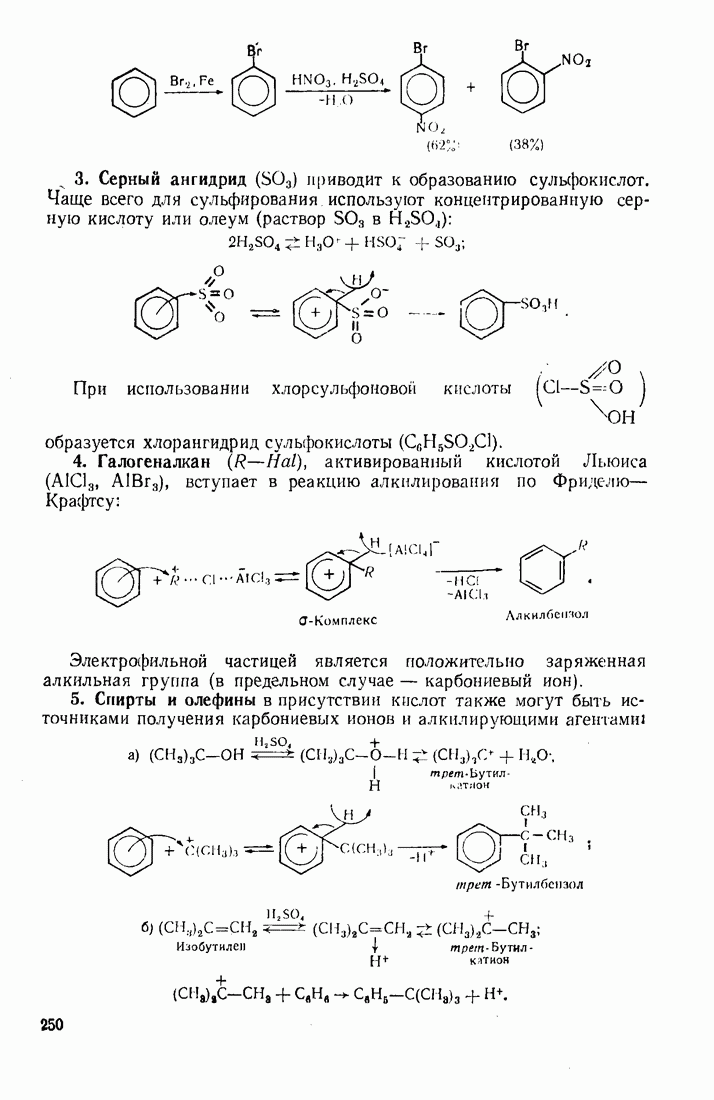
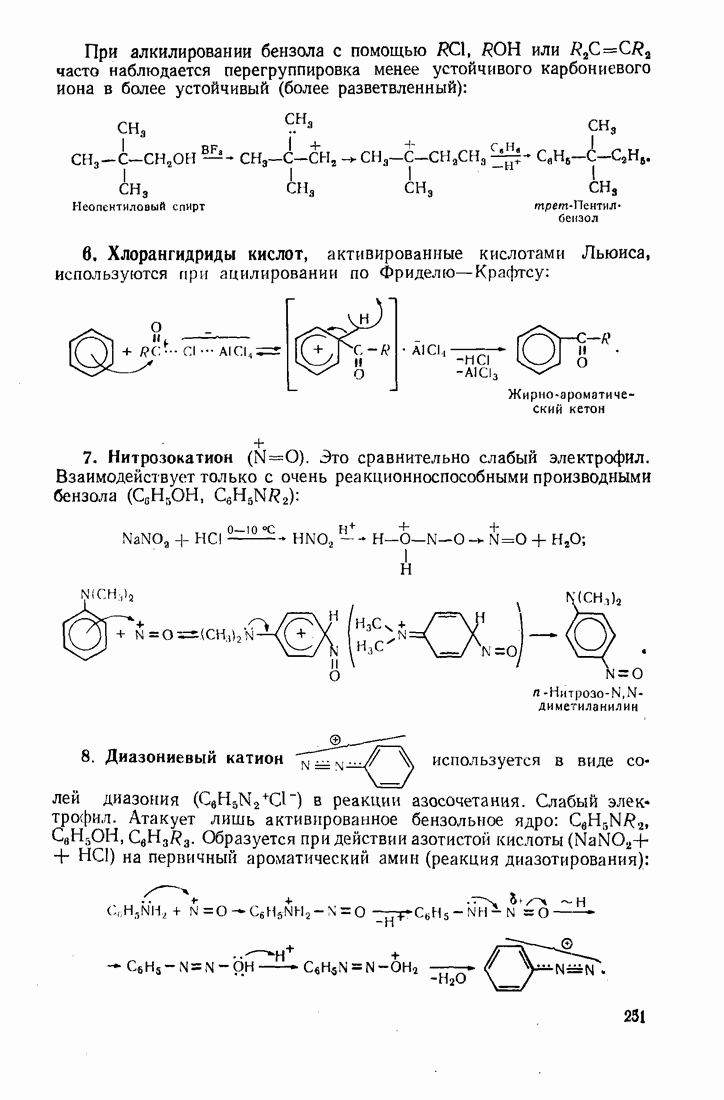
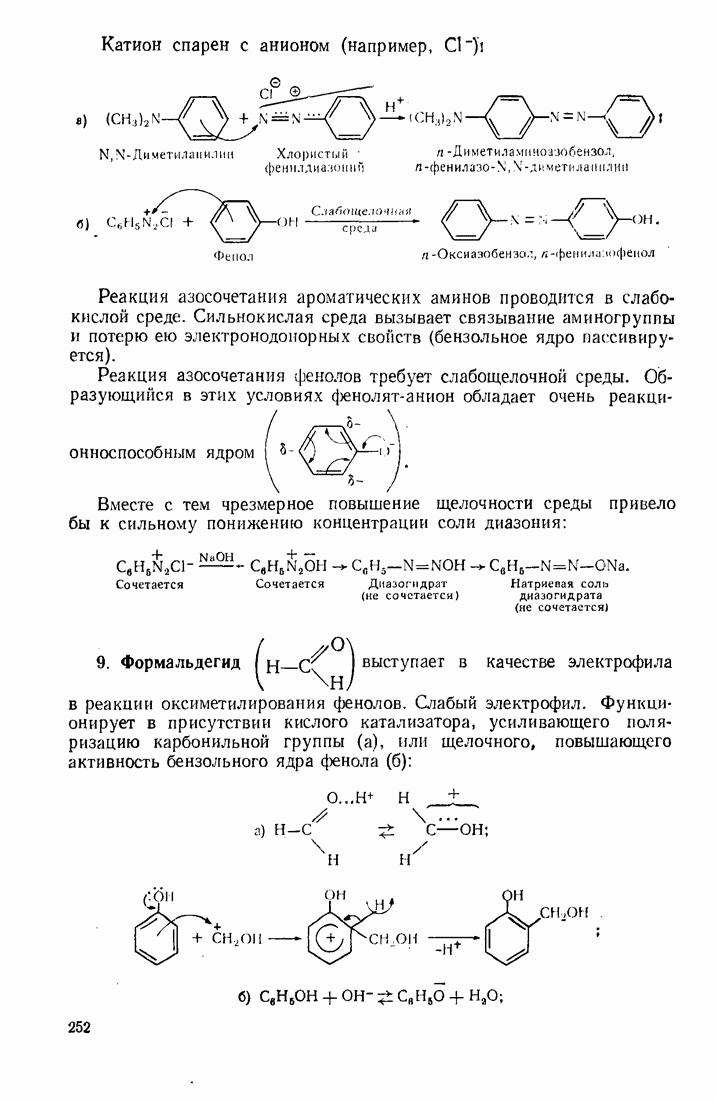
- 7.2. ЭЛЕКТРОФИЛЬНОЕ ЗАМЕЩЕНИЕ В БЕНЗОЛЬНОМ ЯДРЕ
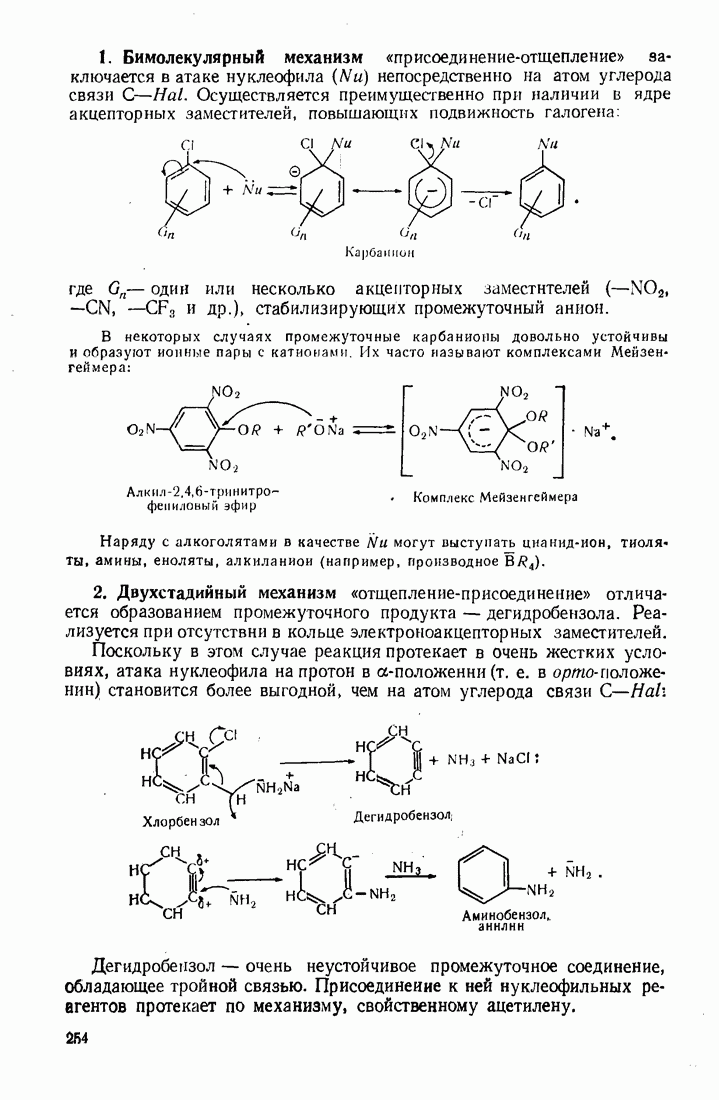
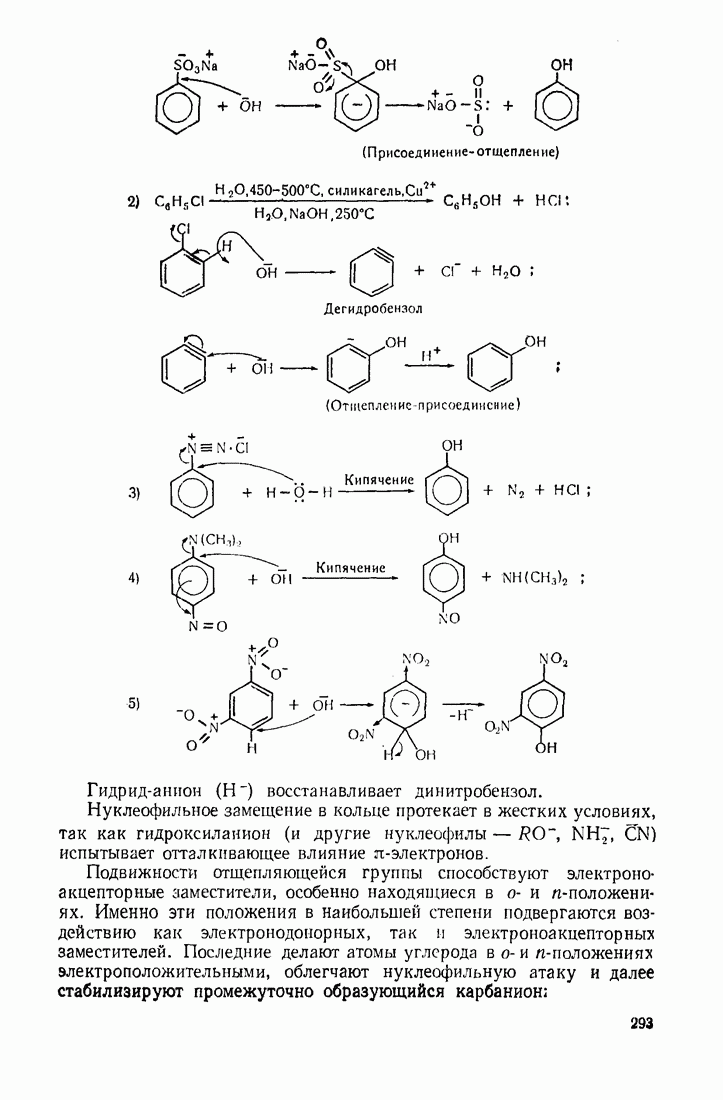
- 7.3. НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ В БЕНЗОЛЬНОМ ЯДРЕ
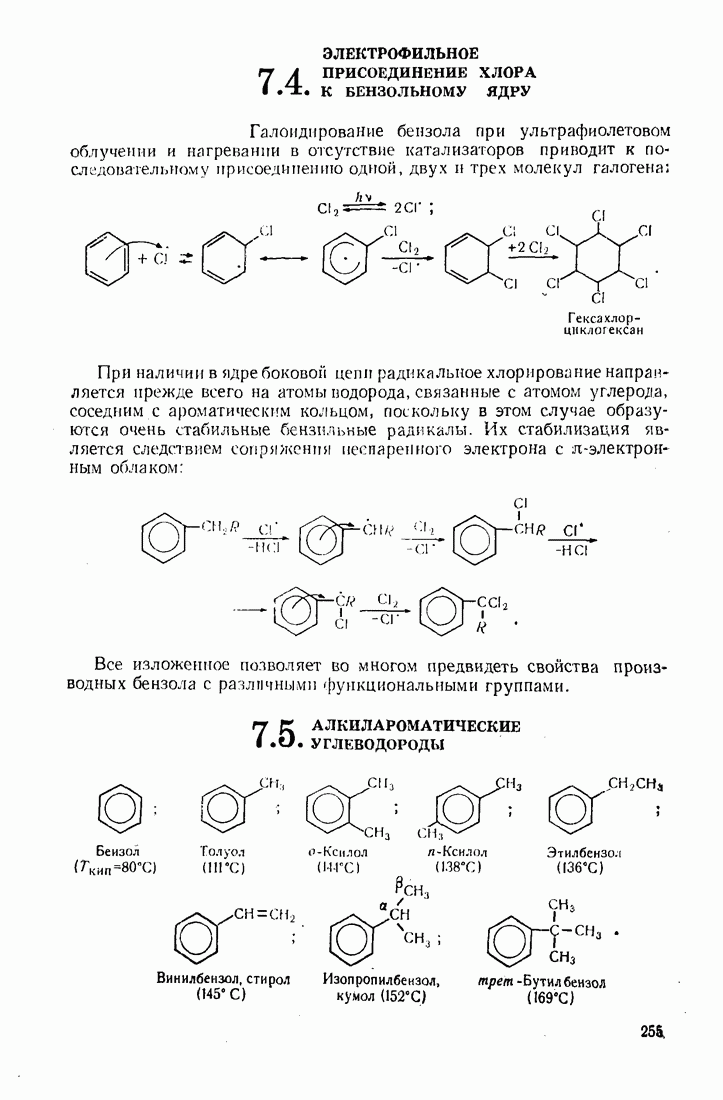
- 7.4. ЭЛЕКТРОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ ХЛОРА К БЕНЗОЛЬНОМУ ЯДРУ
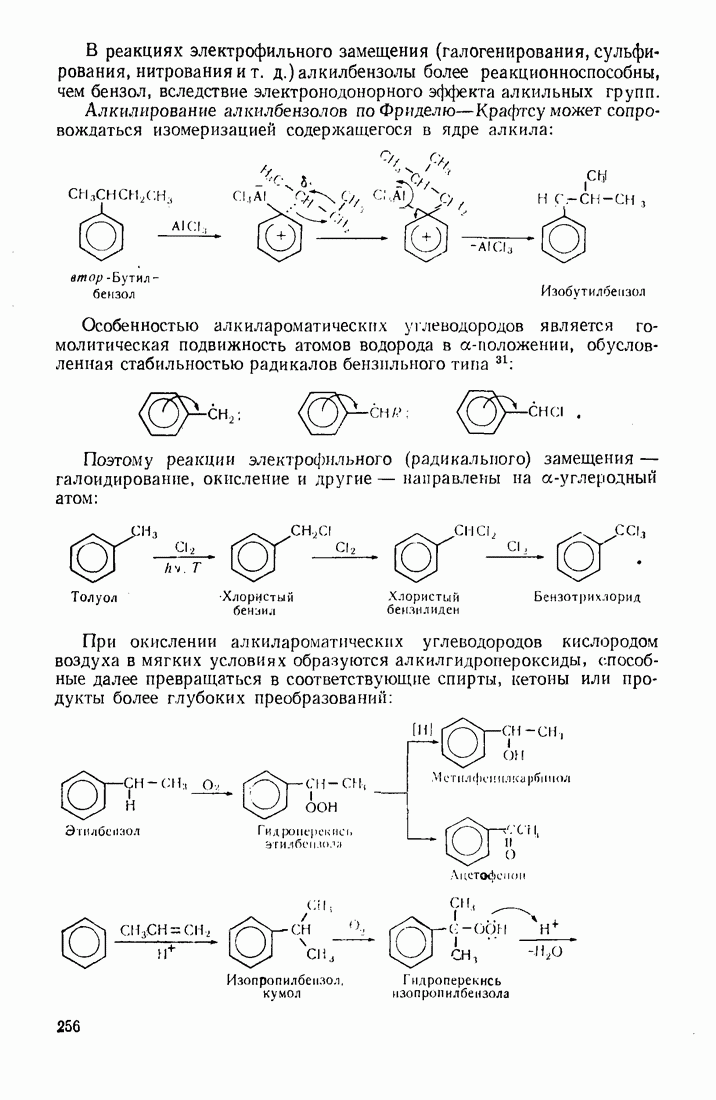
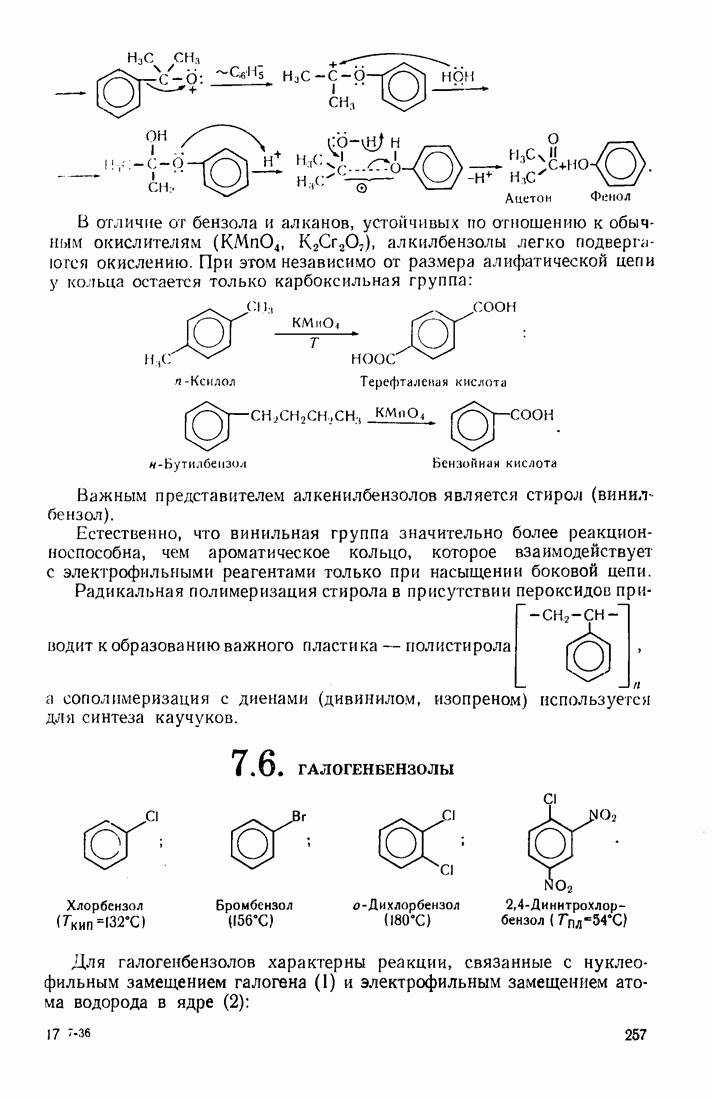
- 7.5. АЛКИЛАРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
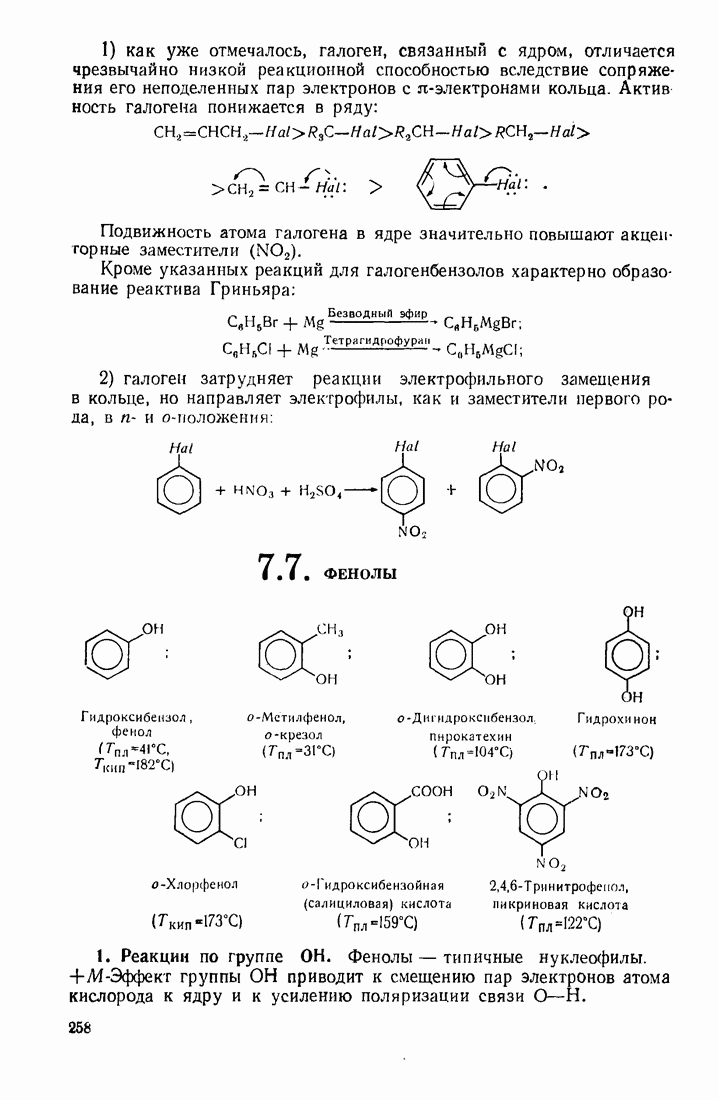
- 7.6. ГАЛОГЕНБЕНЗОЛЫ
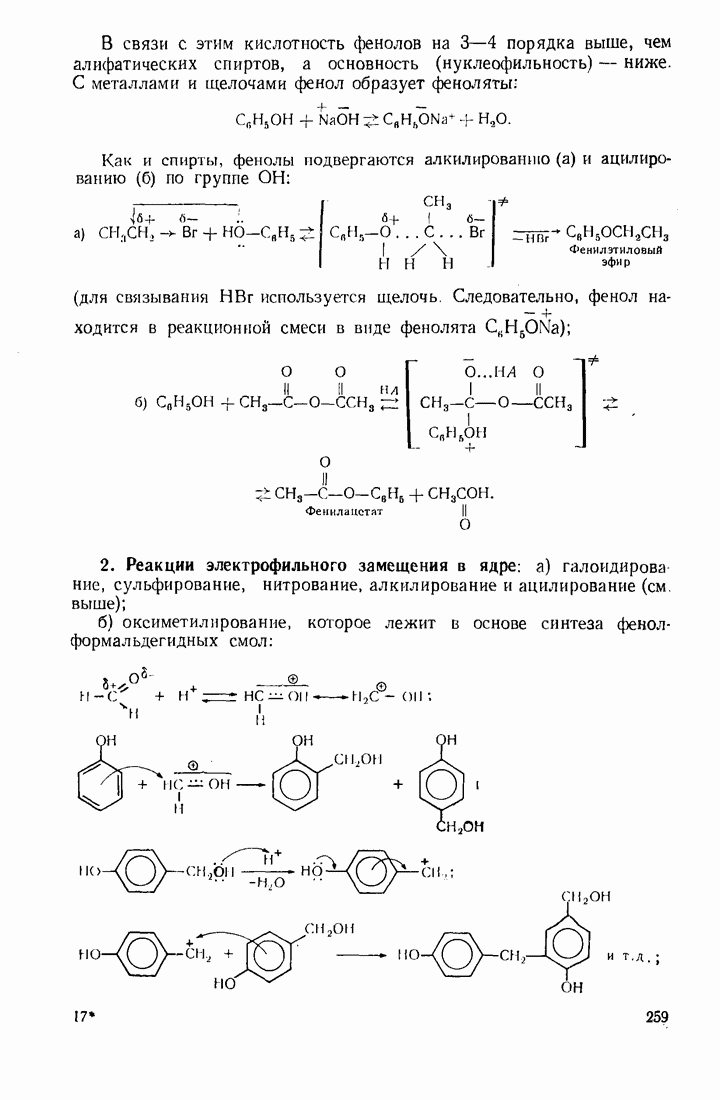
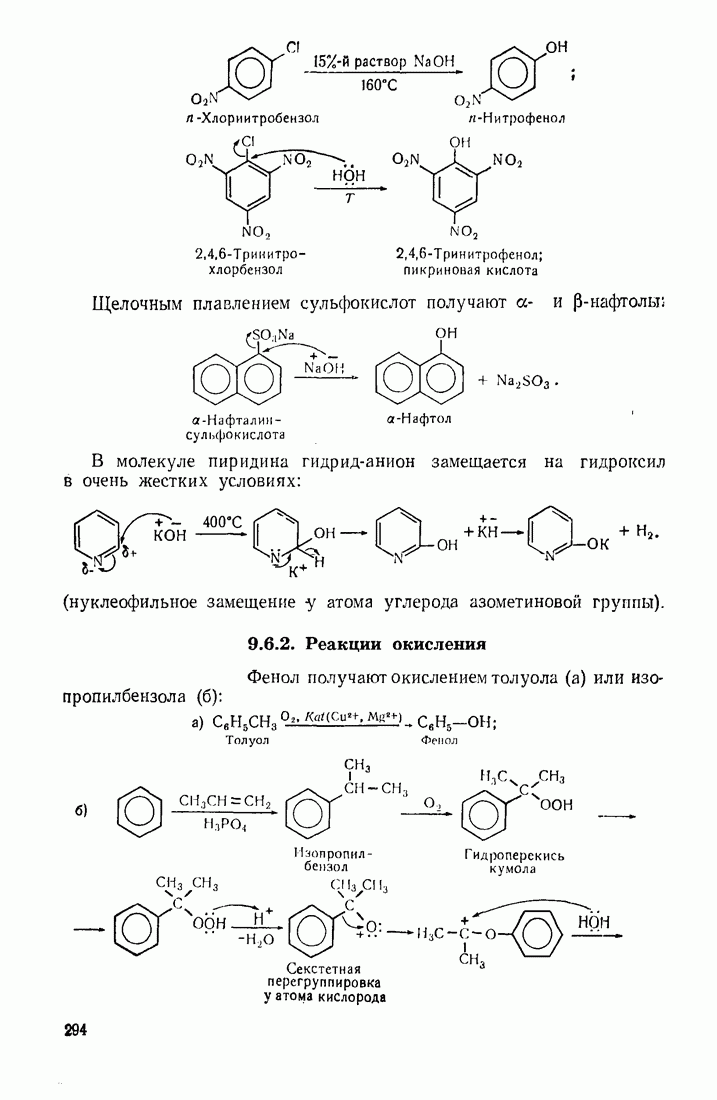
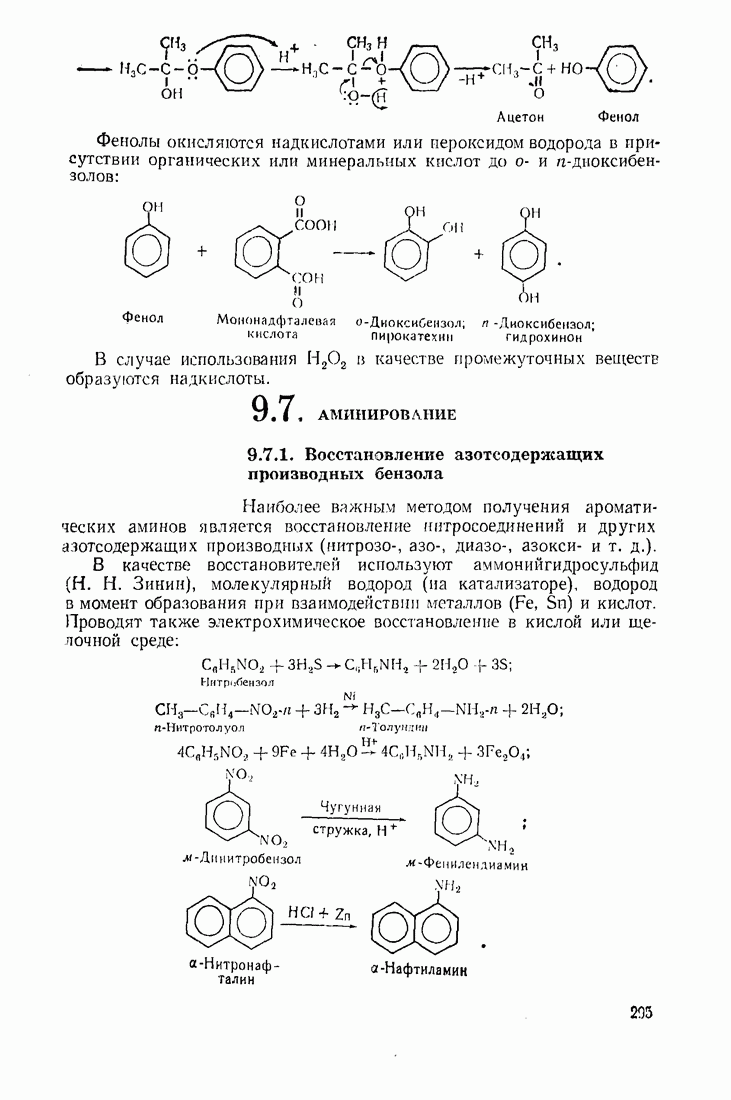
- 7.7. ФЕНОЛЫ
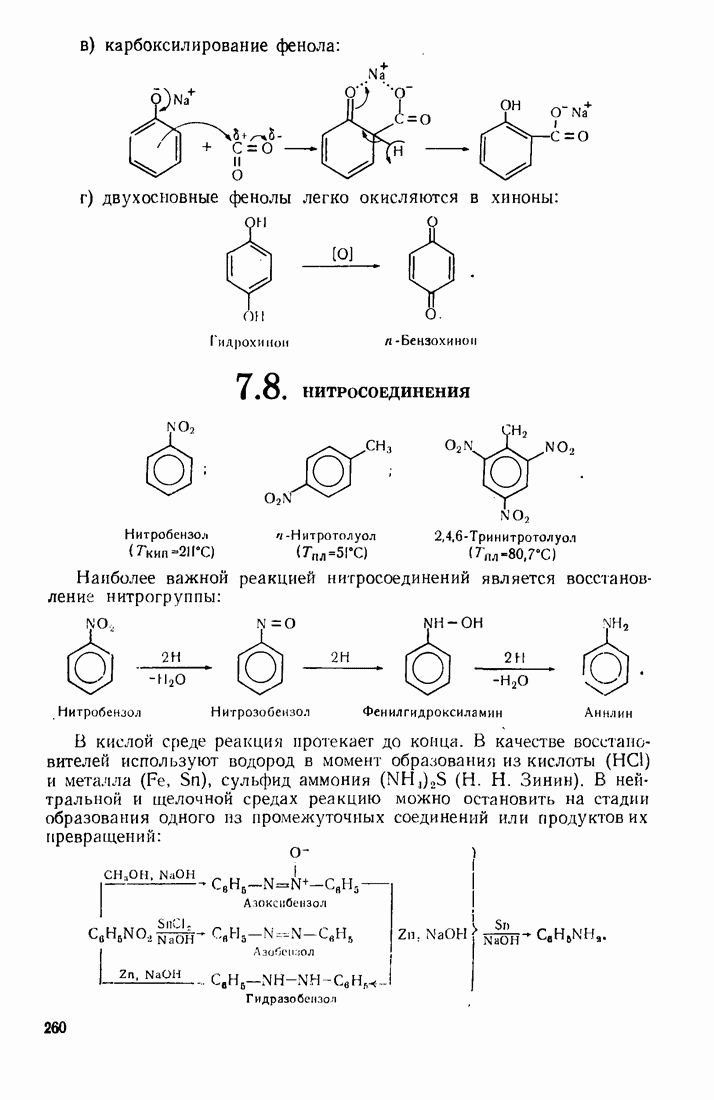
- 7.8. НИТРОСОЕД ИНЕНИЯ
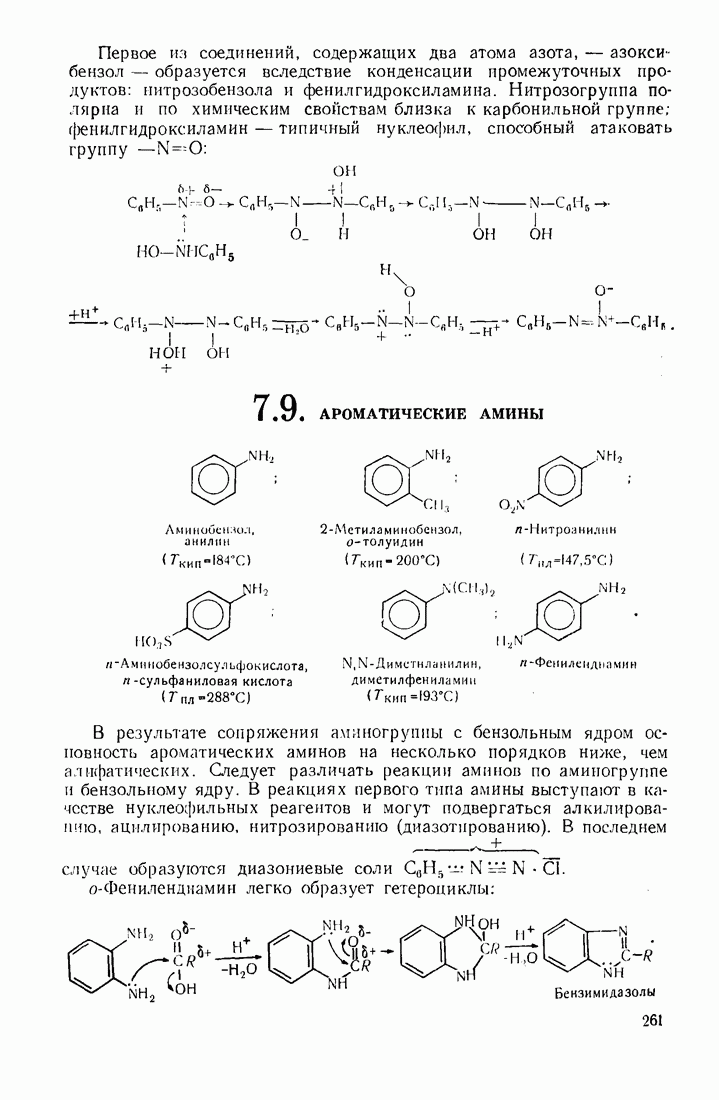
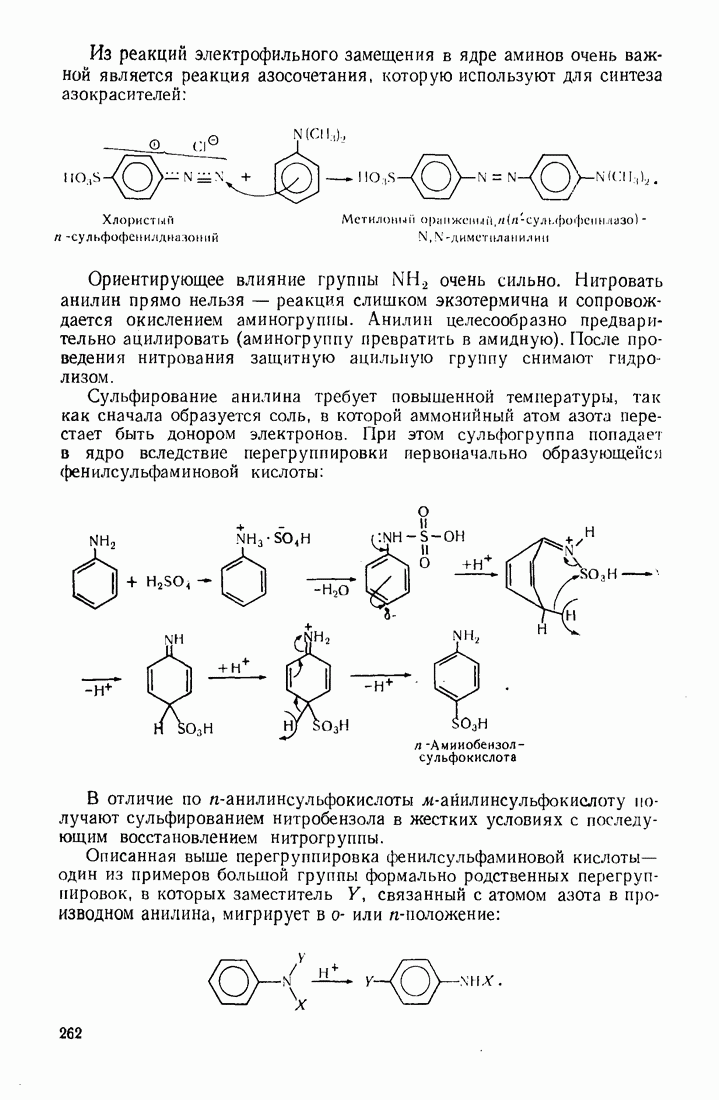
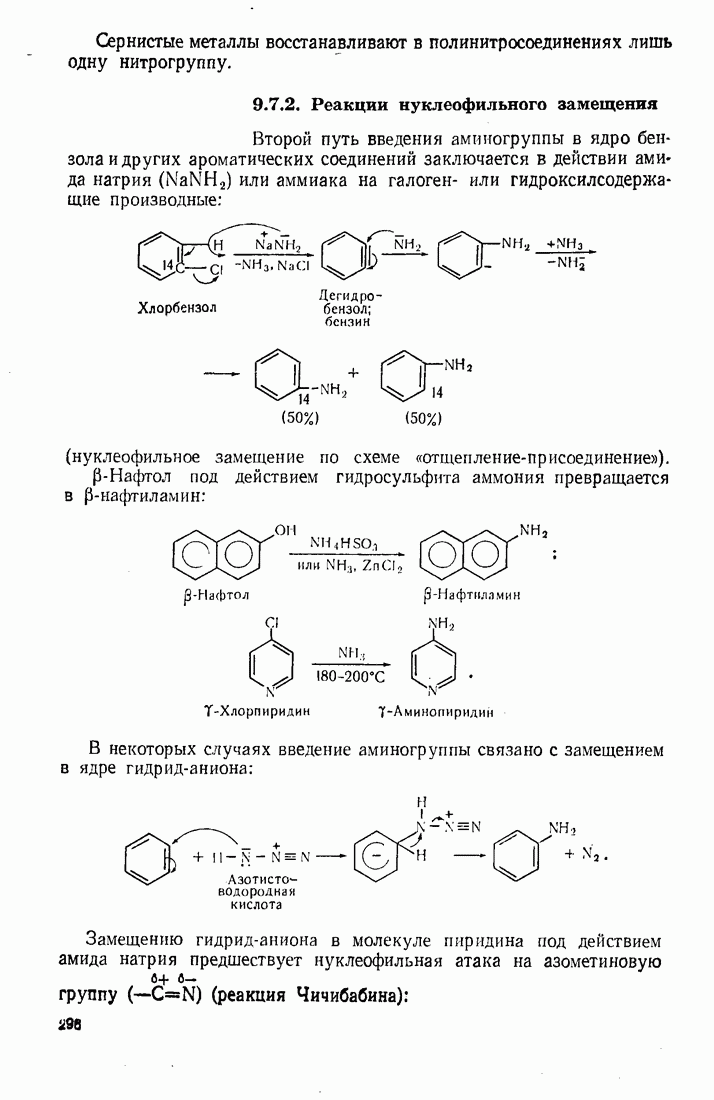
- 7.9. АРОМАТИЧЕСКИЕ АМИНЫ
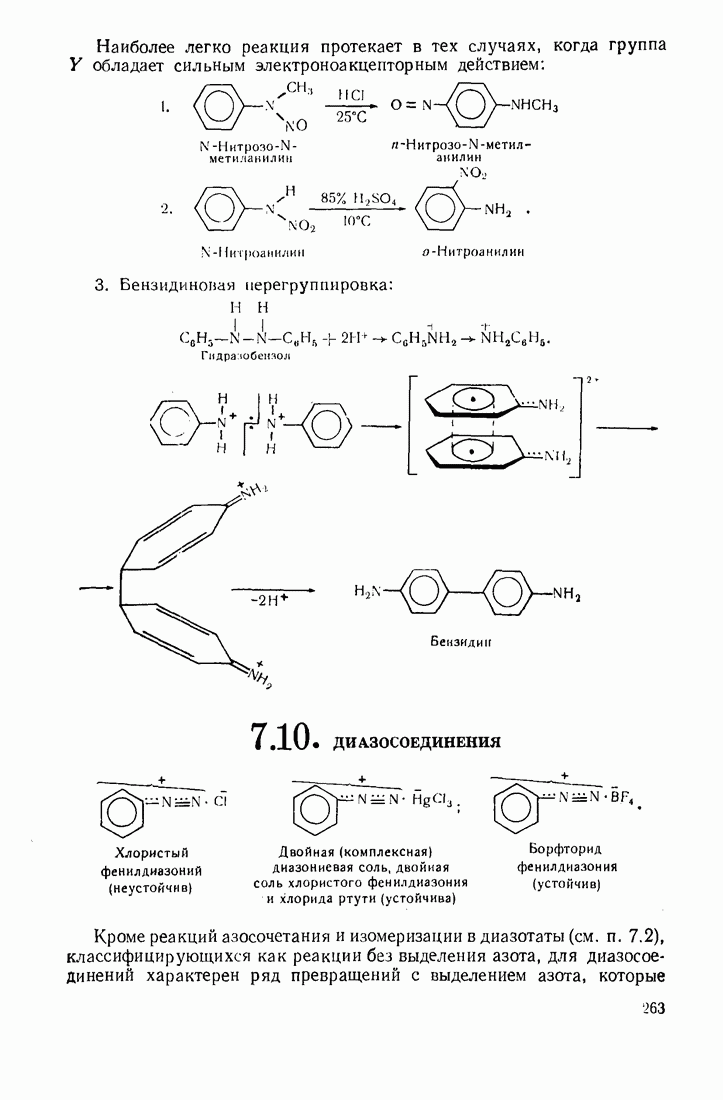
- 7.10. ДИАЗОСОЕДИНЕНИЯ
- 7.11. АЗОСОЕДИНЕНИЯ
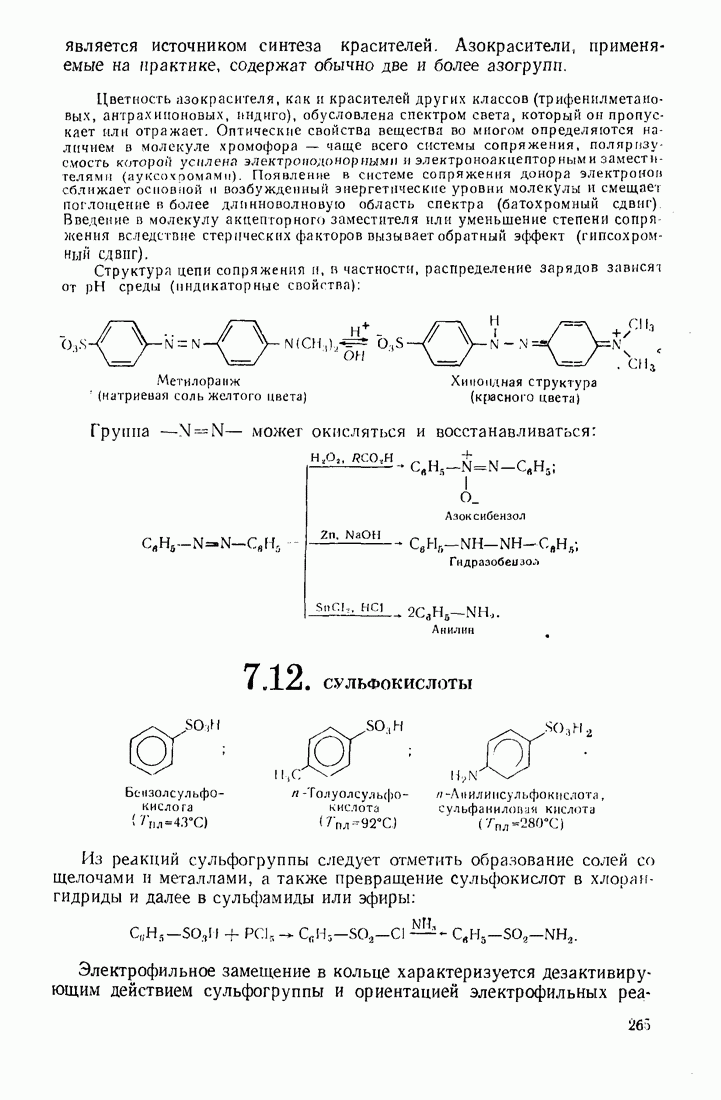
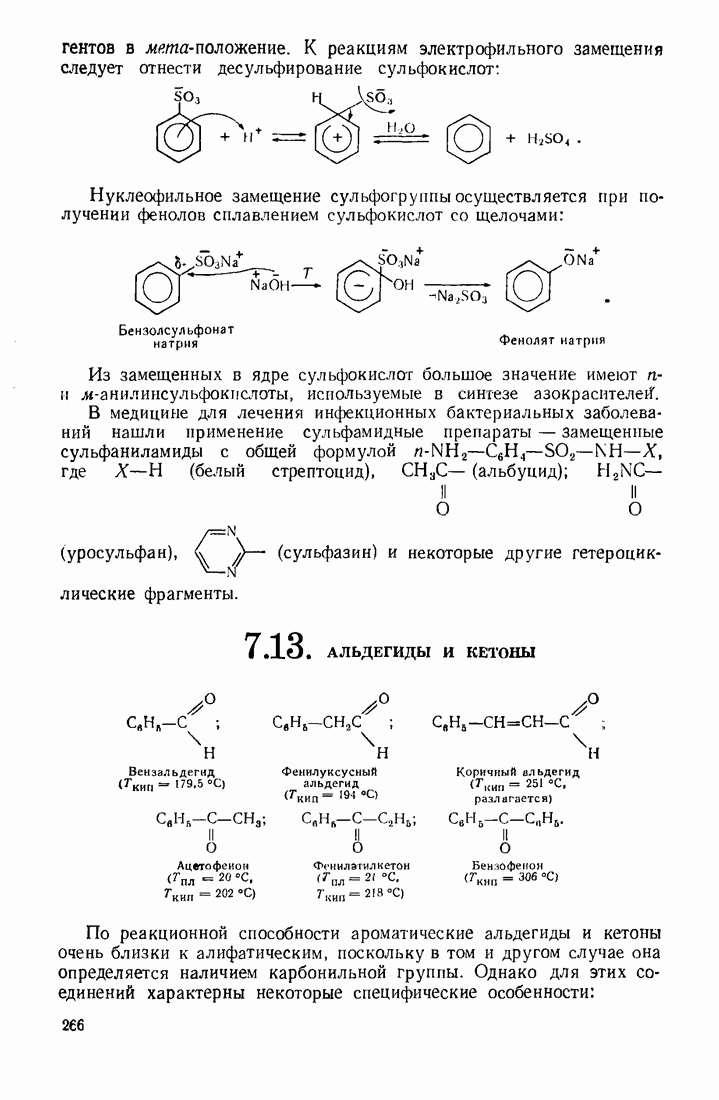
- 7.12. СУЛЬФОКИСЛОТЫ
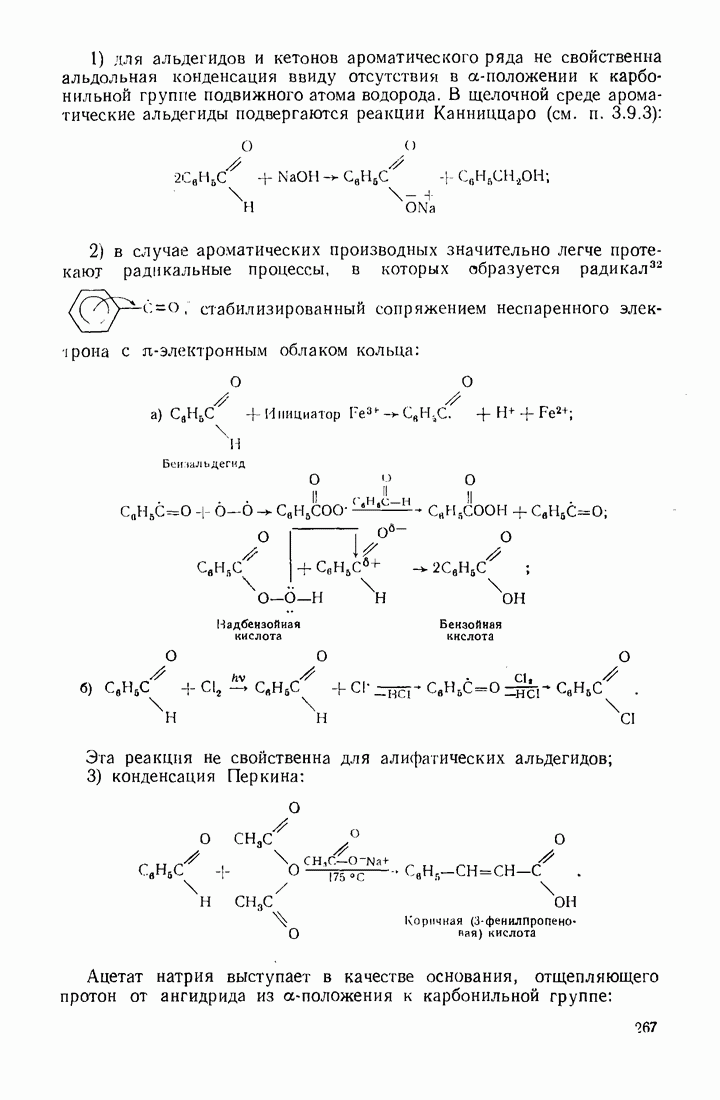
- 7.13. АЛЬДЕГИДЫ И КЕТОНЫ
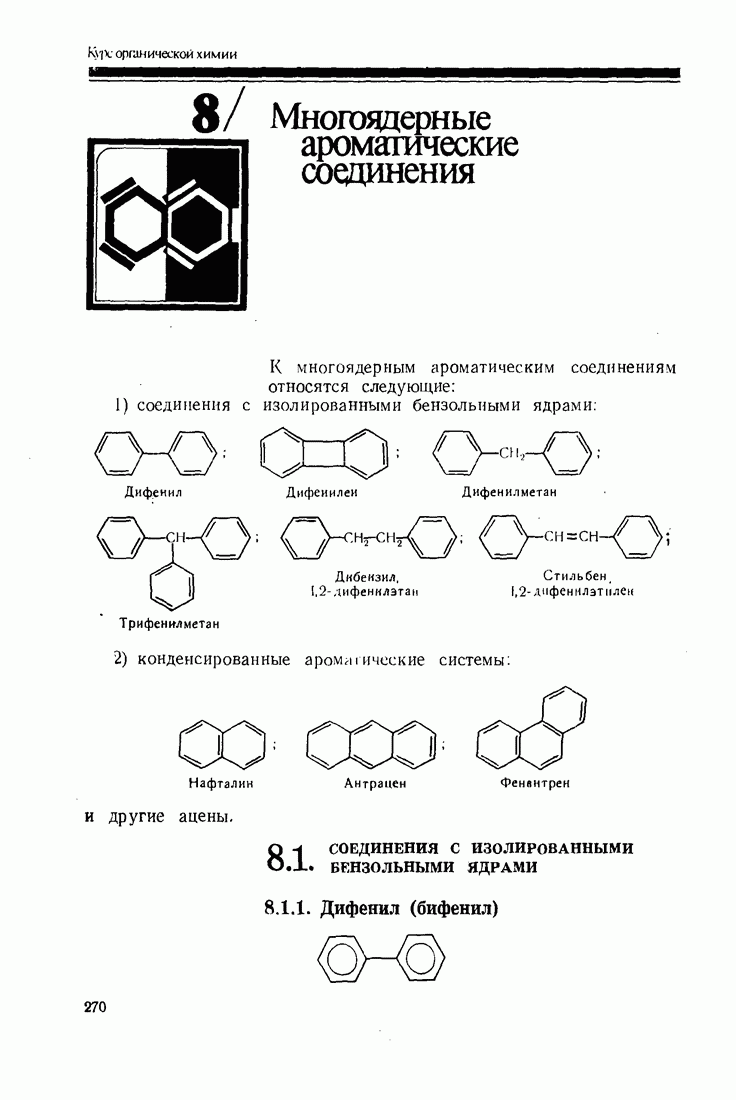
- 8. Многоядерные ароматические соединения
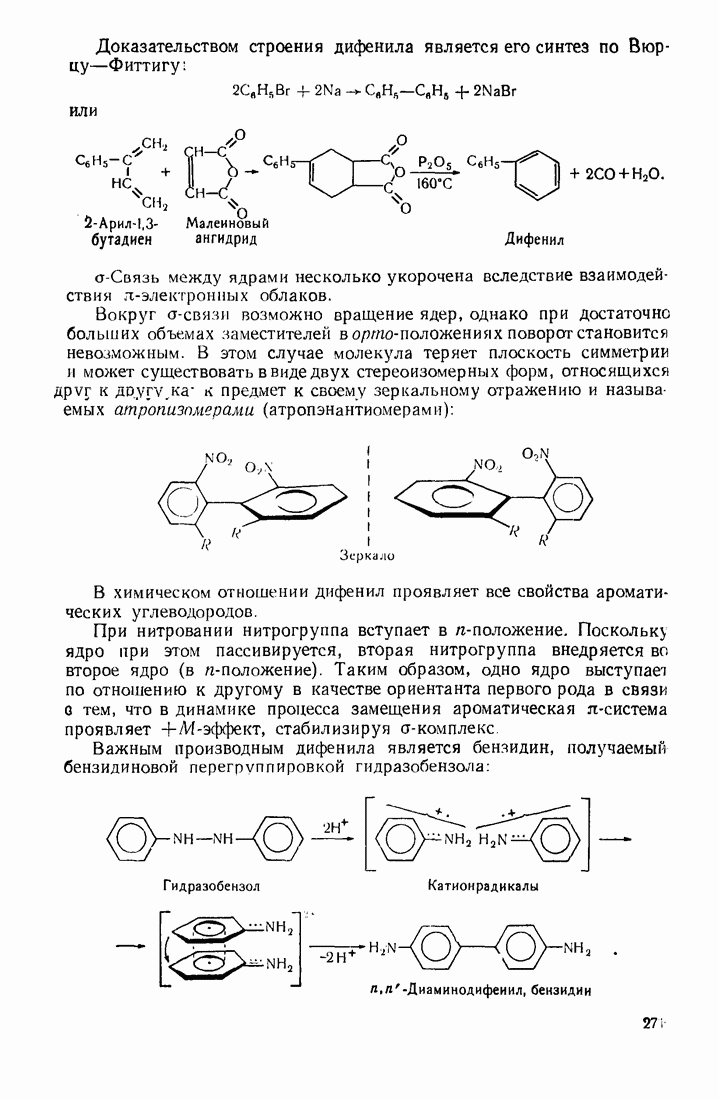
- 8.1. СОЕДИНЕНИЯ С ИЗОЛИРОВАННЫМИ БЕНЗОЛЬНЫМИ ЯДРАМИ
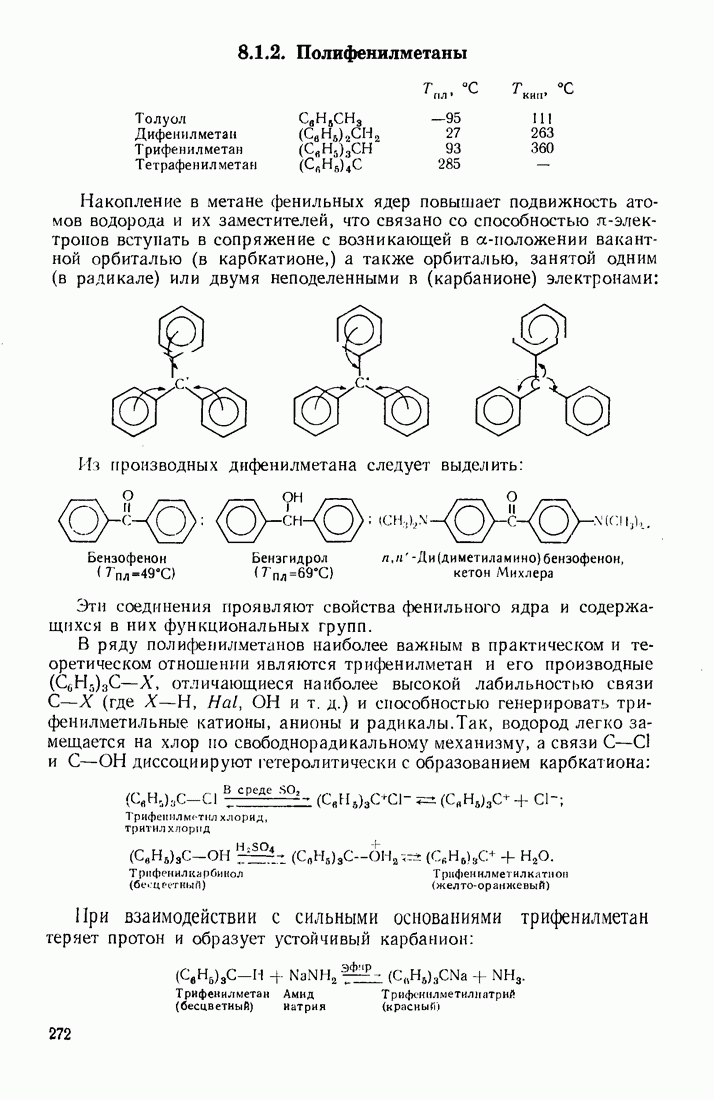
- 8.1.2. Полифенилметаны
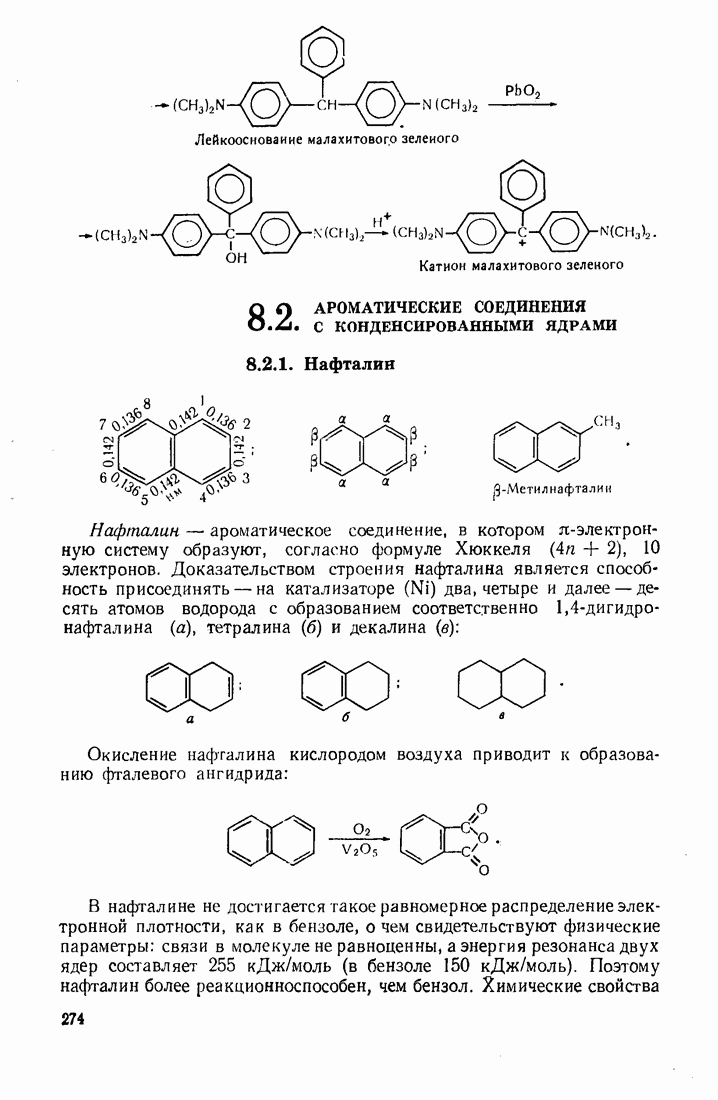
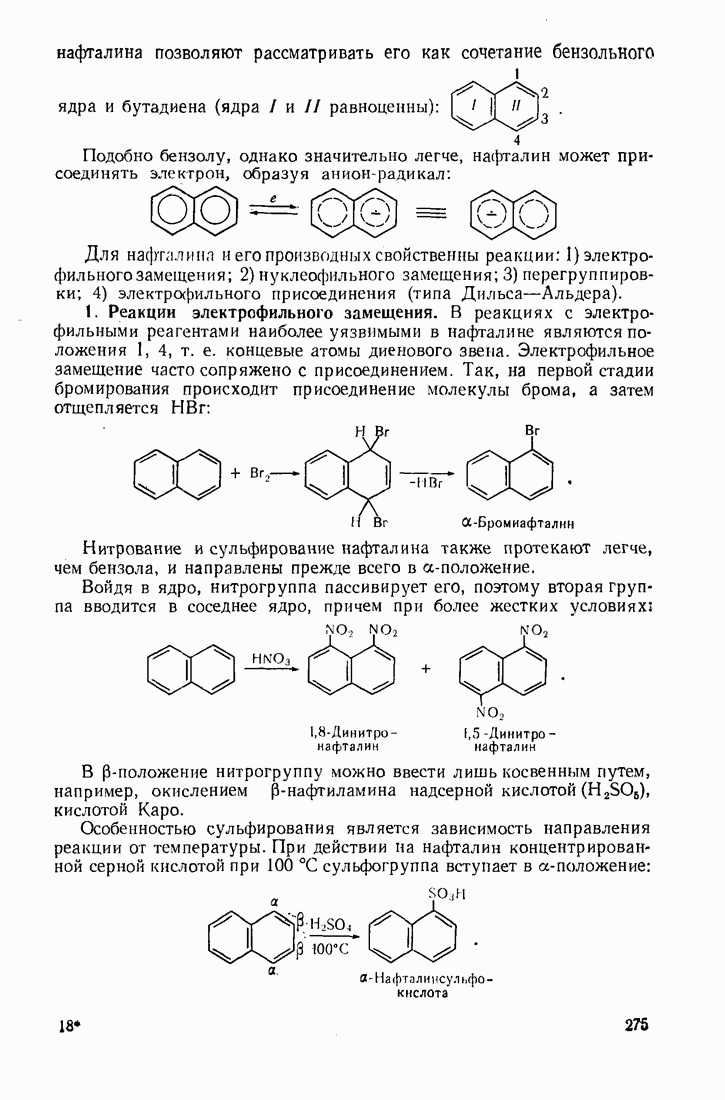
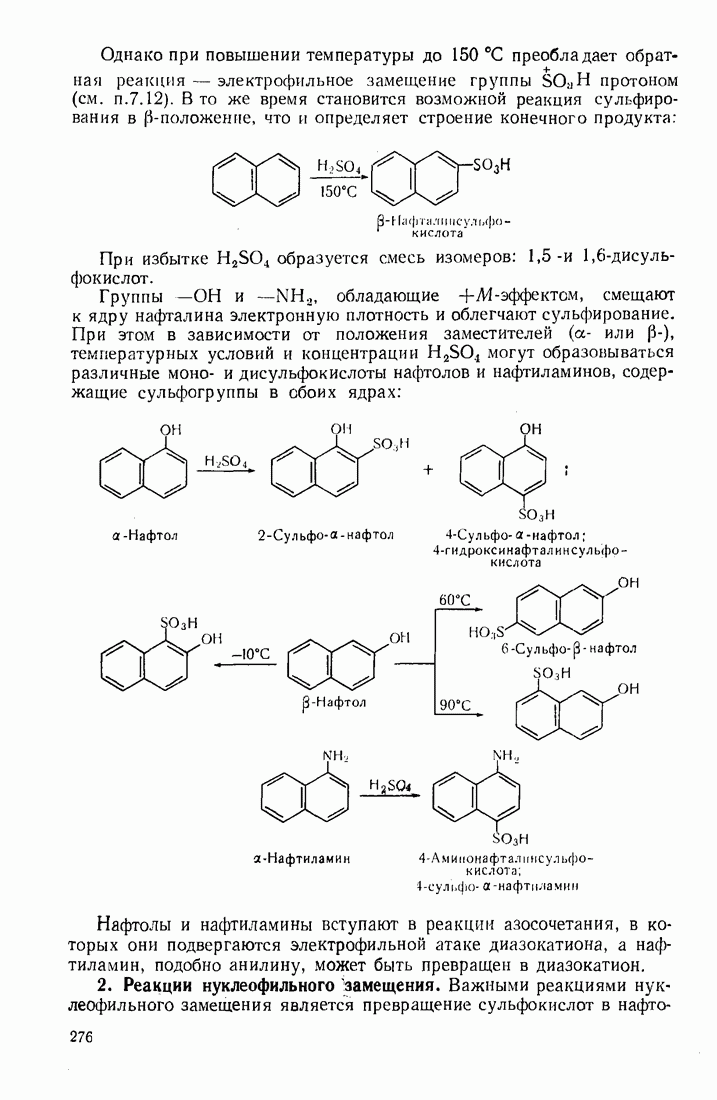
- 8.2. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ С КОНДЕНСИРОВАННЫМИ ЯДРАМИ
- 8.2.2. Антрацен
- 8.2.3. Фенантрен
- 9. Методы синтеза в ряду ароматических соединений
- 9.1. ГАЛОГЕНИРОВАНИЕ
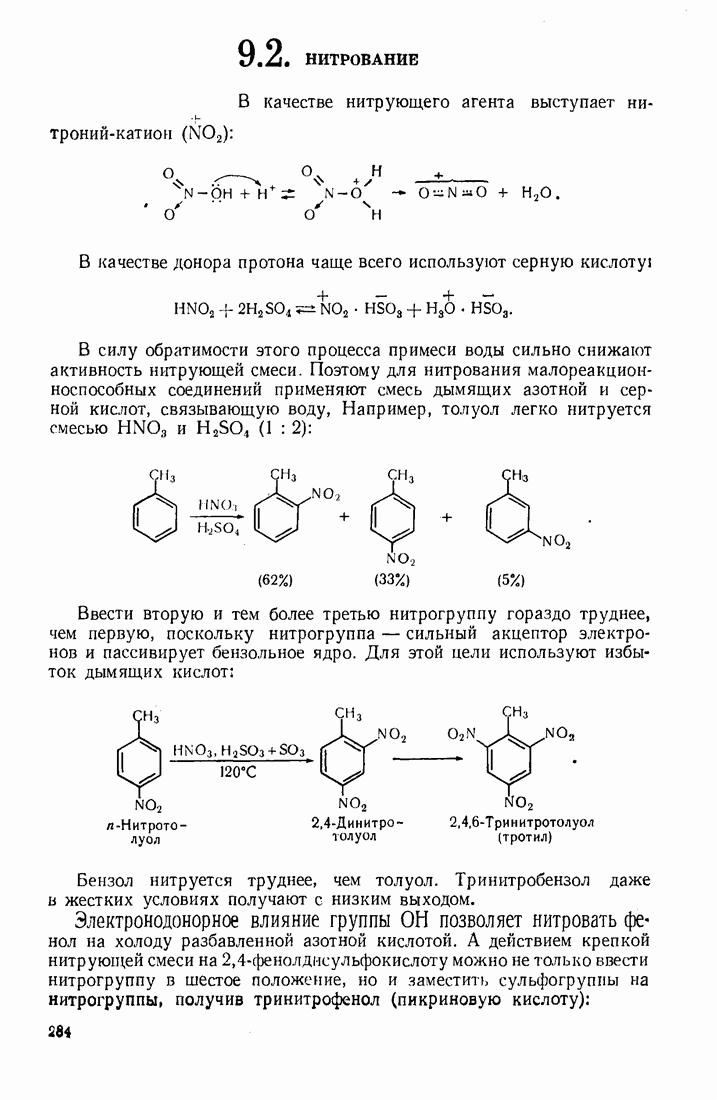
- 9.2. НИТРОВАНИЕ
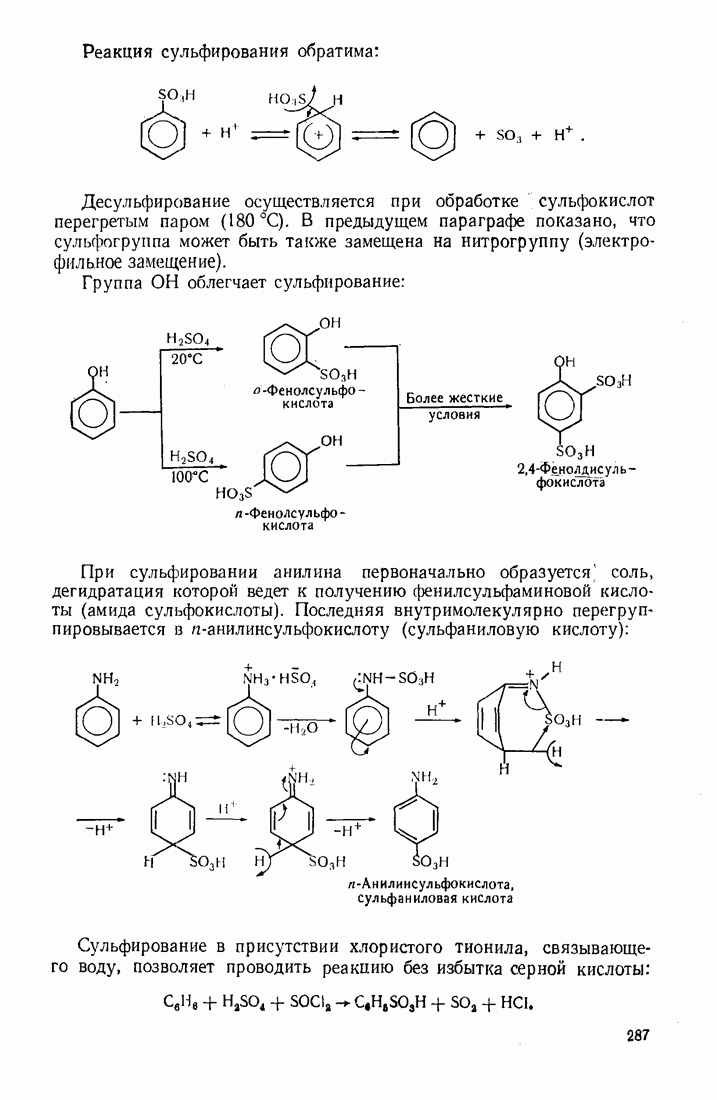
- 9.3. СУЛЬФИРОВАНИЕ
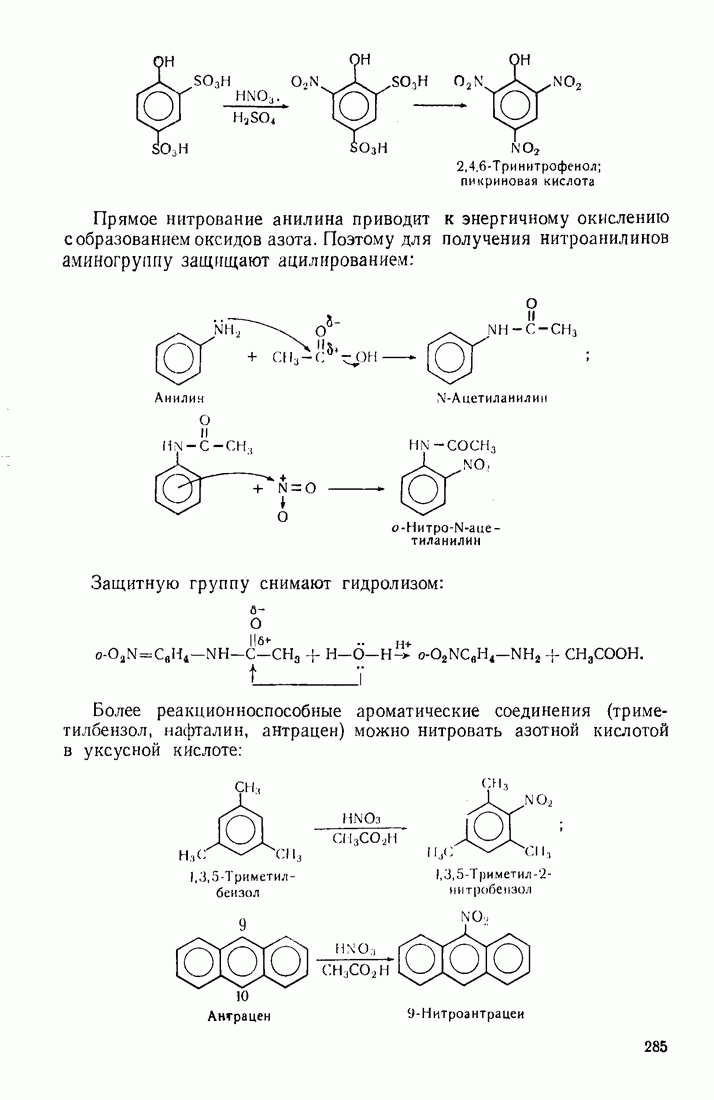
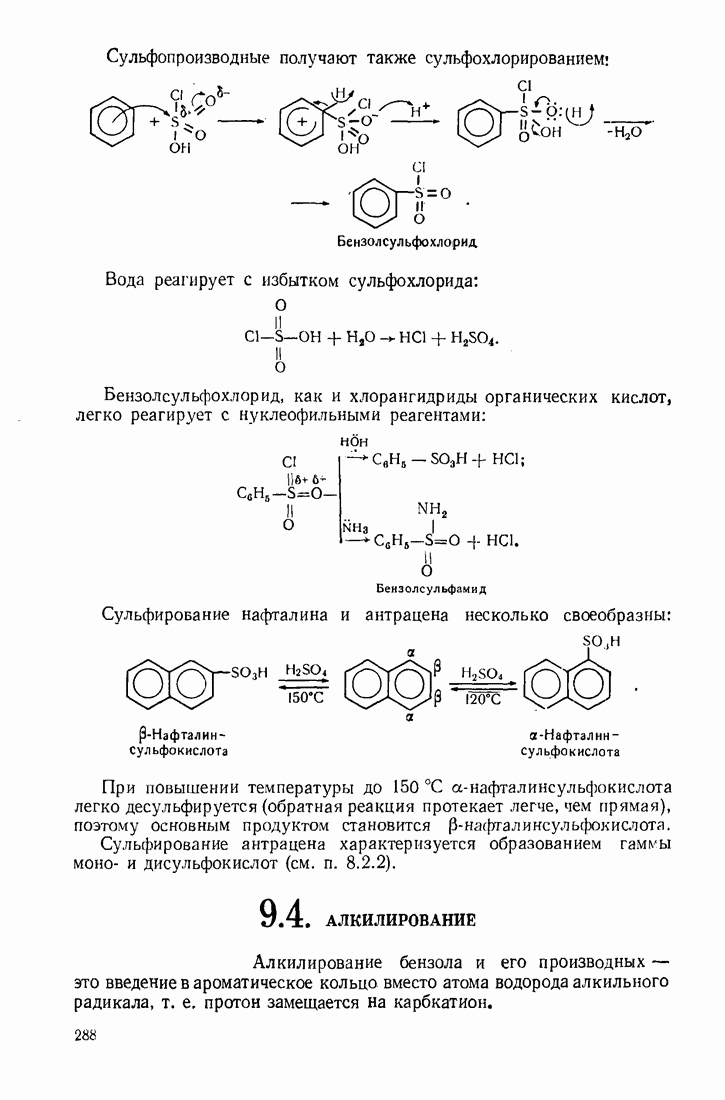
- 9.4. АЛКИЛИРОВАНИЕ
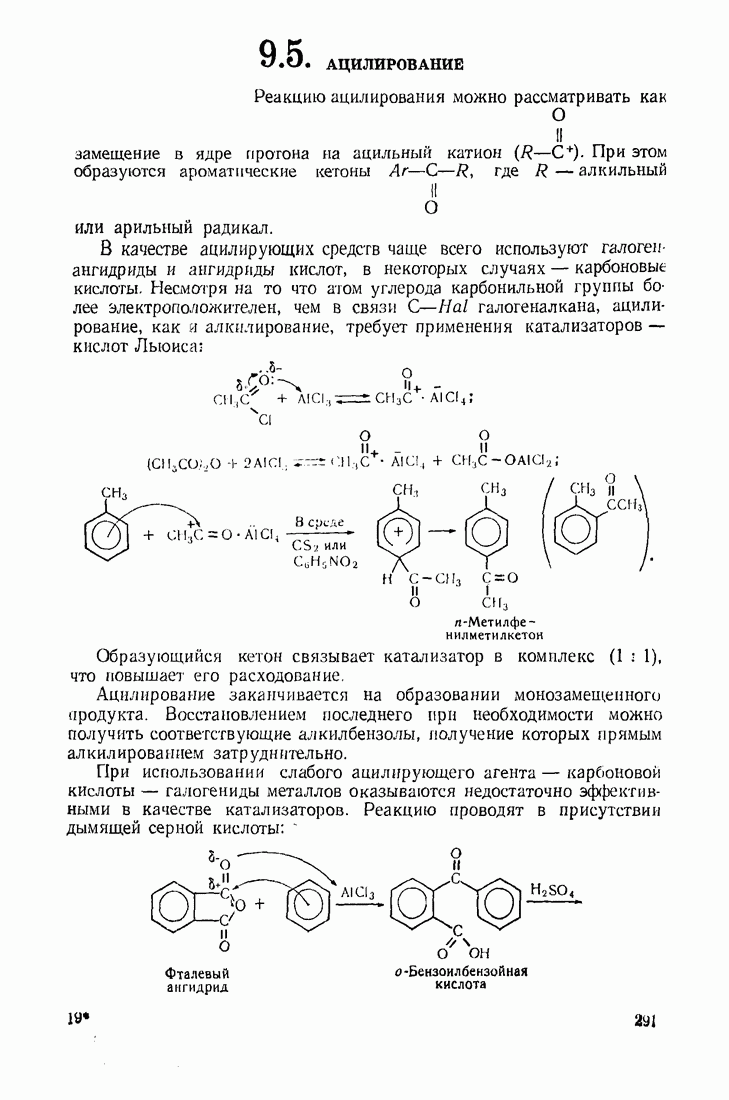
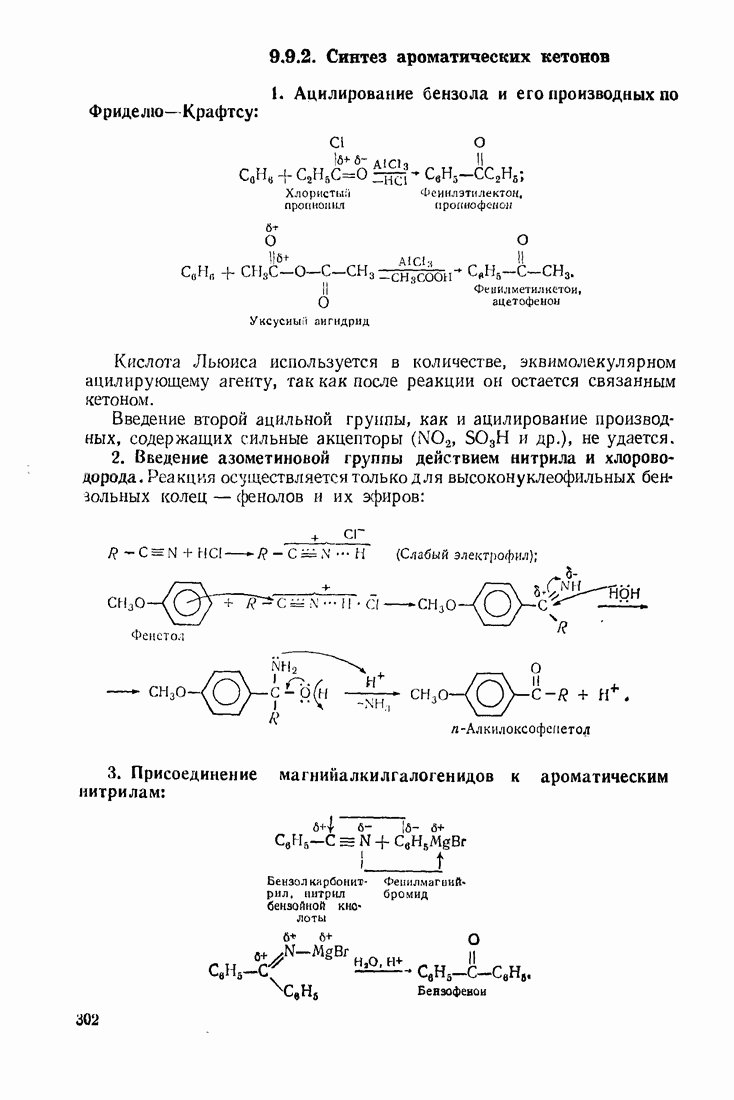
- 9.5. АЦИЛИРОВАНИЕ
- 9.6. ГИДРОКСИЛИРОВАНИЕ
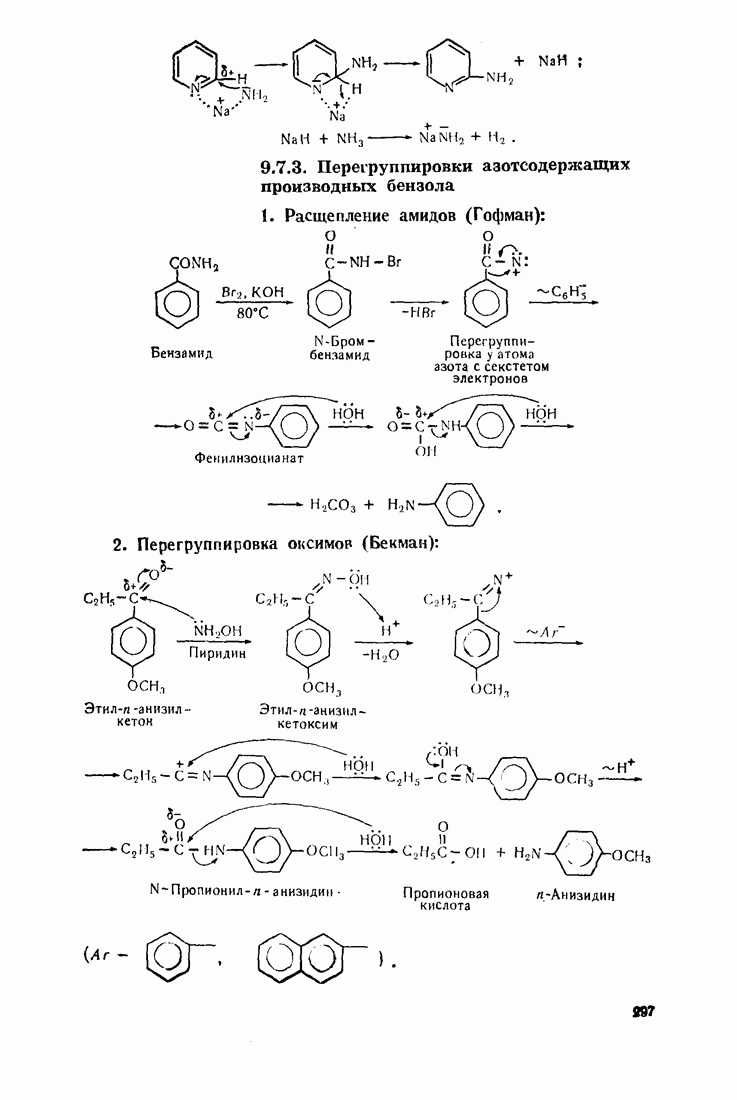
- 9.7. АМИНИРОВАНИЕ
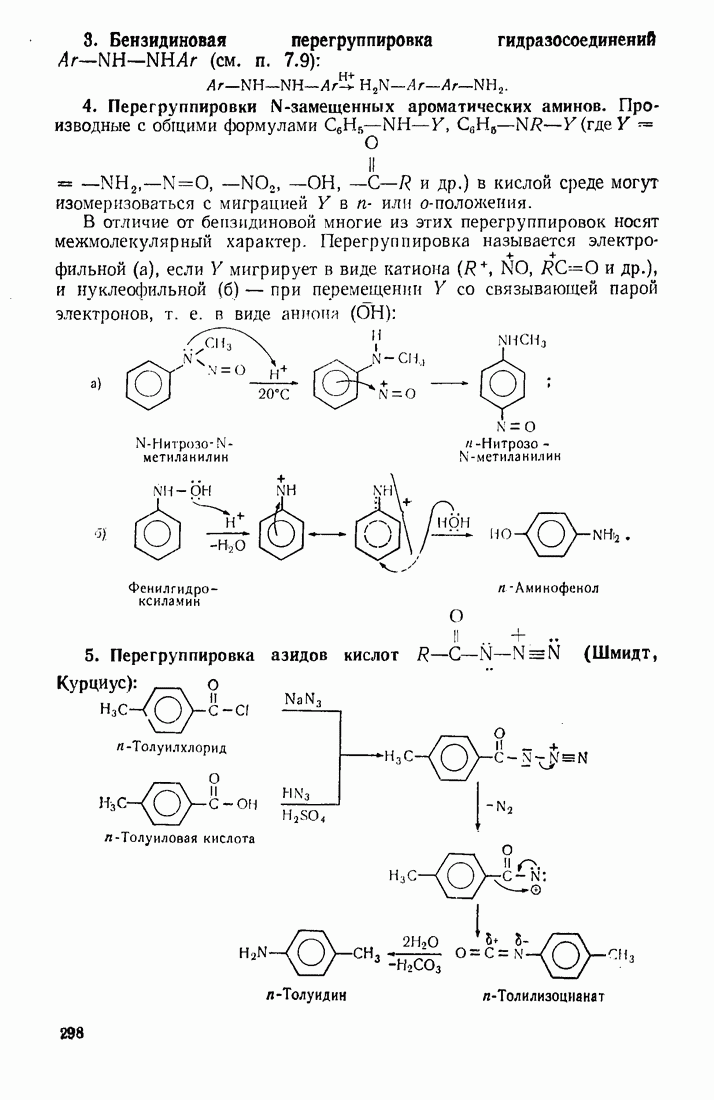
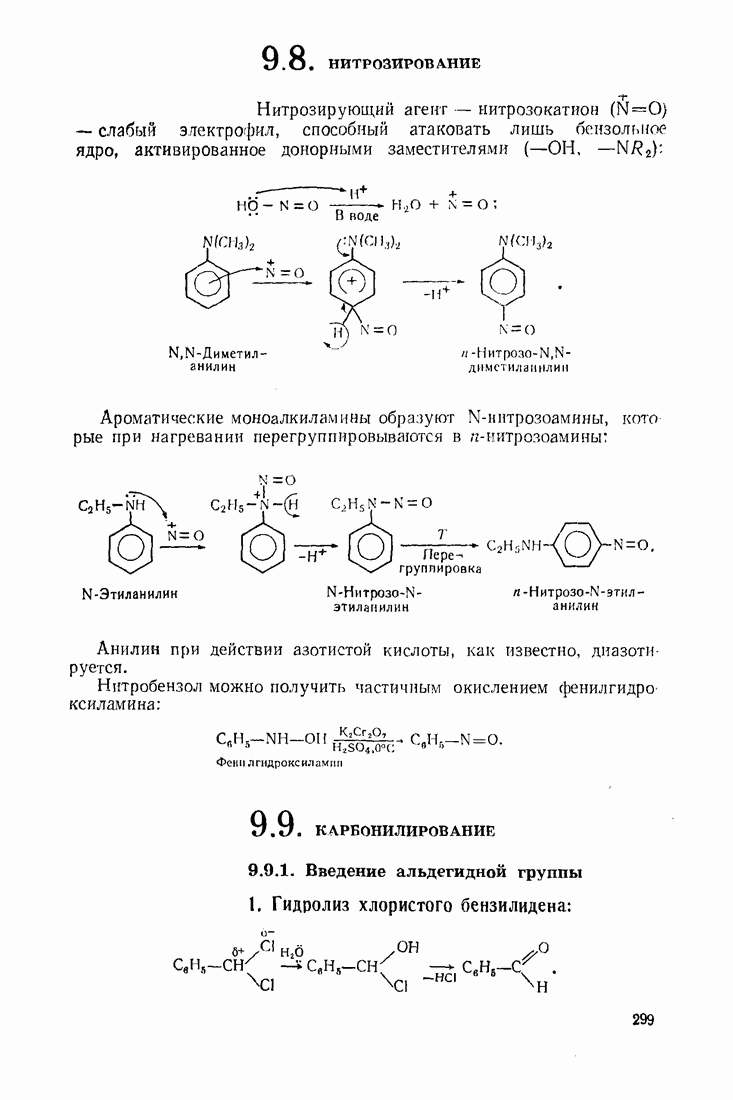
- 9.8. НИТРОЗИРОВАНИЕ
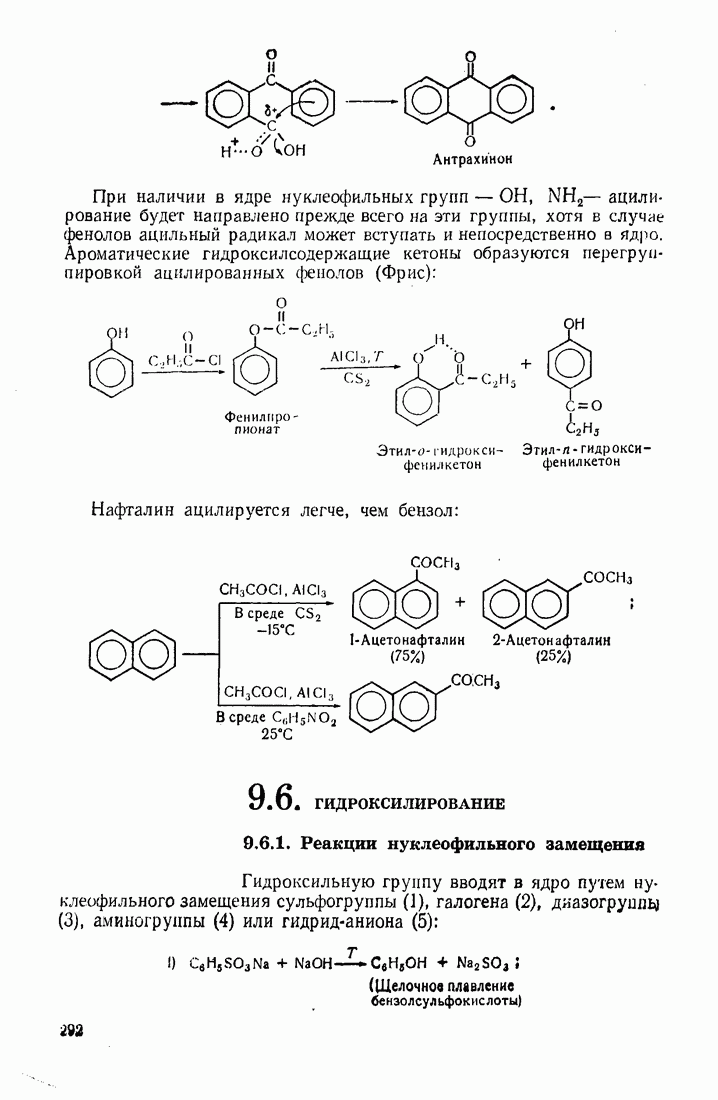
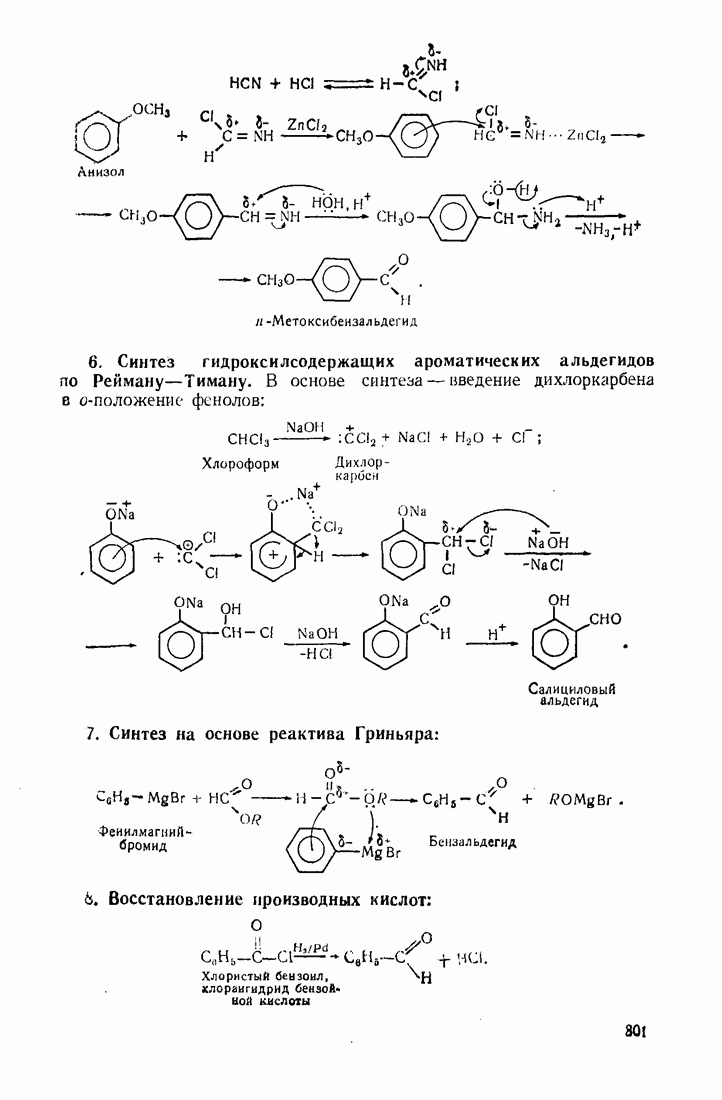
- 9.9. КАРБОНИЛИРОВАНИЕ
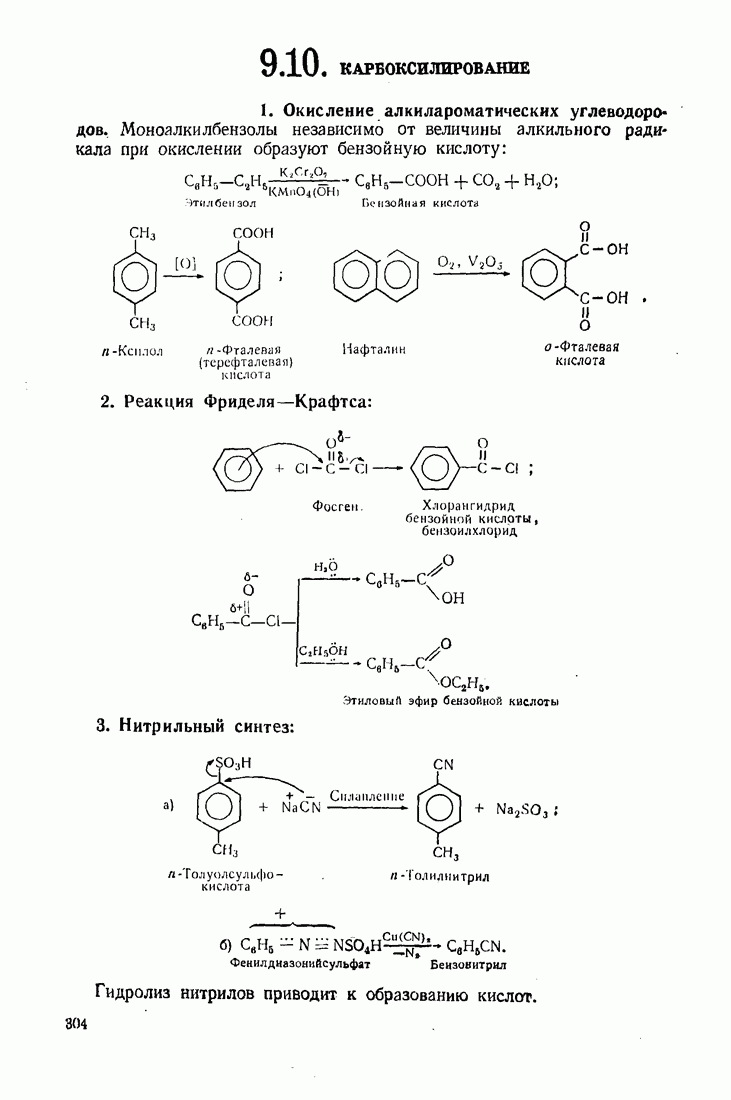
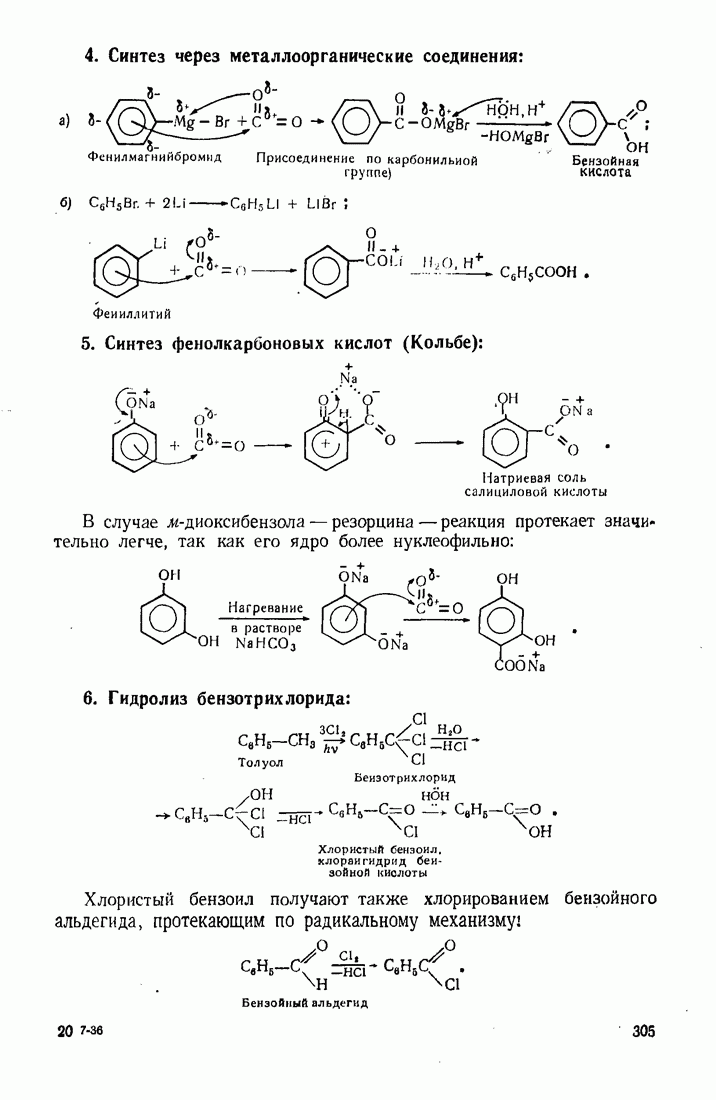
- 9.10. КАРБОКСИЛИРОВАНИЕ
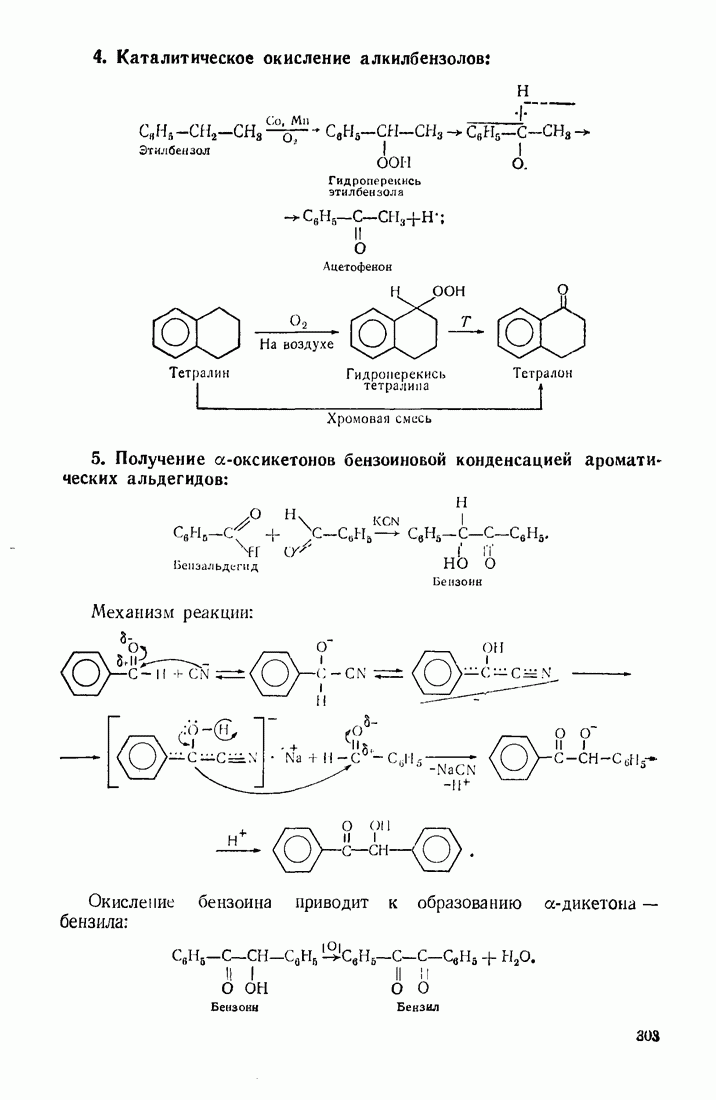
- 9.11. ОКИСЛЕНИЕ
- 9.12. ВОССТАНОВЛЕНИЕ
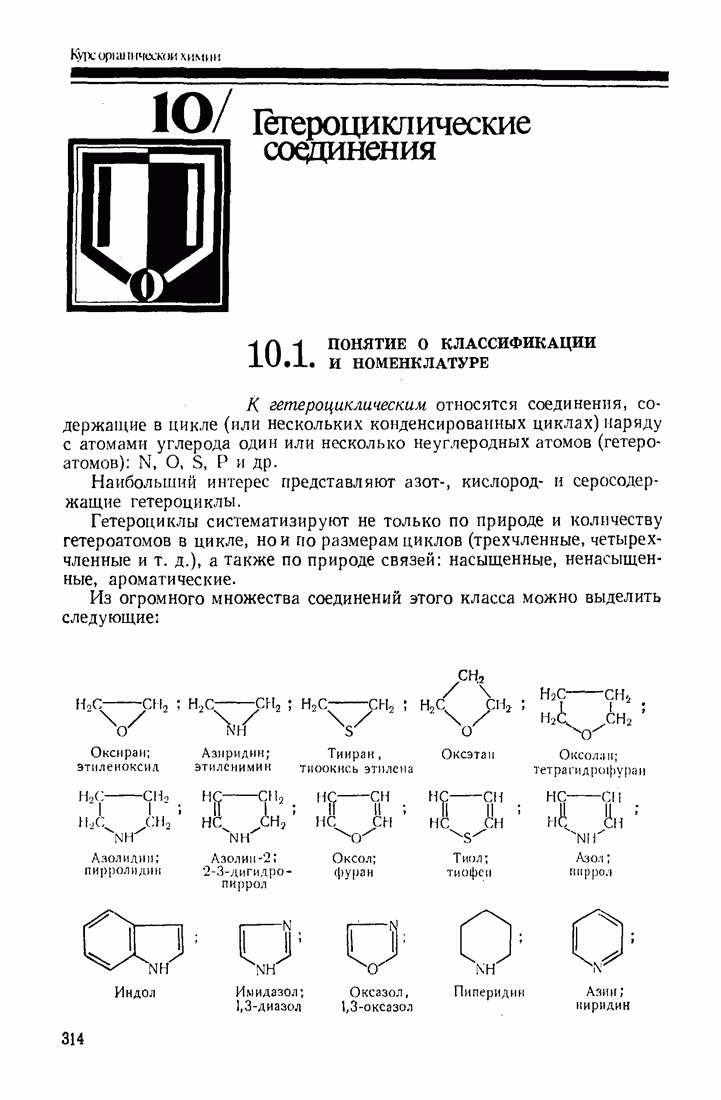
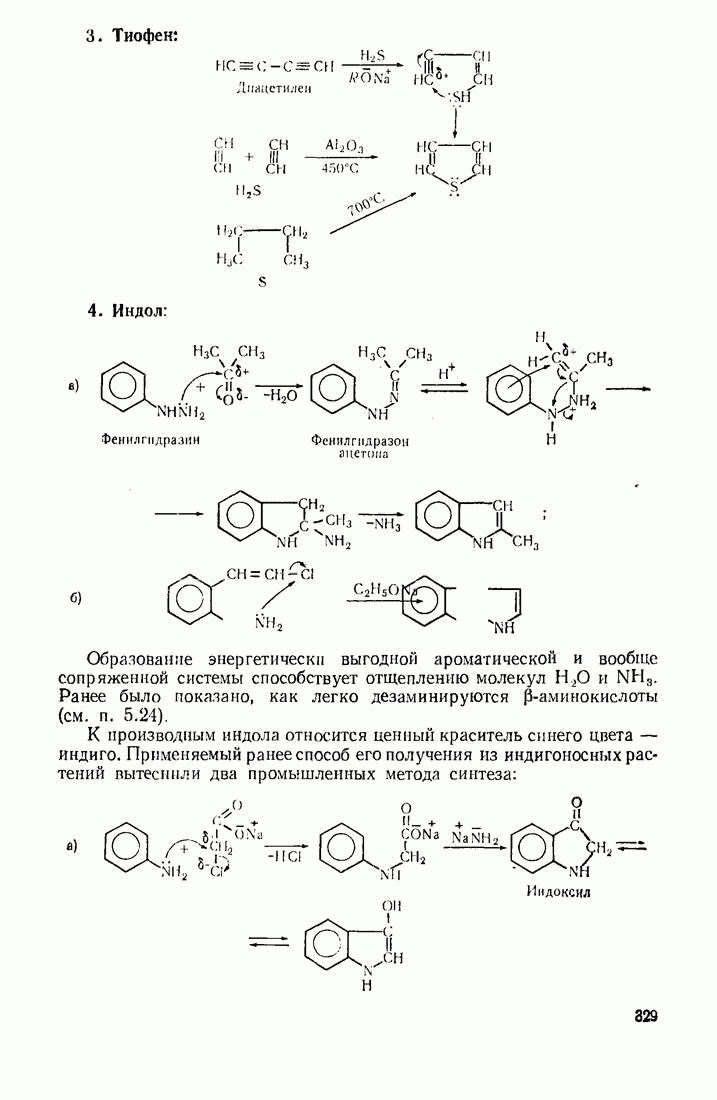
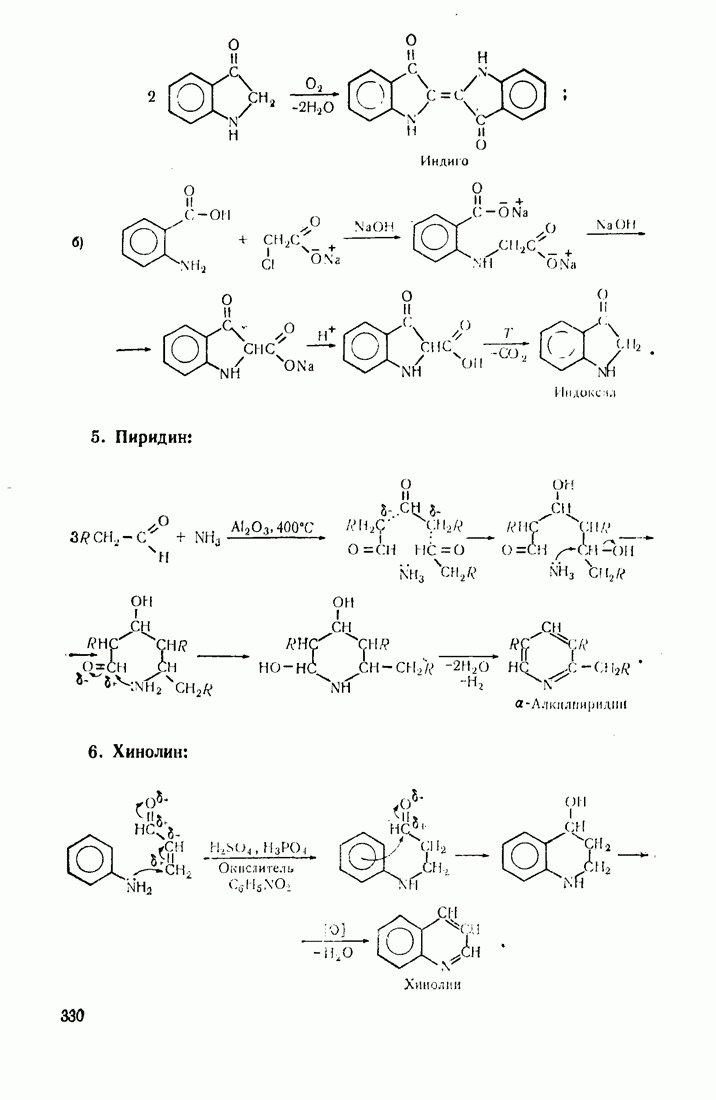
- 10. Гетероциклические соединения
- 10.2. ОБЩАЯ ХАРАКТЕРИСТИКА СТРОЕНИЯ И РЕАКЦИОННОЙ СПОСОБНОСТИ
- 10.3. ПЯТИ- И ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С ОДНИМ ГЕТЕРОАТОМОМ
- 10.4. ГЕТЕРОЦИКЛЫ С НЕСКОЛЬКИМИ ГЕТЕРОАТОМАМИ
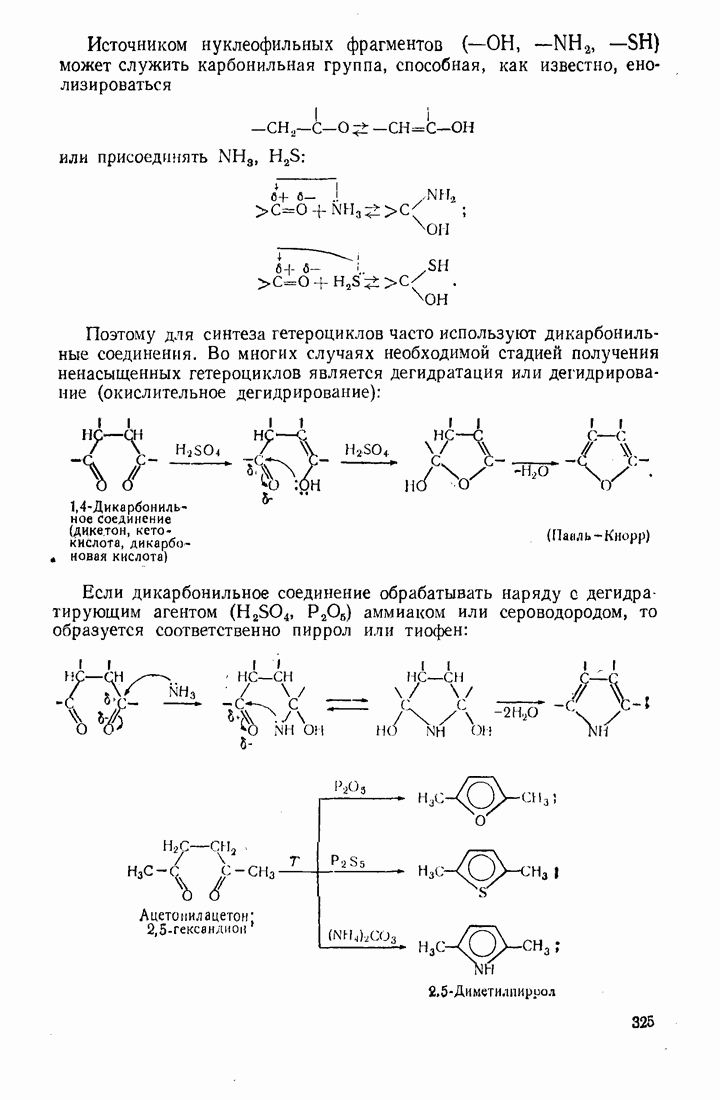
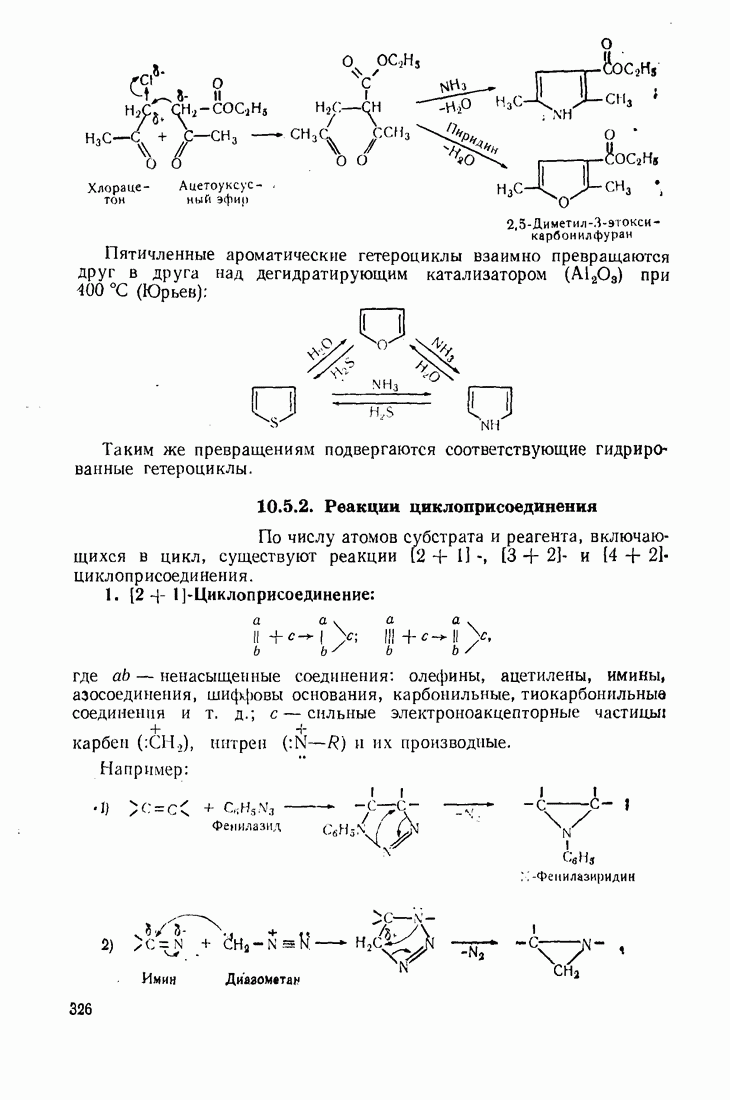
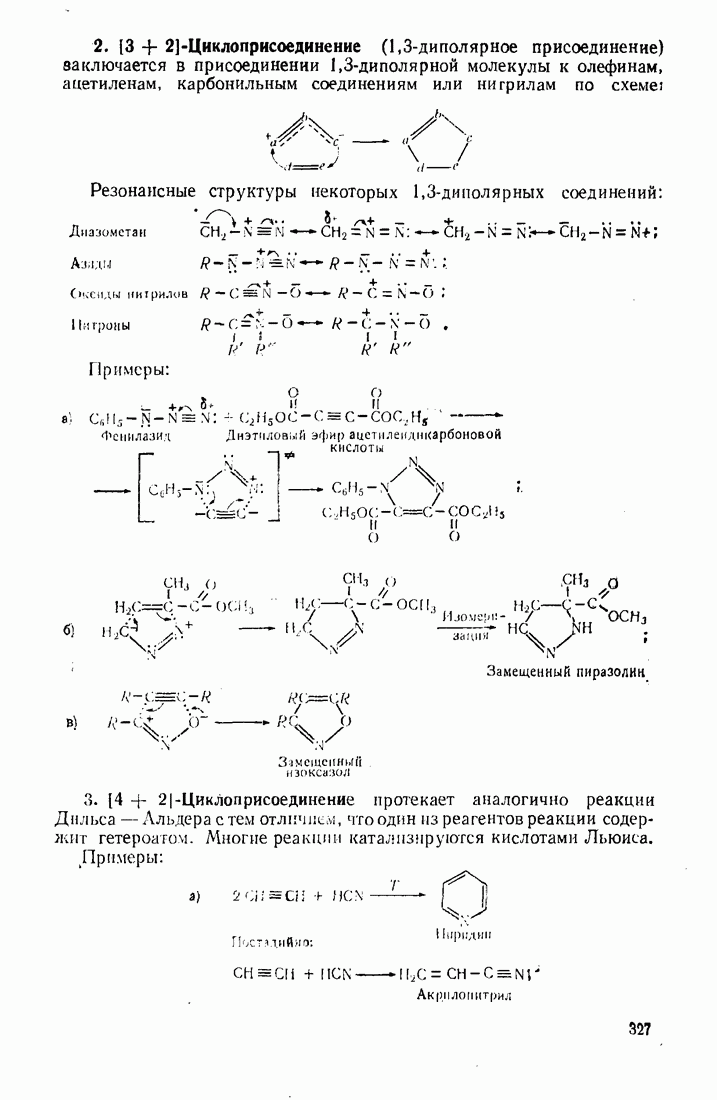
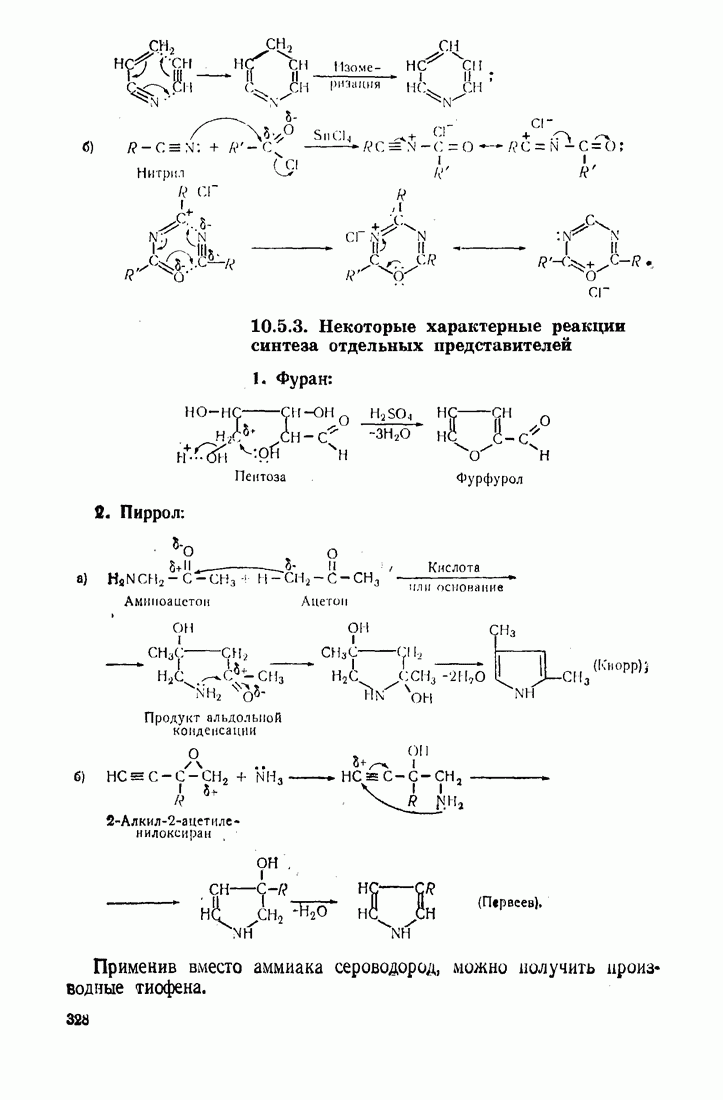
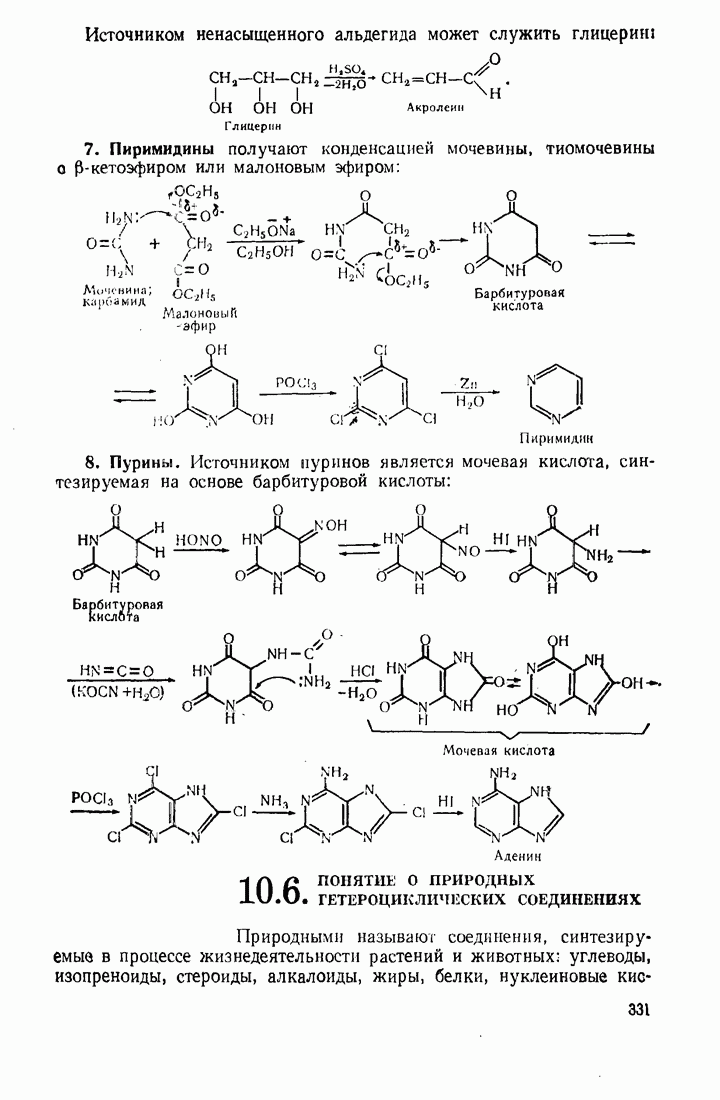
- 10.5. МЕТОДЫ СИНТЕЗА ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
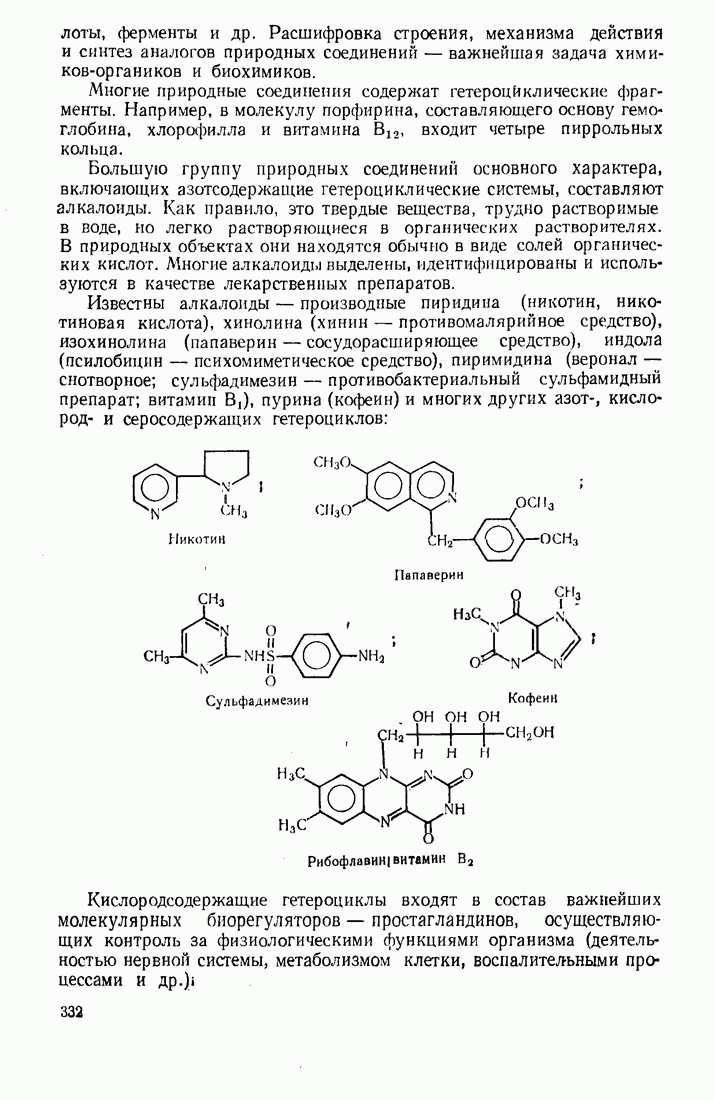
- 10.6. П0НЯТИЕ О ПРИРОДНЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЯХ
- 11. Зпементоорганические соединения
- 11.2. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ НЕКОТОРЫХ НЕМЕТАЛЛОВ
- 11.3. МЕГАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- 11.4. ОРГАНИЧЕСКИЕ ПРОИЗВОДНЫЕ ПЕРЕХОДНЫХ МЕТАЛЛОВ
- 12. Сырье и основные направления развития промышленности органического синтеза
- 12.1.1. Нефть и сопутствующий природный газ
- 12.1.2. Углехимическое сырье
- 12.1.3. Лесохимическое и сельскохозяйственное сырье
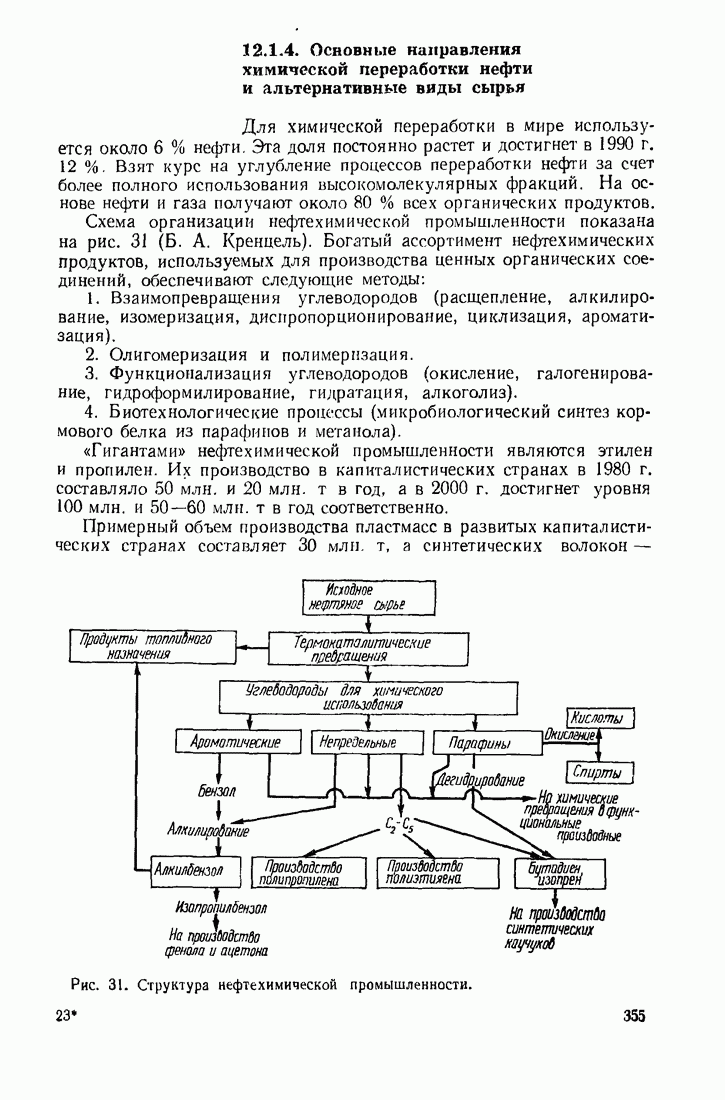
- 12.1.4. Основные направления химической переработки нефти и альтернативные виды сырья
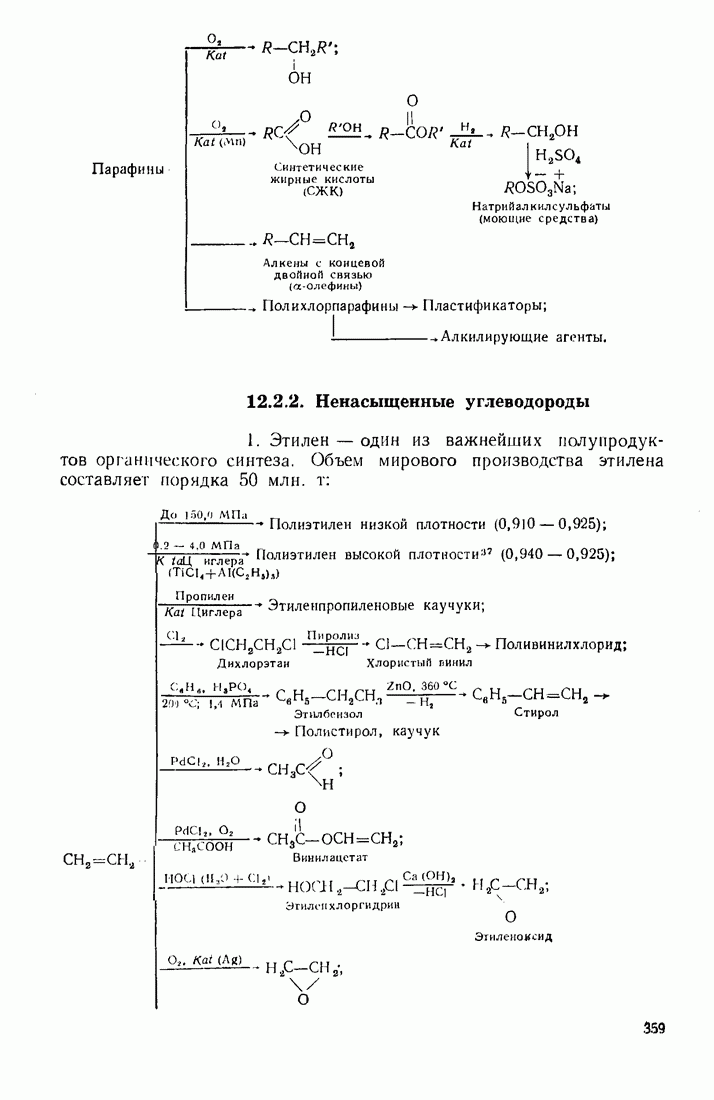
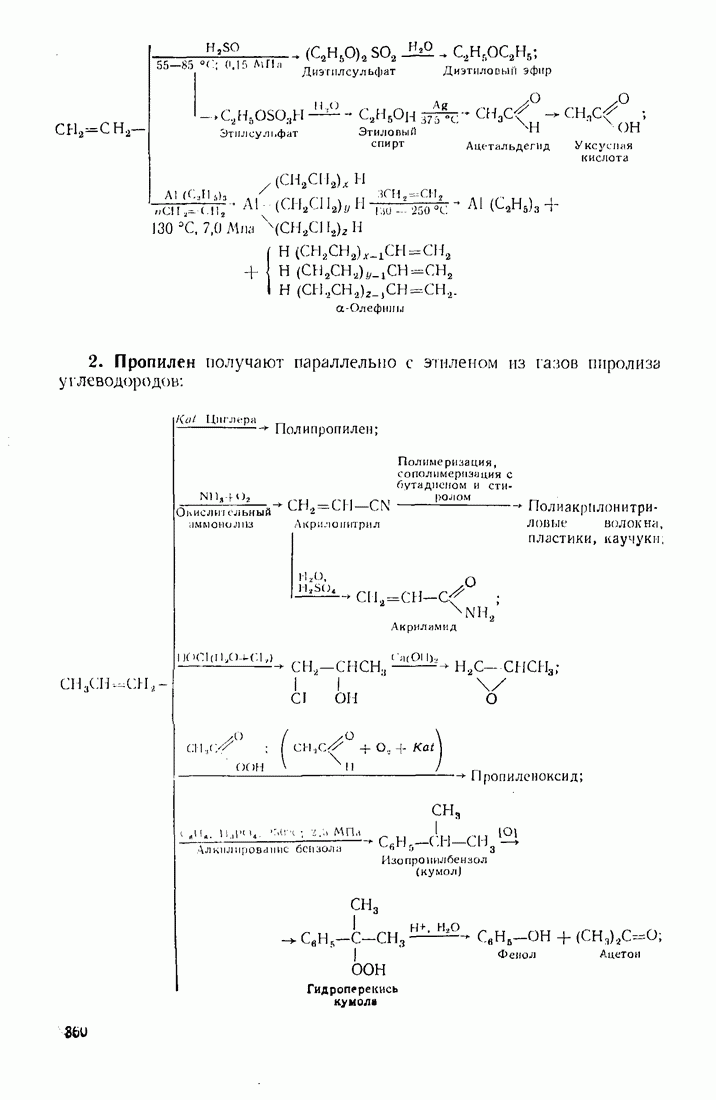
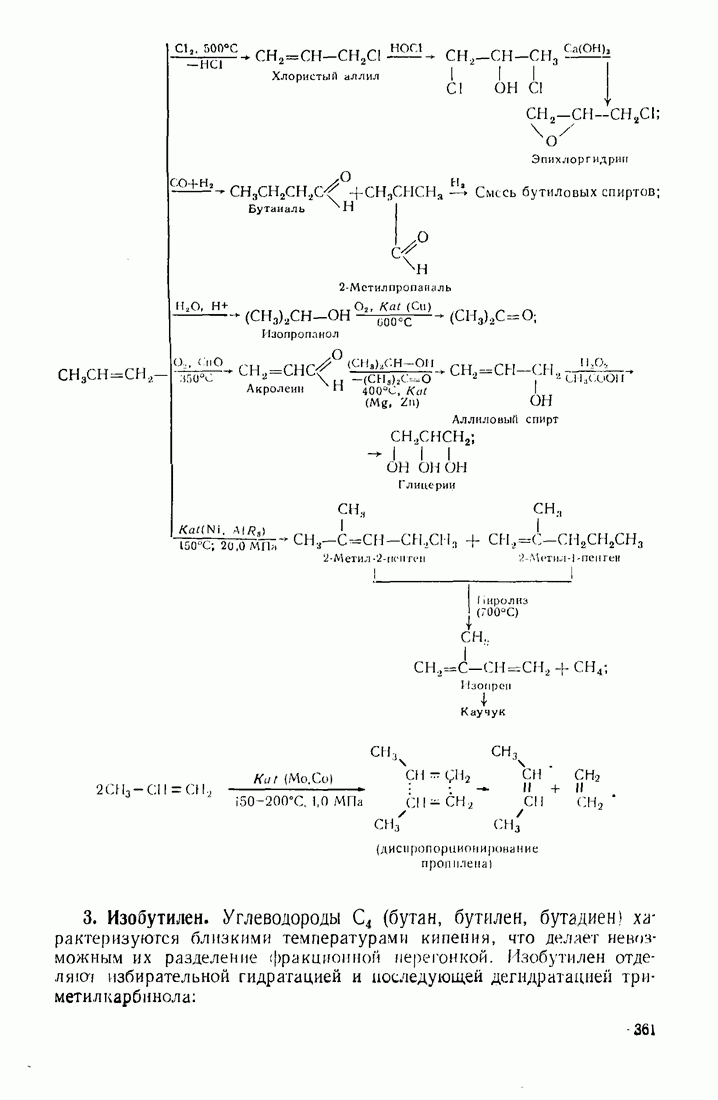
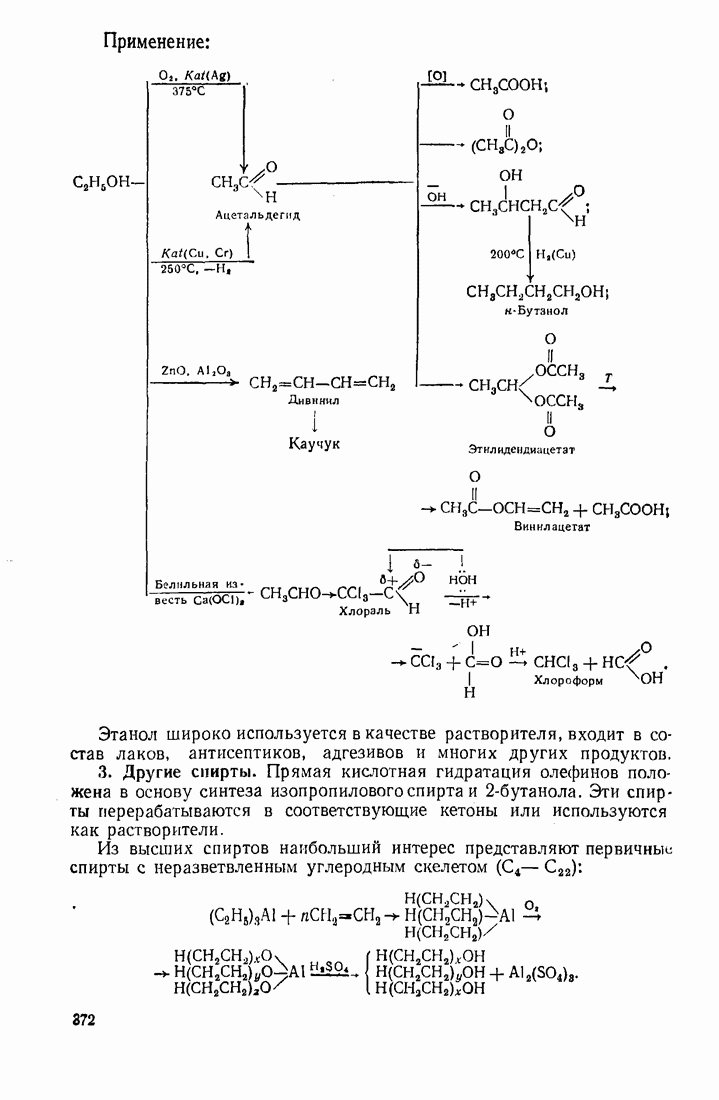
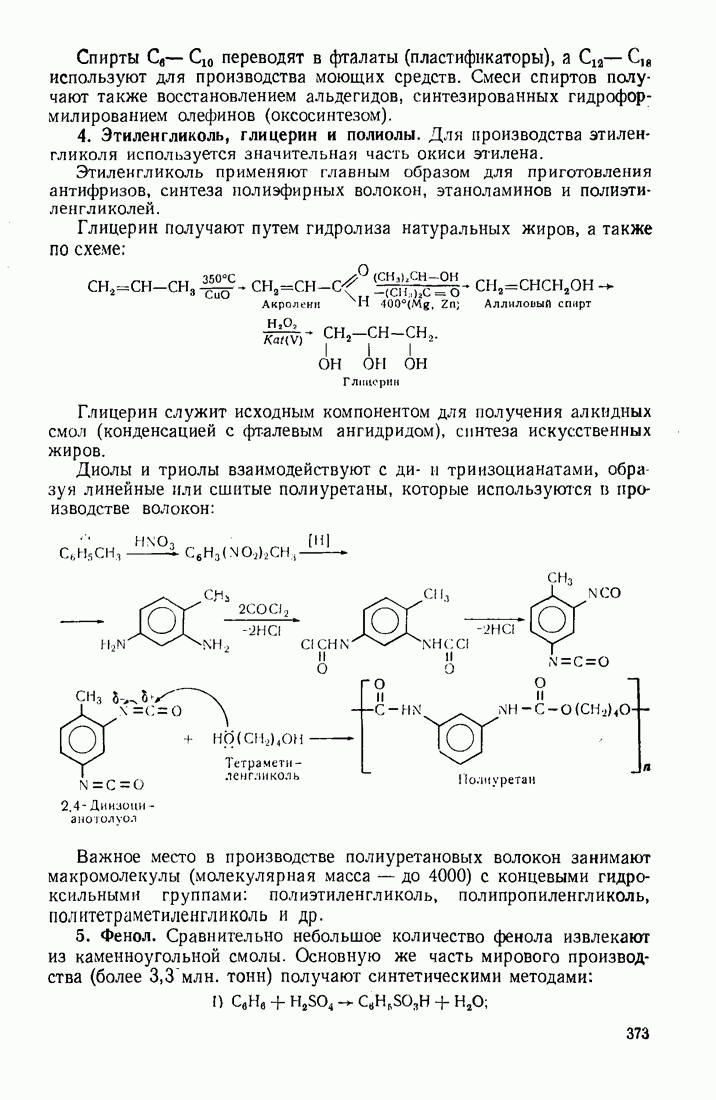
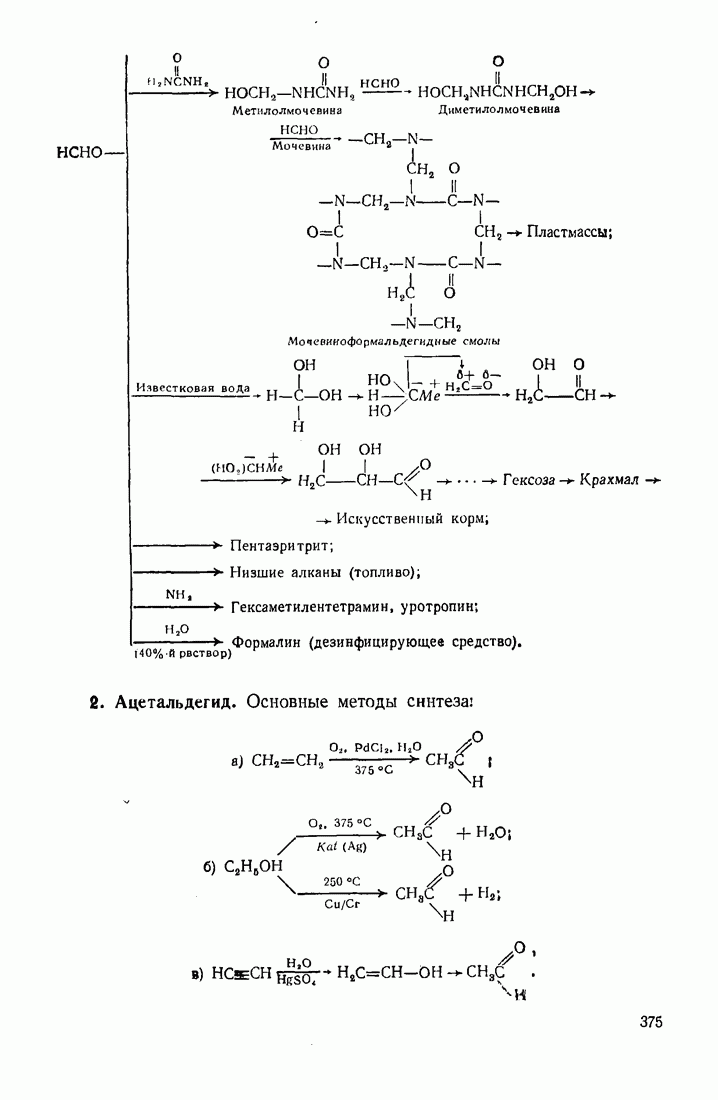
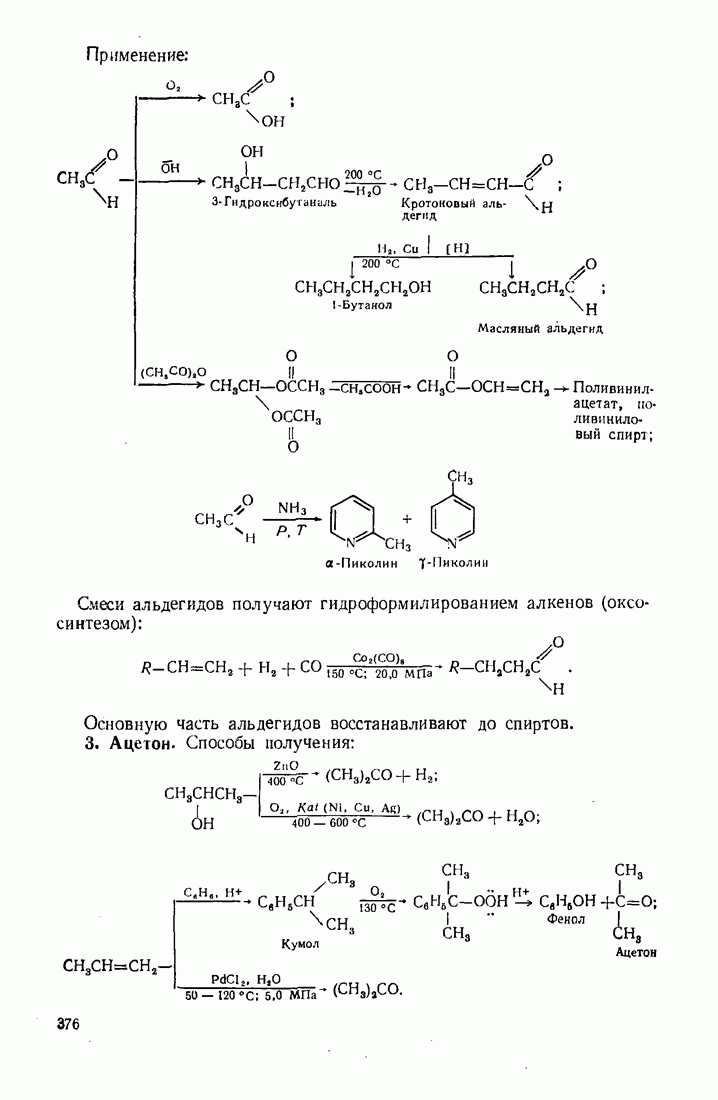
- 12.2. ПУТИ ИСПОЛЬЗОВАНИЯ УГЛЕВОДОРОДОВ И ИХ ПРОИЗВОДНЫХ
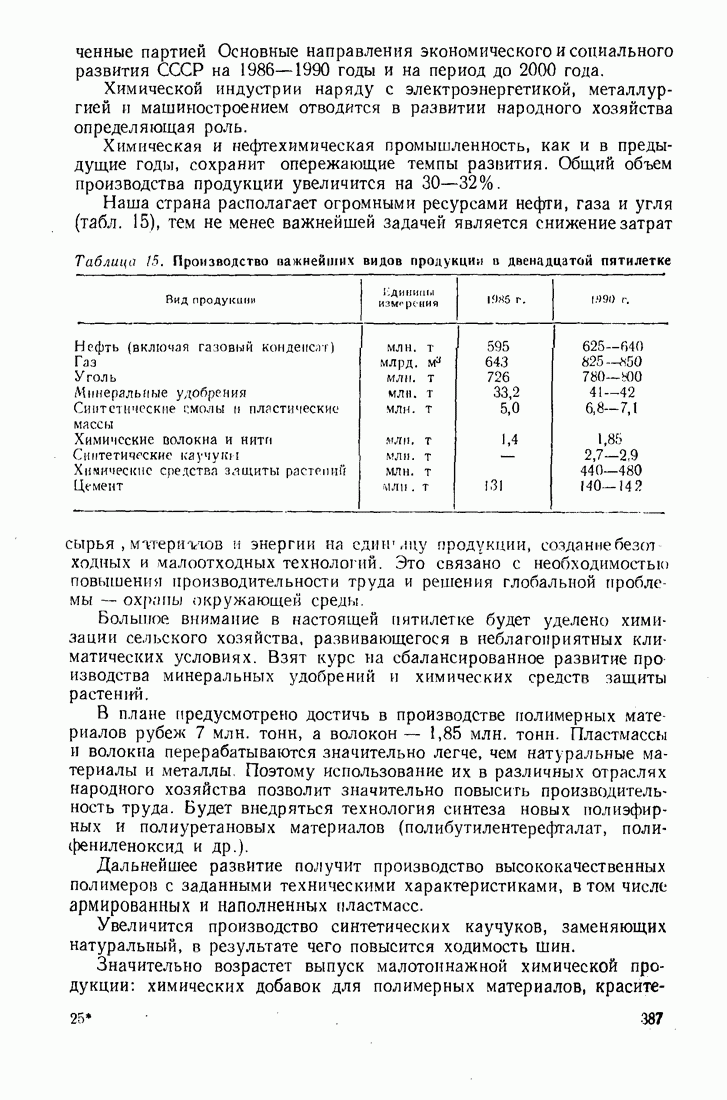
- 12.3. РАЗВИТИЕ ХИМИЧЕСКОЙ ПРОМЫШЛЕННОСТИ В СССР В ДВЕНАДЦАТОЙ ПЯТИЛЕТКЕ