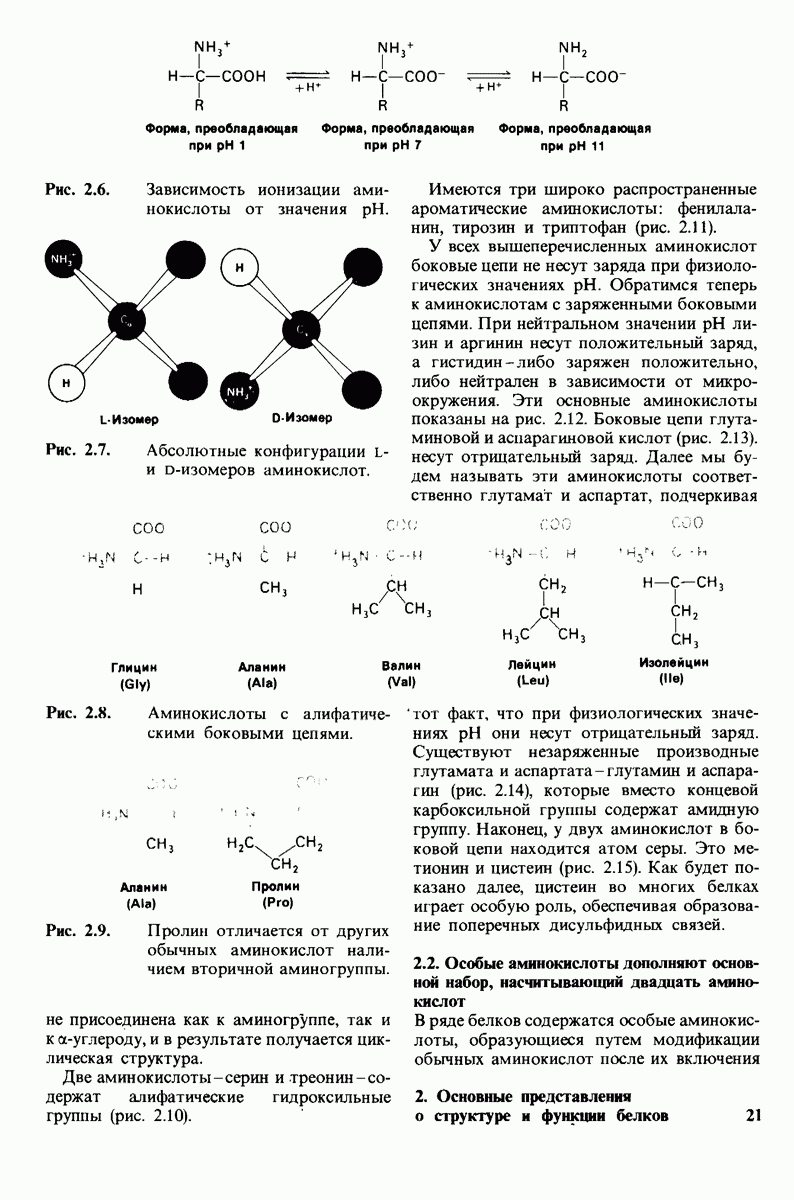
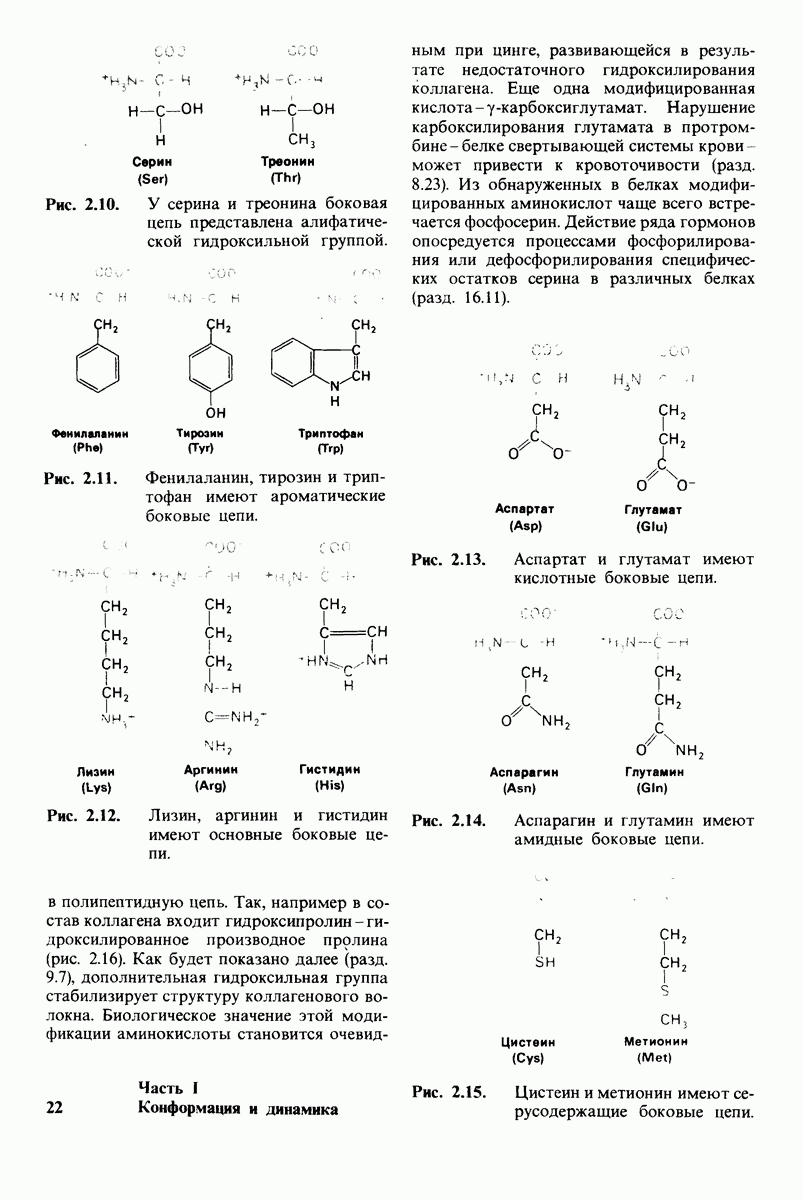
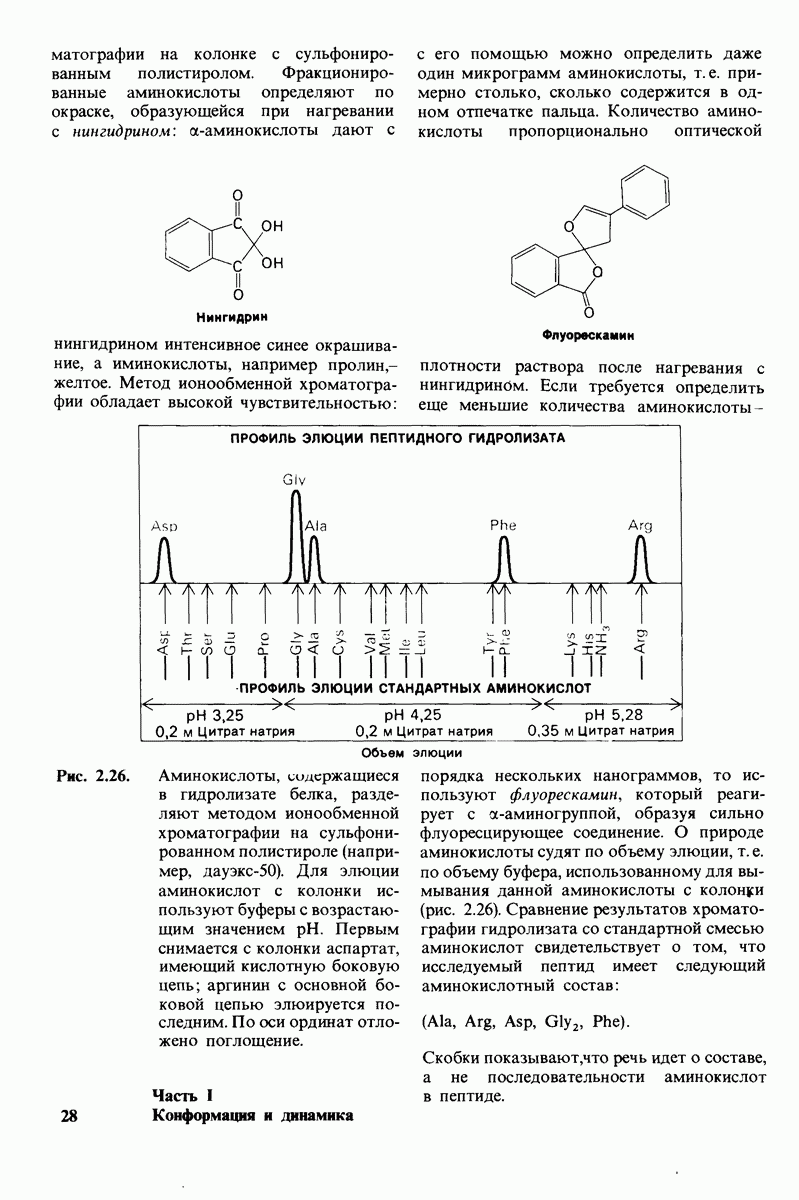
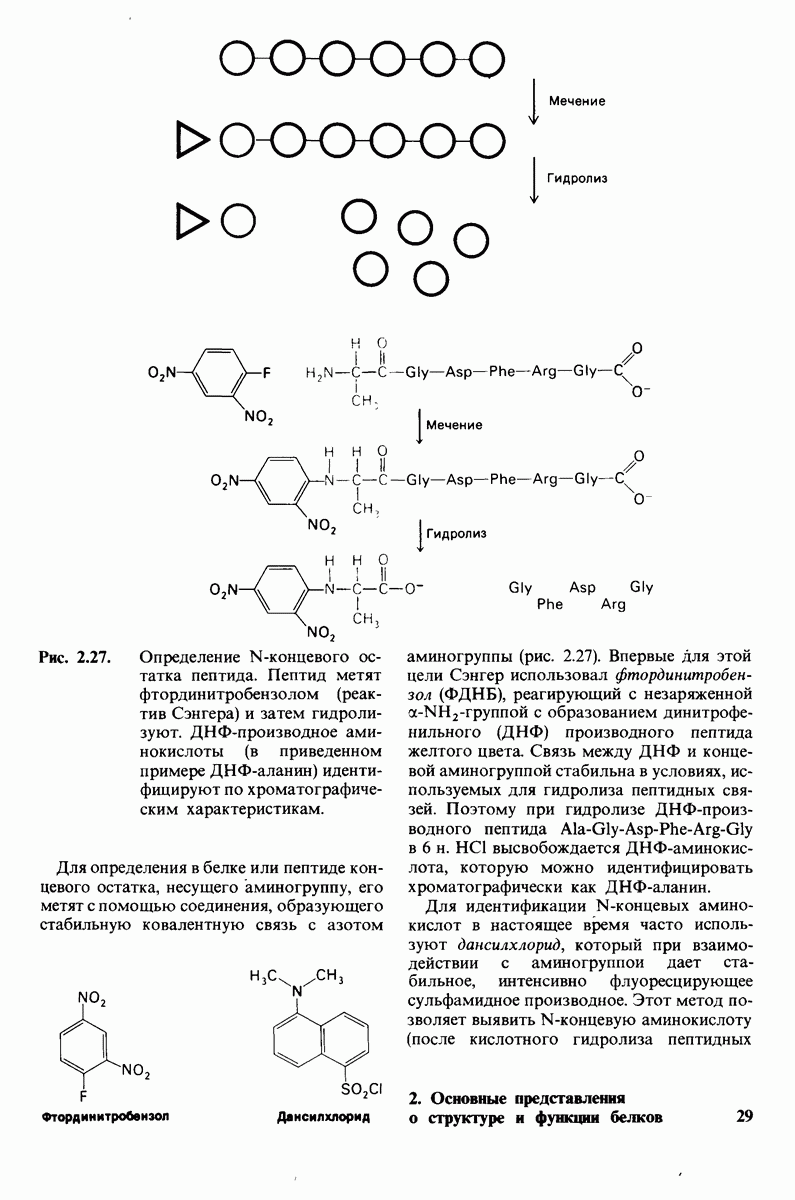
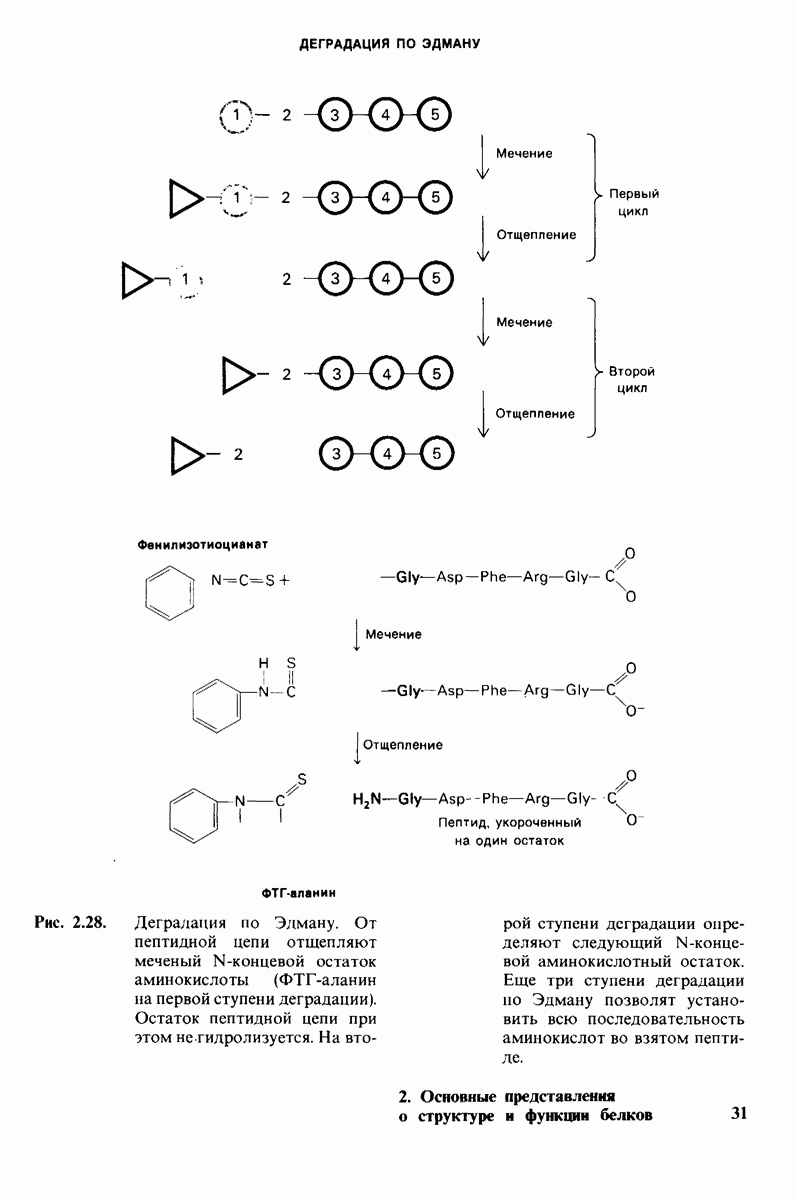
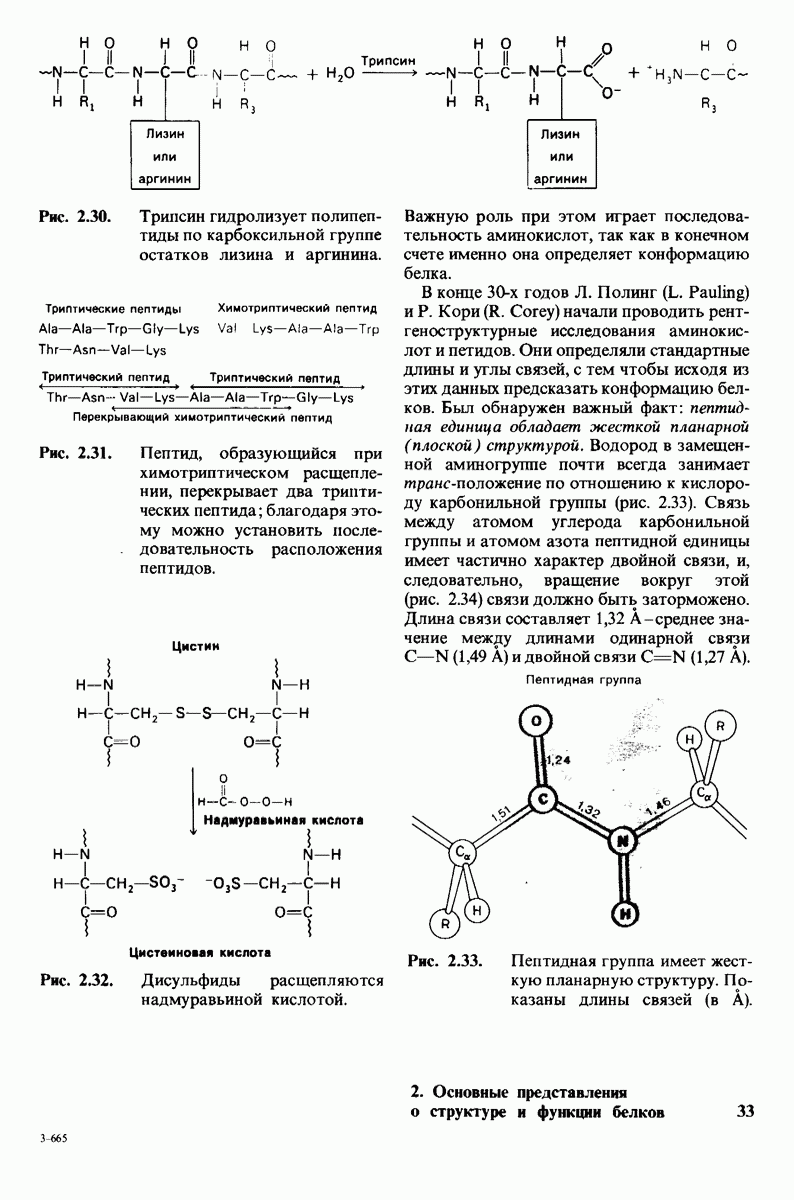
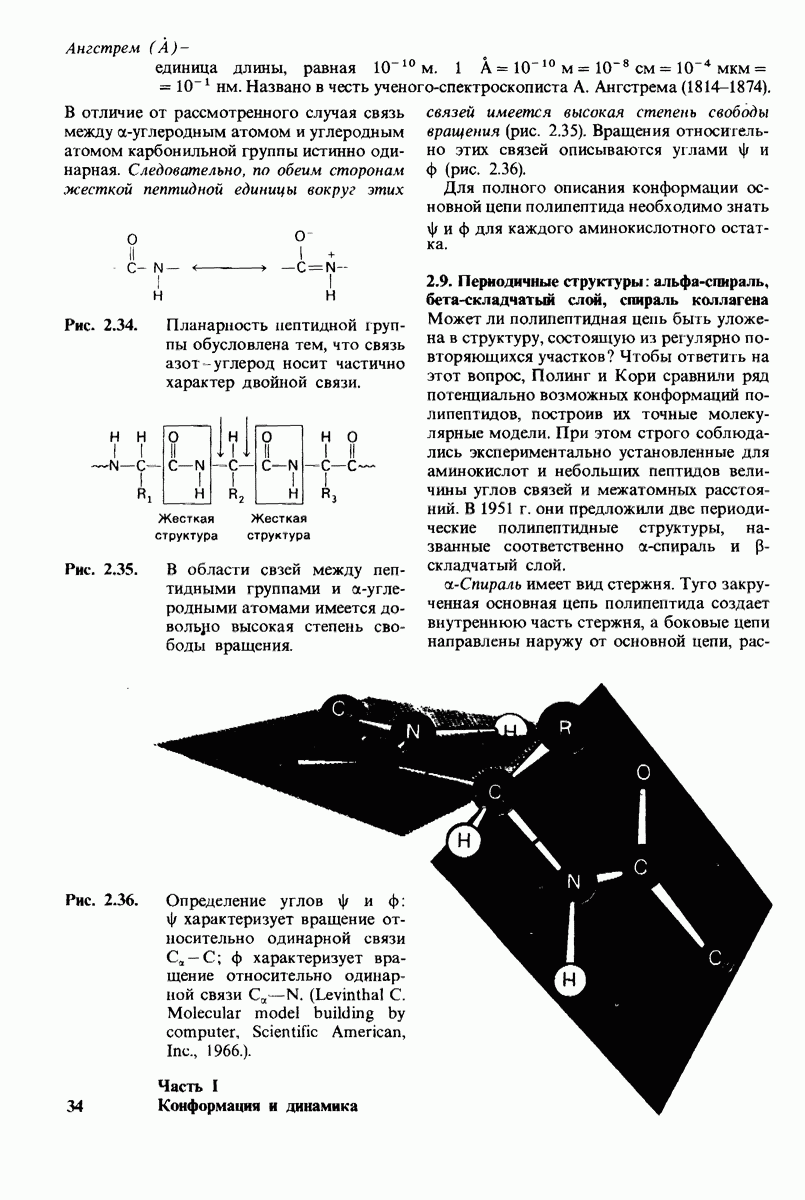
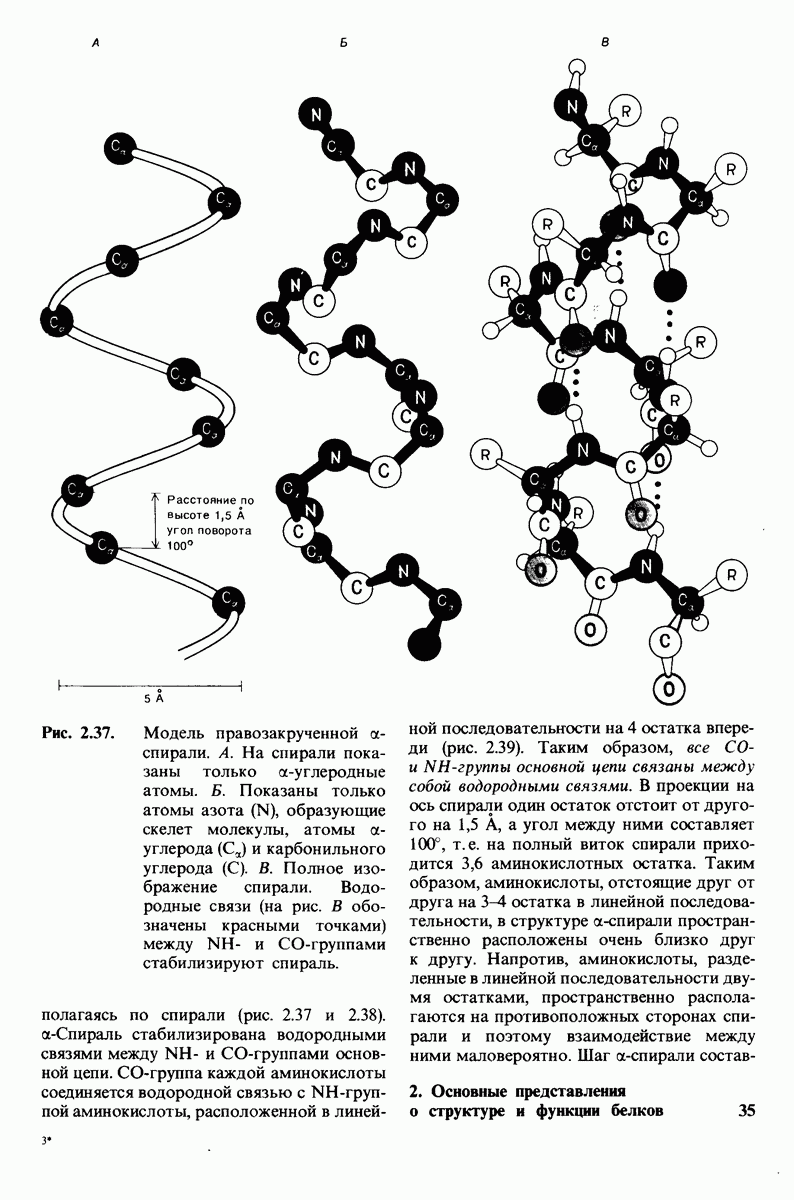
| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
3.16. Возникновение гемоглобина - новый этап в эволюции
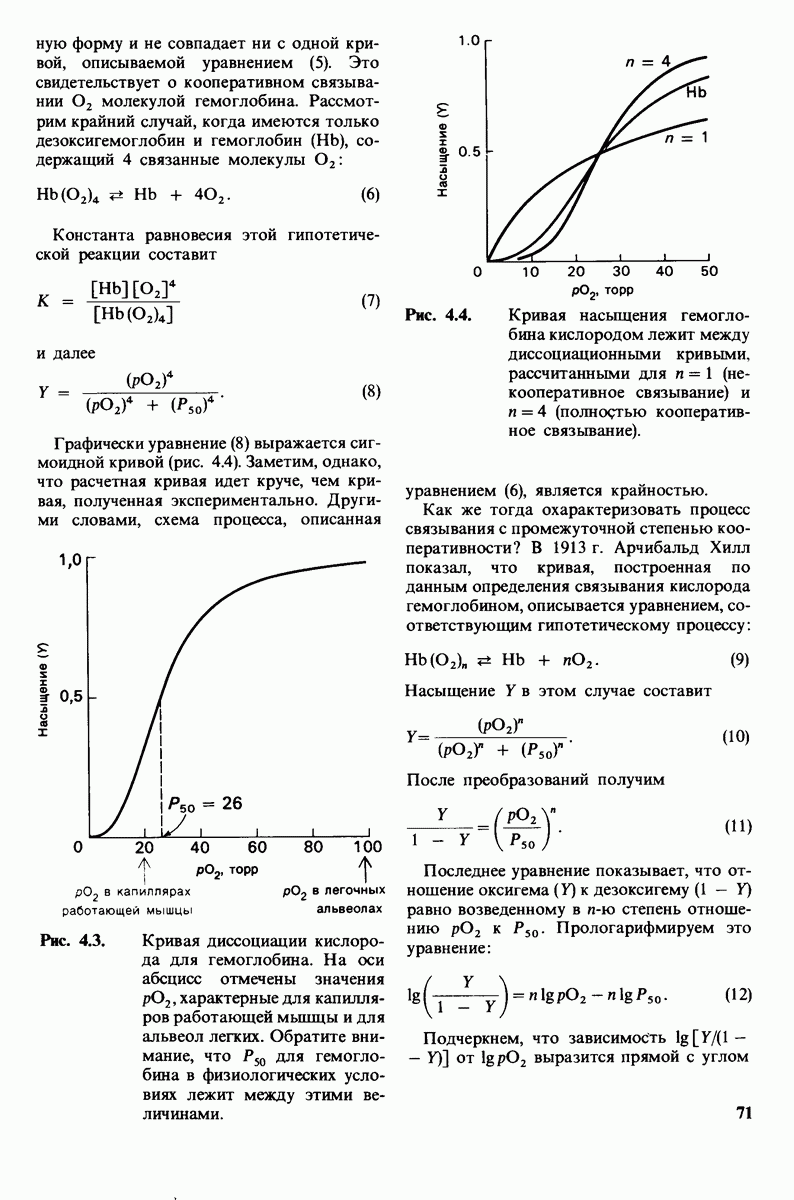
До сих пор мы акцентировали внимание на структурном сходстве между миоглобином и гемоглобином. Однако функционально эти две молекулы соврешенно различны. Субъединицы гемоглобина имеют ту же конфигурацию, что и миоглобин. Но соединение субъединиц с образованием тетрамера  приводит к появлению новых свойств огромного биологического значения. Этому вопросу посвящена следующая глава.
приводит к появлению новых свойств огромного биологического значения. Этому вопросу посвящена следующая глава.
Заключение
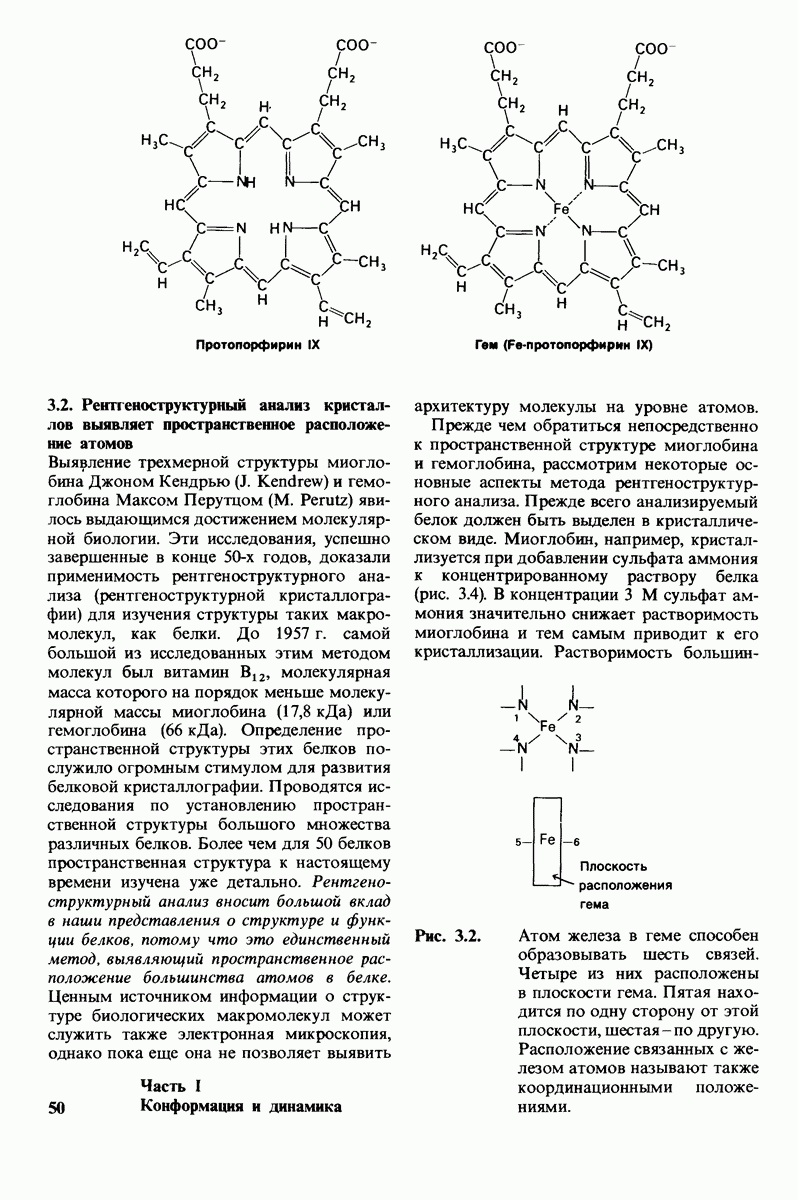
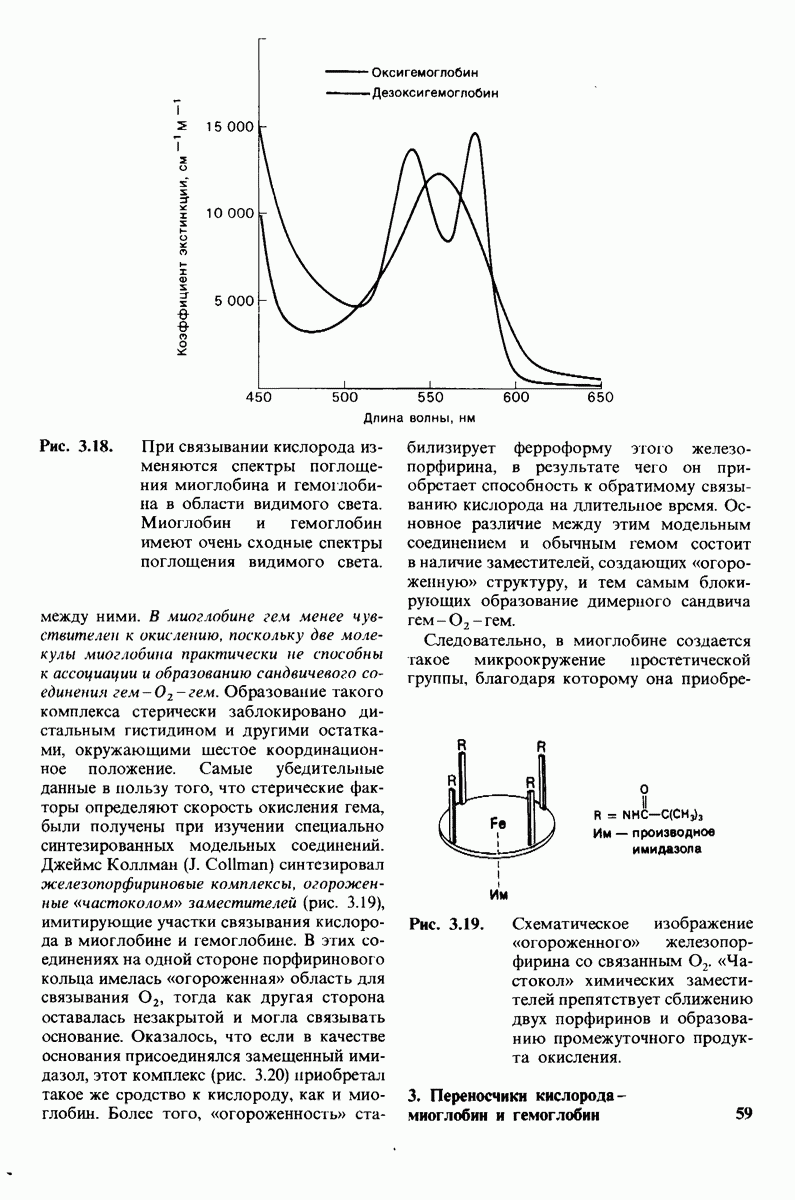
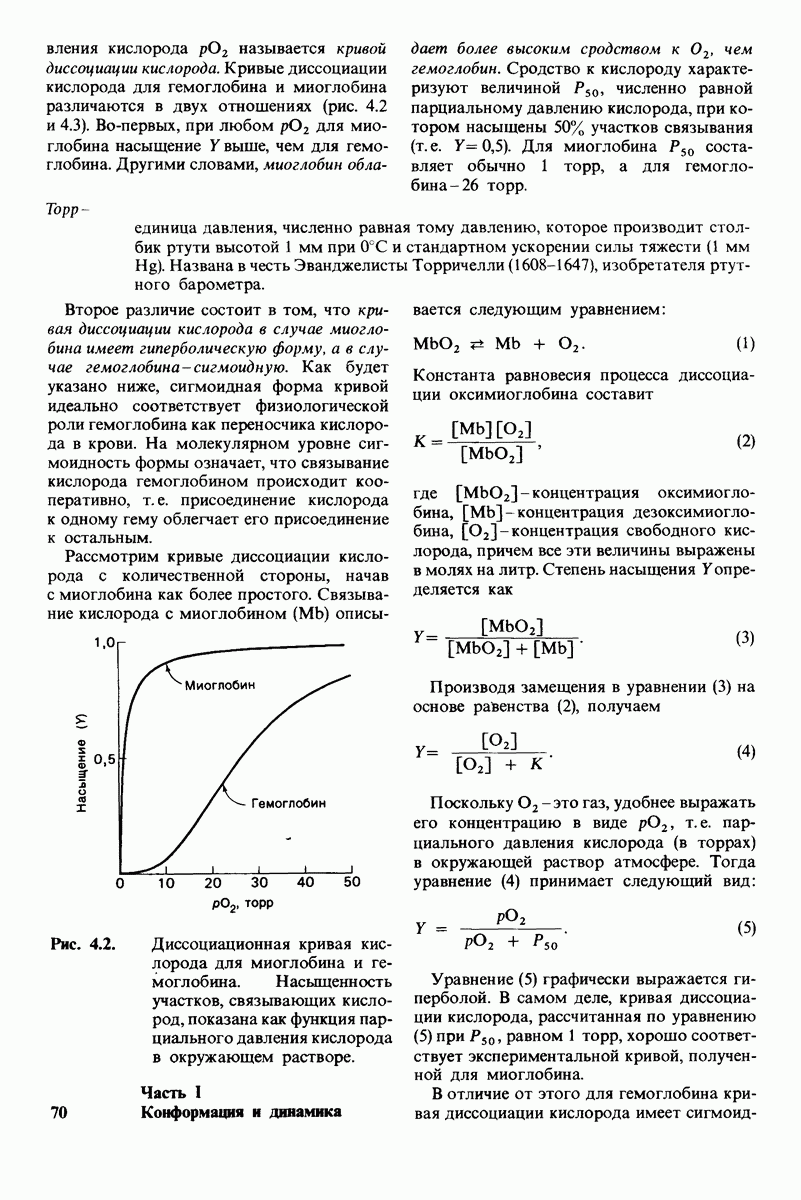
Миоглобин и гемоглобин - белки, выполняющие у позвоночных роль переносчиков кислорода. Миоглобин облегчает перенос кислорода в мышцах и обеспечивает его накопление в этой ткани. Гемоглобин, находящийся в эритроцитах, является переносчиком кислорода в крови. Способность этих белков связывать кислород обусловлена наличием в их молекуле прочно связанной простетической группы гема. Гем представляет собой замещенный порфирин с центрально расположенным атомом железа. Железо в теме может быть в ферроформе  или ферриформе
или ферриформе  Только ферро-форма способна связывать
Только ферро-форма способна связывать 
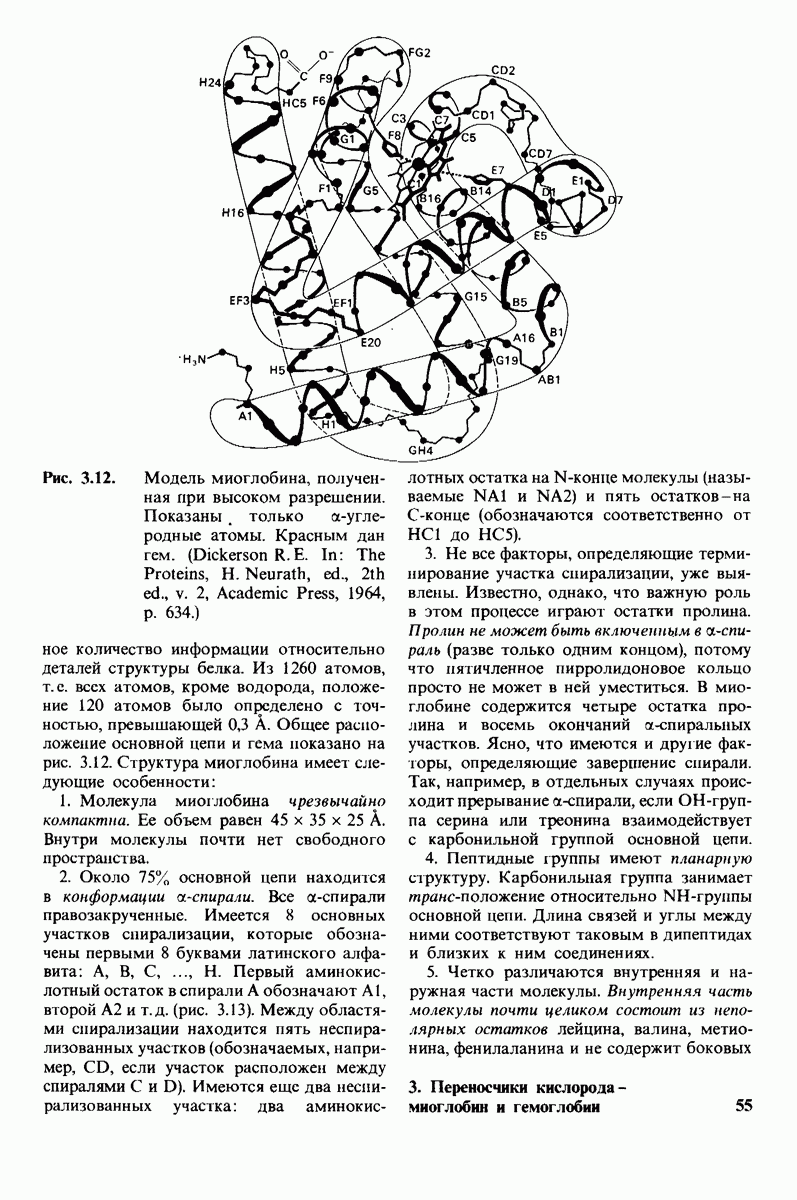
Миоглобин представлен одной полипептидной цепью, состоящей из 153 аминокислотных остатков ( и имеет компактную форму. Во внутренней части молекулы находятся почти исключительно неполярные остатки, тогда как снаружи расположены и полярные, и неполярные аминокислотные остатки.
и имеет компактную форму. Во внутренней части молекулы находятся почти исключительно неполярные остатки, тогда как снаружи расположены и полярные, и неполярные аминокислотные остатки.

Рис. 3.27. Перекрест цепей  в миоглобине. В положении
в миоглобине. В положении  практически всегда стоит глицин, поскольку для более длинной, чем у глицина, боковой цепи нет места.
практически всегда стоит глицин, поскольку для более длинной, чем у глицина, боковой цепи нет места.
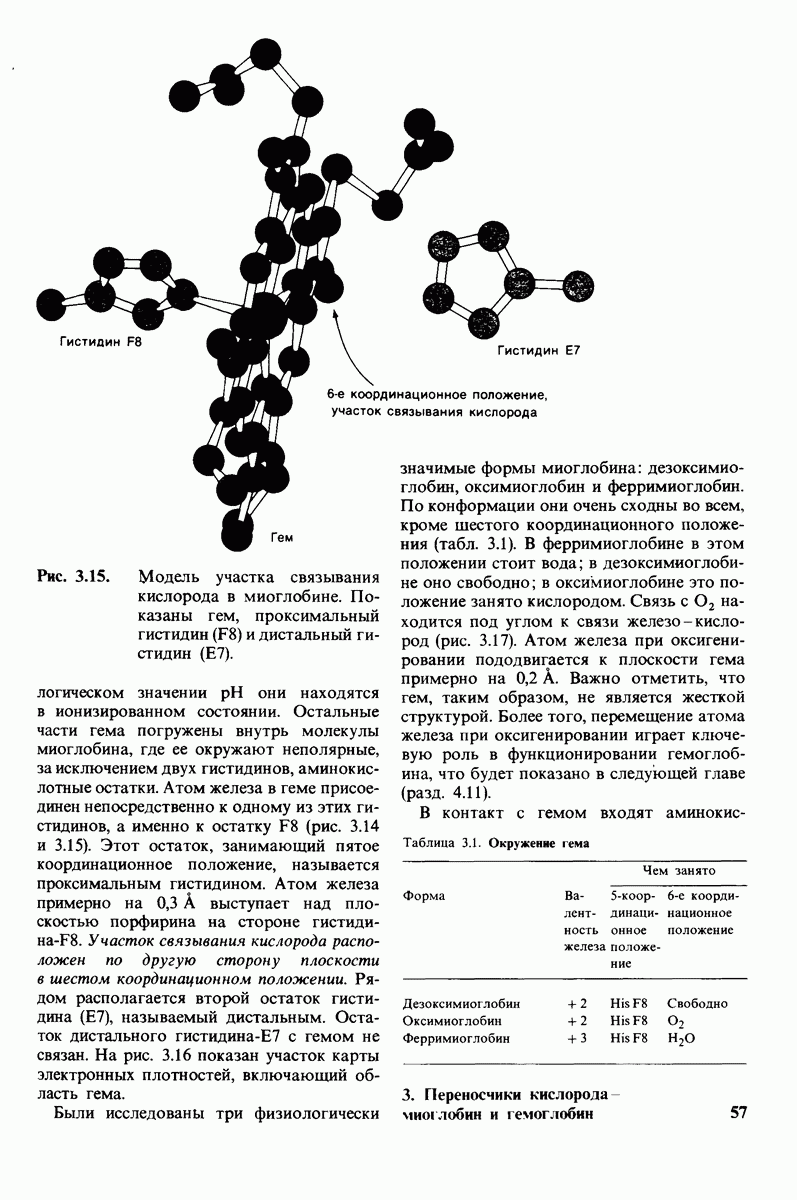
Около 75% полипептидной цепи имеет структуру  -спирали, причем имеется 8 спирализованных участков. Единственный феррогем локализован в неполярной нише, что защищает его от окисления в ферриформу. Атом железа в геме непосредственно связан с атомом азота боковой цепи гистидина. Этот проксимальный гистидин
-спирали, причем имеется 8 спирализованных участков. Единственный феррогем локализован в неполярной нише, что защищает его от окисления в ферриформу. Атом железа в геме непосредственно связан с атомом азота боковой цепи гистидина. Этот проксимальный гистидин  занимает пятое координационное положение. Шестое координационное положение по другую сторону плоскости гема - это участок связывания
занимает пятое координационное положение. Шестое координационное положение по другую сторону плоскости гема - это участок связывания  Второй гистидин, называемый дистальным
Второй гистидин, называемый дистальным  расположен непосредственно рядом с этим участком. Проксимальный гистидин повышает сродство гема к кислороду, а дистальный гистидин оказывает стерический эффект, снижая связывание оксида углерода. Дистальный гистидин и другие аминокислотные остатки вблизи шестого координационного положения подавляют также окисление гема в ферриформу.
расположен непосредственно рядом с этим участком. Проксимальный гистидин повышает сродство гема к кислороду, а дистальный гистидин оказывает стерический эффект, снижая связывание оксида углерода. Дистальный гистидин и другие аминокислотные остатки вблизи шестого координационного положения подавляют также окисление гема в ферриформу.
Из смеси денатурированного (с развернутой структурой) апомиоглобина и гема можно получить функционально активный миоглобин. Такой опыт по ренату рации показывает, что конформация миоглобина
предопределена последовательностью аминокислот в нем; аналогичное явление впервые было установлено в отношении рибонуклеазы. Во внутренней части молекулы миоглобина сгруппированы неполярные аминокислотные остатки, что, по-видимому, обеспечивает взаимное притяжение, необходимое для образования свернутой компактной структуры.
Гемоглобин состоит из четырех полипептидных цепей, каждая из которых содержит гем. Гемоглобин  -основной гемоглобин взрослого организма - имеет субъединичную структуру Гемоглобин
-основной гемоглобин взрослого организма - имеет субъединичную структуру Гемоглобин  минорный гемоглобин взрослых - имеет состав
минорный гемоглобин взрослых - имеет состав  а эмбриональный гемоглобин
а эмбриональный гемоглобин  Пространственные структуры
Пространственные структуры  и
и  -цепей гемоглобина и миоглобина обладают поразительным сходством, несмотря на большие различия в последовательности аминокислотных остатков. Сравнение последовательности аминокислот в гемоглобинах многих видов животных показало, что положение девяти аминокислот остается во всех случаях практически инвариантным. К этой группе консервативных аминокислотных остатков относится несколько остатков, расположенных вблизи гема, в частности проксимальный и дистальный гистидины. Консервативным свойством является также выраженная неполярность внутренней части структуры каждой субъединицы.
-цепей гемоглобина и миоглобина обладают поразительным сходством, несмотря на большие различия в последовательности аминокислотных остатков. Сравнение последовательности аминокислот в гемоглобинах многих видов животных показало, что положение девяти аминокислот остается во всех случаях практически инвариантным. К этой группе консервативных аминокислотных остатков относится несколько остатков, расположенных вблизи гема, в частности проксимальный и дистальный гистидины. Консервативным свойством является также выраженная неполярность внутренней части структуры каждой субъединицы.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
(см. скан)
Вопросы и задачи
(см. скан)
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- Предисловие редактора перевода
- ГЛАВА 1. Молекулы и жизнь
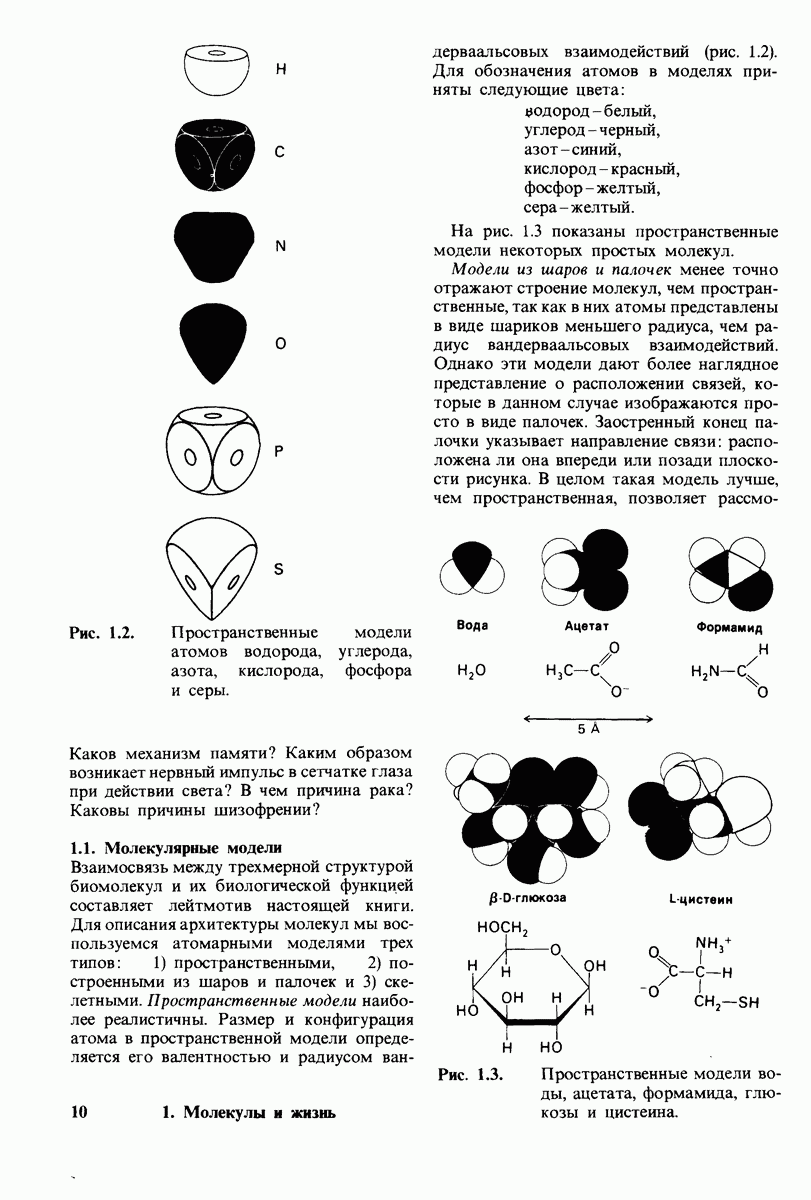
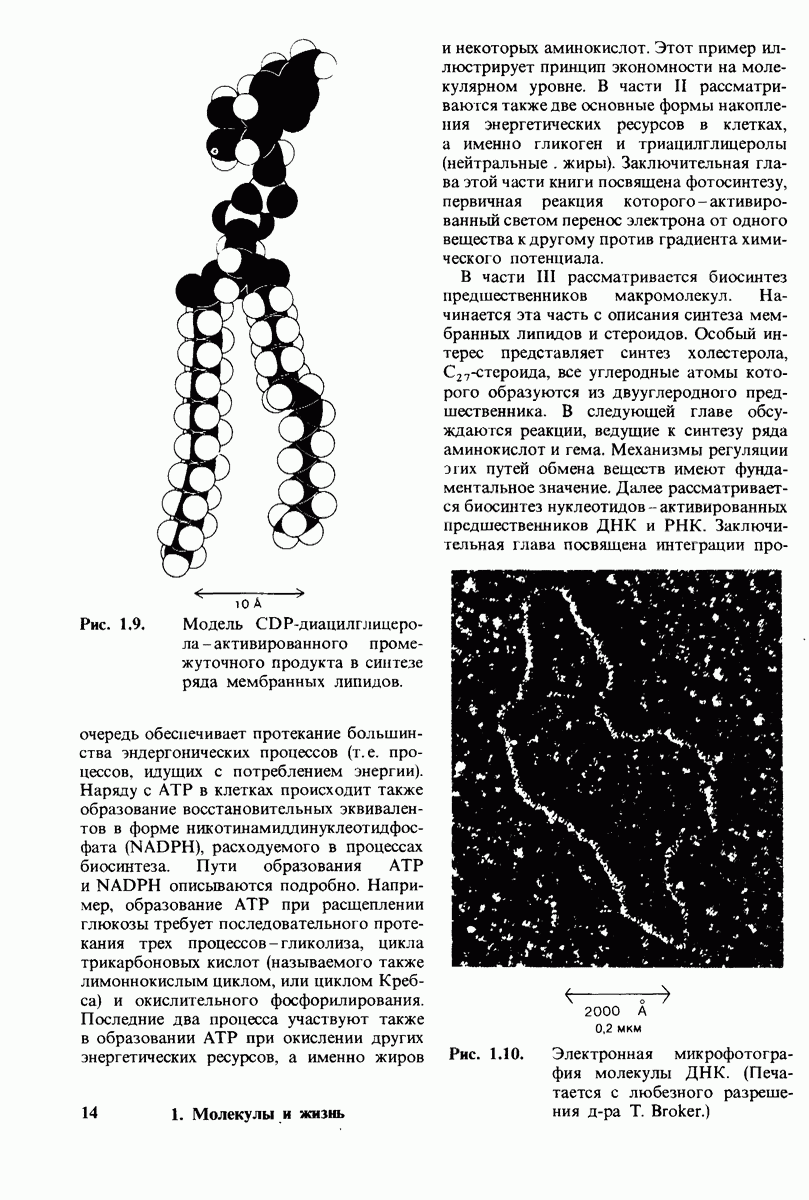
- 1.1. Молекулярные модели
- 1.2. Пространство, время и энергия
- 1.3. Структура данной книги
- Часть I. Конформация и динамика
- ГЛАВА 2. Основные представления о структуре и функции белков
- 2.1. Белки построены из аминокислот
- 2.2. Особые аминокислоты дополняют основной набор, насчитывающий двадцать аминокислот
- 2.3. Аминокислоты, соединяясь пептидной связью, образуют полипептидные цепи
- 2.4. Белки состоят из одной или нескольких полипептндных цепей
- 2.5. Для очистки белков можно использовать множество различных методов
- 2.6 Последовательность аминокислот в белках уникальна и детерминируется генами
- 2.7. Экспериментальные методы определения последовательности аминокислот
- 2.8. Конформация полипептидных цепей
- 2.9. Периодичные структуры: альфа-спираль, бета-складчатый слой, спираль коллагена
- 2.10. Полипептидная цепь может поворачиваться на 180° благодаря образованию бетта-изгибов
- 2.11. Структурные уровни в архитектуре белков
- 2.12. Последовательность аминокислот определяет трехмерную структуру
- 2.13. Формирование свернутой молекулы белков происходит путем ассоциации альфа-спиралей и складчатых бетта-слоев
- Заключение
- ПРИЛОЖЕНИЕ. Понятия кислотности и основности
- ГЛАВА 3. Переносчики киспорода — миоглобин и гемоглобин
- 3.1. Кислород присоединяется к простетической группе гема
- 3.2. Рентгеноструктурный анализ кристаллов выявляет пространственное расположение атомов
- 3.3. Этапы рентгеноструктурного анализа миоглобина
- 3.4. Структура миоглобина характеризуется компактностью и высокой степенью альфа-спирализованности
- 3.5. Участок связывания кислорода в миоглобине
- 3.6. Жесткое окружение гема обеспечивает обратимость оксигенирования
- 3.7. Присутствие дистального гистидина снижает связывание оксида углерода
- 3.8. В растворенном виде и в кристаллическом состоянии миоглобин имеет практически одинаковую структуру
- 3.9. Неполярные взаимодействия играют важную роль в стабилизировании конформации миоглобина
- 3.10. Развернутая молекула миоглобина спонтанно принимает функционально активную конфигурацию
- 3.11. Гемоглобин состоит из четырех полипептидных цепей
- 3.12. Рентгеноструктурный анализ гемоглобина
- 3.13. Четвертичная структура гемоглобина
- 3.14. а- и b-Цепи гемоглобина очень сходны с миоглобином
- 3.15. Критически необходимые остатки в последовательности аминокислот
- 3.16. Возникновение гемоглобина — новый этап в эволюции
- ГЛАВА 4. Гемоглобин: аллостерический белок
- 4.1. Функциональные различия между миоглобином и гемоглобином
- 4.2. Кооперативность связывания кислорода гемоглобином
- 4.3. Кооперативное связывание кислорода гемоглобином увеличивает транспорт кислорода
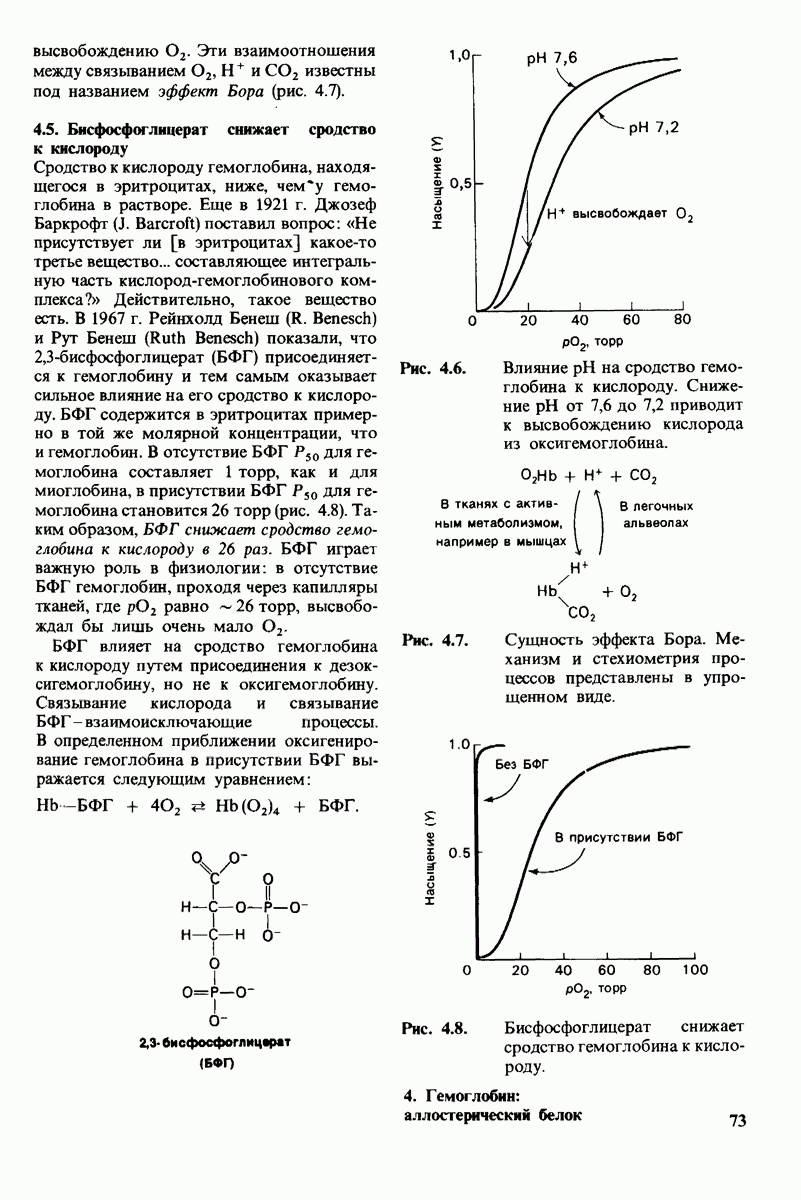
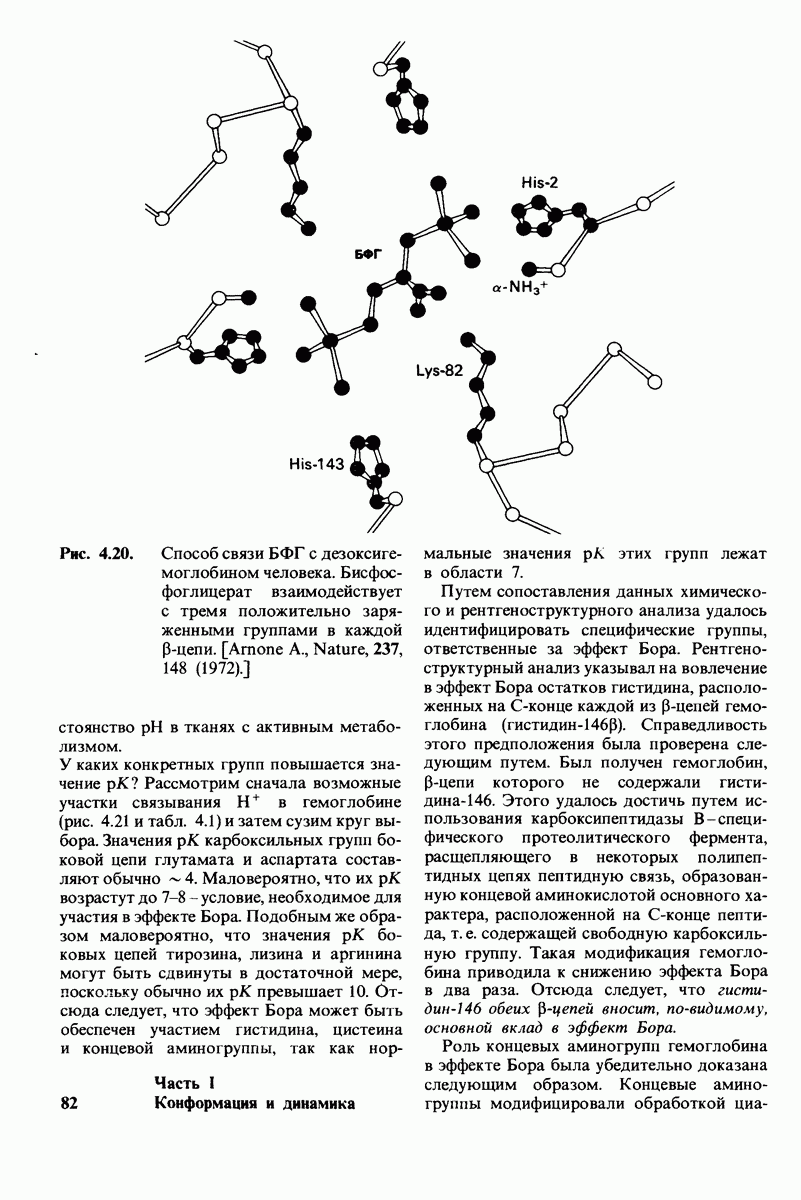
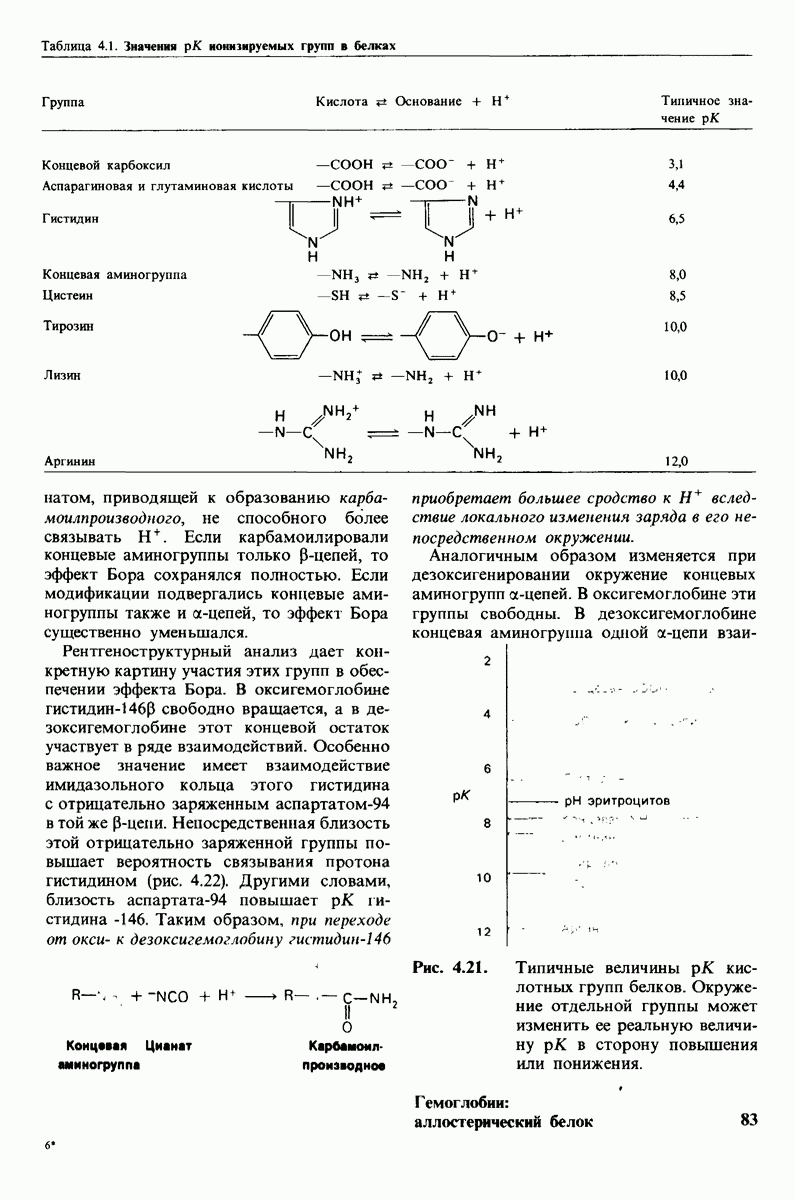
- 4.4. H+ и CO2 способствуют высвобождению O2 (эффект Бора)
- 4.5. Бисфосфоглицерат снижает сродство к кислороду
- 4.6. Клиническое значение биофосфо-глицерата
- 4.7. Гемоглобин плода характеризуется высоким сродством к кислороду
- 4.8. Для проявления аллостерического эффекта необходимо взаимодействие субъединиц
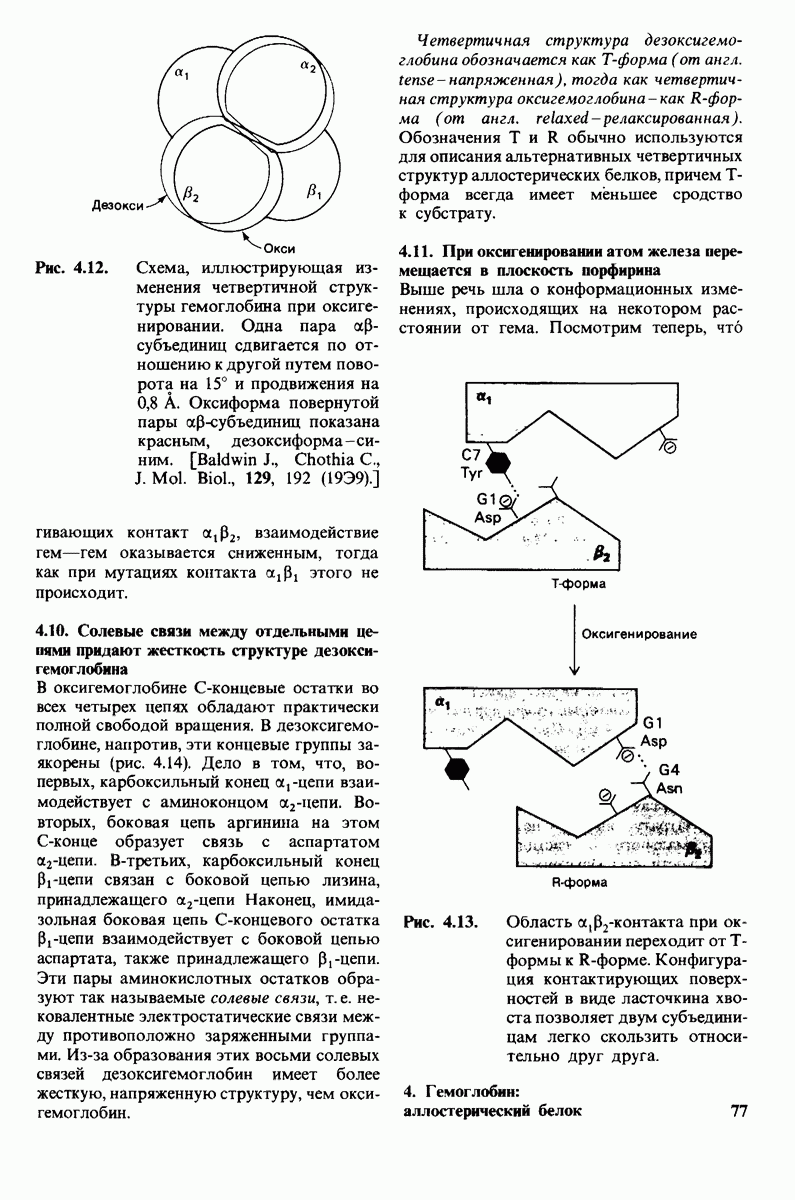
- 4.9. Четвертичная структура гемоглобина значительно изменяется при оксигенировании
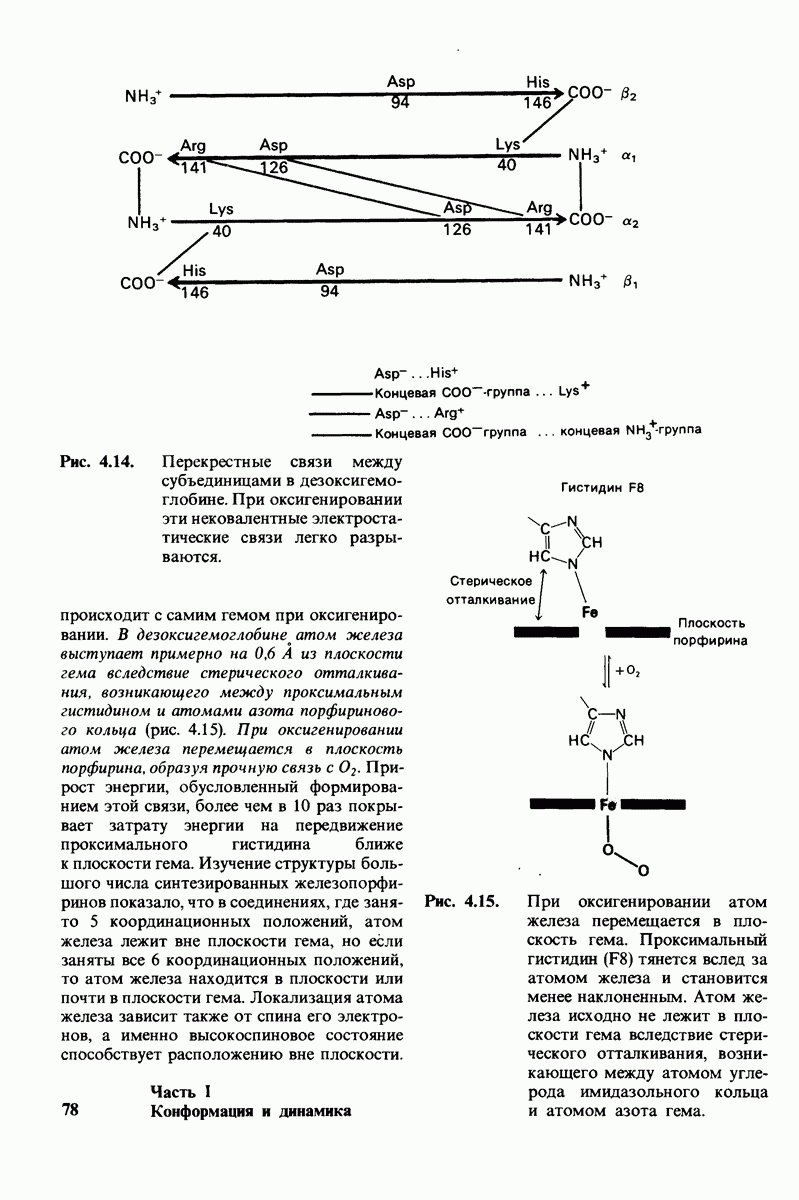
- 4.10. Солевые связи между отдельными цепями придают жесткость структуре дезоксигемоглобина
- 4.11. При оксигенировании атом железа перемещается в плоскость порфирина
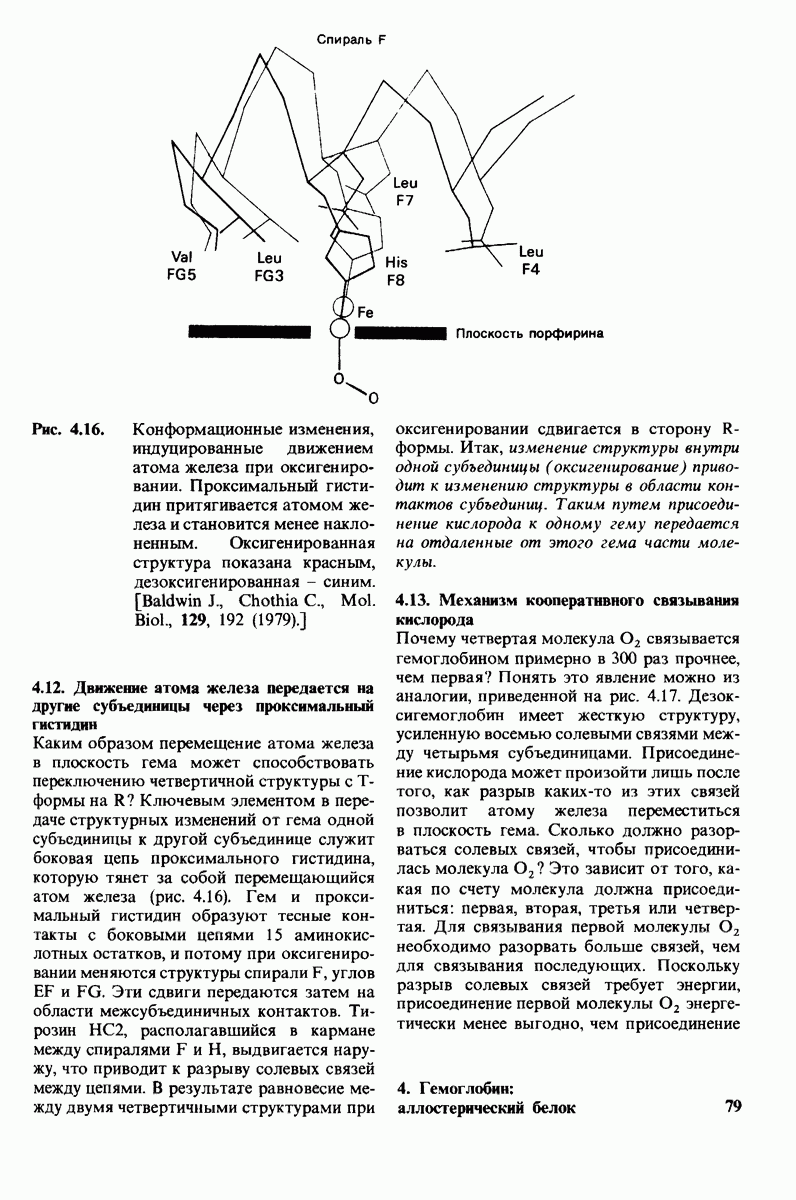
- 4.12. Движение атома железа передается на другие субъединицы через проксимальный гистидин
- 4.13. Механизм кооперативного связывания кислорода
- 4.14. Бисфосфоглицерат снижает сродство к кислороду путем образования перекрестных связей с дезоксигемоглобнном
- 4.15. CO2 присоединяется к концевым аминогруппам гемоглобина, снижая его сродство к кислороду
- 4.16. Механизм эффекта Бора
- 4.17. Коммуникация внутри белковой молекулы
- ГЛАВА 5. Молекулярные болезни: серповидноклеточная анемия
- 5.1. Серповидиоклеточная анемия — хроническая гемолитическая болезнь, передающаяся по наследству
- 5.2. Дезокснгенированный серповидноклеточный гемоглобин имеет пониженную растворимость
- 5.3. Гемоглобин S отличается от гемоглобина A по электрофоретической подвижности
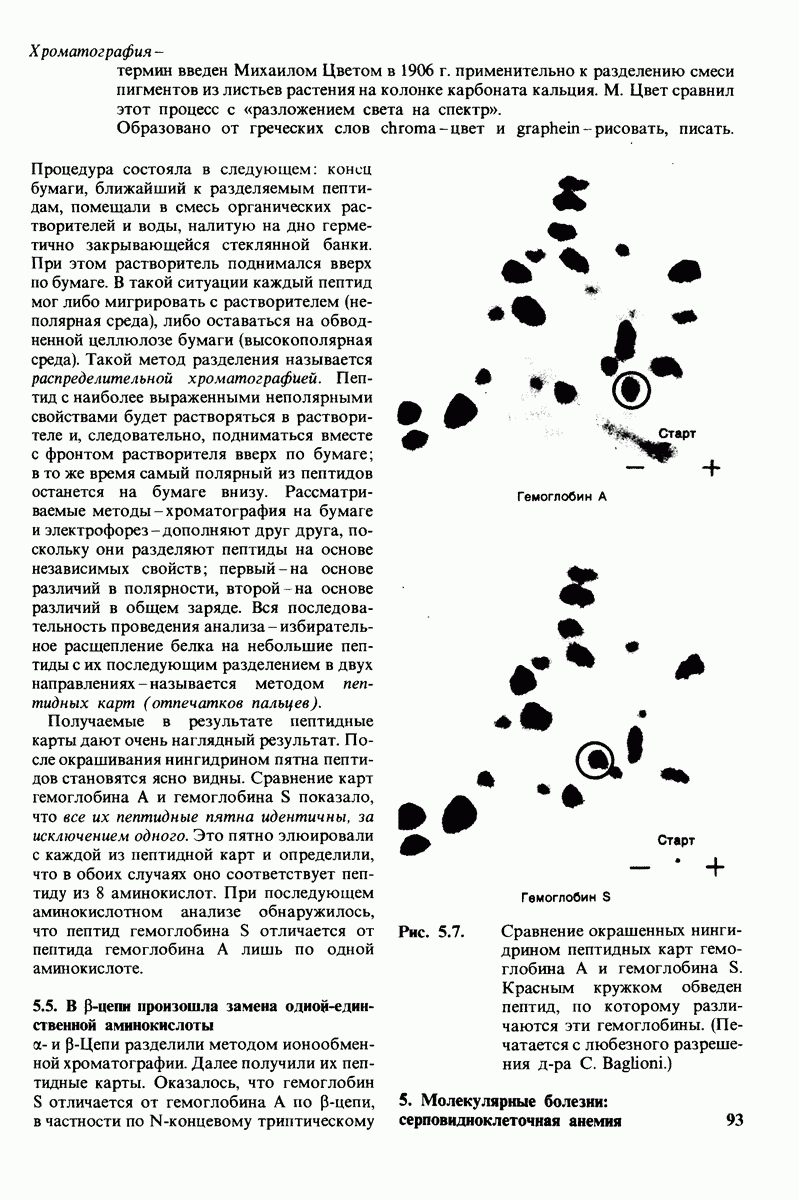
- 5.4. Получение пептидных карт: выявление аминокислотной замены в гемоглобине серповидных клеток
- 5.5. В бетта-цепи произошла замена одной-единственной аминокислоты
- 5.6. На поверхности гемоглобина серповидных клеток имеются «липкие» участки
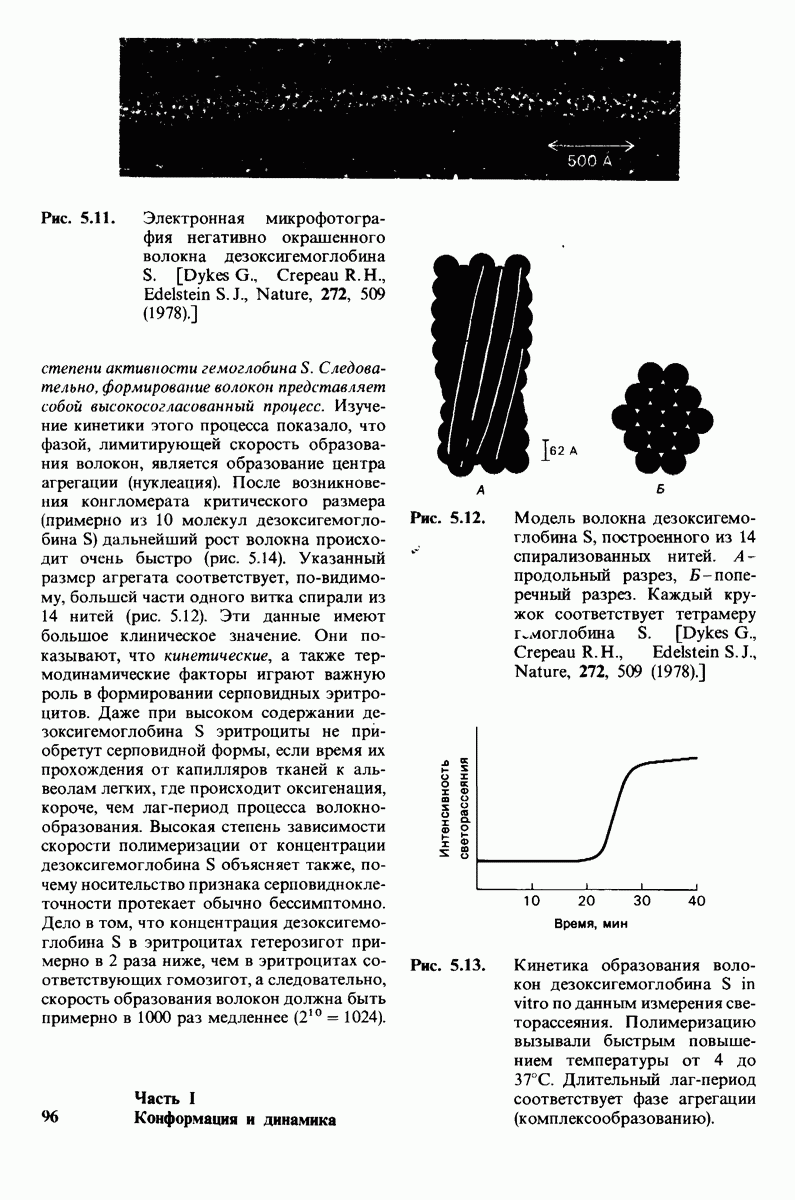
- 5.7. Дезоксигемоглобин S образует длинные спирализованные волокна
- 5.8. Скорость образования волокон в высокой степени зависит от концентрации дезоксигемоглобина S
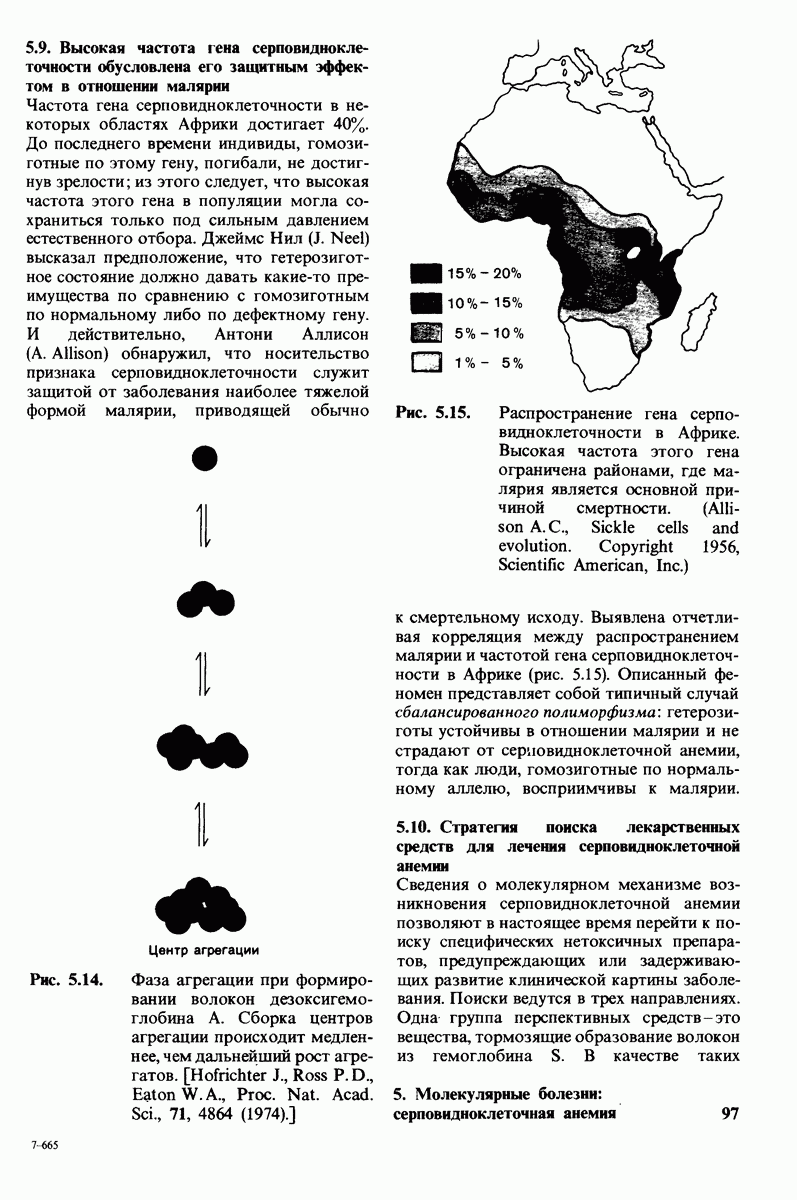
- 5.9. Высокая частота гена серповидноклеточностн обусловлена его защитным эффектом в отношении малярии
- 5.10. Стратегия поиска лекарственных средств для лечения серповидноклеточной анемии
- 5.11. Молекулярная патология гемоглобина
- 5.12. Гемоглобин М: продукт мутации в активном центре
- 5.13. Полярные группы в щели, занимаемой гемом, ослабляют его связывание с полипептидной цепью
- 5.14. В результате некоторых мутаций гемоглобины утрачивают стабильность из-за деформаций третичной структуры
- 5.15. Мутации в области контактов нарушают аллостерические взаимодействия
- 5.16. Значение открытия мутантных гемоглобннов
- ГЛАВА 6. Введение в энзимологию
- 6.2. Ферменты обладают высокой специфичностью
- 6.3. Активность некоторых ферментов регулируется
- 6.4. Ферменты осуществляют трансформацию различных видов энергии
- 6.5. Ферменты не сдвигают равновесия реакции
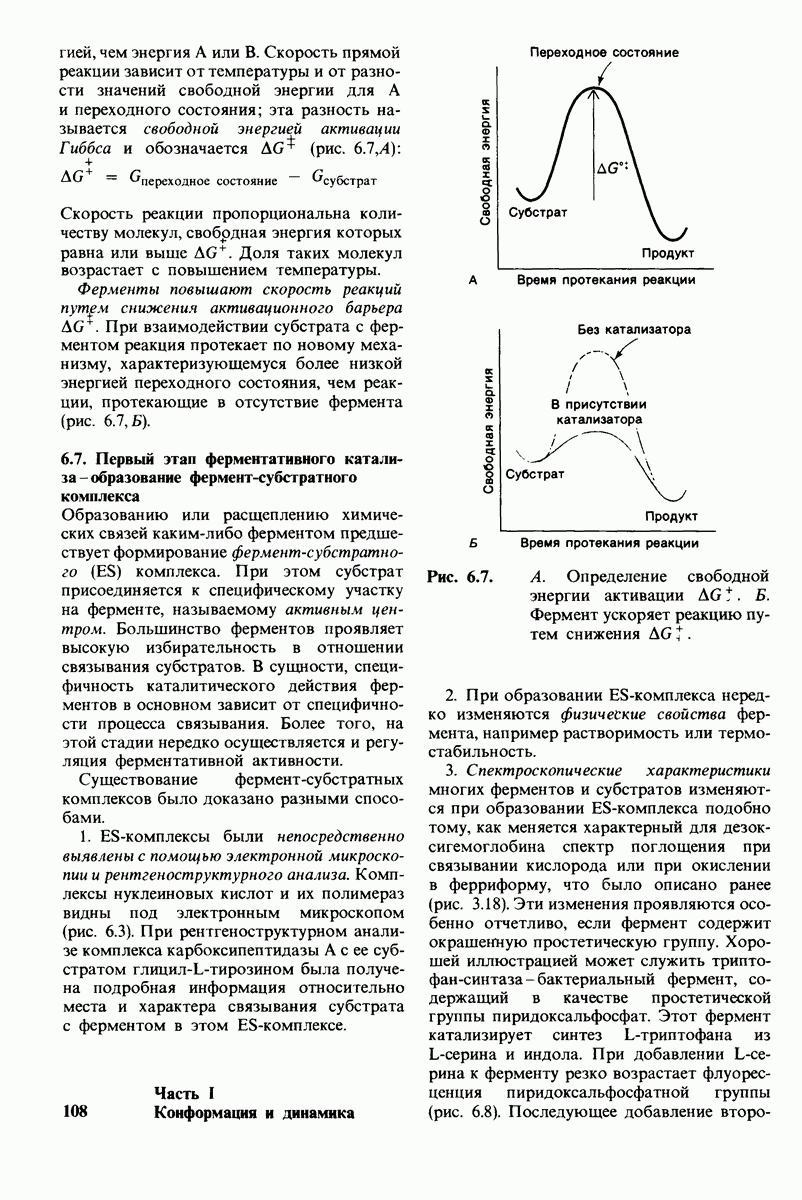
- 6.6. Ферменты снижают энергию активации катализируемых ими реакций
- 6.7. Первый этап ферментативного катализа — образование фермент-субстратного комплекса
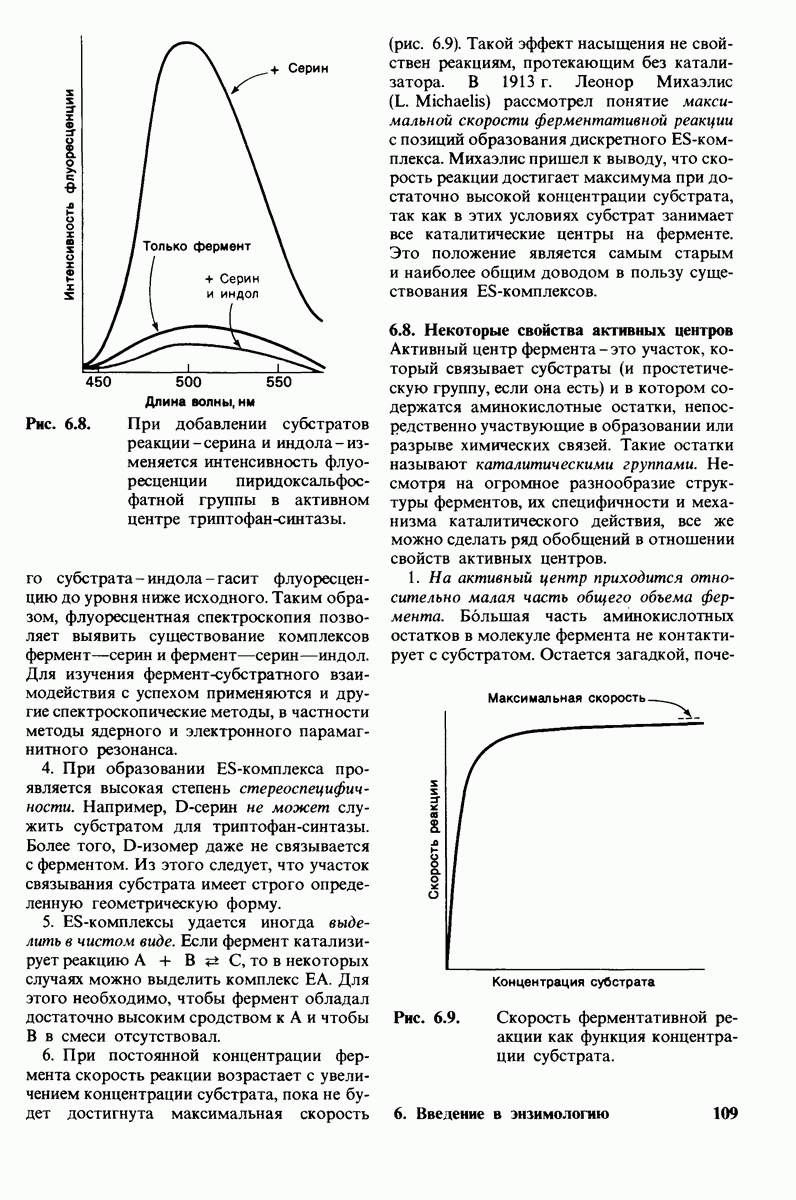
- 6.8. Некоторые свойства активных центров
- 6.9. Кинетика многих ферментов описывается моделью Михаэлиса — Ментен
- 6.10. … можно определить, используя различные концентрации субстрата
- 6.11. Значение величин …
- 6.12. О степени совершенства кинетики ферментативного катализа судят по критерию …
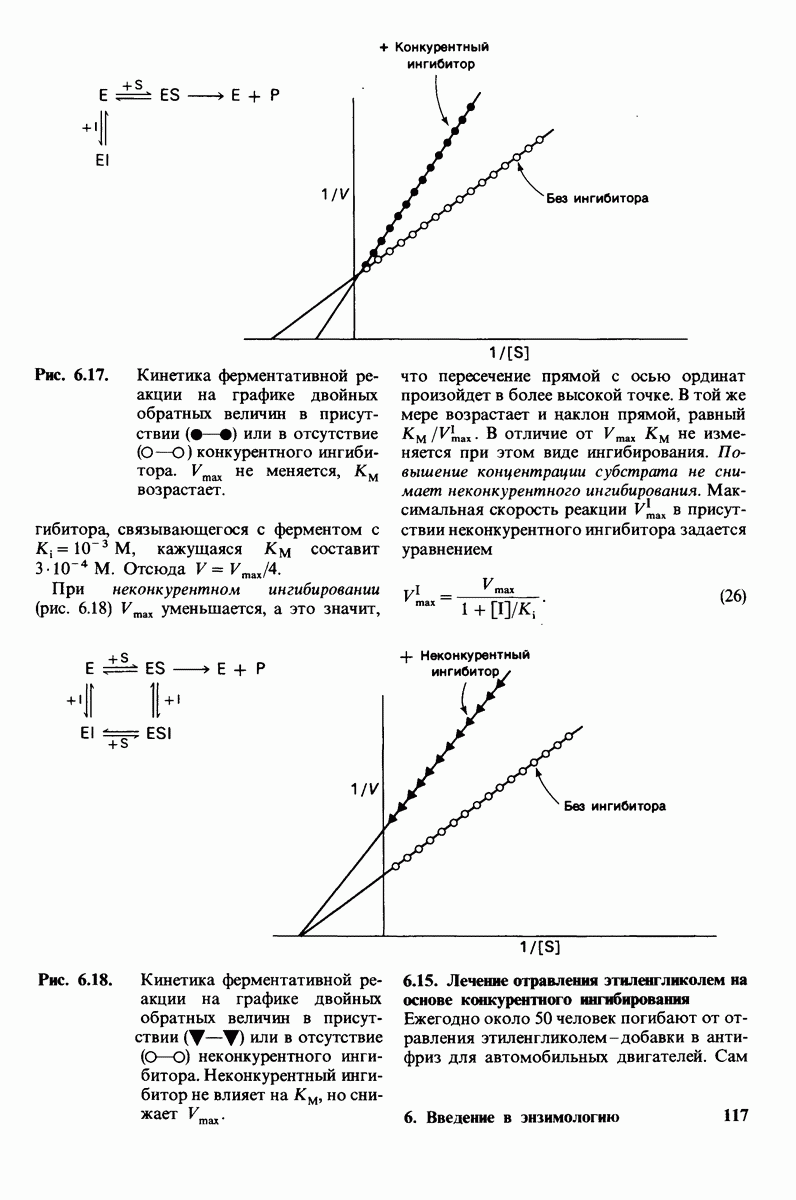
- 6.13. Ферменты могут ингибироваться специфическими молекулами
- 6.15. Лечение отравления этиленгликолем на основе конкурентного ингибирования
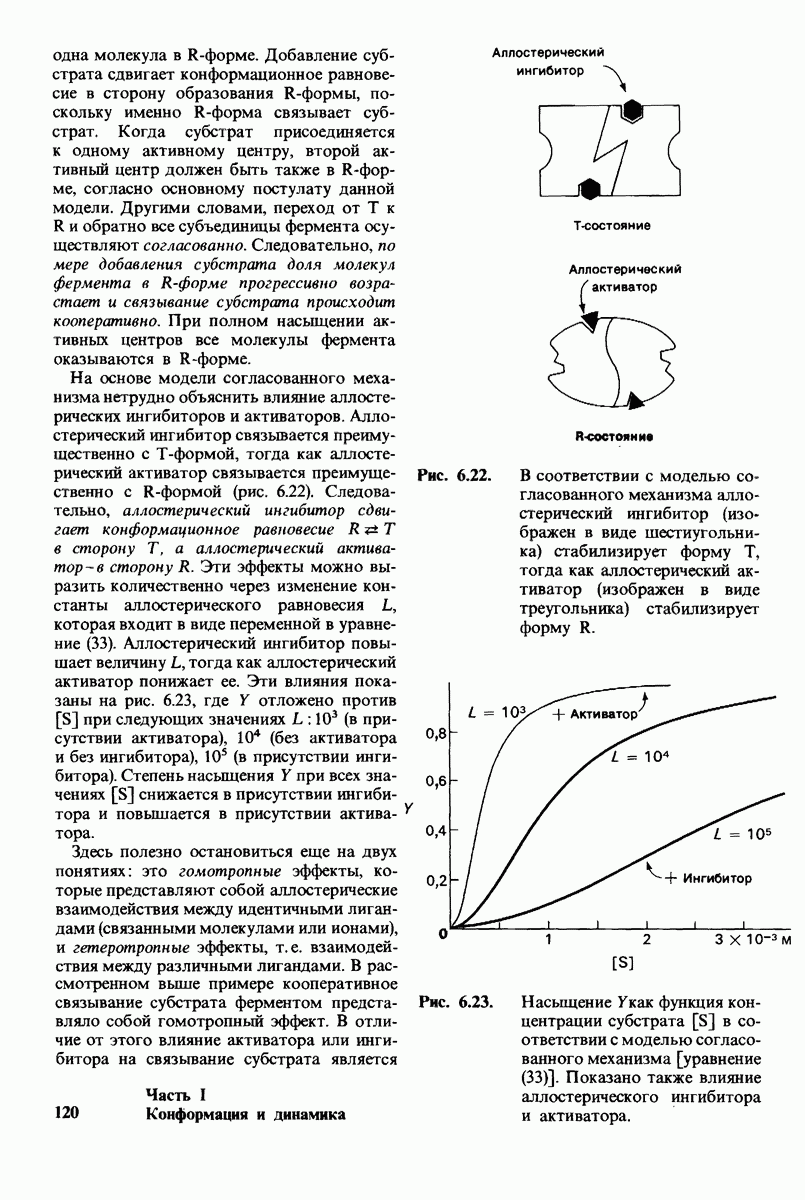
- 6.16. Аллостерические ферменты не подчиняются кинетике Михаэлиса — Ментен
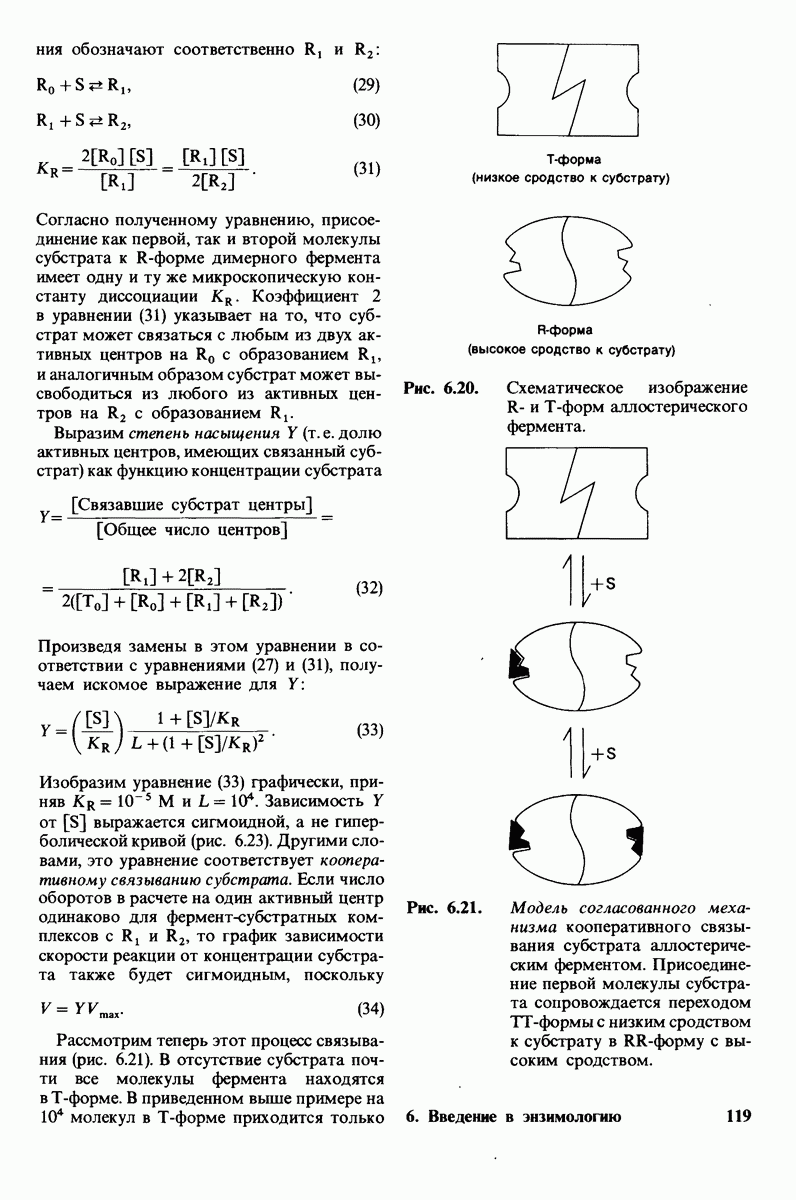
- 6.17. Согласованный механизм аллостерических взаимодействий
- 6.18. Последовательный механизм аллосгерического взаимодействия
- 6.19. Водородные связи, а также электростатические и вандерваальсовы взаимодействия в фермент-субстратных комплексах
- 6.20. Заряженные субстраты могут связываться с противоположно заряженными группами фермента
- 6.21. При связывании субстратов с ферментами образуются строго ориентированные водородные связи
- 6.22. Белки обладают выраженной способностью к образованию водородных связей
- 6.23. Вандерваальсовы взаимодействия играют важную роль в случаях стернческой комплементарности
- 6.24. Биологически важные свойства воды: полярность воды и ее способность к когезин
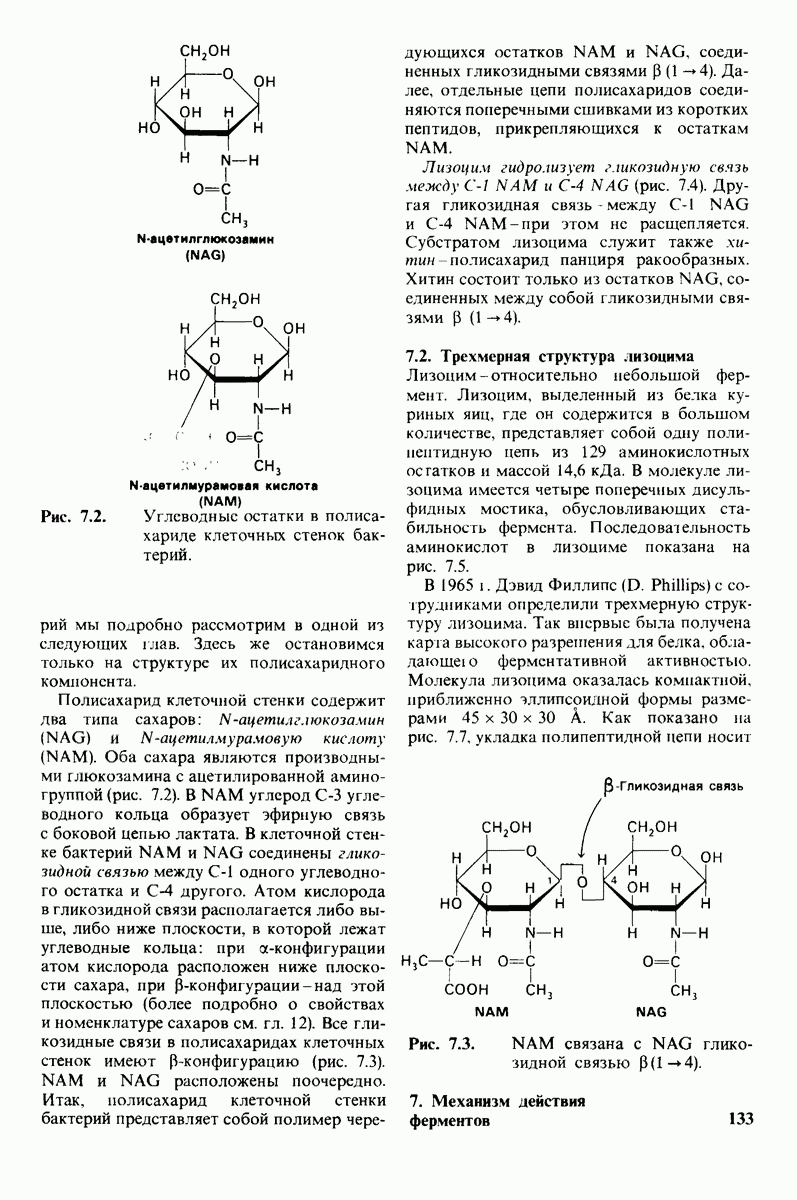
- 6.25. Присутствие воды ослабляет полярные взаимодействия
- 6.26. Гидрофобные взаимодействия; в водной среде неполярные группы стремятся ассоциировать
- ГЛАВА 7. Механизм действия ферментов: лизоцим и карбоксипептидаза
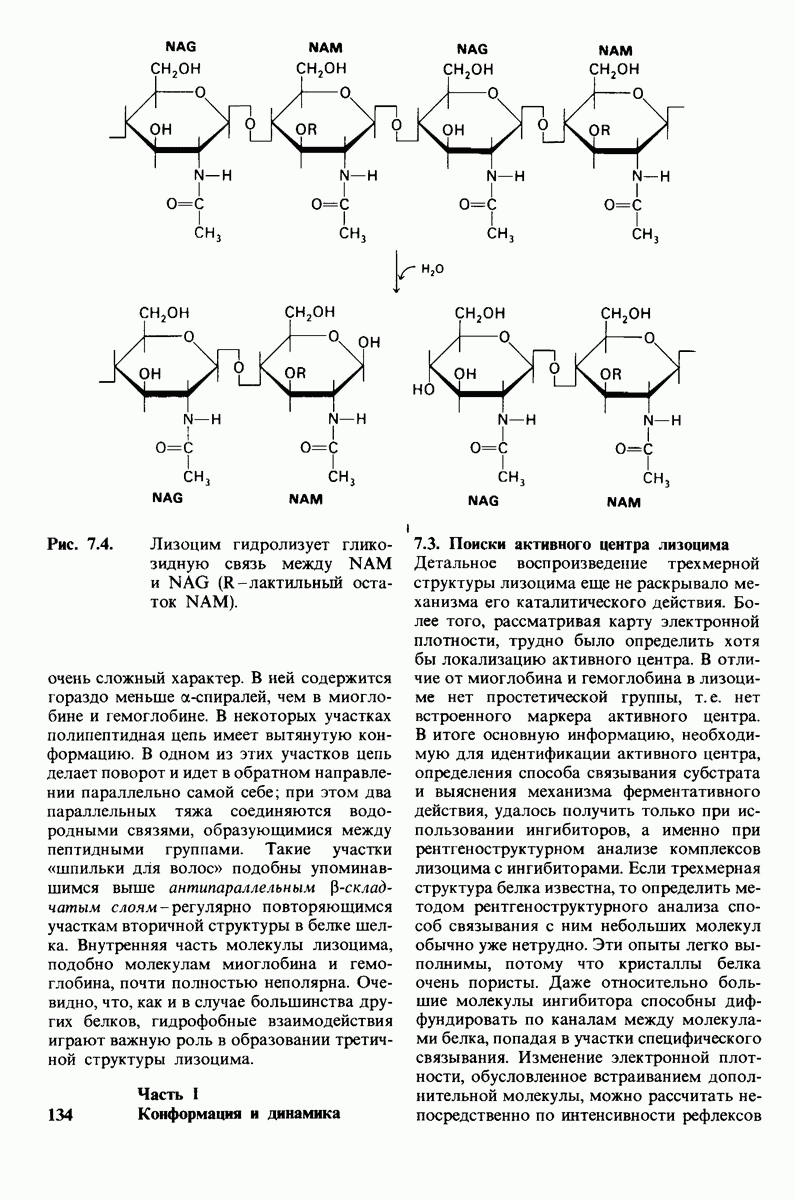
- 7.1. Лизоцим расщепляет клеточные стенки бактерий
- 7.2. Трехмерная структура лизоцима
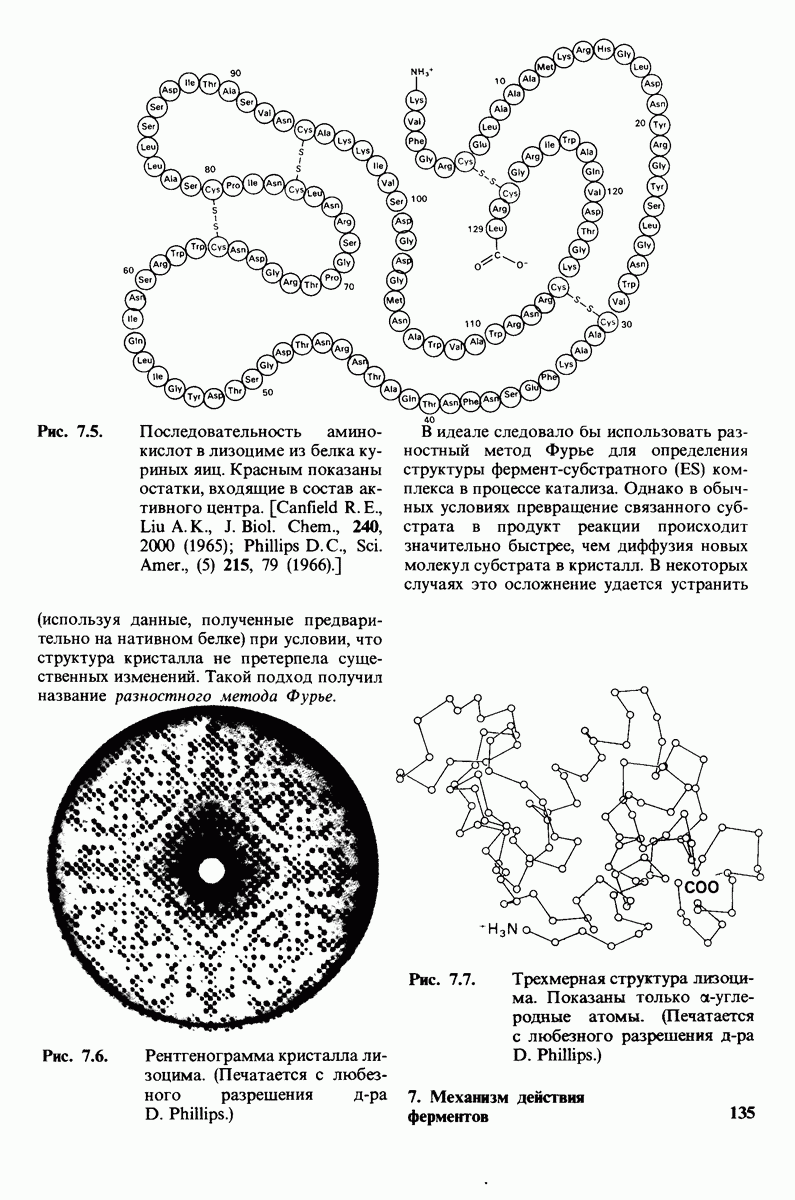
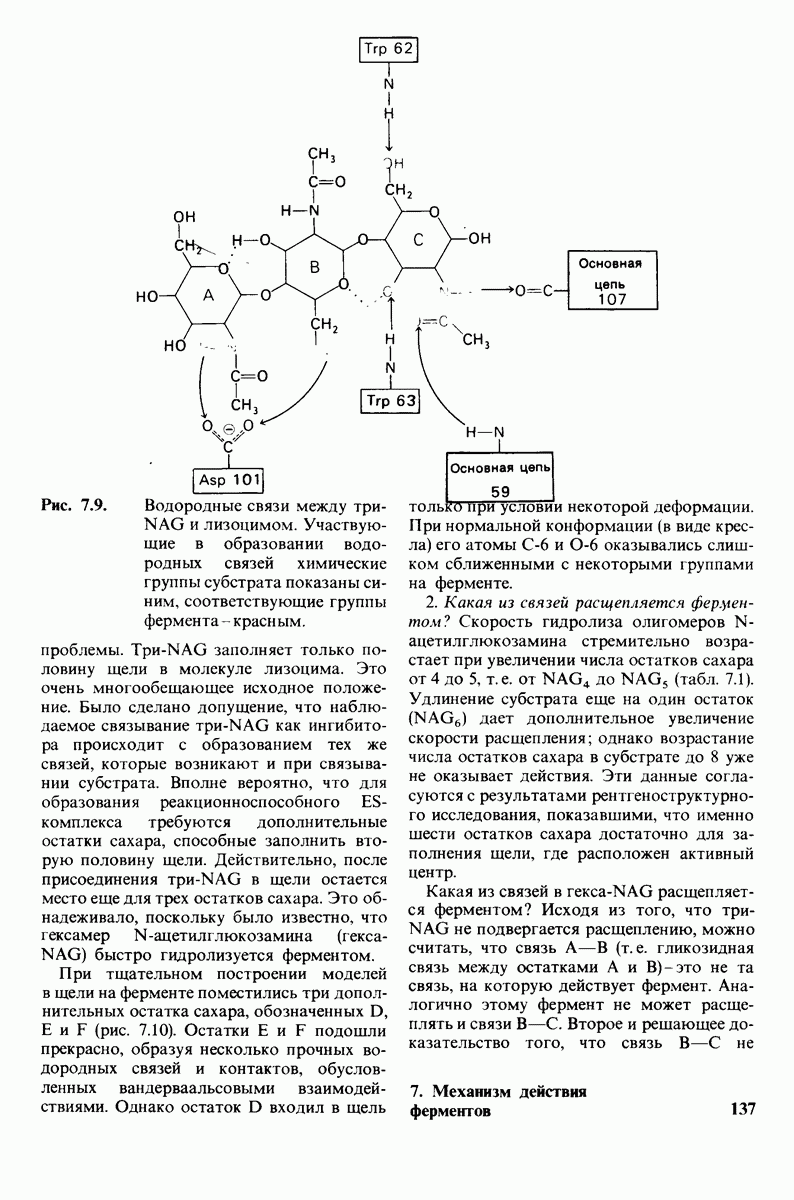
- 7.3. Поиски активного центра лизоцима
- 7.4. Способ связывания конкурентного ингибитора
- 7.5. От структуры фермента — к механизму ферментативного действия
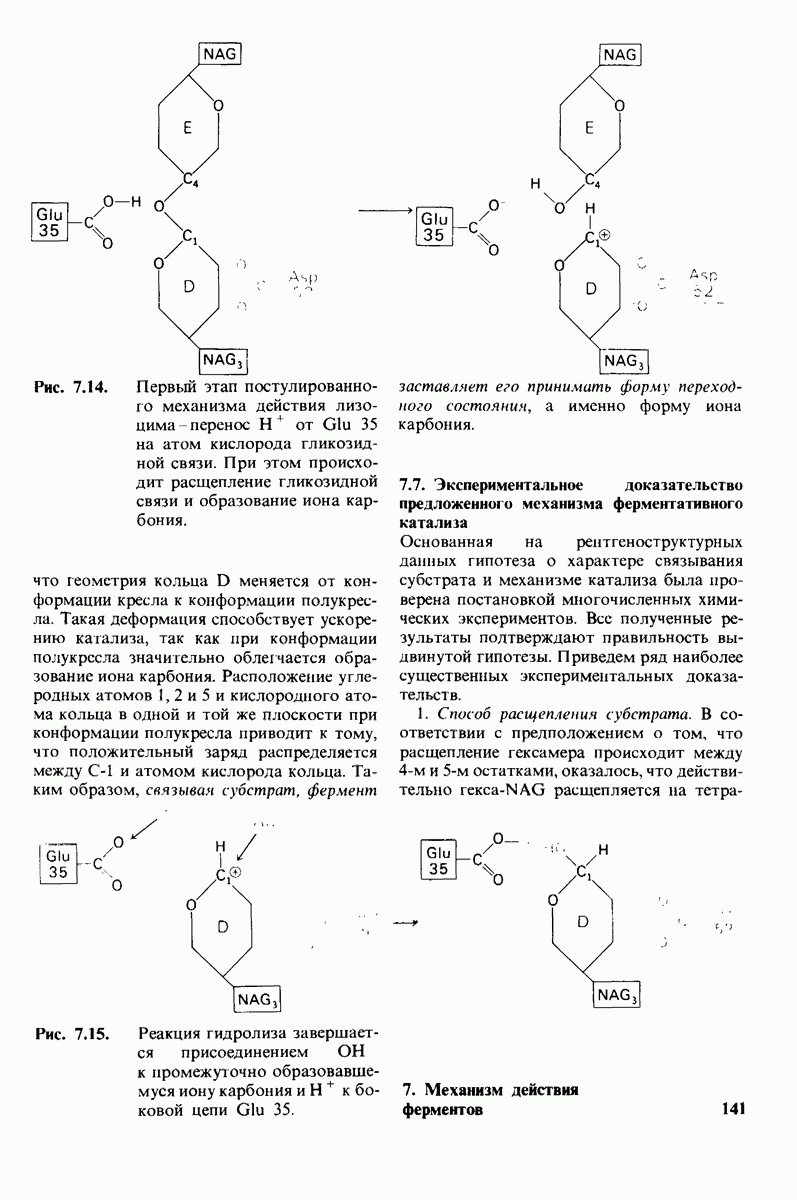
- 7.6. Промежуточное образование иона карбония — критический этап катализа
- 7.7. Экспериментальное доказательство предложенного механизма ферментативного катализа
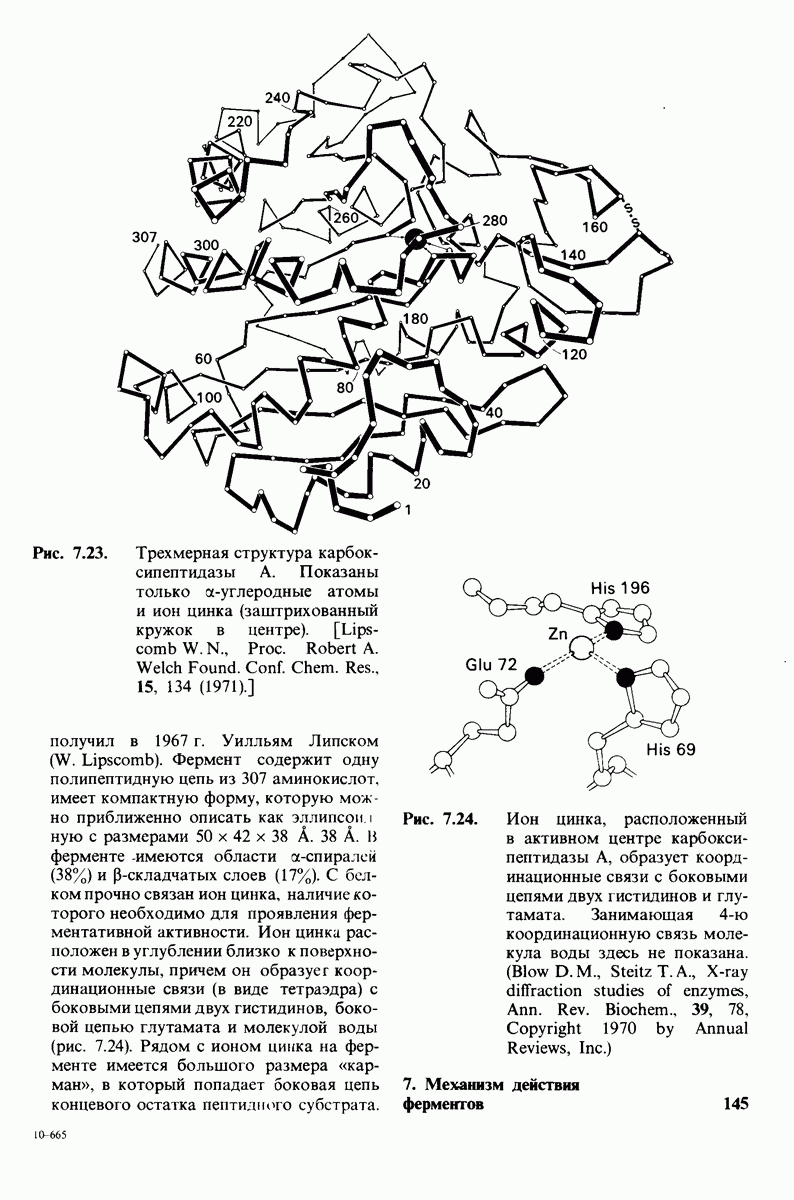
- 7.8. Карбоксипептидаза А: протеолитический фермент, содержащий цинк
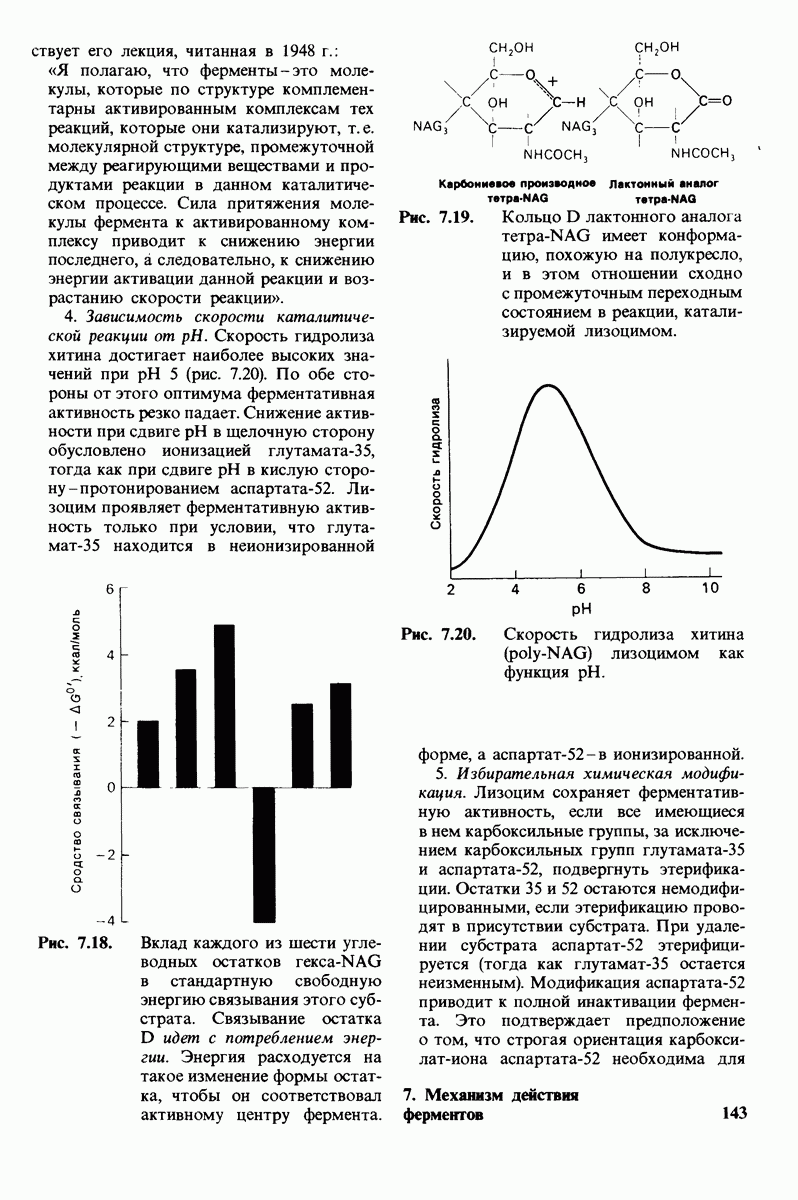
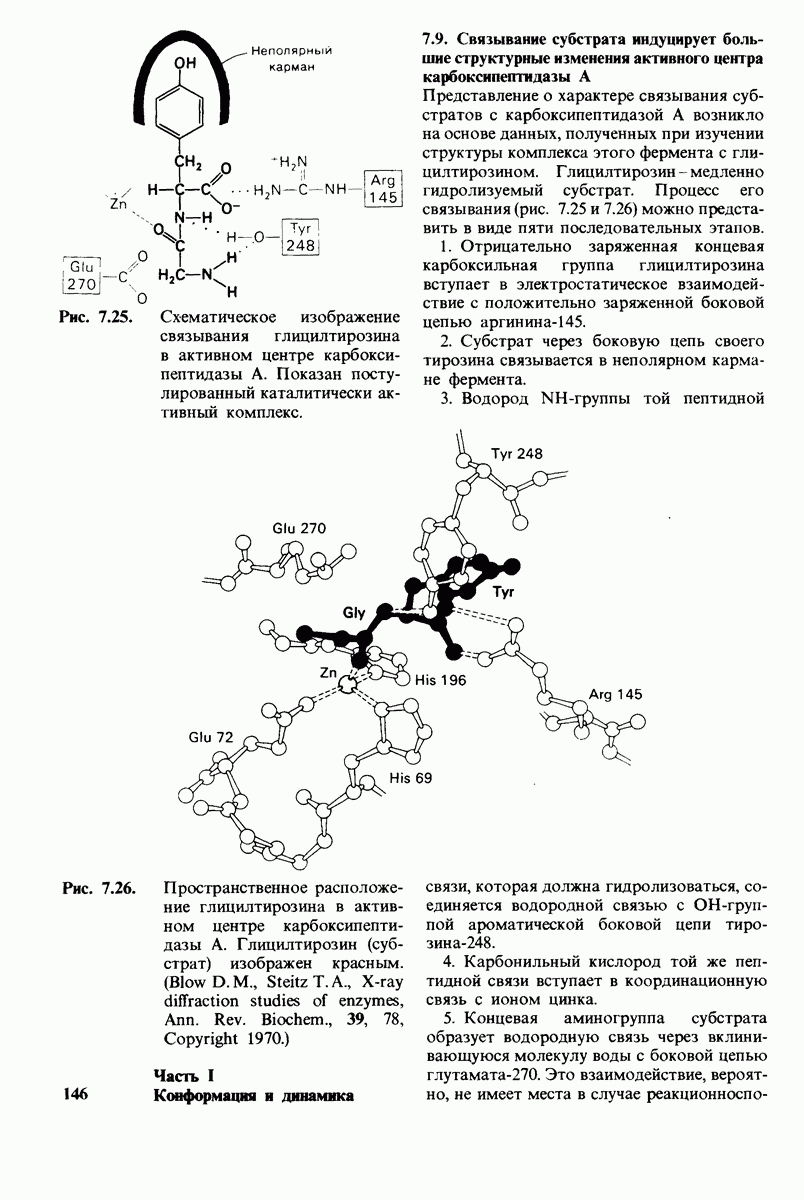
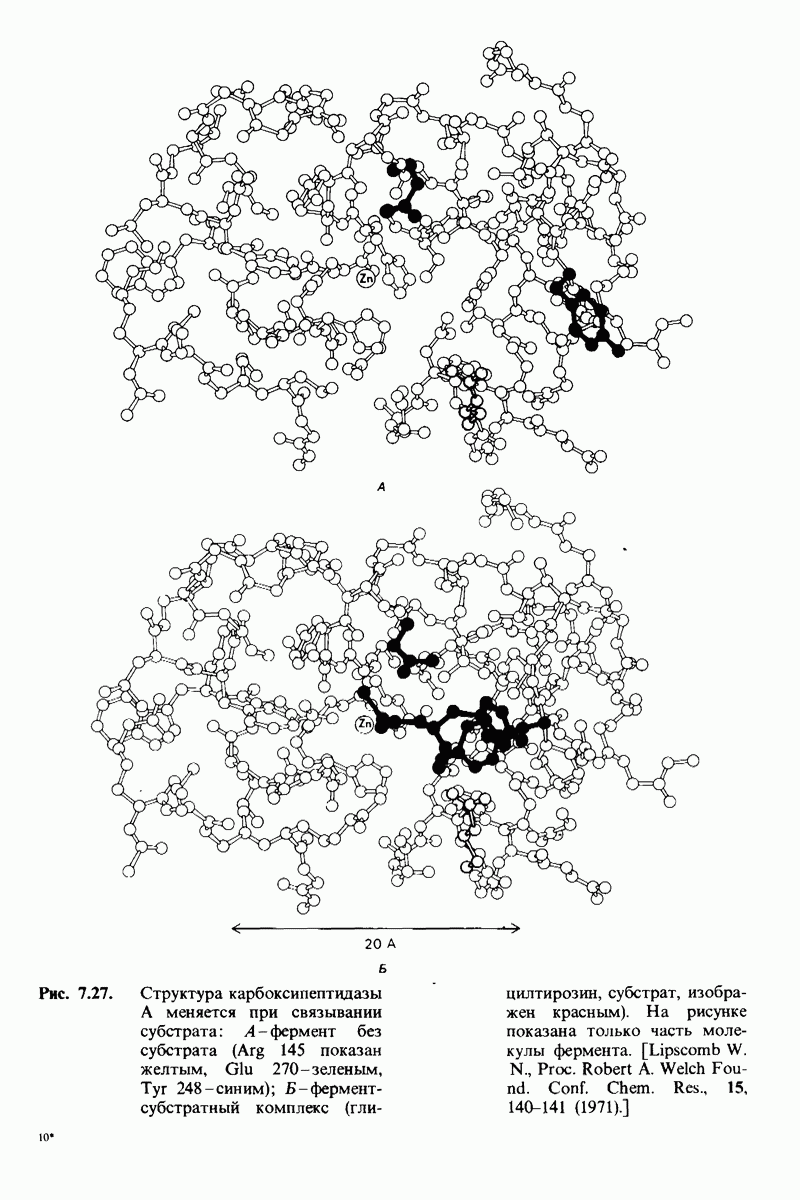
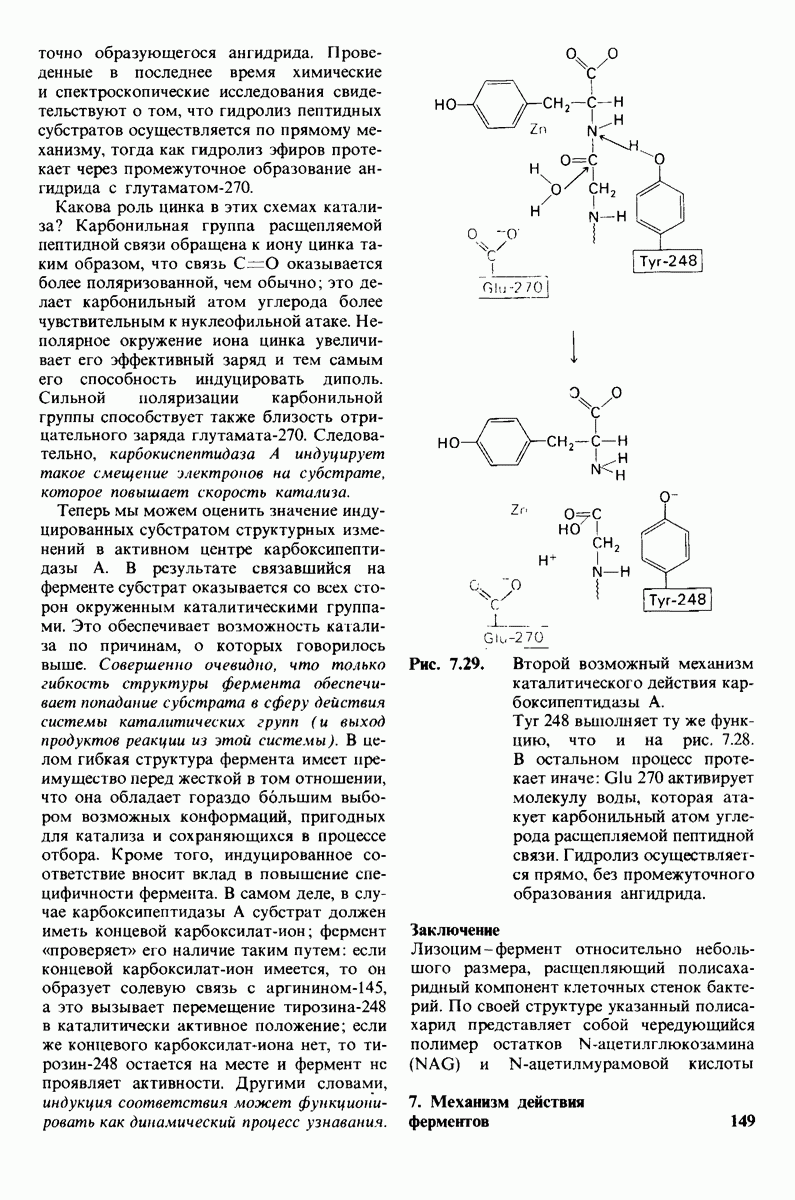
- 7.9. Связывание субстрата индуцирует большие структурные изменения активного центра карбоксипептидазы А
- 7.10. Скорость катализа карбоксипептидазой А возрастает благодаря смещению электронов
- ГЛАВА 8. Активация проферментов: пищеварительные ферменты и факторы свертывания крови
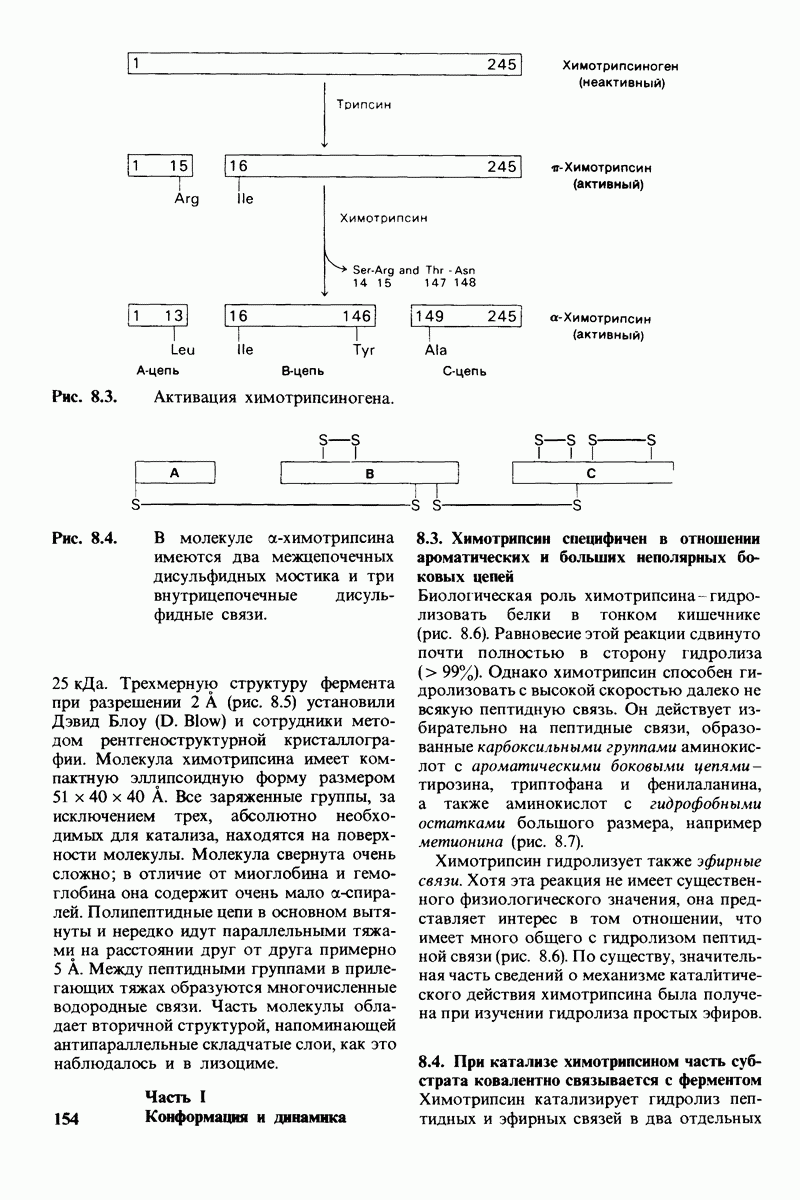
- 8.1. Активация химотрипсиногена происходит путем специфического расщепления одной пептидной связи
- 8.2. Трехмерная структура химотрипсина
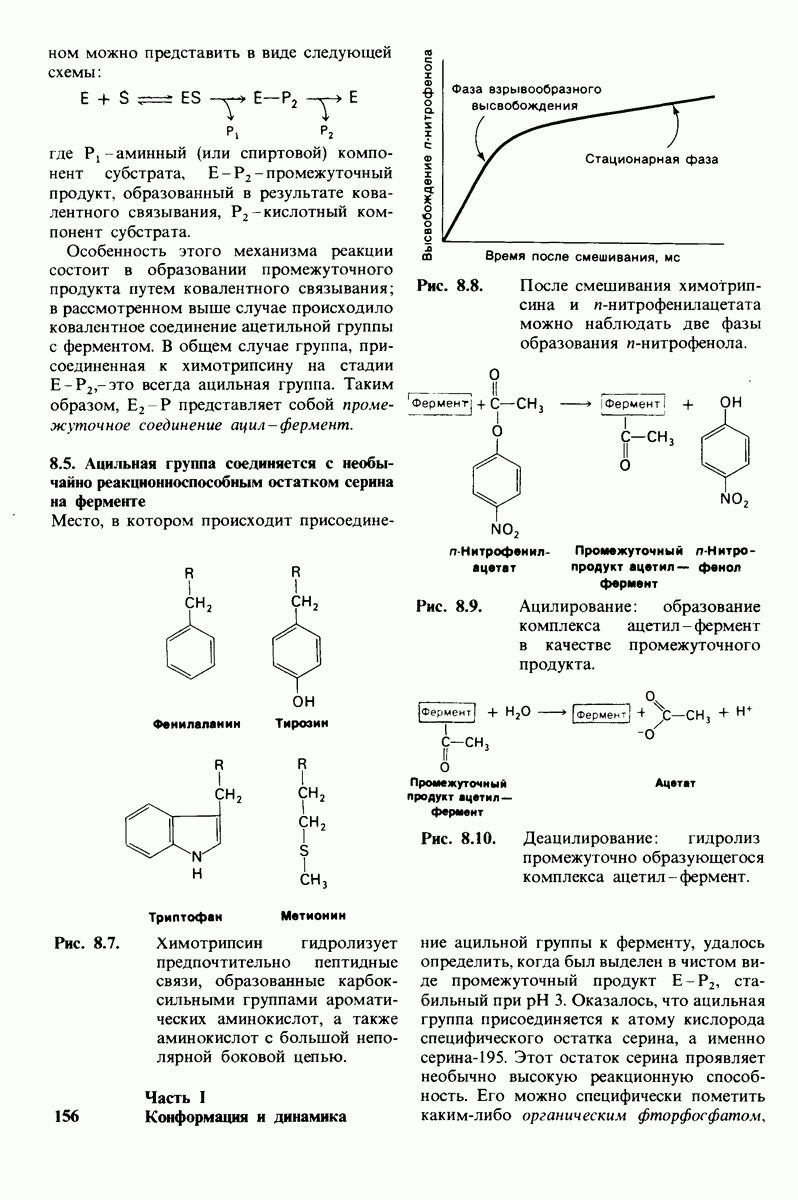
- 8.3. Химотрипсии специфичен в отношении ароматических и больших неполярных боковых цепей
- 8.4. При катализе химотрипсином часть субстрата ковалентно связывается с ферментом
- 8.5. Ацильная группа соединяется с необычайно реакционноспособным остатком серина на ферменте
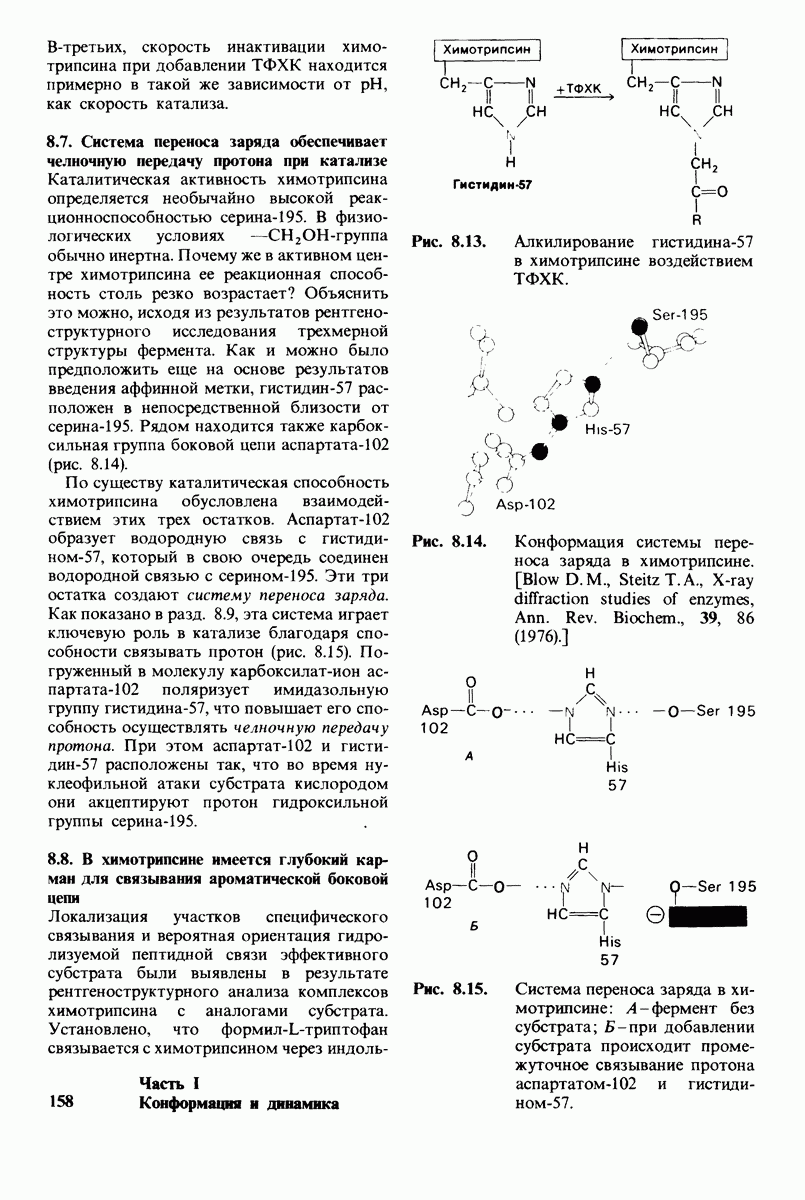
- 8.6. Участие гистидина-57 в катализе выявляется с помощью аффинной метки
- 8.7. Система переноса заряда обеспечивает челночную передачу протона при катализе
- 8.8. В химотрипснне имеется глубокий карман для связывания ароматической боковой цепи
- 8.9. В процессе катализа образуется переходное тетраэдрическое промежуточное соединение
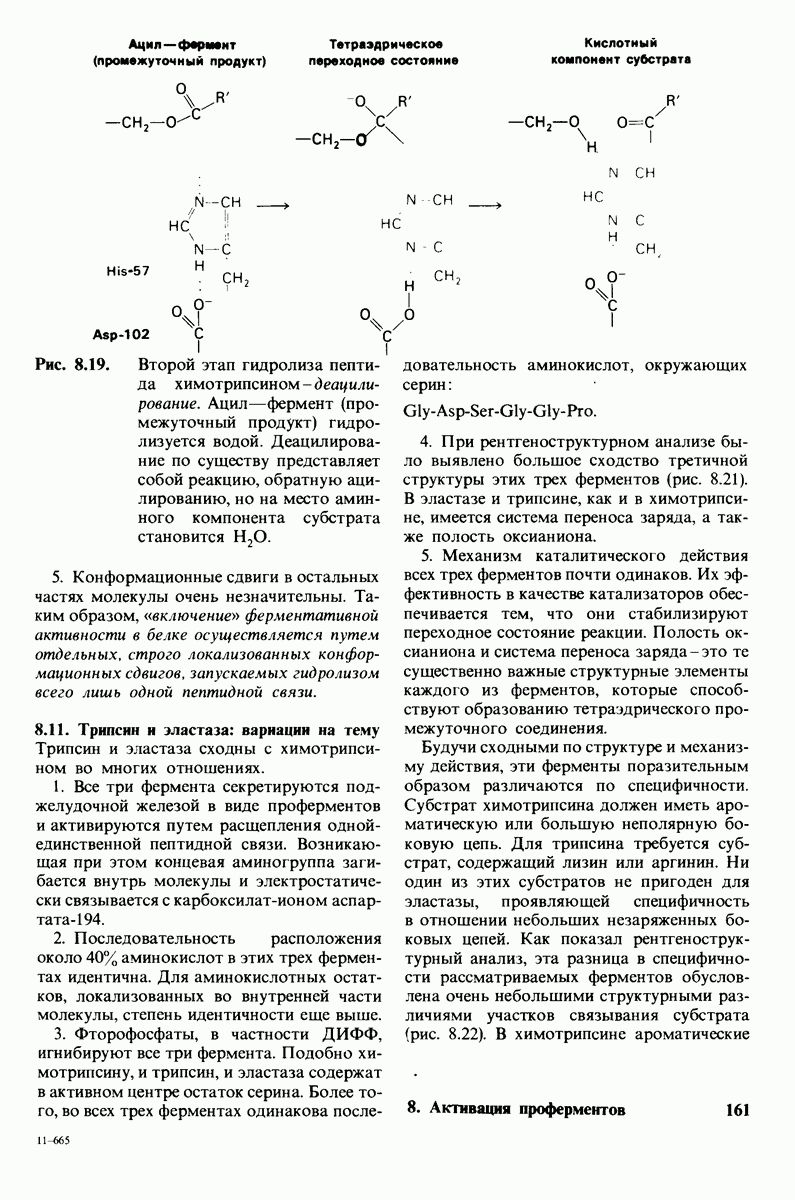
- 8.10. Механизм активации профермента
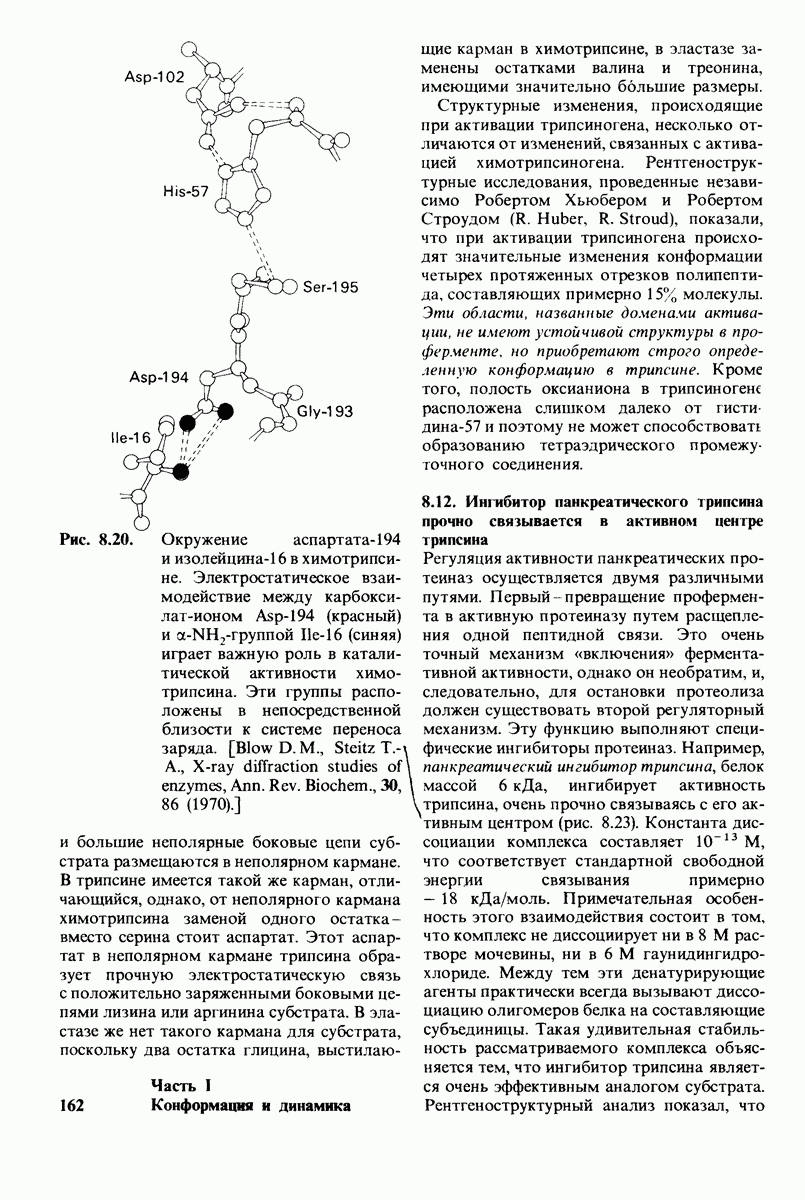
- 8.11. Трипсин и эластаза: вариации на тему
- 8.12. Ингибитор панкреатического трипсина прочно связывается в активном центре трипсина
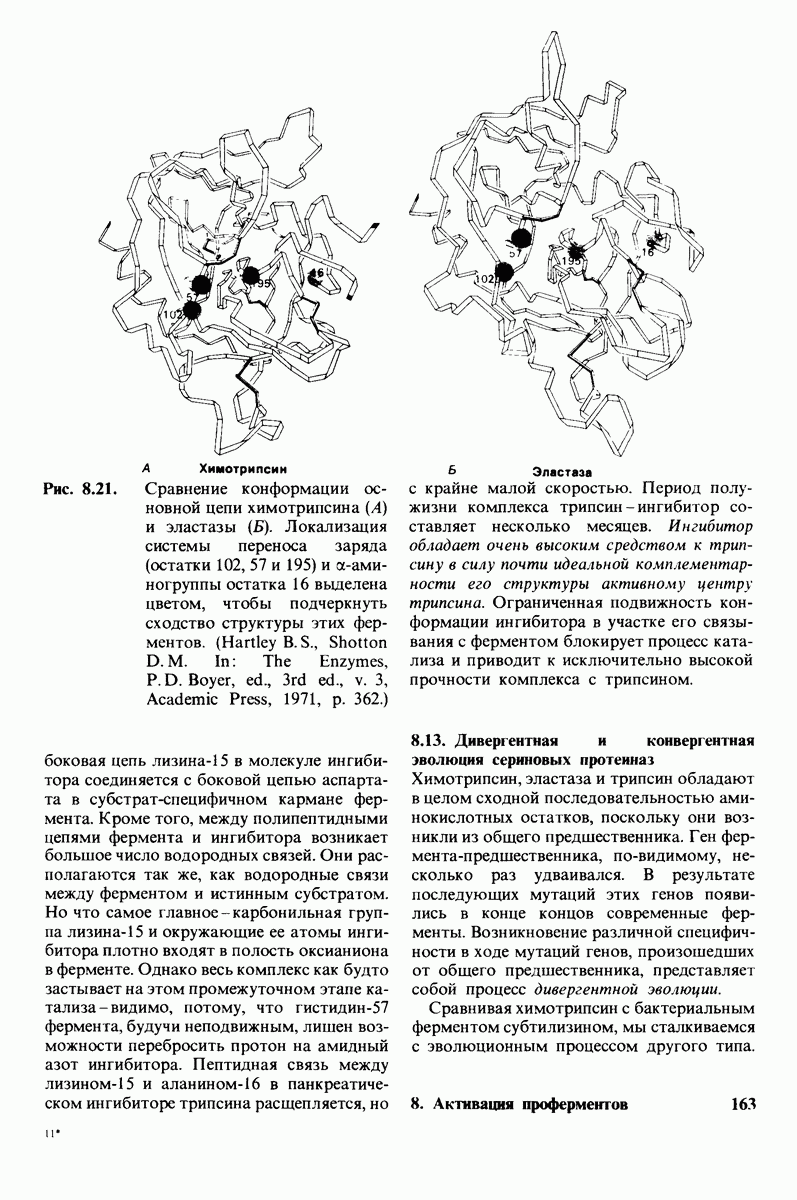
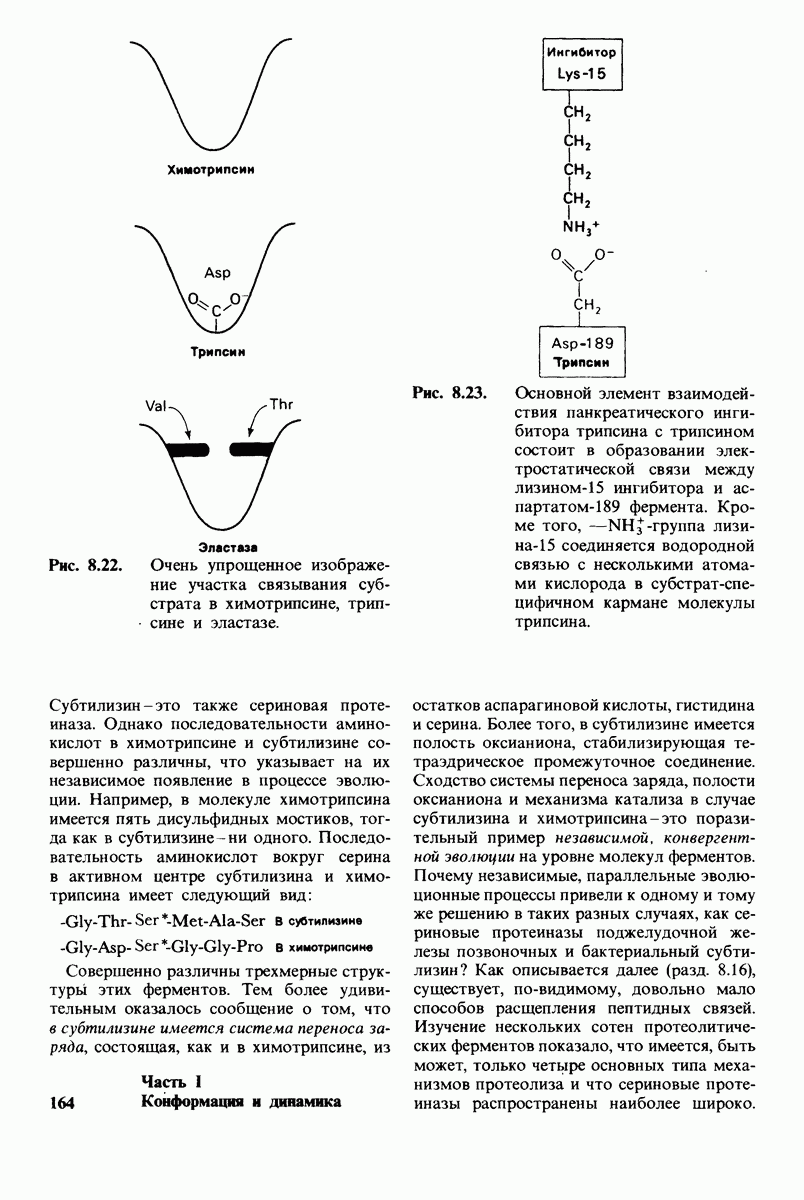
- 8.13. Дивергентная и конвергентная эволюция сериновых протеиназ
- 8.14. Координированная активация панкреатических проферментов
- 8.16. Основные типы протеолитических ферментов — это сериновые протеиназы и карбоксипротеиназы
- 8.17. Свертывание крови как каскад реакций активации проферментов
- 8.18. Образование кровяного сгустка требует взаимодействия двух типов ферментативных превращений
- 8.19. Фибриноген превращается в фибриновый сгусток под действием тромбина
- 8.20. Мономеры фибрина спонтанно образуют фибриллы
- 8.21. Сгусток фибрина стабилизирован ковалентными поперечными связями
- 8.22. Тромбин гомологичен трипсину
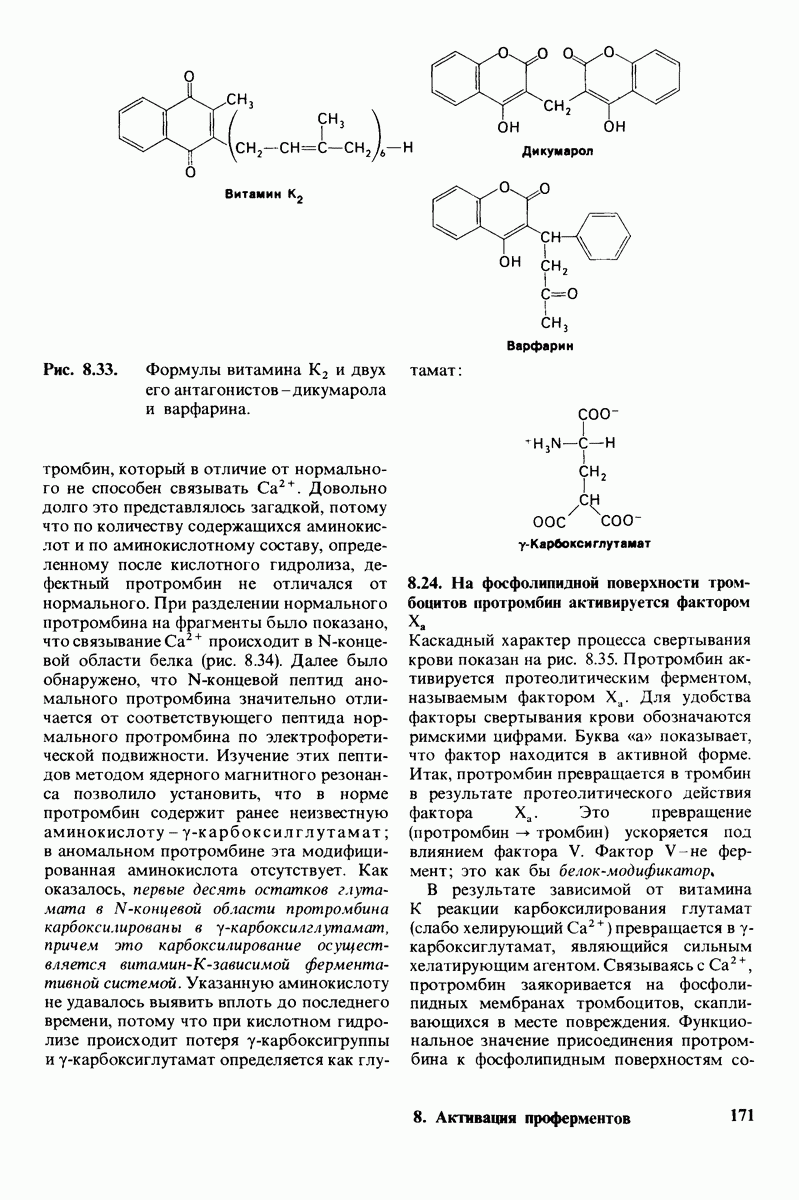
- 8.23. Для синтеза протромбина необходим витамин К
- 8.24. На фосфолипидной поверхности тромбоцитов протромбин активируется фактором …
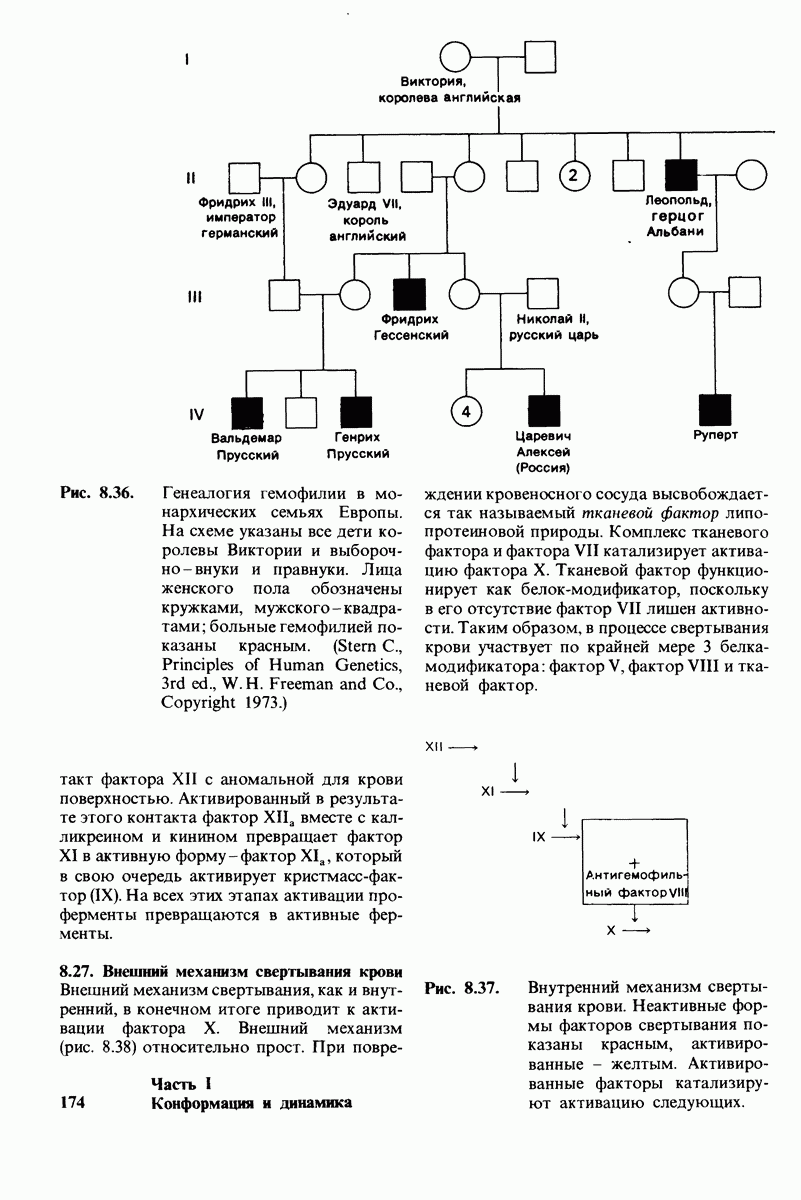
- 8.25. Гемофилия и другие формы нарушения свертывания крови позволили выявить ряд начальных этапов образования кровяного сгустка
- 8.26. Внутренний механизм свертывания крови
- 8.27. Внешний механизм свертывания крови
- 8.28. Контроль свертывания крови: проблема, требующая внимания
- ГЛАВА 9. Белки соединительной ткани: коллаген, эластин и протеогликаны
- 9.1. Тропоколлагеи как основная структурная единица коллагена
- 9.2. Коллаген обладает необычным составом и необычной последовательностью аминокислот
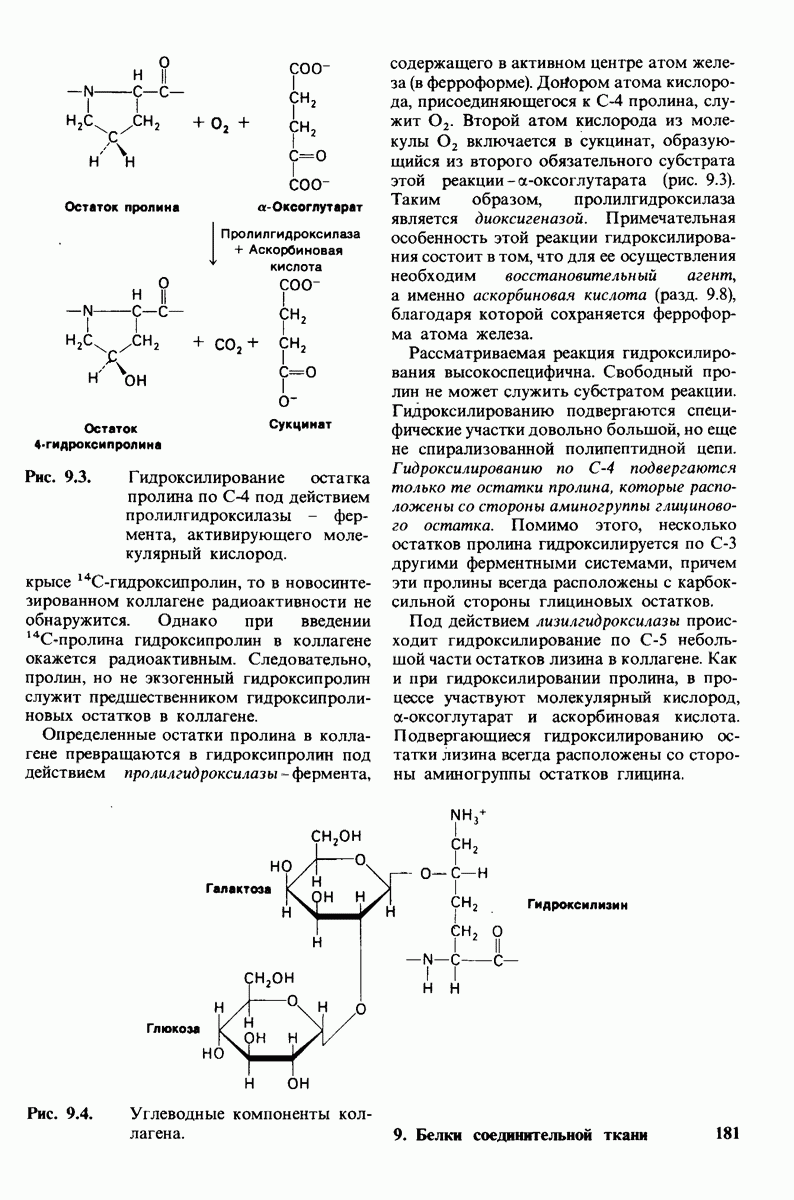
- 9.3. Некоторые остатки пролина и лизина в коллагене гидроксилируются
- 9.4. К остаткам гидроксилизина присоединены сахара
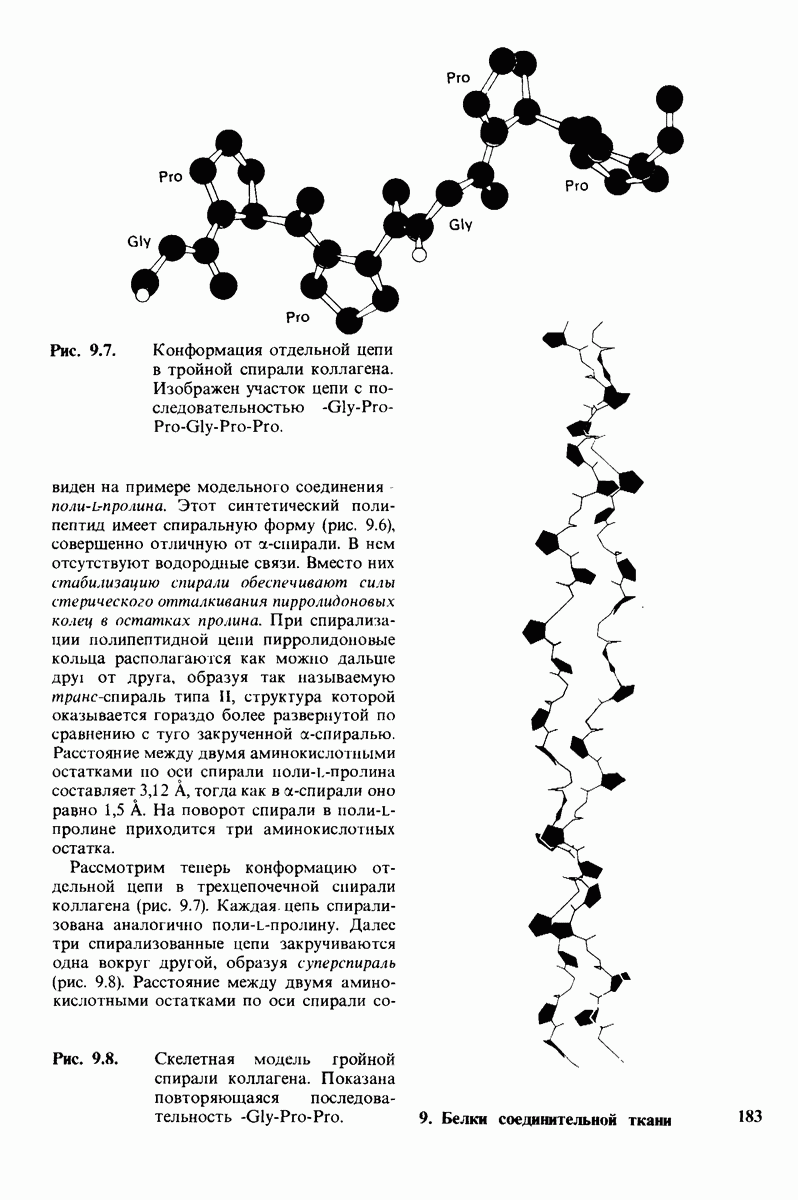
- 9.5. Структура тропоколлагена — это тройной спирально скрученный тяж
- 9.6. Малые размеры глицина делают его незаменимым компонентом структуры
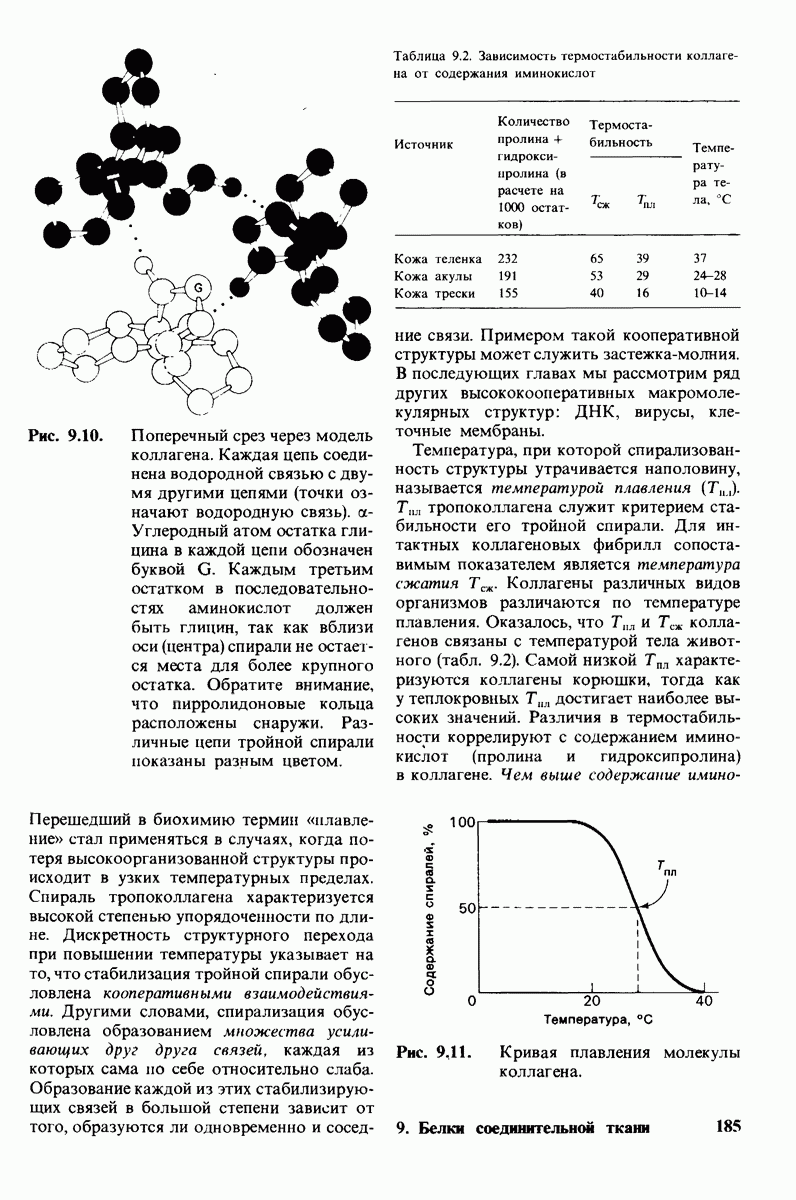
- 9.7. Стабильность спирали коллагена зависит от кооперативных взаимодействий
- 9.8. Нарушение гидроксилирования — один из биохимических дефектов при цинге
- 9.9. Проколлаген предшественник коллагена при его биосинтезе
- 9.10. Дополнительные пептиды цепей-предшественников отщепляются ферментативно
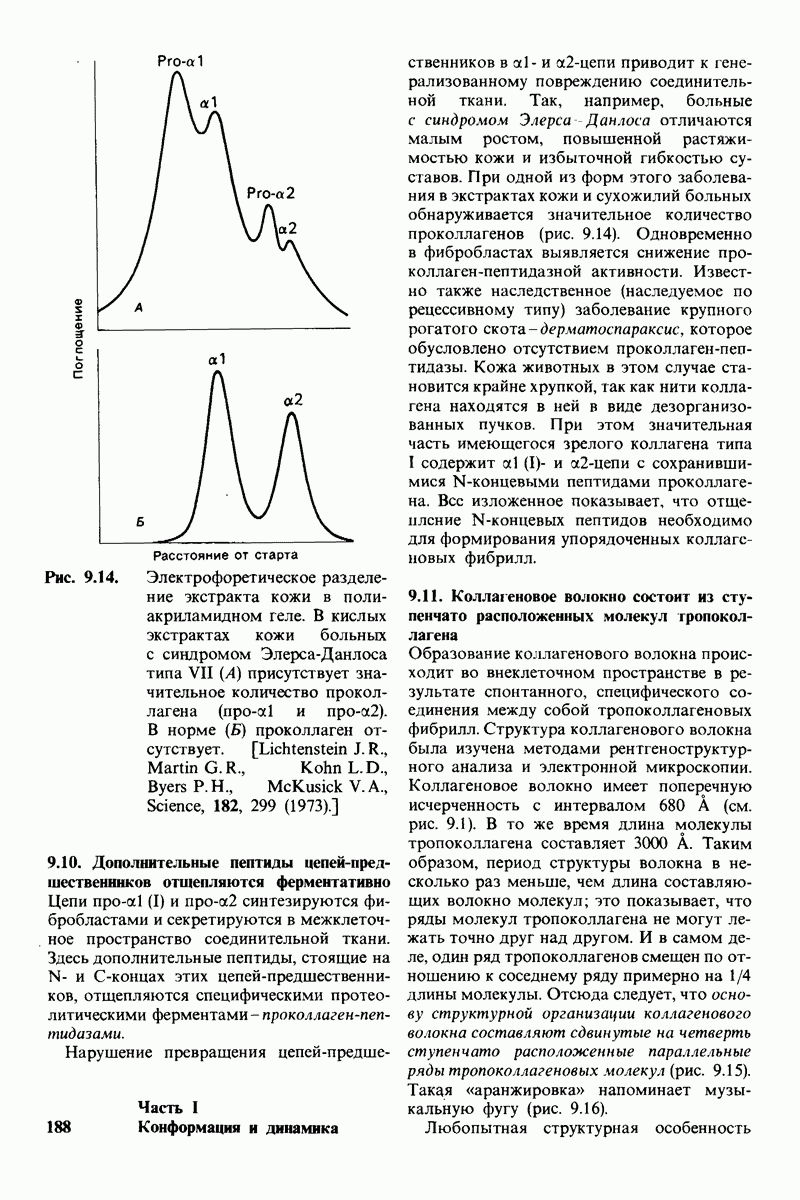
- 9.11. Коллагеновое волокно состоит из ступенчато расположенных молекул гропоколлагена
- 9.12. Образование коллагенового волокна регулируется проколлаген-пептидазами
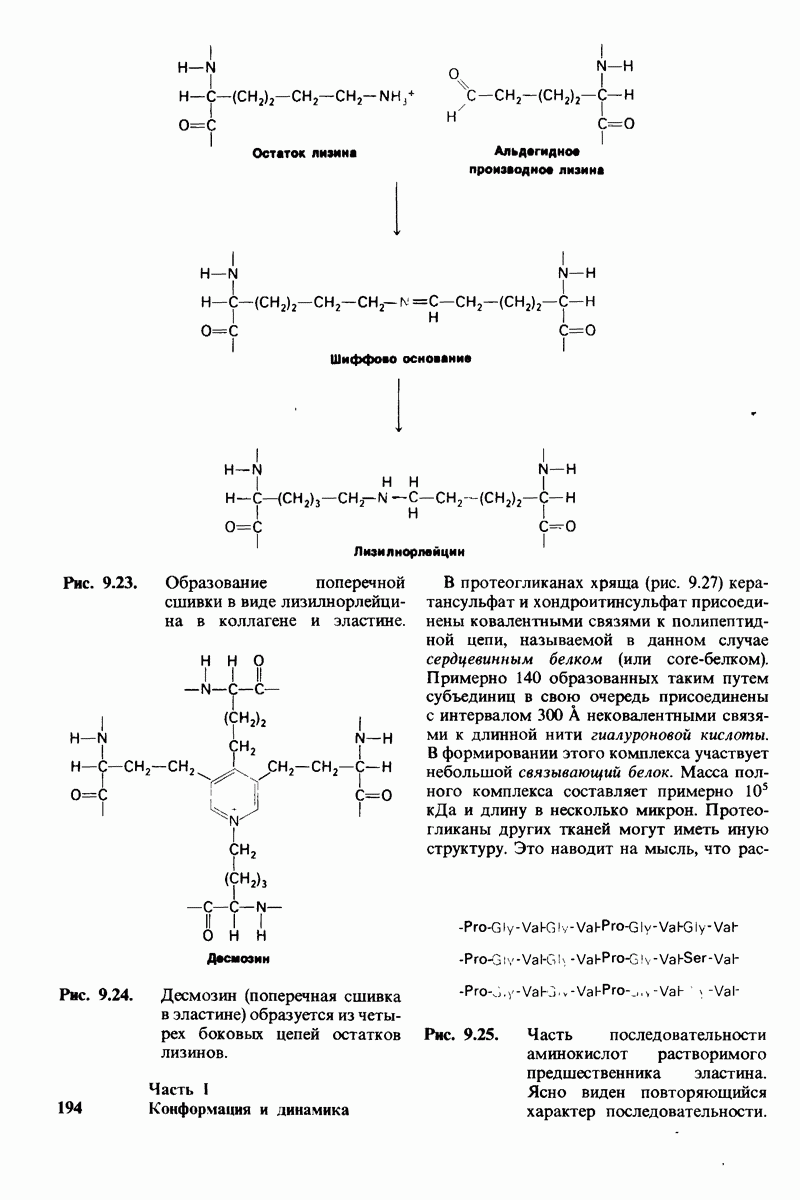
- 9.13. Поперечные связи повышают прочность коллагенового волокна
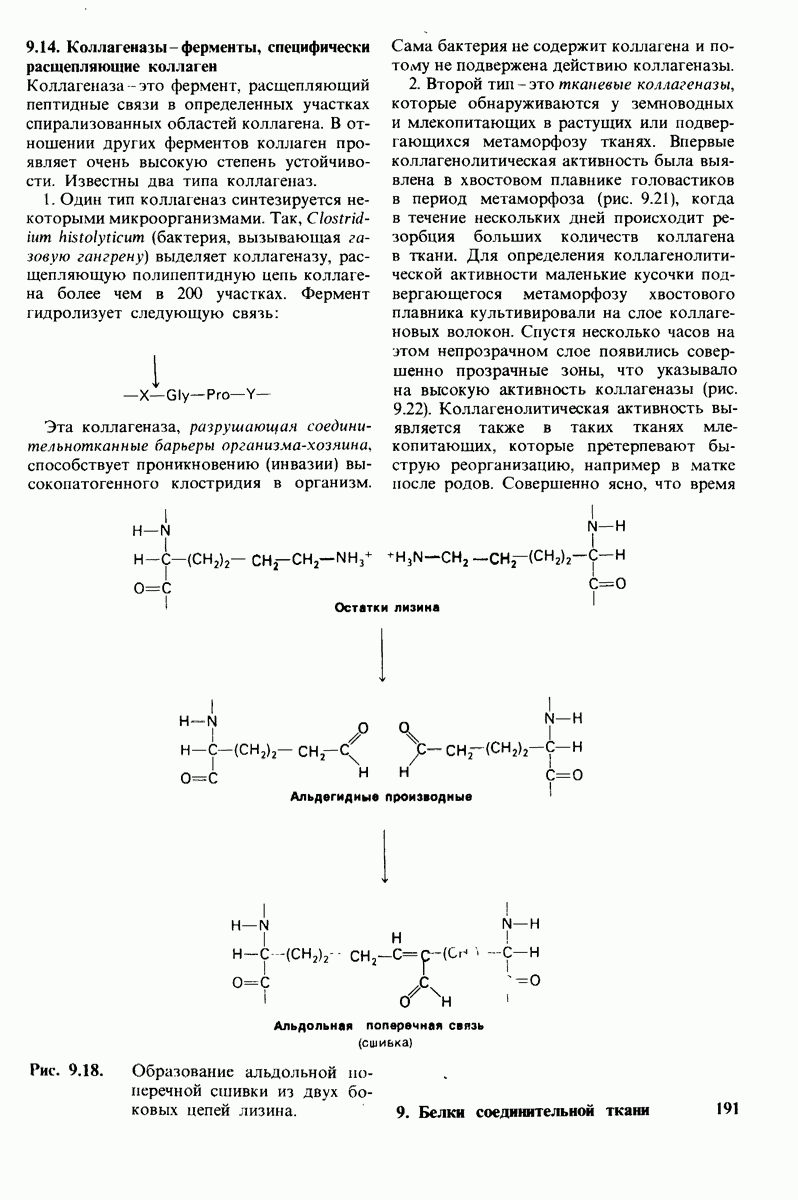
- 9.14. Коллагеназы-ферменты, специфически расщепляющие коллаген
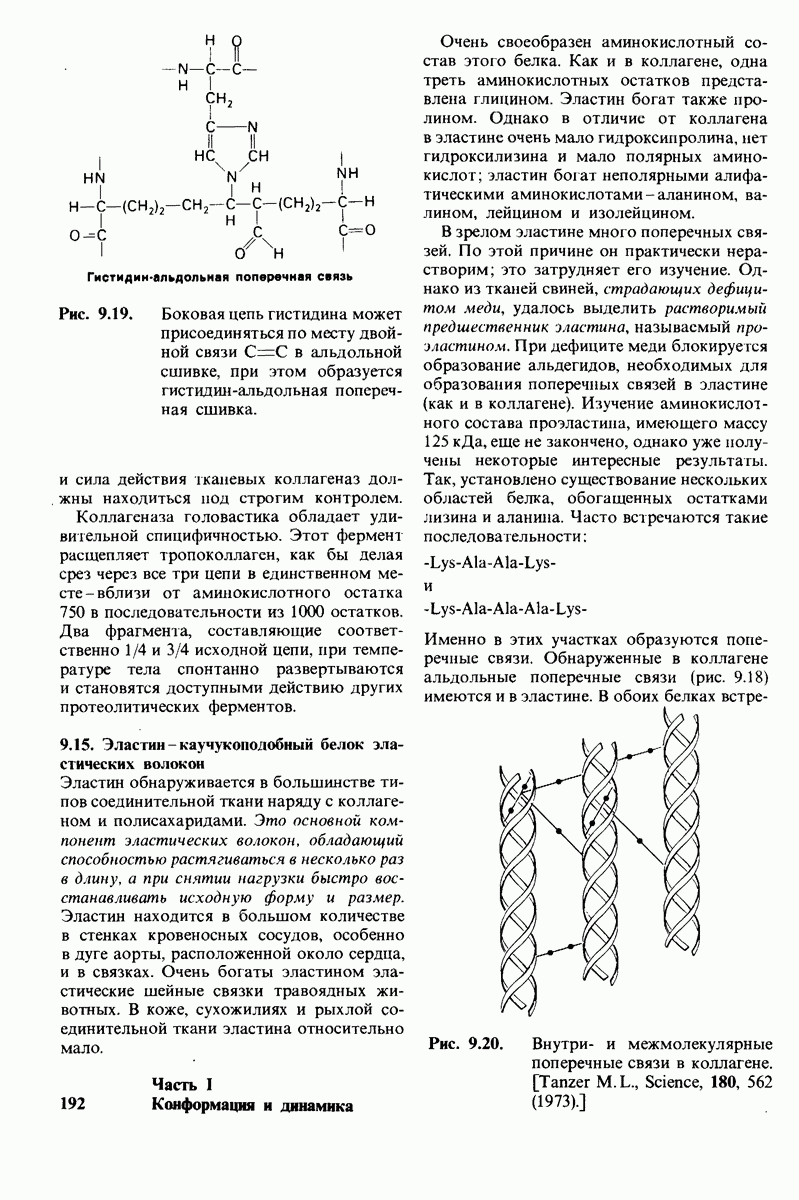
- 9.15. Эластин — каучукоподобный белок эластических волокон
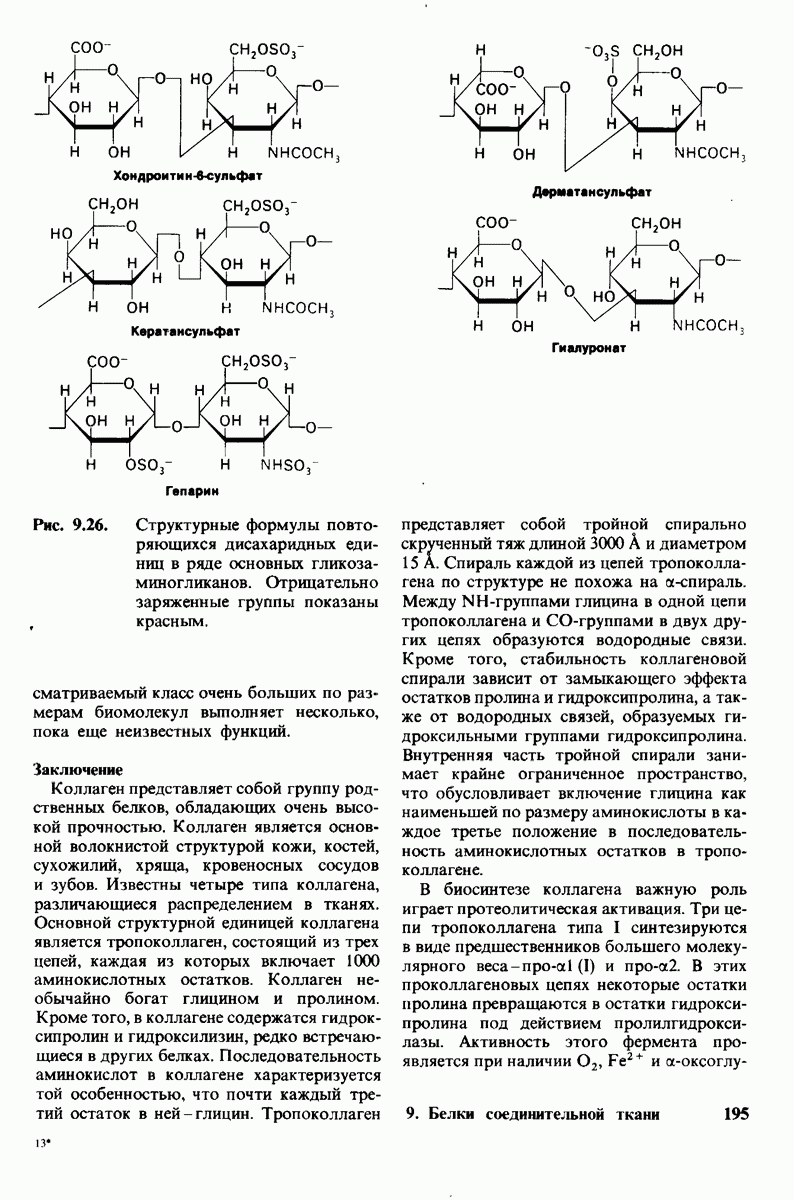
- 9.16. Протеогликаны образуют основное вещество соединительной ткани
- ГЛАВА 10. Введение в проблему биологических мембран
- 10.1. Общие свойства биологических мембран
- 10.2. Фосфолипиды — основной класс мембранных липидов
- 10.3. В большинстве мембран имеются также гликолипиды и холестерол
- 10.4. Фосфолипиды и глнколипиды легко образуют бислон
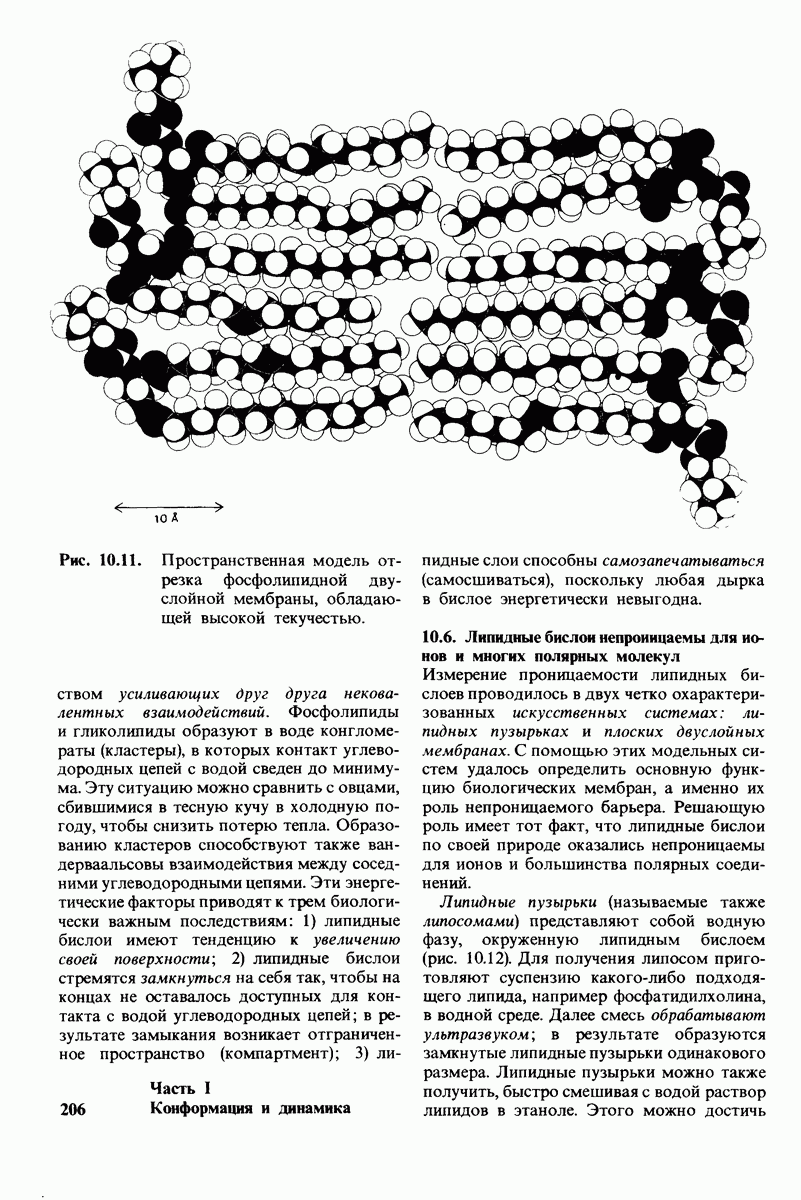
- 10.5. Липидные бислои — нековалентные кооперативные структуры
- 10.6. Липидные бислои непроницаемы для ионов и многих полярных молекул
- 10.7. Большинство мембранных процессов опосредовано белками
- 10.8. Реконструкция функционирующих мембранных систем из очищенных компонентов
- 10.9. Отдельные белки мембран глубоко погружены в липидный бислой
- 10.10. В мембране эритроцитов содержатся различные периферические и интегральные белки
- 10.11. Мембрану эритроцита пронизывают канал для анионов и сложный белок гликофорин
- 10.12. Углеводные единицы расположены на наружной стороне плазматической мембраны
- 10.13. Липиды и многие мембранные белки быстро диффундируют в плоскости мембраны
- 10.14. Мембранные белки не перемещаются поперек бислоев
- 10.15. Жидкостно-мозаичная модель биологических мембран
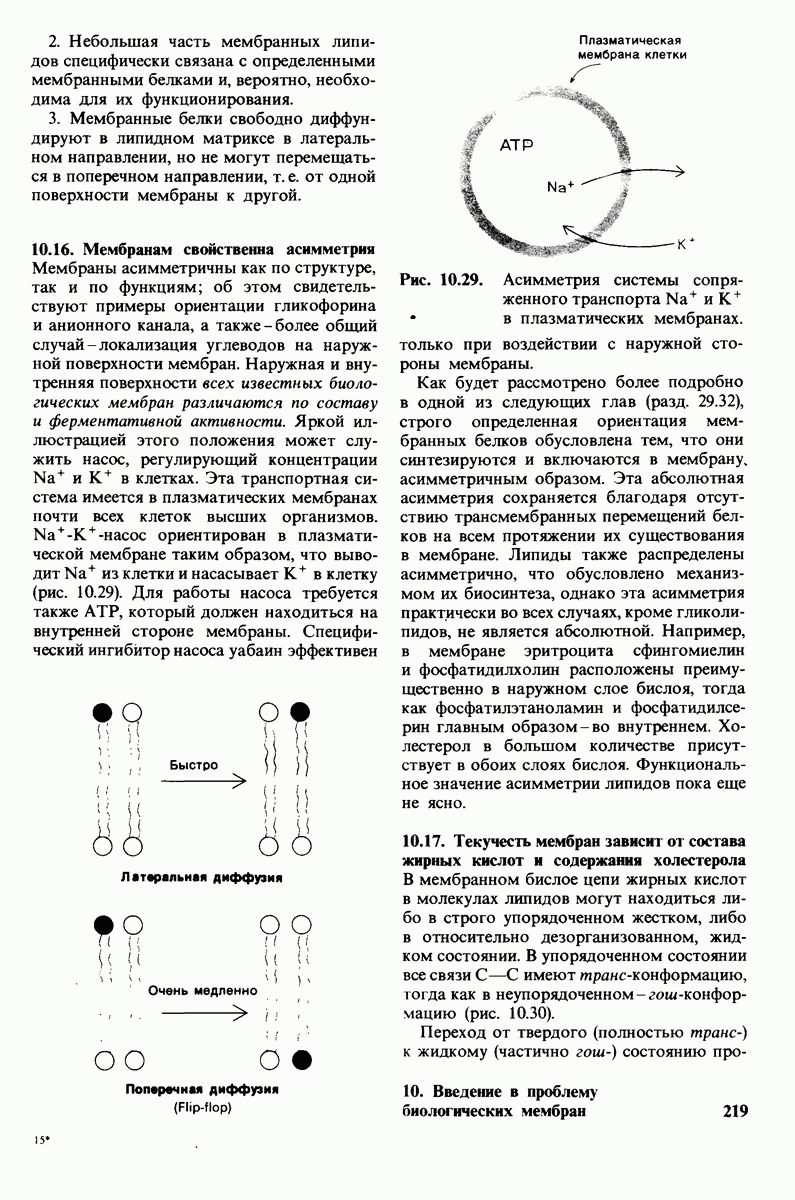
- 10.16. Мембранам свойственна асимметрия
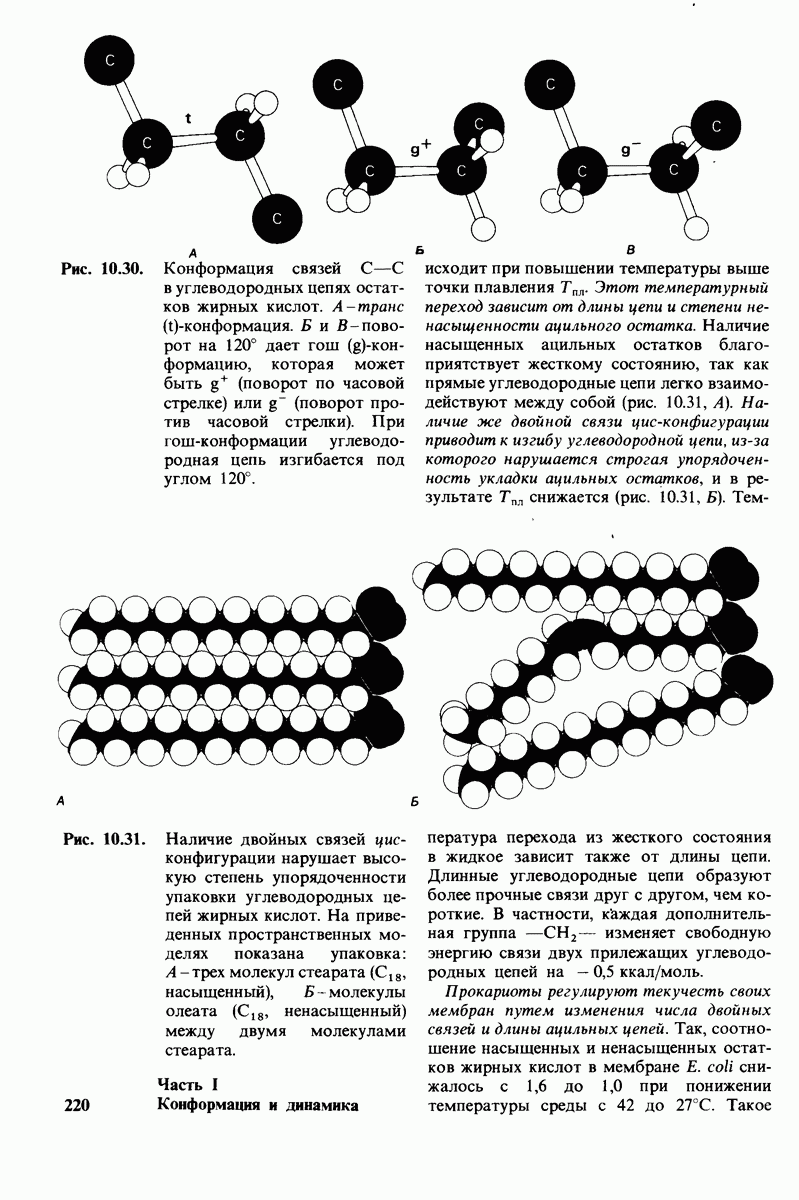
- 10.17. Текучесть мембран зависит от состава жирных кислот и содержания холестерола
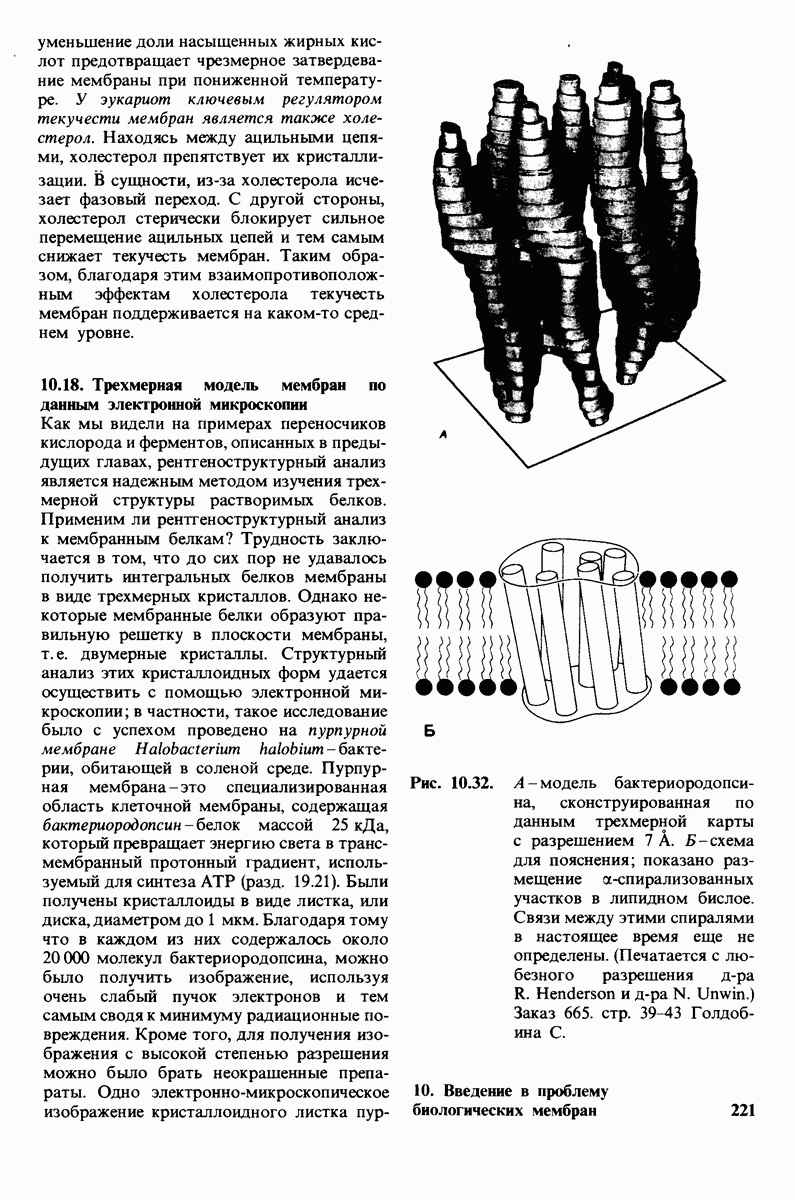
- 10.18. Трехмерная модель мембран по данным электронной микроскопии