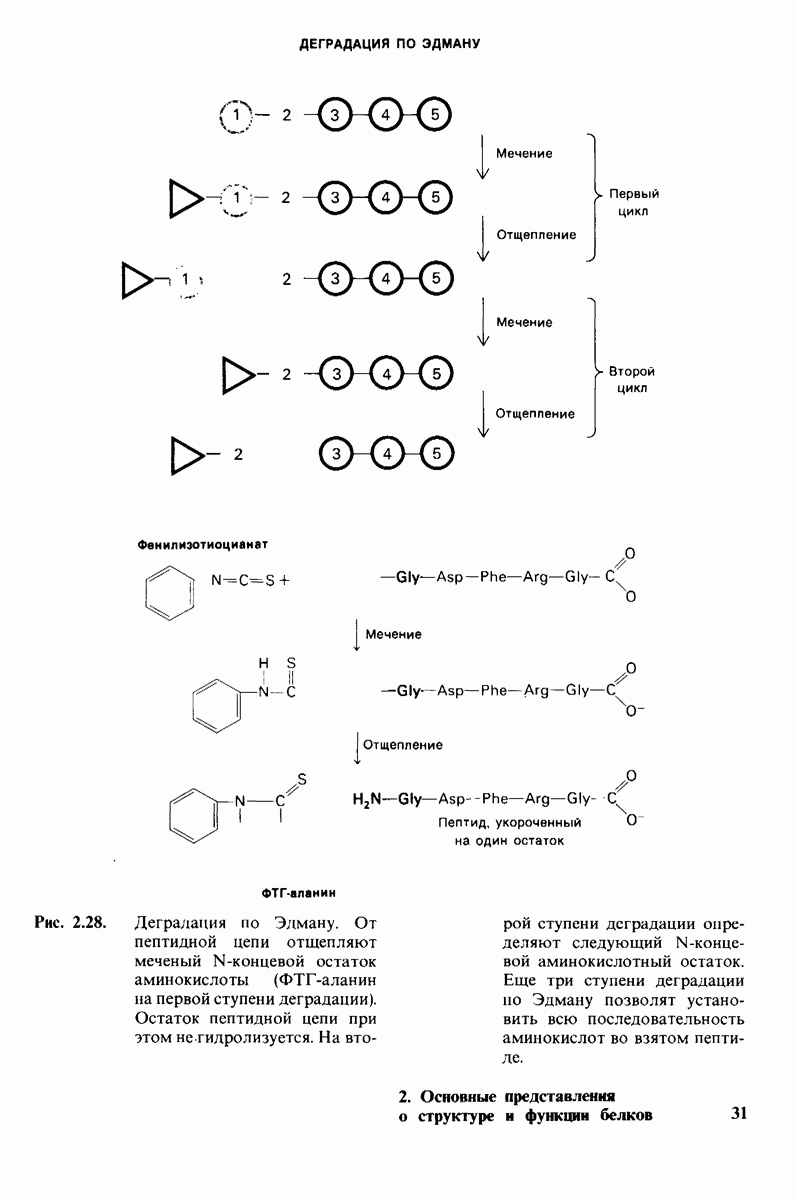
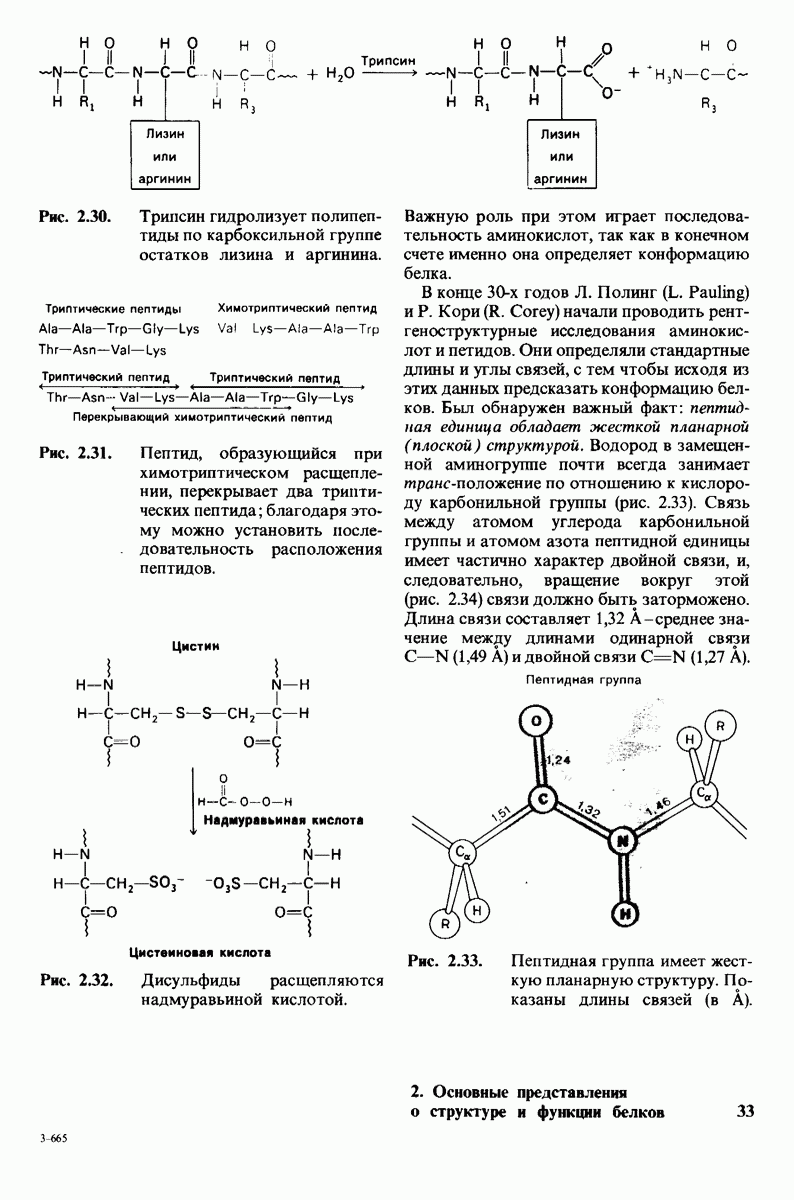
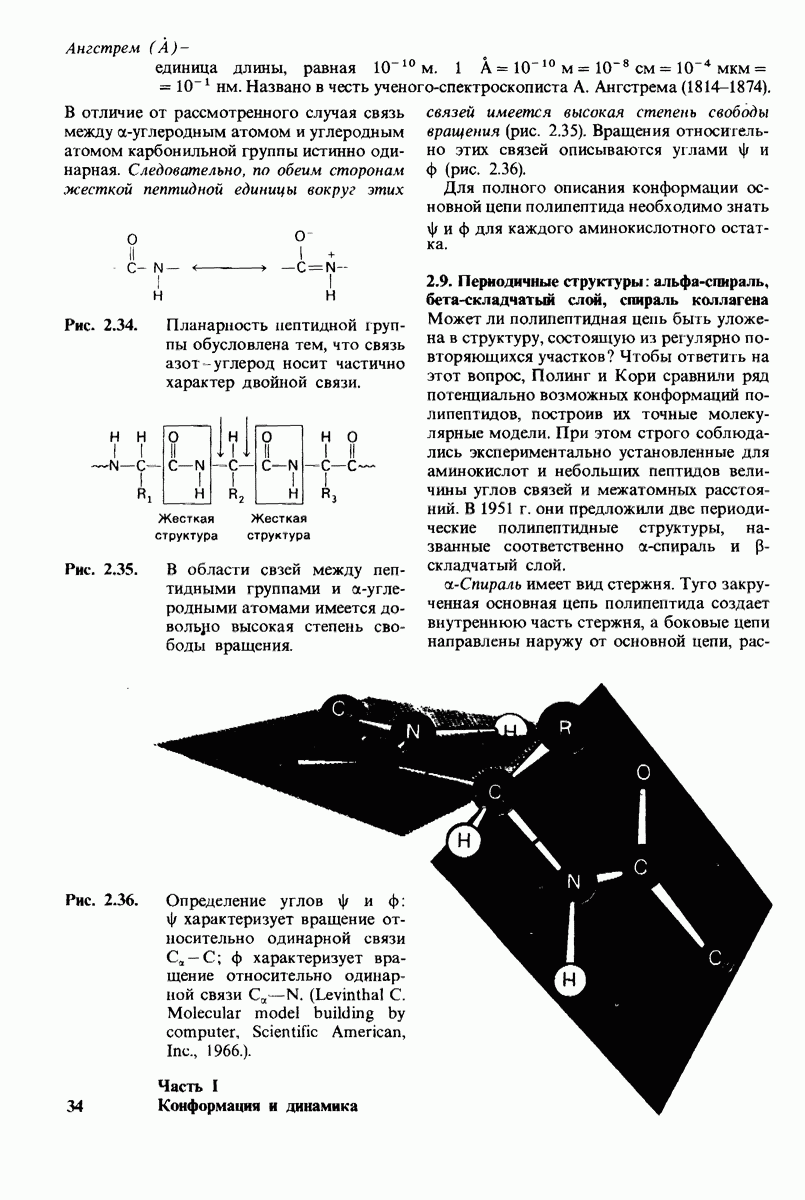
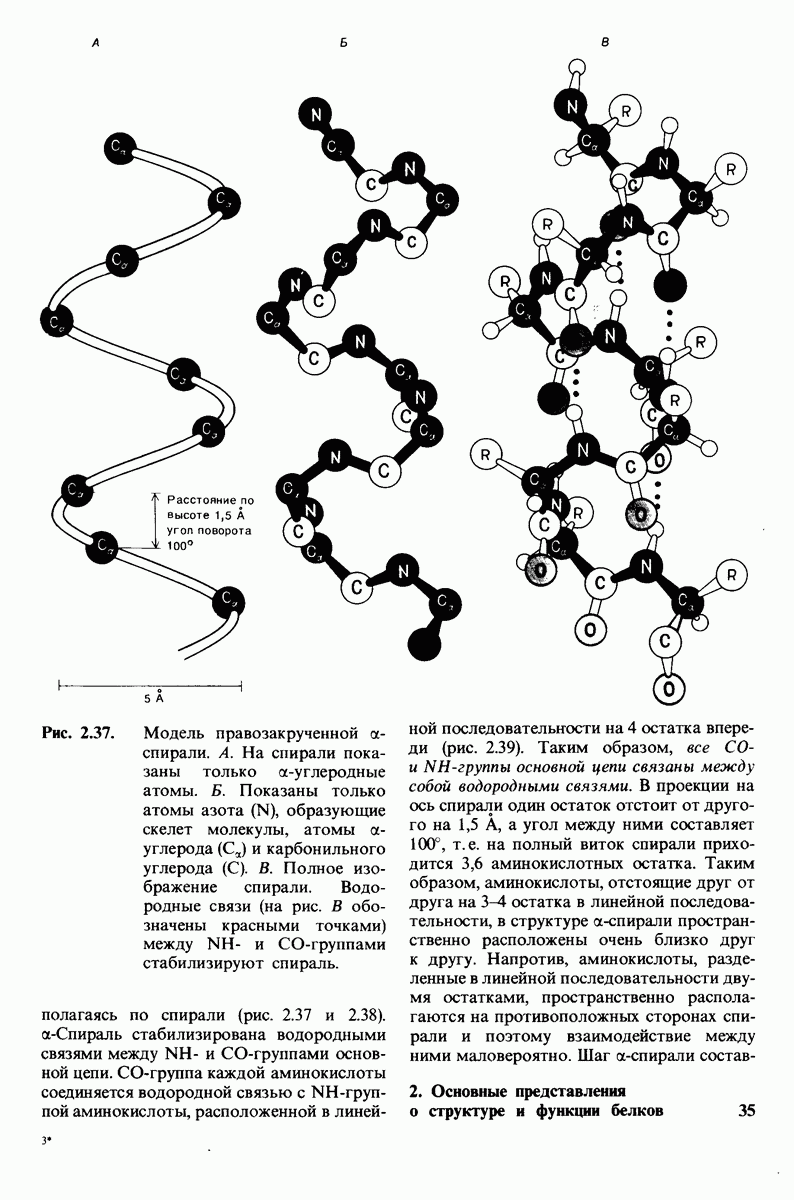
| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
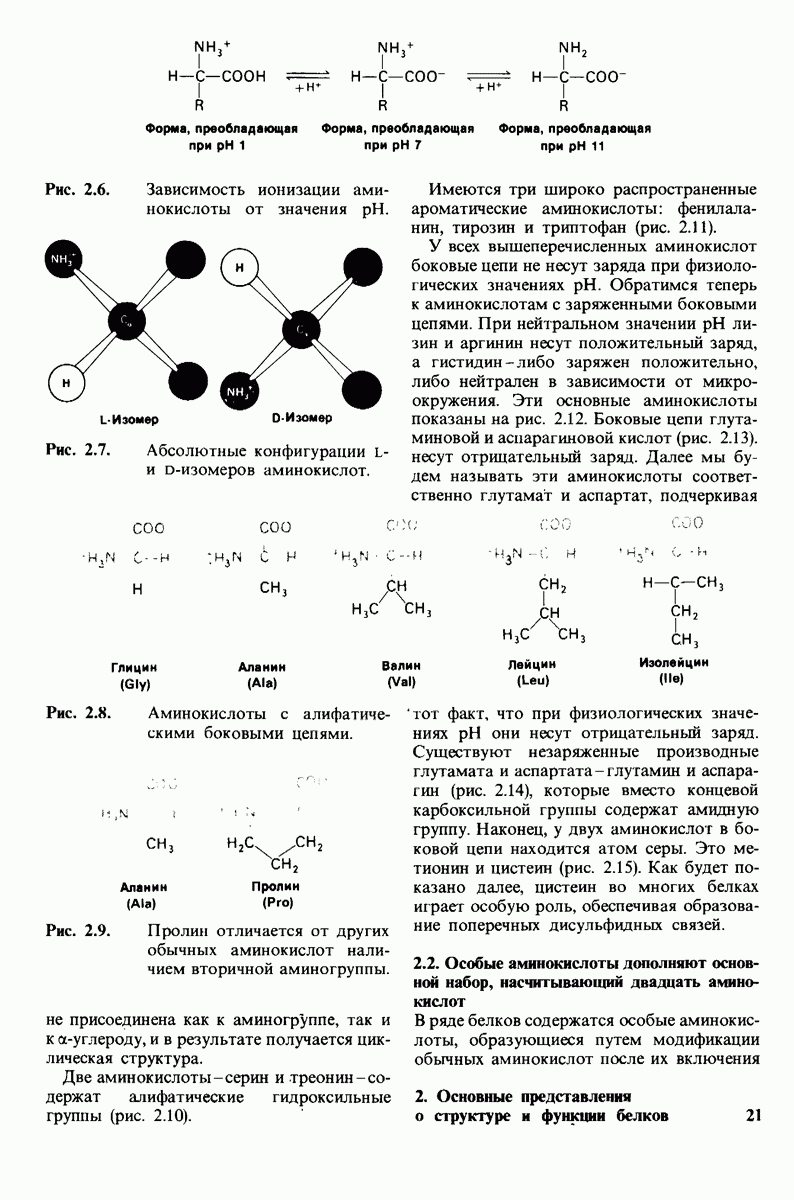
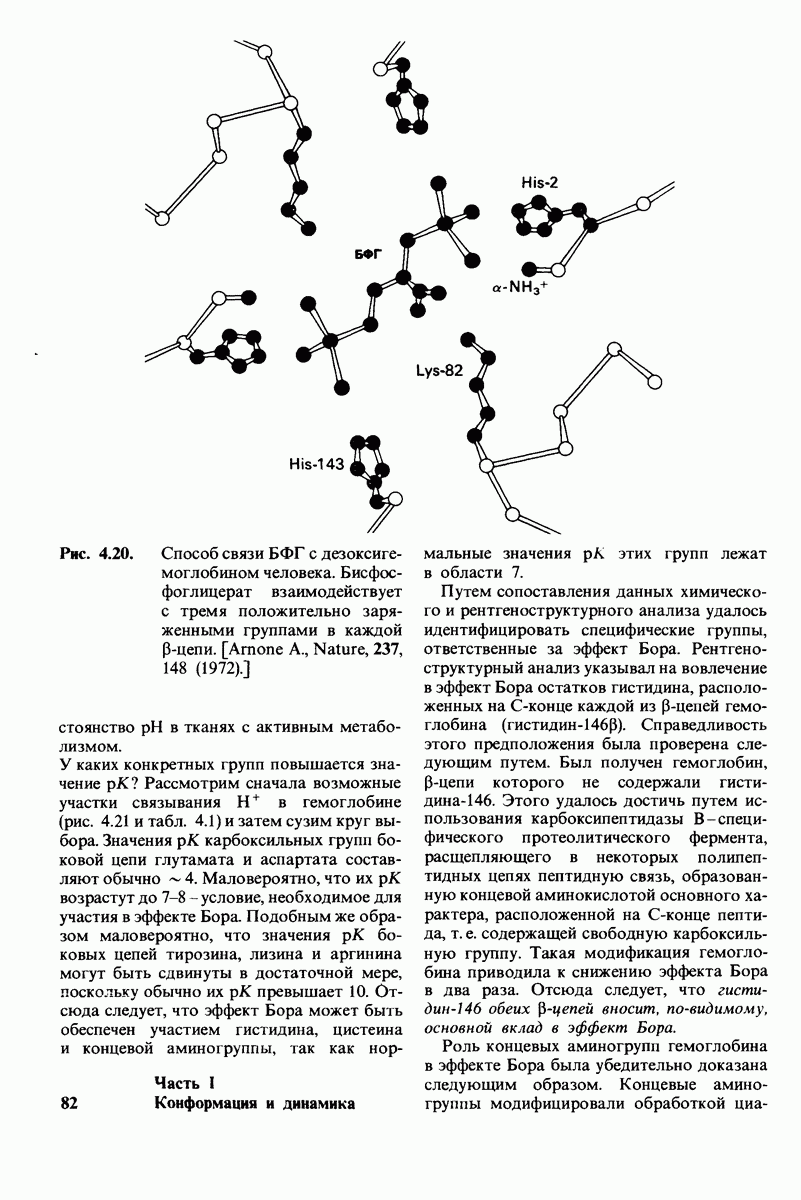
4.14. Бисфосфоглицерат снижает сродство к кислороду путем образования перекрестных связей с дезоксигемоглобнном
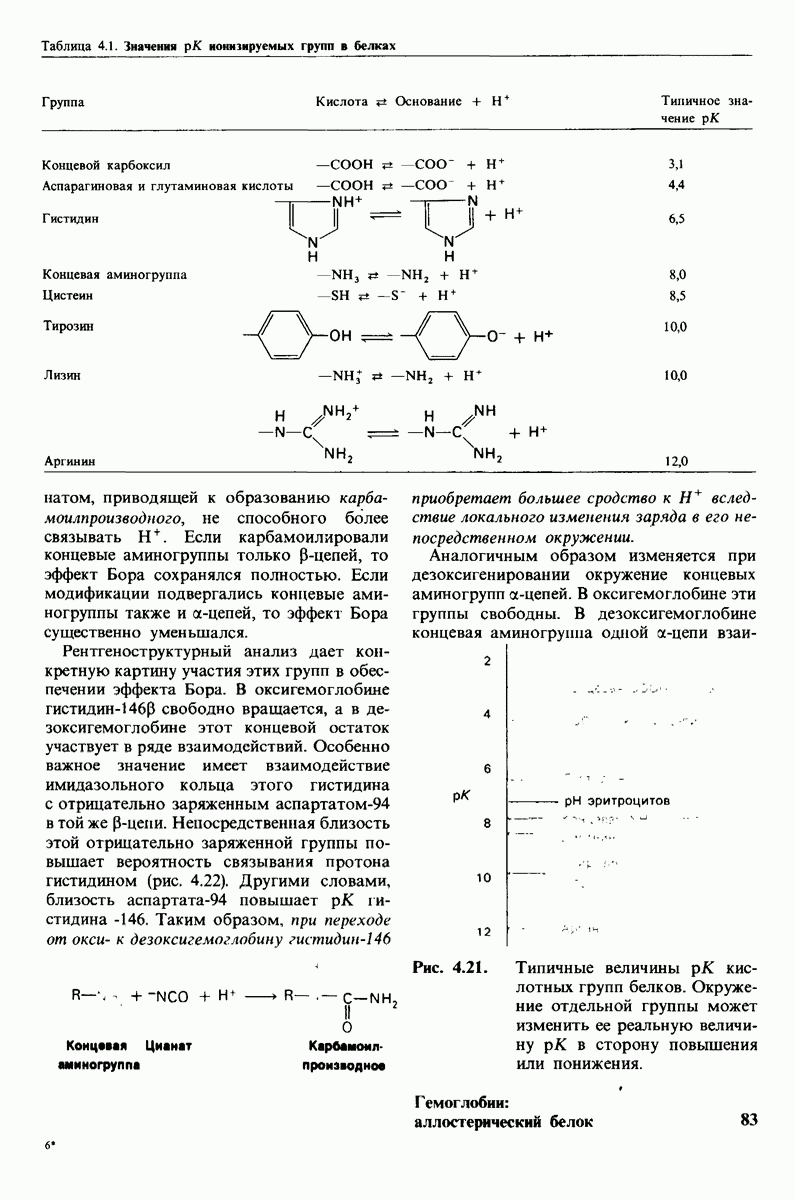
БФГ специфически связывается с дезоксигемоглобнном в соотношении  на 1 тетрамер гемоглобина. Это очень интересная стехиометрия. Казалось бы, белок, имеющий структуру
на 1 тетрамер гемоглобина. Это очень интересная стехиометрия. Казалось бы, белок, имеющий структуру  должен обладать по крайней мере двумя участками связывания какого бы то ни было небольшого соединения. Наличие только одного участка связывания тотчас же наводит на мысль, что БФГ связывается по оси симметрии молекулы гемоглобина в центральной полости, где
должен обладать по крайней мере двумя участками связывания какого бы то ни было небольшого соединения. Наличие только одного участка связывания тотчас же наводит на мысль, что БФГ связывается по оси симметрии молекулы гемоглобина в центральной полости, где

Рис. 4.18. Свободная энергия связи последовательных молекул  (ср. с моделью, описанной на рис. 4.17). Сродство связывания
(ср. с моделью, описанной на рис. 4.17). Сродство связывания  возрастает, так как для присоединения четвертой молекулы
возрастает, так как для присоединения четвертой молекулы  нужно разорвать меньше перекрестных связей, чем для присоединения первой.
нужно разорвать меньше перекрестных связей, чем для присоединения первой.
сходятся 4 субъединицы (рис. 4.19). Участок связывания БФГ образован положительно заряженными остатками, принадлежащими обеим  -цепям, а именно:
-цепям, а именно:  -аминогруппой, лизином
-аминогруппой, лизином  и гистидином
и гистидином  Очевидно, что эти группы легко взаимодействуют с отрицательно заряженным
Очевидно, что эти группы легко взаимодействуют с отрицательно заряженным  имеющим при физиологическом значении рН почти 4 отрицательных заряда. Стереохимически БФГ комплементарен констелляции из 6 положительно заряженных групп
имеющим при физиологическом значении рН почти 4 отрицательных заряда. Стереохимически БФГ комплементарен констелляции из 6 положительно заряженных групп  -цепей, обращенных к внутренней полости молекулы гемоглобина (рис. 4.20). Более слабое связывание БФГ гемоглобином плода по сравнению с гемоглобином А объясняется тем, что у гемоглобина плода в положении
-цепей, обращенных к внутренней полости молекулы гемоглобина (рис. 4.20). Более слабое связывание БФГ гемоглобином плода по сравнению с гемоглобином А объясняется тем, что у гемоглобина плода в положении  находится серин, а не гистидин.
находится серин, а не гистидин.
При оксигенировании БФГ отщепляется, поскольку центральная полость становится слишком мала. В частности, сужается промежуток между  -спиралями
-спиралями  -цепей. Кроме того, расстояние между
-цепей. Кроме того, расстояние между  -аминогруппами возрастает с 16 до 20 А, вследствие чего исчезает контакт между ними и фосфатными группами БФГ.
-аминогруппами возрастает с 16 до 20 А, вследствие чего исчезает контакт между ними и фосфатными группами БФГ.
Теперь нам понятно, почему БФГ снижает сродство к кислороду. Образуя перекрестные связи с  -цепями, БФГ стабилизирует четвертичную структуру дезоксигемоглобина. Другими словами, БФГ сдвигает равновесие в сторону
-цепями, БФГ стабилизирует четвертичную структуру дезоксигемоглобина. Другими словами, БФГ сдвигает равновесие в сторону  -формы. Как уже упоминалось, в дезоксигемоглобине имеется 8 солевых связей, заякоривающих его концевые карбоксильные остатки. Для того чтобы произошло оксигенирование, эти солевые связи необходимо разорвать. Присоединение БФГ создает дополнительные солевые связи, которые должны быть разорваны. В итоге сродство гемоглобина к кислороду при присоединении БФГ оказывается сниженным.
-формы. Как уже упоминалось, в дезоксигемоглобине имеется 8 солевых связей, заякоривающих его концевые карбоксильные остатки. Для того чтобы произошло оксигенирование, эти солевые связи необходимо разорвать. Присоединение БФГ создает дополнительные солевые связи, которые должны быть разорваны. В итоге сродство гемоглобина к кислороду при присоединении БФГ оказывается сниженным.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- Предисловие редактора перевода
- ГЛАВА 1. Молекулы и жизнь
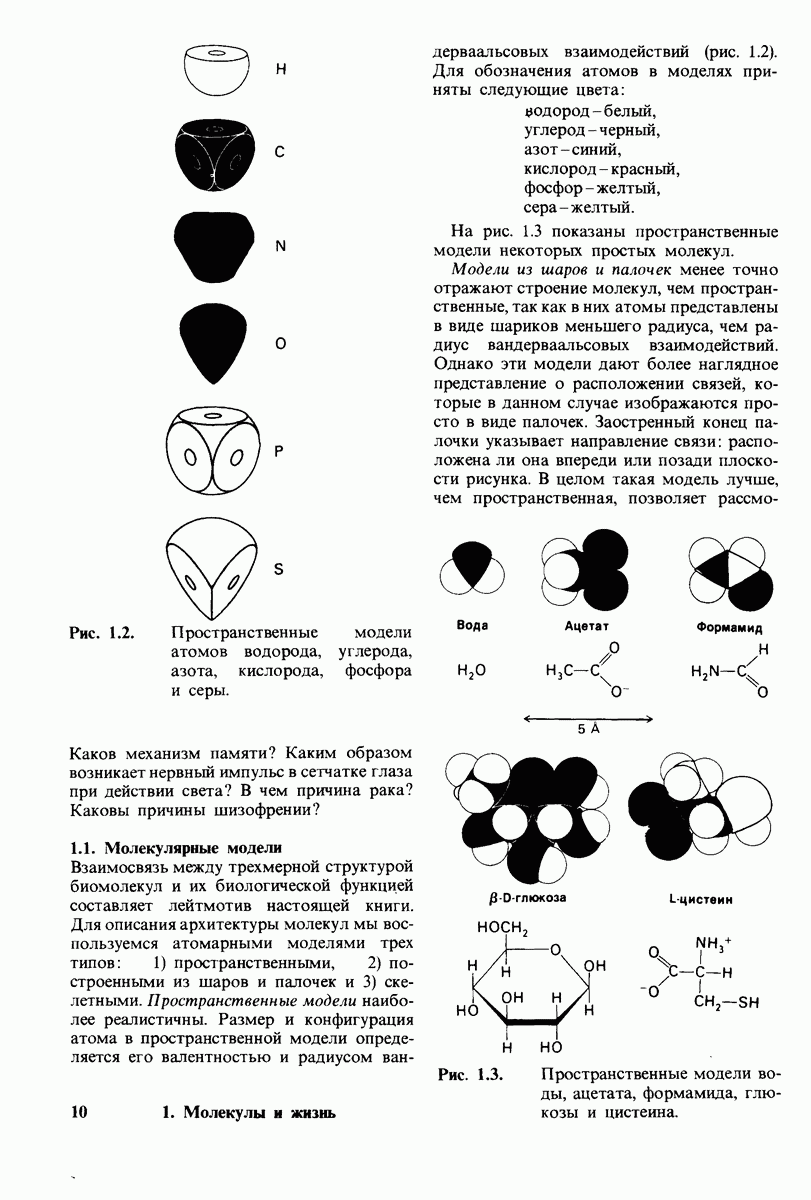
- 1.1. Молекулярные модели
- 1.2. Пространство, время и энергия
- 1.3. Структура данной книги
- Часть I. Конформация и динамика
- ГЛАВА 2. Основные представления о структуре и функции белков
- 2.1. Белки построены из аминокислот
- 2.2. Особые аминокислоты дополняют основной набор, насчитывающий двадцать аминокислот
- 2.3. Аминокислоты, соединяясь пептидной связью, образуют полипептидные цепи
- 2.4. Белки состоят из одной или нескольких полипептндных цепей
- 2.5. Для очистки белков можно использовать множество различных методов
- 2.6 Последовательность аминокислот в белках уникальна и детерминируется генами
- 2.7. Экспериментальные методы определения последовательности аминокислот
- 2.8. Конформация полипептидных цепей
- 2.9. Периодичные структуры: альфа-спираль, бета-складчатый слой, спираль коллагена
- 2.10. Полипептидная цепь может поворачиваться на 180° благодаря образованию бетта-изгибов
- 2.11. Структурные уровни в архитектуре белков
- 2.12. Последовательность аминокислот определяет трехмерную структуру
- 2.13. Формирование свернутой молекулы белков происходит путем ассоциации альфа-спиралей и складчатых бетта-слоев
- Заключение
- ПРИЛОЖЕНИЕ. Понятия кислотности и основности
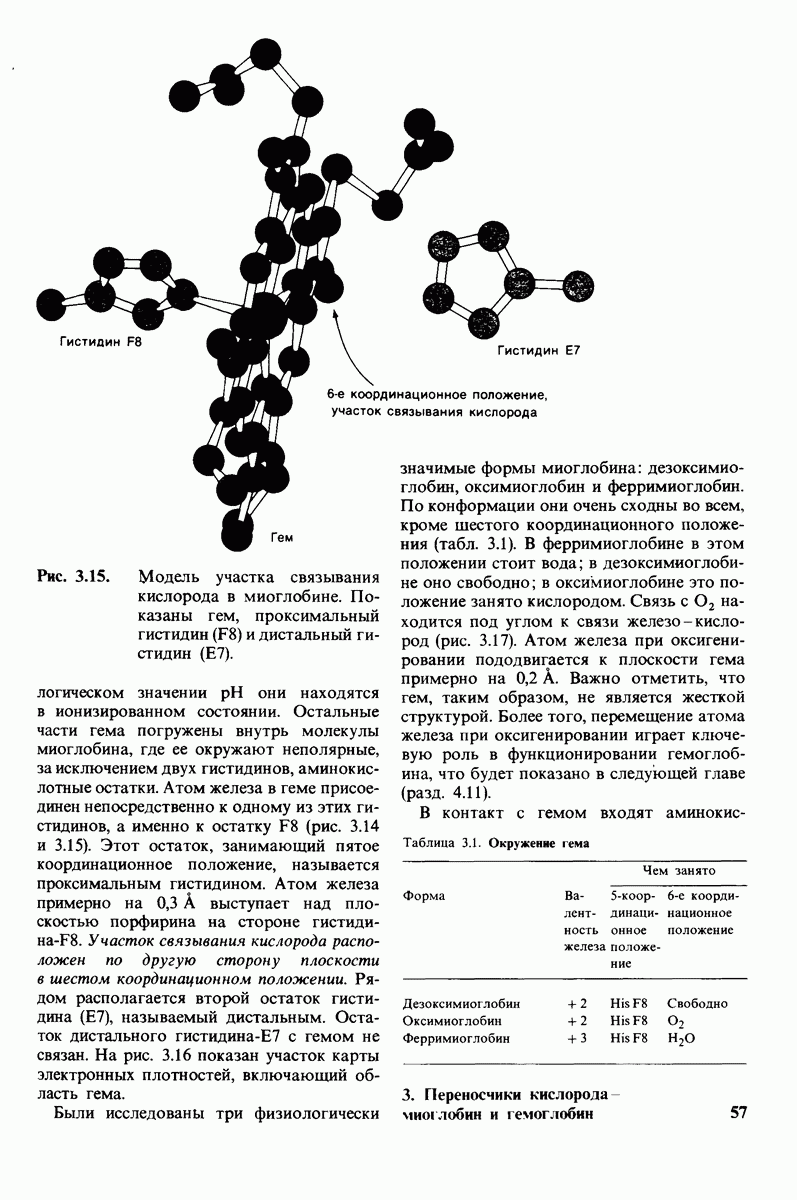
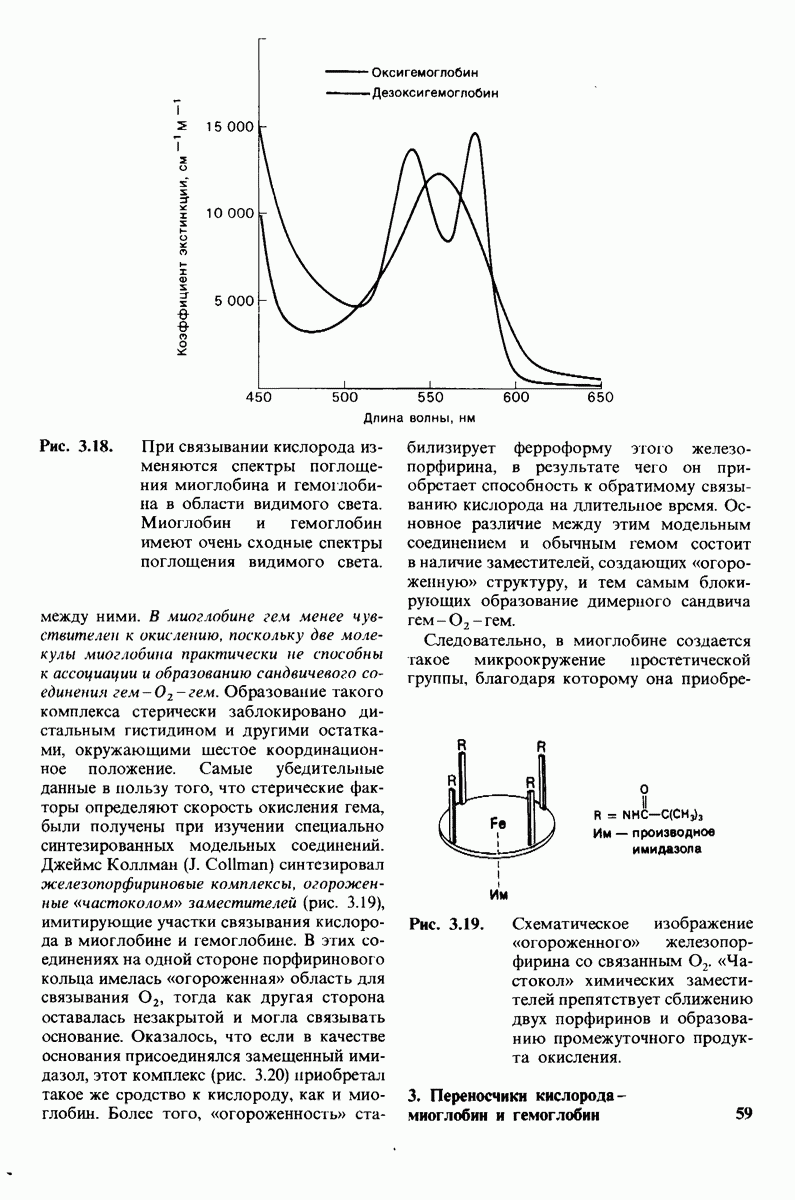
- ГЛАВА 3. Переносчики киспорода — миоглобин и гемоглобин
- 3.1. Кислород присоединяется к простетической группе гема
- 3.2. Рентгеноструктурный анализ кристаллов выявляет пространственное расположение атомов
- 3.3. Этапы рентгеноструктурного анализа миоглобина
- 3.4. Структура миоглобина характеризуется компактностью и высокой степенью альфа-спирализованности
- 3.5. Участок связывания кислорода в миоглобине
- 3.6. Жесткое окружение гема обеспечивает обратимость оксигенирования
- 3.7. Присутствие дистального гистидина снижает связывание оксида углерода
- 3.8. В растворенном виде и в кристаллическом состоянии миоглобин имеет практически одинаковую структуру
- 3.9. Неполярные взаимодействия играют важную роль в стабилизировании конформации миоглобина
- 3.10. Развернутая молекула миоглобина спонтанно принимает функционально активную конфигурацию
- 3.11. Гемоглобин состоит из четырех полипептидных цепей
- 3.12. Рентгеноструктурный анализ гемоглобина
- 3.13. Четвертичная структура гемоглобина
- 3.14. а- и b-Цепи гемоглобина очень сходны с миоглобином
- 3.15. Критически необходимые остатки в последовательности аминокислот
- 3.16. Возникновение гемоглобина — новый этап в эволюции
- ГЛАВА 4. Гемоглобин: аллостерический белок
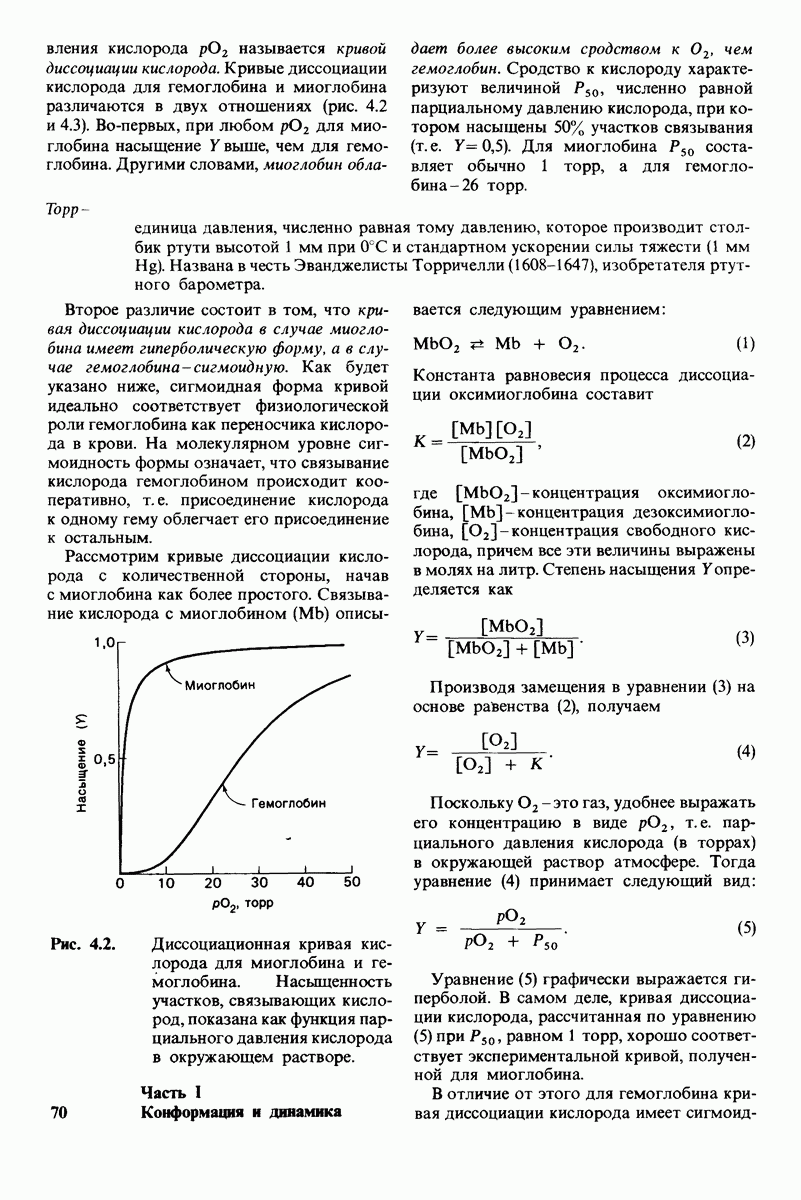
- 4.1. Функциональные различия между миоглобином и гемоглобином
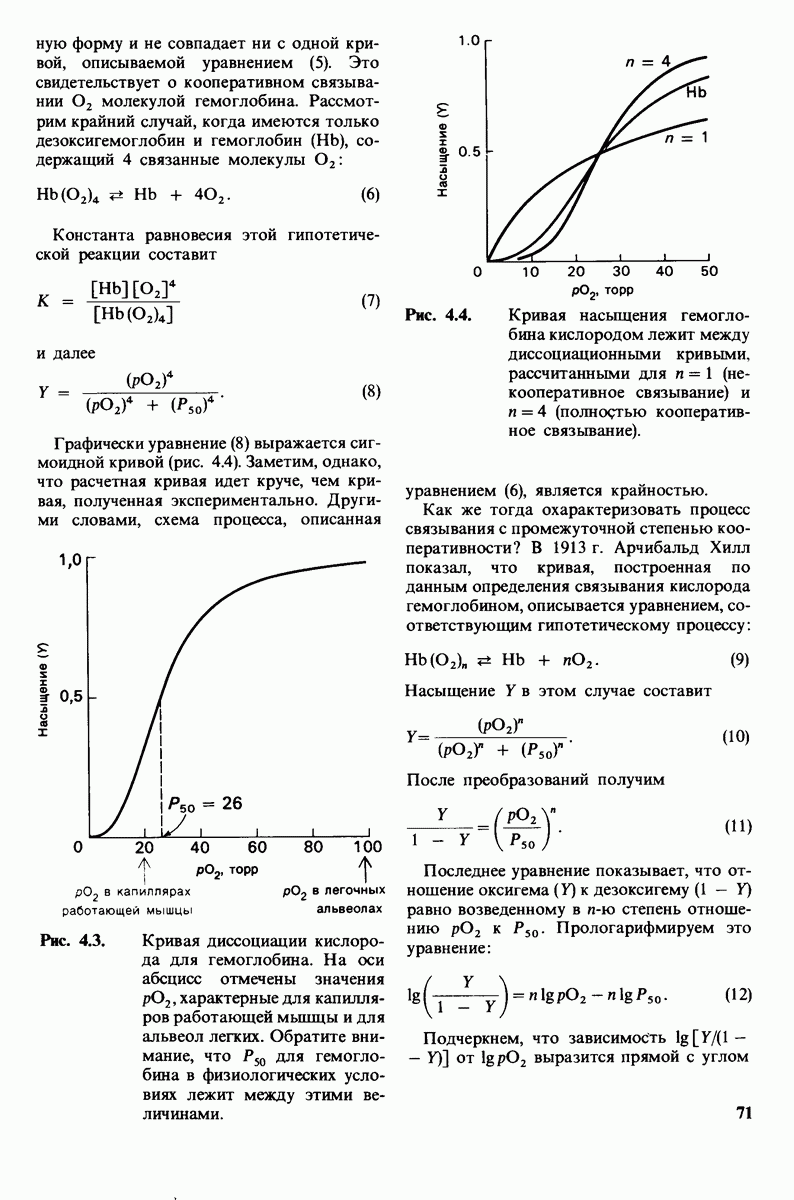
- 4.2. Кооперативность связывания кислорода гемоглобином
- 4.3. Кооперативное связывание кислорода гемоглобином увеличивает транспорт кислорода
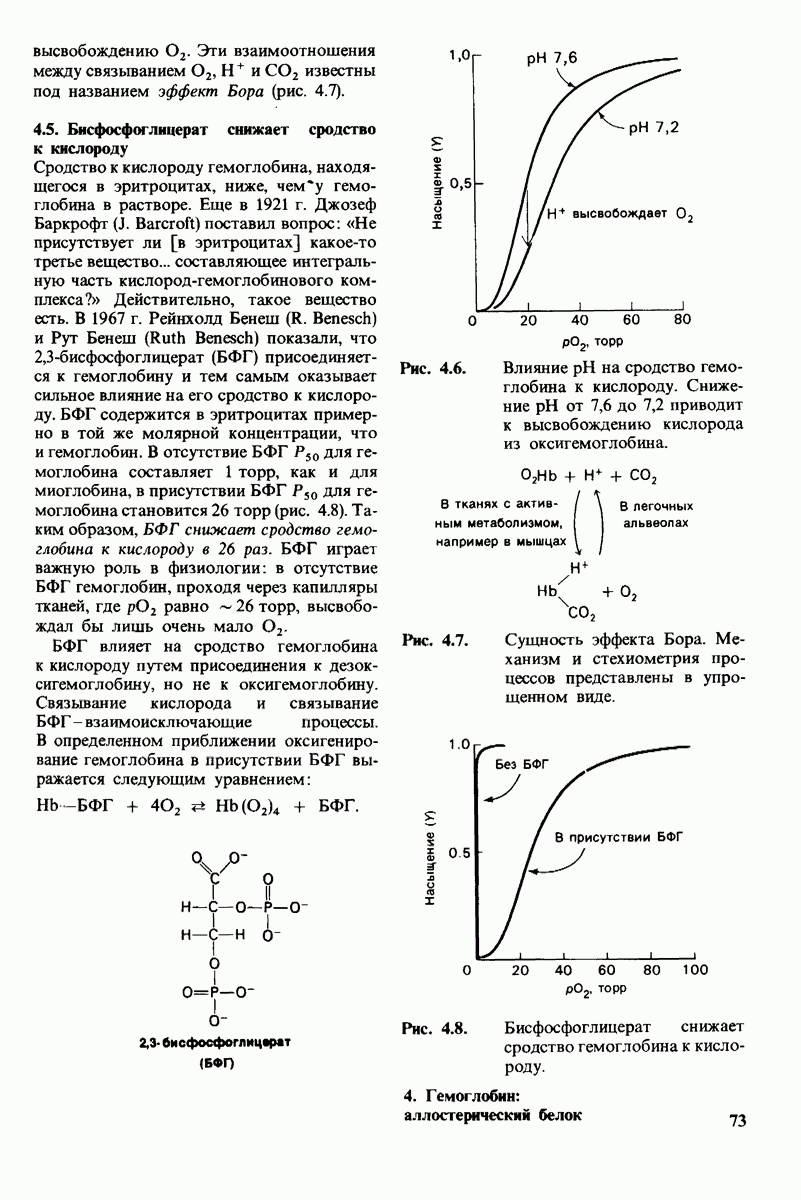
- 4.4. H+ и CO2 способствуют высвобождению O2 (эффект Бора)
- 4.5. Бисфосфоглицерат снижает сродство к кислороду
- 4.6. Клиническое значение биофосфо-глицерата
- 4.7. Гемоглобин плода характеризуется высоким сродством к кислороду
- 4.8. Для проявления аллостерического эффекта необходимо взаимодействие субъединиц
- 4.9. Четвертичная структура гемоглобина значительно изменяется при оксигенировании
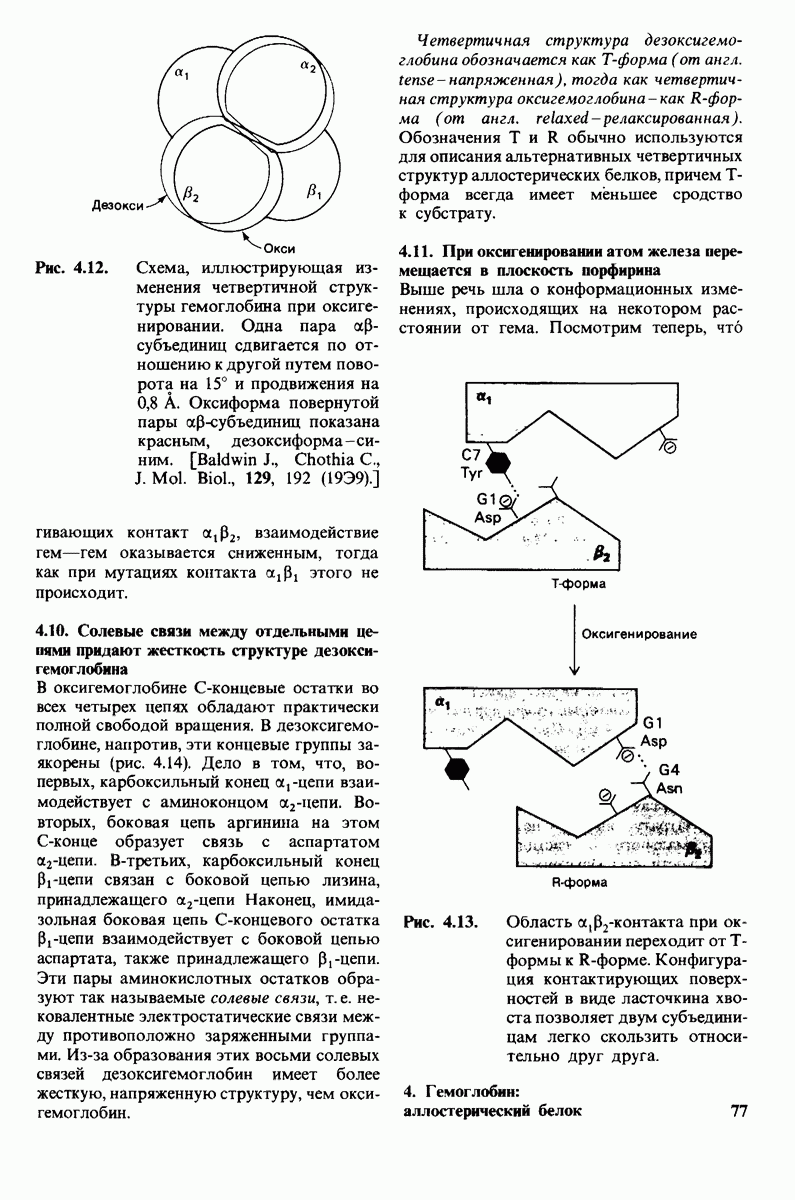
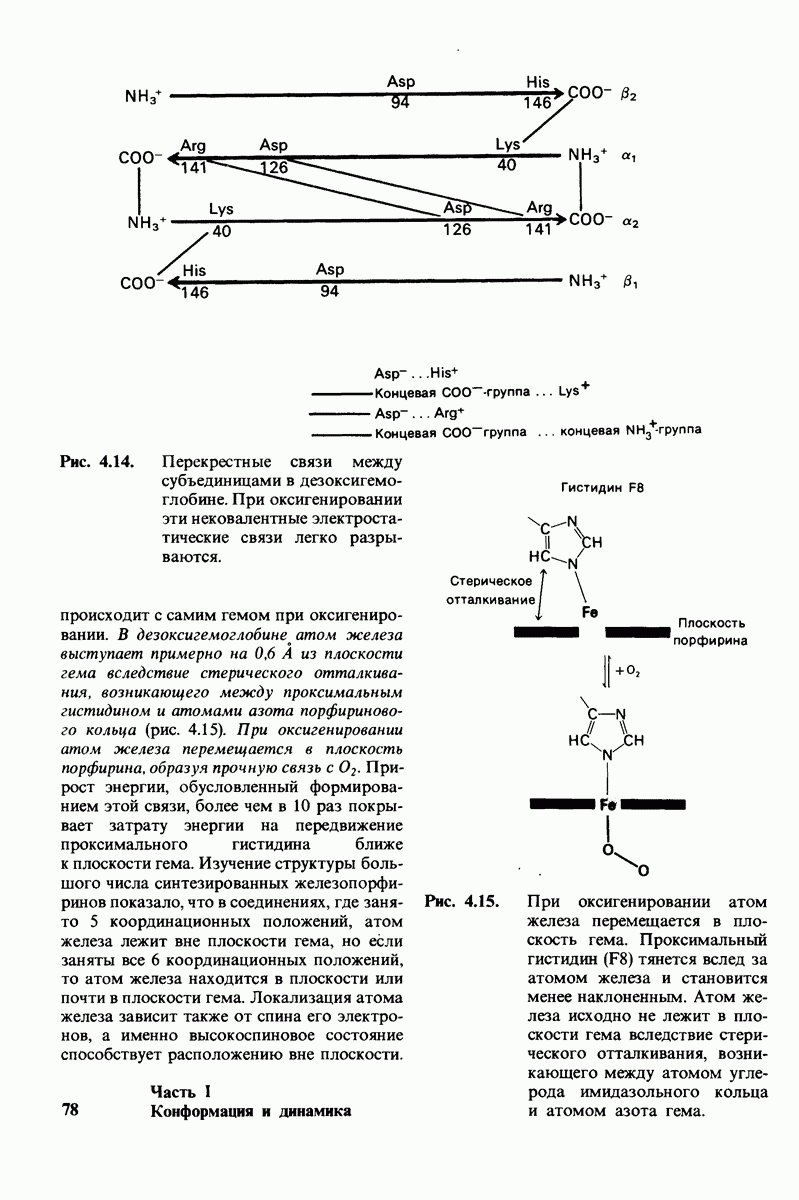
- 4.10. Солевые связи между отдельными цепями придают жесткость структуре дезоксигемоглобина
- 4.11. При оксигенировании атом железа перемещается в плоскость порфирина
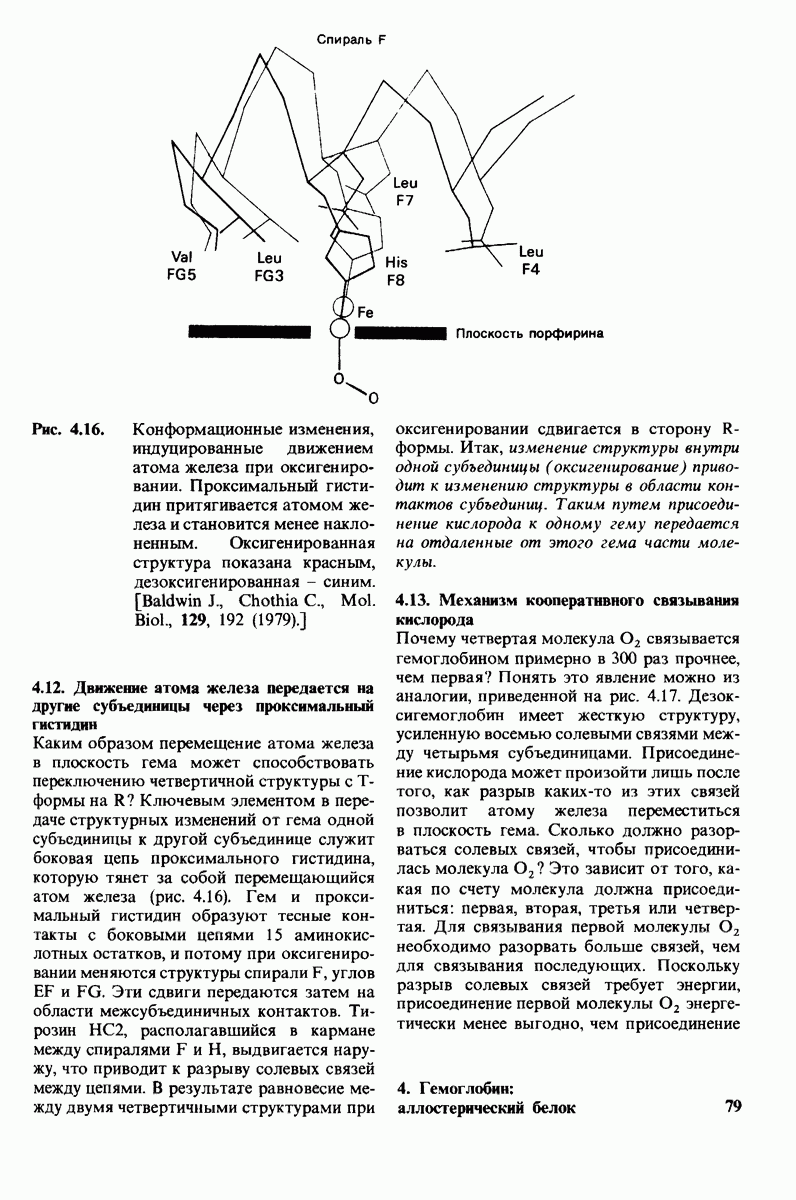
- 4.12. Движение атома железа передается на другие субъединицы через проксимальный гистидин
- 4.13. Механизм кооперативного связывания кислорода
- 4.14. Бисфосфоглицерат снижает сродство к кислороду путем образования перекрестных связей с дезоксигемоглобнном
- 4.15. CO2 присоединяется к концевым аминогруппам гемоглобина, снижая его сродство к кислороду
- 4.16. Механизм эффекта Бора
- 4.17. Коммуникация внутри белковой молекулы
- ГЛАВА 5. Молекулярные болезни: серповидноклеточная анемия
- 5.1. Серповидиоклеточная анемия — хроническая гемолитическая болезнь, передающаяся по наследству
- 5.2. Дезокснгенированный серповидноклеточный гемоглобин имеет пониженную растворимость
- 5.3. Гемоглобин S отличается от гемоглобина A по электрофоретической подвижности
- 5.4. Получение пептидных карт: выявление аминокислотной замены в гемоглобине серповидных клеток
- 5.5. В бетта-цепи произошла замена одной-единственной аминокислоты
- 5.6. На поверхности гемоглобина серповидных клеток имеются «липкие» участки
- 5.7. Дезоксигемоглобин S образует длинные спирализованные волокна
- 5.8. Скорость образования волокон в высокой степени зависит от концентрации дезоксигемоглобина S
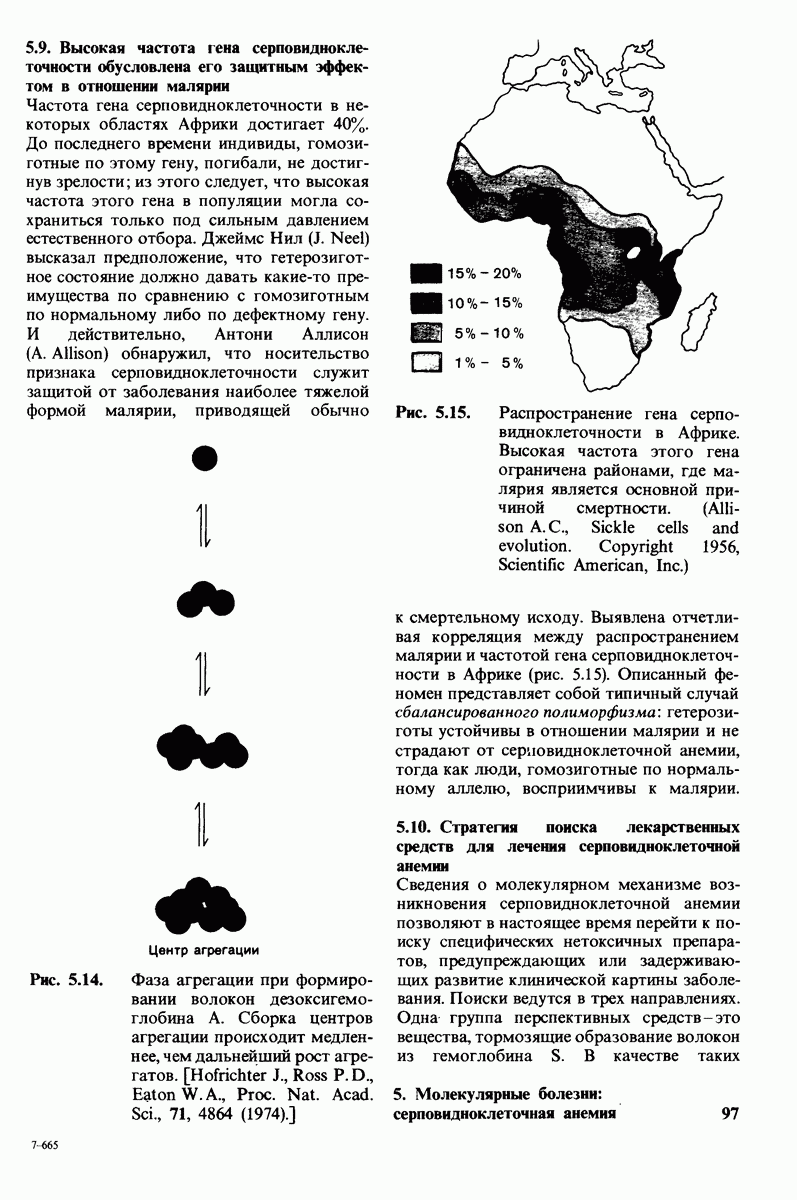
- 5.9. Высокая частота гена серповидноклеточностн обусловлена его защитным эффектом в отношении малярии
- 5.10. Стратегия поиска лекарственных средств для лечения серповидноклеточной анемии
- 5.11. Молекулярная патология гемоглобина
- 5.12. Гемоглобин М: продукт мутации в активном центре
- 5.13. Полярные группы в щели, занимаемой гемом, ослабляют его связывание с полипептидной цепью
- 5.14. В результате некоторых мутаций гемоглобины утрачивают стабильность из-за деформаций третичной структуры
- 5.15. Мутации в области контактов нарушают аллостерические взаимодействия
- 5.16. Значение открытия мутантных гемоглобннов
- ГЛАВА 6. Введение в энзимологию
- 6.2. Ферменты обладают высокой специфичностью
- 6.3. Активность некоторых ферментов регулируется
- 6.4. Ферменты осуществляют трансформацию различных видов энергии
- 6.5. Ферменты не сдвигают равновесия реакции
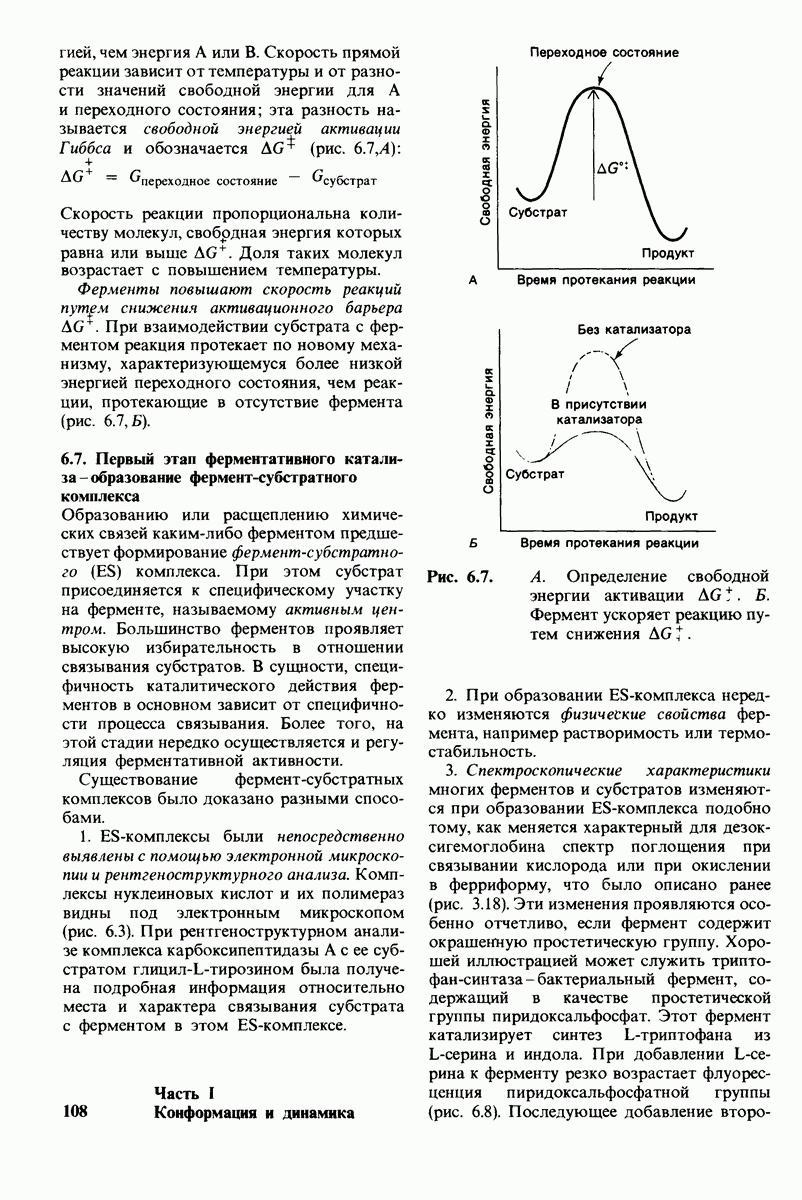
- 6.6. Ферменты снижают энергию активации катализируемых ими реакций
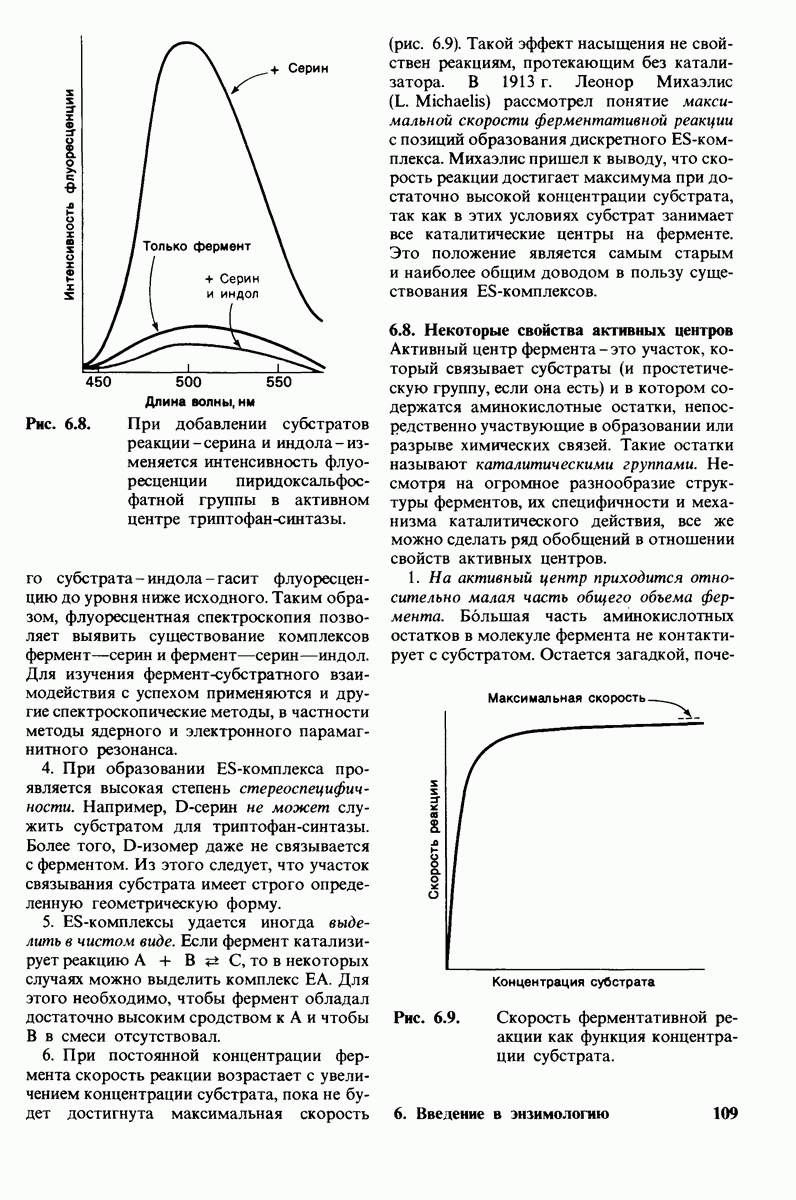
- 6.7. Первый этап ферментативного катализа — образование фермент-субстратного комплекса
- 6.8. Некоторые свойства активных центров
- 6.9. Кинетика многих ферментов описывается моделью Михаэлиса — Ментен
- 6.10. … можно определить, используя различные концентрации субстрата
- 6.11. Значение величин …
- 6.12. О степени совершенства кинетики ферментативного катализа судят по критерию …
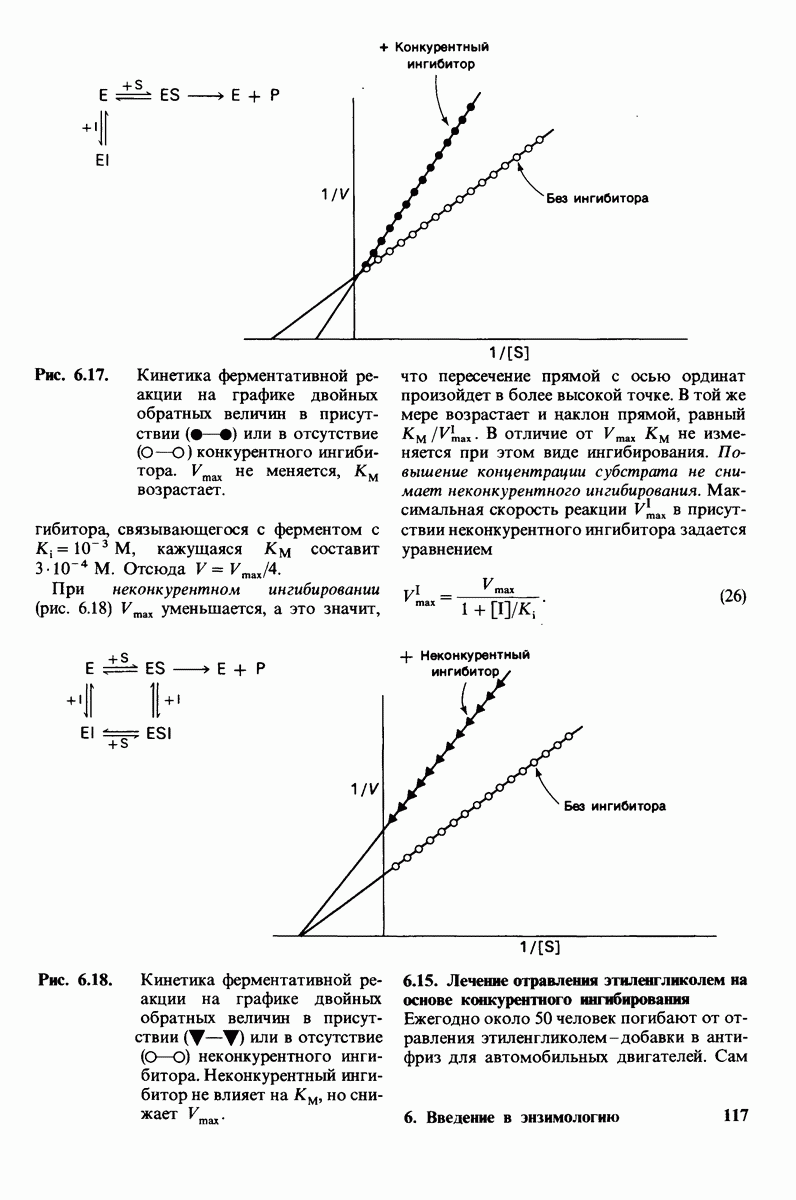
- 6.13. Ферменты могут ингибироваться специфическими молекулами
- 6.15. Лечение отравления этиленгликолем на основе конкурентного ингибирования
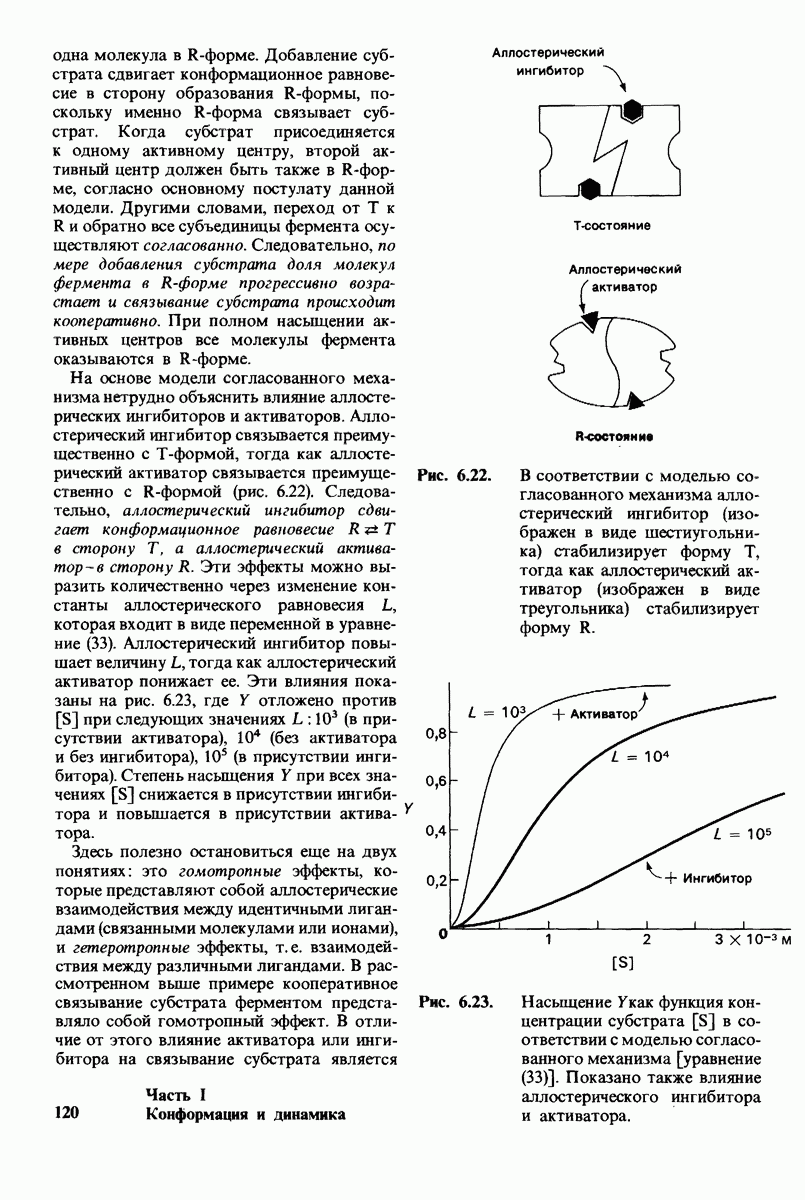
- 6.16. Аллостерические ферменты не подчиняются кинетике Михаэлиса — Ментен
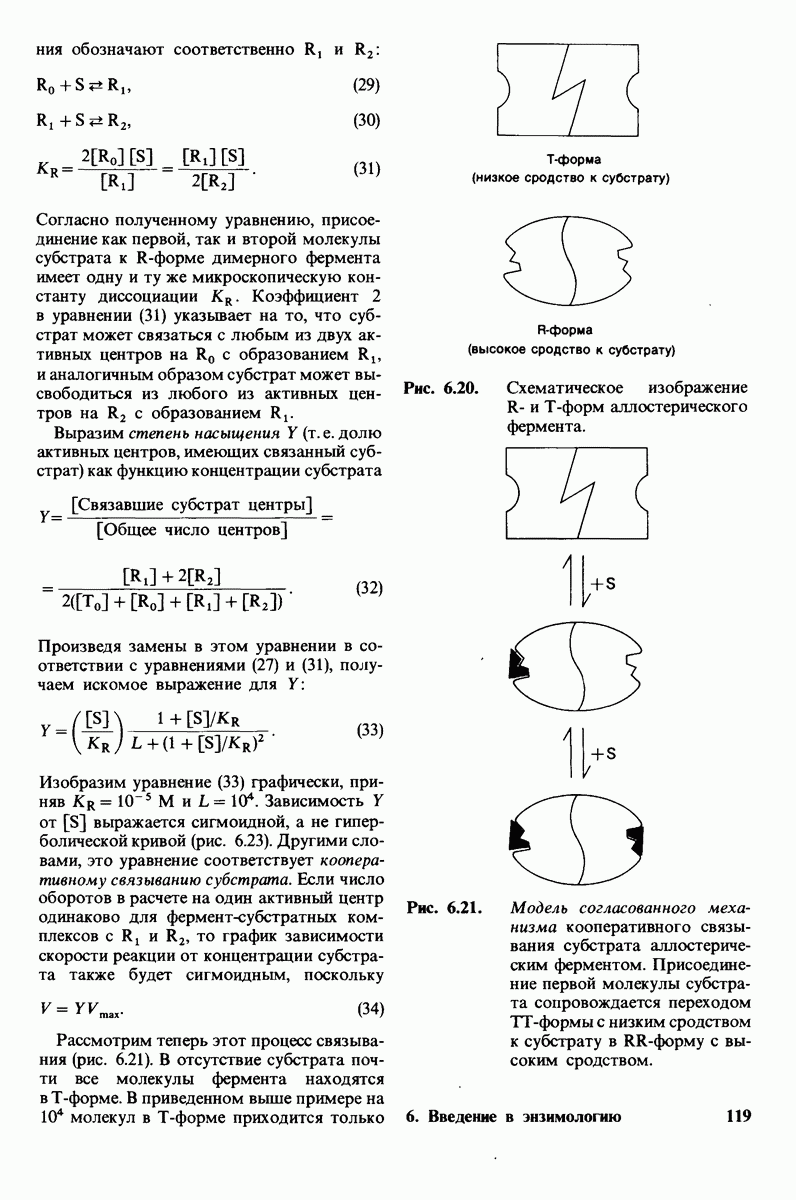
- 6.17. Согласованный механизм аллостерических взаимодействий
- 6.18. Последовательный механизм аллосгерического взаимодействия
- 6.19. Водородные связи, а также электростатические и вандерваальсовы взаимодействия в фермент-субстратных комплексах
- 6.20. Заряженные субстраты могут связываться с противоположно заряженными группами фермента
- 6.21. При связывании субстратов с ферментами образуются строго ориентированные водородные связи
- 6.22. Белки обладают выраженной способностью к образованию водородных связей
- 6.23. Вандерваальсовы взаимодействия играют важную роль в случаях стернческой комплементарности
- 6.24. Биологически важные свойства воды: полярность воды и ее способность к когезин
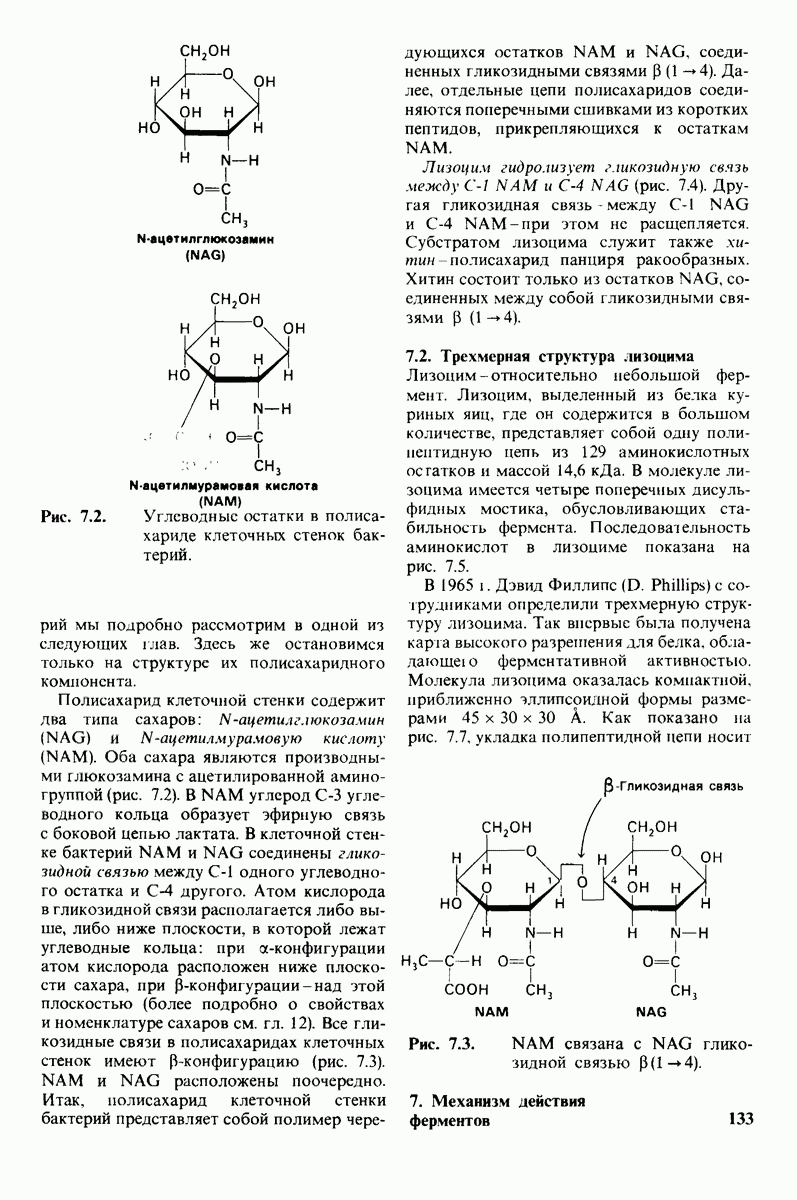
- 6.25. Присутствие воды ослабляет полярные взаимодействия
- 6.26. Гидрофобные взаимодействия; в водной среде неполярные группы стремятся ассоциировать
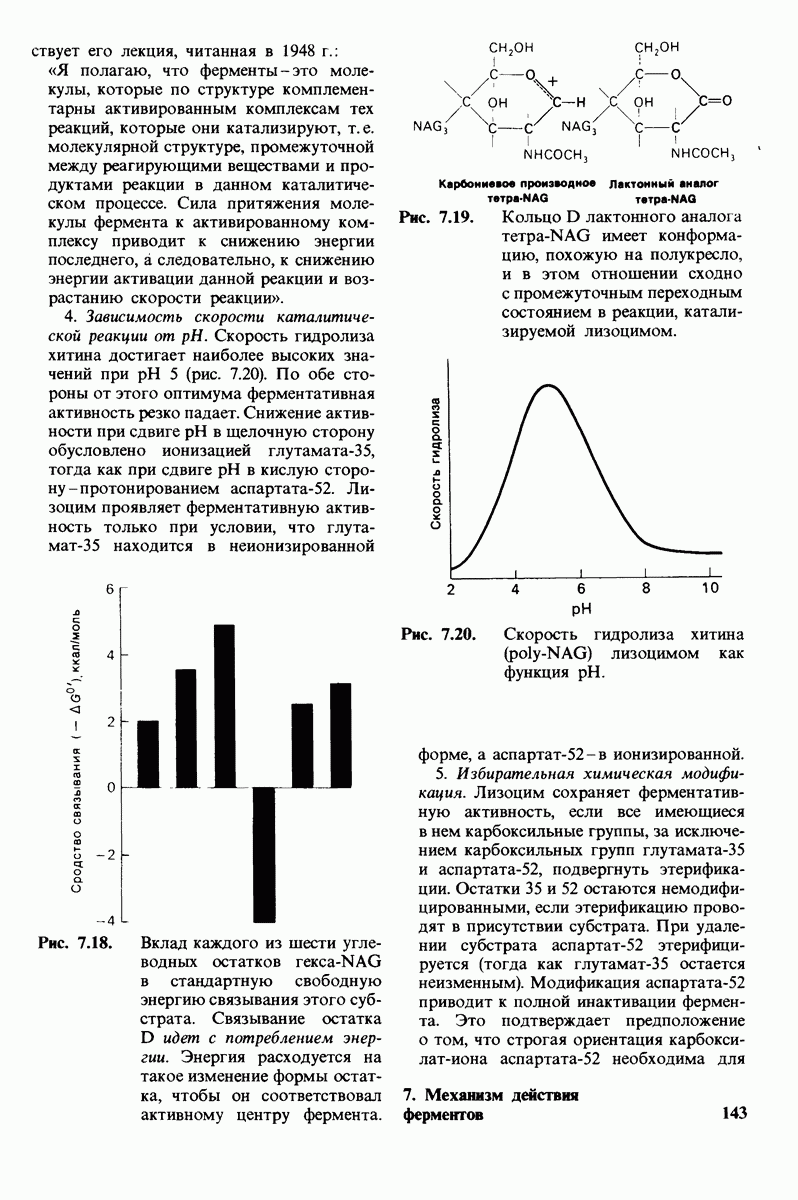
- ГЛАВА 7. Механизм действия ферментов: лизоцим и карбоксипептидаза
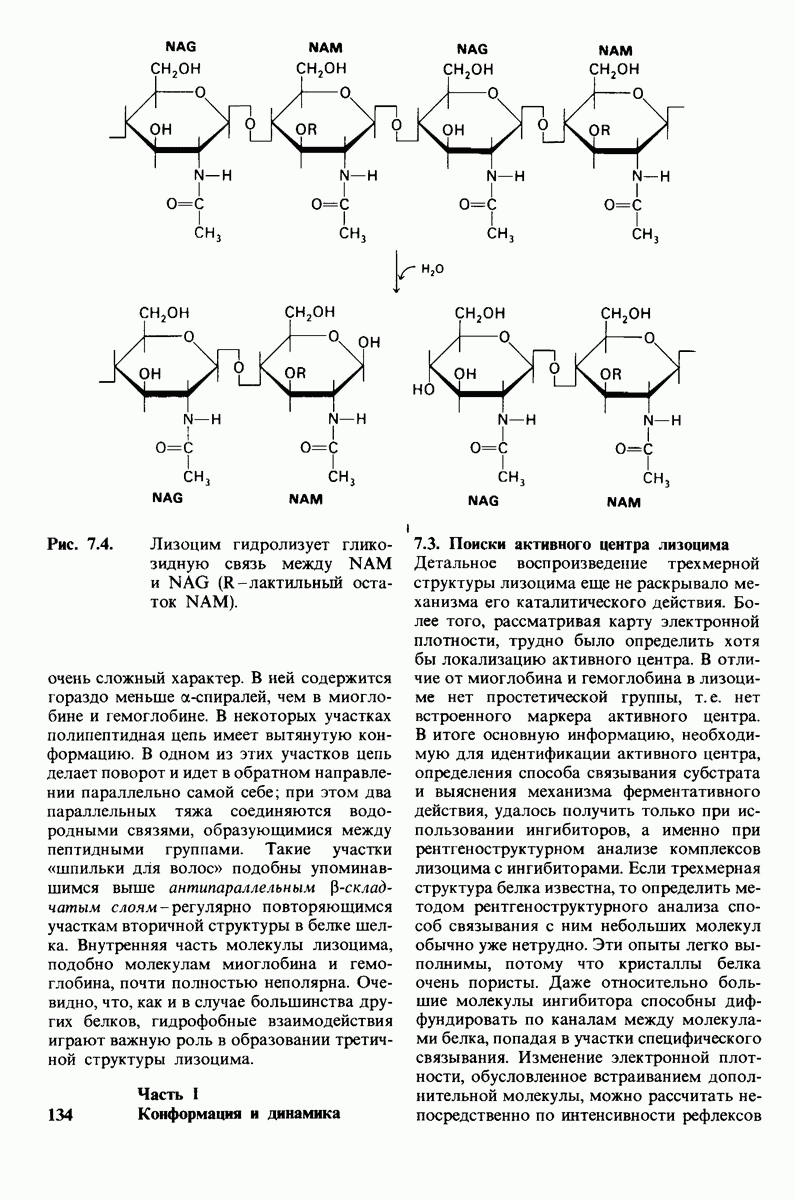
- 7.1. Лизоцим расщепляет клеточные стенки бактерий
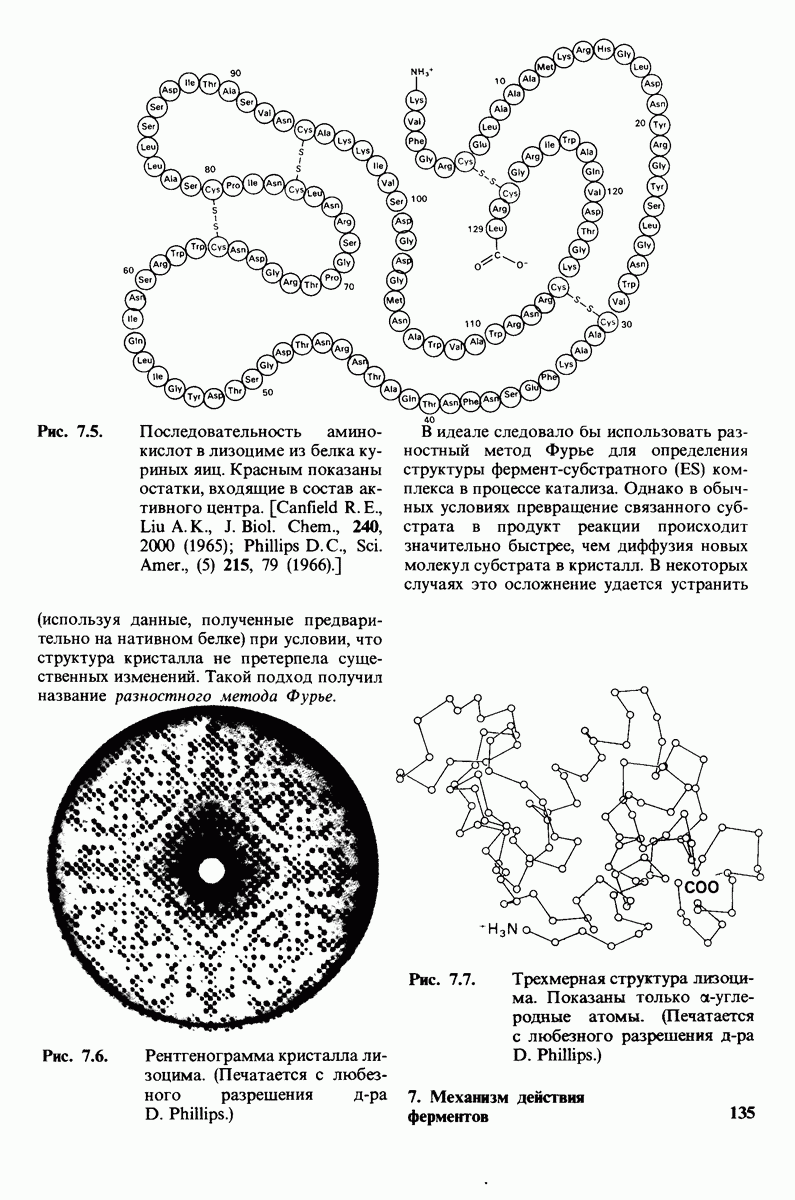
- 7.2. Трехмерная структура лизоцима
- 7.3. Поиски активного центра лизоцима
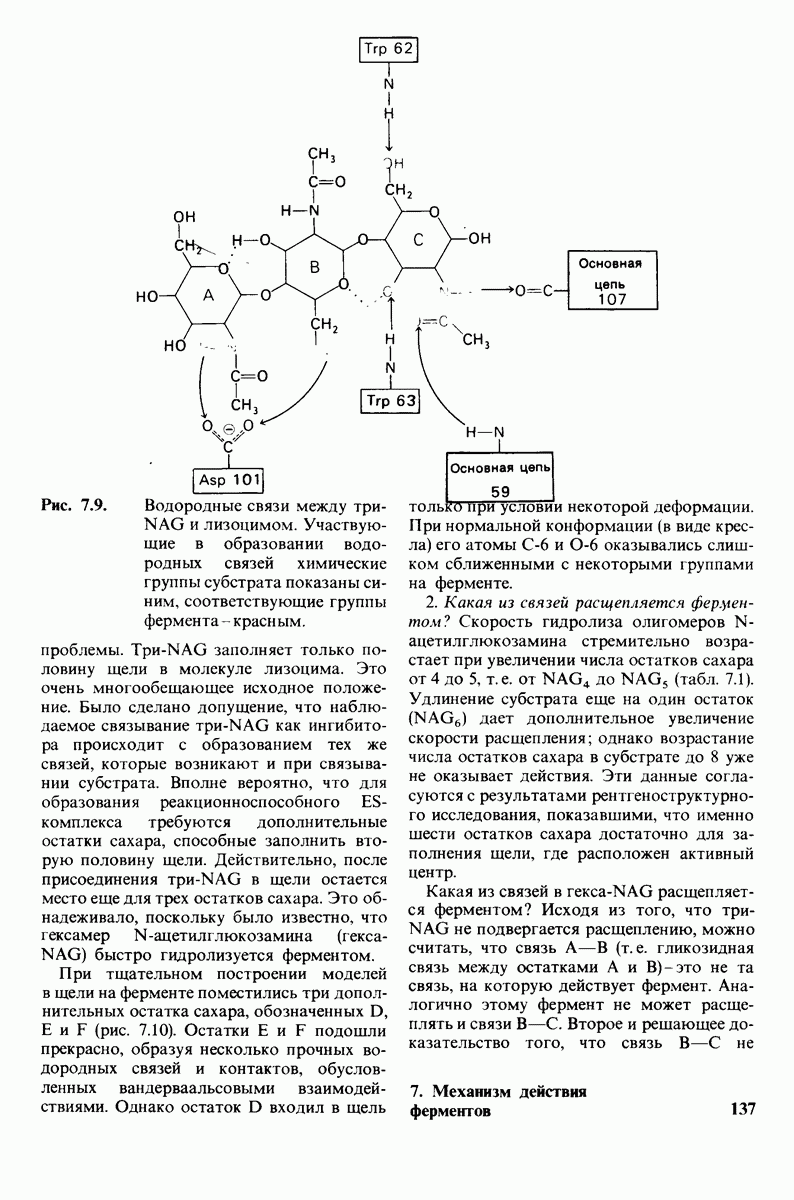
- 7.4. Способ связывания конкурентного ингибитора
- 7.5. От структуры фермента — к механизму ферментативного действия
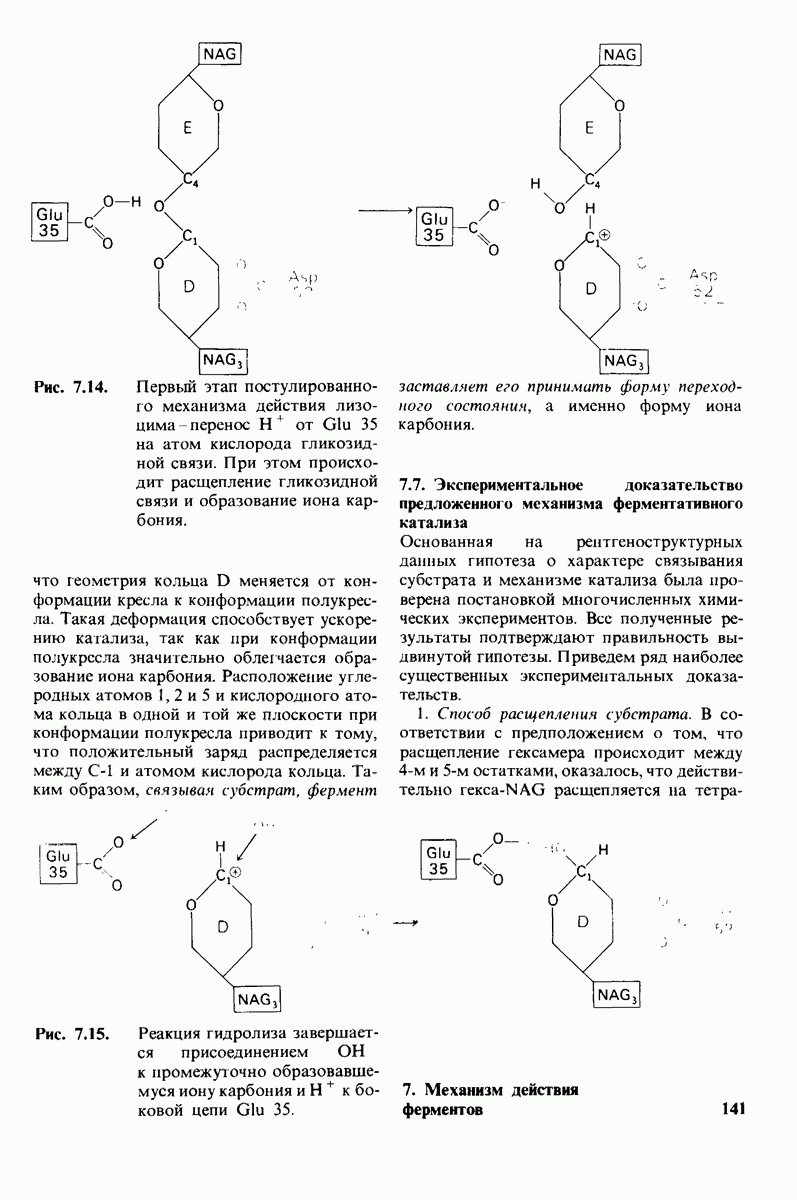
- 7.6. Промежуточное образование иона карбония — критический этап катализа
- 7.7. Экспериментальное доказательство предложенного механизма ферментативного катализа
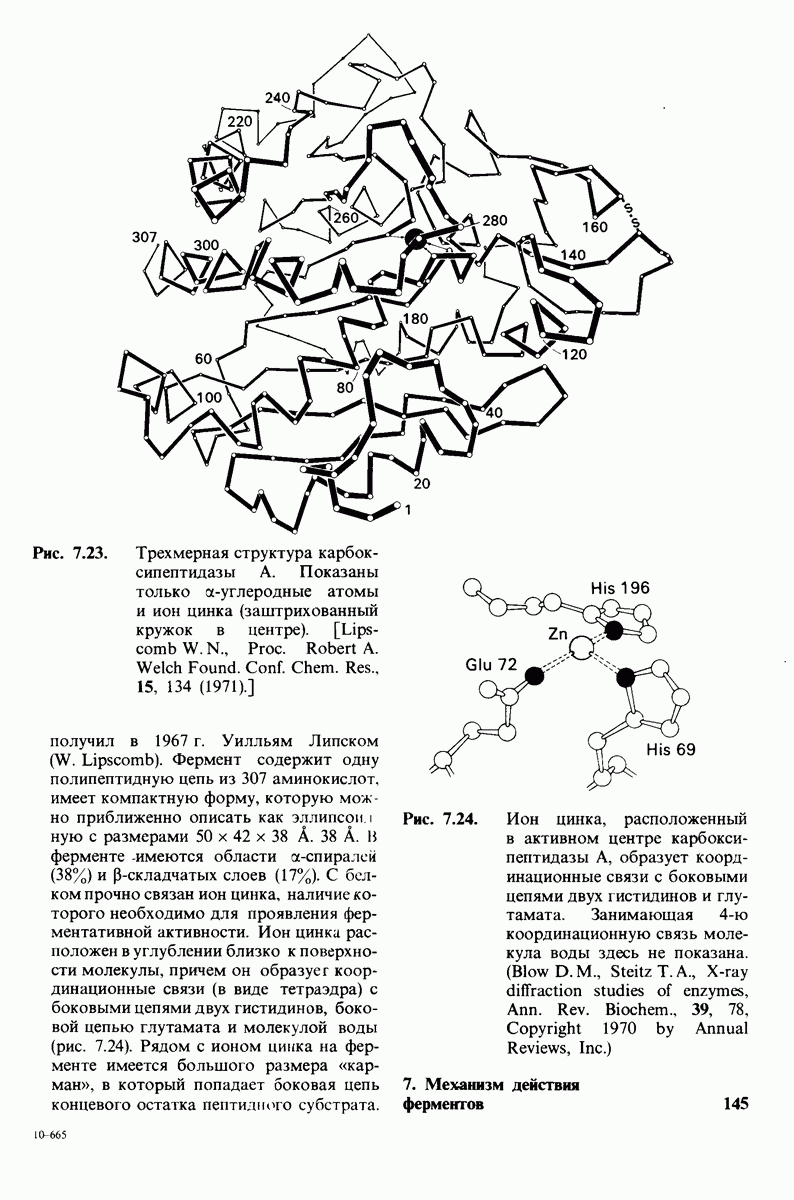
- 7.8. Карбоксипептидаза А: протеолитический фермент, содержащий цинк
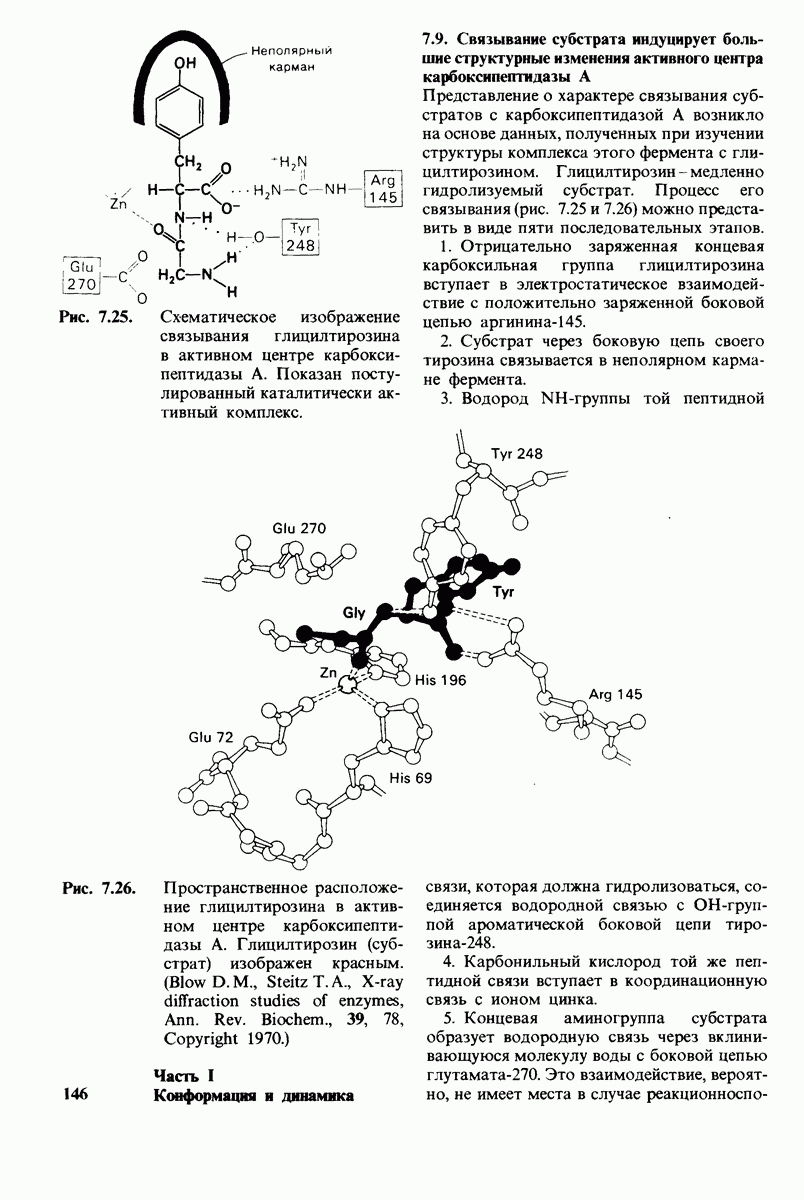
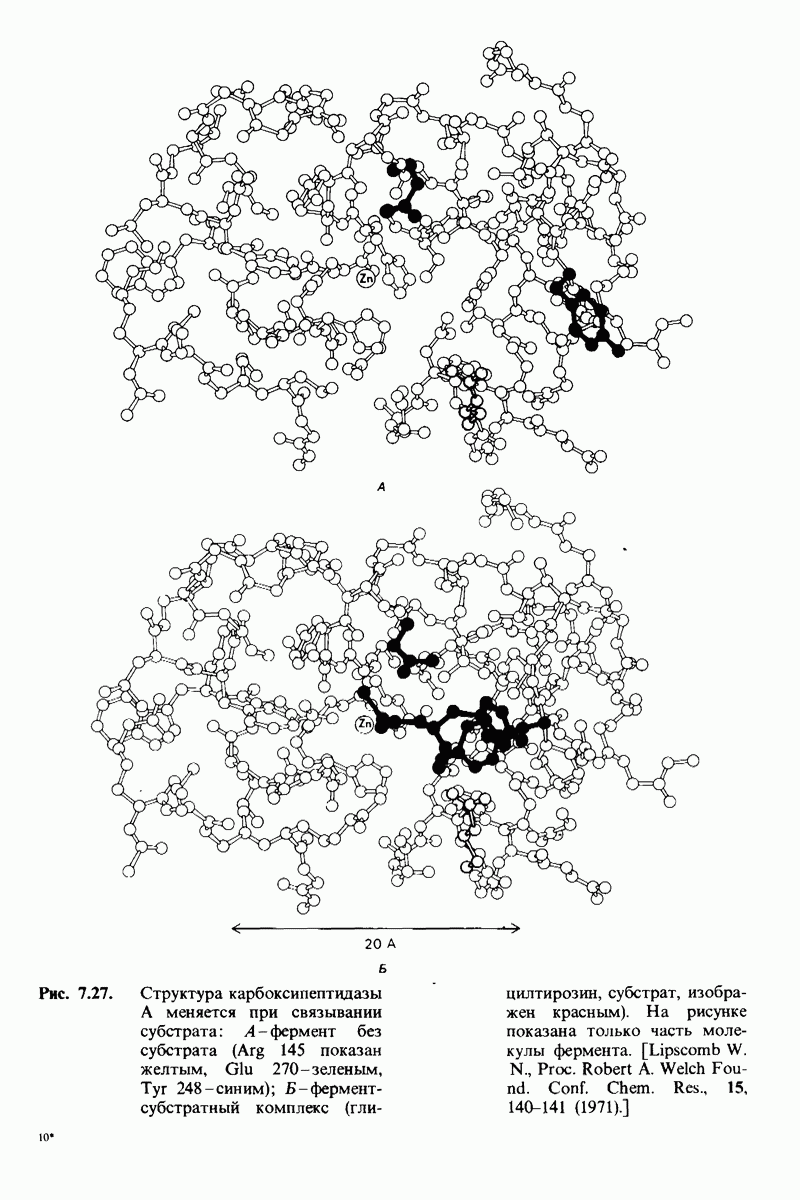
- 7.9. Связывание субстрата индуцирует большие структурные изменения активного центра карбоксипептидазы А
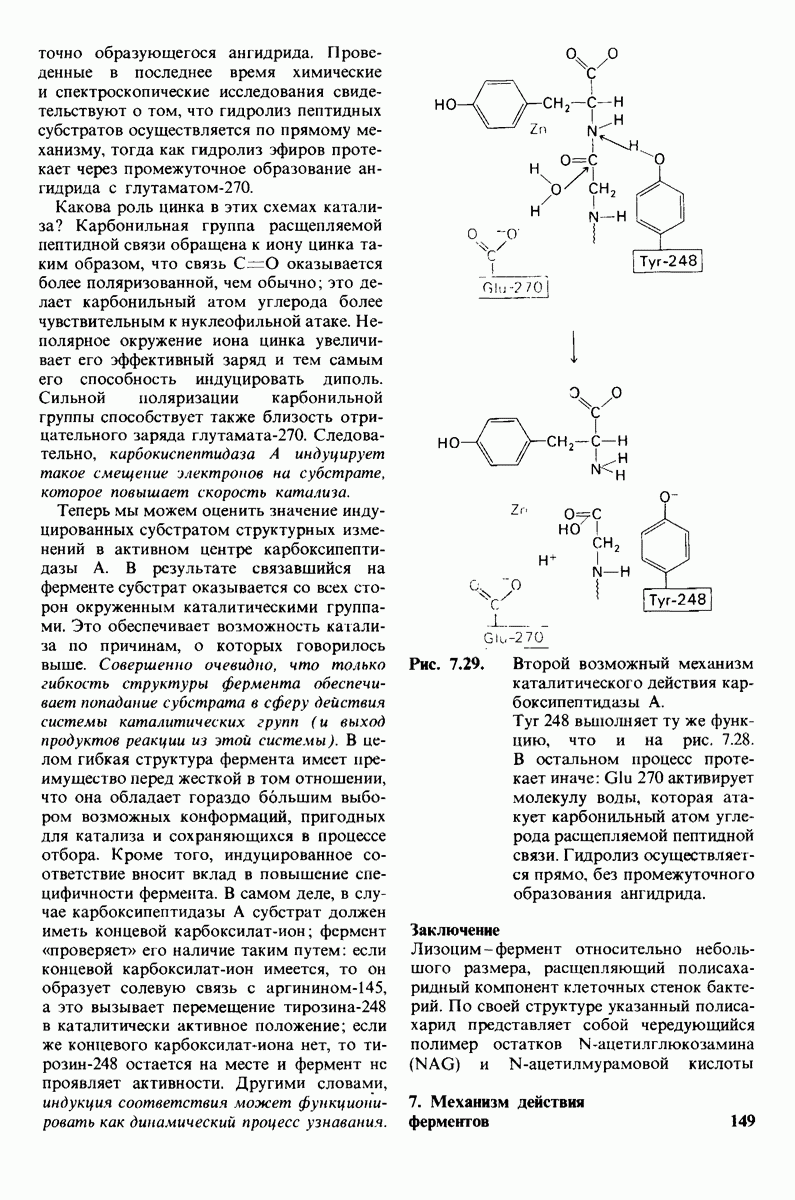
- 7.10. Скорость катализа карбоксипептидазой А возрастает благодаря смещению электронов
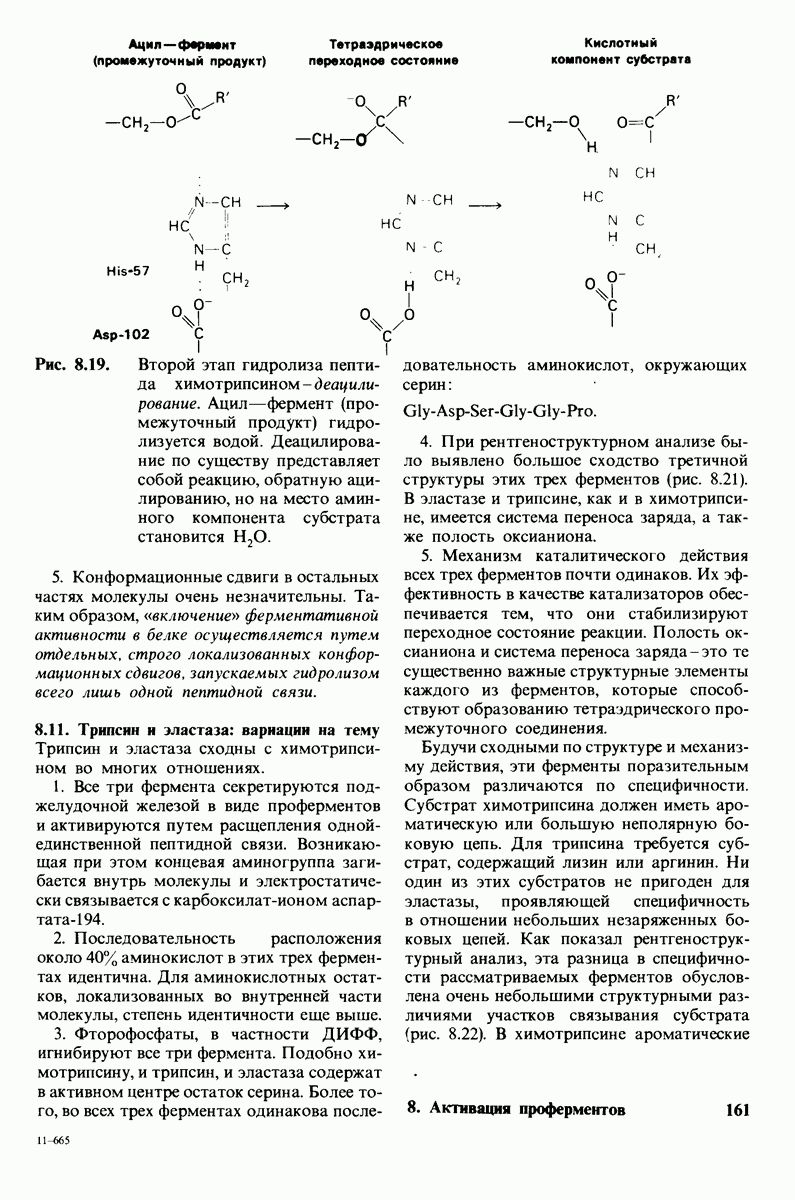
- ГЛАВА 8. Активация проферментов: пищеварительные ферменты и факторы свертывания крови
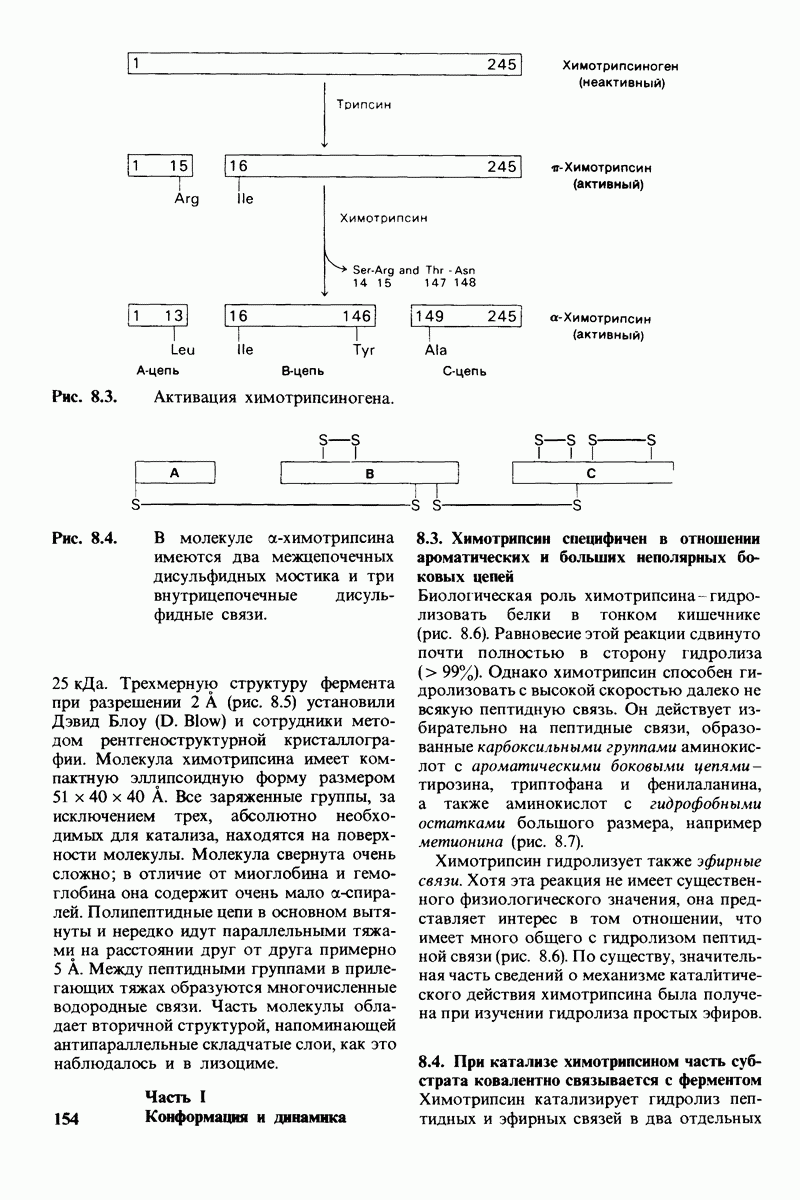
- 8.1. Активация химотрипсиногена происходит путем специфического расщепления одной пептидной связи
- 8.2. Трехмерная структура химотрипсина
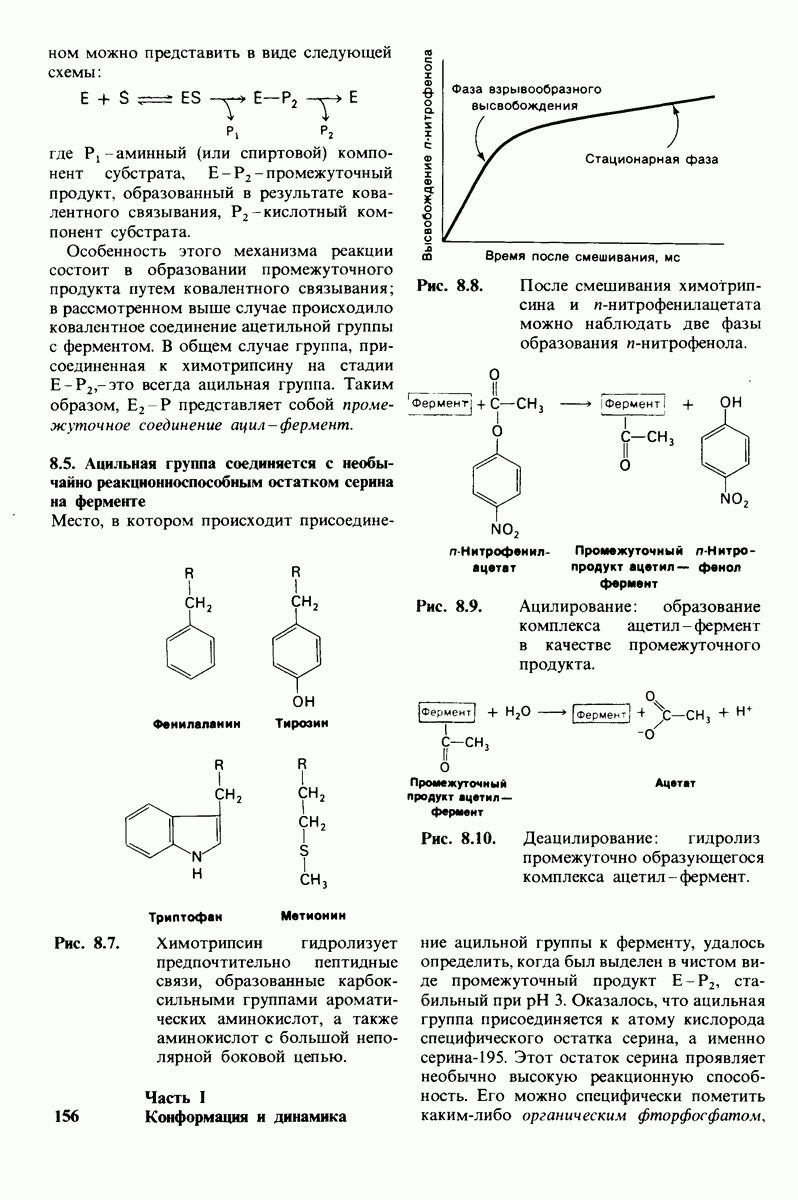
- 8.3. Химотрипсии специфичен в отношении ароматических и больших неполярных боковых цепей
- 8.4. При катализе химотрипсином часть субстрата ковалентно связывается с ферментом
- 8.5. Ацильная группа соединяется с необычайно реакционноспособным остатком серина на ферменте
- 8.6. Участие гистидина-57 в катализе выявляется с помощью аффинной метки
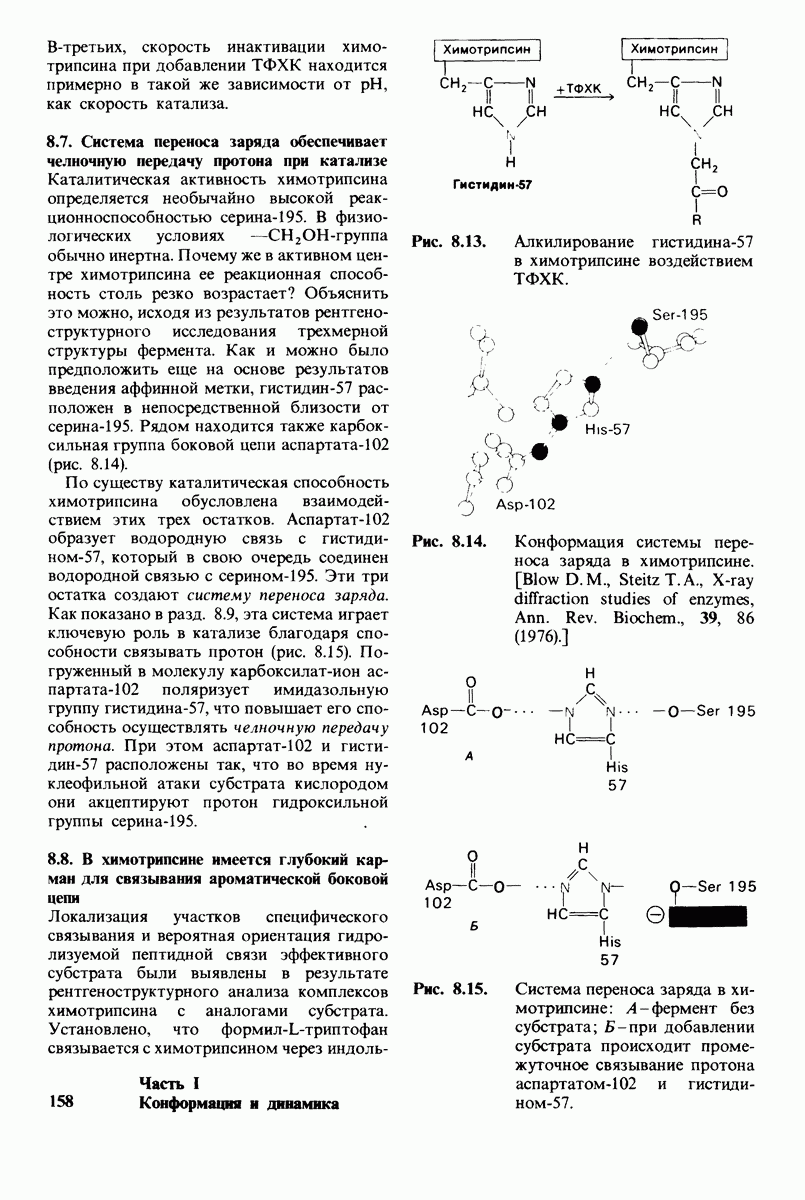
- 8.7. Система переноса заряда обеспечивает челночную передачу протона при катализе
- 8.8. В химотрипснне имеется глубокий карман для связывания ароматической боковой цепи
- 8.9. В процессе катализа образуется переходное тетраэдрическое промежуточное соединение
- 8.10. Механизм активации профермента
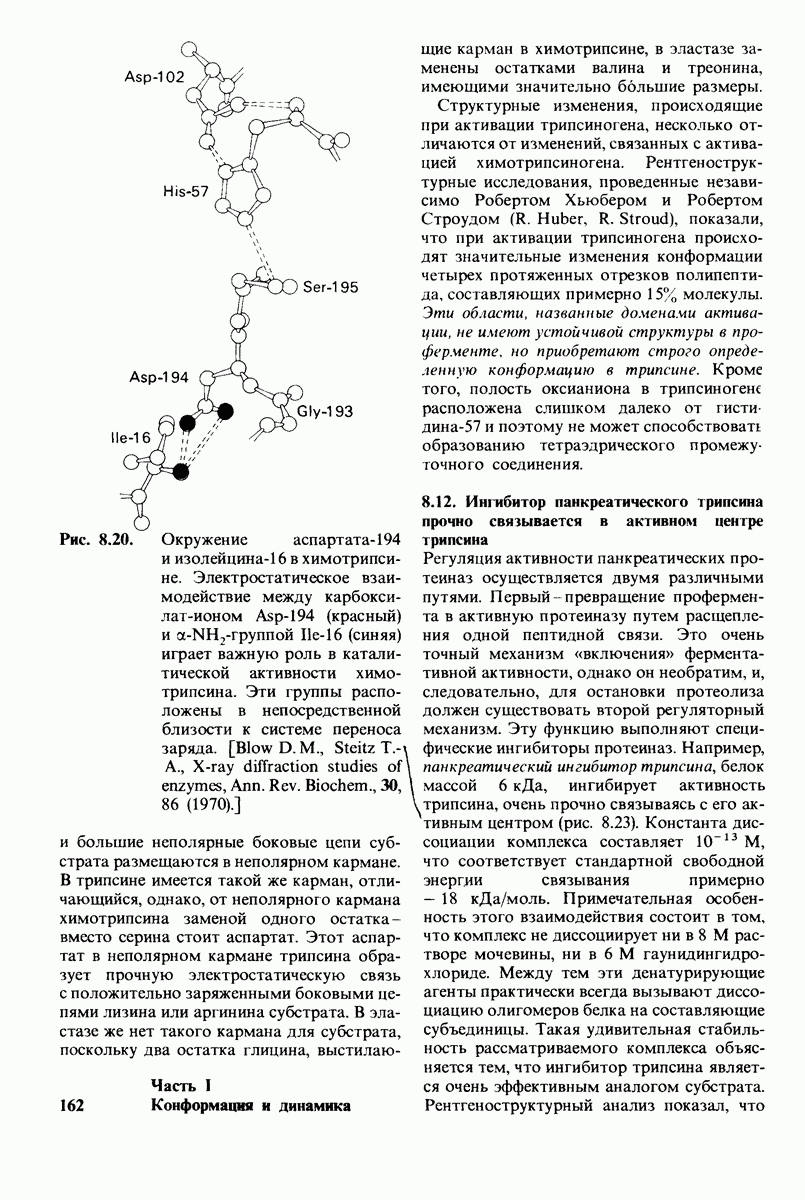
- 8.11. Трипсин и эластаза: вариации на тему
- 8.12. Ингибитор панкреатического трипсина прочно связывается в активном центре трипсина
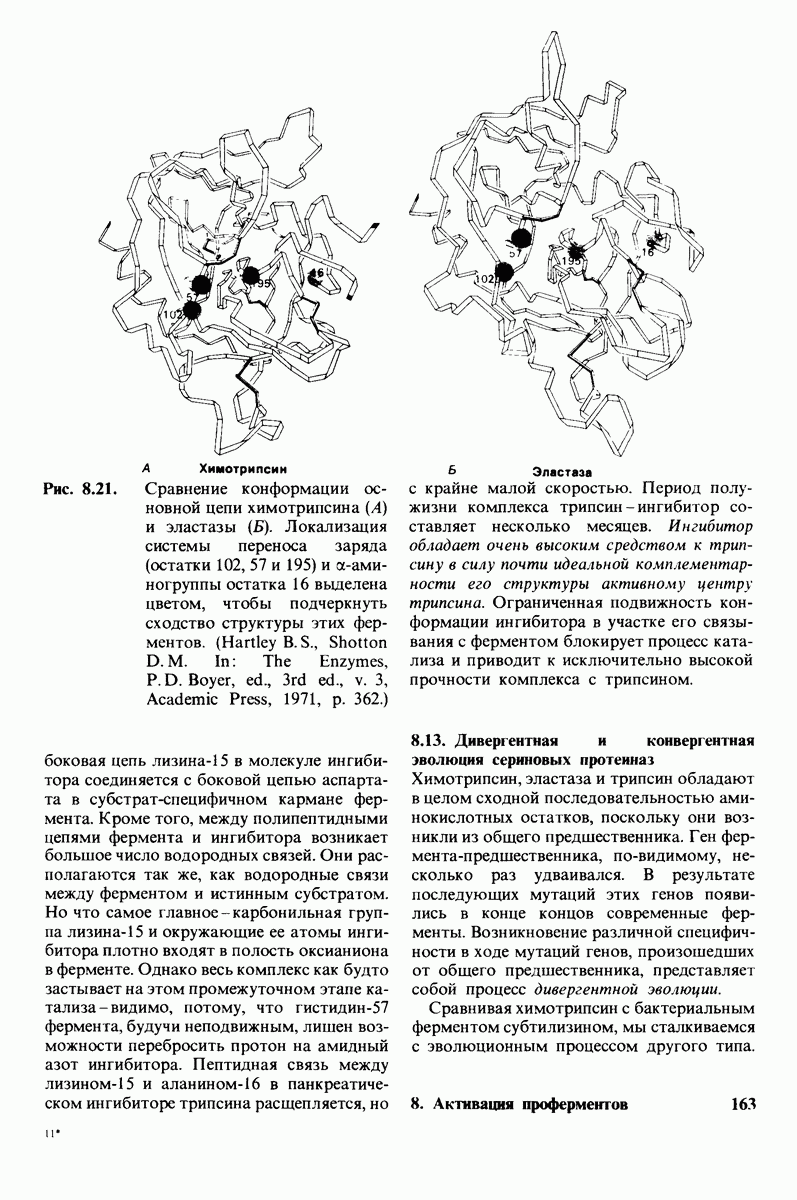
- 8.13. Дивергентная и конвергентная эволюция сериновых протеиназ
- 8.14. Координированная активация панкреатических проферментов
- 8.16. Основные типы протеолитических ферментов — это сериновые протеиназы и карбоксипротеиназы
- 8.17. Свертывание крови как каскад реакций активации проферментов
- 8.18. Образование кровяного сгустка требует взаимодействия двух типов ферментативных превращений
- 8.19. Фибриноген превращается в фибриновый сгусток под действием тромбина
- 8.20. Мономеры фибрина спонтанно образуют фибриллы
- 8.21. Сгусток фибрина стабилизирован ковалентными поперечными связями
- 8.22. Тромбин гомологичен трипсину
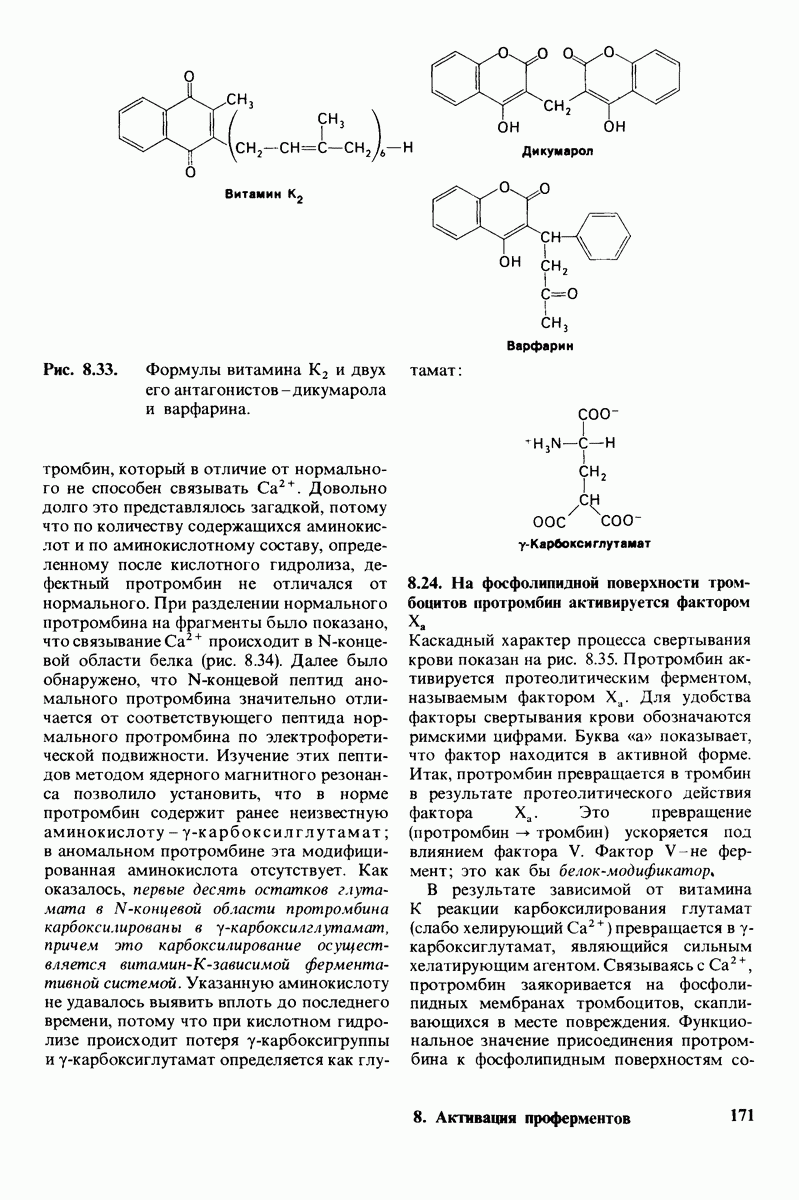
- 8.23. Для синтеза протромбина необходим витамин К
- 8.24. На фосфолипидной поверхности тромбоцитов протромбин активируется фактором …
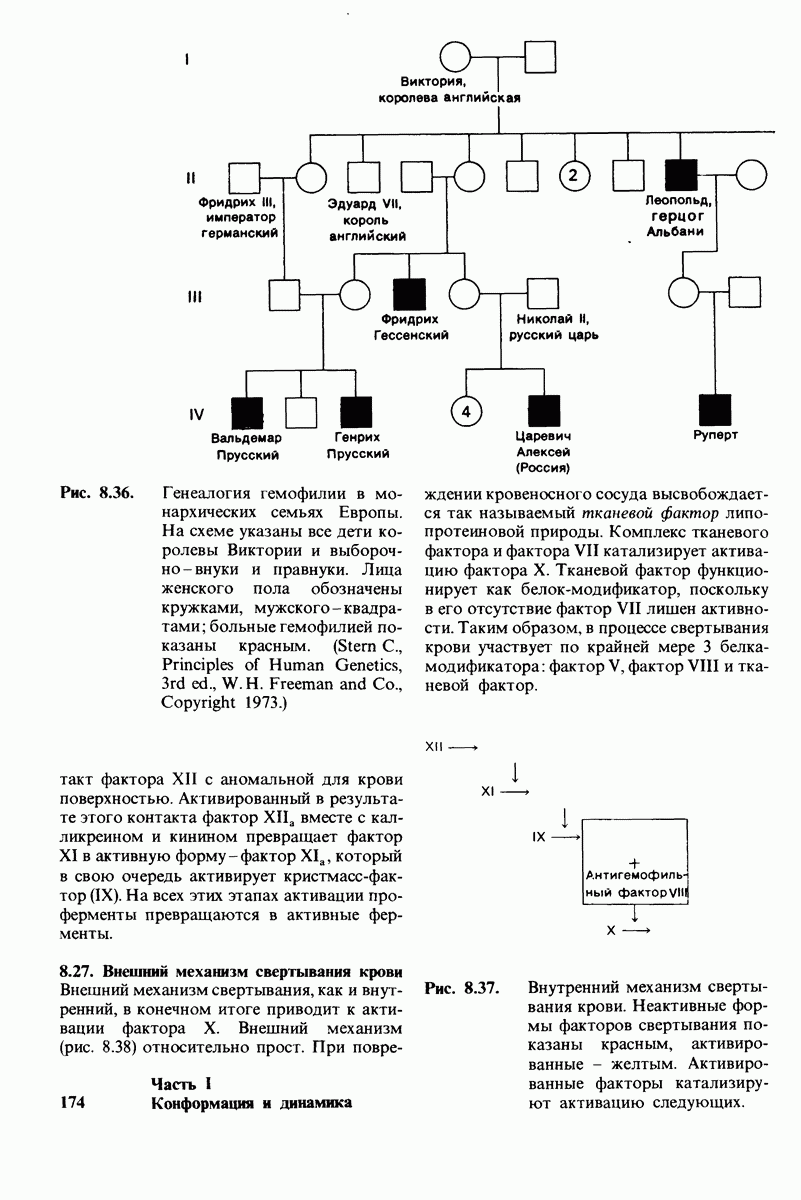
- 8.25. Гемофилия и другие формы нарушения свертывания крови позволили выявить ряд начальных этапов образования кровяного сгустка
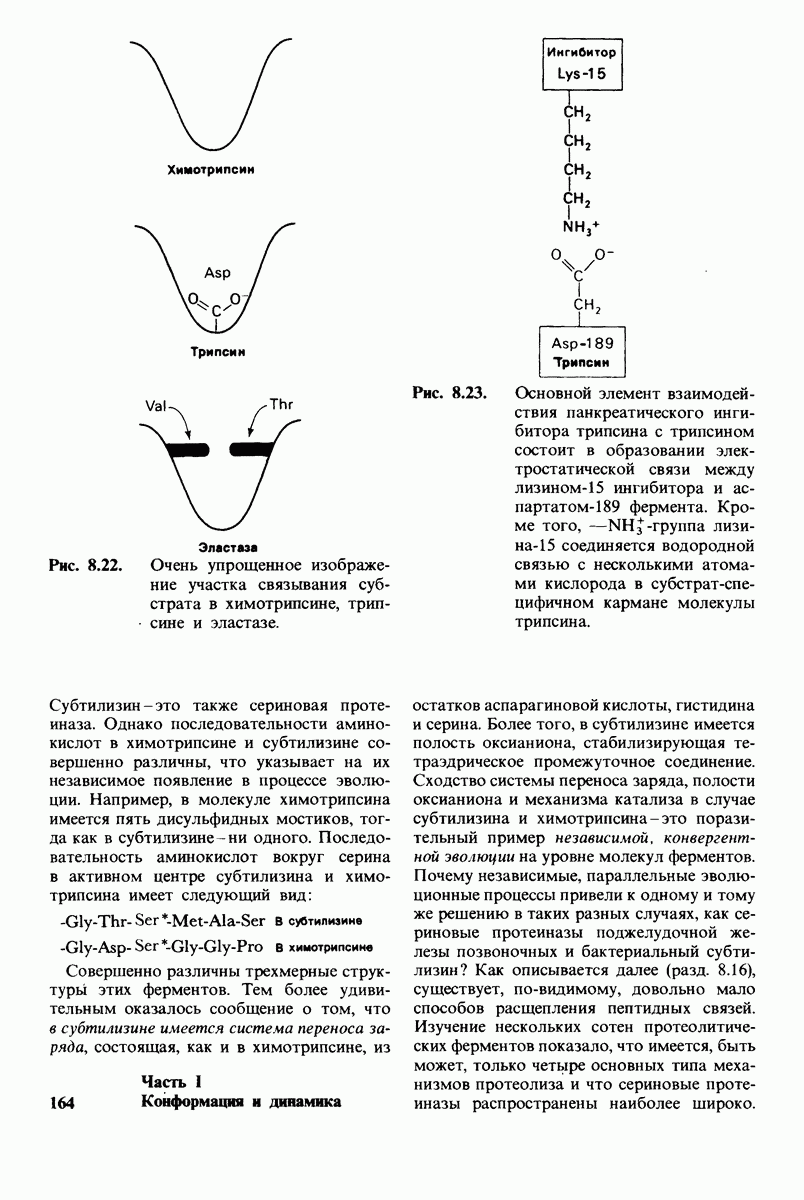
- 8.26. Внутренний механизм свертывания крови
- 8.27. Внешний механизм свертывания крови
- 8.28. Контроль свертывания крови: проблема, требующая внимания
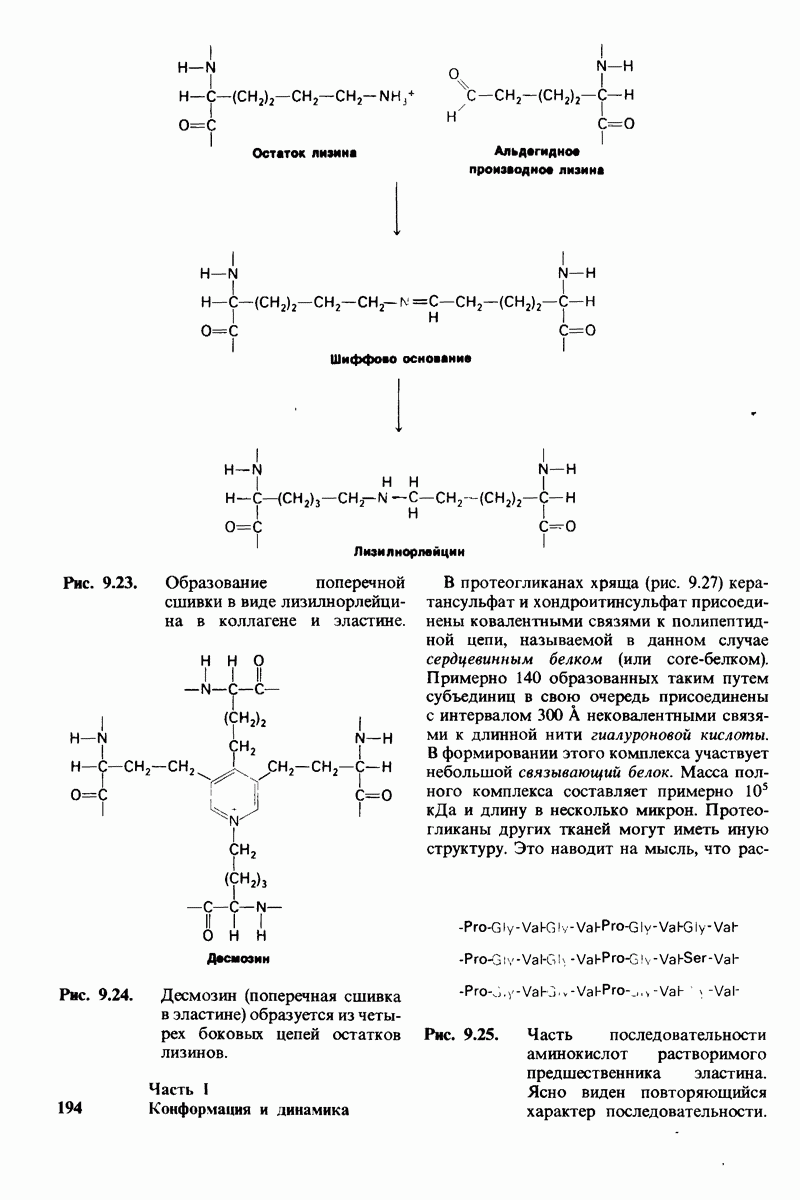
- ГЛАВА 9. Белки соединительной ткани: коллаген, эластин и протеогликаны
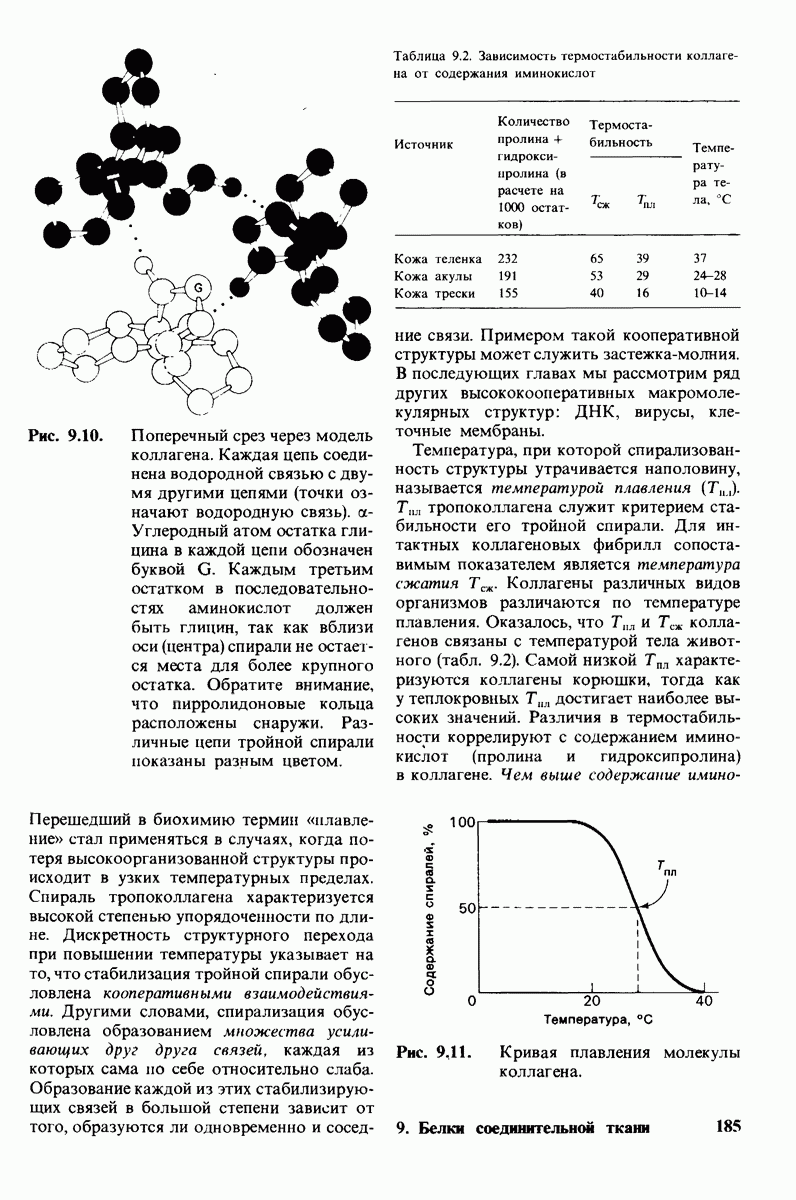
- 9.1. Тропоколлагеи как основная структурная единица коллагена
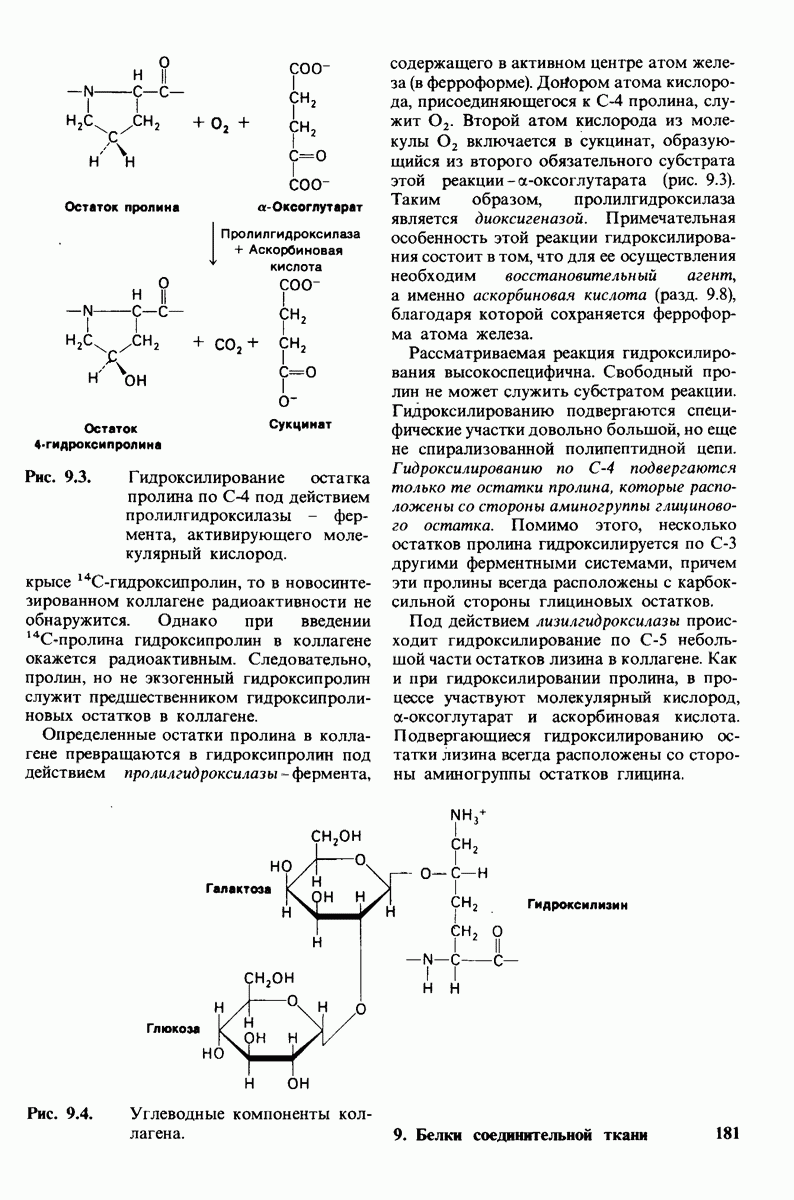
- 9.2. Коллаген обладает необычным составом и необычной последовательностью аминокислот
- 9.3. Некоторые остатки пролина и лизина в коллагене гидроксилируются
- 9.4. К остаткам гидроксилизина присоединены сахара
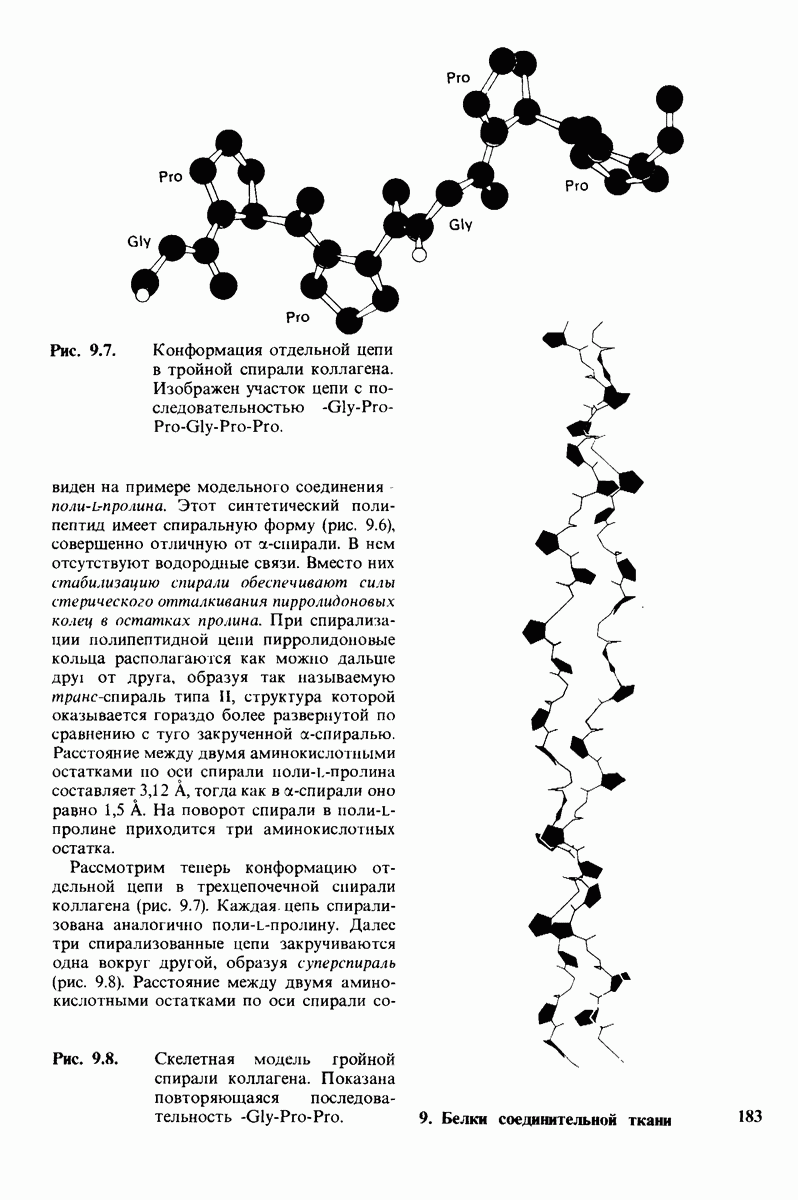
- 9.5. Структура тропоколлагена — это тройной спирально скрученный тяж
- 9.6. Малые размеры глицина делают его незаменимым компонентом структуры
- 9.7. Стабильность спирали коллагена зависит от кооперативных взаимодействий
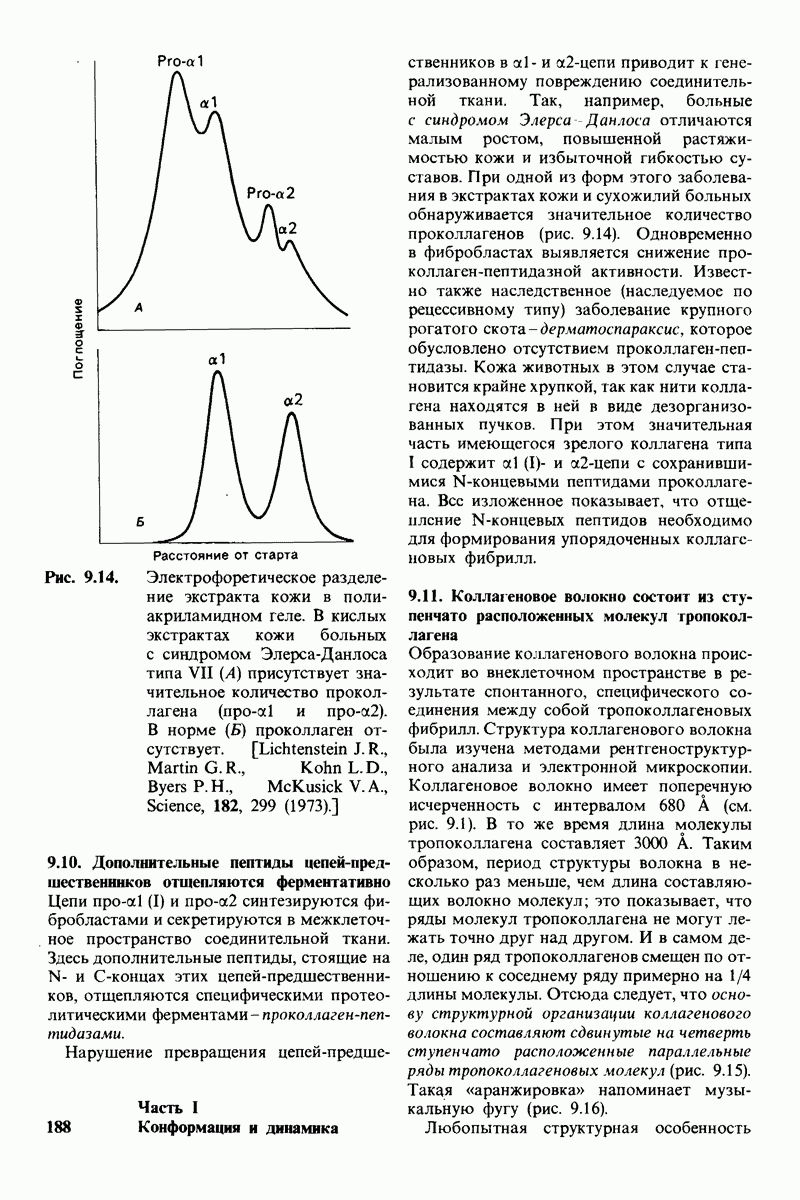
- 9.8. Нарушение гидроксилирования — один из биохимических дефектов при цинге
- 9.9. Проколлаген предшественник коллагена при его биосинтезе
- 9.10. Дополнительные пептиды цепей-предшественников отщепляются ферментативно
- 9.11. Коллагеновое волокно состоит из ступенчато расположенных молекул гропоколлагена
- 9.12. Образование коллагенового волокна регулируется проколлаген-пептидазами
- 9.13. Поперечные связи повышают прочность коллагенового волокна
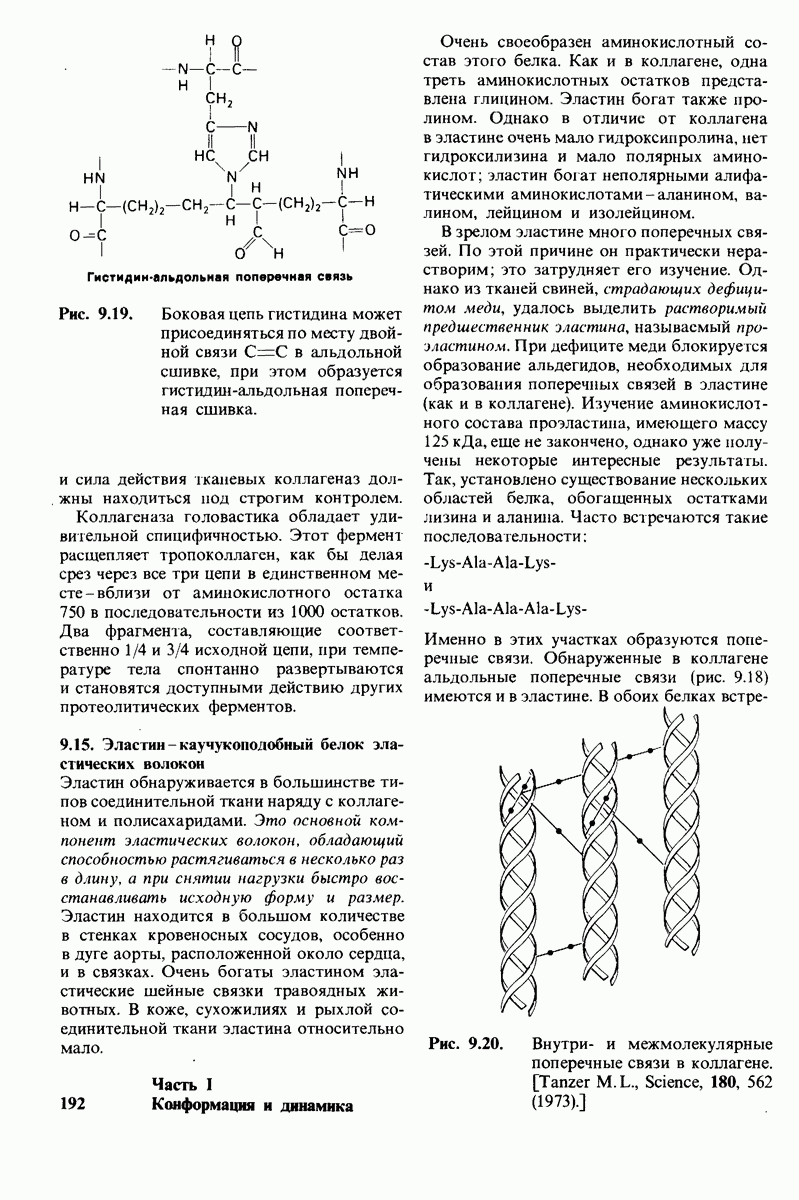
- 9.14. Коллагеназы-ферменты, специфически расщепляющие коллаген
- 9.15. Эластин — каучукоподобный белок эластических волокон
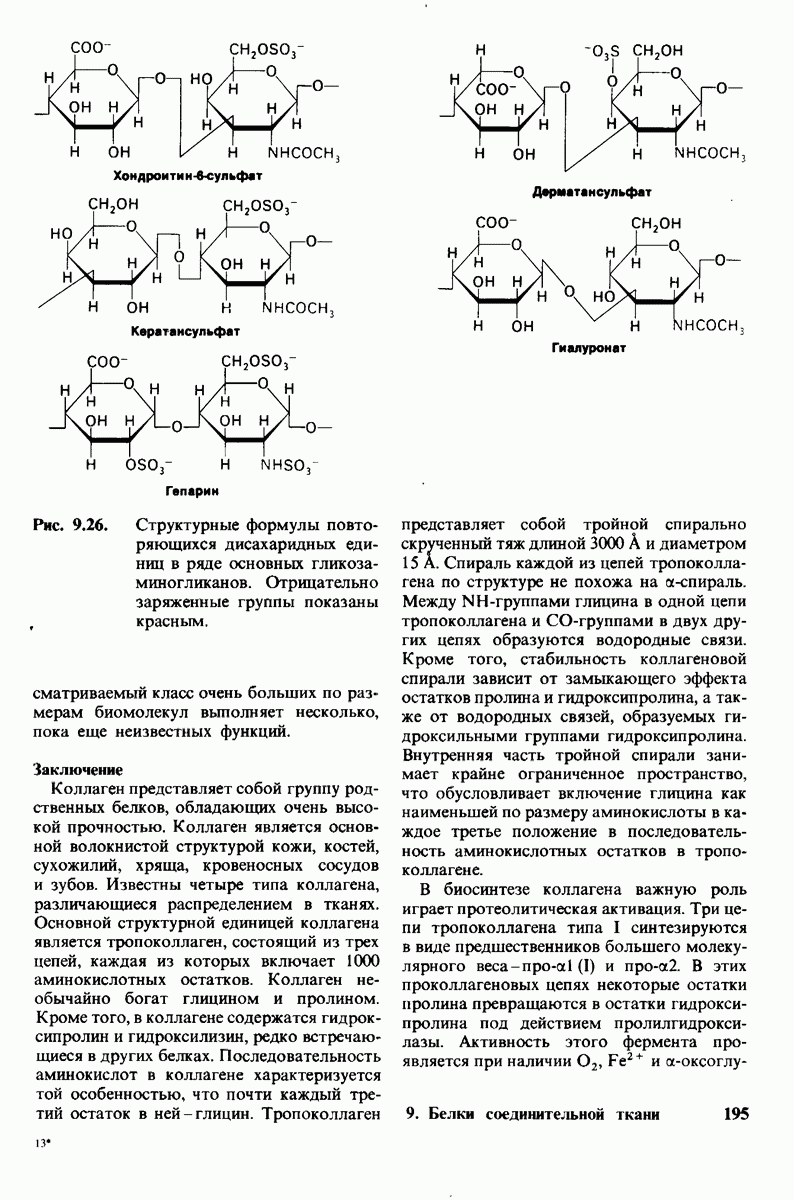
- 9.16. Протеогликаны образуют основное вещество соединительной ткани
- ГЛАВА 10. Введение в проблему биологических мембран
- 10.1. Общие свойства биологических мембран
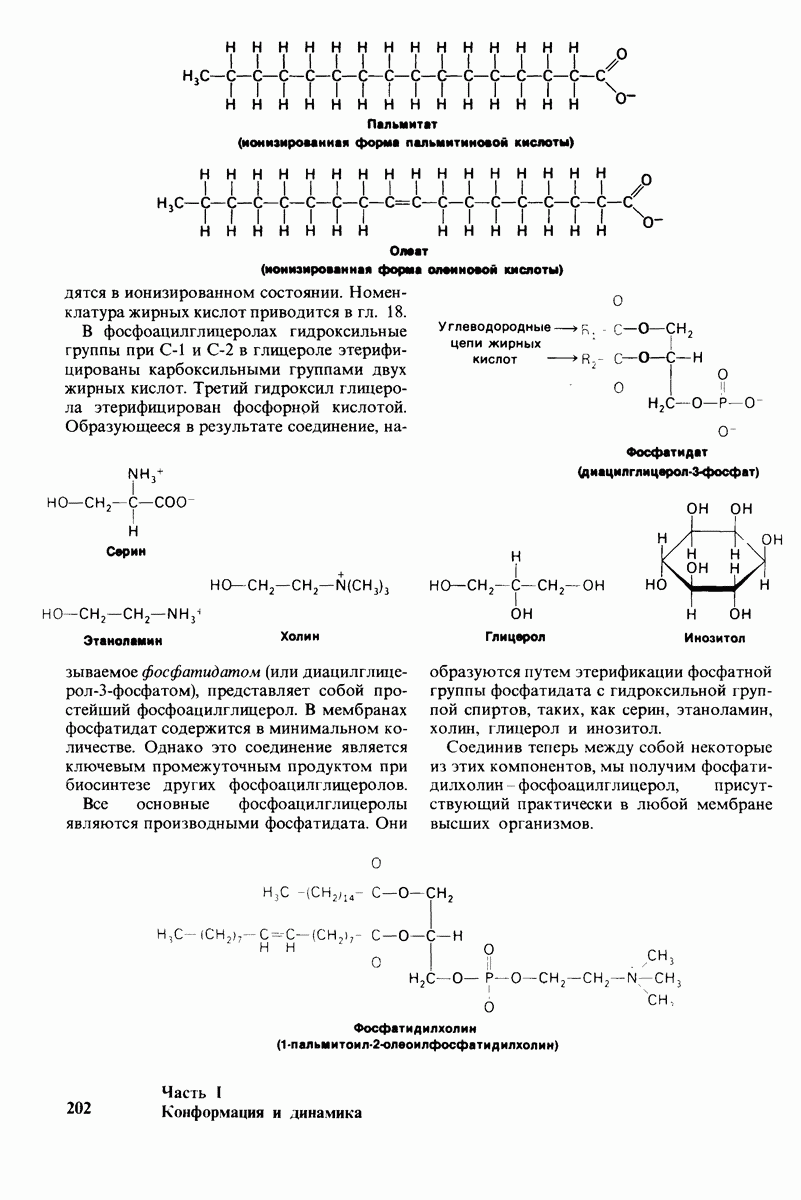
- 10.2. Фосфолипиды — основной класс мембранных липидов
- 10.3. В большинстве мембран имеются также гликолипиды и холестерол
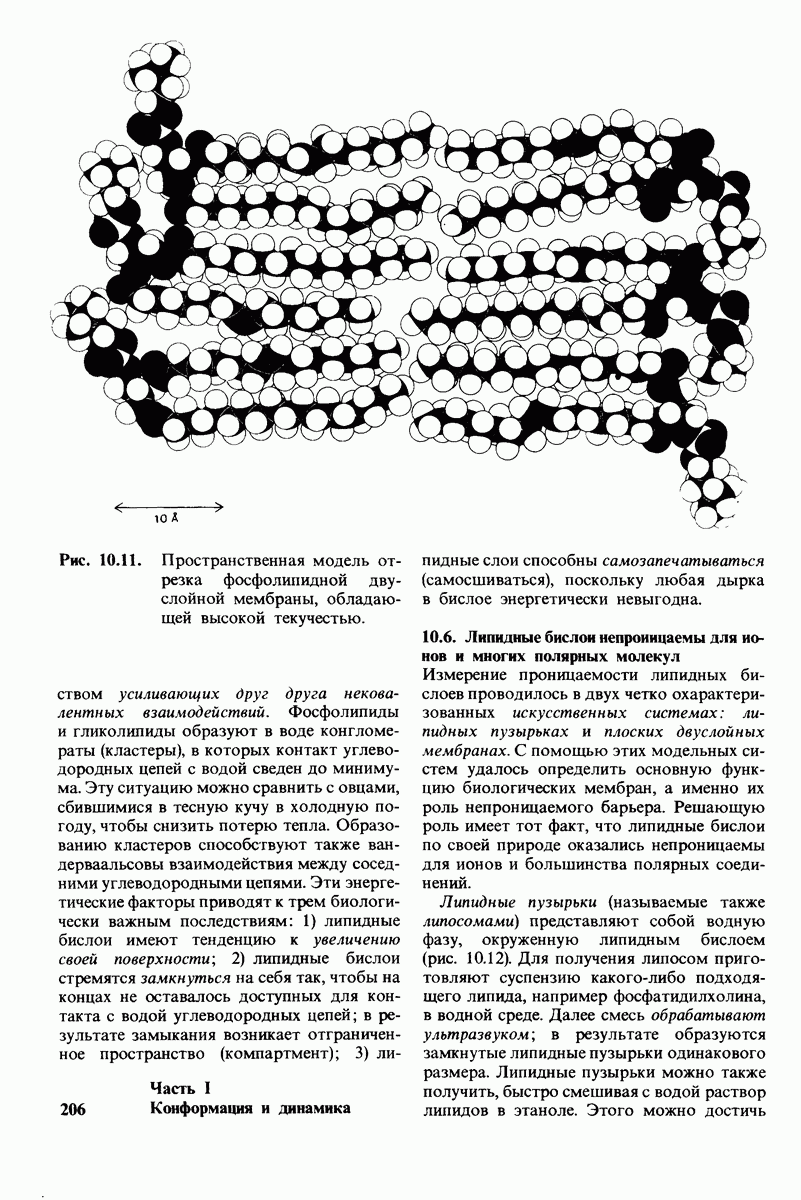
- 10.4. Фосфолипиды и глнколипиды легко образуют бислон
- 10.5. Липидные бислои — нековалентные кооперативные структуры
- 10.6. Липидные бислои непроницаемы для ионов и многих полярных молекул
- 10.7. Большинство мембранных процессов опосредовано белками
- 10.8. Реконструкция функционирующих мембранных систем из очищенных компонентов
- 10.9. Отдельные белки мембран глубоко погружены в липидный бислой
- 10.10. В мембране эритроцитов содержатся различные периферические и интегральные белки
- 10.11. Мембрану эритроцита пронизывают канал для анионов и сложный белок гликофорин
- 10.12. Углеводные единицы расположены на наружной стороне плазматической мембраны
- 10.13. Липиды и многие мембранные белки быстро диффундируют в плоскости мембраны
- 10.14. Мембранные белки не перемещаются поперек бислоев
- 10.15. Жидкостно-мозаичная модель биологических мембран
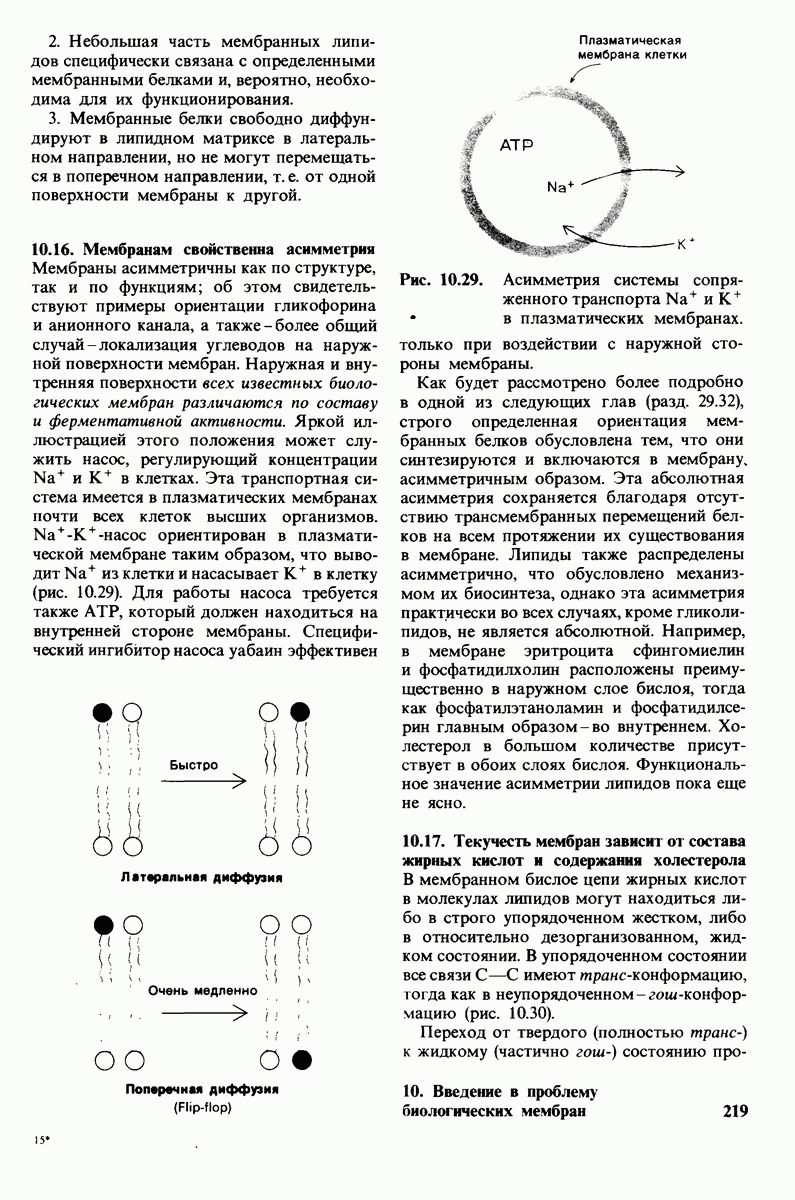
- 10.16. Мембранам свойственна асимметрия
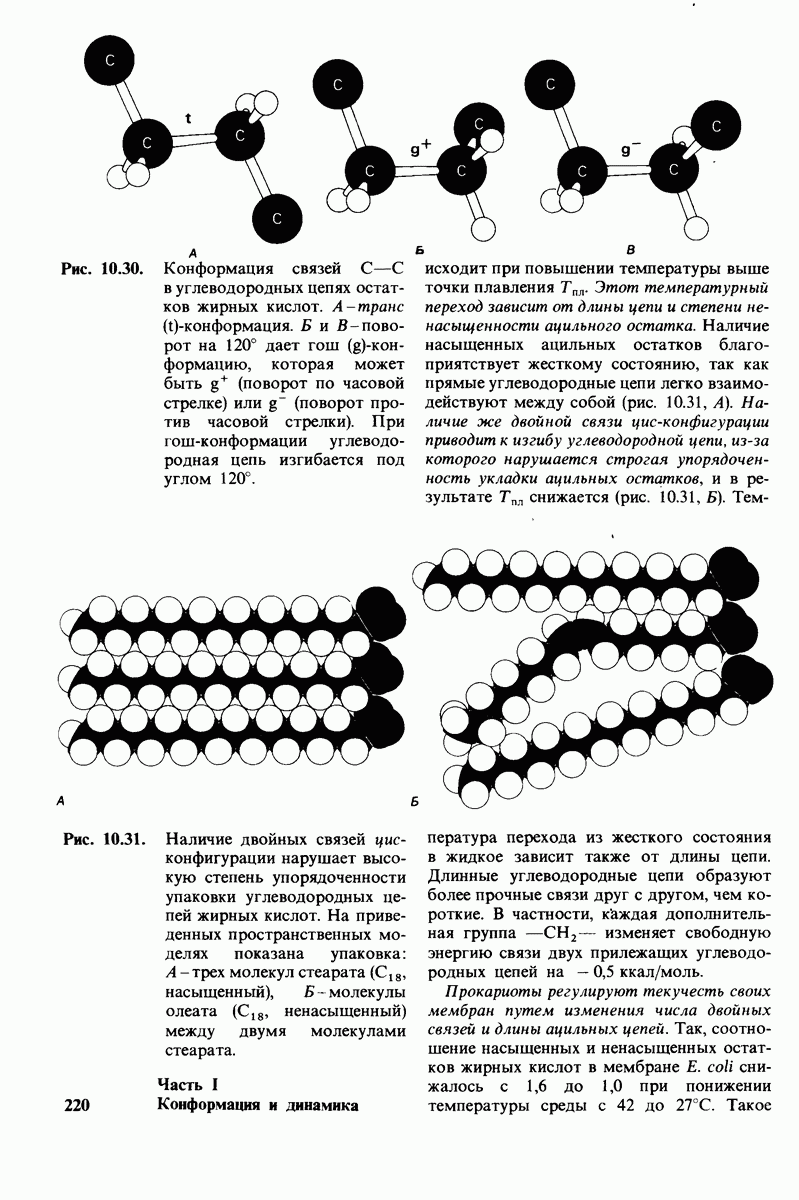
- 10.17. Текучесть мембран зависит от состава жирных кислот и содержания холестерола
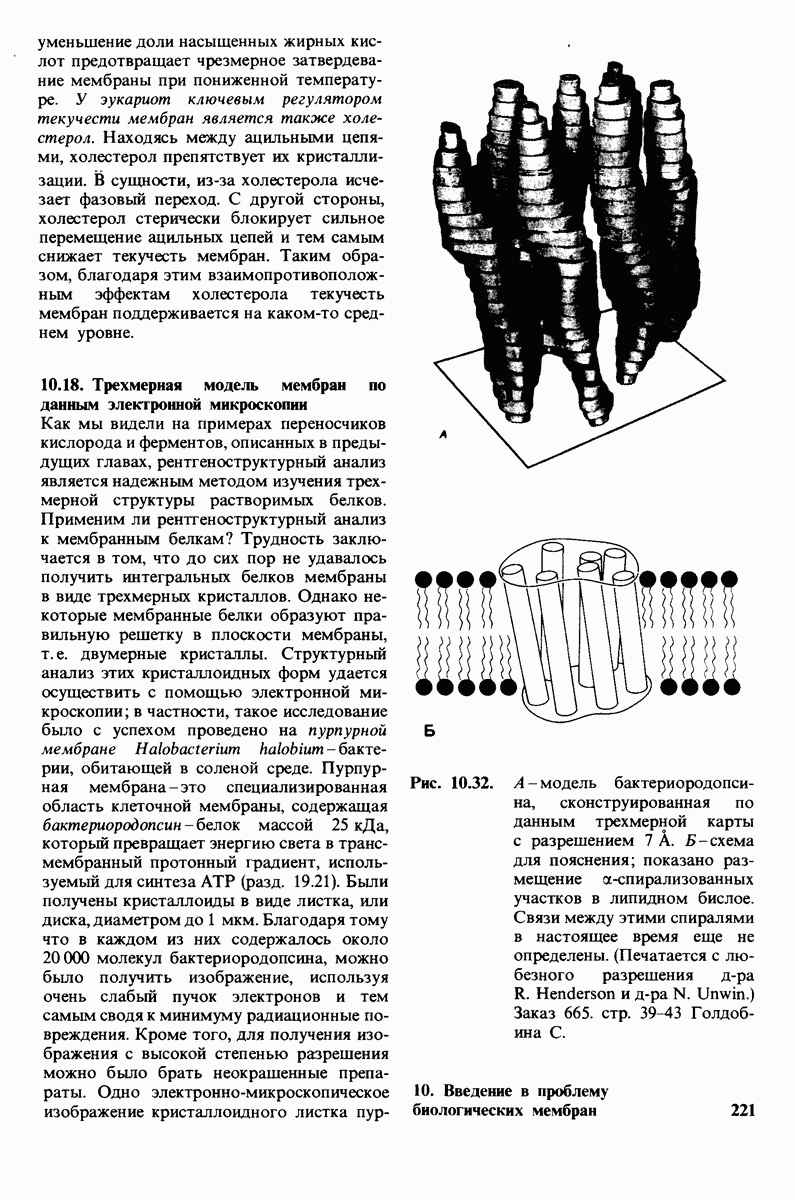
- 10.18. Трехмерная модель мембран по данным электронной микроскопии