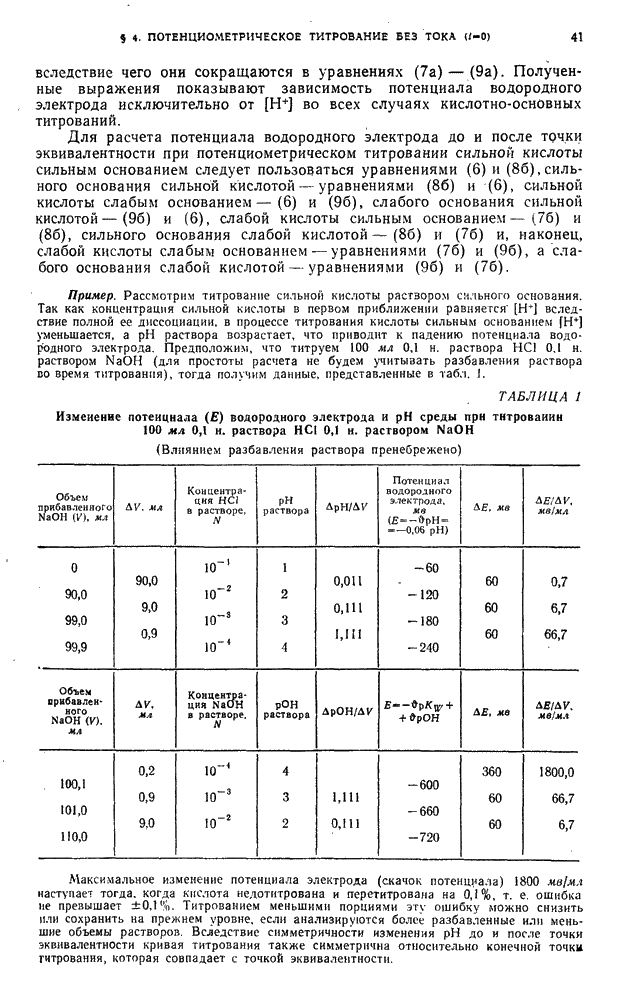
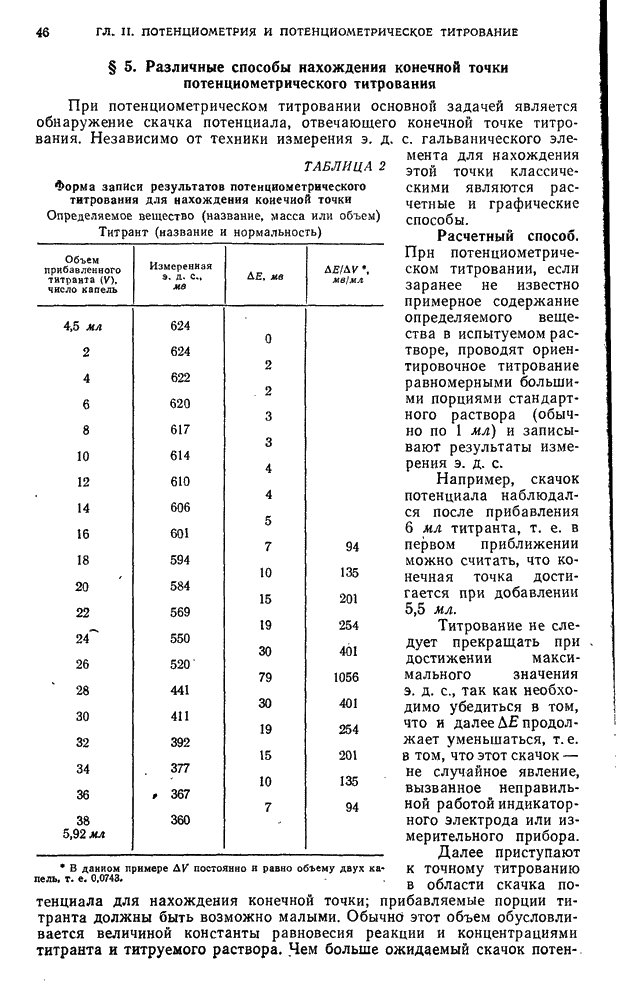
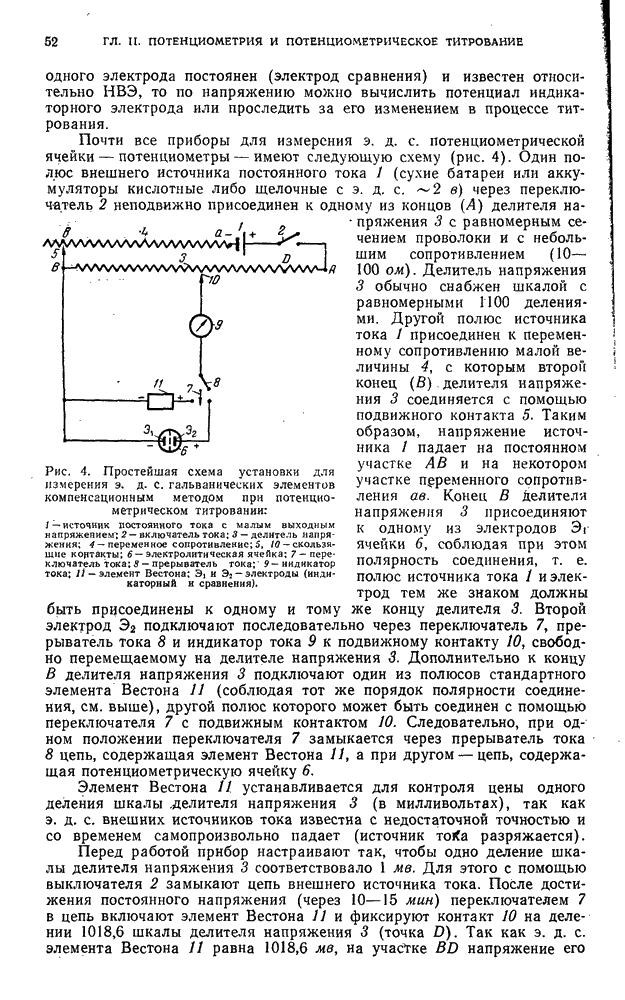
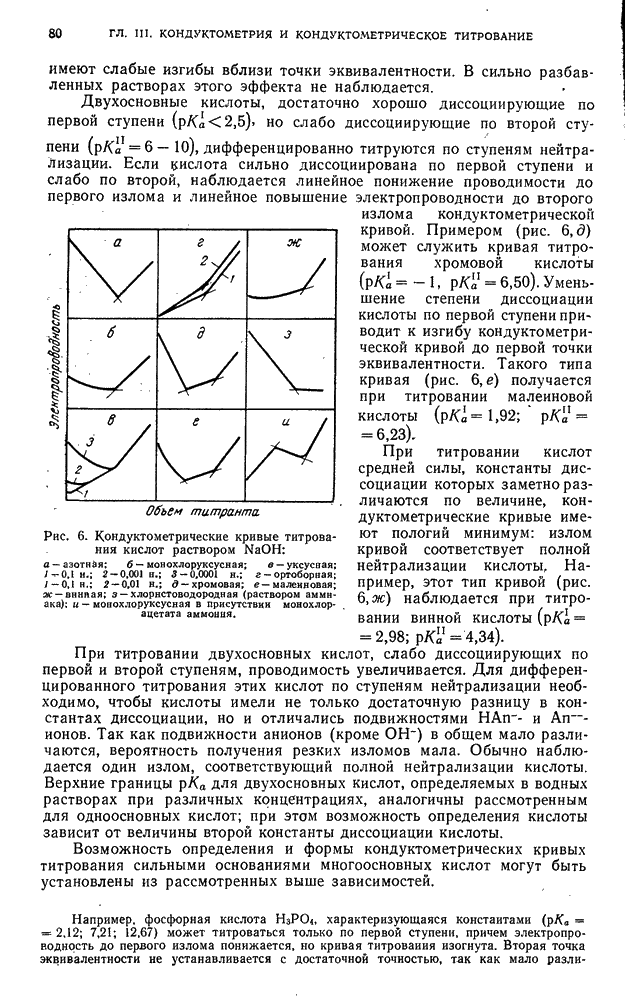
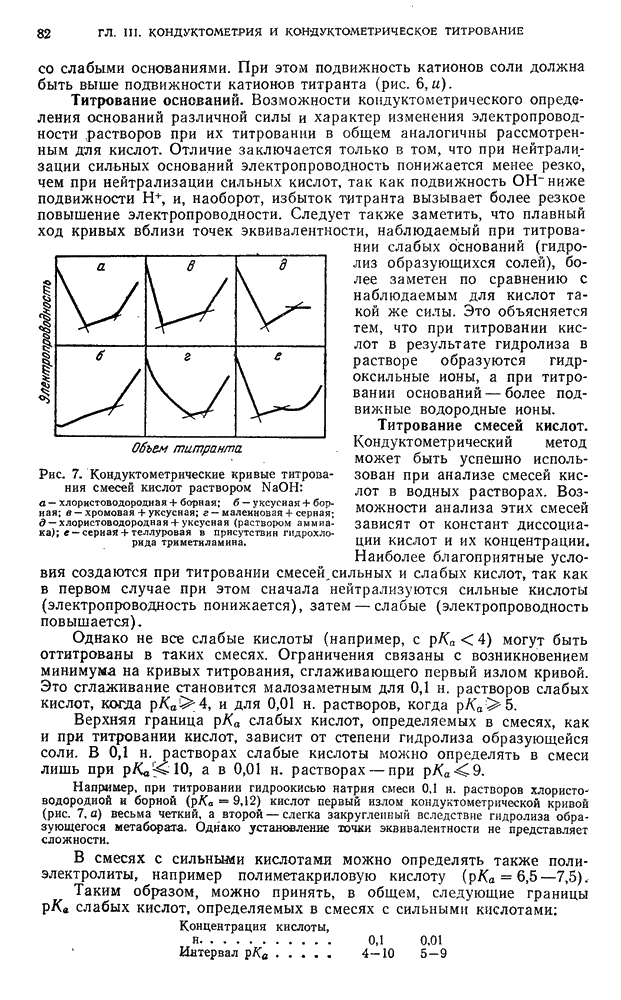
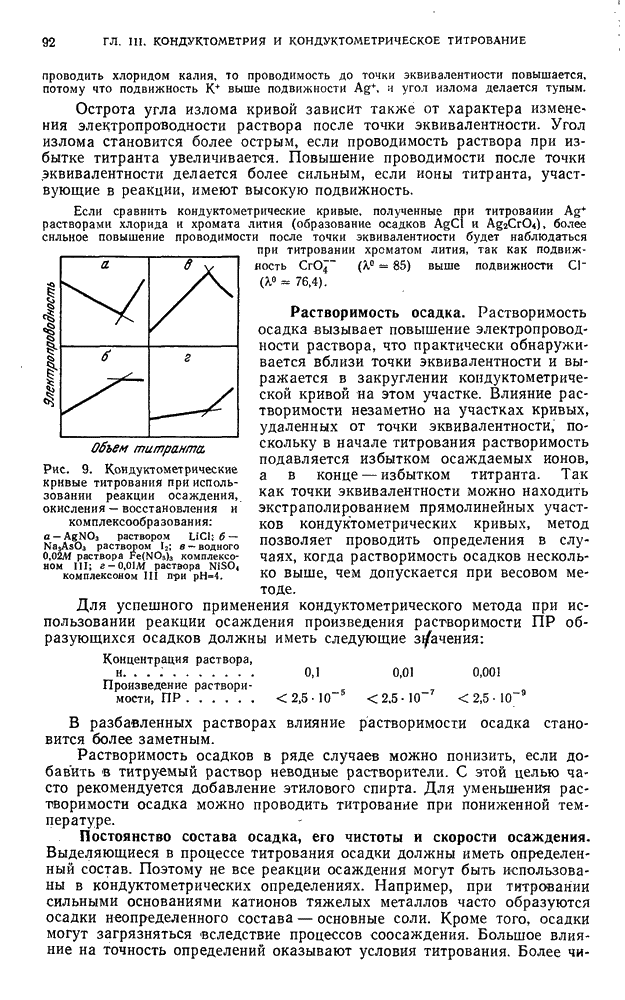
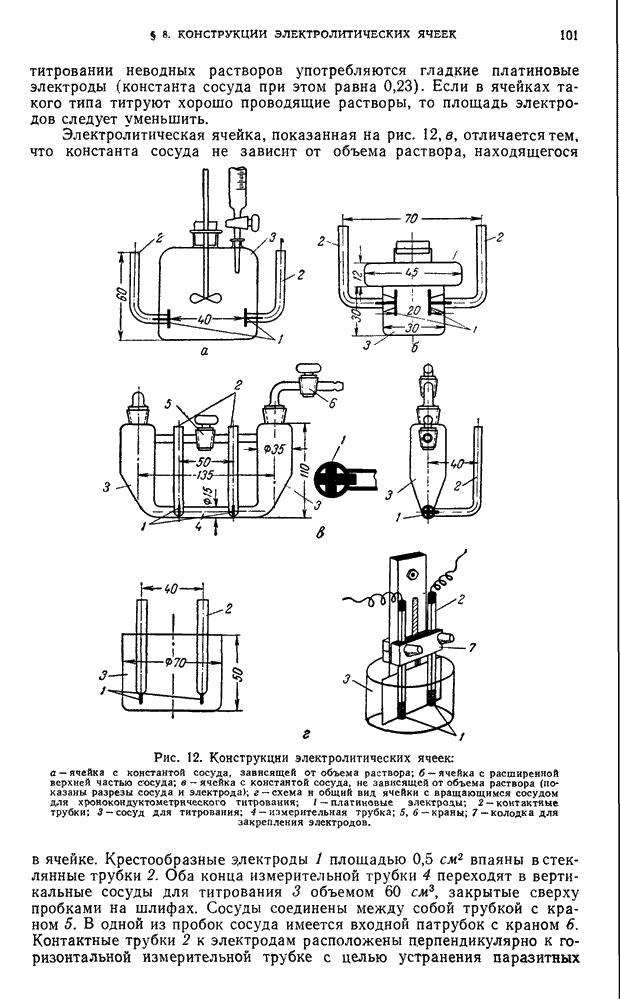
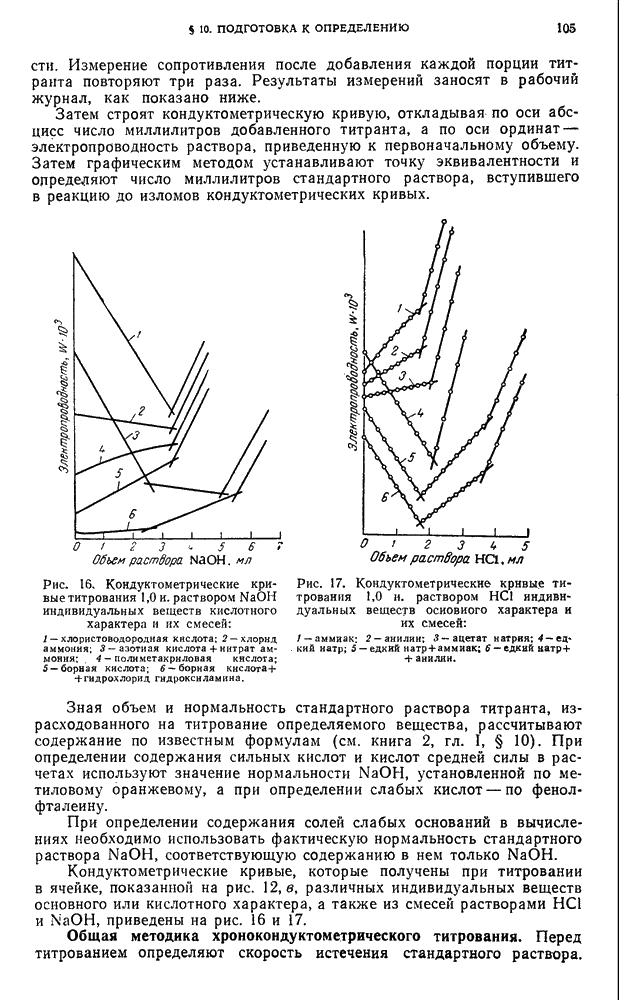
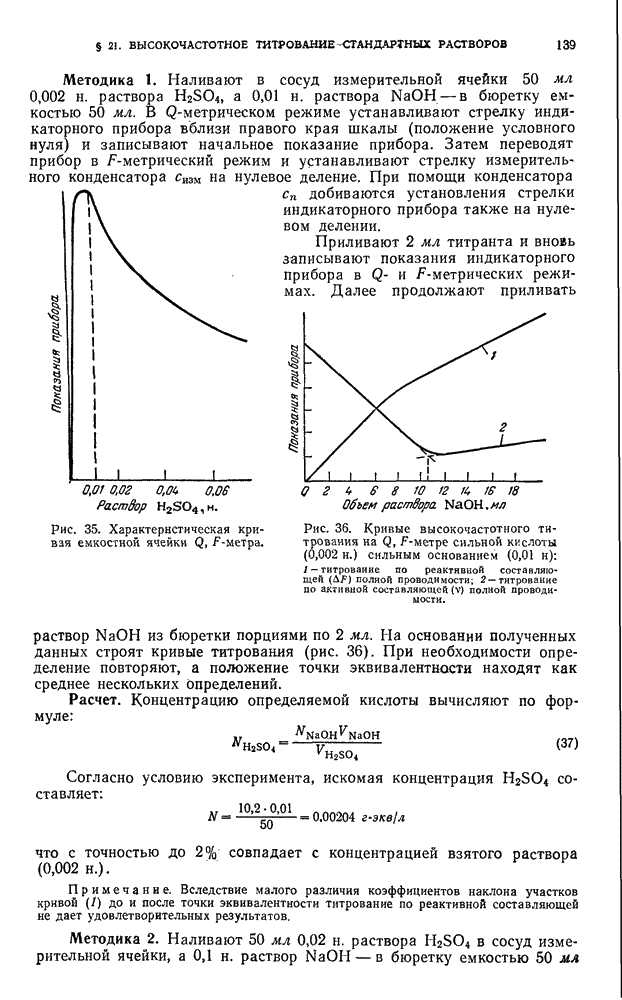
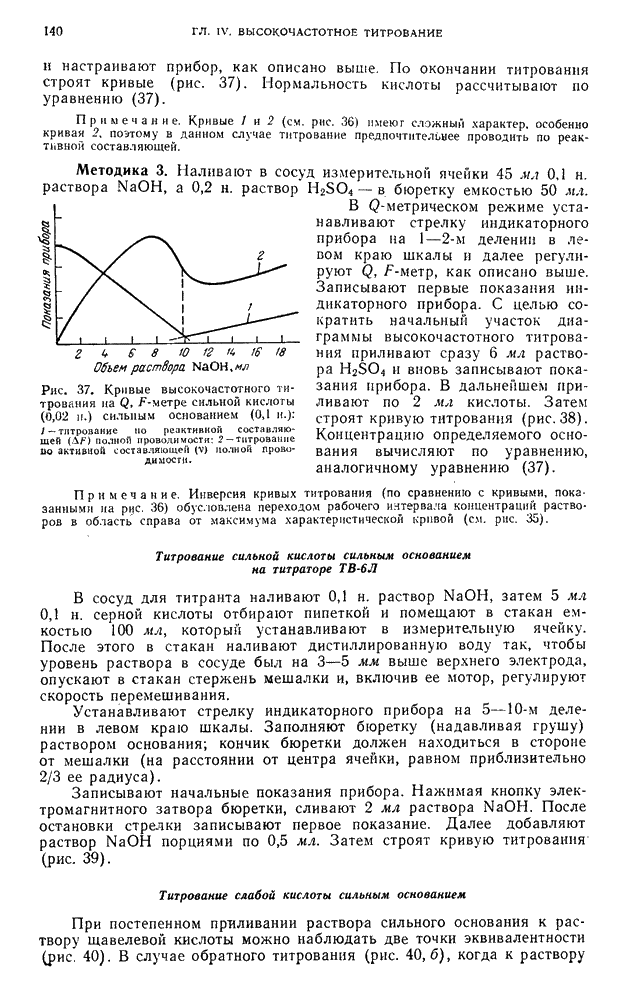
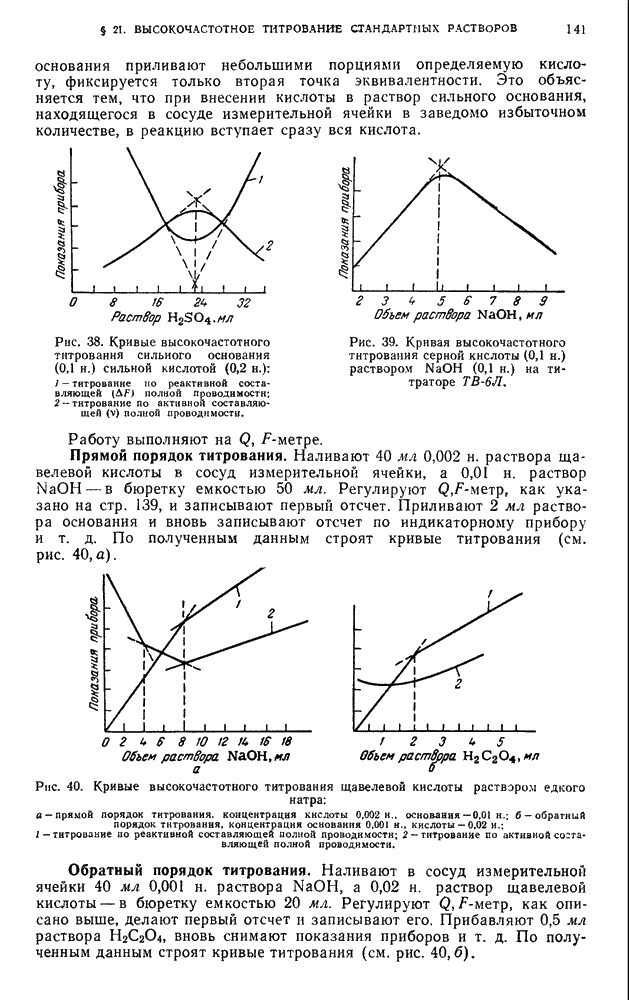
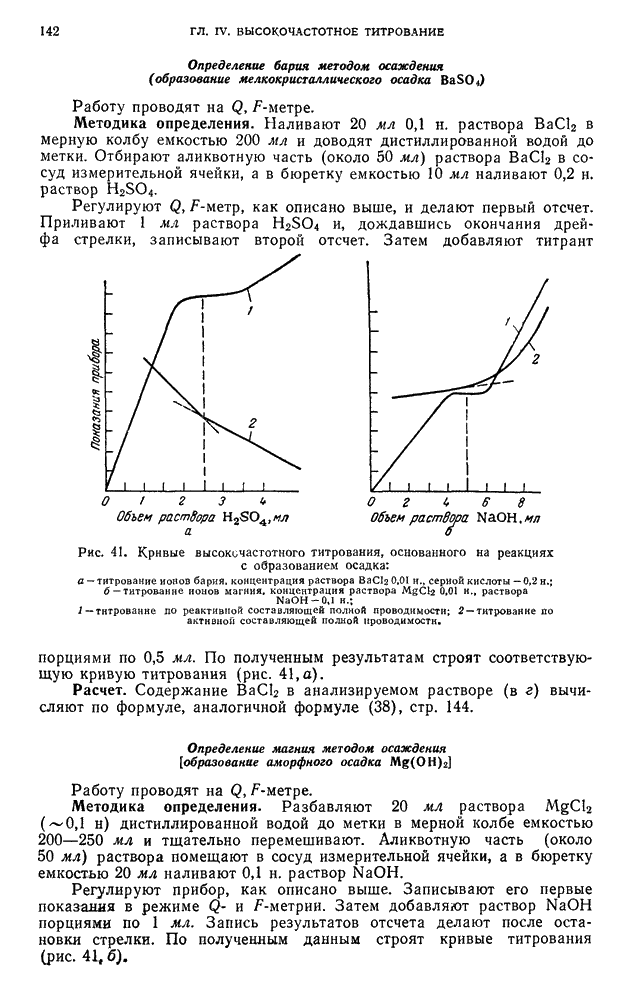
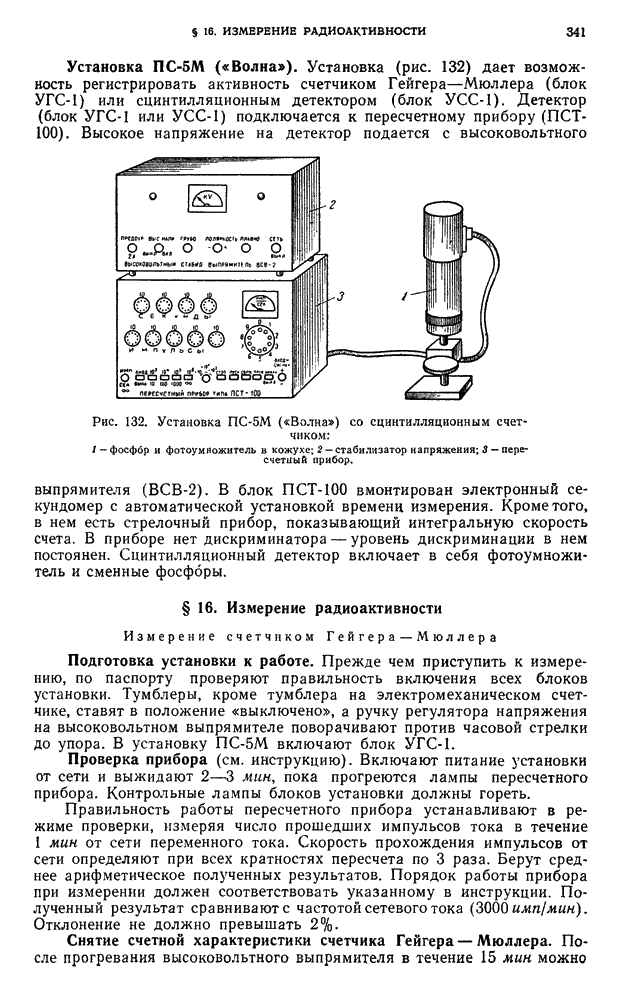
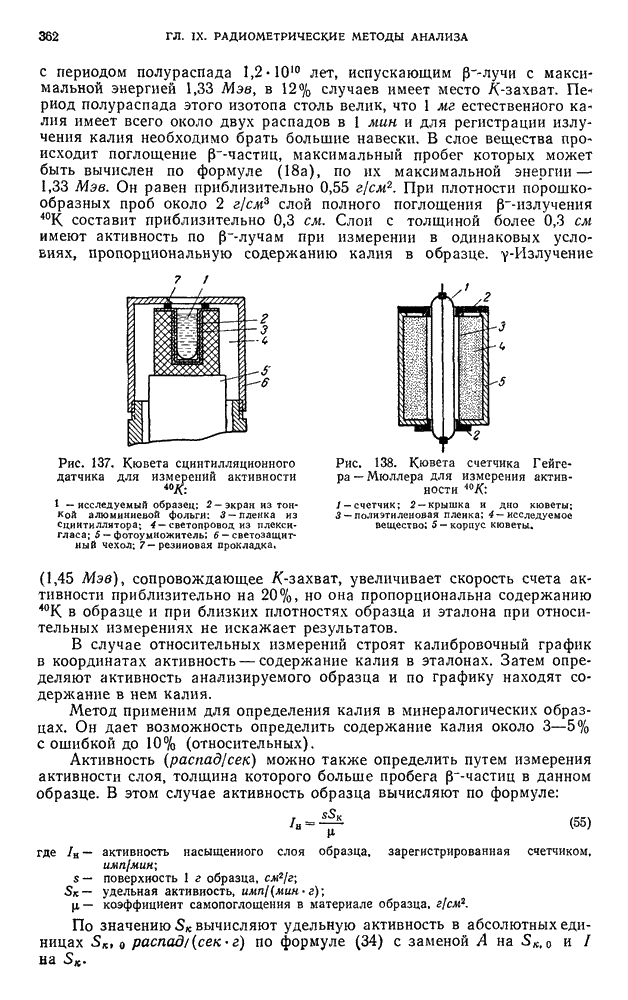
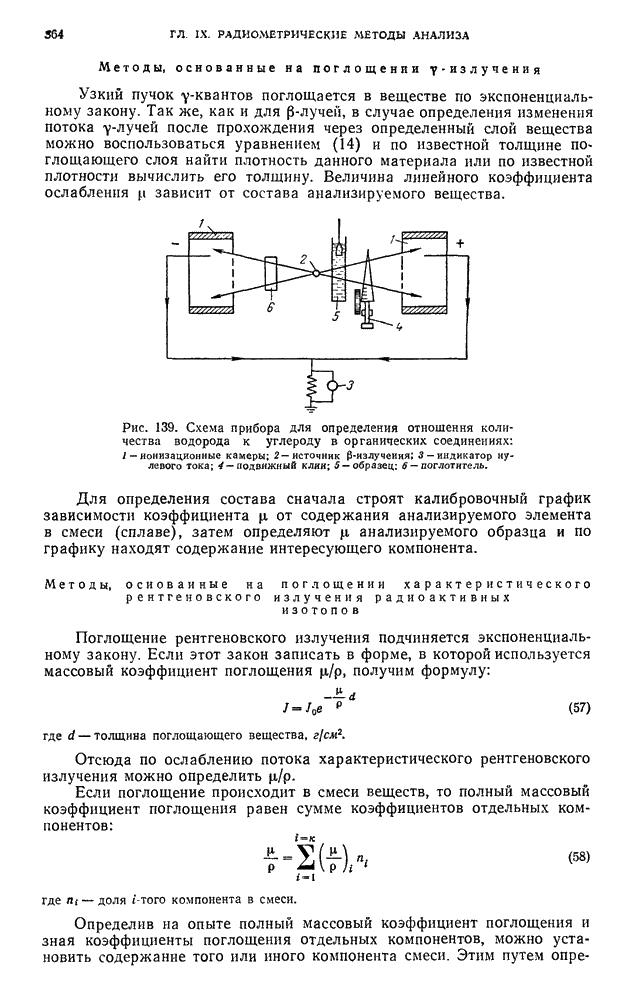
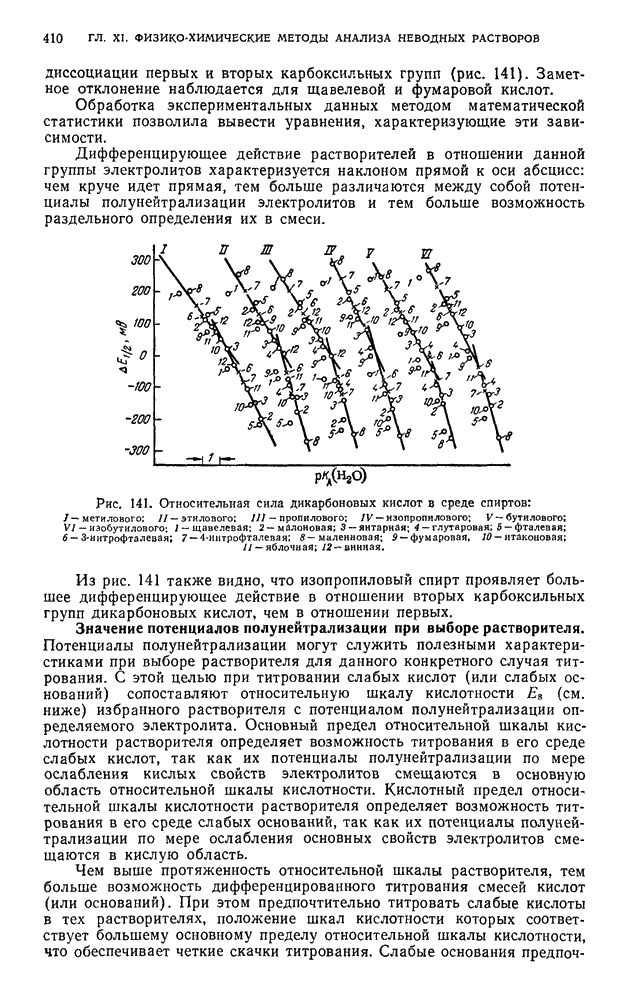
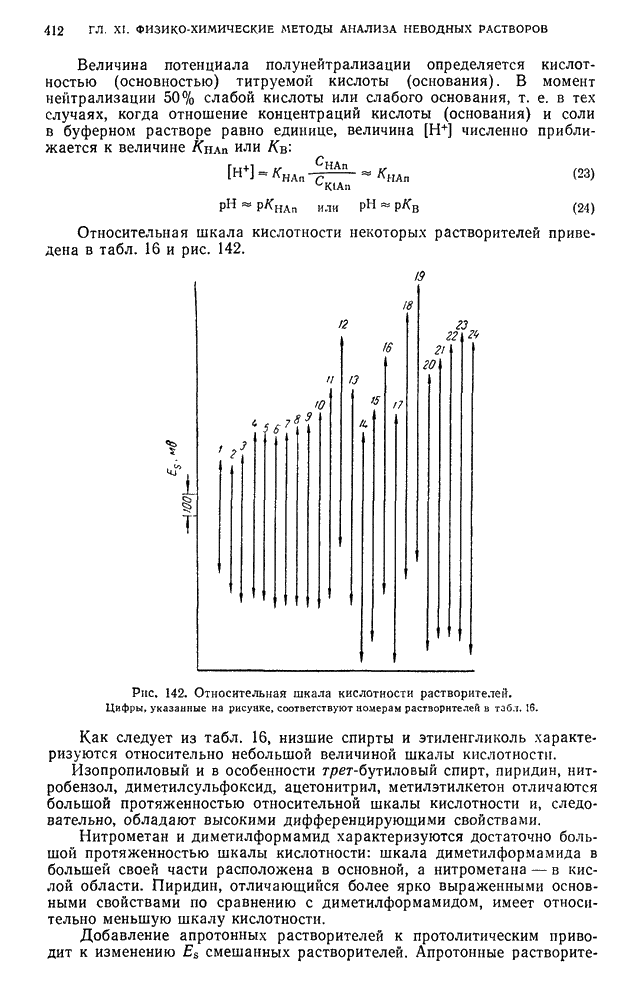
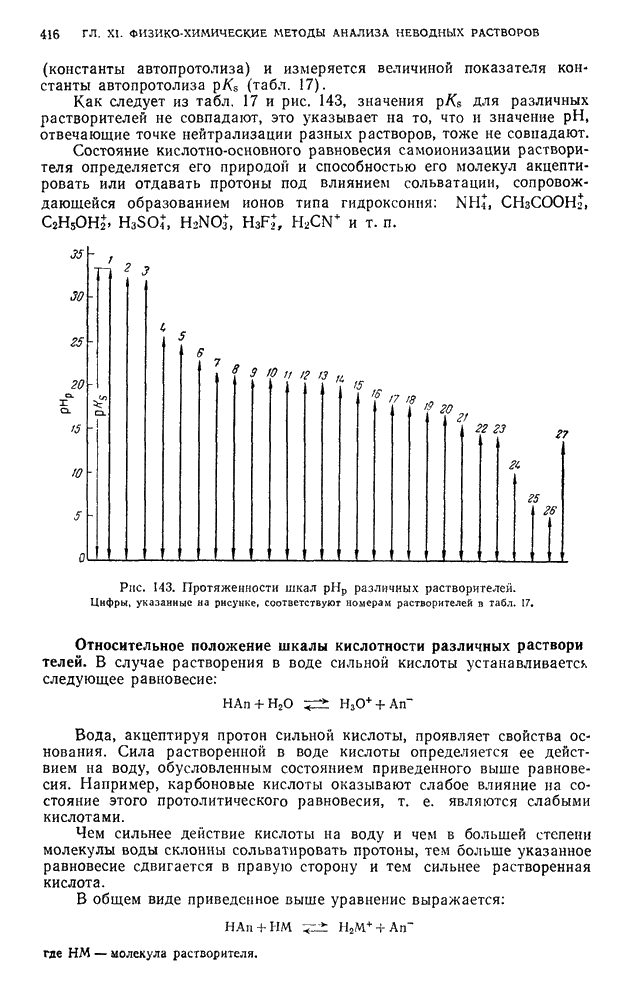
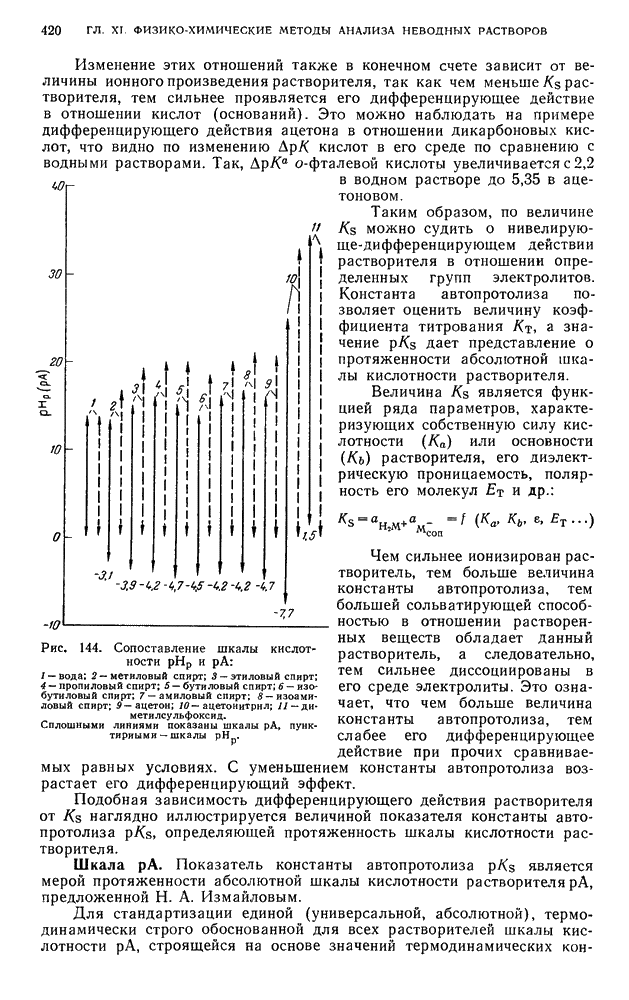
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ГЛАВА XI. ФИЗИКО-ХИМИЧЕСКИЕ (ИНСТРУМЕНТАЛЬНЫЕ) МЕТОДЫ АНАЛИЗА НЕВОДНЫХ РАСТВОРОВ
Новые методы анализа, основанные на использовании реакций, которые протекают в неводных растворах, имеют большое значение.
Прогресс, наблюдаемый в аналитической химии неводных растворов, объясняется многими их особенностями. Основное преимущество использования неводных растворов состоит в том, что в среде неводных растворителей можно дифференцированно (раздельно) титровать многокомпонентные смеси веществ, которые нельзя оттитровать в водных растворах. Например, в неводных средах можно дифференцированно титровать смеси электролитов, характеризующихся близкими значениями  , смеси соединений, относящихся к одному и тому же гомологическому ряду, смеси изомеров и т. п. (см. книга 2, гл. II, § 34).
, смеси соединений, относящихся к одному и тому же гомологическому ряду, смеси изомеров и т. п. (см. книга 2, гл. II, § 34).
А. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
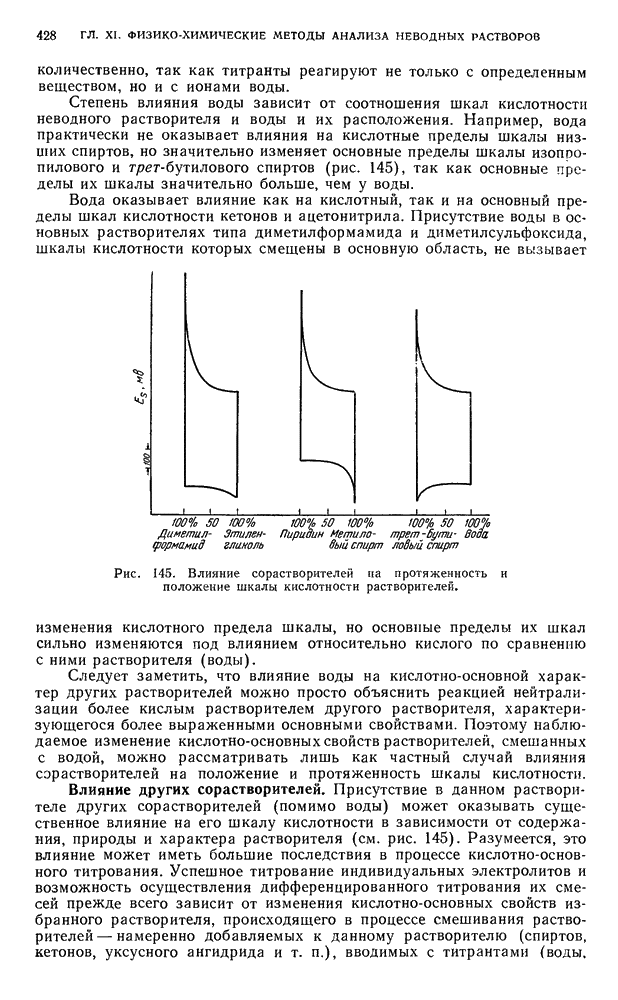
§ 1. Влияние химической природы и физико-химических свойств растворителей на свойства растворенного вещества
Развитие теории аналитической химии неводных растворов. Успешное применение методов титрования неводных растворов оказалось возможным благодаря развитию теории аналитической химии неводных растворов, достигшей уже такого развития, которое позволяет с известной степенью достоверности предвидеть поведение растворенного вещества в данном растворителе, теоретически объяснить процессы, протекающие при титровании разнообразных веществ в неводных средах, предопределить выбор растворителя и титранта для данного конкретного случая титрования, произвести соответствующие количественные расчеты и т. д.
В растворах различных веществ в жидких неводных растворителях и сжиженных газах помимо ионов, предсказываемых теорией электролитической диссоциации, имеются разнообразные ионы и молекулы, вызывающие аномалии в поведении истинных растворов, которые не могут быть объяснены ни гипотезой С. Аррениуса, ни современными теориями Дебая — Хюккеля и Л. Онзагера, поскольку предметом их не является изучение влияния растворителей на свойства электролитов. Следует отметить, что теория Бренстеда и другие теории, предметом которых было исследование влияния растворителей на силу кислот и оснований, также не объясняют аномалий в поведении электролитов в неводных растворах. Как показывают исследования, указанные аномалии обусловливаются взаимодействием растворенного вещества с растворителем.
Влияние индивидуального характера растворителя сказывается на электропроводности, на состоянии ионов в растворах, на преимущественном направлении реакций, на химических свойствах растворенного вещества и т. п.
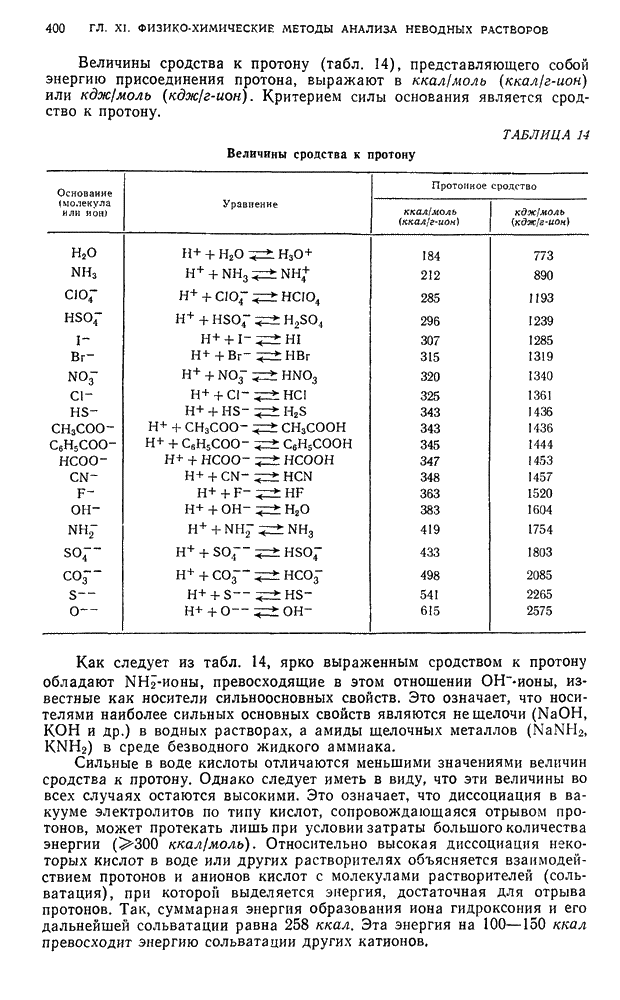
Кислотно-основное взаимодействие растворенного вещества с растворителем. Особый интерес для аналитической химии представляет необычное поведение в неводных растворах многих веществ. Например,  , обладающая в водных растворах свойствами слабой кислоты, ведет себя в жидком аммиаке как сильная кислота, а в среде жидкого фтористого водорода — как основание.
, обладающая в водных растворах свойствами слабой кислоты, ведет себя в жидком аммиаке как сильная кислота, а в среде жидкого фтористого водорода — как основание.
Столь необычное поведение  в различных растворителях объясняется тем, что вода является слабым, а жидкий аммиак — сильным акцептором по отношению к протонам
в различных растворителях объясняется тем, что вода является слабым, а жидкий аммиак — сильным акцептором по отношению к протонам  , т. е. в реакции
, т. е. в реакции

протолитическое равновесие смещено справа налево, а в реакции

протолитическое равновесие смещено слева направо.
Безводный жидкий фтористый водород обладает донорными свойствами и в реакции:

протолитическое равновесие смещено слева направо. Поэтому уксусная и муравьиная кислоты и фенолы, проявляющие в водных растворах кислые свойства, ведут себя в среде жидкого аммиака как сильные кислоты, а в среде жидкого фтористого водорода — как основания.
В растворителях типа безводной уксусной кислоты кислые свойства проявляют лишь те минеральные кислоты, которые являются сильными кислотами в водных растворах. Все органические кислоты, как правило, не проявляют в протогенных растворителях кислых свойств. В еще более протогенных растворителях типа безводной серной кислоты или жидкого фтористого водорода они в ряде случаев обнаруживают свойства оснований. Это специфическое действие кислых растворителей на кислоты в обычном смысле понимания связано со сродством к протону молекул и анионов кислот  , растворенных в протогенном растворителе (НМ).
, растворенных в протогенном растворителе (НМ).
Аналогично в основных растворителях типа безводного аммиака основные свойства проявляют лишь те из оснований, которые обладают сильноосновным характером в водных растворах.
Следовательно, сила основания возрастает с увеличением кислотности, а сила кислоты — с увеличением основности растворителя. Сила основания или кислоты связана также с величиной диэлектрической проницаемости  растворителя.
растворителя.
А. М. Шкодин показал, что  кислот, оснований и солей в кислых растворителях одной химической природы является линейной функцией
кислот, оснований и солей в кислых растворителях одной химической природы является линейной функцией  — величины, обратной диэлектрической проницаемости среды.
— величины, обратной диэлектрической проницаемости среды.
Таким образом, сила данной кислоты или основания, а также характер кривых титрования зависят не только от природы растворенного вещества, но и от свойств растворителя и величины его диэлектрической проницаемости.
Самой сильной кислотой в растворителе (НМ) является сольватированный протон  (ионы лиония) и сильнейшим основанием ионы
(ионы лиония) и сильнейшим основанием ионы  лиата
лиата  .
.
Количественная зависимость силы кислот и оснований от свойств растворителя и растворенного вещества. Для характеристики изменения свойств электролитов под влиянием растворителей можно воспользоваться выведенным Н. А. Измайловым основным уравнением, характеризующим влияние растворителей на силу электролита:

где  константа диссоциации, измеренная обычными методами и выражающая отношение произведения активностей свободных ионов к сумме активностей недиссоциированных частиц электролита;
константа диссоциации, измеренная обычными методами и выражающая отношение произведения активностей свободных ионов к сумме активностей недиссоциированных частиц электролита;  — для кислот эта величина определяется константами двух равновесий — константой собственной кислотности кислоты
— для кислот эта величина определяется константами двух равновесий — константой собственной кислотности кислоты  характеризующейся сродством аниона кислоты к протону и константой собственной кислотности ионов лиония растворителя
характеризующейся сродством аниона кислоты к протону и константой собственной кислотности ионов лиония растворителя  характеризующейся сродством молекулы растворителя к протону или обратной ей величиной — константой собственной основности растворителя
характеризующейся сродством молекулы растворителя к протону или обратной ей величиной — константой собственной основности растворителя  , т. е.
, т. е.

Для оснований величина Кяяег, определяется константами собственной основности основания  и константой собственной основности ионов лиата растворителя
и константой собственной основности ионов лиата растворителя 
или обратной ей величиной  константой собственной кислотности растворителя
константой собственной кислотности растворителя  , нм, т. е.
, нм, т. е.

где  — сумма энергий сольватации ионов
— сумма энергий сольватации ионов  ;
;  — энергия сольватации молекул.
— энергия сольватации молекул.
Для кислоты величина  . представляет собой энергию сольватации протона,
. представляет собой энергию сольватации протона, 
складывающуюся из энергии присоединения протона к молекуле растворителя НМ, т. е. образования иона лиония  , и энергии его сольватации.
, и энергии его сольватации.
Для основания величина  выражает энергию сольватации
выражает энергию сольватации  -иона, образующегося в процессе взаимодействия молекулы основания с ионами водорода растворителя;
-иона, образующегося в процессе взаимодействия молекулы основания с ионами водорода растворителя;
А — энергия образования и сольватации иона лиата  .
.
Частными случаями приведенного выше уравнения (1) являются: для кислот

для оснований

Пользуясь этими уравнениями, можно проследить влияние протогенных и протофильных растворителей на силу электролитов. Зависимость значения  от величины, обратной диэлектрической проницаемости среды, характеризует влияние диэлектрических свойств растворителей на силу электролитов. В растворителях с высокой диэлектрической проницаемостью, например в воде, для кислот устанавливается следующая система равновесий:
от величины, обратной диэлектрической проницаемости среды, характеризует влияние диэлектрических свойств растворителей на силу электролитов. В растворителях с высокой диэлектрической проницаемостью, например в воде, для кислот устанавливается следующая система равновесий:

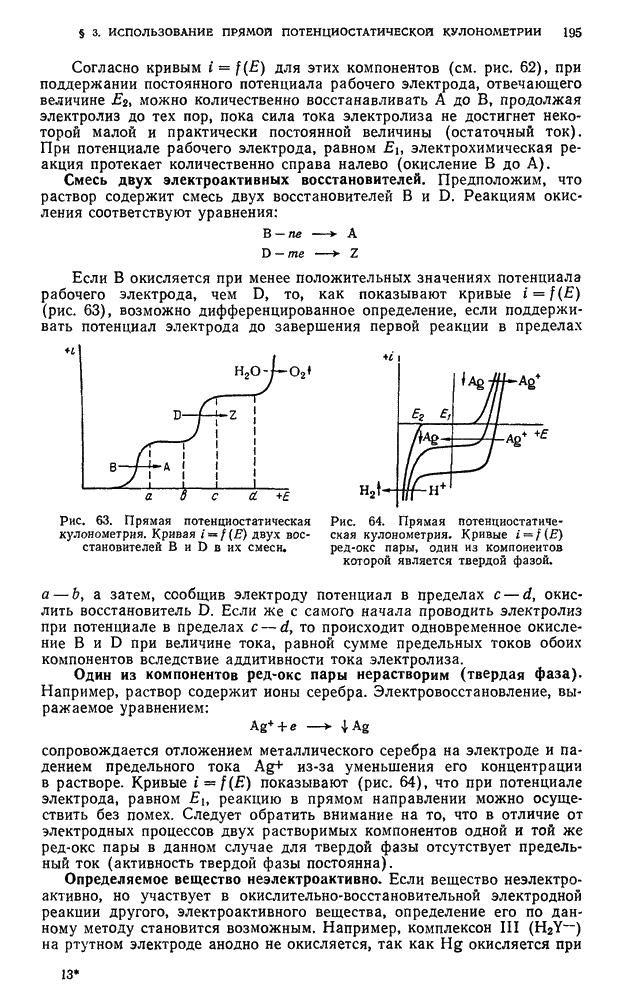
Ионная пара  в таких растворителях является сильным электролитом и практически полностью диссоциирует на ионы
в таких растворителях является сильным электролитом и практически полностью диссоциирует на ионы  . Поэтому
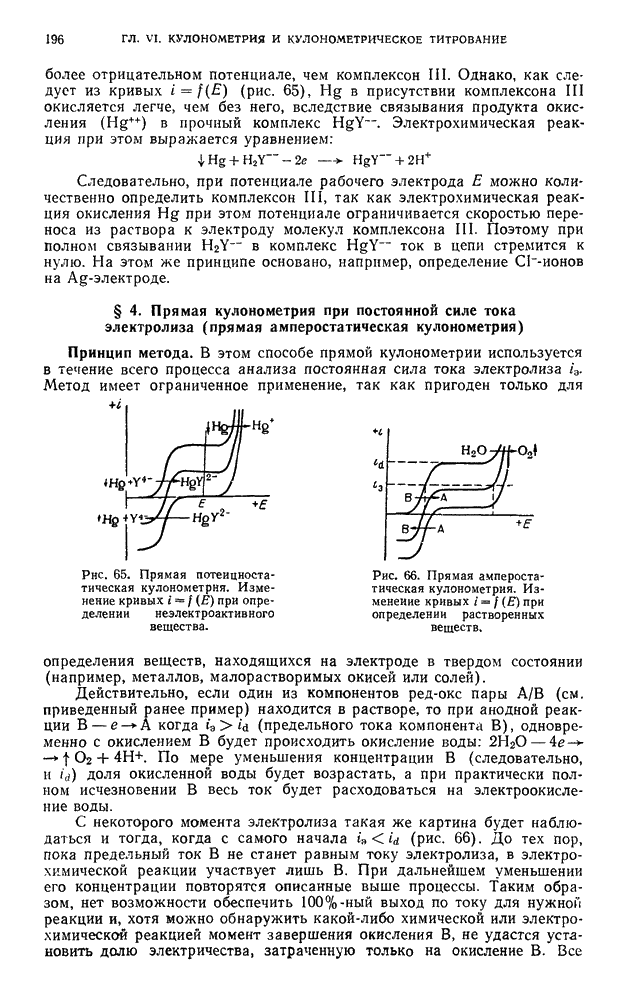
. Поэтому

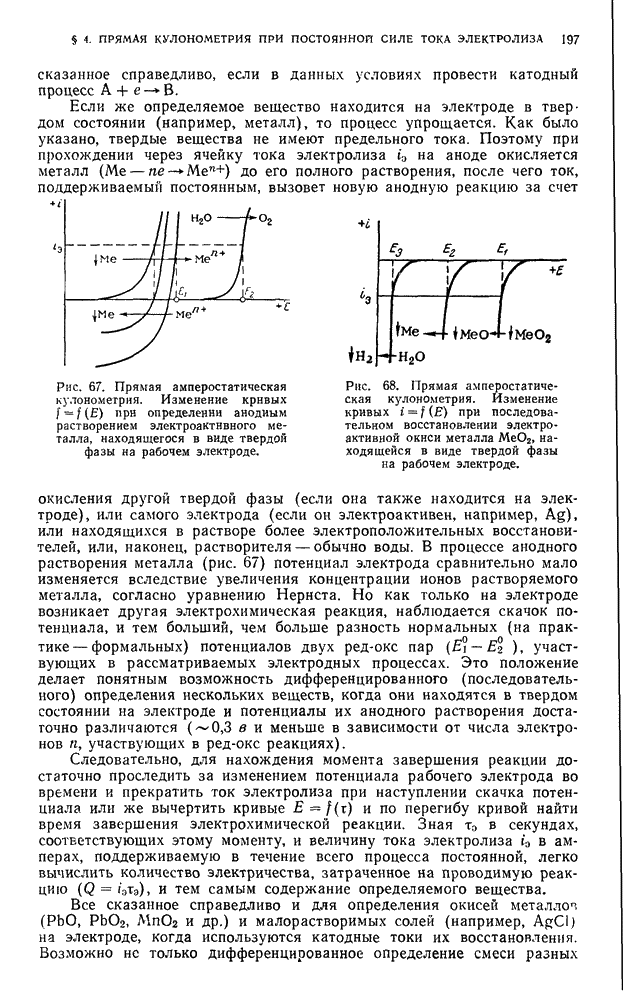
Величина  является количественной мерой силы кислоты.
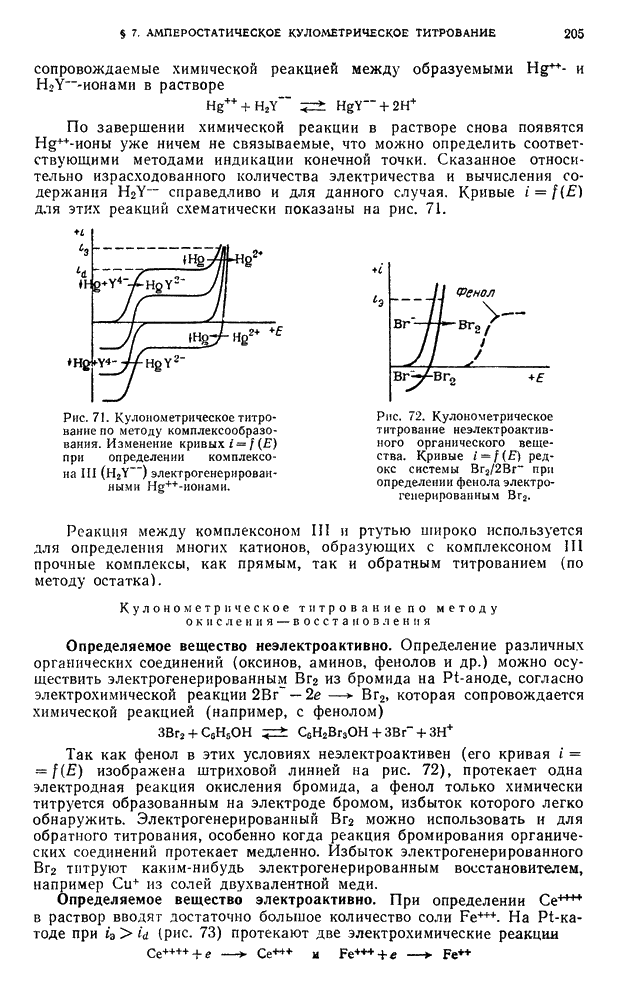
является количественной мерой силы кислоты.
В растворителях, подобных безводной уксусной кислоте, т. е. обладающих низкой диэлектрической проницаемостью, даже самые сильные электролиты лишь очень слабо диссоциируют на ионы. В таких средах преобладают ионные пары с малыми константами диссоциации.
Образование ионных пар можно рассматривать по Кольтгофу как процесс ионизации, а распад ионных пар на ионы — как процесс диссоциации. Эти процессы в среде безводной уксусной кислоты можно выразить следующими уравнениями:
для сильной кислоты 

для сильного основания (В):

т. е.

где  — константы равновесия, отражающие процессы ионизации кислоты
— константы равновесия, отражающие процессы ионизации кислоты
и основания; а — активности.
Константы диссоциации кислоты или основания можно выразить следующими уравнениями:

Константа диссоциации  может быть представлена в виде следующего уравнения:
может быть представлена в виде следующего уравнения:

где  — активность недиссоциированных молекул растворенного вещества, представляющая собой сумму активностей свободных молекул кислоты
— активность недиссоциированных молекул растворенного вещества, представляющая собой сумму активностей свободных молекул кислоты  и активностей ионных пар
и активностей ионных пар 
Или

Из уравнения (7) находим:

Следовательно

Подставляя значение  из уравнения (7), получим:
из уравнения (7), получим:

Отсюда [см. уравнение (9)] получим:

Аналогично можно получить общую константу диссоциации основания  :
:

Величины  , по мнению Кольтгофа и Брукенстейна, дают лучшее представление о силе кислоты или основания в неводном растворителе, чем обычные константы равновесия. Однако уравнения, описывающие
, по мнению Кольтгофа и Брукенстейна, дают лучшее представление о силе кислоты или основания в неводном растворителе, чем обычные константы равновесия. Однако уравнения, описывающие  и К ион, представляют собой лишь частный случай общего уравнения Н. А. Измайлова.
и К ион, представляют собой лишь частный случай общего уравнения Н. А. Измайлова.
Согласно Измайлову, диссоциация кислот, солей и оснований на ионы в водных и неводных растворах зависит от ряда сопряженных динамических равновесий: образования сольватов — продуктов присоединения электролита к молекулам растворителя, диссоциации сольватов с образованием сольватированных ионов лиония и лиата, ассоциации сольватированных ионов с образованием ионных пар, или двойников. Соотношения между активными концентрациями продуктов этих реакций зависят от свойств растворенного электролита и растворителя, а также от их концентраций.
Константа диссоциации  , определяемая обычными методами, эквивалентна общей константе диссоциации и выражается по Измайлову следующим образом (см. книга 2, гл. II, § 33):
, определяемая обычными методами, эквивалентна общей константе диссоциации и выражается по Измайлову следующим образом (см. книга 2, гл. II, § 33):

где  — константа равновесия, отражающего процесс диссоциации образовавшегося продукта присоединения на сольватированные ионы;
— константа равновесия, отражающего процесс диссоциации образовавшегося продукта присоединения на сольватированные ионы;  — константа нестойкости, отражающая процесс образования продуктов присоединения молекул электролита к молекулам растворителя;
— константа нестойкости, отражающая процесс образования продуктов присоединения молекул электролита к молекулам растворителя;  — константа, отражающая процесс превращения недиссоциированного продукта в ионные пары;
— константа, отражающая процесс превращения недиссоциированного продукта в ионные пары;  .
.
Обратная величина константы ассоциации по Измайлову эквивалентна константе диссоциации по Кольтгофу:

В ряде случаев уравнение (14) принимает частные значения. Например, при условии, когда  значительно меньше 1:
значительно меньше 1:

Пользуясь этими уравнениями, можно решать многие вопросы, интересующие химиков-аналитиков подобно тому, как применение закона действия масс в его классической форме дает возможность решать задачи, связанные с использованием водных растворов.
Реакции титрования. Вследствие малой диэлектрической проницаемости некоторых неводных растворителей типа безводной уксусной кислоты все известные кислоты и основания мало диссоциированы в них. Наиболее сильной кислотой в среде безводной уксусной кислоты является хлорная кислота  Серная кислота в безводной уксусной кислоте проявляет себя более слабой кислотой
Серная кислота в безводной уксусной кислоте проявляет себя более слабой кислотой  чем сама уксусная в водном растворе
чем сама уксусная в водном растворе  Поэтому для титрования слабых оснований в неводных растворах очень часто применяют растворы хлорной кислоты в безводной уксусной кислоте и диоксане. Как показали наши исследования, лучшим растворителем для хлорной кислоты является метилэтилкетон или смесь растворителей: безводная уксусная кислота — уксусный ангидрид. В качестве титрантов оснований широко используются также
Поэтому для титрования слабых оснований в неводных растворах очень часто применяют растворы хлорной кислоты в безводной уксусной кислоте и диоксане. Как показали наши исследования, лучшим растворителем для хлорной кислоты является метилэтилкетон или смесь растворителей: безводная уксусная кислота — уксусный ангидрид. В качестве титрантов оснований широко используются также  -толуолсульфокислота и хлористоводородная кислота. Процессы, протекающие при титровании органических оснований
-толуолсульфокислота и хлористоводородная кислота. Процессы, протекающие при титровании органических оснований  в среде протогенных растворителей, можно представить в виде уравнений:
в среде протогенных растворителей, можно представить в виде уравнений:

Для титрования кислот в неводных растворах применяют преимущественно органические основания, имеющие малые значения  . Большей частью применяют гидроокиси тетраалкиламмония, например гидроокись тетраэтиламмония.
. Большей частью применяют гидроокиси тетраалкиламмония, например гидроокись тетраэтиламмония.
Процессы, протекающие при титровании кислот в неводных растворителях, можно представить в виде уравнений:

Кислотные или основные свойства электролитов в неводных растворах объясняются в известной мере тем, что соответствующие продукты реакции растворенного электролита с молекулами растворителя, подобно аквакомплексиым соединениям (а), сообщают растворам кислую или щелочную реакцию среды вследствие диссоциации по типу кислот (б) или по типу оснований (в):

Существование в неводных растворах кислот и оснований, не содержащих в своем составе ионов водорода или гидроксил-ионов, может быть объяснено свойствами соединений, склонных акцептировать молекулы и ионы, являющиеся носителями кислых и основных свойств:  и ОН- — в водных растворах;
и ОН- — в водных растворах;  — в среде жидкого аммиака;
— в среде жидкого аммиака;  среде безводной уксусной кислоты и т. д.
среде безводной уксусной кислоты и т. д.
В процессе титрования под воздействием кислот или оснований динамические равновесия смещаются, а координированно связанные молекулы растворителя, являясь акцепторами или донорами протонов или соответствующих анионов, реагируют с образованием продуктов нейтрализации.
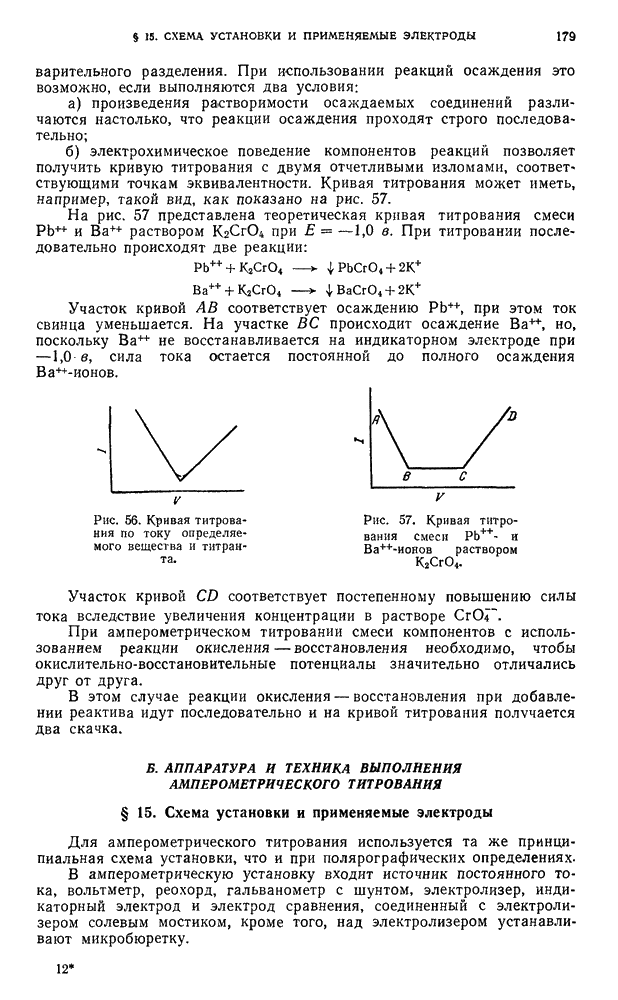
Изменение в соотношении силы электролитов. Под влиянием растворителей изменяется не только сила электролитов, но и соотношение в их силе. Указанное положение особенно применимо к кислотам и основаниям различной природы, растворимым в растворителях с низкой диэлектрической проницаемостью. Это дает возможность осуществлять дифференцированное титрование смесей кислот или оснований, а также многоосновных кислот и оснований.
С другой стороны, в зависимости от избранного растворителя меняется отношение:

где  — ионное произведение данного растворителя.
— ионное произведение данного растворителя.
Возможность осуществления того или иного конкретного случая титрования в неводных растворах основана на выборе соответствующих растворителей.
Интересно, что во многих случаях, когда в неводных растворителях титруют слабые электролиты, изменение  кислот и оснований происходит аналогично изменениям, наблюдающимся при нейтрализации сильного основания сильной кислотой в водных растворах, и получаемые кривые нейтрализации имеют резкие скачки титрования. Это объясняется большой протяженностью шкалы
кислот и оснований происходит аналогично изменениям, наблюдающимся при нейтрализации сильного основания сильной кислотой в водных растворах, и получаемые кривые нейтрализации имеют резкие скачки титрования. Это объясняется большой протяженностью шкалы  неводных растворителей, характеризующихся очень малым значением
неводных растворителей, характеризующихся очень малым значением  . Поэтому в среде неводных растворителей с
. Поэтому в среде неводных растворителей с  . сильно превышающем
. сильно превышающем  , возможно дифференцированно титровать слабые и очень слабые кислоты (или основания) и соединения, нерастворимые в воде, разлагаемые водой и образующие с водой стойкие нерасслаивающиеся эмульсии.
, возможно дифференцированно титровать слабые и очень слабые кислоты (или основания) и соединения, нерастворимые в воде, разлагаемые водой и образующие с водой стойкие нерасслаивающиеся эмульсии.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- ГЛАВА I. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКИХ (ИНСТРУМЕНТАЛЬНЫХ) МЕТОДОВ АНАЛИЗА
- § 1. Особенности физико-химических методов анализа
- § 2. Области применения инструментальных методов анализа
- § 3. Анализ веществ высокой чистоты
- § 4. Повышение чувствительности и точности методов определения следов примесей
- § 5. Инструментальные методы титрования
- § 6. Применение физико-химических методов анализа для определения индивидуальных соединений
- § 7. Применение физико-химических методов для анализа смесей веществ
- § 8. Классификация инструментальных количественных методов анализа
- § 9. Электрохимические методы анализа
- § 10. Спектральные (оптические) методы анализа
- § 11. Хроматографические методы анализа
- § 12. Радиометрические методы анализа
- § 13. Масс-спектрометрические методы анализа
- § 14. Физико-химический анализ по Н. С. Курнакову
- § 15. Другие методы анализа
- ГЛАВА II. ПОТЕНЦИОМЕТРИЯ И ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 1. Зависимость величины электродных потенциалов от концентрации (активности)
- § 2. Применение потенциометрического метода анализа
- § 3. Потенциометрическое титрование
- § 4. Потенциометрическое титрование без тока (i=0)
- § 5. Различные способы нахождения конечной точки потенциометрического титрования
- § 6. Некомпенсационный метод потенциометрического титрования
- § 7. Потенциометрическое титрование под током (i != 0)
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 8. Измерение электродвижущей силы
- § 9. Установка для поляризации электродов при потенциометрическом титровании под током
- § 10. Некоторые приборы, применяемые в потенциометрическом титровании
- § 11. Электроды
- В. ПРАКТИЧЕСКИЕ РАБОТЫ ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ БЕЗ ТОКА (i=0)
- § 12. Кислотно-основное титрование
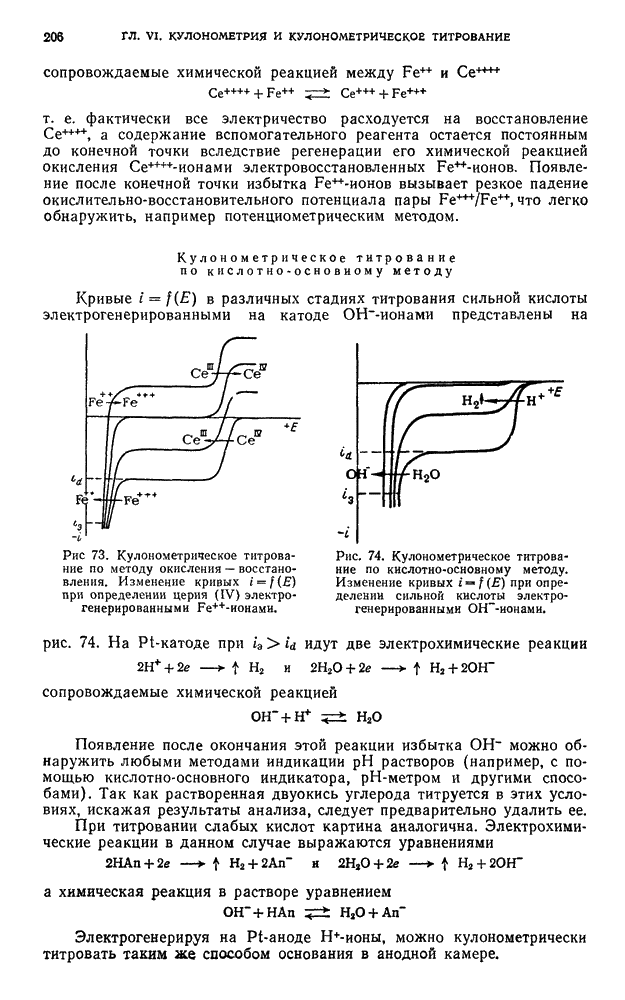
- § 13. Титрование по методу окисления — восстановления
- § 14. Титрование по методу осаждения
- § 15. Титрование по методу комплексообразования
- ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ ПОД ТОКОМ (i != 0)
- § 16. Титрование по методу окисления — восстановления
- ГЛАВА III. КОНДУКТОМЕТРИЯ и КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 1. Удельная и эквивалентная электропроводность
- § 2. Кондуктометрическне методы анализа
- § 3. Кислотно-основное титрование
- § 4. Титрование, основанное на реакциях осаждения
- § 5. Титрование, основанное на реакциях окисления — восстановления
- § 6. Титрование, основанное на реакциях комплексообразования
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 7. Измерение электропроводности растворов
- § 8. Конструкции электролитических ячеек
- § 9. Измерения в хронокондуктометрическом титровании
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 10. Подготовка к определению
- §11. Определение индивидуальных кислот методом кондуктометрического титрования
- § 12. Определение индивидуальных оснований методом кондуктометрического титрования
- § 13. Анализ смесей оснований методом кондуктометрического титрования
- § 14. Определение солей методом кондуктометрического титрования
- § 15. Анализ смесей кислот и солей слабых оснований методом кондуктометрического титрования
- § 16. Анализ смесей кислот методом хронокондуктометрического титрования
- § 17. Анализ смесей оснований и солей слабых кислот методом хронокондуктометрического титрования
- ГЛАВА IV. ВЫСОКОЧАСТОТНОЕ ТИТРОВАНИЕ
- § 1. Общие положения теории высокочастотного титрования
- § 2. Физические основы и погрешности метода высокочастотного титрования
- § 3. Физические основы метода диэлкометрического титрования
- § 4. Погрешности метода диэлкометрического титрования
- ТЕОРИЯ ИЗМЕРИТЕЛЬНЫХ ЯЧЕЕК ЕМКОСТНОГО ТИПА
- § 5. Электрическая эквивалентная схема ячейки и физические процессы, протекающие в ее объеме
- § 6. Импеданс и полная проводимость ячейки
- § 7. Характеристические кривые ячейки
- § 8. Чувствительность ячейки
- § 9. Критерий применимости и постоянная с-ячейки
- ТЕОРИЯ ИЗМЕРИТЕЛЬНЫХ ЯЧЕЕК ИНДУКТИВНОГО ТИПА
- § 10. Электрическая эквивалентная схема ячейки
- § 11. Импеданс и характеристические кривые ячейки
- § 12. Критерий применимости и постоянная L-ячейки
- § 13. Влияние на характеристические кривые ячейки ее некомпенсированного электрического поля
- ДИАГРАММЫ СООТВЕТСТВИЯ
- § 14. Диаграмма соответствия для титрования по активной составляющей полной проводимости
- § 15. Диаграмма соответствия для титрования по реактивной составляющей полной проводимости
- § 16. Выбор типа диаграмм
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 17. Измерительные ячейки (датчики) высокочастотного метода и области их применения
- § 18. Классификация аппаратуры высокочастотного метода
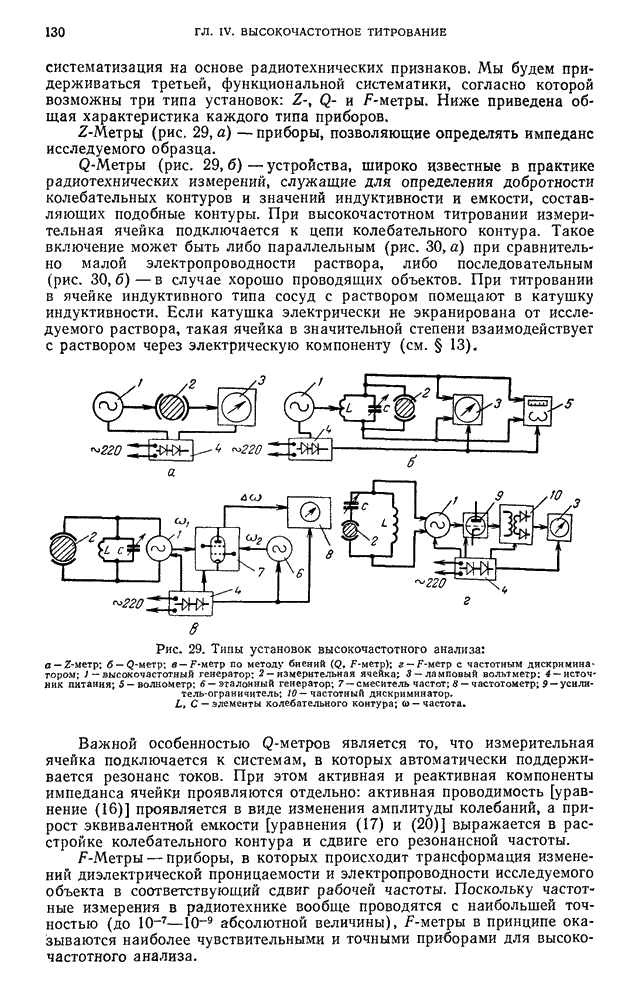
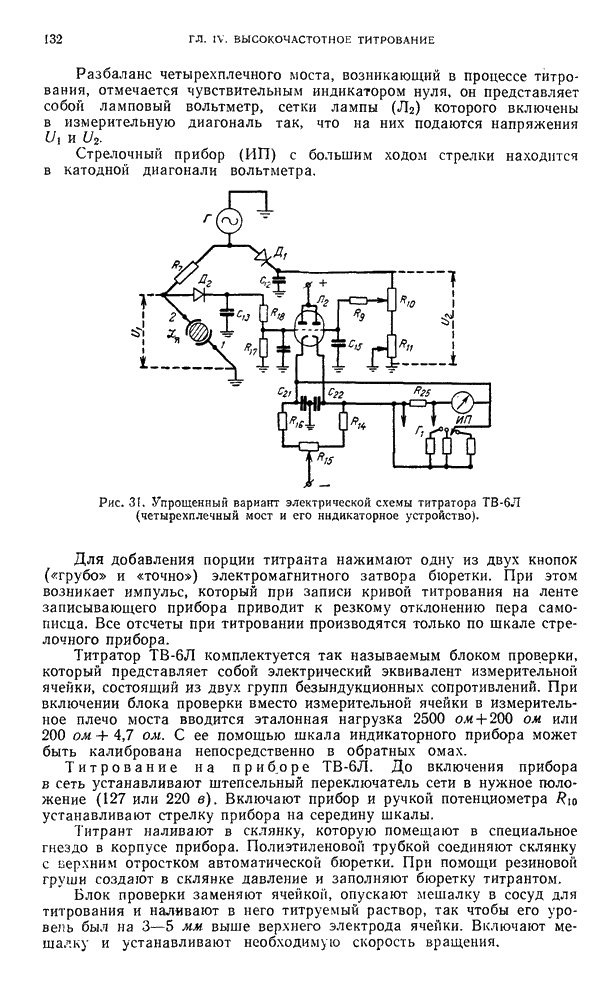
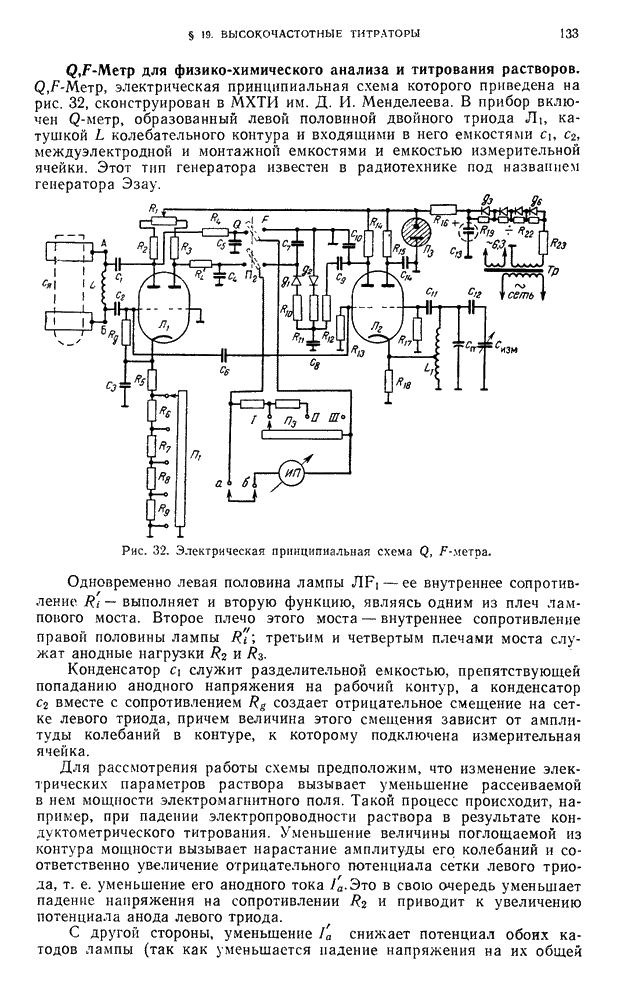
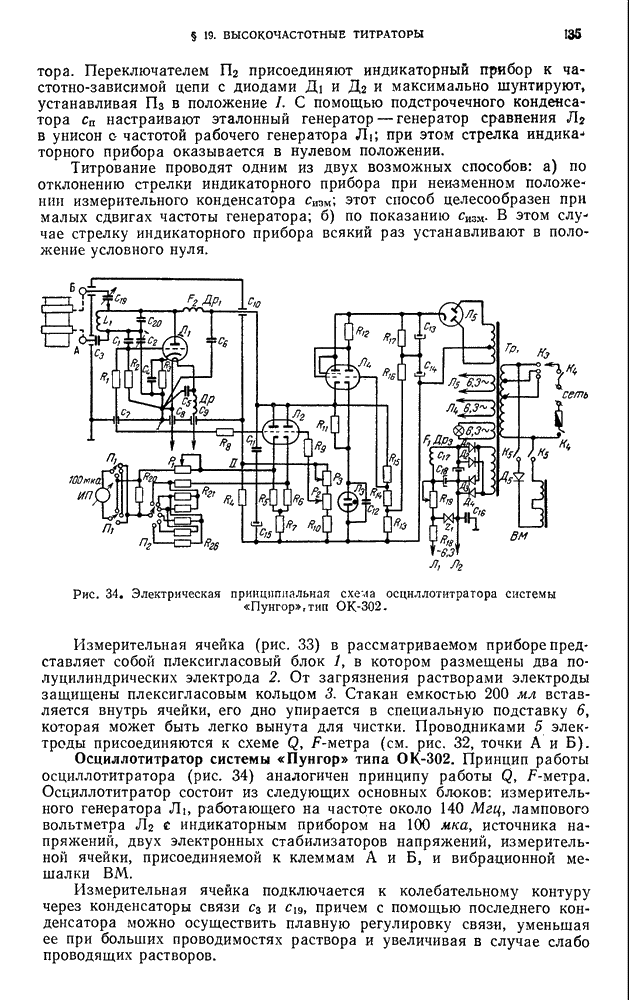
- § 19. Высокочастотные титраторы
- § 20. Общие правила работы с приборами для высокочастотного анализа
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 21. Высокочастотное титрование стандартных растворов
- § 22. Высокочастотное титрование растворов неизвестной концентрации
- ГЛАВА V. ПОЛЯРОГРАФИЧЕСКИЙ МЕТОД АНАЛИЗА И АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 1. Предельный, или диффузионный, ток
- § 2. Возникновение диффузионного тока на твердых микроэлектродах
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ ПОЛЯРОГРАФИЧЕСКОГО АНАЛИЗА
- § 3. Полярографы
- § 4. Электролитическая ячейка
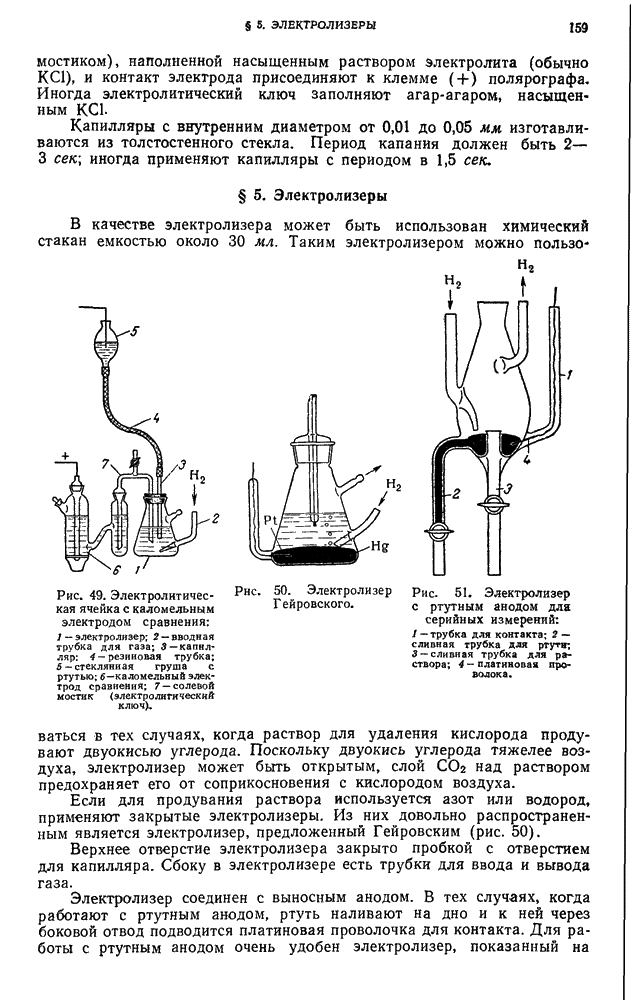
- § 5. Электролизеры
- § 6. Электроды сравнения
- § 7. Снятие полярограммы на полярографической установке с визуальным полярографом
- § 8. Методы количественного полярографического анализа
- § 9. Правила техники безопасности при работе с металлической ртутью
- В. НОВЫЕ НАПРАВЛЕНИЯ В ПОЛЯРОГРАФИИ
- § 10. Амальгамная полярография с накоплением
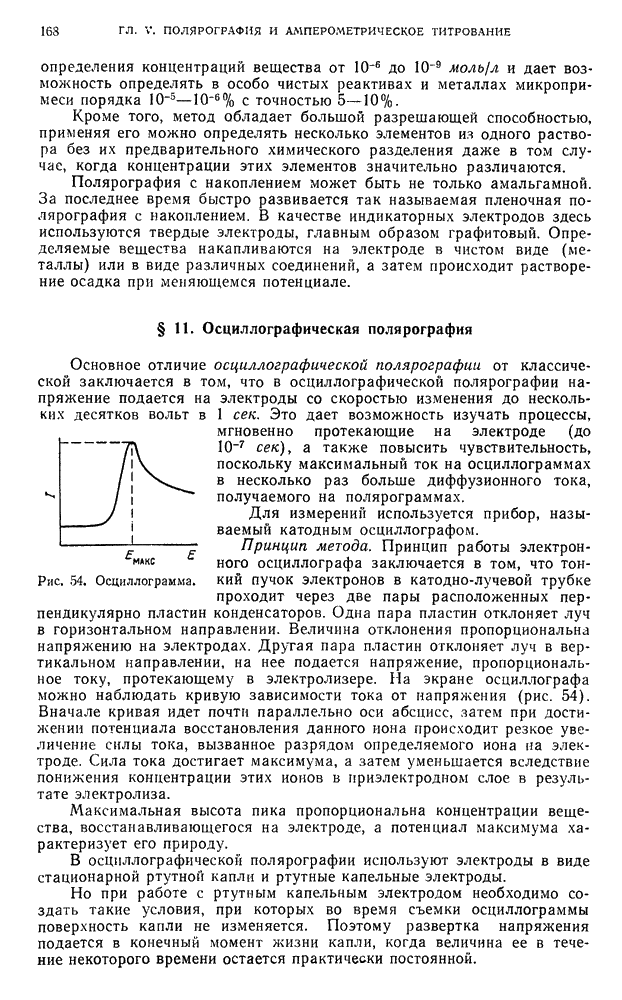
- § 11. Осциллографическая полярография
- § 12. Переменнотоковая полярография
- Г. ПРАКТИЧЕСКИЕ РАБОТЫ С ПРИМЕНЕНИЕМ ПОЛЯРОГРАФИЧЕСКОГО МЕТОДА АНАЛИЗА
- § 13. Примеры полярографических определений
- АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 14. Особенности амперометрического титрования
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АМПЕРОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
- § 15. Схема установки и применяемые электроды
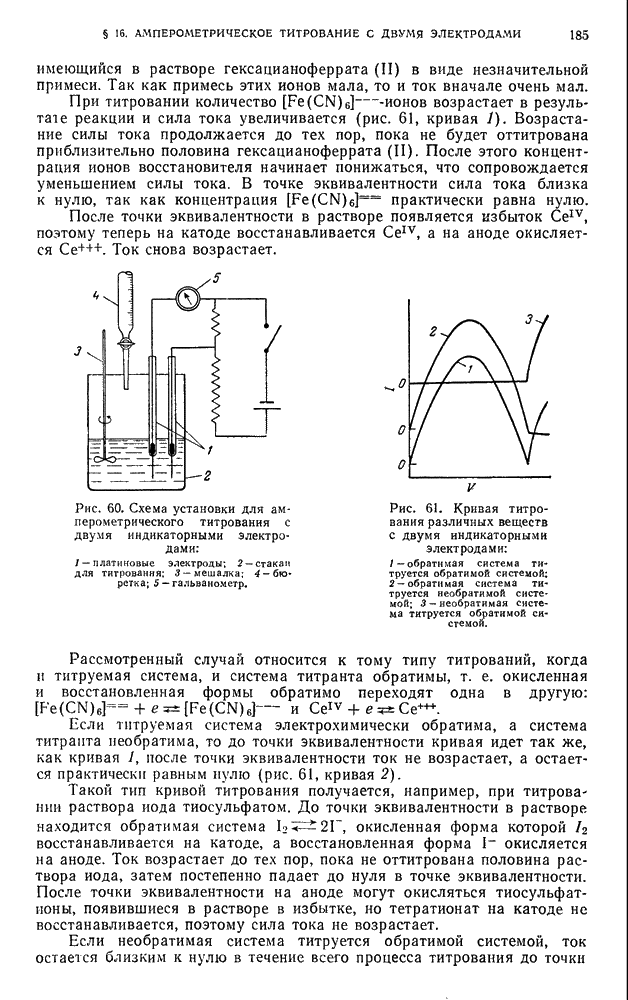
- § 16. Амперометрическое титрование с двумя индикаторными электродами
- В. ПРАКТИЧЕСКИЕ РАБОТЫ С ПРИМЕНЕНИЕМ АМПЕРОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
- § 17. Примеры амперометрического титрования
- ГЛАВА VI. КУЛОНОМЕТРИЯ И КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 1. Сущность и классификация кулонометрических методов
- ПРЯМАЯ КУЛОНОМЕТРИЯ
- § 2. Прямая кулонометрия при постоянном потенциале рабочего электрода (прямая потенциостатическая кулонометрия)
- § 3. Использование прямой потенциостатической кулонометрии
- § 4. Прямая кулонометрия при постоянной силе тока электролиза (прямая амперостатическая кулонометрия)
- § 5. Использование прямой амперостатической кулонометрии
- КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 6. Кулонометрическое титрование при постоянной силе тока электролиза
- § 7. Использование амперостатического кулонометрического титрования
- § 8. Кулонометрическое титрование првд постоянном потенциале рабочего электрода
- § 9. Особенности кулонометрических методов анализа
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 10. Электроды
- § 11. Электролизеры
- § 12. Приборы для измерения количества электричества, израсходованного на электролиз вещества
- § 13. Приборы, обеспечивающие стабильность потенциала рабочего электрода или силы тока электролиза, и установки для кулонометрического анализа
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 14. Работы, выполняемые методом прямой кулонометрии
- § 15. Работы, выполняемые методом косвенной кулонометрии, или кулонометрического титрования, при постоянной силе тока электролиза
- ГЛАВА VII. СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА
- § 1. Общая характеристика метода
- § 2. Классификация методов эмиссионного спектрального анализа
- § 3. Качественный спектральный анализ
- § 4. Полуколичественные методы спектрального анализа
- § 5. Количественный спектральный анализ
- § 6. Основы фотографического метода эмиссионного количественного анализа
- § 7. Зависимость между почернением фотопластинки и интенсивностью излучения
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 8. Источники возбуждения спектров
- § 9. Спектральные приборы
- § 10. Вспомогательные приборы и принадлежности
- § 11. Микрофотометр МФ-2
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 12. Качественный анализ при помощи стилоскопа
- § 13. Качественный анализ фотографическим методом при помощи спектра железа в ультрафиолетовой области
- § 14. Полуколичественный анализ
- § 15. Количественный анализ
- СПЕКТРОФОТОМЕТРИЯ ПЛАМЕНИ
- § 16. Общая характеристика метода
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 17. Схема установки, применяемой для анализа методом спектрофотометрии пламени
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 18. Определения по методу спектрофотометрии пламени
- АТОМНО-АБСОРБЦИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ
- § 19. Общая характеристика метода
- МОЛЕКУЛЯРНО-АБСОРБЦИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ
- § 20. Общая характеристика метода
- § 21. Законы поглощения света
- § 22. Отклонения от закона Бугера—Ламберта—Бера
- § 23. Качественный анализ спектрофотометрическим методом
- § 24. Количественный анализ спектрофотометрическим методом
- § 25. Методы определения концентрации веществ, поглощающих в видимой и ультрафиолетовой областях спектра
- § 26. Определение нескольких компонентов в растворе
- § 27. Определение концентрации вещества в растворе дифференциальным методом
- § 28. Выбор толщины слоя и оптимальной концентрации исследуемого раствора
- § 29. Выбор длины волны поглощаемого излучения при спектрофотометрических измерениях
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 30. Приборы, применяемые для спектрофотометрического анализа в ультрафиолетовой и видимой областях спектра
- § 31. Приборы, применяемые для колориметрического анализа
- § 32. Приборы, применяемые для спектрофотометрического анализа в инфракрасной области спектра
- § 33. Нулевые растворы
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 34. Определение в ультрафиолетовой области спектра
- § 35. Определение в видимой области спектра
- § 36. Определение в инфракрасной области спектра
- СПЕКТРОФОТОМЕТРИЧЕСКИЕ (ФОТОМЕТРИЧЕСКИЕ) МЕТОДЫ ТИТРОВАНИЯ
- § 37. Общая характеристика метода
- § 38. Кривые спектрофотометрического титрования
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ ТИТРОВАНИЯ
- § 39. Установки для спектрофотометрического титрования
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 40. Спектрофотометрическое титрование
- НЕФЕЛОМЕТРИЧЕСКИЙ И ТУРБИДИМЕТРИЧЕСКИЙ МЕТОДЫ АНАЛИЗА
- § 41. Общая характеристика методов
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 42. Приборы, применяемые для нефелометрических и турбидиметрических измерений
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 43. Нефелометрические и турбидиметрические определения
- § 44. Фототурбидиметрическое и фотонефелометрическое титрование
- ГЛАВА VIII. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- § 1. Классификация хроматографических методов анализа
- § 2. Адсорбционная хроматография
- § 3. Разновидности газовой хроматографии
- § 4. Распределительная хроматография
- § 5. Ионообменная хроматография
- § 6. Константа ионного обмена
- § 7. Осадочная хроматография
- § 8. Окислительно-восстановительная хроматография
- § 9. Адсорбционно-комплексообразовательная хроматография
- § 10. Хроматографические колонки, применяемые в адсорбционно-жидкостной хроматографии
- § 11. Аппаратура, применяемая в газовой хроматографии
- § 12. Приборы и материалы, применяемые в распределительной хроматографии
- § 13. Колонки, применяемые в ионообменной хроматографии
- § 14. Колонки, применяемые в осадочной и окислительновосстановительной хроматографии
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 15. Работы по методу адсорбционной (жидкостной и газовой) хроматографии
- § 16. Работы по методу распределительной хроматографии
- § 17. Работы по методу ионообменной хроматографии
- § 18. Работы по методу осадочной хроматографии
- § 19. Работы по методу окислительно-восстановительной хроматографии
- § 20. Работы по методу адсорбционно-комплексообразовательной хроматографии
- ГЛАВА IX. РАДИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- § 1. Виды радиоактивного распада
- § 2. Скорость распада
- § 3. Взаимодействие излучения с веществом
- § 4. Ошибки при измерении радиоактивности
- Б. ЭЛЕМЕНТЫ ТЕХНИКИ БЕЗОПАСНОСТИ ПРИ РАБОТЕ С РАДИОАКТИВНЫМИ ВЕЩЕСТВАМИ
- § 5. Понятия и единицы измерения
- § 6. Классификация источников радиоактивного излучения и радиоактивных изотопов
- § 7. Классификация химических операций с радиоактивными веществами
- § 8. Устройство лабораторий и классификация работ
- § 9. Специальное оборудование для работ с радиоактивными веществами
- § 10. Средства индивидуальной защиты
- § 11. Проведение работ в химической лаборатории с радиоактивными веществами
- § 12. Правила работы с радиоактивными веществами
- В. МЕТОДЫ РЕГИСТРАЦИИ РАДИОАКТИВНОГО ИЗЛУЧЕНИЯ
- § 13. Ионизационные методы
- § 14. Сцинтилляционный метод
- Г. АППАРАТУРА И ТЕХНИКА ИЗМЕРЕНИЯ РАДИОАКТИВНОСТИ
- § 15. Радиометрические установки
- § 16. Измерение радиоактивности
- § 17. Измерение дозы на рабочем месте, индивидуальной дозы, полученной работающим, и загрязненности рабочих поверхностей, рук и одежды
- § 18. Абсолютные и относительные измерения активности
- Д. РАДИОМЕТРИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
- § 19. Приготовление раствора с заданной активностью
- § 20. Прямое определение ионов химических элементов в растворе с помощью радиоактивных реагентов
- § 21. Практические работы, выполняемые методом прямого определения
- § 22. Метод радиометрического титрования
- § 23. Практические работы, выполняемые методом радиометрического титрования
- § 24. Метод изотопного разбавления
- § 25. Практические работы, выполняемые методом изотопного разбавления
- § 26. Метод активационного анализа
- § 27. Практические работы, выполняемые методом активационного анализа
- § 28. Фотонейтронный метод
- § 29. Практические работы, выполняемые фотонейтронным методом
- § 30. Методы определения содержания химических элементов по излучению их естественных радиоактивных изотопов
- § 31. Практические работы по определению содержания химических элементов методом измерения излучения их естественных радиоактивных изотопов
- § 32. Методы анализа, основанные на поглощении излучения
- § 33. Практические работы, выполняемые по методу анализа, основанному на поглощении излучения
- § 34. Метод, основанный на отражении бетта-излучения
- § 35. Практические работы, выполняемые по методу, основанному на отражении бетта-излучения
- ГЛАВА X. ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ РЕДКИХ ЭЛЕМЕНТОВ
- § 1. Работы, выполняемые методом амперометрического титрования
- § 2. Работы, выполняемые полярографическим методом
- § 3. Работы, выполняемые фотометрическим методом
- § 4. Работы, выполняемые экстракционно-фотометрическим методом
- § 5. Работы, выполняемые спектрофотометрическим методом
- § 6. Работы, выполняемые флуориметрическим методом
- § 7. Работы, выполняемые методом потенциометрического титрования
- ГЛАВА XI. ФИЗИКО-ХИМИЧЕСКИЕ (ИНСТРУМЕНТАЛЬНЫЕ) МЕТОДЫ АНАЛИЗА НЕВОДНЫХ РАСТВОРОВ
- § 1. Влияние химической природы и физико-химических свойств растворителей на свойства растворенного вещества
- § 2. Классификация неводных растворителей по их протонно-донорно-акцепторным свойствам
- § 3. Классификация неводных растворителей по признаку их влияния на относительную силу электролитов
- § 4. Дифференцирующее действие растворителей
- § 5. Константы диссоциации, потенциалы полунейтрализации в неводных средах и относительная шкала кислотности
- § 6. Шкала pH и константы автопротолиза неводных растворителей
- § 7. Абсолютная (единая) шкала кислотности растворителей
- § 8. Химико-аналитическое использование неводных растворителей
- Б. АППАРАТУРА И ТЕХНИКА ТИТРОВАНИЯ НЕВОДНЫХ РАСТВОРОВ
- § 9. Установки, используемые при амперометрическом титровании неводных растворов
- § 10. Установки, используемые при потенциометрическом титровании неводных растворов
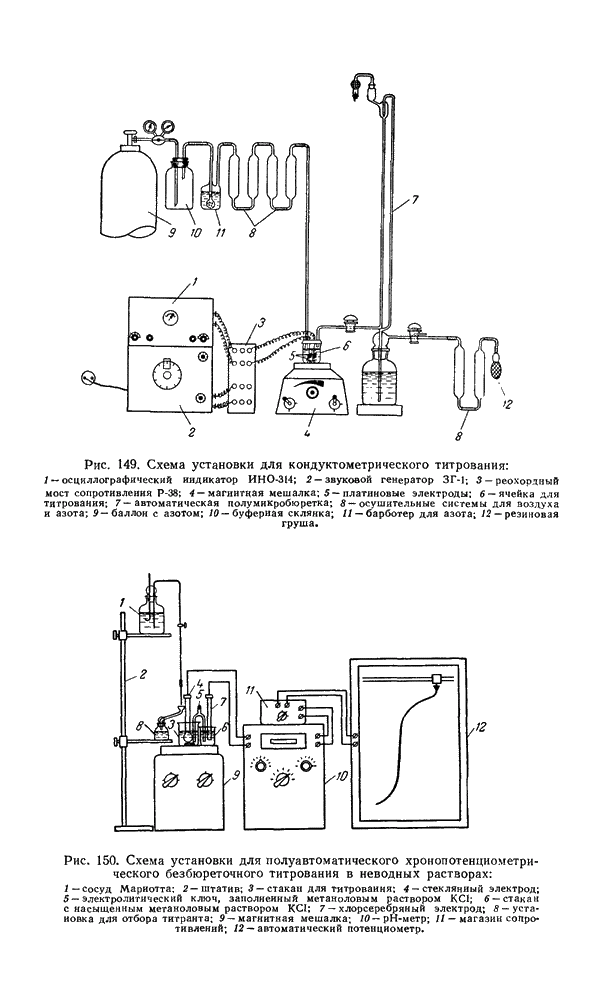
- § 11. Установки, используемые при кондуктометрическом титровании неводных растворов
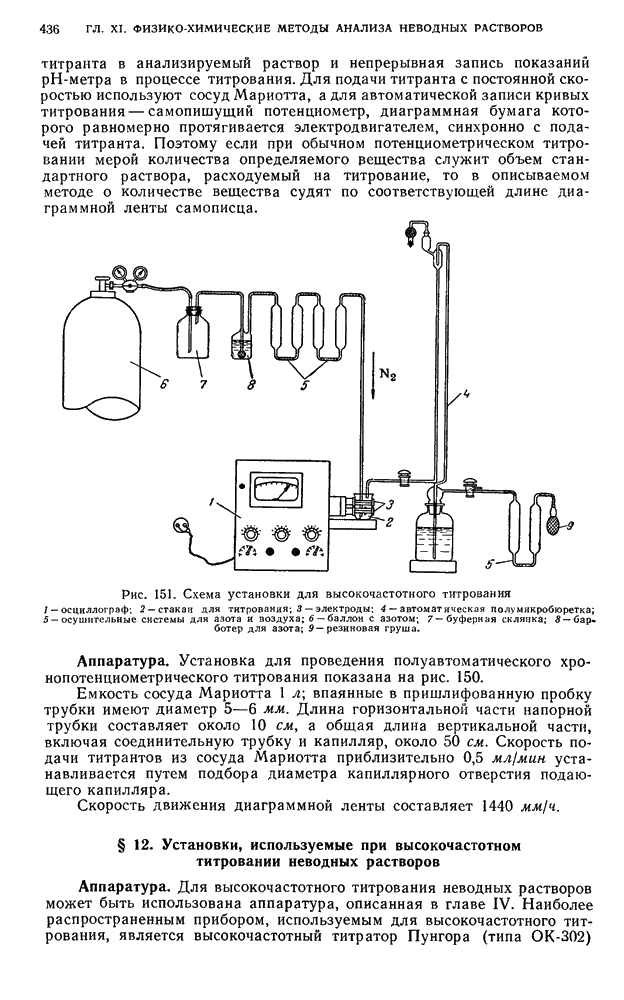
- § 12. Установки, используемые при высокочастотном титровании неводных растворов
- § 13. Установки, используемые при спектрофотометрическом титровании неводных растворов
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 14. Очистка и обезвоживание неводных растворителей
- § 15. Титранты, применяемые для титрования кислот и оснований в неводных растворах
- § 16. Амперометрическое титрование
- § 17. Методы прямого потенциометрического титрования
- § 18. Методы косвенного потенциометрического титрования
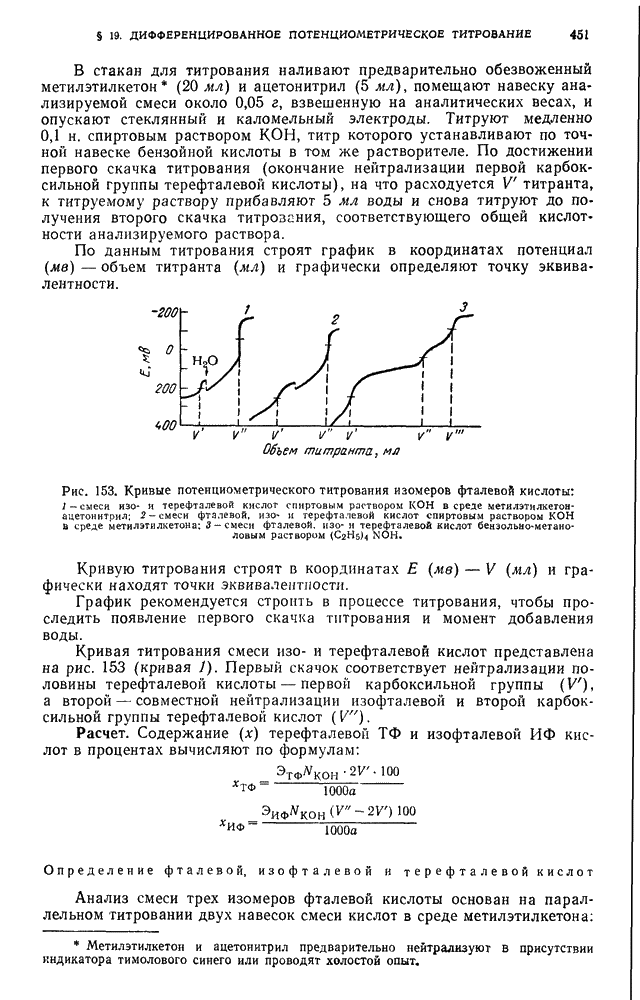
- § 19. Дифференцированное потенциометрическое титрование
- § 20. Комбинированные методы потенциометрического титрования
- § 21. Хронопотенциометрическое титрование
- § 22. Кондуктометрическое титрование
- § 23. Хронокондуктометрическое титрование
- § 24. Спектрофотометрическое титрование