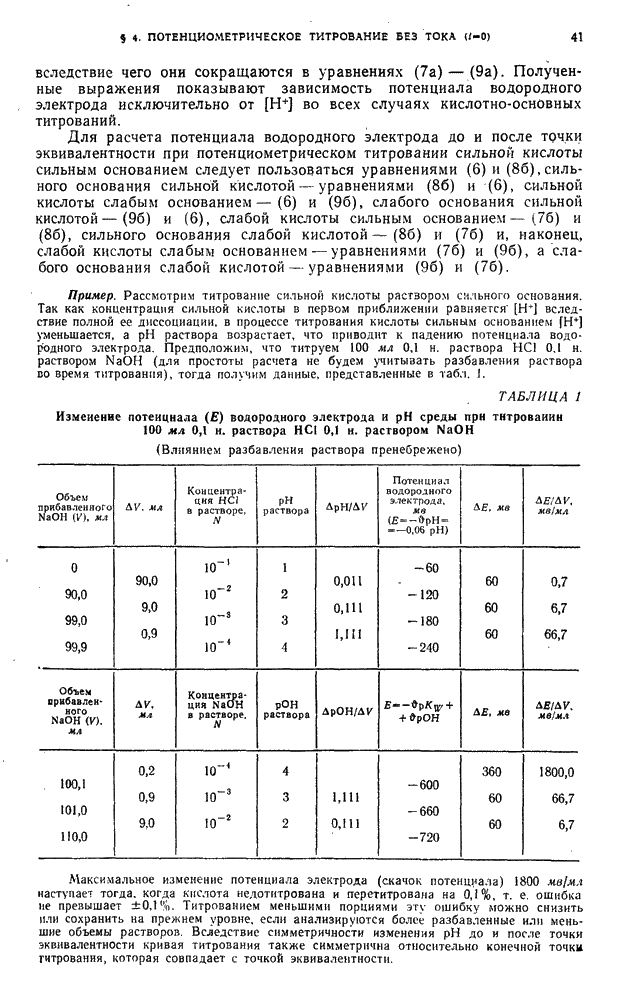
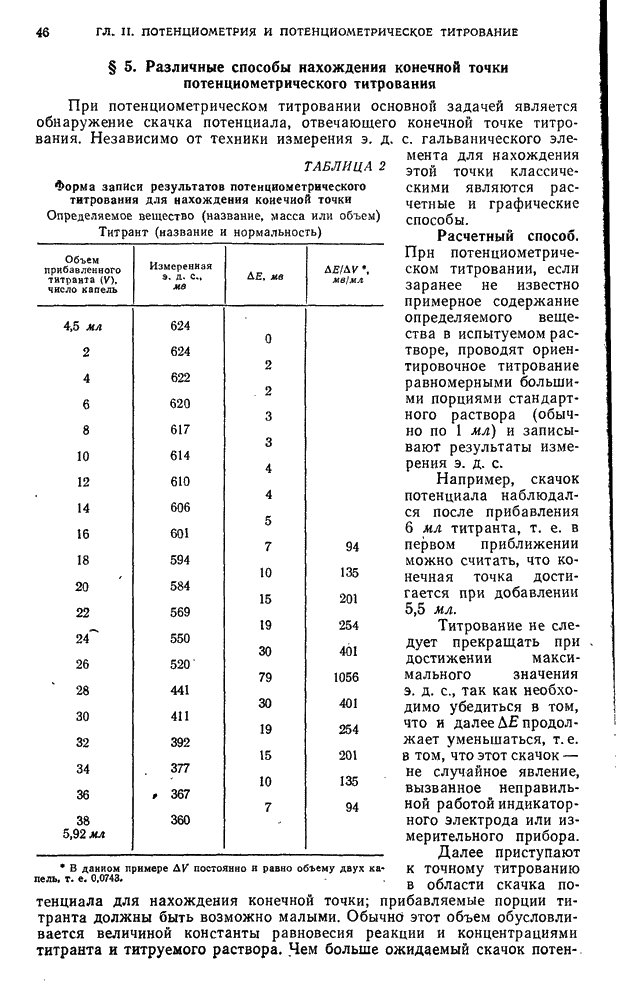
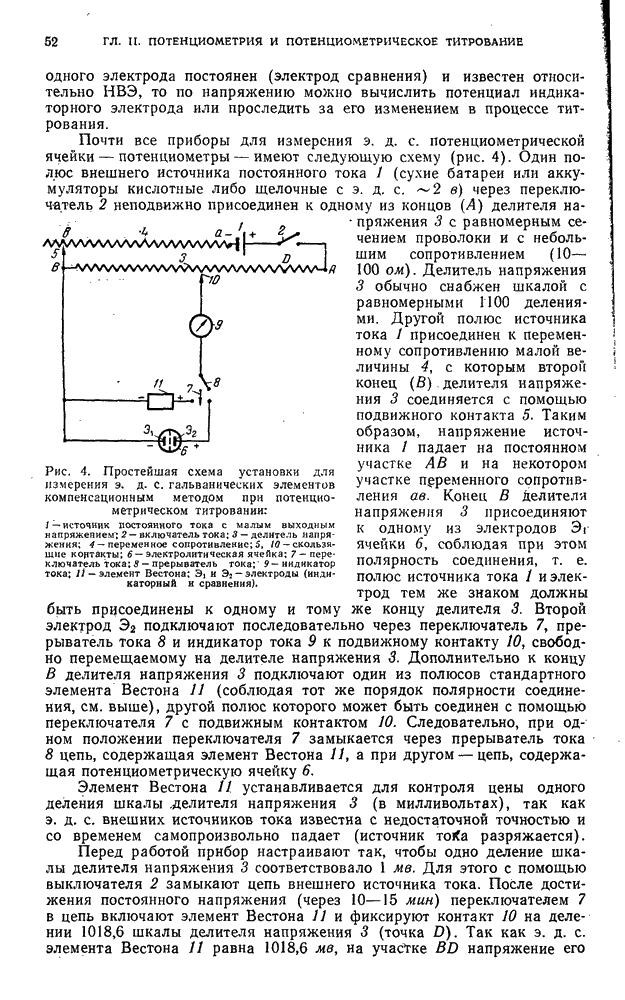
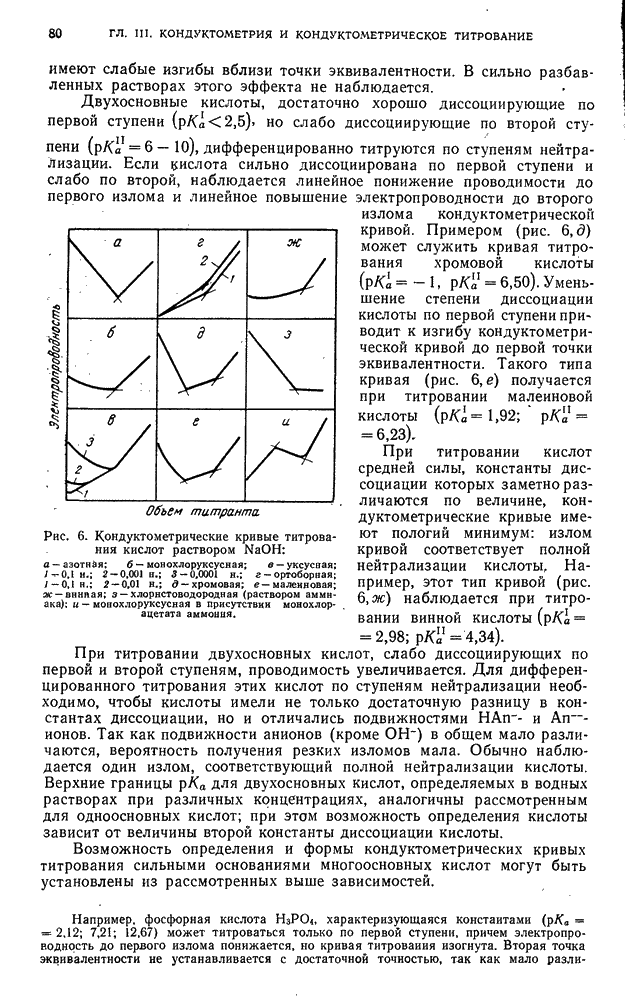
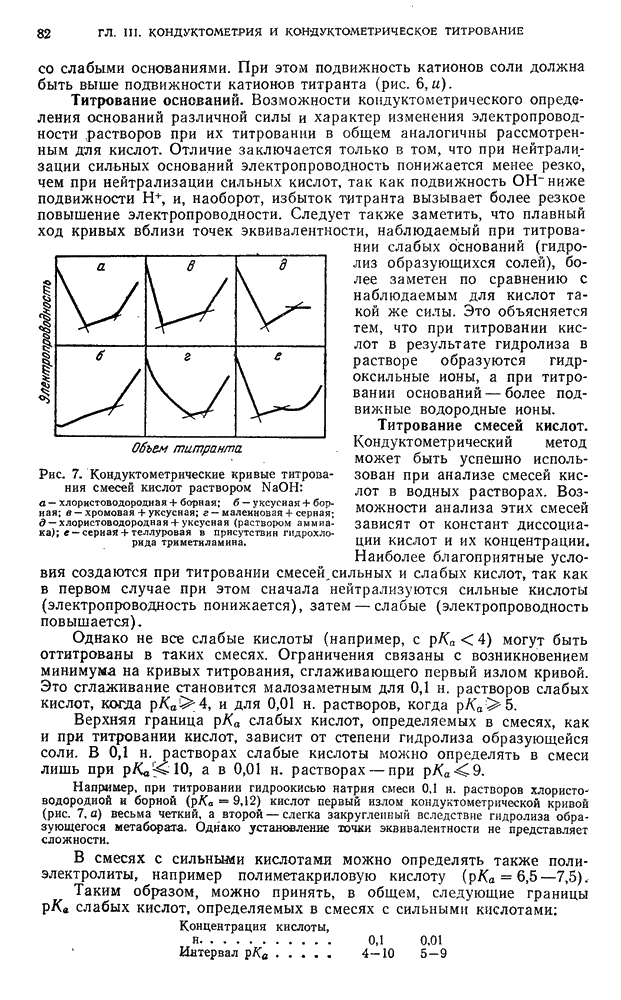
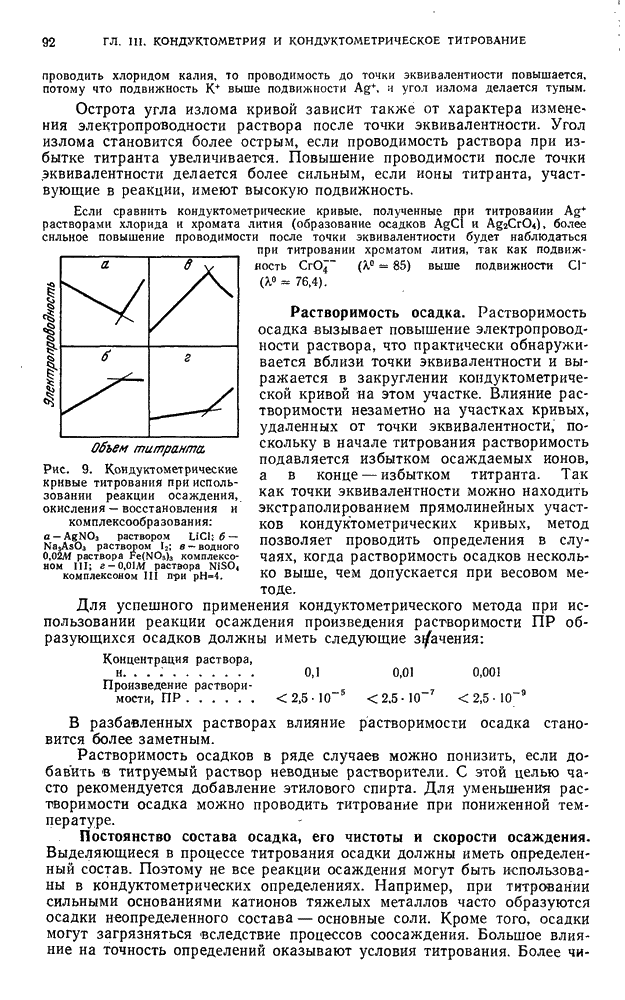
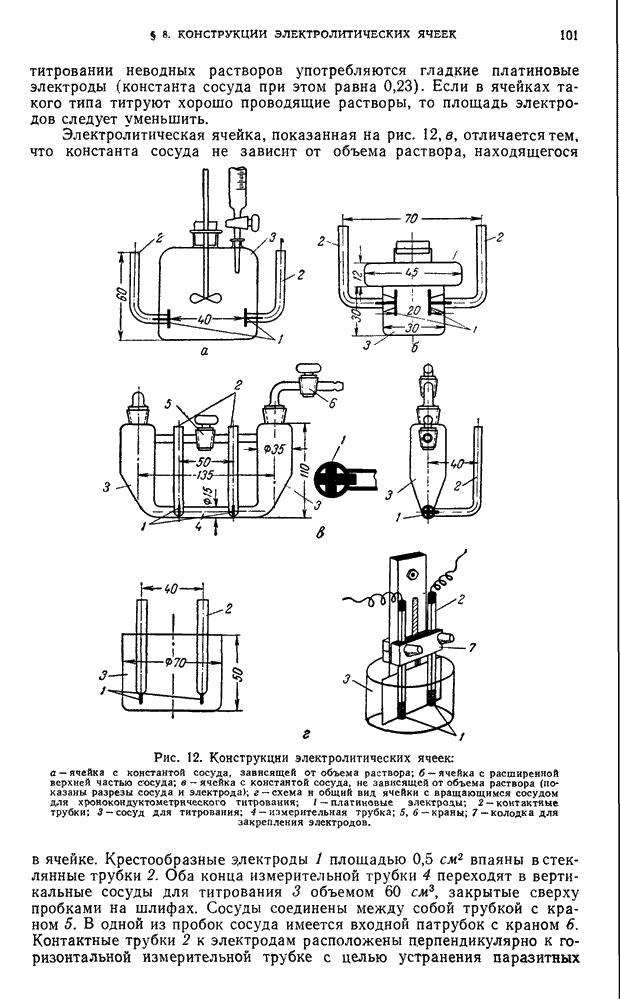
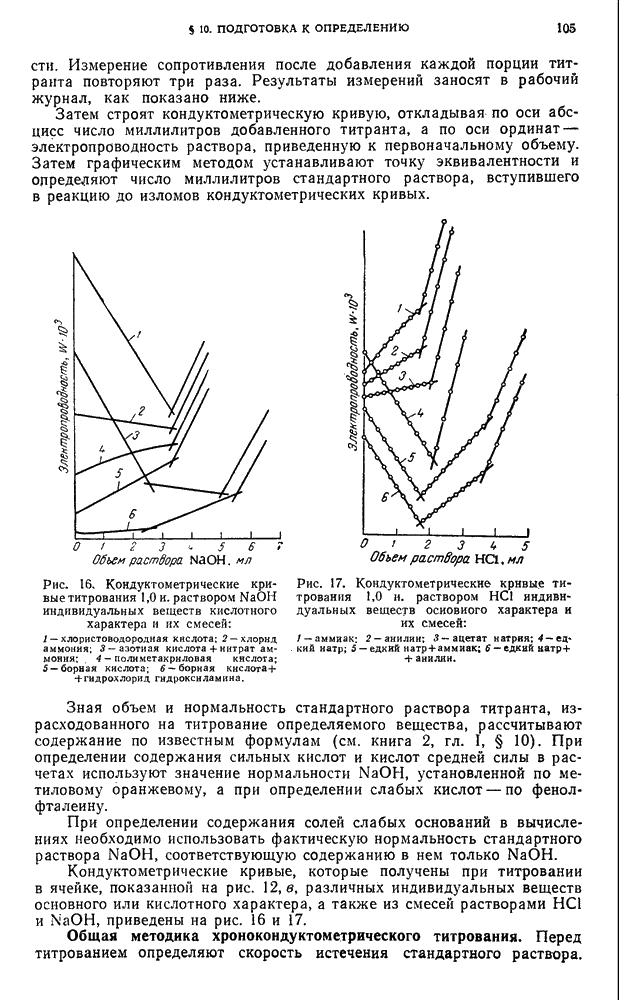
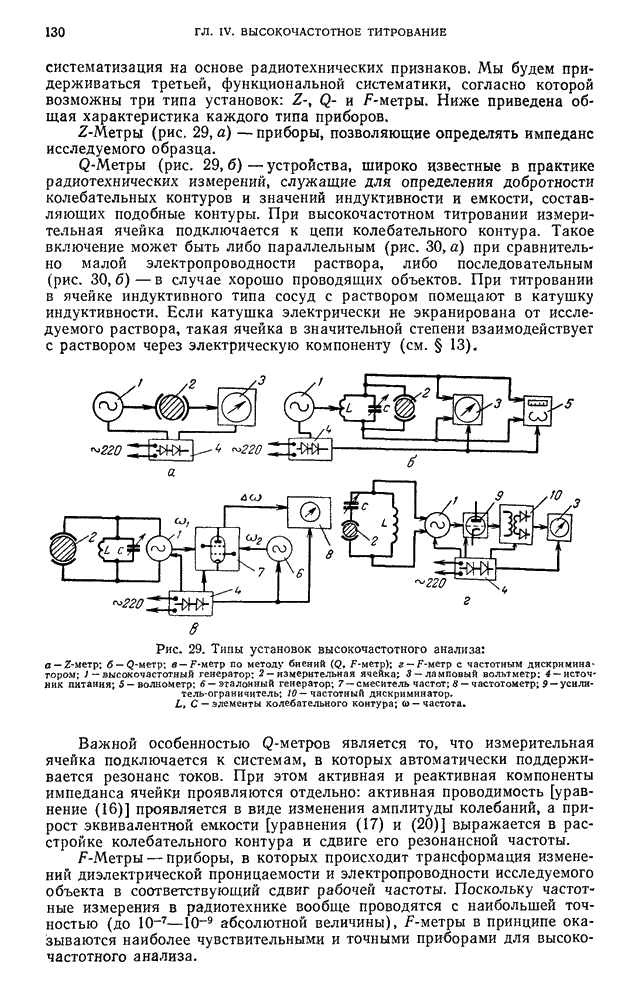
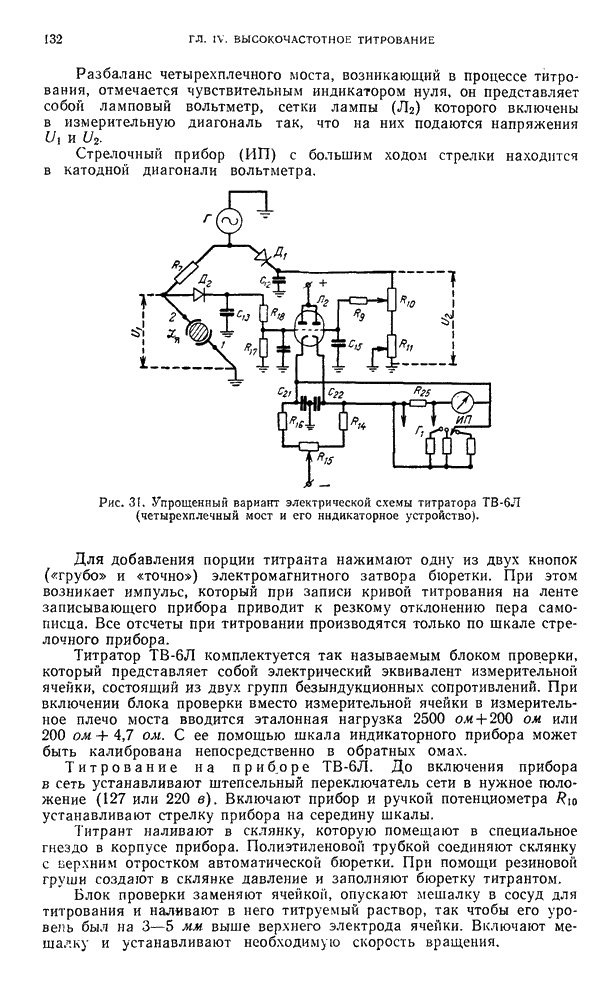
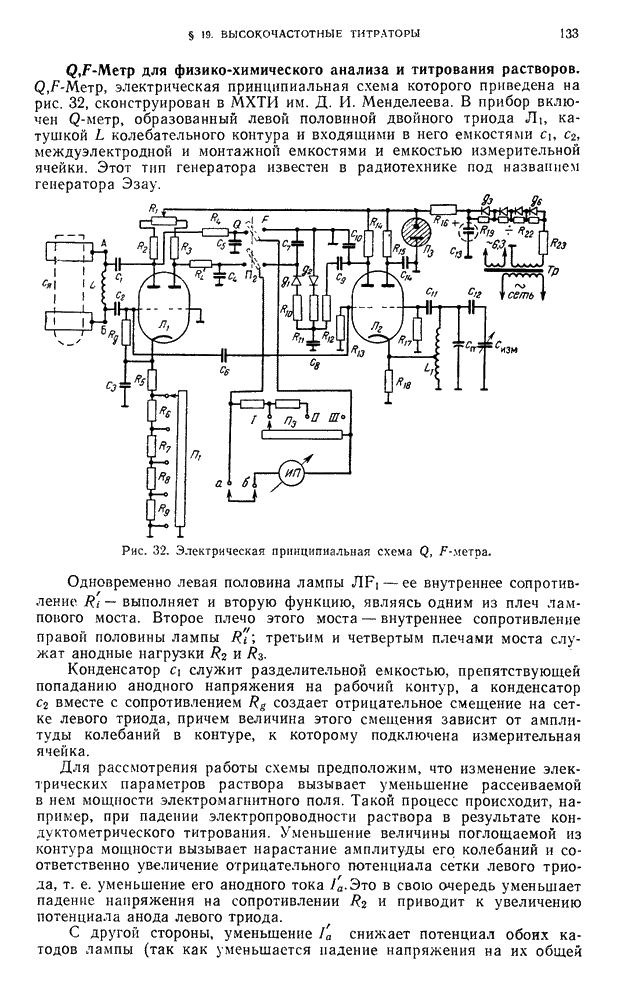
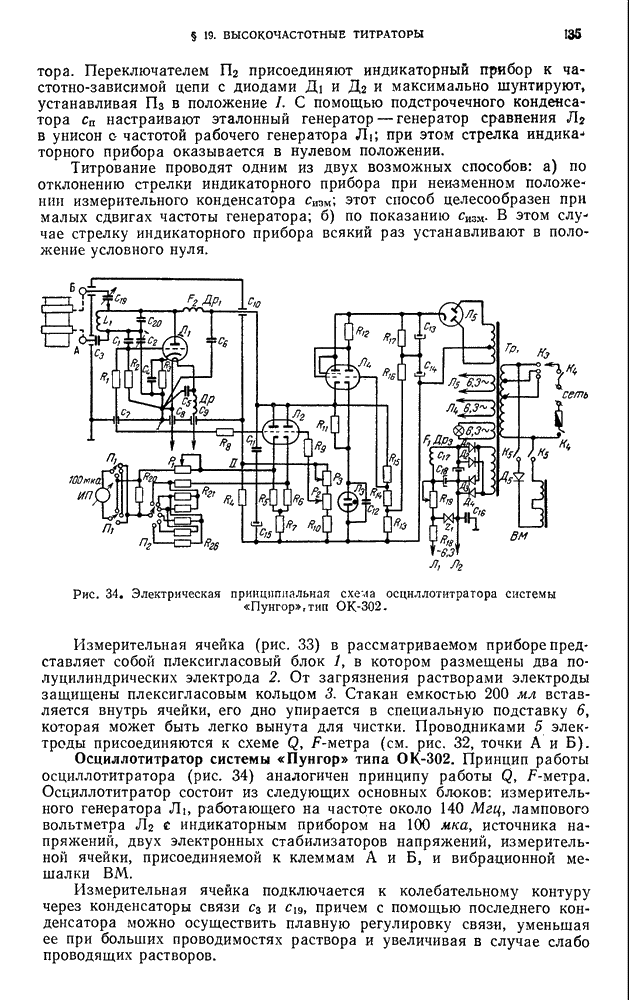
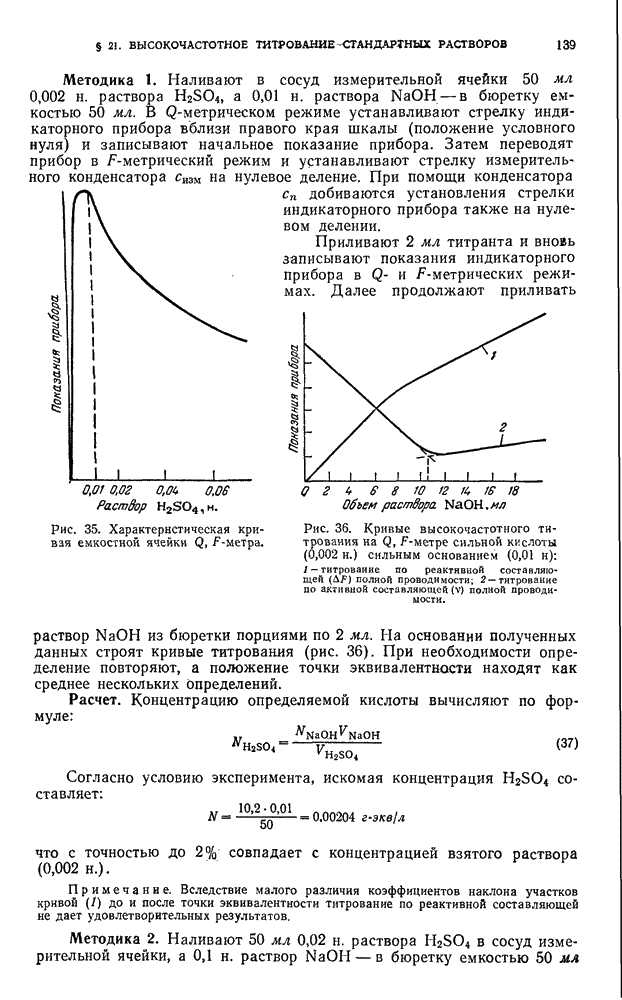
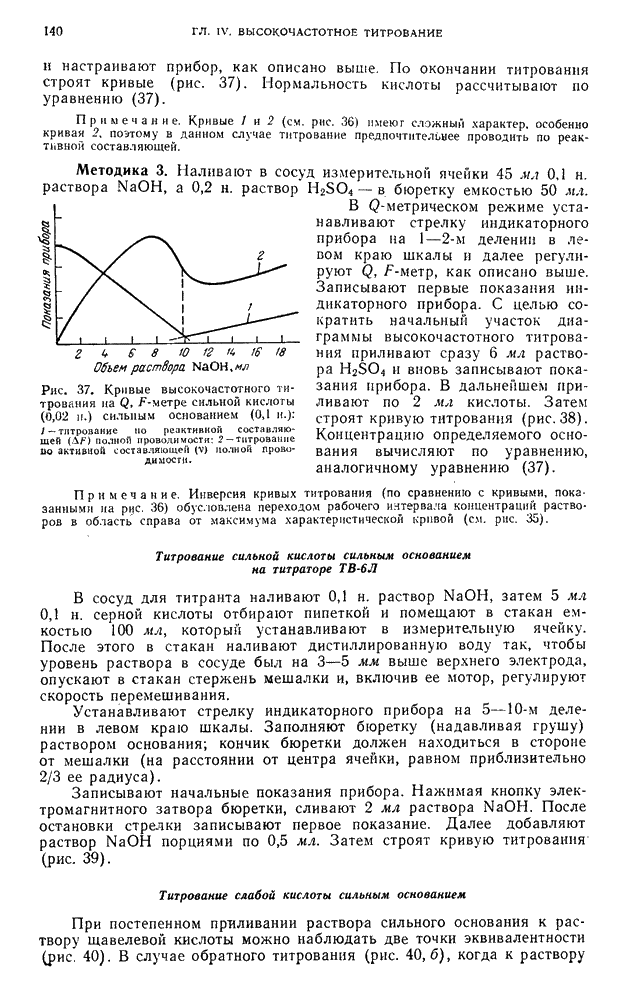
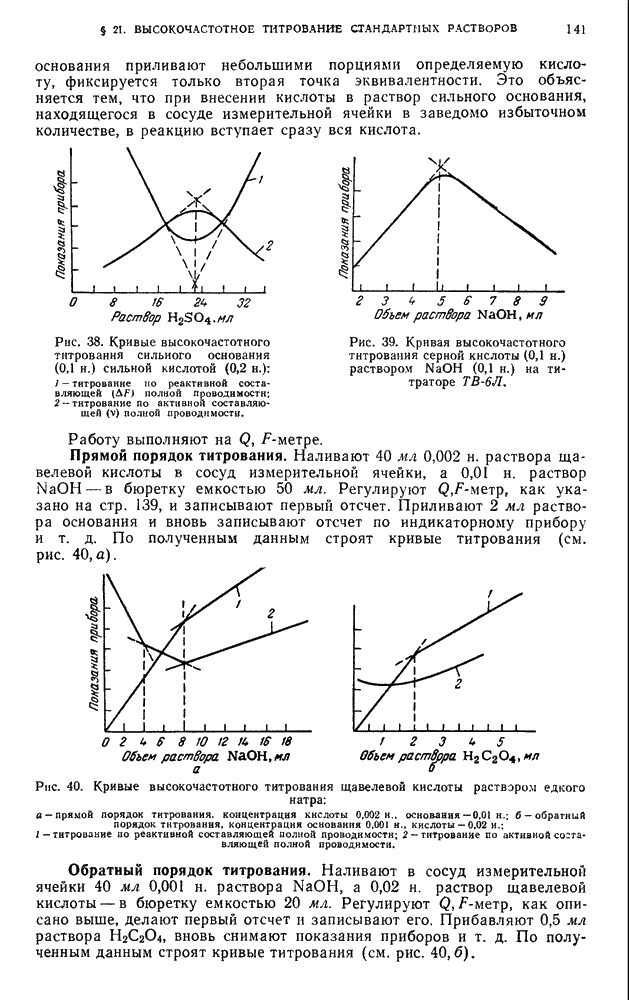
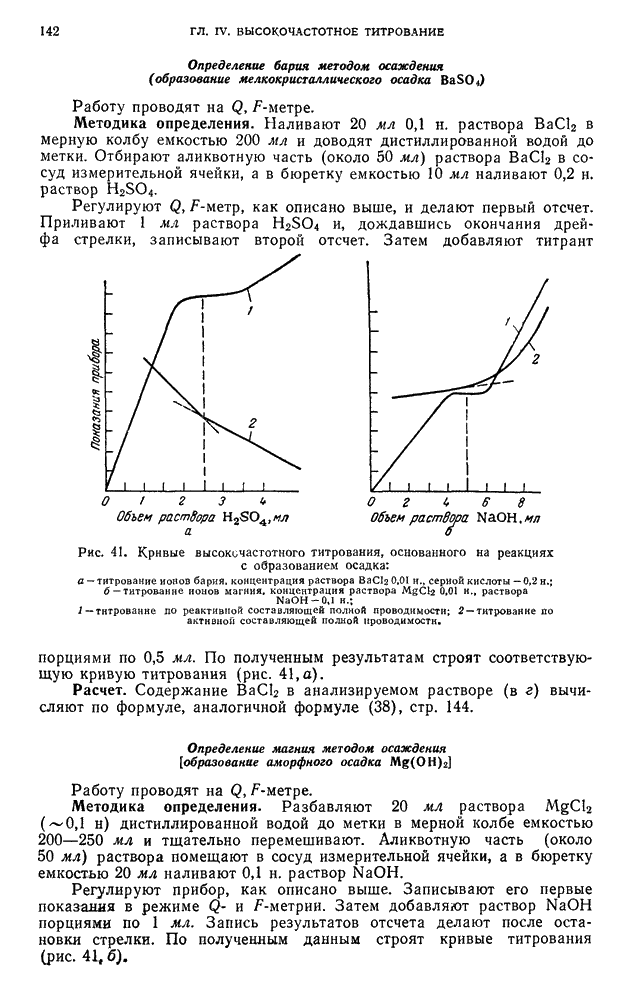
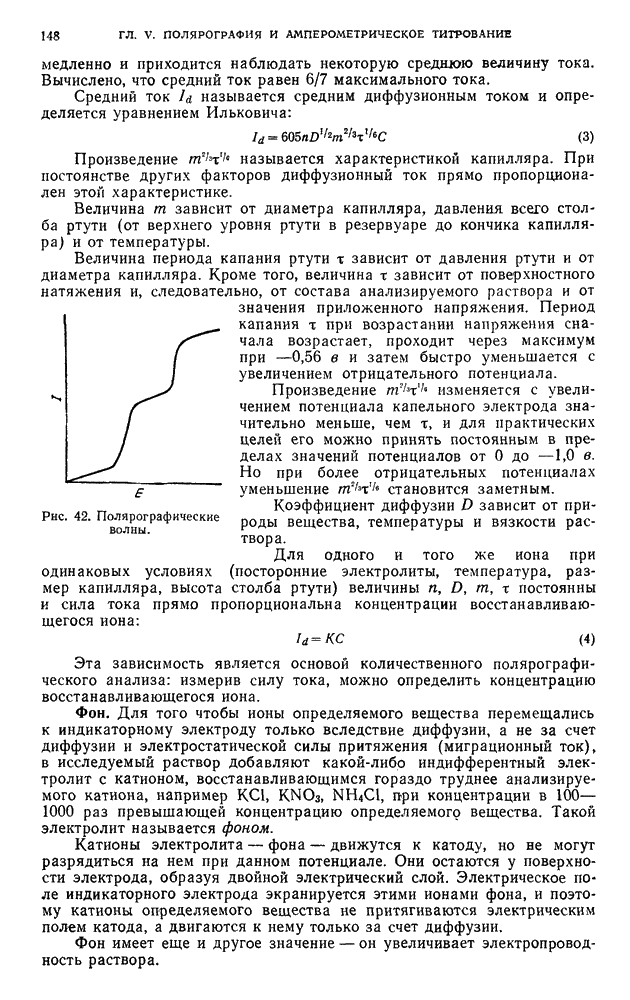
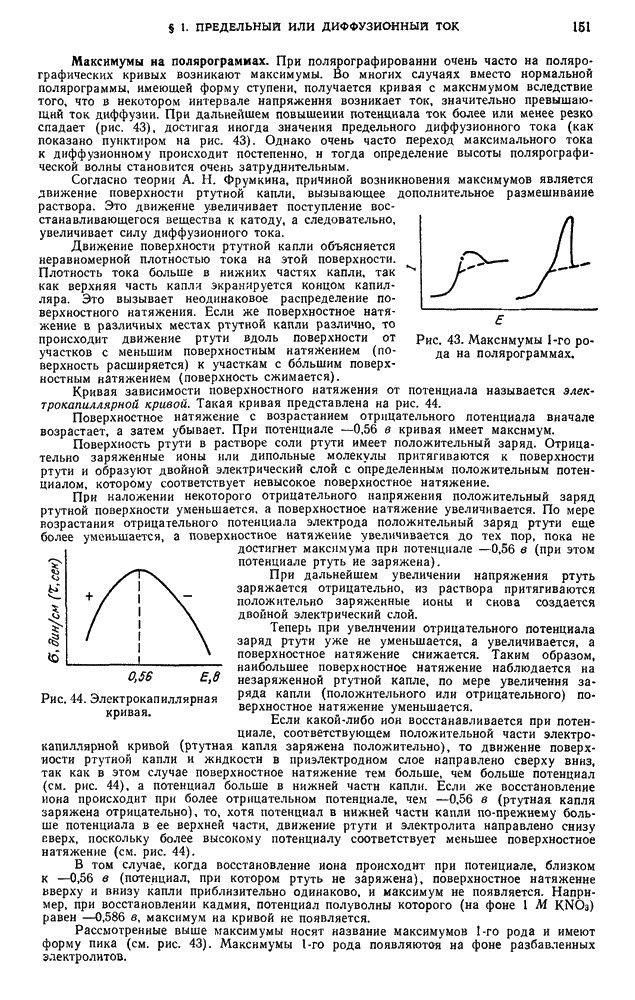
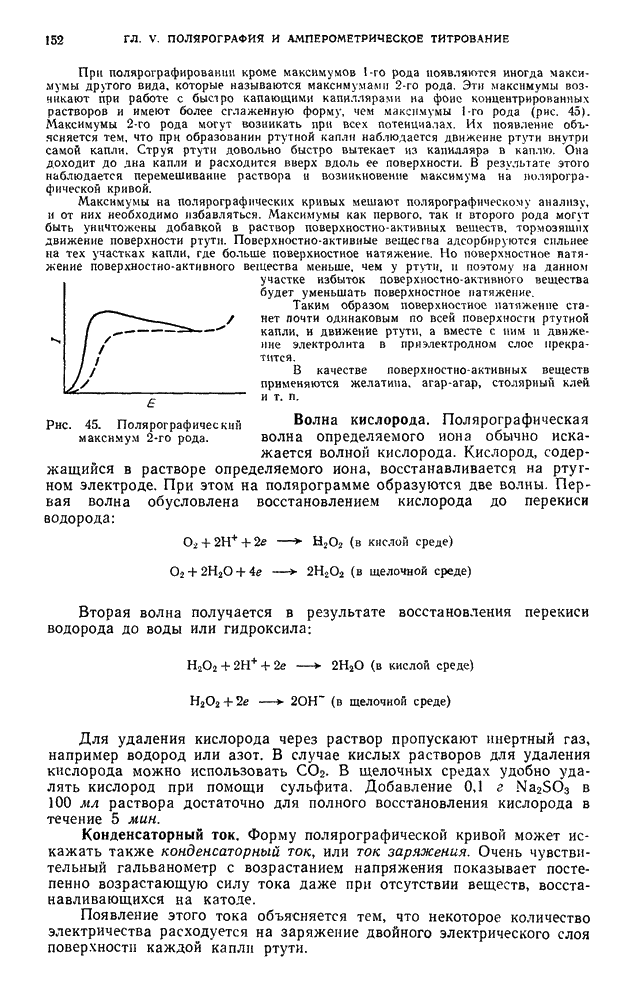
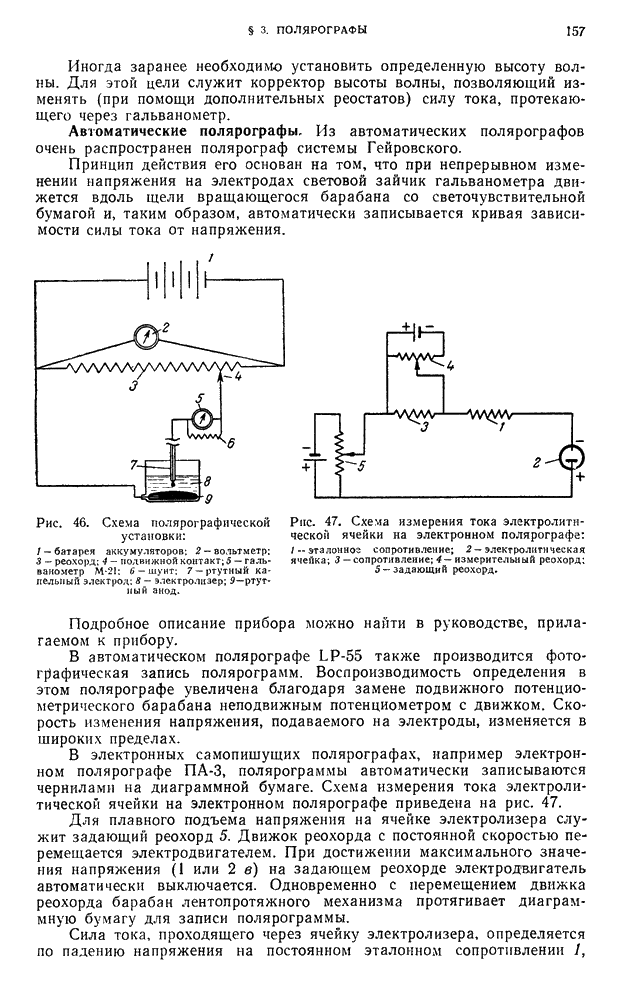
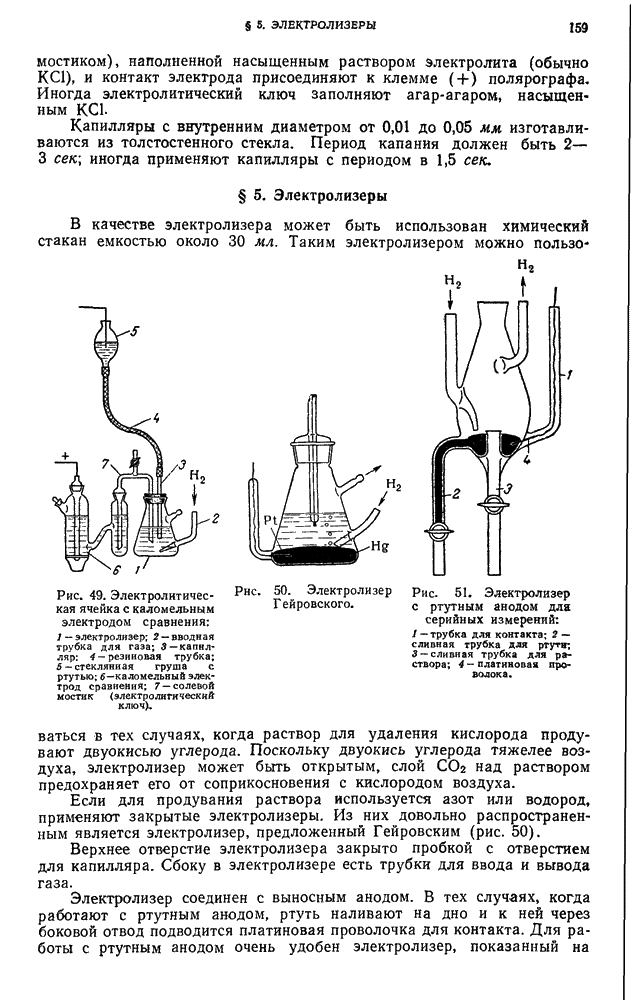
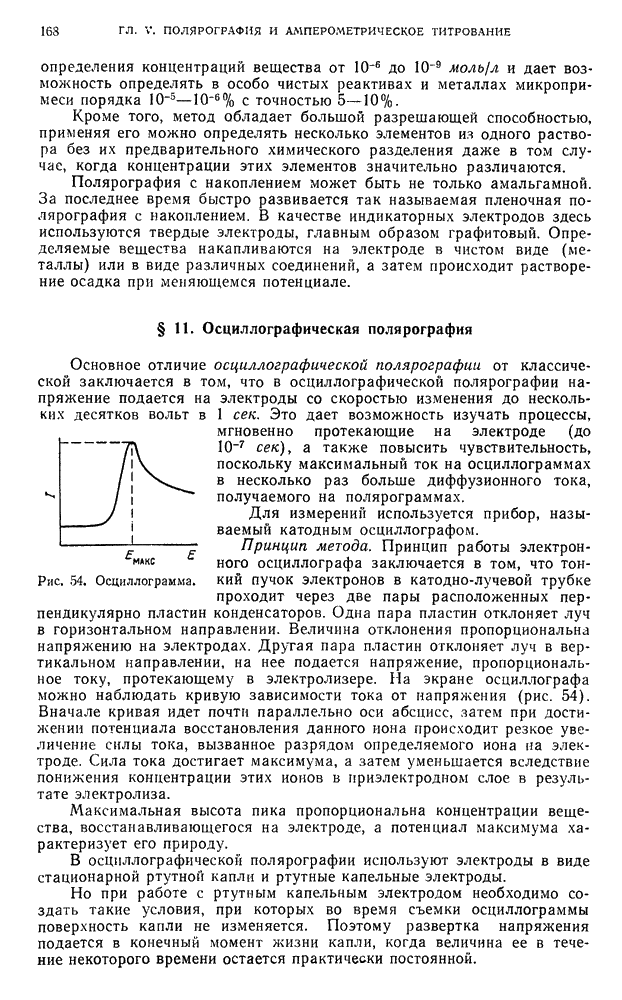
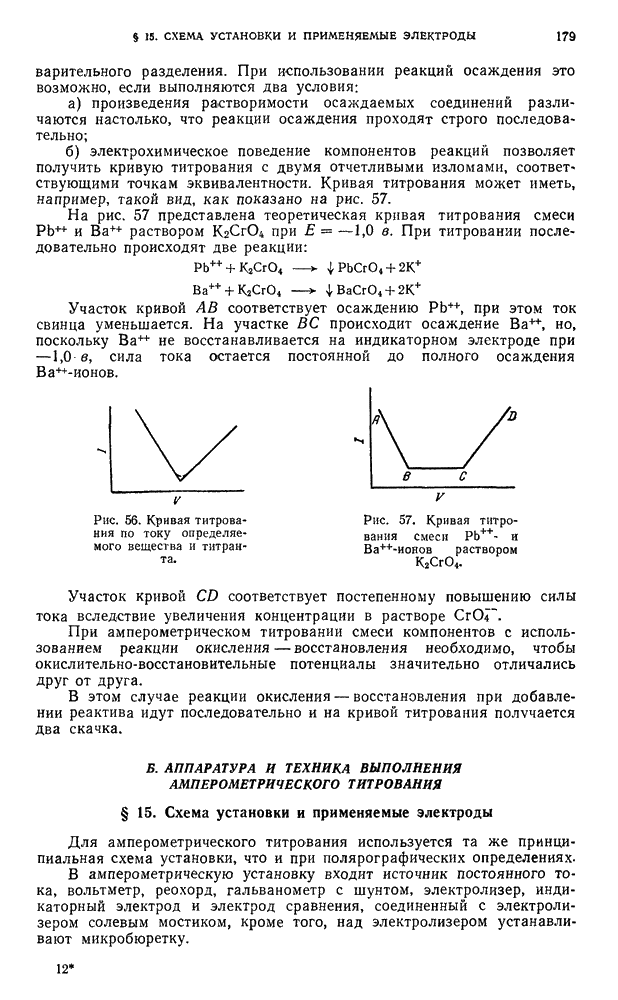
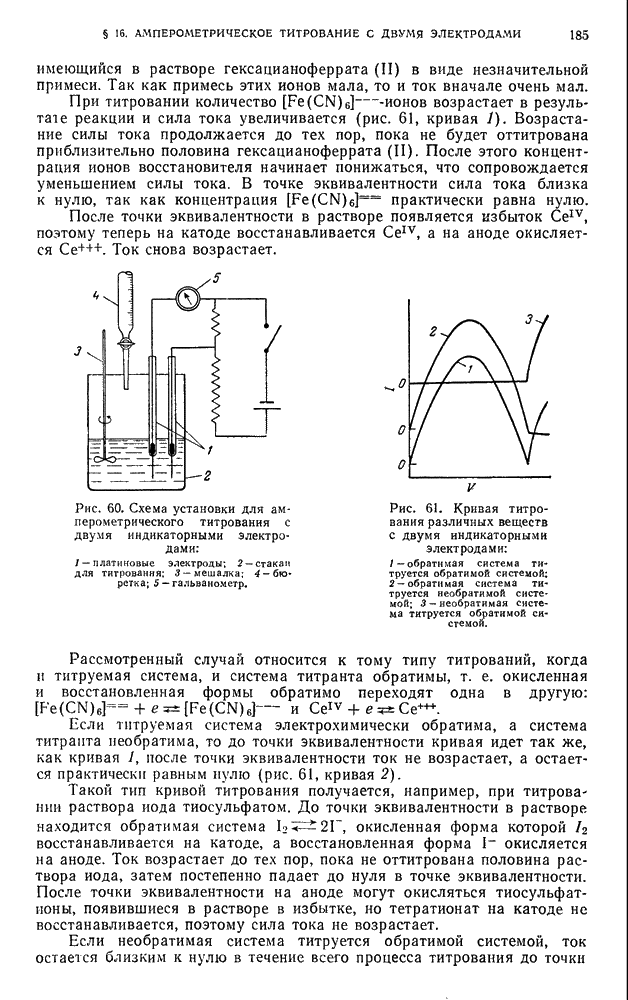
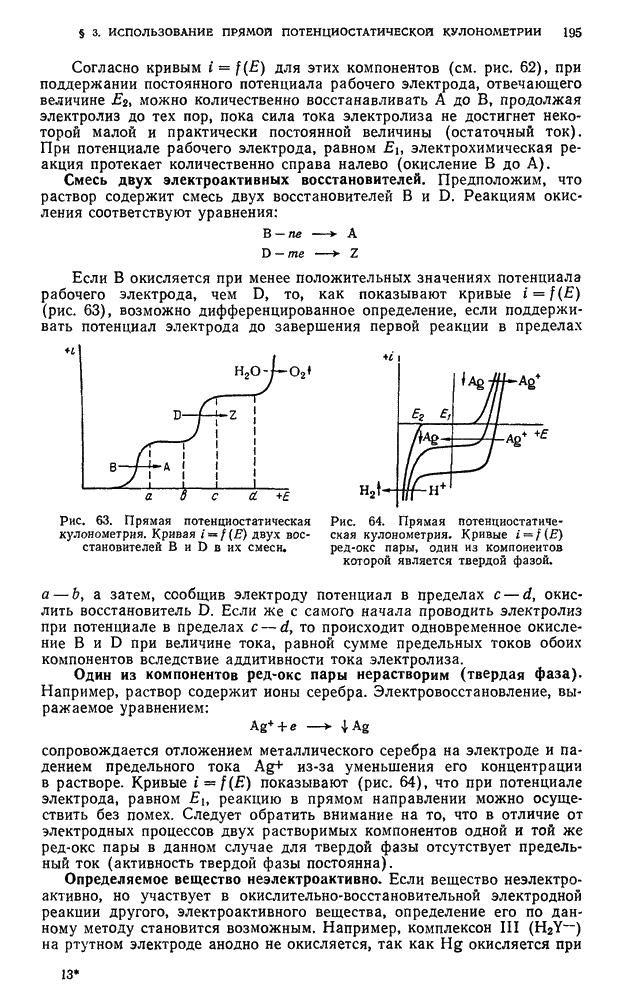
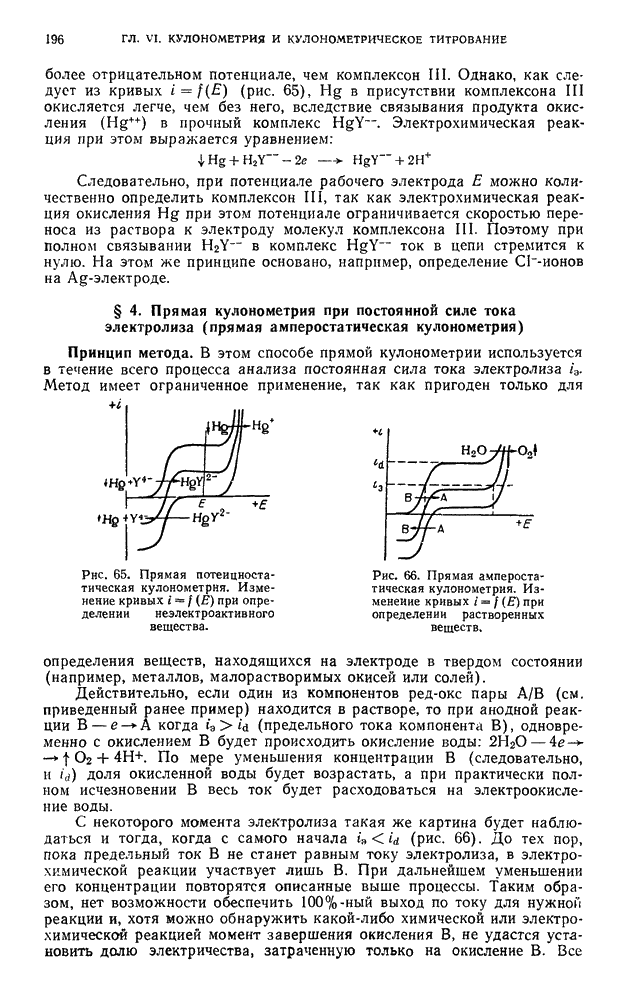
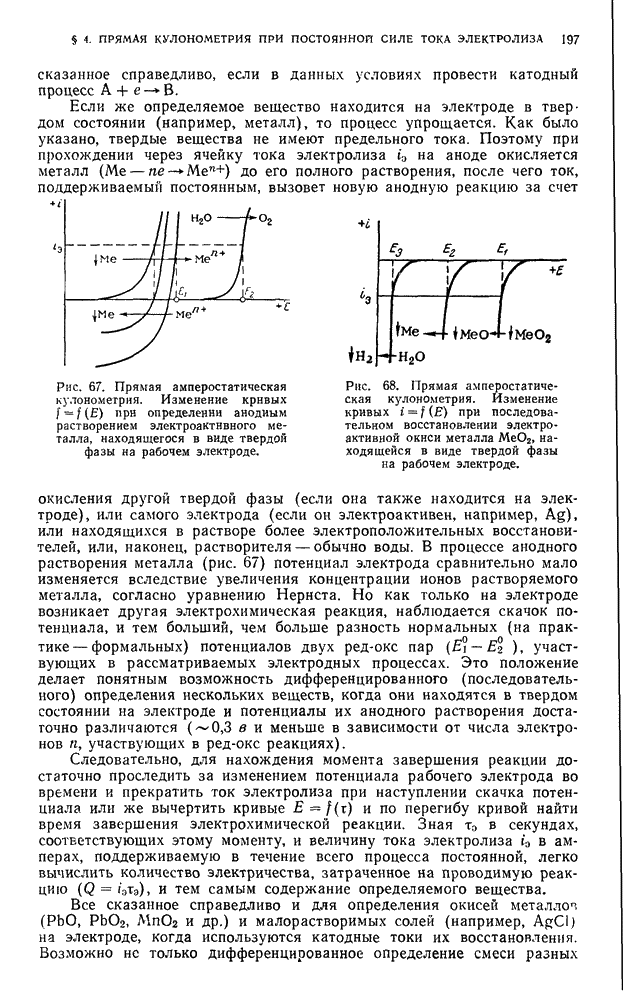
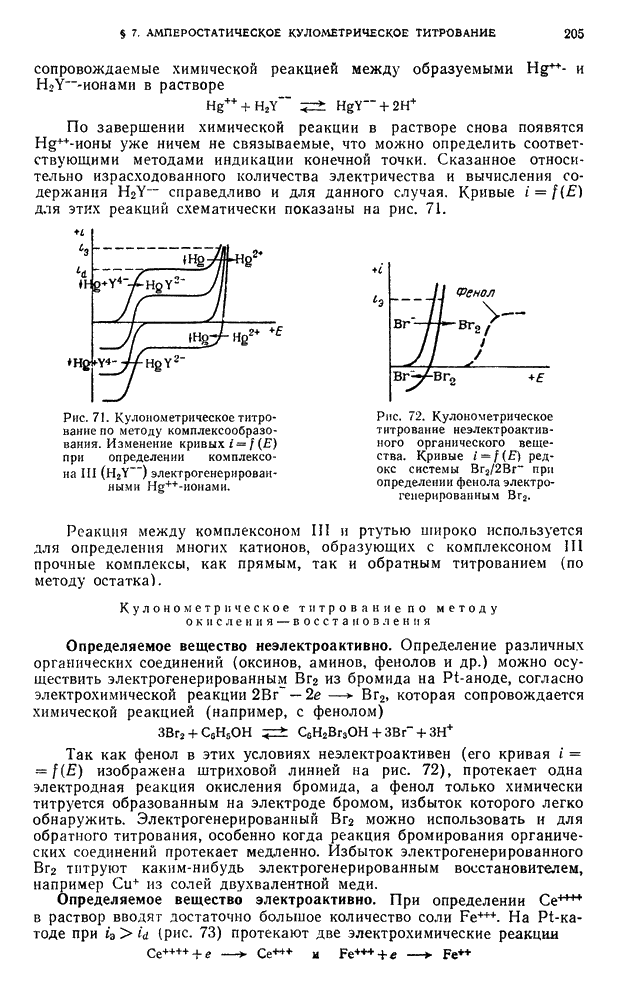
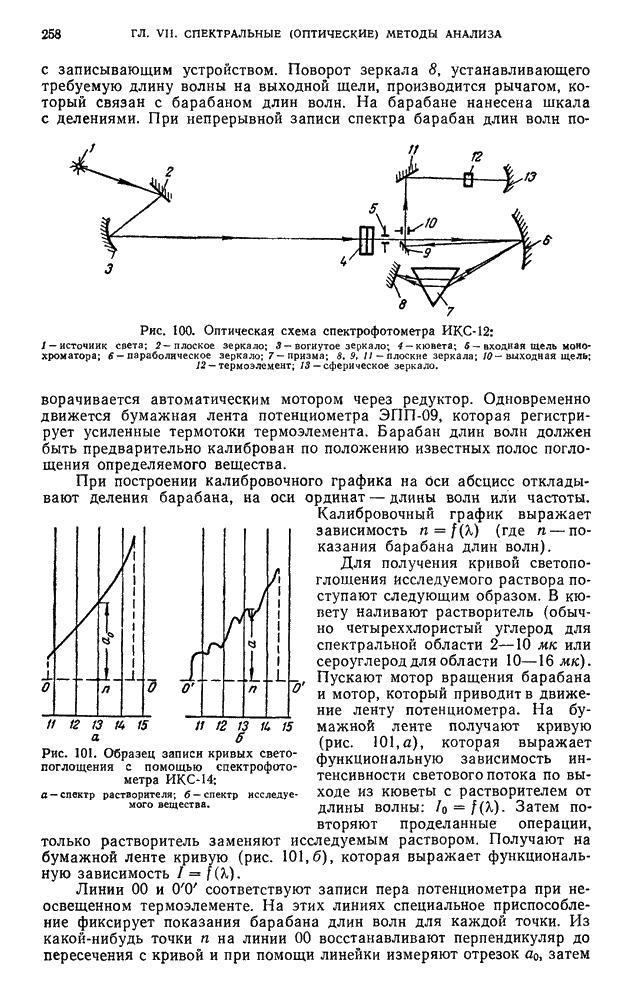
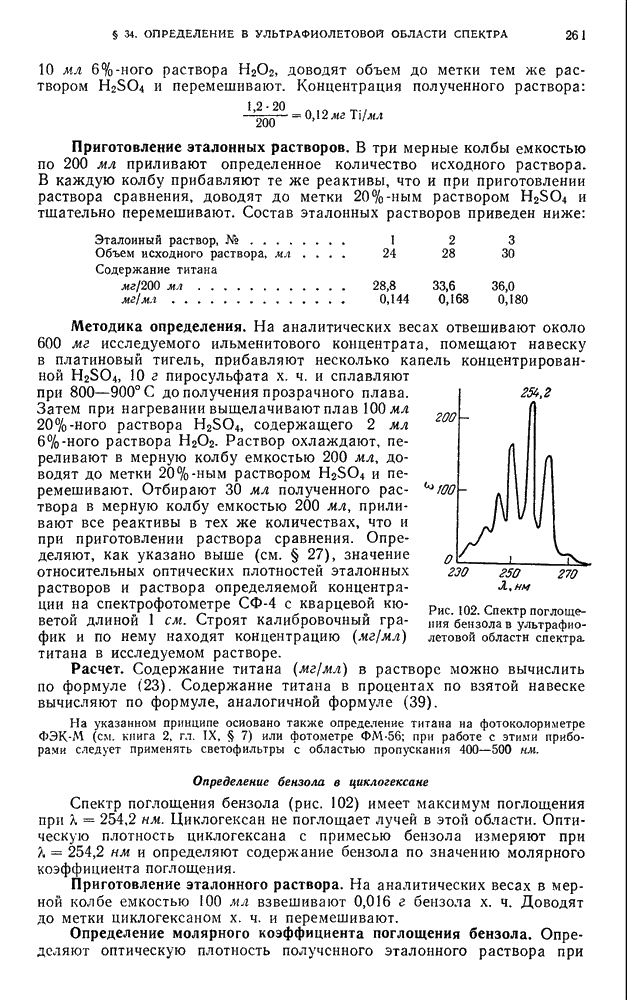
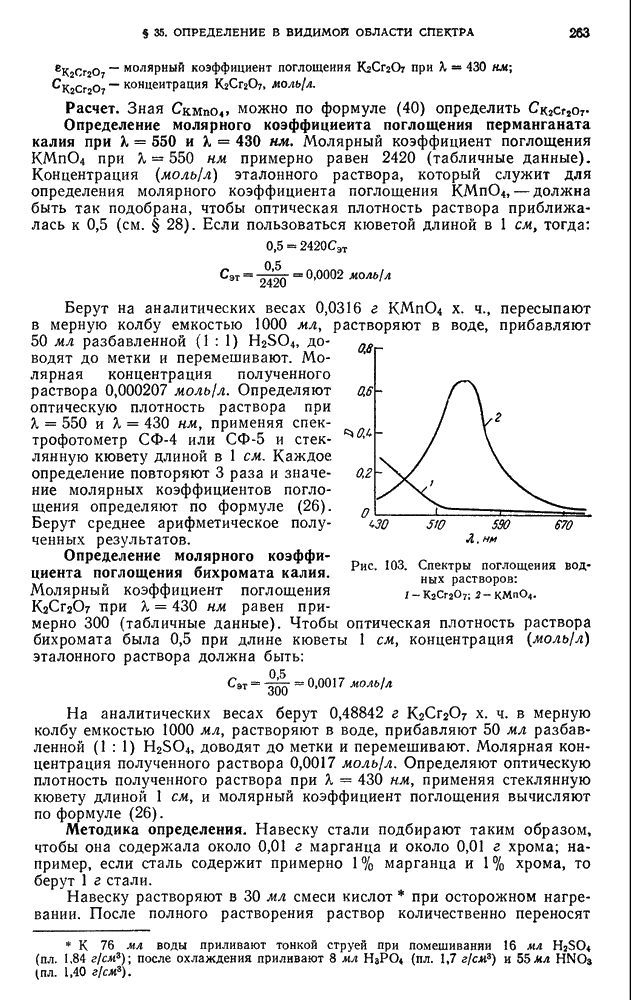
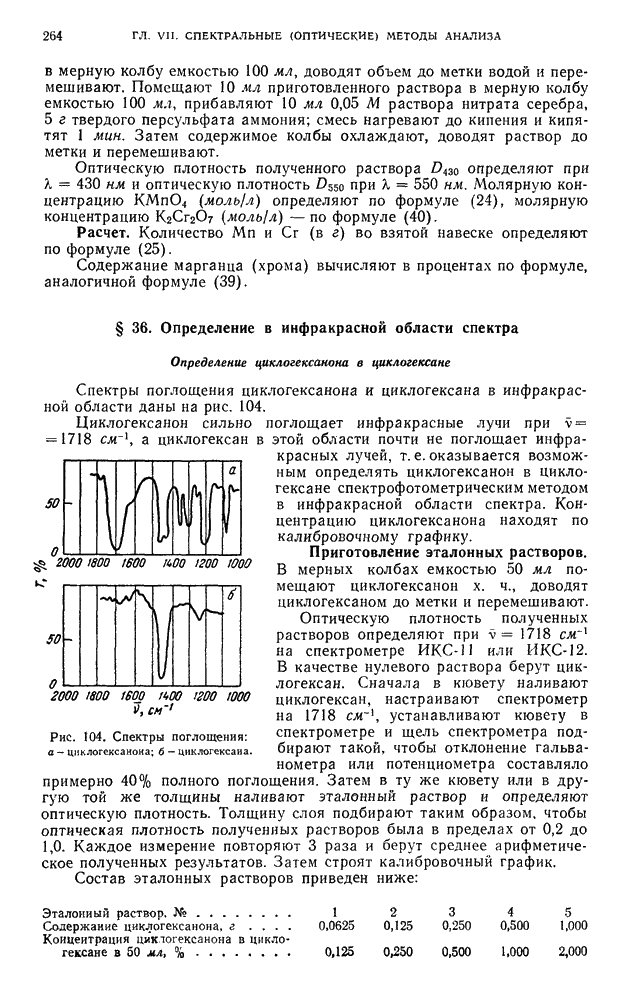
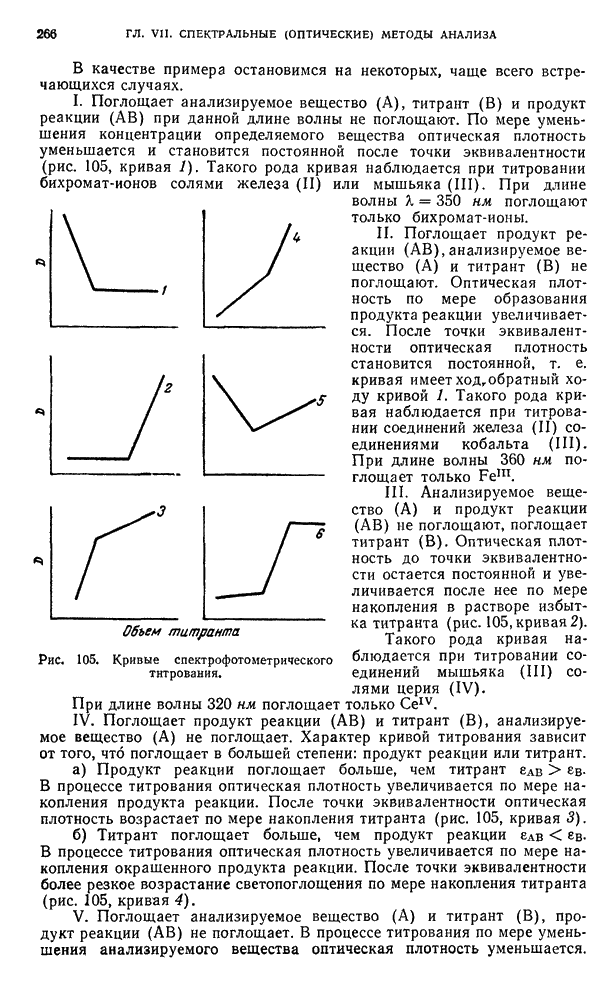
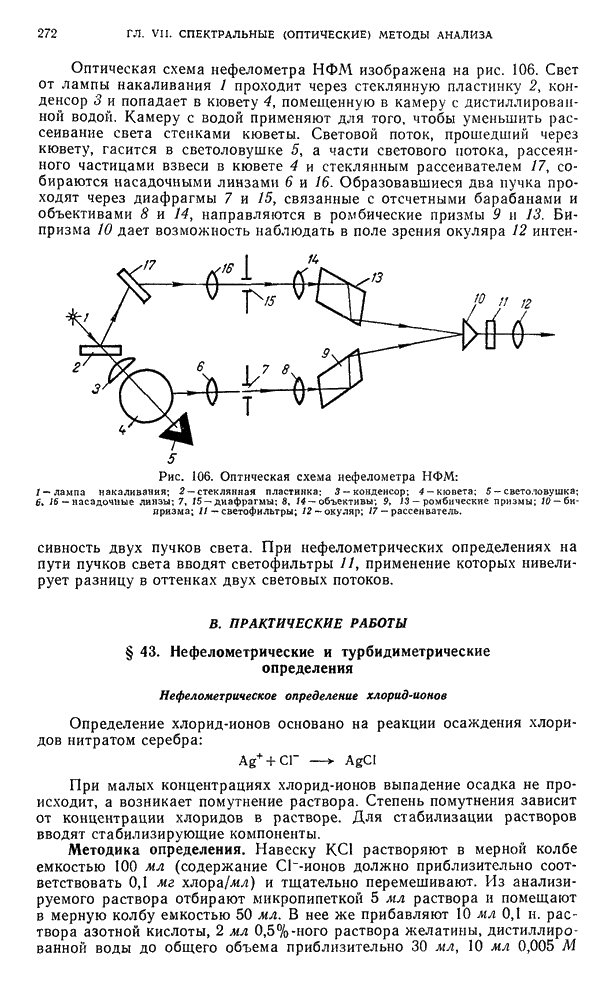
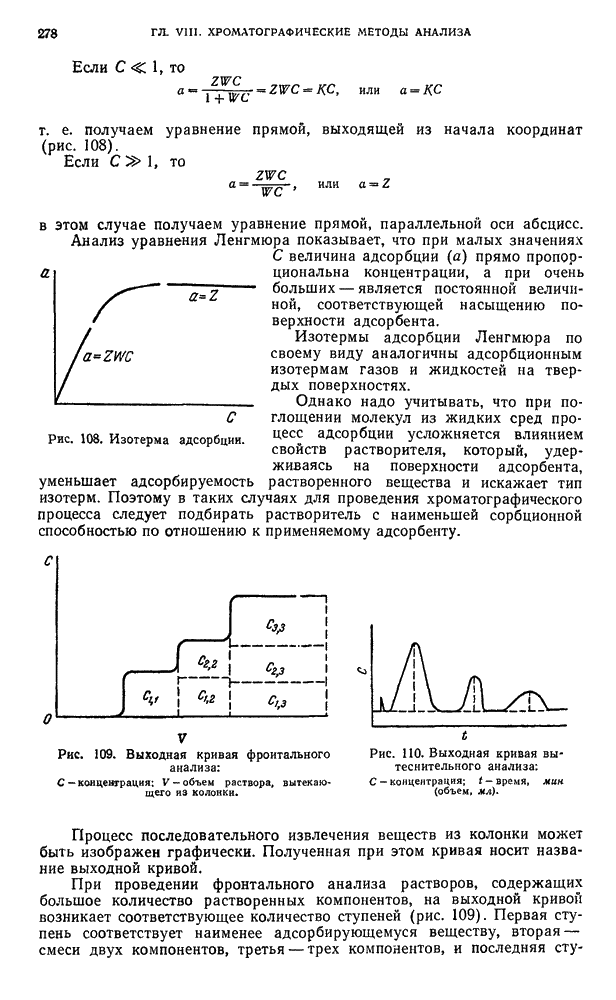
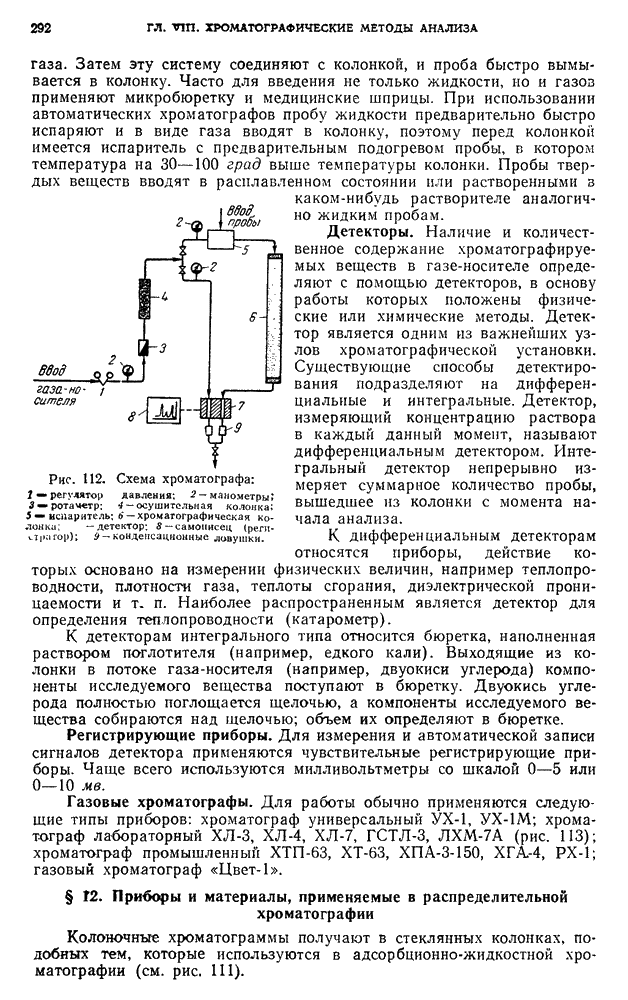
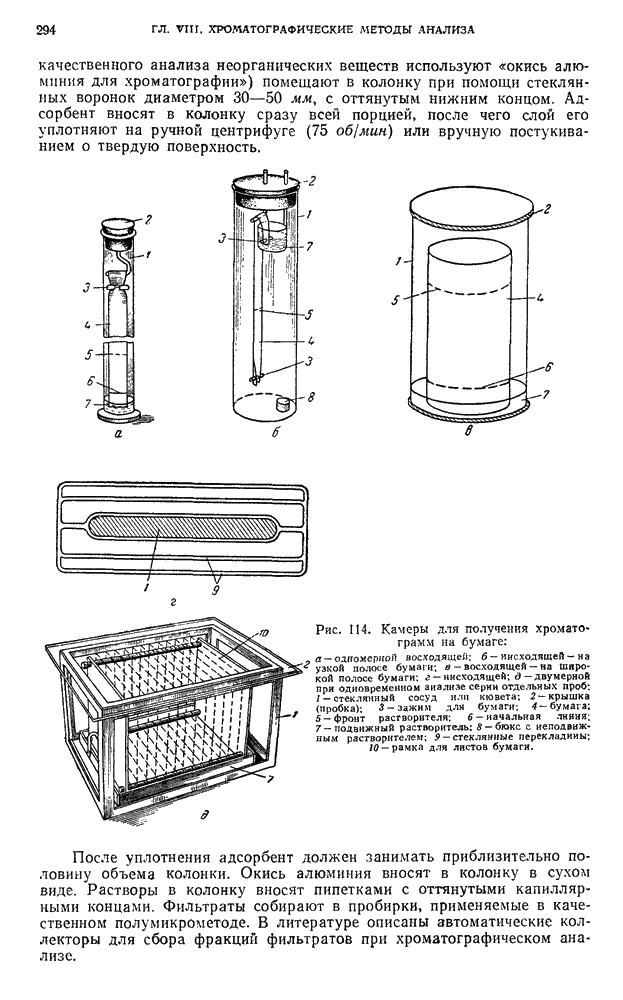
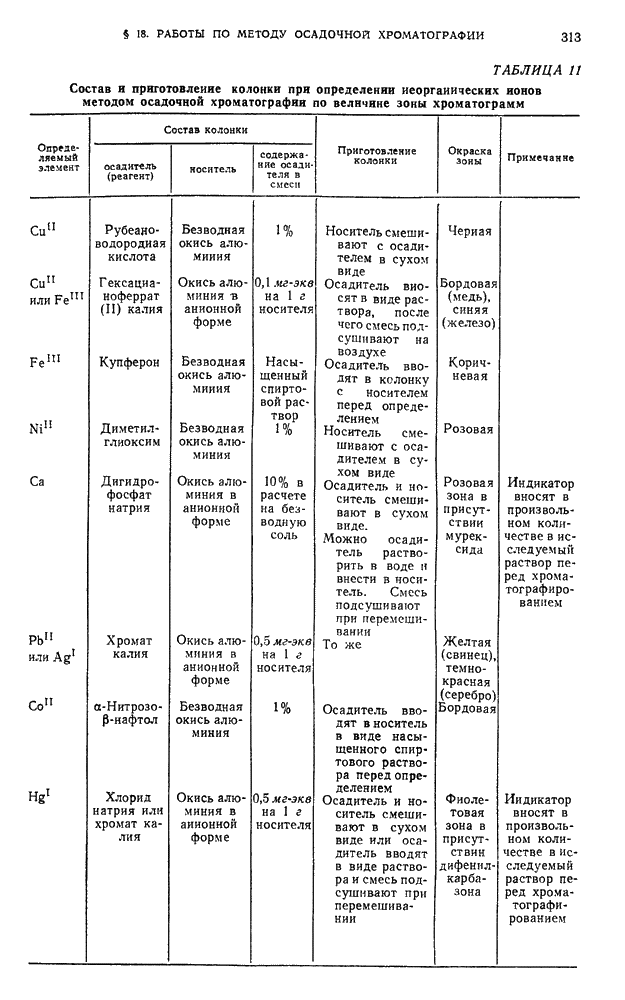
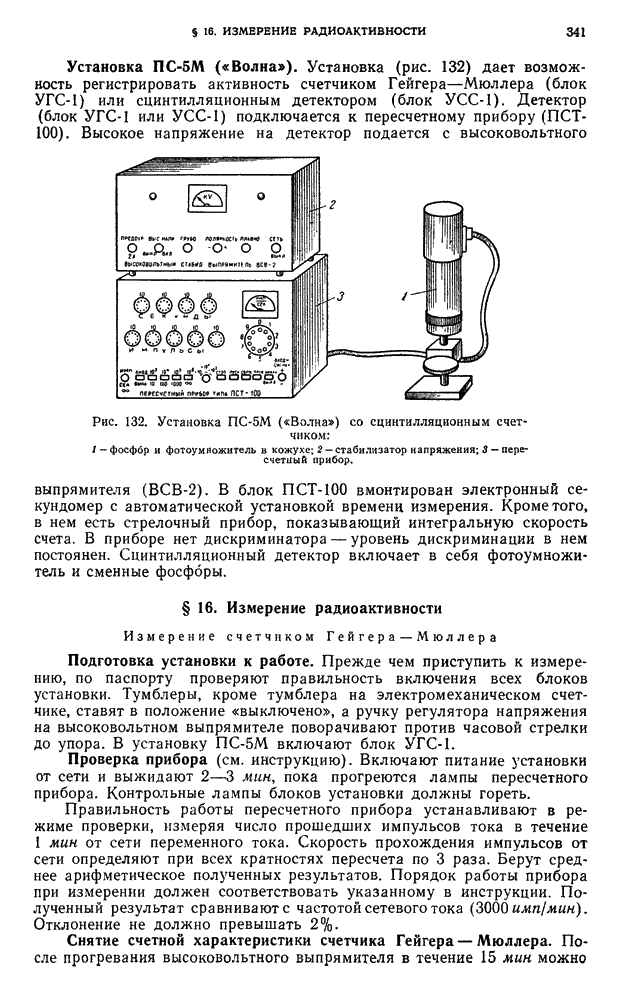
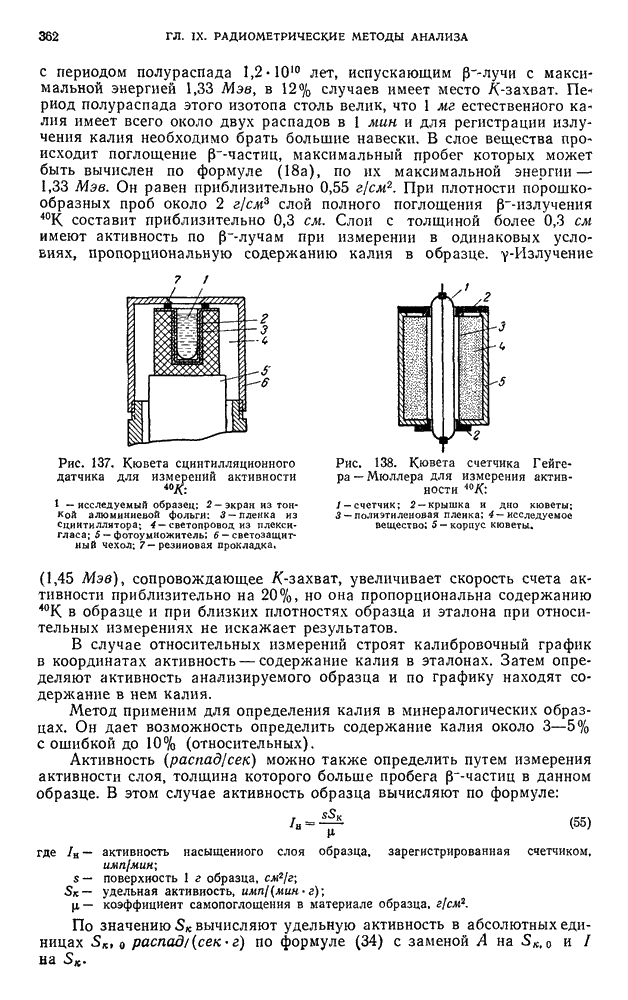
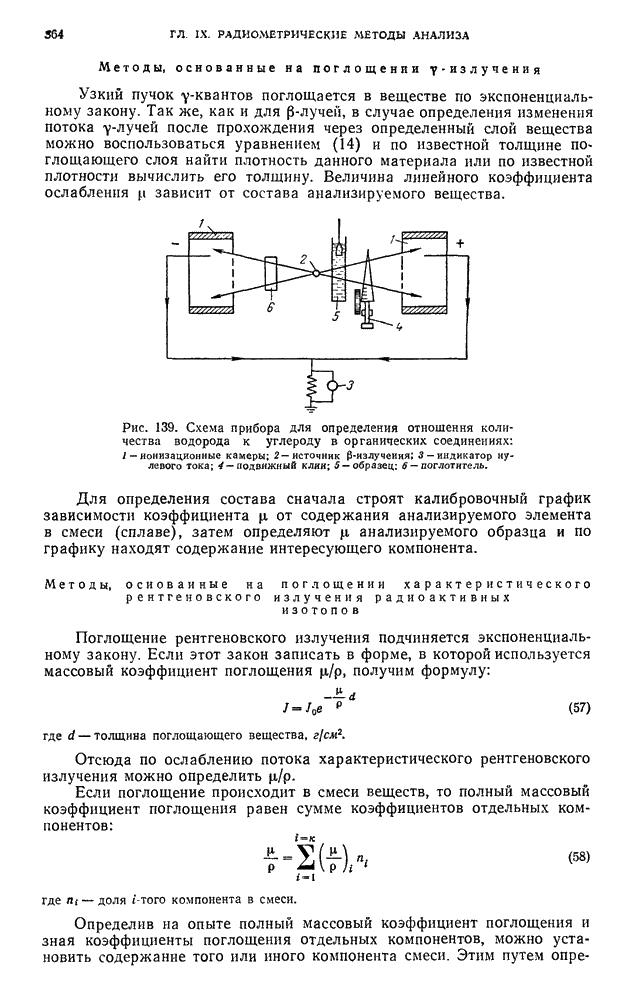
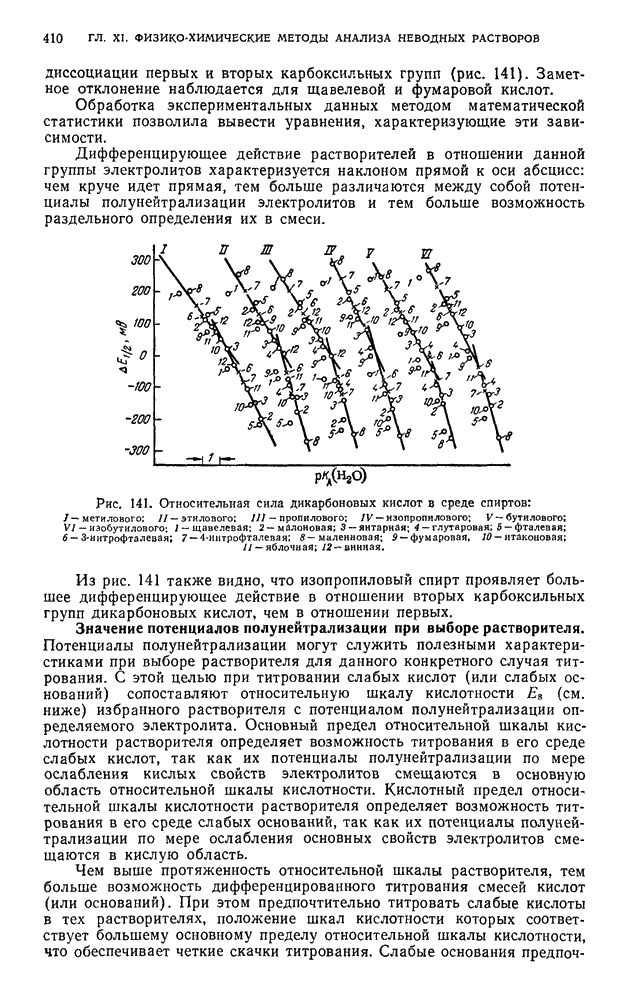
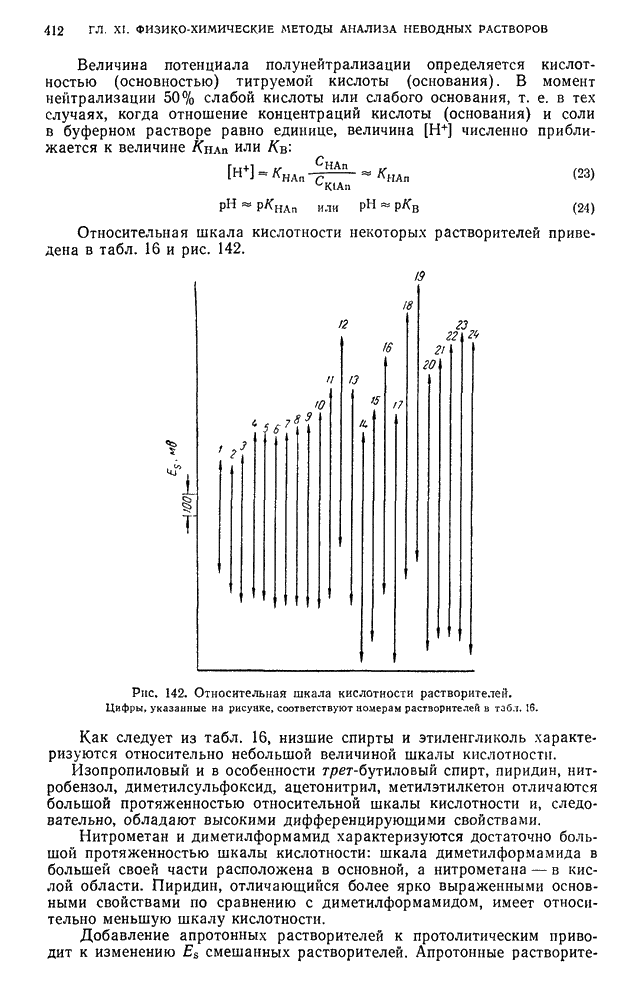
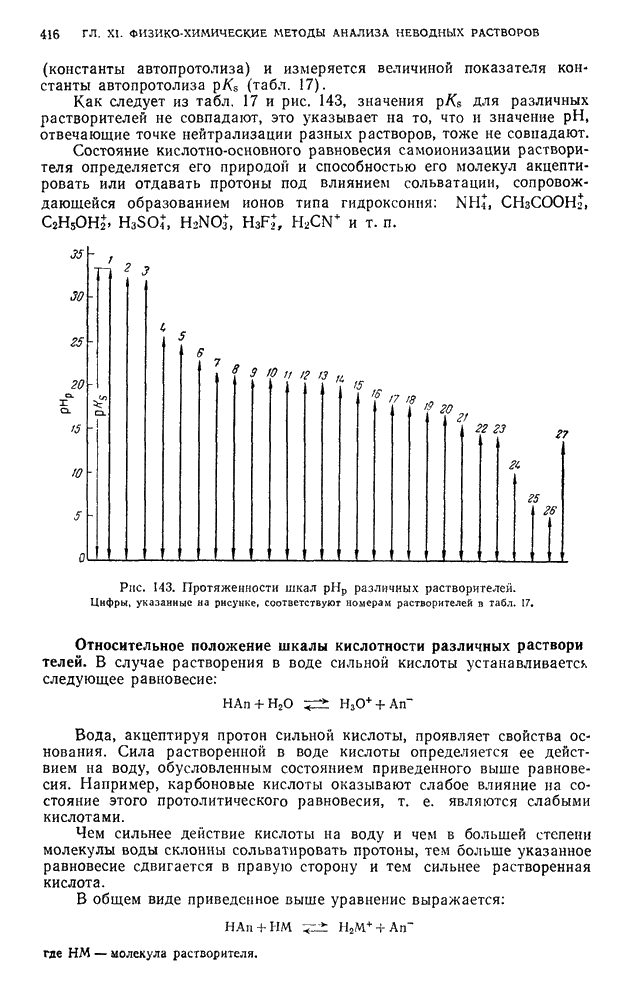
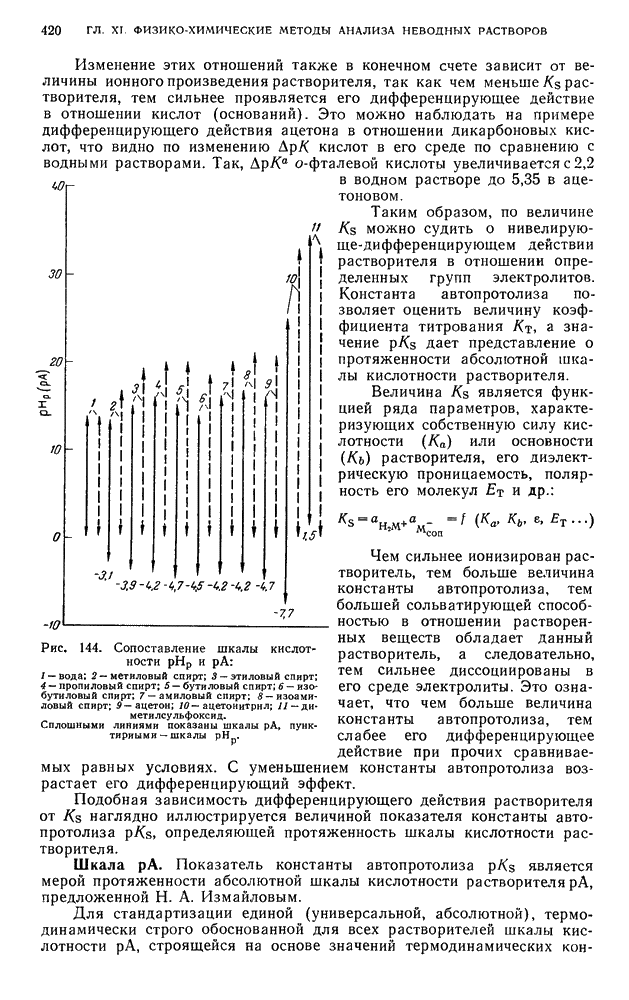
| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
ГЛАВА III. КОНДУКТОМЕТРИЯ и КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
А. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ МЕТОДА
§ 1. Удельная и эквивалентная электропроводность
Электропроводность растворов электролитов обусловливается движением ионов под действием электрического поля. Перенос электричества в растворах электролитов осуществляется ионами. Как и все проводники, растворы электролитов характеризуются определенным сопротивлением. Величина, обратная этому сопротивлению, называется электропроводностью:

где  — сопротивление раствора, ом;
— сопротивление раствора, ом;  — электропроводность раствора, выражаемая в обратных омах,
— электропроводность раствора, выражаемая в обратных омах,  .
.
Сопротивление раствора электролита прямо пропорционально расстоянию  между погруженными в него электродами и обратно пропорционально их площади
между погруженными в него электродами и обратно пропорционально их площади  :
:

Коэффициент пропорциональности  называется удельным сопротивлением. Если
называется удельным сопротивлением. Если  , то
, то  .
.
Следовательно, удельное сопротивление равно сопротивлению столба жидкости длиной в 1 см с поперечным сечением  , т. е. сопротивлению
, т. е. сопротивлению  раствора.
раствора.
Удельная электропроводность  представляет собой величину, обратную удельному сопротивлению:
представляет собой величину, обратную удельному сопротивлению:

Таким образом, удельная электропроводность соответствует электропроводности  раствора, находящегося между электродами площадью в
раствора, находящегося между электродами площадью в  , расположенными на расстоянии 1 см друг от друга.
, расположенными на расстоянии 1 см друг от друга.
Электропроводность электролитов удобнее относить к числу грамм-эквивалентов растворенного вещества. Поэтому было введено понятие эквивалентной электропроводности: Эквивалентная электропроводность (X) равна электропроводности такого объема раствора, помещенного между двумя параллельными электродами, расположенными на расстоянии 1 см, который содержит один грамм-эквивалент вещества.
Эквивалентная и удельная электропроводность связаны следующей зависимостью. Если концентрация электролита (С) выражена в грамм-эквивалентах на  , то в
, то в  раствора содержится
раствора содержится  грамм-эквивалентов. Объем (V) в кубических сантиметрах, содержащий 1 г-экв растворенного вещества, называется разбавлением.
грамм-эквивалентов. Объем (V) в кубических сантиметрах, содержащий 1 г-экв растворенного вещества, называется разбавлением.
Этот объем равен  . Эквивалентную электропроводность можно выразить через удельную электропроводность и разбавление
. Эквивалентную электропроводность можно выразить через удельную электропроводность и разбавление  -экв):
-экв):

Эквивалентные электропроводности (подвижности) ионов. Предположим что в растворе электролита на расстоянии I находятся электроды площадью S, к которым приложена разность потенциалов  как в растворах электричество переносится ионами, величина удельной электропроводности зависит от концентрации и заряда ионов, а также скорости их движения. Допустим, что электролит образует однозарядные ионы. Обозначим концентрацию электролита (С) в грамм-эквивалентах, а степень его диссоциации через а. Абсолютные скорости движения катионов и анионов при падении потенциала в 1 в на 1 см назовем
как в растворах электричество переносится ионами, величина удельной электропроводности зависит от концентрации и заряда ионов, а также скорости их движения. Допустим, что электролит образует однозарядные ионы. Обозначим концентрацию электролита (С) в грамм-эквивалентах, а степень его диссоциации через а. Абсолютные скорости движения катионов и анионов при падении потенциала в 1 в на 1 см назовем  и
и  . Если разность потенциалов между электродами Е, а расстояние между ними
. Если разность потенциалов между электродами Е, а расстояние между ними  , скорости катионов и анионов имеют значение
, скорости катионов и анионов имеют значение  и
и  . Сила тока, проходящего через раствор, зависит от количества ионов обоих знаков, перемещающихся в противоположных направлениях. Через поперечное сечение S между электродами в 1 сек пройдут все катионы и анионы, содержащиеся в объеме
. Сила тока, проходящего через раствор, зависит от количества ионов обоих знаков, перемещающихся в противоположных направлениях. Через поперечное сечение S между электродами в 1 сек пройдут все катионы и анионы, содержащиеся в объеме  .
.
Сила тока, т. е. количество электричества в кулонах, перенесенное ионами в 1 сек, равна:

где  — число Фарадея, равное 96 500 кулонов.
— число Фарадея, равное 96 500 кулонов.
Согласно закону  , отсюда электропроводность равна.
, отсюда электропроводность равна.

Если  , а 1—1 см, то W представляет собой удельную электропроводность
, а 1—1 см, то W представляет собой удельную электропроводность  :
:

Поскольку эквивалентная электропроводность  , находим:
, находим:

Абсолютные скорости движения ионов очень малы, поэтому пользуются величинами в F раз большими, называемыми подвижностями ионов. Подвижности ионов представляют собой эквивалентные электропроводности ионов, которые обозначают  и
и  . Отсюда значения удельной и эквивалентной электропроводности могут быть выражены:
. Отсюда значения удельной и эквивалентной электропроводности могут быть выражены:

и

При бесконечно большом разбавлении  и эквивалентная электропроводность стремится к наибольшему значению
и эквивалентная электропроводность стремится к наибольшему значению  . В этом случае
. В этом случае

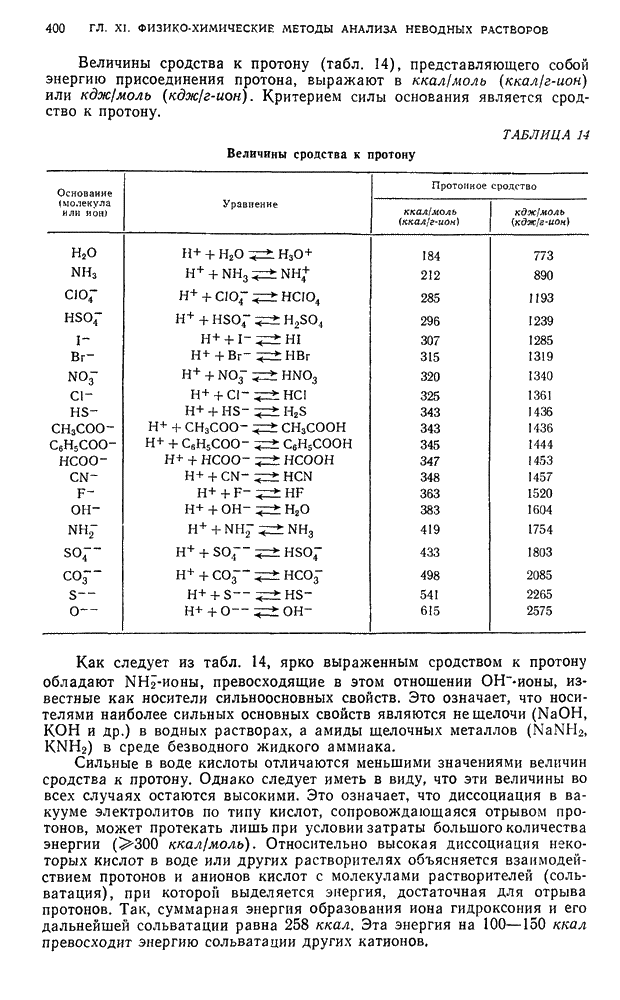
Таким образом, предельная эквивалентная электропроводность равна сумме предельных эквивалентных электропроводностей ионов или сумме подвижностей ионов при бесконечном разбавлении. Предельные эквивалентные электропроводности некоторых ионов приведены в табл. 4.
ТАБЛИЦА 4. Предельная эквивалентная электропроводность (подвижность) ионов  в водных растворах при
в водных растворах при 

Подвижности ионов имеют большое значение для кондуктометрических определений,  этих величин, изменяющихся в связи с изменеаием состава ионов, можно предвидеть характер изменения
этих величин, изменяющихся в связи с изменеаием состава ионов, можно предвидеть характер изменения  в процессе титрования.
в процессе титрования.
Влияние природы электролита и растворителя на электропроводность. Природа электролитами растворителя оказывает большое влияние на электропроводность. Как видно из табл. 4, ионы обладают различной подвижностью. Аномально высокой подвижностью в водных растворах обладают  -ионы
-ионы  и
и  -ионы
-ионы  . Это объясняется специфическим механизмом их движения в растворе. Перемещение этих ионов к электродам осуществляется «эстафетным» путем. Находящиеся в растворе ионы гидроксония
. Это объясняется специфическим механизмом их движения в растворе. Перемещение этих ионов к электродам осуществляется «эстафетным» путем. Находящиеся в растворе ионы гидроксония  передают свои протоны соседним молекулам воды, которые в свою очередь превращаются в ионы гидроксония, а протоны перемещаются по направлению к катоду. Аналогичные процессы происходят и с участием гидроксильных ионов. Другие катионы и анионы в водных растворах сравнительно мало различаются своей подвижностью; изменение подвижности наблюдается в пределах 30—70.
передают свои протоны соседним молекулам воды, которые в свою очередь превращаются в ионы гидроксония, а протоны перемещаются по направлению к катоду. Аналогичные процессы происходят и с участием гидроксильных ионов. Другие катионы и анионы в водных растворах сравнительно мало различаются своей подвижностью; изменение подвижности наблюдается в пределах 30—70.
В других растворителях электропроводность электролитов изменяется. Наибольшее влияние при этом оказывает вязкость растворителя и его диэлектрическая проницаемость; изменяются скорости движения ионов, степени диссоциации электролитов, а в растворителях с низкими значениями диэлектрической проницаемости наблюдаются процессы ассоциации ионов.
Подвижности водородных и гидроксильных ионов уменьшаются и в некоторых средах мало отличаются от подвижностей других ионов.
Влияние концентрации электролита на электропроводность. Сильные электролиты. Сильные электролиты в водных растворах практически полностью диссоциированы и для них принимают степень диссоциации а, равную 1. Однако абсолютные скорости движения, а следовательно, и подвижности зависят от концентрации ионов в растворе, что объясняется силами межионного взаимодействия. С увеличением концентрации уменьшаются расстояния между ионами и увеличиваются межионные взаимодействия, что приводит к торможению движения катионов и анионов, а следовательно, к понижению их подвижности. Поэтому эквивалентная электропроводность сильных электролитов, имеющая максимальное значение при бесконечном разбавлении, уменьшается с повышением концентрации.
Отношение эквивалентной электропроводности при данной концентрации к эквивалентной электропроводности при бесконечном разбавлении называется коэффициентом электропроводности  . Этим коэффициентом вносится поправка на силы межионного взаимодействия. Величину
. Этим коэффициентом вносится поправка на силы межионного взаимодействия. Величину  электропроводности сильного электролита при данной концентрации с учетом коэффициента электропроводности находят по формуле:
электропроводности сильного электролита при данной концентрации с учетом коэффициента электропроводности находят по формуле:

При малых концентрациях зависимость эквивалентной электропроводности сильного электролита от концентрации выражается эмпирическим уравнением:

где а постоянная, зависящая от природы растворителя и температуры; С — концентрация электролита.
Удельная электропроводность сильных электролитов с учетом коэффициента электропроводности выражается формулой:

С увеличением концентрации удельная электропроводность сильных электролитов сначала возрастает, а затем может понижаться, что приводит к появлению максимума удельной электропроводности. Это объясняется влиянием двух факторов. С одной стороны, увеличение концентрации вызывает повышение электропроводности, так как увеличивается содержание ионов в единице объема. С другой стороны, увеличение концентрации снижает скорость движения ионов, что уменьшает проводимость. Однако максимумы обнаруживаются для концентрированных растворов, которые обычно не применяются в аналитической практике.
Слабые электролиты. Растворы слабых электролитов имеют невысокие концентрации ионов, и межионные взаимодействия в них невелики. Поэтому в разбавленных растворах  может быть принят равным единице, а эквивалентные электропроводности ионов можцо считать равными их предельному значению
может быть принят равным единице, а эквивалентные электропроводности ионов можцо считать равными их предельному значению  . Следовательно, в разбавленных растворах удельная и эквивалентная электропроводности равны:
. Следовательно, в разбавленных растворах удельная и эквивалентная электропроводности равны:

и

Таким образом, большое влияние на электропроводность слабых электролитов оказывает степень их диссоциации. С разбавлением эквивалентная электропроводность слабых электролитов растет вследствие увеличения степени диссоциации и принимает максимальное значение при бесконечном разбавлении  .
.
При кондуктометрическом определении слабых электролитов большое значение имеют величины констант диссоциации, так как они дают возможность рассчитывать равновесные концентрации ионов при данном разбавлении и предугадывать характер изменения проводимости раствора при титровании.
Удельная электропроводность слабых электролитов незначительно увеличивается с повышением концентрации. При высоких концентрациях уменьшение степени диссоциации может вызвать ее понижение.
Если раствор представляет смесь электролитов, величину удельной электропроводности разбавленных растворов вычисляют по уравнению:

 — концентрация ионов;
— концентрация ионов;  — эквивалентные электропроводности ионов.
— эквивалентные электропроводности ионов.
Влияние температуры на электропроводность. Зависимость удельной электропроводности от температуры выражают уравнением:

где  — удельная электропроводность раствора при
— удельная электропроводность раствора при  ;
;  — коэффициенты, зависящие от природы электролита и концентрации;
— коэффициенты, зависящие от природы электролита и концентрации;  — температура.
— температура.
С повышением температуры электропроводность увеличивается, так как уменьшение вязкости раствора приводит к увеличению подвижности ионов. Увеличение степени диссоциации также может привести к повышению электропроводности. Повышение температуры на 1 град вызывает увеличение электропроводности раствора на  .
.
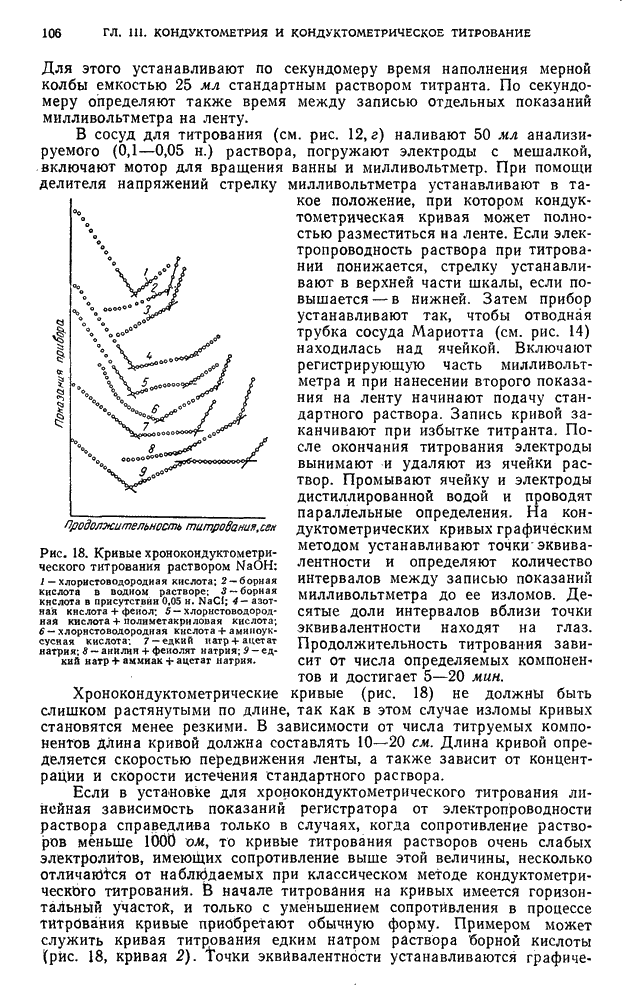
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- ГЛАВА I. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКИХ (ИНСТРУМЕНТАЛЬНЫХ) МЕТОДОВ АНАЛИЗА
- § 1. Особенности физико-химических методов анализа
- § 2. Области применения инструментальных методов анализа
- § 3. Анализ веществ высокой чистоты
- § 4. Повышение чувствительности и точности методов определения следов примесей
- § 5. Инструментальные методы титрования
- § 6. Применение физико-химических методов анализа для определения индивидуальных соединений
- § 7. Применение физико-химических методов для анализа смесей веществ
- § 8. Классификация инструментальных количественных методов анализа
- § 9. Электрохимические методы анализа
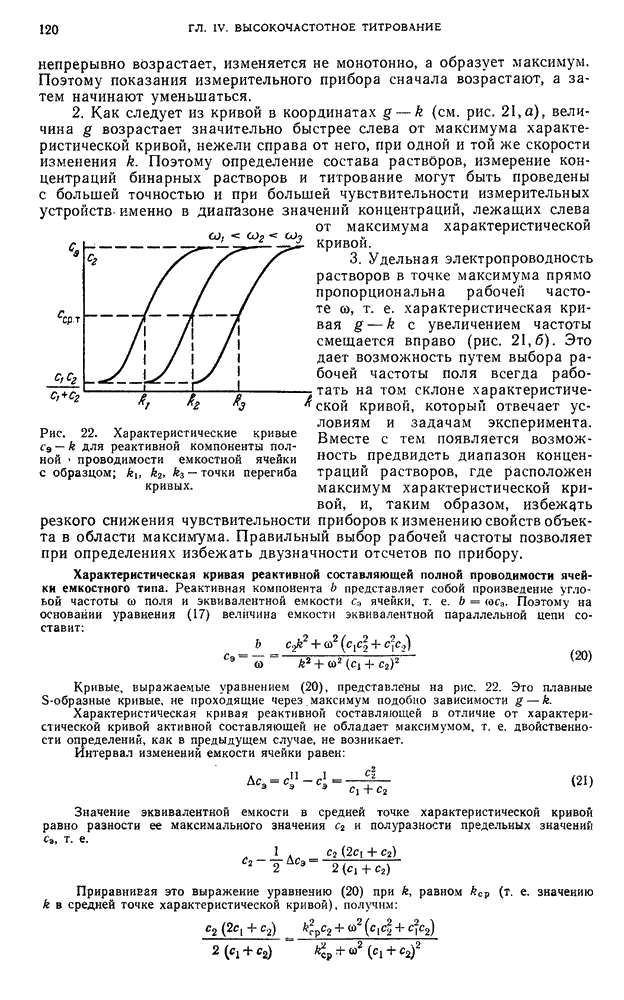
- § 10. Спектральные (оптические) методы анализа
- § 11. Хроматографические методы анализа
- § 12. Радиометрические методы анализа
- § 13. Масс-спектрометрические методы анализа
- § 14. Физико-химический анализ по Н. С. Курнакову
- § 15. Другие методы анализа
- ГЛАВА II. ПОТЕНЦИОМЕТРИЯ И ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
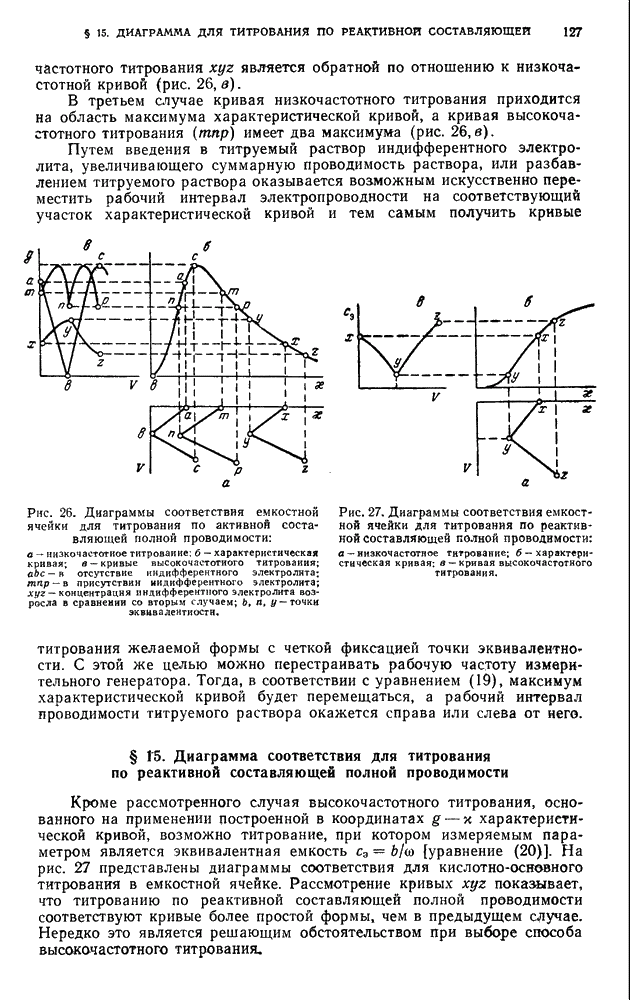
- § 1. Зависимость величины электродных потенциалов от концентрации (активности)
- § 2. Применение потенциометрического метода анализа
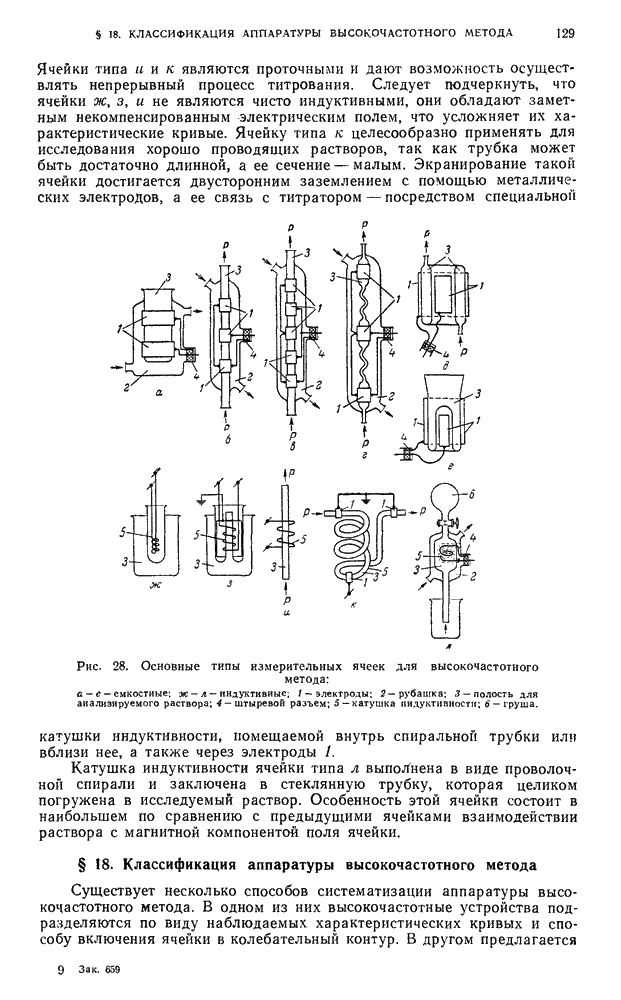
- § 3. Потенциометрическое титрование
- § 4. Потенциометрическое титрование без тока (i=0)
- § 5. Различные способы нахождения конечной точки потенциометрического титрования
- § 6. Некомпенсационный метод потенциометрического титрования
- § 7. Потенциометрическое титрование под током (i != 0)
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 8. Измерение электродвижущей силы
- § 9. Установка для поляризации электродов при потенциометрическом титровании под током
- § 10. Некоторые приборы, применяемые в потенциометрическом титровании
- § 11. Электроды
- В. ПРАКТИЧЕСКИЕ РАБОТЫ ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ БЕЗ ТОКА (i=0)
- § 12. Кислотно-основное титрование
- § 13. Титрование по методу окисления — восстановления
- § 14. Титрование по методу осаждения
- § 15. Титрование по методу комплексообразования
- ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ ПОД ТОКОМ (i != 0)
- § 16. Титрование по методу окисления — восстановления
- ГЛАВА III. КОНДУКТОМЕТРИЯ и КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 1. Удельная и эквивалентная электропроводность
- § 2. Кондуктометрическне методы анализа
- § 3. Кислотно-основное титрование
- § 4. Титрование, основанное на реакциях осаждения
- § 5. Титрование, основанное на реакциях окисления — восстановления
- § 6. Титрование, основанное на реакциях комплексообразования
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 7. Измерение электропроводности растворов
- § 8. Конструкции электролитических ячеек
- § 9. Измерения в хронокондуктометрическом титровании
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 10. Подготовка к определению
- §11. Определение индивидуальных кислот методом кондуктометрического титрования
- § 12. Определение индивидуальных оснований методом кондуктометрического титрования
- § 13. Анализ смесей оснований методом кондуктометрического титрования
- § 14. Определение солей методом кондуктометрического титрования
- § 15. Анализ смесей кислот и солей слабых оснований методом кондуктометрического титрования
- § 16. Анализ смесей кислот методом хронокондуктометрического титрования
- § 17. Анализ смесей оснований и солей слабых кислот методом хронокондуктометрического титрования
- ГЛАВА IV. ВЫСОКОЧАСТОТНОЕ ТИТРОВАНИЕ
- § 1. Общие положения теории высокочастотного титрования
- § 2. Физические основы и погрешности метода высокочастотного титрования
- § 3. Физические основы метода диэлкометрического титрования
- § 4. Погрешности метода диэлкометрического титрования
- ТЕОРИЯ ИЗМЕРИТЕЛЬНЫХ ЯЧЕЕК ЕМКОСТНОГО ТИПА
- § 5. Электрическая эквивалентная схема ячейки и физические процессы, протекающие в ее объеме
- § 6. Импеданс и полная проводимость ячейки
- § 7. Характеристические кривые ячейки
- § 8. Чувствительность ячейки
- § 9. Критерий применимости и постоянная с-ячейки
- ТЕОРИЯ ИЗМЕРИТЕЛЬНЫХ ЯЧЕЕК ИНДУКТИВНОГО ТИПА
- § 10. Электрическая эквивалентная схема ячейки
- § 11. Импеданс и характеристические кривые ячейки
- § 12. Критерий применимости и постоянная L-ячейки
- § 13. Влияние на характеристические кривые ячейки ее некомпенсированного электрического поля
- ДИАГРАММЫ СООТВЕТСТВИЯ
- § 14. Диаграмма соответствия для титрования по активной составляющей полной проводимости
- § 15. Диаграмма соответствия для титрования по реактивной составляющей полной проводимости
- § 16. Выбор типа диаграмм
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 17. Измерительные ячейки (датчики) высокочастотного метода и области их применения
- § 18. Классификация аппаратуры высокочастотного метода
- § 19. Высокочастотные титраторы
- § 20. Общие правила работы с приборами для высокочастотного анализа
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 21. Высокочастотное титрование стандартных растворов
- § 22. Высокочастотное титрование растворов неизвестной концентрации
- ГЛАВА V. ПОЛЯРОГРАФИЧЕСКИЙ МЕТОД АНАЛИЗА И АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 1. Предельный, или диффузионный, ток
- § 2. Возникновение диффузионного тока на твердых микроэлектродах
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ ПОЛЯРОГРАФИЧЕСКОГО АНАЛИЗА
- § 3. Полярографы
- § 4. Электролитическая ячейка
- § 5. Электролизеры
- § 6. Электроды сравнения
- § 7. Снятие полярограммы на полярографической установке с визуальным полярографом
- § 8. Методы количественного полярографического анализа
- § 9. Правила техники безопасности при работе с металлической ртутью
- В. НОВЫЕ НАПРАВЛЕНИЯ В ПОЛЯРОГРАФИИ
- § 10. Амальгамная полярография с накоплением
- § 11. Осциллографическая полярография
- § 12. Переменнотоковая полярография
- Г. ПРАКТИЧЕСКИЕ РАБОТЫ С ПРИМЕНЕНИЕМ ПОЛЯРОГРАФИЧЕСКОГО МЕТОДА АНАЛИЗА
- § 13. Примеры полярографических определений
- АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 14. Особенности амперометрического титрования
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АМПЕРОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
- § 15. Схема установки и применяемые электроды
- § 16. Амперометрическое титрование с двумя индикаторными электродами
- В. ПРАКТИЧЕСКИЕ РАБОТЫ С ПРИМЕНЕНИЕМ АМПЕРОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
- § 17. Примеры амперометрического титрования
- ГЛАВА VI. КУЛОНОМЕТРИЯ И КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 1. Сущность и классификация кулонометрических методов
- ПРЯМАЯ КУЛОНОМЕТРИЯ
- § 2. Прямая кулонометрия при постоянном потенциале рабочего электрода (прямая потенциостатическая кулонометрия)
- § 3. Использование прямой потенциостатической кулонометрии
- § 4. Прямая кулонометрия при постоянной силе тока электролиза (прямая амперостатическая кулонометрия)
- § 5. Использование прямой амперостатической кулонометрии
- КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 6. Кулонометрическое титрование при постоянной силе тока электролиза
- § 7. Использование амперостатического кулонометрического титрования
- § 8. Кулонометрическое титрование првд постоянном потенциале рабочего электрода
- § 9. Особенности кулонометрических методов анализа
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 10. Электроды
- § 11. Электролизеры
- § 12. Приборы для измерения количества электричества, израсходованного на электролиз вещества
- § 13. Приборы, обеспечивающие стабильность потенциала рабочего электрода или силы тока электролиза, и установки для кулонометрического анализа
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 14. Работы, выполняемые методом прямой кулонометрии
- § 15. Работы, выполняемые методом косвенной кулонометрии, или кулонометрического титрования, при постоянной силе тока электролиза
- ГЛАВА VII. СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА
- § 1. Общая характеристика метода
- § 2. Классификация методов эмиссионного спектрального анализа
- § 3. Качественный спектральный анализ
- § 4. Полуколичественные методы спектрального анализа
- § 5. Количественный спектральный анализ
- § 6. Основы фотографического метода эмиссионного количественного анализа
- § 7. Зависимость между почернением фотопластинки и интенсивностью излучения
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 8. Источники возбуждения спектров
- § 9. Спектральные приборы
- § 10. Вспомогательные приборы и принадлежности
- § 11. Микрофотометр МФ-2
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 12. Качественный анализ при помощи стилоскопа
- § 13. Качественный анализ фотографическим методом при помощи спектра железа в ультрафиолетовой области
- § 14. Полуколичественный анализ
- § 15. Количественный анализ
- СПЕКТРОФОТОМЕТРИЯ ПЛАМЕНИ
- § 16. Общая характеристика метода
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 17. Схема установки, применяемой для анализа методом спектрофотометрии пламени
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 18. Определения по методу спектрофотометрии пламени
- АТОМНО-АБСОРБЦИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ
- § 19. Общая характеристика метода
- МОЛЕКУЛЯРНО-АБСОРБЦИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ
- § 20. Общая характеристика метода
- § 21. Законы поглощения света
- § 22. Отклонения от закона Бугера—Ламберта—Бера
- § 23. Качественный анализ спектрофотометрическим методом
- § 24. Количественный анализ спектрофотометрическим методом
- § 25. Методы определения концентрации веществ, поглощающих в видимой и ультрафиолетовой областях спектра
- § 26. Определение нескольких компонентов в растворе
- § 27. Определение концентрации вещества в растворе дифференциальным методом
- § 28. Выбор толщины слоя и оптимальной концентрации исследуемого раствора
- § 29. Выбор длины волны поглощаемого излучения при спектрофотометрических измерениях
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 30. Приборы, применяемые для спектрофотометрического анализа в ультрафиолетовой и видимой областях спектра
- § 31. Приборы, применяемые для колориметрического анализа
- § 32. Приборы, применяемые для спектрофотометрического анализа в инфракрасной области спектра
- § 33. Нулевые растворы
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 34. Определение в ультрафиолетовой области спектра
- § 35. Определение в видимой области спектра
- § 36. Определение в инфракрасной области спектра
- СПЕКТРОФОТОМЕТРИЧЕСКИЕ (ФОТОМЕТРИЧЕСКИЕ) МЕТОДЫ ТИТРОВАНИЯ
- § 37. Общая характеристика метода
- § 38. Кривые спектрофотометрического титрования
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ ТИТРОВАНИЯ
- § 39. Установки для спектрофотометрического титрования
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 40. Спектрофотометрическое титрование
- НЕФЕЛОМЕТРИЧЕСКИЙ И ТУРБИДИМЕТРИЧЕСКИЙ МЕТОДЫ АНАЛИЗА
- § 41. Общая характеристика методов
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 42. Приборы, применяемые для нефелометрических и турбидиметрических измерений
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 43. Нефелометрические и турбидиметрические определения
- § 44. Фототурбидиметрическое и фотонефелометрическое титрование
- ГЛАВА VIII. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- § 1. Классификация хроматографических методов анализа
- § 2. Адсорбционная хроматография
- § 3. Разновидности газовой хроматографии
- § 4. Распределительная хроматография
- § 5. Ионообменная хроматография
- § 6. Константа ионного обмена
- § 7. Осадочная хроматография
- § 8. Окислительно-восстановительная хроматография
- § 9. Адсорбционно-комплексообразовательная хроматография
- § 10. Хроматографические колонки, применяемые в адсорбционно-жидкостной хроматографии
- § 11. Аппаратура, применяемая в газовой хроматографии
- § 12. Приборы и материалы, применяемые в распределительной хроматографии
- § 13. Колонки, применяемые в ионообменной хроматографии
- § 14. Колонки, применяемые в осадочной и окислительновосстановительной хроматографии
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 15. Работы по методу адсорбционной (жидкостной и газовой) хроматографии
- § 16. Работы по методу распределительной хроматографии
- § 17. Работы по методу ионообменной хроматографии
- § 18. Работы по методу осадочной хроматографии
- § 19. Работы по методу окислительно-восстановительной хроматографии
- § 20. Работы по методу адсорбционно-комплексообразовательной хроматографии
- ГЛАВА IX. РАДИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- § 1. Виды радиоактивного распада
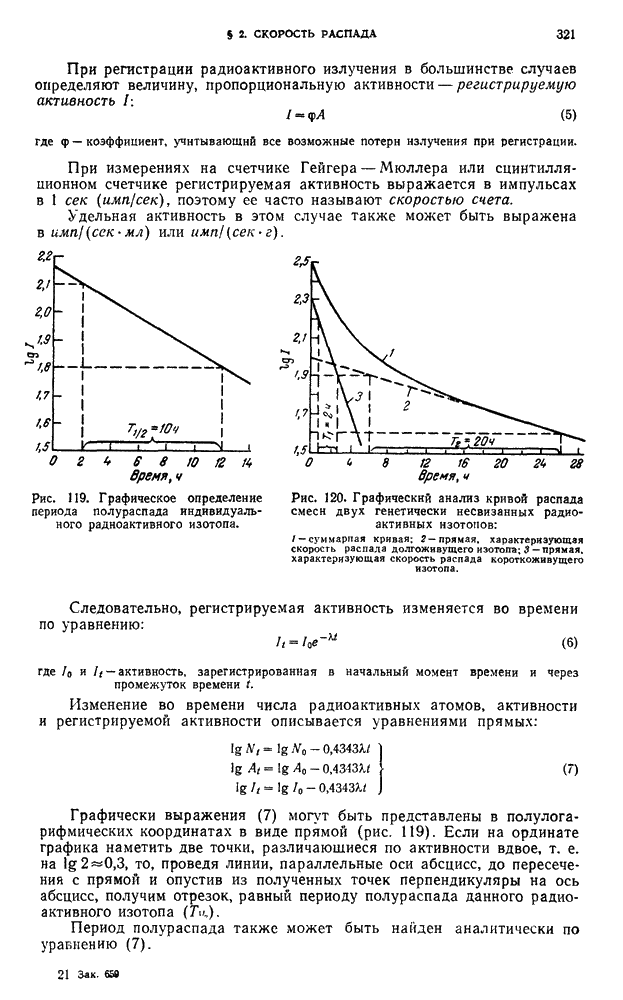
- § 2. Скорость распада
- § 3. Взаимодействие излучения с веществом
- § 4. Ошибки при измерении радиоактивности
- Б. ЭЛЕМЕНТЫ ТЕХНИКИ БЕЗОПАСНОСТИ ПРИ РАБОТЕ С РАДИОАКТИВНЫМИ ВЕЩЕСТВАМИ
- § 5. Понятия и единицы измерения
- § 6. Классификация источников радиоактивного излучения и радиоактивных изотопов
- § 7. Классификация химических операций с радиоактивными веществами
- § 8. Устройство лабораторий и классификация работ
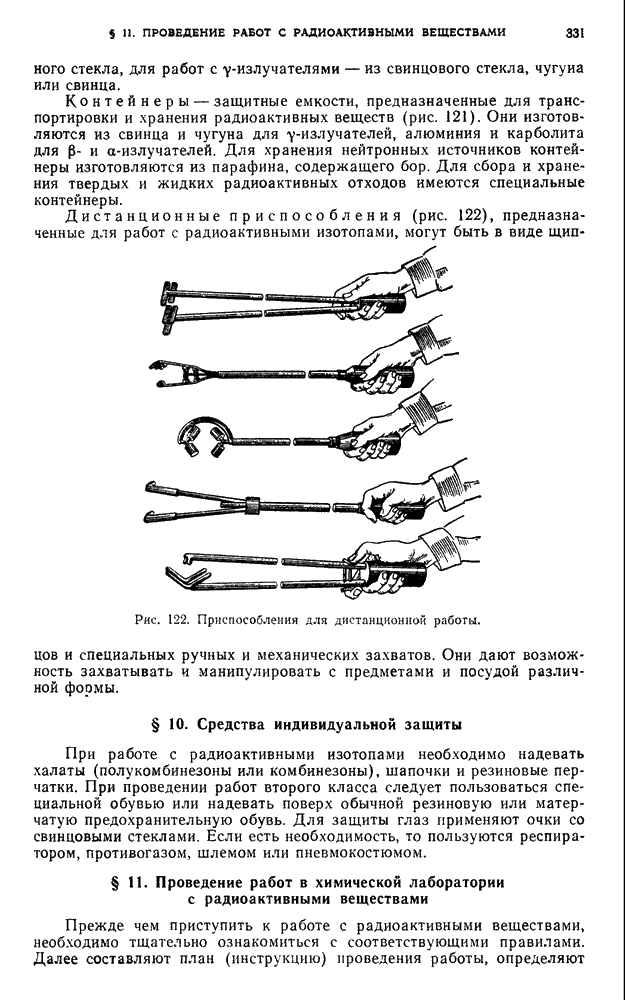
- § 9. Специальное оборудование для работ с радиоактивными веществами
- § 10. Средства индивидуальной защиты
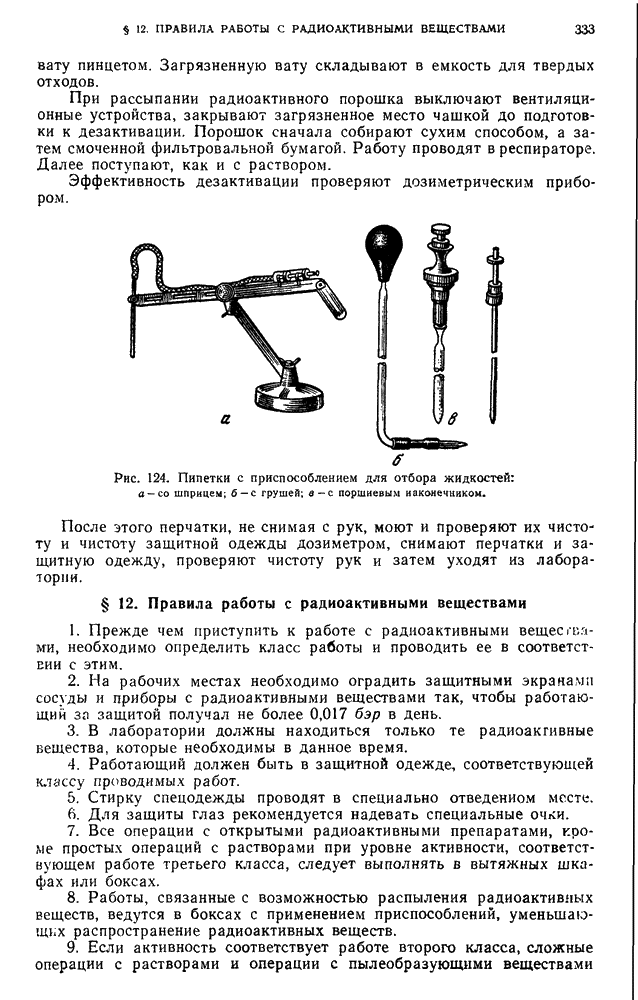
- § 11. Проведение работ в химической лаборатории с радиоактивными веществами
- § 12. Правила работы с радиоактивными веществами
- В. МЕТОДЫ РЕГИСТРАЦИИ РАДИОАКТИВНОГО ИЗЛУЧЕНИЯ
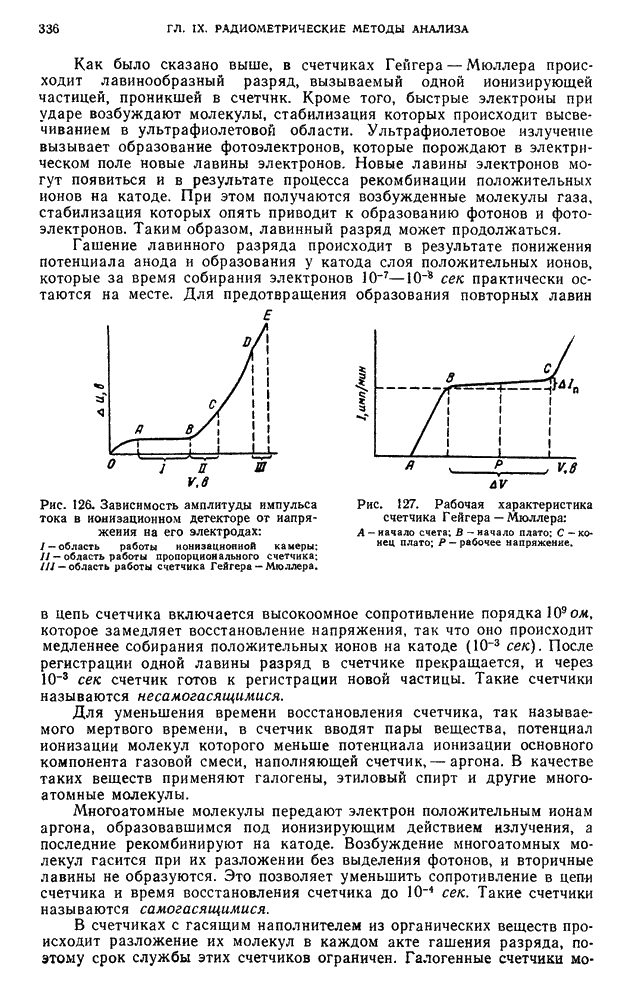
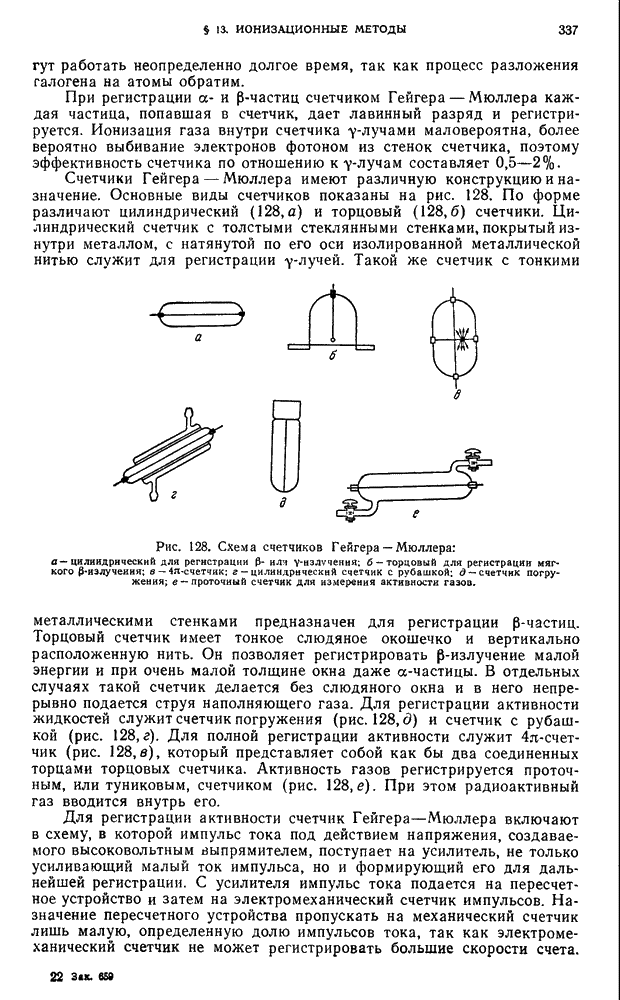
- § 13. Ионизационные методы
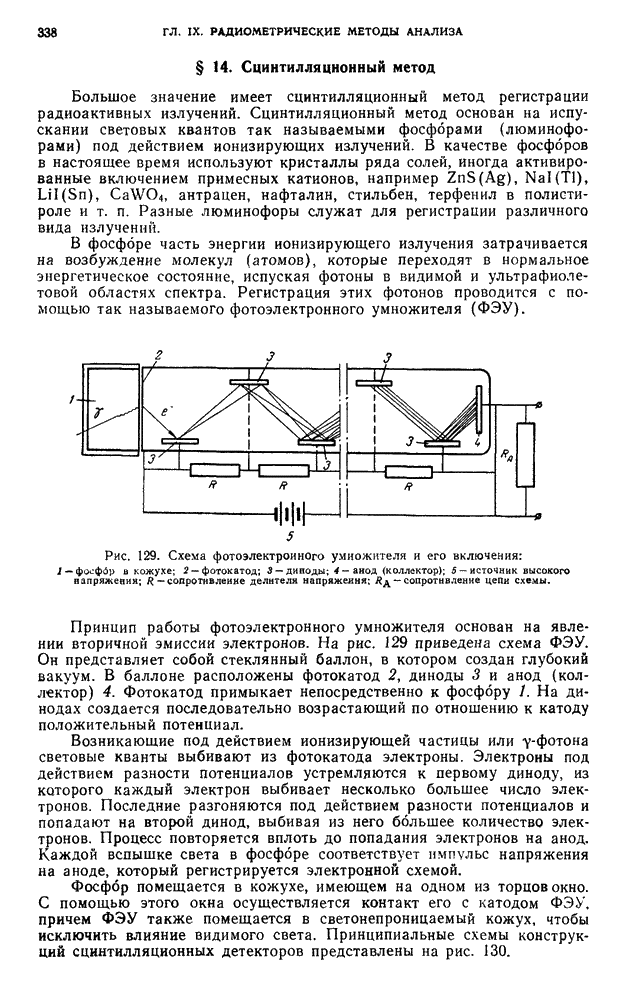
- § 14. Сцинтилляционный метод
- Г. АППАРАТУРА И ТЕХНИКА ИЗМЕРЕНИЯ РАДИОАКТИВНОСТИ
- § 15. Радиометрические установки
- § 16. Измерение радиоактивности
- § 17. Измерение дозы на рабочем месте, индивидуальной дозы, полученной работающим, и загрязненности рабочих поверхностей, рук и одежды
- § 18. Абсолютные и относительные измерения активности
- Д. РАДИОМЕТРИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
- § 19. Приготовление раствора с заданной активностью
- § 20. Прямое определение ионов химических элементов в растворе с помощью радиоактивных реагентов
- § 21. Практические работы, выполняемые методом прямого определения
- § 22. Метод радиометрического титрования
- § 23. Практические работы, выполняемые методом радиометрического титрования
- § 24. Метод изотопного разбавления
- § 25. Практические работы, выполняемые методом изотопного разбавления
- § 26. Метод активационного анализа
- § 27. Практические работы, выполняемые методом активационного анализа
- § 28. Фотонейтронный метод
- § 29. Практические работы, выполняемые фотонейтронным методом
- § 30. Методы определения содержания химических элементов по излучению их естественных радиоактивных изотопов
- § 31. Практические работы по определению содержания химических элементов методом измерения излучения их естественных радиоактивных изотопов
- § 32. Методы анализа, основанные на поглощении излучения
- § 33. Практические работы, выполняемые по методу анализа, основанному на поглощении излучения
- § 34. Метод, основанный на отражении бетта-излучения
- § 35. Практические работы, выполняемые по методу, основанному на отражении бетта-излучения
- ГЛАВА X. ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ РЕДКИХ ЭЛЕМЕНТОВ
- § 1. Работы, выполняемые методом амперометрического титрования
- § 2. Работы, выполняемые полярографическим методом
- § 3. Работы, выполняемые фотометрическим методом
- § 4. Работы, выполняемые экстракционно-фотометрическим методом
- § 5. Работы, выполняемые спектрофотометрическим методом
- § 6. Работы, выполняемые флуориметрическим методом
- § 7. Работы, выполняемые методом потенциометрического титрования
- ГЛАВА XI. ФИЗИКО-ХИМИЧЕСКИЕ (ИНСТРУМЕНТАЛЬНЫЕ) МЕТОДЫ АНАЛИЗА НЕВОДНЫХ РАСТВОРОВ
- § 1. Влияние химической природы и физико-химических свойств растворителей на свойства растворенного вещества
- § 2. Классификация неводных растворителей по их протонно-донорно-акцепторным свойствам
- § 3. Классификация неводных растворителей по признаку их влияния на относительную силу электролитов
- § 4. Дифференцирующее действие растворителей
- § 5. Константы диссоциации, потенциалы полунейтрализации в неводных средах и относительная шкала кислотности
- § 6. Шкала pH и константы автопротолиза неводных растворителей
- § 7. Абсолютная (единая) шкала кислотности растворителей
- § 8. Химико-аналитическое использование неводных растворителей
- Б. АППАРАТУРА И ТЕХНИКА ТИТРОВАНИЯ НЕВОДНЫХ РАСТВОРОВ
- § 9. Установки, используемые при амперометрическом титровании неводных растворов
- § 10. Установки, используемые при потенциометрическом титровании неводных растворов
- § 11. Установки, используемые при кондуктометрическом титровании неводных растворов
- § 12. Установки, используемые при высокочастотном титровании неводных растворов
- § 13. Установки, используемые при спектрофотометрическом титровании неводных растворов
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 14. Очистка и обезвоживание неводных растворителей
- § 15. Титранты, применяемые для титрования кислот и оснований в неводных растворах
- § 16. Амперометрическое титрование
- § 17. Методы прямого потенциометрического титрования
- § 18. Методы косвенного потенциометрического титрования
- § 19. Дифференцированное потенциометрическое титрование
- § 20. Комбинированные методы потенциометрического титрования
- § 21. Хронопотенциометрическое титрование
- § 22. Кондуктометрическое титрование
- § 23. Хронокондуктометрическое титрование
- § 24. Спектрофотометрическое титрование