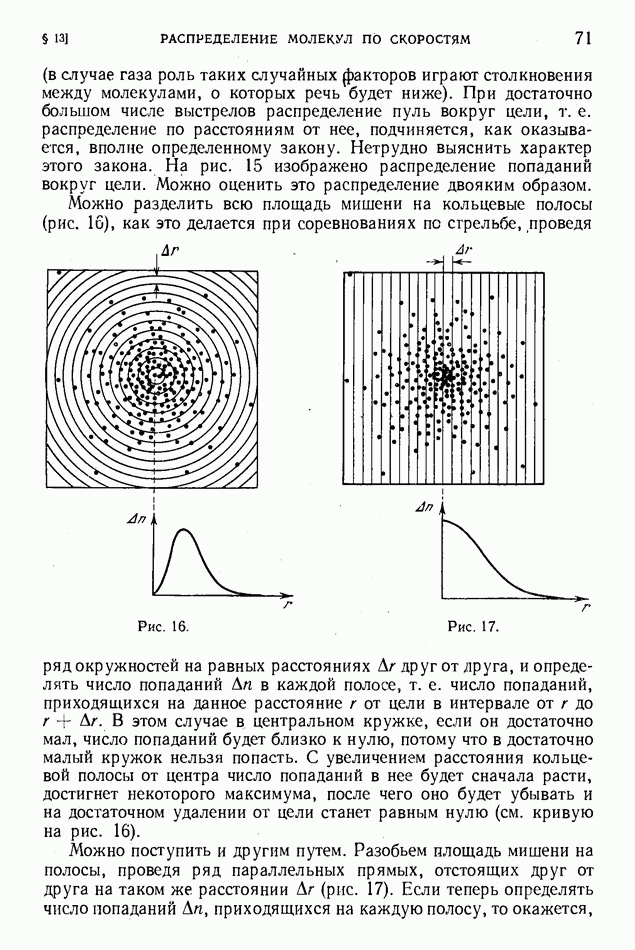
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 27. Теплоемкость двухатомных и многоатомных газов
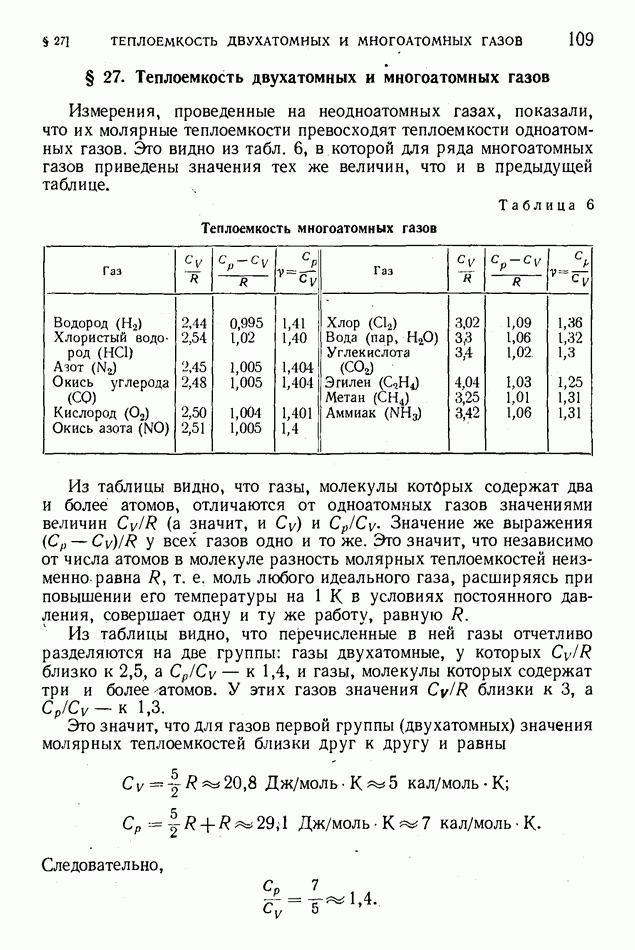
Измерения, проведенные на неодноатомных газах, показали, что их молярные теплоемкости превосходят теплоемкости одноатомных газов. Это видно из табл. 6, в которой для ряда многоатомных газов приведены значения тех же величин, что и в предыдущей таблице.
Таблица 6 (см. скан) Теплоемкость многоатомных газов
Из таблицы видно, что газы, молекулы которых содержат два и более атомов, отличаются от одноатомных газов значениями величин  (а значит, и
(а значит, и  Значение же выражения
Значение же выражения  у всех газов одно и то же. Это значит, что независимо от числа атомов в молекуле разность молярных теплоемкостей неизменно равна
у всех газов одно и то же. Это значит, что независимо от числа атомов в молекуле разность молярных теплоемкостей неизменно равна  т. е. моль любого идеального газа, расширяясь при повышении его температуры на 1 К в условиях постоянного давления, совершает одну и ту же работу, равную
т. е. моль любого идеального газа, расширяясь при повышении его температуры на 1 К в условиях постоянного давления, совершает одну и ту же работу, равную 
Из таблицы видно, что перечисленные в ней газы отчетливо разделяются на две группы: газы двухатомные, у которых  близко к
близко к  к 1,4, и газы, молекулы которых содержат три и более атомов. У этих газов значения
к 1,4, и газы, молекулы которых содержат три и более атомов. У этих газов значения  близки к 3, а
близки к 3, а  — к 1,3.
— к 1,3.
Это значит, что для газов первой группы (двухатомных) значения молярных теплоемкостей близки друг к другу и равны

Следовательно,

Для газов, молекулы которых состоят из трех или более атомов, теплоемкости, как это видно из табл. 6, имеют следующие численные значения:

отсюда

Приведенные экспериментальные данные о теплоемкости относятся к газам при сравнительно небольших давлениях (порядка атмосферы и ниже) и к температурам, близким к комнатным. В этих условиях газы мало отличаются от идеальных.
Чем же объяснить такие закономерности, относящиеся к величинам теплоемкости двух- и многоатомных газов? Ответ на этот вопрос дает так называемый закон равнораспределения.
Закон равнораспределения и теплоемкость многоатомных газов. В предыдущем параграфе, при рассмотрении теплоемкости одноатомного газа, было обращено внимание на то, что средняя кинетическая энергия молекулы, приходящаяся на одну степень свободы, равна  Естественно было предположить, что если бы молекула газа обладала еще какими-нибудь степенями свободы, то и на каждую из них пришлась бы кинетическая энергия
Естественно было предположить, что если бы молекула газа обладала еще какими-нибудь степенями свободы, то и на каждую из них пришлась бы кинетическая энергия 
Действительно, в классической статистической физике (классической — значит не квантовой) такая теорема доказывается (Больцман). Эту теорему можно сформулировать так: если система молекул находится в тепловом равновесии при температуре  то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна
то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна 
(Другая формулировка этого же закона гласит: если какая-либо составляющая энергии системы пропорциональна квадрату координаты или компоненты скорости, то в состоянии теплового равновесия системы при температуре  среднее значение этой части энергии равно
среднее значение этой части энергии равно 
Эта теорема называется законом равномерного распределения кинетической энергии по степеням свободы, или, коротко, законом равнораспределения.
Этот закон позволяет ответить на поставленный выше вопрос.
В отношении своей внутренней энергии двух- и многоатомные газы отличаются от одноатомных числом степеней свободы своих молекул. Значит, для вычисления внутренней энергии газа и, следовательно, теплоемкости надо уметь определять число степеней свободы молекул газа.
Рассмотрим сначалзпростейший случай — двухатомной молекулы. Ее можно себе представить в виде системы, состоящей из двух атомов, расположенных на некотором расстоянии друг от друга (рис. 34). Если расстояние между этими атомами не меняется (такие молекулы мы будем называть жесткими), то такая система, вообще говоря, имеет шесть степеней свободы.
Действительно, положение и конфигурация такой молекулы определяются: тремя координатами ее центра масс, которыми определяется поступательное движение молекулы как целого, и тремя координатами, определяющими возможные вращения молекулы около взаимно перпендикулярных осей. 

Рис. 34.
Однако опыт и теория показывают, что вращение молекул около оси X (см. рис. 34), на которой лежат центры обоих атомов, может быть возбуждено лишь при очень высоких температурах. При обычных температурах вращение около оси X не происходит, так же как не вращается отдельный атом. Поэтому для описания возможных вращений нашей молекулы достаточно двух координат.
Следовательно, число степеней свободы жесткой двухатомной молекулы равно 5, из них три поступательные (как принято говорить) и две вращательные степени свободы.
Но атомы в молекуле не всегда жестко связаны друг с другом; они могут совершать колебания друг относительно друга. Тогда, очевидно, требуется еще одна координата для определения конфигурации молекулы, это — расстояние между атомами.

Рис. 35.
Следовательно, в общем случае двухатомная молекула обладает шестью степенями свободы: тремя поступательными, двумя вращательными и одной колебательной.
Если молекула состоит из  атомов, нежестко связанных, то она имеет
атомов, нежестко связанных, то она имеет  степеней свободы (каждый атом имеет три степени свободы). Из этого числа три степени свободы поступательные и три вращательные, за исключением случая, когда атомы расположены на одной прямой, — тогда вращательных степеней свободы только две (как у двух-, атомной молекулы).
степеней свободы (каждый атом имеет три степени свободы). Из этого числа три степени свободы поступательные и три вращательные, за исключением случая, когда атомы расположены на одной прямой, — тогда вращательных степеней свободы только две (как у двух-, атомной молекулы).
Для примера на рис. 35 приведена модель трехатомной молекулы и показаны оси  вдоль которых может быть разложен
вдоль которых может быть разложен
вектор угловой скорости молекулы. Таким образом, нелинейная n-атомная молекула в общем случае может иметь  колебательных степеней свободы, а линейная
колебательных степеней свободы, а линейная 
Во многих случаях колебательное движение атомов вовсе не возбуждается. Но если колебания атомов в молекуле совершаются и если их амплитуды достаточно малы (по сравнению с расстоянием между ними), то такие колебания можно считать гармоническими; атомы в этом случае являются гармоническими осцилляторами.
Но осциллятор обладает не только кинетической, но и потенциальной энергией (последняя обусловлена силами, возвращающими атом в положение равновесия). Для гармонического осциллятора, как известно из механики, средние значения кинетической и потенциальной энергии равны между собой. Следовательно, если в молекуле возбуждены гармонические колебания атомов, то по закону равнораспределения на каждую колебательную степень свободы преходится  в виде кинетической энергии и
в виде кинетической энергии и  в виде потенциальной. Для ангармоничных (не гармонических) колебаний это неверно.
в виде потенциальной. Для ангармоничных (не гармонических) колебаний это неверно.
Другими словами: энергия, приходящаяся на каждую колебательную степень свободы, равна не 
После этого нетрудно вычислить теплоемкость многоатомных газов.
Если число степеней свободы молекулы газа равно  то ее средняя энергия равна
то ее средняя энергия равна

а внутренняя энергия одного моля такого газа

Соответственно этому молярные теплоемкости газа

и

При подсчете числа степеней свободы  надо число колебательных степеней свободы удвоить. Этого можно не делать, если дать несколько другое определение числу степеней свободы
надо число колебательных степеней свободы удвоить. Этого можно не делать, если дать несколько другое определение числу степеней свободы  именно, если это число определить как число независимых квадратичных переменных, которым и определяется энергия системы.
именно, если это число определить как число независимых квадратичных переменных, которым и определяется энергия системы.
В самом деле, кинетическая энергия поступательного и вращательного движений молекулы пропорциональна сумме квадратов соответствующих (независимых) компонент скоростей (линейных и угловых).
Что касается энергии колебаний атомов внутри молекулы, совершаемых, например, вдоль оси X, то она равна сумме кинетической энергии, пропорциональной квадрату скорости  и потенциальной, которая, как известно, пропорциональна
и потенциальной, которая, как известно, пропорциональна  квадрату смещения х относительно положения равновесия. Таким образом, согласно новому определению числа степеней свободы, колебательному движению атома вдоль данной оси следует приписать две степени свободы, и формула (27.1) применима без оговорок (сравните вторую формулировку закона равнораспределения).
квадрату смещения х относительно положения равновесия. Таким образом, согласно новому определению числа степеней свободы, колебательному движению атома вдоль данной оси следует приписать две степени свободы, и формула (27.1) применима без оговорок (сравните вторую формулировку закона равнораспределения).
Изложенные только что соображения о возможном числе степеней свободы молекул позволяют истолковать приведенные выше экспериментальные данные о теплоемкости многоатомных газов.
Так, например, из того факта, что теплоемкость водорода, азота, кислорода и некоторых других двухатомных газов довольно точно равна  следует, что число степеней свободы молекул этих газов равно 5. Это значит, что молекулы этих газов можно считать жесткими (колебательные степени свободы - не возбуждены). То же относится и к некоторым трехатомным газам. Но здесь экспериментальные результаты обнаруживают существенные отклонения от теоретически ожидаемых. Из формулы (27.2) следует, что теплоемкость
следует, что число степеней свободы молекул этих газов равно 5. Это значит, что молекулы этих газов можно считать жесткими (колебательные степени свободы - не возбуждены). То же относится и к некоторым трехатомным газам. Но здесь экспериментальные результаты обнаруживают существенные отклонения от теоретически ожидаемых. Из формулы (27.2) следует, что теплоемкость  для «жестких» трехатомных молекул должна равняться
для «жестких» трехатомных молекул должна равняться 
Между тем теплоемкости всех трехатомных газов, перечисленных в табл. 6, оказываются несколько больше этого значения (на величину, которую нельзя объяснить погрешностями измерения).
На трудности наталкивается и попытка объяснить с точки зрения изложенной теории найденные значения теплоемкости хлора. Приведенное в табл. 6 значение теплоемкости хлора  соответствует шести степеням свободы для молекулы хлора. Но молекула хлора, как двухатомная, может иметь либо пять степеней свободы, если два его атома жестко связаны между собой (тогда
соответствует шести степеням свободы для молекулы хлора. Но молекула хлора, как двухатомная, может иметь либо пять степеней свободы, если два его атома жестко связаны между собой (тогда  либо семь степеней свободы (согласно второму определению числа
либо семь степеней свободы (согласно второму определению числа  если атомы внутри молекулы могут совершать колебания (тогда
если атомы внутри молекулы могут совершать колебания (тогда 
Как видно, и в этом случае теория теплоемкости не может считаться удовлетворительной. Это объясняется тем, что наша теория не в состоянии должным образом учесть энергию, связанную с внутренними движениями в молекуле, к которым закон равнораспределения не всегда применим.
Особенно важным отклонением от результатов теории является тот факт, что теплоемкость оказывается зависящей от температуры, в то время как, согласно уравнению (27.2), она должна быть для данного газа с данным значением  величиной постоянной. Опыт
величиной постоянной. Опыт
показывает, что теплоемкость с понижением температуры уменьшается.
Эту зависимость можно было бы объяснить тем, что с изменением температуры изменяется число «действующих» степеней свободы молекул, т. е. какие-то движения молекул, происходящие в одной области температур, прекращаются в другой. Однако такое предположение требует, чтобы теплоемкость изменялась с температурой скачками. Ведь то или иное движение может или происходить, или не происходить; в нервом случае ему соответствует энергия  во втором эта энергия и связанный с ней вклад в теплоемкость отсутствуют. Возможно, конечно, не внезапное прекращение или возникновение того или иного вида движения молекулы, а постепенное изменение его интенсивности. Но закон равнораспределения не различает этого; с любой степенью свободы связана одна и та же энергия. Между тем температурная зависимость теплоемкости, как показывает опыт, имеет плавный ход — теплоемкость изменяется постепенно. Это свидетельствует о том, что закон равномерного распределения энергии по степеням свободы не может считаться вполне верным и имеет ограниченную применимость.
во втором эта энергия и связанный с ней вклад в теплоемкость отсутствуют. Возможно, конечно, не внезапное прекращение или возникновение того или иного вида движения молекулы, а постепенное изменение его интенсивности. Но закон равнораспределения не различает этого; с любой степенью свободы связана одна и та же энергия. Между тем температурная зависимость теплоемкости, как показывает опыт, имеет плавный ход — теплоемкость изменяется постепенно. Это свидетельствует о том, что закон равномерного распределения энергии по степеням свободы не может считаться вполне верным и имеет ограниченную применимость.
Теплоемкость водорода. Водород обладает той особенностью, что температурная зависимость теплоемкости у него особенно резко выражена. Если при комнатной температуре теплоемкость водорода при постоянном объеме равна  то при температуре около 50 К (-223°С) она становится равной
то при температуре около 50 К (-223°С) она становится равной  т. е. водород ведет себя как одноатомный газ, обладающий тремя степенями свободы.
т. е. водород ведет себя как одноатомный газ, обладающий тремя степенями свободы.

Рис. 36.
Кривая зависимости теплоемкости водорода от температуры представлена на рис. 36, из которого видно, что теплоемкость с понижением температуры падает постепенно, что, вообще говоря, необъяснимо с точки зрения классической теории теплоемкости. Можно, правда, предположить, что с понижением температуры постепенно уменьшается число молекул, совершающих вращательное движение, но и в этом случае остается неясным, почему именно одна часть молекул совершает такие движения, в то время как у другой эти степени свободы «выключены».
Здесь мы встречаемся с одним из многих случаев, когда классическая физика оказывается не в состоянии объяснить опытные
факты. В нашем случае расхождение теории и опыта свидетельствует, очевидно, о том, что представление о молекулах как о твердых шариках, движения которых происходят по законам механики, не вполне соответствует действительности. Теперь хорошо известно, что молекулы состоят из взаимодействующих между собой атомов, а атомы имеют сложное строение и состоят из многих еще меньших частиц, которые также движутся сложным образом. Движение же атомных частиц не подчиняется классической механике, а управляется особым «сводом законов» — квантовой механикой. Поэтому, пока идет речь о теплоемкости одноатомных газов, на которую не влияют внутриатомные движения и связанная с ними энергия, изложенная выше теория теплоемкости оказывается в превосходном согласии с опытом. Но во многоатомных молекулах существенную роль играют уже внутренние процессы в молекулах и атомах, с которыми несомненно связаны, например, колебательные степени свободы. Естественно, что наша, теория, не учитывающая особых квантовых свойств атомных систем, в этом случае дает лишь приблизительно верные результаты. Квантовая же теория дает полное объяснение всем опытным данным о теплоемкости.
В частности, в случае атома-водорода квантовая теория показывает, что молекулы водорода могут находиться в двух разных состояниях — в состоянии параводорода и ортоводорода, теплоемкости которых должны отличаться друг от друга. Различие между этими состояниями состоит в следующем.
Из квантовой теории следует, что атомы (точнее, атомные ядра) обладают некоторым моментом количества движения (моментом импульса). Когда из двух атомов водорода образуется молекула, эти моменты ядер (они, как и всякие другие моменты, являются векторными величинами) могут расположиться либо параллельно  либо антипараллельно
либо антипараллельно  друг другу. Как само существование ядерных моментов, так и их возможные ориентации являются следствием квантовой механики и из обычной механики не могут быть получены. Водород, молекулы которого состоят из атомов с параллельно ориентированными моментами ядер, называется ортоводородом, в отличие от водорода с антипараллельными моментами ядер атомов в молекуле, который называется параводородом.
друг другу. Как само существование ядерных моментов, так и их возможные ориентации являются следствием квантовой механики и из обычной механики не могут быть получены. Водород, молекулы которого состоят из атомов с параллельно ориентированными моментами ядер, называется ортоводородом, в отличие от водорода с антипараллельными моментами ядер атомов в молекуле, который называется параводородом.
В обычном водороде содержатся оба вида молекул, причем их относительное содержание зависит от температуры. При комнатной температуре в нормальном водороде содержится около 25% параводорода, а с понижением температуры содержание параводорода возрастает, так что при 20 К водород почти целиком состоит из параводорода (99,8%).
Орто- и парасостояиию водорода соответствуют разные значения энергии вращательного движения, чем и объясняется различное значение теплоемкости водорода в этих двух состояниях. Но при низких температурах (около 50 К) теплоемкость, зависящая от вращательного движения молекул, в обоих состояниях становится равной нулю. Этим и объясняется то, что теплоемкость водорода становится такой же, как у одноатомного газа.
Теплоемкость других многоатомных газов, так же как у водорода, падает с понижением температуры, стремясь к значению теплоемкости одноатомных газов  но происходит это в области очень низких температур, когда непосредственное измерение теплоемкости газов встречает большие трудности.
но происходит это в области очень низких температур, когда непосредственное измерение теплоемкости газов встречает большие трудности.
Измерения теплоемкости позволяют, таким образом, сделать важные заключения о строении молекул. Поэтому такие измерения, особенно при низких температурах, имеют большое значение. Кроме того, знание величины теплоемкости и ее температурной зависимости необходимо при решении многих технических проблем.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- Глава I. КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ
- § 1. Идеальный газ
- § 2. Давление газа
- § 3. Температура
- § 4. Уравнение состояния идеального газа
- § 5. Законы идеального газа
- § 6. Скорости газовых молекул
- § 7. Броуновское движение
- § 8. Барометрическая формула
- § 9. Закон Больцмана
- § 10. Понятие о вероятности
- § 11. Понятие о распределении. Функция распределения
- § 12. Распределение молекул по компонентам скорости
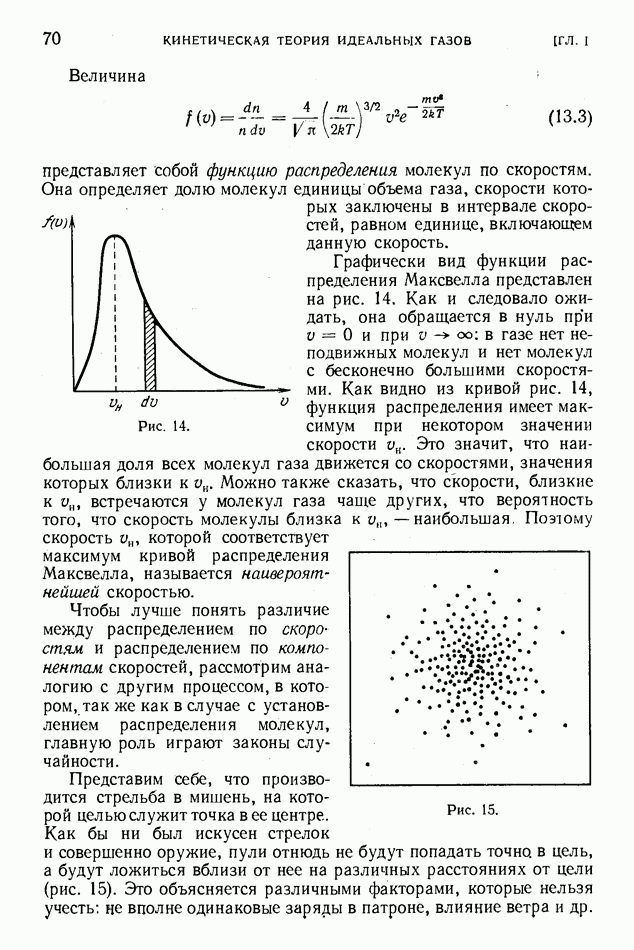
- § 13. Распределение молекул по скоростям
- § 14. Средние скорости молекул
- § 15. Наивероятнейшая скорость молекул
- § 16. Формула Максвелла для относительных скоростей
- § 17. Закон распределения молекул по скоростям и атмосферы планет
- § 18. Экспериментальная проверка закона распределения
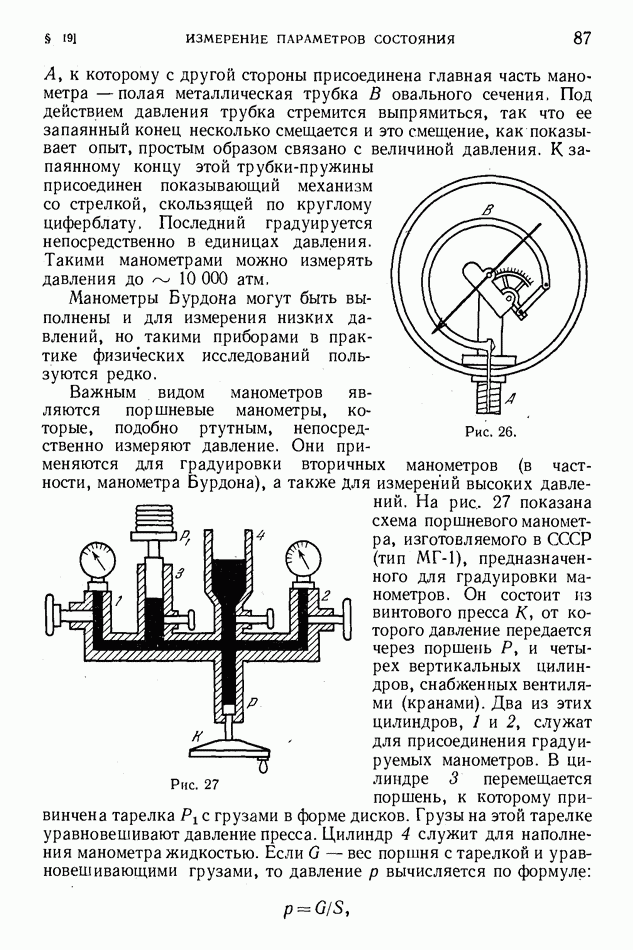
- § 19. Измерение параметров состояния
- Глава II. КИНЕТИЧЕСКАЯ ТЕОРИЯ ТЕПЛОТЫ. ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ
- § 20. Внутренняя энергия идеального газа
- § 21. Количество теплоты
- § 22. Механический эквивалент теплоты
- § 23. Первое начало термодинамики
- § 24. Теплоемкость идеальных газов
- § 25. Теплоемкость одноатомных газов
- § 26. Теплоемкость газов и число степеней свободы молекул
- § 27. Теплоемкость двухатомных и многоатомных газов
- § 28. Изменение состояния при изменении объема газа
- § 29. Работа при изотермическом изменении объема идеального газа
- § 30. Адиабатное изменение объема идеального газа
- § 31. Работа при адиабатном изменении объема газа
- § 32. Политропический процесс
- § 33. Расширение газа в пустоту
- § 34. Измерение количества теплоты и теплоемкости
- Глава III. СТОЛКНОВЕНИЯ МОЛЕКУЛ И ЯВЛЕНИЯ ПЕРЕНОСА
- § 35. Молекулярные движения и явления переноса
- § 36. Среднее число столкновений в единицу времени и средняя длина свободного пробега молекул
- § 37. Эффективное поперечное сечение частицы и вероятность
- § 38. Рассеяние молекулярного пучка в газе
- § 39. Экспериментальное определение длины свободного пробега
- § 40. Диффузия в газах
- § 41. Нестационарная диффузия
- § 42. Стационарная диффузия. Вычисление коэффициента диффузии
- § 43. Коэффициент взаимной диффузии
- § 44. Термическая диффузия
- § 45. Теплопроводность газов
- § 46. Нестационарная теплопроводность
- § 47. Стационарная теплопроводность. Вычисление коэффициента теплопроводности
- § 48. Вязкость газов (внутреннее трение)
- § 49. Измерение коэффициента вязкости (вискозиметрия)
- § 50. Соотношения между коэффициентами переноса
- Глава IV. ФИЗИЧЕСКИЕ ЯВЛЕНИЯ В РАЗРЕЖЕННЫХ ГАЗАХ (ВАКУУМЕ)
- § 51. Теплопередача в газах при малых давлениях
- § 52. Течение газов при малых давлениях (молекулярное течение)
- § 53. Молекулярное течение газа в цилиндрической трубе
- § 54. Молекулярное течение смеси газов. Разделение газовых смесей
- § 55. Диффузия газов в вакууме
- § 56. Разность давлений между различно нагретыми частями газа (тепловая транспирация)
- § 57. Элементы вакуумной техники
- § 58. Измерение малых давлений
- § 59. Вакуумная установка
- Глава V. НЕИДЕАЛЬНЫЕ (РЕАЛЬНЫЕ) ГАЗЫ. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА
- § 60. Отклонения свойств газов от идеальности
- § 61. Сжижение газов (конденсация)
- § 62. Фазовый переход
- § 63. Фазовые диаграммы
- § 64. Методы определения критических параметров
- § 65. Уравнение Ван-дер-Ваальса
- § 66. Изотермы Ван-дер-Ваальса
- § 67. Критическая температура и критическое состояние
- § 68. Экспериментальное определение констант уравнения Ван-дер-Ваальса
- § 69. Сравнение уравнения Ван-дер-Ваальса с данными опыта
- § 70. Приведенное уравнение Ван-дер-Ваальса. Закон соответственных состояний
- § 71. Межмолекулярные силы взаимодействия в реальном газе
- § 72. Теплоемкость неидеальных газов
- Глава VI. ЭЛЕМЕНТЫ ТЕРМОДИНАМИКИ
- § 73. Равновесные состояния
- § 74. Обратимые и необратимые процессы
- § 75. Квазистатические процессы
- § 76. Необратимость и вервятность
- § 77. Взаимные превращения механической и тепловой энергии
- § 78. Первое начало термодинамики
- § 79. Преобразование теплоты в механическую работу
- § 80. Цикл Карно
- § 81. Холодильная машина
- § 82. Доказательство теорем Карно
- § 83. Свободная энергия
- § 84. Энтропия
- § 85. Некоторые термодинамические соотношения
- § 86. Энтропия при обратимых процессах в замкнутой системе
- § 87. Энтропия при необратимых процессах в замкнутой системе, акон возрастания энтропии
- § 88. Второе начало термодинамики и превращение теплоты в работу
- § 89. Физический смысл энтропии. Энтропия и вероятность
- § 90. Энтропия и беспорядок
- § 91. «Демон» Максвелла
- § 92. Термодинамическая шкала температур
- § 93. Третье начало термодинамики
- § 94. Отрицательные температуры
- Глава VII. СВОЙСТВА ЖИДКОСТЕЙ
- § 95. Объемные свойства жидкостей
- § 96. Теплоемкость жидкостей
- § 97. Явления переноса в жидкостях
- § 98. Явления на границе жидкости
- § 99. Условия равновесия на границе двух сред. Краевой угол
- § 100. Силы, возникающие на кривой поверхности жидкости
- § 101. Капиллярные явления
- § 102. Некоторые методы измерения коэффициента поверхностного натяжения
- § 103. Зависимость коэффициента поверхностного натяжения от температуры
- § 104. Испарение и кипение жидкостей
- § 105. Температурная зависимость упругости насыщенных паров
- § 106. Упругость насыщенного пара над кривой поверхностью жидкости
- § 107. Кипение жидкостей
- § 108. Жидкие растворы
- § 109. Осмотическое давление
- Глава VIII. НИЗКИЕ ТЕМПЕРАТУРЫ
- § 110. Сжижение газов
- § 111. Эффект Джоуля-Томсона
- § 112. Адиабатное расширение газа с совершением внешней работы
- § 113. Сжижение газов с использованием эффекта Джоуля — Томсона (метод Линде)
- § 114. Сжижение газов методом адиабатного расширения в детандерах (метод Клода)
- § 115. Некоторые свойства сжиженных газов
- § 116. Сверхнизкие температуры
- § 117. Свойства вещества при низких температурах
- § 118. Жидкий гелий
- Глава IX. ТВЕРДОЕ ТЕЛО
- § 120. Кристаллическая решетка
- § 121. Дефекты в кристаллах
- § 122. Механические свойства твердых тел. Деформации
- § 123. Деформация растяжения и сжатия. Сдвиг
- § 124. Связь между модулями упругости
- § 125. Упругая деформация и тепловое расширение
- § 126. Зависимость деформации от напряжения
- § 127. Механизм пластической деформации
- § 128. Дислокации в кристаллах
- § 129. Переход в твердое состояние
- § 130. Диаграмма состояния. Тройная точка
- § 131. Фазовые переходы первого и второго рода
- § 132. Твердый гелий
- § 133. Растворение и кристаллизация из раствора
- § 134. Сплавы. Диаграммы плавкости
- § 135. Зонная очистка металлов
- § 136. Опытное определение температуры плавления
- § 137. Тепловые свойства твердых тел
- § 138. Измерение теплоемкости
- § 139. Тепловое расширение твердых тел
- § 140. Теплопроводность
- § 141. Диффузия в твердых телах