| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
§ 4. Уравнение состояния идеального газа
Развитые выше молекулярно-кинетические представления и полученные на их основе уравнения позволяют найти те соотношения, которые связывают между собой величины, определяющие состояние газа. Этими величинами являются: давление  под которым находится газ, его температура
под которым находится газ, его температура  и объем V, занимаемый определенной массой газа. Их называют параметрами состояния.
и объем V, занимаемый определенной массой газа. Их называют параметрами состояния.
Перечисленные три величины не являются независимыми. Каждая из них является функцией двух других. Уравнение, связывающее все три величины — давление, объем и температуру газа для данной его массы, называется уравнением состояния и может быть в общем виде записано так:

Это значит, что состояние газа определяется только двумя параметрами (например, давлением и объемом, давлением и температурой или, наконец, объемом и температурой), третий параметр однозначно определяется двумя другими. Если уравнение состояния известно в явном виде, то любой параметр можно вычислить, зная два других.
Для изучения различных процессов в газах (и не только в газах) удобно пользоваться графическим представлением уравнения состояния в виде кривых зависимости одного из параметров от другого при заданном постоянном третьем. Например, при заданной постоянной температуре зависимость давления газа от его объема
имеет вид, изображенный на рис. 4, где разные кривые соответствуют разным значениям температуры: чем выше температура, тем выше на графике лежит кривая. Состояние газа на такой диаграмме изображается точкой. Кривая же зависимости одного параметра от другого показывает изменение состояния, называемое процессом в газе. Так, например, кривые рис. 4 изображают процесс расширения или сжатия газа при данной постоянной температуре.
В дальнейшем мы будем широко пользоваться подобными графиками при изучении различных процессов в молекулярных системах.

Рис. 4,
Для идеальных газов уравнение состояния легко получить из основных уравнений кинетической теории (2.4) и (3.1).
В самом деле, подставив в уравнение (2.4) вместо средней кинетической энергии молекул ее выражение из уравнения (3.1), получаем:

Если в объеме V содержится  частиц, то
частиц, то  подставив это выражение в (4.1), имеем:
подставив это выражение в (4.1), имеем:

Это уравнение, в которое входят все три параметра состояния, и является уравнением состояния идеальных газов.
Его, однако, полезно преобразовать так, чтобы в него вместо недоступного прямому измерению числа частиц  входила легко измеряемая масса газа
входила легко измеряемая масса газа  Для такого преобразования воспользуемся понятием о грамм-молекуле, или моле. Напомним, что молем вещества называется такое его количество, масса которого, выраженная в граммах, равна относительной молекулярной массе вещества (иногда говорят: молекулярному весу). Эта своеобразная единица количества вещества замечательна, как известно, тем, что моль любого вещества содержит одно и то же число молекул. В самом деле, если обозначить относительные массы двух каких-либо веществ через и
Для такого преобразования воспользуемся понятием о грамм-молекуле, или моле. Напомним, что молем вещества называется такое его количество, масса которого, выраженная в граммах, равна относительной молекулярной массе вещества (иногда говорят: молекулярному весу). Эта своеобразная единица количества вещества замечательна, как известно, тем, что моль любого вещества содержит одно и то же число молекул. В самом деле, если обозначить относительные массы двух каких-либо веществ через и  а массы молекул этих веществ — через
а массы молекул этих веществ — через  то можно написатьтакие очевидные равенства;
то можно написатьтакие очевидные равенства;

где  числа частиц в моле этих веществ. Так как из самого определения относительной массы вытекает, что
числа частиц в моле этих веществ. Так как из самого определения относительной массы вытекает, что  то,
то, 
разделив первое из равенств (4,3) на второе, получим, что  что моль любого вещества содержит одинаковое число молекул.
что моль любого вещества содержит одинаковое число молекул.
Число частиц в моле, одинаковое для всех веществ, называется числом Авогадро. Мы будем его обозначать через  Мы можем, таким образом, определить моль как единицу особой величины — количества вещества:
Мы можем, таким образом, определить моль как единицу особой величины — количества вещества:
1 моль — это количество вещества, содержащее число молекул или других частиц (например, атомов, если вещество состоит из атомов), равное числу Авогадро.
Если разделить число молекул  в данной массе газа на число Авогадро
в данной массе газа на число Авогадро  то" мы получим число молей в этой массе газа. Но эту же величину можно получить, разделив массу
то" мы получим число молей в этой массе газа. Но эту же величину можно получить, разделив массу  газа на его относительную массу
газа на его относительную массу  так что
так что

Подставим это выражение для  в формулу (4,2). Тогда уравнение состояния примет вид:
в формулу (4,2). Тогда уравнение состояния примет вид:

В это уравнение входят две универсальные константы: число Авогадро  и постоянная Больцмана
и постоянная Больцмана  Зная одну из них, например постоянную Больцмана, можно другую (число Авогадро) определить простыми опытами, пользуясь самим уравнением (4.4). Для этого следует взять какой-нибудь газ с известным значением относительной массы
Зная одну из них, например постоянную Больцмана, можно другую (число Авогадро) определить простыми опытами, пользуясь самим уравнением (4.4). Для этого следует взять какой-нибудь газ с известным значением относительной массы  заполнить им сосуд известного объема V, измерить давление
заполнить им сосуд известного объема V, измерить давление  этого газа и его температуру
этого газа и его температуру  и определить его массу
и определить его массу  взвесив пустой (откачанный) сосуд и сосуд, наполненный газом. Число Авогадро
взвесив пустой (откачанный) сосуд и сосуд, наполненный газом. Число Авогадро  оказалось равным
оказалось равным  моль.
моль.
Наиболее точное к настоящему времени значение числа Авогадро:

Произведение универсальных констант  очевидно, тоже является универсальной константой. Она получила название универсальной газовой постоянной и обычно обозначается через
очевидно, тоже является универсальной константой. Она получила название универсальной газовой постоянной и обычно обозначается через 

(Точное значение:  )
)
Заменив в уравнении  универсальной газовой постоянной
универсальной газовой постоянной  получим:
получим:

Представленное в таком виде уравнение состояния идеального газа часто называют уравнением Клапейрона — Менделеева. Величина  входящая в это уравнение, представляет собой число молей в данной массе газа. Для одного моля газа, т. е. для случая, когда
входящая в это уравнение, представляет собой число молей в данной массе газа. Для одного моля газа, т. е. для случая, когда  уравнение (4,5) имеет вид:
уравнение (4,5) имеет вид:

| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- Глава I. КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ
- § 1. Идеальный газ
- § 2. Давление газа
- § 3. Температура
- § 4. Уравнение состояния идеального газа
- § 5. Законы идеального газа
- § 6. Скорости газовых молекул
- § 7. Броуновское движение
- § 8. Барометрическая формула
- § 9. Закон Больцмана
- § 10. Понятие о вероятности
- § 11. Понятие о распределении. Функция распределения
- § 12. Распределение молекул по компонентам скорости
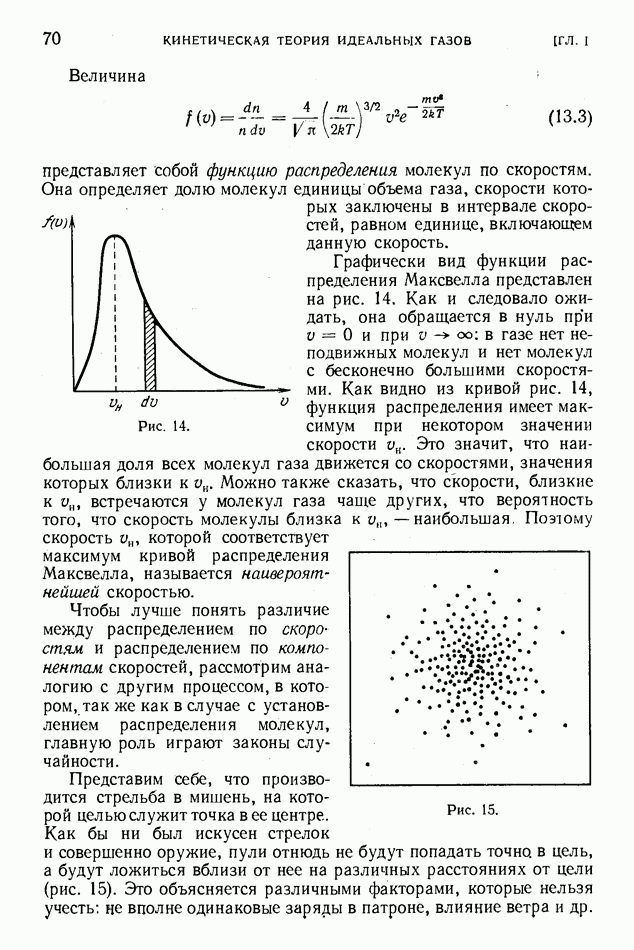
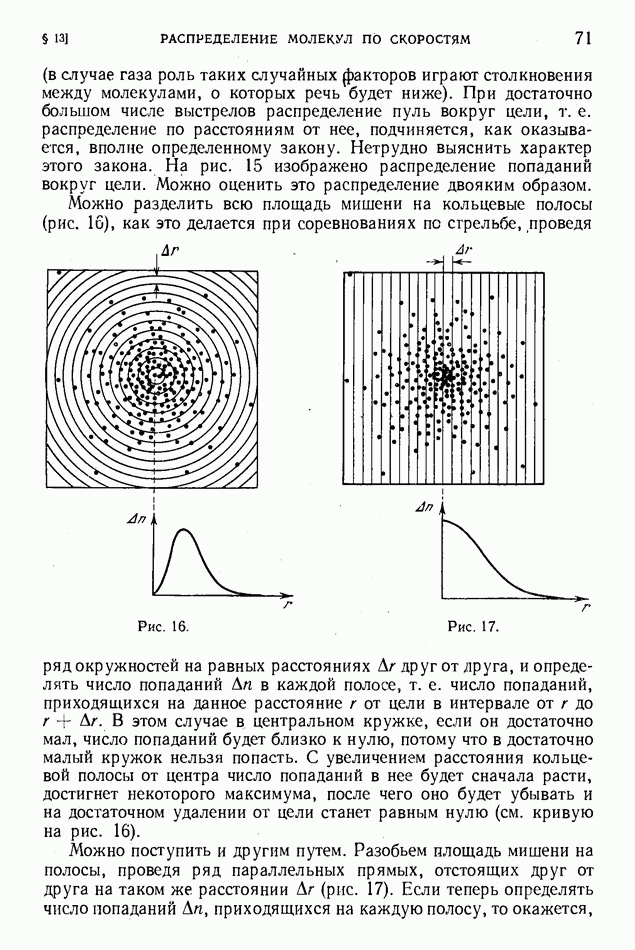
- § 13. Распределение молекул по скоростям
- § 14. Средние скорости молекул
- § 15. Наивероятнейшая скорость молекул
- § 16. Формула Максвелла для относительных скоростей
- § 17. Закон распределения молекул по скоростям и атмосферы планет
- § 18. Экспериментальная проверка закона распределения
- § 19. Измерение параметров состояния
- Глава II. КИНЕТИЧЕСКАЯ ТЕОРИЯ ТЕПЛОТЫ. ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ
- § 20. Внутренняя энергия идеального газа
- § 21. Количество теплоты
- § 22. Механический эквивалент теплоты
- § 23. Первое начало термодинамики
- § 24. Теплоемкость идеальных газов
- § 25. Теплоемкость одноатомных газов
- § 26. Теплоемкость газов и число степеней свободы молекул
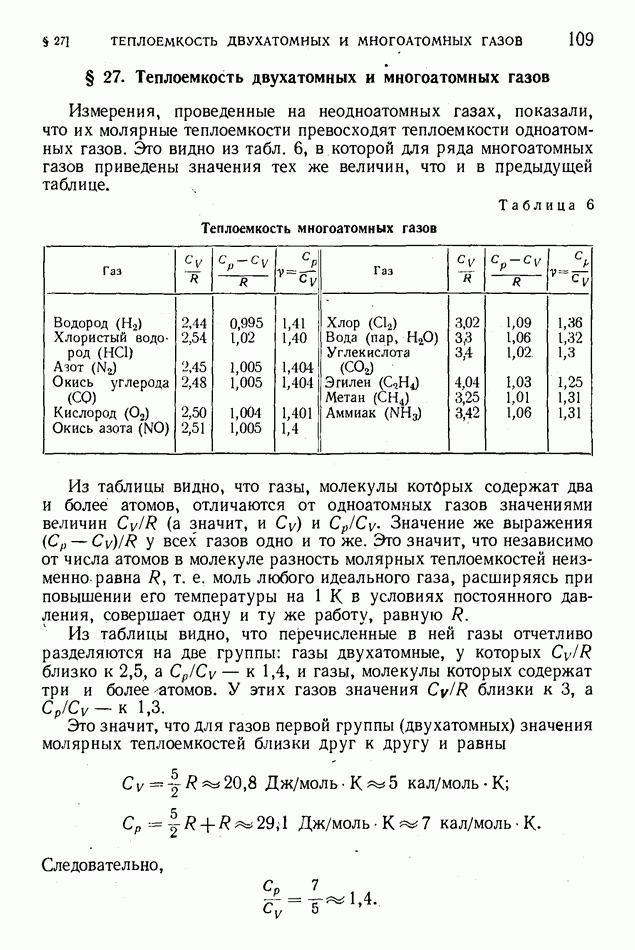
- § 27. Теплоемкость двухатомных и многоатомных газов
- § 28. Изменение состояния при изменении объема газа
- § 29. Работа при изотермическом изменении объема идеального газа
- § 30. Адиабатное изменение объема идеального газа
- § 31. Работа при адиабатном изменении объема газа
- § 32. Политропический процесс
- § 33. Расширение газа в пустоту
- § 34. Измерение количества теплоты и теплоемкости
- Глава III. СТОЛКНОВЕНИЯ МОЛЕКУЛ И ЯВЛЕНИЯ ПЕРЕНОСА
- § 35. Молекулярные движения и явления переноса
- § 36. Среднее число столкновений в единицу времени и средняя длина свободного пробега молекул
- § 37. Эффективное поперечное сечение частицы и вероятность
- § 38. Рассеяние молекулярного пучка в газе
- § 39. Экспериментальное определение длины свободного пробега
- § 40. Диффузия в газах
- § 41. Нестационарная диффузия
- § 42. Стационарная диффузия. Вычисление коэффициента диффузии
- § 43. Коэффициент взаимной диффузии
- § 44. Термическая диффузия
- § 45. Теплопроводность газов
- § 46. Нестационарная теплопроводность
- § 47. Стационарная теплопроводность. Вычисление коэффициента теплопроводности
- § 48. Вязкость газов (внутреннее трение)
- § 49. Измерение коэффициента вязкости (вискозиметрия)
- § 50. Соотношения между коэффициентами переноса
- Глава IV. ФИЗИЧЕСКИЕ ЯВЛЕНИЯ В РАЗРЕЖЕННЫХ ГАЗАХ (ВАКУУМЕ)
- § 51. Теплопередача в газах при малых давлениях
- § 52. Течение газов при малых давлениях (молекулярное течение)
- § 53. Молекулярное течение газа в цилиндрической трубе
- § 54. Молекулярное течение смеси газов. Разделение газовых смесей
- § 55. Диффузия газов в вакууме
- § 56. Разность давлений между различно нагретыми частями газа (тепловая транспирация)
- § 57. Элементы вакуумной техники
- § 58. Измерение малых давлений
- § 59. Вакуумная установка
- Глава V. НЕИДЕАЛЬНЫЕ (РЕАЛЬНЫЕ) ГАЗЫ. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА
- § 60. Отклонения свойств газов от идеальности
- § 61. Сжижение газов (конденсация)
- § 62. Фазовый переход
- § 63. Фазовые диаграммы
- § 64. Методы определения критических параметров
- § 65. Уравнение Ван-дер-Ваальса
- § 66. Изотермы Ван-дер-Ваальса
- § 67. Критическая температура и критическое состояние
- § 68. Экспериментальное определение констант уравнения Ван-дер-Ваальса
- § 69. Сравнение уравнения Ван-дер-Ваальса с данными опыта
- § 70. Приведенное уравнение Ван-дер-Ваальса. Закон соответственных состояний
- § 71. Межмолекулярные силы взаимодействия в реальном газе
- § 72. Теплоемкость неидеальных газов
- Глава VI. ЭЛЕМЕНТЫ ТЕРМОДИНАМИКИ
- § 73. Равновесные состояния
- § 74. Обратимые и необратимые процессы
- § 75. Квазистатические процессы
- § 76. Необратимость и вервятность
- § 77. Взаимные превращения механической и тепловой энергии
- § 78. Первое начало термодинамики
- § 79. Преобразование теплоты в механическую работу
- § 80. Цикл Карно
- § 81. Холодильная машина
- § 82. Доказательство теорем Карно
- § 83. Свободная энергия
- § 84. Энтропия
- § 85. Некоторые термодинамические соотношения
- § 86. Энтропия при обратимых процессах в замкнутой системе
- § 87. Энтропия при необратимых процессах в замкнутой системе, акон возрастания энтропии
- § 88. Второе начало термодинамики и превращение теплоты в работу
- § 89. Физический смысл энтропии. Энтропия и вероятность
- § 90. Энтропия и беспорядок
- § 91. «Демон» Максвелла
- § 92. Термодинамическая шкала температур
- § 93. Третье начало термодинамики
- § 94. Отрицательные температуры
- Глава VII. СВОЙСТВА ЖИДКОСТЕЙ
- § 95. Объемные свойства жидкостей
- § 96. Теплоемкость жидкостей
- § 97. Явления переноса в жидкостях
- § 98. Явления на границе жидкости
- § 99. Условия равновесия на границе двух сред. Краевой угол
- § 100. Силы, возникающие на кривой поверхности жидкости
- § 101. Капиллярные явления
- § 102. Некоторые методы измерения коэффициента поверхностного натяжения
- § 103. Зависимость коэффициента поверхностного натяжения от температуры
- § 104. Испарение и кипение жидкостей
- § 105. Температурная зависимость упругости насыщенных паров
- § 106. Упругость насыщенного пара над кривой поверхностью жидкости
- § 107. Кипение жидкостей
- § 108. Жидкие растворы
- § 109. Осмотическое давление
- Глава VIII. НИЗКИЕ ТЕМПЕРАТУРЫ
- § 110. Сжижение газов
- § 111. Эффект Джоуля-Томсона
- § 112. Адиабатное расширение газа с совершением внешней работы
- § 113. Сжижение газов с использованием эффекта Джоуля — Томсона (метод Линде)
- § 114. Сжижение газов методом адиабатного расширения в детандерах (метод Клода)
- § 115. Некоторые свойства сжиженных газов
- § 116. Сверхнизкие температуры
- § 117. Свойства вещества при низких температурах
- § 118. Жидкий гелий
- Глава IX. ТВЕРДОЕ ТЕЛО
- § 120. Кристаллическая решетка
- § 121. Дефекты в кристаллах
- § 122. Механические свойства твердых тел. Деформации
- § 123. Деформация растяжения и сжатия. Сдвиг
- § 124. Связь между модулями упругости
- § 125. Упругая деформация и тепловое расширение
- § 126. Зависимость деформации от напряжения
- § 127. Механизм пластической деформации
- § 128. Дислокации в кристаллах
- § 129. Переход в твердое состояние
- § 130. Диаграмма состояния. Тройная точка
- § 131. Фазовые переходы первого и второго рода
- § 132. Твердый гелий
- § 133. Растворение и кристаллизация из раствора
- § 134. Сплавы. Диаграммы плавкости
- § 135. Зонная очистка металлов
- § 136. Опытное определение температуры плавления
- § 137. Тепловые свойства твердых тел
- § 138. Измерение теплоемкости
- § 139. Тепловое расширение твердых тел
- § 140. Теплопроводность
- § 141. Диффузия в твердых телах