| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 133. Квантовая теория строения атома водорода (по Бору). Объяснение спектров излучения и поглощения водорода
В атоме водорода вокруг ядра (протона), несущего один элементарный заряд  движется один электрон. Ядро можно считать неподвижным, поскольку его масса в 1840 раз больше массы электрона; орбиты электрона можно (в первом приближении) полагать круговыми.
движется один электрон. Ядро можно считать неподвижным, поскольку его масса в 1840 раз больше массы электрона; орбиты электрона можно (в первом приближении) полагать круговыми.
Очевидно, что центростремительной силой, удерживающей электрон на орбите радиусом  является кулоновская сила притяжения между электроном и ядром:
является кулоновская сила притяжения между электроном и ядром:

где  масса электрона,
масса электрона,  его скорость,
его скорость,  электрическая постоянная.
электрическая постоянная.
Решая уравнение (13) совместно с уравнением (11), получим после простых преобразований выражение радиуса стационарных орбит атома водорода

где квантовое число  имеет значения
имеет значения  По формуле (14) можно рассчитать радиус любой стационарной орбиты. Так, например, радиус ближайшей к ядру орбиты
По формуле (14) можно рассчитать радиус любой стационарной орбиты. Так, например, радиус ближайшей к ядру орбиты  равен
равен

В правой части уравнения (14) все величины, кроме  являются постоянными. Следовательно, радиусы стационарных орбит относятся между собой как квадраты чисел натурального ряда, т. е. как
являются постоянными. Следовательно, радиусы стационарных орбит относятся между собой как квадраты чисел натурального ряда, т. е. как 
Орбиты водородного атома, рассчитанные по формуле (14), изображены на рис. 358; выраженные в пикометрах значения радиуса орбит равны:  большого радиуса вычерчены неполностью).
большого радиуса вычерчены неполностью).

Рис. 358
Определим теперь полную энергию  электрона в атоме. Она слагается из кинетической энергии
электрона в атоме. Она слагается из кинетической энергии  поступательного движения электрона по орбите и потенциальной энергии
поступательного движения электрона по орбите и потенциальной энергии  притяжения электрона к ядру.
притяжения электрона к ядру.
Учитывая формулу (13), получим

Что касается потенциальной энергии электрона, то она должна быть отрицательна и равна

[согласно расчету потенциальной энергии системы двух разноименных зарядов, который был выполнен в § 78, формула  Поэтому
Поэтому

т. е. полная энергия электрона оказывается отрицательной и равной по абсолютной величине его кинетической энергии.
Подставляя в формулу (17) выражение радиуса (14), получим

По этой формуле можно рассчитать энергию электрона для любой стационарной орбиты. Так, например, для ближайшей к ядру орбиты  получим
получим

Величина полной энергии электрона, находящегося на стационарной орбите, называется уровнем энергии атома (или энергетическим уровнем). На рис. 359 схематически изображены уровни энергии водородного атома, рассчитанные по формуле (18); здесь же указаны соответствующие им значения энергии в электрон вольтах 
Согласно формуле (18), энергия атома возрастает с увеличением квантового числа  или, что то же, с увеличением радиуса электронной орбиты. Здесь надо учитывать, что энергия
или, что то же, с увеличением радиуса электронной орбиты. Здесь надо учитывать, что энергия  отрицательна; поэтому уменьшение ее абсолютной величины соответствует возрастанию энергии. Минимумом энергии
отрицательна; поэтому уменьшение ее абсолютной величины соответствует возрастанию энергии. Минимумом энергии  атом обладает при движении электрона по ближайшей к ядру орбите
атом обладает при движении электрона по ближайшей к ядру орбите  а максимумом энергии
а максимумом энергии  при движении электрона по самой дальней орбите
при движении электрона по самой дальней орбите 

Рис. 359
При переходе электрона с одной стационарной орбиты на другую (ближнюю к ядру) орбиту излучается квант энергии, равный разности энергетических уровней атома до излучения и после него. Так, например, переход электрона со второй орбиты  на первую
на первую  сопровождается излучением кванта
сопровождается излучением кванта  а переход электрона с третьей орбиты
а переход электрона с третьей орбиты  на вторую
на вторую  сопровождается излучением кванта
сопровождается излучением кванта  Этим излучениям соответствуют следующие значения частот (длин волн):
Этим излучениям соответствуют следующие значения частот (длин волн):

Самопроизвольный переход электрона на более далекую орбиту т. е. самопроизвольный переход атома на более высокий энергетический уровень невозможен. Для осуществления такого перехода необходимо сообщить атому определенное количество энергии извне, т. е. возбудить атом. Так, например, переход электрона о первой стационарной орбиты на вторую совершается при поглощении атомом кванта, равного  а переход электрона со второй орбиты на третью — поглощением кванта, равного
а переход электрона со второй орбиты на третью — поглощением кванта, равного 
Таким образом, атом может излучать и поглощать волны только вполне определенных частот (длин), чем и обусловлен линейчатый характер водородного спектра.
Нормальным состоянием атома является такое, при котором электрон движется по самой близкой к ядру орбите  В этом случае атом не может излучать, поскольку электрон не имеет возможности перейти
В этом случае атом не может излучать, поскольку электрон не имеет возможности перейти  этой орбиты еще ближе к ядру. Энергетический уровень
этой орбиты еще ближе к ядру. Энергетический уровень  соответствующий нормальному состоянию атома, называется нормальным уровнем; все остальные уровни называются возбужденными.
соответствующий нормальному состоянию атома, называется нормальным уровнем; все остальные уровни называются возбужденными.
Выведем теперь общую формулу частоты  излучения атома. Для этого подставим выражение энергии (18) в условие частот (12):
излучения атома. Для этого подставим выражение энергии (18) в условие частот (12):

где  квантовое число и энергия, соответствующие начальному состоянию атома
квантовое число и энергия, соответствующие начальному состоянию атома  излучения),
излучения),  те же характеристики конечного состояния атома (после излучения). Величина постоянного множителя, стоящего в правой части формулы (19), оказывается равной постоянной Ридберга:
те же характеристики конечного состояния атома (после излучения). Величина постоянного множителя, стоящего в правой части формулы (19), оказывается равной постоянной Ридберга:

в чем легко убедиться, подставляя в формулу (20) численные значения универсальных постоянных  Тогда формула (19) примет вид
Тогда формула (19) примет вид

Сопоставление формулы (21) в эмпирическими сериальными формулами (8), (9) и (10) показывает, что они являются частными случаями формулы (21). В самом деле, при  формула (21) дает серию Лаймана, при
формула (21) дает серию Лаймана, при  серию Бальмера, при
серию Бальмера, при  серию Пашена.
серию Пашена.
Следовательно, спектральные линии серии Лаймана соответствуют излучению атома водорода при переходе электрона со второй, третьей, четвертой и т. д. орбит на первую; линии серии Бальмера соответствуют излучению при переходе электрона с третьей, четвертой, пятой и т. д. орбит на вторую; линии серии Пашена соответствуют излучению при переходе электрона в четвертой, пятой, шестой и т. д. орбит на третью.
Так как газ состоит из множества различно возбужденных атомов, то в нем одновременно совершаются все возможные типы переходов электрона. Поэтому в спектре излучения водорода одновременно представлены линии всех серий (при том, конечно, условии, что атомы все время возбуждаются посредством какого-либо внешнего источника энергии).
Образование спектральных серий Лаймана, Бальмера и Пашена схематически показано на рис. 358 и 359.
Отметим, что в каждой серии расстояние между спектральными линиями постепенно уменьшается в сторону коротких волн и в конце концов линии практически сливаются (см., например, рис. 357). Таким образом, каждая серия оказывается ограниченной со стороны коротких волн. Эта граница называется головой серии; ее частота определяется по формуле (21) при  что соответствует падению свободного электрона на одну из стационарных орбит водородного иона (протона).
что соответствует падению свободного электрона на одну из стационарных орбит водородного иона (протона).
Рассмотренная теория строения атома водорода применима и к водородоподобным атомам, т. е. к ионизированным атомам, содержащим только один электрон (например, к ионам  Однако в этом случае при выводе формул следует полагать заряд ядра равным не
Однако в этом случае при выводе формул следует полагать заряд ядра равным не  атомный номер элемента).
атомный номер элемента).
Применительно к водородоподобным атомам спектральная формула Бора (21) примет вид

Квантовая теория Бора сыграла важную роль в развитии физики. Количественно объяснив строение атома водорода и сложную структуру водородного спектра, она наметила правильный подход к изучению внутриатомных процессов. Правда, непосредственное использование теории Бора (в том виде, в каком она изложена ранее) для расчета спектров многоэлектронных атомов оказалось
невозможным. Понадобилось дальнейшее развитие этой теории, завершившееся созданием современной квантовой механики, количественно объясняющей все особенности строения и свойств атомов и молекул.
Тем не менее теория Бора дает возможность качественно (и притом весьма наглядно) объяснить общие черты строения многоэлектронных атомов и их спектров, в частности дает возможность обосновать закономерности расположения химических элементов в периодической системе Менделеева.
Ограниченность квантовой теории Бора обусловлена тем, что она не вполне последовательна в своих построениях: базируясь на квантовых исходных положениях (постулатах), она пользуется законами классической механики для описания движения электронов в атоме (в этом смысле ее можно было бы назвать «полуквантовой» теорией).
Между тем электрон в атоме уже не является обычной (классической) частицей, в чем легко убедиться, применив к этому электрону принцип Гейзенберга (см. § 20). Так как скорость электрона в атоме имеет порядок  то неточность в ее определении по крайней мере не должна превышать величины самой скорости, т. е. максимально допускаемая неточность
то неточность в ее определении по крайней мере не должна превышать величины самой скорости, т. е. максимально допускаемая неточность  Тогда, согласно соотношению неопределенностей (принципу Гейзенберга), неточность в определении координаты
Тогда, согласно соотношению неопределенностей (принципу Гейзенберга), неточность в определении координаты

Но  см есть размер самого атома. Следовательно, понятие местоположения электрона в атоме теряет смысл. Лишаются содержания и такие классические понятия, как траектория электрона в атоме и перемещение при его переходе с одной орбиты на другую (т. е. из одного энергетического состояния в другое). Итак, действительно, атомный электрон не является обычной частицей (в классическом смысле этого слова).
см есть размер самого атома. Следовательно, понятие местоположения электрона в атоме теряет смысл. Лишаются содержания и такие классические понятия, как траектория электрона в атоме и перемещение при его переходе с одной орбиты на другую (т. е. из одного энергетического состояния в другое). Итак, действительно, атомный электрон не является обычной частицей (в классическом смысле этого слова).
В связи с этим современная квантовая механика не устанавливает точного положения электронов в объеме атома, а рассматривает лишь вероятность нахождения электрона в том или ином месте объема. Это значит, что с точки зрения квантовой механики заряд электрона не сосредоточен в том месте, где в данный момент находится электрон, а распределен («размазан») по всему объему атома, образуя электронное облако переменной плотности. Плотность электронного облака в любой точке объема атома пропорциональна вероятности нахождения электрона в этой точке.
В современной квантовой механике состояние движения электронов в атоме характеризуется не одним, а четырьмя квантовыми числами (главным, побочным, магнитным и спиновым).
Главное квантовое число  принимает только целочисленные значения от 1 до
принимает только целочисленные значения от 1 до 
Побочное (или орбитальное) квантовое число  принимает целочисленные значения от
принимает целочисленные значения от  до
до  (всего
(всего  значений).
значений).
Магнитное квантовое число  принимает целочисленные значения от
принимает целочисленные значения от  до
до  включая
включая  (всего
(всего  значений).
значений).
Спиновое квантовое число  может иметь только два полуцелых значения
может иметь только два полуцелых значения  .
.
Совокупность электронов, характеризующихся одним и тем же значением главного квантового числа  образует электронный слой, или энергетический уровень атома.
образует электронный слой, или энергетический уровень атома.
Совокупность электронов с одним и тем же значением побочного квантового числа  образует подгруппу, или энергетический подуровень. Электроны
образует подгруппу, или энергетический подуровень. Электроны
данного подуровня несколько различаются между собой величиной энергии, обладая различными значениями магнитного  или спинового
или спинового  квантовых чисел. Таким образом, квантовые числа определяют возможные значения энергий электронов в атоме, т. е. возможные энергетические состояния атома.
квантовых чисел. Таким образом, квантовые числа определяют возможные значения энергий электронов в атоме, т. е. возможные энергетические состояния атома.
Распределение электронов в атоме по энергетическим уровням и подуровням (т. е. по значениям квантовых чисел) осуществляется на основе следующих двух принципов:
1) принципа Паули, согласно которому
в атоме не может быть электронов, характеризующихся одинаковой комбинацией значений квантовых чисел; иначе говоря, в атоме состояния всех электронов различны:
2) принципа минимума энергии:
распределение электронов в атоме соответствует минимуму энергии атома
Учитывая принцип Паули, можно найти максимальное число электронов в любом электронном слое атома. Так как  имеет
имеет  значений, а при каждом
значений, а при каждом  величина
величина  принимает два значения, то число электронов с данными
принимает два значения, то число электронов с данными  равно
равно  При данном
При данном  величина I принимает
величина I принимает  значений от
значений от  до
до  Поэтому максимальное число электронов, характеризующееся данным значением
Поэтому максимальное число электронов, характеризующееся данным значением  т. е. максимально возможное число электронов в данном слое, равно (в соответствии с формулой суммы членов арифметической прогрессии)
т. е. максимально возможное число электронов в данном слое, равно (в соответствии с формулой суммы членов арифметической прогрессии)

Устанавливаемые квантовой механикой закономерности внутриатомных процессов с исключительной точностью подтверждаются опытными данными, однако она уже не обладает той наглядностью и простотой, которые (с позиции привычных представлений) присущи теории Бора.
| << Предыдущий параграф | Следующий параграф >> |
- Предисловие
- Введение
- § 1. Предмет физики. Связь физики с другими науками и производством
- § 2. О единицах измерения и размерности физических величин
- § 3. О некоторых математических понятиях и символах
- 1. Физические основы механики
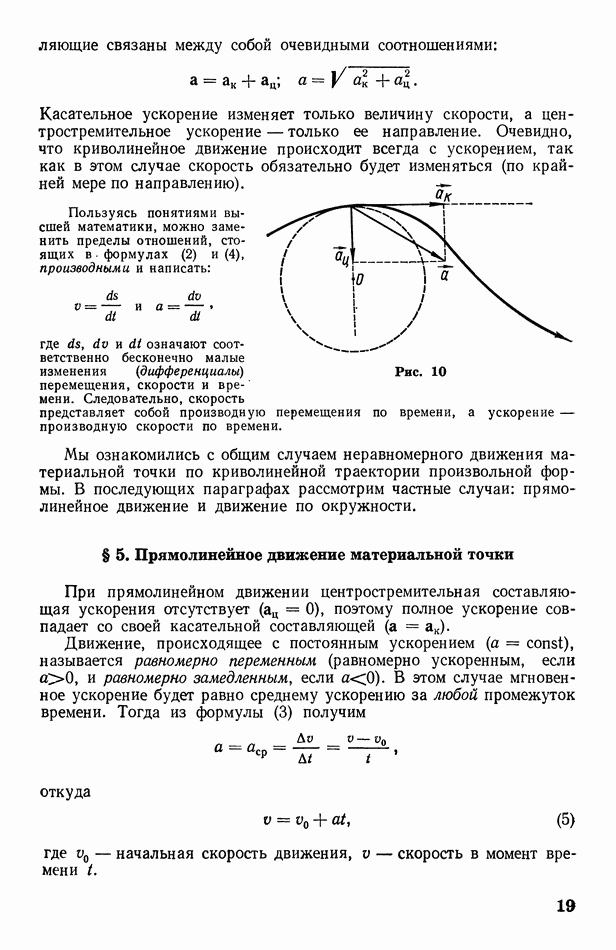
- § 4. Общий случай криволинейного движения материальной точки; основные характеристики движения
- § 5. Прямолинейное движение материальной точки
- § 6. Движение материальной точки по окружности
- Глава II. Основные законы динамики
- § 7. Законы Ньютона. Масса и сила
- § 8. Закон изменения количества движения (импульса)
- § 9. Закон сохранения количества движения в изолированной системе
- § 10. Силы упругости
- § 11. Силы трения
- § 12. Силы тяготения (гравитационные силы)
- § 13. Центростремительная сила
- § 14. Инерциальные и неинерциальные системы отсчета. Силы инерции
- § 15. Вес тел. Ускорение силы тяжести. Невесомость
- Глава III. Работа и энергия
- § 16. Работа и мощность
- § 17. Энергия
- § 18. Закон сохранения и превращения энергии
- § 19. О космических скоростях
- § 20. Границы применимости классической механики
- Глава IV. Вращательное движение твердого тела
- § 21. Основной закон динамики вращения
- § 22. Моменты инерции некоторых тел
- § 23. Закон сохранения момента количества движения. Кинетическая энергия вращающегося тела
- Глава V. Движение жидкости
- § 24. Основные определения. Уравнение неразрывности
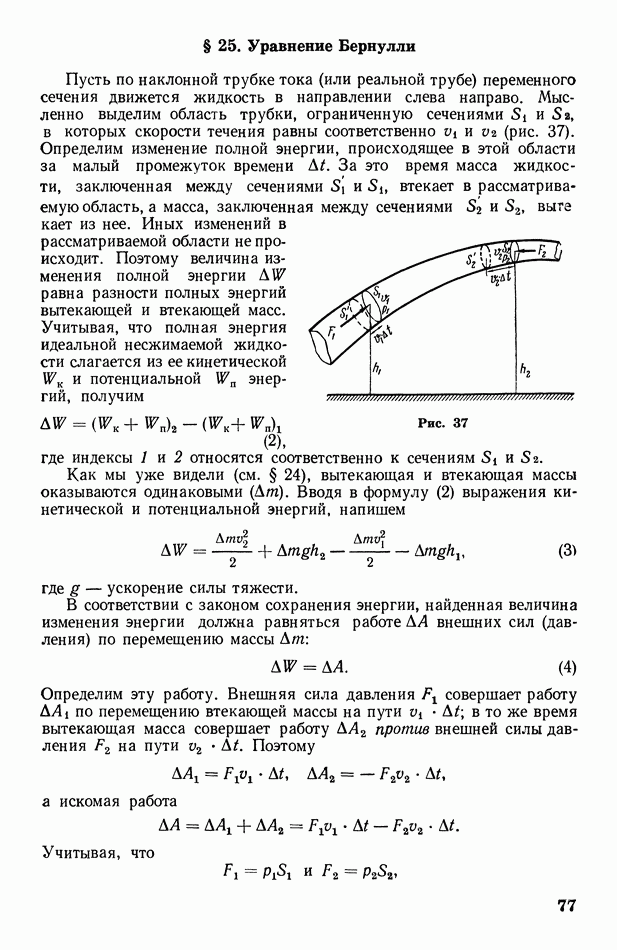
- § 25. Уравнение Бернулли
- § 26. О некоторых приложениях уравнения Бернулли
- Глава VI. Колебания и волны
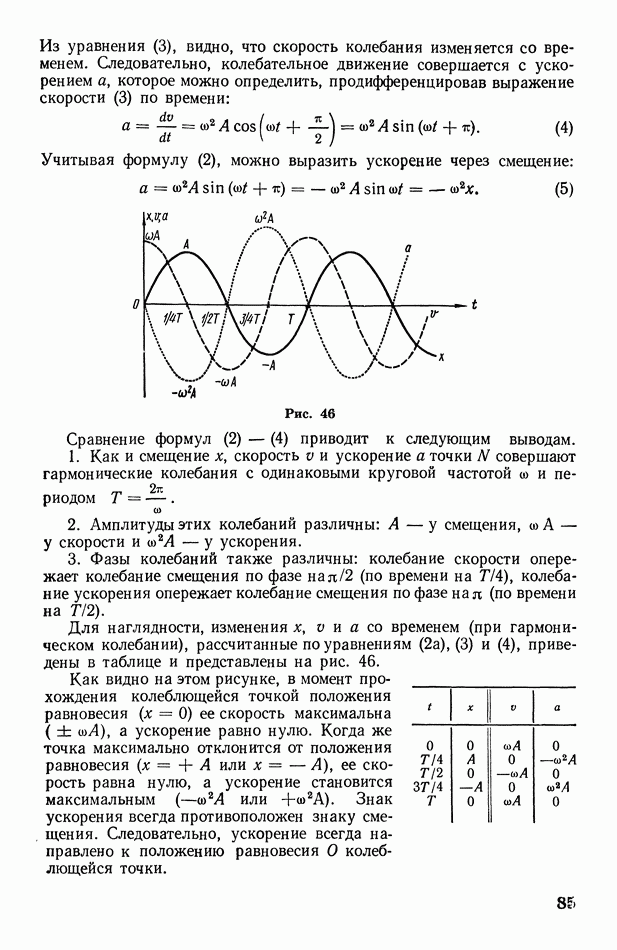
- § 27. Гармоническое колебание и его характеристики
- § 28. Сложение гармонических колебаний
- § 29. Динамика колебательного движения. Маятник
- § 30. О затухающих и вынужденных колебаниях
- § 31. Волновой процесс
- § 32. Уравнение волны. Интенсивность волны
- § 33. Интерференция волн. Стоячие волны
- § 34. Фронт волны. Принцип Гюйгенса-Френеля
- 2. Молекулярная физика и термодинамика
- § 35. Основные положения молекулярно-кинетической теории
- § 36. О некоторых явлениях, подтверждающих основные положения молекулярно-кинетической теории
- § 37. О теплоте и температуре
- § 38. О предмете и методах молекулярной физики
- Глава VIII. Газы
- § 39. Экспериментальные газовые законы: Бойля-Мариотта, Гей-Люссака, Дальтона, Авогадро. Абсолютная температура
- § 40. Уравнение Клапейрона — Менделеева. Универсальная газовая постоянная
- § 41. Основное уравнение кинетической теории идеального газа
- § 42. Средняя кинетическя энергия поступательного движения молекулы идеального газа
- § 43. О числе степеней свободы. Внутренняя энергия газа
- § 44. Теплоемкости газа. Физический смысл универсальной газовой постоянной
- § 45. Скорость поступательного движения молекул газа. Распределение числа молекул по скоростям
- § 46. Средняя длина свободного пробега молекул
- § 47. Явления переноса в газах. Уравнение переноса
- § 48. Диффузия
- § 49. Теплопроводность
- § 50. Внутреннее трение (вязкость)
- Глава IX. Жидкости и твердые тела
- § 51. Особенности строения жидкостей и твердых тел
- § 52. Деформация твердого тела
- § 53. Тепловое расширение твердых и жидких тел
- § 54. Теплоемкость твердых и жидких тел
- § 55. Диффузия в жидких и твердых телах
- § 56. Осмос
- § 57. Теплопроводность жидких и твердых тел
- § 58. Вязкость жидкости. Турбулентное движение жидкости
- § 59. Внутреннее давление в жидкости. Поверхностное натяжение и свободная энергия поверхности жидкости
- § 60. Дополнительное давление под искривленной поверхностью жидкости. Формула Лапласа
- § 61. Капиллярные явления; формула Жюрена
- Глава X. Изменение агрегатного состояния вещества (фазовые превращения)
- § 62. Понятие о фазовых превращениях и диаграмме состояний вещества
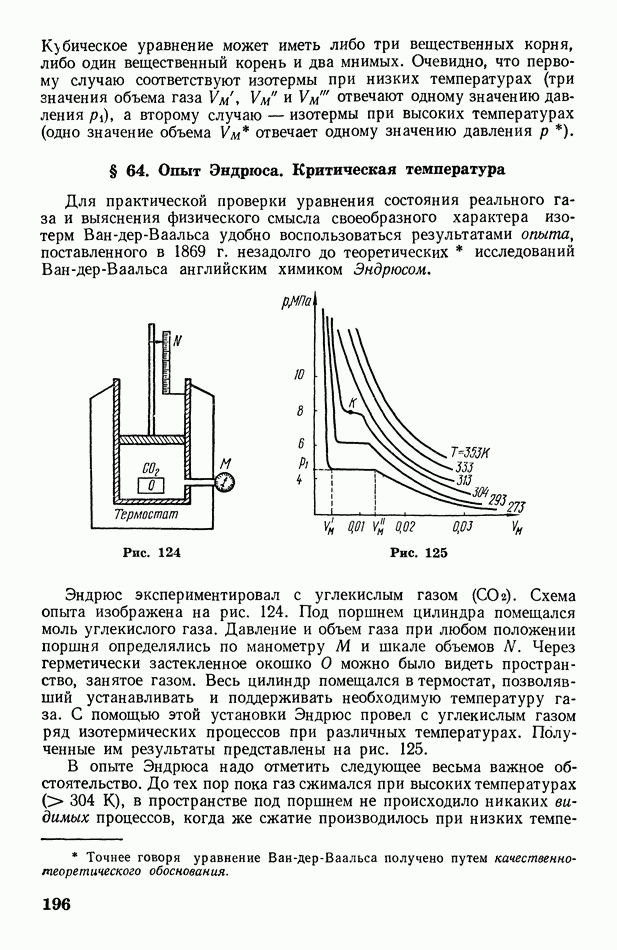
- § 63. Реальный газ. Уравнение Ван-дер-Ваальса
- § 64. Опыт Эндрюса. Критическая температура
- § 65. Сжижение газов. Эффект Джоуля-Томсона
- § 66. Испарение и конденсация. Кипение
- § 67. Упругость насыщенного пара над искривленной поверхностью жидкости и над раствором
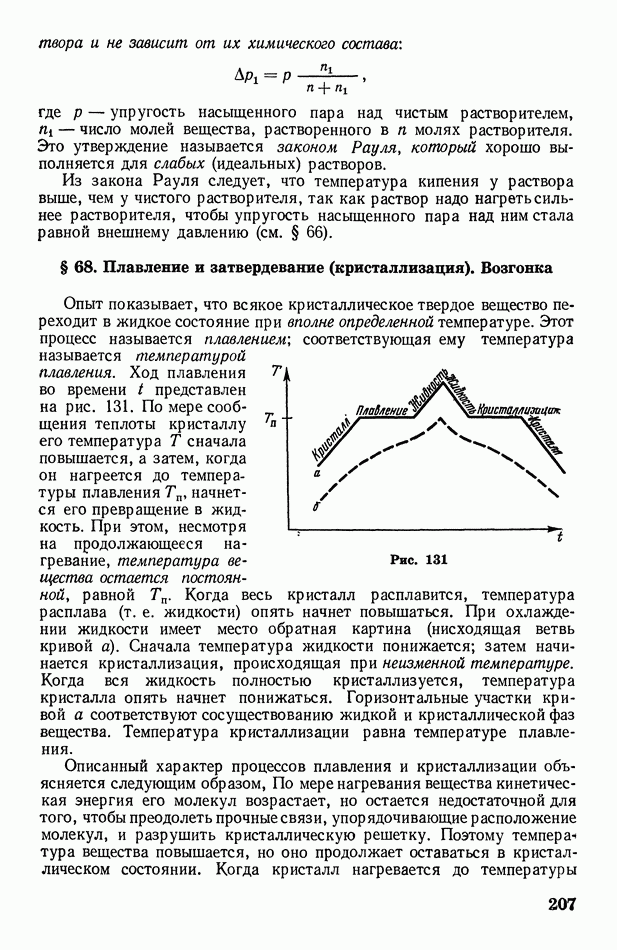
- § 68. Плавление и затвердевание (кристаллизация). Возгонка
- Глава XI. Основы термодинамики
- § 69. О некоторых общих понятиях термодинамики. Первое начало термодинамики
- § 70. Работа, совершаемая при изменении объема газа. Адиабатические процессы
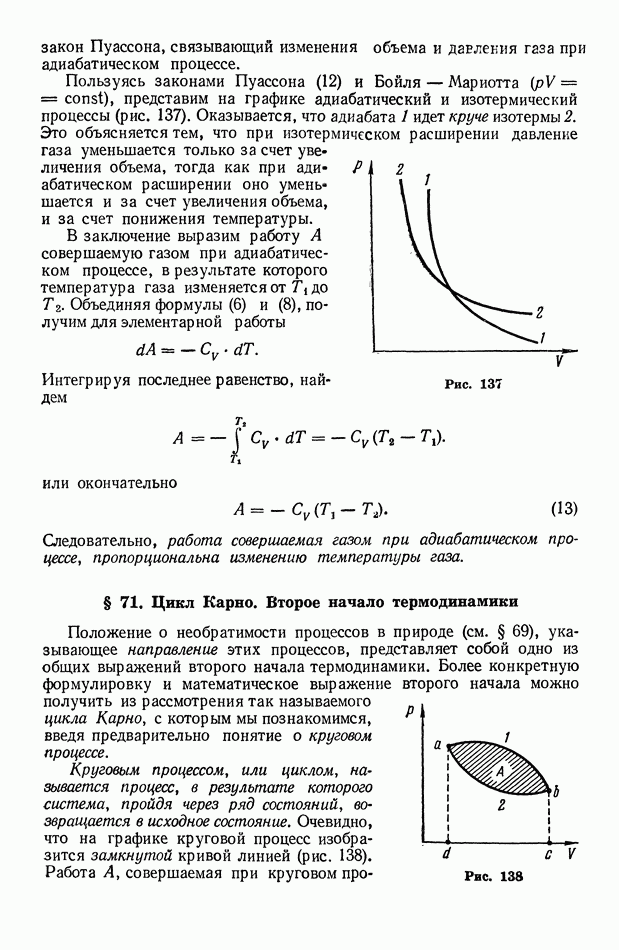
- § 71. Цикл Карно. Второе начало термодинамики
- § 72. Энтропия
- § 73. О статистическом смысле энтропии и второго начала термодинамики
- 3. Электричество и магнетизм
- § 74. Электризация тел. Электрический заряд
- § 75. Взаимодействие электрических зарядов в вакууме. Электрическое поле и его напряженность
- § 76 Электрический диполь. Поле диполя
- § 77. Теорема Остроградского-Гаусса и ее приложения
- § 78. Работа перемещения заряда в электрическом поле. Потенциал
- § 79. О неустойчивости статических систем электрических зарядов
- § 80. Проводники в электрическом поле. Электроемкость. Энергия заряженного проводника
- § 81. Диэлектрики в электрическом поле. Поляризация диэлектриков
- § 82. Электрическое поле в диэлектрике. Диэлектрическая проницаемость. Вектор электрической индукции
- § 83. Конденсатор. Энергия электрического поля
- Глава XIII. Постоянный электрический ток
- § 84. Электрический ток. Сила тока. Электродвижущая сила. Напряжение
- § 85. Ток в металлических проводниках. Сопротивление. Законы Ома. Работа и мощность тока
- § 86. Разветвленная электрическая цепь. Правила Кирхгофа
- § 87. Контактная разность потенциалов. Термоэлектрические явления
- § 88. Эмиссия электронов. Термоэлектронная эмиссия. Электронные лампы
- § 89. Ток в полупроводниках. Собственная и примесная проводимости полупроводников
- § 90. Запирающий слой. Полупроводниковые выпрямители, усилители и термоэлектрические батареи
- § 91. Ток в жидкостях. Электролиз. Законы Фарадея
- § 92. Ток в газах. Несамостоятельный и самостоятельный газовые разряды
- § 93. Типы самостоятельного газового разряда
- Глава XIV. Электромагнетизм
- § 94. Постоянный магнит и круговой ток. Магнитные поля магнитов и токов
- § 95. Магнитное взаимодействие токов в вакууме; закон Ампера
- § 96. Напряженность магнитного поля. Формула Ампера. Закон Био-Савара-Лапласа
- § 97. Некоторые приложения закона Био-Савара-Лапласа
- § 98. Магнитные поля соленоида и тороида
- § 99. Диамагнитные, парамагнитные и ферромагнитные вещества. Магнитная проницаемость. Магнитная индукция. Поток магнитной индукции
- § 100. Действие магнитного поля на проводник с током. Определение ампера
- § 101. Движение заряженных частиц в электрическом и магнитном полях. Определение удельного заряда и массы электрона
- § 102. О некоторых приборах и установках, основанных на движении заряженных частиц в электрическом и магнитном полях
- Глава XV. Электромагнитная индукция и переменный ток
- § 103. Электромагнитная индукция. Закон Фарадея. Правило Ленца. Токи Фуко
- § 104. Взаимная индукция и самоиндукция
- § 105. Энергия магнитного поля. Понятие об электромагнитной теории Максвелла
- § 106. Контур, вращающийся в магнитном поле. Синусоидальный переменный ток. Работа и мощность переменного тока
- § 107. Емкостное и индуктивное сопротивления
- § 108. Обобщенный закон Ома. Электрический резонанс. Коэффициент мощности электрической цепи
- § 109. Понятие о трехфазном токе
- Глава XVI. Электрические колебания и электромагнитные волны
- § 110. Электромагнитные волны
- § 111. Закрытый колебательный контур
- § 112. Вибратор Герца. Автоколебательный контур. О диапазоне частот электромагнитных волн
- § 113. Радиосвязь
- 4. Оптика и атомная физика
- § 114. Природа света
- § 115. Отражение и преломление света. Полное отражение
- § 116. Дисперсия света. Спектры
- § 117. Тонкие линзы. Микроскоп
- § 118. Глаз как оптическая система. Спектральная чувствительность глаза
- § 119. Основные фотометрические характеристики
- § 120. Поглощение света. О физиологическом действии света
- Глава XVIII. Волновые свойства света
- § 121. Интерференция света. Интерферометр
- § 122. Об интерференции света, отраженного от прозрачных пленок
- § 123. Дифракция света. Разрешающая способность оптических приборов
- § 124. Дифракция от щелей. Дифракционные спектры. Дифракционная решетка. О рассеянии света в мутной среде
- § 125. Дифракция рентгеновских лучей. Формула Вульфа-Брэггов
- § 126. О дифракции микрочастиц и волнах де-Бройля
- § 127. Поляризация света. Естественный и поляризованный свет. Поляризация света в турмалине. Поляроиды
- § 128. Двойное лучепреломление. Поляризация света в исландском шпате. Призма Николя
- 129. Вращение плоскости колебаний поляризованного света. Поляриметр
- Глава XIX. Квантовые свойства света и строение атома
- § 130. Тепловое лучеиспускание и лучепоглощение. Абсолютно черное тело. Закон Кирхгофа
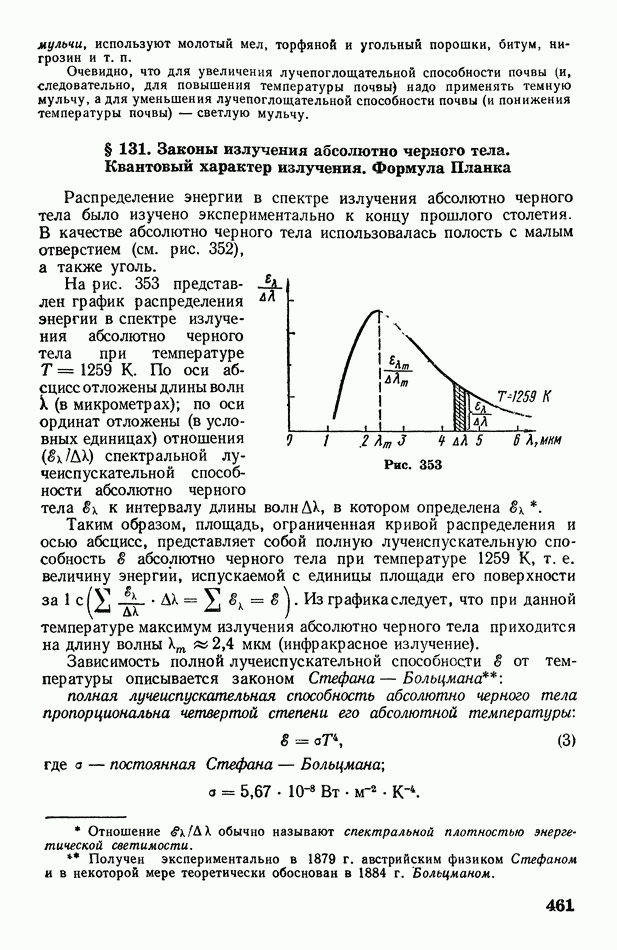
- § 131. Законы излучения абсолютно черного тела. Квантовый характер излучения. Формула Планка
- § 132. Строение атома (ядерная модель). Дискретность энергетических состояний атома. Постулаты Бора
- § 133. Квантовая теория строения атома водорода (по Бору). Объяснение спектров излучения и поглощения водорода
- § 134. Понятие о строении многоэлектронных атомов и образовании оптических и рентгеновских (характеристических) спектров
- § 135. Люминесценция. Законы фотолюминесценции и некоторые ее практические применения
- § 136. Фотоэффект. Законы фотоэффекта. Фотоэлементы
- § 137. Масса и импульс фотона. Световое давление. Эффект Комптона. Флуктуации света
- Глава XX. Атомное ядро и внутриядерные процессы
- § 138. Общие сведения об атомных ядрах. Изотопы
- § 139. Естественная радиоактивность. Альфа-, бета- и гамма-лучи. Законы радиоактивного распада
- § 140. О методах наблюдения и регистрации микрочастиц
- § 141. Ядерные реакции. Искусственная радиоактивность
- § 142. Энергия связи и дефект массы атомного ядра
- § 143. Реакция деления. Цепная реакция. Ядерный реактор
- § 144. Реакция синтеза (термоядерная реакция). Энергия звезд
- § 145. Космические лучи. Элементарные частицы
- § 146. Об использовании ядерной энергии