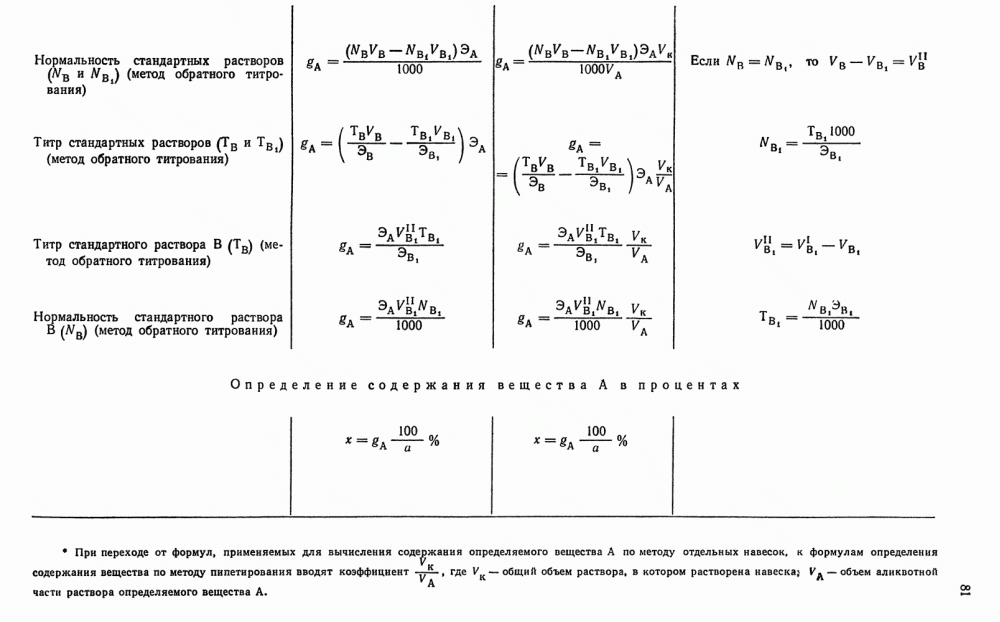
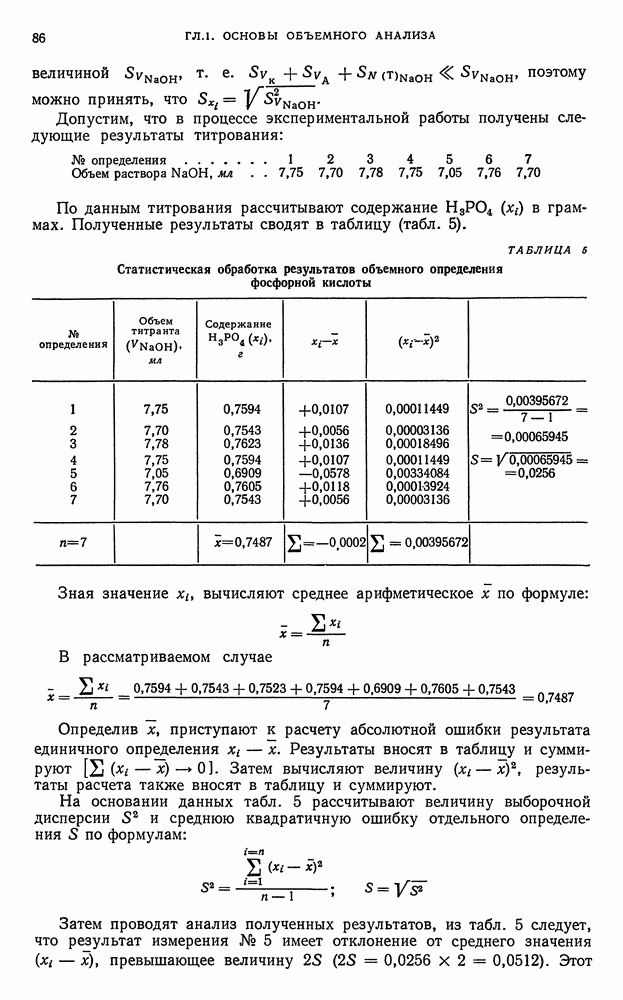
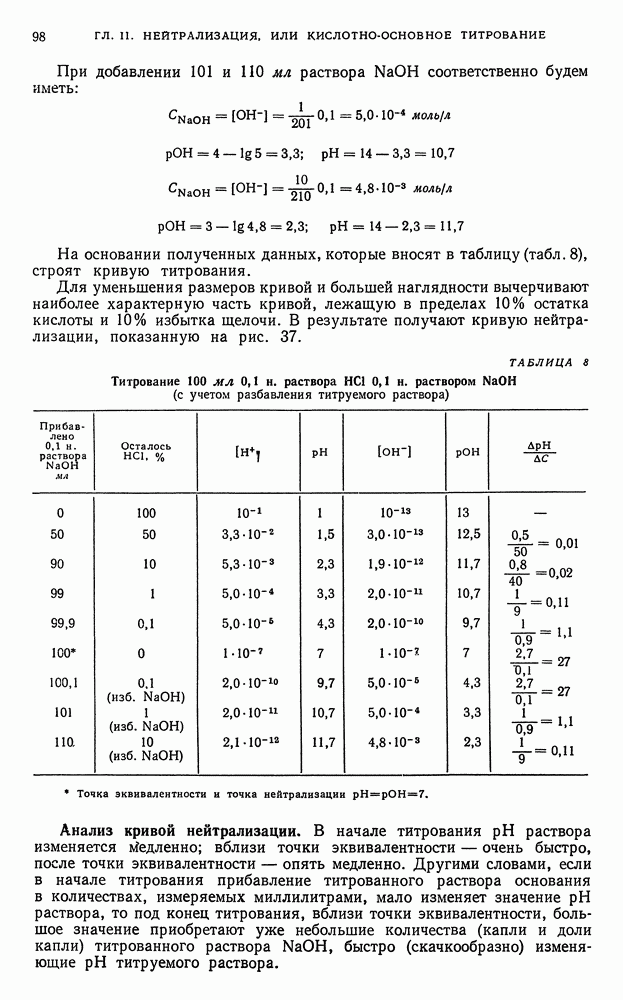
| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
§ 31. Преимущества и недостатки иодометрического метода
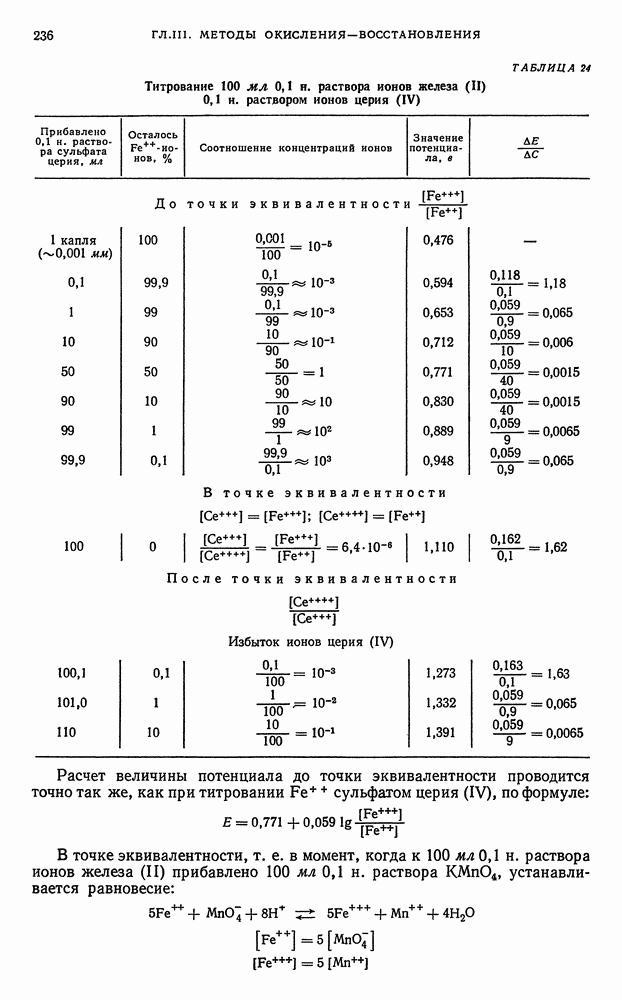
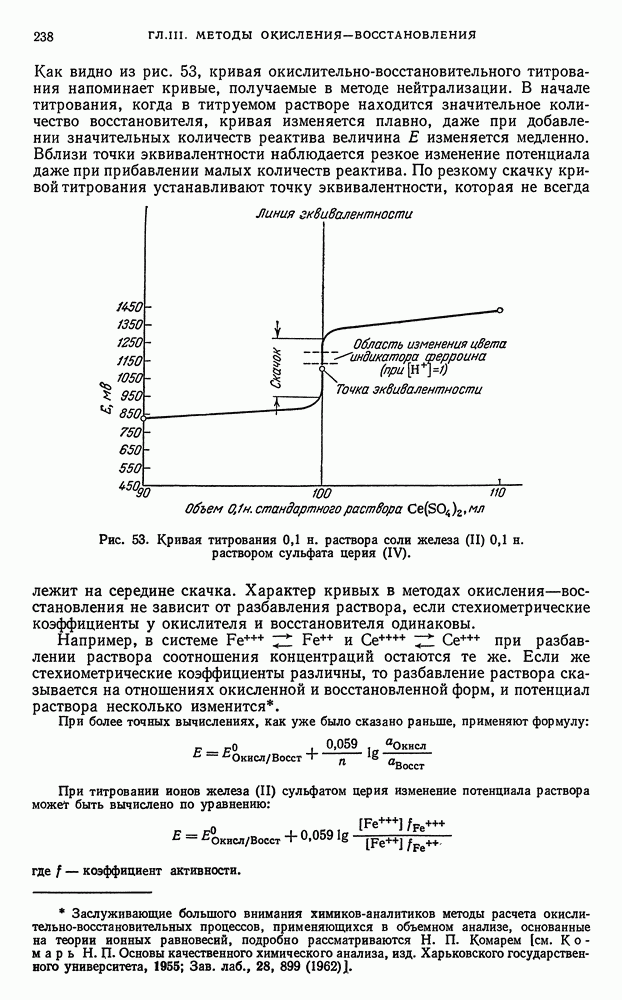
Вещества, определяемые иодометрическим методом. Наряду с перманганатометрией иодометрический метод титрования также является одним из наиболее широко применяемых ред-окс-методов. Окислительновосстановительный потенциал системы  меньше потенциала
меньше потенциала  возможности иодометрического метода достаточно велики. Поскольку иод реагирует не только как окислитель, способный окислять многие неорганические и органические вещества, но и проявляет наряду с этим и другие свойства, используемые в объемном анализе. Титрование иодом основано на следующих реакциях.
возможности иодометрического метода достаточно велики. Поскольку иод реагирует не только как окислитель, способный окислять многие неорганические и органические вещества, но и проявляет наряду с этим и другие свойства, используемые в объемном анализе. Титрование иодом основано на следующих реакциях.
Реакция окисления—восстановления. Элементарный иод или его растворы в KI или в органических растворителях способны окислять:  , сульфиды, сульфиты, тиосульфаты, цианиды, роданиды, гидразин, гидроксиламин, фосфористый водород, фосфористую кислоту, полифенолы, аскорбиновую кислоту, меркаптаны, мочевую кислоту и др.
, сульфиды, сульфиты, тиосульфаты, цианиды, роданиды, гидразин, гидроксиламин, фосфористый водород, фосфористую кислоту, полифенолы, аскорбиновую кислоту, меркаптаны, мочевую кислоту и др.
Используя восстановительные свойства иодистоводородной кислоты или иодидов, возможно определять иодометрическим методом большое число сильных окислителей, при взаимодействии с которыми иодиды, окисляясь, образуют элементарный иод, титруемый затем тиосульфатом. К таким окислителям относятся: нитриты, гипогалогениты, селениты, перманганаты, бихроматы, иодаты, броматы, перекиси,  и многие другие.
и многие другие.
Реакции присоединения. Эти реакции широко применяются в аналитической химии органических соединений для количественного определения двойных связей в ненасыщенных соединениях:

Одним из таких способов определения ненасыщенности органических соединений является метод Гюбля, основанный на способности спиртового раствора иода в присутствии хлорида окисной ртути давать продукты присоединения по месту двойной связи:

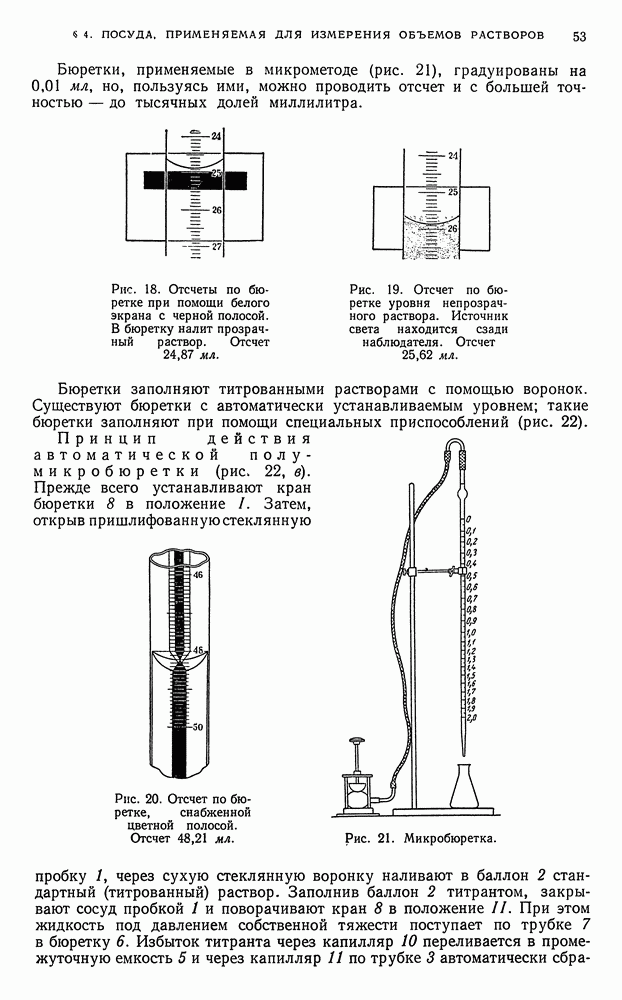
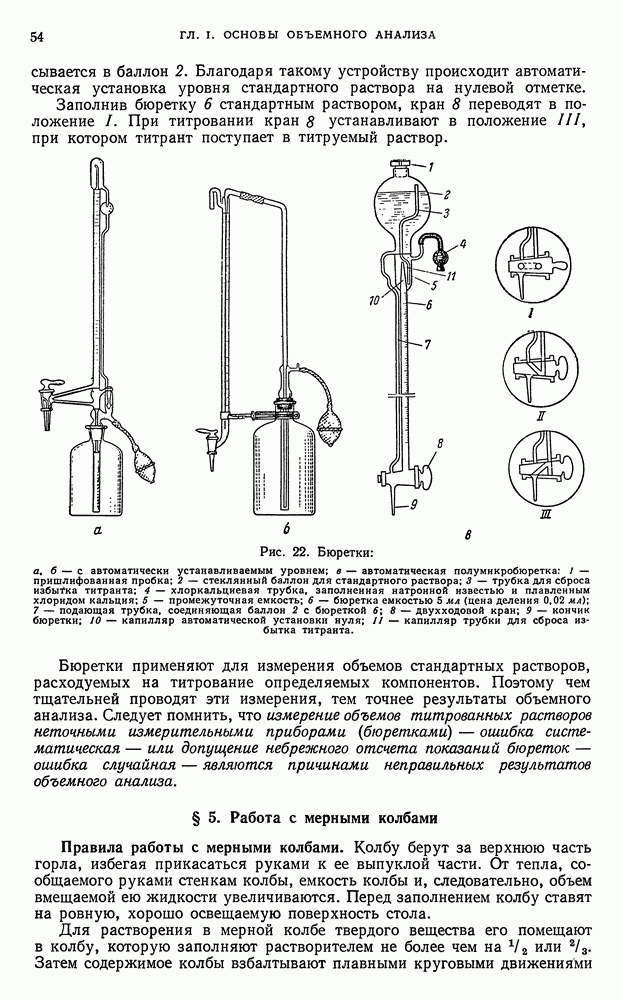
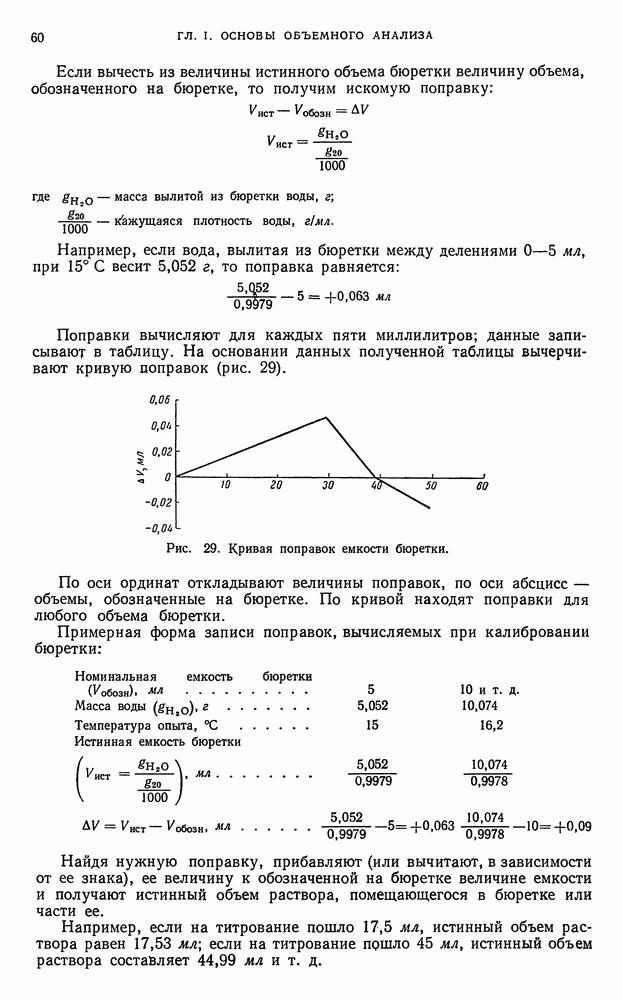
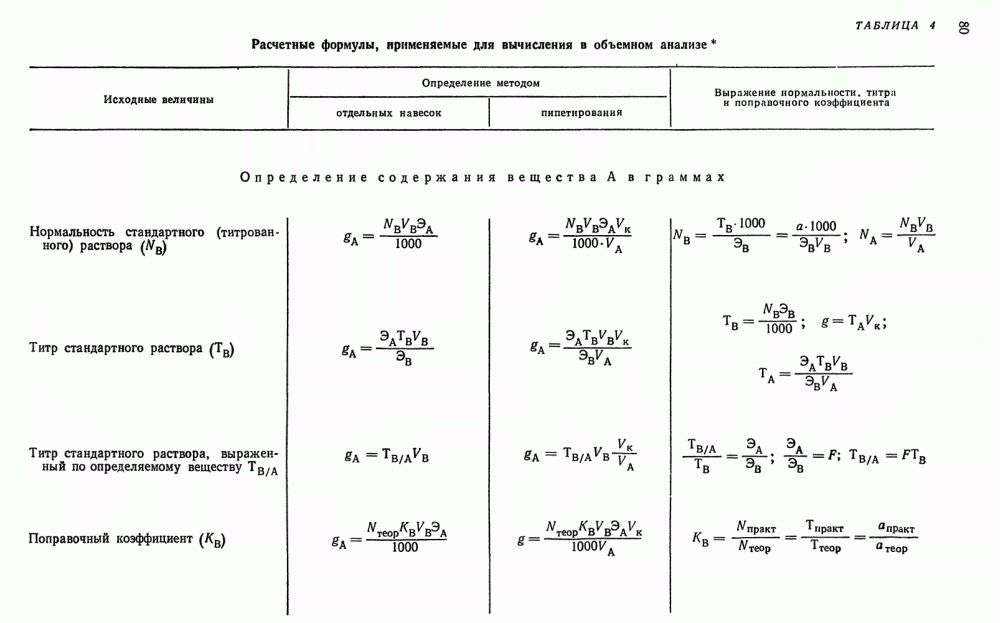
Стейень ненасыщенности определяется йодным числом, т. е. количеством галогена (в процентах), перечисленном на иод, которое присоединяется анализируемым продуктом, растворенным в индиферентном растворителе (например, в хлороформе). Йодное число является одним из важнейших критериев ненасыщенности органических соединений.
Реакции замещения. Иод способен замещать атомы водорода в ароматических и гетероциклических кольцах органических соединений, например, в ряде фенолов дифенолов и ароматических диаминов.
Реакции образования периодидов. Многие органические основания и красители способны реагировать с водными растворами иодида калия, содержащего иод, с образованием нерастворимых в воде продуктов. Например,

Другие реакции. В анализе широко используются реакции иода, например, с диазосоединениями:

Преимущества иодометрического метода. Иодометрические определения отличаются большим разнообразием и этим объясняется широкое применение метода в практике заводских, научно-исследовательских и вузовских лабораторий.
1. Иодометрический метод применим для определения многих соединений, не реагирующих непосредственно с иодом или иодидами. В качестве примера приведем очень важный метод иодометрического определения воды по Фишеру (см. § 41) и и одометр ическое определение кислот (см. § 40).
2. Иодометрический метод отличается большой точностью, превосходящей точность других окислительно-восстановительных методов.
3. Растворы иода окрашены и поэтому иодометрическое титрование можно осуществлять не прибегая к использованию индикаторов, так как о конечной точке титрования можно судить по исчезновению или появлению окраски иода. Желтая окраска комплексных ионов  наблюдается при очень малой их концентрации, составляющей
наблюдается при очень малой их концентрации, составляющей  н., при условии отсутствия в растворе других окрашенных продуктов.
н., при условии отсутствия в растворе других окрашенных продуктов.
4. Иод хорошо растворим в органических растворителях, поэтому широко применяют не только водные, но и неводные растворы иода для всевозможных иодометрических определений.
Недостатки иодометрического метода. Главнейшие ошибки в иодометрии возникают по ряду причин.
Потери иода вследствие его летучести. Титрование следует проводить в условиях, исключающих потери иода в результате его улетучивания, на холоду и по возможности быстро. Умеренный избыток KI уменьшает эти ошибки титрования. В тех случаях, когда титруемый раствор должен постоять некоторое время для завершения реакции, титрование следует проводить в колбе, снабженной притертой пробкой. Ни в коем случае не разрешается проводить титрование в химическом стакане.
Окисление  -ионов кислородом воздуха:
-ионов кислородом воздуха:

Окислению  способствует уменьшение
способствует уменьшение  раствора и действие солнечного света. Поэтому иодометрическое титрование следует проводить при умеренной кислотности раствора. При хранении стандартных (титрованных) растворов иода надо защищать их от действия прямого солнечного света и хранить их в темных склянках или в закрытых шкафах.
раствора и действие солнечного света. Поэтому иодометрическое титрование следует проводить при умеренной кислотности раствора. При хранении стандартных (титрованных) растворов иода надо защищать их от действия прямого солнечного света и хранить их в темных склянках или в закрытых шкафах.
Следует иметь в виду, что некоторые вещества индуцируют окисление  кислородом воздуха. Поэтому иодометр ическое титрование необходимо проводить в отсутствие таких веществ
кислородом воздуха. Поэтому иодометр ическое титрование необходимо проводить в отсутствие таких веществ  и др.). В тех случаях, когда приходится вести определение в присутствии указанных веществ, титрование следует заканчивать по возможности быстро.
и др.). В тех случаях, когда приходится вести определение в присутствии указанных веществ, титрование следует заканчивать по возможности быстро.
Наличие свободных ионов гидроксила. Ионы гидроксила вызывают реакцию диспропорционирования иода. Поэтому иодометрическое титрование нельзя проводить в щелочной среде.
Недостаточность времени для завершения реакции окисления иодидов окислителями или восстановления иода восстановителями. Там, где это требуется по условиям титрования (определение  и др.), необходимо давать достаточное время для достижения полноты желаемой реакции окисления—восстановления.
и др.), необходимо давать достаточное время для достижения полноты желаемой реакции окисления—восстановления.
Адсорбция элементарного иода. Поверхностно-активные вещества и некоторые осадки, получающиеся в процессе иодометрического титрования, обладают способностью удерживать иод.
Поэтому к концу титрования следует тщательно взбалтывать титруемый раствор, содержащий осадок, или вводить органический растворитель для экстракции адсорбированного осадком иода.
Изменение титров стандартных растворов иода и тиосульфата в процессе их хранения и использования. Во избежание этих ошибок необходимо периодически проверять титр тиосульфата по бихромату, а иода по тиосульфату.
Нарушение методики определения в отношении концентраций применяемых растворов, порядка приливания растворов и других условий протекания реакций. Для получения точных и хорошо воспроизводимых результатов необходимо строго придерживаться рекомендуемых методик определения.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ
- ВВЕДЕНИЕ
- § 1. Понятие о количественном анализе
- § 2. Классификация методов количественного анализа
- § 3. Характеристика методов количественного анализа
- § 4. Анализ больших и малых количеств вещества
- § 5. Отбор средней пробы
- § 6. Подготовка вещества для взвешивания
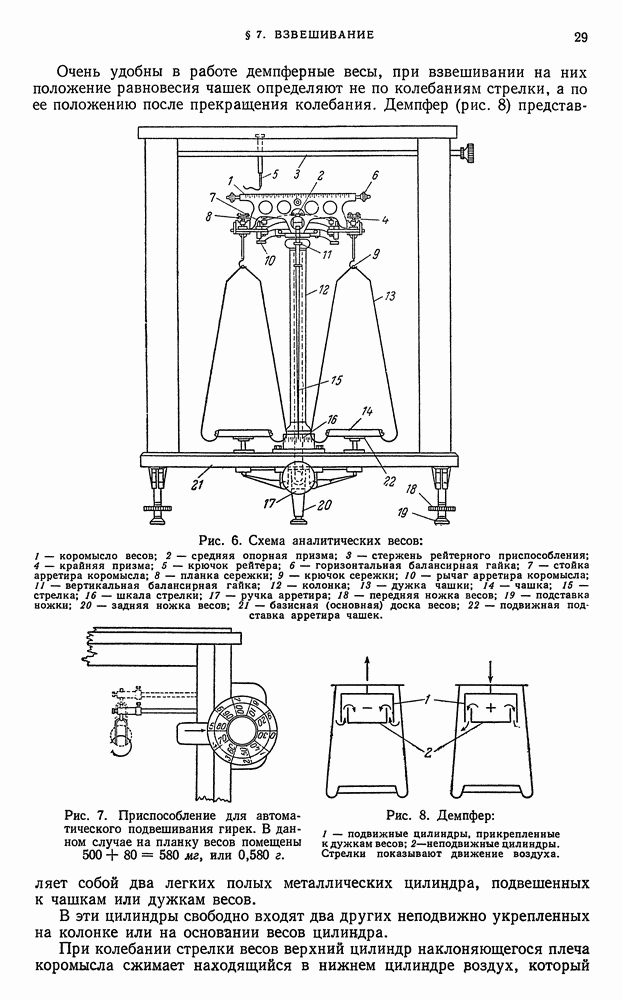
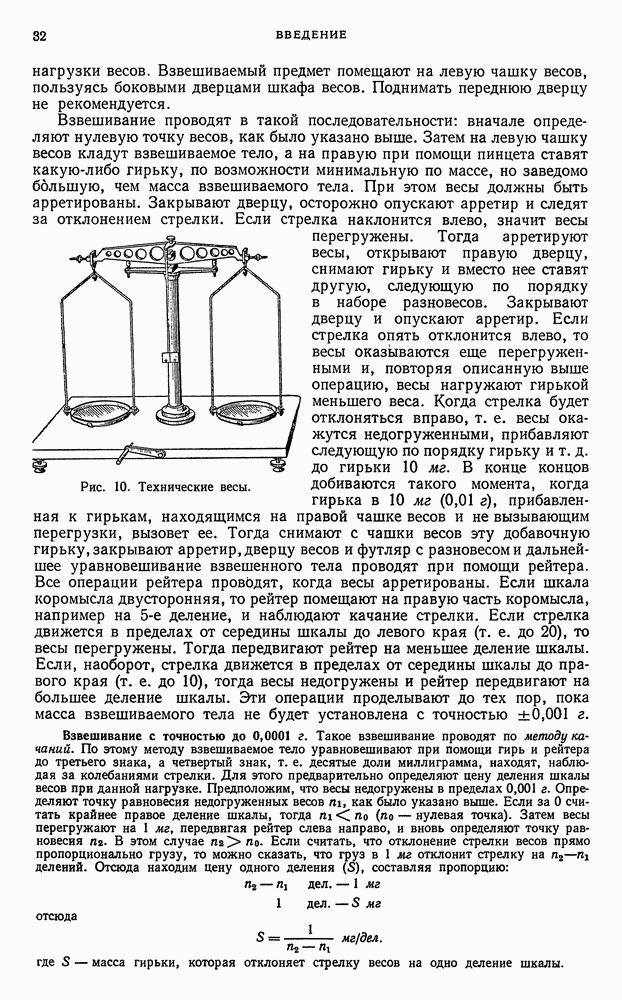
- § 7. Взвешивание
- § 8. Техника взвешивания на аналитических весах
- § 9. Правила обращения с аналитическими весами
- § 10. Приготовление раствора для анализа
- § 11. Запись результатов анализа
- Часть первая. Объемный анализ
- § 1. Сущность объемного анализа
- § 2. Общее уравнение реакции титрования и выводы из него
- Б. ТЕХНИКА ХИМИЧЕСКОГО ЭКСПЕРИМЕНТА В ОБЪЕМНОМ АНАЛИЗЕ
- § 3. Измерение объемов растворов
- § 4. Посуда, применяемая для измерения объемов растворов
- § 5. Работа с мерными колбами
- § 6. Работа с пипетками
- § 7. Работа с бюретками
- § 8. Приготовление стандартных растворов
- В. ВЫЧИСЛЕНИЯ В ОБЪЕМНОМ АНАЛИЗЕ
- § 9. Концентрация растворов и способы ее выражения
- § 10. Способы вычисления в объемном анализе
- § 11. Связь между точностью измерений и точностью вычислений
- § 12. Краткие сведения о статистической обработке экспериментальных данных
- Г. ПОЛУМИКРООБЪЕМНЫЙ МЕТОД АНАЛИЗА
- § 13. Понятие о полумикрообъемном анализе
- § 14. Особенности техники измерения объемов растворов в полумикрометоде
- Д. БЕЗБЮРЕТОЧНЫЕ МЕТОДЫ ТИТРОВАНИЯ
- § 15. Понятие о безбюреточных методах титрования
- § 16. Классификация методов безбюреточного титрования
- Е. АВТОМАТИЧЕСКИЕ МЕТОДЫ
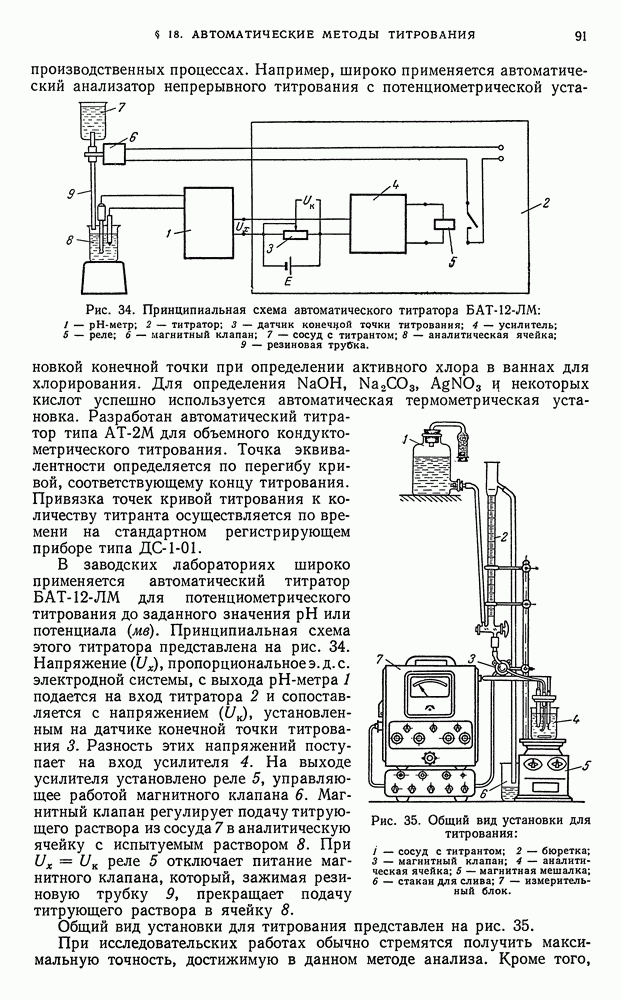
- § 17. Химико-аналитический контроль производства
- § 18. Автоматические методы титрования
- ГЛАВА II. МЕТОДЫ НЕЙТРАЛИЗАЦИИ, ИЛИ МЕТОДЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
- § 1. Характеристика метода
- § 2. Установление точки эквивалентности
- § 3. Графический метод изображения процесса нейтрализации
- § 4. Вычисление концентрации ионов водорода в водных растворах сильных кислот и оснований
- § 5. Вычисление активности ионов водорода в водных растворах сильных кислот и оснований
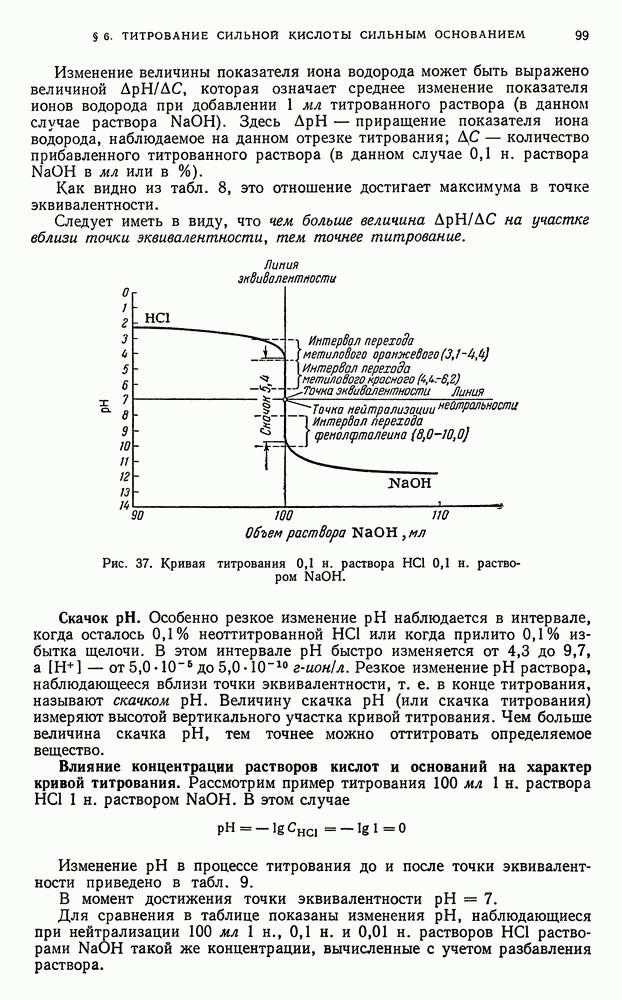
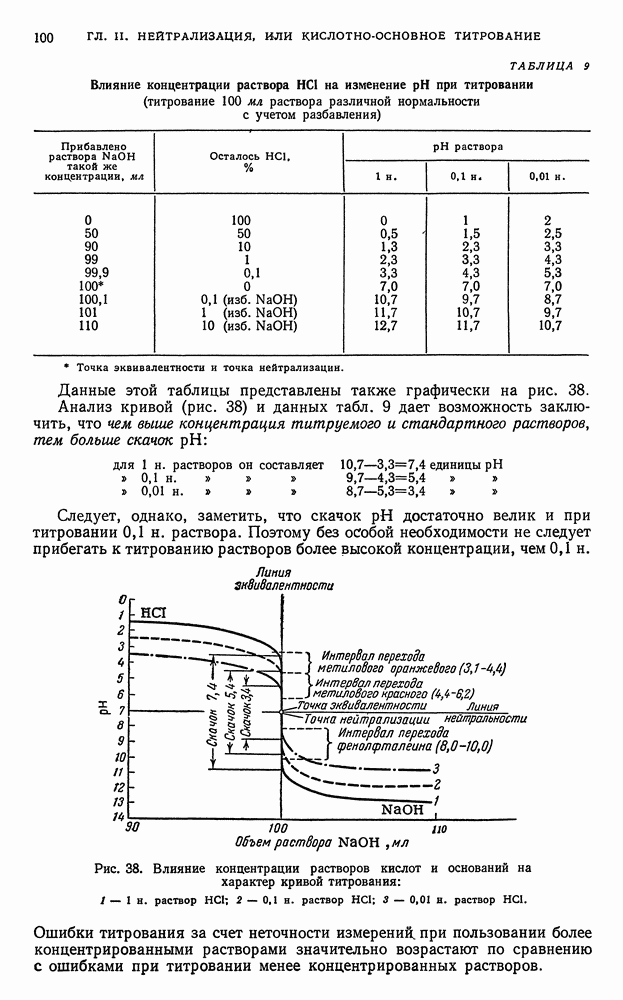
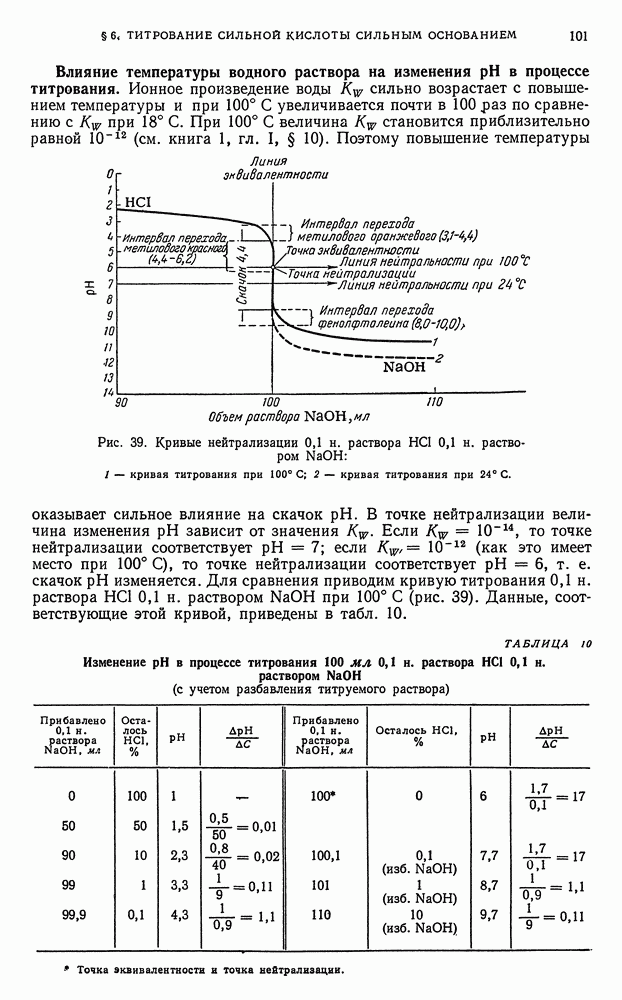
- § 6. Титрование сильной кислоты сильным основанием
- § 7. Вычисление концентрации ионов водорода в растворах слабых кислот и оснований
- § 8. Вычисление активности ионов водорода в водных растворах слабых кислот и оснований
- § 9. Равновесия в водных буферных растворах слабых кислот в присутствии солей этих кислот
- § 10. Равновесия в водных буферных растворах слабых оснований в присутствии солей этих оснований
- § 11. Вычисление концентрации ионов водорода в водных буферных растворах
- § 12. Вычисление активности ионов водорода в водных буферных растворах
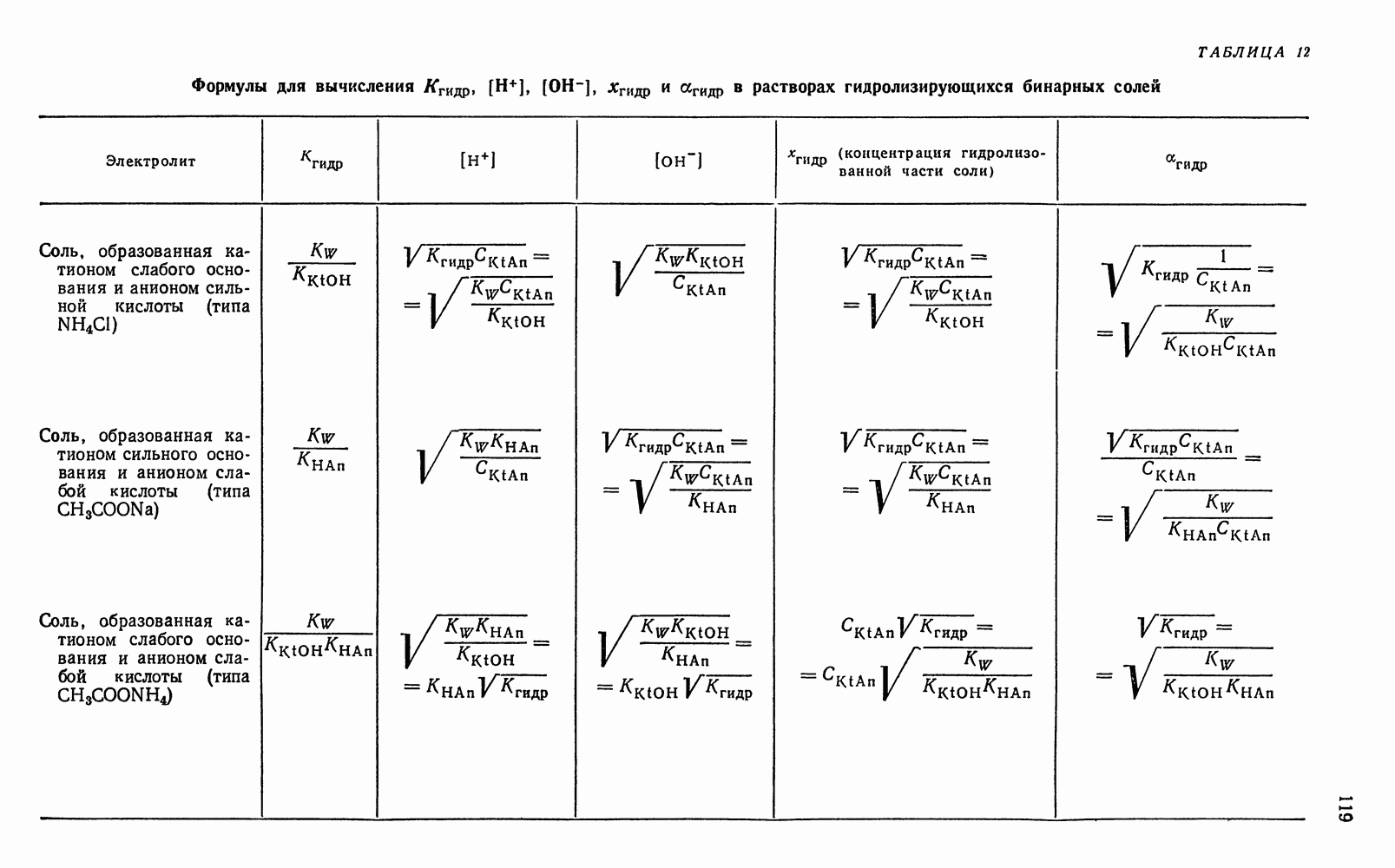
- § 13. Вычисление концентрации ионов водорода и степени гидролиза в водных растворах гидролизующихся бинарных солей
- § 14. Вычисление активности ионов водорода в водных растворах гидролизующихся бинарных солей
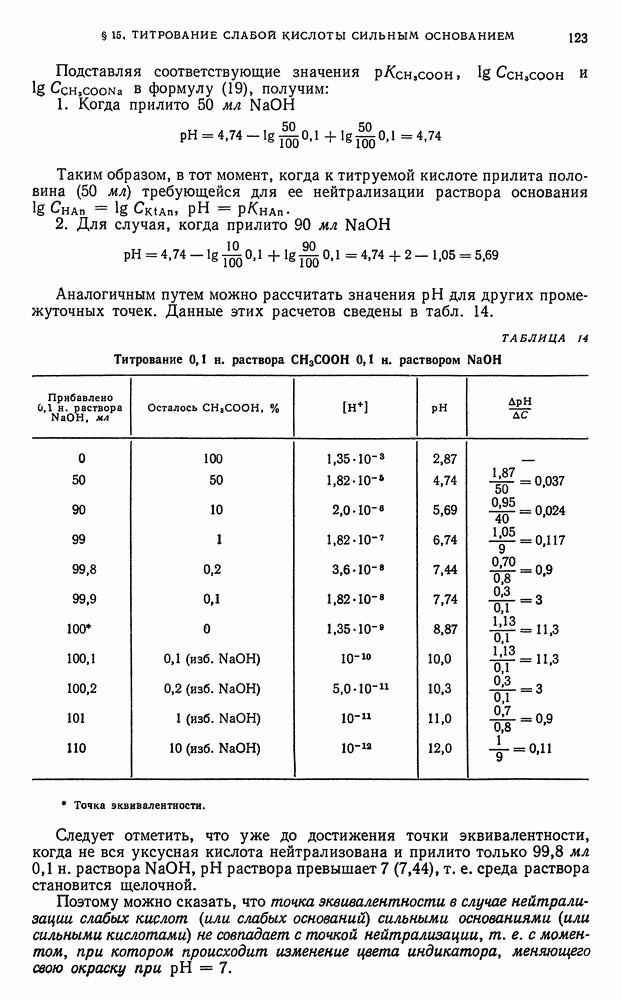
- § 15. Титрование слабой кислоты сильным основанием
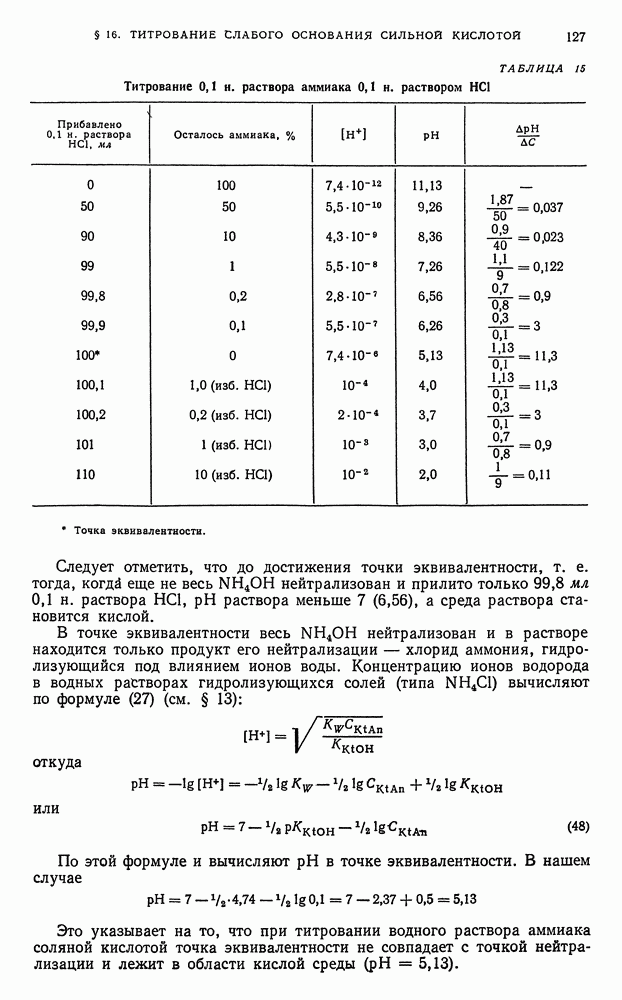
- § 16. Титрование слабого основания сильной кислотой
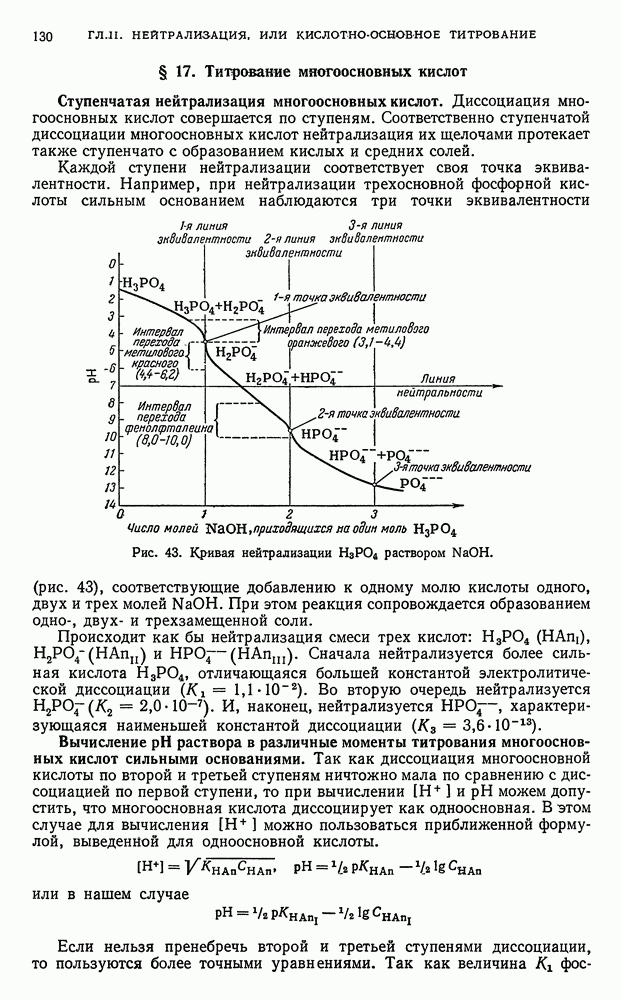
- § 17. Титрование многоосновных кислот
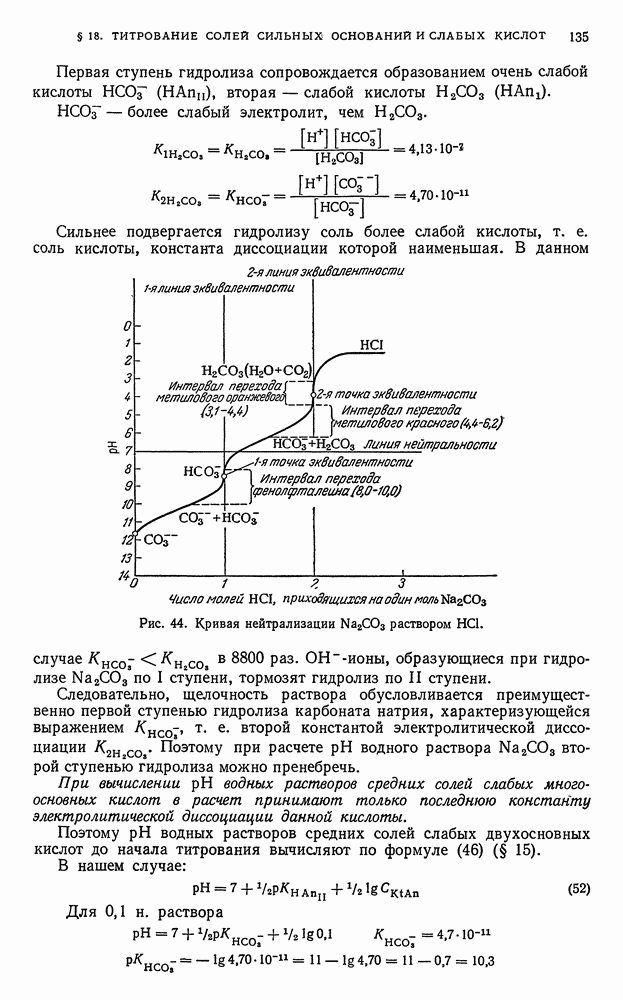
- § 18. Титрование солей, образованных катионами сильных оснований и анионами слабых многоосновных кислот
- § 19. Изменение активности и показателя активности ионов водорода в процессе титрования водных растворов кислот и оснований
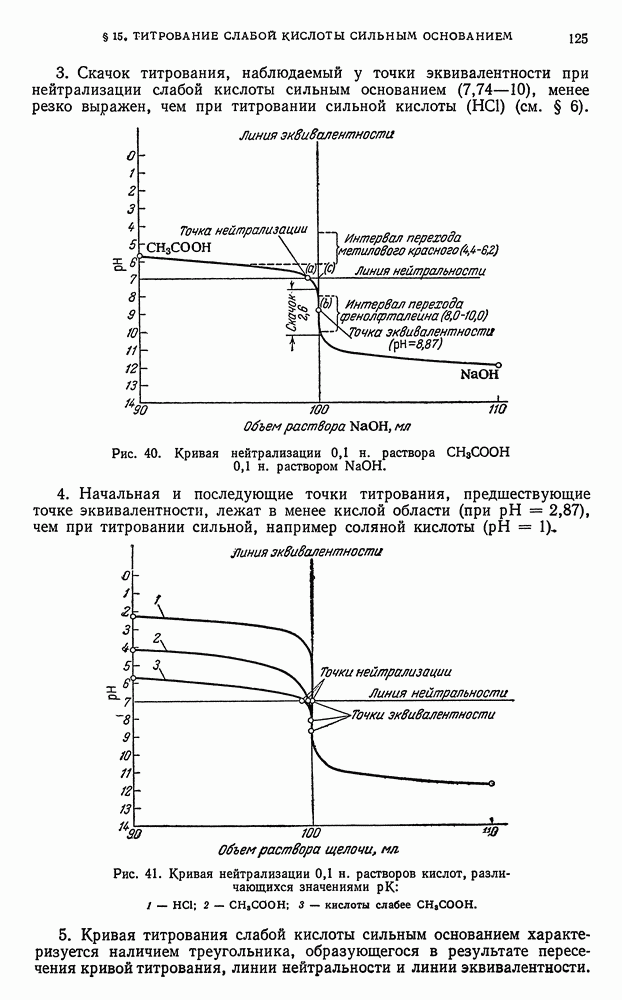
- § 20. Выводы, вытекающие из рассмотрения кривых нейтрализации
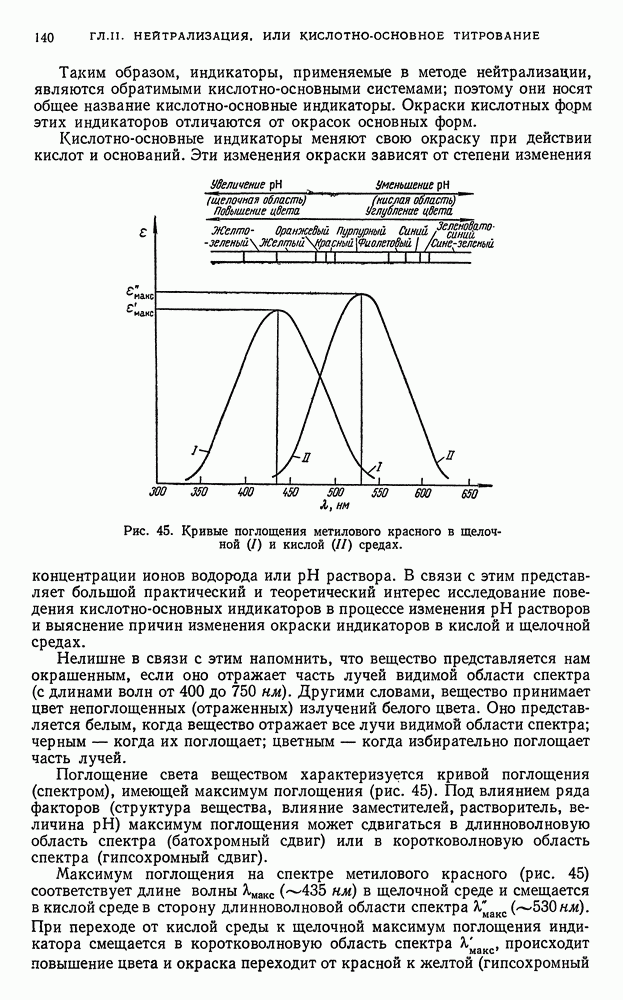
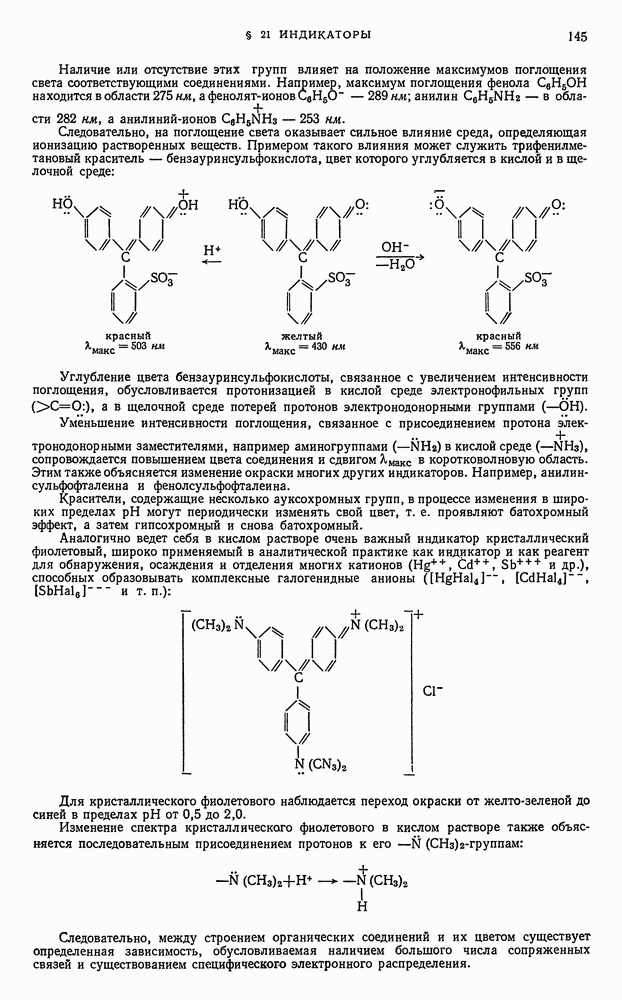
- § 21. Индикаторы
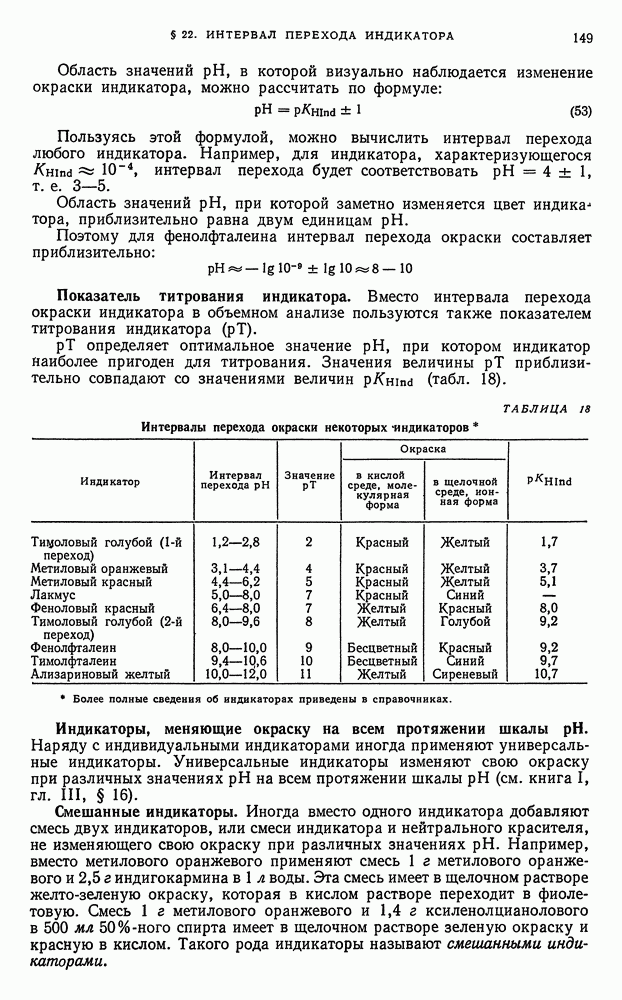
- § 22. Интервал перехода индикатора
- § 23. Выбор индикатора
- § 24. Ошибки титрования
- Б. ПРАКТИЧЕСКАЯ ЧАСТЬ
- § 25. Организация рабочего места
- § 26. Приготовление стандартных (титрованных) растворов
- § 27. Приготовление 0,1 н. раствора хлористоводородной кислоты
- § 28. Установка титра 0,1 н. раствора хлористоводородной кислоты
- § 29. Приготовление 0,1 н. раствора едкого натра
- § 30. Установка титра 0,1 н. раствора едкого натра
- § 31. Определение карбонатов
- § 32. Определение содержания H2SO4 в технической серной кислоте
- § 33. Определение содержания уксусной кислоты
- § 34. Определение содержания Na2CO3 и NaOH при их совместном присутствии
- § 35. Определение содержания Na2CO3 и NaHCO3 при их совместном присутствии
- § 36. Определение жесткости воды
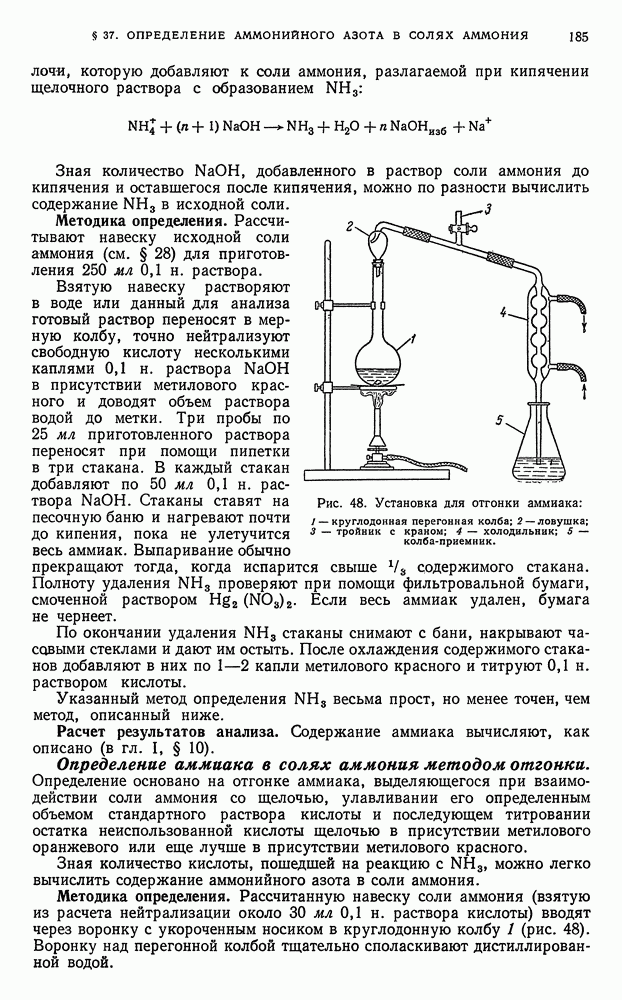
- § 37. Определение аммонийного азота в солях аммония
- § 38. Определение содержания фосфорной кислоты
- В. КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ В НЕВОДНЫХ СРЕДАХ
- § 39. Неводные растворы
- § 40. Современные представления о кислотах и основаниях
- § 41. Диссоциация электролитов в неводных растворах
- § 42. Влияние неводных растворителей на силу кислот и оснований
- § 43. Применение закона действия масс к растворам сильных электролитов
- § 44. Титрование кислот и оснований в неводных растворах
- § 45. Методы кислотно-основного титрования в неводных средах
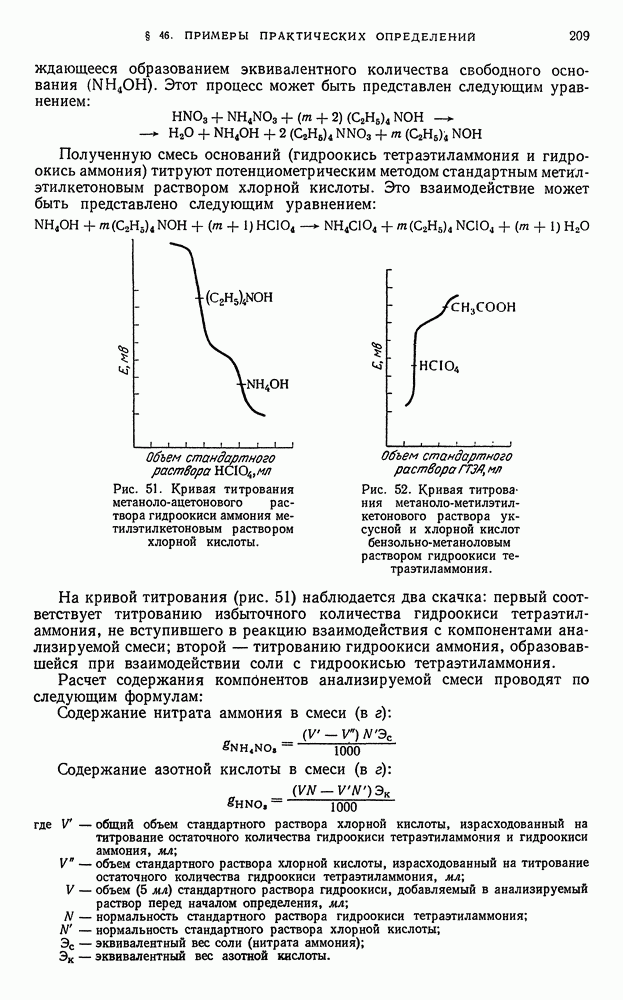
- § 46. Примеры практических определений в неводных растворах
- ГЛАВА III. МЕТОДЫ ОКИСЛЕНИЯ—ВОССТАНОВЛЕНИЯ (ОКСИДИМЕТРИЯ, ОКСРЕДМЕТРИЯ, РЕД-ОКС-МЕТОДЫ)
- § 1. Значение окислительно-восстановительных потенциалов
- § 2. Реакции окисления—восстановления и комплексообразования
- § 3. Примеры окислительно-восстановительного титрования
- § 4. Константы равновесия окислительно-восстановительных реакций
- § 5. Связь между константами равновесия окислительно-восстановительных реакций и нормальными потенциалами
- § 6. Вычисление констант равновесия окислительно-восстановительных реакций
- § 8. Зависимость скорости реакций окисления—восстановления от различных факторов
- § 9. Графический метод изображения процесса окисления—восстановления
- § 10. Фиксирование точки эквивалентности в методах окисления—восстановления
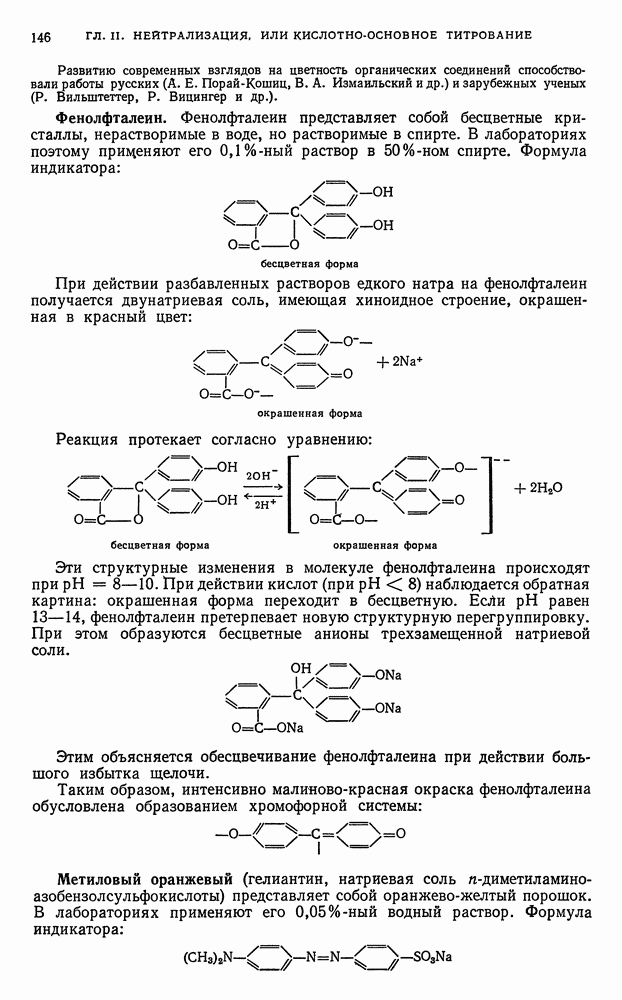
- § 11. Окислительно-восстановительные индикаторы (ред-окс-индикаторы)
- Б. ПЕРМАНГАНАТОМЕТРИЯ
- § 12. Основы перманганатометрии
- § 13. Титрование перманганатом в кислой среде
- § 14. Титрование перманганатом в щелочной среде
- § 15. Приготовление стандартного (титрованного) раствора перманганата калия
- § 16. Установка титра стандартного раствора перманганата калия
- § 17. Установка титра и нормальности раствора перманганата калия по оксалату аммония
- § 18. Вещества, определяемые методом перманганатометрии
- ОПРЕДЕЛЕНИЕ ВОССТАНОВИТЕЛЕЙ
- § 19. Определение щавелевой кислоты и оксалатов
- § 20. Определение соединений железа (II)
- § 21. Определение содержания металлического железа в присутствии окислов железа
- § 22. Определение азотистой кислоты и нитритов
- § 23. Определение содержания марганца (II) в рудах
- ОПРЕДЕЛЕНИЕ ОКИСЛИТЕЛЕЙ
- § 24. Определение соединений железа (III)
- § 25. Определение нитратов
- § 26. Определение бихроматов
- § 27. Определение содержания MnO2 в пиролюзите
- ОПРЕДЕЛЕНИЕ ДРУГИХ ВЕЩЕСТВ
- § 28. Определение ионов кальция
- В. ИОДОМЕТРИЯ
- § 29. Основы иодометрии
- § 30. Методы иодометрического титрования
- § 31. Преимущества и недостатки иодометрического метода
- § 32. Приготовление стандартного (титрованного) раствора тиосульфата и установка его титра
- § 33. Приготовление стандартного (титрованного) раствора иода и установка его титра
- МЕТОДЫ ПРЯМОГО ТИТРОВАНИЯ
- § 34. Определение мышьяка (III)
- МЕТОДЫ ОБРАТНОГО ТИТРОВАНИЯ
- § 35. Определение сульфита натрия
- § 36. Определение содержания формальдегида в формалине
- МЕТОДЫ КОСВЕННОГО ОПРЕДЕЛЕНИЯ
- § 37. Определение ионов меди (II)
- § 38. Определение двуокиси свинца в сурике
- МЕТОД ТИТРОВАНИЯ ЗАМЕСТИТЕЛЕЙ
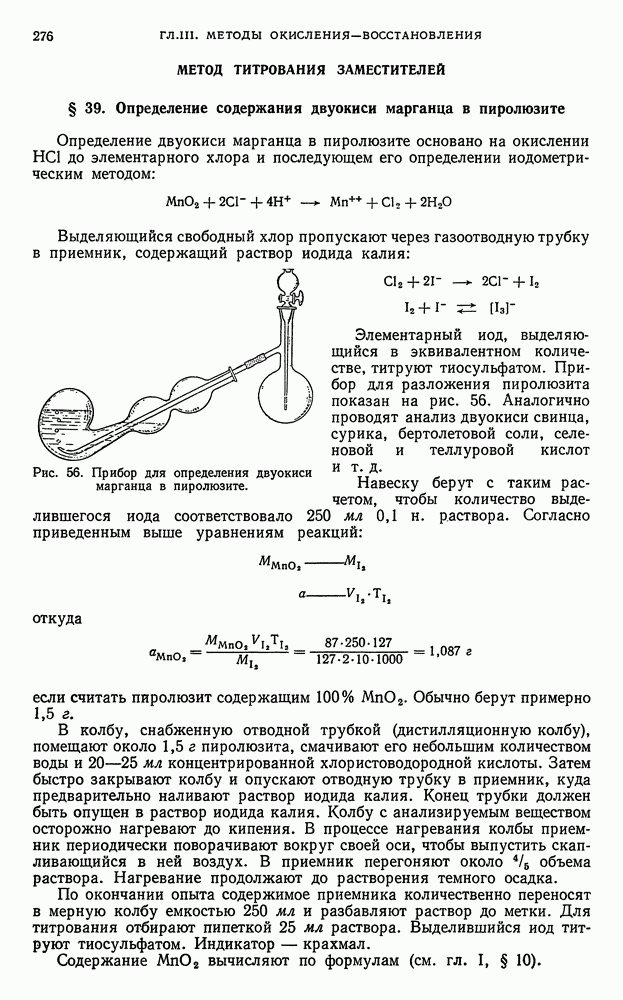
- § 39. Определение содержания двуокиси марганца в пиролюзите
- МЕТОД ОПРЕДЕЛЕНИЯ КИСЛОТ
- § 40. Определение хлористоводородной кислоты
- § 41. Определение воды по Фишеру
- Г. ПОНЯТИЕ О ДРУГИХ МЕТОДАХ ОКИСЛЕНИЯ — ВОССТАНОВЛЕНИЯ
- § 42. Хроматометрия
- § 43. Определение содержания железа (II)
- § 44. Цериметрия
- § 45. Броматометрия
- § 46. Ванадатометрия
- § 47. Аскорбинометрия
- § 48. Титанометрия
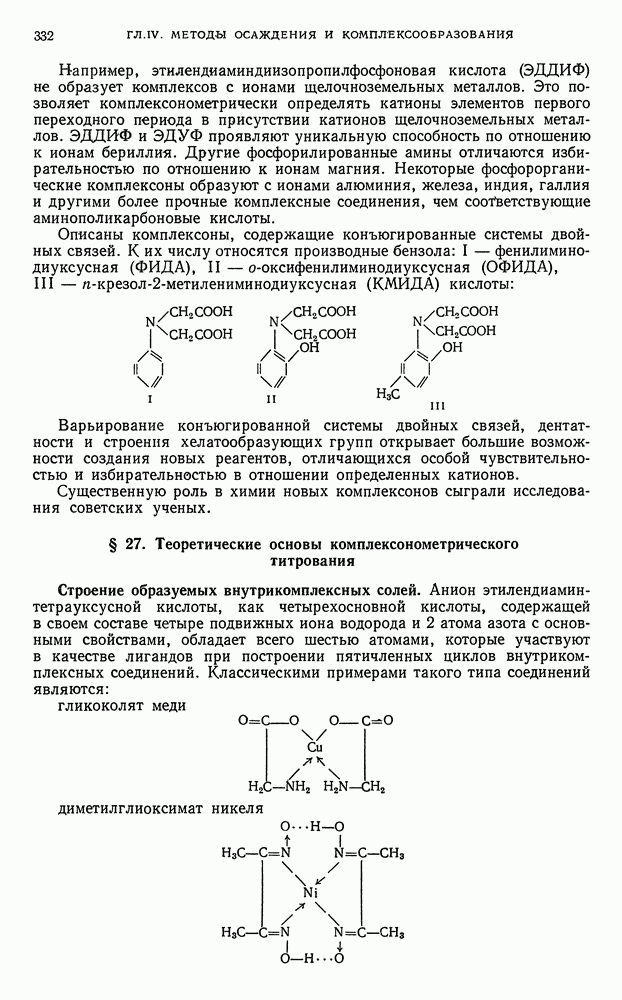
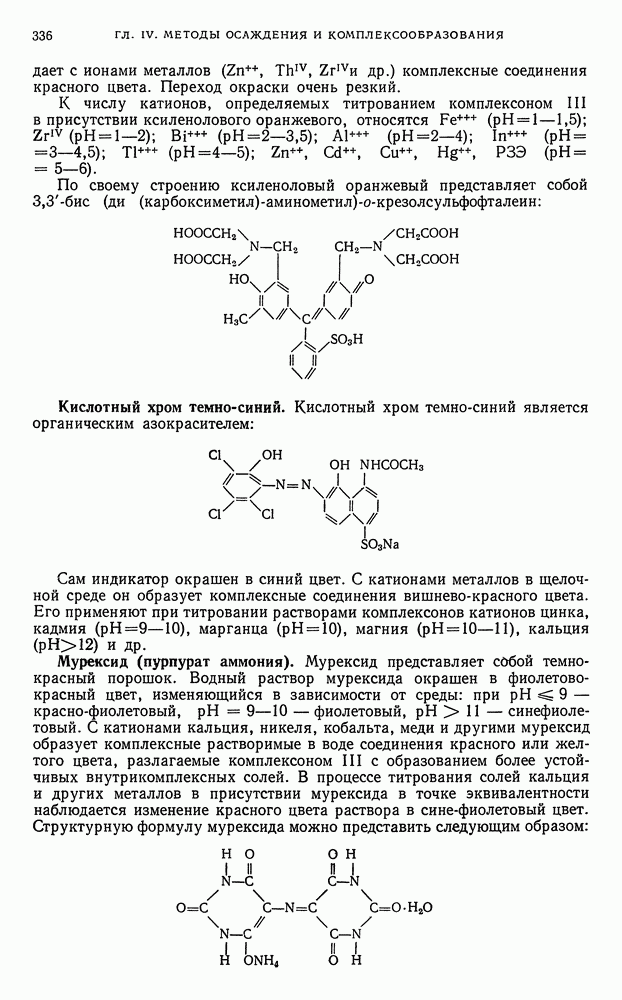
- ГЛАВА IV. МЕТОДЫ ОСАЖДЕНИЯ И КОМПЛЕКСООБРАЗОВАНИЯ
- § 1. Общая характеристика методов
- § 2. Классификация методов осаждения и комплексообразования
- § 3. Применение теории осаждения к объемному анализу
- § 4. Вычисление растворимости электролитов в воде с учетом коэффициентов активности
- § 5. Влияние одноименных ионов на растворимость малорастворимого электролита
- § 6. Солевой эффект
- § 7. Влияние концентрации ионов водорода на растворимость малорастворимых соединений
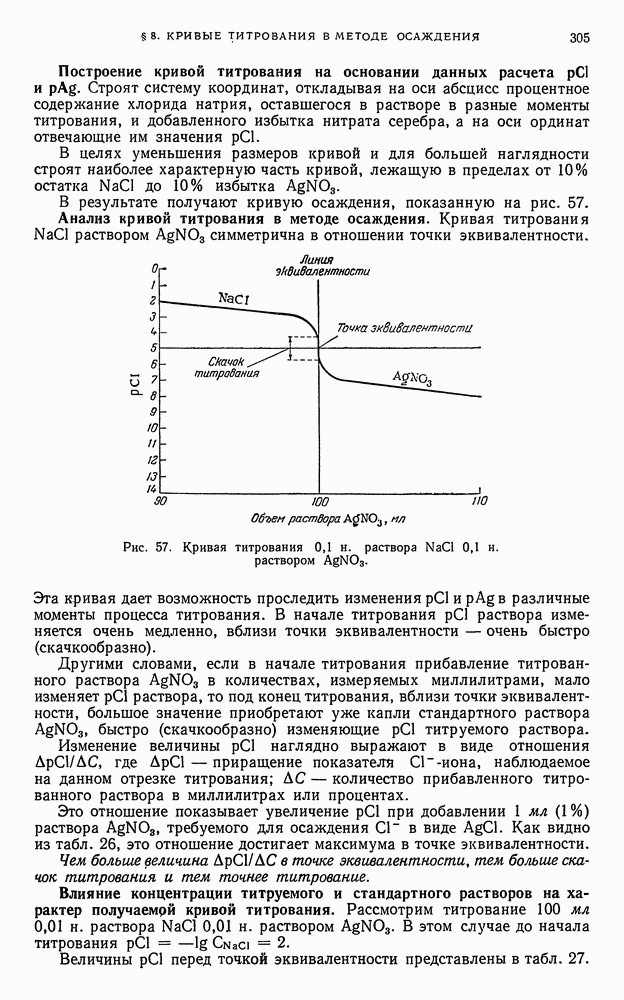
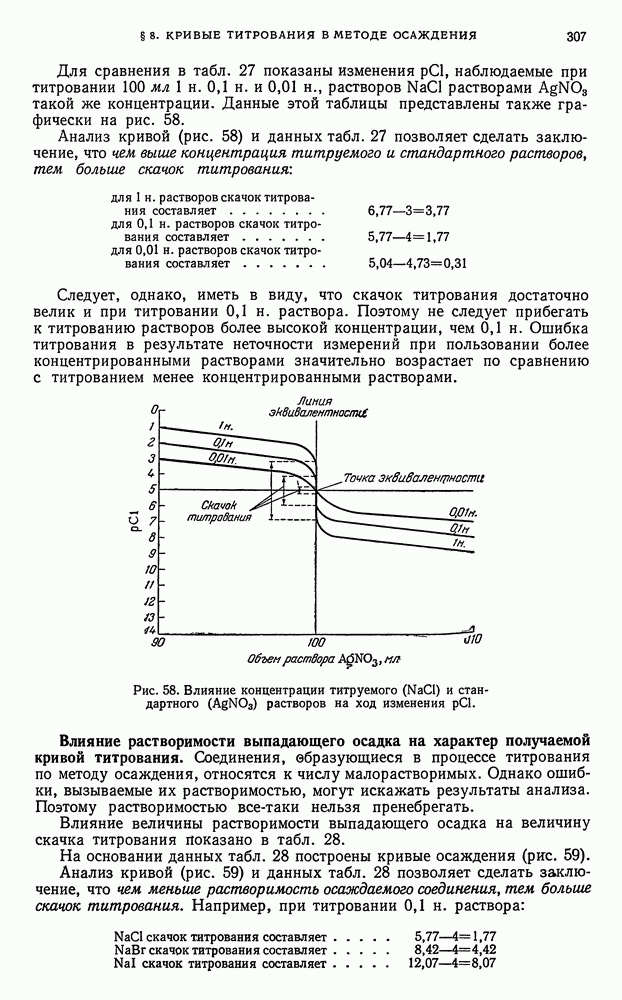
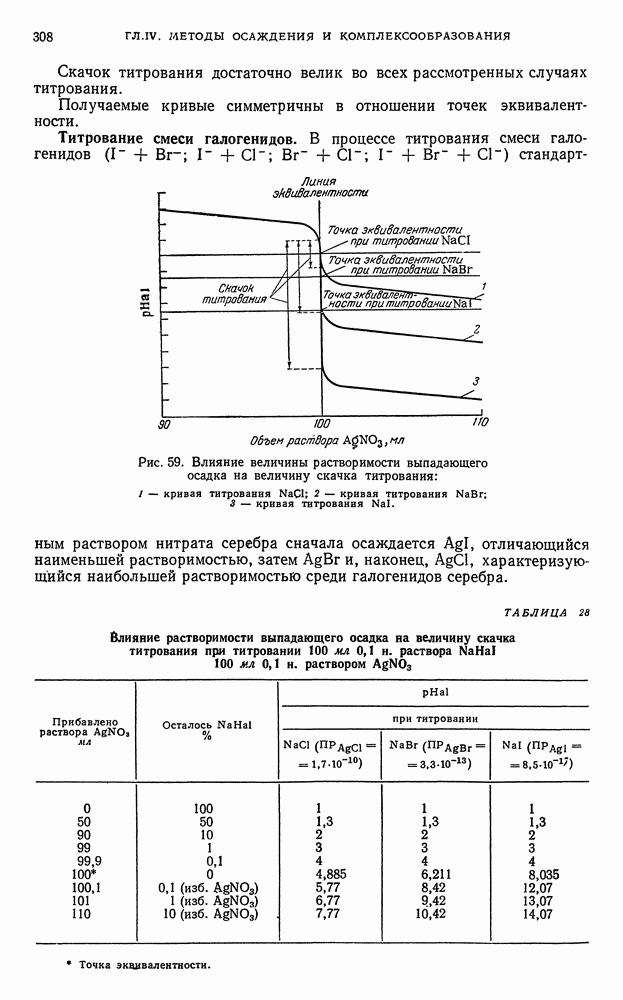
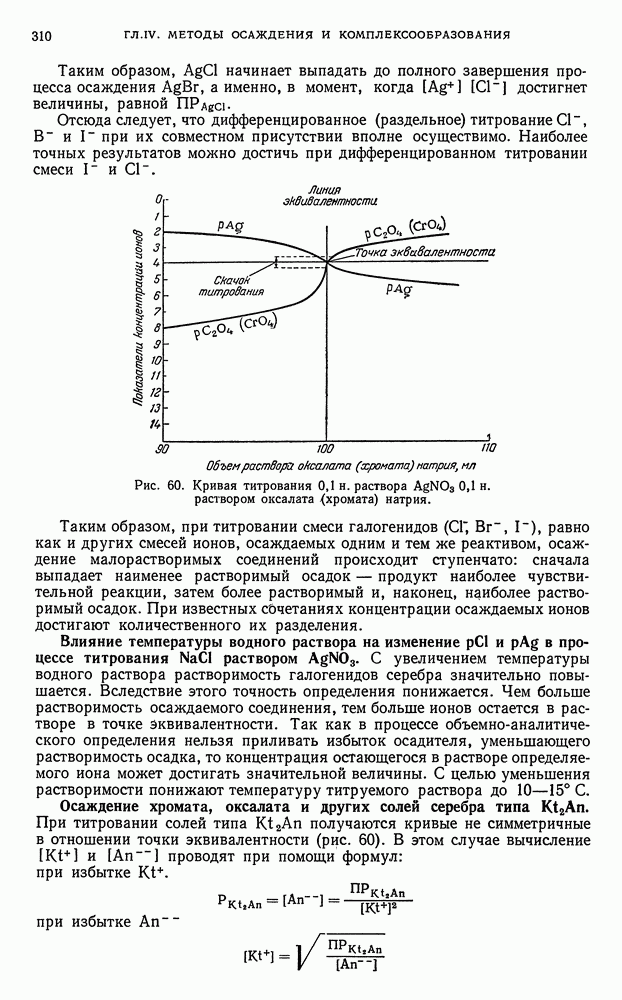
- § 8. Кривые титрования в методе осаждения
- § 9. Общие выводы, вытекающие из рассмотрения кривых осаждения
- § 10. Адсорбционные явления, наблюдаемые при титровании по методу осаждения
- Б. АРГЕНТОМЕТРИЯ
- § 11. Характеристика метода
- § 12. Приготовление 0,1 н. раствора нитрата серебра
- § 13. Приготовление стандартного раствора хлорида натрия
- § 14. Установка титра 0,1 н. раствора нитрата серебра по точной навеске хлорида натрия
- §15. Определение ионов хлора в техническом хлориде натрия по методу Мора
- § 16. Определение хлоридов по методу Фаянса
- В. РОДАНОМЕТРИЯ
- § 17. Характеристика метода
- § 18. Приготовление 0,1 н. раствора роданида аммония
- § 19. Определение ионов хлора в растворимых хлоридах по методу Фольгарда
- § 20. Определение серебра в сплавах
- Г. МЕРКУРИМЕТРИЯ
- § 21. Характеристика метода
- § 22. Приготовление 0,1 н. раствора нитрата ртути (II)
- § 23. Установка титра раствора нитрата ртути (II)
- § 24. Определение ионов хлора в воде меркуриметрическим методом
- Д. МЕРКУРОМЕТРИЯ
- § 25. Краткая характеристика метода
- Е. КОМПЛЕКСОНОМЕТРИЯ (ХЕЛАТОМЕТРИЯ)
- § 26. Характеристика метода
- § 27. Теоретические основы комплексонометрического титрования
- § 28. Классификация методов комплексонометрического титрования
- § 29. Установка титра раствора комплексона III
- § 30. Определение содержания кальция
- § 31. Определение жесткости воды комплексонометрическим методом
- § 32. Анализ смеси ионов кальция и магния
- § 33. Определение содержания алюминия
- § 34. Раздельное определение ионов кальция и алюминия
- § 35. Раздельное определение ионов алюминия и железа
- Часть вторая. Весовой анализ
- § 1. Сущность весового анализа
- § 2. Классификация методов весового анализа
- § 3. Расчеты в весовом анализе
- Б. ТЕХНИКА ВЕСОВОГО АНАЛИЗА
- § 4. Взятие и растворение навески
- § 5. Техника осаждения
- § 6. Фильтрование и промывание осадков
- § 7. Получение весовой формы
- § 8. Взвешивание весовой формы
- В. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
- § 9. Теоретические основы выделения осадков из растворов с помощью специфических неорганических и органических реактивов
- § 10. Требования, предъявляемые к осадкам
- § 11. Методы повышения точности весовых определений
- § 12. Теоретические обоснования выбора оптимальных условий для весового определения
- Г. ПРАКТИЧЕСКАЯ ЧАСТЬ
- § 13. Определение кристаллизационной воды в BaCl2 2H2O
- § 14. Определение сульфат-ионов или серы
- § 15. Определение ионов железа (III)
- § 16. Определение содержания кальция в карбонате кальция
- § 17. Определение содержания магния
- § 18. Определение ионов хлора в растворимых хлоридах или в хлористоводородной кислоте
- § 19. Анализ силикатов
- § 20. Анализ доломита
- § 21. Анализ бронзы и латуни
- Д. МЕТОДЫ ВЕСОВЫХ ОПРЕДЕЛЕНИЙ, ОСНОВАННЫЕ НА ПРИМЕНЕНИИ ОРГАНИЧЕСКИХ РЕАКТИВОВ
- § 22. Определение никеля
- § 23. Определение алюминия
- Часть третья. Понятие о физических и физико-химических (инструментальных) методах анализа
- § 1. Электрохимические методы
- § 2. Спектральные (оптические) методы
- § 3. Хроматографические методы
- § 4. Радиометрические методы
- § 5. Масс-спектрометрические методы
- ГЛАВА VII ЭЛЕКТРОВЕСОВЫЕ МЕТОДЫ АНАЛИЗА
- § 1. Характеристика методов электроанализа
- § 2. Химические процессы, протекающие при электролизе
- § 3. Методы электроанализа
- § 4. Электровесовой анализ
- § 5. Метод внутреннего электролиза
- § 6. Определение меди в растворе сульфата меди с применением платиновых сетчатых электродов
- § 7. Определение меди и свинца в латуни с применением платиновых сетчатых электродов
- § 8. Определение малых количеств меди методом внутреннего электролиза
- ГЛАВА VIII. ОБЪЕМНЫЕ ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
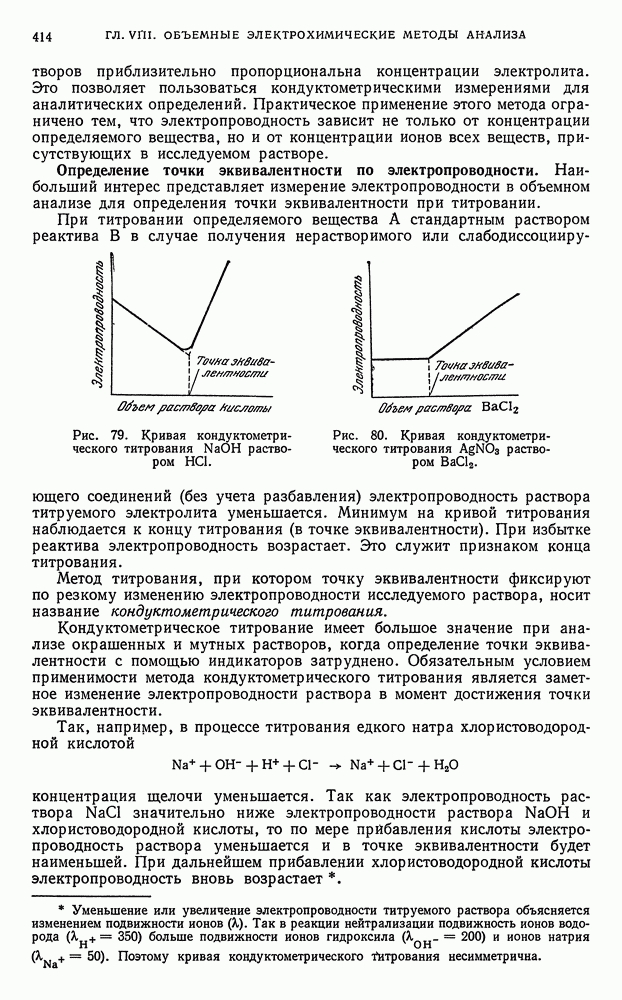
- § 1. Особенности объемных электрохимических методов анализа
- § 2. Кондуктометрическое титрование
- § 3. Высокочастотное титрование
- § 4. Потенциометрическое титрование
- § 5. Полярографический метод анализа
- § 6. Амперометрическоб титрование
- § 7. Кулонометрическое титрование
- ГЛАВА IX. СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА
- § 1. Понятие об эмиссионном спектральном анализе
- Б. КОЛОРИМЕТРИЯ
- § 2. Особенности колориметрических методов анализа
- § 3. Характеристика колориметрических методов анализа
- В. ОПТИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ ТОЧКИ ЭКВИВАЛЕНТНОСТИ
- § 4. Спектрофотометрическое титрование
- § 5. Фототурбидиметрическое и фотонефелометрическое титрование
- Г. ЛАБОРАТОРНЫЕ РАБОТЫ
- § 6. Определение содержания ионов железа методом колориметрического титрования
- § 7. Определение содержания титана
- ГЛАВА X. МЕТОДЫ РАЗДЕЛЕНИЯ, ВЫДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ ОТДЕЛЬНЫХ КОМПОНЕНТОВ АНАЛИЗИРУЕМЫХ СМЕСЕЙ
- § 1. Определение следов элементов (микропримесей)
- § 2. Метод осаждения малорастворимых соединений
- § 3. Электрохимические методы разделения
- § 4. Метод экстрагирования
- § 5. Методы отгонки летучих соединений
- § 6. Хроматографические методы разделения
- § 7. Метод флотации