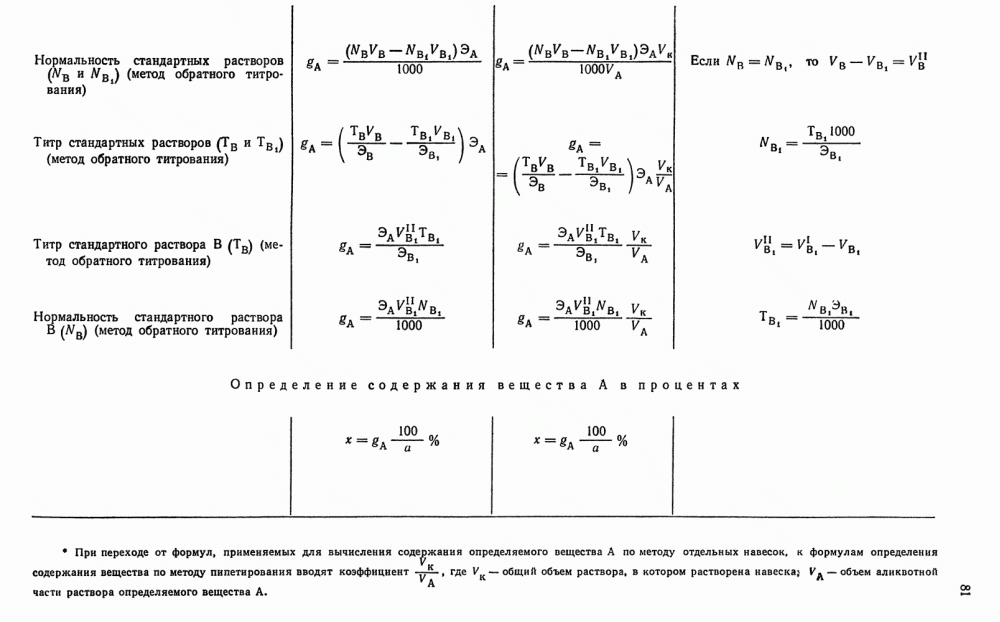
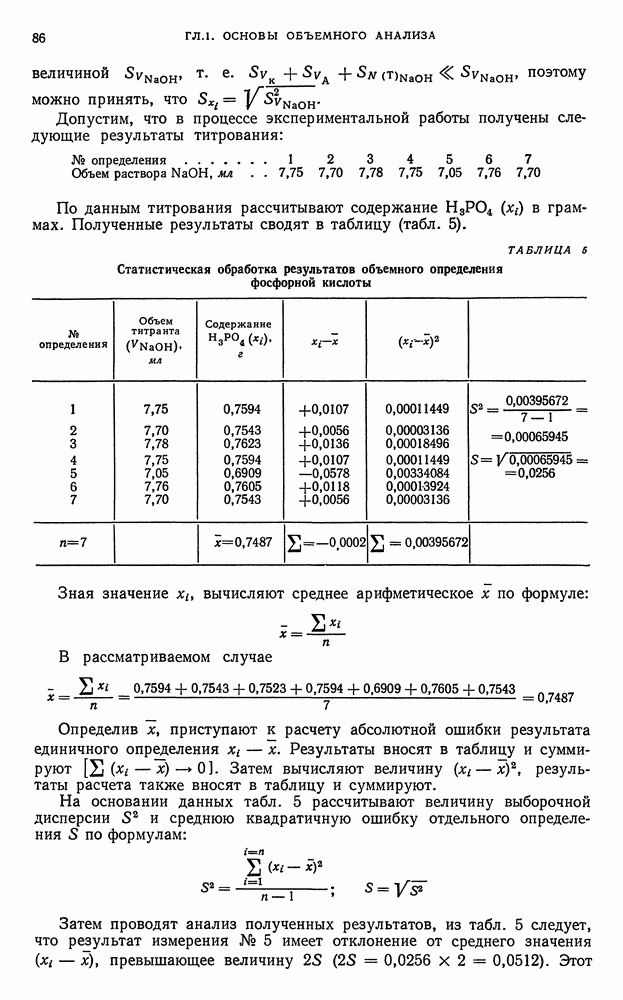
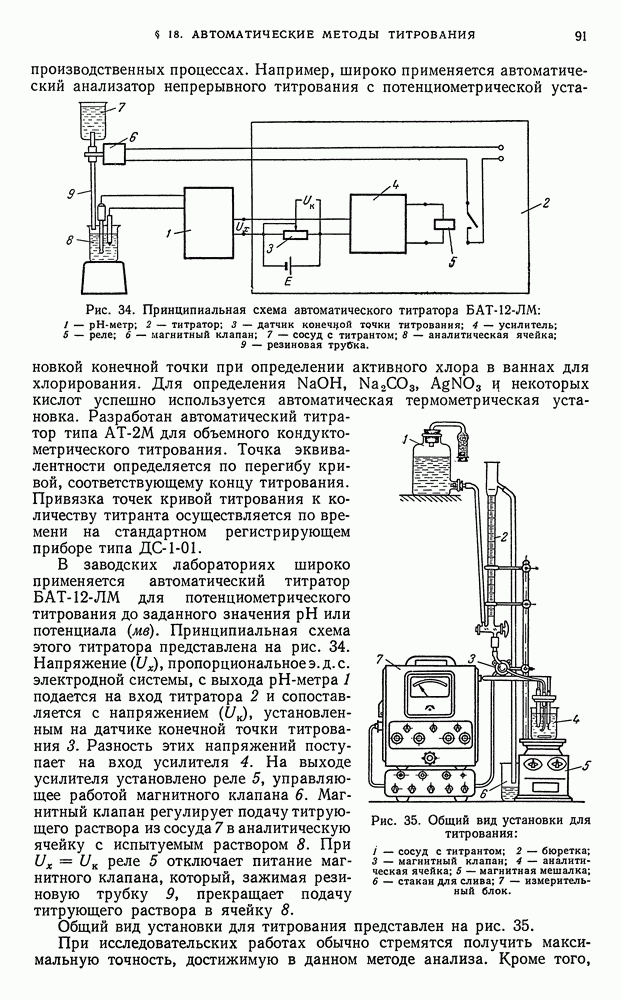
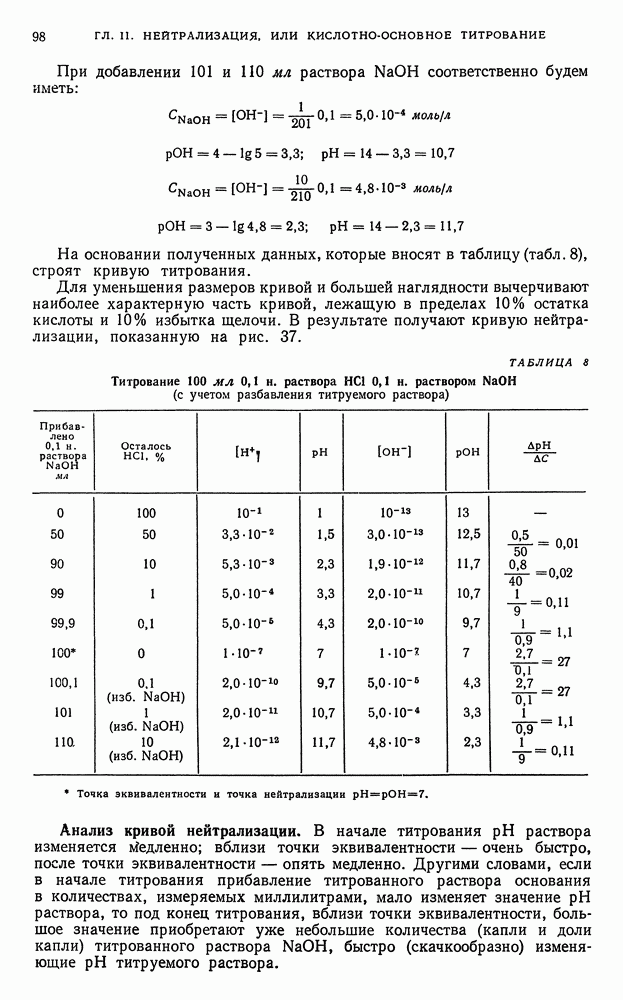
| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
§ 3. Электрохимические методы разделения
Электрохимические методы разделения основаны на выделении на инертном электроде определяемого вещества в элементарном состоянии или в виде нерастворимого осадка, выпадающего при пропускании через анализируемый раствор постоянного электрического тока.
Теория и практика электрохимических методов разделения подробно изложены в гл. VI.
В настоящее время электрохимические методы применяются для разделения соединений большинства химических элементов и оказались очень удобными вследствие того, что они не требуют введения в анализируемый раствор посторонних веществ. Используя различные способы электрохимического осаждения с применением платиновых или других электродов и ртутного катода, а также внутреннего электролиза (см. гл. VI, § 5), можно разделять катионы алюминия, титана, циркония, ванадия, урана от катионов хрома, железа, кобальта, никеля, цинка, меди, серебра, кадмия, германия, молибдена, олова, висмута и других элементов. Можно также отделять примеси от основных компонентов при анализе цветных металлов, их сплавов и руд.
Разделение сложной смеси, состоящей из различных электролитически осаждаемых ионов, достигают либо подбором соответствующего электролита, либо проведением электролиза с автоматическим контролем электродного потенциала, при котором ведется электроосаждение.
Осаждение на ртутном, катоде. Особым видой! электролитического разделения является осаждение на ртутном катоде. При этом металлы под действием электрического тока выделяются на ртути с образованием амальгам. Вследствие этого выделение и разделение многих металлов происходит быстро и количественно. Некоторые металлы (например,  ), не выделяющиеся на твердом катоде, количественно выделяются при электролизе на ртутном катоде. Однако ряд металлов (например,
), не выделяющиеся на твердом катоде, количественно выделяются при электролизе на ртутном катоде. Однако ряд металлов (например,  ) не осаждается на ртутном катоде.
) не осаждается на ртутном катоде.
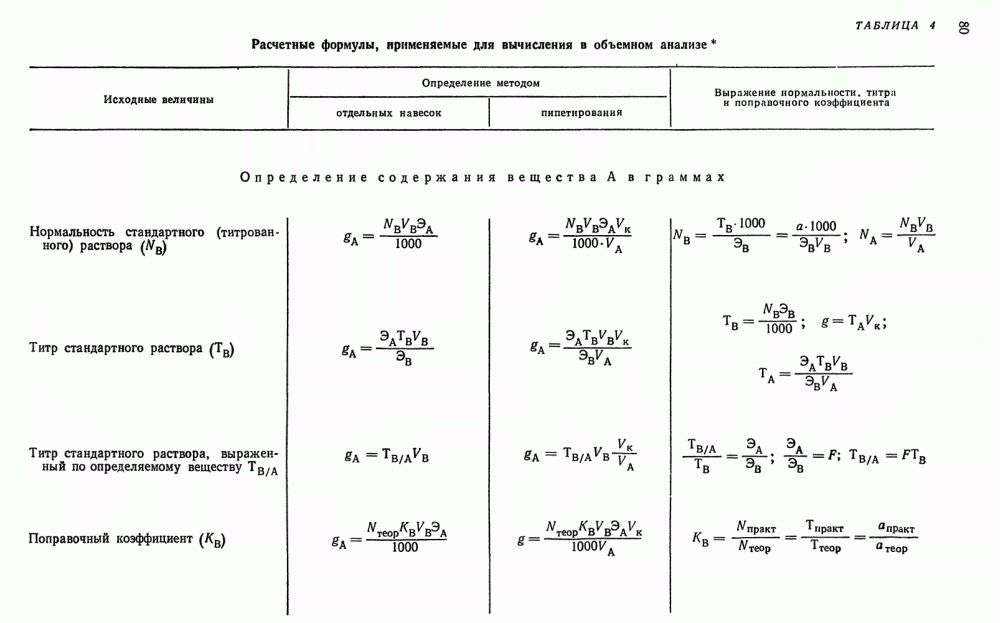
Электролиз с ртутным катодом проводят в специальных приборах (рис. 95). Для этого в сосуд, в котором проводят электролиз, вносят около 200 г металлической ртути, наливают анализируемый раствор и ведут электролиз при плотности тока около  . Анод укрепляют у поверхности раствора. В процессе электролиза ртуть перемешивают. По окончании электролиза проба раствора должна давать отрицательную реакцию на отделяемые элементы.
. Анод укрепляют у поверхности раствора. В процессе электролиза ртуть перемешивают. По окончании электролиза проба раствора должна давать отрицательную реакцию на отделяемые элементы.
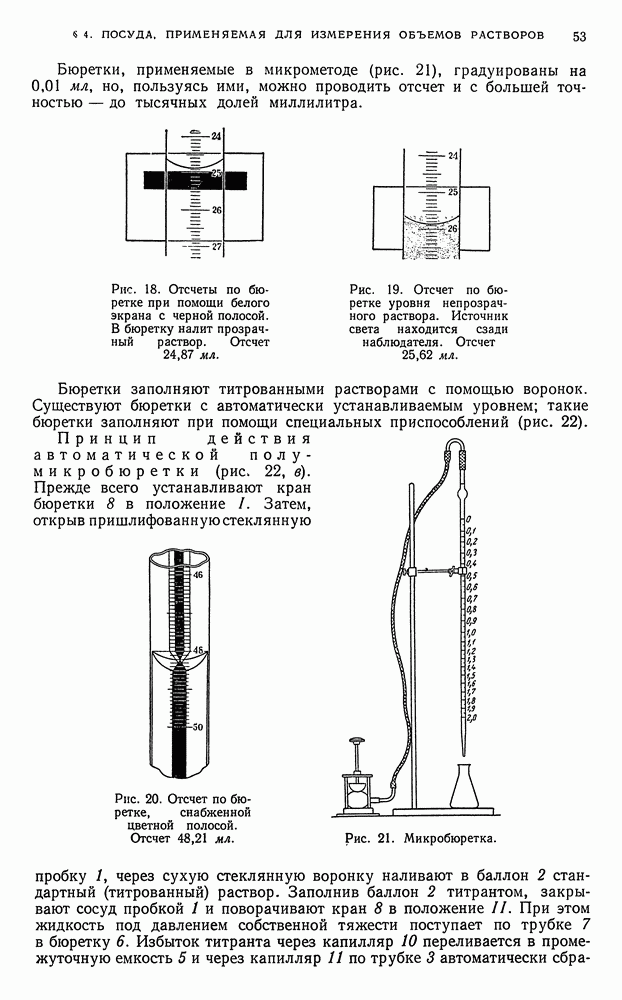
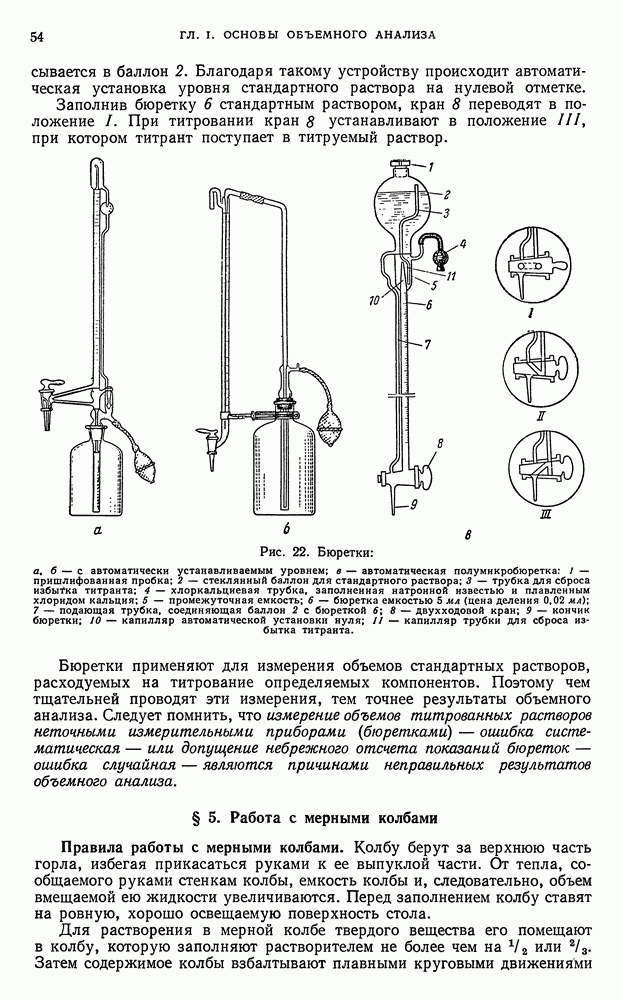
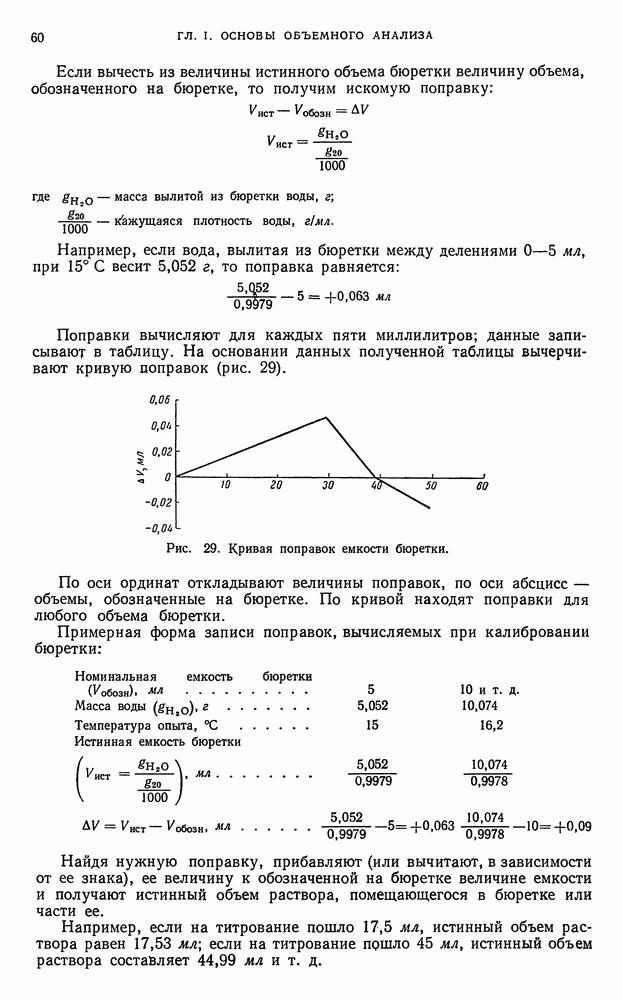
Не прерывая тока, раствор сливают со ртути и ртуть промывают водой. Промывные воды присоединяют к основному раствору. Полученный раствор, свободный от элементов, выделенных на ртутном катоде подвергают анализу. Если нужно извлечь из ртути осажденные в ней металлы, амальгаму растворяют в кислотах или отгоняют ртуть.
При помощи ртутного катода можно отделить:
а) алюминий от железа, цинка, меди;
б) титан от индия, рения, молибдена, германия;
в) ванадий от молибдена;
г) соединения фосфора и мышьяка от всех выделяемых на ртутном катоде элементов (железа, цинка, кобальта, никеля, хрома, серебра, меди, кадмия, ртути, олова, платины, золота и др.).
Так, например, метод количественного определения алюминия в присутствии ионов железа и других элементов, основанный на выделении железа электролизом на ртутном катоде, состоит в следующем. Сначала выделяют железо из сернокислого раствора на ртутном катоде; вместе с железом выделяются другие элементы: цинк, хром, никель, кобальт и т. д. В растворе остаются ионы алюминия, бериллия, титана, фосфора и т. п. Затем определяют обычным путем ионы алюминия, которые осаждают из фильтрата оксихинолином или купфероном в аммиачном или слабоуксуснокислом растворе. Титан осаждают в кислом растворе купфероном.
Электрохимические методы могут быть использованы не только для разделения и выделения элементов, но и для концентрирования определяемых веществ.
Такого рода концентрирование (накопление) определяемого элемента на стационарной капле ртути имеет место в методе амальгамной полярографии. Сущность метода заключается в том, что путем электролиза в течение некоторого времени при потенциале предельного тока определяемого металла проводится его концентрирование в виде амальгамы из разбавленного раствора на стационарной капле ртути, которая выполняет роль ртутного микроэлектрода. Затем при линейно изменяющемся напряжении регистрируется кривая анодного растворения амальгамы. При этом на полярограмме получаются анодные пики, положение которых по потенциалу характеризует природу вещества, а высота пика — концентрацию примеси.
Метод предложен Баркером и исследовался Шейном, Кемуля, А. Г. Стромбергом, Е. Н. Виноградовой, Л. Н. Васильевой, С. И. Синяковой и др. Большую теоретическую и практическую ценность для амальгамной полярографии с предварительным концентрированием (накоплением) на стационарной капле ртути представляют работы М. Т. Козловского в области исследования металлических амальгам.

Рис. 95. Ртутный катод.
Сочетание электрохимического концентрирования определяемых элементов на стационарной капле ртути с последующей анодной поляризацией полученной амальгамы дает возможность на несколько порядков повысить чувствительность метода по сравнению с обычным методом полярографии. Это имеет важное практическое значение для анализа особо чистых металлов, химических реактивов и полупроводниковых материалов.
Существует несколько вариантов концентрирования микропримесей порядка  электрохимическим (полярографическим) методом. Общим принципом их является накопление определяемых элементов путем предварительного электролиза на стационарном электроде.
электрохимическим (полярографическим) методом. Общим принципом их является накопление определяемых элементов путем предварительного электролиза на стационарном электроде.
С целью электрохимического концентрирования разработаны методики амальгамной полярографии для определения  примесей в цинке, алюминии, индии, олове, мышьяке, галлии, в урановых солях, в химически чистых реактивах, в биологических объектах, пищевых продуктах и т. п.
примесей в цинке, алюминии, индии, олове, мышьяке, галлии, в урановых солях, в химически чистых реактивах, в биологических объектах, пищевых продуктах и т. п.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ
- ВВЕДЕНИЕ
- § 1. Понятие о количественном анализе
- § 2. Классификация методов количественного анализа
- § 3. Характеристика методов количественного анализа
- § 4. Анализ больших и малых количеств вещества
- § 5. Отбор средней пробы
- § 6. Подготовка вещества для взвешивания
- § 7. Взвешивание
- § 8. Техника взвешивания на аналитических весах
- § 9. Правила обращения с аналитическими весами
- § 10. Приготовление раствора для анализа
- § 11. Запись результатов анализа
- Часть первая. Объемный анализ
- § 1. Сущность объемного анализа
- § 2. Общее уравнение реакции титрования и выводы из него
- Б. ТЕХНИКА ХИМИЧЕСКОГО ЭКСПЕРИМЕНТА В ОБЪЕМНОМ АНАЛИЗЕ
- § 3. Измерение объемов растворов
- § 4. Посуда, применяемая для измерения объемов растворов
- § 5. Работа с мерными колбами
- § 6. Работа с пипетками
- § 7. Работа с бюретками
- § 8. Приготовление стандартных растворов
- В. ВЫЧИСЛЕНИЯ В ОБЪЕМНОМ АНАЛИЗЕ
- § 9. Концентрация растворов и способы ее выражения
- § 10. Способы вычисления в объемном анализе
- § 11. Связь между точностью измерений и точностью вычислений
- § 12. Краткие сведения о статистической обработке экспериментальных данных
- Г. ПОЛУМИКРООБЪЕМНЫЙ МЕТОД АНАЛИЗА
- § 13. Понятие о полумикрообъемном анализе
- § 14. Особенности техники измерения объемов растворов в полумикрометоде
- Д. БЕЗБЮРЕТОЧНЫЕ МЕТОДЫ ТИТРОВАНИЯ
- § 15. Понятие о безбюреточных методах титрования
- § 16. Классификация методов безбюреточного титрования
- Е. АВТОМАТИЧЕСКИЕ МЕТОДЫ
- § 17. Химико-аналитический контроль производства
- § 18. Автоматические методы титрования
- ГЛАВА II. МЕТОДЫ НЕЙТРАЛИЗАЦИИ, ИЛИ МЕТОДЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
- § 1. Характеристика метода
- § 2. Установление точки эквивалентности
- § 3. Графический метод изображения процесса нейтрализации
- § 4. Вычисление концентрации ионов водорода в водных растворах сильных кислот и оснований
- § 5. Вычисление активности ионов водорода в водных растворах сильных кислот и оснований
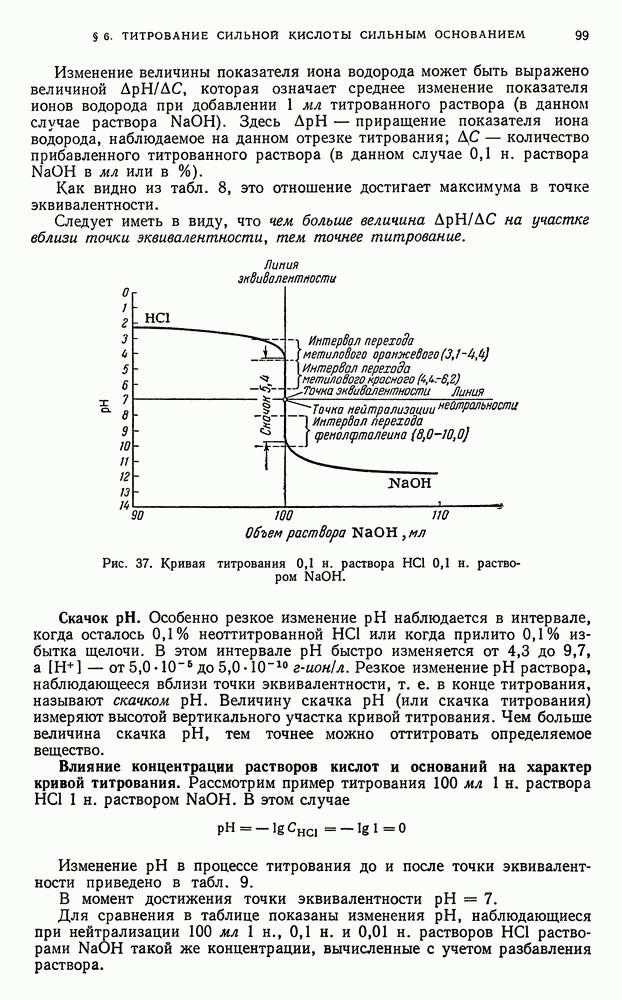
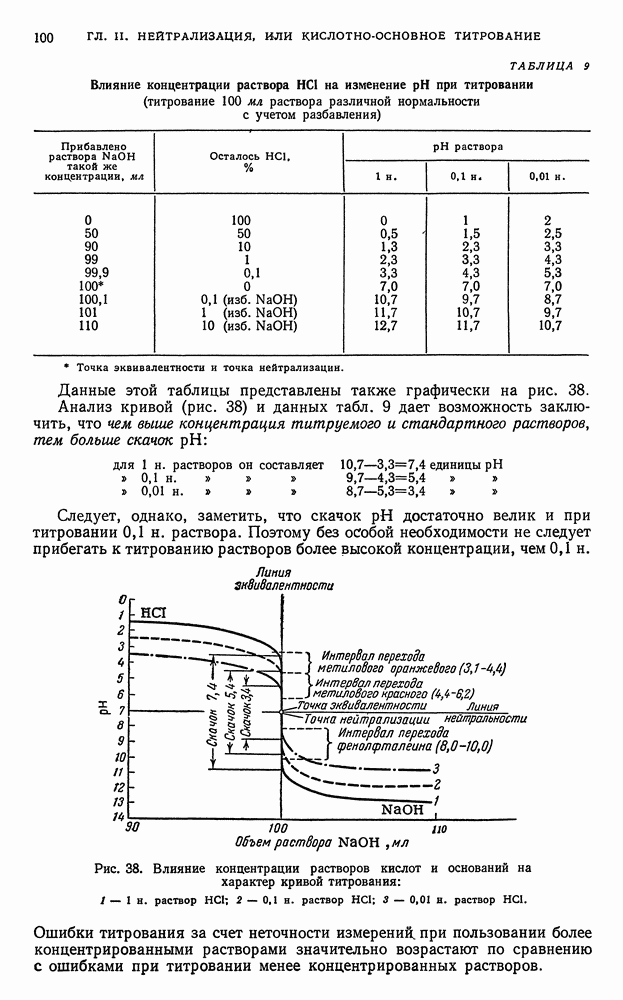
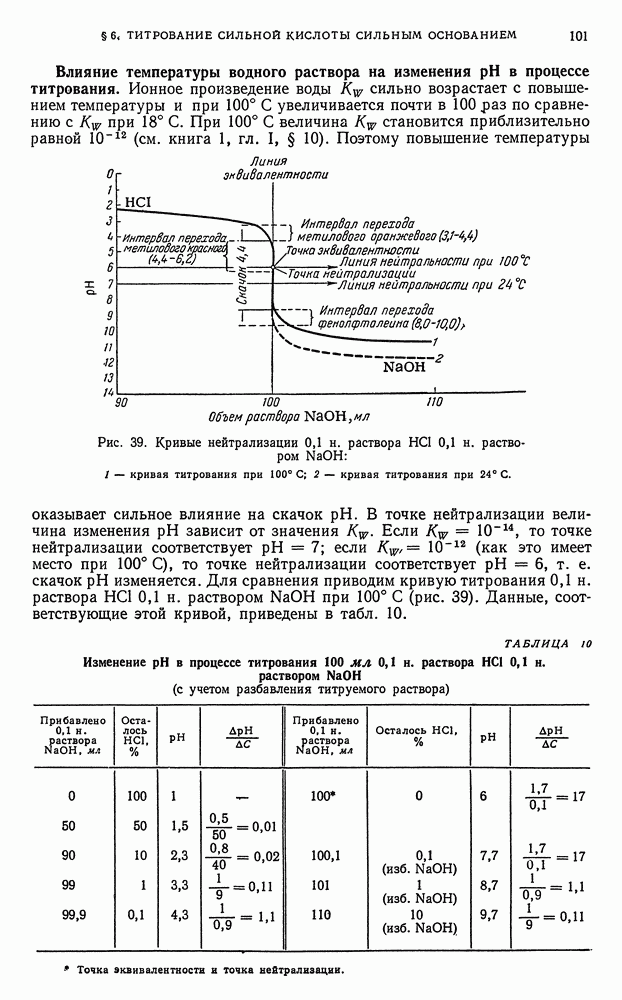
- § 6. Титрование сильной кислоты сильным основанием
- § 7. Вычисление концентрации ионов водорода в растворах слабых кислот и оснований
- § 8. Вычисление активности ионов водорода в водных растворах слабых кислот и оснований
- § 9. Равновесия в водных буферных растворах слабых кислот в присутствии солей этих кислот
- § 10. Равновесия в водных буферных растворах слабых оснований в присутствии солей этих оснований
- § 11. Вычисление концентрации ионов водорода в водных буферных растворах
- § 12. Вычисление активности ионов водорода в водных буферных растворах
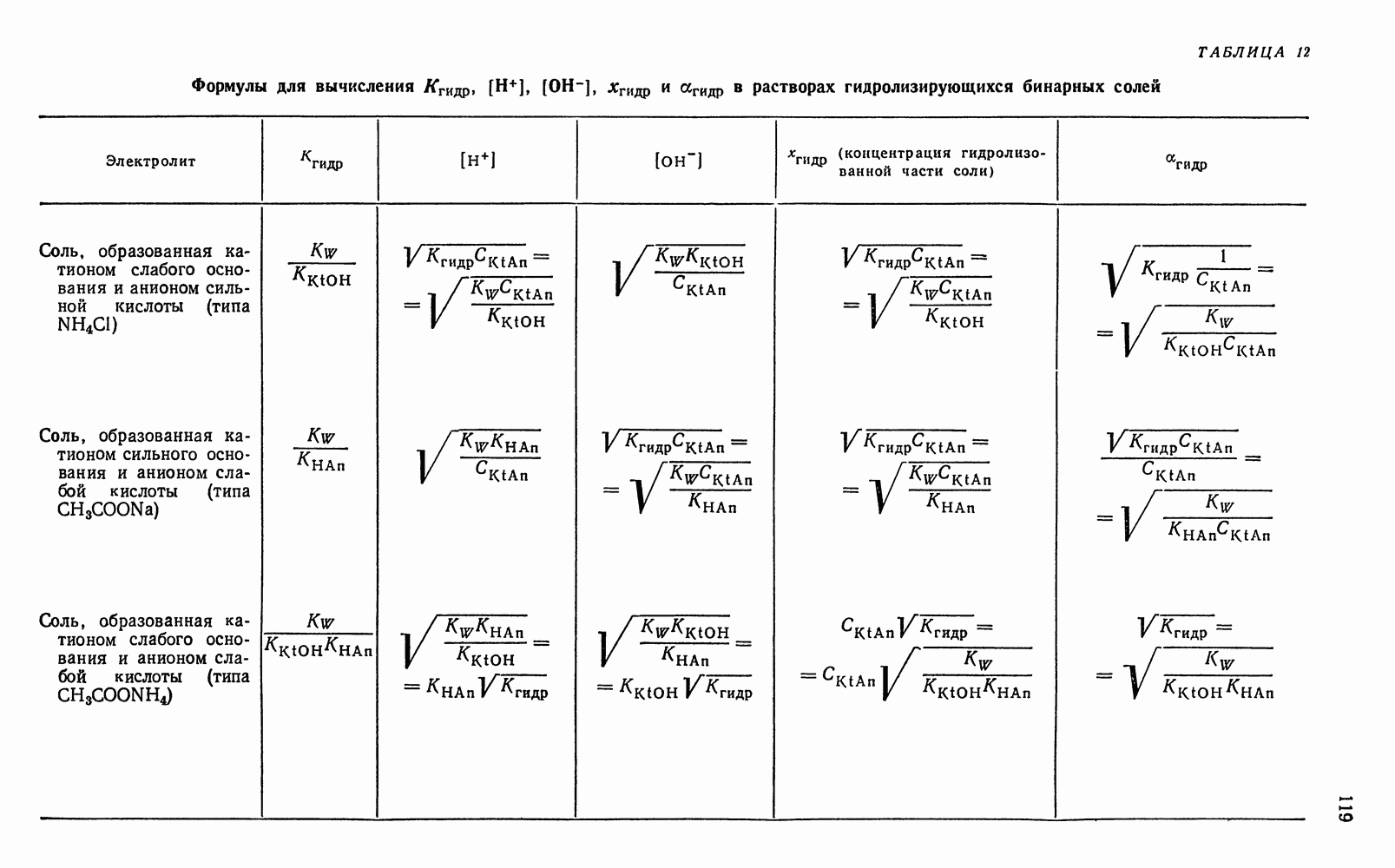
- § 13. Вычисление концентрации ионов водорода и степени гидролиза в водных растворах гидролизующихся бинарных солей
- § 14. Вычисление активности ионов водорода в водных растворах гидролизующихся бинарных солей
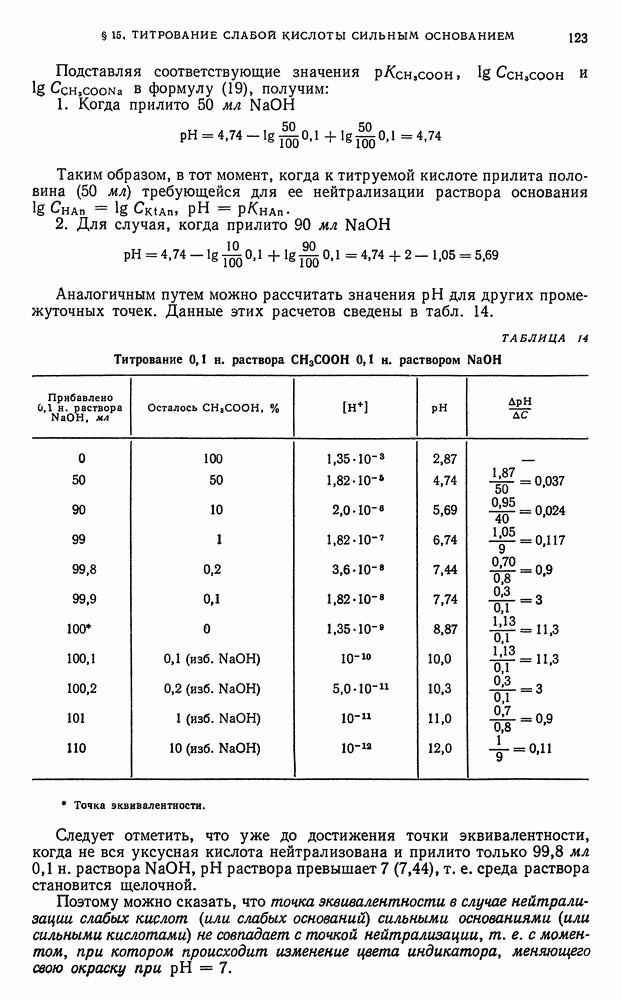
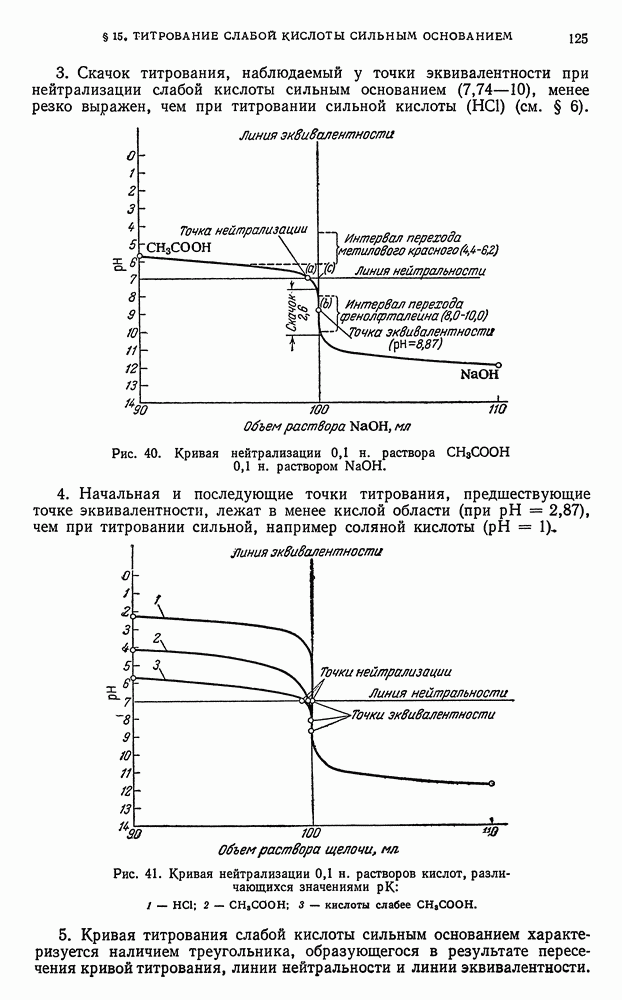
- § 15. Титрование слабой кислоты сильным основанием
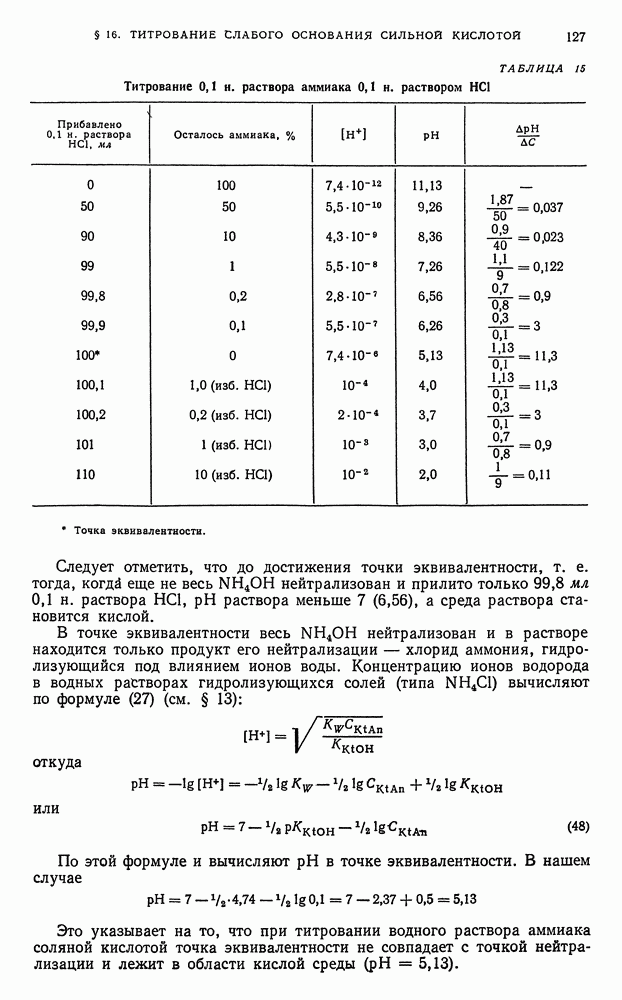
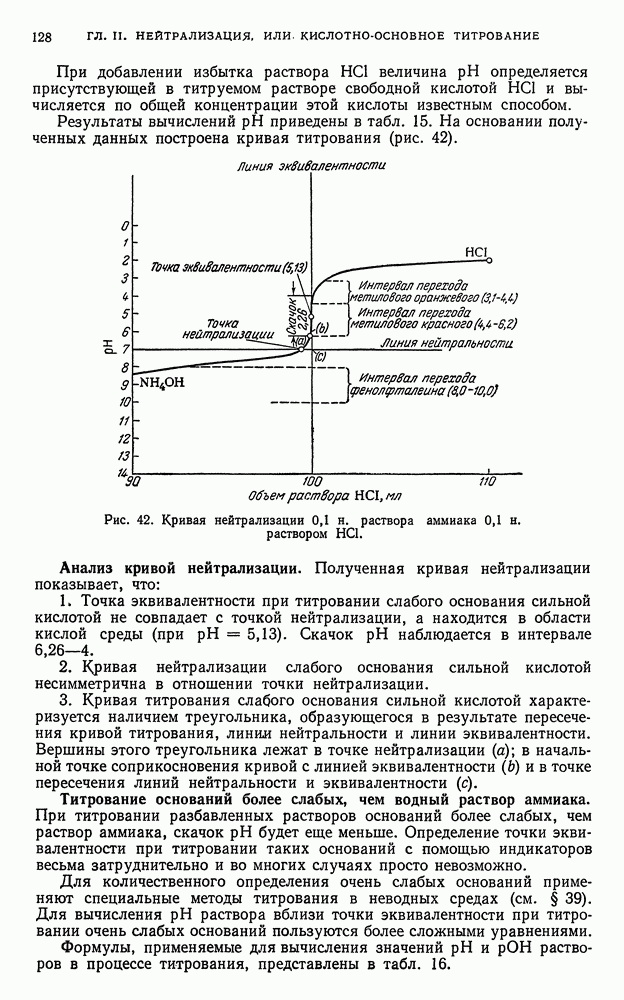
- § 16. Титрование слабого основания сильной кислотой
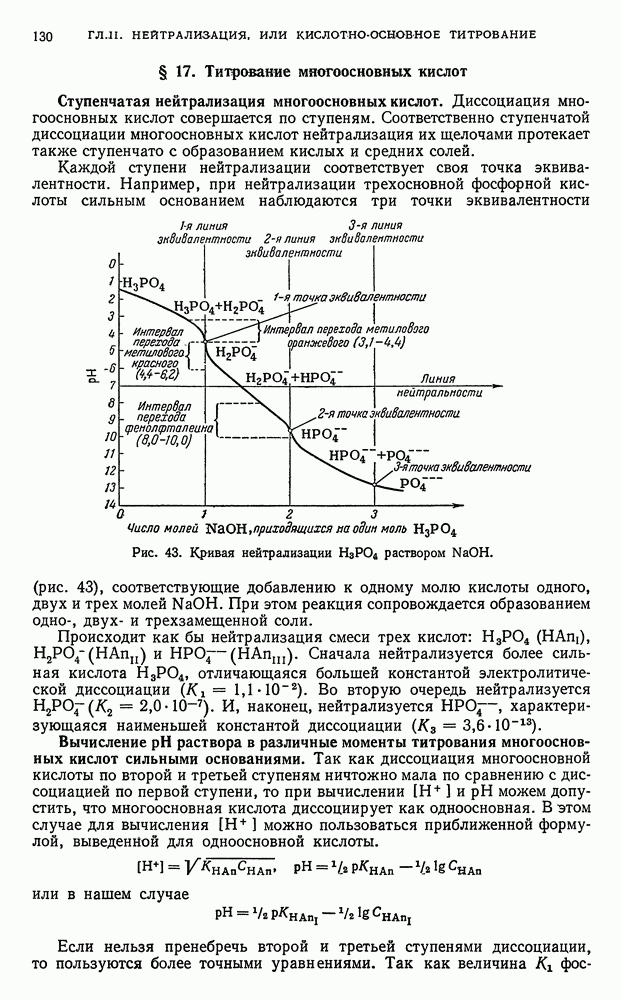
- § 17. Титрование многоосновных кислот
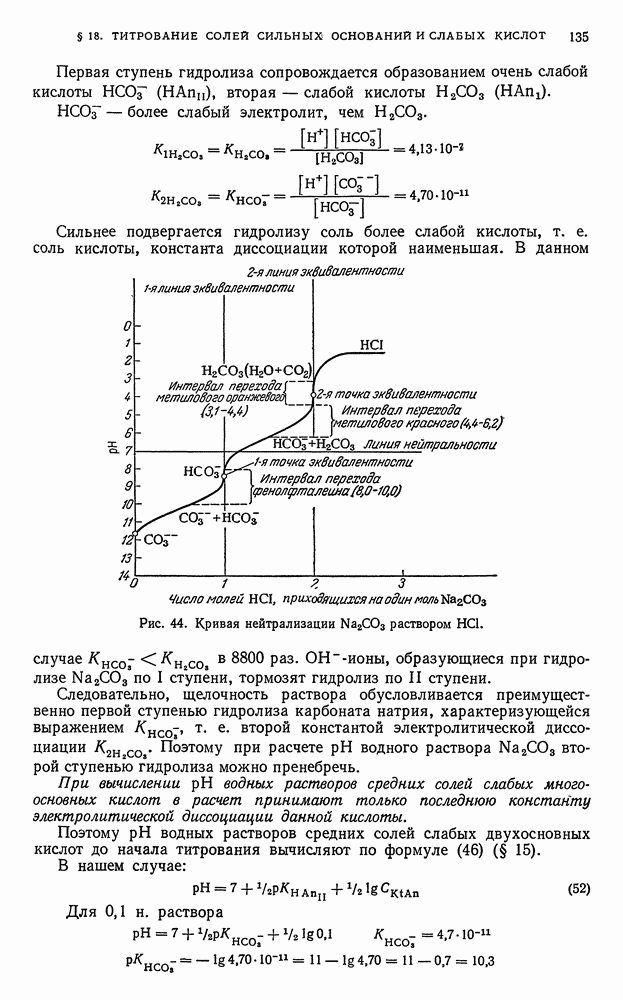
- § 18. Титрование солей, образованных катионами сильных оснований и анионами слабых многоосновных кислот
- § 19. Изменение активности и показателя активности ионов водорода в процессе титрования водных растворов кислот и оснований
- § 20. Выводы, вытекающие из рассмотрения кривых нейтрализации
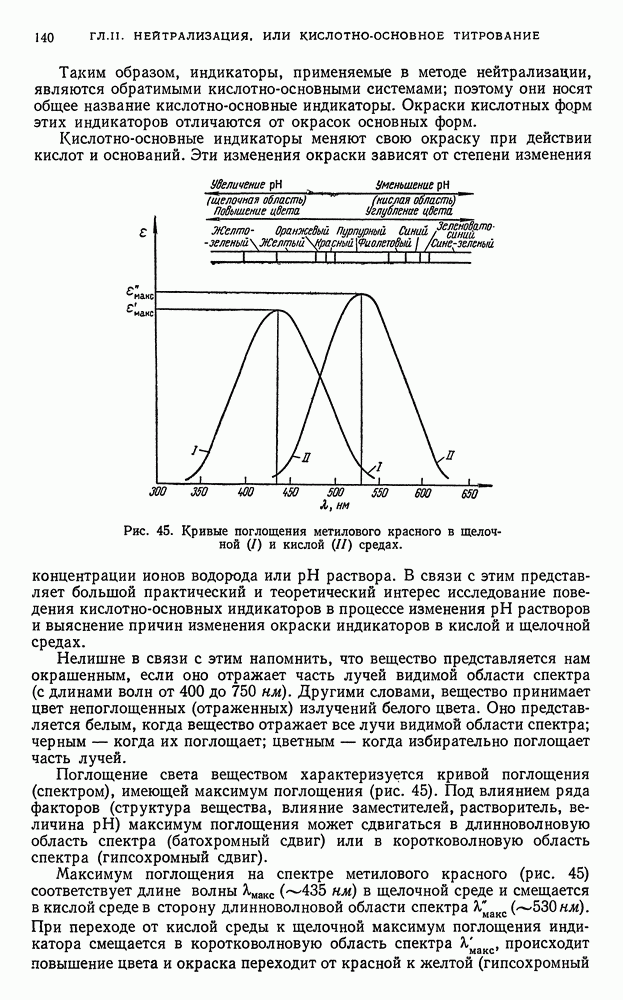
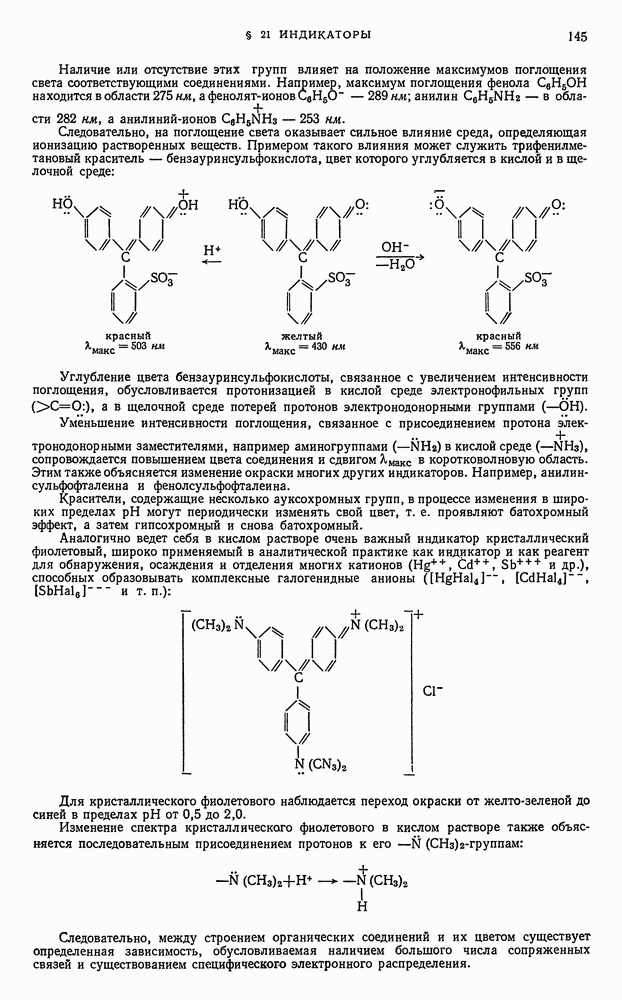
- § 21. Индикаторы
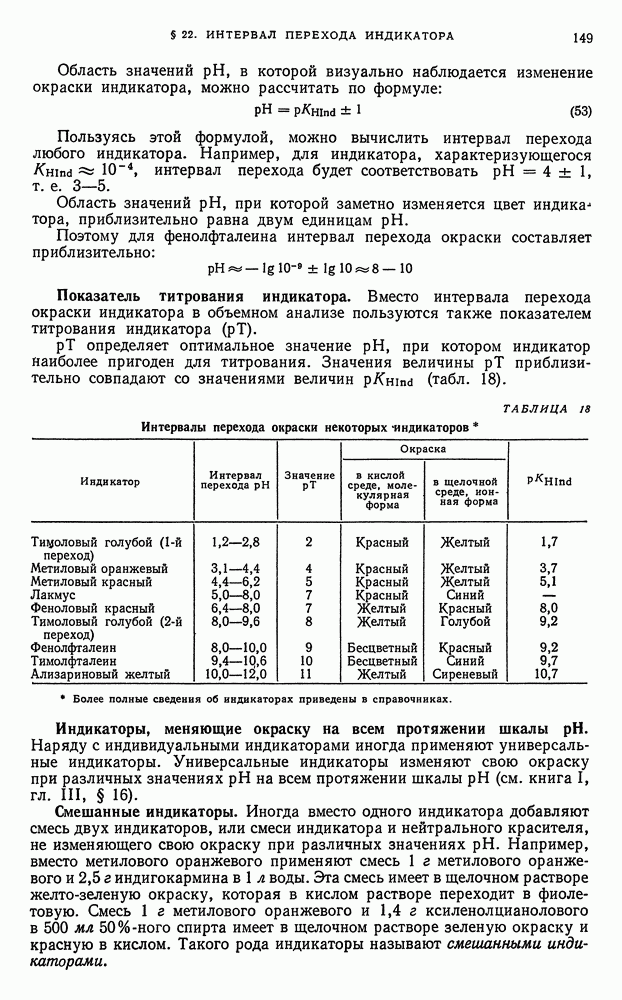
- § 22. Интервал перехода индикатора
- § 23. Выбор индикатора
- § 24. Ошибки титрования
- Б. ПРАКТИЧЕСКАЯ ЧАСТЬ
- § 25. Организация рабочего места
- § 26. Приготовление стандартных (титрованных) растворов
- § 27. Приготовление 0,1 н. раствора хлористоводородной кислоты
- § 28. Установка титра 0,1 н. раствора хлористоводородной кислоты
- § 29. Приготовление 0,1 н. раствора едкого натра
- § 30. Установка титра 0,1 н. раствора едкого натра
- § 31. Определение карбонатов
- § 32. Определение содержания H2SO4 в технической серной кислоте
- § 33. Определение содержания уксусной кислоты
- § 34. Определение содержания Na2CO3 и NaOH при их совместном присутствии
- § 35. Определение содержания Na2CO3 и NaHCO3 при их совместном присутствии
- § 36. Определение жесткости воды
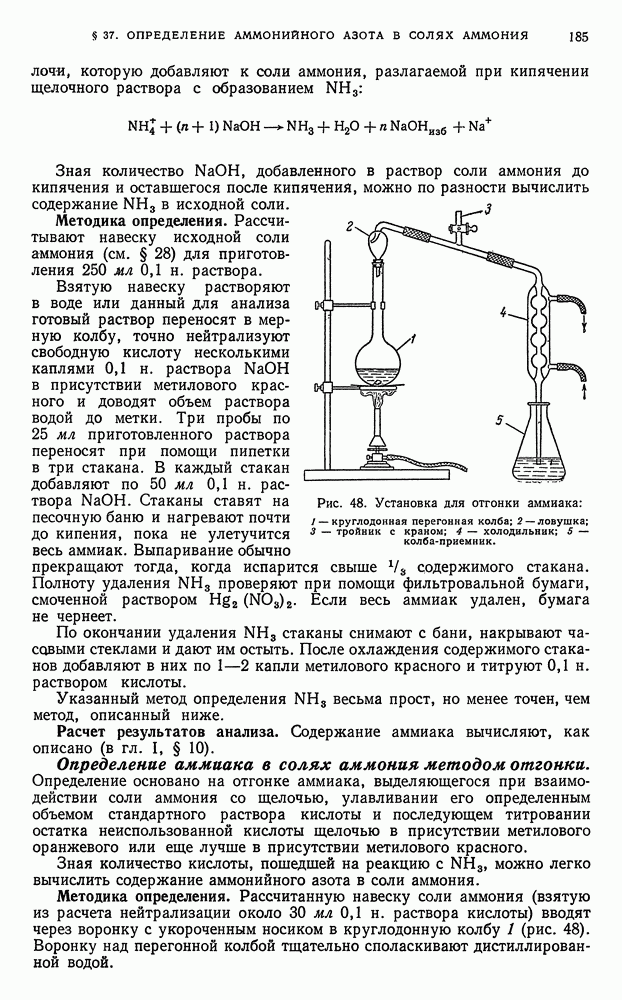
- § 37. Определение аммонийного азота в солях аммония
- § 38. Определение содержания фосфорной кислоты
- В. КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ В НЕВОДНЫХ СРЕДАХ
- § 39. Неводные растворы
- § 40. Современные представления о кислотах и основаниях
- § 41. Диссоциация электролитов в неводных растворах
- § 42. Влияние неводных растворителей на силу кислот и оснований
- § 43. Применение закона действия масс к растворам сильных электролитов
- § 44. Титрование кислот и оснований в неводных растворах
- § 45. Методы кислотно-основного титрования в неводных средах
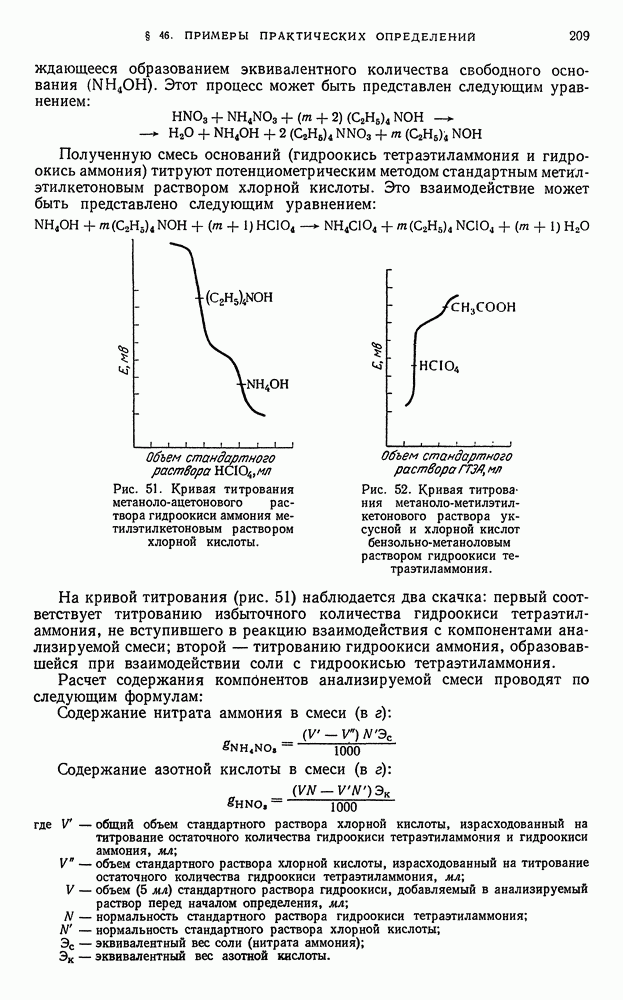
- § 46. Примеры практических определений в неводных растворах
- ГЛАВА III. МЕТОДЫ ОКИСЛЕНИЯ—ВОССТАНОВЛЕНИЯ (ОКСИДИМЕТРИЯ, ОКСРЕДМЕТРИЯ, РЕД-ОКС-МЕТОДЫ)
- § 1. Значение окислительно-восстановительных потенциалов
- § 2. Реакции окисления—восстановления и комплексообразования
- § 3. Примеры окислительно-восстановительного титрования
- § 4. Константы равновесия окислительно-восстановительных реакций
- § 5. Связь между константами равновесия окислительно-восстановительных реакций и нормальными потенциалами
- § 6. Вычисление констант равновесия окислительно-восстановительных реакций
- § 8. Зависимость скорости реакций окисления—восстановления от различных факторов
- § 9. Графический метод изображения процесса окисления—восстановления
- § 10. Фиксирование точки эквивалентности в методах окисления—восстановления
- § 11. Окислительно-восстановительные индикаторы (ред-окс-индикаторы)
- Б. ПЕРМАНГАНАТОМЕТРИЯ
- § 12. Основы перманганатометрии
- § 13. Титрование перманганатом в кислой среде
- § 14. Титрование перманганатом в щелочной среде
- § 15. Приготовление стандартного (титрованного) раствора перманганата калия
- § 16. Установка титра стандартного раствора перманганата калия
- § 17. Установка титра и нормальности раствора перманганата калия по оксалату аммония
- § 18. Вещества, определяемые методом перманганатометрии
- ОПРЕДЕЛЕНИЕ ВОССТАНОВИТЕЛЕЙ
- § 19. Определение щавелевой кислоты и оксалатов
- § 20. Определение соединений железа (II)
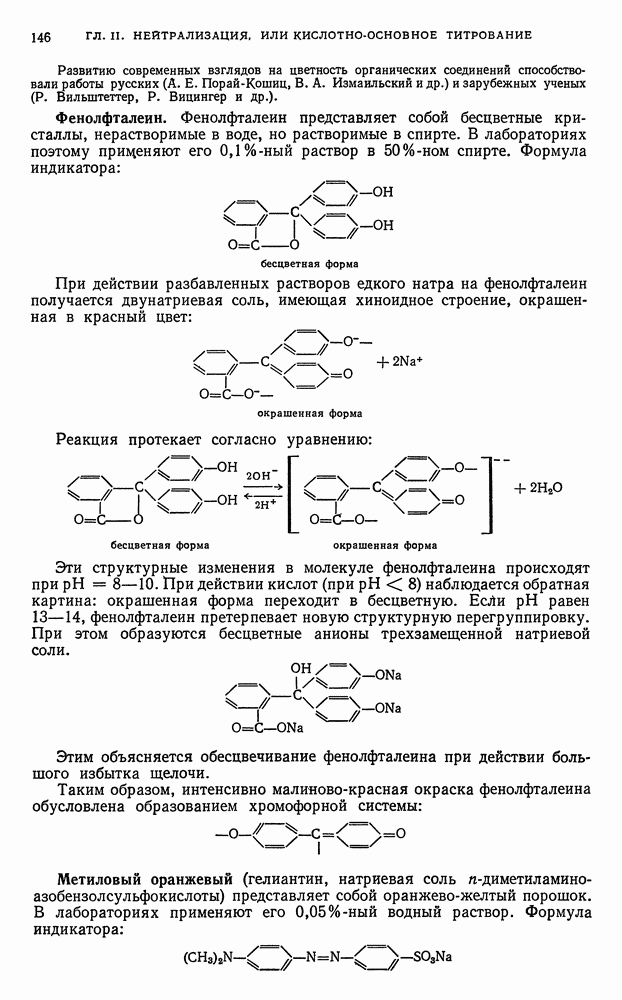
- § 21. Определение содержания металлического железа в присутствии окислов железа
- § 22. Определение азотистой кислоты и нитритов
- § 23. Определение содержания марганца (II) в рудах
- ОПРЕДЕЛЕНИЕ ОКИСЛИТЕЛЕЙ
- § 24. Определение соединений железа (III)
- § 25. Определение нитратов
- § 26. Определение бихроматов
- § 27. Определение содержания MnO2 в пиролюзите
- ОПРЕДЕЛЕНИЕ ДРУГИХ ВЕЩЕСТВ
- § 28. Определение ионов кальция
- В. ИОДОМЕТРИЯ
- § 29. Основы иодометрии
- § 30. Методы иодометрического титрования
- § 31. Преимущества и недостатки иодометрического метода
- § 32. Приготовление стандартного (титрованного) раствора тиосульфата и установка его титра
- § 33. Приготовление стандартного (титрованного) раствора иода и установка его титра
- МЕТОДЫ ПРЯМОГО ТИТРОВАНИЯ
- § 34. Определение мышьяка (III)
- МЕТОДЫ ОБРАТНОГО ТИТРОВАНИЯ
- § 35. Определение сульфита натрия
- § 36. Определение содержания формальдегида в формалине
- МЕТОДЫ КОСВЕННОГО ОПРЕДЕЛЕНИЯ
- § 37. Определение ионов меди (II)
- § 38. Определение двуокиси свинца в сурике
- МЕТОД ТИТРОВАНИЯ ЗАМЕСТИТЕЛЕЙ
- § 39. Определение содержания двуокиси марганца в пиролюзите
- МЕТОД ОПРЕДЕЛЕНИЯ КИСЛОТ
- § 40. Определение хлористоводородной кислоты
- § 41. Определение воды по Фишеру
- Г. ПОНЯТИЕ О ДРУГИХ МЕТОДАХ ОКИСЛЕНИЯ — ВОССТАНОВЛЕНИЯ
- § 42. Хроматометрия
- § 43. Определение содержания железа (II)
- § 44. Цериметрия
- § 45. Броматометрия
- § 46. Ванадатометрия
- § 47. Аскорбинометрия
- § 48. Титанометрия
- ГЛАВА IV. МЕТОДЫ ОСАЖДЕНИЯ И КОМПЛЕКСООБРАЗОВАНИЯ
- § 1. Общая характеристика методов
- § 2. Классификация методов осаждения и комплексообразования
- § 3. Применение теории осаждения к объемному анализу
- § 4. Вычисление растворимости электролитов в воде с учетом коэффициентов активности
- § 5. Влияние одноименных ионов на растворимость малорастворимого электролита
- § 6. Солевой эффект
- § 7. Влияние концентрации ионов водорода на растворимость малорастворимых соединений
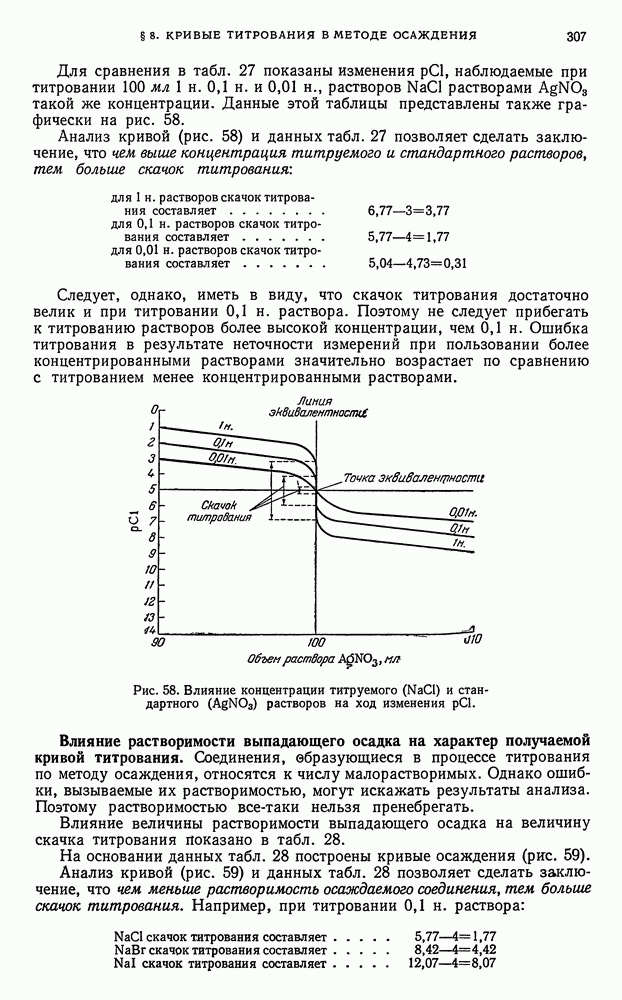
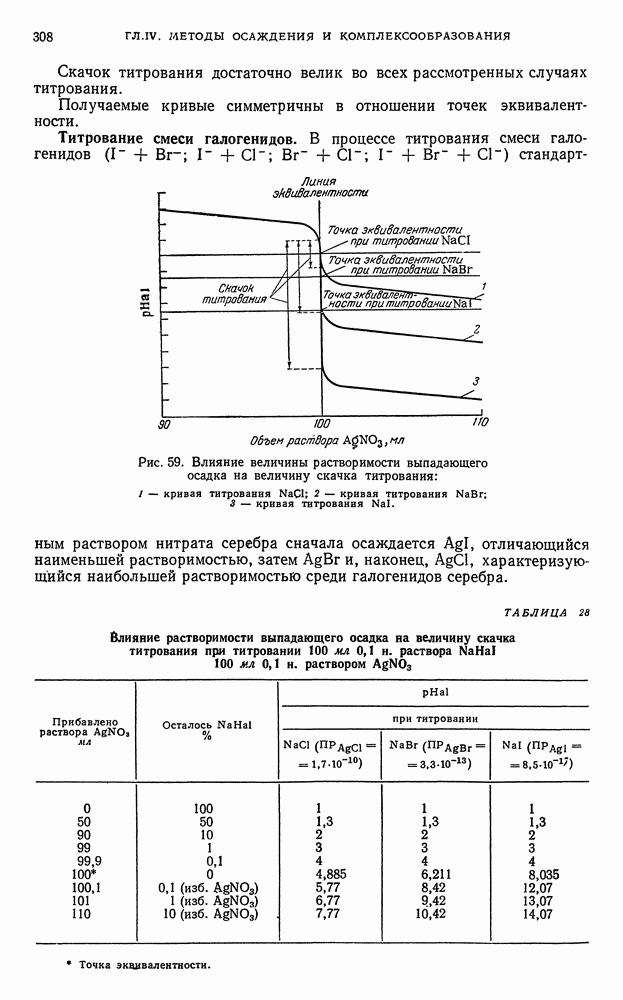
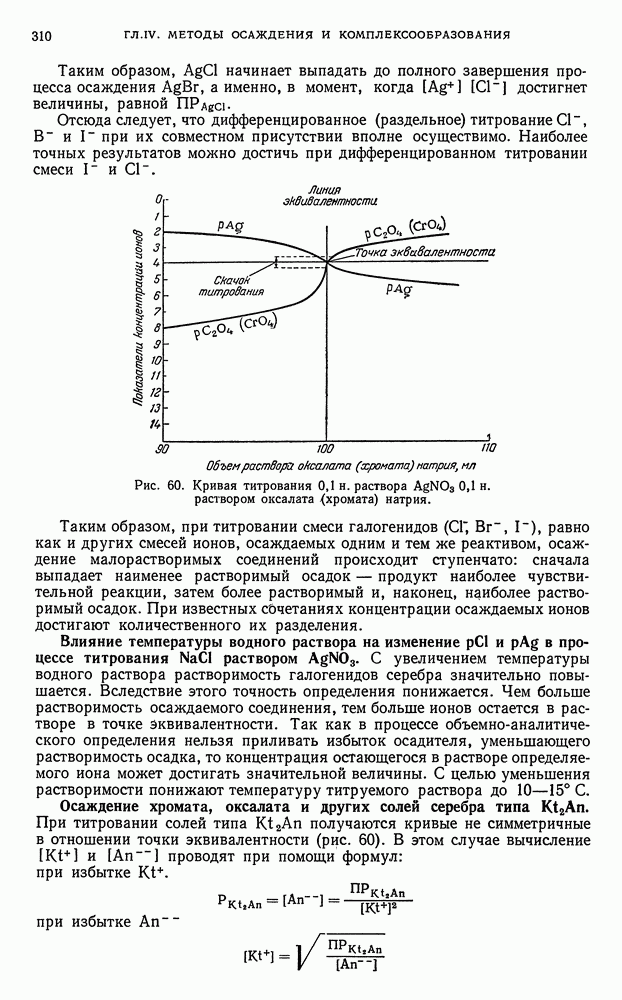
- § 8. Кривые титрования в методе осаждения
- § 9. Общие выводы, вытекающие из рассмотрения кривых осаждения
- § 10. Адсорбционные явления, наблюдаемые при титровании по методу осаждения
- Б. АРГЕНТОМЕТРИЯ
- § 11. Характеристика метода
- § 12. Приготовление 0,1 н. раствора нитрата серебра
- § 13. Приготовление стандартного раствора хлорида натрия
- § 14. Установка титра 0,1 н. раствора нитрата серебра по точной навеске хлорида натрия
- §15. Определение ионов хлора в техническом хлориде натрия по методу Мора
- § 16. Определение хлоридов по методу Фаянса
- В. РОДАНОМЕТРИЯ
- § 17. Характеристика метода
- § 18. Приготовление 0,1 н. раствора роданида аммония
- § 19. Определение ионов хлора в растворимых хлоридах по методу Фольгарда
- § 20. Определение серебра в сплавах
- Г. МЕРКУРИМЕТРИЯ
- § 21. Характеристика метода
- § 22. Приготовление 0,1 н. раствора нитрата ртути (II)
- § 23. Установка титра раствора нитрата ртути (II)
- § 24. Определение ионов хлора в воде меркуриметрическим методом
- Д. МЕРКУРОМЕТРИЯ
- § 25. Краткая характеристика метода
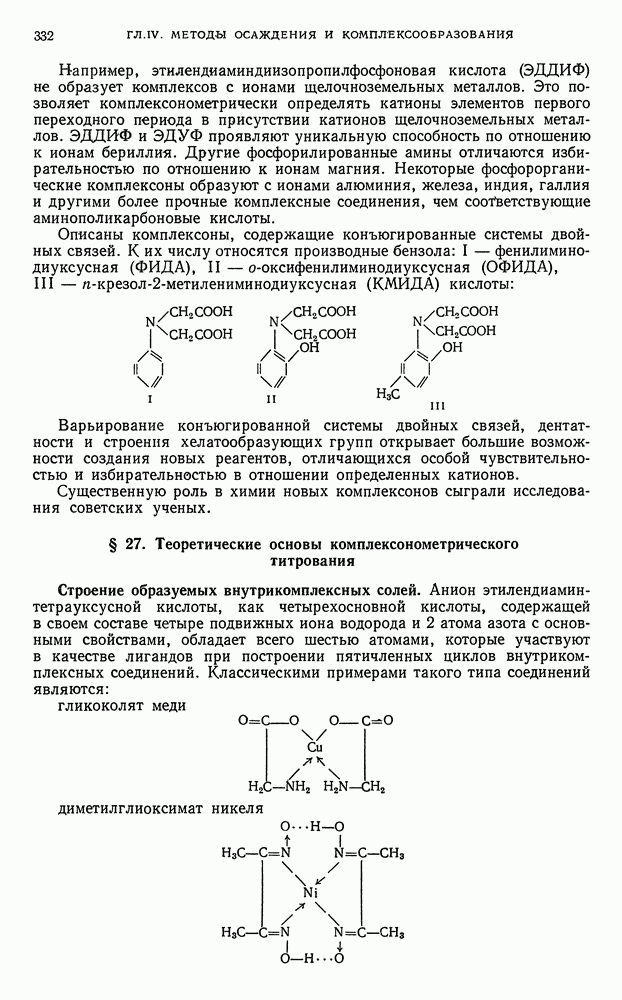
- Е. КОМПЛЕКСОНОМЕТРИЯ (ХЕЛАТОМЕТРИЯ)
- § 26. Характеристика метода
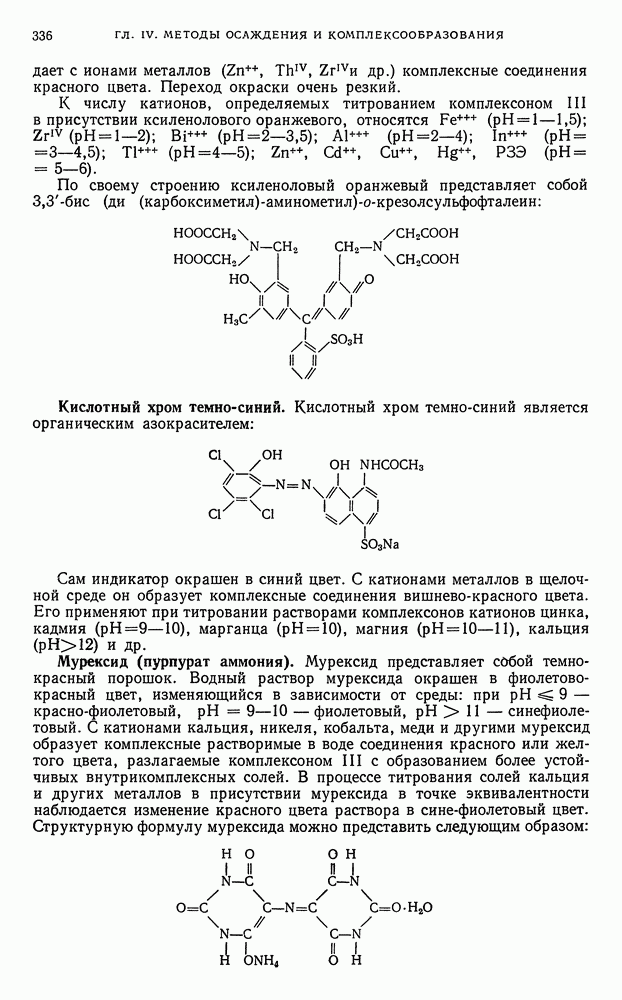
- § 27. Теоретические основы комплексонометрического титрования
- § 28. Классификация методов комплексонометрического титрования
- § 29. Установка титра раствора комплексона III
- § 30. Определение содержания кальция
- § 31. Определение жесткости воды комплексонометрическим методом
- § 32. Анализ смеси ионов кальция и магния
- § 33. Определение содержания алюминия
- § 34. Раздельное определение ионов кальция и алюминия
- § 35. Раздельное определение ионов алюминия и железа
- Часть вторая. Весовой анализ
- § 1. Сущность весового анализа
- § 2. Классификация методов весового анализа
- § 3. Расчеты в весовом анализе
- Б. ТЕХНИКА ВЕСОВОГО АНАЛИЗА
- § 4. Взятие и растворение навески
- § 5. Техника осаждения
- § 6. Фильтрование и промывание осадков
- § 7. Получение весовой формы
- § 8. Взвешивание весовой формы
- В. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
- § 9. Теоретические основы выделения осадков из растворов с помощью специфических неорганических и органических реактивов
- § 10. Требования, предъявляемые к осадкам
- § 11. Методы повышения точности весовых определений
- § 12. Теоретические обоснования выбора оптимальных условий для весового определения
- Г. ПРАКТИЧЕСКАЯ ЧАСТЬ
- § 13. Определение кристаллизационной воды в BaCl2 2H2O
- § 14. Определение сульфат-ионов или серы
- § 15. Определение ионов железа (III)
- § 16. Определение содержания кальция в карбонате кальция
- § 17. Определение содержания магния
- § 18. Определение ионов хлора в растворимых хлоридах или в хлористоводородной кислоте
- § 19. Анализ силикатов
- § 20. Анализ доломита
- § 21. Анализ бронзы и латуни
- Д. МЕТОДЫ ВЕСОВЫХ ОПРЕДЕЛЕНИЙ, ОСНОВАННЫЕ НА ПРИМЕНЕНИИ ОРГАНИЧЕСКИХ РЕАКТИВОВ
- § 22. Определение никеля
- § 23. Определение алюминия
- Часть третья. Понятие о физических и физико-химических (инструментальных) методах анализа
- § 1. Электрохимические методы
- § 2. Спектральные (оптические) методы
- § 3. Хроматографические методы
- § 4. Радиометрические методы
- § 5. Масс-спектрометрические методы
- ГЛАВА VII ЭЛЕКТРОВЕСОВЫЕ МЕТОДЫ АНАЛИЗА
- § 1. Характеристика методов электроанализа
- § 2. Химические процессы, протекающие при электролизе
- § 3. Методы электроанализа
- § 4. Электровесовой анализ
- § 5. Метод внутреннего электролиза
- § 6. Определение меди в растворе сульфата меди с применением платиновых сетчатых электродов
- § 7. Определение меди и свинца в латуни с применением платиновых сетчатых электродов
- § 8. Определение малых количеств меди методом внутреннего электролиза
- ГЛАВА VIII. ОБЪЕМНЫЕ ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- § 1. Особенности объемных электрохимических методов анализа
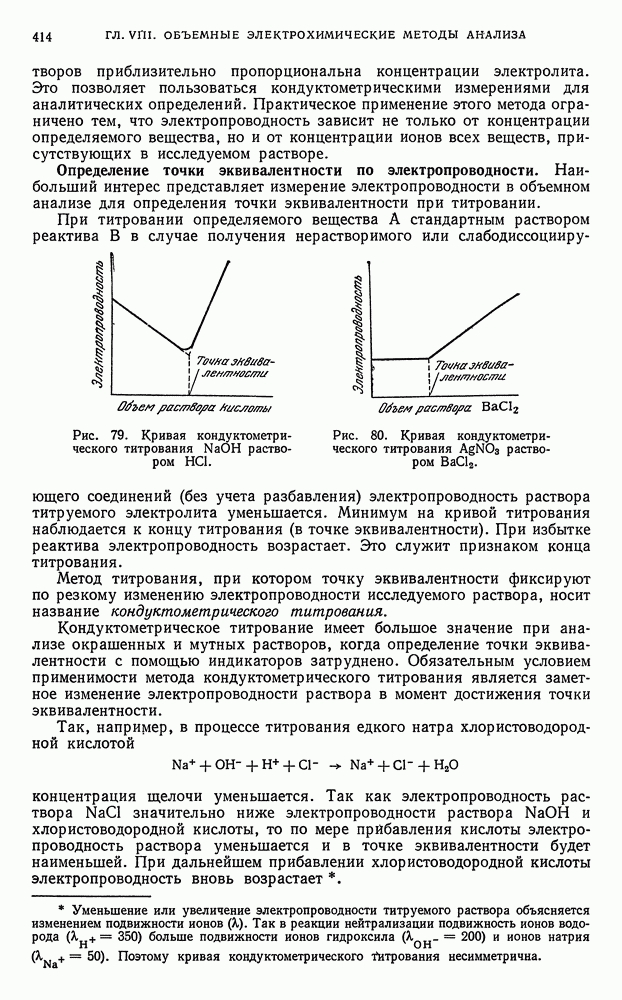
- § 2. Кондуктометрическое титрование
- § 3. Высокочастотное титрование
- § 4. Потенциометрическое титрование
- § 5. Полярографический метод анализа
- § 6. Амперометрическоб титрование
- § 7. Кулонометрическое титрование
- ГЛАВА IX. СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА
- § 1. Понятие об эмиссионном спектральном анализе
- Б. КОЛОРИМЕТРИЯ
- § 2. Особенности колориметрических методов анализа
- § 3. Характеристика колориметрических методов анализа
- В. ОПТИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ ТОЧКИ ЭКВИВАЛЕНТНОСТИ
- § 4. Спектрофотометрическое титрование
- § 5. Фототурбидиметрическое и фотонефелометрическое титрование
- Г. ЛАБОРАТОРНЫЕ РАБОТЫ
- § 6. Определение содержания ионов железа методом колориметрического титрования
- § 7. Определение содержания титана
- ГЛАВА X. МЕТОДЫ РАЗДЕЛЕНИЯ, ВЫДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ ОТДЕЛЬНЫХ КОМПОНЕНТОВ АНАЛИЗИРУЕМЫХ СМЕСЕЙ
- § 1. Определение следов элементов (микропримесей)
- § 2. Метод осаждения малорастворимых соединений
- § 3. Электрохимические методы разделения
- § 4. Метод экстрагирования
- § 5. Методы отгонки летучих соединений
- § 6. Хроматографические методы разделения
- § 7. Метод флотации