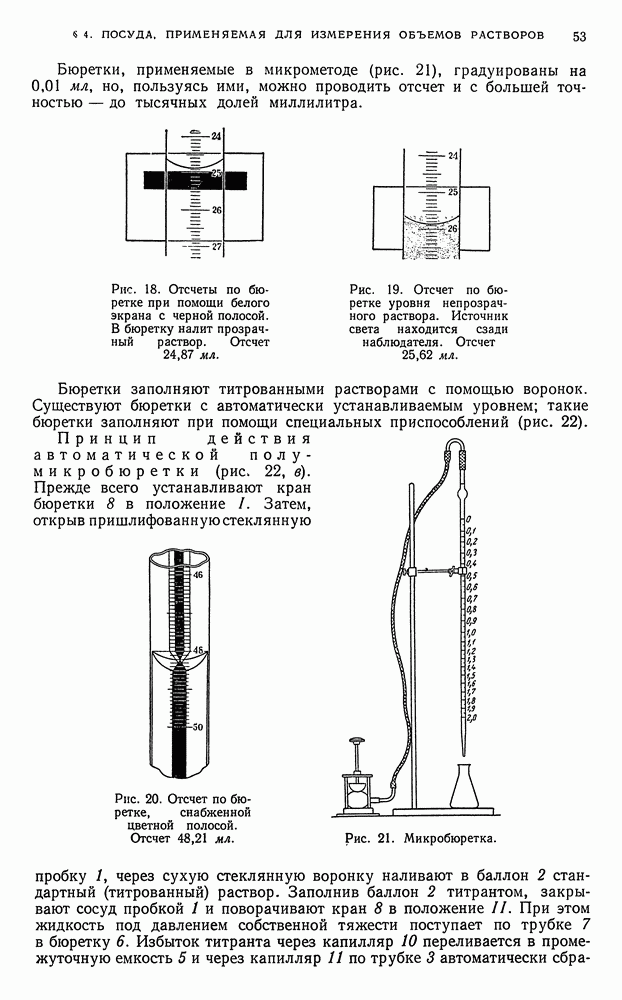
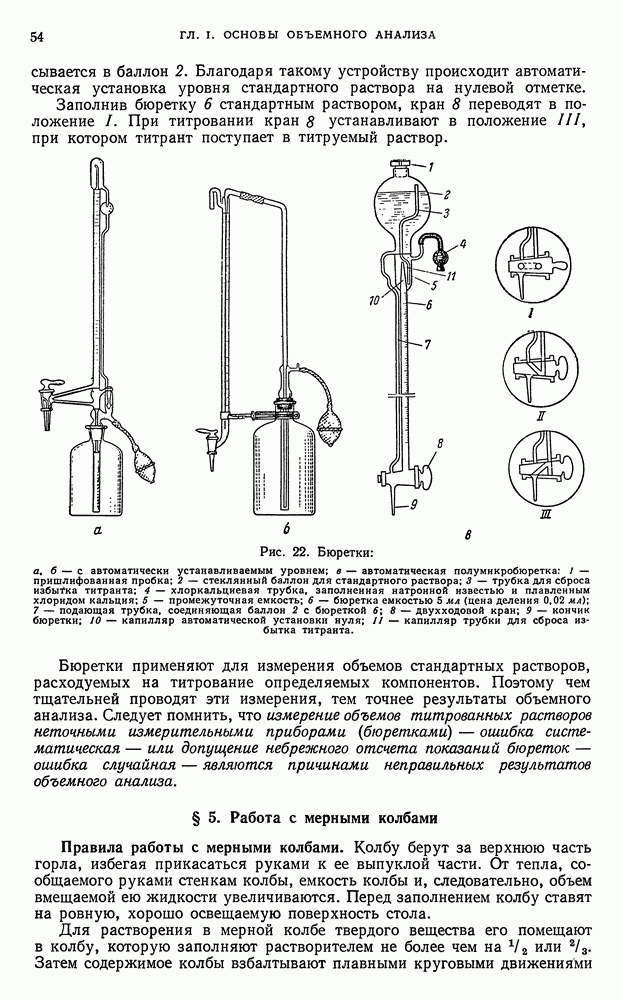
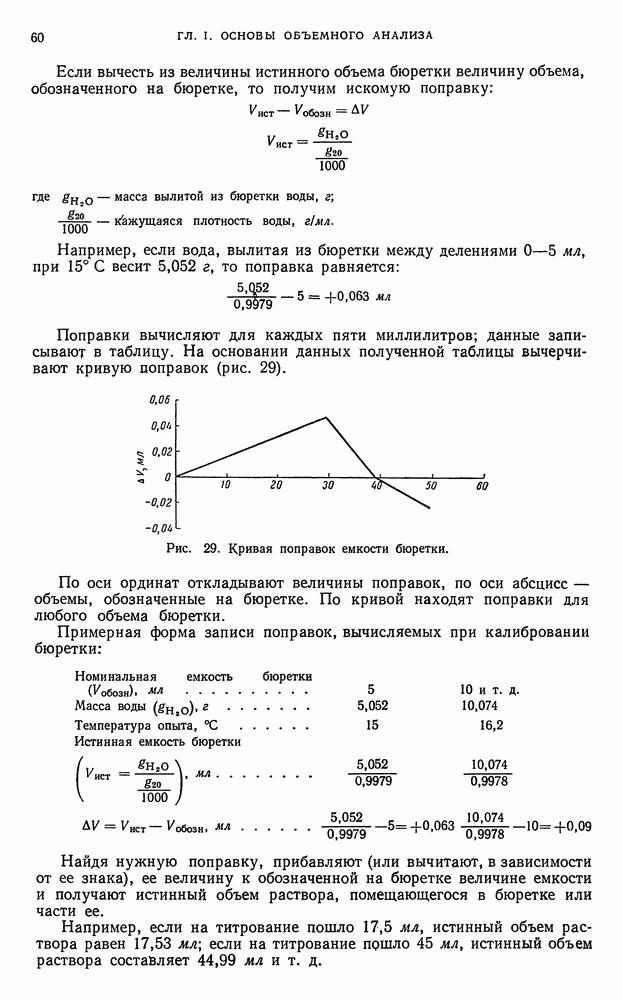
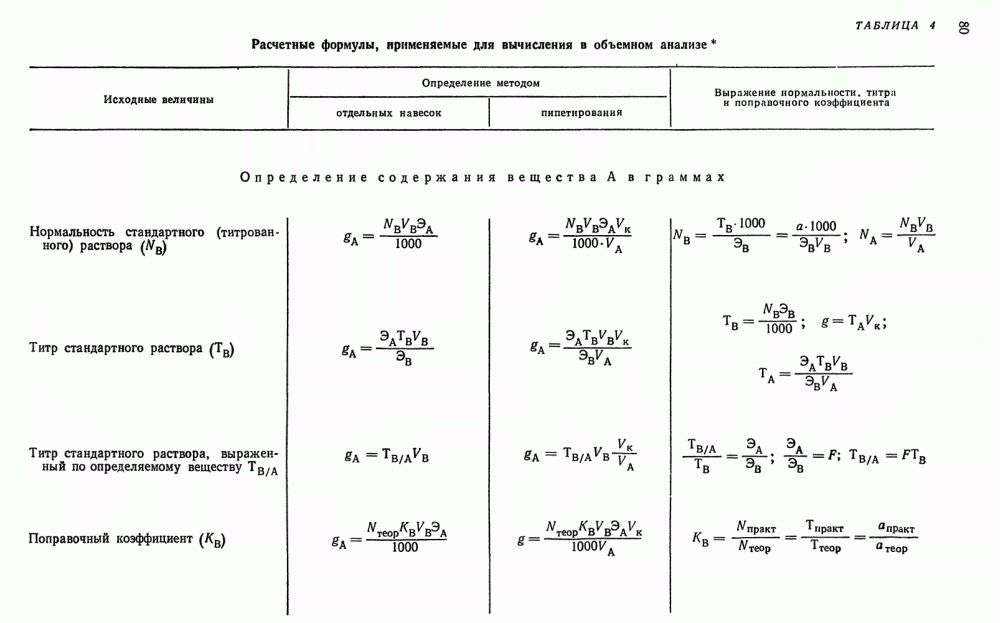
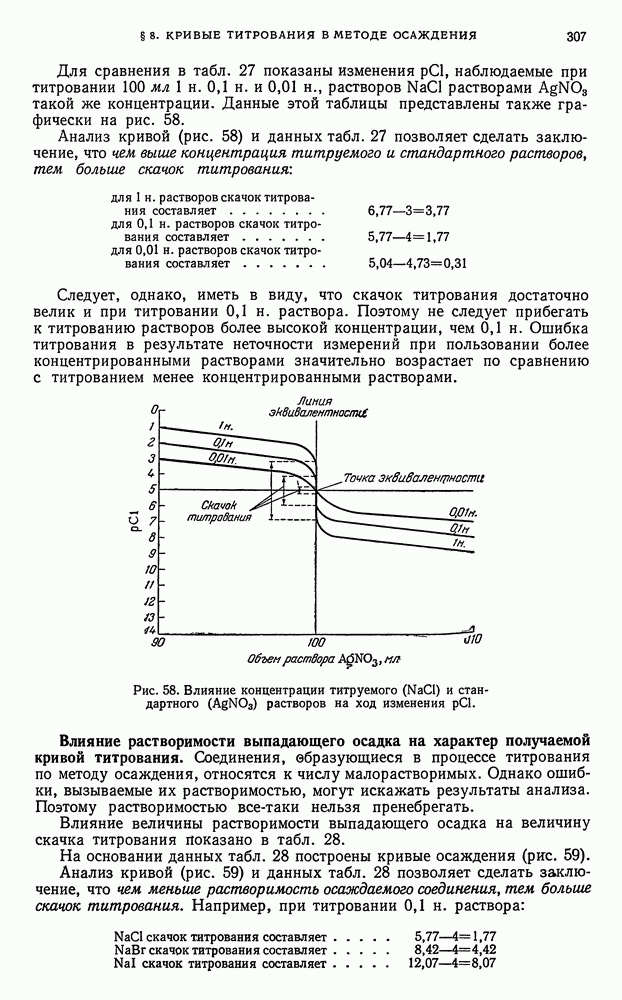
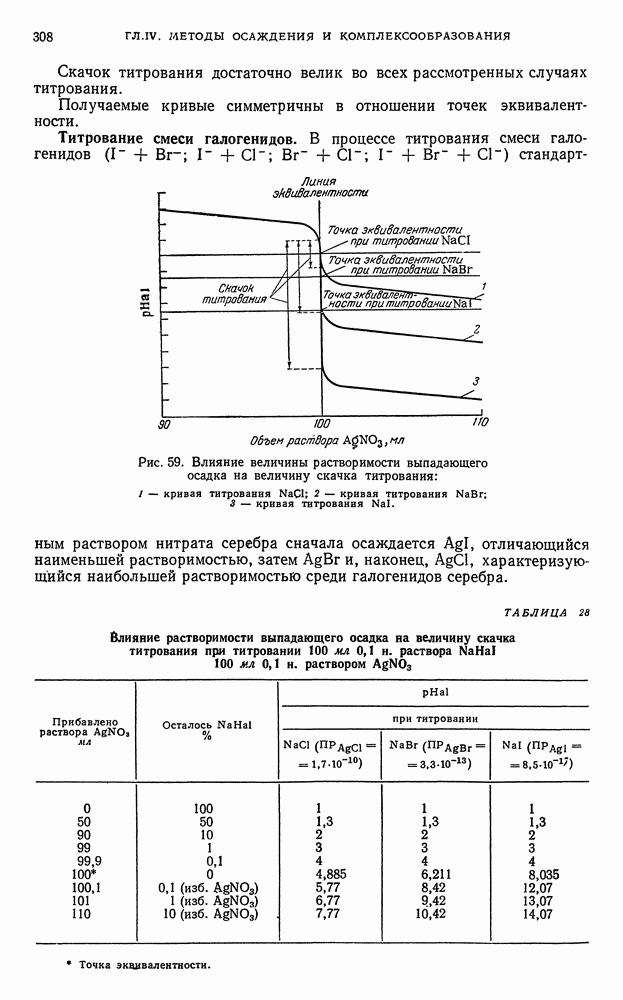
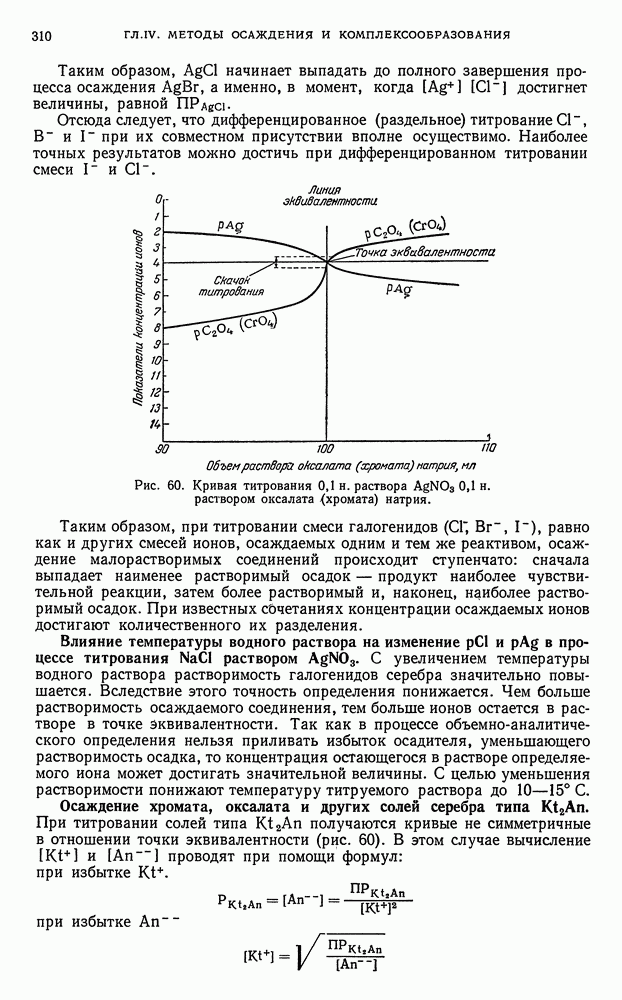
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 2. Общее уравнение реакции титрования и выводы из него
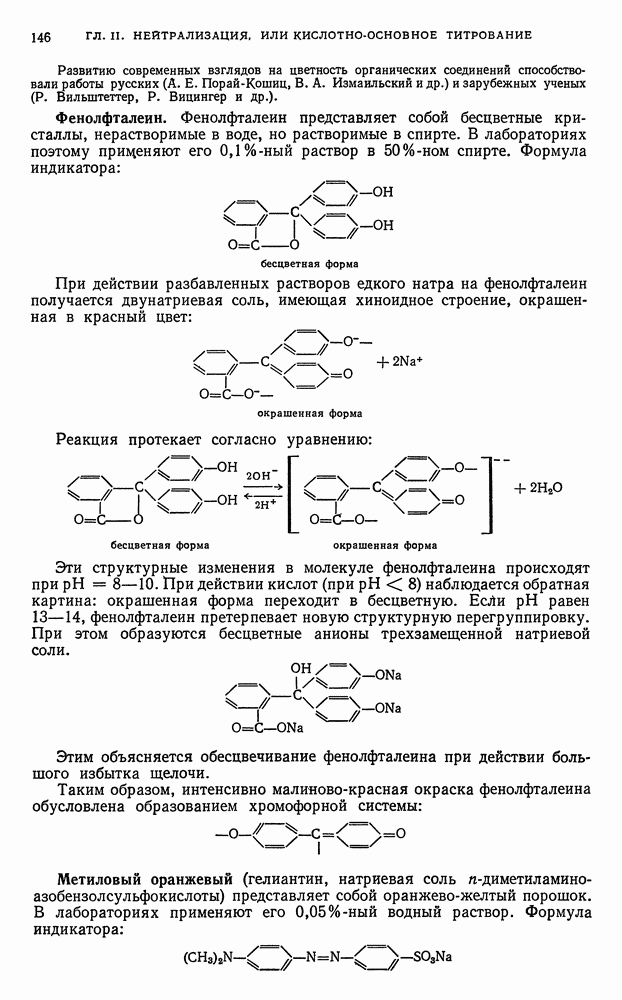
Методы установления точек эквивалентности. Установление (фиксирование) конечной точки титрования или точки эквивалентности представляет собой важнейшую операцию титриметрического метода анализа, так как от точности определения точки эквивалентности зависит точность результатов анализа. Обычно конец титрования устанавливают по изменению окраски титруемого раствора или индикатора, вводимого в начале или в процессе титрования. Применяют также безындикаторные методы, основанные на использовании специальных приборов, позволяющих судить об изменениях, которые происходят в титруемом растворе в процессе титрования. Такие методы называют физико-химическими, или инструментальными, методами определения точек эквивалентности. Они основаны на измерении электропроводности, величин потенциалов, оптической плотности и других физико-химических параметров титруемых растворов, которые резко изменяются в точке эквивалентности.
Общее уравнение реакции титрования. Процесс титрования можно представить в виде следующего общего уравнения:

где  — определяемые вещества, находящиеся в титруемом растворе; В — реагент (титрант);
— определяемые вещества, находящиеся в титруемом растворе; В — реагент (титрант);  — продукты реакции определяемого вещества А с реагентом (титрантом) В;
— продукты реакции определяемого вещества А с реагентом (титрантом) В;  — избыток реагента.
— избыток реагента.
По мере титрования койцентрация определяемого вещества А постепенно уменьшается до точки эквивалентности; в точке эквивалентности она уменьшается до минимума; после точки эквивалентности — остается практически равной нулю.
До точки эквивалентности концентрация реагента В остается равной нулю, так как по мере приливания титрованного раствора реагент В вступает в реакцию с определяемым веществом. В точке эквивалентности в титруемом растворе появляются следы реагента В после точки эквивалентности, разумеется, концентрация реагента начинает повышаться, так как концентрация определяемого вещества в это время становится равной нулю.
Концентрации продуктов реакции D и Е соответственно, по мере вступления реагента В в реакцию с определяемым веществом, постепенно повышаются, достигают максимума в точке эквивалентности и практически остаются постоянными после точки эквивалентности.
ТАБЛИЦА 3. Изменение концентрации реагирующих и образующихся веществ в процессе титрования

Точку эквивалентности можно определить следующими методами:
1) визуально — по изменению цвета раствора, если определяемое вещество А или реагент В окрашены, так как в точке эквивалентности концентрация определяемого вещества уменьшается до минимума, а концентрация реагента В начинает повышаться;
2) визуально — по появлению помутнения или по изменению окраски раствора, вызываемой образованием продуктов реакции, или индикатора, если А и В бесцветны;
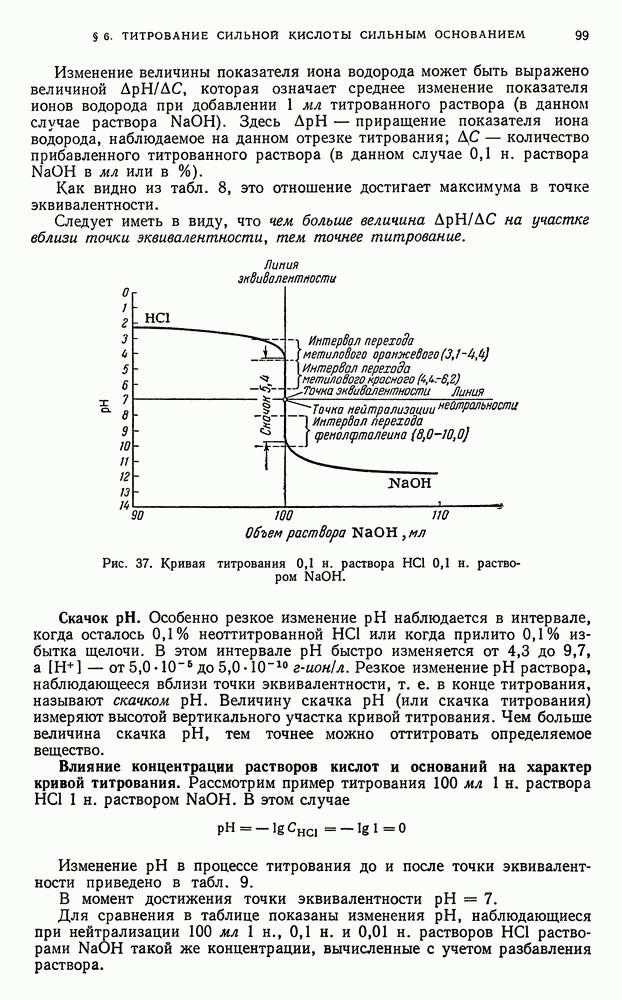
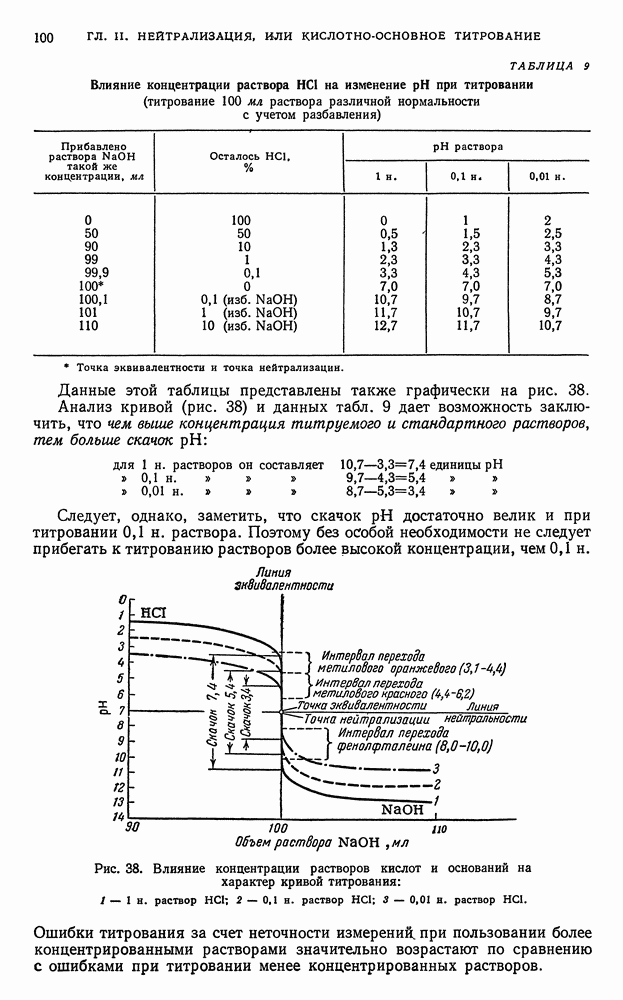
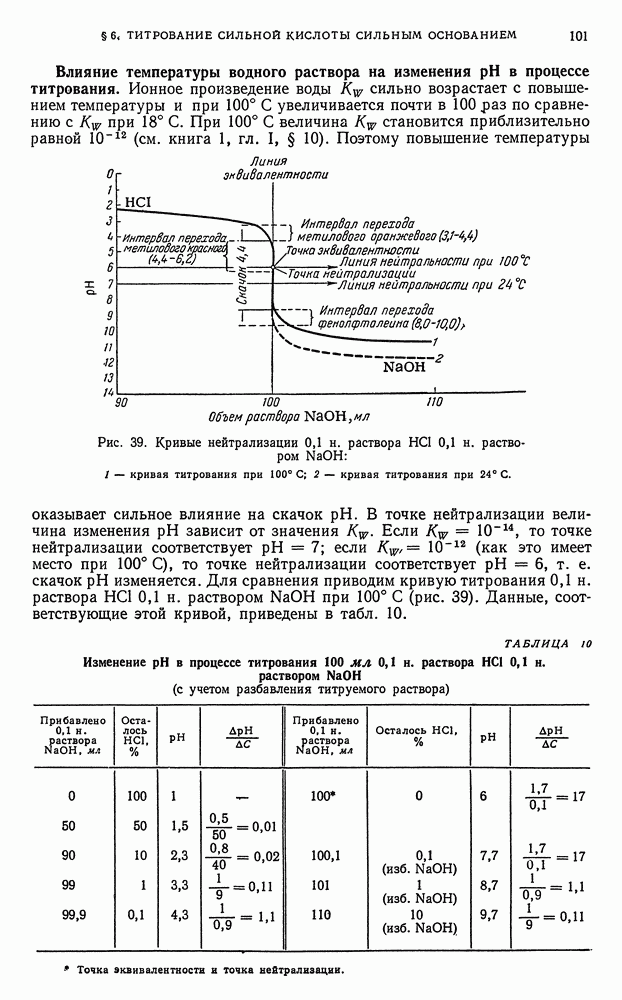
3) физико-химическими (инструментальными) методами с последующим анализом кривых титрования, отражающих происходящие в процессе титрования изменения физико-химических параметров титруемых растворов (например,  ) независимо от окраски А и В. Точку эквивалентности устанавливают по пересечению кривых или по скачку кривой титрования.
) независимо от окраски А и В. Точку эквивалентности устанавливают по пересечению кривых или по скачку кривой титрования.
Общие приемы титрования. Прямое титрование. Простейший прием титрования в объемном анализе состоит в том, что к определенному объему раствора или к определенной навеске вещества А, растворенного в подходящем растворителе, по каплям приливают из точно калиброванной бюретки стандартный (титрованный) раствор реагента В.
Точку эквивалентности устанавливают по резкому уменьшению  , сопровождающемуся, например, исчезновением окраски раствора (если определяемое вещество А окрашено) или по началу повышения
, сопровождающемуся, например, исчезновением окраски раствора (если определяемое вещество А окрашено) или по началу повышения  (по появлению окраски раствора, если реагент В окрашен), или по изменению окраски индикатора.
(по появлению окраски раствора, если реагент В окрашен), или по изменению окраски индикатора.
Если в распоряжении аналитика имеется титрованный раствор требуемого реагента В, то весь процесс прямого титрования вещества А занимает несколько минут.
Зная количество стандартного раствора реагента В, израсходованного на реакцию с определяемым веществом А, можно легко вычислить содержание вещества А.
Примером применения прямого метода титрования является определение содержания  в технической соляной кислоте с помощью
в технической соляной кислоте с помощью  .
.
Обратное титрование. Иногда по тем или иным причинам нельзя применить метод прямого титрования. Тогда прибегают к так называемому методу обратного титрования  титрование по остатку). Этот прием состоит в том, что к определенному объему раствора или к определенной навеске вещества А, растворенного в подходящем растворителе, приливают точно измеренный объем титрованного раствора реагента В, взятый в избытке. Избыток не вошедшего в реакцию реагента В оттитровывают стандартным раствором другого вспомогательного реагента
титрование по остатку). Этот прием состоит в том, что к определенному объему раствора или к определенной навеске вещества А, растворенного в подходящем растворителе, приливают точно измеренный объем титрованного раствора реагента В, взятый в избытке. Избыток не вошедшего в реакцию реагента В оттитровывают стандартным раствором другого вспомогательного реагента  точно известной концентрации. На титрование избытка реагента В должно идти не менее
точно известной концентрации. На титрование избытка реагента В должно идти не менее  реагента
реагента  (макрометодом) или
(макрометодом) или  (микрометодом).
(микрометодом).
Например, для определения содержания  в соляной кислоте неизвестной концентрации можно прибавить к ней точно отмеренное количество титрованного раствора
в соляной кислоте неизвестной концентрации можно прибавить к ней точно отмеренное количество титрованного раствора  , взятого с избытком, а затем непрореагировавший избыток
, взятого с избытком, а затем непрореагировавший избыток  оттитровать стандартным раствором подходящего реагента, реагирующего с ионами серебра, не вошедшими в реакцию. Таким реагентом является роданид аммония, вступающий в реакцию с ионами серебра с образованием малорастворимого
оттитровать стандартным раствором подходящего реагента, реагирующего с ионами серебра, не вошедшими в реакцию. Таким реагентом является роданид аммония, вступающий в реакцию с ионами серебра с образованием малорастворимого  .
.
Если реакцию обратного титрования вести в присутствии ионов железа (III), то лишняя капля титрованного раствора вспомогательного реагента  вызывает окрашивание раствора в розово-красный цвет вследствие образования
вызывает окрашивание раствора в розово-красный цвет вследствие образования  . Появление розовой окраски свидетельствует об окончании реакции.
. Появление розовой окраски свидетельствует об окончании реакции.
Как и при прямом титровании, зная количество стандартного раствора реагента В, израсходованного на реакцию с определяемым веществом А, можно легко вычислить содержание вещества А.
Косвенное титрование. Этот вид титрования имеет несколько вариантов.
Титрование заместителя. Сущность этого варианта заключается в следующем. К определяемому веществу А прибавляют какой-либо вспомогательный реагент  , реагирующий с ним с выделением эквивалентного количества нового вещества
, реагирующий с ним с выделением эквивалентного количества нового вещества  которое оттитровывают стандартным раствором основного реагента В. Другими словами, вместо непосредственного титрования определяемого вещества А титруют его заместитель
которое оттитровывают стандартным раствором основного реагента В. Другими словами, вместо непосредственного титрования определяемого вещества А титруют его заместитель  .
.
Поясним это на примере. Окислитель  можно оттитровать с помощью стандартного раствора восстановителя. Но не всякий восстановитель пригоден для этой цели. Например,
можно оттитровать с помощью стандартного раствора восстановителя. Но не всякий восстановитель пригоден для этой цели. Например,  , являющийся хорошим восстановителем, нельзя, по ряду причин непосредственно применить для титрования таких сильных окислителей, какими являются
, являющийся хорошим восстановителем, нельзя, по ряду причин непосредственно применить для титрования таких сильных окислителей, какими являются  и т. д.
и т. д.
Однако раствор  с успехом применяют для титрования такого слабого окислителя, как иод. Поэтому предварительно действуют на
с успехом применяют для титрования такого слабого окислителя, как иод. Поэтому предварительно действуют на  в кислой среде вспомогательным реагентом KI (
в кислой среде вспомогательным реагентом KI ( ), который реагирует с
), который реагирует с  с выделением иода
с выделением иода  .
.
Иод выделяется в эквивалентном количестве по отношению к  . Если оттитровать выделившийся иод [заместитель перманганата
. Если оттитровать выделившийся иод [заместитель перманганата  ] стандартным раствором основного реагента
] стандартным раствором основного реагента  , то можно вычислить количество
, то можно вычислить количество  .
.
Конец титрования определяют с помощью индикатора — раствора крахмала. В присутствии иода крахмал окрашивается в синий цвет. По мере восстановления иода тиосульфатом синяя окраска крахмала постепенно исчезает; в точке эквивалентности раствор полностью обесцвечивается.
Количество израсходованного на реакцию основного реагента  эквивалентно количеству выделившегося иода
эквивалентно количеству выделившегося иода  . Количество выделившегося иода (заместителя —
. Количество выделившегося иода (заместителя —  ) в свою очередь эквивалентно количеству
) в свою очередь эквивалентно количеству  , содержащегося в образце.
, содержащегося в образце.
Зная, сколько основного реагента  израсходовано на реакцию с 12, нетрудно вычислить содержание определяемого вещества —
израсходовано на реакцию с 12, нетрудно вычислить содержание определяемого вещества —  .
.
Определение по содержанию продуктов реакции титрования. Содержание продуктов реакции D или Е определяют тем или иным способом после взаимодействия определяемого вещества А с реагентом В.
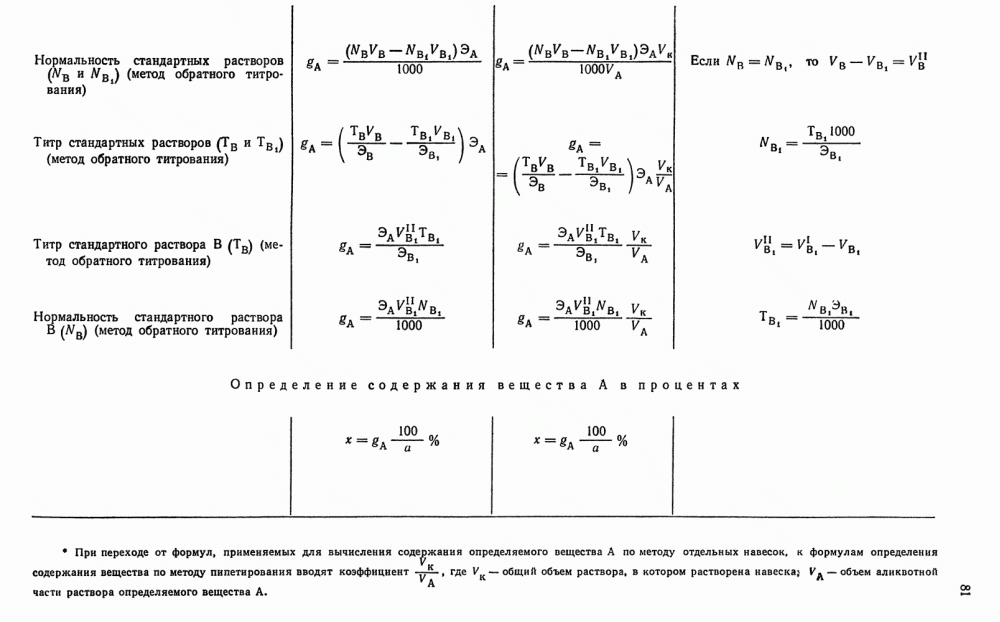
Определение по разности. Если известно или определено содержание всех компонентов и компонентов  в титруемом растворе, легко можно вычислить содержание компонента А:
в титруемом растворе, легко можно вычислить содержание компонента А:

Например, при анализе смеси  сначала прямым или обратным титрованием стандартным раствором
сначала прямым или обратным титрованием стандартным раствором  определяют суммарное содержание
определяют суммарное содержание 

Затем прямым или обратным титрованием стандартным раствором в отдельной порции исследуемого раствора определяют содержание в смеси  :
:

Зная суммарное содержание  и содержание
и содержание  , рассчитывают содержание
, рассчитывают содержание  .
.
Иногда для анализа сложной смеси комбинируют разные приемы титрования. Например, анализ смеси бензоилхлорида и нафталина основан на использовании следующей реакции с морфолином:

Избыток морфолина  обратно оттитровывают уксуснокислым раствором хлорной кислоты. Хлористоводородную кислоту (Е), образующуюся в эквивалентном количестве по отношению содержащегося в растворе определяемого вещества А, оттитровывают стандартным раствором едкого натра или солями серебра.
обратно оттитровывают уксуснокислым раствором хлорной кислоты. Хлористоводородную кислоту (Е), образующуюся в эквивалентном количестве по отношению содержащегося в растворе определяемого вещества А, оттитровывают стандартным раствором едкого натра или солями серебра.
Нафталин осаждают пикриновой кислотой в виде пикрата, образовавшийся пикрат восстанавливают соединениями титана (III) и затем избыток восстановителя обратно оттитровывают солями железа (III).
Реверсивное титрование. Во многих случаях с целью получения более надежных данных проводят так называемое реверсивное титрование. При реверсивном титровании раствором определяемого вещества титруют стандартный раствор реагента. Поясним это двумя примерами.
Определение азотистой кислоты и нитритов, основанное на взаимодействии их с перманганатом калия в кислой среде, проводят не прямым методом титрования анализируемого раствора стандартным раствором перманганата, а предпочтительно реверсивным методом, титруя кислый раствор перманганата калия анализируемым раствором. Такой способ титрования дает возможность предотвратить разложение азотистой кислоты и окисление ее кислородом воздуха. Благодаря этому результаты анализа оказываются более точными, чем при использовании прямого метода титрования.
Другим примером может служить реверсивный метод титрования раствором определяемых солей ртути (II) стандартного раствора иодида калия.
В начале титрования, когда в растворе находится много иодида и мало ионов ртути, протекает реакция:

а в конце титрования при эквивалентном содержании  :
:

Понятие «реверсивное» титрование не следует отождествлять с понятием «обратное титрование», поскольку принципы их различны.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ
- ВВЕДЕНИЕ
- § 1. Понятие о количественном анализе
- § 2. Классификация методов количественного анализа
- § 3. Характеристика методов количественного анализа
- § 4. Анализ больших и малых количеств вещества
- § 5. Отбор средней пробы
- § 6. Подготовка вещества для взвешивания
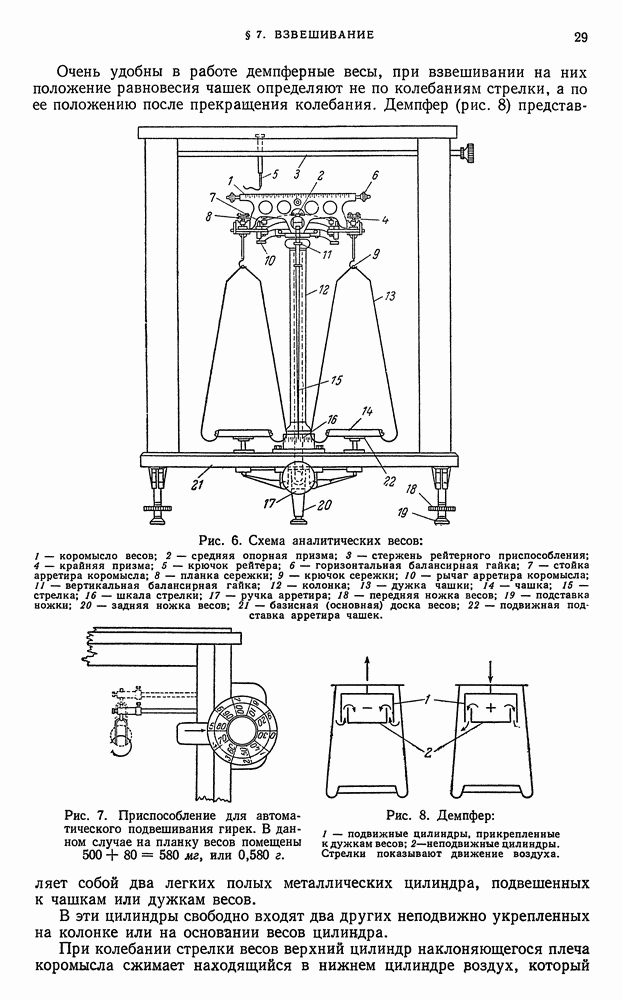
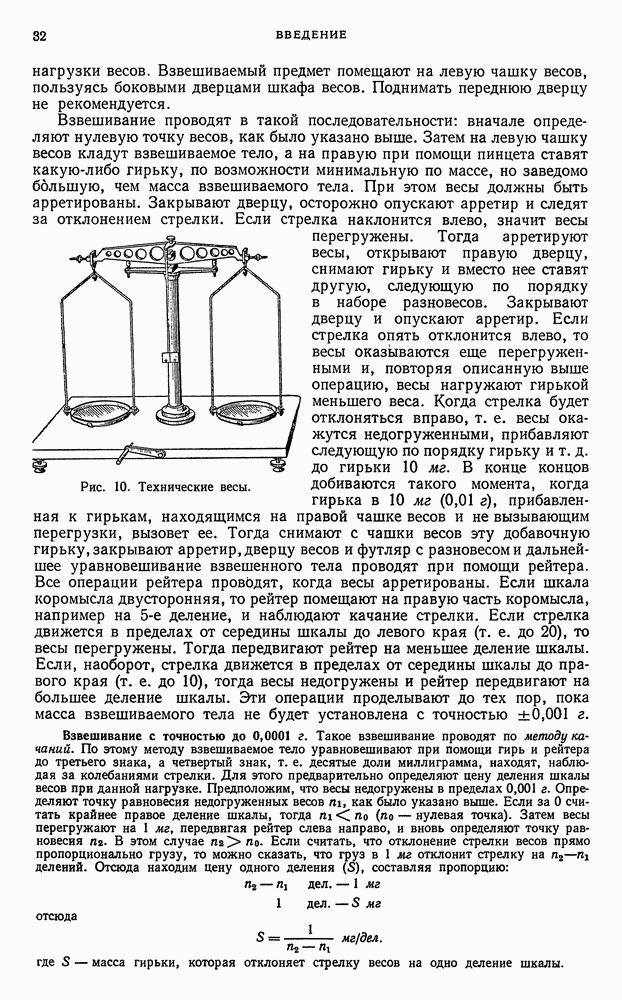
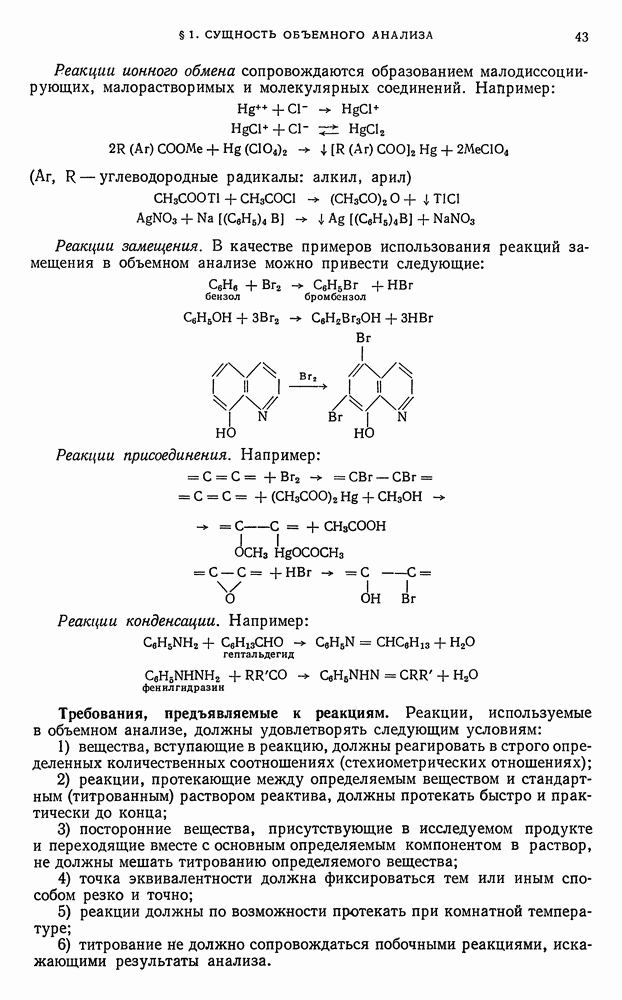
- § 7. Взвешивание
- § 8. Техника взвешивания на аналитических весах
- § 9. Правила обращения с аналитическими весами
- § 10. Приготовление раствора для анализа
- § 11. Запись результатов анализа
- Часть первая. Объемный анализ
- § 1. Сущность объемного анализа
- § 2. Общее уравнение реакции титрования и выводы из него
- Б. ТЕХНИКА ХИМИЧЕСКОГО ЭКСПЕРИМЕНТА В ОБЪЕМНОМ АНАЛИЗЕ
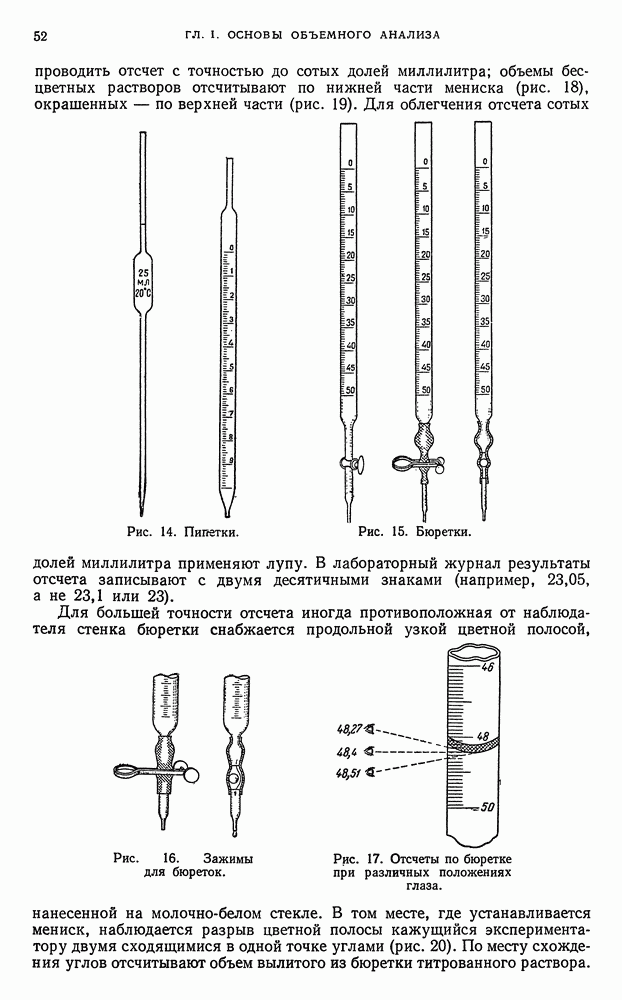
- § 3. Измерение объемов растворов
- § 4. Посуда, применяемая для измерения объемов растворов
- § 5. Работа с мерными колбами
- § 6. Работа с пипетками
- § 7. Работа с бюретками
- § 8. Приготовление стандартных растворов
- В. ВЫЧИСЛЕНИЯ В ОБЪЕМНОМ АНАЛИЗЕ
- § 9. Концентрация растворов и способы ее выражения
- § 10. Способы вычисления в объемном анализе
- § 11. Связь между точностью измерений и точностью вычислений
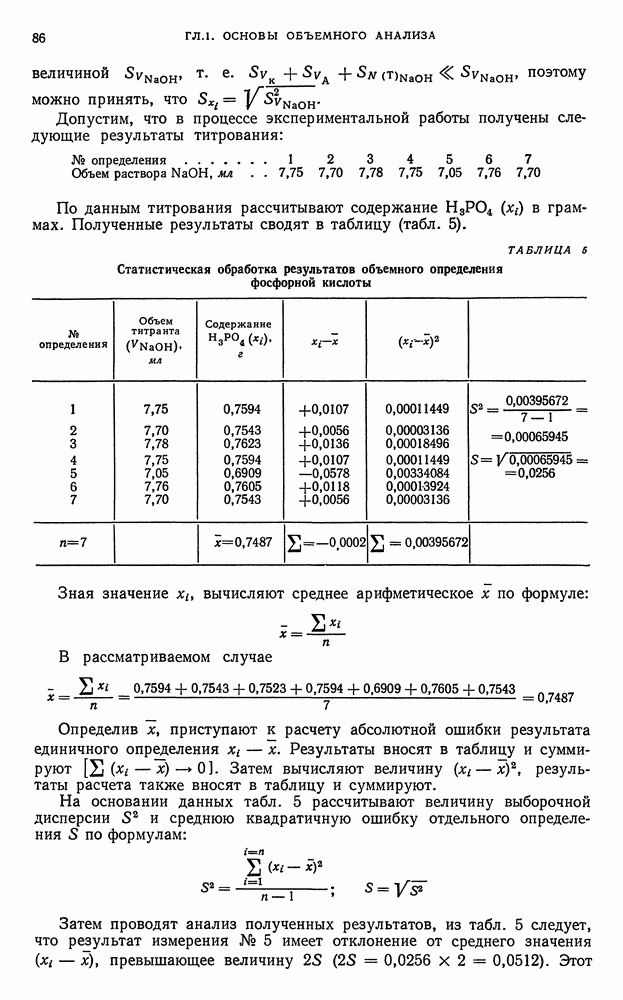
- § 12. Краткие сведения о статистической обработке экспериментальных данных
- Г. ПОЛУМИКРООБЪЕМНЫЙ МЕТОД АНАЛИЗА
- § 13. Понятие о полумикрообъемном анализе
- § 14. Особенности техники измерения объемов растворов в полумикрометоде
- Д. БЕЗБЮРЕТОЧНЫЕ МЕТОДЫ ТИТРОВАНИЯ
- § 15. Понятие о безбюреточных методах титрования
- § 16. Классификация методов безбюреточного титрования
- Е. АВТОМАТИЧЕСКИЕ МЕТОДЫ
- § 17. Химико-аналитический контроль производства
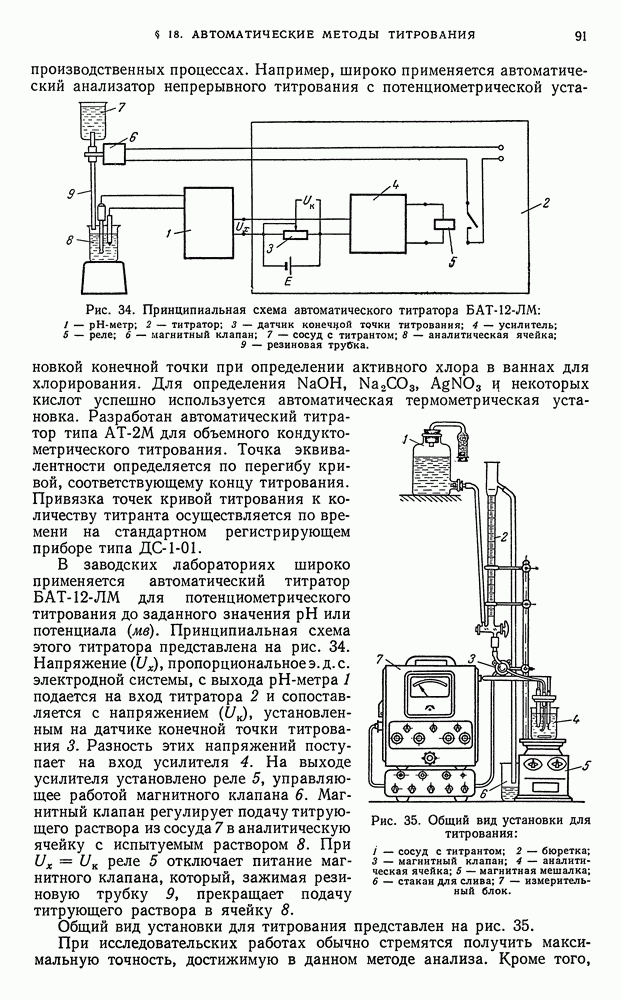
- § 18. Автоматические методы титрования
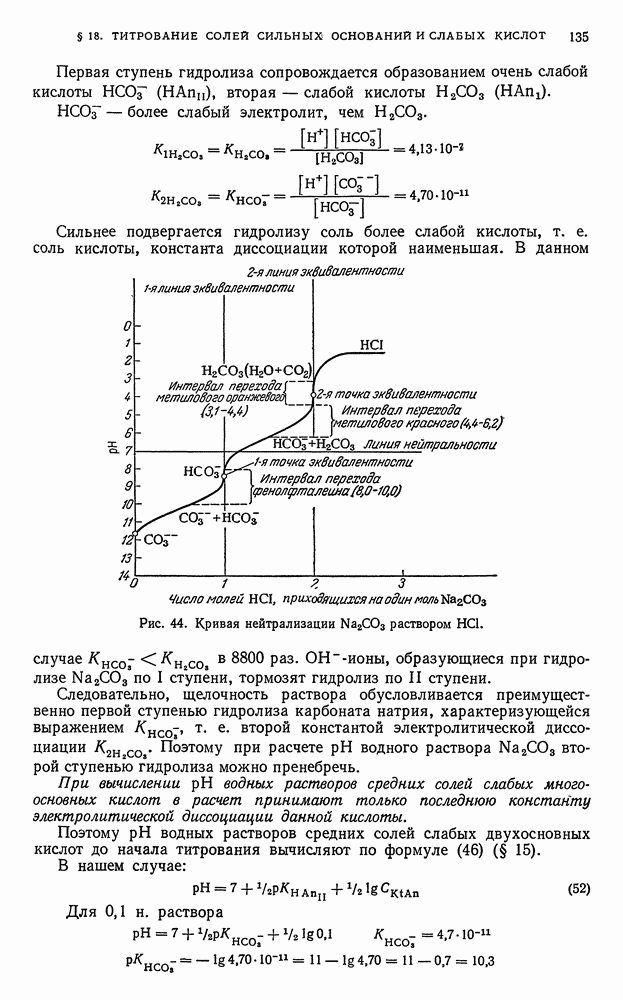
- ГЛАВА II. МЕТОДЫ НЕЙТРАЛИЗАЦИИ, ИЛИ МЕТОДЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
- § 1. Характеристика метода
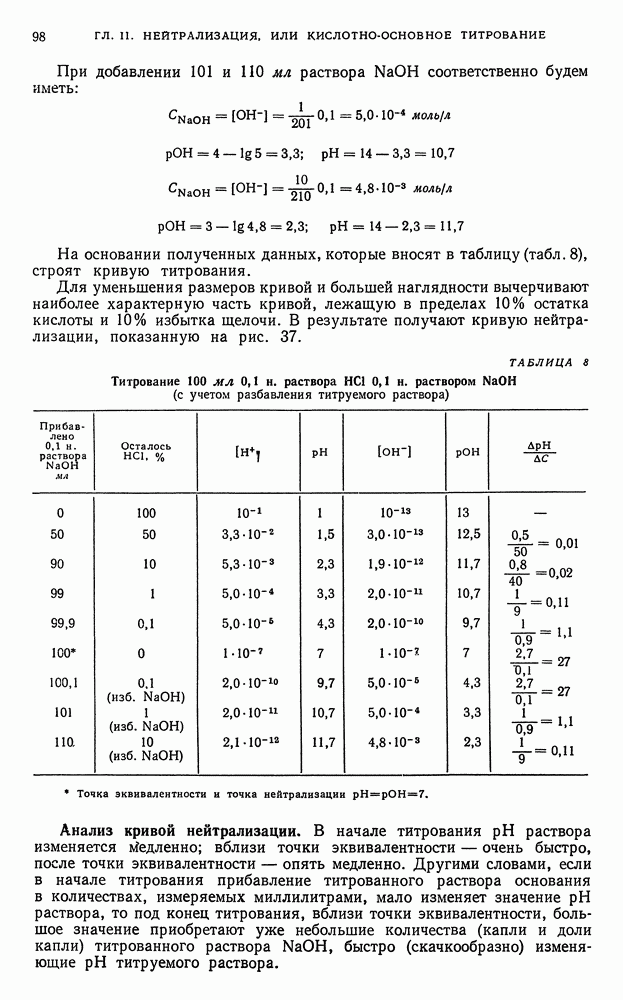
- § 2. Установление точки эквивалентности
- § 3. Графический метод изображения процесса нейтрализации
- § 4. Вычисление концентрации ионов водорода в водных растворах сильных кислот и оснований
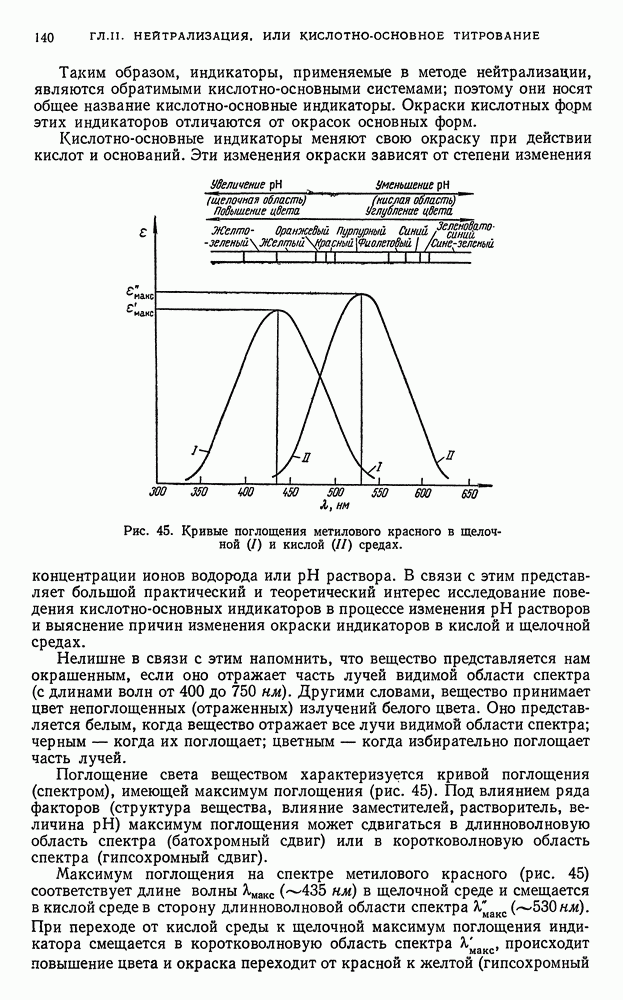
- § 5. Вычисление активности ионов водорода в водных растворах сильных кислот и оснований
- § 6. Титрование сильной кислоты сильным основанием
- § 7. Вычисление концентрации ионов водорода в растворах слабых кислот и оснований
- § 8. Вычисление активности ионов водорода в водных растворах слабых кислот и оснований
- § 9. Равновесия в водных буферных растворах слабых кислот в присутствии солей этих кислот
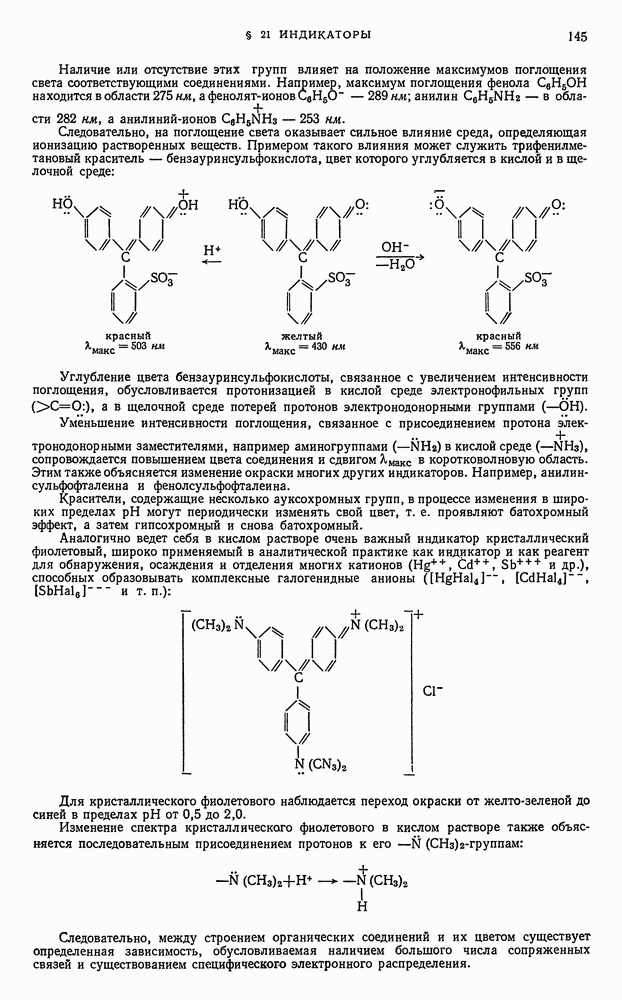
- § 10. Равновесия в водных буферных растворах слабых оснований в присутствии солей этих оснований
- § 11. Вычисление концентрации ионов водорода в водных буферных растворах
- § 12. Вычисление активности ионов водорода в водных буферных растворах
- § 13. Вычисление концентрации ионов водорода и степени гидролиза в водных растворах гидролизующихся бинарных солей
- § 14. Вычисление активности ионов водорода в водных растворах гидролизующихся бинарных солей
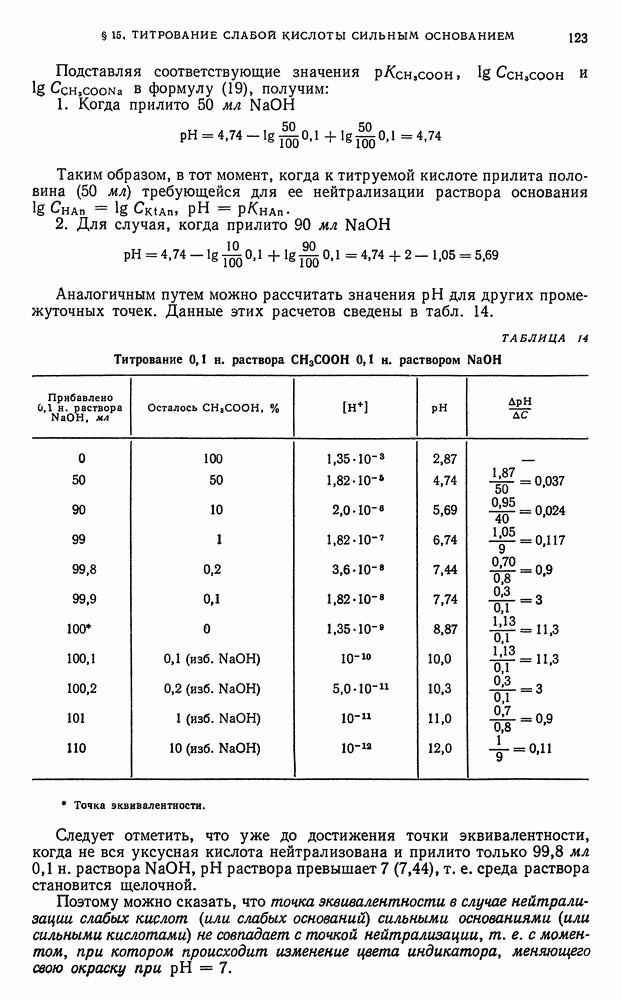
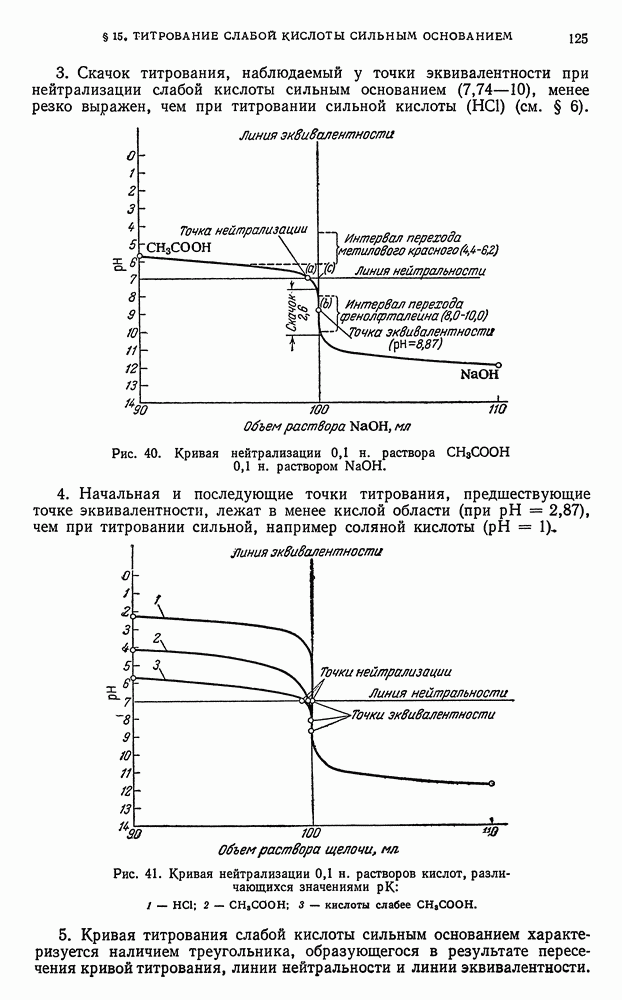
- § 15. Титрование слабой кислоты сильным основанием
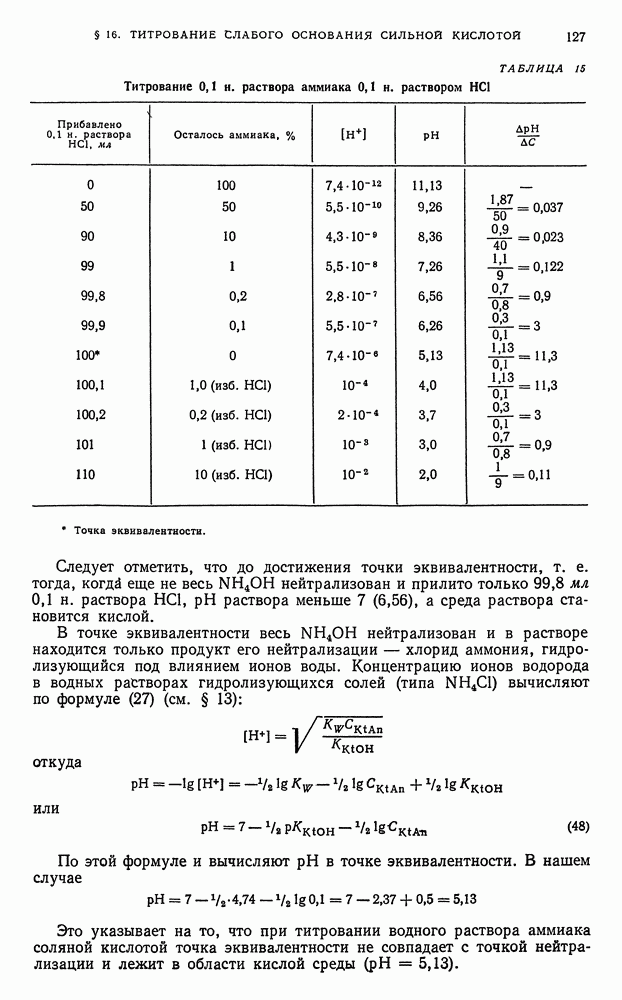
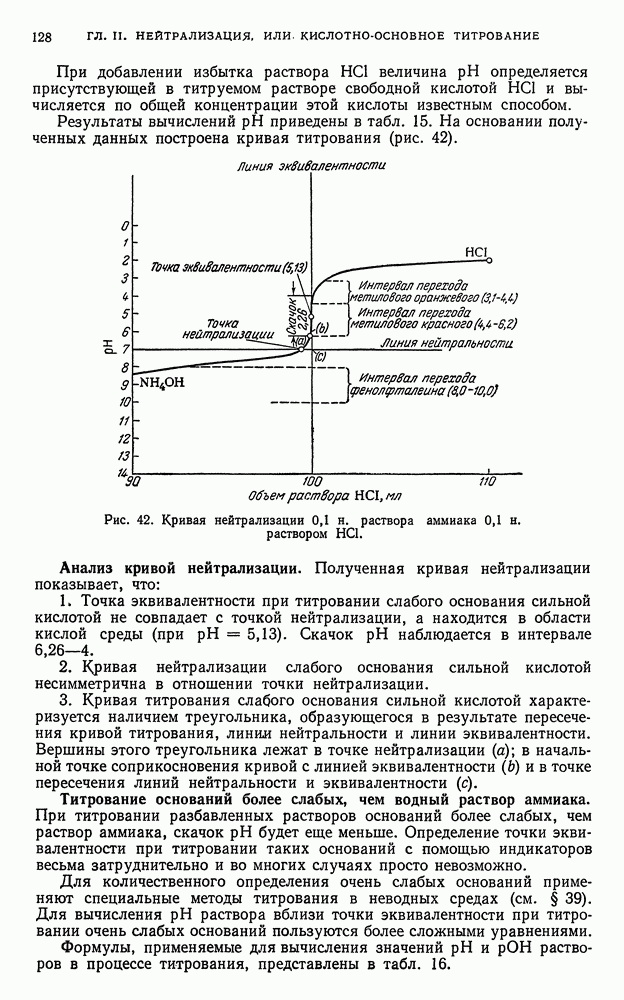
- § 16. Титрование слабого основания сильной кислотой
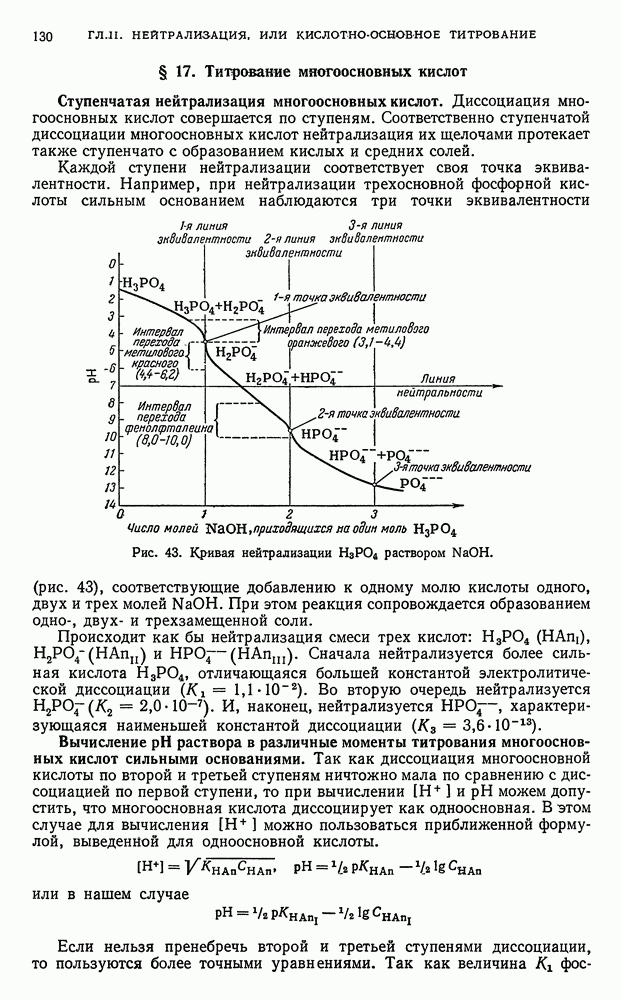
- § 17. Титрование многоосновных кислот
- § 18. Титрование солей, образованных катионами сильных оснований и анионами слабых многоосновных кислот
- § 19. Изменение активности и показателя активности ионов водорода в процессе титрования водных растворов кислот и оснований
- § 20. Выводы, вытекающие из рассмотрения кривых нейтрализации
- § 21. Индикаторы
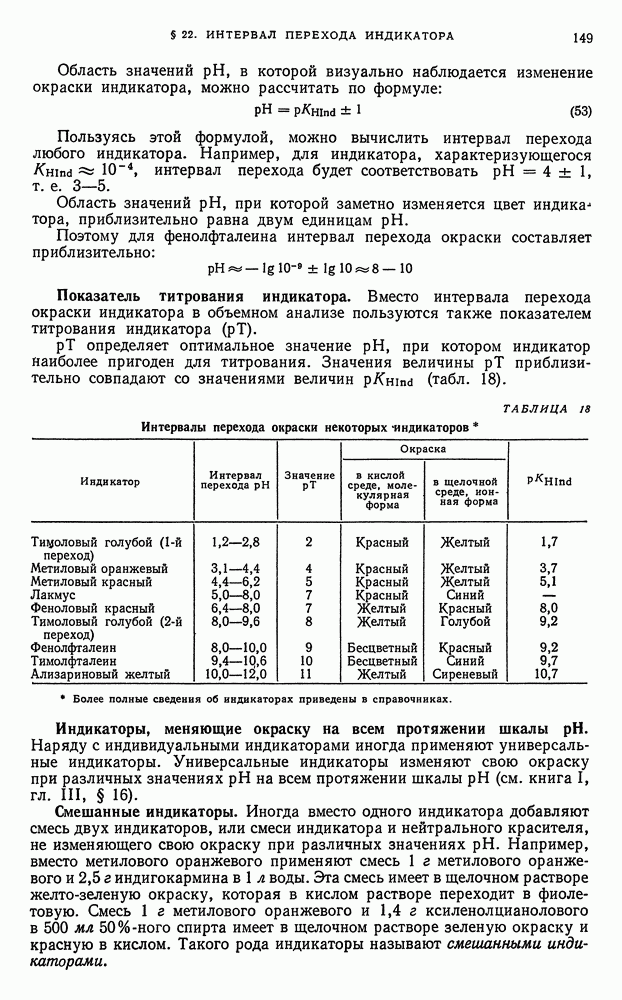
- § 22. Интервал перехода индикатора
- § 23. Выбор индикатора
- § 24. Ошибки титрования
- Б. ПРАКТИЧЕСКАЯ ЧАСТЬ
- § 25. Организация рабочего места
- § 26. Приготовление стандартных (титрованных) растворов
- § 27. Приготовление 0,1 н. раствора хлористоводородной кислоты
- § 28. Установка титра 0,1 н. раствора хлористоводородной кислоты
- § 29. Приготовление 0,1 н. раствора едкого натра
- § 30. Установка титра 0,1 н. раствора едкого натра
- § 31. Определение карбонатов
- § 32. Определение содержания H2SO4 в технической серной кислоте
- § 33. Определение содержания уксусной кислоты
- § 34. Определение содержания Na2CO3 и NaOH при их совместном присутствии
- § 35. Определение содержания Na2CO3 и NaHCO3 при их совместном присутствии
- § 36. Определение жесткости воды
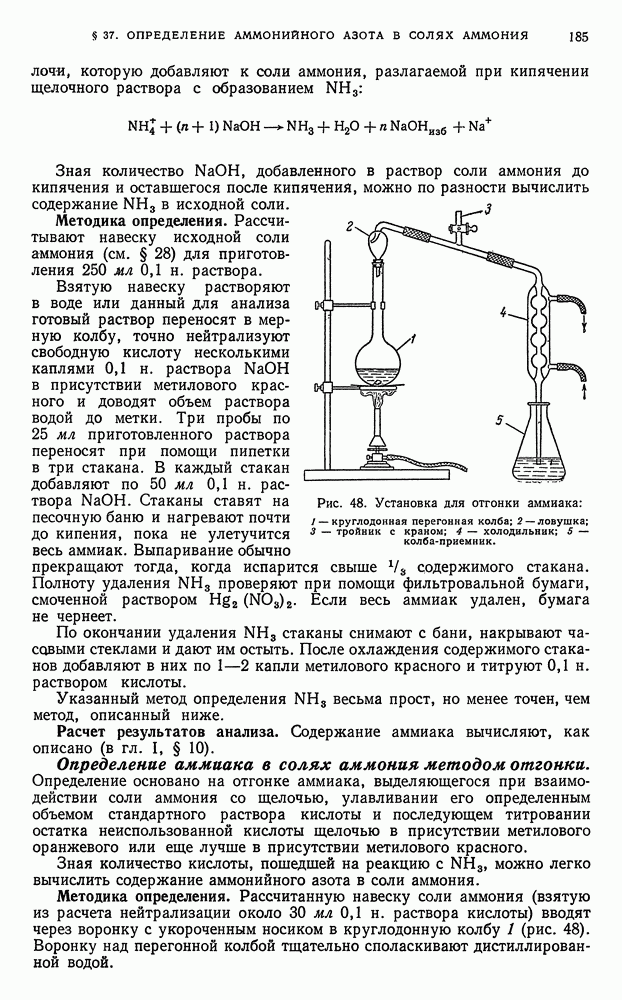
- § 37. Определение аммонийного азота в солях аммония
- § 38. Определение содержания фосфорной кислоты
- В. КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ В НЕВОДНЫХ СРЕДАХ
- § 39. Неводные растворы
- § 40. Современные представления о кислотах и основаниях
- § 41. Диссоциация электролитов в неводных растворах
- § 42. Влияние неводных растворителей на силу кислот и оснований
- § 43. Применение закона действия масс к растворам сильных электролитов
- § 44. Титрование кислот и оснований в неводных растворах
- § 45. Методы кислотно-основного титрования в неводных средах
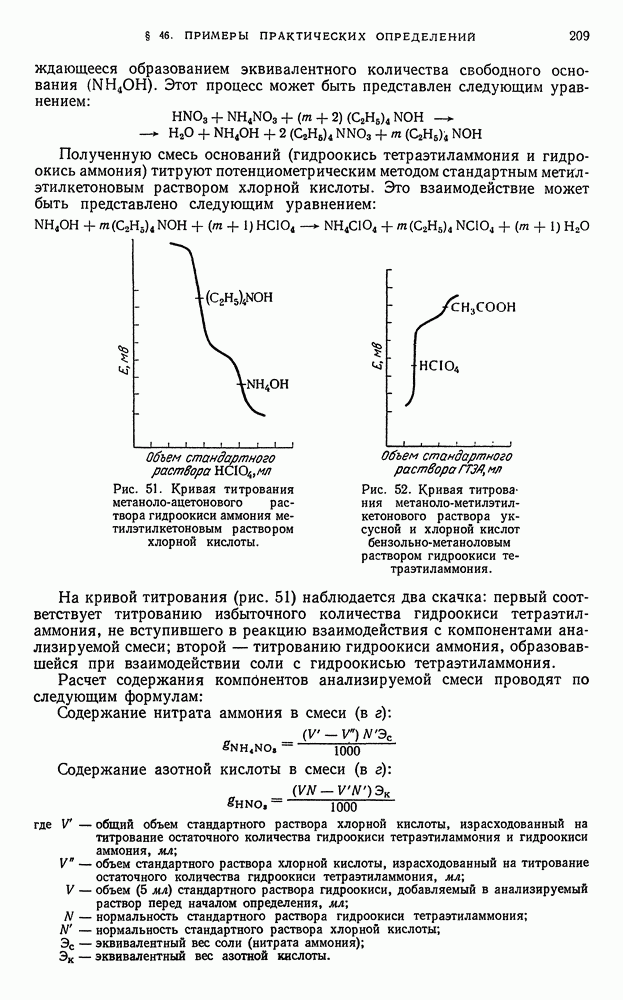
- § 46. Примеры практических определений в неводных растворах
- ГЛАВА III. МЕТОДЫ ОКИСЛЕНИЯ—ВОССТАНОВЛЕНИЯ (ОКСИДИМЕТРИЯ, ОКСРЕДМЕТРИЯ, РЕД-ОКС-МЕТОДЫ)
- § 1. Значение окислительно-восстановительных потенциалов
- § 2. Реакции окисления—восстановления и комплексообразования
- § 3. Примеры окислительно-восстановительного титрования
- § 4. Константы равновесия окислительно-восстановительных реакций
- § 5. Связь между константами равновесия окислительно-восстановительных реакций и нормальными потенциалами
- § 6. Вычисление констант равновесия окислительно-восстановительных реакций
- § 8. Зависимость скорости реакций окисления—восстановления от различных факторов
- § 9. Графический метод изображения процесса окисления—восстановления
- § 10. Фиксирование точки эквивалентности в методах окисления—восстановления
- § 11. Окислительно-восстановительные индикаторы (ред-окс-индикаторы)
- Б. ПЕРМАНГАНАТОМЕТРИЯ
- § 12. Основы перманганатометрии
- § 13. Титрование перманганатом в кислой среде
- § 14. Титрование перманганатом в щелочной среде
- § 15. Приготовление стандартного (титрованного) раствора перманганата калия
- § 16. Установка титра стандартного раствора перманганата калия
- § 17. Установка титра и нормальности раствора перманганата калия по оксалату аммония
- § 18. Вещества, определяемые методом перманганатометрии
- ОПРЕДЕЛЕНИЕ ВОССТАНОВИТЕЛЕЙ
- § 19. Определение щавелевой кислоты и оксалатов
- § 20. Определение соединений железа (II)
- § 21. Определение содержания металлического железа в присутствии окислов железа
- § 22. Определение азотистой кислоты и нитритов
- § 23. Определение содержания марганца (II) в рудах
- ОПРЕДЕЛЕНИЕ ОКИСЛИТЕЛЕЙ
- § 24. Определение соединений железа (III)
- § 25. Определение нитратов
- § 26. Определение бихроматов
- § 27. Определение содержания MnO2 в пиролюзите
- ОПРЕДЕЛЕНИЕ ДРУГИХ ВЕЩЕСТВ
- § 28. Определение ионов кальция
- В. ИОДОМЕТРИЯ
- § 29. Основы иодометрии
- § 30. Методы иодометрического титрования
- § 31. Преимущества и недостатки иодометрического метода
- § 32. Приготовление стандартного (титрованного) раствора тиосульфата и установка его титра
- § 33. Приготовление стандартного (титрованного) раствора иода и установка его титра
- МЕТОДЫ ПРЯМОГО ТИТРОВАНИЯ
- § 34. Определение мышьяка (III)
- МЕТОДЫ ОБРАТНОГО ТИТРОВАНИЯ
- § 35. Определение сульфита натрия
- § 36. Определение содержания формальдегида в формалине
- МЕТОДЫ КОСВЕННОГО ОПРЕДЕЛЕНИЯ
- § 37. Определение ионов меди (II)
- § 38. Определение двуокиси свинца в сурике
- МЕТОД ТИТРОВАНИЯ ЗАМЕСТИТЕЛЕЙ
- § 39. Определение содержания двуокиси марганца в пиролюзите
- МЕТОД ОПРЕДЕЛЕНИЯ КИСЛОТ
- § 40. Определение хлористоводородной кислоты
- § 41. Определение воды по Фишеру
- Г. ПОНЯТИЕ О ДРУГИХ МЕТОДАХ ОКИСЛЕНИЯ — ВОССТАНОВЛЕНИЯ
- § 42. Хроматометрия
- § 43. Определение содержания железа (II)
- § 44. Цериметрия
- § 45. Броматометрия
- § 46. Ванадатометрия
- § 47. Аскорбинометрия
- § 48. Титанометрия
- ГЛАВА IV. МЕТОДЫ ОСАЖДЕНИЯ И КОМПЛЕКСООБРАЗОВАНИЯ
- § 1. Общая характеристика методов
- § 2. Классификация методов осаждения и комплексообразования
- § 3. Применение теории осаждения к объемному анализу
- § 4. Вычисление растворимости электролитов в воде с учетом коэффициентов активности
- § 5. Влияние одноименных ионов на растворимость малорастворимого электролита
- § 6. Солевой эффект
- § 7. Влияние концентрации ионов водорода на растворимость малорастворимых соединений
- § 8. Кривые титрования в методе осаждения
- § 9. Общие выводы, вытекающие из рассмотрения кривых осаждения
- § 10. Адсорбционные явления, наблюдаемые при титровании по методу осаждения
- Б. АРГЕНТОМЕТРИЯ
- § 11. Характеристика метода
- § 12. Приготовление 0,1 н. раствора нитрата серебра
- § 13. Приготовление стандартного раствора хлорида натрия
- § 14. Установка титра 0,1 н. раствора нитрата серебра по точной навеске хлорида натрия
- §15. Определение ионов хлора в техническом хлориде натрия по методу Мора
- § 16. Определение хлоридов по методу Фаянса
- В. РОДАНОМЕТРИЯ
- § 17. Характеристика метода
- § 18. Приготовление 0,1 н. раствора роданида аммония
- § 19. Определение ионов хлора в растворимых хлоридах по методу Фольгарда
- § 20. Определение серебра в сплавах
- Г. МЕРКУРИМЕТРИЯ
- § 21. Характеристика метода
- § 22. Приготовление 0,1 н. раствора нитрата ртути (II)
- § 23. Установка титра раствора нитрата ртути (II)
- § 24. Определение ионов хлора в воде меркуриметрическим методом
- Д. МЕРКУРОМЕТРИЯ
- § 25. Краткая характеристика метода
- Е. КОМПЛЕКСОНОМЕТРИЯ (ХЕЛАТОМЕТРИЯ)
- § 26. Характеристика метода
- § 27. Теоретические основы комплексонометрического титрования
- § 28. Классификация методов комплексонометрического титрования
- § 29. Установка титра раствора комплексона III
- § 30. Определение содержания кальция
- § 31. Определение жесткости воды комплексонометрическим методом
- § 32. Анализ смеси ионов кальция и магния
- § 33. Определение содержания алюминия
- § 34. Раздельное определение ионов кальция и алюминия
- § 35. Раздельное определение ионов алюминия и железа
- Часть вторая. Весовой анализ
- § 1. Сущность весового анализа
- § 2. Классификация методов весового анализа
- § 3. Расчеты в весовом анализе
- Б. ТЕХНИКА ВЕСОВОГО АНАЛИЗА
- § 4. Взятие и растворение навески
- § 5. Техника осаждения
- § 6. Фильтрование и промывание осадков
- § 7. Получение весовой формы
- § 8. Взвешивание весовой формы
- В. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
- § 9. Теоретические основы выделения осадков из растворов с помощью специфических неорганических и органических реактивов
- § 10. Требования, предъявляемые к осадкам
- § 11. Методы повышения точности весовых определений
- § 12. Теоретические обоснования выбора оптимальных условий для весового определения
- Г. ПРАКТИЧЕСКАЯ ЧАСТЬ
- § 13. Определение кристаллизационной воды в BaCl2 2H2O
- § 14. Определение сульфат-ионов или серы
- § 15. Определение ионов железа (III)
- § 16. Определение содержания кальция в карбонате кальция
- § 17. Определение содержания магния
- § 18. Определение ионов хлора в растворимых хлоридах или в хлористоводородной кислоте
- § 19. Анализ силикатов
- § 20. Анализ доломита
- § 21. Анализ бронзы и латуни
- Д. МЕТОДЫ ВЕСОВЫХ ОПРЕДЕЛЕНИЙ, ОСНОВАННЫЕ НА ПРИМЕНЕНИИ ОРГАНИЧЕСКИХ РЕАКТИВОВ
- § 22. Определение никеля
- § 23. Определение алюминия
- Часть третья. Понятие о физических и физико-химических (инструментальных) методах анализа
- § 1. Электрохимические методы
- § 2. Спектральные (оптические) методы
- § 3. Хроматографические методы
- § 4. Радиометрические методы
- § 5. Масс-спектрометрические методы
- ГЛАВА VII ЭЛЕКТРОВЕСОВЫЕ МЕТОДЫ АНАЛИЗА
- § 1. Характеристика методов электроанализа
- § 2. Химические процессы, протекающие при электролизе
- § 3. Методы электроанализа
- § 4. Электровесовой анализ
- § 5. Метод внутреннего электролиза
- § 6. Определение меди в растворе сульфата меди с применением платиновых сетчатых электродов
- § 7. Определение меди и свинца в латуни с применением платиновых сетчатых электродов
- § 8. Определение малых количеств меди методом внутреннего электролиза
- ГЛАВА VIII. ОБЪЕМНЫЕ ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- § 1. Особенности объемных электрохимических методов анализа
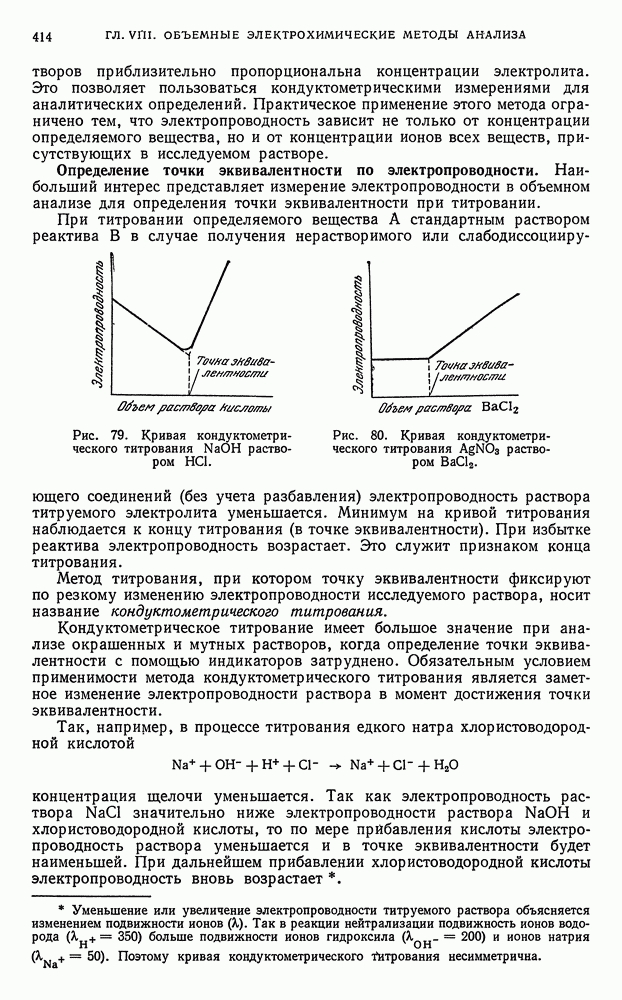
- § 2. Кондуктометрическое титрование
- § 3. Высокочастотное титрование
- § 4. Потенциометрическое титрование
- § 5. Полярографический метод анализа
- § 6. Амперометрическоб титрование
- § 7. Кулонометрическое титрование
- ГЛАВА IX. СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА
- § 1. Понятие об эмиссионном спектральном анализе
- Б. КОЛОРИМЕТРИЯ
- § 2. Особенности колориметрических методов анализа
- § 3. Характеристика колориметрических методов анализа
- В. ОПТИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ ТОЧКИ ЭКВИВАЛЕНТНОСТИ
- § 4. Спектрофотометрическое титрование
- § 5. Фототурбидиметрическое и фотонефелометрическое титрование
- Г. ЛАБОРАТОРНЫЕ РАБОТЫ
- § 6. Определение содержания ионов железа методом колориметрического титрования
- § 7. Определение содержания титана
- ГЛАВА X. МЕТОДЫ РАЗДЕЛЕНИЯ, ВЫДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ ОТДЕЛЬНЫХ КОМПОНЕНТОВ АНАЛИЗИРУЕМЫХ СМЕСЕЙ
- § 1. Определение следов элементов (микропримесей)
- § 2. Метод осаждения малорастворимых соединений
- § 3. Электрохимические методы разделения
- § 4. Метод экстрагирования
- § 5. Методы отгонки летучих соединений
- § 6. Хроматографические методы разделения
- § 7. Метод флотации