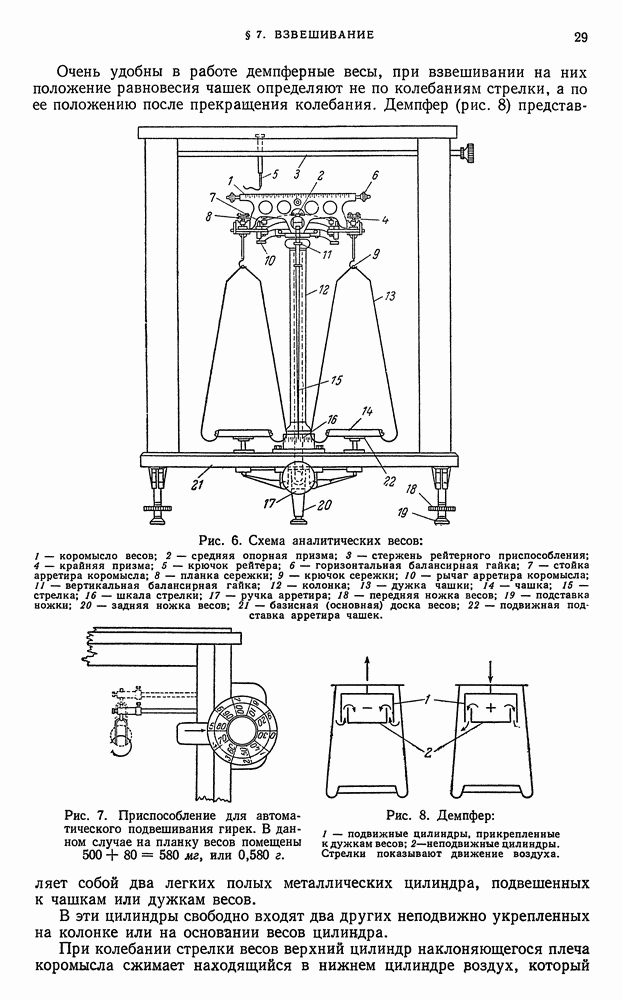
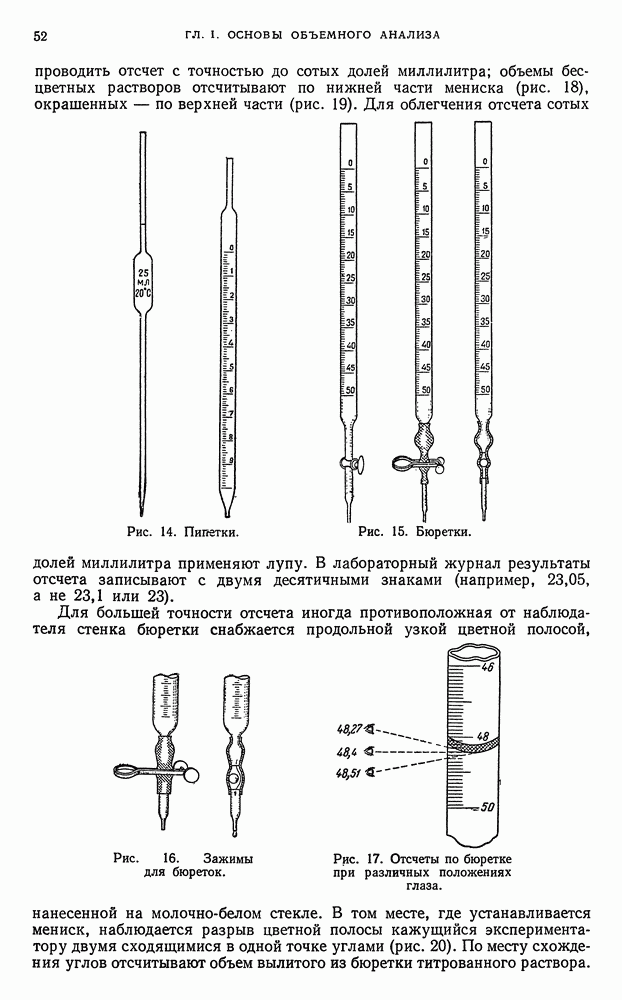
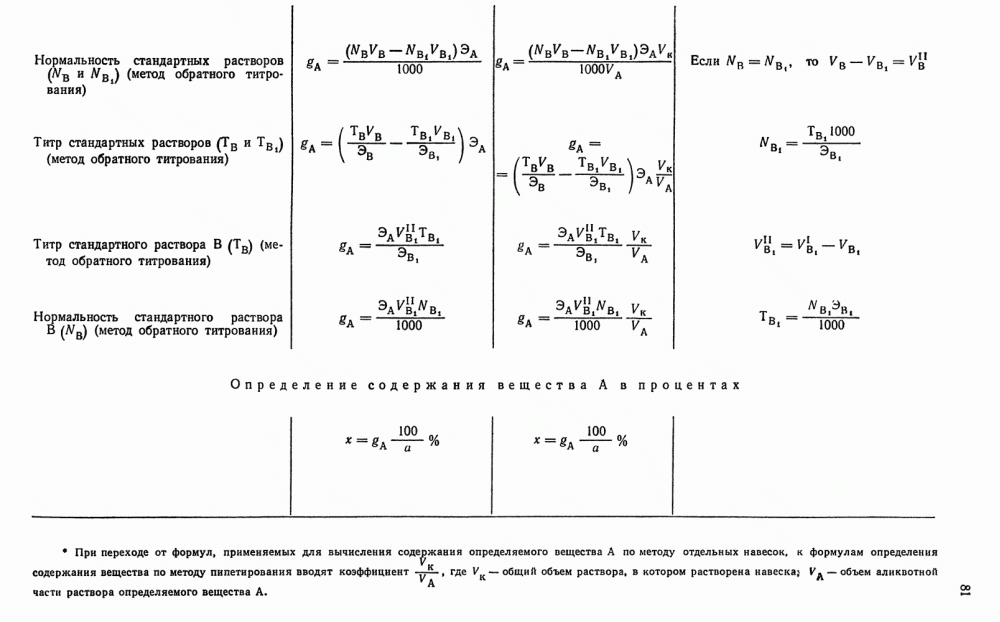
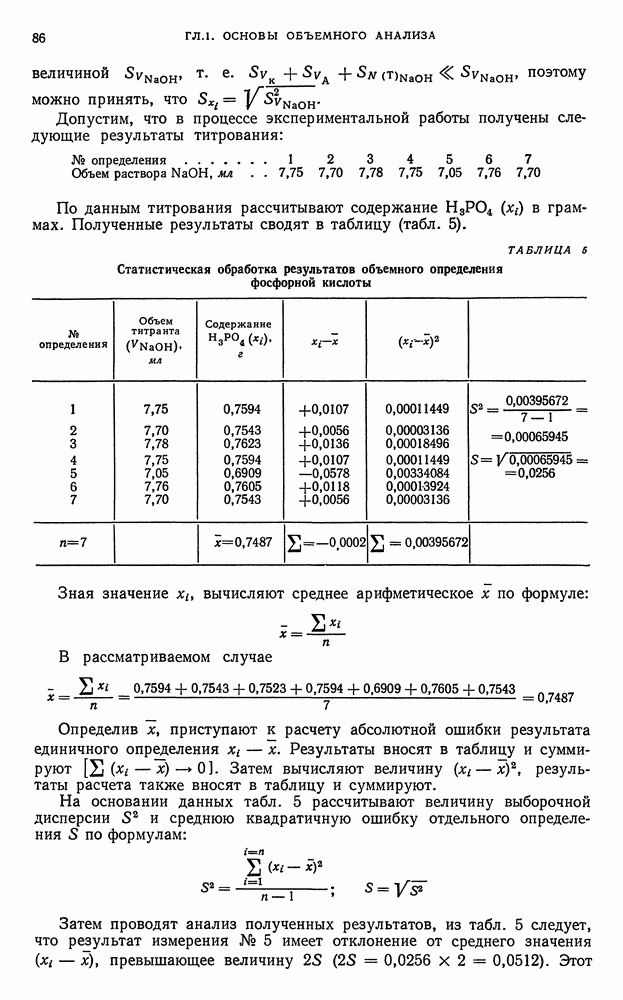
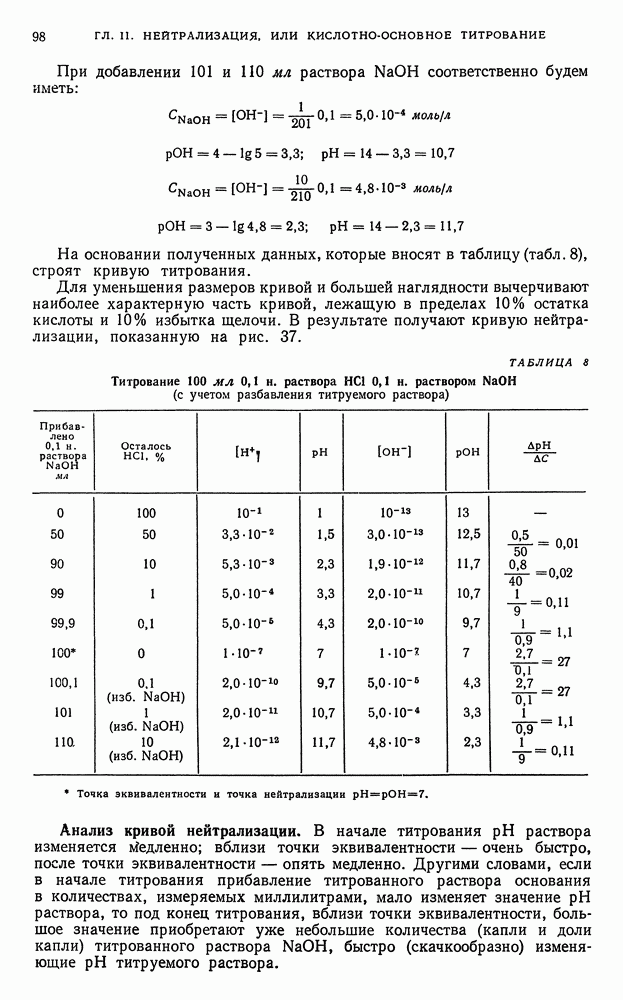
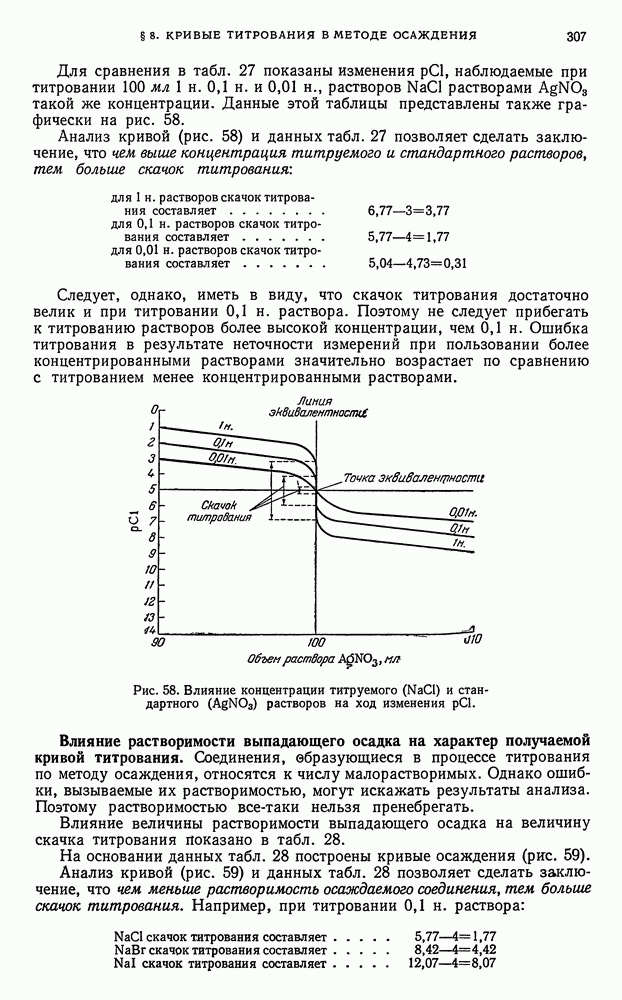
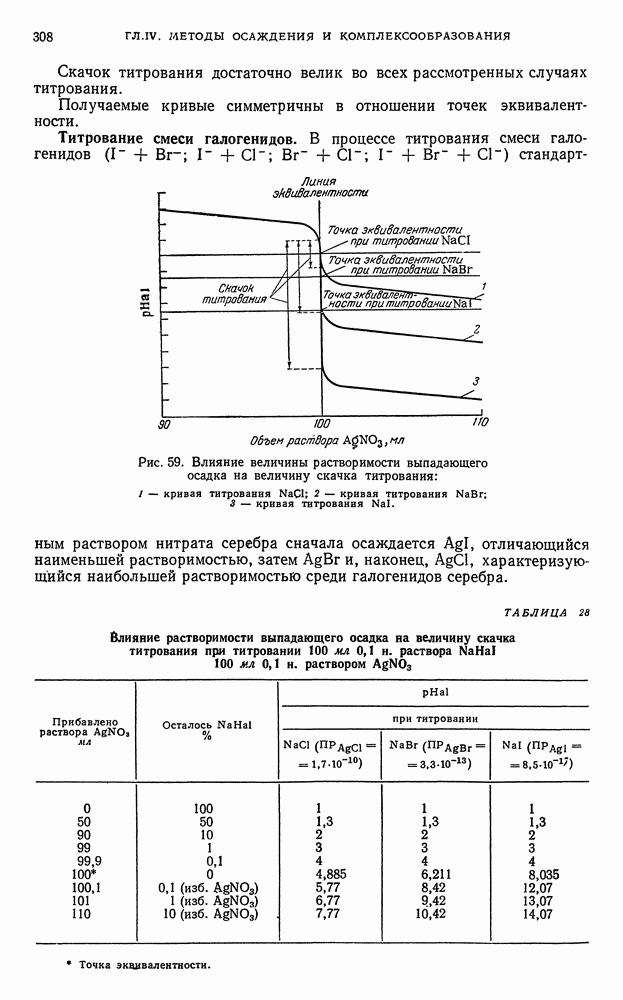
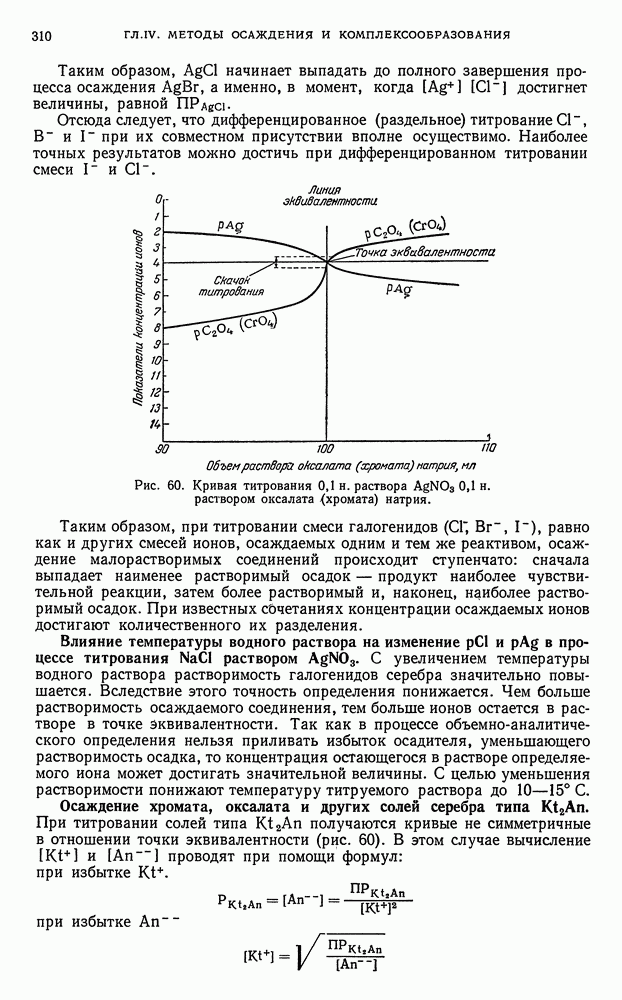
| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
ГЛАВА III. МЕТОДЫ ОКИСЛЕНИЯ—ВОССТАНОВЛЕНИЯ (ОКСИДИМЕТРИЯ, ОКСРЕДМЕТРИЯ, РЕД-ОКС-МЕТОДЫ)
А. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
§ 1. Значение окислительно-восстановительных потенциалов
Понятие об окислительно-восстановительных методах титрования.
Методы окисления—восстановления основаны на использовании реакций окисления—восстановления. Поэтому иногда эти методы называют редокс-методами. В качестве стандартных (титрованных) растворов в методах окисления—восстановления применяют растворы самых разнообразных окислителей и восстановителей:
окислители: перманганат калия, растворы элементарного иода, бихромат калия, гексанитратоцерат (IV) аммония  , бромат калия, иодат калия, йодная кислота
, бромат калия, иодат калия, йодная кислота  , перйодат калия
, перйодат калия  , ванадат аммония
, ванадат аммония  , перкупраты (соединения
, перкупраты (соединения  , например,
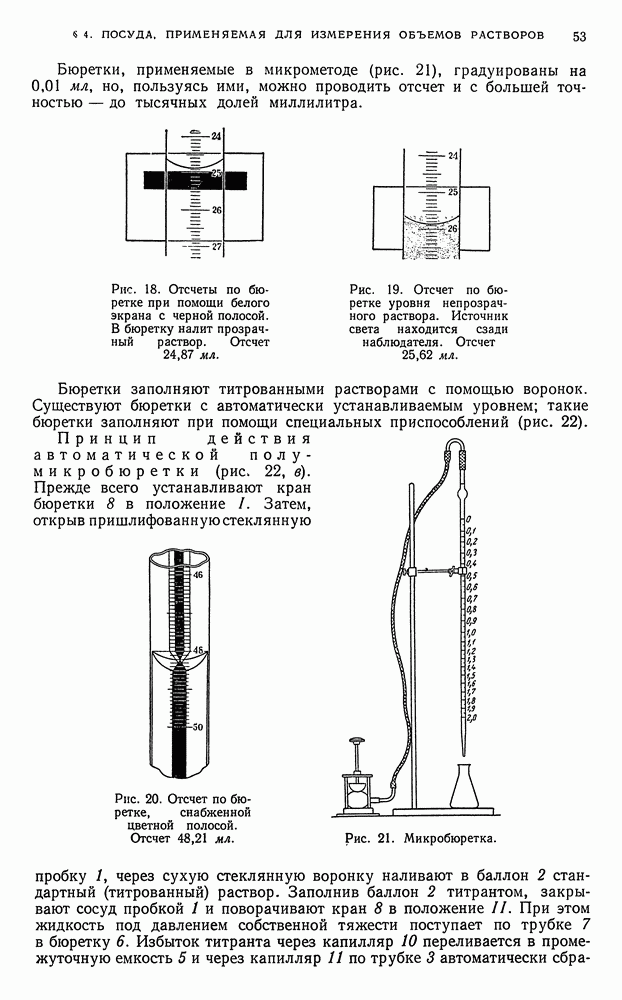
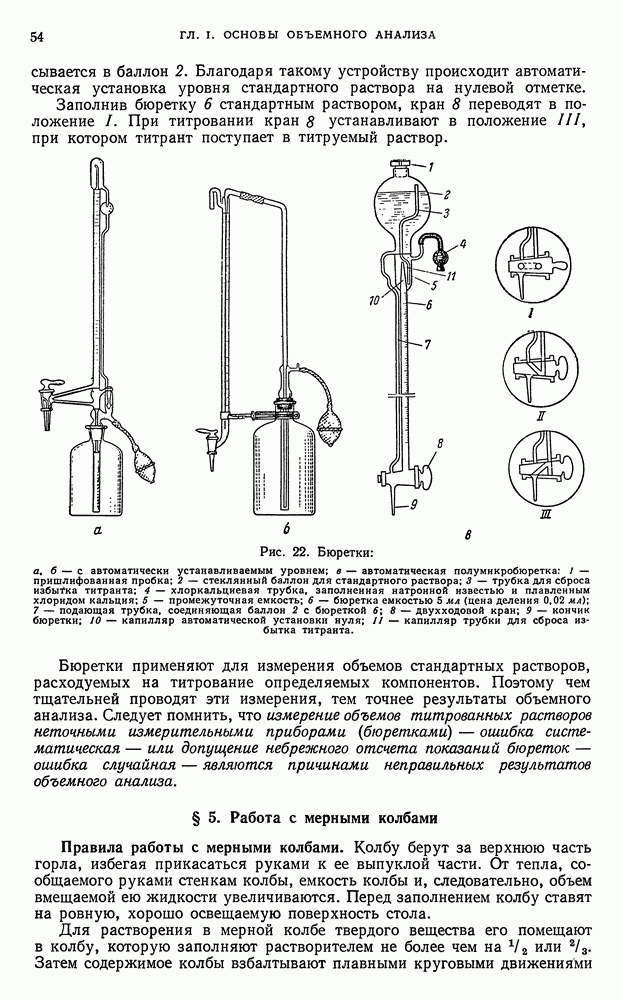
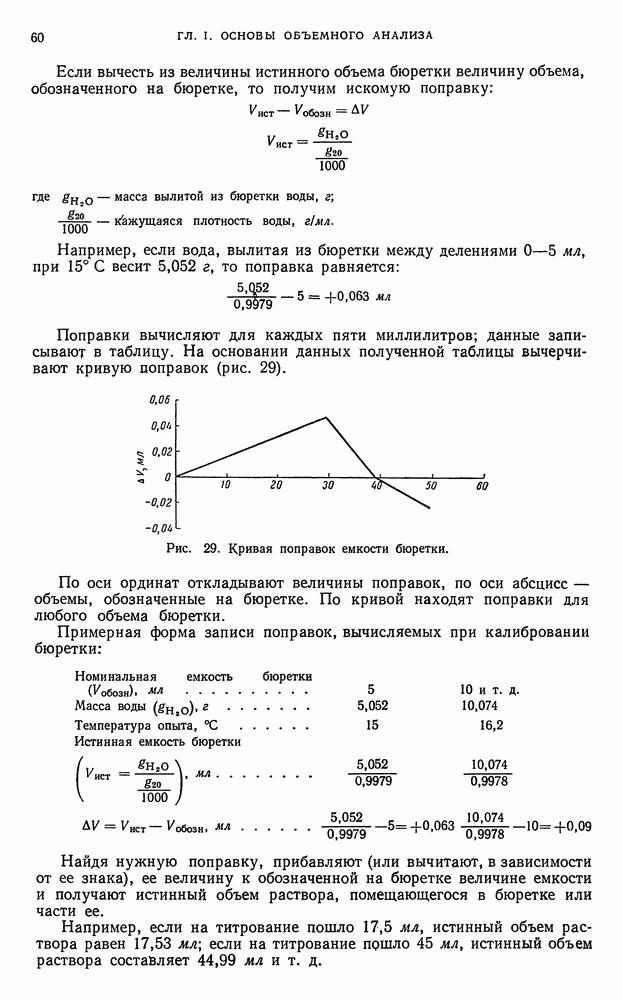
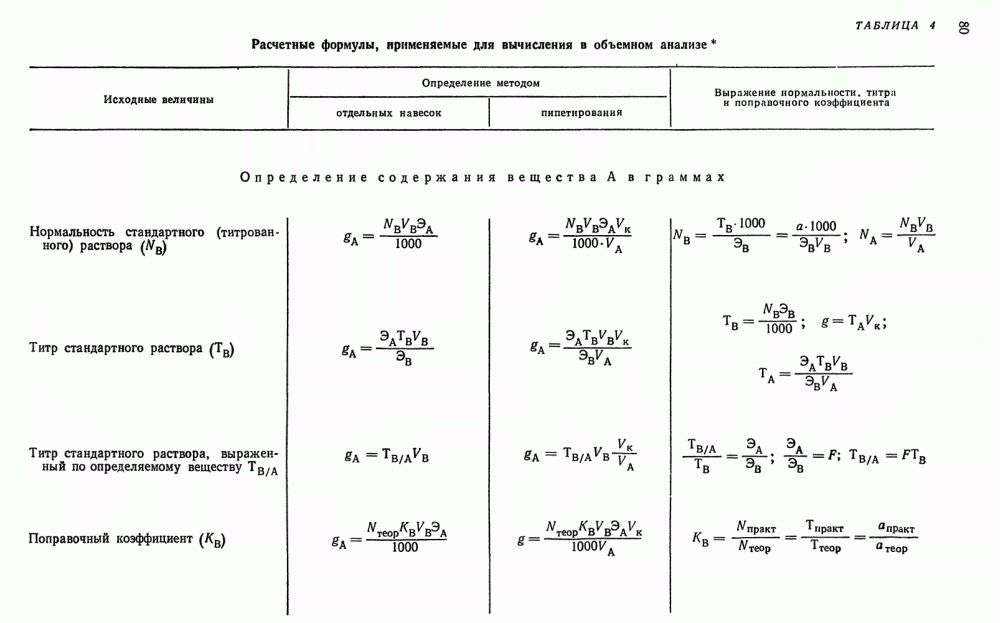
, например,  , соединения свинца (IV) и многие другие;
, соединения свинца (IV) и многие другие;
восстановители: соль Мора  , сульфат железа (II), хлорид титана (III), хлорид олова (II), сульфат хрома (II), аскорбиновая кислота
, сульфат железа (II), хлорид титана (III), хлорид олова (II), сульфат хрома (II), аскорбиновая кислота  , соединения мышьяка (III), хлорид меди (I), гидрохинон
, соединения мышьяка (III), хлорид меди (I), гидрохинон  , тиосульфат натрия
, тиосульфат натрия  , щавелевая кислота, перекись водорода и многие другие.
, щавелевая кислота, перекись водорода и многие другие.
Как правило, восстановители титруют растворами окислителей, а окислители — растворами восстановителей.
Например, соединения низших степеней окисления многих элементов  и т. п.) окисляют в соединения высшей степени окисления
и т. п.) окисляют в соединения высшей степени окисления  и т. д.) титрованием такими сильными окислителями, какими являются перманганат, бихромат и др.:
и т. д.) титрованием такими сильными окислителями, какими являются перманганат, бихромат и др.:

Соединения высших степеней окисления многих элементов восстанавливают в их соединения низших степеней окисления титрованием такими сильными восстановителями, какими являются  и т. п.:
и т. п.:

Очень часто определяемый окислитель предварительно восстанавливают до низшей степени окисления, а затем титруют стандартным раствором другого окислителя:

Иногда определяемый восстановитель предварительно окисляют до высшей степени окисления, а затем титруют стандартным раствором другого восстановителя:

Посредством стандартных растворов окислителей и восстановителей можно определять и вещества, не обладающие окислительными или восстановительными свойствами, но осаждающиеся в виде нерастворимых соединений при действии окислителей или восстановителей. Определение такого рода веществ основано на предварительном их осаждении и последующем титровании ионов, связанных в осадок, или избытка окислителя, или восстановителя, не вошедшего в реакцию:

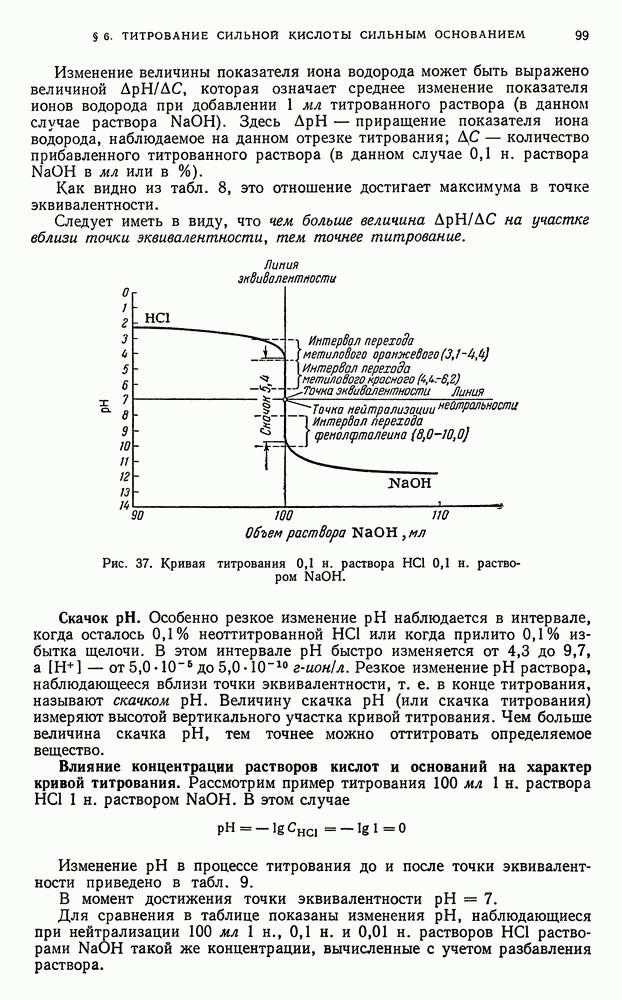
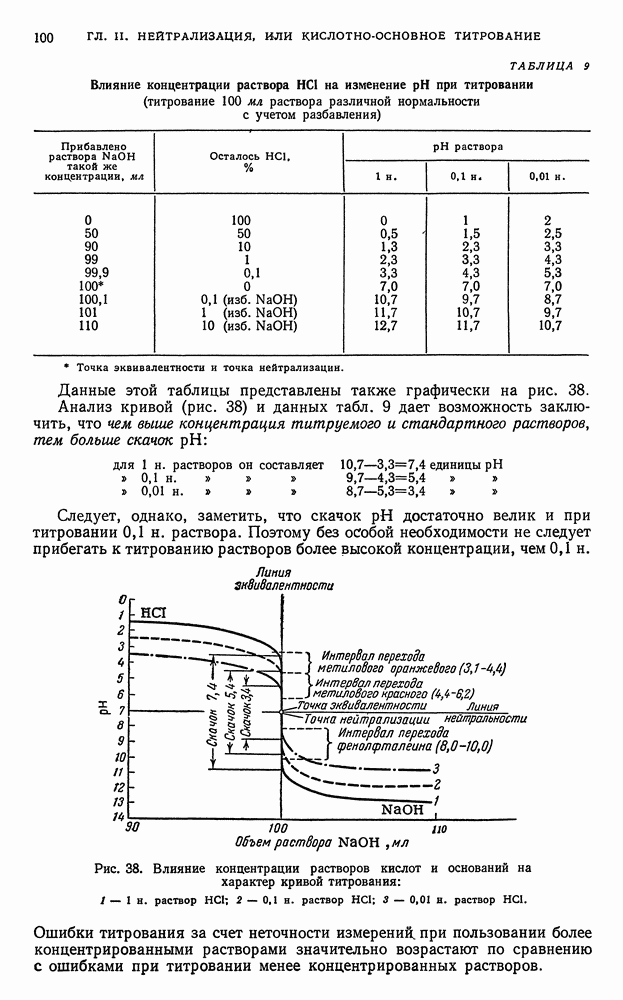
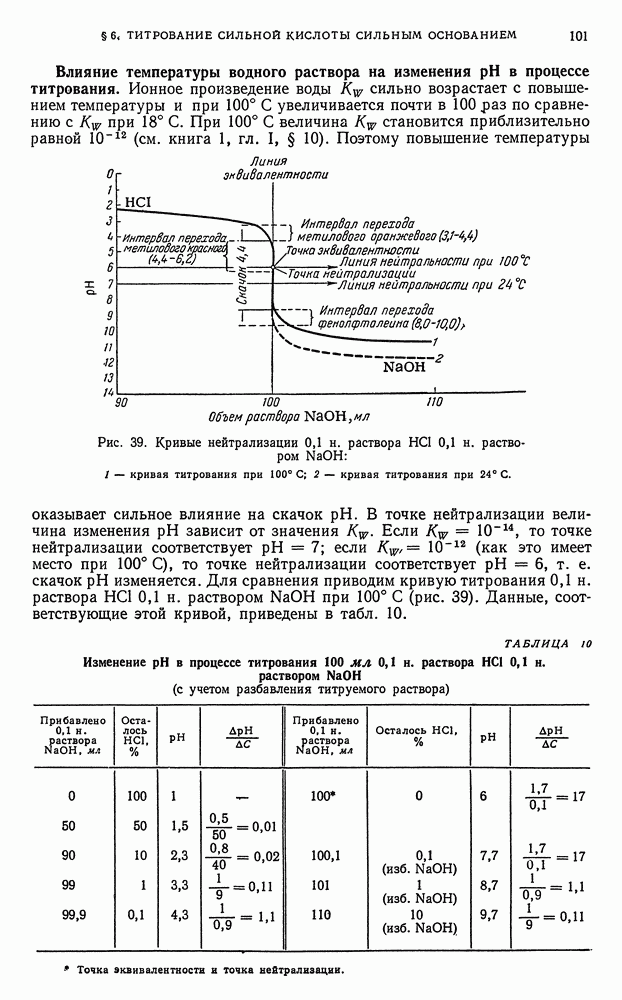
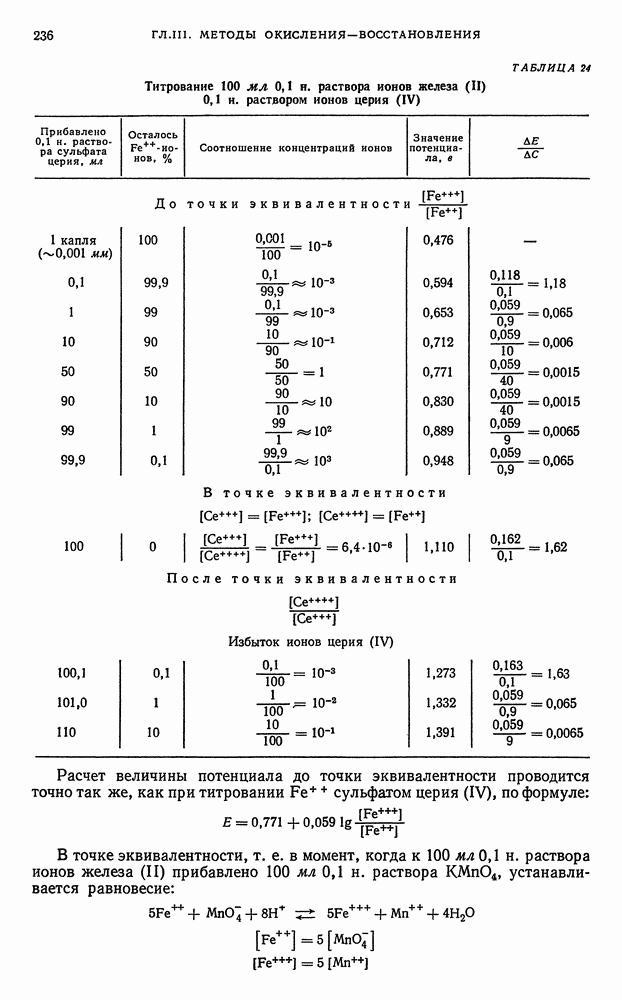
Изменение окислительно-восстановительных потенциалов в процессе титрования. В процессе титрования по методу окисления—восстановления наблюдается изменение окислительно-восстановительных потенциалов взаимодействующих друг с другом систем. Поэтому, прослеживая за изменением ред-окс-потенциалов систем во время титрования, можно судить о протекании процесса окисления—восстановления на различных его этапах.
Как было указано ранее (см. книга 1, гл. II, § 4), количественная зависимость окислительно-восстановительного потенциала системы от концентрации (активности) реагирующих веществ может быть представлена рядом уравнений.
Для простейшей обратимой редокс-системы, выражаемой уравнением

величина окислительно-восстановительного потенциала Е может быть представлена уравнением (1):

Если 

При замене концентраций активностями получаем:

где Е — окислительно-восстановительный потенциал системы, в;  — нормальный окислительно-восстановительный потенциал, в;
— нормальный окислительно-восстановительный потенциал, в;  — газовая константа, равна 8,314 джоуля; Т — абсолютная температура,
— газовая константа, равна 8,314 джоуля; Т — абсолютная температура,  ;
;  — число теряемых или приобретаемых электронов;
— число теряемых или приобретаемых электронов;  — число Фарадея, равное 96 500 кулонам; [Окисл] —концентрация окисленной формы; [Восст] — концентрация восстановенной формы.
— число Фарадея, равное 96 500 кулонам; [Окисл] —концентрация окисленной формы; [Восст] — концентрация восстановенной формы.
Если в реакции принимают участие ионы водорода, то величина Е также зависит и от концентрации ионов водорода:
 (1в)
(1в)
Если заменить константы их числовыми значениями и перейти от натуральных логарифмов к десятичным (коэффициент перевода 2,303), то при  уравнение (1) примет вид:
уравнение (1) примет вид:
 (1г)
(1г)
При замене равновесных концентраций активностями уравнение (1) примет вид:

Для более сложной редокс-системы

потенциал выражают в виде уравнения:

Исследуя уравнения (I — 1д), можно прийти к следующим выводам.
1. Потенциал системы зависит от величины нормального окислительновосстановительного потенциала  , концентрации окислителя
, концентрации окислителя  , восстановителя [Восст], ионов водорода
, восстановителя [Восст], ионов водорода  и от температуры Г.
и от температуры Г.
По мере увеличения  или уменьшения [Восст] Е увеличивается; по мере уменьшения [Окисл] или увеличения [Восст] Е уменьшается.
или уменьшения [Восст] Е увеличивается; по мере уменьшения [Окисл] или увеличения [Восст] Е уменьшается.
Другими словами, изменение отношения концентраций (активности) окислителя и восстановителя приводит к изменению величины окислительно-восстановительного потенциала редокс-системы. В том случае, когда йктивности всех веществ, участвующих в реакции, равны единице, потенциал системы равен стандартному нормальному окислительновосстановительному потенциалу.
2. С повышением температуры (Т) потенциал редокс-системы увеличивается, так как коэффициент  увеличивается по мере возрастания температуры.
увеличивается по мере возрастания температуры.
3. В тех случаях, когда в реакции принимают участие ионы водорода, Е увеличивается по мере возрастания активности ионов водорода.
4. Введением в окислительно-восстановительную систему осадителя, осаждающего в виде нерастворимого соединения окислитель или восстановитель, можно изменить потенциал системы Е. Если при этом в осадок выпадает окисленная форма, то  если выпадет в осадок восстановленная форма, то
если выпадет в осадок восстановленная форма, то  если в равной мере в осадок выпадают и окисленная и восстановленная формы, то отношение концентраций обеих форм равно единице, а
если в равной мере в осадок выпадают и окисленная и восстановленная формы, то отношение концентраций обеих форм равно единице, а  .
.
Таким образом, осаждение, вызывая изменение концентрации ионов окисленной или восстановленной форм, обусловливает изменение окислительно-восстановительного потенциала системы.
Аналогичное явление наблюдается при образовании (вместо осадка) слабодиссоциирующих соединений.
Например, нормальный окислительно-восстановительный потенциал системы, состоящей из  , равен 0,771 в. Если изменить величину
, равен 0,771 в. Если изменить величину  или
или  , то изменится
, то изменится  .
.
Концентрацию (или активность)  можно изменить несколькими способами. Простейший способ — добавление в раствор
можно изменить несколькими способами. Простейший способ — добавление в раствор  или
или  . Другим способом является восстановление
. Другим способом является восстановление  подходящим восстановителем (например,
подходящим восстановителем (например,  ) или окисление
) или окисление  подходящим окислителем (например,
подходящим окислителем (например,  ). Третьим способом может служить добавление комплексующих агентов (например, фторида натрия, фосфорной кислоты, тартратов и т. п.), которые с
). Третьим способом может служить добавление комплексующих агентов (например, фторида натрия, фосфорной кислоты, тартратов и т. п.), которые с  образуют стойкие комплексные ионы. Существуют и другие способы изменения окислительно-восстановительных потенциалов.
образуют стойкие комплексные ионы. Существуют и другие способы изменения окислительно-восстановительных потенциалов.
Изменение величины окислительно-восстановительных потенциалов может привести к изменению направления реакции.
Поясним это на примере. Если к раствору  прибавить
прибавить  , то наблюдается выделение свободного иода:
, то наблюдается выделение свободного иода:

или в ионной форме:

Это означает, что  :
:

Если предварительно к раствору  добавить
добавить  , образующий с
, образующий с  комплексные ионы
комплексные ионы  , то выделения иода не наблюдается, потому что
, то выделения иода не наблюдается, потому что  меньше
меньше  —
—  в.
в.
При известных условиях (при соответствующем изменении потенциала системы  см. табл. 23).
см. табл. 23).  -ионы окисляются элементарным иодом. В этом случае реакцию представляют в виде следующего уравнения:
-ионы окисляются элементарным иодом. В этом случае реакцию представляют в виде следующего уравнения:

т. е. реакция протекает справа налево. Это объясняется тем, что при данных условиях 
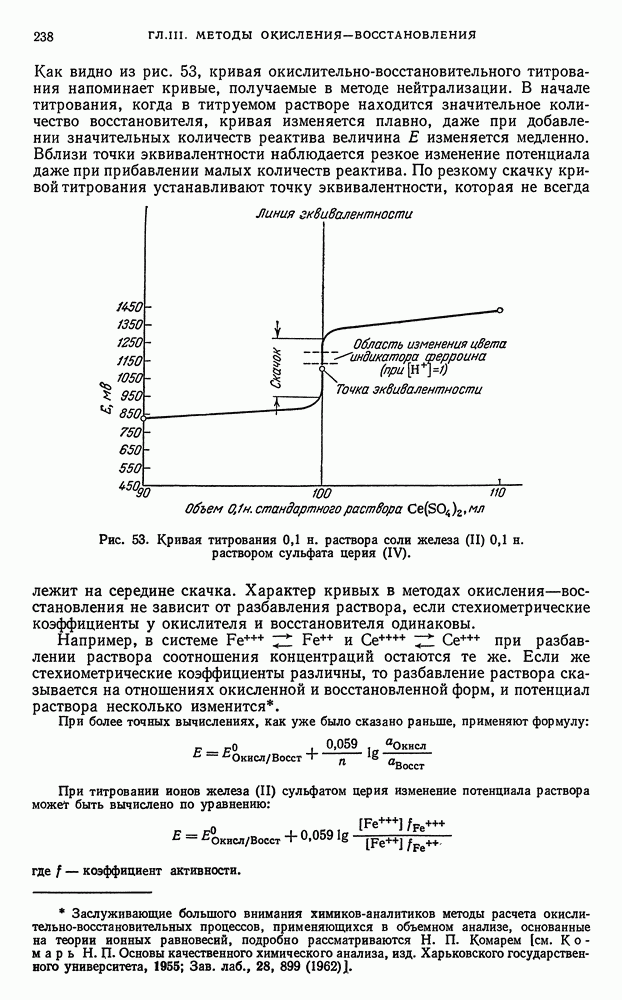
Таким образом, величины окислительно-восстановительных потенциалов можно изменять в достаточно широких пределах, благодаря чему оказывается возможным сдвигать течение реакции в нужном направлении, причем если разность окислительно-восстановительных потенциалов реагирующих между собой систем достаточно большая, то реакция окисления — восстановления количественно протекает до конца и поэтому возможно прямое титрование.
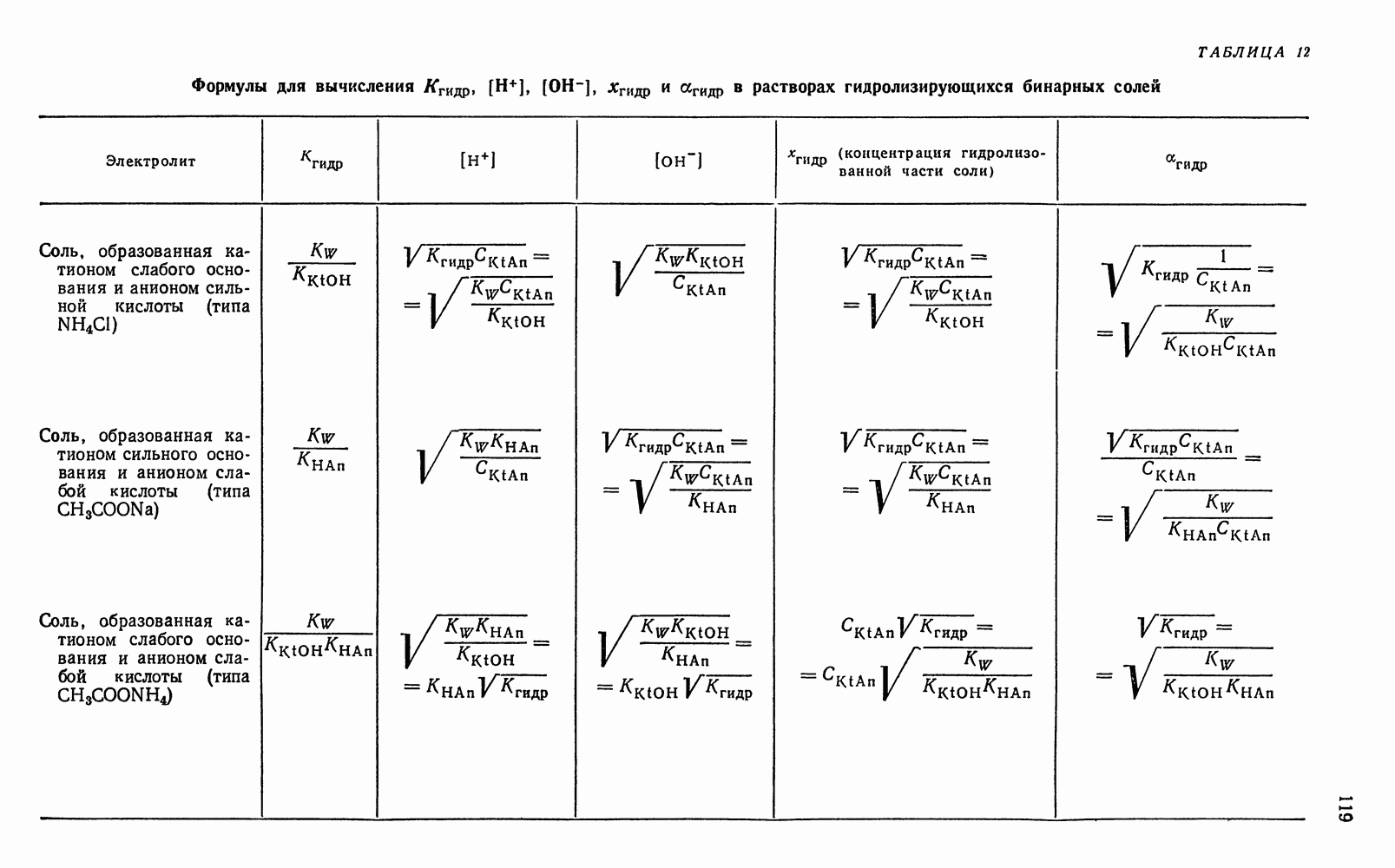
Частные случаи выражения величин окислительно-восстановительных потенциалов редокс-систем. Для некоторых редокс-систем выражение величин окислительно-восстановительных потенциалов могут быть представлены частными уравнениями. Это возможно в тех случаях, когда в процессе окисления—восстановления образуется или участвует растворитель (вода), а одно из реагирующих веществ выпадает в осадок, представляет собой малорастворимый газ или полностью комплексуется, т. е. практически не принимает участие в окислительно-восстановительной реакции.
Например, для редокс-системы, выражаемой уравнением:

согласно уравнению (2):

Двуокись марганца  — твердое вещество и его концентрация
— твердое вещество и его концентрация  или активность
или активность  является величиной постоянной, так как раствор всегда насыщен двуокисью марганца, характеризующейся определенной растворимостью в данной среде. Концентрация воды также является величиной постоянной. Поэтому уравнение (3) можно представить в следующем виде:
является величиной постоянной, так как раствор всегда насыщен двуокисью марганца, характеризующейся определенной растворимостью в данной среде. Концентрация воды также является величиной постоянной. Поэтому уравнение (3) можно представить в следующем виде:

Аналогично для реакции анодного окисления гидроксильных ионов, выражаемой уравнением:

согласно уравнению (2):

или, учитывая, что [02] является постоянной величиной (раствор насыщен малорастворимым в воде кислородом), и концентрация воды также представляет постоянную величину, можно уравнение (5) написать так:

Это означает, что потенциал указанной системы главным образом зависит от концентрации гидроксильных ионов.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ
- ВВЕДЕНИЕ
- § 1. Понятие о количественном анализе
- § 2. Классификация методов количественного анализа
- § 3. Характеристика методов количественного анализа
- § 4. Анализ больших и малых количеств вещества
- § 5. Отбор средней пробы
- § 6. Подготовка вещества для взвешивания
- § 7. Взвешивание
- § 8. Техника взвешивания на аналитических весах
- § 9. Правила обращения с аналитическими весами
- § 10. Приготовление раствора для анализа
- § 11. Запись результатов анализа
- Часть первая. Объемный анализ
- § 1. Сущность объемного анализа
- § 2. Общее уравнение реакции титрования и выводы из него
- Б. ТЕХНИКА ХИМИЧЕСКОГО ЭКСПЕРИМЕНТА В ОБЪЕМНОМ АНАЛИЗЕ
- § 3. Измерение объемов растворов
- § 4. Посуда, применяемая для измерения объемов растворов
- § 5. Работа с мерными колбами
- § 6. Работа с пипетками
- § 7. Работа с бюретками
- § 8. Приготовление стандартных растворов
- В. ВЫЧИСЛЕНИЯ В ОБЪЕМНОМ АНАЛИЗЕ
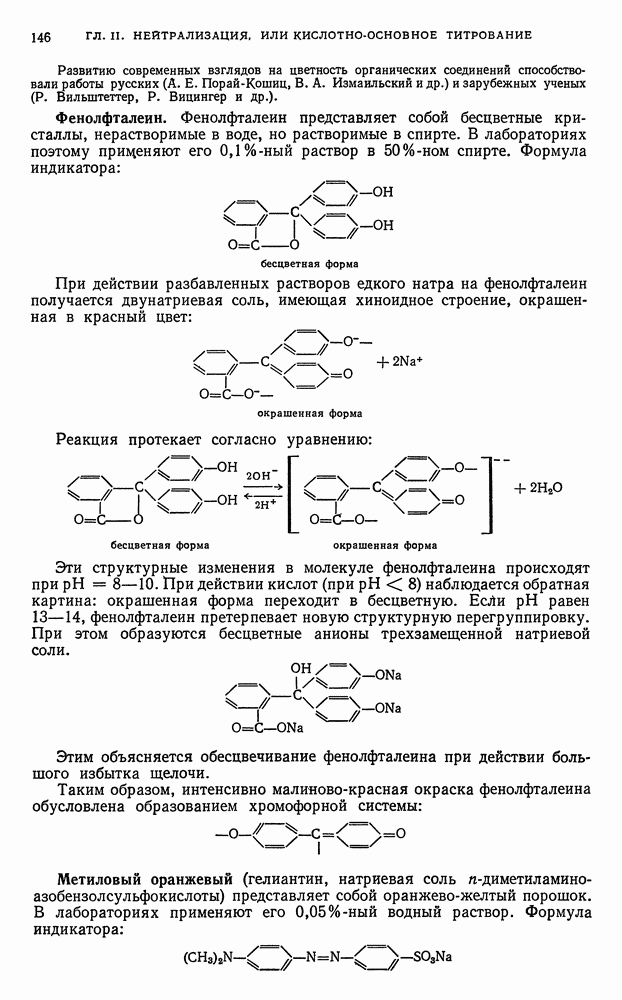
- § 9. Концентрация растворов и способы ее выражения
- § 10. Способы вычисления в объемном анализе
- § 11. Связь между точностью измерений и точностью вычислений
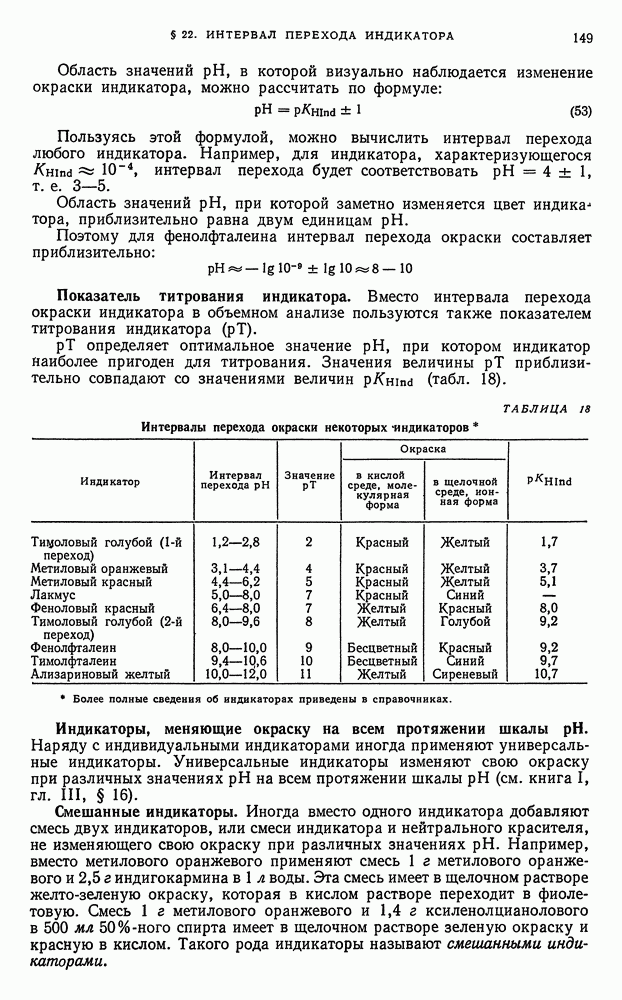
- § 12. Краткие сведения о статистической обработке экспериментальных данных
- Г. ПОЛУМИКРООБЪЕМНЫЙ МЕТОД АНАЛИЗА
- § 13. Понятие о полумикрообъемном анализе
- § 14. Особенности техники измерения объемов растворов в полумикрометоде
- Д. БЕЗБЮРЕТОЧНЫЕ МЕТОДЫ ТИТРОВАНИЯ
- § 15. Понятие о безбюреточных методах титрования
- § 16. Классификация методов безбюреточного титрования
- Е. АВТОМАТИЧЕСКИЕ МЕТОДЫ
- § 17. Химико-аналитический контроль производства
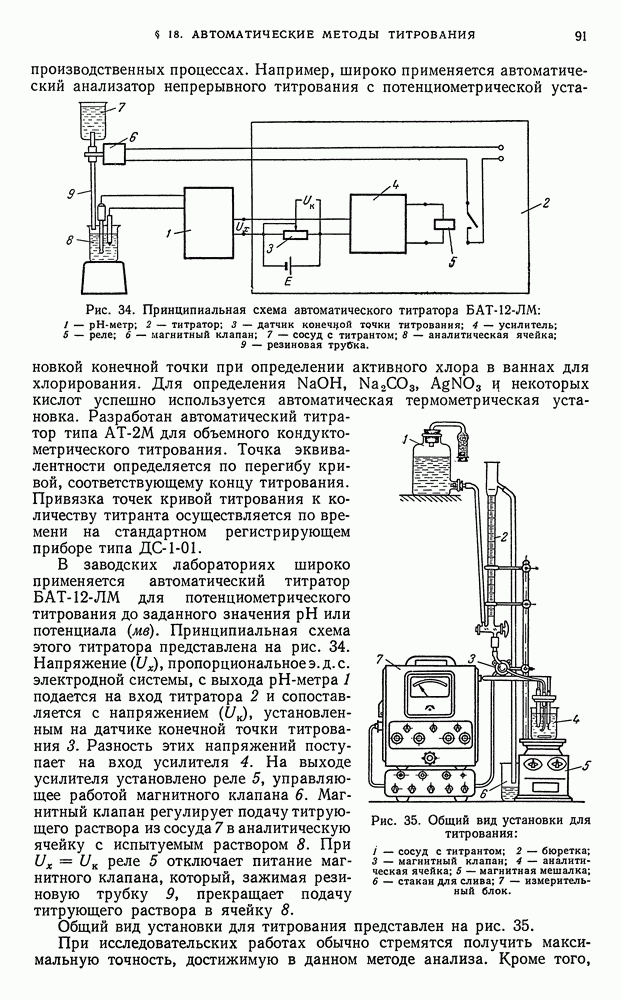
- § 18. Автоматические методы титрования
- ГЛАВА II. МЕТОДЫ НЕЙТРАЛИЗАЦИИ, ИЛИ МЕТОДЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
- § 1. Характеристика метода
- § 2. Установление точки эквивалентности
- § 3. Графический метод изображения процесса нейтрализации
- § 4. Вычисление концентрации ионов водорода в водных растворах сильных кислот и оснований
- § 5. Вычисление активности ионов водорода в водных растворах сильных кислот и оснований
- § 6. Титрование сильной кислоты сильным основанием
- § 7. Вычисление концентрации ионов водорода в растворах слабых кислот и оснований
- § 8. Вычисление активности ионов водорода в водных растворах слабых кислот и оснований
- § 9. Равновесия в водных буферных растворах слабых кислот в присутствии солей этих кислот
- § 10. Равновесия в водных буферных растворах слабых оснований в присутствии солей этих оснований
- § 11. Вычисление концентрации ионов водорода в водных буферных растворах
- § 12. Вычисление активности ионов водорода в водных буферных растворах
- § 13. Вычисление концентрации ионов водорода и степени гидролиза в водных растворах гидролизующихся бинарных солей
- § 14. Вычисление активности ионов водорода в водных растворах гидролизующихся бинарных солей
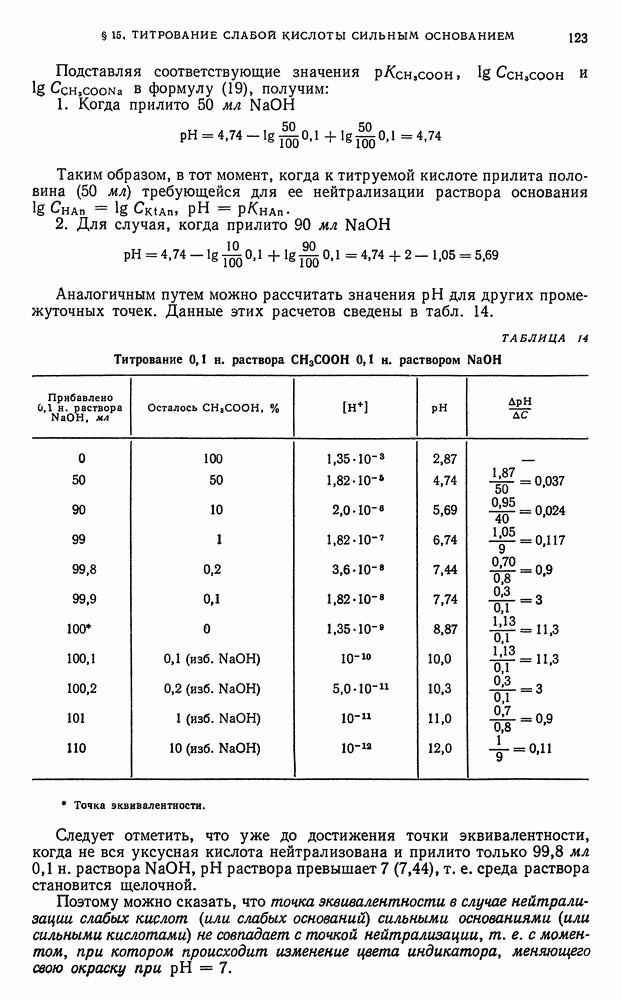
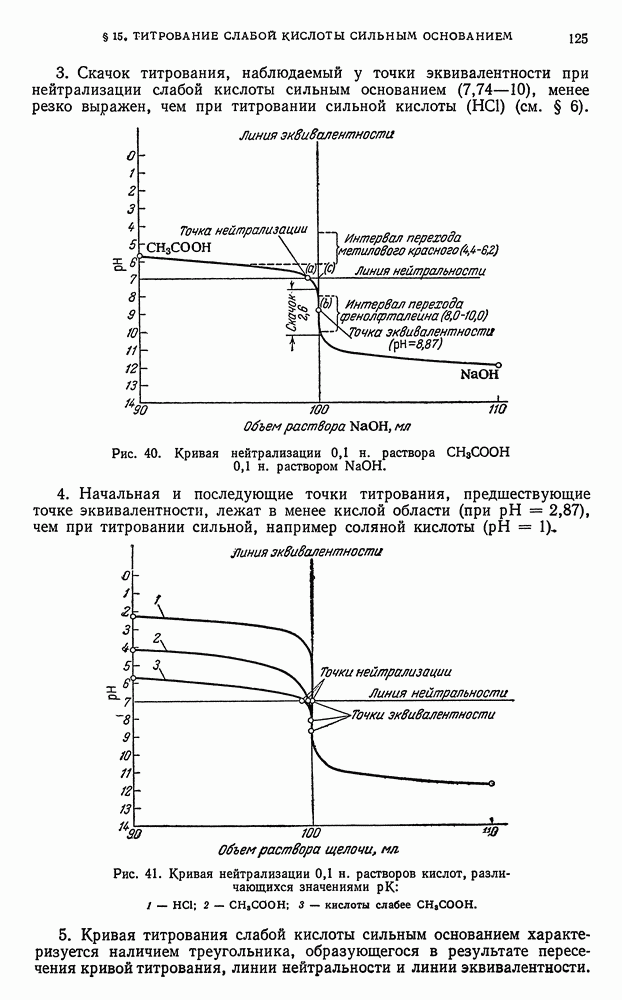
- § 15. Титрование слабой кислоты сильным основанием
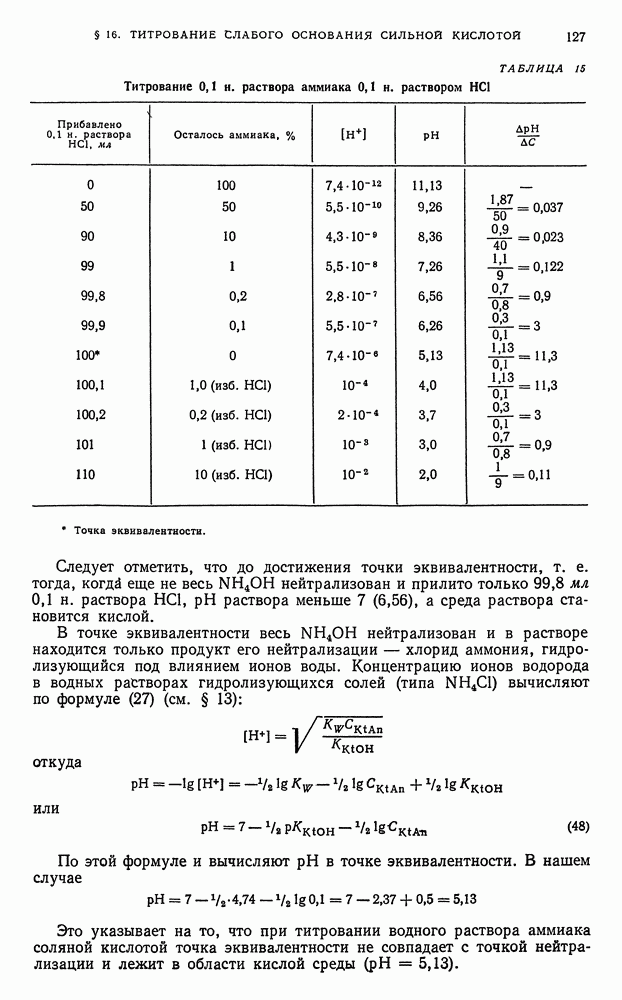
- § 16. Титрование слабого основания сильной кислотой
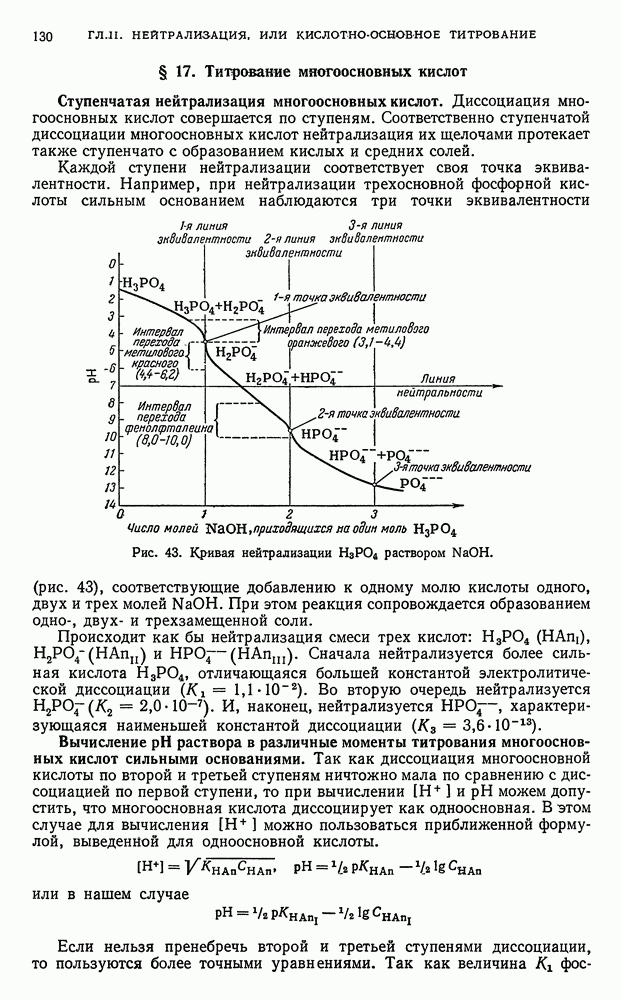
- § 17. Титрование многоосновных кислот
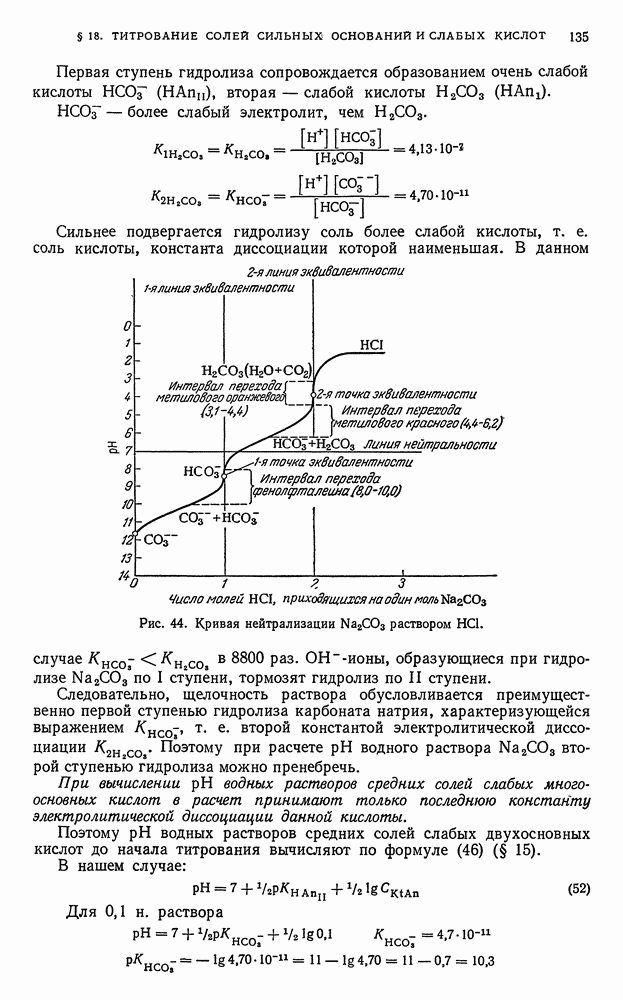
- § 18. Титрование солей, образованных катионами сильных оснований и анионами слабых многоосновных кислот
- § 19. Изменение активности и показателя активности ионов водорода в процессе титрования водных растворов кислот и оснований
- § 20. Выводы, вытекающие из рассмотрения кривых нейтрализации
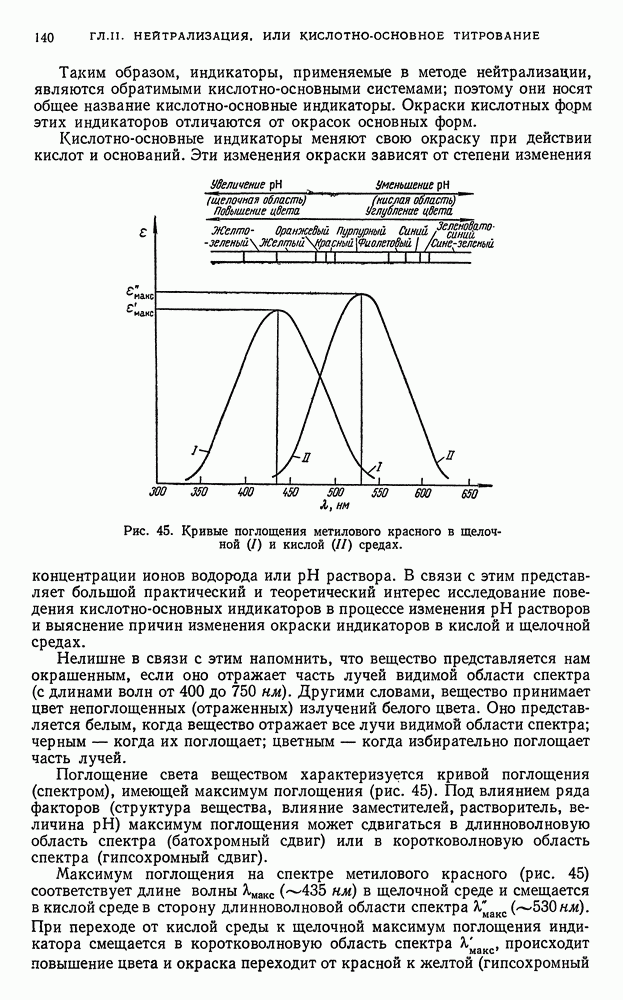
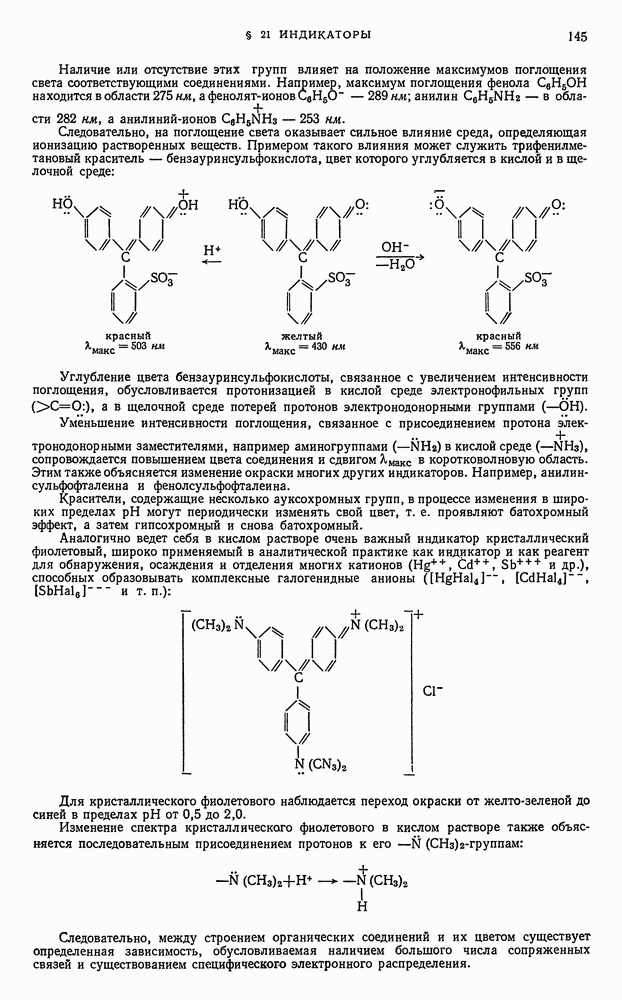
- § 21. Индикаторы
- § 22. Интервал перехода индикатора
- § 23. Выбор индикатора
- § 24. Ошибки титрования
- Б. ПРАКТИЧЕСКАЯ ЧАСТЬ
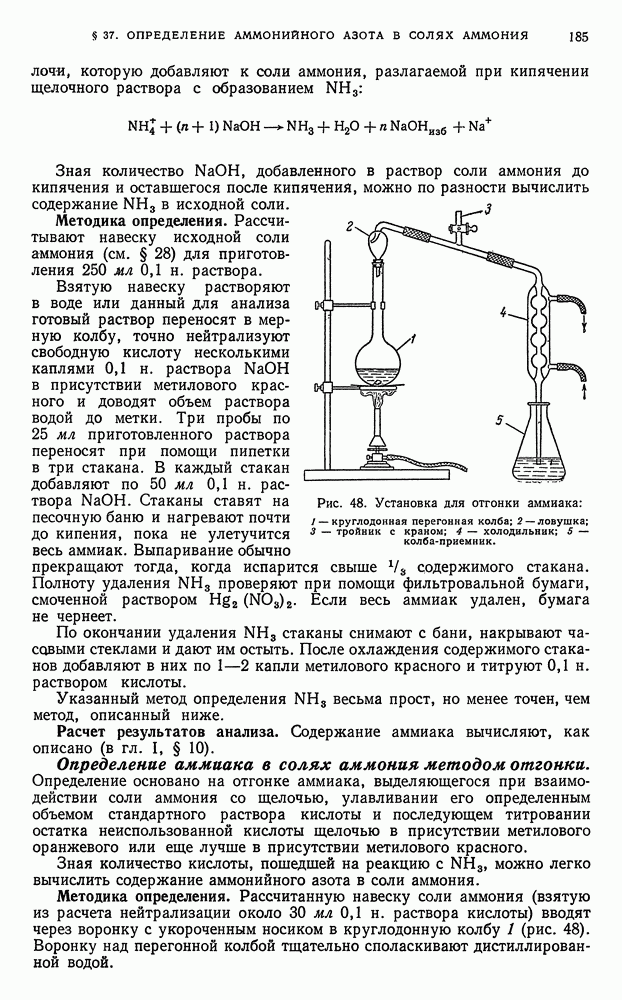
- § 25. Организация рабочего места
- § 26. Приготовление стандартных (титрованных) растворов
- § 27. Приготовление 0,1 н. раствора хлористоводородной кислоты
- § 28. Установка титра 0,1 н. раствора хлористоводородной кислоты
- § 29. Приготовление 0,1 н. раствора едкого натра
- § 30. Установка титра 0,1 н. раствора едкого натра
- § 31. Определение карбонатов
- § 32. Определение содержания H2SO4 в технической серной кислоте
- § 33. Определение содержания уксусной кислоты
- § 34. Определение содержания Na2CO3 и NaOH при их совместном присутствии
- § 35. Определение содержания Na2CO3 и NaHCO3 при их совместном присутствии
- § 36. Определение жесткости воды
- § 37. Определение аммонийного азота в солях аммония
- § 38. Определение содержания фосфорной кислоты
- В. КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ В НЕВОДНЫХ СРЕДАХ
- § 39. Неводные растворы
- § 40. Современные представления о кислотах и основаниях
- § 41. Диссоциация электролитов в неводных растворах
- § 42. Влияние неводных растворителей на силу кислот и оснований
- § 43. Применение закона действия масс к растворам сильных электролитов
- § 44. Титрование кислот и оснований в неводных растворах
- § 45. Методы кислотно-основного титрования в неводных средах
- § 46. Примеры практических определений в неводных растворах
- ГЛАВА III. МЕТОДЫ ОКИСЛЕНИЯ—ВОССТАНОВЛЕНИЯ (ОКСИДИМЕТРИЯ, ОКСРЕДМЕТРИЯ, РЕД-ОКС-МЕТОДЫ)
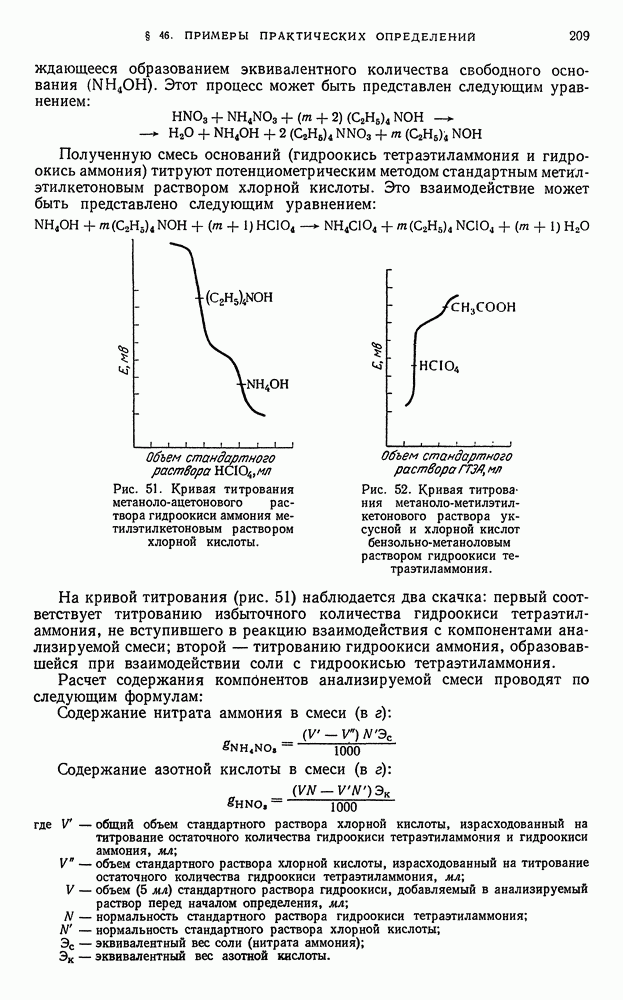
- § 1. Значение окислительно-восстановительных потенциалов
- § 2. Реакции окисления—восстановления и комплексообразования
- § 3. Примеры окислительно-восстановительного титрования
- § 4. Константы равновесия окислительно-восстановительных реакций
- § 5. Связь между константами равновесия окислительно-восстановительных реакций и нормальными потенциалами
- § 6. Вычисление констант равновесия окислительно-восстановительных реакций
- § 8. Зависимость скорости реакций окисления—восстановления от различных факторов
- § 9. Графический метод изображения процесса окисления—восстановления
- § 10. Фиксирование точки эквивалентности в методах окисления—восстановления
- § 11. Окислительно-восстановительные индикаторы (ред-окс-индикаторы)
- Б. ПЕРМАНГАНАТОМЕТРИЯ
- § 12. Основы перманганатометрии
- § 13. Титрование перманганатом в кислой среде
- § 14. Титрование перманганатом в щелочной среде
- § 15. Приготовление стандартного (титрованного) раствора перманганата калия
- § 16. Установка титра стандартного раствора перманганата калия
- § 17. Установка титра и нормальности раствора перманганата калия по оксалату аммония
- § 18. Вещества, определяемые методом перманганатометрии
- ОПРЕДЕЛЕНИЕ ВОССТАНОВИТЕЛЕЙ
- § 19. Определение щавелевой кислоты и оксалатов
- § 20. Определение соединений железа (II)
- § 21. Определение содержания металлического железа в присутствии окислов железа
- § 22. Определение азотистой кислоты и нитритов
- § 23. Определение содержания марганца (II) в рудах
- ОПРЕДЕЛЕНИЕ ОКИСЛИТЕЛЕЙ
- § 24. Определение соединений железа (III)
- § 25. Определение нитратов
- § 26. Определение бихроматов
- § 27. Определение содержания MnO2 в пиролюзите
- ОПРЕДЕЛЕНИЕ ДРУГИХ ВЕЩЕСТВ
- § 28. Определение ионов кальция
- В. ИОДОМЕТРИЯ
- § 29. Основы иодометрии
- § 30. Методы иодометрического титрования
- § 31. Преимущества и недостатки иодометрического метода
- § 32. Приготовление стандартного (титрованного) раствора тиосульфата и установка его титра
- § 33. Приготовление стандартного (титрованного) раствора иода и установка его титра
- МЕТОДЫ ПРЯМОГО ТИТРОВАНИЯ
- § 34. Определение мышьяка (III)
- МЕТОДЫ ОБРАТНОГО ТИТРОВАНИЯ
- § 35. Определение сульфита натрия
- § 36. Определение содержания формальдегида в формалине
- МЕТОДЫ КОСВЕННОГО ОПРЕДЕЛЕНИЯ
- § 37. Определение ионов меди (II)
- § 38. Определение двуокиси свинца в сурике
- МЕТОД ТИТРОВАНИЯ ЗАМЕСТИТЕЛЕЙ
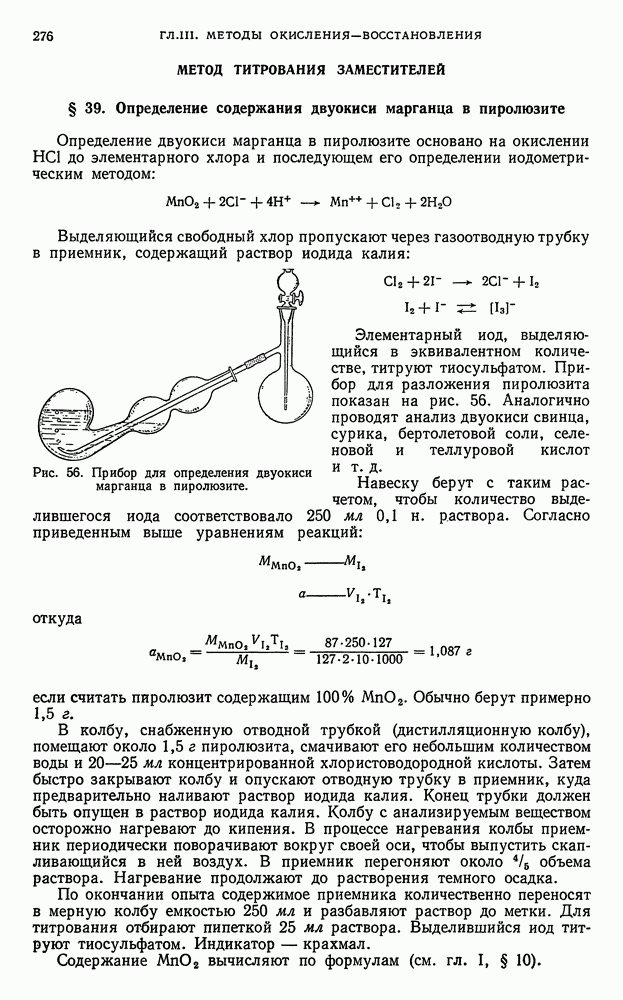
- § 39. Определение содержания двуокиси марганца в пиролюзите
- МЕТОД ОПРЕДЕЛЕНИЯ КИСЛОТ
- § 40. Определение хлористоводородной кислоты
- § 41. Определение воды по Фишеру
- Г. ПОНЯТИЕ О ДРУГИХ МЕТОДАХ ОКИСЛЕНИЯ — ВОССТАНОВЛЕНИЯ
- § 42. Хроматометрия
- § 43. Определение содержания железа (II)
- § 44. Цериметрия
- § 45. Броматометрия
- § 46. Ванадатометрия
- § 47. Аскорбинометрия
- § 48. Титанометрия
- ГЛАВА IV. МЕТОДЫ ОСАЖДЕНИЯ И КОМПЛЕКСООБРАЗОВАНИЯ
- § 1. Общая характеристика методов
- § 2. Классификация методов осаждения и комплексообразования
- § 3. Применение теории осаждения к объемному анализу
- § 4. Вычисление растворимости электролитов в воде с учетом коэффициентов активности
- § 5. Влияние одноименных ионов на растворимость малорастворимого электролита
- § 6. Солевой эффект
- § 7. Влияние концентрации ионов водорода на растворимость малорастворимых соединений
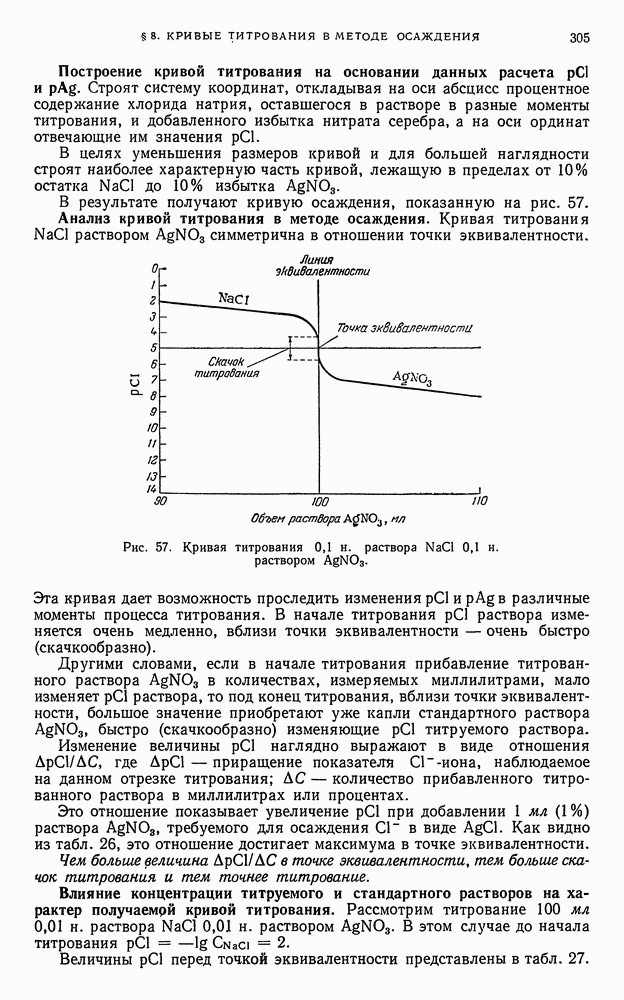
- § 8. Кривые титрования в методе осаждения
- § 9. Общие выводы, вытекающие из рассмотрения кривых осаждения
- § 10. Адсорбционные явления, наблюдаемые при титровании по методу осаждения
- Б. АРГЕНТОМЕТРИЯ
- § 11. Характеристика метода
- § 12. Приготовление 0,1 н. раствора нитрата серебра
- § 13. Приготовление стандартного раствора хлорида натрия
- § 14. Установка титра 0,1 н. раствора нитрата серебра по точной навеске хлорида натрия
- §15. Определение ионов хлора в техническом хлориде натрия по методу Мора
- § 16. Определение хлоридов по методу Фаянса
- В. РОДАНОМЕТРИЯ
- § 17. Характеристика метода
- § 18. Приготовление 0,1 н. раствора роданида аммония
- § 19. Определение ионов хлора в растворимых хлоридах по методу Фольгарда
- § 20. Определение серебра в сплавах
- Г. МЕРКУРИМЕТРИЯ
- § 21. Характеристика метода
- § 22. Приготовление 0,1 н. раствора нитрата ртути (II)
- § 23. Установка титра раствора нитрата ртути (II)
- § 24. Определение ионов хлора в воде меркуриметрическим методом
- Д. МЕРКУРОМЕТРИЯ
- § 25. Краткая характеристика метода
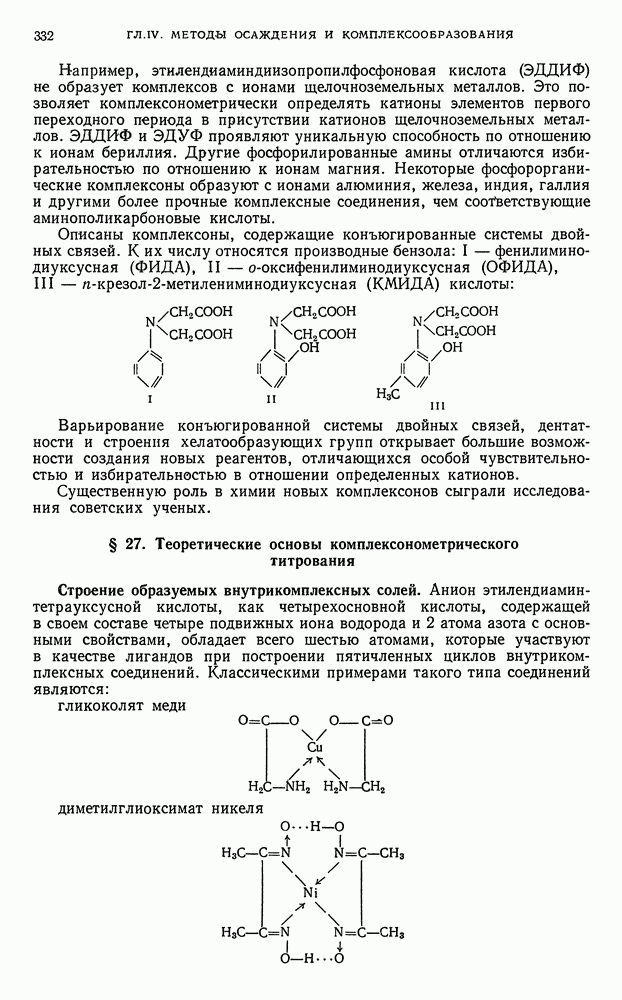
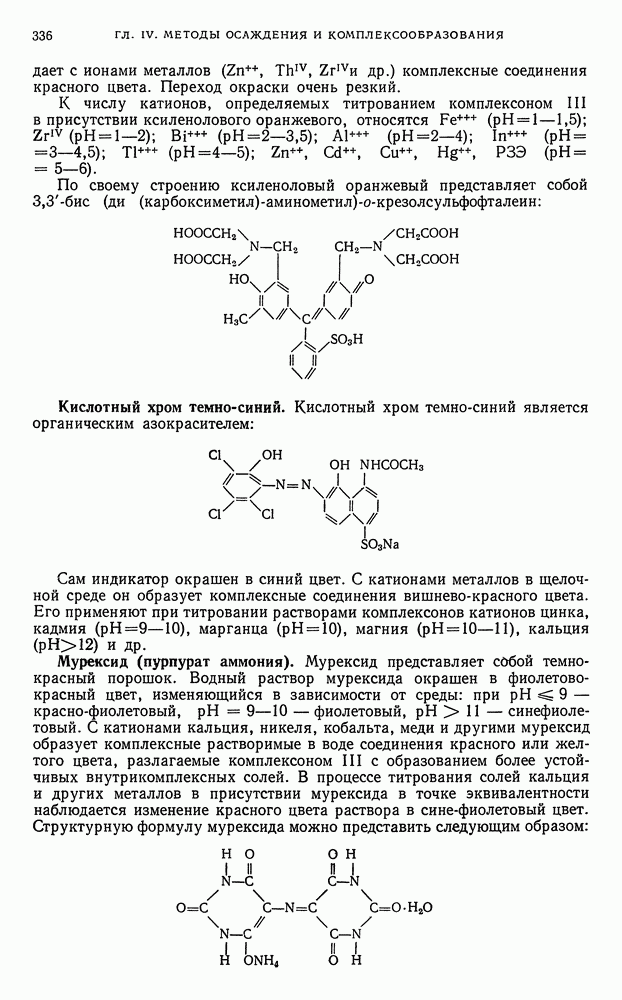
- Е. КОМПЛЕКСОНОМЕТРИЯ (ХЕЛАТОМЕТРИЯ)
- § 26. Характеристика метода
- § 27. Теоретические основы комплексонометрического титрования
- § 28. Классификация методов комплексонометрического титрования
- § 29. Установка титра раствора комплексона III
- § 30. Определение содержания кальция
- § 31. Определение жесткости воды комплексонометрическим методом
- § 32. Анализ смеси ионов кальция и магния
- § 33. Определение содержания алюминия
- § 34. Раздельное определение ионов кальция и алюминия
- § 35. Раздельное определение ионов алюминия и железа
- Часть вторая. Весовой анализ
- § 1. Сущность весового анализа
- § 2. Классификация методов весового анализа
- § 3. Расчеты в весовом анализе
- Б. ТЕХНИКА ВЕСОВОГО АНАЛИЗА
- § 4. Взятие и растворение навески
- § 5. Техника осаждения
- § 6. Фильтрование и промывание осадков
- § 7. Получение весовой формы
- § 8. Взвешивание весовой формы
- В. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
- § 9. Теоретические основы выделения осадков из растворов с помощью специфических неорганических и органических реактивов
- § 10. Требования, предъявляемые к осадкам
- § 11. Методы повышения точности весовых определений
- § 12. Теоретические обоснования выбора оптимальных условий для весового определения
- Г. ПРАКТИЧЕСКАЯ ЧАСТЬ
- § 13. Определение кристаллизационной воды в BaCl2 2H2O
- § 14. Определение сульфат-ионов или серы
- § 15. Определение ионов железа (III)
- § 16. Определение содержания кальция в карбонате кальция
- § 17. Определение содержания магния
- § 18. Определение ионов хлора в растворимых хлоридах или в хлористоводородной кислоте
- § 19. Анализ силикатов
- § 20. Анализ доломита
- § 21. Анализ бронзы и латуни
- Д. МЕТОДЫ ВЕСОВЫХ ОПРЕДЕЛЕНИЙ, ОСНОВАННЫЕ НА ПРИМЕНЕНИИ ОРГАНИЧЕСКИХ РЕАКТИВОВ
- § 22. Определение никеля
- § 23. Определение алюминия
- Часть третья. Понятие о физических и физико-химических (инструментальных) методах анализа
- § 1. Электрохимические методы
- § 2. Спектральные (оптические) методы
- § 3. Хроматографические методы
- § 4. Радиометрические методы
- § 5. Масс-спектрометрические методы
- ГЛАВА VII ЭЛЕКТРОВЕСОВЫЕ МЕТОДЫ АНАЛИЗА
- § 1. Характеристика методов электроанализа
- § 2. Химические процессы, протекающие при электролизе
- § 3. Методы электроанализа
- § 4. Электровесовой анализ
- § 5. Метод внутреннего электролиза
- § 6. Определение меди в растворе сульфата меди с применением платиновых сетчатых электродов
- § 7. Определение меди и свинца в латуни с применением платиновых сетчатых электродов
- § 8. Определение малых количеств меди методом внутреннего электролиза
- ГЛАВА VIII. ОБЪЕМНЫЕ ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- § 1. Особенности объемных электрохимических методов анализа
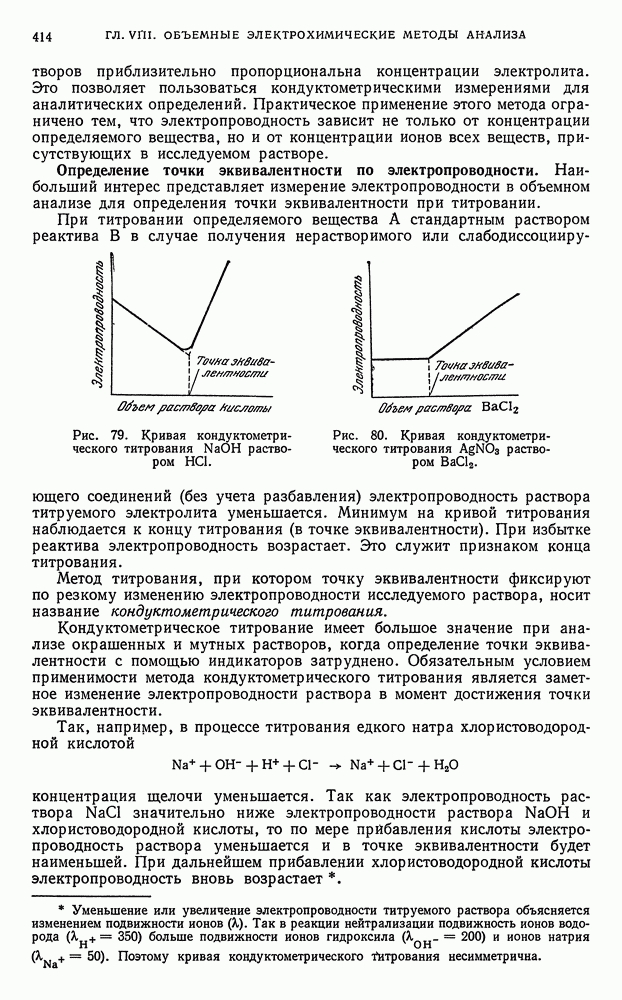
- § 2. Кондуктометрическое титрование
- § 3. Высокочастотное титрование
- § 4. Потенциометрическое титрование
- § 5. Полярографический метод анализа
- § 6. Амперометрическоб титрование
- § 7. Кулонометрическое титрование
- ГЛАВА IX. СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА
- § 1. Понятие об эмиссионном спектральном анализе
- Б. КОЛОРИМЕТРИЯ
- § 2. Особенности колориметрических методов анализа
- § 3. Характеристика колориметрических методов анализа
- В. ОПТИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ ТОЧКИ ЭКВИВАЛЕНТНОСТИ
- § 4. Спектрофотометрическое титрование
- § 5. Фототурбидиметрическое и фотонефелометрическое титрование
- Г. ЛАБОРАТОРНЫЕ РАБОТЫ
- § 6. Определение содержания ионов железа методом колориметрического титрования
- § 7. Определение содержания титана
- ГЛАВА X. МЕТОДЫ РАЗДЕЛЕНИЯ, ВЫДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ ОТДЕЛЬНЫХ КОМПОНЕНТОВ АНАЛИЗИРУЕМЫХ СМЕСЕЙ
- § 1. Определение следов элементов (микропримесей)
- § 2. Метод осаждения малорастворимых соединений
- § 3. Электрохимические методы разделения
- § 4. Метод экстрагирования
- § 5. Методы отгонки летучих соединений
- § 6. Хроматографические методы разделения
- § 7. Метод флотации