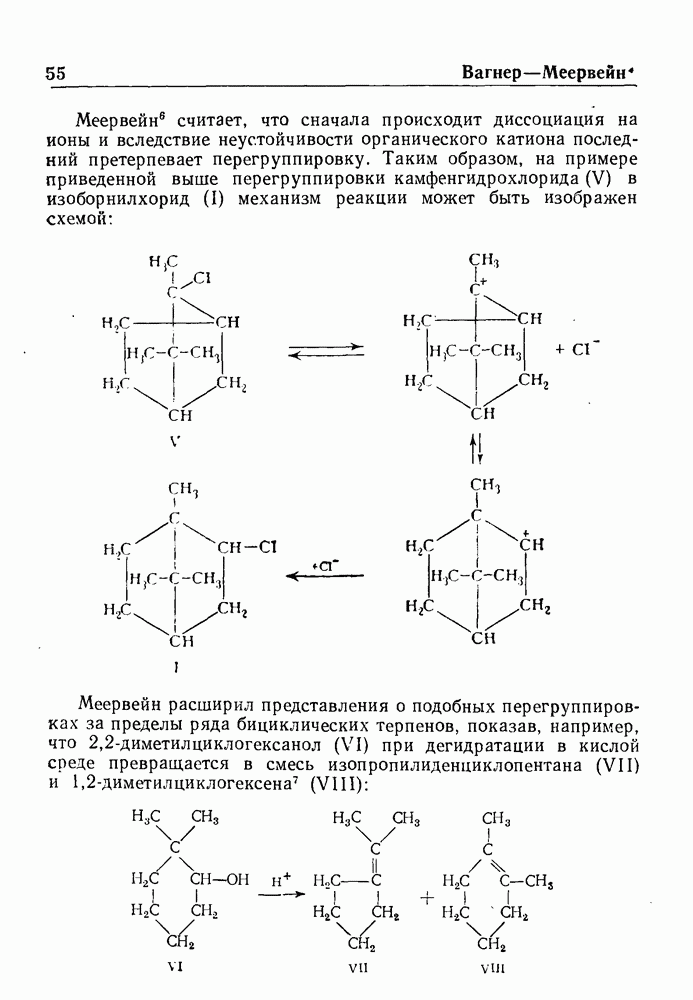
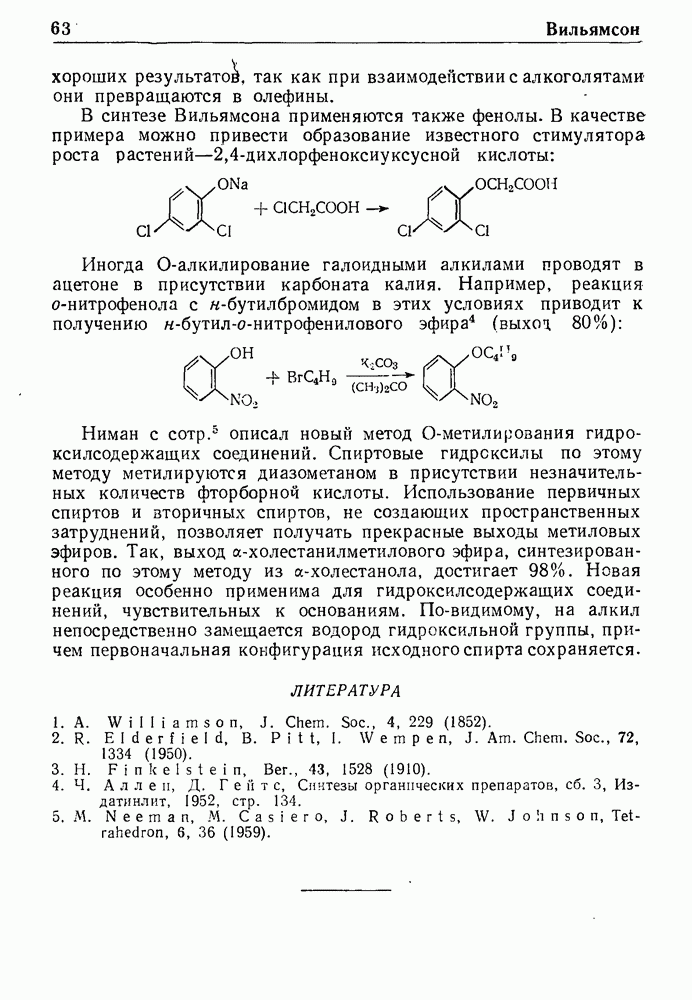
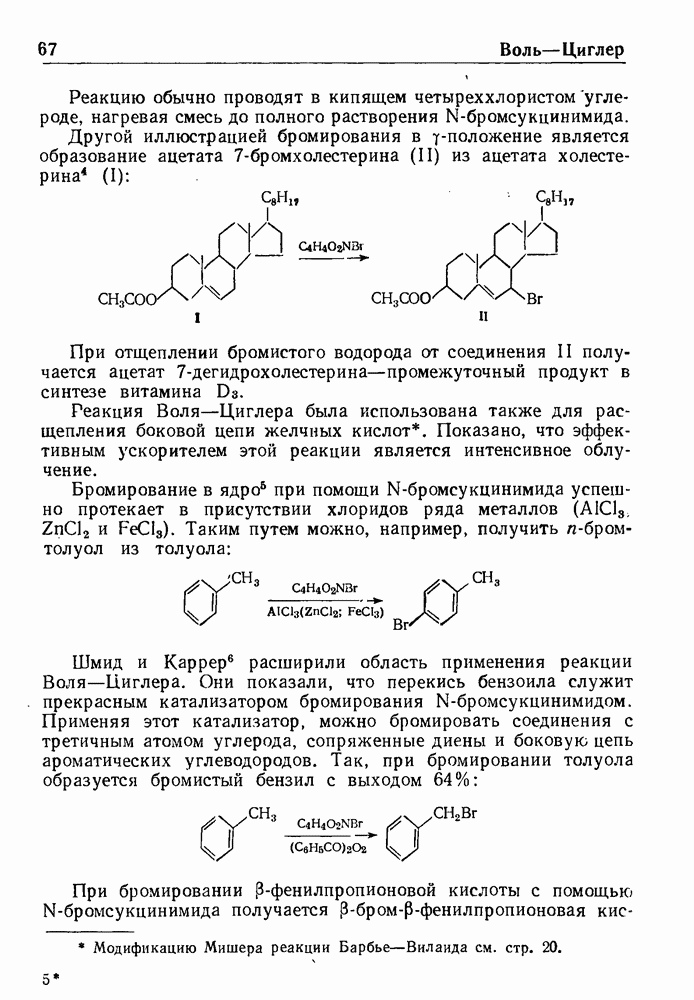
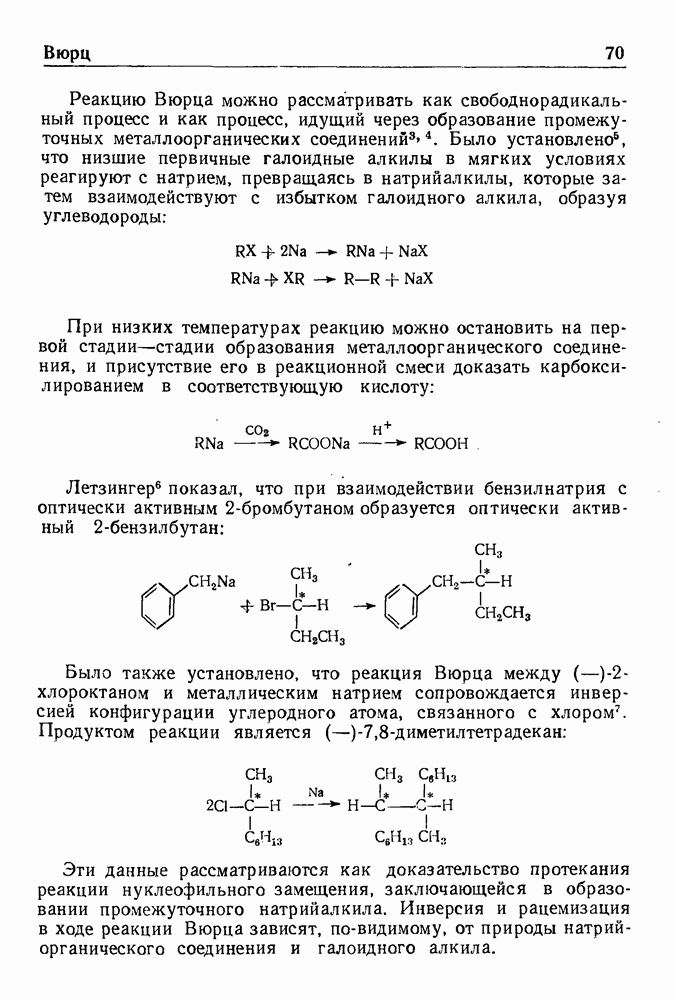
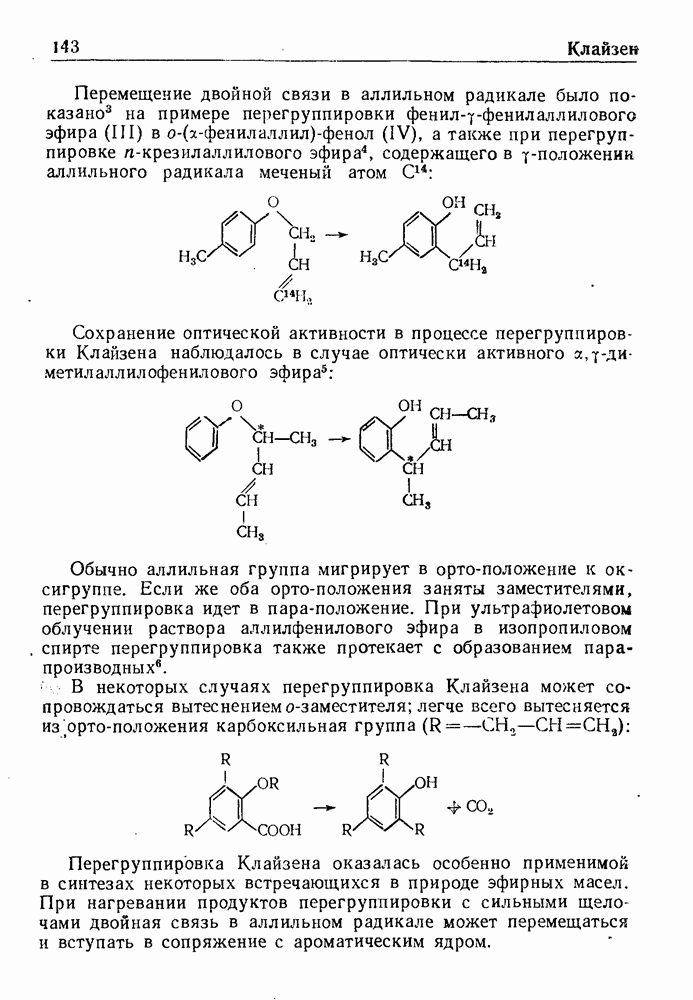
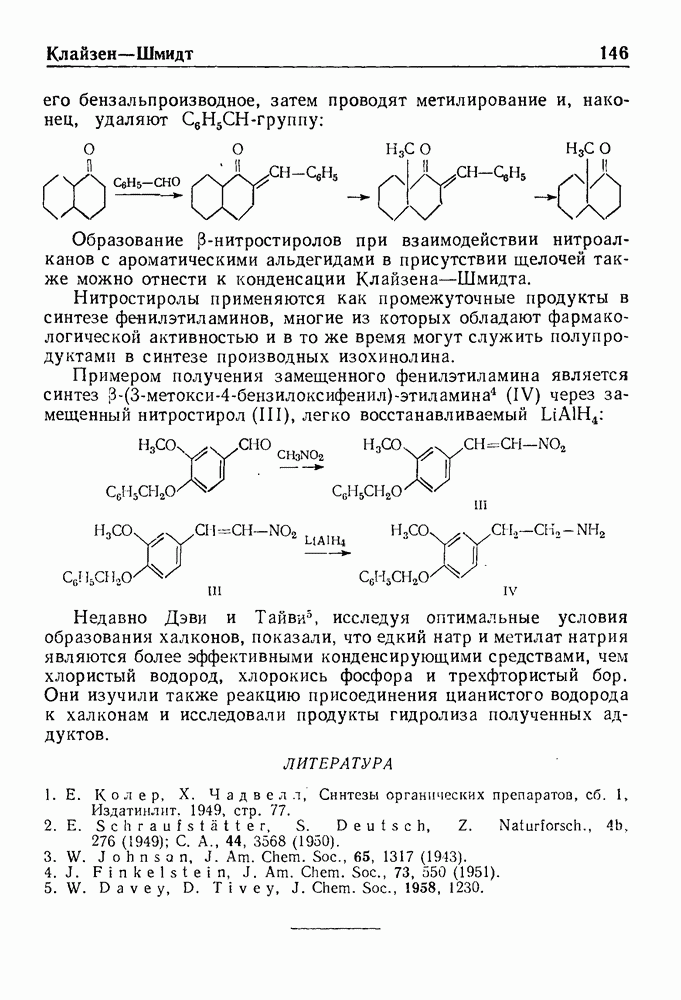
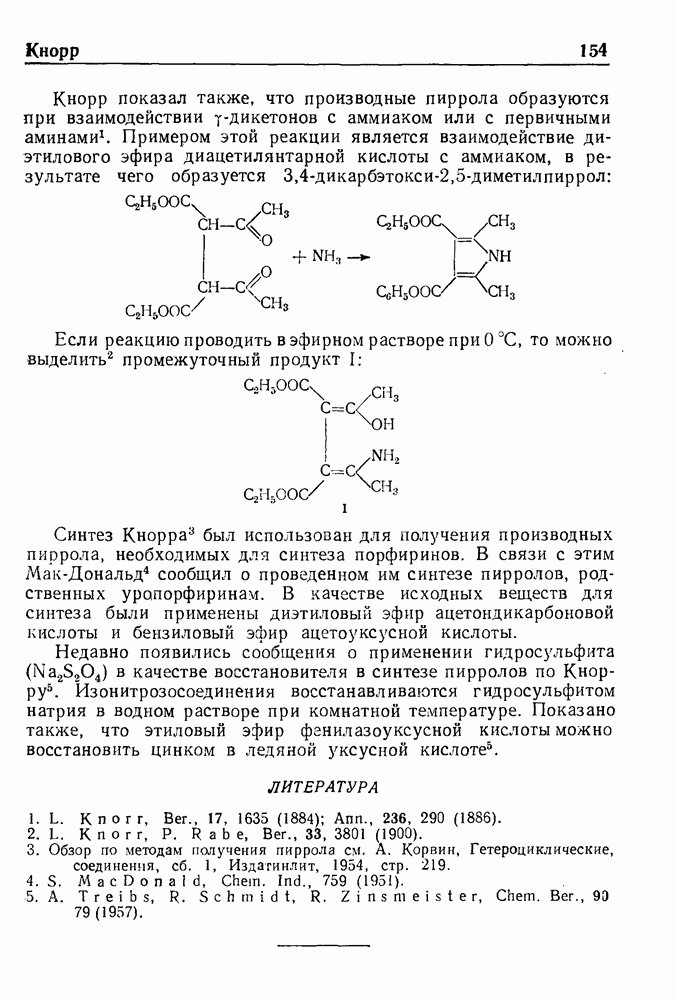
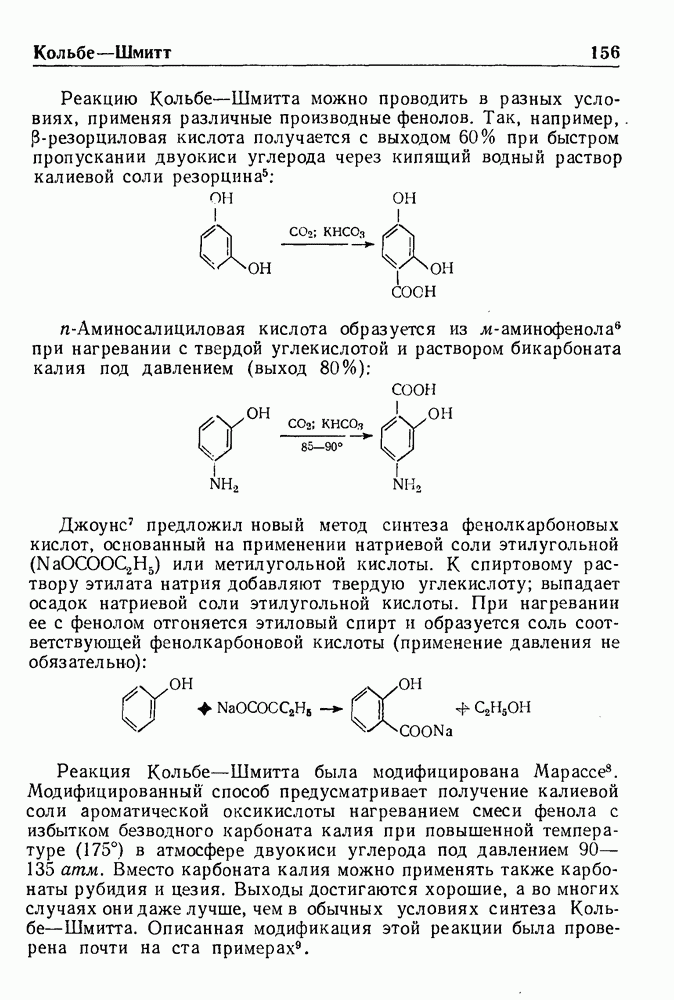
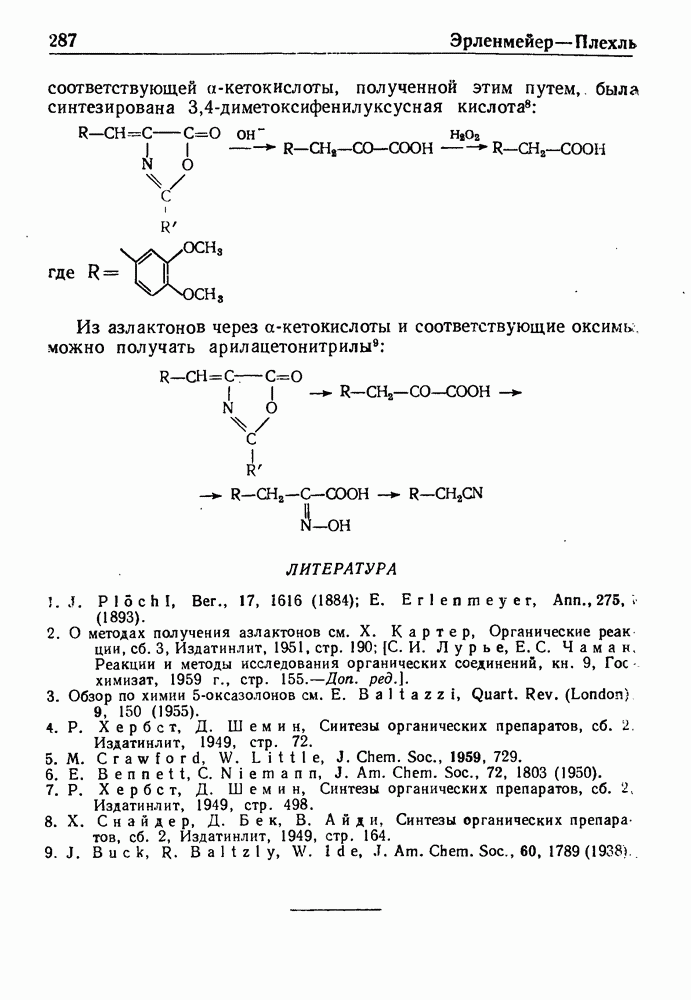
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
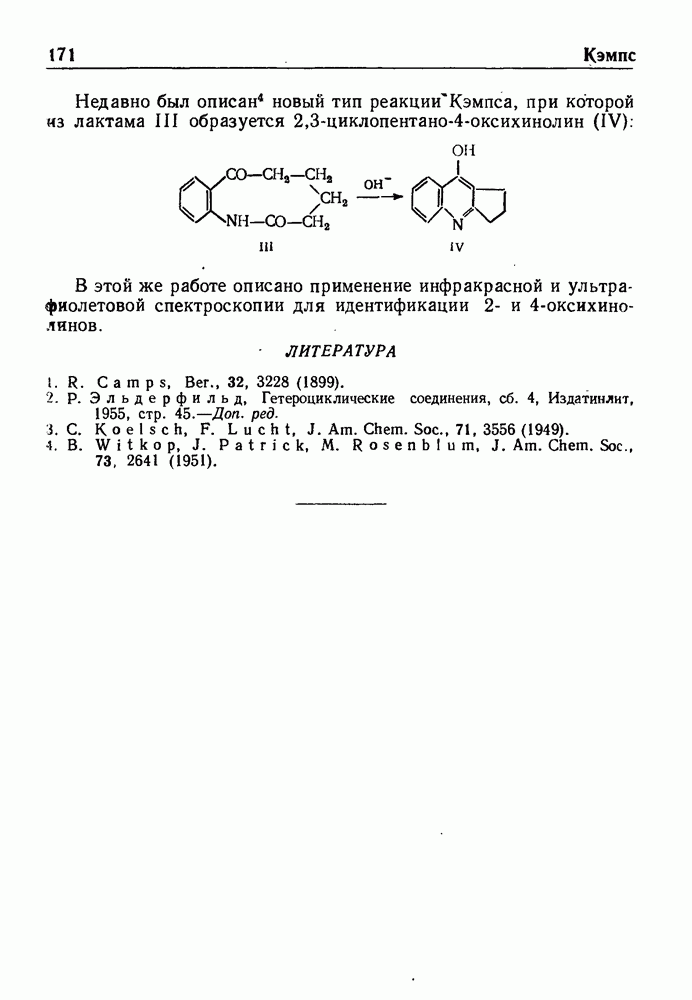
РЕАКЦИЯ БИШЛЕРА—НАПИРАЛЬСКОГО
Август Бишлер (Augustus Bischler, 1865-1957) изучал химию в Цюрихском политехникуме под руководством В. Мейера и А. Ганча. В 1897-1910 гг. научный руководитель фирмы «Циба» в Базеле (Швейцария), затем директор химической фабрики в г. Монте. Продолжал научную деятельность в различных лабораториях до 1955 г. В процессе исследования алкалоидов открыл реакцию синтеза изохинолина.
Б. Напиральский — ученик А. Бишлера.
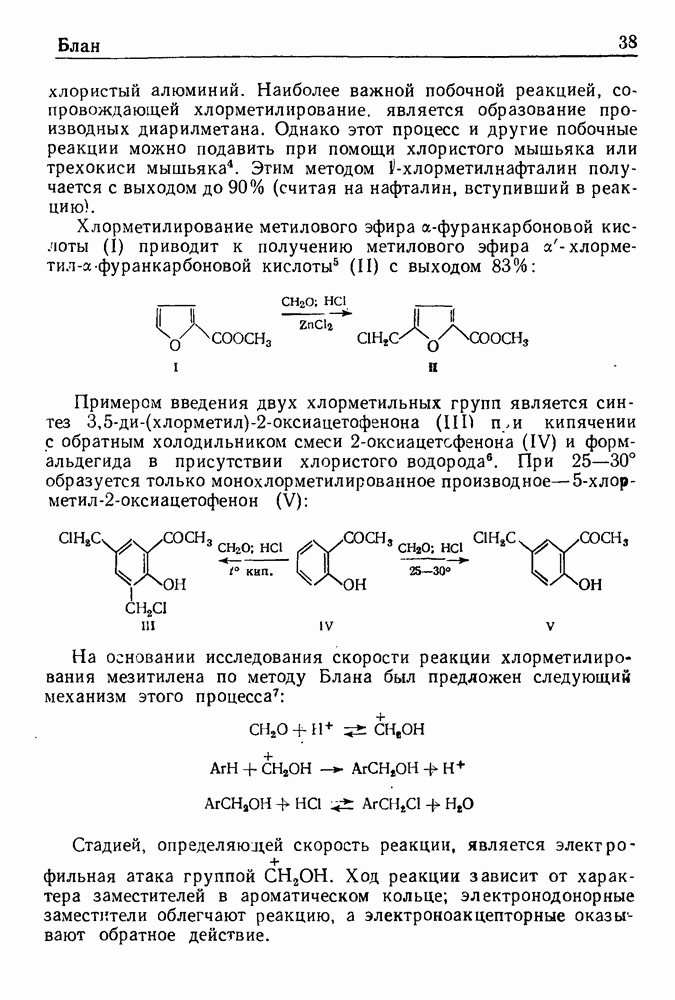
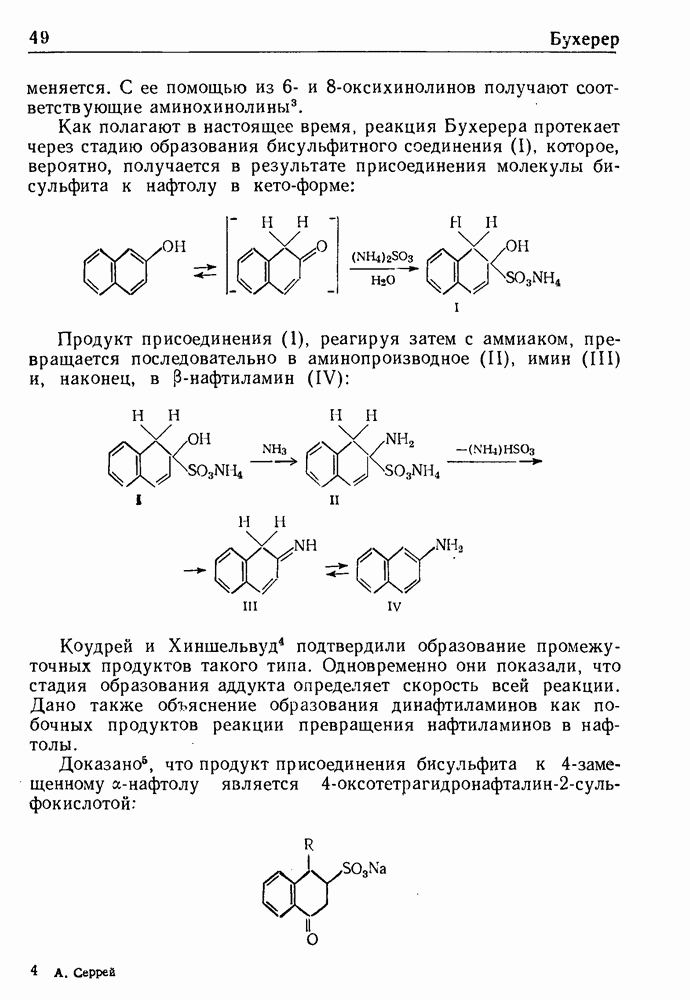
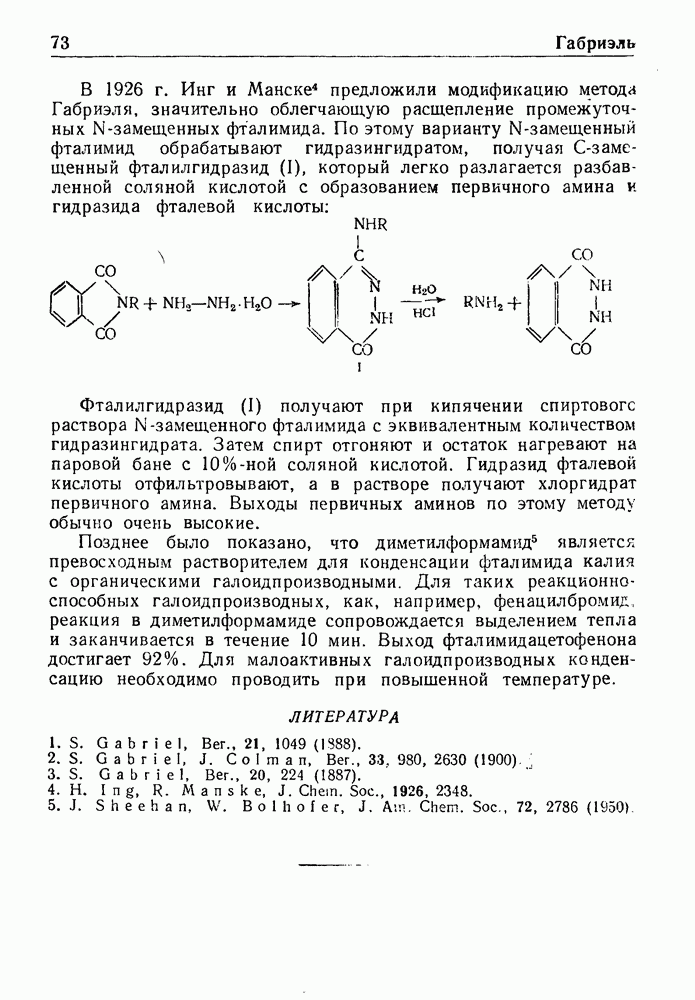
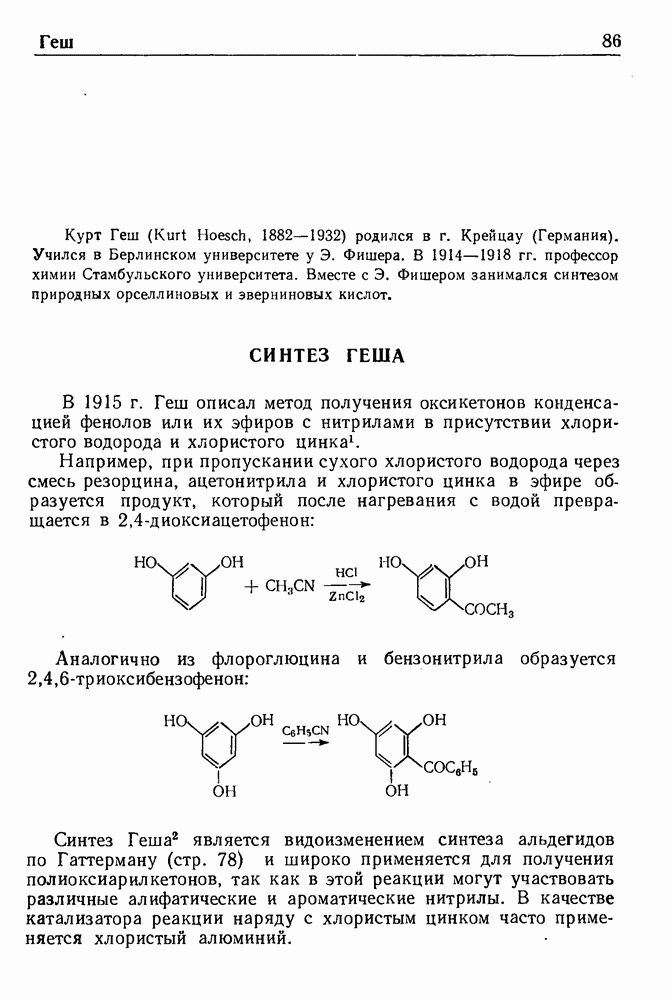
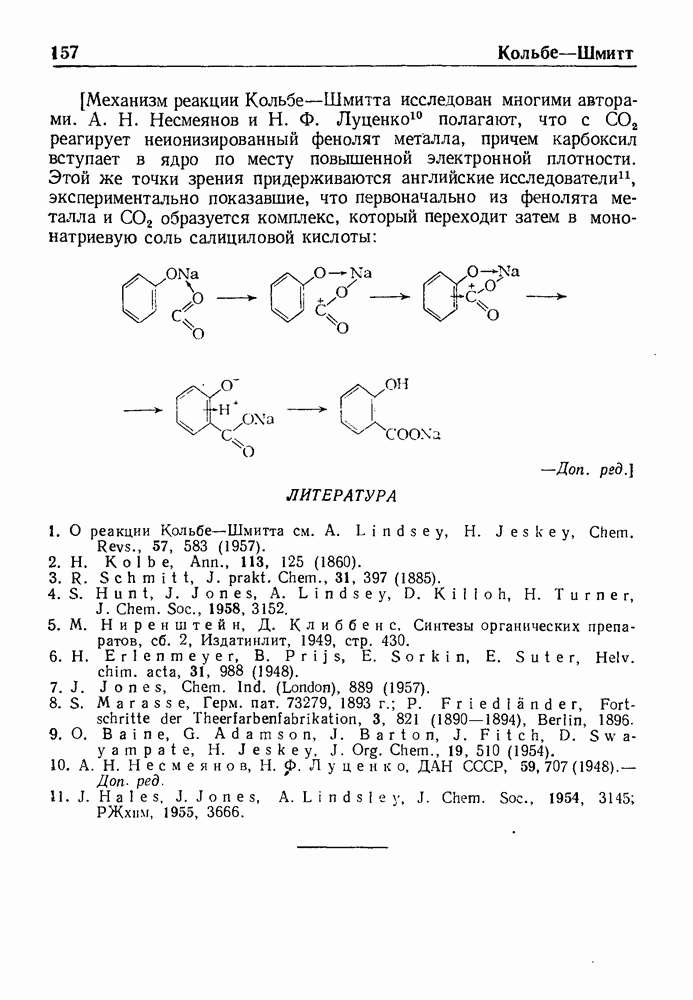
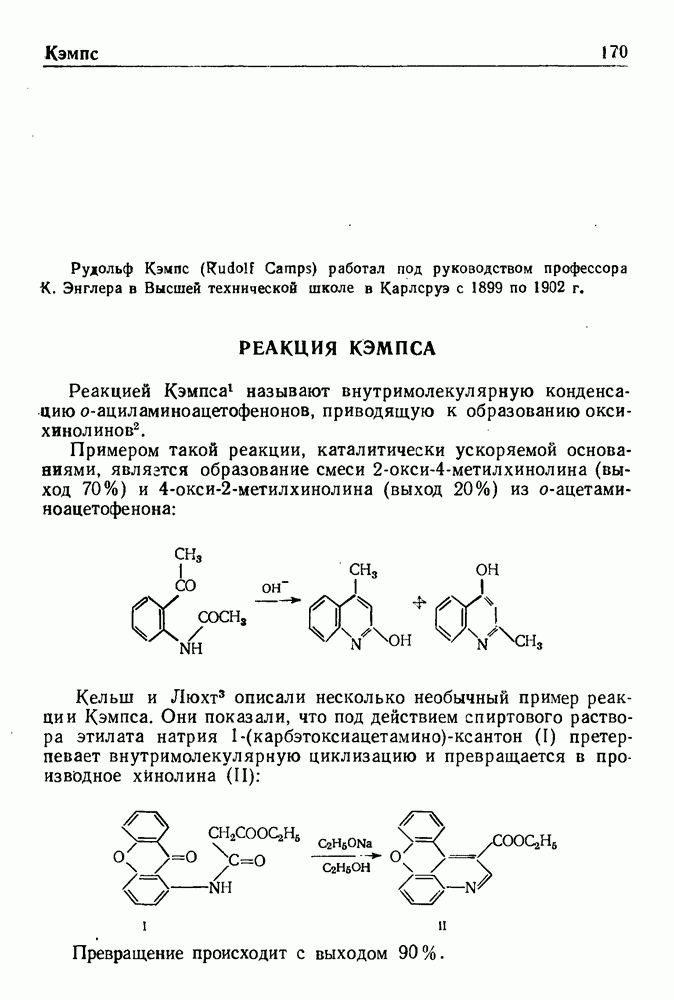
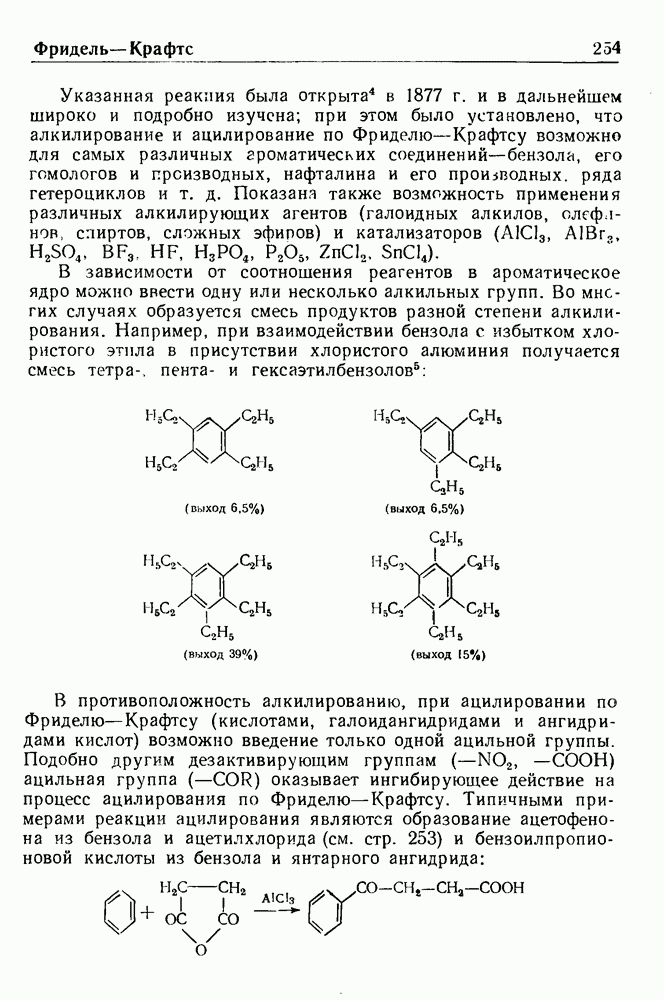
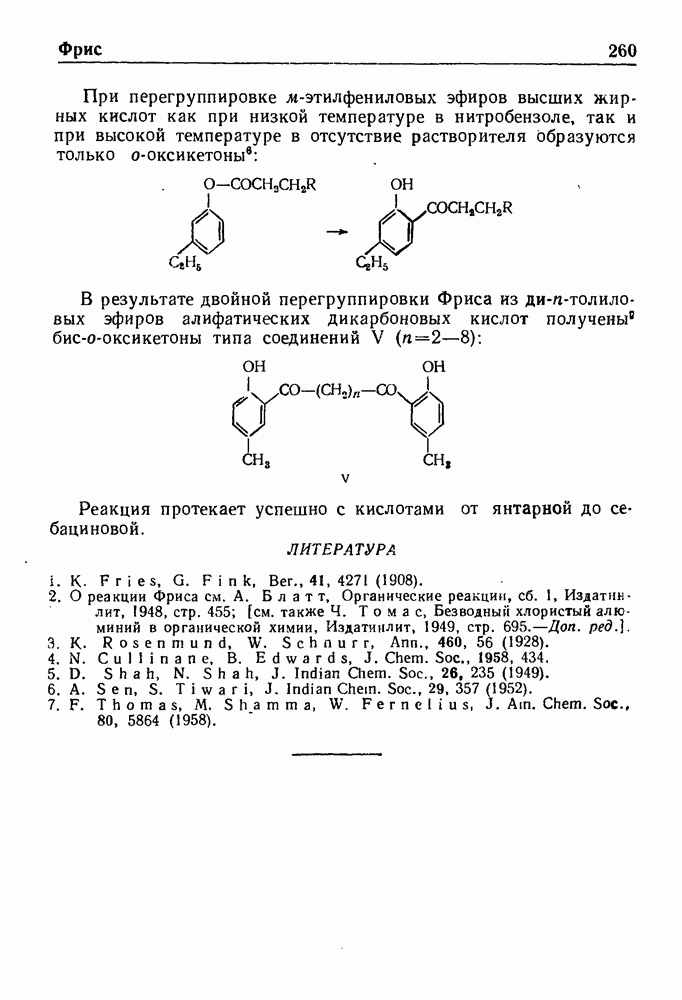
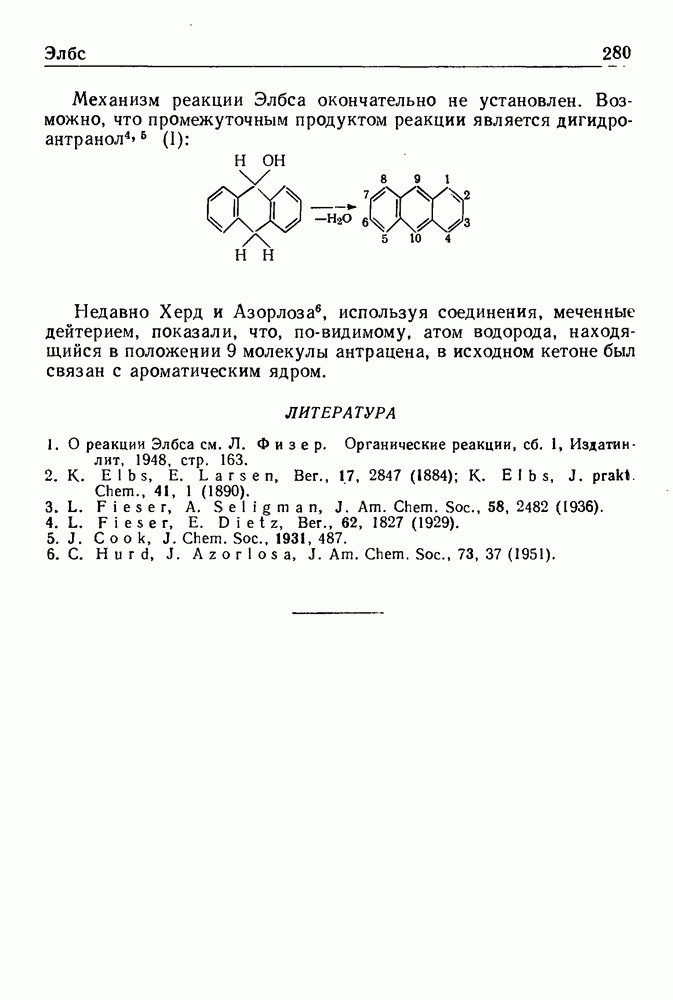
При обработке N-ацилпроизводных фенилэтиламина ( -фенилэтиламидов кислот) такими дегидратирующими агентами, как хлорокись фосфора, пятиокись фосфора или полифосфорная кислота, происходит циклодегидратация и образуются производные 3,4-дигидроизохинолина:
-фенилэтиламидов кислот) такими дегидратирующими агентами, как хлорокись фосфора, пятиокись фосфора или полифосфорная кислота, происходит циклодегидратация и образуются производные 3,4-дигидроизохинолина:

Эта реакция, открытая Бишлером и Напиральским в 1893 г., является ценным методом получения большого числа различных соединений ряда изохинолина, особенно алкалоидов. В реакции Бишлера-Напиральского могут с успехом применяться ароматические, жирноароматические и алифатические амиды, которые нагревают с дегидратирующим агентом в среде инертных растворителей (хлороформ, бензол, толуол или нитробензол). Выбор растворителя определяется температурой, необходимой для проведения реакции; обычно синтез проводят при температуре кипения реакционной смеси. Полученный  -дигидроизохинолин выделяют перегонкой с водяным паром или экстракцией.
-дигидроизохинолин выделяют перегонкой с водяным паром или экстракцией.
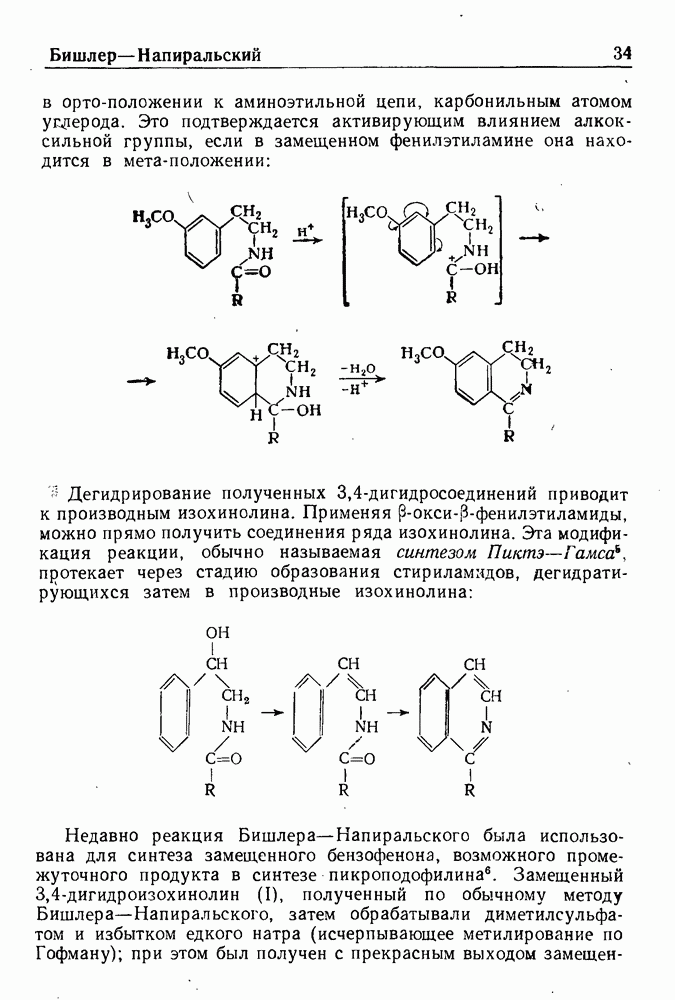
Механизм реакции Бишлера-Напиральского заключается, вероятно, в электрофильной атаке атома углерода, находящегося
в орто-положении к аминоэтильной цепи, карбонильным атомом углерода. Это подтверждается активирующим влиянием алкоксильной группы, если в замещенном фенилэтиламине она находится в мета-положении:

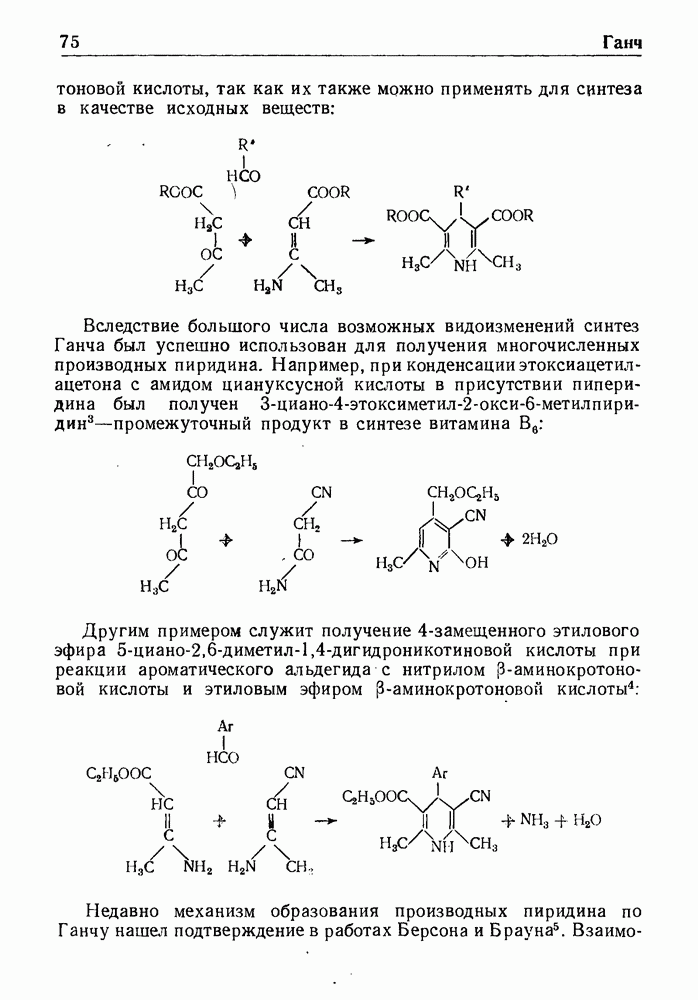
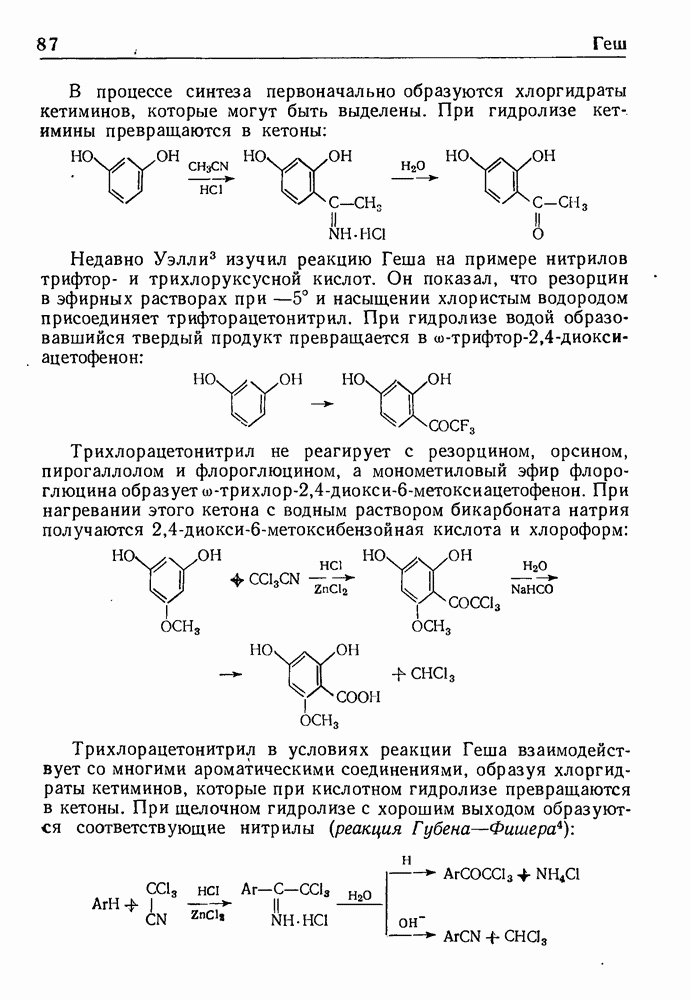
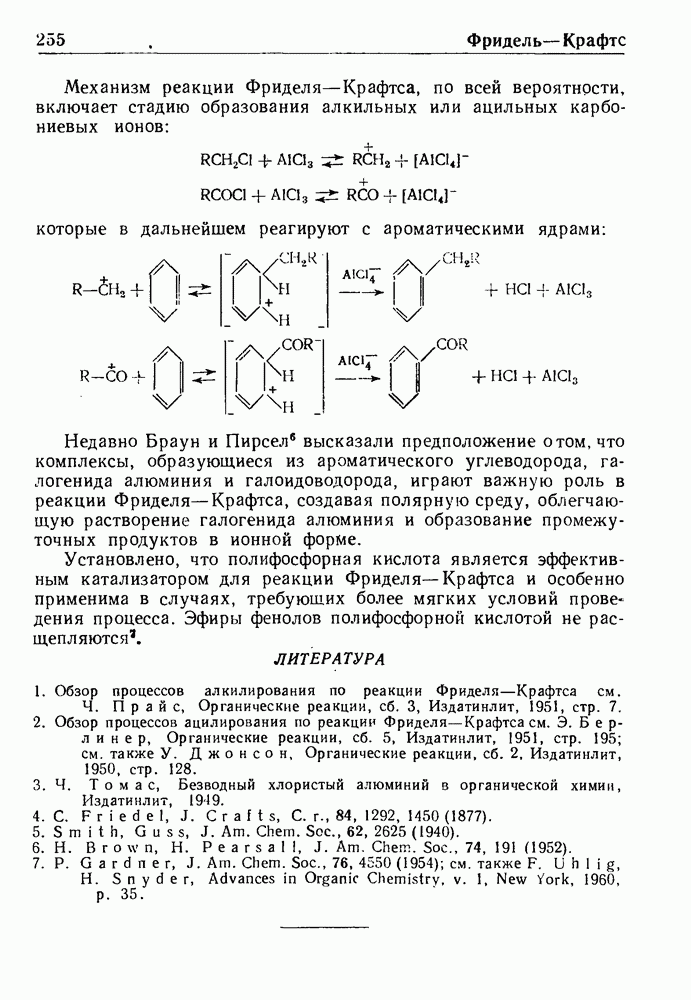
Дегидрирование полученных 3,4-дигидросоединений приводит к производным изохинолина. Применяя (3-окси-b-фенилэтиламиды, можно прямо получить соединения ряда изохинолина. Эта модификация реакции, обычно называемая синтезом Пикта-Гамса, протекает через стадию образования стириламидов, дегидратирующихся затем в производные изохинолина:

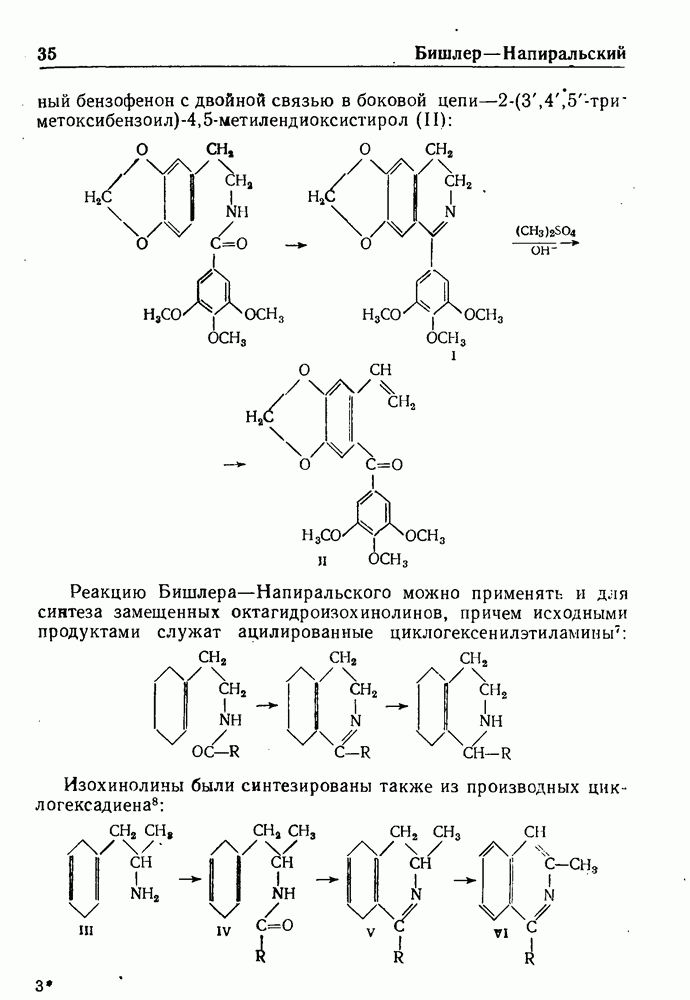
Недавно реакция Бишлера-Напиральского была использована для синтеза замещенного бензофенона, возможного промежуточного продукта в синтезе пикроподофилина. Замещенный 3,4-дигидроизохинолин (I), полученный по обычному методу Бишлера-Напирал ьского, затем обрабатывали диметилсульфатом и избытком едкого натра (исчерпывающее метилирование по Гофману); при этом был получен с прекрасным выходом
замещенный бензофенон с двойной связью в боковой цепи цепи-2-(3,4,5:три~ метоксибензоил)-4,5-метилендиоксистирол (II):

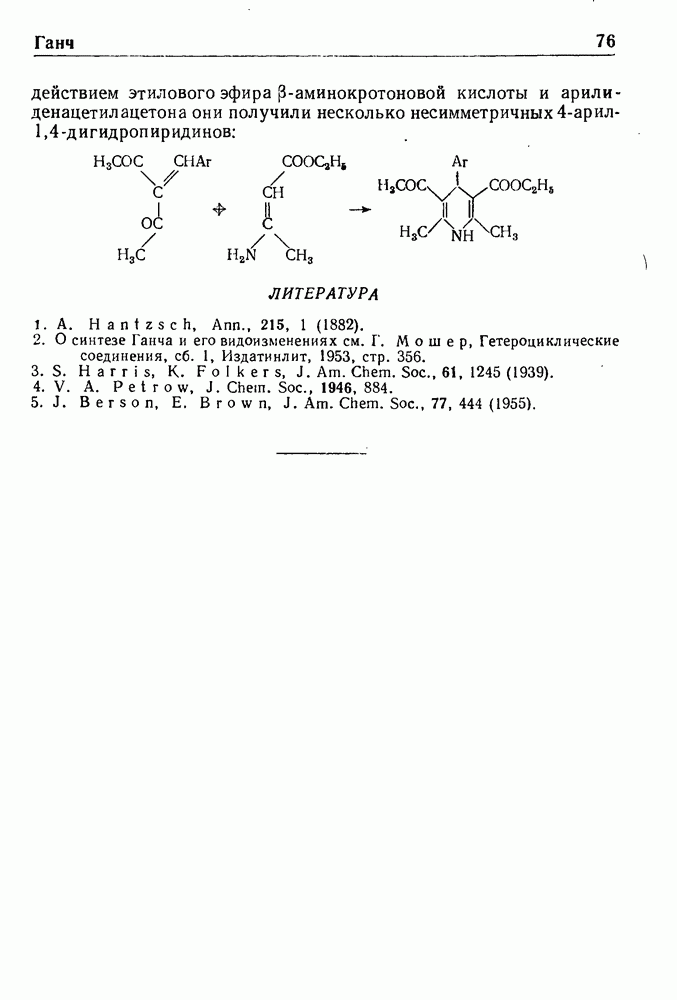
Реакцию Бишлера-Напиральского можно применять и для синтеза замещенных октагидроизохинолинов, причем исходными продуктами служат ацилированные циклогексенилэтиламины:

Изохинолины были синтезированы также из производных циклогексадиена:

Дигидросоединение III, полученное восстановлением по методу Берча, обрабатывали 3,4-диметоксифенилацетилхлоридом и образовавшийся ациламин IV циклизовали при помощи хлорокиси фосфора в бензоле. Соединение V для превращения в производное изохинолина VI было дегидрировано в две стадии: а) под действием  в ксилоле и б) в присутствии
в ксилоле и б) в присутствии  и этилового эфира комичной кислоты.
и этилового эфира комичной кислоты.
Реакция Бишлера-Напиральского была использована также для синтеза производных пиридина. Так, циклизацией  -ацилиро-ванного 5-фенилпентен-4-ил-1-амина были получены 2-замещенные 3-бензилиден-3,6-дигидропиридина:
-ацилиро-ванного 5-фенилпентен-4-ил-1-амина были получены 2-замещенные 3-бензилиден-3,6-дигидропиридина:

ЛИТЕРАТУРА
(см. скан)
| << Предыдущий параграф | Следующий параграф >> |
- ОТ РЕДАКТОРА
- ПЕРЕГРУППИРОВКА АРБУЗОВА
- СИНТЕЗ АРНДТА—ЭЙСТЕРТА
- ОКИСЛЕНИЕ ПО БАЙЕРУ—ВИЛЛИГЕРУ
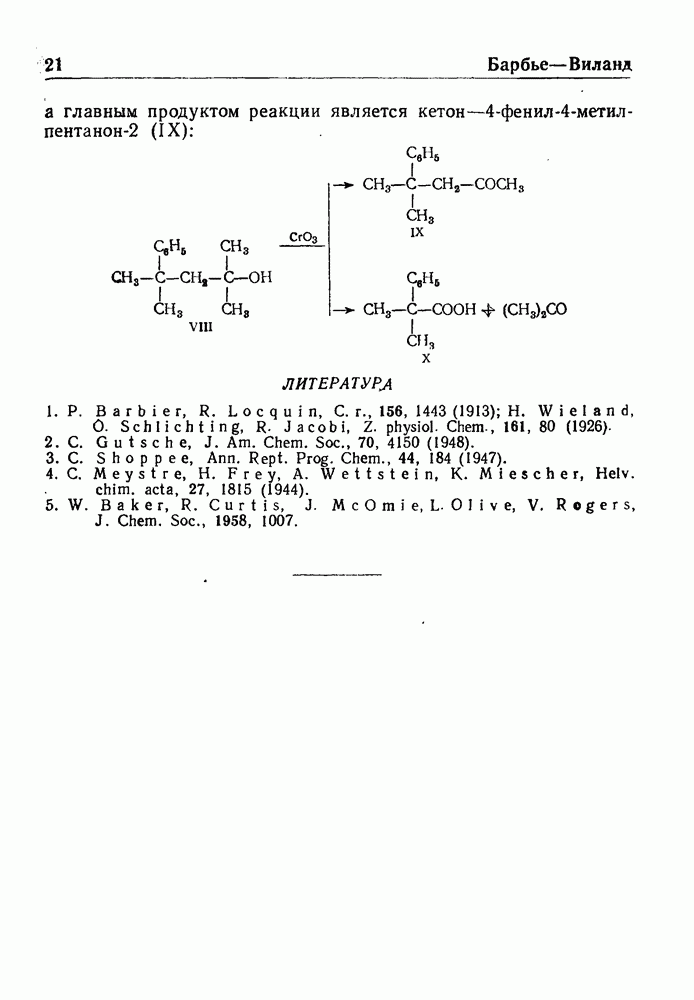
- РАСЩЕПЛЕНИЕ ПО БАРБЬЕ—ВИЛАНДУ
- РЕАКЦИЯ БАРТА
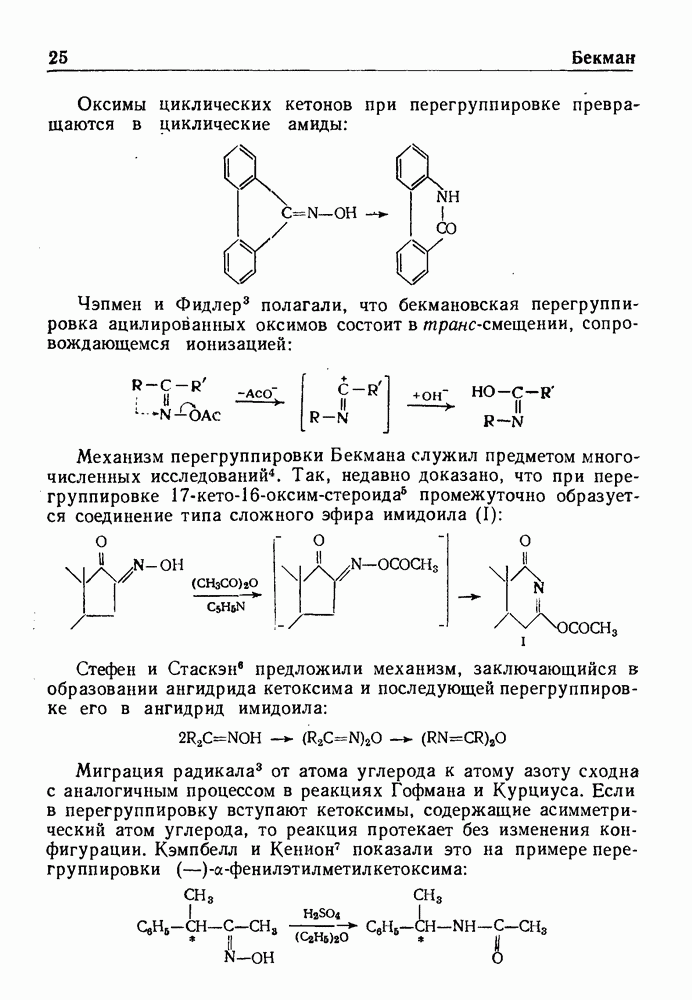
- ПЕРЕГРУППИРОВКА БЕКМАНА
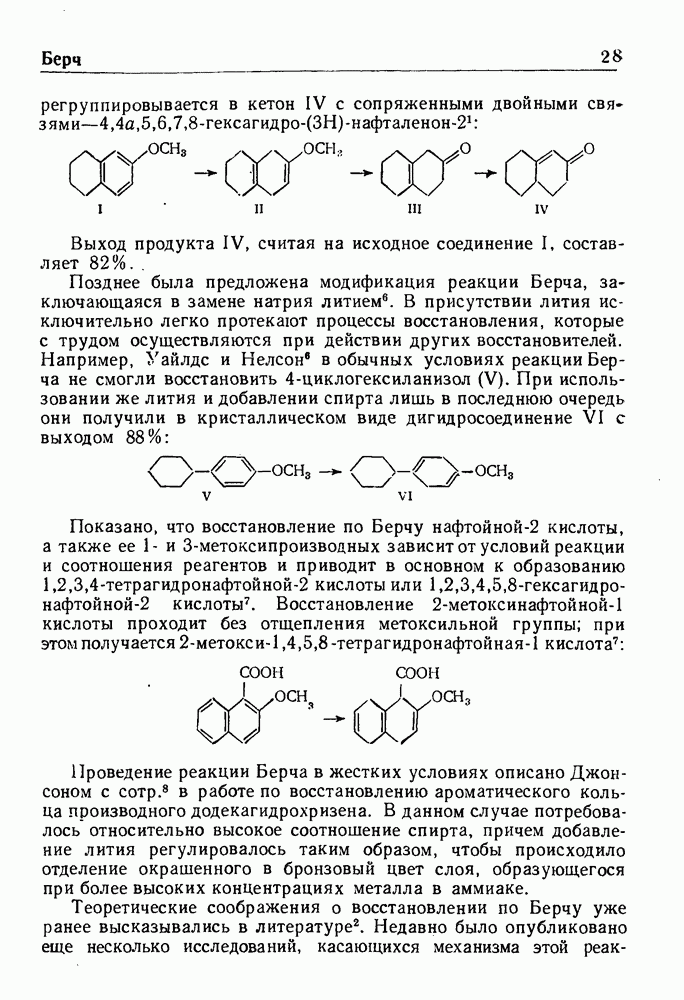
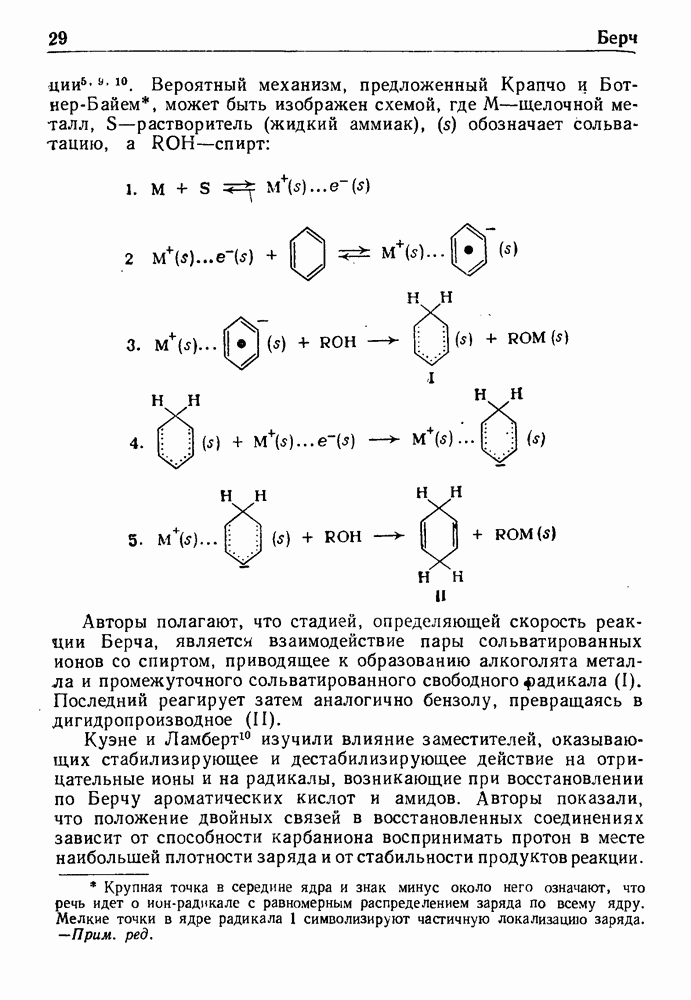
- ВОССТАНОВЛЕНИЕ ПО БЕРНУ
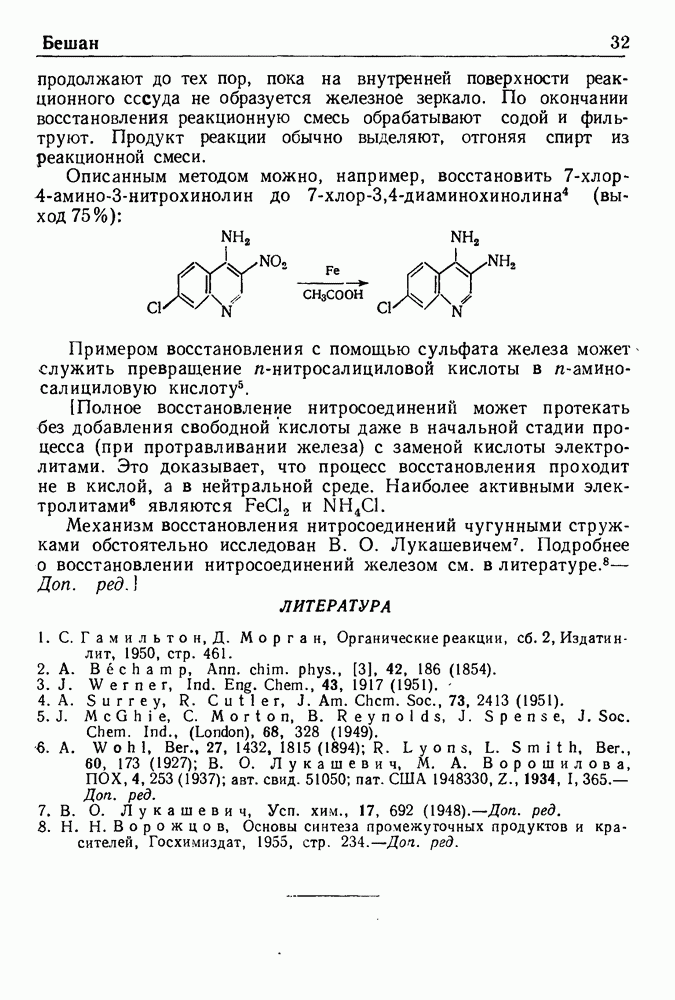
- ВОССТАНОВЛЕНИЕ ПО БЕШАНУ
- РЕАКЦИЯ БИШЛЕРА—НАПИРАЛЬСКОГО
- ХЛОРМЕТИЛИРОВАНИЕ ПО БЛАНУ
- РЕАКЦИЯ БРАУНА
- РАСЩЕПЛЕНИЕ АМИНОВ ПО БРАУНУ
- ВОССТАНОВЛЕНИЕ ПО БУВО—БЛАНУ
- СИНТЕЗ АЛЬДЕГИДОВ ПО БУВО
- РЕАКЦИЯ БУХЕРЕРА
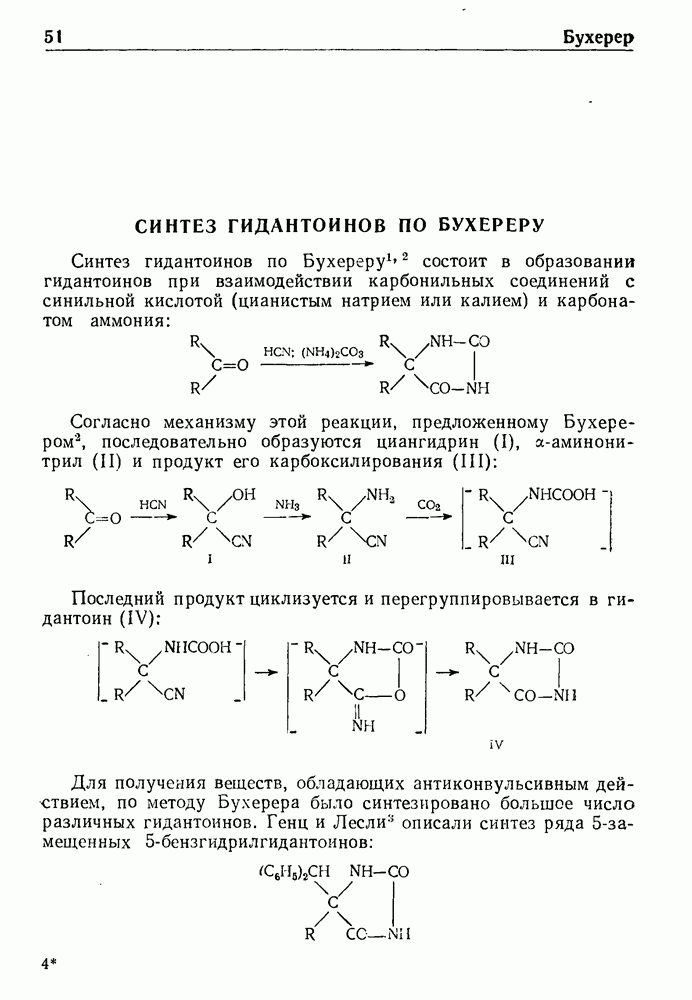
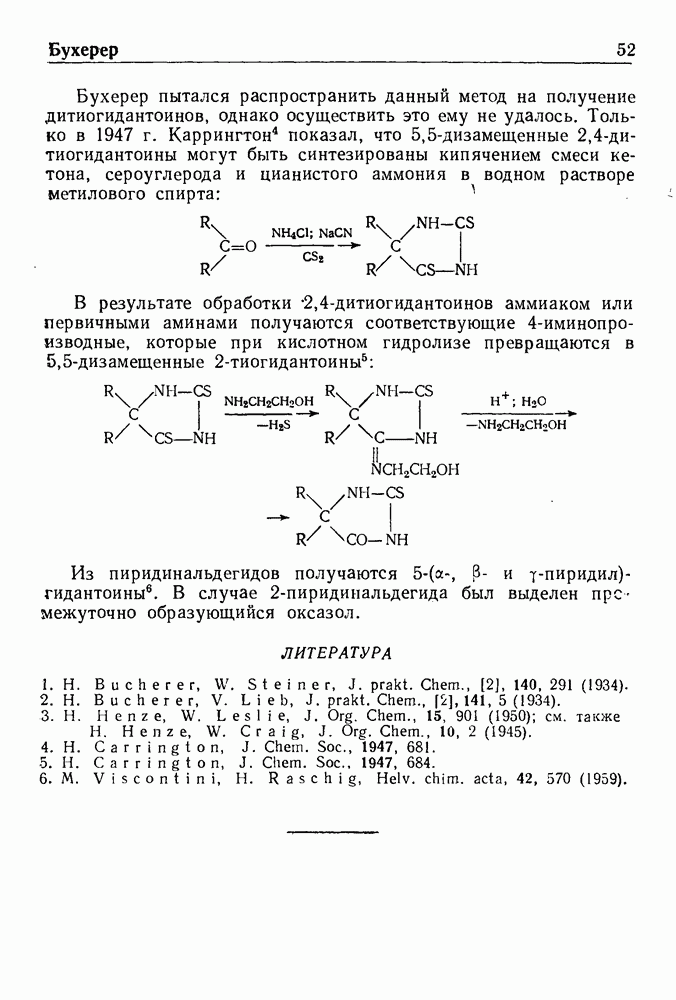
- СИНТЕЗ ГИДАНТОИНОВ ПО БУХЕРЕРУ
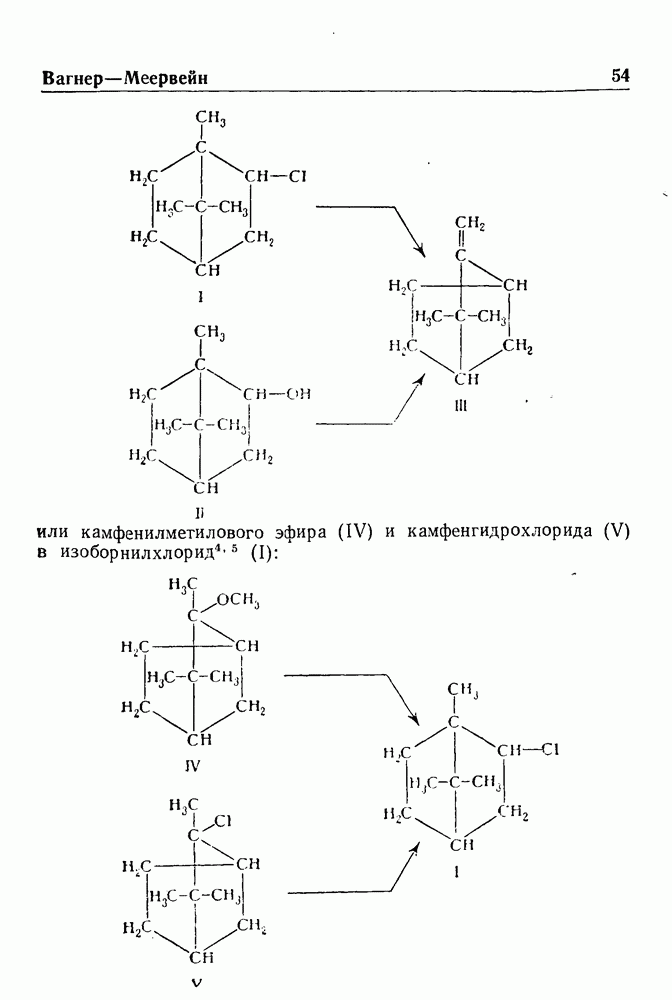
- ПЕРЕГРУППИРОВКА ВАГНЕРА—МЕЕРВЕЙНА
- РЕАКЦИЯ ВАЛЛАХА
- РЕАКЦИЯ ВИЛЬГЕРОДТА
- СИНТЕЗ ВИЛЬЯМСОНА
- РЕАКЦИЯ ВИТТИГА
- РЕАКЦИЯ ВОЛЯ-ЦИГЛЕРА
- РЕАКЦИЯ ВЮРЦА
- СИНТЕЗ ГАБРИЭЛЯ
- СИНТЕЗ ГАНЧА
- РЕАКЦИЯ ГАТТЕРМАНА
- СИНТЕЗ АЛЬДЕГИДОВ ПО ГАТТЕРМАНУ
- РЕАКЦИЯ ГАТТЕРМАНА—КОХА
- РЕАКЦИЯ ГЕЛЛЯ—ФОЛЬГАРДА—ЗЕЛИНСКОГО
- СИНТЕЗ ГЕША
- РЕАКЦИЯ ГОМБЕРГА—БАХМАНА—ХЕЯ
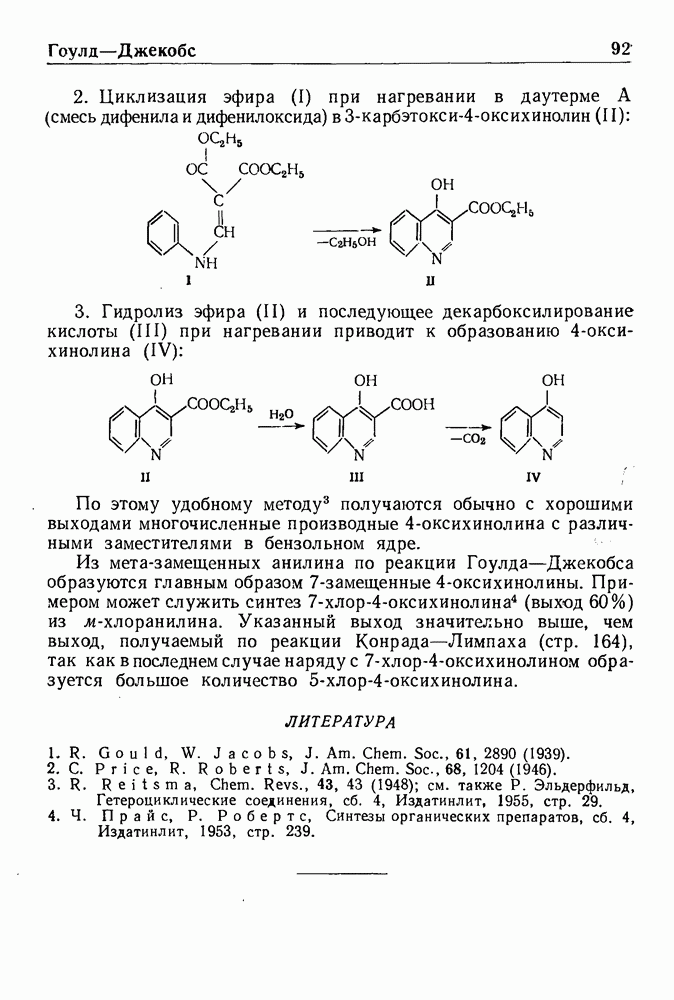
- РЕАКЦИЯ ГОУЛДА—ДЖЕКОБСА
- ПЕРЕГРУППИРОВКА ГОФМАНА
- РАСЩЕПЛЕНИЕ ПО ГОФМАНУ
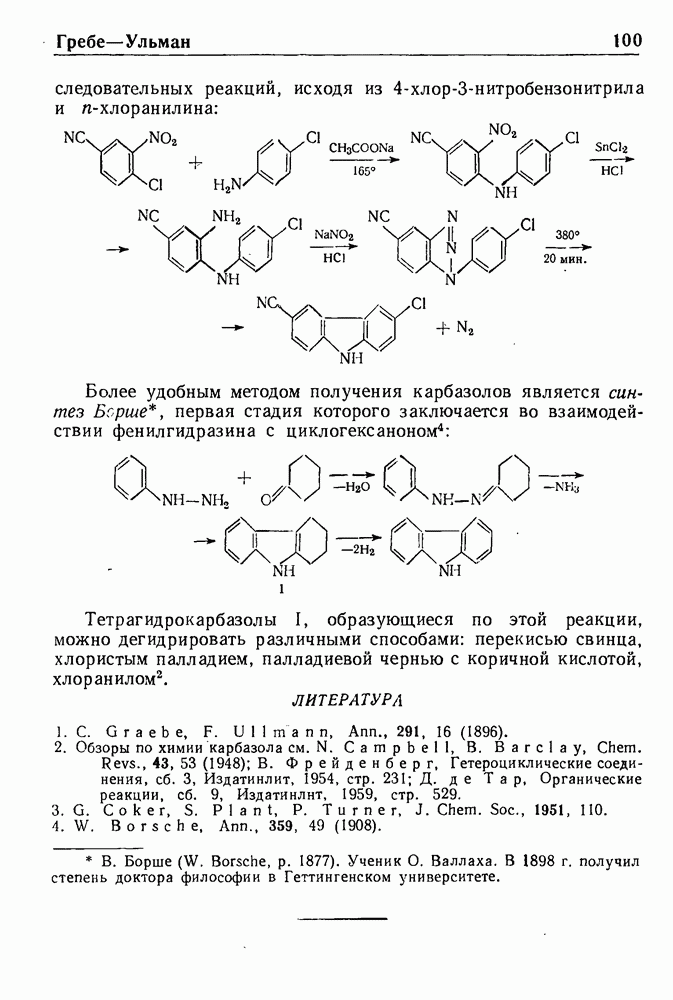
- СИНТЕЗ ГРЕБЕ—УЛЬМАНА
- РЕАКЦИЯ ГРИНЬЯРА
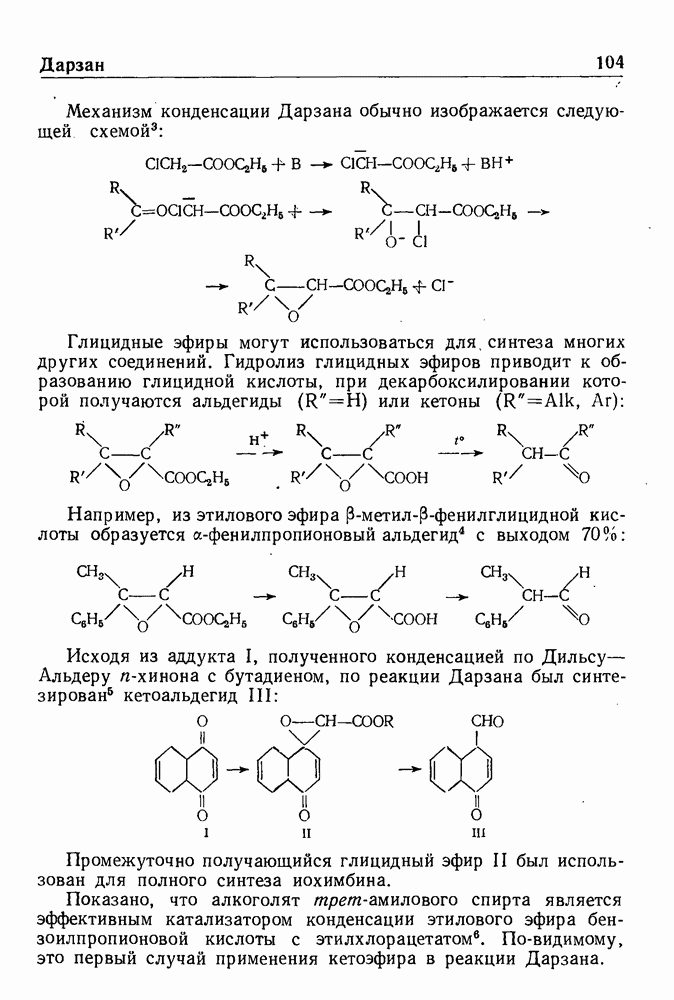
- СИНТЕЗ ГЛИЦИДНЫХ ЭФИРОВ ПО ДАРЗАНУ
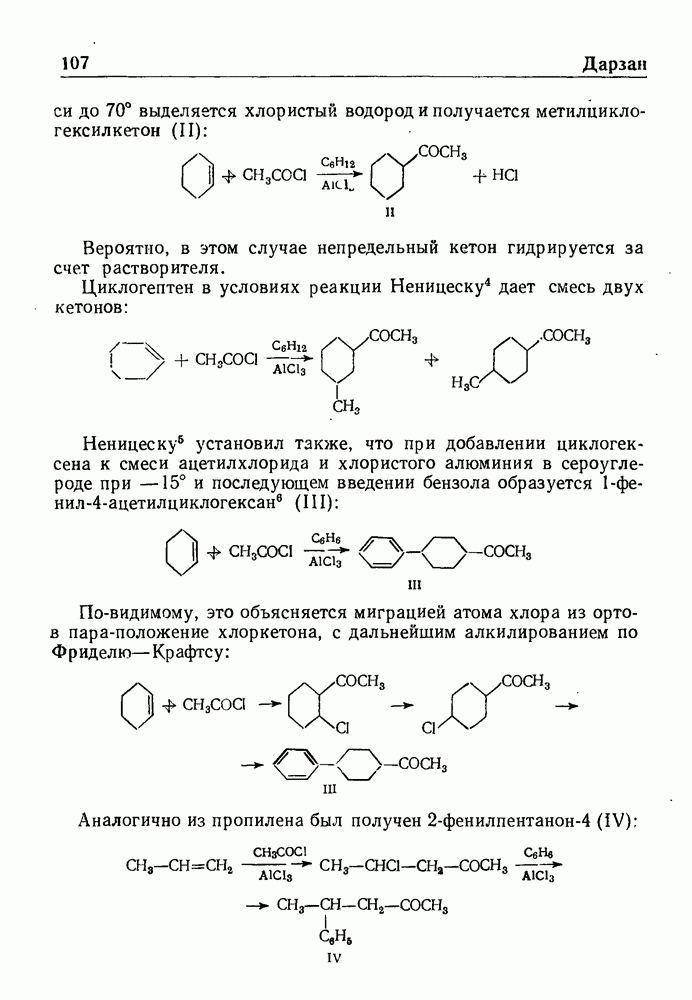
- СИНТЕЗ НЕПРЕДЕЛЬНЫХ КЕТОНОВ ПО ДАРЗАНУ
- РЕАКЦИЯ ДАФФА
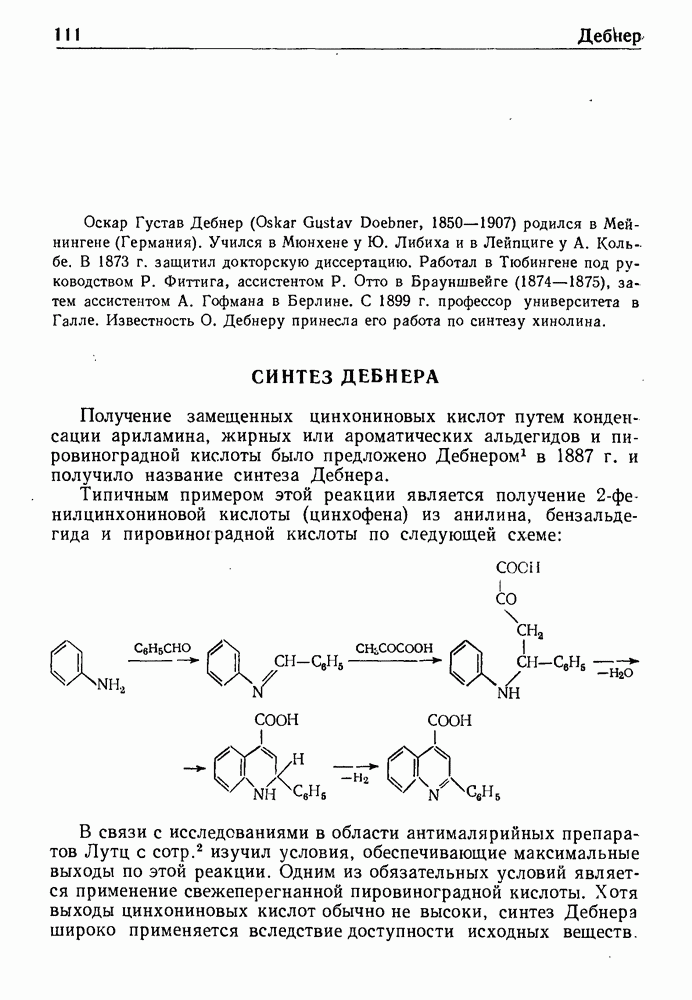
- СИНТЕЗ ДЕБНЕРА
- СИНТЕЗ ДЕБНЕРА—МИЛЛЕРА
- РЕАКЦИЯ ДЕЛЕПИНА
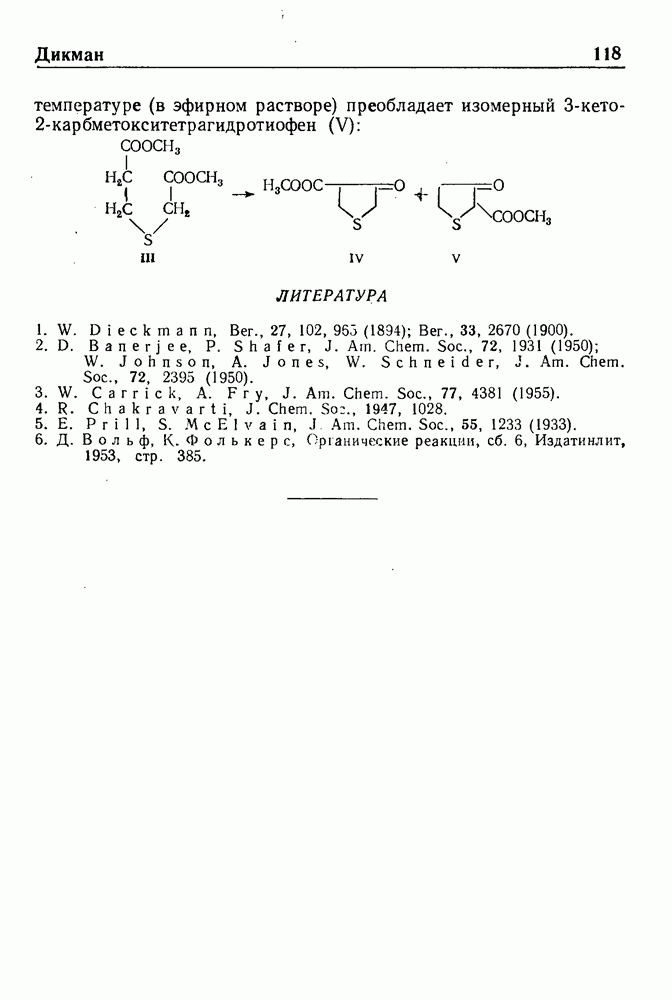
- РЕАКЦИЯ ДИКМАНА
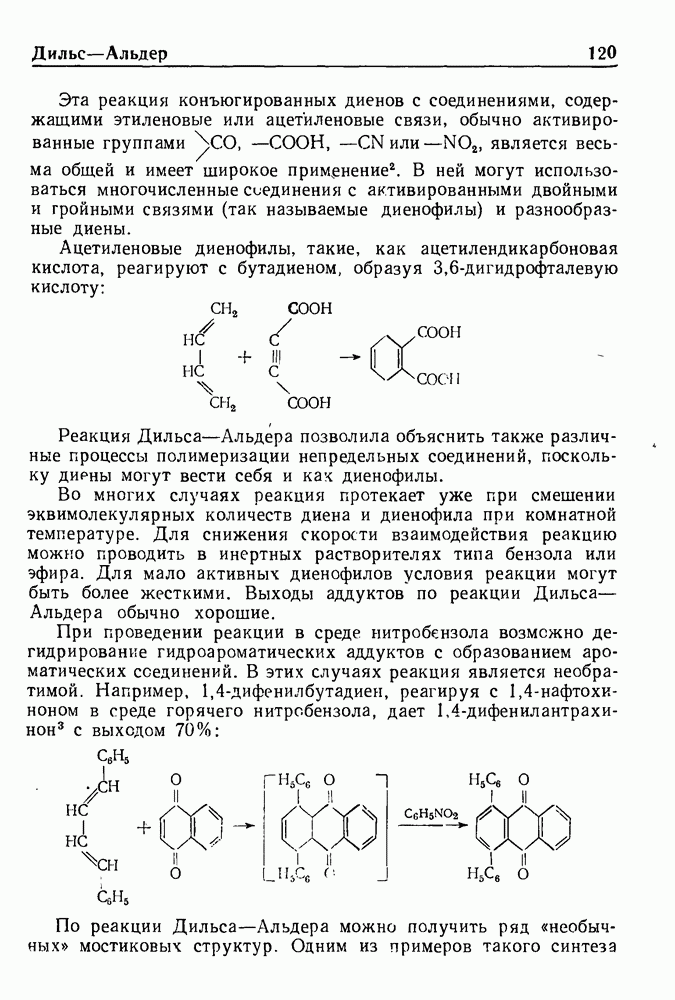
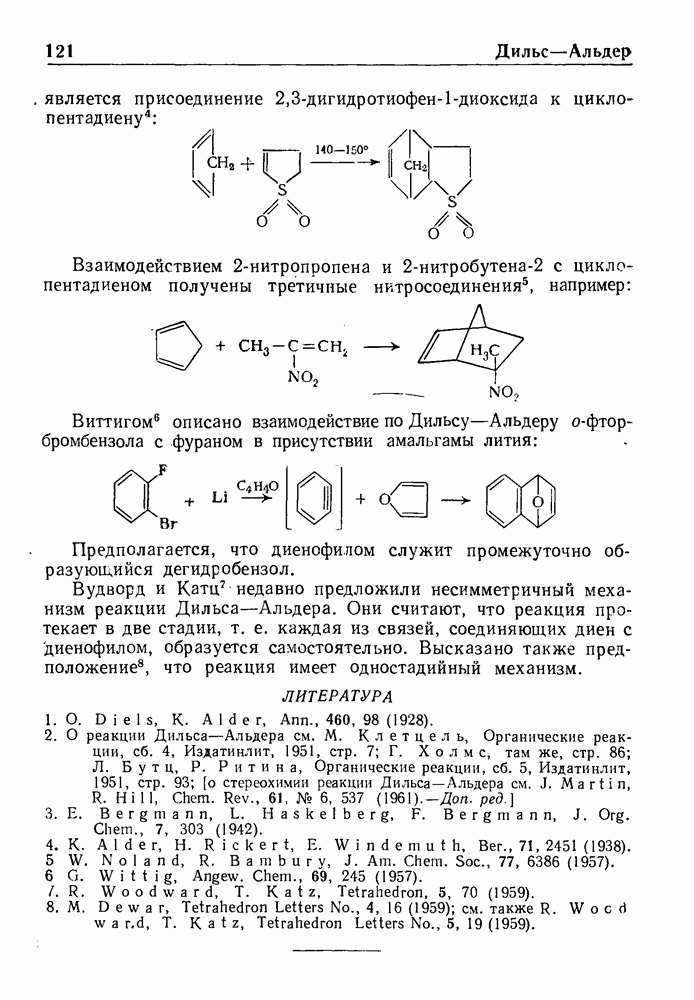
- РЕАКЦИЯ ДИЛЬСА-АЛЬДЕРА
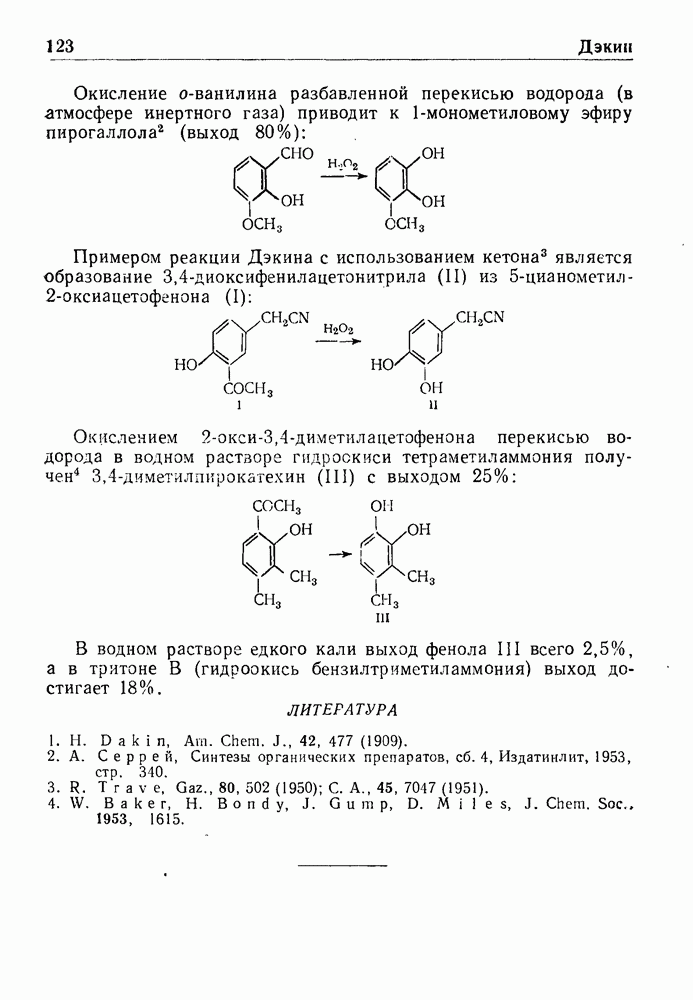
- РЕАКЦИЯ ДЭКИНА
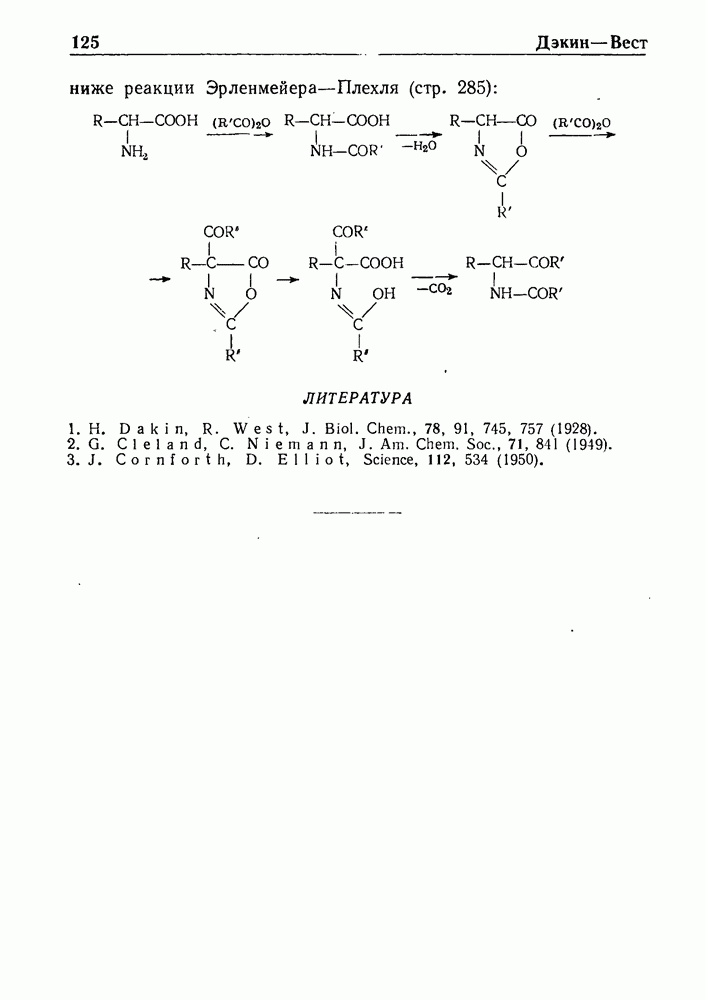
- РЕАКЦИЯ ДЭКИНА—ВЕСТА
- РЕАКЦИЯ ЗАНДМЕЙЕРА
- РЕАКЦИЯ ИВАНОВА
- РЕАКЦИЯ ИОЦИЧА
- РЕАКЦИЯ КАННИЦЦАРО
- РЕАКЦИЯ КИЖНЕРА
- КОНДЕНСАЦИЯ КЛАЙЗЕНА
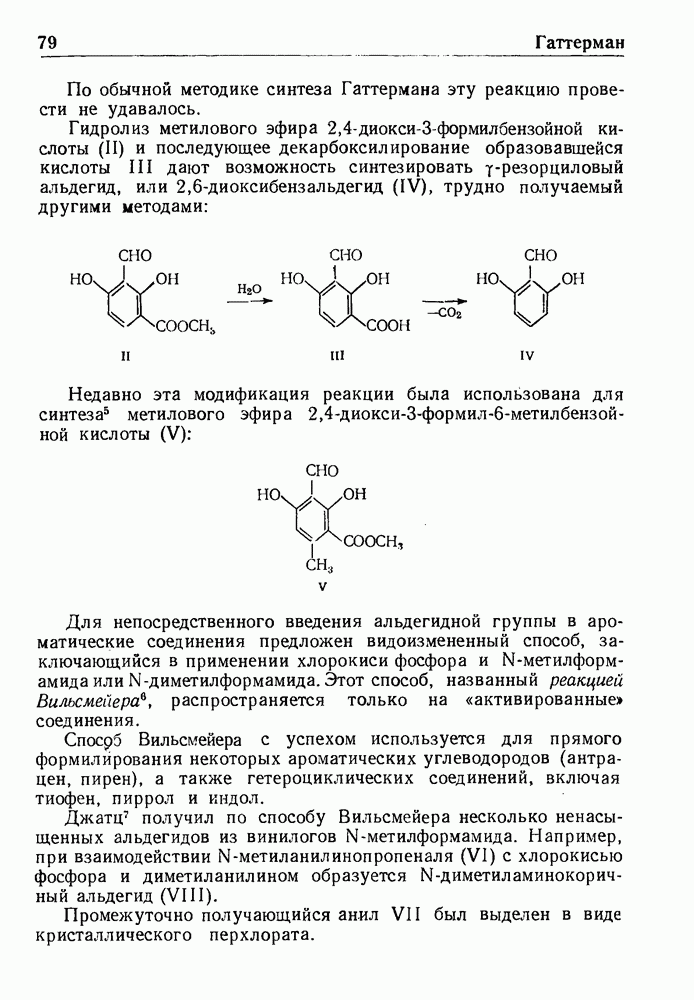
- ПЕРЕГРУППИРОВКА КЛАЙЗЕНА
- КОНДЕНСАЦИЯ КЛАЙЗЕНА—ШМИДТА
- ВОССТАНОВЛЕНИЕ ПО КЛЕММЕНСЕНУ
- РЕАКЦИЯ КНЕВЕНАГЕЛЯ
- СИНТЕЗ КНОРРА
- РЕАКЦИЯ КОЛЬБЕ—ШМИТТА
- ЭЛЕКТРОХИМИЧЕСКАЯ РЕАКЦИЯ КОЛЬБЕ
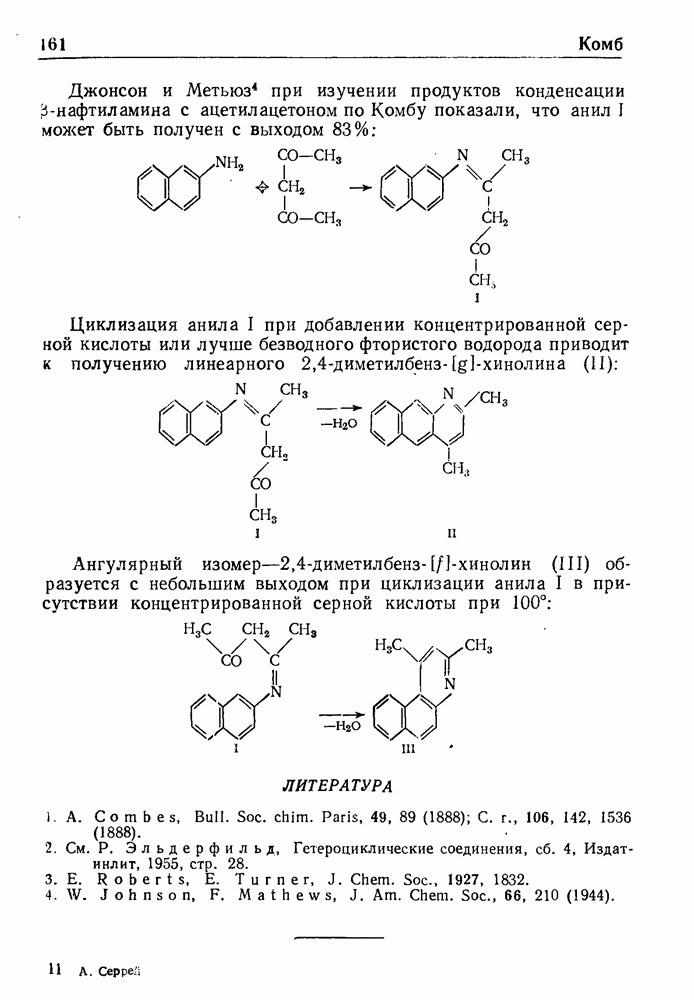
- СИНТЕЗ ХИНОЛИНА ПО КОМБУ
- РЕАКЦИЯ КОНОВАЛОВА
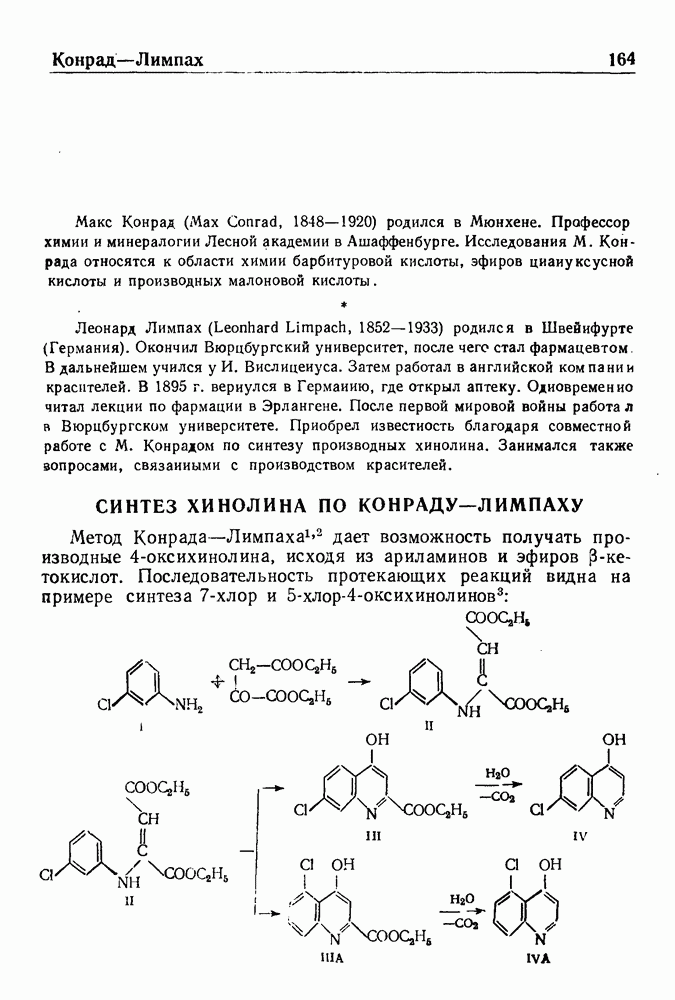
- СИНТЕЗ ХИНОЛИНА ПО КОНРАДУ—ЛИМПАХУ
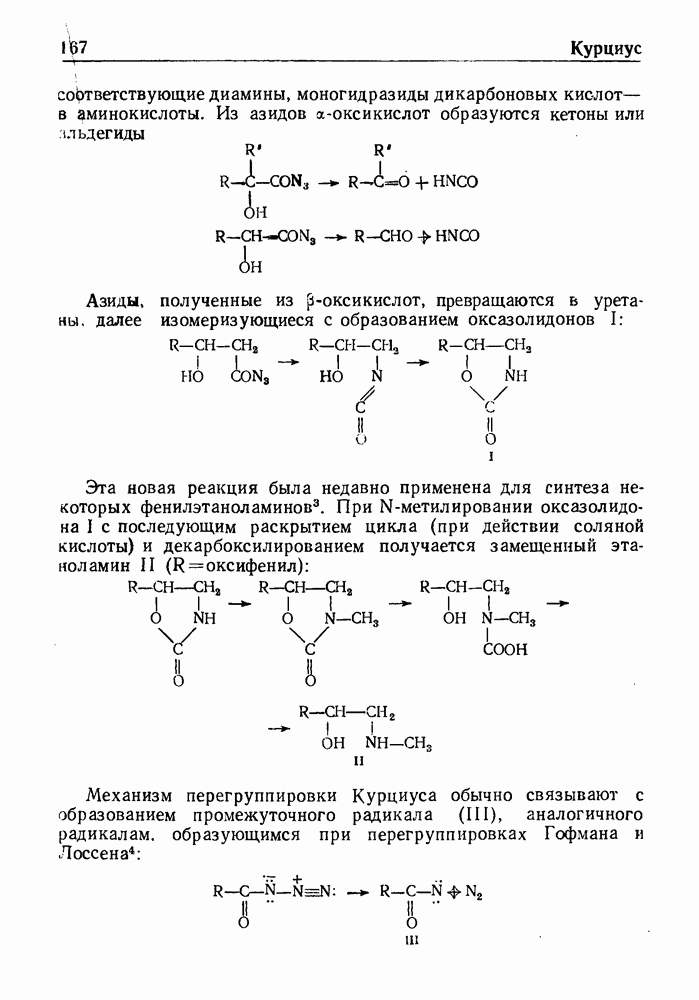
- РЕАКЦИЯ КУРЦИУСА
- РЕАКЦИЯ КУЧЕРОВА
- РЕАКЦИЯ КЭМПСА
- РЕАКЦИЯ ЛЕЙКАРТА
- РЕАКЦИЯ ЛОССЕНА
- ВОССТАНОВЛЕНИЕ ПО МАК ФАДИЕНУ—СТИВЕНСУ
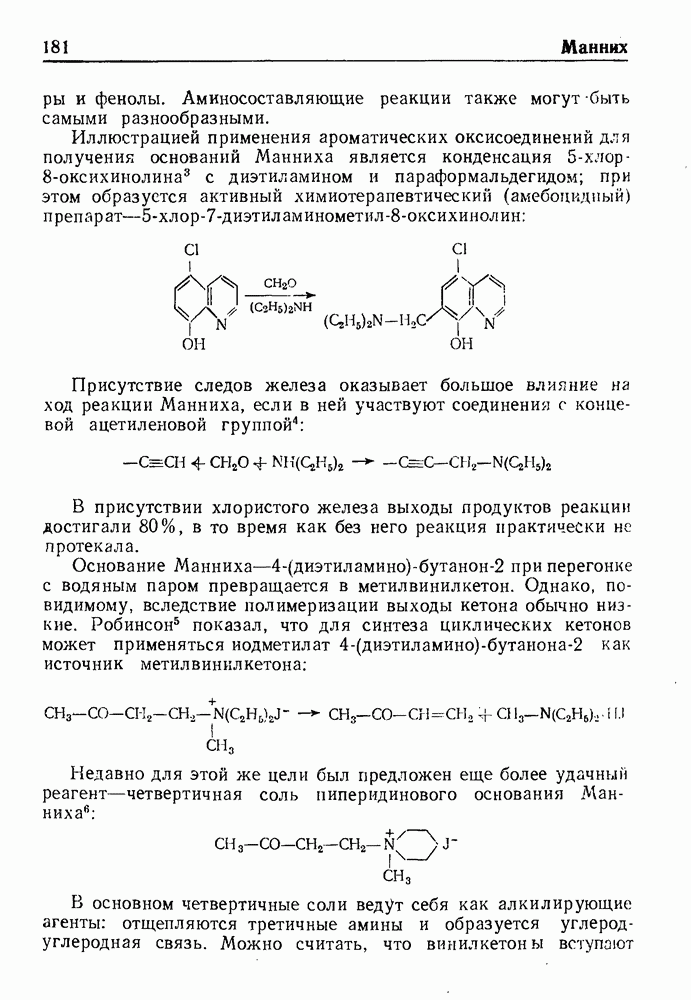
- РЕАКЦИЯ МАННИХА
- КОНДЕНСАЦИЯ МЕЕРВЕЙНА
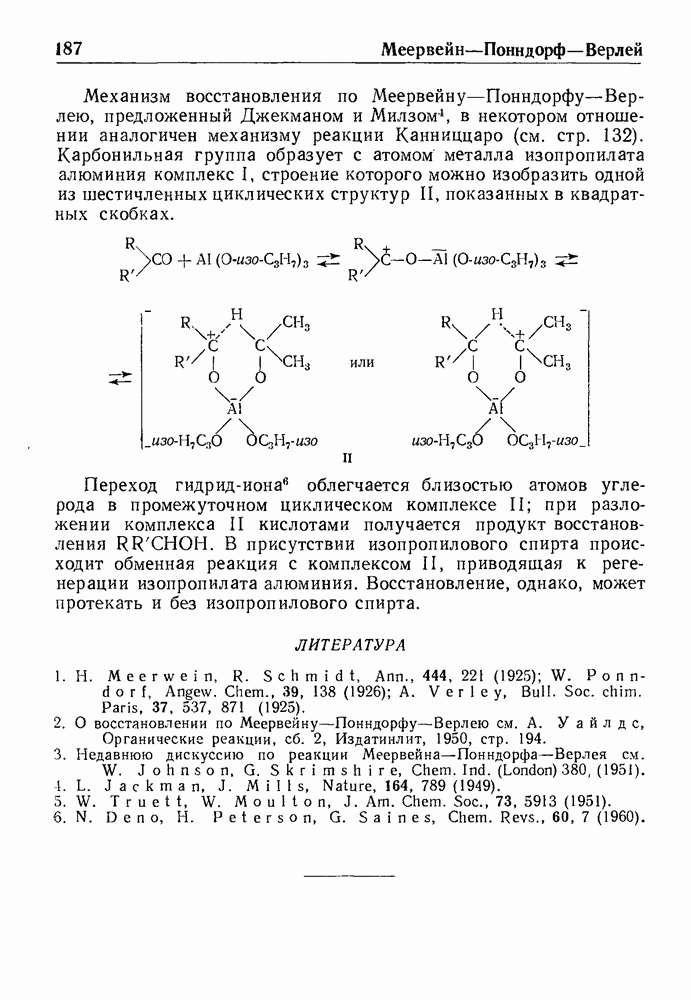
- ВОССТАНОВЛЕНИЕ ПО МЕЕРВЕЙНУ-ПОННДОРФУ-ВЕРЛЕЮ
- РЕАКЦИЯ МИХАЭЛЯ
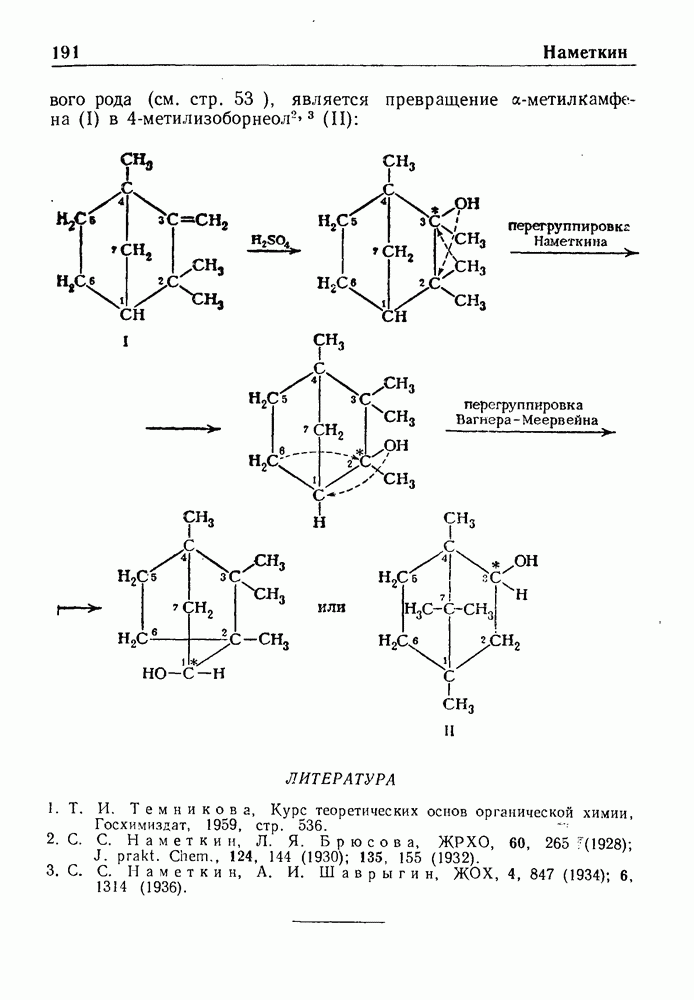
- ПЕРЕГРУППИРОВКА НАМЕТКИНА
- РЕАКЦИЯ НЕСМЕЯНОВА
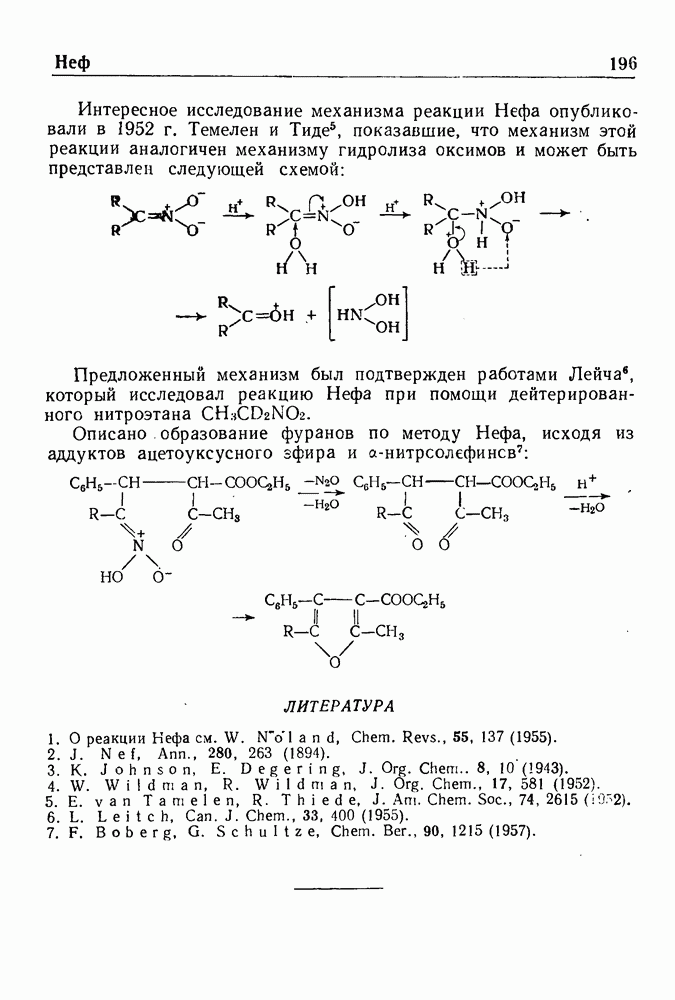
- РЕАКЦИЯ НЕФА
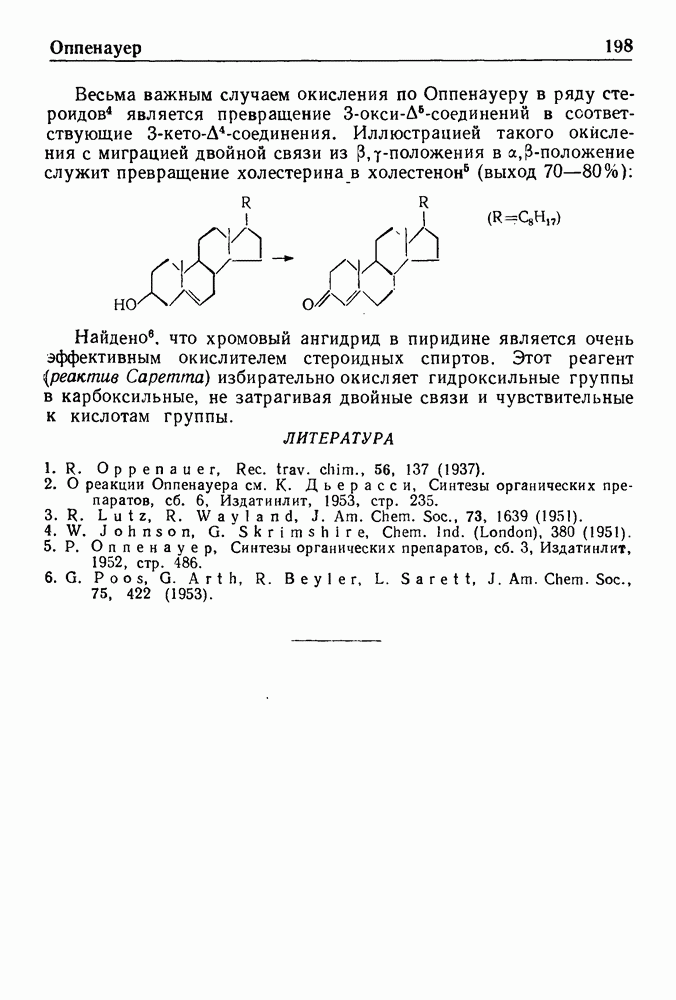
- ОКИСЛЕНИЕ ПО ОППЕНАУЕРУ
- РЕАКЦИЯ ПАССЕРИНИ
- РЕАКЦИЯ ПЕРКИНА
- КОНДЕНСАЦИЯ ПЕХМАНА
- РЕАКЦИЯ ПИКТЭ—ШПЕНГЛЕРА
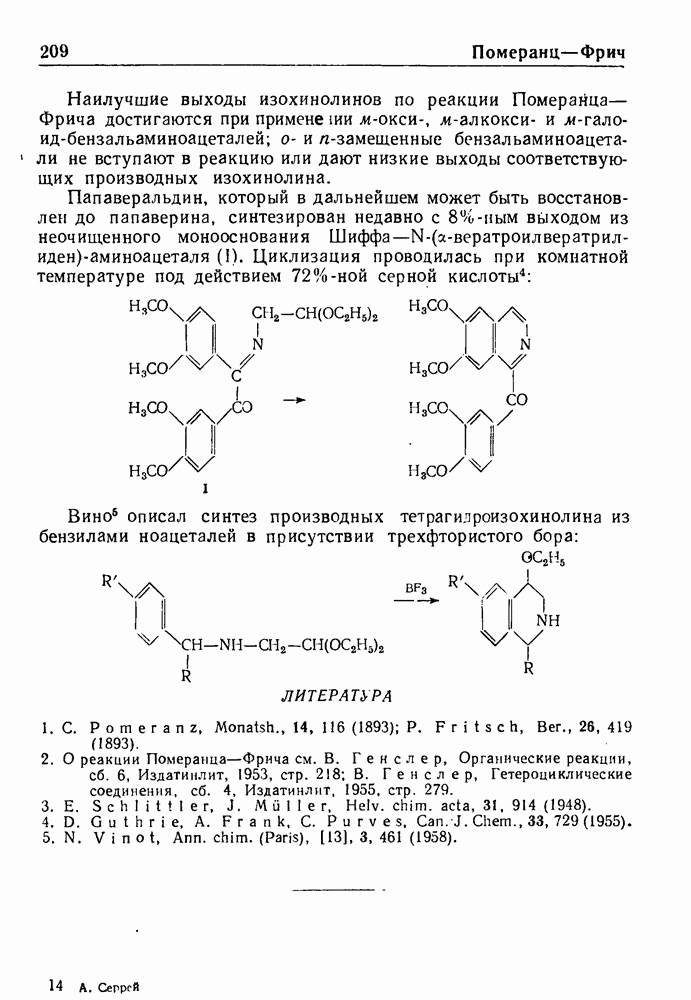
- РЕАКЦИЯ ПОМЕРАНЦА—ФРИЧА
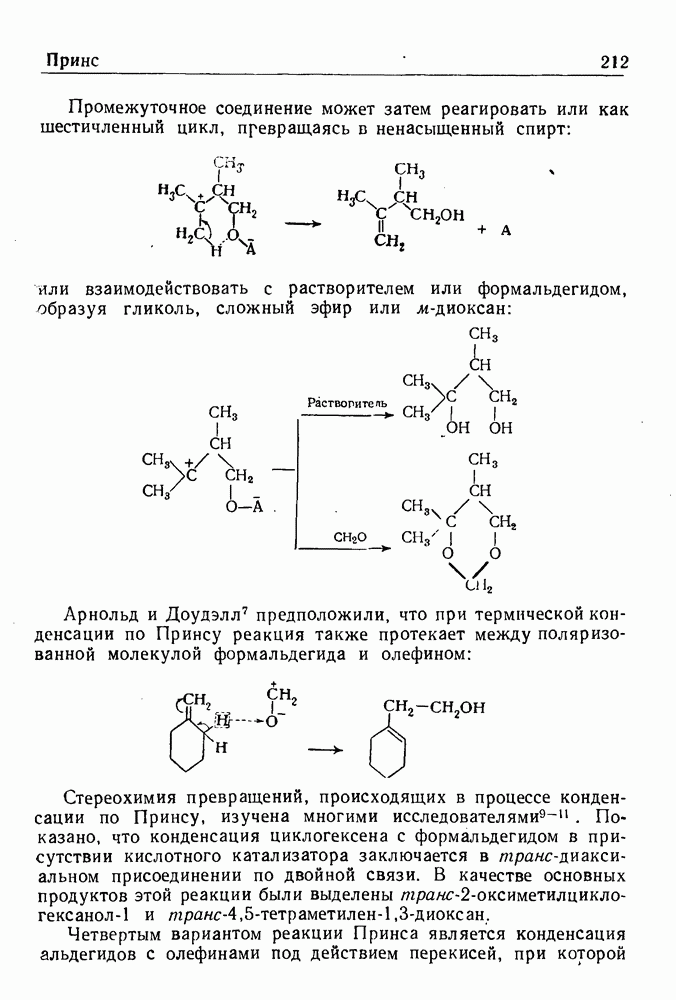
- РЕАКЦИЯ ПРИНСА
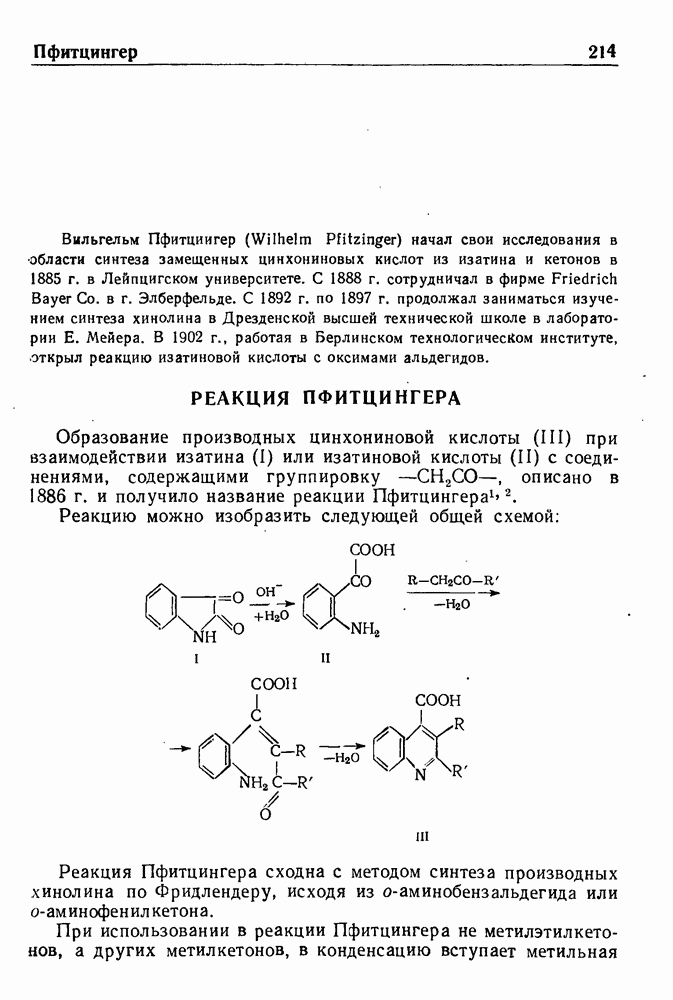
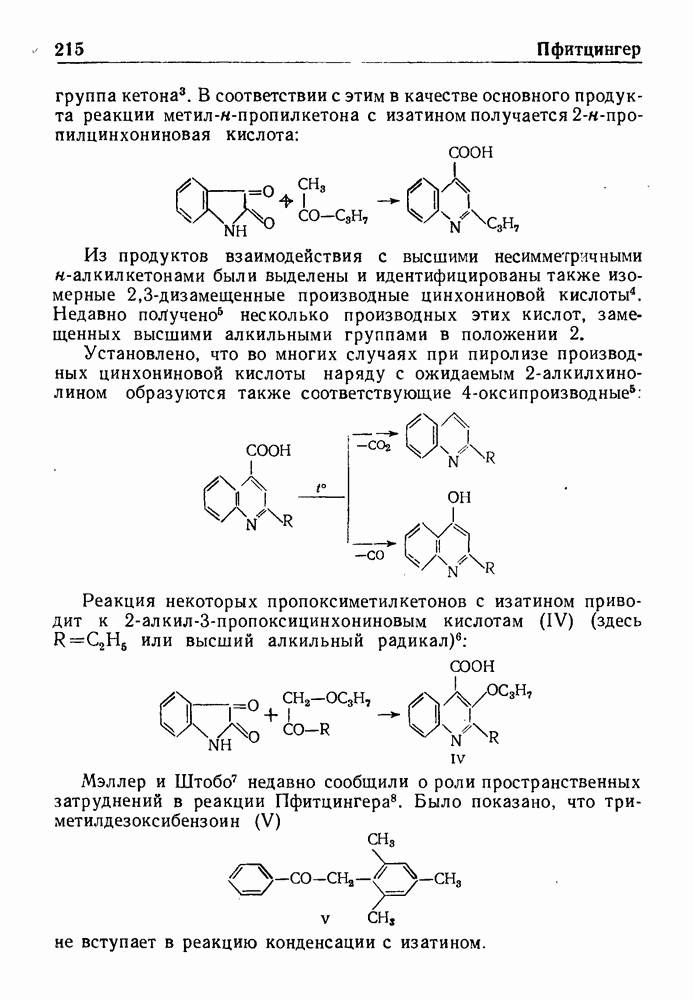
- РЕАКЦИЯ ПФИТЦИНГЕРА
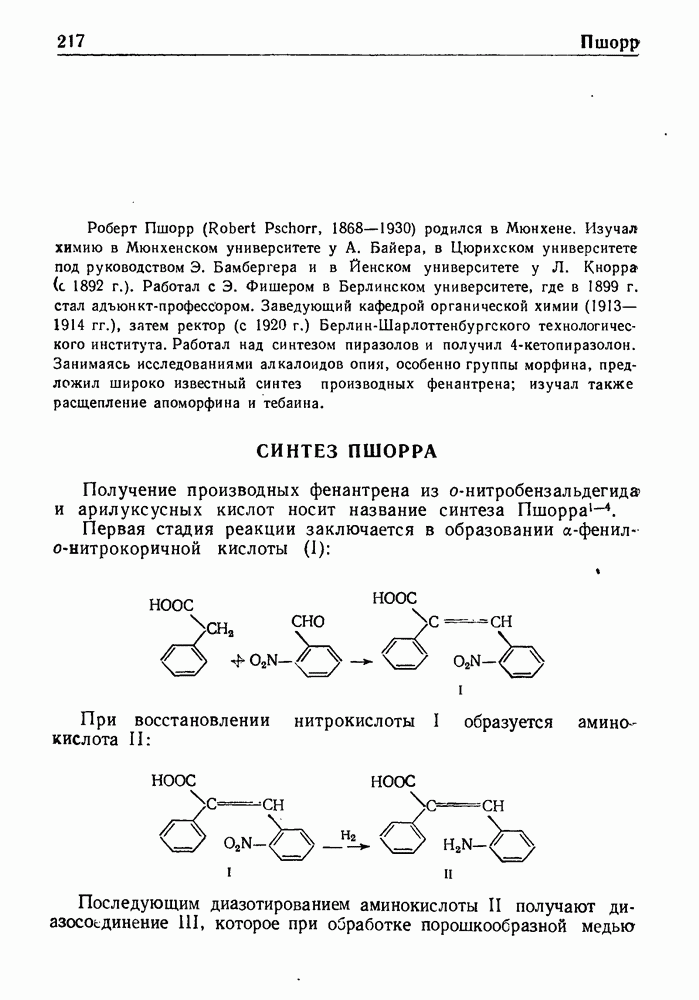
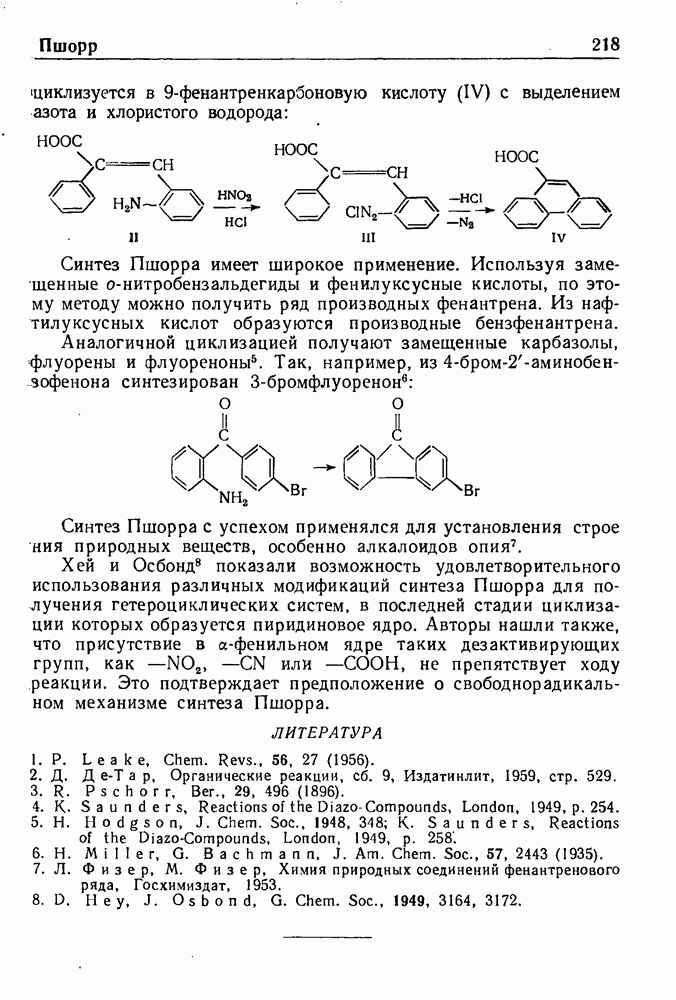
- СИНТЕЗ ПШОРРА
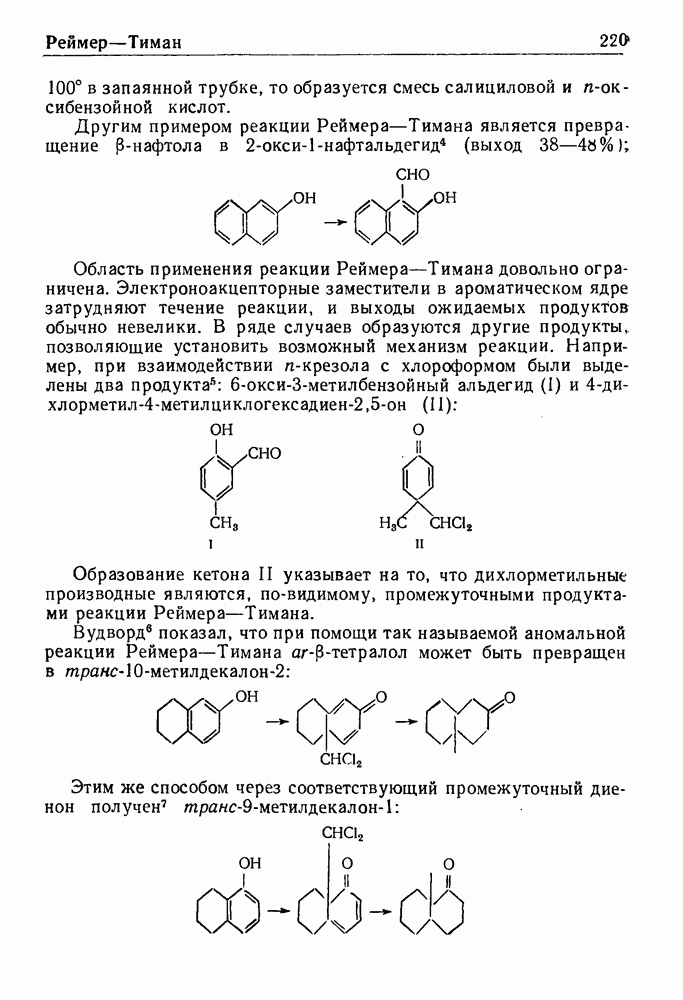
- РЕАКЦИЯ РЕЙМЕРА—ТИМАНА
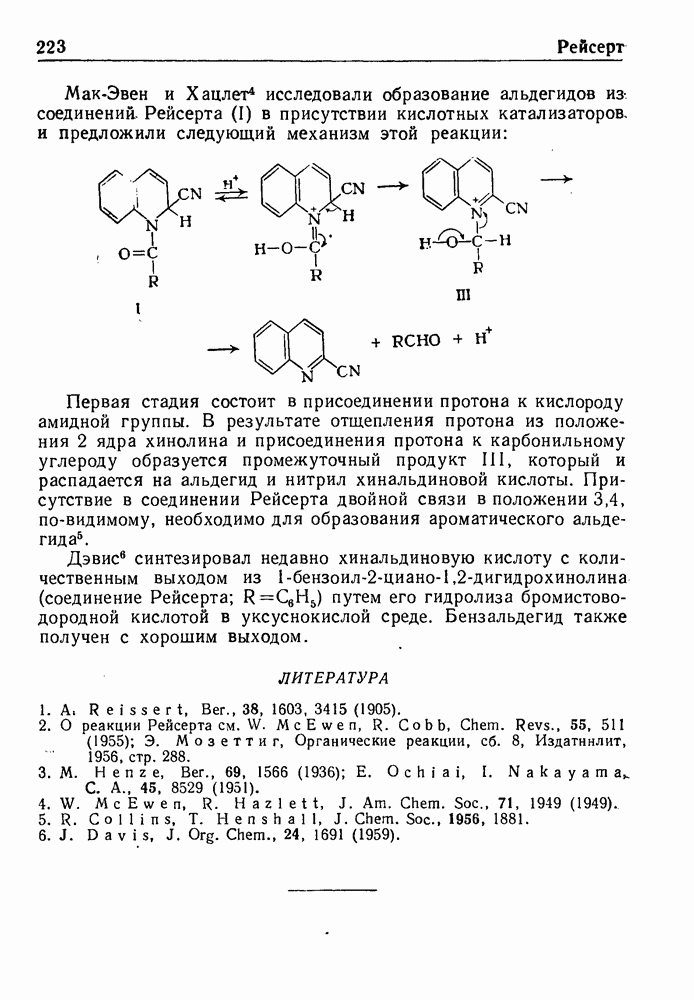
- РЕАКЦИЯ РЕЙСЕРТА
- РЕАКЦИЯ РЕФОРМАТСКОГО
- РЕАКЦИЯ РОДИОНОВА
- ВОССТАНОВЛЕНИЕ ПО РОЗЕНМУНДУ
- РЕАКЦИЯ СКРАУПА
- РЕАКЦИЯ СОММЛЕ
- РЕАКЦИЯ СТЕФЕНА
- ПЕРЕГРУППИРОВКА СТИВЕНСА
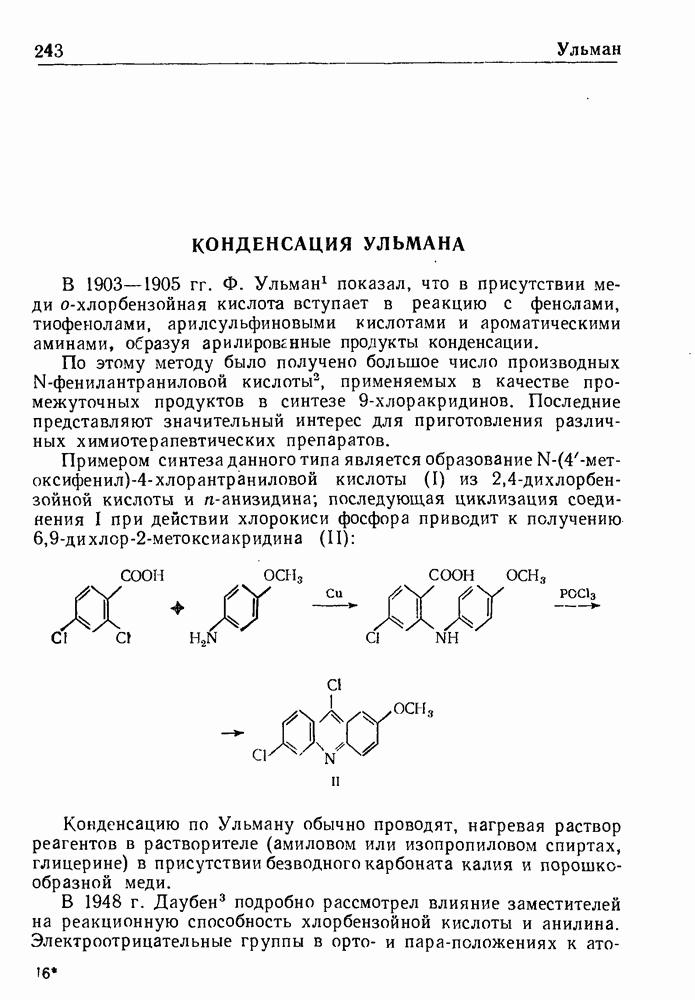
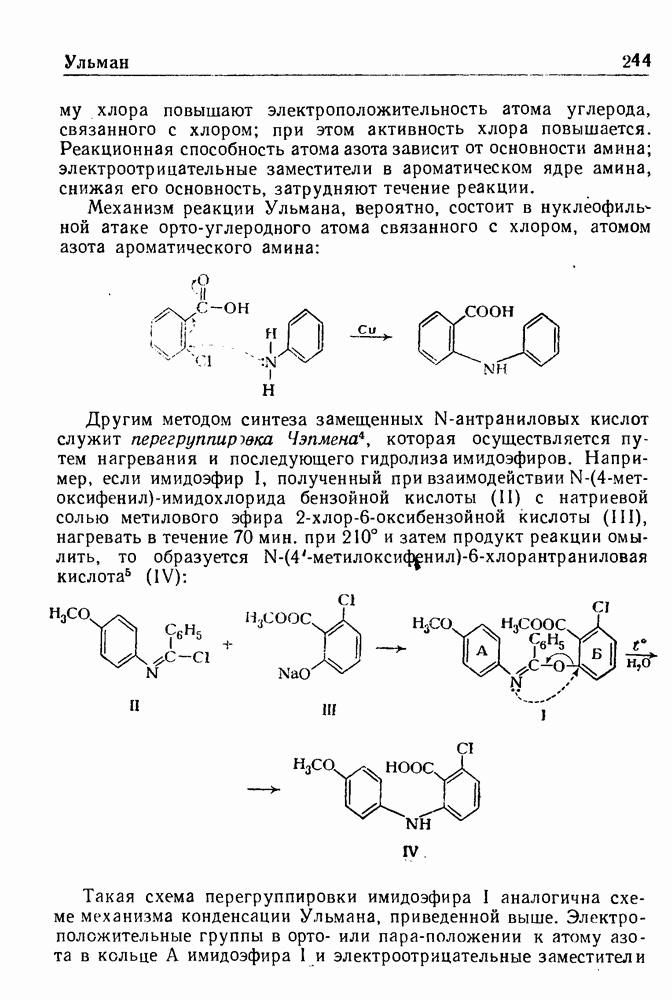
- РЕАКЦИЯ УЛЬМАНА
- КОНДЕНСАЦИЯ УЛЬМАНА
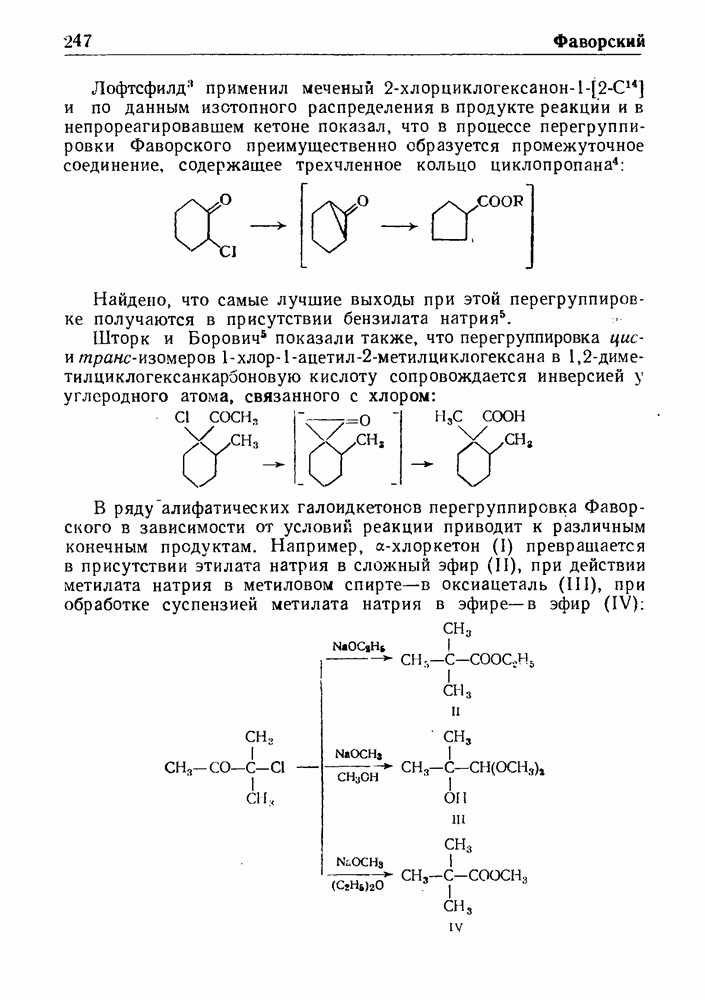
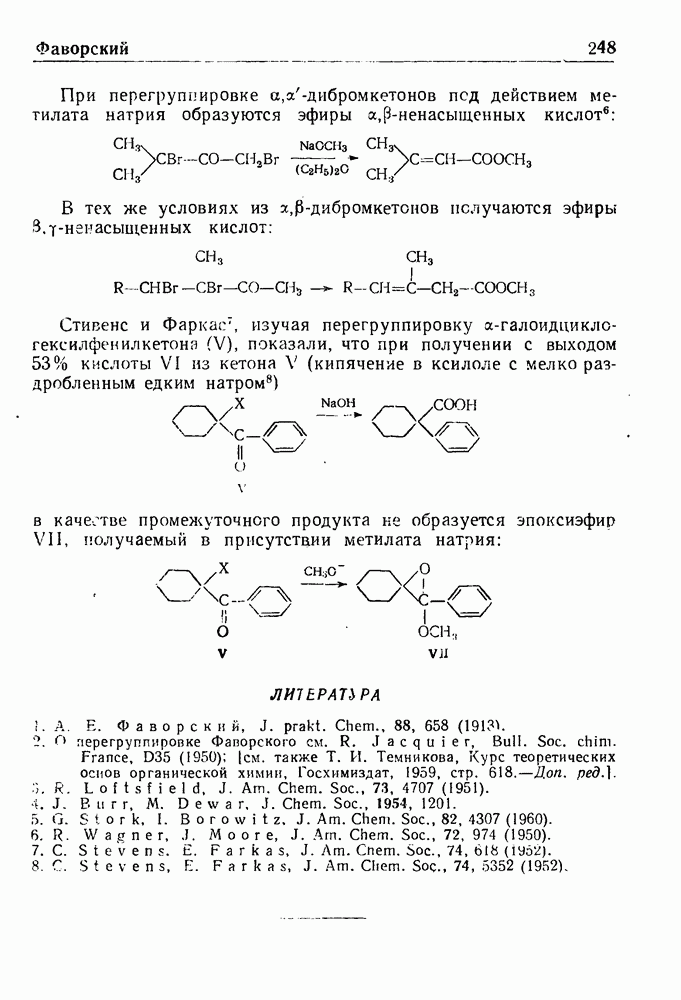
- ПЕРЕГРУППИРОВКА ФАВОРСКОГО
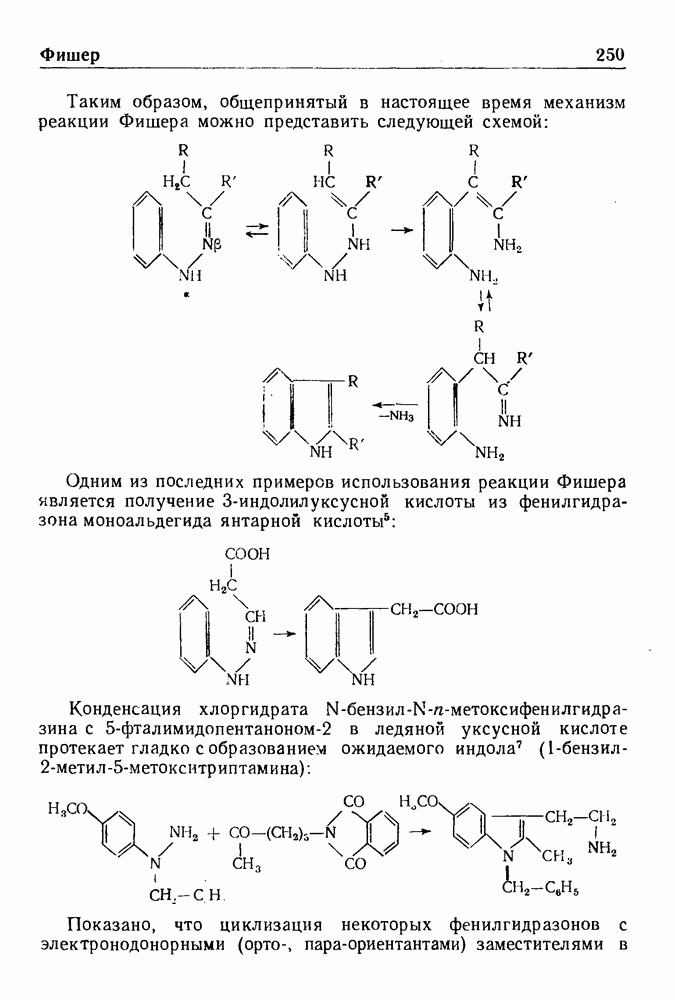
- СИНТЕЗ ИНДОЛА ПО ФИШЕРУ
- РЕАКЦИЯ ФРИДЕЛЯ—КРАФТСА
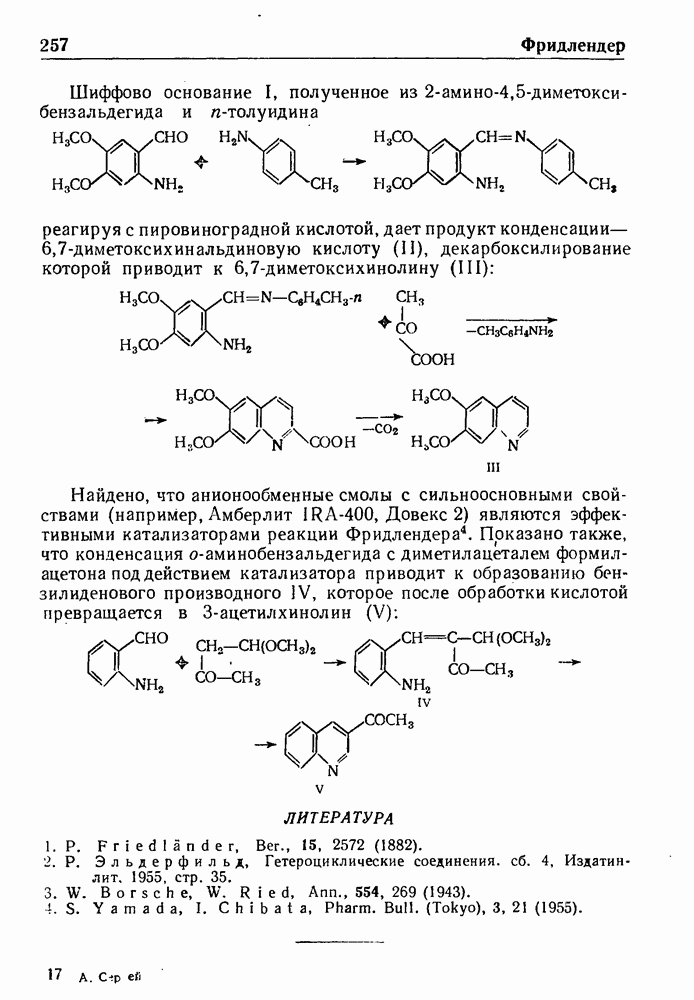
- СИНТЕЗ ФРИДЛЕНДЕРА
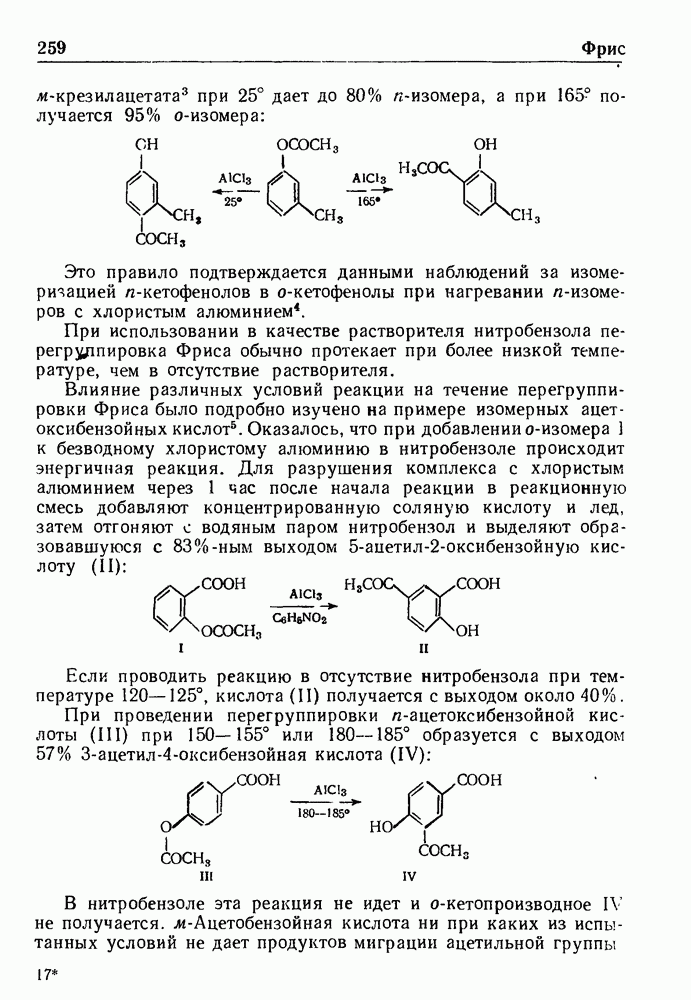
- РЕАКЦИЯ ФРИСА
- РЕАКЦИЯ ХУНСДИККЕРА
- РЕАКЦИЯ ЧИЧИБАБИНА
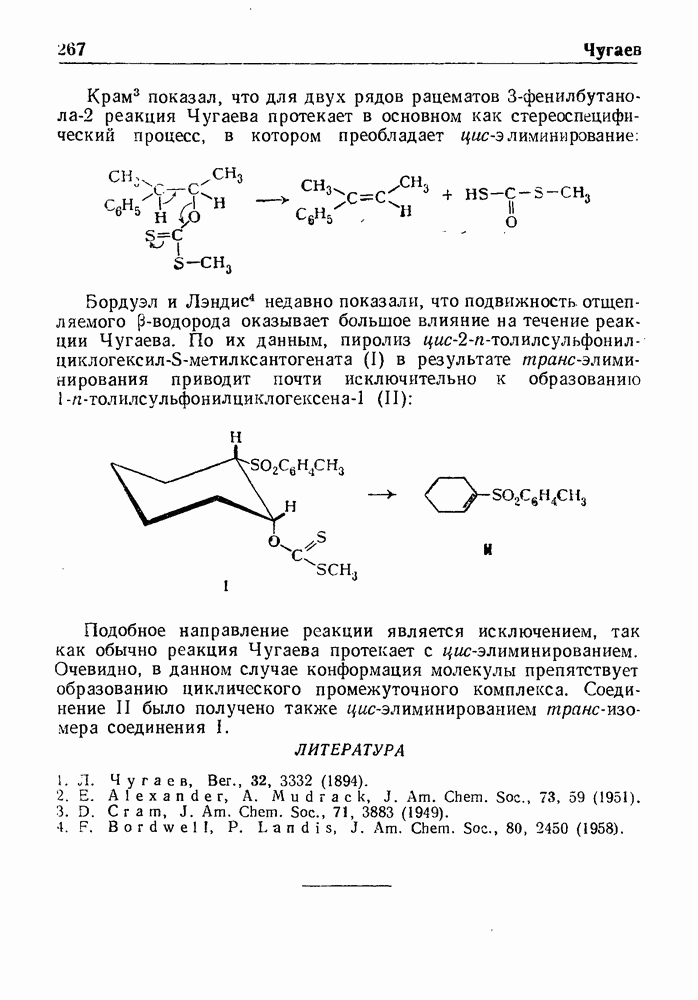
- РЕАКЦИЯ ЧУГАЕВА
- РЕАКЦИЯ ШИМАНА
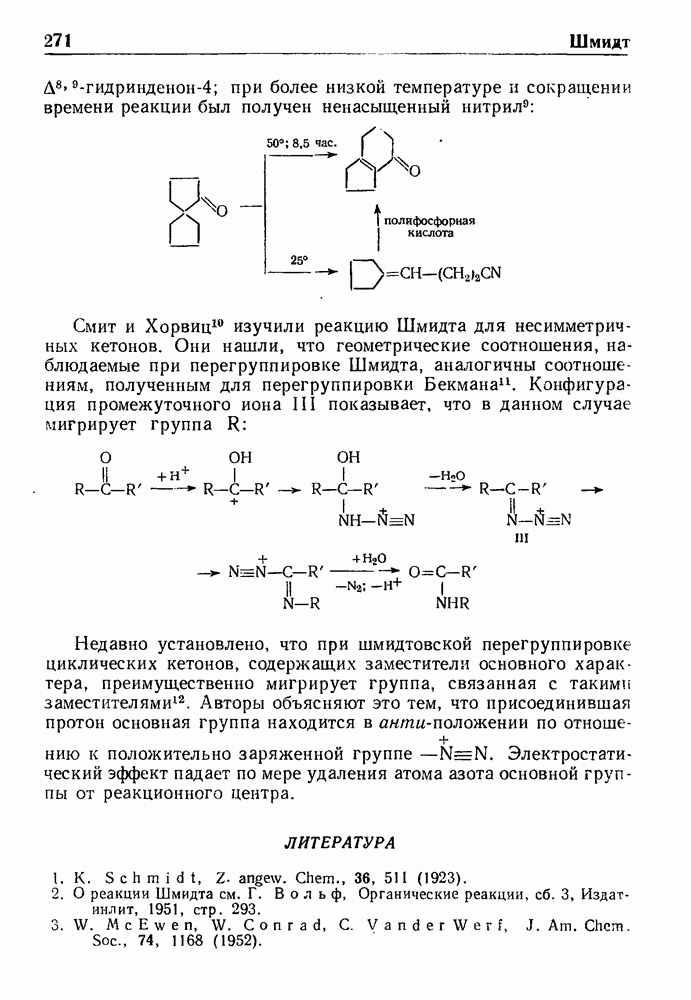
- РЕАКЦИИ ШМИДТА
- КОНДЕНСАЦИЯ ШТОББЕ
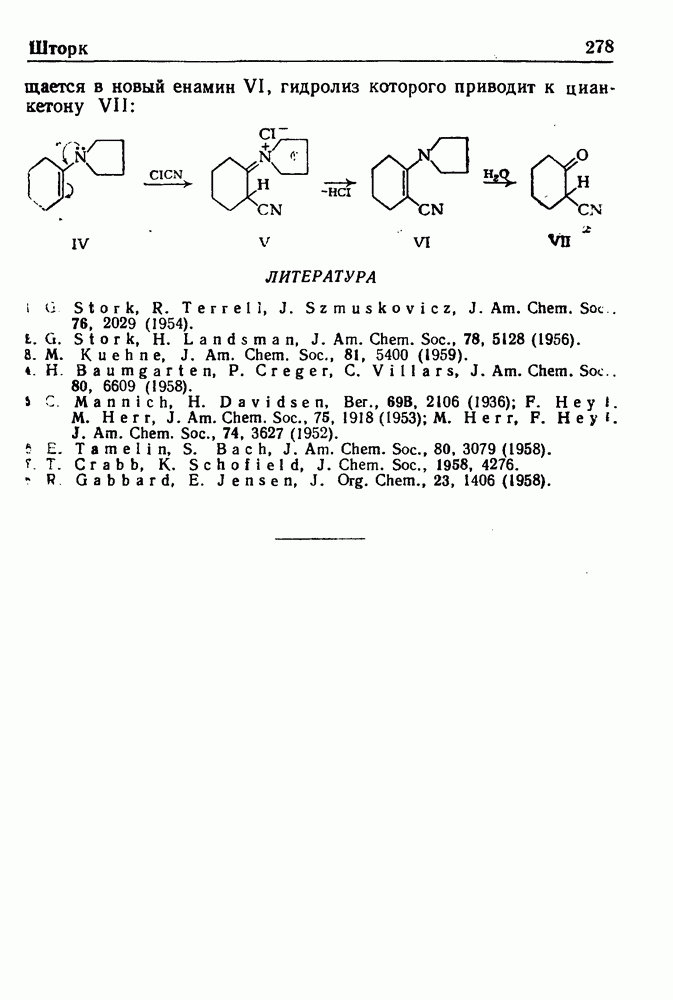
- РЕАКЦИЯ ШТОРКА
- РЕАКЦИЯ ЭЛБСА
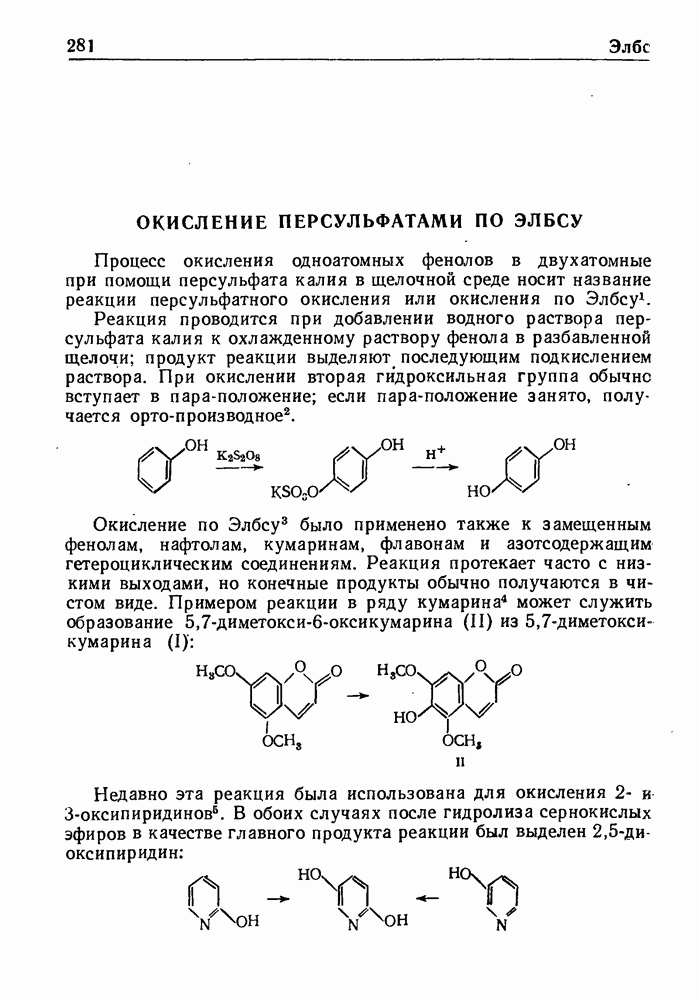
- ОКИСЛЕНИЕ ПЕРСУЛЬФАТАМИ ПО ЭЛБСУ
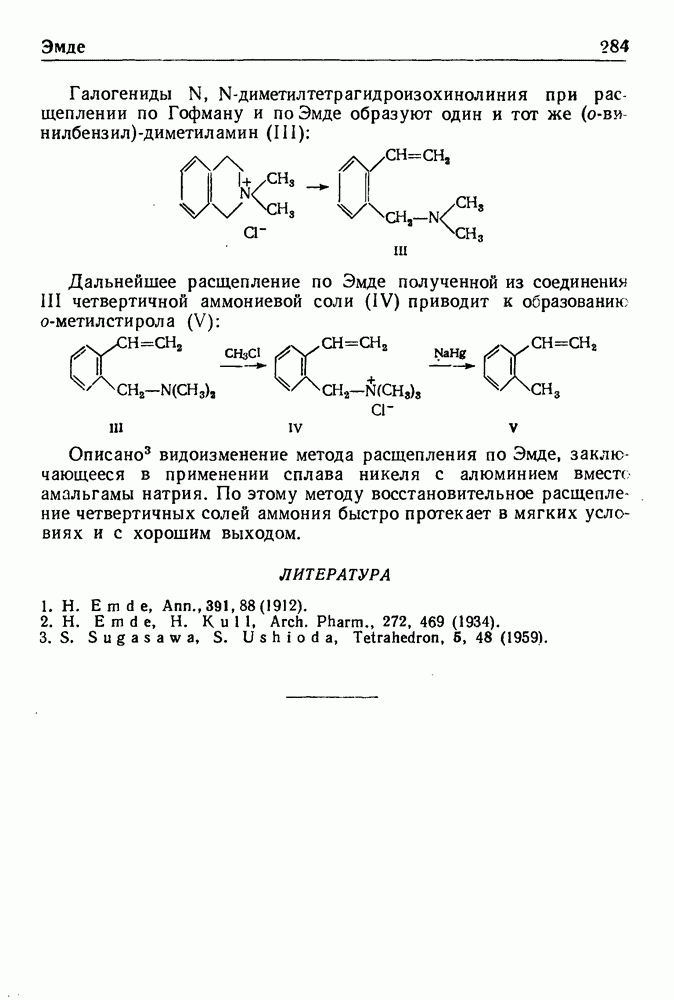
- РАСЩЕПЛЕНИЕ ПО ЭМДЕ
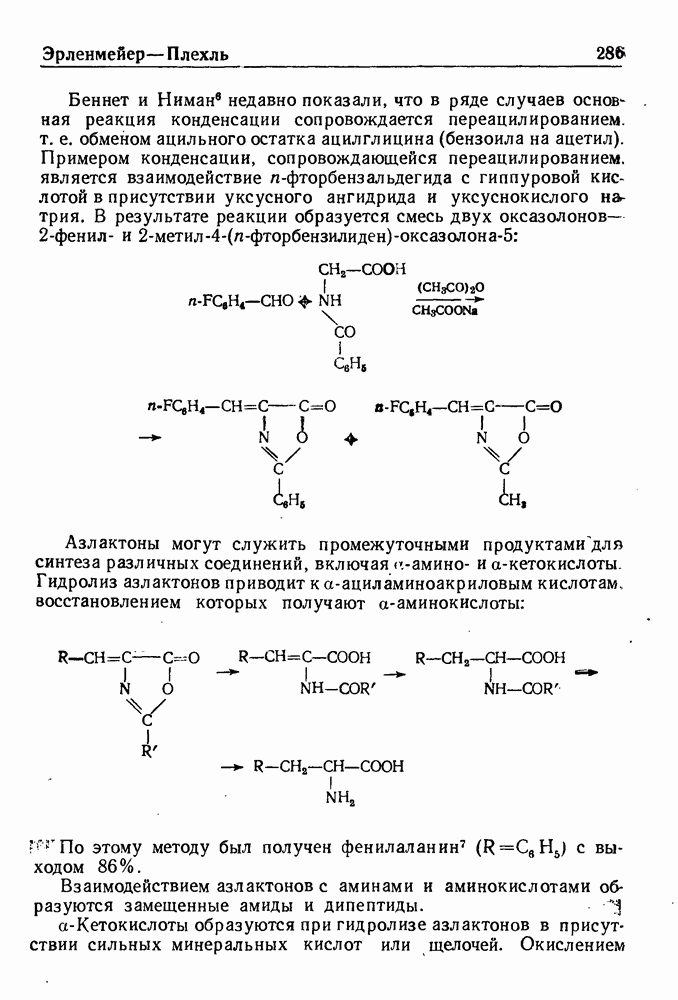
- СИНТЕЗ АЗЛАКТОНОВ ПО ЭРЛЕНМЕИЕРУ—ПЛЕХЛЮ
- РЕАКЦИЯ ЯКОБСЕНА