| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
18.12. Ферменты, содержащие в качестве простетической группы кобаламнн (витамин В12), катализируют процессы перегруппировки и метилирования
Кобаламин (витамин В12) привлекает к себе большой интерес биохимиков и врачей с тех пор, как в 1926 г. Георг Мино (George Minot) и Виллиам Мерфи (William Murphy) открыли, что пернициозную анемию можно лечить введением в рацион больных больших количеств печени. Кобаламин был получен в очищенном виде и кристаллизован в 1948 г. Его сложную трехмерную структуру раскрыла Дороти Ходжкин (Dorothy Hodgkin) в 1956 г. Ядро кобаламина состоит из корринового кольца с центрально расположенным атомом кобальта (рис, 18.12). Кор-риновое кольцо, подобно порфирину, имеет четыре пиррольных кольца. Два из них (кольца  прямо связаны друг с другом, а другие соединяются при помощи метиле-новых мостиков, как это имеет место в порфиринах. Заместителями в пиррольных кольцах являются метильная, пропионамидная и ацетамидная группы.
прямо связаны друг с другом, а другие соединяются при помощи метиле-новых мостиков, как это имеет место в порфиринах. Заместителями в пиррольных кольцах являются метильная, пропионамидная и ацетамидная группы.
Атом кобальта связан с четырьмя атомами азота пиррольных колец. Пятый заместитель (на рис. 18.13, расположенный ниже плоскости коррина) представляет собою производное диметилбензимидазола, содержащее  и аминоизопропанол. Один из атомов азота диметилбензимидазола связан с кобальтом. Аминогруппа аминоизопропанола связана амидной связью с боковой цепью кольца
и аминоизопропанол. Один из атомов азота диметилбензимидазола связан с кобальтом. Аминогруппа аминоизопропанола связана амидной связью с боковой цепью кольца  Шестой заместитель при атоме кобальта (на
Шестой заместитель при атоме кобальта (на
рис. 18.13 расположенный над плоскостью коррина) может быть представлен  или дезоксиаденозилом. Присутствие цианид-иона в шестом координационном положении цианкобаламина, наиболее обычной среди получаемых в промышленном масштабе форм витамина, является результатом процедуры его выделения. In vivo цианид не связан с кобаламином.
или дезоксиаденозилом. Присутствие цианид-иона в шестом координационном положении цианкобаламина, наиболее обычной среди получаемых в промышленном масштабе форм витамина, является результатом процедуры его выделения. In vivo цианид не связан с кобаламином.
Атом кобальта в кобаламине может находиться в степени окисления  или
или  В гидроксокобаламине (в котором шестое координационное положение занимает
В гидроксокобаламине (в котором шестое координационное положение занимает  атом кобальта находится в степени окисления
атом кобальта находится в степени окисления  Эта форма,
Эта форма,  восстанавливается до двухвалентного состояния, называемого
восстанавливается до двухвалентного состояния, называемого  под действием флавопротеин-редуктазы, В12
под действием флавопротеин-редуктазы, В12

Рис. 18.12. Корриновое ядро кобаламина.
Заместители при пирролах и двух других кобальтовых лигандах на этой схеме не показаны.

Рис. 18.13. Структура 5-дезоксиадено-зилкобаламина.

Рис. 18.14. 5-углеродный атом 5-дезок-сиаденозина находится в координационной связи с атомом кобальта 5-дезоксиаде-нозилкобаламина. Это - единственный известный пример связи углерод - металл в биомолекуле,
восстанавливается второй флавопротеин-редуктазой в  Восстановителем в обеих реакциях служит NADH. Форма
Восстановителем в обеих реакциях служит NADH. Форма  представляет собою субстрат для последней ферментативной реакции, приводящей к образованию активного кофермента, 5-дезоксиаденозильная группа переносится с АТР на витамин
представляет собою субстрат для последней ферментативной реакции, приводящей к образованию активного кофермента, 5-дезоксиаденозильная группа переносится с АТР на витамин  образуя 5-де-зоксиаденозилкобаламин, являющийся коферментом метилмалонил-СоА-мутазы (рис. 18.13).
образуя 5-де-зоксиаденозилкобаламин, являющийся коферментом метилмалонил-СоА-мутазы (рис. 18.13).

Кобаламиновые ферменты катализируют реакции двух типов: 1) реакции перегруппировки, например превращение L-метилмалонил-СоА в сукцинил-СоА, и 2) реакции метилирования, например синтез метионина (разд. 21.7). Перегруппировка представляет собою взаимообмен двух групп, присоединенных к соседним углеродным атомам (рис. 18.16). Атом водорода мигрирует от одного атома углерода к следующему, а группа  одновременно перемещается в противоположном направлении. При этих внутримолекулярных перестройках разрушается связь углерод—кобальт в 5-дезок-сиаденозилкобаламине. Углеродный атом субстрата, отдающий свой атом водорода, оказывается временно связанным с кобальтом.
одновременно перемещается в противоположном направлении. При этих внутримолекулярных перестройках разрушается связь углерод—кобальт в 5-дезок-сиаденозилкобаламине. Углеродный атом субстрата, отдающий свой атом водорода, оказывается временно связанным с кобальтом.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ГЛАВА 11. Метаболизм: основные положения и обозначения
- 11.1. Свободная энергия — самая полезная термодинамическая функция в биохимии
- 11.2. Изменение стандартной свободной энергии реакции и его связь с константой равновесия
- 11.3 Термодинамически невыгодная реакция может быть индуцирована термодинамически выгодной реакцией
- 11.4. АТР — универсальная энергетическая валюта в биологических системах
- 11.5. АТР постоянно образуется и потребляется
- 11.6. Структурная основа АТР, определяющая высокий потенциал переноса групп
- 11.7. Гидролиз АТР сдвигает равновесие сопряженных реакций в 10^8 раз
- 11.8. NADH и FADH2 — основные переносчики электронов при окислении топливных молекул
- 11.9. NADPH — главный донор электронов в восстановительном биосинтезе
- 11.10. Кофермент А как универсальный переносчик ацильных групп
- 11.11. Большинство водорастворимых витаминов являются компонентами коферментов
- 11.12. Стадии извлечения энергии из пищевых веществ
- 11.13. Процессы обмена веществ регулируются множеством различных механизмов
- ГЛАВА 12. Гликолиз
- 12.1. Номенклатура и конформация моносахаридов
- 12.2. Общий обзор ключевых структур и реакций
- 12.3. Образование фруктозо-1,6-бисфосфата из глюкозы
- 12.4. Образование глицеральдегид-3-фосфата путем расщепления и изомеризации
- 12.5. Хранение энергии: фосфорилирование, сопряженное с окислением глицеральдегид-3-фосфата
- 12.6. Образование АТР из 13-бисфосфо-глицерата
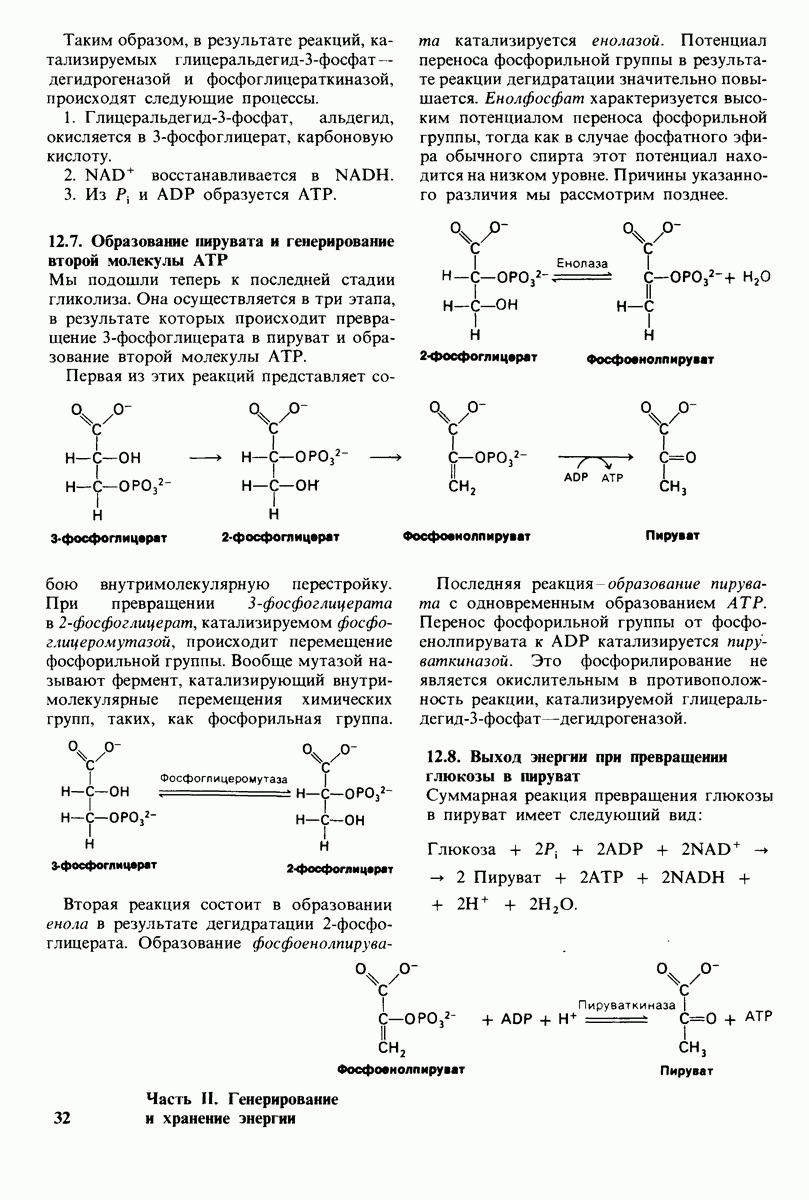
- 12.7. Образование пирувата и генерирование второй молекулы АТР
- 12.8. Выход энергии при превращении глюкозы в пируват
- 12.9. Фосфофруктокиназа — ключевой фермент в регуляции гликолиза
- 12.10. Пируват может превращаться в этанол, лактат или ацетилкофермеит А
- 12.11. Участки связывания NAD+ очень сходны в различных дегидрогеназах
- 12.12. Глюкоза индуцирует большие конформационные изменения в гексокиназе
- 12.13. Альдолаза образует шиффово основание с дигидроксиацетонфосфатом
- 12.14. Образование тиоэфира при окислении глицеральдегид-3-фосфата
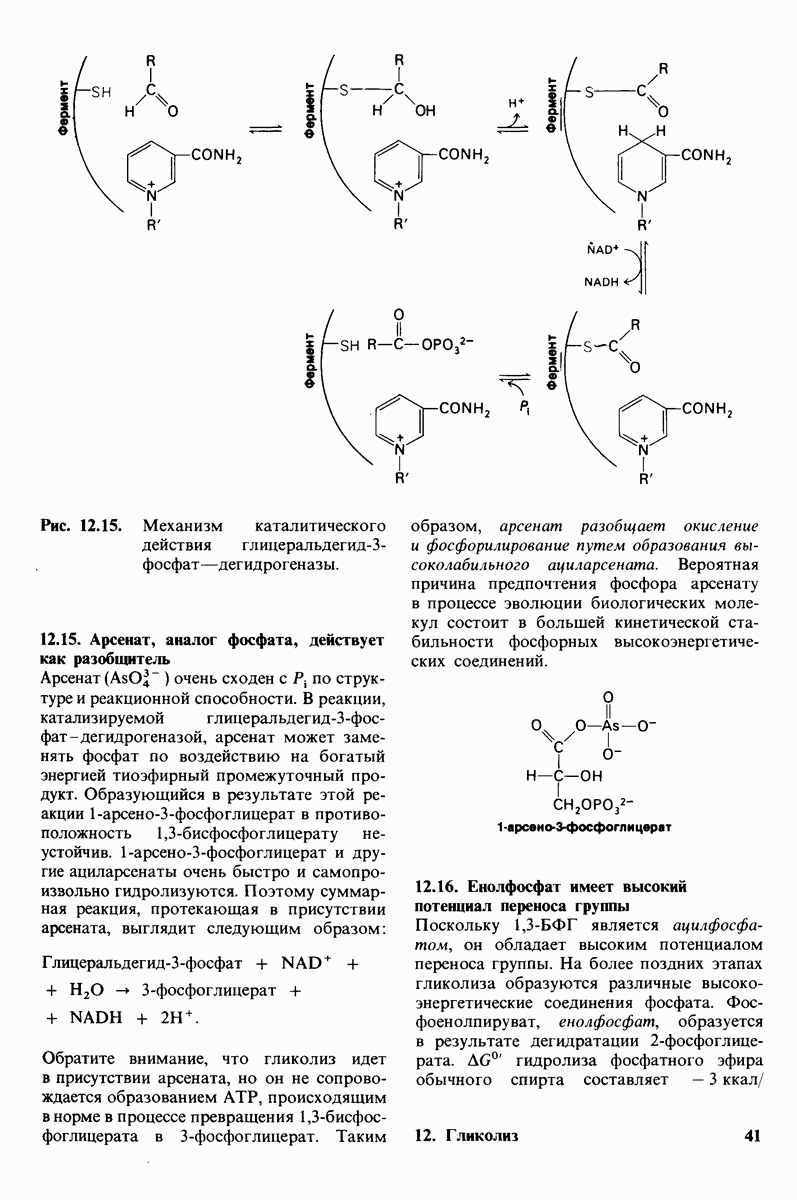
- 12.15. Арсенат, аналог фосфата, действует как разобщитель
- 12.16. Енолфосфат имеет высокий потенциал переноса группы
- 12.17. Метаболизм 2,3-бисфосфоглицерата, регулятора транспорта кислорода
- 12.18. Нарушение гликолиза в эритроцитах приводит к изменению транспорта кислорода
- ГЛАВА 13. Цикл трикарбоновых кислот
- 13.1. Образование ацетил кофермента А из пирувата
- 13.2. Общая характеристика цикла трикарбоновых кислот
- 13.3. Оксалоацетат конденсируется с ацетил-коферментом А с образованием цитрата
- 13.4. Цитрат изомеризуется в изоцитрат
- 13.5. Изоцитрат окисляется и декарбокси-лируется в альфа-оксоглутарат
- 13.6. При окислительном декарбоксилировании альфа-оксоглутарата образуется сукцинил-СоА
- 13.7. Генерирование высокоэнергетической фосфатной связи из сукцинилкофермента А
- 13.8. Регенерирование оксалоацетата при окислении сукцината
- 13.9. Стехиометрия цикла трикарбоновых кислот
- 13.10. Пируват-дегидрогеиазиый комплекс — организованная система ферментов
- 13.11. Вариации на мультиферментнуко тему: альфа-оксоглутарат-дегидрогеназный комплекс
- 13.12. Бери-бери вызывается недостаточностью тиамина
- 13.13. Симметричные молекулы могут реагировать асимметрично
- 13.14. Стереоспецифический перенос водорода NAD+-дегидрогеназами
- 13.15. Летальный синтез: превращение фторацетата во фторцитрат
- 13.16. Цикл трикарбоновых кислот — источник предшественников для процессов биосинтеза
- 13.17. Регуляция пируват-дегндрогеназного комплекса
- 13.18 Регуляция цикла трикарбоновых кислот
- 13.19. Открытие цикла Кребсом
- ПРИЛОЖЕНИЕ. RS-обозначение хиральности
- ГЛАВА 14. Окислительное фосфорилирование
- 14.1. Окислительное фосфорилирование происходит в митохондриях
- 14.2. Окислительно-восстановительные потенциалы и изменения свободной энергии
- 14.3. Величина окислительно-восстановительного потенциала дыхательной цепи составляет 1,14 В, что соответствует 53 ккал
- 14.4. Флавин, железо-серные комплексы, хинон и гемовые группы переносят электроны от NADH к O2
- 14.5. Сопряжение окисления и фосфорилирования осуществляется протонным градиентом
- 14.6. Протонный градиент генерируется в трех пунктах
- 14.7. Протоны выталкиваются асимметрично ориентированными трансмембранными комплексами
- 14.8. АТР синтезируется при обратном токе протонов в матрикс через протонные каналы
- 14.9. Электроны от цитоплазматического NADH поступают в митохондрии при помощи глицерофосфатного челночного механизма
- 14.10. Поступление ADP в митохондрии требует выхода АТР
- 14.11. Митохондрии содержат многочисленные транспортные системы для ионов и метаболитов
- 14.12. Полное окисление глюкозы дает 36 АТР
- 4.13. Скорость окислительного фосфорилнрования определяется по потребности в АТР
- 14.14. Динитрофенол разобщает окислительное фосфорилирование путем разрушения протонного градиента
- 14.15. Трехмерная структура цитохрома c
- 14.16. Взаимодействие цитохрома с с его редуктазой и оксидазой
- 14.17. Конформация цитохрома с оставалась в основном постоянной в течение миллиардов лет
- 14.18. Передача прот оно движу щей силы протонными градиентами центральный мотив биоэнергетики
- ГЛАВА 15. Пентозофосфатный путь и глюконеогенез
- 15.1. Пентозофосфатный путь генерирует АТР и синтезирует пятиуглеродные сахара
- 15.2. Две молекулы NADPH генерируются при превращении глюкозо-6-фосфата в рибулозо-5-фосфат
- 15.4. Пентозофосфатный путь и гликолиз связаны между собой транскетолазой и трансальдолазой
- 15.5. Скорость функционирования пентозофосфатного пути регулируется концентрацией NADP+
- 15.6. Судьба глюкозо-6-фосфата зависит от потребности в NADPH, и рибозо-5-фосфате и АТР
- 15.7. Активность пентозофосфатного пути в жировой ткани значительно выше, чем в мышцах
- 15.8. Тиаминпирофосфат, простетическая группа транскетолазы, переносит активированные альдегиды
- 15.9. Нарушение способности транскетолазы связывать ТПФ может быть причиной нервно-психического расстройства
- 15.10. Активированный дигидроксиацетон переносится трансальдолазой в виде шиффова основания
- 15.11. Недостаточность глюкозо-6-фосфат-дегидрогеназы — причина лекарственной гемолитической анемии
- 15.12. Глутатион-редуктаза переносит электроны от NADPH к окисленному глутатиону при участии FAD
- 15.13. Глюкоза может синтезироваться из неуглеводных предшественников
- 15.14. Глюконеогенез — это не обращение гликолиза
- 15.15. Биотин — мобильный переносчик активированного CO2
- 15.16. Пируват-карбоксилаза активируется при участии ацетил-СоА
- 15.17. Оксалоацетат переходит по челночному механизму в цитозоль и превращается в фосфоенолпируват
- 15.18. Шесть высокоэнергетических фосфатных связей расходуются при синтезе глюкозы из пирувата
- 15.19. Глюконеогенез и гликолиз регулируются реципрокно
- 15.20. Субстратные циклы амплифнцнруют метаболические сигналы и образование тепла
- 15.21. Лактат, образованный сокращающейся мышцей, превращается в печени в глюкозу
- ГЛАВА 16. Гликоген и обмен дисахаридов
- 16.1. Фосфорнлаза катализирует фосфоролитическое расщепление гликогена до глюкозо-1-фосфата
- 16.2. Для распада гликогена необходим также фермент, разрывающий связи в местах ветвления
- 16.3. Фосфоглюкомутаза превращает глюкозо-1-фосфат в глюкозо-6-фосфат
- 16.4. Печень содержит глюкозо-6-фосфатазу, гидролитический фермент, отсутствующий в мышцах
- 16.5. Синтез и расщепление гликогена происходят различными путями
- 16.6. UDP-глюкоза — активированная форма глюкозы
- 16.7. Гликоген-синтаза катализирует перенос глюкозы от UDP-глюкозы к растущей цепи
- 16.8. Ветвящий фермент образует альфа-1,6-связи
- 16.9. Гликоген — очень эффективная резервная форма глюкозы
- 16.10. Циклический AMP занимает центральное положение в координированном контроле синтеза и распада гликогена
- 16.11. Фосфорилаза активируется путем фосфорилирования специфического остатка серина
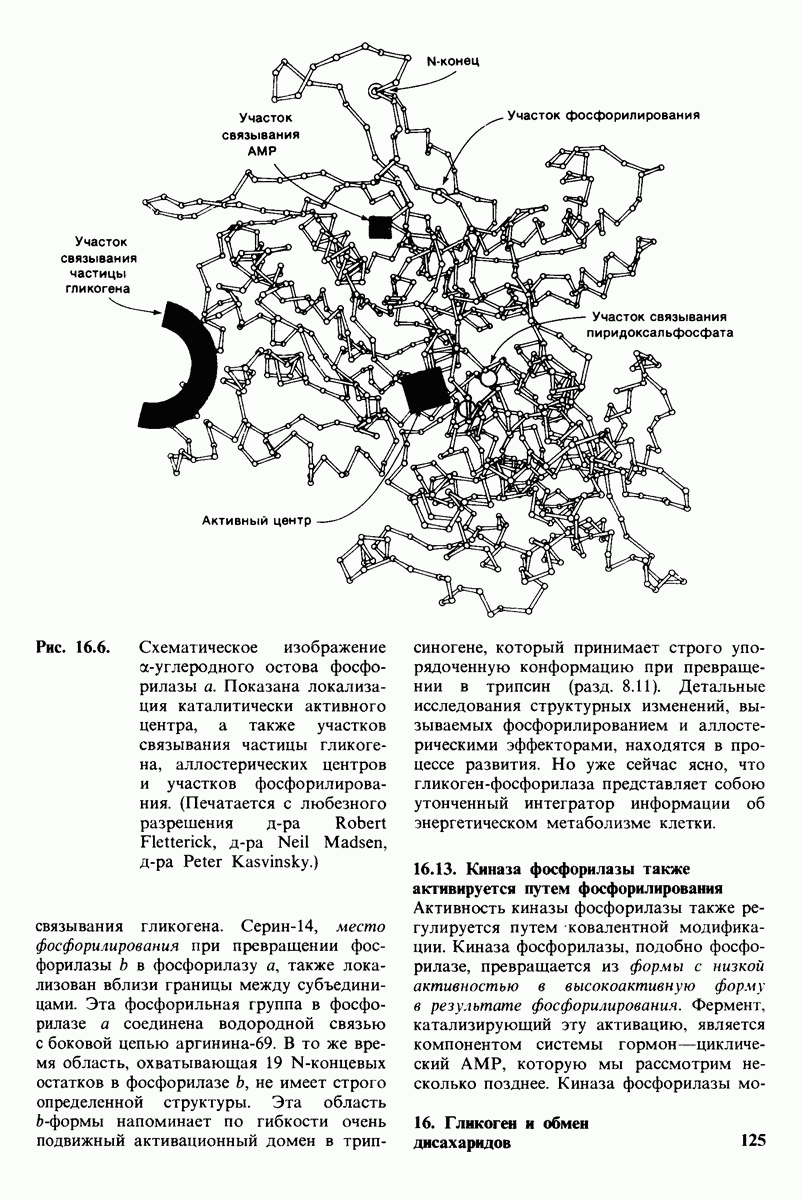
- 16.12. Трехмерная структура гликоген-фосфорилазы
- 16.13. Кииаза фосфорилазы также активируется путем фосфорилирования
- 16.14. Гликоген-синтаза инактивируется при фосфорнлнровании специфического серинового остатка
- 16.15. Каскад реакций контролирует фосфорилирование гликоген-синтазы и гликоген-фосфорилазы
- 16.16. Фосфатазы вызывают обращение рсгуляторных эффектов киназ
- 16.17. Каскад реакций амплифицирует гормональный сигнал
- 16.18. Обмен гликогена в печени регулирует содержание глюкозы в крови
- 16.19. Известен ряд генетически детерминированных болезней накопления гликогена
- 16.20. Крахмал — резервный полисахарид у растений
- 16.21. Мальтоза, сахароза и лактоза — широко распространенные дисахарнды
- 16.22. Синтез лактозы контролируется модифицирующей субъединицей
- 16.23. Интолерантность к молоку у взрослых, обусловленная недостаточностью лактазы
- 16.24. Вступление фруктозы и галактозы на путь гликолиза
- 16.25. При отсутствии трансферазы галактоза высокотоксична
- ГЛАВА 17. Обмен жирных кислот
- 17.1. Номенклатура жирных кислот
- 17.2. Жирные кислоты варьируют по длине цепи и по степени ненасыщенности
- 17.3. Триацилглицеролы (триглицериды) — высококонцентрированные резервы энергии
- 17.4. Триацилглицеролы гидролизуются липазами, регулируемыми циклическим AMP
- 17.5 Жирные кислоты распадаются путем последовательного удаления двухуглеродных фрагментов
- 17.6. Окислению жирных кислот предшествует связывание с коферментом А
- 17.7. Карнитин переносит в митохондриальный матрикс активированные жирные кислоты с длинной цепью
- 17.8. В каждом цикле окисления жирной кислоты происходит генерирование ацетил-СоА, и NADH и FADH2
- 17.9. При полном окислении пальмитата образуется 129 АТР
- 17.10. Необходимость изомеразы и эпимеразы для окисления ненасыщенных жирных кислот
- 17.11. Жирные кислоты с нечетным числом углеродных атомов образуют при завершающем тиолизе пропионил-СоА
- 17.12. Образование кетоновых тел из ацетилкофермента А в условиях, когда расщепление жиров преобладает
- 17.13. Ацетоацетат — основное топливо в некоторых тканях
- 17.14. Животные неспособны превращать жирные кислоты в глюкозу
- 17.15. Синтез и распад жирных кислот идут различными путями
- 17.16. Образование малоннлкофермента А — решающий шаг в синтезе жирных кислот
- 17.17. Промежуточные продукты синтеза жирных кислот присоединены к ацилпереносящему белку
- 17.18. Цикл элонгации в синтезе жирных кислот
- 17.20. Жирные кислоты синтезируются у эукариот мультиферментным комплексом
- 17.21. Цитрат переносит ацетильные группы для синтеза жирных кислот из митохондрий в цитозоль
- 17.22. Источники NADPH для синтеза жирных кислот
- 17.23. Элонгация и десатурация жирных кислот осуществляются добавочными ферментными системами
- 17.24. Регуляция синтеза жирных кислот
- ГЛАВА 18. Разрушение аминокислот и цикл мочевины
- 18.2. Пиридоксальфасфат, простетическая группа аминотрансфераз, образует в качестве промежуточных продуктов шнффовы основания
- 18.3. Серии и треонин могут дезамннироваться непосредственно
- 18.4. У большинства наземных позвоночных NH4 превращается в мочевину и в таком виде экскретируется
- 18.5. Цикл мочевины связан с циклом трикарбоновых кислот
- 18.6. Наследственные ферментные нарушения цикла мочевины приводят к гипераммонемии
- 18.7. Судьба атомов углерода распавшихся аминокислот
- 18.8. Семейство С3-аминокислот: аланин, серин и цистеин превращаются в пируват
- 18.9. Семейство С4-аминокислот: аспартат и аспарагин превращаются в оксалоацетат
- 18.10. Семейство С5-аминокислот: некоторые аминокислоты превращаются в альфа-оксоглутарат через глутамат
- 18.11. Сукцинил-кофермент А-пункт включения в цикл трикарбоновых кислот для некоторых аминокислот
- 18.12. Ферменты, содержащие в качестве простетической группы кобаламнн (витамин В12), катализируют процессы перегруппировки и метилирования
- 18.13. При пернициозиой анемии нарушается всасывание кобаламина
- 18.14. Известно несколько наследственных дефектов обмена метилмалонил-кофермента А
- 18.15. Лейцин распадается на ацетил-кофермент А и ацетоацетил-кофермент А
- 18.16. Фенилаланин и тирозин распадаются под действием оксигеназ на ацетоацетат и фумарат
- 18.17. Открытие Гэрродом наследственных нарушений метаболизма
- 18.18. Блокирование гидроксилировання фенилаланина может привести к резко выраженной умственной отсталости
- ГЛАВА 19. Фотосинтез
- 19.1. Открытие основного уравнения фотосинтеза
- 19.2. Хлорофиллы представляют собой фоторецепторные молекулы
- 19.3. Первичные события фотосинтеза происходят в высокоорганизованной системе мембран
- 19.4. Фотосинтетическая единица: фотоны стекаются в реакционный центр
- 19.5. Кислород, выделяющийся при фотосинтезе, происходит из воды
- 19.6. Реакция Хилла: освещенные протопласты выделяют кислород и восстанавливают искусственный акцептор электронов
- 19.7. Фотосинтез требует взаимодействия двух видов фотосистем
- 19.8. Роль двух фотосистем
- 19.10. Фотосистема II генерирует сильный окислитель, который расщепляет воду
- 19.11. При переносе электронов от фотосистемы II к фотосистеме I создается протонный градиент
- 19.12. При циклическом переносе электронов через фотосистему I может образовываться также АТР
- 19.13. Протонный градиент через мембрану тилакондов запускает синтез АТР
- 19.14. Исследование пути углерода с использованием импульсной радиоактивной метки
- 19.15. CO2 реагирует с рибулозобисфосфатом с образованием двух фосфоглицератов
- 19.16. Образование фруктозо-6-фосфата и регенерирование рибулозо-1,5-бисфосфата
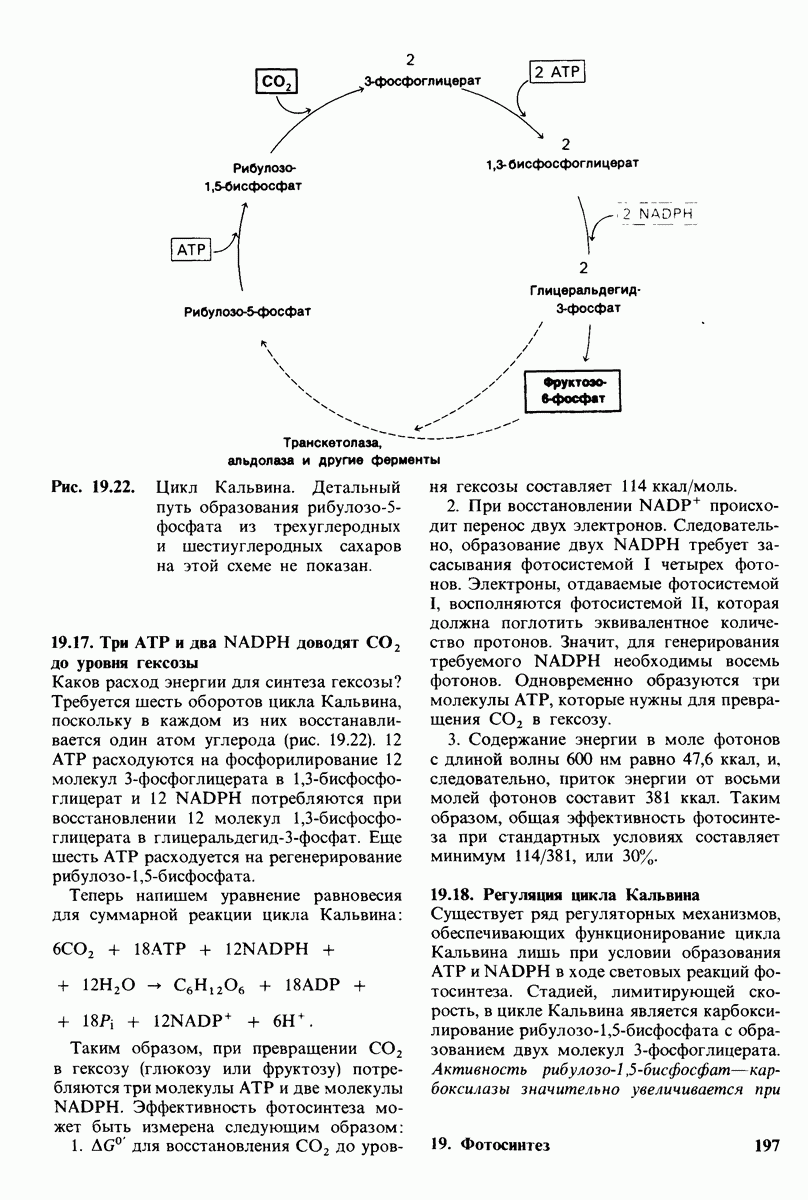
- 19.17. Три АТР и два NADPH доводят CO2 до уровня гексозы
- 19.18. Регуляция цикла Кальвина
- 19.19. У тропических растений функционирует С4-путь, ускоряющий фотосинтез путем концентрирования CO2
- 19.20. Гликолат — основной субстрат при фотодыхании
- 19.21. Белок пурпурных мембран галобактерий перекачивает протоны для синтеза АТР
- ГЛАВА 20. Биосинтез мембранных липидов и стероидных гормонов
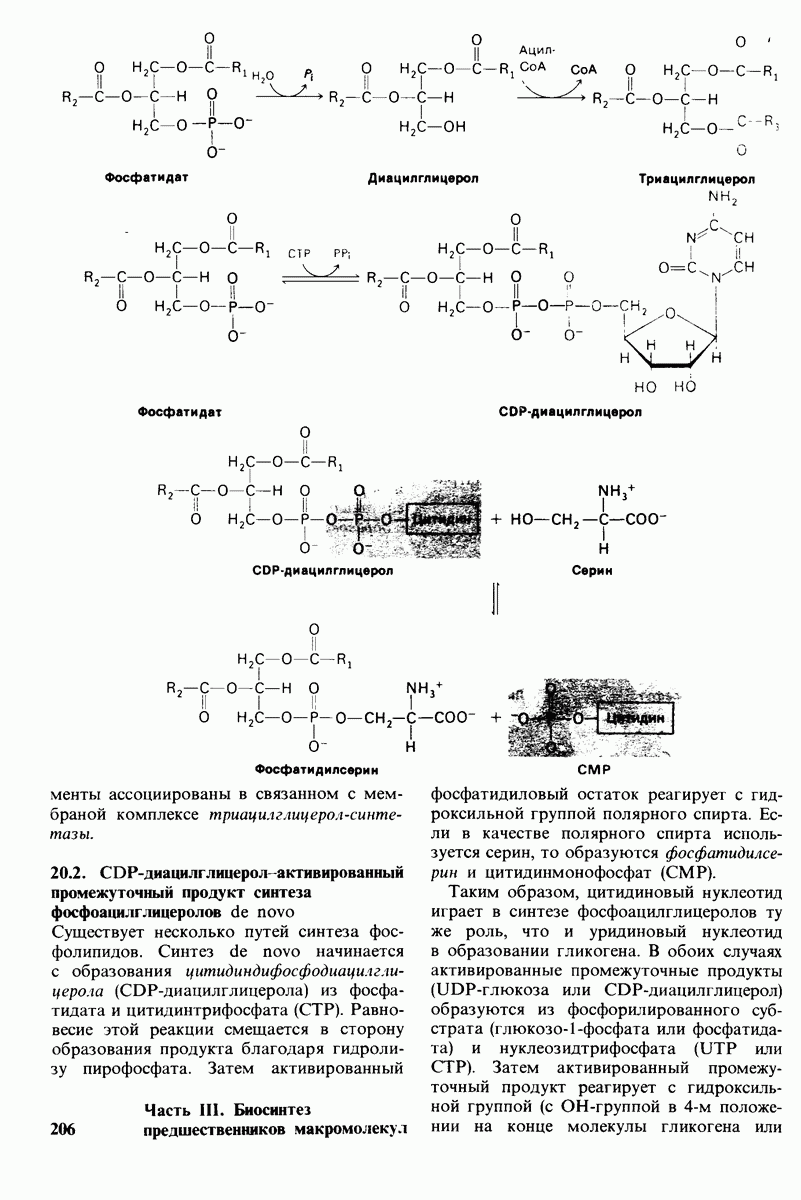
- 20.2. СDР-диацилглицерол активированный промежуточный продукт синтеза фосфоацилглицеролов de novo
- 20.3. Фосфатидилэтаноламин и фосфатидилхолин могут образовываться из фосфатидилсерина
- 20.4. Фосфоацилглицеролы могут также синтезироваться из готовых остатков
- 20.5. Выделено несколько специфических фосфолипаз
- 20.6. Синтез церамида — основной структурной единицы сфинголипидов
- 20.7. Ганглиозиды — богатые углеводами сфинголипиды, содержащие кислые сахара
- 20.8. Болезнь Тея-Сакса: наследуемое нарушение расщепления ганглиозидов
- 20.9. Холестерол синтезируется из ацетил-кофермента А
- 20.10. Мевалонат и сквален — промежуточные продукты синтеза холестерола
- 20.11. Синтез изопентенилпирофосфата — активированного промежуточного продукта при образовании холестерола
- 20.12. Синтез сквалена из изопентенилпирофосфата
- 20.13. 2,3-оксид сквалена циклизуется с образованием ланостерола, который в свою очередь превращается в холестерол
- 20.14. Желчные кислоты, облегчающие переваривание липидов, образуются из холестерола
- 20.15. Синтез холестерола в печени подавляется холестеролом, поступающим с пищей
- 20.16. Холестерол и другие липиды переносятся к органам-мишеням с помощью различных липопротеинов
- 20.17. Рецепторы липопротеинов низкой плотности играют ключевую роль в регуляции метаболизма холестерола
- 20.18. Отсутствие рецепторов ЛНП приводит к гиперхолестеролемии и преждевременному атеросклерозу
- 20.19. Номенклатура стероидов
- 20.20. Стероидные гормоны образуются из холестерола
- 20.21. Стероиды гидроксилируются под действием монооксигеназ, использующих NADPH и кислород
- 20.22. Прегненолон образуется из холестерола путем отщепления боковой цепи
- 20.23. Синтез прогестерона и кортикоидов
- 20.24. Синтез андрогенов и эстрогенов
- 20.25. Недостаточная активность 21-гидроксилазы приводит к вирилизму и увеличению надпочечников
- 20.26. Витамин D образуется из холестерола под действием света
- 20.27. При соединений пятиуглеродных элементов образуются самые разнообразные молекулы
- ГЛАВА 21. Биосинтез аминокислот и гема
- 21.1. Микроорганизмы используют АТР и сильный восстановитель для превращения N2 в NH4
- 21.2. NH4+- включается в аминокислоты через глутамат и глутамин
- 21.3. Аминокислоты синтезируются из промежуточных продуктов цикла трикарбоновых кислот и других важных метаболитов
- 21.4. Глутамат — предшественник глутамнна и пролина
- 21.5. Серии синтезируется из 3-фосфоглицерата
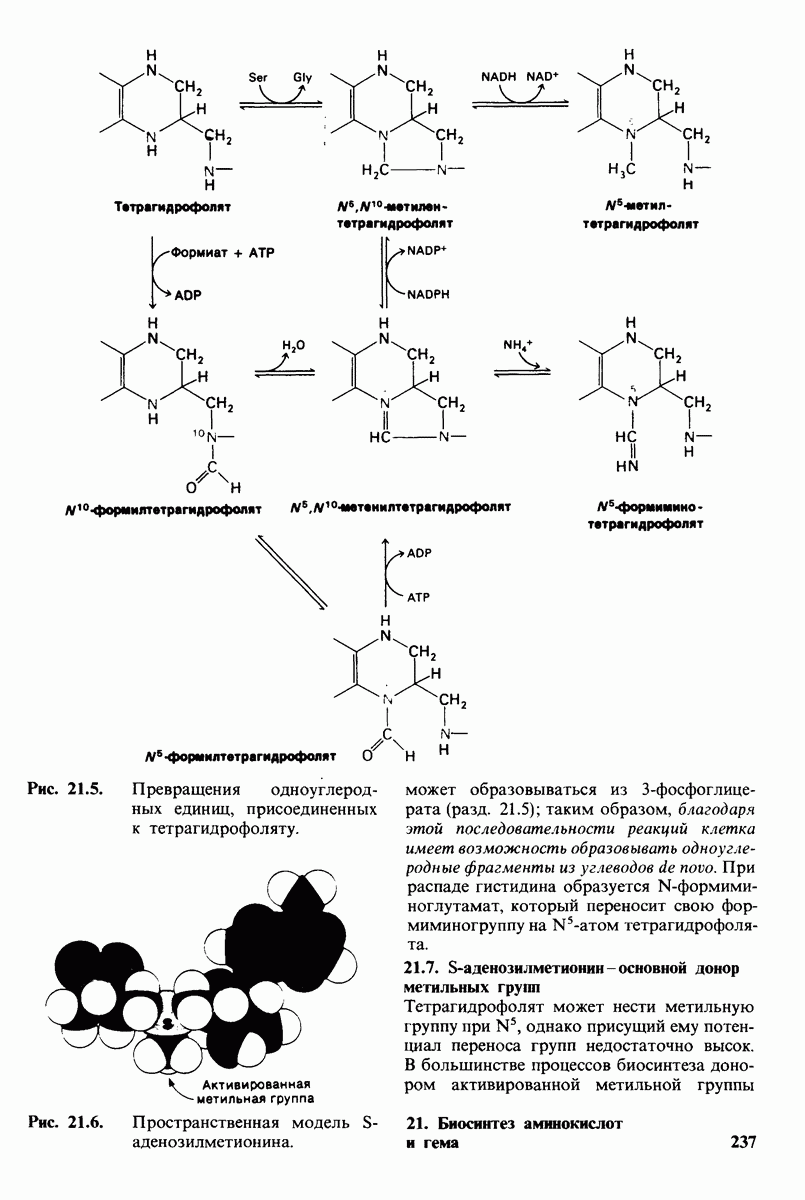
- 21.6. Тетрагидрофолят переносит активированные одноуглеродные фрагменты с различной степенью окисления
- 21.7. S-аденозилметионин — основной донор метильных групп
- 21.8. Цистеин синтезируется из серина и гомоцистеина
- 21.9. Шикимат и хоризмат-промежуточные продукты биосинтеза ароматических аминокислот
- 21.10. Гистидин синтезируется из АТР, ФРПФ и глутамина
- 21.11. Биосинтез аминокислот регулируется ингибированием конечным продуктом
- 21.12. Активность глутамин-синтетазы регулируется путем аденилирования
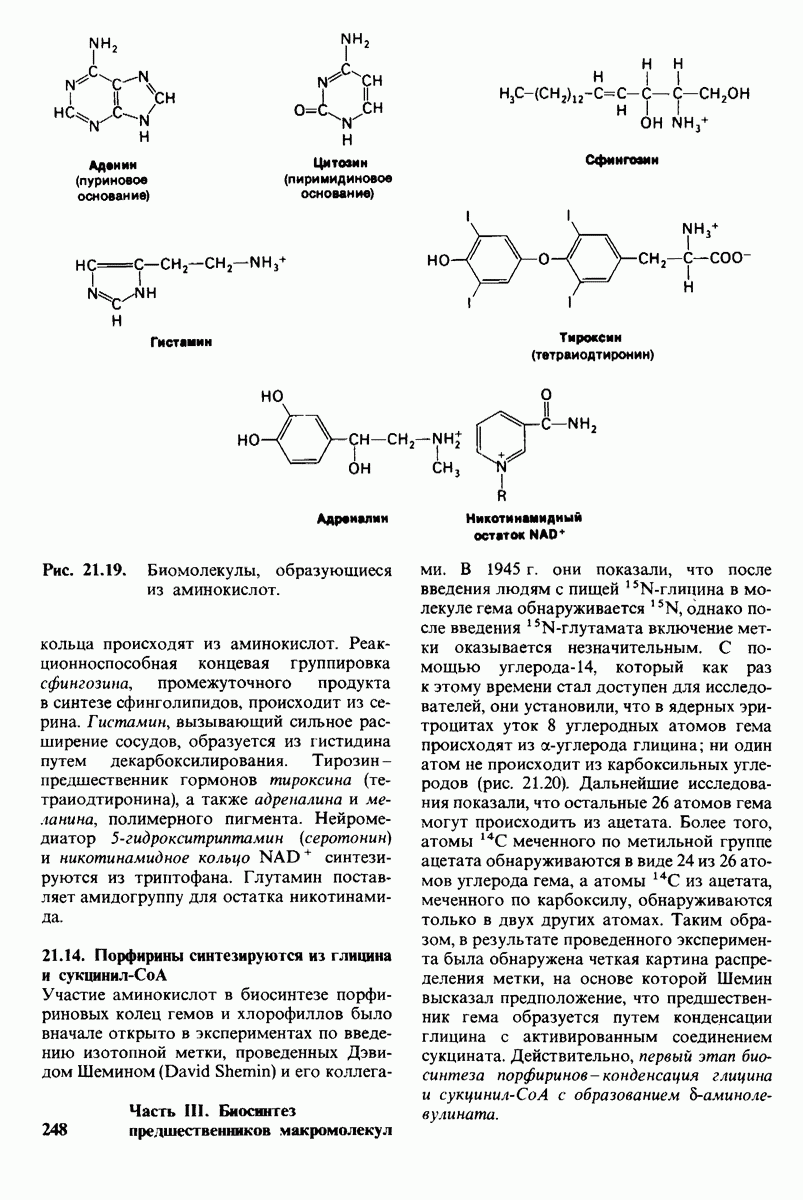
- 21.13. Аминокислоты — предшественники множества других биомолекул
- 21.14. Порфирины синтезируются из глицина и сукцинил-СоА
- 21.15. При некоторых наследственных нарушениях метаболизма порфнринов происходит их накопление
- 21.16. Биливердин и билирубин — промежуточные продукты распада гема
- ГЛАВА 22. Биосинтез нуклеотидов
- 22.1. Номенклатура оснований, нуклеозидов и нуклеотидов
- 22.2. Пуриновое кольцо синтезируется из аминокислот, производных тетрагндрофолята и CO2
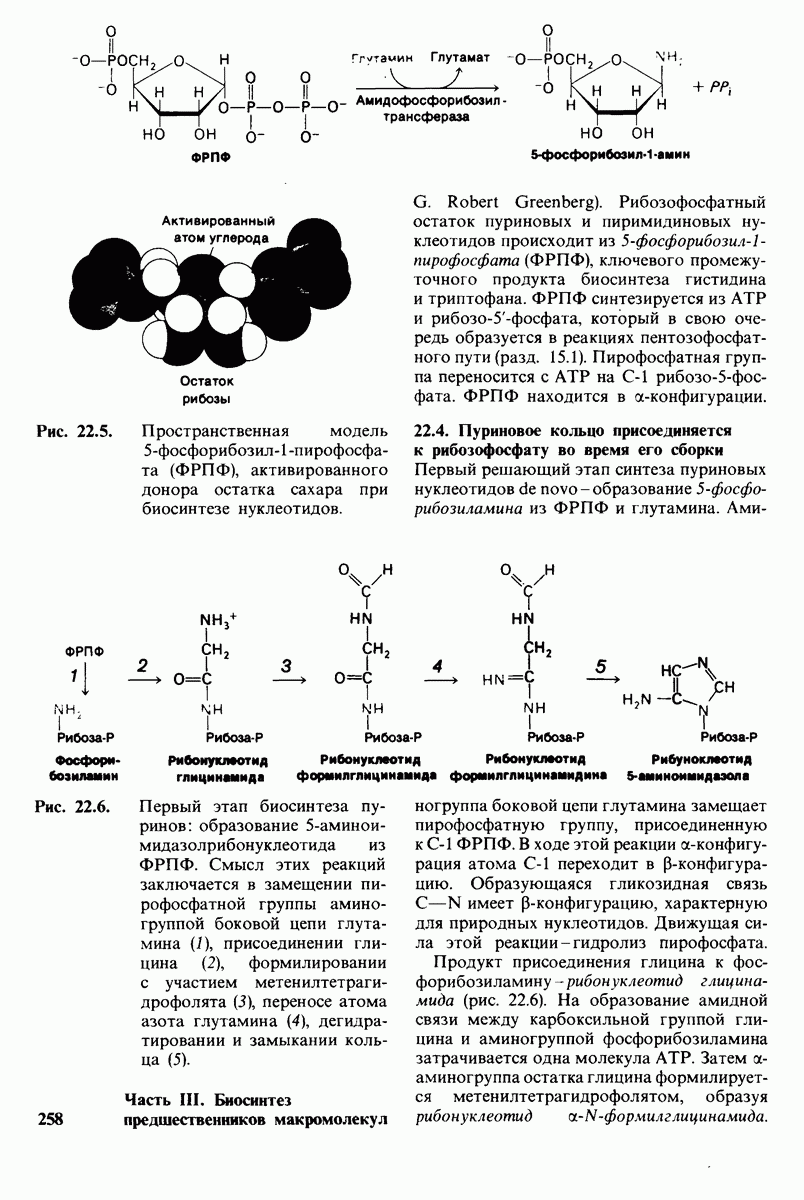
- 22.3. Фосфорибозилпирофосфат — донор рибозофосфатного остатка нуклеотидов
- 22.4. Пуриновое кольцо присоединяется к рибозофосфату во время его сборки
- 22.5. AMP и GMP образуются из IMP
- 22.6. Пурнновые основания могут использоваться повторно с помощью реакций синтеза из готовых остатков с участием ФРПФ
- 22.7. AMP и GMP-ретроингибиторы биосинтеза пуриновых нуклеотидов
- 22.8. Пиримидиновое кольцо синтезируется из карбамоилфосфата и аспартата
- 22.9. К оротату присоединяется рибозофосфатный остаток ФРПФ
- 22.10. Первые три фермента биосинтеза пиримидинов синтезируются в виде одной полинентилной цепи
- 22.11. Нуклеозидмоно-, нуклеозидди- и нуклеозидтрифосфаты способны к взаимопревращениям
- 22.12. СТР образуется путем аминирования UTP
- 22.13. Биосинтез пиримидиннуклеотидов регулируется ингибнрованием по принципу обратной связи
- 22.14. Аспартат-транскарбамоилаза состоит из отдельных каталитической и регуляторной субъединиц
- 22.15. Дезоксирибонуклеотнды синтезируются путем восстановления рибонуклеозиддифосфатов
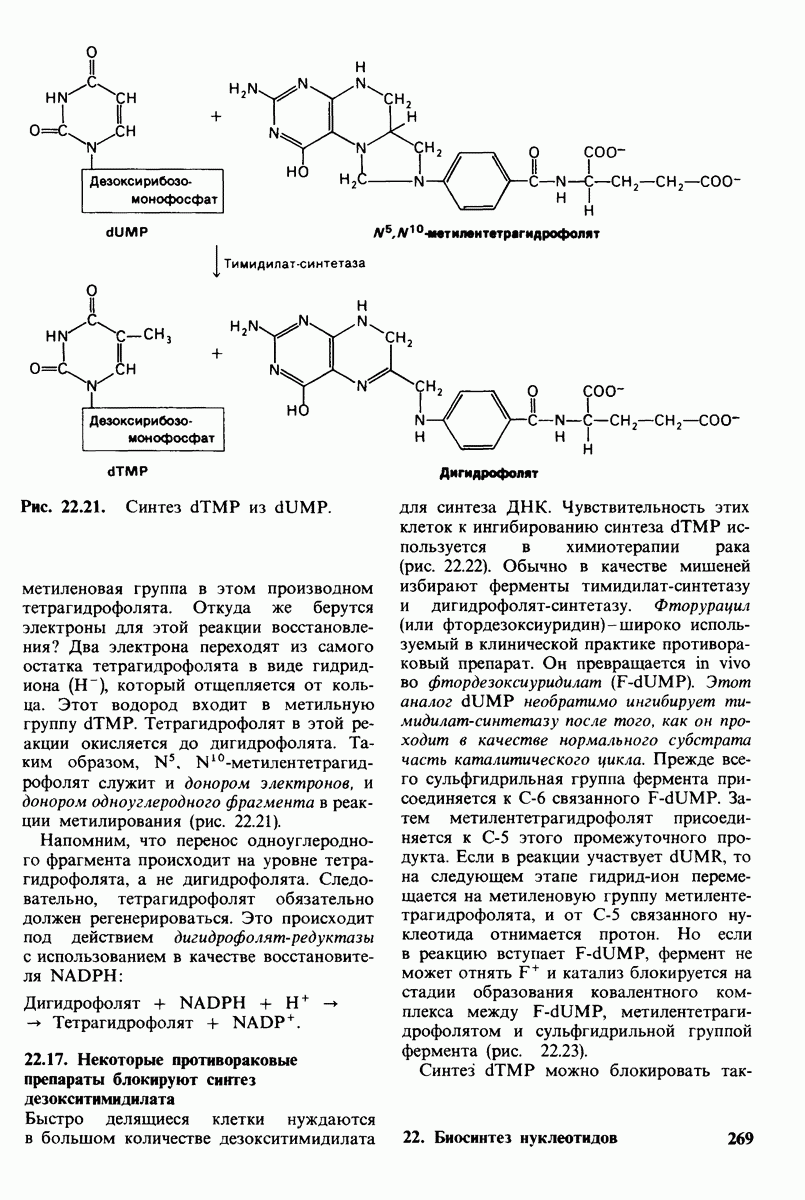
- 22.16. Дезокситимнднлат образуется путем метилирования дезоксиуридилата
- 22.17. Некоторые противораковые препараты блокируют синтез дезокситимидилата
- 22.18. АТР — предшественник NAD+ , FAD и кофермента А
- 22.19. В организме человека пурины распадаются до мочевой кислоты
- 22.20. У некоторых организмов происходит дальнейший распад мочевой кислоты
- 22.21. Птицы и наземные рептилии выделяют мочевую кислоту вместо мочевины, чтобы сохранить воду
- 22.22. Распад пиримидинов
- 22.23. Избыточное образование мочевой кислоты — причина подагры
- 22.24. Синдром Леша-Нихана: членовредительство, умственное отставание и избыточное образование мочевой кислоты
- ГЛАВА 23. Интеграция метаболизма
- 23.1. Стратегия метаболизма: основные положения
- 23.2. Повторяющиеся мотивы в механизмах регуляции метаболизма
- 23.3. Основные метаболические пути и регуляторные этапы
- 23.4. Ключевые соединения: глюкозо-6-фосфат, пируват и ацетил-СоА
- 23.5. Метаболические особенности основных органов
- 23.6. Гормональные регуляторы энергетического метаболизма
- 23.7. Печень выполняет роль буфера в регуляции содержания глюкозы в крови
- 23.8. Адаптация метаболизма к продолжительному голоданию: снижение распада белков
- 23.9. Огромные запасы жира позволяют перелетным птицам покрывать большие расстояния