| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
22.14. Аспартат-транскарбамоилаза состоит из отдельных каталитической и регуляторной субъединиц
Если обработать АТКазу каким-нибудь органическим соединением ртути, например  -гидроксимеркурийбензоатом, она теряет свои регуляторные свойства. АТР и СТР уже не влияют на ее каталитическую активность. Кроме того, связывание субстратов становится некооперативным, Тем не менее модифицированный фермент обладает полноценной каталитической активностью. Такая утрата регуляторных свойств при сохранении ферментативной активности называется десенсибилизацией.
-гидроксимеркурийбензоатом, она теряет свои регуляторные свойства. АТР и СТР уже не влияют на ее каталитическую активность. Кроме того, связывание субстратов становится некооперативным, Тем не менее модифицированный фермент обладает полноценной каталитической активностью. Такая утрата регуляторных свойств при сохранении ферментативной активности называется десенсибилизацией.
Десенсибилизация АТКазы органическими соединениями ртути сопровождается ее диссоциацией на субъединицы двух типов, как показали исследования с применением ультрацентрифугирования (рис. 22.15). Коэффициент седиментации нативного фермента  а коэффициент седиментации диссоциированных субъединиц - 2,8 и
а коэффициент седиментации диссоциированных субъединиц - 2,8 и  Эти субъединицы можно легко разделить с помощью ионообменной хроматографии, так как они существенно различаются по заряду, или с помощью ультрацентрифугирования в градиенте концентрации сахарозы, так как они различаются по размеру. После того как субъединицы разделены,
Эти субъединицы можно легко разделить с помощью ионообменной хроматографии, так как они существенно различаются по заряду, или с помощью ультрацентрифугирования в градиенте концентрации сахарозы, так как они различаются по размеру. После того как субъединицы разделены,  -гидроксимеркурийбензоат можно удалить. Большая субъединица каталитически активна; ее называют каталитической субъединицей. Однако АТР и СТР не влияют на активность выделенной каталитической субъединицы. Меньшая
-гидроксимеркурийбензоат можно удалить. Большая субъединица каталитически активна; ее называют каталитической субъединицей. Однако АТР и СТР не влияют на активность выделенной каталитической субъединицы. Меньшая

Рис. 22.15. Картина седиментации в ультрацентрифуге нативной АТКазы (А) и того же фермента, продиссоциировавшего под действием соединения ртути на регуляторную и каталитическую субъединицы (Б). [Gerhart J. С,, Schachman Н. К,, Biochemistry, 4, 1054 (1965),]

Рис. 22.16. Расположение каталитических (К, синие шарики) и регуляторных (Р, розовые шарики) субъединиц аспартат-транскарбамоилазы (По рисунку, любезно предоставленному д-ром William Lipscomb.)
субъединица, называемая регуляторной субъединицей, лишена каталитической активности, но содержит специфические участки связывания СТР и АТР. Каталитическая субъединица состоит из трех полипептидных цепей с мол. массой по 34 кДа, а регуляторная - из двух цепей по 17 кДа.
При смешивании каталитической и регуляторной субъединиц они быстро соединяются. Образуется комплекс с такой же структурой, как и нативный фермент -  :
:


Рис. 22.17. Электронная микрофотография аспартат-транскарбамоилазы. (Печатается с любезного разрешения д-ра Robley С. Williams.)
Более того, реконструированный фермент обладает такими же аллостерическими свойствами, как и нативный фермент.
В лаборатории Уильяма Липскома (William Lipscomb) проводится кристаллографическое изучение АТКазы с помощью рентгеноструктурного анализа. Карта электронной плотности с разрешением 3,0 А показывает, что два каталитических тримера  расположены сверху и снизу от расположенного экваториально пояса, состоящего из трех регуляторных димеров
расположены сверху и снизу от расположенного экваториально пояса, состоящего из трех регуляторных димеров  (рис. 22.16). Особенность этой молекулы состоит в том, что она содержит большую центральную полость, доступ в которую открывается через несколько каналов.
(рис. 22.16). Особенность этой молекулы состоит в том, что она содержит большую центральную полость, доступ в которую открывается через несколько каналов.  тересно отметить, что аллостерические участки связывания СТР расположены далеко от каталитических центров.
тересно отметить, что аллостерические участки связывания СТР расположены далеко от каталитических центров.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ГЛАВА 11. Метаболизм: основные положения и обозначения
- 11.1. Свободная энергия — самая полезная термодинамическая функция в биохимии
- 11.2. Изменение стандартной свободной энергии реакции и его связь с константой равновесия
- 11.3 Термодинамически невыгодная реакция может быть индуцирована термодинамически выгодной реакцией
- 11.4. АТР — универсальная энергетическая валюта в биологических системах
- 11.5. АТР постоянно образуется и потребляется
- 11.6. Структурная основа АТР, определяющая высокий потенциал переноса групп
- 11.7. Гидролиз АТР сдвигает равновесие сопряженных реакций в 10^8 раз
- 11.8. NADH и FADH2 — основные переносчики электронов при окислении топливных молекул
- 11.9. NADPH — главный донор электронов в восстановительном биосинтезе
- 11.10. Кофермент А как универсальный переносчик ацильных групп
- 11.11. Большинство водорастворимых витаминов являются компонентами коферментов
- 11.12. Стадии извлечения энергии из пищевых веществ
- 11.13. Процессы обмена веществ регулируются множеством различных механизмов
- ГЛАВА 12. Гликолиз
- 12.1. Номенклатура и конформация моносахаридов
- 12.2. Общий обзор ключевых структур и реакций
- 12.3. Образование фруктозо-1,6-бисфосфата из глюкозы
- 12.4. Образование глицеральдегид-3-фосфата путем расщепления и изомеризации
- 12.5. Хранение энергии: фосфорилирование, сопряженное с окислением глицеральдегид-3-фосфата
- 12.6. Образование АТР из 13-бисфосфо-глицерата
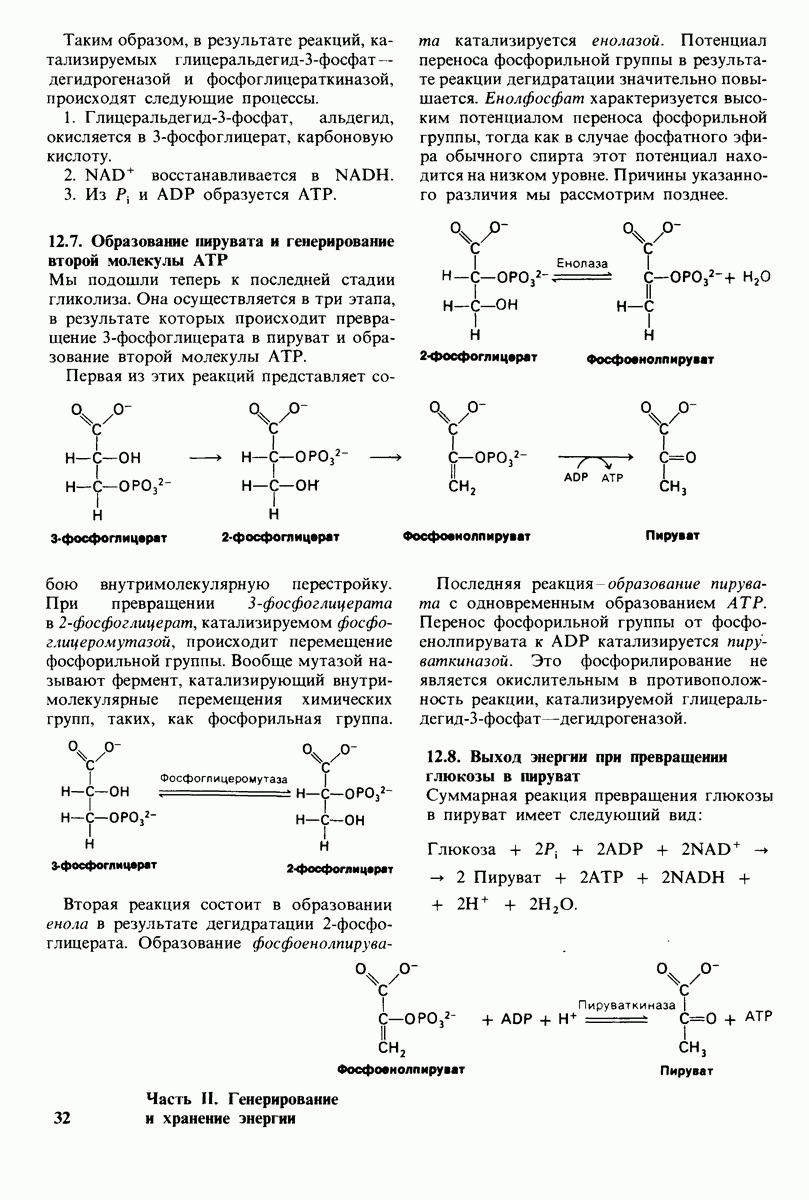
- 12.7. Образование пирувата и генерирование второй молекулы АТР
- 12.8. Выход энергии при превращении глюкозы в пируват
- 12.9. Фосфофруктокиназа — ключевой фермент в регуляции гликолиза
- 12.10. Пируват может превращаться в этанол, лактат или ацетилкофермеит А
- 12.11. Участки связывания NAD+ очень сходны в различных дегидрогеназах
- 12.12. Глюкоза индуцирует большие конформационные изменения в гексокиназе
- 12.13. Альдолаза образует шиффово основание с дигидроксиацетонфосфатом
- 12.14. Образование тиоэфира при окислении глицеральдегид-3-фосфата
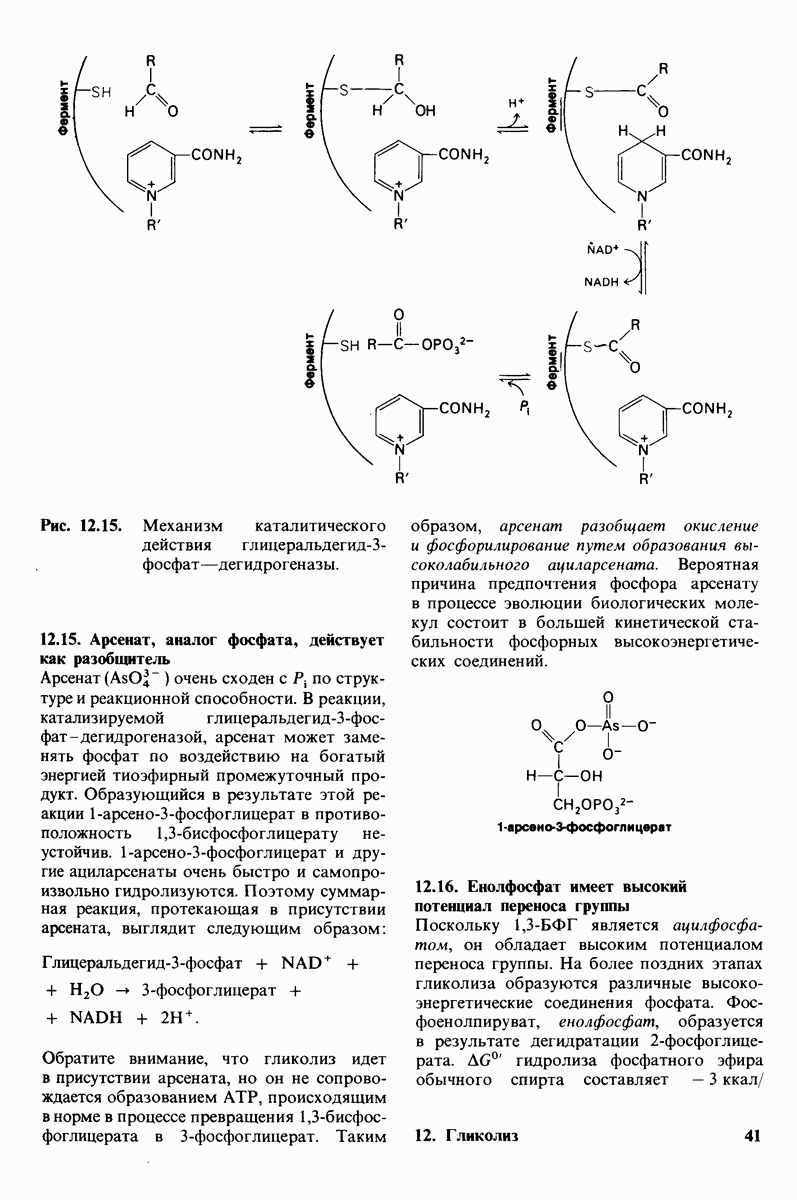
- 12.15. Арсенат, аналог фосфата, действует как разобщитель
- 12.16. Енолфосфат имеет высокий потенциал переноса группы
- 12.17. Метаболизм 2,3-бисфосфоглицерата, регулятора транспорта кислорода
- 12.18. Нарушение гликолиза в эритроцитах приводит к изменению транспорта кислорода
- ГЛАВА 13. Цикл трикарбоновых кислот
- 13.1. Образование ацетил кофермента А из пирувата
- 13.2. Общая характеристика цикла трикарбоновых кислот
- 13.3. Оксалоацетат конденсируется с ацетил-коферментом А с образованием цитрата
- 13.4. Цитрат изомеризуется в изоцитрат
- 13.5. Изоцитрат окисляется и декарбокси-лируется в альфа-оксоглутарат
- 13.6. При окислительном декарбоксилировании альфа-оксоглутарата образуется сукцинил-СоА
- 13.7. Генерирование высокоэнергетической фосфатной связи из сукцинилкофермента А
- 13.8. Регенерирование оксалоацетата при окислении сукцината
- 13.9. Стехиометрия цикла трикарбоновых кислот
- 13.10. Пируват-дегидрогеиазиый комплекс — организованная система ферментов
- 13.11. Вариации на мультиферментнуко тему: альфа-оксоглутарат-дегидрогеназный комплекс
- 13.12. Бери-бери вызывается недостаточностью тиамина
- 13.13. Симметричные молекулы могут реагировать асимметрично
- 13.14. Стереоспецифический перенос водорода NAD+-дегидрогеназами
- 13.15. Летальный синтез: превращение фторацетата во фторцитрат
- 13.16. Цикл трикарбоновых кислот — источник предшественников для процессов биосинтеза
- 13.17. Регуляция пируват-дегндрогеназного комплекса
- 13.18 Регуляция цикла трикарбоновых кислот
- 13.19. Открытие цикла Кребсом
- ПРИЛОЖЕНИЕ. RS-обозначение хиральности
- ГЛАВА 14. Окислительное фосфорилирование
- 14.1. Окислительное фосфорилирование происходит в митохондриях
- 14.2. Окислительно-восстановительные потенциалы и изменения свободной энергии
- 14.3. Величина окислительно-восстановительного потенциала дыхательной цепи составляет 1,14 В, что соответствует 53 ккал
- 14.4. Флавин, железо-серные комплексы, хинон и гемовые группы переносят электроны от NADH к O2
- 14.5. Сопряжение окисления и фосфорилирования осуществляется протонным градиентом
- 14.6. Протонный градиент генерируется в трех пунктах
- 14.7. Протоны выталкиваются асимметрично ориентированными трансмембранными комплексами
- 14.8. АТР синтезируется при обратном токе протонов в матрикс через протонные каналы
- 14.9. Электроны от цитоплазматического NADH поступают в митохондрии при помощи глицерофосфатного челночного механизма
- 14.10. Поступление ADP в митохондрии требует выхода АТР
- 14.11. Митохондрии содержат многочисленные транспортные системы для ионов и метаболитов
- 14.12. Полное окисление глюкозы дает 36 АТР
- 4.13. Скорость окислительного фосфорилнрования определяется по потребности в АТР
- 14.14. Динитрофенол разобщает окислительное фосфорилирование путем разрушения протонного градиента
- 14.15. Трехмерная структура цитохрома c
- 14.16. Взаимодействие цитохрома с с его редуктазой и оксидазой
- 14.17. Конформация цитохрома с оставалась в основном постоянной в течение миллиардов лет
- 14.18. Передача прот оно движу щей силы протонными градиентами центральный мотив биоэнергетики
- ГЛАВА 15. Пентозофосфатный путь и глюконеогенез
- 15.1. Пентозофосфатный путь генерирует АТР и синтезирует пятиуглеродные сахара
- 15.2. Две молекулы NADPH генерируются при превращении глюкозо-6-фосфата в рибулозо-5-фосфат
- 15.4. Пентозофосфатный путь и гликолиз связаны между собой транскетолазой и трансальдолазой
- 15.5. Скорость функционирования пентозофосфатного пути регулируется концентрацией NADP+
- 15.6. Судьба глюкозо-6-фосфата зависит от потребности в NADPH, и рибозо-5-фосфате и АТР
- 15.7. Активность пентозофосфатного пути в жировой ткани значительно выше, чем в мышцах
- 15.8. Тиаминпирофосфат, простетическая группа транскетолазы, переносит активированные альдегиды
- 15.9. Нарушение способности транскетолазы связывать ТПФ может быть причиной нервно-психического расстройства
- 15.10. Активированный дигидроксиацетон переносится трансальдолазой в виде шиффова основания
- 15.11. Недостаточность глюкозо-6-фосфат-дегидрогеназы — причина лекарственной гемолитической анемии
- 15.12. Глутатион-редуктаза переносит электроны от NADPH к окисленному глутатиону при участии FAD
- 15.13. Глюкоза может синтезироваться из неуглеводных предшественников
- 15.14. Глюконеогенез — это не обращение гликолиза
- 15.15. Биотин — мобильный переносчик активированного CO2
- 15.16. Пируват-карбоксилаза активируется при участии ацетил-СоА
- 15.17. Оксалоацетат переходит по челночному механизму в цитозоль и превращается в фосфоенолпируват
- 15.18. Шесть высокоэнергетических фосфатных связей расходуются при синтезе глюкозы из пирувата
- 15.19. Глюконеогенез и гликолиз регулируются реципрокно
- 15.20. Субстратные циклы амплифнцнруют метаболические сигналы и образование тепла
- 15.21. Лактат, образованный сокращающейся мышцей, превращается в печени в глюкозу
- ГЛАВА 16. Гликоген и обмен дисахаридов
- 16.1. Фосфорнлаза катализирует фосфоролитическое расщепление гликогена до глюкозо-1-фосфата
- 16.2. Для распада гликогена необходим также фермент, разрывающий связи в местах ветвления
- 16.3. Фосфоглюкомутаза превращает глюкозо-1-фосфат в глюкозо-6-фосфат
- 16.4. Печень содержит глюкозо-6-фосфатазу, гидролитический фермент, отсутствующий в мышцах
- 16.5. Синтез и расщепление гликогена происходят различными путями
- 16.6. UDP-глюкоза — активированная форма глюкозы
- 16.7. Гликоген-синтаза катализирует перенос глюкозы от UDP-глюкозы к растущей цепи
- 16.8. Ветвящий фермент образует альфа-1,6-связи
- 16.9. Гликоген — очень эффективная резервная форма глюкозы
- 16.10. Циклический AMP занимает центральное положение в координированном контроле синтеза и распада гликогена
- 16.11. Фосфорилаза активируется путем фосфорилирования специфического остатка серина
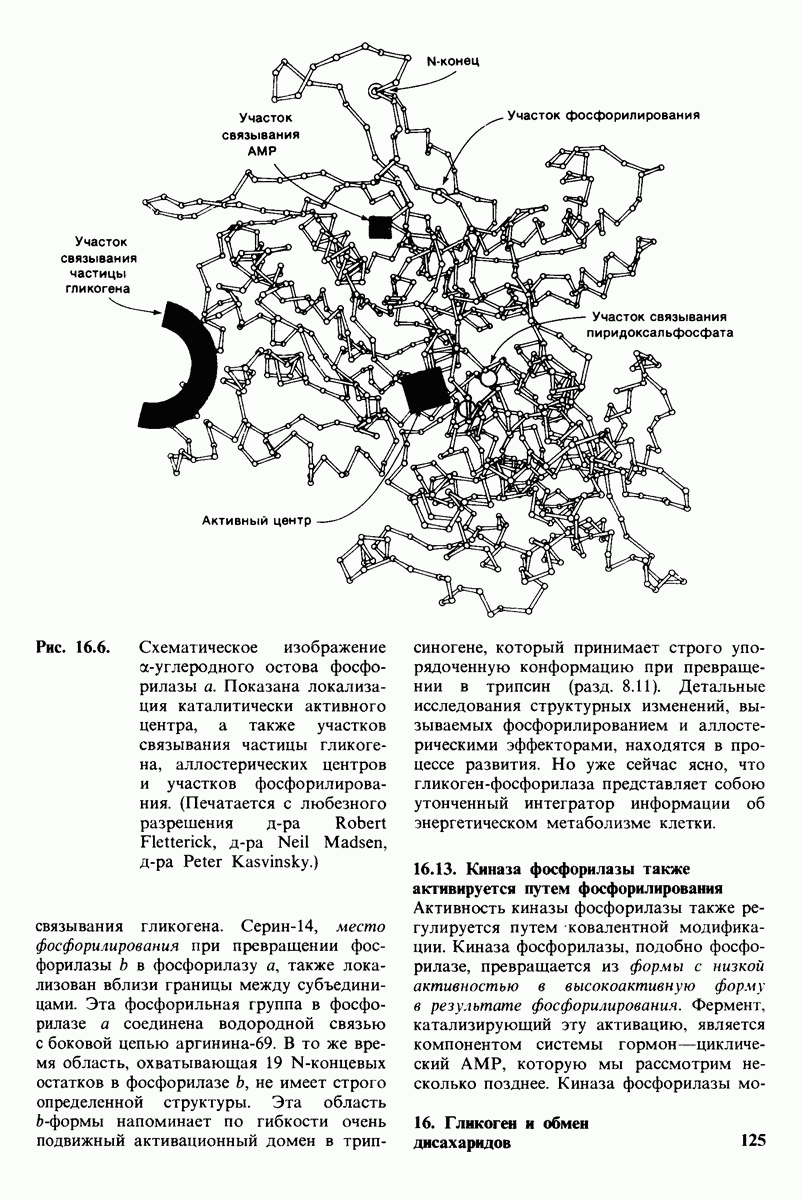
- 16.12. Трехмерная структура гликоген-фосфорилазы
- 16.13. Кииаза фосфорилазы также активируется путем фосфорилирования
- 16.14. Гликоген-синтаза инактивируется при фосфорнлнровании специфического серинового остатка
- 16.15. Каскад реакций контролирует фосфорилирование гликоген-синтазы и гликоген-фосфорилазы
- 16.16. Фосфатазы вызывают обращение рсгуляторных эффектов киназ
- 16.17. Каскад реакций амплифицирует гормональный сигнал
- 16.18. Обмен гликогена в печени регулирует содержание глюкозы в крови
- 16.19. Известен ряд генетически детерминированных болезней накопления гликогена
- 16.20. Крахмал — резервный полисахарид у растений
- 16.21. Мальтоза, сахароза и лактоза — широко распространенные дисахарнды
- 16.22. Синтез лактозы контролируется модифицирующей субъединицей
- 16.23. Интолерантность к молоку у взрослых, обусловленная недостаточностью лактазы
- 16.24. Вступление фруктозы и галактозы на путь гликолиза
- 16.25. При отсутствии трансферазы галактоза высокотоксична
- ГЛАВА 17. Обмен жирных кислот
- 17.1. Номенклатура жирных кислот
- 17.2. Жирные кислоты варьируют по длине цепи и по степени ненасыщенности
- 17.3. Триацилглицеролы (триглицериды) — высококонцентрированные резервы энергии
- 17.4. Триацилглицеролы гидролизуются липазами, регулируемыми циклическим AMP
- 17.5 Жирные кислоты распадаются путем последовательного удаления двухуглеродных фрагментов
- 17.6. Окислению жирных кислот предшествует связывание с коферментом А
- 17.7. Карнитин переносит в митохондриальный матрикс активированные жирные кислоты с длинной цепью
- 17.8. В каждом цикле окисления жирной кислоты происходит генерирование ацетил-СоА, и NADH и FADH2
- 17.9. При полном окислении пальмитата образуется 129 АТР
- 17.10. Необходимость изомеразы и эпимеразы для окисления ненасыщенных жирных кислот
- 17.11. Жирные кислоты с нечетным числом углеродных атомов образуют при завершающем тиолизе пропионил-СоА
- 17.12. Образование кетоновых тел из ацетилкофермента А в условиях, когда расщепление жиров преобладает
- 17.13. Ацетоацетат — основное топливо в некоторых тканях
- 17.14. Животные неспособны превращать жирные кислоты в глюкозу
- 17.15. Синтез и распад жирных кислот идут различными путями
- 17.16. Образование малоннлкофермента А — решающий шаг в синтезе жирных кислот
- 17.17. Промежуточные продукты синтеза жирных кислот присоединены к ацилпереносящему белку
- 17.18. Цикл элонгации в синтезе жирных кислот
- 17.20. Жирные кислоты синтезируются у эукариот мультиферментным комплексом
- 17.21. Цитрат переносит ацетильные группы для синтеза жирных кислот из митохондрий в цитозоль
- 17.22. Источники NADPH для синтеза жирных кислот
- 17.23. Элонгация и десатурация жирных кислот осуществляются добавочными ферментными системами
- 17.24. Регуляция синтеза жирных кислот
- ГЛАВА 18. Разрушение аминокислот и цикл мочевины
- 18.2. Пиридоксальфасфат, простетическая группа аминотрансфераз, образует в качестве промежуточных продуктов шнффовы основания
- 18.3. Серии и треонин могут дезамннироваться непосредственно
- 18.4. У большинства наземных позвоночных NH4 превращается в мочевину и в таком виде экскретируется
- 18.5. Цикл мочевины связан с циклом трикарбоновых кислот
- 18.6. Наследственные ферментные нарушения цикла мочевины приводят к гипераммонемии
- 18.7. Судьба атомов углерода распавшихся аминокислот
- 18.8. Семейство С3-аминокислот: аланин, серин и цистеин превращаются в пируват
- 18.9. Семейство С4-аминокислот: аспартат и аспарагин превращаются в оксалоацетат
- 18.10. Семейство С5-аминокислот: некоторые аминокислоты превращаются в альфа-оксоглутарат через глутамат
- 18.11. Сукцинил-кофермент А-пункт включения в цикл трикарбоновых кислот для некоторых аминокислот
- 18.12. Ферменты, содержащие в качестве простетической группы кобаламнн (витамин В12), катализируют процессы перегруппировки и метилирования
- 18.13. При пернициозиой анемии нарушается всасывание кобаламина
- 18.14. Известно несколько наследственных дефектов обмена метилмалонил-кофермента А
- 18.15. Лейцин распадается на ацетил-кофермент А и ацетоацетил-кофермент А
- 18.16. Фенилаланин и тирозин распадаются под действием оксигеназ на ацетоацетат и фумарат
- 18.17. Открытие Гэрродом наследственных нарушений метаболизма
- 18.18. Блокирование гидроксилировання фенилаланина может привести к резко выраженной умственной отсталости
- ГЛАВА 19. Фотосинтез
- 19.1. Открытие основного уравнения фотосинтеза
- 19.2. Хлорофиллы представляют собой фоторецепторные молекулы
- 19.3. Первичные события фотосинтеза происходят в высокоорганизованной системе мембран
- 19.4. Фотосинтетическая единица: фотоны стекаются в реакционный центр
- 19.5. Кислород, выделяющийся при фотосинтезе, происходит из воды
- 19.6. Реакция Хилла: освещенные протопласты выделяют кислород и восстанавливают искусственный акцептор электронов
- 19.7. Фотосинтез требует взаимодействия двух видов фотосистем
- 19.8. Роль двух фотосистем
- 19.10. Фотосистема II генерирует сильный окислитель, который расщепляет воду
- 19.11. При переносе электронов от фотосистемы II к фотосистеме I создается протонный градиент
- 19.12. При циклическом переносе электронов через фотосистему I может образовываться также АТР
- 19.13. Протонный градиент через мембрану тилакондов запускает синтез АТР
- 19.14. Исследование пути углерода с использованием импульсной радиоактивной метки
- 19.15. CO2 реагирует с рибулозобисфосфатом с образованием двух фосфоглицератов
- 19.16. Образование фруктозо-6-фосфата и регенерирование рибулозо-1,5-бисфосфата
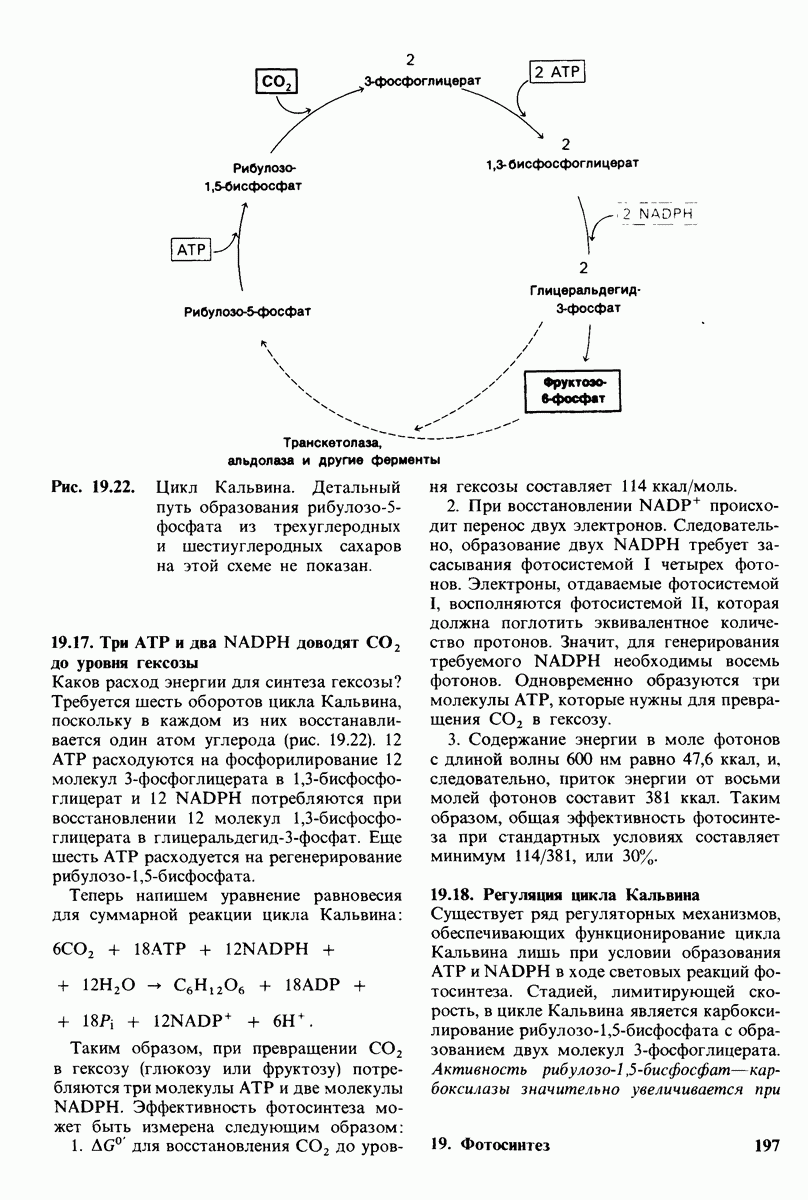
- 19.17. Три АТР и два NADPH доводят CO2 до уровня гексозы
- 19.18. Регуляция цикла Кальвина
- 19.19. У тропических растений функционирует С4-путь, ускоряющий фотосинтез путем концентрирования CO2
- 19.20. Гликолат — основной субстрат при фотодыхании
- 19.21. Белок пурпурных мембран галобактерий перекачивает протоны для синтеза АТР
- ГЛАВА 20. Биосинтез мембранных липидов и стероидных гормонов
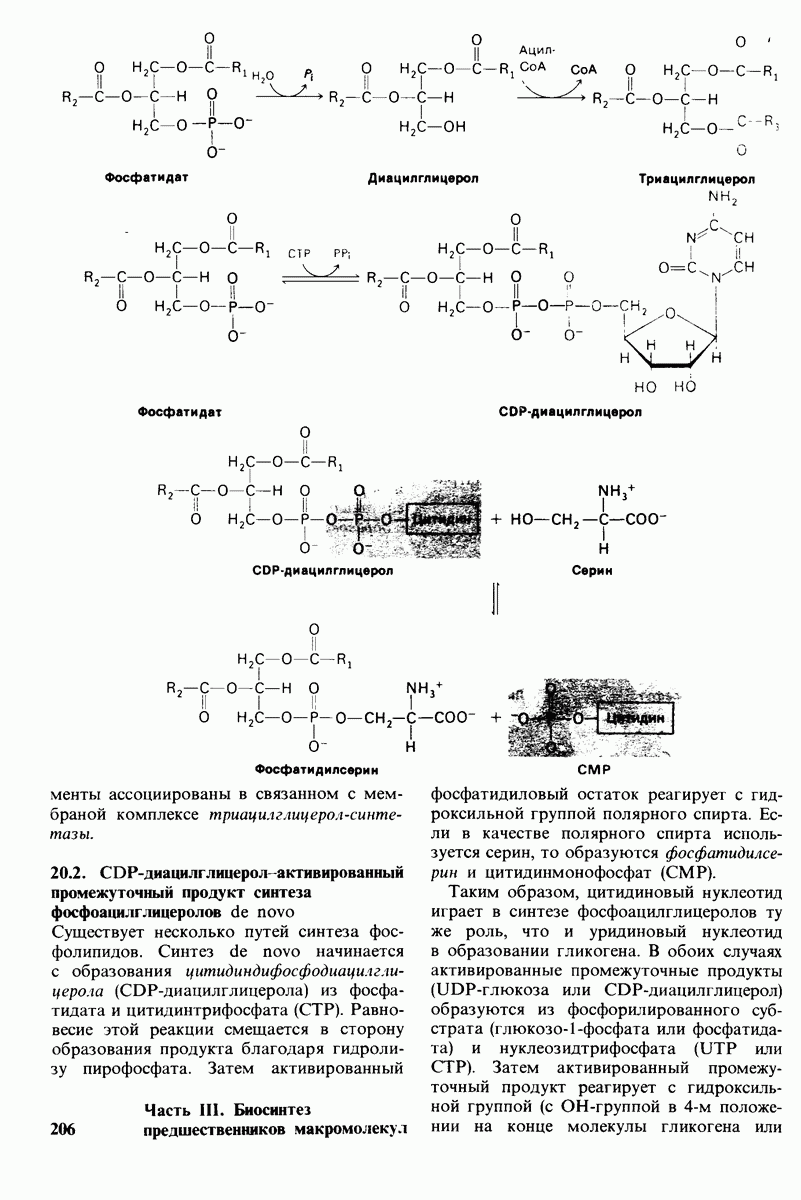
- 20.2. СDР-диацилглицерол активированный промежуточный продукт синтеза фосфоацилглицеролов de novo
- 20.3. Фосфатидилэтаноламин и фосфатидилхолин могут образовываться из фосфатидилсерина
- 20.4. Фосфоацилглицеролы могут также синтезироваться из готовых остатков
- 20.5. Выделено несколько специфических фосфолипаз
- 20.6. Синтез церамида — основной структурной единицы сфинголипидов
- 20.7. Ганглиозиды — богатые углеводами сфинголипиды, содержащие кислые сахара
- 20.8. Болезнь Тея-Сакса: наследуемое нарушение расщепления ганглиозидов
- 20.9. Холестерол синтезируется из ацетил-кофермента А
- 20.10. Мевалонат и сквален — промежуточные продукты синтеза холестерола
- 20.11. Синтез изопентенилпирофосфата — активированного промежуточного продукта при образовании холестерола
- 20.12. Синтез сквалена из изопентенилпирофосфата
- 20.13. 2,3-оксид сквалена циклизуется с образованием ланостерола, который в свою очередь превращается в холестерол
- 20.14. Желчные кислоты, облегчающие переваривание липидов, образуются из холестерола
- 20.15. Синтез холестерола в печени подавляется холестеролом, поступающим с пищей
- 20.16. Холестерол и другие липиды переносятся к органам-мишеням с помощью различных липопротеинов
- 20.17. Рецепторы липопротеинов низкой плотности играют ключевую роль в регуляции метаболизма холестерола
- 20.18. Отсутствие рецепторов ЛНП приводит к гиперхолестеролемии и преждевременному атеросклерозу
- 20.19. Номенклатура стероидов
- 20.20. Стероидные гормоны образуются из холестерола
- 20.21. Стероиды гидроксилируются под действием монооксигеназ, использующих NADPH и кислород
- 20.22. Прегненолон образуется из холестерола путем отщепления боковой цепи
- 20.23. Синтез прогестерона и кортикоидов
- 20.24. Синтез андрогенов и эстрогенов
- 20.25. Недостаточная активность 21-гидроксилазы приводит к вирилизму и увеличению надпочечников
- 20.26. Витамин D образуется из холестерола под действием света
- 20.27. При соединений пятиуглеродных элементов образуются самые разнообразные молекулы
- ГЛАВА 21. Биосинтез аминокислот и гема
- 21.1. Микроорганизмы используют АТР и сильный восстановитель для превращения N2 в NH4
- 21.2. NH4+- включается в аминокислоты через глутамат и глутамин
- 21.3. Аминокислоты синтезируются из промежуточных продуктов цикла трикарбоновых кислот и других важных метаболитов
- 21.4. Глутамат — предшественник глутамнна и пролина
- 21.5. Серии синтезируется из 3-фосфоглицерата
- 21.6. Тетрагидрофолят переносит активированные одноуглеродные фрагменты с различной степенью окисления
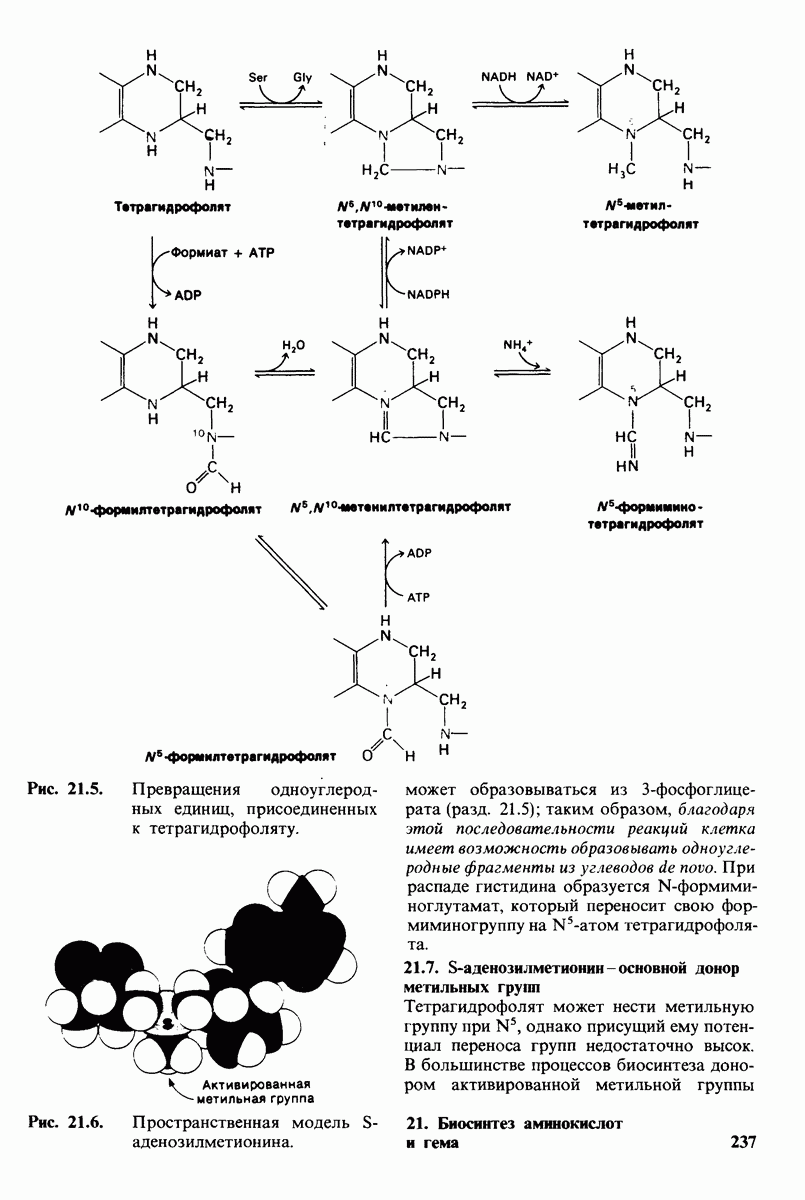
- 21.7. S-аденозилметионин — основной донор метильных групп
- 21.8. Цистеин синтезируется из серина и гомоцистеина
- 21.9. Шикимат и хоризмат-промежуточные продукты биосинтеза ароматических аминокислот
- 21.10. Гистидин синтезируется из АТР, ФРПФ и глутамина
- 21.11. Биосинтез аминокислот регулируется ингибированием конечным продуктом
- 21.12. Активность глутамин-синтетазы регулируется путем аденилирования
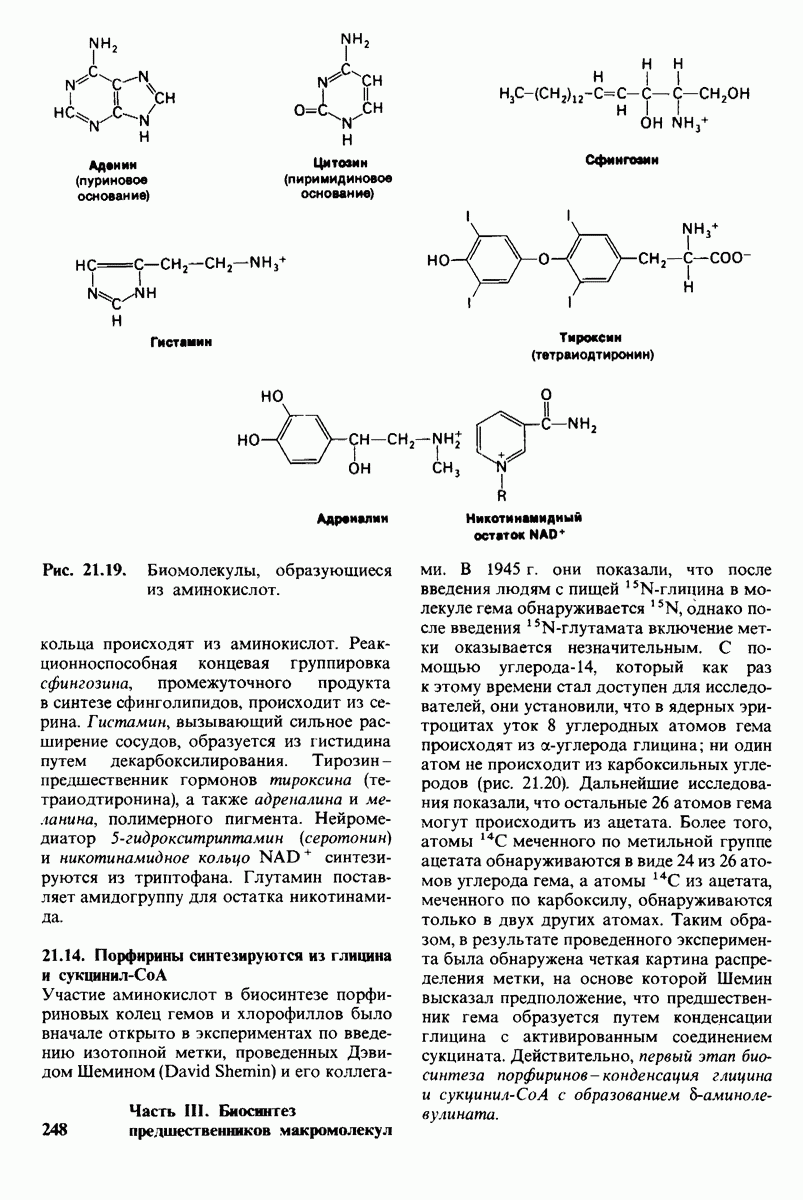
- 21.13. Аминокислоты — предшественники множества других биомолекул
- 21.14. Порфирины синтезируются из глицина и сукцинил-СоА
- 21.15. При некоторых наследственных нарушениях метаболизма порфнринов происходит их накопление
- 21.16. Биливердин и билирубин — промежуточные продукты распада гема
- ГЛАВА 22. Биосинтез нуклеотидов
- 22.1. Номенклатура оснований, нуклеозидов и нуклеотидов
- 22.2. Пуриновое кольцо синтезируется из аминокислот, производных тетрагндрофолята и CO2
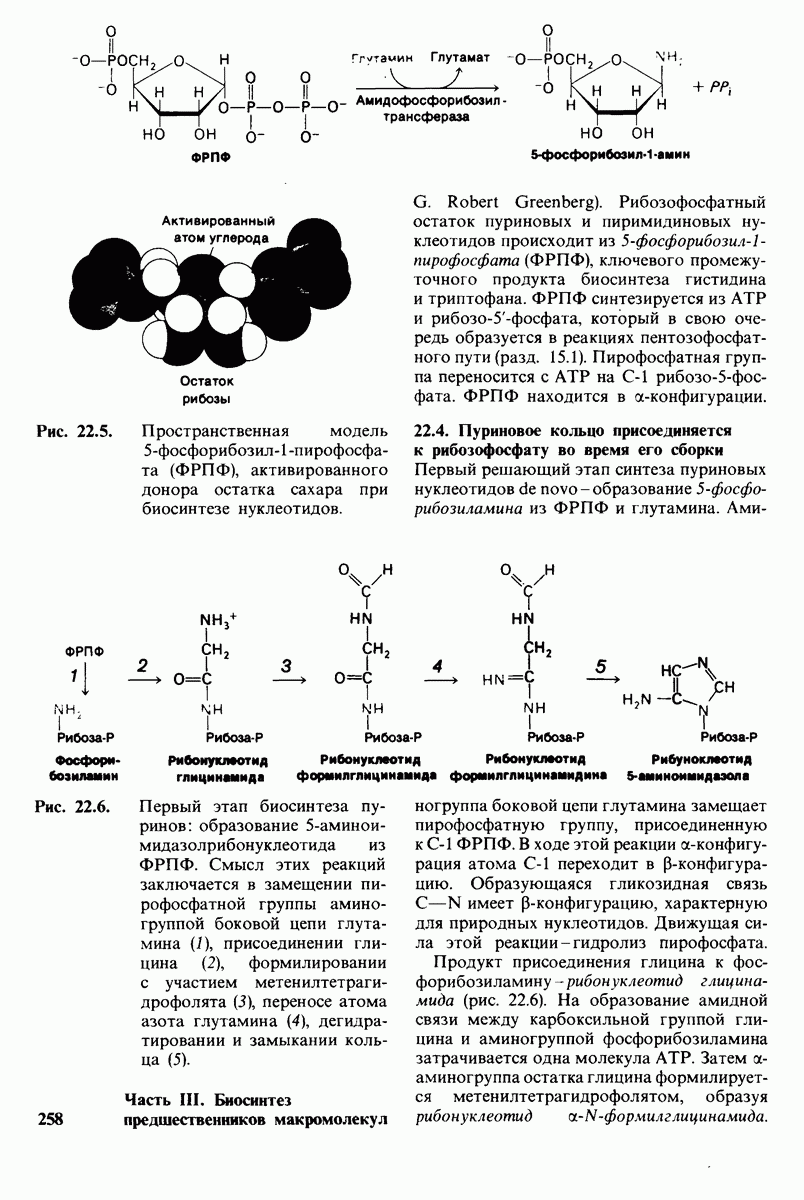
- 22.3. Фосфорибозилпирофосфат — донор рибозофосфатного остатка нуклеотидов
- 22.4. Пуриновое кольцо присоединяется к рибозофосфату во время его сборки
- 22.5. AMP и GMP образуются из IMP
- 22.6. Пурнновые основания могут использоваться повторно с помощью реакций синтеза из готовых остатков с участием ФРПФ
- 22.7. AMP и GMP-ретроингибиторы биосинтеза пуриновых нуклеотидов
- 22.8. Пиримидиновое кольцо синтезируется из карбамоилфосфата и аспартата
- 22.9. К оротату присоединяется рибозофосфатный остаток ФРПФ
- 22.10. Первые три фермента биосинтеза пиримидинов синтезируются в виде одной полинентилной цепи
- 22.11. Нуклеозидмоно-, нуклеозидди- и нуклеозидтрифосфаты способны к взаимопревращениям
- 22.12. СТР образуется путем аминирования UTP
- 22.13. Биосинтез пиримидиннуклеотидов регулируется ингибнрованием по принципу обратной связи
- 22.14. Аспартат-транскарбамоилаза состоит из отдельных каталитической и регуляторной субъединиц
- 22.15. Дезоксирибонуклеотнды синтезируются путем восстановления рибонуклеозиддифосфатов
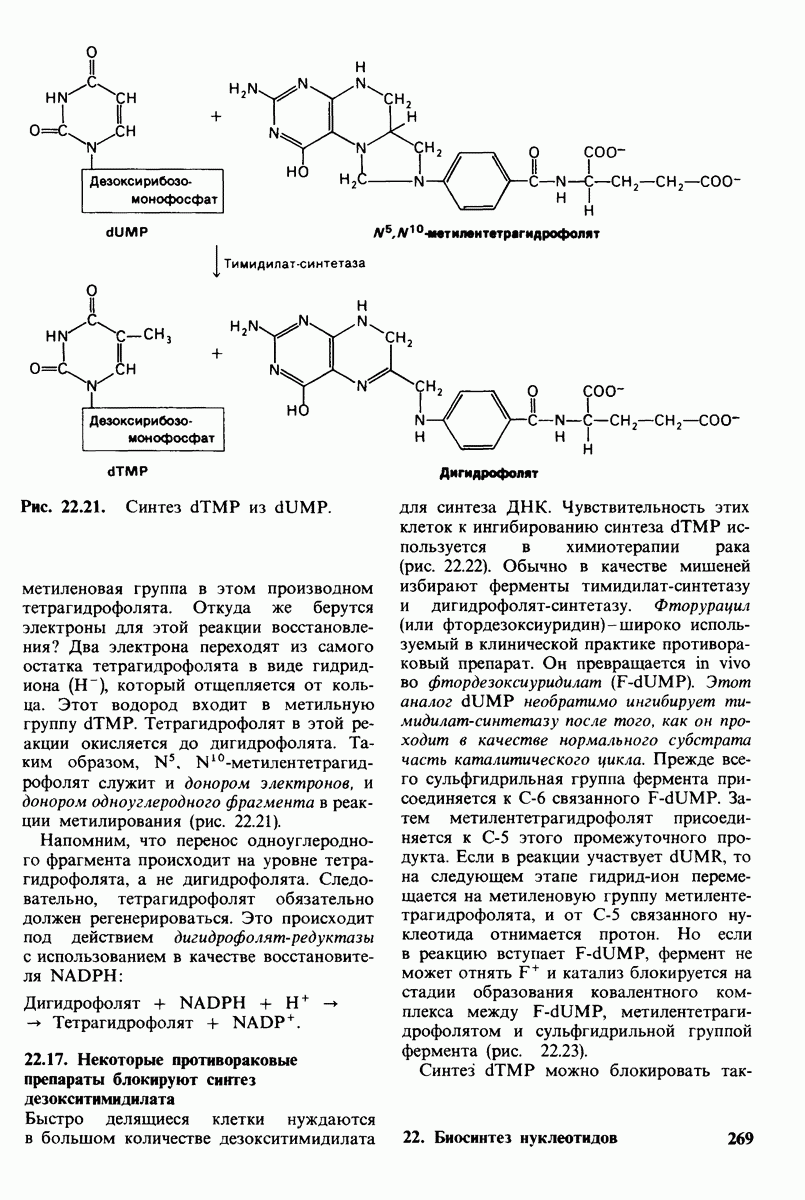
- 22.16. Дезокситимнднлат образуется путем метилирования дезоксиуридилата
- 22.17. Некоторые противораковые препараты блокируют синтез дезокситимидилата
- 22.18. АТР — предшественник NAD+ , FAD и кофермента А
- 22.19. В организме человека пурины распадаются до мочевой кислоты
- 22.20. У некоторых организмов происходит дальнейший распад мочевой кислоты
- 22.21. Птицы и наземные рептилии выделяют мочевую кислоту вместо мочевины, чтобы сохранить воду
- 22.22. Распад пиримидинов
- 22.23. Избыточное образование мочевой кислоты — причина подагры
- 22.24. Синдром Леша-Нихана: членовредительство, умственное отставание и избыточное образование мочевой кислоты
- ГЛАВА 23. Интеграция метаболизма
- 23.1. Стратегия метаболизма: основные положения
- 23.2. Повторяющиеся мотивы в механизмах регуляции метаболизма
- 23.3. Основные метаболические пути и регуляторные этапы
- 23.4. Ключевые соединения: глюкозо-6-фосфат, пируват и ацетил-СоА
- 23.5. Метаболические особенности основных органов
- 23.6. Гормональные регуляторы энергетического метаболизма
- 23.7. Печень выполняет роль буфера в регуляции содержания глюкозы в крови
- 23.8. Адаптация метаболизма к продолжительному голоданию: снижение распада белков
- 23.9. Огромные запасы жира позволяют перелетным птицам покрывать большие расстояния